Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
ЧАСТЬ II. ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКИХ РАВНОВЕСИЙ И ПРОЦЕССОВ. Глава 4. СВОЙСТВА РАСТВОРОВ НИЗКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
...А растворы и их образования играют роль первостепенную не только в природе, называемую мертвой, но и в организмах.
Д. И. Менделеев
4.1. ОСНОВНЫЕ ПОНЯТИЯ О РАСТВОРАХ. ХАРАКТЕРИСТИКА ЖИДКИХ РАСТВОРОВ. ЧИСЛО ГИДРАТАЦИИ. СТРУКТУРИРУЮЩИЕ И ДЕСТРУКТУРИРУЮЩИЕ ИОНЫ
Растворы имеют особое значение в жизни и в практической деятельности человека. Они составляют основную часть внутренней среды организма, обеспечивают процессы всасывания, транспорта питательных веществ и элиминации продуктов обмена в организме. Растворами являются все важнейшие физиологические жидкости организма: кровь, лимфа, моча и т.д. Биохимические процессы протекают в водных растворах и с участием растворителя, растворенных частиц и продуктов их взаимодействия.
Производство лекарственных веществ связано с использованием растворов, и основные их формы представляют собой растворы. Велика роль растворов, процесса растворения в гигиене и санитарии. В жидких растворах обеспечивается кислотно-основной и концентрационный гомеостаз биологически важных соединений.
В природе существуют истинные растворы и коллоидные растворы.
Истинные растворы - это гомогенная однофазная система переменного состава, состоящая из 2 компонентов или более, каждый из которых равномерно распределен в массе другого в виде молекул, атомов или ионов. Компонент, агрегатное состояние которого не изменяется при образовании раствора, принято считать растворителем.
Например, в физиологическом растворе растворителем является вода. В случае же если все исходные компоненты раствора находятся
в одном агрегатном состоянии, то под растворителем понимают компонент, концентрация которого преобладает.
Растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны растворы, как и химические соединения, однородны. С другой стороны, в растворах нет строгого стехиоме-трического соотношения между растворенным веществом и растворителем, т.е. растворы не подчиняются закону постоянства состава, кроме того, они могут быть разделены на составные части. При упаривании раствора хлорида натрия можно выделить из раствора кристаллы хлорида натрия.
В основе получения растворов лежат процесс химического взаимодействия между растворителем и растворяемым веществом, называемого процессом сольватации, а в случае водных растворов - процессом гидратации, и образование в первом случае сольватов, а во втором гидратов, находящихся в равновесии с исходными веществами и между собой. Установлен донорно-акцепторный механизм гидратации ионов, единая донорно-акцепторная природа межмолекулярных связей, например, катионов и анионов.
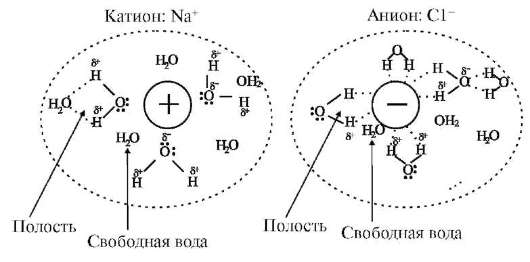
Каждая молекула воды может образовать четыре водородные связи: две за счет своих атомов водорода и две за счет атомов водорода соседних молекул и своего атома кислорода. Такая структура характерна для чистой воды в твердом агрегатном состоянии. Кроме того, за счет неподеленной электронной пары кислорода может быть образована донорно-акцепторная связь. Например, при образовании донорно-акцепторной связи с протоном образуется катион гидроксония - H3O+. В процессе гидратации в водных растворах образуются гидратирован-ные ионы. С учетом водородных связей катиону гидроксония будет соответствовать формула H9O4+. Было введено число гидратации, показывающее число молекул воды координированных ионом и образующих его
гидратную оболочку. Число гидратации пропорционально размеру и величине заряда иона. Чем больше заряд иона и меньше его размер, тем больше число гидратации. Радиусы гидратированных ионов существенно больше, чем ионные радиусы, например, натрия и калия.
Радиус негидратированного иона Na+ составляет 0,095 нм, K+ - 0,130 нм, радиус гидратированного иона Na+ - 0,240 нм, K+ - 0,170 нм.
Размер гидратированных ионов определяют многие их свойства (проницаемость через клеточные мембраны (ион натрия - внеклеточный ион, а ион калия - внутриклеточный), адсорбционную и коагулирующую способности ионов). Многие физические характеристики растворов определяются электролитным составом растворов. В медицине это используют для коррекции вязкости крови и других жидкостей организма. Ион-дипольное взаимодействие между ионами, молекулами растворенных частиц в растворе и молекулами воды может существенно влиять на макроскопические свойства воды. Однозарядные ионы, такие, как Na+, Li+, ОН-, F- с малым размером и многозарядные Fe3+, Al3+, называют структурирующими ионами. Высокая напряженность электрического поля, создаваемого этими ионами, может поляризовать молекулы воды, создавая дополнительную упорядоченность за пределами первой гидратной оболочки. Это приводит к повышению вязкости раствора. В то же время однозарядные ионы большого размера, такие, как Rb+, K+, Cs+, NH4+, NO3-, ClO4-, - называют деструктурирующи-ми ионами, имеют в оболочке тонкий плотный структурированный слой и толстый рыхлый деструктурированный, не поляризуют молекулы воды за пределами первой гидратной оболочки. В результате вязкость растворов, содержащих эти ионы, оказывается ниже, чем вязкость воды. Поэтому многие физиологические характеристики растворов определяются электролитным составом растворов, а точнее, составом и свойствами продуктов взаимодействия компонентов растворов. В медицине это используется для коррекции вязкости, биологической активности крови и других жидкостей организма.
4.2. СВОЙСТВА ВОДЫ
Основным растворителем в природе является вода. Организм человека на 60%, а у эмбриона на 94% состоит из воды, из них 42% приходится на внутриклеточную, 18% на внеклеточную. Вода не только среда, но также и активный участник процессов жизнедеятельности. Если орга-
низм человека теряет 20% воды, то в клетках происходят необратимые изменения, и человек умирает. Большая роль воды в живой природе связана с рядом уникальных свойств, благодаря которым вода является средой, растворителем и метаболитом. Вода имеет высокую молярную теплоемкость - 75,9 Дж/моль-К и большую мольную теплоту испарения - 40,6 кДж/моль. Поэтому вода участвует в термостатировании организма. Высокая диэлектрическая проницаемость воды (ε = 78,5) способствует растворению и диссоциации электролитов, что обеспечивает быструю миграцию ионов через мембраны.
Высокий дипольный момент молекул воды (1,82 Д) и способность образовывать донорно-акцепторные связи обеспечивают высокую растворяющую способность вещества, благоприятствуют образованию полимерных структур, гидратной оболочки вещества, водных ассо-циатов, полимеров, часто обеспечивают биологическую активность веществ, транспортные, метаболические, защитные и дезинтоксикаци-онные функции в организме.
В стандартных условиях 30% всех молекул воды находится в виде отдельных полимерных молекул, а 70% входят в состав ассоциатов. Из них 40% приходится на структурированную воду и 30% на случайные ассо-циаты, не имеющих определенной структуры, и составляют деструкту-рированную воду. Много структурированной воды в родниковой воде. Биологические и физиологические функции биосубстратов сильно зависят от соотношения структурированной и деструктурированной воды, отражающего упорядоченность водных систем во внутри- и межклеточных жидкостях. Итак, при растворении веществ не только происходит гидратация частиц, но изменяется структура воды. В живом организме следует различать «свободную» и «связанную» воду. Внутриклеточная вода в отличие от межклеточной не содержит свободной воды, а представляет собой связанную воду гидратных оболочек компонентов клеток (ионов, молекул). Вода - сложная, разнообразная и динамичная система.
Вода участвует в качестве реагента в четырех типах химических реакций. Она обладает амфотерными свойствами, которые обусловлены способностью воды к автопротолизу: 2H2O ↔ H3O+ + OH-. Это позволяет воде быть, с одной стороны, акцептором протонов: HCl + H2O ↔ H3O+ + Cl- , с другой стороны - донором протона NH3 + H2O ↔ NH4+ + OH- .
Молекулы воды участвуют в реакциях гидролиза органических и неорганических соединений, например АТФ + H2O ↔ АДФ + Ф. Вода образует аквакомплексы, выступая в качестве лиганда: H+ + 4H2O ↔ H9O4+.
Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. За счет водорода, находящегося в высшей степени окисления, вода окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова: Na + H2O → NaOH + H2↑ , за счет кислорода, находящегося в низшей степени окисления, она восстанавливает только фтор: F2 + H2O → 2HF + O.
Итак, вода обладает кислотно-основными свойствами, участвует в реакциях гидролиза, комплексообразования и окисления-восстановления.
4.3. ТЕРМОДИНАМИКА РАСТВОРОВ. ТЕПЛОТА РАСТВОРЕНИЯ
Образование раствора идет самопроизвольно и необратимо, вплоть до состояния устойчивого равновесия. Движущей силой процесса растворения является уменьшение свободной энергии по сравнению со свободной энергией исходных составных частей раствора (ΔG раств < 0). При полном растворении система приходит в состояние химического равновесия (ΔG раств = 0). У кристаллических веществ при их растворении энтропия увеличивается (ΔS > 0), а энтальпия уменьшается или увеличивается. Тепловые эффекты процессов растворения веществ бывают двух видов. Экзоэффекты обусловлены образованием сольватов (гидратов), т.е. процессом химического взаимодействия растворителя и растворяемого вещества (Е°); эндоэффекты - разрушением кристаллической решетки вещества (Е'), разрывом связи между частицами растворяемого вещества, процессом ионизации (Е"), разрушением исходной структуры растворителя (Е''').
Тепловой эффект процесса растворения (Qраств) можно выразить уравнением:
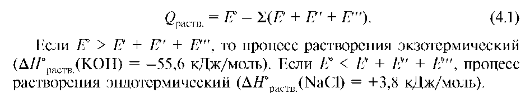
Количество теплоты (поглощающейся или выделяющейся) при растворении 1 моль вещества называется теплотой растворения этого вещества Q.
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты (ΔHраств. < 0). Поэтому растворимость газов с повы-
шением температуры согласно принципу Ле Шателье понижается. Эту закономерность часто используют для удаления растворенных газов (CO2) из воды кипячением. Иногда растворение газа сопровождается поглощением теплоты, например растворение благородных газов в некоторых органических растворителях. В этом случае повышение температуры увеличивает растворимость газа.
При растворении газа в жидкости происходит значительное уменьшение объема системы. Газ не растворяется в жидкости беспредельно. Если газ малорастворим и давление невелико, то растворимость газа пропорциональна его давлению.
Количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямопропорционально давлению газа. Эта зависимость получила название закона Генри (1803):

где с(Х) - концентрация газа в насыщенном растворе, моль/л; р(Х) - давление газа Х над раствором, Па; КГ(Х) - постоянная Генри для газа Х, моль/л•Па.
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителем. Постоянная Генри зависит от природы газа, растворителя и температуры.
Закон Генри является частным случаем общего закона Дальтона. Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и природы других компонентов.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач-физиолог И.М. Сеченов установил следующую закономерность.
Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание газов.

где с(Х) - растворимость газа Х в присутствии электролита; со(Х) - растворимость газа Х в чистом растворителе; сЭ - концентрация электролита; KC - постоянная Сеченова, зависящая от природы газа, электролита и температуры.
В соответствии с законом Сеченова не только электролиты, но и белки, липиды и другие вещества, содержание которых в крови
может изменяться в физиологических пределах, оказывают влияние на растворимость компонентов воздуха.
Законы Генри-Дальтона и Сеченова имеют большое практическое значение для медицины. Изменение растворимости газов в крови при изменении давления может вызывать тяжелые заболевания (кессонная болезнь, тромбоэмболия). Для лечения газовой гангрены применяют гипербарическую оксигенацию в барокамерах. При этом улучшается снабжение тканей кислородом, вследствие улучшения его растворимости в крови.
4.4. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. ОСМОМОЛЯЛЬНОСТЬ. ЗАКОН РАУЛЯ-ВАНТ-ГОФФА. ГИПЕРТОНИЧЕСКИЕ, ГИПОТОНИЧЕСКИЕ РАСТВОРЫ
Истинные растворы гомогенны, устойчивы во времени, прозрачны в рассеянном и проходящем свете, не разрушаются при изменении внешних условий. Растворитель и растворяемое вещество не могут быть разделены фильтрованием даже через ультрафильтры. Они обладают коллигативными (коллективными) свойствами.
Коллигативные свойства разбавленных растворов определяются не природой, а числом растворенных частиц. К ним следует отнести осмотическое давление, повышение температуры кипения и понижение температуры замерзания растворов, понижение давления насыщенного пара растворителя над раствором и др. При внесении веществ в растворитель или изменении их концентрации изменяются их коллигативные свойства.
При наличии мембран в растворах наблюдается явление осмоса. Осмосом называется преимущественное проникновение молекул растворителя через мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Движущей силой осмоса является стремление системы к выравниванию концентраций, так как при этом энтропия возрастает (ΔS > 0), химические потенциалы выравниваются, градиент концентрации ликвидируется.
Скорость диффузии вещества пропорциональна поверхности мембраны, через которую переносится вещество, и градиенту концентрации вещества (закон Фика).
Разность концентраций двух растворов, разделенных полупроницаемой мембраной, определяет величину осмотического давления (мембранный
потенциал). Если же градиент концентрации ликвидируется, то мембранный потенциал и осмотическое давление будут равны нулю.
Для расчета осмотического давления Вант-Гофф предложил уравнение:

где с(Х) - молярная концентрация вещества, моль/л; π - осмотическое давление, кПа; R - универсальная газовая постоянная, 8,31 кПа-л/моль•K; Т - температура, K.
Уравнение справедливо для растворов, в которых отсутствует взаимодействие веществ, т.е. для идеальных растворов. Для учета межчастичных взаимодействий Вант-Гофф предложил использовать изотонический коэффициент (i).
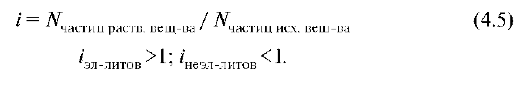
Избирательная проницаемость мембраны, основанная на процессах диффузии низкомолекулярных соединений вдоль градиента концентрации, используется в клинике для создания аппаратов типа искусственной почки.
Коллигативные свойства разбавленных растворов изменяются пропорционально количеству растворенного неэлектролита - это закон Рауля-Вант-Гоффа.
У млекопитающих основным органом осморегуляции являются почки. Осмотическое давление в жидкостях организма создается за счет присутствия осмотически активных частиц. Осмомоляльность - осмотически активная концентрация частиц, непроникающих через мембрану. Постоянство осмомоляльности называют изоосмией. Осмомоляльность определяется количеством всех осмотически активных частиц в растворе. Два раствора, имеющих одинаковое осмотическое давление, называют изотоническими. Осмомоляльности раствора глюкозы с моляльной концентрацией 0,2 моль/кг и раствора хлорида натрия с моляль-ной концентрацией 0,1 моль/кг одинаковы и равны 0,2 моль/кг. Так как степень электролитической диссоциации (а) хлорида натрия близка к 100%: NaCl → Na+ + Cl-, то из одной молекулы в растворе образуются две осмотически активные частицы. Физиологический раствор - 0,9% водный раствор хлорида натрия - имеет одинаковое осмотическое давление с сывороткой крови. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотиче-
ским давлением называют гипертоническим по отношению ко второму, а с меньшим - гипотоническим по отношению к первому. Существующая система осморегуляции позволяет поддерживать общий гомеостаз веществ в организме - концентрационный гомеостаз.
Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток - тургор, обеспечивающая эластичность тканей, поддержание формы органов, обусловлена осмотическим давлением. При помещении клеток в гипотонический раствор вода из менее концентрированного раствора переходит внутрь клеток, что приводит к набуханию и разрыву клеток и вытеканию клеточного содержимого. Такое разрушение клеток называют лизисом. В случае эритроцитов этот процесс называют гемолизом. При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор. Происходит сморщивание клеток. Этот процесс называют плазмолизом. Биологические жидкости (кровь, лимфа, тканевая жидкость) - это водные растворы НМС (NaCl, СаС12), ВМС (белка, нуклеиновых кислот, полисахаридов). Их суммарным действием определяется осмотическое давление, равное при 37 °С 7,7 атмосфер, которое постоянно, т.е. имеет место осмотический гомеостаз.
4.5. ЭЛЕМЕНТЫ ТЕОРИИ СЛАБЫХ ЭЛЕКТРОЛИТОВ. КОНСТАНТА ИОНИЗАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА. СТЕПЕНЬ ЭЛЕКТРИЧЕСКОЙ ДИССОЦИАЦИИ. ЗАКОН РАЗВЕДЕНИЯ ОСТВАЛЬДА
Все биологические, а также многие химические системы представляют собой растворы, содержащие различные молекулы или ионы. Устойчивость биомакромолекул и скорость многих биохимических реакций в большой мере зависят от природы и концентрации, присутствующих в системе частиц.
Электролитом называется вещество, растворение которого в воде приводит к образованию электропроводного раствора.
Электролит может быть кислотой, основанием или солью, т.е. веществом, которое распадается в растворе на ионы. Электропроводность растворов электролитов является одним из их свойств. Это свойство позволяет изучать поведение ионов в растворе.
Электролиты, диссоциирующие в растворах неполностью, называются слабыми электролитами. В 0,01-0,1 н растворе диссоциирует <3% молекул. В их растворах устанавливается равновесие между недиссо-
циированными молекулами и продуктами их ионизации - ионами, например: в растворе уксусной кислоты происходит реакция ионизации:
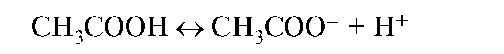
Количественной характеристикой процесса электролитической диссоциации веществ является константа диссоциации. Для слабых электролитов, например СН3СООН, такой количественной характеристикой будет являться константа ионизации кислотного типа:
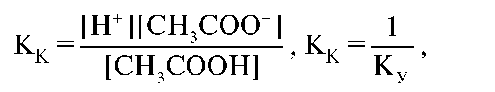
где КУ - константа устойчивости вещества.
Чем больше КК, тем лучше кислота распадается на ионы. Чем меньше КК, тем слабее кислота как электролит. Для каждого вещества значение КК постоянно и не зависит от концентрации. В литературе указывается, как правило, десятичный логарифм константы диссоциации с обратным знаком: КК(СН3СООН) ≈ 1 • 10-5; рКК(СН3СООН) ≈ 5.
Степень электролитической диссоциации - отношение числа молей, распавшихся на ионы, к общему числу молей растворенного электролита:

где α - степень электролитической диссоциации; nи - число молекул электролита, распавшихся на ионы; n - число молей электролита, введенных в раствор. Выражают степень диссоциации либо в долях единицы, либо в процентах.
Если α = 0, то диссоциация отсутствует, если α = 1 или 100%, то электролит полностью диссоциирует. При увеличении концентрации раствора слабого электролита а уменьшается, стремясь к 0.
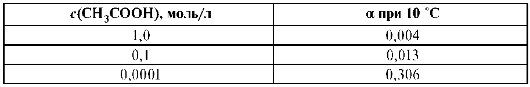
На степень электролитической ионизации а в соответствии с принципом Ле Шателье оказывает влияние снижение концентрации вещества: КtАn + mH2O ↔ Kt+ (H20)x + An-(H2O)m_x. Конкурирующее влияние воды увеличивает число диссоциированных молекул. Если
диссоциация сопровождается выделением или поглощением теплоты, то степень диссоциации должна зависеть от температуры. Влияние температуры можно также оценить по принципу Ле Шателье. Если электролитическая диссоциация протекает с поглощением теплоты ΔH > 0, то с повышением температуры а увеличивается, а при ΔH < 0 уменьшается.
На степень диссоциации слабых электролитов влияет и добавление одноименных ионов. Так, введение в равновесную систему CH3COOH ↔ CH3COO- + H+ сильного электролита CH3COONa увеличивает концентрацию ионов CH3COO-, что в соответствии с принципом Ле Шателье приводит к значительному сдвигу равновесия диссоциации влево, т.е. к уменьшению степени диссоциации. Таким образом, добавление к раствору слабого электролита одноименных ионов уменьшает степень его диссоциации.
Пусть имеется диссоциирующий на два иона слабый бинарный электролит КtАn, молярная концентрация которого с(Х), а степень диссоциации - α. В растворе этого электролита устанавливается рав-

Это соотношение называют законом разведения Оствальда. Уравнение (4.7) выражает зависимость степени диссоциации от концентрации раствора. Если электролит очень слабый, а <<1. Следовательно, величиной а в знаменателе можно пренебречь, и уравнение примет вид: Кд ≈ α2, или

Если вместо 1/с(Х) в уравнении (4.8) подставить V(Х) = 1/с(Х), называемую разбавлением, уравнение примет вид:

Соответственно, закон Оствальда может быть сформулирован следующим образом: степень диссоциации слабого электролита возрастает с разбавлением раствора. Сильные электролиты не подчиняются этому закону.
4.6. ЭЛЕМЕНТЫ ТЕОРИИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ. АКТИВНОСТЬ И КОЭФФИЦИЕНТ АКТИВНОСТИ. ИОННАЯ СИЛА РАСТВОРОВ. ЭЛЕКТРОЛИТЫ В ОРГАНИЗМЕ ЧЕЛОВЕКА
Электролиты, практически полностью диссоциирующие в водных растворах, называются сильными электролитами. К сильным электролитам относится большинство солей, которые уже в кристаллическом состоянии построены из ионов, гидроксиды щелочных и щелочноземельных металлов, некоторые кислоты (НС1, HBr, HI, HClO4,
HNO3).
В растворах сильных электролитов концентрация ионов довольно велика и силы межионного взаимодействия заметно проявляются, даже при малой концентрации электролита, поэтому ионы не вполне свободны в своем движении, и все свойства электролита, зависящие от числа ионов, проявляются слабее, чем следовало бы ожидать при полной диссоциации электролита. Поэтому для описания состояния ионов в растворе пользуются, наряду с концентрацией ионов, их активностью, т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона связана с его молярной концентрацией в растворе соотношением:

где γ - коэффициент активности иона (безразмерная величина), зависит от состава и концентрации раствора, от заряда и природы иона (при отсутствии межионных взаимодействий) и других условий; с(Х) - концентрация вещества Х, моль/л; n - число ионов, образующихся при диссоциации одной молекулы.
В разбавленных растворах (с <0,5 моль/л) коэффициент активности зависит только от заряда иона и ионной силы раствора.
Уравнение Дебая-Хюккеля:

где γ - коэффициент активности i-го иона; zi - заряд иона; I - ионная сила.
Впервые понятие об ионной силе раствора ввел Льюис. Суммарное влияние смеси различных ионов в растворе на их активность выражают ионной силой. Ионной силой (I) раствора электролита называют величину, измеряемую полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда (z2).

где с(Х1, Х2) - концентрация ионов Х1, Х2 в растворе, моль/л.
Биологические жидкости и ткани содержат много различных электролитов NaCl, КО, СаCl2, NaH2PO4 и т.п.; их физико-химические свойства можно правильно рассмотреть только с учетом указанных закономерностей и, в частности, при определенной ионной силе, которая в биологических жидкостях равна 0,15.
4.7. ВОПРОСЫ И УПРАЖНЕНИЯ
ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ
К ЗАЧЕТАМ И ЭКЗАМЕНАМ
1. Основные понятия о растворах. Характеристика истинных растворов.
2. Какое свойство воды обеспечивает термостатирование организма, быструю миграцию ионов через мембраны, растворение и диссоциацию электролитов в клетках?
3. Какие термохимические факторы определяют возможность самопроизвольного растворения веществ?
4. Дать понятие о биологической роли гидратной оболочки веществ. Структурирующие и деструктурирующие ионы.
5. Что происходит с клеткой в гипо- и гипертоническом растворах?
6. Объясните высокую биологическую активность родниковой и дождевой воды.
7. Дать понятие о коллигативных свойствах воды.
8. Как будет меняться осмотическое давление раствора во времени, в котором происходит ферментативный гидролиз дипептида? Дайте пояснения.
9. Как будет меняться во времени осмотическое давление раствора, в котором будет происходить самопроизвольная полимеризация акриловой кислоты? Дайте пояснения.
10. Смешали равные объемы растворов хлорида натрия и сульфата натрия с равными ионными силами. Какой будет ионная сила нового раствора?
11. Определите степень диссоциации (в процентах) 0,1 М раствора уксусной кислоты, если КК = 1,8-10-5 моль/л.
12. При растворении в воде натрия сульфата, меди сульфата (безводных) наблюдается повышение температуры раствора, а при растворении кристаллогидратов CuSO4 х 5Н20 и других температура раствора понижается. Объяснить это явление.
13. Учет законов растворимости газов при работе в горных районах, профилактике кессонной болезни, лечении газовой гангрены.
4.8. ТЕСТОВЫЕ ЗАДАНИЯ
1. Какая из приведенных кислот является одновременно непрочной и слабой?
а) H2SO4;
б) Н3РО4;
в) Н2СО3;
г) HCl.
2. Какая из ниже приведенных формул является выражением закона разбавления Оствальда?
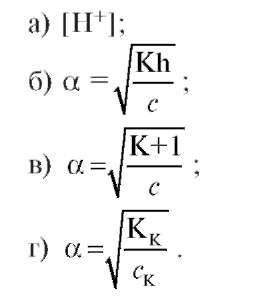

а) HCl;
б) Вa(OH)2;
в) H2SO4;
г) NaOH;
д) NH4OH.
4. Какая из приведенных кислот является кислотой средней силы?
а) H2SO4;
б) HCl;
в) H2S;
г) HClO4;
д) Н3РО4.
5. Какая из приведенных кислот является сильной, так как ее степень диссоциации не зависит от концентрации?
а) HNO2;
б) H2S;
в) HCN;
г) H2SO3;
д) HNO3.
6. Какое из приведенных соединений не является электролитом?
а) NaOH;
б) H2SO4;
в) Н3РО4;
г) (C6H12O5)n;
д) Са(OH)2.
7. Сильные электролиты - это вещества со связью:
а) ионной;
б) ковалентной неполярной;
в) водородной;
г) координационной.
8. Размер частиц растворенного вещества в истинных растворах:
а) <10-9 м;
б) находится в пределах 10-9-10-7 м;
в) >10-7 м;
г) может значительно варьировать.
9. 0,9% водный раствор хлорида натрия является:
а) гипертоническим;
б) гипотоническим;
в) изотоническим;
г) атоническим.
10. Зависимость активности от заряда иона и ионной силы раствора описывает:
а) закон Рауля;
б) закон Вант-Гоффа;
в) закон Оствальда;
г) уравнение Дебая-Хюккеля.