Руководство по кардиологии : Учебное пособие в 3 т. / Под ред. Г.И. Сторожакова, А.А. Горбаченкова. - Т. 2. - 512 с. : ил.
|
|
|
|
ГЛАВА 4 МИОКАРДИТЫ
НЕРЕВМАТИЧЕСКИЕ МИОКАРДИТЫ
Миокардит - воспалительное заболевание сердечной мышцы, вызванное инфекцией, физическими или химическими агентами, аллергическими или аутоиммунными процессами. Миокардит может быть изолированным (первичный) или являться синдромом при системных заболеваниях (вторичный). Для обозначения воспалительных заболеваний миокарда может также использоваться термин «воспалительная кардиомиопатия». Чаще всего миокардит является осложнением респираторных вирусных инфекций. Клиническая картина миокардита малоспецифична. Диагноз устанавливается на основании комплексного обследования, включающего: морфометрическиеметоды (эндомиокардиальная биопсия, коронароангиография, компьютерная томография с использовванием радиофармпрепаратов тропных к участкам воспаления), оценка функции и степени ремоделирования сердца (ЭхоКГ, ЭКГ), оценка иммуновоспалительных процессов (кардиоспецифические ферменты и белки, маркеры воспаления, иммунологические тесты), выявление этиологического фактора (культура, антитела, полимеразная цепная реакция и др.).
Миокардит может протекать в острой, подострой или хронической форме с возможным исходом последней в воспалительную ДКМП.
Фармакотерапия миокардита включает назначение этиотропных, противоспалительных, антигистаминных средств, дезагрегантов, воздействие на САС и РААС, проведение иммуномодулирующей, метаболической и цитопротекторной терапии.
Ключевые слова: миокард, воспаление, миокардит, воспалительная кардиомиопатия.
ИСТОРИЯ И ОПРЕДЕЛЕНИЕ
Миокардит - это поражение сердечной мышцы преимущественно воспалительного характера, обусловленное непосредственным или опосредованным через иммунные механизмы воздействием инфекции, паразитарной или протозойной инвазии, химических и физических факторов, а также поражения, возникающие при аллергических и аутоиммунных заболеваниях (Палеев Н.Р., 1997). Понятие «миокардит» объединяет разные по этиологии и патогенезу воспалительные заболевания миокарда, как при изолированном его поражении (первичные миокардиты), так и при системных патологических процессах (вторичные миокардиты). В последних случаях миокардит составляет только часть органных поражений и является одним из многих синдромов заболевания (например, при диффузных заболеваниях соединительной ткани, ожоговой болезни или реакции отторжения трансплантата). Миокардит является самостоятельной нозологической единицей, если имеет место изолированное поражение миокарда.
Начало исследований воспалительного поражения сердечной мышцы можно отнести к первой четверти XIX века, когда данное заболевание было впервые упомянуто J. Corvisart. Термин «миокардит» и концепция миокардита как воспалительного заболевания миокарда были предложены в 1837 г. I. Soberheim. Опираясь на дан-
ные аутопсии и микроскопии тканей сердца, В. Ruhle в 1878 г. описал острый и хронический миокардиты, рассматривая их как последовательные стадии заболевания, возникшего после перенесенной инфекции. Развитие микроскопии и бактериологии в XIX-XX вв. способствовало интенсивному изучению влияния инфекции в развитии миокардита, а многочисленные экспериментальные исследования послужили основанием для гипотезы о возможности возникновения воспаления миокарда в связи со всеми основными инфекционными заболеваниями. Постепенно, со второй половины XIX в. диагноз «миокардит» приобрел весьма широкое распространение, т.к. боли в области сердца, слабость и одышка, возникшие после инфекционного заболевания, рассматривались как проявления миокардита.
В конце XIX в. из всех кардиологических заболеваний в качестве самостоятельного направления выделилась группа, связанная с патологией коронарных артерий. В дальнейшем, после внедрения в широкую клиническую практику аппаратов, позволяющих регистрировать артериальное давление, выделилась еще одна группа сердечнососудистых заболеваний, обусловленных артериальной гипертензией. P. White (1932) и Г.Ф. Ланг (1936) показали, что при большинстве кардиологических заболеваний воспалительный процесс в миокарде отсутствует, а преобладают дегенеративные и дистрофические изменения. Поэтому неоправданно популярный диагноз «миокардит» практически полностью исчезает из научной литературы и заменяется термином «дистрофия миокарда». В 40-е годы XX в. к термину «миокардит» обращались только в связи с ревматизмом и дифтерией.
Диагноз «миокардит» вновь завоевал себе право на жизнь после Второй мировой войны. В 1947 г. J. Gore и О. Saphir опубликовали отчет о частоте встречаемости миокардита по данным аутопсии 40 тысяч пациентов, умерших от различных причин. Патоморфологические признаки воспаления в сердечной мышце были обнаружены в 1402 случаях, что составило в среднем 3,6%. Авторы указали, что воспалительный процесс в миокарде практически всегда (в 75-90% случаев) сопровождает такие заболевания, как инфекционный эндокардит, ревматизм, болезнь Чагаса, трихинеллез и риккетсиозы. При дифтерии, скарлатине, инфекционном мононуклеозе, возвратном тифе, менингококцемии, бруцеллезе, стрептококковом и пневмококковом сепсисе признаки воспаления в мышце сердца наблюдаются примерно в половине случаев. Однако при жизни кардиальные осложнения были распознаны только у четверти умерших.
В 1964 г. Нью-Йоркская ассоциация кардиологов (NYHA) предложила алгоритм клинической диагностики миокардитов, который был принят к использованию во всех странах и в течение длительного времени помогал практическим врачам диагностировать воспалительное поражение миокарда. Эта схема неоднократно редактировалась, в нее включались новые критерии, однако диагностическая эффективность алгоритма была невысока, т.к. все опорные пункты доказательства поражения мышцы сердца имели косвенный характер.
В третьей четверти XX в. для диагностики патологических изменений в сердечной мышце стали существенно чаще применяться морфометрические методы, позволяющие определить выраженность воспалительной инфильтрации в миокарде и миокардитического кардиосклероза: биопсия эндомиокарда, томосцинтиграфия сердца и магнитно-резонансная томография. В настоящее время в странах Западной Европы и Северной Америки у больных молодого возраста при наличии патологических изменений сердца (кардиомегалия, систолическая дисфункция, впервые выявленные нарушения ритма и проводимости) и при отсутствии поражений коронарных артерий считается обязательным проведение морфологической диагностики.
РАСПРОСТРАНЕННОСТЬ, КЛАССИФИКАЦИИ И ЭТИОПАТОГЕНЕЗ МИОКАРДИТОВ
Данные о частоте встречаемости миокардитов достаточно противоречивы. В статистических отчетах миокардиты не стоят в ряду первоочередных социально значимых проблем кардиологии, таких как ИБС или артериальная гипертензия. Чаще всего воспаление миокарда выявляется как осложнение острых респираторных вирусных инфекций, поэтому заболеваемость увеличивается во время эпидемических вспышек. По данным ВОЗ, установлено, что при заражении вирусами Коксаки группы А воспалительное поражение сердечной мышцы развивается в 2,9% случаев, при гриппе А - в 1,4%, при гриппе В - в 1,2%, при парагриппе - в 1,7%, при аденовирусных инфекциях - 1,0%, при воздействии вирусов герпеса - в 0,4% случаев. После бактериальных инфекций воспаление мышцы сердца развиваются в 4-5% случаев. Среди микробных возбудителей наибольшее значение в этиологии миокардитов принадлежит стрептококкам группы
А (вызывающим ангину и скарлатину), возбудителям дифтерии, брюшного тифа, стафилококкам, менингококкам, пневмококкам. Значительно реже миокардиты развиваются у больных бруцелезом, трихинелезом, токсоплазмозом, боррелиозом, хламидиозом, однако при этих инфекциях воспаление сердечной мышцы имеет в основном хронический характер.
В кардиологических стационарах, вне эпидемических вспышек инфекционных заболеваний, больные с диагнозом «миокардит» составляют 0,2-0,7%. В Вооруженных Силах РФ самостоятельной причиной госпитализации миокардит является в 3-5% случаев. При системных ревматологических заболеваниях миокардит как синдром выявляется примерно в 30% случаев. По данным патологоанатомических отделений, известно, что миокардит является причиной внезапной смерти у 3-5% больных молодого возраста. Однако патоморфологические исследования не могут дать полного представления о частоте миокардитов, так как абсолютное большинство заболевших острыми миокардитами выздоравливают. Поэтому в силу объективных трудностей диагностики, а также субъективной трактовки данных клинико-инструментальных признаков заболевания, достаточно большое количество миокардитов не диагностируется и не учитывается в статистических отчетах.
Классификации
С 1995 года действует Международная статистическая классификация болезней (МКБ-10), которая подразделяет все заболевания сердечной мышцы на миокардиты и кардиомиопатии (таблица 4.1). Острые воспалительные процессы в мышце сердца в этой классификации указаны как миокардиты, а хронические, в том числе и воспалительного генеза, названы кардиомиопатиями.
Статистическая классификация болезней является только перечислением заболеваний миокарда, не касаясь вопросов патогенеза, клинического течения, стадий и осложнений. Развернутая клиническая классификация миокардитов (Палеев Н.Р., Гуревич М.А., Палеев Ф.Н., 2002), которая подразделяет воспалительные заболевания миокарда по этиологической характеристике, по патогенетическим вариантам, по распространенности поражения мышцы сердца, течению заболевания и клиническим вариантам (таблица 4.2).
Таблица 4.1
Фрагмент Международной статистической классификации болезней десятого пересмотра, описывающий заболевания миокарда
Заболевание | Код |
Острый миокардит | I40 |
Острый ревматический миокардит | I01.2 |
Инфекционный миокардит | I40.0 |
Острый миокардит неуточненный | I40.9 |
Миокардит при вирусных болезнях, классифицированных в других рубриках | I41.1 |
Миокардит при бактериальных болезнях, классифицированных в других рубриках | I41.0 |
Миокардит при болезнях, классифицированных в других рубриках | I41 |
Миокардит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках | I41.2 |
Миокардит при других болезнях, классифицированных в других рубриках | I41.8 |
Миокардит неуточненный | I51.4 |
Поражение сердечно-сосудистой системы при других инфекционных и паразитарных болезнях, классифицированных в других рубриках | I98.1 |
Кардиомиопатия | I42 |
Кардиомиопатия при инфекционных и паразитарных болезнях, классифицированных в других рубриках | I43.0 |
Кардиомиопатия при других болезнях, классифицированных в других рубриках | I43.8 |
Другие кардиомиопатии | I42.8 |
Другие поражения сердца при бактериальных болезнях, классифицированных в других рубриках | I52.0 |
Другие поражения сердца при других инфекционных и паразитарных болезнях, классифицированных в других рубриках | I52.1 |
Таблица 4.2
Клиническая классификация миокардитов (Палеев Н.Р., Гуревич М.А., Палеев Ф.Н., 2002)
1. По этиологической характеристике и патогенетическим вариантам:
Инфекционно-иммунный и инфекционный
• вирусные (вирусы Коксаки, грипп, ЕСНО, СПИД и др.),
• внфекционные (дифтерия, скарлатина, туберкулез и др.),
• при инфекционном эндокардите,
• спирохетозные (сифилис, лептоспироз, возвратный тиф),
• риккетсиозные (сыпной тиф, лихорадка КУ),
• паразитарные (токсоплазмоз, болезнь Чагаса, трихинеллез),
• грибковые (актиномикоз, кандидоз, аспергиллез и др.). Аутоиммунный
• лекарственные,
• сывороточные,
• нутритивные,
• при системных заболеваниях соединительной ткани,
• при бронхиальной астме,
• при синдроме Лайелла,
• при синдроме Гудпасчера,
• ожоговые,
• трансплантационные. Токсикоиммунный
• тиреотоксические,
• уремические,
• алкогольные.
2. По патогенетической фазе:
• инфекционно-токсическая,
• аутоиммунная,
• дистрофическая,
• миокардиосклеротическая.
3. По распространенности:
• очаговые,
• диффузные.
4. По клиническим вариантам:
• псевдокоронарный,
• декомпенсационный,
• псевдоклапанный,
• аритмический,
• тромбоэмболический,
• смешанный,
• малосимптомный.
5. Варианты течения миокардита:
Окончание табл. 4.2
• острый миокардит легкого течения,
• острый миокардит тяжелого течения,
• миокардит рецидивирующий,
• хронический миокардит.
Комитет экспертов ВОЗ (World Heart Federation Consensus conferences definition of Inflammatory Cardiomyopathy, 1997) для обозначения всех воспалительных заболеваний сердца предлагает использовать термин «воспалительная кардиомиопатия». «Воспалительная кардиомиопатия» (inflammatory cardiomyopathy) - это целая группа заболеваний, которая включает в себя все хронические воспалительные поражения мышцы сердца, все случаи дилатационной кардиомиопатии с воспалительной инфильтрацией в миокарде, все острые или хронические миокардиты, ассоциированные с перикардитом и с сердечной дисфункцией, все случаи идиопатических, аутоиммунных и инфекционных поражений миокарда, связанных с инфекцией и систолической дисфункцией, а также все случаи миокардитического кардиосклероза (James K.B. et al., 1997; КьЫ U. et al., 1997; Maisch B. et al., 2000; Richardson P. et al., 1996). Важным является то, что понятие «воспалительная кардиомиопатия» включает в себя не только процесс воспаления, но его исход - миокардитический кардиосклероз.
Использование данного термина на практике значительно упрощает задачу врача, поскольку действительно бывает трудно определить - имеет данный процесс острый характер или же он еще впоследствии проявит себя в виде рецидива воспаления или развития сердечной недостаточности вследствие кардиосклероза. Это тем более важно, что редко, но на практике встречаются ситуации, когда воспалительный процесс имел характер типичный для острого течения, то есть с отчетливым началом и вполне отчетливым его окончанием, но в его результате сформировался достаточно выраженный фиброз, сопровождающийся электрической или механической дисфункцией (выздоровление с дефектом). Подобная ситуация может иметь место и при затяжном и даже формально хроническом течении воспаления, но все-таки в конце концов завершающемся. И все же в большинстве случаев на практике хватает критериев, позволяющих уточнить диагноз, хотя бы в системе координат «острый-хронический», «инфекционный или неинфекционный» миокардит.
Этиология и патогенез миокардитов
Выделяют инфекционные и неинфекционные миокардиты. Инфекционные и инфекционно-иммунные миокардиты могут возникать при дифтерии, ангине, туберкулезе, сыпном тифе, лептоспирозе и т.д. Описаны варианты воспалительного поражения сердечной мышцы при паразитарных и грибковых заболеваниях. Достаточно часто регистрируются миокардиты при острых вирусных заболеваниях: при гриппе, инфекционном мононуклеозе, краснухе, ветряной оспе и др. Причиной развития аутоиммунных миокардитов являются иммуноаллергические реакции с образованием комплексов антиген-антитело, что наблюдается при ожоговой болезни, лекарственной аллергии, реакции отторжения трансплантата. Аутоиммунное повреждение миокарда выявляется при системных заболеваниях соединительной ткани, бронхиальной астме, синдромах Лайелла и Гудпасчера. Миокардиты, наблюдающиеся при тиреотоксикозе, уремии, при употреблении алкоголя, нарушениях обмена веществ (меди, железа), составляют группу токсико-иммунных.
Воспалительное поражение миокарда может возникнуть после воздействия любого инфекционного возбудителя, патогенного для человека. Наибольшей кардиотропностью обладают вирусы, а вирусная этиология острых миокардитов считается наиболее аргументированной. В качестве доказательств вирусной теории выступают следующие аргументы: высокая заболеваемость миокардитами в период вирусных эпидемий; обнаружение сначала вирусов в носоглотке и испражнениях больных в течение первой недели острого миокардита, а в дальнейшем (со 2-3 недели) выявление в крови противовирусных антител; выделение из миокарда вирусов и вирусной ДНК методом полимеразной цепной реакции (ПЦР); отработана экспериментальная модель миокардита, где заболевание развивается при заражении лабораторных животных различными вирусами.
До сих пор нельзя считать решенным вопрос о длительности персистирования вируса в миокарде. Традиционные представления, сформированные в значительной степени на основании экспериментальных исследований С. Kawai (1999), предполагают, что в течение недели происходит элиминация вирусов из ткани миокарда как в случае острого, так и хронического течения миокардита. Однако результаты проведения методики полимеразно-цепной реакции в ткани сердца показали, что при хроническом течении заболевания ДНК или РНК возбудителя может обнаруживаться в течение многих месяцев.
До сих пор нельзя считать решенным вопрос о роли внутриклеточной инфекции, персистирующей в организме большинства формально здоровых людей. Речь идет о вирусах простого герпеса, вирусах Эпштейна-Барра, боррелиях, токсоплазме, хламидиях, цитомегаловирусах. Могут ли эти возбудители быть непосредственной причиной миокардита, не вполне ясно, однако можно считать доказанным, что, негативно влияя на состояние клеточного и гуморального иммунитета, они создают благоприятные условия для реализации патогенности собственно кардиотропных возбудителей.
Влияние инфекции, как непосредственной причины миокардита, прослеживается практически всегда, но не меньшая роль в патогенезе заболевания отводится аутоиммунным нарушениям. При этом считается, что именно неадекватность аутоиммунного ответа является главной причиной хронизации процесса. В ответ на проникновение вируса в макроорганизм и его репликацию увеличивается выработка интерферона, активируются моноциты, нейтрофилы, Т- и В-лимфоциты. Движение лейкоцитов в очаг воспаления идет по законам хемотаксиса, при этом большое значение имеет состояние эндотелия. В обычных условиях циркулирующие лейкоциты вступают лишь в кратковременные контакты с эндотелиальными клетками, они как бы скользят по поверхности сосудистой стенки. При повреждении эндотелия и кардиомиоцитов, лейкоциты закрепляются на их поверхности посредством взаимодействия лейкоцитарных адгезионных молекул с соответствующими лигандами клеток-мишеней. Адгезионные молекулы способствуют прочной фиксации на поверхности кардиомиоцита цитотоксических Т-лимфоцитов и Т-киллеров, содержащих в цитоплазматических гранулах перфорин (протеин, формирующий поры). Именно перфорин способствует цитолизу пораженной вирусом клетки путем ступенчатого апоптоза. Адгезионные молекулы являются, с одной стороны, лигандами для связывания цитотоксических Т-лимфоцитов с кардиомиоцитами, а с другой - неоантигенами. Поверхность миоцита, на котором фиксировались адгезионные молекулы, приобретает аутоантигенные свойства, в том числе и способность индуцировать выработку соответствующих аутоантител. Другими неоантигенами для продукции антител выступают белки цитоскелета (аденозин-нуклеотидный транслокатор, актин, миозин, десмин, виметин и т.д.), т.к. их антигенная структура совпадает с последовательностью нуклеотидов в некоторых локусах вирусных мембран. Последствием реакции аутоантиген-аутоантитело является
нарушение проницаемости мембран кардиомиоцитов, что приводит к снижению энергопродукции в митохондриях, нарушению сократительной способности клетки или даже к гибели кардиомиоцита.
У больных миокардитом (особенно с неблагоприятным течением) увеличивается концентрации цитокинов (фактора некроза опухоли-α, интерферона-α, Ил-1а, Ил-1р, Ил-12), повышающих функциональную активность Т-хелперов 1-го типа, т.е. усиливающих цитотоксический и противовирусный потенциал иммунокомпетентных клеток (что обеспечивает успешную элиминацию возбудителя). Одновременно с этим возрастает и концентрация цитокинов (Ил-4 и Ил-6), регулирующих активность Т-хелперов 2-го типа, благодаря чему интенсивность воспалительной реакции в миокарде может снижаться. Следствием цитокинового дисбаланса является чрезмерная активация цитотоксических реакций, непосредственное воздействие ряда цитокинов на миокардиальные клетки и опосредованное (через образование антител) цитотоксическое воздействие Т-киллеров на непораженный вирусом миокард. При длительной персистенции вирусных частиц или соответствующего геномного материала в ткани сердца больного и чрезмерной активизации аутоиммунных реакций заболевание достаточно часто приобретает затяжное или хроническое течение, что приводит впоследствии к избыточному процессу фиброзирования в мышце сердца.
В ходе воспалительных и иммунных реакций в миокарде высвобождаются многие биологически активные вещества (простагландины, кинины, серотонин, гистамин, ацетилхолин и др.), способствующие повышению проницаемости сосудов, вызывающих отек, геморрагии и гипоксию. В местный воспалительный процесс вовлекаются сосуды микроциркуляторного русла, в которых отмечается альтеративно-продуктивное воспаление, приводящее к образованию микротромбов, а в дальнейшем - к избыточному кардиосклерозу. Замыкается круг аутоиммунных реакций, а ДНК возбудителя, спровоцировавшего аутоиммунный каскад, может либо элиминироваться, либо длительно персистировать in situ, повторяя иммуновоспалительные реакции с поражением все новых кардиомиоцитов.
ДИАГНОСТИКА МИОКАРДИТОВ
Клиническая картина миокардита малоспецифична и зависит от вида и вирулентности возбудителя, резистентности макроорганизма,
выраженности воспалительной инфильтрации и фиброза в миокарде, степени вовлечения в воспалительный процесс других органов и систем, что влияет на течение и исход заболевания в целом.
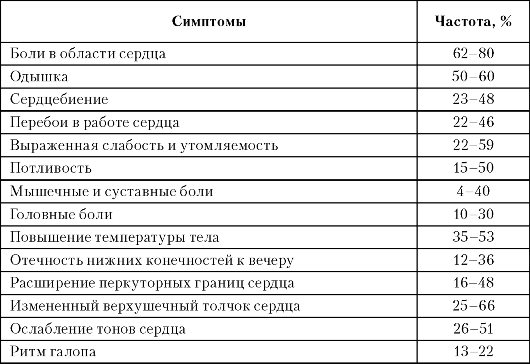
Острый миокардит, развивающийся на фоне острого инфекционного заболевания (грипп, дифтерия, брюшной тиф и пр.), дает более четкую клиническую картину с характерными кардиальными жалобами и объективными симптомами, указывающими на поражение мышцы сердца. При миокардитах хронического течения, связь начала заболевания сердца с перенесенной инфекцией, как правило, отсутствует, при этом жалобы больных и клинические симптомы часто имеют неотчетливый характер. Примерно в 25% случаев хронический миокардит имеет малосимптомное течение, где регистрируется только изменение на ЭКГ и отклонения лабораторных тестов. В таблице 4.3 представлены обобщенные данные литературы по частоте встречаемости кардиальных жалоб и клинических признаков заболевания, выявляемых у больных миокардитом и острого, и хронического течения.
Таблица 4.3
Частота встречаемости субъективных и объективных клинических симптомов у больных миокардитом
 Окончание табл. 4.3
Окончание табл. 4.3
 Клиническая
диагностика миокардитов затруднительна, т.к. какого-либо одного
объективного симптома, лабораторного показателя или инструментального
синдрома, патогномоничного для воспалительного поражения миокарда, не
существует. Окончательный диагноз должен устанавливаться после
тщательного изучения данных анамнеза, врачебного осмотра и результатов
обследования, при этом существенное значение имеют опорные
клинико-инструментальные критерии (синдромы) заболевания.
Клиническая
диагностика миокардитов затруднительна, т.к. какого-либо одного
объективного симптома, лабораторного показателя или инструментального
синдрома, патогномоничного для воспалительного поражения миокарда, не
существует. Окончательный диагноз должен устанавливаться после
тщательного изучения данных анамнеза, врачебного осмотра и результатов
обследования, при этом существенное значение имеют опорные
клинико-инструментальные критерии (синдромы) заболевания.
Известные диагностические критерии миокардита (NYHA, 1964, 1973, 1980) в значительной мере сохраняют свое клиническое значение, однако не полностью решают проблемы клинической диагностики и дифференциации заболеваний миокарда (таблица 4.4).
Перечисленные в таблице 4.4 критерии диагностики миокардита не учитывают ни жалобы больных, ни клинические симптомы заболевания, а главным образом констатируют изменения лабораторных тестов и инструментальных показателей, характеризующих электрическую и систолическую функции сердца в связи с острым инфекционным заболеванием.
Диагноз миокардита правомочен при сочетании предшествующей инфекции (или другого этиологического фактора, например лекарственной аллергии) с двумя или более из указанных признаков поражения миокарда: с патологическими изменениями ЭКГ, с повышением уровня КФК или ЛДГ, кардиомегалией, с застойной сердечной недостаточностью, с тахикардией и др. По этой схеме возможна и целесообразна диагностика острых миокардитов. Выявление же миокардита хронического течения по этой схеме весьма затруднительно. Если при тщательном подходе у больных с подозрением на миокардит хронического течения удается определить 1-2 больших
Таблица 4.4
Алгоритм клинико-инструментальной диагностики миокардитов NYHA
и 1-2 малых признака, то подтвердить непосредственную связь с инфекцией, обнаружить повышение биохимических маркеров воспаления и кардиоселективных ферментов не всегда возможно.
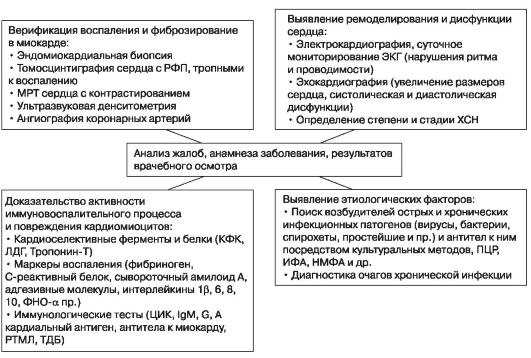
В конце ХХ в. были разработаны и внедрены в клиническую практику неинвазивные методы верификации воспалительной инфильтрации и миокардитического кардиосклероза, появились новые данные по этиологии и патогенезу заболевания. В 2004 г. был апробирован и предложен алгоритм диагностики, который позволяет доказать наличие воспалительной инфильтрации в миокарде не только косвенными, но и прямыми (морфометрическими) методами, что практически решает дифференциальной диагностики миокардита хронического течения с другими синдромосходными заболеваниями (таблица 4.5).
Данная диагностическая схема представляет собой комплекс лабораторно-инструментальных методов, сгруппированных в четыре диагностических направления. Первое (основное) диагностическое направление включает морфометрические методы, позволяющие получить информацию о наличии или отсутствии воспалительной инфильтрации в миокарде, ее локализации и распространенности, а
Критерии диагностики: I. Связь с перенесенной инфекцией, доказанная клинически и лабораторными данными: выделение возбудителя, его антигенов, выявление антител к инфекционным патогенам, а также лейкоцитоз, ускорение СОЭ, появление С-реактивного белка. II. Признаки поражения миокарда. Большие признаки: • патологические изменения на ЭКГ (нарушения реполяризации, ритма и проводимости); • повышение концентрации кардиоселективных ферментов и белков (КФК, КФК-МВ, ЛДГ, тропонин-Т); • увеличение размеров сердца по данным рентгенографии или эхокардиографии; • застойная сердечная недостаточность (застойные хрипы в легких, отеки на нижних конечностях); • положительные иммунологические тесты. III. Малые признаки: тахикардия (или брадикардия), ослабление первого тона, ритм галопа. |
Таблица 4.5
Диагностический алгоритм миокардита хронического течения
 также
о наличии и выраженности фиброза в мышце сердца. Сюда же включены
методики, показывающие состояния коронарных артерий сердца (селективная
ангиография коронарных артерий или мультиспиральная компьютерная
томография сердца с контрастированием). Второе диагностическое направление позволяет выявить ремоделирование сердца и нарушение функции миокарда (электрическая и механическая дисфункции). Третье направление дает информацию о повреждении кардиомиоцитов и об активности иммуновоспалительного процесса, четвертое диагностическое направление показывает
этиологические факторы воспалительного поражения миокарда (наличие
вирусов, бактерий, спирохет, простейших и антител к ним).
также
о наличии и выраженности фиброза в мышце сердца. Сюда же включены
методики, показывающие состояния коронарных артерий сердца (селективная
ангиография коронарных артерий или мультиспиральная компьютерная
томография сердца с контрастированием). Второе диагностическое направление позволяет выявить ремоделирование сердца и нарушение функции миокарда (электрическая и механическая дисфункции). Третье направление дает информацию о повреждении кардиомиоцитов и об активности иммуновоспалительного процесса, четвертое диагностическое направление показывает
этиологические факторы воспалительного поражения миокарда (наличие
вирусов, бактерий, спирохет, простейших и антител к ним).
Практическая реализация диагностических методик, входящих в алгоритм, не предполагает строго определенной последовательности, но по каждому диагностическому блоку должна быть получена максимально исчерпывающая информация. Параллельно определяется круг сопутствующих и синдромо-сходных заболеваний. Окончательный диагноз устанавливался на основании всех резуль-
татов комплексного обследования. Обобщив данные клинического, лабораторного и инструментального обследования по всем четырем диагностическим направлениям, можно утверждать о наличии или отсутствии у больного миокардита хронического течения.
Диагностическая ценность изложенной выше схемы обследования больного для верификации воспалительного поражения миокарда составляет 93-99%. Дублирование и повторение методов оценки выраженности воспаления и фиброза в миокарде повышает достоверность полученных результатов. Исключение из плана обследования иммунологических и особенно морфометрических методик значительно снижает достоверность всего диагностического комплекса до 65-73%.
Морфометрические методы диагностики миокардитов
Для установления окончательного диагноза, что особенно важно в случаях проведения экспертизы, необходимо подтверждать воспаление и его последствия морфометрическими методами, т.к. все изменения, выявленные при лабораторном (в т.ч. иммунологическом обследовании), с помощью ЭКГ и ЭхоКГ, не являются специфичными признаками, характерными только для миокардита. К морфометрическим методам относятся биопсия миокарда с последующим гистологическим изучением микропрепаратов, томосцинтиграфия сердца с «воспалительными» и кардиотропными радиофармпрепаратами и магнитно-резонансная томография сердца с контрастированием.
Эндомиокардиальную биопсию (ЭМБ) целесообразно проводить для определения причин труднообъяснимой дилатации или локальной гипертрофии сердца, а также при констриктивных и рестриктивных заболеваниях. Для морфологического подтверждения диагноза считается необходимым получить от 3 до 7 биоптатов сердца (но не менее 3). Основным морфологическим признаком воспаления является наличие клеточной инфильтрации, которая состоит из лимфоцитов, нейтрофилов, эозинофилов и гистиоцитов. Помимо воспалительной инфильтрации можно выявить отек межклеточного пространства, полнокровие сосудов микроциркуляторного русла, набухание эндотелия, дистрофические изменения кардиомиоцитов и миокардитический кардиосклероз.
Оценку результатов ЭМБ проводят по критериям морфологической классификации миокардита, принятым в 1984 в Далласе.
При первичной ЭМБ делают следующие варианты заключений: а) активный миокардит с фиброзом или без фиброза; б) пограничный миокардит с фиброзом или без фиброза (в этом случае возможна повторная биопсия); в) отсутствие миокардита. Заключениями повторной ЭМБ могут быть следующие: а) продолжающийся миокардит с фиброзом или без фиброза; б) разрешающийся миокардит с фиброзом или без него; в) разрешившийся миокардит с фиброзом или без него. Для активного миокардита характерно наличие 14 и более лимфоцитов в поле зрения (при увеличении микроскопа в 400 раз), для пограничного - от 5 до 14 клеток, при отсутствии миокардита - в поле зрения должно быть 4 и менее клеток воспаления. В соответствии с Марбургским соглашением Комитета экспертов ВОЗ (1997) далласские критерии были уточнены и дополнены. Рекомендовано выделять активный миокардит с фиброзом или без фиброза, хронический миокардит с фиброзом или без фиброза и отсутствие миокардита. Отличия Марбургских морфологических критериев от далласских заключается в следующем: 1) оценка гистологического препарата проводится не в одном поле зрения, а на площади 1 мм2; 2) количество клеток воспаления при активном миокардите должно быть не менее 14, но не в поле зрения, а на площади 1 мм2; 3) при хроническом миокардите рекомендовано иммуногистохимическое выявление специфических Т-лимфоцитов (CD-45) в мышце сердца, которые являются признаком хронического воспаления. Следует учесть, что ЭМБ не дает полной гарантии постановки диагноза, поскольку достаточно высока вероятность забора неизмененной ткани и получения ложноотрицательного результата. Опыт многих авторов показал, что ЭМБ подтверждает клинический диагноз миокардита только в 17-50% случаев.
Для определения наличия лейкоцитарной инфильтрации в мышце сердца и выраженности перфузионных нарушений, помимо биопсии, в клинической практике используется однофотонная эмиссионная компьютерная томография сердца (ОФЭКТ) с различными радиофармпрепаратами (РФП). Для верификации воспаления используют РФП, которые избирательно накапливаются в зоне воспаления: цитрат галлия-67 (67Ga); аутолейкоциты, меченные технецием-99 или индием-111-оксимом (111In) и антитела к миозину, меченные 111In. ОФЭКТ позволяет получать качественные многомерные изображения миокарда с толщиной каждого томографического скана до 0,88 см. Таким образом, при анализе серии компьютерных срезов
сердца можно определить наличие и протяженность лейкоцитарной инфильтрации в миокарде.
При радиоизотопном исследовании, помимо определения площади воспаления в миокарде, необходимо проведение повторной томосцинтиграфии с перфузионными РФП. Для этого используют такие РФП, как 99Тс-технетрил (или "Тс-MIBI) и излучающие нуклиды таллия хлорида-201 (201Tl). Перфузионный РФП накапливается в интактной ткани сердечной мышцы, оставляя участки ишемии, некроза и кардиосклероза в виде «дефектов накопления». Для диагностики стенозирующего атеросклероза коронарных артерий необходимо выполнение нагрузочных проб (велоэргометрия, тредмил, проба с допамином), и на высоте нагрузки, когда создаются условия несоответствия доставки кислорода в ткани и его повышенным потреблением, вводят перфузионный РФП, а затем проводят сцинтиграфию миокарда. ОФЭКТ сердца, выполненная в покое, используется для оценки микроциркуляторного русла, а нарушение микроциркуляции у больных миокардитом при сохранении магистрального кровотока по венечным артериям чаще всего связано с миокардитическим кардиосклерозом.
Таким образом, проведение радиоизотопной диагностики в комплексе из двух исследований позволяет оценить наличие воспалительной инфильтрации в миокарде, а также определить нарушение перфузии, что может быть связано с миокардитическим кардиосклерозом. Диагностическая ценность комплексной радиоизотопной диагностики достигает 80-85%.
Воспалительную инфильтрацию в миокарде можно выявить посредством магнитно-резонансной томографии (МРТ) с контрастированием парамагнитными контрастирующими препаратами. Метод МРТ позволяет визуализировать участки внеклеточной воды, что характерно для отека в миокарде. Исследование проводится в два этапа. Сначала необходимо выполнить первичную МРТ сердца, затем внутривенно ввести парамагнитный контраст и через 10-30 минут провести повторное магнитно-резонансное исследование. Контраст избирательно накапливается в участках внеклеточной воды и изменяет резонансные свойства тканей, т.е. по серии изображений миокарда до и после контрастирования можно судить о локализации и протяженности воспалительной инфильтрации в миокарде. Диагностическая ценность магнитно-резонансной томографии сердца с контрастированием при выявлении миокардита составляет около 80%.
Кроме выявления воспалительной инфильтрации, целесообразно исключить наличие патологии венечных сосудов как причины формирования болевого синдрома, изменений ЭКГ, дисфункции ЛЖ и биохимических отклонений. Коронарная патология в варианте аномалии развития является достаточно редким, но все же весьма вероятным событием даже у лиц молодого возраста. Для верификации стенозирующего поражения коронарных артерий, помимо стандартных методов функциональной диагностики (суточного мониторирования ЭКГ, нагрузочных и медикаментозных ЭКГ-пробы, стресс-ЭхоКГ), верификация диагноза может потребовать проведение селективной или компьютерной коронароангиографии.
Функциональные методы диагностики миокардитов
Функциональные методы позволяют выявить электрическую и механическую дисфункции сердца, для чего регистрируют параметры ЭКГ в покое, проводят суточное мониторирование ЭКГ, ультразвуковое исследование сердца и изучают появление признаков ХСН при дозированной физической нагрузке. Патологические электрокардиографические изменения при миокардитах наблюдаются у 50-90% больных, они неспецифичны и связаны не только с воспалительной инфильтрацией, но и с дистрофией кардиомиоцитов, и с миокардитическим кардиосклерозом. В зависимости от локализации воспалительного процесса отмечается значительная вариабельность изменений на ЭКГ. Воспалительная инфильтрация, локализованная преимущественно в области предсердий, может сопровождаться синусовой тахикардией, суправентрикулярной экстрасистолией и мерцательной аритмией. Вовлечение в патологический процесс МЖП способно вызвать нарушение предсердно-желудочковой проводимости и блокаду ножек пучка Гиса. Реполяризационные изменения конечной части желудочкового комплекса отмечаются при появлении жидкости в полости перикарда, при дистрофии кардиомиоцитов и при миокардитическом кардиосклерозе.
К наиболее частым ЭКГ-синдромам миокардитов по миннесотскому коду относят изменение зубца Т (уплощение и инверсия), которое встречается у 50-70% больных. Вторым по частоте проявлением на ЭКГ является изменение сегмента ST (30-50%). Сегмент ST-T может смещаться вниз или вверх от изоэлектрической линии в зависимости от поражения субэндоили субэпикардиальных слоев миокарда и сопутствующего перикардита. Третьим по вероятности обнаружения
ЭКГ-синдромом является наджелудочковая и желудочковая экстрасистолия (25-45%). Экстрасистолы могут быть единичными и множественными, может регистрироваться пароксизмальная мерцательная аритмия и желудочковая тахикардия. Нарушения проводимости (синоатриальные и атриовентрикулярные блокады) наблюдаются достаточно редко - только в 5-15% случаев, значительно чаще (до 30%) отмечаются блокады ножек пучка Гиса.
Использование суточного мониторирования ЭКГ позволяет регистрировать преходящие нарушения ритма и проводимости. Если нарушения ритма, проводимости и реполяризационные изменения выявляются на протяжении нескольких месяцев и лет, то следует думать о наличии миокардитического кардиосклероза. В редких случаях (у 0,5-3% больных) миокардит может стать причиной развития крупных очагов некроза. В подобных случаях на ЭКГ отмечаются изменения, характерные для острого инфаркта миокарда (формируется патологический зубец QS) в соответствующих отведениях.
Косвенные признаки воспалительного поражения миокарда могут выявляться с помощью ЭхоКГ. К этим признакам относятся дилатация камер сердца, снижение систолической функции (ФВ) и наличие жидкости в полости перикарда (сопутствующий перикардит). Значимость этих признаков повышается, если они развиваются за короткое время. Дилатация камер сердца выявляется у 25-40% больных, она может быть аневризматической или равномерной. Аневризматическое расширение ЛЖ при миокардитах связано в основном с развитием крупноочагового миокардитического кардиосклероза. Увеличение систолических и диастолических размеров ЛЖ может сопровождаться компенсаторной гипертрофией миокарда. Особенностью эхокардиографической картины миокардита в отличие от ИБС является более частое увеличение размеров правого желудочка.
Важным показателем, позволяющим объективно отслеживать увеличение камер сердца при динамическом наблюдении, является индекс сферичности, который рассчитывается по четырехкамерному изображению сердца в диастолу и является отношением продольного размера полости ЛЖ (от верхушки сердца до линии клапанного кольца) к максимальному поперечному размеру в средней трети ЛЖ. В норме индекс сферичности составляет 1,8-1,6. Снижение этого показателя в динамике до 1,5 и ниже свидетельствует о прогрессирующей дилатации левого желудочка.
При миокардитах в 10-20% случаев на ЭхоКГ выявляется сопутствующий перикардит в виде сепарации листов перикарда. Очень редко перикардит бывает «сухим» (1-5% случаев) с характерными аускультативными феноменами, в основном это экссудативный перикардит. Объем жидкости в полости перикарда редко бывает значительным, чаще регистрируется расхождение листов перикарда в области задней стенки ЛЖ до 1,0 см.
В 15-30% случаев у больных миокардитом снижается систолическая функция ЛЖ, а изменение диастолической функции ЛЖ выявляется у 35-50% пациентов. При этом чаще диастолическая дисфункция свидетельствует не о выраженности воспалительного процесса, наличии фиброзных изменений в ткани миокарда. Нарушение диастолической функции ЛЖ диагностируется по кривой трансмитрального кровотока при проведении ЭхоКГ.
В 15-36% случаев у больных миокардитом выявляются признаки хронической сердечной недостаточности (ХСН). Помимо классических критериев функционального класса ХСН в силу весьма частой неотчетливости клинических проявлений и одновременно оценки компенсаторных возможностей организма целесообразно оценить общее состояние больного по шкале оценки клинических показателей (В.Ю. Мареев, 2000). Затем следует определить параметры физической активности по тесту с 6-минутной ходьбой, изучить систолическую и диастолическую функции ЛЖ по данным ЭхоКГ, рассчитать ударный индекс и общее периферическое сопротивление артериального русла по данным тетраполярной реографии.
АД зависит от выраженности поражения миокарда и от активности периферических компенсаторных механизмов. При тяжелом поражении мышцы сердца систолическое АД понижается, а диастолическое повышается либо существенно не меняется. В период выздоровления при остром миокардите АД может повышаться, как систолическое, так и диастолическое.
На рентгенограмме органов грудной клетки у 15-30% больных миокардитом отмечается увеличение тени сердца как за счет левого, так и за счет правого желудочка. У 10-20% пациентов выявляется усиление легочного рисунка за счет венозного застоя, что косвенно свидетельствует о снижении сократительной способности миокарда.
Лабораторные методы диагностики миокардитов
Лабораторное обследование при миокардитах должно включать изучение показателей кардиоселективных ферментов, воспалительных белков и проведение иммунологических тестов. Повышение концентрации КФК, КФК-МВ и ЛДГ выявляется только у 25-40% больных, причем эти показатели превышают нормативные значения всего на 20-50%. Отмечается лабильность концентрации вышеуказанных ферментов, уровень которых нормализуются у больных как острым, так и хроническим миокардитом через 2-5 дней постельного режима и проведения терапии. Кардиальные белки тропонин-Т и I выявляются в крови у 30-40% больных, но сохраняются в циркуляции до 10-20 суток.
У 25-60% больных миокардитом отмечается повышение биохимических маркеров воспаления. Увеличивается количество α-, β- и γ-глобулинов, С-реактивного белка и фибриногена. Однако изменение биохимических показателей при миокардитах чаще затрагивает 1-2 лабораторных теста.
Более чувствительными для выявления воспаления в миокарде являются иммунологические методики. При миокардите у 40% больных миокардитом в сыворотке крови выявляются кардиальные антигены, которые циркулируют до 4-6 месяцев, а у 70% пациентов выявляются антикардиальные антитела к различным белкам цитоскелета кардиомиоцита, находящиеся в циркуляции до 1,5 лет. Регистрируется повышение концентрации провоспалительных цитокинов - интерлейкинов 1β, 8, 10, а также фактора некроза опухоли-α, интерферона-α и адгезионных молекул. У 75% больных миокардитом отмечается гиперчувствительность лимфоцитов к ткани миокарда (в реакции торможения миграции лимфоцитов) и положительный тест дегрануляции базофилов (ТДБ). Базофилы и тучные клетки являются клетками-мишенями, на поверхности которых протекает реакция антиген-антитело с дегрануляцией этих клеток и высвобождением биологически активных веществ. У 90% больных миокардитом ТДБ превышает норму в 2-3 и более раз, что позволяет использовать его в диагностических целях.
Этиологическая диагностика миокардитов
При обследовании больных миокардитами весьма важно постараться выявить этиологические причины миокардита. Воспаление в сердечной мышце может быть осложнением любого острого инфек-
Таблица 4.6
Шкала оценки клинического состояния больных с ХСН
Клинический признак | Количество баллов | |||
0 | 1 | 2 | 3 | |
Одышка | нет | при нагрузке | в покое | |
Изменение веса за последнюю неделю | нет | увеличился | ||
Перебои в работе сердца | нет | есть | ||
Положение в постели | горизонтально | с поднятым изголовьем | просыпается от удушья | сидя |
Набухшие шейные вены | нет | лежа | стоя | |
Хрипы в легких | нет | в нижних отделах (ДО Уз) | до лопаток (до 2/3) | над всей поверхностью легких |
Ритм галопа | нет | есть | ||
Печень | не увеличена | выступает до 5 см | выступает более 5 см | |
Отеки | нет | пастозность | отеки | анасарка |
Уровень систолического АД | более 120 мм Hg. | 100-120 мм Hg. | 100 мм Hg. | |
Примечание. Баллы суммируются: 0 баллов - ХСН-0; 1-5 баллов - ХСН I ф.к.; 6-10 баллов - ХСН II ф.к.; 11-15 баллов - ХСН III ф.к.; 16-20 баллов - ХСН (IV ф.к.)
ционного процесса, поэтому при сборе анамнеза заболевания необходимо уточнить перенесенные заболевания.
Диагностический поиск необходимо проводить по следующим направлениям:
1) обследование крови на наличие антигенов и специфических антител как острых, так и хронических инфекционных патогенов;
2) целенаправленное выявление очагов хронической инфекции. В случаях манифестации миокардита через 2-3 недели после
перенесенного острого респираторного заболевания следует провести обследование крови на наличие антигенов и антител к вирусам гриппа А, Коксаки А и аденовирусам, т.к. они обладают наибольшей кардиотропностью. Если признаки миокардита появились после перенесенной ангины, необходимо изучать посевы слизи из зева и носоглотки на наличие патогенных стрептококков, стафилококков и возбудителей дифтерии, параллельно с этим целесообразно определить антитела к этим возбудителям. В случаях появления признаков сердечного заболевания после острых кишечных инфекций следует проводить посевы кала на дизентерийную группу, сальмонеллез, брюшной тиф и паратифы с обязательным исследованием крови на специфические антитела к этим возбудителям. Если больной параллельно с жалобами кардиологической направленности отмечает упорные артралгии, необходимо дополнительное обследование для исключения ревматизма, ревматоидного артрита и других заболеваний соединительной ткани, а также проводить микробиологическое обследование на наличие хламидийной инфекции и клещевого Лайм-боррелиоза.
Следует учесть, что не всегда, даже при острых миокардитах, удается верифицировать возбудителя острой инфекции. Воспалительное заболевание миокарда могут провоцировать возбудители хронических инфекций (вирусы простого герпеса, вирусы Эпштейна-Барр, боррелии, токсоплазмы, хламидии, цитомегаловирусы, вирусы гепатита В и С). Эти внутриклеточные инфекционные патогены способны к длительной персистенции в организме, негативно влияя на состояние клеточного и гуморального иммунитета и создавая тем самым благоприятные условия для реализации патогенности кардиотропных возбудителей.
В настоящее время в лабораторной диагностике инфекций приоритетными считаются методики выявления ДНК-возбудителя посредством полимеразной цепной реакции и определение в крови
специфических антител к инфекционным патогенам посредством иммуноферментного анализа или методом флюоресценцирующих антител.
Помимо микробиологического обследования, необходимо проводить у больных целенаправленное выявление очагов хронической инфекции (тонзиллит, гайморит, глубокий кариес, периодонтит, аднексит, простатит и др.) как при первичном врачебном осмотре, так и при дополнительном инструментальном обследовании (рентгенография придаточных пазух носа, ортопантомография), для чего целесообразно привлекать к осмотрам соответствующих специалистов - стоматологов, оториноларингологов, урологов, гинекологов.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ МИОКАРДИТОВ
Воспалительные заболевания мышцы сердца могут протекать в острой, подострой (затяжной) и хронической формах с постепенным исходом в застойную сердечную недостаточность.
Острый миокардит, как правило, проявляется на фоне острого инфекционного заболевания (грипп, дифтерия, менингит, брюшной тиф, геморрагические лихорадки и др.), а после проведения адекватной терапии все клинические симптомы и патологические изменения лабораторно-инструментальных показателей быстро купируются. В терапевтический стационар больные миокардитом как правило попадают либо через 1-2 месяца после острого инфекционного заболевания, перенесенного «на ногах», либо после активизации эндогенной хронической инфекции. В большинстве случаев «терапевтический» миокардит изначально бывает затяжным или хроническим. Точные сроки трансформации острого миокардита в хронический неизвестны, но в литературе указываются временные интервалы от 3 до 6 месяцев и больше.
Клиническое течение миокардитов бывает разнообразным:
1) с выздоровлением при адекватном лечении или быстро наступающей смертью;
2) с медленно прогрессирующей дилатацией и гипертрофией сердца;
3) с повторными обострениями и нарастанием сердечной недостаточности.
Данные проспективных клинических исследований свидетельствуют, что обратное развитие клинической симптоматики после проведенного лечения отмечается примерно у 60-70% пациентов, но об их выздоровлении можно говорить не ранее, чем через 6-12 месяцев после проведенной терапии. У 15-20% больных заболевание имеет рецидивирующее течение с исходом каждого эпизода воспаления в кардиосклероз и с неуклонным прогрессированием застойной сердечной недостаточности. В 5-10% случаев миокардит имеет непрерывнопрогрессирующее течение. Летальные исходы заболевания, несмотря на лечение, отмечаются в 1-5% случаев. По данным В.А. Максимова (1979), который наблюдал больных миокардитом в терапевтическом стационаре в течение 5 лет, выздоровление отмечено в 30% случаев, частичное улучшение имело место у 50% пациентов, а у 20% возникли рецидивы заболевания. М.А. Гуревич и соавт. (1981) наблюдал рецидивы миокардита у 23% больных.
К фактором, неблагоприятно влияющим на течение и исход миокардитов, относятся: снижение ФВ меньше 35%; увеличение диастолического размера ЛЖ более 65 мм; ХСН III-IV ф.к.; признаки крупноочагового миокардитического кардиосклероза (зубец QS на ЭКГ и аневризма ЛЖ на ЭхоКГ) и повышение центрального венозного давления более 25 мм водного столба (Палеев Н.Р. и др., 1988, 1989). Все летальные исходы при миокардитах связаны либо с застойной сердечной недостаточностью, либо с нарушениями ритма и проводимости (фибрилляция желудочков, остро возникшая AV блокада II-III ст., тахисистолическая форма мерцательной аритмии), либо с тромбэмболическими осложнениями.
По мнению К. Валгма (1990), прогноз миокардита зависит от площади воспаления в миокарде, а также от частоты рецидивов заболевания. Каждый последующий рецидив заболевания постепенно увеличивает функциональный класс сердечной недостаточности, выраженность нарушений ритма и риск тромбоэмболических осложнений. A. D'Ambrosio с соавт. (2001) также связывает неблагоприятное течение миокардита с частотой рецидивов, со снижением систолической функции ЛЖ, дилатацией сердца, нарушениями ритма и проводимости (постоянная форма мерцательной аритмии, желудочковая тахикардия и AB-блокада).
Рецидивы заболевания зависят от состояния гуморального иммунитета, особенно от концентрации фактора некроза опухоли-α, интерферона-α и антител к миокарду, т.к. они, вызывая цитотокси-
ческие реакции, поддерживают и воспалительный процесс, и фиброзирование в сердечной мышце (Палеев Ф.Н., 2004). Носительство хронической очаговой и внутриклеточной инфекции является самостоятельным неблагоприятным фактором, способным поддерживать хроническое воспалительное поражение в миокарде, через развитие перекрестных аутоиммунных реакций.
Наиболее важными показателями, свидетельствующими о стойкой клинико-лабораторной ремиссии миокардита, являются: отсутствие прогрессирующей дилатации сердца, увеличение ФВ, постоянная масса тела, стабилизация и регресс признаков ХСН, стабилизация нарушений ритма и проводимости, отсутствие в крови кардиальных антигенов и адгезионных молекул; снижение концентрации антител к миокарду, интерлейкинов 1, 6, 8, фактора некроза опухоли-α, интерферона-α, а также отсутствие рецидивов миокардита в течение года после проведенного лечения.
ЛЕЧЕНИЕ БОЛЬНЫХ МИОКАРДИТАМИ
Все миокардиты вне зависимости от этиологии имеют в целом сходный набор основных элементов патогенеза. К ним относятся: инфекционно-обусловленное воспаление, неадекватный иммунный ответ, гибель кардиомиоцитов (вследствие некроза и прогрессирующей дистрофии), миокардитический кардиосклероз (заместительный и избыточный), а также нарушение метаболизма кардиомиоцитов (нарушение продукции АТФ и дисбаланс между свободнорадикальным окислением и антиоксидантной защитой). Именно эти факторы, в разной степени выраженности, являются морфологической основой клинических проявлений заболевания, таких как боли в области сердца, признаки ХСН, иммуновоспалительный и интоксикационный синдромы, нарушения сердечного ритма и проводимости.
Стационарный этап лечения и реабилитации составляет от 3 до 8 недель в зависимости от тяжести состояния. Он предполагает решение трех основных вопросов: проведение медикаментозной терапии, санацию очагов хронической инфекции и начальную физическую реабилитацию. Медикаментозное лечение включает назначение этиотропных, противовоспалительных, антигистаминных средств, дезагрегантов, препаратов, уменьшающих активность ренин-ангиотензин-альдостероновой и симпат-адреналовой систем, а также
проведение иммунокоррегирующей, метаболической и цитопротективной терапии.
Патологической основой миокардита является инфекционно обусловленное воспаление. Выраженность воспалительных реакций определяется вирулентностью возбудителя и адекватностью иммунного ответа организма. Бактерии вызывают более выраженное воспаление, однако они легче поддаются воздействию антибиотиков и в меньшей степени вызывают хронизацию процесса. Этиотропное лечение миокардитов вызванных бактериями, целесообразно проводить антибиотиками (предпочтительнее цефалоспоринами). Наличие хронической внутриклеточной инфекции предопределяет иной подход к этиотропной терапии. При лечении миокардитов, где причиной заболевания являются внутриклеточные патогены, необходимо прибегать к повторным курсам антибиотиков (макролиды, фторхинолоны) в сочетании с экзогенными интерферонами и индукторами эндогенного интерферона (неовир, виферон). Экзогенный интерферон является наиболее эффективным средством в случаях вирусного поражения миокарда.
Для купирования воспалительной реакции in situ необходимо назначение противовоспалительных и антигистаминных средств: коротких курсов нестероидных противовоспалительных препаратов (метиндол, диклофенак и пр.) параллельно с антигистаминными средствами (супрастин, тавегил). В дальнейшем целесообразно длительное применение делагила (до 4-6 мес). Назначения стероидных противовоспалительных средств (преднизолон, дексаметазон и др.) целесообразно только в тех случаях, когда доказан выраженный аутоиммунный компонент воспаления, т.е. выявлены кардиальный антиген, антитела к миокарду, значительно повышена концентрация ФНО-α и интерферона-α.
Преднизолон лучше назначать коротким курсом в виде пульстерапии (внутривенно через день 5 инъекций в дозе 3-5 мг/кг массы тела больного). Возможно назначение преднизолона внутрь (в дозе 0,5 мг/кг массы тела в течение 7-10 дней) с последующей отменой в течение месяца. Положительные клинические эффекты после назначения преднизолона отмечаются достаточно быстро. Уменьшаются отеки и одышка, несколько увеличивается фракция выброса, возможна стабилизация нарушений ритма и проводимости. Однако следует помнить о побочных эффектах препаратов этой группы. Стойкая иммуносупрессия после приема преднизолона существенно
снижает степень защищенности организма перед новыми эпидемиями воздушно-капельных инфекций, при этом каждое повторное респираторное заболевание способно вызвать рецидив миокардита. При выявлении у больного хронической внутриклеточной инфекции сначала целесообразно провести курс противовирусной терапии и только затем назначать стероидные противовоспалительные препараты.
С течением времени воспалительная инфильтрация в миокарде уступает место фибробластам, а на месте воспаления формируется миокардитический кардиосклероз, который затрудняет кровообращение в микроциркуляторном русле. Поэтому с первых дней лечения необходимо назначение дезагрегантов (аспирин-кардио, тромбоАСС, трентал, вессел дуэ ф), а также препаратов, замедляющих ремоделирование и фиброзирование миокарда: ингибиторы АПФ, β-адреноблокаторов и антагонистов альдостерона.
Учитывая тот факт, что при миокардитах практически всегда возникают перекрестные аутоиммунные реакции, необходимо проводить иммунокоррегирующую терапию: повторные сеансы плазмафереза (для удаления кардиальных антигенов, антител к миокарду, фактора некроза опухоли-α и адгезионных молекул), курсы глюкокортикоидов и индукторов интерферона.
Метаболическая терапия направлена на оптимизацию процессов образования и расхода энергии и нормализацию свободнорадикального окисления. Для уменьшения расхода АТФ больному показан постельный режим на 1-2 недели (на период этиотропной терапии). Для увеличения синтеза макроэргов назначают внутривенные инфузии «поляризующей» инсулин-глюкозо-калиевой смеси, рибоксина и цитохрома С. Метаболическая терапия должна начинаться до назначения антибиотиков и противовирусных средств.
Симптоматическая терапия включает применение антиаритмических средств, мочегонных препаратов и пр.
Важным аспектом стационарного этапа является лечение очагов хронической инфекции (хронический тонзиллит, синусит, пульпит и пр.). Время санации должно быть выбрано с таким расчетом, чтобы местная и общая реакция на хирургическое вмешательство не вызвала обострения заболевания или тяжелых осложнений.
По окончании стационарного этапа терапии больных направляют для дальнейшего лечения и реабилитации либо в местные санатории,
либо в поликлинику по месту жительства. В период санаторного и поликлинического этапов продолжается медикаментозная терапия, включающая противовоспалительные средства (делагил), дезагреганты (аспирин, трентал, вессел дуэ ф). На данном этапе обязательно применение антагонистов альдостерона, β-адреноблокаторов и ингибиторов АПФ. При необходимости назначают антиаритмические средства и другие препараты.
РЕВМАТИЧЕСКИЙ КАРДИТ
Воспалительные и дистрофические изменения в сердце при ревматической лихорадке (РЛ) могут поражать все его слои с развитием эндокардита (вальвулита), миокардита и перикардита. РЛ обычно развивается у предрасположенных лиц после инфекции дыхательных путей, вызванной гемолитическим стрептококком группы А. Для диагноза РЛ используются критерии Джонса: большие (кардит, полиартрит, хорея, кольцевидная эритема, подкожные узелки), малые (артралгия, лихорадка, высокая СОЭ и С-реактивный белок, изменения ЭКГ), а также лабораторные признаки перенесенной стрептококковой инфекции. Тяжелый кардит сопровождается развитием кардиомегалии, перикардита и застойной сердечной недостаточности. При первичном ревмокардите у каждого пятого формируется порок сердца. Стационарное лечение включает антибактериальную (пенициллины) и противоспалительную терапию.
Ключевые слова: ревматическая лихорадка, ревмокардит, эндокардит, миокардит, вторичная профилактика, b-гемолитический стрептококк группы А.
ИСТОРИЯ, ПРОИСХОЖДЕНИЕ И РАСПРОСТРАНЕННОСТЬ
Термином «ревмокардит» обозначают поражение сердца при острой ревматической лихорадке (РЛ). Первые сообщения о поражении сердца при ревматических заболеваниях суставов появились в конце XVIII века, но эти факты рассматривались, как рядовое сочетание двух различных заболеваний, а не как единая болезнь.
Впервые Pitcairn (1788) отметил частые поражения сердца при ревматизме. Он допускал общую причину заболевания сердца и суставов, что позволило ему ввести термин «ревматизм сердца». Большинство ученых того времени придавали главенствующее значение развитию при ревматизме эндокардита и перикардита, профессор Московского университета Г.И. Сокольский в работе «О ревматизме мышечной ткани сердца» (1836) выделил клинико-анатомические формы ревматического поражения сердца - миокардита, эндокардита и перикардита, уделив большое место ревматическому миокардиту.
В 1894 г. Romberg у 2 умерших больных обнаружил значительные инфильтраты в месте прикрепления клапанов, а в миокарде - многочисленные маленькие мозоли из соединительной ткани, подтвердив ревматическое поражение миокарда, доказанное позже классическими работами Ашоффа, описавшего ревматические гранулемы в миокарде.
РЛ, по определению Столлермана, - это постинфекционное осложнение А-стрептококкового тонзиллофарингита у предрасположенных лиц с развитием аутоиммунного ответа на эпитопы стрептококка группы А и перекрестной реактивности со сходными эпитопами тканей человека (сердце, суставы, ЦНС).
Хотя с середины XX века отмечалось резкое снижение тяжести и смертности от РЛ, в конце 70-80-х гг. прошлого столетия произошли вспышки РЛ в США, Японии, Италии, которые напомнили, что заболевание остается проблемой для здоровья даже в развитых странах, к тому же РЛ до настоящего времени продолжает оставаться актуальной в развивающихся странах. По предварительным подсчетам в этих странах, в которых живет 2/3 всей популяции людей, случается от 10 до 20 млн новых случаев РЛ в год. Социальная значимость РЛ и ревматических пороков сердца (РПС) обусловлена их высокой распространенностью во многих странах мира, в том числе и в нашей стране, высокой временной нетрудоспособностью и ранней стойкой
инвалидизацией лиц молодого трудоспособного возраста. Так, по данным ВОЗ, именно ревмокардит и РПС составляют главную причину смертности в первые четыре десятилетия жизни людей.
В России частота острой РЛ составляет 0,05%, а РПС - 0,17%. РЛ - одно из немногих ревматических заболеваний, этиология которого является доказанным фактом. Бесспорно, что РЛ вызывается b-гемолитическим стрептококком группы А (БГСА). По образному выражению академика А.И. Нестерова, «без стрептококка нет ни ревматизма, ни его рецидивов».
ПАТОГЕНЕЗ
Патогенетические концепции формирования ревмокардита опираются на теорию аномальной иммунной реакции на стрептококковые антигены, основу которой составляет перекрестная реактивность между различными структурами БГСА и белками хозяина. В последнее время эта теория получила ряд новых доказательств существования гомологии молекулы М-белка стрептококка и тропомиозина, пепсинового фрагмента М-5 и сарколеммы, способности антител к трем эпитопам серотипов М-3, 5, 18 реагировать с тканью сердца. Полученные данные подкрепили концепцию молекулярной мимикрии, как основного патогенетического механизма реализации стрептококковой инфекции при ревмокардите за счет того, что образующиеся в ответ на антигены стрептококка антитела перекрестно реагируют с аутоантигенами хозяина (рисунок).
В последние годы доказано, что М-протеин обладает свойствами суперантигена, индуцирующего эффект аутоиммунитета. Приобретенный аутоиммунный ответ может быть усилен последующим инфицированием «ревматогенными» штаммами, БГСА содержащими перекрестнореагирующие эпитопы.
В 2000-2002 гг. Европейское общество кардиологов опубликовало данные о возможной триггерной роли вирусов, стресс-белков теплового шока (heat stress proteins) в формировании рецидивов РЛ и ревмокардита. В ряде работ бесспорно доказано кардиотоксическое действие таких агентов БГСА, как СЛ-О, М-протеина, группового полисахарида А, протеиназы и ДНК-азы B, показано участие антител к СЛ-О в формировании циркулирующих иммунных комплексов, уровень которых коррелировал с поражениями сердца.
Однако указанные механизмы не позволяют ответить на вопрос, почему РЛ и ревмокардит развиваются лишь у небольшого числа пациентов, перенесших инфекцию БГСА. Ответ кроется в признании роли генетической предрасположенности индивидуумов, которая, по современным представлениям, реализуется с помощью В-клеточного аллоантигена лимфоцитов, определяемого моноклональными антителами D8/17, полученными учеными Рокфеллеровского университета. Кроме того, есть данные о высокой распространенности при РЛ 2-го класса антигенов системы HLA, что является в настоящее время предметом изучения.
ФАКТОРЫ РИСКА И МОРФОЛОГИЯ
Факторами риска РЛ и ревмокардита являются: молодой возраст, скученность населения, плохое питание, неудовлетворительные социально-бытовые условия, наследственная предрасположенность, низкий уровень медицинской помощи.
Таким образом, в основу современных представлений о РЛ положено признание этиологической роли БГСА и наследственной предрасположенности к заболеванию, реализующейся аномалией иммунного ответа организма. Структурную основу РЛ составляет прогрессирующая дезорганизация соединительной ткани. Одним из основных проявлений болезни является ревмокардит.
Морфологическими критериями ревмокардита являются:
1. Субэндокардиальные или миокардильные гранулемы АшоффаТалалаева;
2. Бородавчатый эндокардит клапанов;
3. Аурикулит задней стенки левого предсердия;
4. Лимфогистиоцитарная инфильтрация.
Гранулемы Ашоффа-Талалаева являются маркерами ревматического процесса и обычно локализуются в миокарде, эндокарде и периваскулярно в соединительной ткани сердца, при этом их не обнаруживают в других органах и тканях.
В 1904 году Ашофф описал при ревматизме специфические гранулемы в миокарде. В.Т. Талалаеву (1929) принадлежит исключительная заслуга в изучении стадий развития ревматического процесса. Значение разработанных Ашоффом и В.Т. Талалаевым морфологи-
ческих критериев ревмокардита настолько велико, что ревматические гранулемы с полным правом именуются ашофф-талалаевскими.
В настоящее время показано, что не все бородавчатые наложения на клапанах и не все гранулемы являются признаками активности ревматического процесса. «Активными» считаются гранулемы с экссудативной воспалительной реакцией, альтернативными изменениями коллагеновых волокон и дегенеративными изменениями миокарда. При отсутствии признаков фибриноидного некроза на фоне выраженного периваскулярного склероза гранулемы рассматриваются как «старые», «неактивные». Последние могут сохраняться многие годы и представляют собой остаточные явления прежней активности без связи с продолжающейся активностью и дальнейшим прогнозом. Подобные изменения наиболее часто встречаются у больных с тяжелым митральным стенозом.
По данным А.И. Струкова, основанным на аутопсиях пациентов с текущим ревмокардитом, что не было в 50-60-е годы прошлого столетия редкостью, обнаруживается распространенный острый экссудативно-альтеративный воспалительный процесс в соединительной ткани с образованием ревматических гранулем, наиболее характерный для первых атак ревматизма. Для рецидивирующего миокардита характерен преимущественно гранулематозный процесс и, в меньшей степени, экссудативно-пролиферативный.
Воспалительные и дистрофические изменения в сердце при РЛ могут поражать все его слои с развитием эндокардита (вальвулита), миокардита, перикардита.
В ряде случаев возникают трудности в распознавании эндокардита и перикардита на фоне острого ревматического миокардита, что привело к введению в практику понятия ревматический кардит, которое в МКБ X пересмотре соответствует термину «острая ревматическая болезнь сердца неуточненная».
По частоте поражения при РЛ лидирует митральный клапан, далее по мере убывания следуют аортальный, трикуспидальный и клапан легочной артерии.
На ранних стадиях ревматического процесса клапанное повреждение заключается в образовании по краям створок бородавчатых образований. Ревматический вальвулит заканчивается утолщением и деформацией створок клапанов, укорочением хорд, сращением комиссур, что приводит к формированию клапанных пороков сердца.
Миокардит при РЛ может быть узелковым или диффузным. Узелковый миокардит характеризуется образованием гранулем периваскулярно, под эндокардом, часто в ушке левого предсердия, в межжелудочковой перегородке и задней стенке левого желудочка. Такой миокардит протекает относительно благоприятно и не сопровождается развитием сердечной недостаточности. При диффузном межуточном экссудативном миокардите отмечаются отек, полнокровие и лимфолейкоцитарная инфильтрация соединительной ткани, интерстиция миокарда. Сердце становится дряблым, сократительная функция миокарда резко снижается. Эти изменения часто наблюдаются у детей и нередко заканчиваются летально. Если указанные морфологические изменения выражены умеренно и носят ограниченный характер, то говорят об очаговом межуточном экссудативном миокардите, который часто наблюдается при латентном течении заболевания. Результатом миокардита чаще всего является очаговое, гнездное, поражение с развитием постмиокардитического фиброза. В последние годы ряд авторов высказывают сомнение в развитии миокардита при РЛ, отводя главную роль вальвулиту. Так, Narula et al. изучили РЛ у пациентов с помощью эндомиокардиальной биопсии, весьма чувствительного инструмента для диагностики миокардита. Узелки Ашоффа и интерстициальный инфильтрат наблюдались у пациентов с РЛ и сердечной недостаточностью, но значительный некроз кардиомиоцитов не обнаружен ни у одного из этих пациентов. Авторы пришли к выводу о том, что их утверждения против использования термина «миокардит» в связи с РЛ, по крайней мере по далласким критериям, вполне применимы, а повреждение миокарда при РЛ является редким, ограничивается интерстициальным поражением без некроза кардиомиоцитов, и поэтому не имеет последствий в виде контрактильных дисфункций и поздних осложнений, в отличие от вирусных миокардитов.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
И ДИАГНОСТИКА РЕВМОКАРДИТА
В течение длительного времени такие проявления РЛ, как артрит, кардит, хорея считались самостоятельными заболеваниями. Диагностические критерии ревматизма впервые были сформулированы советским педиатром А.А. Киселем и включали пять «абсолют-
Таблица 4.7
 Диагностические критерии РЛ (ВОЗ, 2002 г.)
Диагностические критерии РЛ (ВОЗ, 2002 г.)
ных» признаков - ревматические узелки, кольцевидную эритему, хорею, мигрирующий полиартрит и кардит.
Прообразом международной классификации кардитов была характеристика ревматического поражения сердца, предложенная академиком А.И. Нестеровым, согласно которой среди ревмокардитов выделялись: кардиты явные, умеренные, слабые и латентные.
В настоящее время в соответствии с рекомендациями ВОЗ в качестве международных применяются диагностические критерии РЛ Т. Джонса, пересмотренные в 2002 г. (табл. 4.7).
При положительном результате предшествующей стрептококковой инфекции наличие одного большого и двух малых критериев с высокой вероятностью указывает на острую РЛ.
Свидетельством недавно перенесенной стрептококковой инфекции является повышение титров стрептококковых антител, определяемых в парных сыворотках (табл. 4.8), которое наблюдается в течение первого месяца от начала заболевания, сохраняется как правило в течение 3 месяцев, нормализуясь через 4-6 месяцев.
Таблица 4.8
Нормальные, пограничные и высокие цифры стрептококковых антител
(в ед./мл)
Антитела | Титры,ед. | ||
нормальные | пограничные | высокие | |
АСЛ-0 | <250 | 313-500 | >625 |
АСГ | <250 | 330-500 | >625 |
АСК | <200 | 300-500 | >600 |
АДНК-В | <600 | 800-1200 | >1200 |
Наиболее важным признаком РЛ, определяющим тяжесть состояния больного и болезни, является кардит. А.И. Нестеров считал ревматический миокардит основным и наиболее постоянным видом поражения сердца при ревматизме, выделяя острый диффузный или очаговый (гранулематозный) миокардит.
Современные критерии кардита, принятые Американской кардиологической ассоциацией, представлены в таблице 4.9.
Наиболее постоянным признаком кардита является шум, который может с трудом выслушиваться при тахикардии, ЗСН из-за низкого
Таблица 4.9
Международные критерии кардита
1. Органический шум (шумы), ранее не выслушиваемые, или динамика ранее существовавших шумов; 2. Увеличение сердца (кардиомегалия); 3. Застойная сердечная недостаточность (ЗСН) у молодых лиц, шум трения перикарда или признаки выпота в полость перикарда |
систолического объема и при перикардите из-за шума трения перикарда или выпота.
К шумам, свидетельствующим о наличии кардита, эксперты ВОЗ относят:
1) Интенсивный систолический шум над верхушкой, являющийся проявлением вальвулита митрального клапана;
2) Мезодиастолический шум над верхушкой (шум Carey Coombs), формирующийся в результате быстрого сброса крови из предсердий в желудочки во время диастолы, выслушиваемый в положении лежа на левом боку при задержке дыхания на выдохе. Мезодиастолический шум при ревмокардите имеет преходящий характер, часто не диагностируется или принимается за III тон. Наличие подобного шума делает диагноз митрального вальвулита достоверным. Этот шум следует отличать от низкочастотного нарастающего громкого пресистолического шума с последующим усиленным I тоном, что свидетельствует о сформировавшемся митральном стенозе, а не о текущем кардите;
3) Базальный протодиастолический шум, характерный для вальвулита аортального клапана, - это высокочастотный дующий, затухающий, непостоянный шум.
Длительный, дующий, связанный с 1 тоном систолический шум, являющийся отражением митральной регургитации - ведущий симптом ревматического вальвулита. Он занимает большую часть систолы, лучше всего выслушивается в области верхушки сердца и обычно проводится в левую подмышечную область. Интенсивность шума вариабельна, особенно на ранних стадиях заболевания и существенно не изменяется при изменении положения тела и при дыхании. Данный шум следует отличать от мезосистолического «щелчка» и/или позднего систолического шума при пролапсе митрального клапана.
Функциональные шумы, встречающиеся у здоровых лиц (особенно у детей и подростков), отличаются от органических отсутствием связи с 1 тоном, меньшей длительностью и более мягким тембром. Эти шумы непостоянны и меняются по характеру в зависимости от положения тела и фазы дыхания. Выделяют 2 типа функциональных шумов:
1) дующий шум выброса, выслушиваемый лучше всего над легочной артерией;
2) низкочастотный музыкальный шум, слышимый по левому краю грудины.
Первый из этих шумов часто проводится в область шеи и может напоминать шумы при стенозе устья аорты. Второй часто проводится к верхушке и нередко может быть принят за таковой при недостаточности митрального клапана.
В настоящее время некоторые исследователи придерживаются мнения, что дисфункция миокарда при РЛ определяется не текущим миокардитом, а наличием клапанных повреждений, поскольку не обнаруживается существенных эхокардиографических или биохимических признаков повреждения миокарда даже среди пациентов с тяжелой формой кардита, имеющих также экссудативный перикардит. Считается, что ЗСН при острой РЛ часто не является следствием дисфункции левого желудочка, а связана с тяжелой клапанной регургитацией, вызванной ревматическим эндокардитом.
Указанная классификация ревмокардита может с успехом использоваться у больных с первичным ревмокардитом (табл. 4.10).
Таблица 4.10
Классификация ревматического кардита
Симптомы/степень тяжести | Органический шум | Кардиомегалия | Перикардит | ЗСН |
Легкий | + | - | - | - |
Средний | + | - | + | - |
Тяжелый | + | + | + | + |
Ревмокардит на фоне сформированного клапанного порока сердца диагностировать значительно тяжелее. При этом решающее значение имеют доказательства недавно перенесенной стрептококковой инфекции, а также знание данных о состоянии сердечно-сосудистой
системы в период, предшествующей рецидиву, что обеспечивается диспансерным наблюдением за больным. Появление нового шума или изменение интенсивности имевшегося ранее шума или шумов, увеличение по сравнению с исходными размерами сердца, появление или нарастание признаков ЗСН, развитие перикардита при наличии критериев РЛ и изменения лабораторных показателей дают возможность диагностировать возвратный ревмокардит и определить степень его тяжести.
В настоящее время основным критерием ревмокардита считается вальвулит, который может сочетаться как с миокардитом, так и с перикардитом. Панкардит при ревматической лихорадке встречается редко. Наличие у больного миоперикардита без явлений вальвулита делает диагноз ревматической лихорадки маловероятным и предполагает проведение дифференциального диагноза с вирусными миоперикардитами.
Тяжесть ревматической атаки определяется выраженностью кардита. При тяжелом кардите развивается кардиомегалия и сердечная недостаточность.
При ЭКГ-исследовании могут отмечаться нарушением ритма и проводимости: преходящая атриовентрикулярная блокада первой, реже второй степени, экстрасистолия, изменения зубца Т в виде снижения его амплитуды вплоть до появления негативных зубцов. Указанные изменения ЭКГ характеризуются нестойкостью и быстро исчезают в процессе лечения.
ФКГ-исследование уточняет данные аускультации сердца и может использоваться для объективизации изменения тонов и шумов при динамическом наблюдении.
Важным инструментальным методом, позволяющим диагностировать ревмокардит, является двухмерная ЭхоКГс использованием допплеровской техники, т.к. у 20% больных при ЭхоКГ удается выявить изменения клапанов, не сопровождающиеся шумом в сердце.
ЭхоКГ-критериями эндокардита митрального клапана являются:
• булавовидное краевое утолщение митральной створки;
• гипокинезия задней митральной створки;
• митральная регургитация;
• преходящий куполообразный диастолический изгиб передней митральной створки.
Для ревматического эндокардита аортального клапана характерно:
• краевое утолщение створок клапана;
• преходящий пролапс створок;
• аортальная регургитация.
Следует помнить, что изолированное поражение аортального клапана без шума митральной регургитации не характерно для острого ревматического кардита, но не исключает его наличия.
Ревмокардит, особенно если он является ведущим или единственным проявлением предполагаемой РЛ, необходимо дифференцировать со следующими заболеваниями:
• инфекционный эндокардит;
• неревматические миокардиты;
• нейроциркуляторная астения;
• идиопатический пролапс митрального клапана;
• кардиомиопатия;
• миксома сердца;
• первичный антифосфолипидный синдром;
• неспецифический аортоартериит.
ТЕЧЕНИЕ ЗАБОЛЕВАНИЯ И ПРОГНОЗ
РЛ протекает в виде атак. У 70% больных ревматическая атака стихает, по клинико-лабораторным данным, в течение 8-12 недель, у 90-95% - в течение 12-16 недель и лишь у 5% больных атака продолжается более 6 месяцев, т.е. принимает затяжное либо хроническое течение. Таким образом, в большинстве случаев ревматический процесс имеет циклическое течение, и атака заканчивается в среднем в течение 16 недель.
Поражение клапанного аппарата имеет своим следствием развитие порока сердца у 20-25% больных, перенесших первичный ревмокардит. Повторные атаки РЛ могут протекать скрыто, увеличивая частоту образования пороков сердца до 60-70%. Кроме того, даже гемодинамически незначимое повреждение клапанов повышает риск инфекционного эндокардита.
Рецидивы РЛ чаще встречаются в детском, подростковом и юношеском возрасте и развиваются преимущественно у лиц, перенесших среднетяжелый и тяжелый кардит, особенно в случаях формирования РПС.
Таблица 4.11
Дифференциальный диагноз ревматического и неревматических кардитов (Н.А. Шостак, по данным литературы)
Признак | Ревматический кардит | Неревматический кардит |
Пол | Ж>М | М>Ж |
Возраст | Детский, подростковый (пик 12-15 лет), с возрастом риск ревмокардита уменьшается | Молодой, средний, с возрастом риск вирусного миокардита увеличивается |
Этиология | БГСА | Кардиотропные вирусы (коксаки А, В, грипп А, В, аденовирусы), бактерии (дифтерия, менингококк и др.) |
Хронологическая связь | Стрептококковый тонзиллофарингит | Чаще всего вирусной инфекцией |
Первые признаки заболевания | Артралгии, артриты, лихорадка | Сердцебиение, одышка, уменьшение толерантности к нагрузкам |
Боль в груди | Редко | Часто (из-за перикардита) |
Внезапное появление симптомов ЗСН | Редко | Часто |
Варианты поражения сердца | Всегда вальвулит митрального или аортального клапана, реже - миокардит, перикардит | Миоперикардит |
Внесердечные проявления | Артрит, хорея, ревматические узелки (ассоциируются с тяжелым кардитом), аннулярная эритема | Не встречаются |
Продолжение табл. 4.11
Физикальные данные | Тахикардия, в том числе во сне, появление нового или усугубление имеющегося шума в сердце, мезодиастолического шума над верхушкой (при митральном вальвулите), протодиастолического над аортой (при аортальном вальвулите), изменение характера тонов сердца, III тон на верхушке, шум трения перикарда (редко у взрослых, чаще - у детей, от 2 до 7%, соответственно) | Тахикардия, в том числе во сне, иногда брадикардия и снижение пульсового давления, лихорадка, снижение громкости I тона, появление III, IV тонов, при остром вирусном - шум трения перкарда*, плевры, при диффузном, в т.ч. гигантоклеточном - острая сердечная недостаточность, кардиогенный шок * шум трения перикарда в отличие от шума трения плевры, прослушивается при задержке дыхания |
ЭКГ | Синусовая тахикардия, удлинение PQ (I степени), редкие желудочковые экстрасистолы, изменения сегмента ST и зубца Τ | Синусовая тахи(бради)кардия, изменения ST-T, нарушения ритма (наджелудочковые тахикардии, желудочковые экстрасистолии) и проводимости (блокада II-III ст. может потребовать временной кардиостимуляции), полная блокада левой ножки пучка Гиса, нарушение процессов реполяризации |
Рентгенография органов грудной клетки | Обычно изменения не характерны (при отсутствии РПС) | Увеличение размеров сердца, при выпотном перикардите силуэт сердца шарообразный. При диффузном миокардите - венозный застой и отек легких |
Продолжение табл. 4.11
ЭхоКГ | При вальвулите митрального клапана: булавовидное краевое утолщение митральной створки; гипокинезия задней митральной створки; митральная регургитация; преходящий куполообразный диастолический изгиб передней митральной створки. При вальвулите аортального клапана: краевое утолщение створок клапана; преходящий пролапс створок; аортальная регургитация | Признаки диастолической и систолической дисфункции, часто локальные дискинезии стенок сердца, имитирующие острый инфаркт миокарда вплоть до глобальной дискинезии. Может отмечаться увеличение толщины миокарда из-за его воспалительного отека (напоминает ГКМП). Пристеночные тромбозы (15-20%). Сепарация листков перикарда с небольшим или умеренным выпотом - характерный для миокардитов ЭхоКГ-признак. Наличие констриктивного или констриктивно-выпотного перикардита не ассоциируется с вирусным миокардитом (искл. - туберкулез, лучевой перикардит, злокачественные новообразования, уремия) |
Лейкоцитоз, повышение СОЭ, СРВ | + | + |
Повышение или повышающиеся титры антител | К антигенам БГСА, в т.ч. АСЛ-О, АСГ и др. | К кардиотропным вирусам (коксаки А, В, аденовирусам, эховирусам и др.) |
Бактериологическое исследование | «Золотой стандарт» диагностики: положительная глоточная культура БГСА | Не используется ввиду неинформативности |
Повышение карди- оспецифических ферментов | Редко | 6-50% |
Окончание табл. 4.11
Сцинтиграфия миокарда | Чувствительный метод диагностики активного воспалительного процесса в миокарде, но практическое применение с дифференциально-диагностической целью ограниченно ее невысокой специфичностью. | |
Эндомиокардиальная биопсия (ЭМБ) - 4-6 образцов с использованием Далласских крите- риев* | По данным Myocarditis Treatment trial, результаты ЭМБ часто отрицательные, то объясняют: а) очаговым характером поражения миокарда, б) существованием исключительно гуморального или цитокин-опосредованного воспаления, не связанного с образованием массивного клеточного инфильтрата, в) преходящим характером и быстрым разрушением типичных гистологических изменений. В настоящее время показания к ЭМБ - подозрение на гигантоклеточный миокардит, когда требуется агрессивная терапия и ранняя трансплантация сердца. Биопсия миокарда и гистологическое исследование может подтвердить диагноз миокардита, но никогда не позволяет его исключить | |
Исходы | РПС митрального и/или аортального клапанов | Правило «трех третей»: одна треть выздоравливает, у трети - развивается стабильная левожелудочковая дисфункция и еще у одной трети - состояние быстро ухудшается (переход в ДКМП) |
Примечание. * Далласские критерии миокардита: определенный миокардит - воспалительная инфильтрация миокарда с некрозом и/или дегенерацией прилегающих миоцитов, не характерная для ишемических изменений при ИБС; вероятный миокардит - воспалительные инфильтраты достаточно редки либо кардиомиоциты инфильтрированы лейкоцитами, миокардит не может быть диагностирован из-за отсутствия воспаления
Вероятность развития порока сердца возрастает при рецидивах РЛ. Чаще других поражается митральный клапан.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
Лечение РЛ включает обязательную госпитализацию, назначение постельного и сидячего режима в течение острого периода заболевания. Всем больным необходимо 2-3-кратное исследование мазка из зева для выявления Streptococcus pyogenes, а также определение уровня стрептококковых антител до назначения антибактериальной терапии. С момента установления РЛ назначается лечение пенициллином, обеспечивающим удаление БГСА из носоглотки.
Из пенициллинов наиболее часто используют бензилпенициллин или феноксиметилпенициллин. Рекомендованные суточные дозы бензилпенициллина: детям - 400-600 тыс./ЕД, взрослым - 1,5-4 млн./ЕД внутримышечно - по 4 введения в течение 10 дней. Феноксиметилпенициллин рекомендуется взрослым по 500 мг внутрь 2 раза в сутки в течение 10 дней.
Пенициллины должны всегда рассматриваться как препараты выбора в лечении ОРЛ, за исключением случаев их индивидуальной непереносимости, когда назначают макролиды или линкозамиды. Из макролидов наиболее часто используют эритромицин по 250 мг внутрь 4 раза в сутки.
Больным с непереносимостью как бета-лактамов, так и макролидов назначают линкозамиды, в частности линкомицин по 0,5 г внутрь 3 раза в день (10 дней).
Симптоматическая терапия ревмокардита проводится нестероидными противовоспалительными препаратами (НПВП) и глюкокортикостероидами.
При легком кардите и экстракардиальных проявлениях РЛ эффективна ацетилсалициловая кислота 3-4 г в сутки, а при ее непереносимости - вольтарен (ортофен, диклофенак) в суточной дозе 100 мг. Kaplan, Stollerman и др. рекомендуют при тяжелом и упорном, неподдающемся терапии среднетяжелом кардите, маркерами которого являются кардиомегалия, ЗСН, появление внутрисердечных блокад, а также нарушений ритма высоких градаций использовать преднизолон в средней суточной дозе 1,0-1,5 мг/кг массы тела в течение
2 недель с последующим постепенным снижением дозы и назначением НПВП, которые больной должен принимать в течение 4 недель после отмены преднизолона, что может улучшить ближайший прогноз заболевания. Некоторые исследователи предлагают при тяжелом кардите проводить пульс-терапию метипредом.
Антистрептококковая терапия обычно проводится пенициллинами, патогенетическая - нестероидными или (при тяжелом течении) стероидными противовоспалительными препаратами.
В тех случаях, когда сердечная недостаточность при ревмокардите является результатом тяжелого вальвулита и обусловленными им нарушениями внутрисердечной гемодинамики, эксперты ВОЗ рекомендуют рассматривать вопрос об операции на сердце (вальвулопластике) и даже замещении клапана.
При изучении отдаленного прогноза РЛ и анализа частоты формирования пороков сердца в течение 1 года после атаки, по данным Cochrane review, достоверного влияния противовоспалительной терапии не получено. Однако в цитируемом авторами мета-анализе 8 исследований, большая часть которых относилась к 50-60-м гг. XX века и в которых отсутствовали важнейшие принципы качественной клинической практики, например принцип рандомизации, сделанный вывод о неэффективности данной терапии недостаточно обоснован. В связи с этим авторы мета-анализа считают необходимым проведение многоцентровых рандомизированных плацебо-контролируемых исследований по изучению эффективности противовоспалительной терапии при ревмокардите.
Лечение рецидивов при ревмокардите не отличается от лечения первой атаки, однако при наличии симптомов декомпенсации сердечной деятельности, особенно у больных с ранее сформированными пороками сердца, в план лечения включают ингибиторы АПФ, диуретики и по показаниям - сердечные гликозиды.
Цель профилактики - предотвращение рецидива РЛ. Рецидивы наиболее часты в течение 5 лет после первой атаки. Несмотря на то, что количество рецидивов снижается с увеличением возраста пациента, они могут развиться в любые сроки.
Профилактика рецидива должна назначаться сразу в стационаре после окончания 10-дневного лечения пенициллинами (макролида-
Таблица 4.12
Вторичная профилактика РЛ
Препарат | Дозировка |
Бензатинбензилпенициллин (ретарпен, экстенциллин) | 1200000-2400000 ЕД каждые 3-4 недели в/м |
При аллергии на пенициллины | |
Эритромицин 250 мгХ2 р./сутки | |
ми, линкозамидами). Классический парентеральный режим - это бензатинпенициллин G 1,2-2,4 млн ЕД/в/м 1 раз в 3-4 недели. При аллергии на пенициллины может быть использован эритромицин 250 мг дважды в день.
Таблица 4.13
Продолжительность вторичной профилактики РЛ (Braunwald, 2001 г.)
Категория больных | Продолжительность |
РЛ с кардитом и клапанным поражением | По крайней мере 10 лет после последнего эпизода и, по крайней мере до 40-летнего возраста. Иногда пожизненная профилактика |
РЛ с кардитом, но без клапанного поражения | 10 лет или до 21 года |
РЛ без кардита | 5 лет или до 21 года |
Больные, перенесшие операцию на сердце по поводу ревматического порока сердца, подвергаются вторичной профилактике пожизненно.
В настоящее время ведутся исследования по созданию вакцины, содержащей эпитопы М-протеинов «ревматогенных» штаммов стрептококка, не вступающие в перекрестную реакцию с тканевыми антигенами человека. Применение такой вакцины, особенно у лиц- «носителей» генетического маркера РЛ, в рамках первичной профилактики позволило бы избежать возникновения РЛ.
Больные с клапанным ревматически пороком сердца и оперированные по поводу него имеют повышенный риск рецидивов РЛ.
Профилактика инфекционного эндокардита показана всем пациентам, перенесшим РЛ с формированием порока сердца, в следующих ситуациях:
• стоматологические процедуры, вызывающие кровотечение;
• операции на ЛОР-органах (тонзиллэктомиями, аденоидэктомия);
• процедуры на дыхательных путях (бронхоскопия, биопсия слизистой);
• оперативные вмешательства в брюшной полости, мочеполовом тракте, гинекологической сфере.
Приводим принятую на 1-м Национальном конгрессе ревматологов России (Саратов, 2003 г.) отечественную классификацию РЛ (табл. 4.14).
Таблица 4.14
Классификация РЛ (АРР, 2003)
 Примечание. * - по классификации Н.Д. Стражеско и В.Х. Василенко; ** - функциональный класс по NYHA;
Примечание. * - по классификации Н.Д. Стражеско и В.Х. Василенко; ** - функциональный класс по NYHA;
*** - возможно наличие поствоспалительного краевого фиброза клапанных створок без регургитации, который уточняется с помощью ЭхоКР,
**** - при наличии впервые выявленного порока сердца необходимо по возможности исключить другие причины его формирования (ИЭ, первичный антифосфолипидный синдром, кальциноз клапана дегенеративного генеза и др.);
1 - Необходимо дифференцировать истинную хорею Сиденгама при РЛ с синдромом PANDAS (Pediatric Autoimmune Neuropsychiatric Disorders Associated With Streptococcal Infections) [15]. Критерии синдрома PANDAS (1993): 1) Наличие обсессивно-компульсивных расстройств (навязчивые мысли и навязчивые движения) и/или тиковых состояний, 2) Детский возраст: дебют заболевания приходится на период от 3 лет до пубертатного периода, 3) Приступообразное течение заболевания, которое может проявляться отдельными симптомами или эпизодами внезапного ухудшения. Симптомы обычно значительно регрессируют между приступами и в некоторых случаях полностью исчезают между обострениями, 4) Доказанная хронологическая связь с БГСА-инфекцией: выделение возбудителя в мазке из зева и/или диагностическое повышение титров антител (антистрептолизина-О и анти-Днк-азы), 5) Наличие неврологических расстройств: гипермоторные расстройства, хореиформные гиперкинезы.