Нормальная физиология : Учебник. - Р.С. Орлов, А.Д. Ноздрачёв, 2009. - 688 с
|
|
|
|
ГЛАВА 4. МЕЖКЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ
Межклеточные взаимодействия подразделяют на 2 класса - формообразующие (формирующие тканевые и органные структуры, или структурирующие) и информационные. Оба класса межклеточных взаимодействий реализуются при помощи растворимых молекул (или ионов), посредством макромолекул внеклеточного матрикса и пу- тём формирования специализированных межклеточных контактов
(рис. 4-1).
ФОРМООБРАЗУЮЩИЕ ВЗАИМОДЕЙСТВИЯ
Свободное существование в организме характерно только для взвешенных в плазме крови и в лимфе клеточных элементов. Все остальные клетки (как фиксированные in situ, так и подвижные (например, макрофаги)), а также и другие тканевые элементы (например, волокнистые структуры) образуют относительно фиксированные в пространстве органа тканевые структуры. Внутри тканевых структур формируются специализированные межклеточные контакты, необходимые как для функционирования клеток, так и для координации деятельности клеток в составе тканевых структур. Примерами таких тканевых структур являются клеточные островки, пласты (также их варианты - трубки и фолликулы), а также клеточные и неклеточные трёхмерные сети.
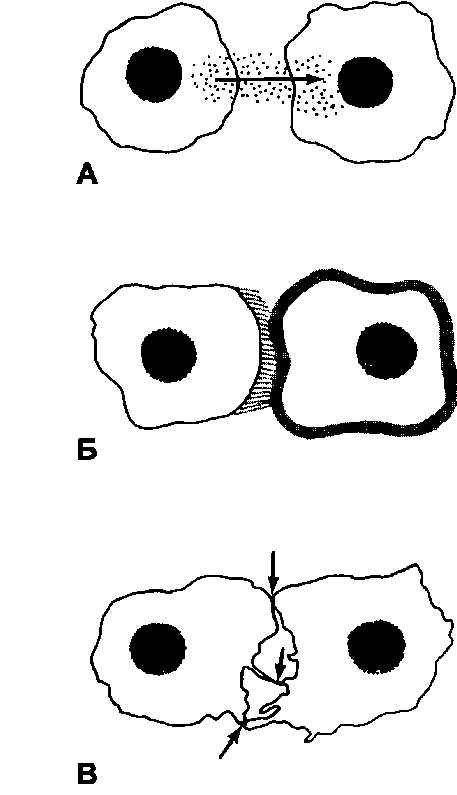 Рис. 4-1. Пути межклеточных взаимодействий [11]. А - при
Рис. 4-1. Пути межклеточных взаимодействий [11]. А - при
помощи диффундирующих молекулярных сигналов. Б через внеклеточный матрикс. В - через специализированные межклеточные контакты
• С физиологической точки зрения клеточные пласты и их варианты, расположенные на границе между разными компартментами (например, между внутренней и внешней средой организма), являются полупроницаемыми барьерами, для которых характерна избирательная проницаемость (см. ниже раздел «Трансклеточная проницаемость»).
• Формирование и функционирование всех тканевых структур происходит только на основе их взаимного узнавания и взаимной адгезии.
Адгезия
Адгезия - способность клеток избирательно прикрепляться друг к другу или к компонентам внеклеточного матрикса.
• Молекулы адгезии. Клеточную адгезию реализуют специальные гликопротеины - молекулы адгезии (рис. 4-2).
• Точечный адгезионный контакт. Прикрепление клеток к молекулам адгезии внеклеточного матрикса реализуют точечные (фокальные) адгезионные контакты (рис. 4-3). В образовании контакта участвуют трансмембранные рецепторы - интегрины, объединяющие внеклеточные и внутриклеточные структуры (рис. 4-3А). Таким образом, адгезионные контакты устанавливают структурную непрерывность между цитоскелетом и внеклеточным матриксом.
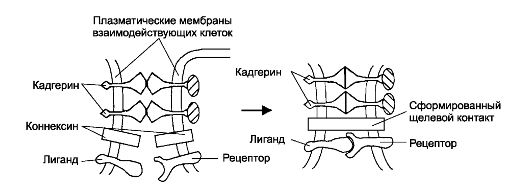 Рис. 4-2. Молекулы адгезии в межклеточной коммуникации [11].
Взаимодействие трансмембранных молекул адгезии (в данном случае -
кадгеринов) обеспечивает узнавание клеточных партнёров и их прикрепление
друг к другу (адгезию), что позволяет клеткам-партнёрам формировать
специализированные межклеточные контакты (например, щелевые), а также
передавать сигналы от клетки к клетке не только при помощи
диффундирующих молекул, но и путём взаимодействия встроенных в мембрану
лигандов со своими рецепторами в мембране клетки-партнёра
Рис. 4-2. Молекулы адгезии в межклеточной коммуникации [11].
Взаимодействие трансмембранных молекул адгезии (в данном случае -
кадгеринов) обеспечивает узнавание клеточных партнёров и их прикрепление
друг к другу (адгезию), что позволяет клеткам-партнёрам формировать
специализированные межклеточные контакты (например, щелевые), а также
передавать сигналы от клетки к клетке не только при помощи
диффундирующих молекул, но и путём взаимодействия встроенных в мембрану
лигандов со своими рецепторами в мембране клетки-партнёра
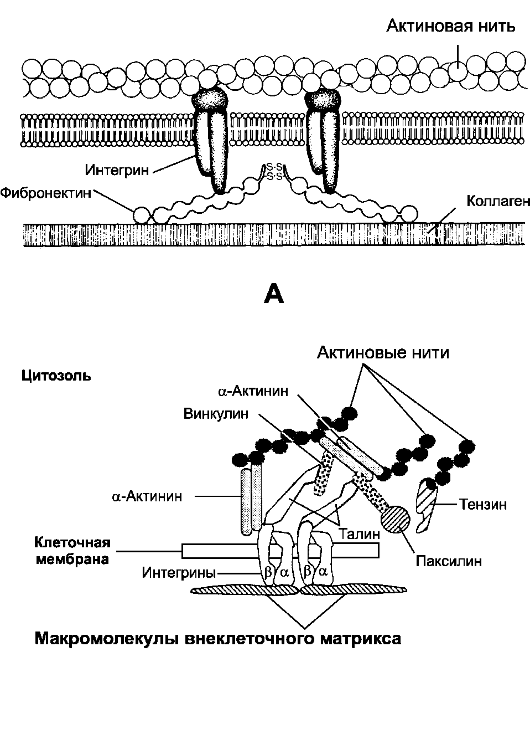
Рис. 4-3. Точечный адгезионный контакт [11]. А. Опосредованная фибронектином связь клетки с коллагеновыми волокнами. Цитоплазматический домен интегрина взаимодействует с примембранными микрофиламентами (актин), а внеклеточный домен - с фибронектином, связанным в свою очередь с коллагеновыми волокнами. В молекуле фибронектина имеются также домены для связывания с гепарином и фибрином. Б. Белки точечного адгезионного контакта. С белковыми макромолекулами внеклеточного матрикса (фибронектин, витронектин) взаимодействует трансмембранный белок-рецептор интегрин, состоящий из α- и β-цепей. На цитоплазматической стороне клеточной мембраны β-СЕ интегрина связывается с талином, взаимодействующим с винкулином. Последний связывается с α-актинином, образующим поперечные связи между актиновыми нитями. Кроме того, α-актинин взаимодействует с цитоплазматической частью β-СЕ интегрина. Подобным образом в единую систему объединяются макромолекулы внеклеточного матрикса, клеточная мембрана и элементы цитоскелета
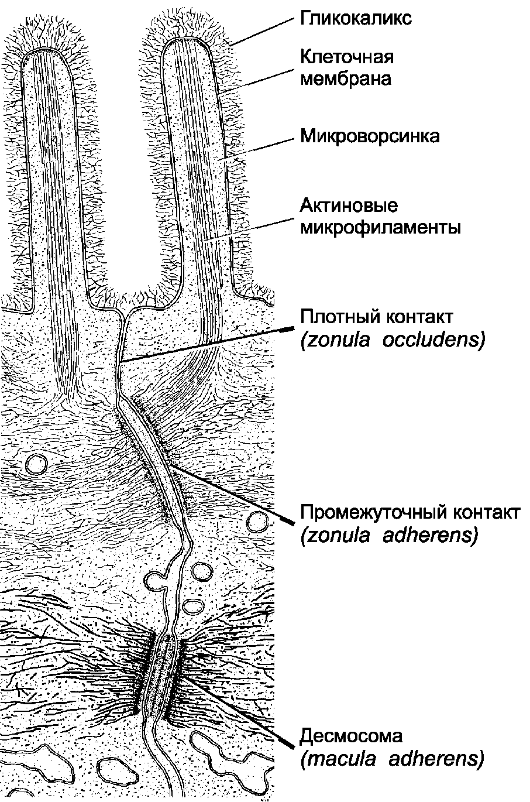 Рис. 4-4. Специализированные межклеточные контакты между
соседними эпителиальными клетками в слизистой оболочке кишки. Каждая
клетка в пласте эпителия по всей её окружности в апикальной области
имеет сплошной пояс плотных контактов, предупреждающих поступление
содержимого кишечника в межклеточные щели. Несколько ниже клетки
соединены также при помощи промежуточных контактов и десмосом. [11]
Рис. 4-4. Специализированные межклеточные контакты между
соседними эпителиальными клетками в слизистой оболочке кишки. Каждая
клетка в пласте эпителия по всей её окружности в апикальной области
имеет сплошной пояс плотных контактов, предупреждающих поступление
содержимого кишечника в межклеточные щели. Несколько ниже клетки
соединены также при помощи промежуточных контактов и десмосом. [11]
Таким образом, прикрепление клеток к компонентам внеклеточного матрикса осуществляют точечные (фокальные) адгезионные контакты. Помимо точечных адгезионных контактов, существуют специализированные межклеточные контакты (рис. 4-4).
Специализированные межклеточные контакты
Межклеточные контакты - специализированные клеточные структуры, скрепляющие клетки между собой, создающие барьеры проницаемости и служащие для межклеточной коммуникации. Межклеточные специализированные контакты подразделяют на адгезионные, замыкающие (плотные) и коммуникационные (проводящие).
• Адгезионные межклеточные контакты механически скрепляют клетки между собой. К ним относятся десмосома (macula adherens), полудесмосома и промежуточный контакт (опоясывающая десмосома, zonula adherens).
❖ Десмосома объединяет 2 структуры. Одна из них (цитоплазматическая пластинка) осуществляет связь промежуточных филаментов клетки с плазматической мембраной; вторая - связь плазматической мембраны с внеклеточным межмембранным материалом (десмоглеей) в пределах десмосомы. Десмосомы поддерживают структурную целостность ткани, скрепляя клетки между собой. Десмосомы в комплексе с промежуточными филаментами придают ткани упругость и поддерживают в ней усилие натяжения.
❖ Промежуточный контакт (опоясывающая десмосома). Мембраны соседних клеток разделены промежутком шириной 10-20 нм, заполненным аморфным или фибриллярным материалом. Электроноплотная пластинка на цитоплазматической стороне клеточной мембраны в пределах контакта содержит белки плакоглобин, винкулин, α-актинин и радиксин. В пластинку вплетены концы актинсодержащих микрофиламентов. В образовании контакта участвуют трансмембранные белки адгезии из семейства кадгеринов. Промежуточный контакт не только скрепляет мембраны соседних клеток, но и стабилизирует их цитоскелет, объединяя клетки с их содержимым в единую жёсткую систему наподобие точечным адгезионным контактам (см. рис. 4-3А).
• Замыкающий, или плотный контакт (zonula occludens) формирует в различных клеточных пластах барьер проницаемости, разделяющий разные по химическому составу среды (например, внутреннюю и внешнюю).
• Коммуникационные контакты. К ним относятся щелевые контакты и синапсы.
❖ Щелевой контакт обеспечивает ионное и метаболическое сопряжение клеток. Плазматические мембраны клеток, образующих щелевой контакт, разделены щелью шириной 2-4 нм. Коннексон - трансмембранный белок цилиндрической конфигурации; состоит из 6 СЕ коннексина. Два коннексона соседних клеток соединяются в межмембранном пространстве и образуют канал между клетками (рис. 4-5). Канал коннексона диаметром от 1,2 нм до 2,0 нм пропускает ионы и молекулы с Mr до 1,5 кД в обе стороны (поляризации - одностороннего направления пропускания - нет). Другими словами, щелевые контакты обеспечивают электрическое сопряжение связанных клеток. Именно
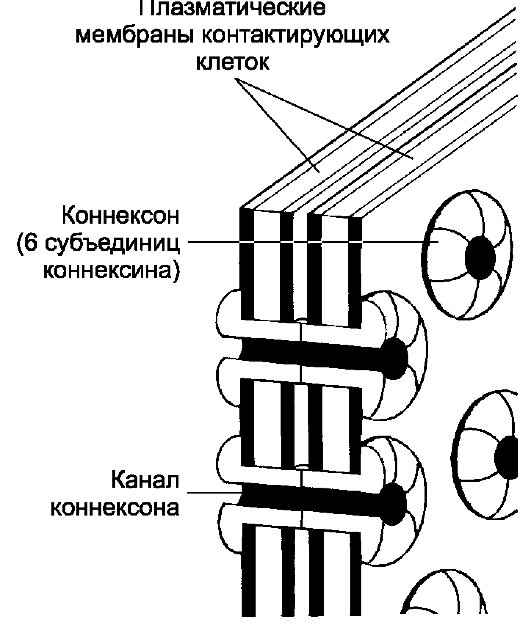 Рис. 4-5. Щелевой контакт [11].
Рис. 4-5. Щелевой контакт [11].
Шесть белковых СЕ в плазматической мембране образуют коннексон. При совмещении коннексонов смежных плазматических мембран формируется канал коннексона, связывающий цитозоль контактирующих клеток. Открытое или закрытое состояние канала коннексона, определяемое конформацией коннексинов, регулируется содержанием в цитозоле ионов Ca2+, pH, а также разностью электрического потенциала связанных клеток
поэтому щелевые контакты обеспечивают распространение возбуждения - переход ионов между мышечными клетками миокарда - кардиомиоцитами, а также между ГМК. ❖ Синапс - специализированный межклеточный контакт - обеспечивает одностороннюю (однонаправленную) передачу сигналов с одной клетки на другую. Сигнальная молекула - нейромедиатор. Синапсы формируются между клетками возбудимых тканей (нервные клетки между собой, нервные клетки и мышечные волокна). Структура и функция синапсов подробно рассмотрена в главе 6 (см., например, нервно-мышечный синапс на рис. 6-2).
Трансклеточная проницаемость
В главе 2 на примере плазмолеммы были рассмотрены транспортные процессы через биологические мембраны. Хотя формально тканевые структуры, формирующие барьеры (например, пласт клеток и его варианты в виде трубок и фолликулов), организованы сложнее (например, имеется базальная мембрана), считают, что общие принципы переноса через клеточный пласт аналогичны происходящему через биологические мембраны транспорту. В частности, кинетика простой диффузии через клеточный пласт будет такой же, что и через биологическую мембрану (см. рис. 2-3А). В то же время даже формальное описание трансмембранной облегчён-
ной диффузии и активного транспорта не может быть прямо перенесено на эти процессы в клеточном пласте. Причина очевидна: и облегчённую диффузию, и активный транспорт осуществляют конкретные белки, вмонтированные в плазматическую мембрану. Между тем транспорт сквозь клеточный барьер происходит минимально через 2 плазмолеммы (верхушечную, или апикальную и базальную) одной и той же клетки (рис. 4-6). Более того, транспорт через барьер (трансцеллюлярный перенос) может происходить не только сквозь клетку, но и по щелям между соседними клетками (парацеллюлярный транспорт), которые обычно перекрыты специализированными межклеточными контактами. Наконец, в базальной части барьера присутствует компактная масса межклеточного вещества - базальная мембрана, барьерная функция которой для веществ разной молекулярной массы и разного заряда - установленный факт.
Свойства барьеров
• Компоненты барьеров. Барьер (см. рис. 4-6) образуют клеточный пласт (или его варианты в виде трубочек или фолликулов), базальная мембрана клеток и щели между клетками, перекрытые специализированными контактами.
• Характеристики барьера определяются свойствами разных барьерных компонентов. Проницаемость различных барьеров (например,
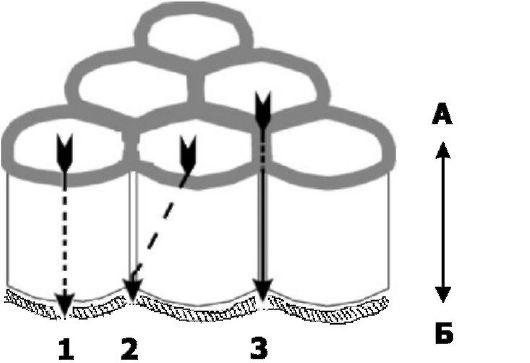 Рис. 4-6. Пути трансклеточной проницаемости. Перенос через клеточный барьер происходит в обоих направлениях: как со стороны верхушечной (апикальной - А) поверхности
(обращена во внешнюю среду организма, либо омывается жидкостью серозных
полостей, либо кровью или лимфой в сосудах, либо ликвором в ЦНС, либо
первичной мочой в просвете почечных канальцев), так и со стороны
базальной поверхности (Б обращена во внутреннюю среду организма).
На рисунке показаны пути переноса через клеточный барьер от его
апикальной поверхности к базальной поверхности (к ней примыкает
базальная мембрана): 1. - трансцеллюлярный; 2 - комбинированный вариант переноса; 3 -
парацеллюлярный. Более подробно парацеллюлярный путь представлен на
рис. 4-4 (в частности, межклеточные щели полностью или частично
перекрыты плотными и промежуточными контактами, а также десмосомами).
Рис. 4-6. Пути трансклеточной проницаемости. Перенос через клеточный барьер происходит в обоих направлениях: как со стороны верхушечной (апикальной - А) поверхности
(обращена во внешнюю среду организма, либо омывается жидкостью серозных
полостей, либо кровью или лимфой в сосудах, либо ликвором в ЦНС, либо
первичной мочой в просвете почечных канальцев), так и со стороны
базальной поверхности (Б обращена во внутреннюю среду организма).
На рисунке показаны пути переноса через клеточный барьер от его
апикальной поверхности к базальной поверхности (к ней примыкает
базальная мембрана): 1. - трансцеллюлярный; 2 - комбинированный вариант переноса; 3 -
парацеллюлярный. Более подробно парацеллюлярный путь представлен на
рис. 4-4 (в частности, межклеточные щели полностью или частично
перекрыты плотными и промежуточными контактами, а также десмосомами).
• плацентарного между организмами матери и плода, аэрогематического в респираторном отделе лёгкого, фильтрационного в почечных тельцах, гематоэнцефалического в ЦНС, гематотимического в вилочковой железе, слизисто-бикарбонатного в желудке, гематотестикулярного в яичках, а также эндотелиальных и различных эпителиальных барьеров) рассматривается в соответствующих главах. Проницаемость широко варьирует между разными барьерами и определяется неспецифическими и специфическими факторами.
❖ Неспецифические факторы проницаемости. К ним относятся свойства биологических мембран в составе барьеров, перекрывающие межклеточные щели специализированные межклеточные контакты, электрохимический градиент между апикальной и базальной поверхностями барьера и электрическое сопротивление барьера.
❖ Специфические свойства проницаемости барьера определяет различный спектр интегральных белков пор, каналов, переносчиков и насосов между плазматическими мембранами апикальной и базальной поверхностей барьера. Для разных барьеров качественные и количественные характеристики таких интегральных белков специфичны, что и определяет специфику переноса конкретных ионов, молекул и воды (особенно это обстоятельство характерно для разных отделов канальцев нефрона). Не в последнюю очередь специфичность спектра белков определяется тем обстоятельством, что в геноме человека имеются сотни генов, кодирующих полипептиды пор, каналов, переносчиков и насосов.
МЕЖКЛЕТОЧНЫЕ ИНФОРМАЦИОННЫЕ ВЗАИМОДЕЙСТВИЯ
Клетки, воспринимая и трансформируя различные сигналы, реагируют на изменения окружающей их среды, являясь местом приложения физических (например, кванты света в фоторецепторах), химических (например, вкусовые и обонятельные молекулы, рН), механических (например, давление или растяжение в механорецепторах) раздражителей внешней и внутренней сред организма и сигналов информационного характера (например, гормоны и нейромедиаторы) из внутренней среды организма. Все виды информационных межклеточных взаимодействий реализуются в рамках концепции «сигнал-ответ», основы которой заложил Пауль Эрлих. Информационные межклеточные взаимодействия укладывается в схему, предусматривающую следующую последовательность событий:
сигнал - рецептор - (посредник) - ответ
Контактная и дистантная регуляция функций
Регуляция функций организма, органов и систем органов, а также отдельных клеток осуществляется при помощи регуляторного сигнала контактно либо дистантно. И при контактном, и при дистантном способах регуляции передача сигнала и регистрация сигнала всегда происходит между отдельными клеточными элементами. Одна клетка регулирует, вторая - регулируется.
Контактная регуляция
При контактном способе регуляции регулирующая и регулируемая клетки находятся друг с другом в контакте.
• Классический пример контактной регуляции - нервная регуляция. Нервная регуляция осуществляется при помощи контактов - синапсов - между регулирующей и регулируемой клетками. Передачу сигнала в синапсе осуществляют специальные молекулы - освобождающиеся из пресинаптической клетки нейромедиаторы, а регистрация сигнала происходит при помощи молекулярных рецепторов, вмонтированных в постсинаптическую мембрану (так, в нервно-мышечном синапсе между терминальными разветвлениями α-мотонейронов и скелетными МВ действует ацетилхолин, связывающийся с никотиновыми ацетилхолиновыми рецепторами).
• Другой пример межклеточной контактной регуляции - щелевые контакты (нексусы, англ. gap junction, лат. nexus), объединяющие отдельные клетки в так называемые функциональные синцитии. Через щелевые контакты осуществляется электротоническое, метаболическое и информационное сообщение между контактирующими клетками. Пример функционального синцития: миокард - совокупность кардиомиоцитов.
Дистантная регуляция
При дистантной (гуморальной) регуляции регулирующая и регулируемая клетки расположены на расстоянии друг от друга, иногда на весьма значительном. При дистантной регуляции необходим материальный агент передачи сигнала между дистантно расположенными клетками. Такими агентами являются информационно активные вещества (гормоны, цитокины, факторы роста и так далее). Молекулы таких веществ на пути от клетки-регулятора до регулируемой клетки-мишени находятся в различных жидкостях (лат. humor) организма: крови, ликворе, лимфе, тканевой жидкости. Отсюда и термин для дистантной регуляции - гуморальная регуляция (рис. 4-7).
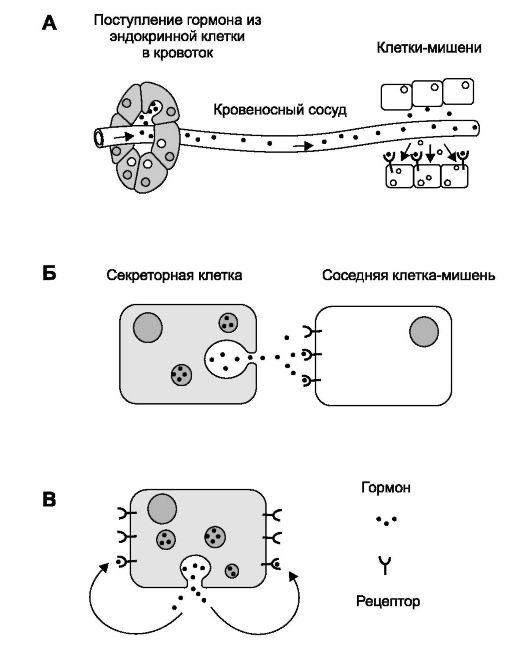 Рис. 4-7. Варианты гуморальной регуляции [11]. А - эндокринная. Б - паракринная. В - аутокринная
Рис. 4-7. Варианты гуморальной регуляции [11]. А - эндокринная. Б - паракринная. В - аутокринная
• Классический пример дистантной (гуморальной) регуляции - эндокринная регуляция (рис. 4-7А): гормоны, секретируемые эндокринными клетками, оказываются в жидкостях организма (в большинстве случаев в крови), через эти жидкости достигают клеток-мишеней, связываются со специфичными именно для конкретного гормона молекулярными рецепторами и изменяют режим функционирования клетки-мишени.
• Циркуляция в крови. Гормоны циркулируют в крови либо свободно, либо в комплексе со связывающими их белками (T4, Т3, стероидные гормоны, инсулиноподобные факторы роста, гормон роста). Связывание с такими белками существенно увеличивает время полужизни гормонов. Так, T4 в составе комплекса циркулирует около одной недели, тогда как время полужизни свободного T4 составляет несколько минут. Варианты дистантной регуляции: паракринная регуляция (рис. 4- 7Б) подразумевает эффекты гормона, влияющего путём диффузии на соседние клетки-мишени, а аутокринная регуляция (рис. 4-7В) - эффекты гормона непосредственно на секретирующую этот гормон клетку.
СИГНАЛЫ. Передачу сигналов от клетки к клетке осуществляют сигнальные молекулы (первый посредник), вырабатываемые в одних клетках и специфически воздействующие на другие клетки - клетки-мишени. Специфичность воздействия сигнальных молекул определяют присутствующие в клетках-мишенях рецепторы, связывающие только собственные лиганды. Все сигнальные молекулы (лиганды) - в зависимости от их физико-химической природы - подразделяют на полярные (точнее - гидрофильные) и аполярные (точнее - жирорастворимые). Гидрофильные молекулы (например, нейромедиаторы, цитокины, пептидные гормоны, Аг) не проникают через плазматическую мембрану и связываются с рецепторами плазмолеммы (мембранные рецепторы). Жирорастворимые молекулы (например, стероидные гормоны) проникают через плазмолемму и связываются с рецепторами внутри клетки (ядерные рецепторы).
Рецепторы
Рецепторы в клетке-мишени - белки (в ряде случаев гликоили липопротеины), в каждой клетке-мишени они начитываются тысячами и десятками тысяч. Количество рецепторов в клетках-ми- шенях не остаётся постоянным: рецепторы инактивируются или разрушаются в процессе их функционирования, реактивируются и постоянно синтезируются в клетках-мишенях. Лиганд, взаимодействуя с его рецептором, образует лиганд-рецепторный комплекс, что самым серьёзным образом изменяет функциональные возможности рецептора и является толчком для проявления физиологического эффекта. Рецепторы (в зависимости от их расположения в клетке-мишени) подразделяют на мембранные (встроенные в плазматическую мембрану) и внутриклеточные - цитозольные и ядерные - (обычно их называют ядерными). Некоторые рецепторы
встроены в мембраны внутриклеточных органоидов (например, в мембранах эндоплазматической сети находятся рецепторы рианодина и ИТФ).
Мембранные рецепторы
• Мембранные рецепторы регистрируют наличие лиганда (пептидного гормона, производных аминокислот, нейромедиаторов, цитокинов) и передают сигнал внутриклеточным химическим соединениям, опосредующим конечный эффект, - вторым посредникам (G-белки, циклические нуклеотиды, ионы Ca2+, ИТФ и др.). Мембранные рецепторы подразделяют на каталитические, связанные с ионными каналами, являющиеся ионными каналами, оперирующие через G-белок и освобождающие факторы транскрипции. Каталитические рецепторы - трансмембранные белки, наружная часть которых содержит связывающий лиганд участок, а цитоплазматическая часть либо сама функционирует как активный центр фермента, либо тесно связана с молекулой фермента. Известно 5 типов каталитических рецепторов.
❖ Рецепторные гуанилатциклазы катализируют образование цГМФ из ГТФ. К таким мембранным рецепторным белкам-ферментам относятся 2 рецептора предсердного натриуретического фактора.
❖ Рецепторные серин/треониновые киназы фосфорилируют остатки серина и/или треонина как самого рецептора (автофосфорилирование), так и внутриклеточных белков. К этим рецепторам относятся рецепторы контролирующих рост и дифференцировку клеток цитокинов - трансформирующих факторов роста β, ингибинов, почти десятка так называемых морфогенетических белков кости.
❖ Рецепторные тирозинкиназы фосфорилируют остатки тирозина как самого белка-рецептора (автофосфорилирование), так и разных внутриклеточных белков. К этой группе рецепторов относятся рецептор инсулина и рецепторы многих факторов роста (фибробластов, нервов, инсулиноподобного I).
❖ Рецепторы, связанные с тирозинкиназами, взаимодействуют с цитоплазматическими тирозинкиназами, многие из которых являются протоонкогенами. К этой многочисленной группе рецепторов относятся рецепторы интерферонов (α, β, γ), интерлейкинов (ИЛ2, ИЛ3, ИЛ4, ИЛ5, ИЛ6), колониестимулирующего фактора гранулоцитов и макрофагов (GM-CSF), эритропоэтина.
❖ Рецепторные тирозинфосфатазы освобождают (дефосфорилируют) фосфатные группировки из фосфорилированных тирозилов внутриклеточных белков. К таким рецепторам относится
общий Аг лимфоцитов CD45 (от англ. cluster of differentiation - кластер дифференцировки, дифференцировочный Аг), обнаруженный в большинстве гемопоэтических клеток. Различные сигналы посредством CD45 запускают дифференцировку таких клеток (в частности, лимфоцитов).
• Рецепторы, связанные с ионными каналами, влияют на проницаемость ионных каналов через вторые посредники. К ним относятся адренорецепторы, мускариновые холинорецепторы, рецепторы серотонина, дофамина. Рецепторы этого типа - метаботропные рецепторы, они активируются в клетке-мишени в результате различных метаболических процессов, происходящих после образования комплекса «лиганд-рецептор».
• Управляемые лигандами ионные каналы - интегральные мембранные белки - сочетают свойства рецептора и ионного канала и встроены в постсинаптическую мембрану нервных клеток, а также в постсинаптическую мембрану нервно-мышечного синапса между разветвлениями аксонов мотонейронов и скелетными МВ. Другими словами, некоторые рецепторы нейромедиаторов (например, никотиновые холинорецепторы, рецепторы глицина, серотонина, ГАМК и глутаминовой кислоты) сами по себе являются ионными каналами - ионотропные рецепторы (связывание лиганда с рецептором регулирует трансмембранную проницаемость за счёт ионного канала в составе рецептора). К этой же группе относятся рецепторы ИТФ и рианодиновые рецепторы (см. рис. 7-5), встроенные в мембраны эндоплазматической сети и фактически являющиеся Ca2+ -каналами.
• Рецепторы, связанные с G-белком - полипептидные цепочки, расположенные в плазматической мембране клетки-мишени таким образом, что полипептид пронизывает мембрану 7 раз, образуя при этом по 3 находящихся кнаружи и кнутри от мембраны петли. Внеклеточный (N-конец) полипептида содержит связывающий лиганд участок, внутриклеточный (C-конец) расположен в цитозоле, а одна из обращённых внутрь клетки петель связывает G-белок.
❖ Лиганды связанных с G-белком мембранных рецепторов: ангиотензин II, АТФ, ацетилхолин (мускариновые рецепторы), нейромедин B, гастрин-РГ, брадикинин, вазопрессин, глюкагон, вещество Р, гистамин, глутамат, люлиберин, нейропептид Y, норадреналин, ПТГ, серотонин, ТТГ, фактор активации тромбоцитов, холецистокинин, эндотелин, метионин-энкефалин и др.
❖ G-белок - тример, т.е. состоит из трёх субъединиц (СЕ) - α, β и γ (рис. 4-8). В покое (рецептор не связан с лигандом) СЕ
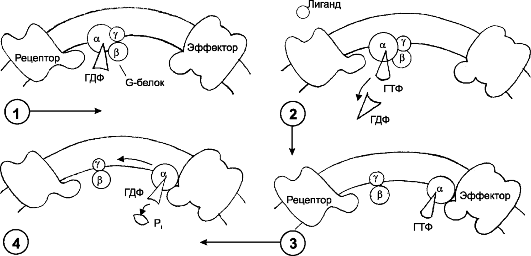 Рис. 4-8. Белок G [11]. 1. Выключенное состояние: α-СЕ связана с гуанозиндифосфатом (ГДФ) и не контактирует с рецептором; 2. При взаимодействии лиганда с рецептором ГДФ заменяется на ГТФ, G-белок активируется; 3. G-белок диссоциирует, несущая ГТФ α-СЕ перемещается в мембране, связывается с эффектором и активирует его; 4. α-СЕ превращает ГТФ в ГДФ, инактивируется и объединяется с другими СЕ G-белка
Рис. 4-8. Белок G [11]. 1. Выключенное состояние: α-СЕ связана с гуанозиндифосфатом (ГДФ) и не контактирует с рецептором; 2. При взаимодействии лиганда с рецептором ГДФ заменяется на ГТФ, G-белок активируется; 3. G-белок диссоциирует, несущая ГТФ α-СЕ перемещается в мембране, связывается с эффектором и активирует его; 4. α-СЕ превращает ГТФ в ГДФ, инактивируется и объединяется с другими СЕ G-белка
G-белка объединены и не контактируют с цитоплазматической петлёй рецептора, при этом α-СЕ связана с гуанозиндифосфатом. При активации G-белка вследствие взаимодействия G-белка с комплексом «лиганд-рецептор» гуанозиндифосфат отделяется от α-СЕ, а место ГДФ занимает ГТФ. В результате G-белок активируется и диссоциирует. При этом α-СЕ с ГТФ перемещается и связывается с эффектором (активируемые соединения и структуры). Затем α-СЕ катализирует переход ГТФ в ГДФ, инактивируется и вновь объединяется с другими СЕ G-белка.
❖ Функциональные формы α-СЕ G-белка Gα). В функциональном отношении различают: Gαs - активатор аденилатциклазы; Gαi - ингибитор аденилатциклазы; Gαp - активатор фосфолипазы C; Gαt - активатор цГМФ-фосфодиэстеразы (трансдуцин) и другие варианты.
❖ Эффекторы - активируемые соединения и структуры. Независимо, антагонистически или синергестически Gα и комплекс Gβγ активируют фосфолипазы А2 и Cβ1-3, активируют или ингибируют аденилатциклазу, активируют фосфодиэстеразу цГМФ, открывают Са2+- и К+-каналы, закрывают Na+-каналы, увеличивают или уменьшают внутриклеточное содержание цАМФ и цГМФ, увеличивают концентрацию внутриклеточного Са2+, ИТФ и диацилглицерола, ускоряют освобождение арахидоновой кислоты. Некоторые G-белки регулируют работу ионных каналов не только опосредованно (посредством цАМФ- активируемых протеинкиназ), но и прямо взаимодействуют с ионными каналами (так, при активации β-адренорецепторов Gαs связывается с Ca2+-каналами типа L в миокарде и в скелетных мышцах).
• Освобождающие факторы транскрипции рецепторы - трансмембранные белки, встроенные в плазмолемму и в мембраны эндоплазматического ретикулума. После активации этого типа рецепторов протеолитические ферменты отщепляют от рецепторов обращённый в цитозоль фрагмент, поступающий в ядро клетки и специфический связывающийся с промоторными последовательностями ДНК, что запускает транскрипцию соответствующего гена. Эти рецепторы и освобождаемые ими факторы транскрипции регулируют процессы дифференцировки (специализации) клеток, внутриклеточное содержание холестерола, а также метаболизм амилоида.
К настоящему времени описаны сотни трансмембранных белков-рецепторов для химических посредников. Эти белки не явля-
ются статическими компонентами, их число и чувствительность к лигандам увеличивается или уменьшается в зависимости от продолжительности ответа, а свойства рецепторов изменяются вместе с изменениями физиологических условий (нисходящая и восходящая регуляция, десенситизация).
• Позитивная регуляция. Недостаток химического посредника приводит к увеличению количества активных рецепторов.
• Негативная регуляция наблюдается при избыточном количестве гормона или нейромедиатора, при этом число действующих рецепторов или их чувствительность к лигандам уменьшается.
• Десенситизация рецепторов - вариант негативной регуляции - процесс, приводящий к значительному уменьшению чувствительности рецепторов к их лигандам. Классический пример такой десенситизации - β-адренергические рецепторы.
Ядерные рецепторы
Ядерные рецепторы - белки-рецепторы стероидных гормонов (минерало- и глюкокортикоиды, эстрогены, прогестины, тестостерон), ретиноидов, тиреоидных гормонов, жёлчных кислот, витамина D3. Каждый рецептор имеет область связывания лиганда и участок, взаимодействующий со специфическими последовательностями ДНК. Другими словами, ядерные рецепторы - активируемые лигандом факторы транскрипции. В геноме человека имеется более 30 ядерных рецепторов, лиганды которых находятся на стадии идентификации (сиротские рецепторы).
Вторые посредники
Внутриклеточные сигнальные молекулы (вторые посредники) передают сигнал от мембранных рецепторов на эффекторы (исполнительные молекулы), опосредующие ответ клетки на сигнал. К вторым (внутриклеточным) посредникам относятся циклические нуклеотиды (цАМФ и цГМФ), ИТФ, диацилглицерол, Ca2+, а также продукты окисления арахидоновой кислоты.
• Циклические нуклеотиды (цАМФ, цГМФ). Цепь реакций, ключевым звеном в которой служит цАМФ, выглядит так: гормон - рецептор - активатор (Gs ) аденилатциклазы - активность аденилатциклазы - [цАМФ]Т - активация цАМФ-зависимой протеинкиназы A - фосфорилирование различных белков (преимущественно ферментов) - каскад ферментативных реакций - физиологический ответ клетки. Фундаментальное свойство этой и других систем вторых посредников заключается в том, что сигнал многократно усиливается (феномен мультипликации). На-
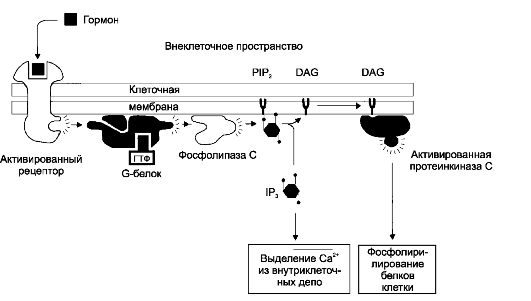 Рис. 4-9. Роль инозитолтрифосфата и диацилглицерола в реализации эффекта лигандов на клетку-мишень [11].
Образование комплекса лиганда с рецептором стимулирует G-белок, который
активирует фосфолипазу С. Фосфолипаза С катализирует расщепление
инозитол-4,5-бифосфата (PIP2) на инозитол-1,4,5-трифосфат (IP3) и диацилглицерол (DAG). Инозитолтрифосфат (IP3) вызывает освобождение Ca2+ из внутриклеточных депо. Ca2+-зависимая протеинкиназа С, активированная диацилглицеролом (DAG), фосфорилирует белки клетки
Рис. 4-9. Роль инозитолтрифосфата и диацилглицерола в реализации эффекта лигандов на клетку-мишень [11].
Образование комплекса лиганда с рецептором стимулирует G-белок, который
активирует фосфолипазу С. Фосфолипаза С катализирует расщепление
инозитол-4,5-бифосфата (PIP2) на инозитол-1,4,5-трифосфат (IP3) и диацилглицерол (DAG). Инозитолтрифосфат (IP3) вызывает освобождение Ca2+ из внутриклеточных депо. Ca2+-зависимая протеинкиназа С, активированная диацилглицеролом (DAG), фосфорилирует белки клетки
пример, достаточно нескольких молекул аденилатциклазы, чтобы активировать многие молекулы других ферментов и пустить в ход нарастающий каскад ферментных реакций. Таким путём даже небольшое количество молекул лиганда может вызвать мощный физиологический ответ клетки-мишени.
• Инозитолтрифосфат и диацилглицерол (рис. 4-9). G-белок активирует фосфолипазу C, что приводит к отщеплению от фосфоинозитолбифосфата фосфолипидов клеточной мембраны двух вторых посредников - цитозольного ИТФ и мембранного диацилглицерола.
• Ионы Ca2+ - распространённый второй посредник, регулирующий множество процессов (рассмотрены в разных главах учебника). Функционирование ионов Ca2+ в качестве вторых посредников возможно лишь при поддержании нормальной [Ca2+] в цитозоле в крайне низких пределах (<100 нмоль/л), что поддер-
• живается Ca2+-АТФазами плазмолеммы и внутриклеточных депо кальция (например, эндоплазматический ретикулум). Рецепторы ионов Ca2+ - Ca2+ связывающие белки (например, тропонин C, кальмодулин и др.). Производные арахидоновой кислоты рассмотрены в главе 18 (раздел «Химия гормонов»).
Ответы клеток-мишеней выполняются на разных уровнях реализации генетической информации (например, транскрипция, посттрансляционная модификация) и крайне разнообразны (изменения режима функционирования клетки, стимуляция или подавление активности ферментов, перепрограммирование синтеза белков и т.д.).
эндокринная, нервная
и нейроэндокринная регуляция
В организме имеются 2 регуляторные системы - нервная и эндокринная. Основные задачи эндокринной системы - поддержание гомеостаза организма в целом, регулирование функций органов, систем органов и клеточных популяций. Практически теми же словами определяются и задачи нервной системы. Эти регуляторные задачи выполняются эндокринной системой гуморальным пу- тём при помощи циркулирующих во внутренней среде организма многочисленных гормонов (гуморальная регуляция), а нервной системой - при помощи строго организованных анатомических структур (нервная регуляция). Каким именно образом и при помощи каких принципов осуществляется нервная регуляция, рассмотрено в последующих главах. Поскольку и нервная, и эндокринная система выполняют одну и ту же - регуляторную - функцию, можно полагать, что и используемые принципы окажутся сходными (например, иерархичность организации, сочетанные и антагонистические эффекты на клетки-мишени, восходящие и нисходящие связи, наличие обратной связи (как отрицательной, так и положительной) и саморегулирующихся контуров, мультипликация эффектов). Существенно также, что обе системы, выполняя ту же самую - регуляторную - функцию, не могут не взаимодействовать друг с другом в условиях целостного организма. В связи с этим сложилось представление о нейроэндокринной регуляции - о сочетанной деятельности мозга и нервных проводников, эндокринных клеток и их мишеней - системе, осуществляющей регуляцию конкретных функций организма. Для нейроэндокринной регуляции ключевым является понятие о саморегулирующихся регуляторных контурах.
Регуляторные контуры. Типичный пример регуляторного контура - половая функция женщины. В этом иерархическом контуре можно выделить «сверху вниз» следующие уровни: нейроны коры большого мозга, подкорковые структуры, нейроэндокринные клетки гипоталамуса, эндокриноциты передней доли гипофиза, эндокринные клетки половых органов, клетки-мишени половых гормонов.
• Сигналы каждого уровня оказывают регуляторное воздействие на следующий уровень в направлении «сверху вниз».
• Каждый уровень контура направляет гуморальные или нервные сигналы к вышерасположенным уровням (чаще - по принципу отрицательной обратной связи - подавляя активность этих уровней).
• В структурах мозга существуют относительно автономные генераторы ритма.
• Один из таких генераторов обеспечивает циклический характер функционирования женской половой системы в виде саморегулирующегося нейроэндокринного контура - овариально-менструального цикла. Подробнее саморегулирующийся контур, обеспечивающий выполнение овариально-менструального цикла, рассмотрен в главе 19. Другие регуляторные контуры разобраны в главе 18 («Эндокринная система»).