Нормальная физиология : Учебник. - Р.С. Орлов, А.Д. Ноздрачёв, 2009. - 688 с
|
|
|
|
ГЛАВА 24. КРОВЬ
Кровь относится к жидкостям внутренней среды организма, точнее - к внеклеточной жидкости, ещё точнее - к циркулирующей в сосудистой системе плазме крови и взвешенным (суспендированным) в плазме клеткам. Свернувшаяся (коагулировавшая) кровь состоит из сгустка (тромб), включающего клеточные элементы и некоторые белки плазмы, и прозрачной жидкости, сходной с плазмой, но лишённой фибриногена (сыворотка). Система крови включает органы кроветворения (гемопоэза) и периферическую кровь (как её циркулирующую, так и депонированную (зарезервированную) в органах и тканях фракции). Кровь - одна из интегрирующих систем организма. Различные отклонения в состоянии организма и отдельных органов приводят к изменениям в системе крови и наоборот. Именно поэтому при оценке состояния здоровья или нездоровья человека тщательно исследуют параметры, характеризующие кровь (гематологические показатели).
Функции крови. Многочисленные функции крови определяются не только присущими самой крови (плазме и клеточным элементам) свойствами, но и теми обстоятельствами, что кровь циркулирует в сосудистой системе, пронизывающей все ткани и органы, и находится в постоянном обмене с интерстициальной жидкостью, омывающей все клетки организма. В самом общем виде к функциям крови относятся транспортная, гомеостатическая, защитная и гемокоагуляционная. Как часть внутренней среды организма, кровь является интегральной частью практически любой функциональной активности (например, участие крови в дыхании, питании и метаболизме, экскреции, регуляция гормональная и температурная, КЩР и объёма жидкостей, реализация иммунных реакций).
Объёмы крови. Общий объём крови принято рассчитывать от массы тела (без учёта жира), что составляет примерно 7% (6-8%, для новорож- дённых - 8,5%). Так, у взрослого мужчины массой 70 кг объём крови составляет около 5600 мл (60 мл/кг массы тела). При этом 3,5-4 л обычно циркулирует в сосудистом русле и полостях сердца (циркулирующая фракция крови, или ОЦК - объём циркулирующей крови), а 1,5-2 л депонировано в сосудах органов брюшной полости, лёгких, подкожной
клетчатки и других тканей (депонированная фракция). Объём плазмы составляет примерно 55% общего объёма крови. Клеточные элементы составляют 45% (36-48) от общего объёма крови. Определение объёма крови осуществляют прямо (за счёт мечения эритроцитов 51Cr) или косвенно (за счёт мечения альбумина плазмы 131I или определения гематокрита).
Гематокрит (гематокритное число) - отношение объёма клеточных элементов крови (99% приходится на эритроциты) к объёму плазмы - в норме равен у мужчин 0,41-0,50, у женщин - 0,36-0,44.
Реологические свойства
Реологические (в том числе вязкие) свойства крови важны для оценки движения крови в сосудах и для оценки суспензионной стабильности эритроцитов.
Вязкость - свойство жидкости, влияющее на скорость её движения. Вязкость крови на 99% определяют эритроциты. Сопротивление потоку крови (по закону Пуазейля) прямо пропорционально вязкости, а вязкость прямо пропорциональна гематокриту. Таким образом, увеличение гематокрита означает увеличение нагрузки на сердце (т.е. происходит увеличение объёмов наполнения и выброса сердцем).
Суспензионная стабильность эритроцитов. Эритроциты в крови отталкиваются друг от друга, так как имеют на поверхности отрицательный заряд. Уменьшение поверхностного отрицательного заряда эритроцитов приводит к их агрегации, такие агрегаты менее устойчивы в гравитационном поле, так как увеличена их эффективная плотность. Скорость оседания эритроцитов (СОЭ) является мерой оценки суспензионной устойчивости эритроцитов. Измерение величины СОЭ проводят в градуированных капиллярных пипетках, а для предотвращения свёртывания крови к ней добавляют трёхзамещённый цитрат натрия (так называемая цитратная кровь). В течение часа в верхней части капиллярной трубки появляется светлый столбик плазмы, высота которого в миллиметрах и является величиной СОЭ (у здоровых лиц 2-15 мм/ч). Наиболее типичная причина повышения СОЭ - воспаление различного генеза (бактериальное, аутоиммунное), беременность, опухолевые заболевания, что приводит к изменениям белкового состава плазмы крови. Особенно «ускоряет» СОЭ увеличение содержания фибриногена и отчасти γ-глобулинов.
ПЛАЗМА
Надосадочная жидкость, образующаяся после центрифугирования свернувшейся крови, - кровяная сыворотка. Надосадочная жидкость после центрифугирования цельной крови с добавленными к ней антикоагулянтами (цитратная кровь, гепаринизированная кровь), -
плазма крови. В отличие от плазмы в сыворотке нет ряда плазменных факторов свёртывания крови (I - фибриноген, II - протромбин, V - проакцелерин и VIII - антигемофилический фактор). Плазма - жидкость бледноянтарного цвета, содержащая белки, углеводы, липиды, липопротеины, электролиты, гормоны и другие химические соединения. Объём плазмы - около 5% массы тела (при массе 70 кг - 3500 мл) и 7,5% всей воды организма. Плазма крови состоит из воды (90%) и растворённых в ней веществ (10%, органические - 9%, неорганические - 1%; в твёрдом остатке на долю белков приходится примерно 2/3, а 1/3 - низкомолекулярные вещества и электролиты). Химический состав плазмы сходен с интерстициальной жидкостью (преобладающий катион - Na+, преобладающие анионы - Cl-, HCO3-), но концентрация белка в плазме выше (70 г/л).
Белки
В плазме содержится несколько сотен различных белков, поступающих в основном из печени, но также из циркулирующих в крови клеточных элементов и из множества внесосудистых источников. Функции плазменных белков крайне разнообразны.
Классификации. Плазменные белки классифицируют по физико-химической характеристике (точнее - по их подвижности в электрическом поле), а также в соответствии с выполняемыми функциями.
• Электрофоретическая подвижность. Выделено 5 электрофоретических фракций плазменных белков: альбумины и глобулины (α1- и α2-, β- и γ-).
❖ Альбумины (40 г/л, Mr =60-65 кД) в значительной степени определяют онкотическое (коллоидно-осмотическое) давление (25 мм рт.ст., или 3,3 кПа) крови (в 5 раз более онкотического давления межклеточной жидкости). Именно поэтому при массивной потере альбуминов (гипоальбуминемия) через почки развиваются «почечные» отёки, а при голодании - «голодные» отёки.
❖ Глобулины (30 г/л), в том числе (примеры):
♦ а^глобулины: а1-антитрипсин, а^липопротеины (высокой плотности), протромбин;
♦ а2-глобулины: а2-макроглобулин, а2-антитромбин III, а2-гаптоглобулин, плазминоген;
♦ β-глобулины: β-липопротеины (низкой плотности), апоферритин, гемопексин, фибриноген, C-реактивный белок;
♦ γ-Глобулины: иммуноглобулины (IgA, IgD, IgE, IgG, IgM).
• Функциональная классификация. Выделяют три главных группы: 1. белки системы свёртывания крови; 2. белки, участвующие в иммунных реакциях; 3. транспортные белки.
1. Белки системы свёртывания крови. Различают коагулянты и антикоагулянты. Обе группы белков обеспечивают равновесие между процессами формирования и разрушения тромба.
♦ Коагулянты (в первую очередь это плазменные факторы свёр- тывания) участвуют в формировании тромба. Например, фибриноген (синтезируется в печени и при гемокоагуляции превращается в фибрин).
♦ Антикоагулянты - компоненты фибринолитической системы (препятствуют свёртыванию).
2. Белки, участвующие в иммунных реакциях. К этой группе относят Ig и белки системы комплемента (подробнее см. главу 29).
3. Транспортные белки - альбумины (жирные кислоты), аполипопротеины (холестерин), трансферрин (железо), гаптоглобин (Hb), церулоплазмин (медь), транскортин (кортизол), транскобаламины (витамин B12) и множество других.
Липопротеины
В плазме крови холестерин и триглицериды формируют комплексы с белками. Такие различные по величине и другим характеристикам комплексы называются липопротеинами (ЛП). Транспорт холестерина осуществляют липопротеины низкой плотности (ЛПНП), ЛП очень низкой плотности (ЛПОНП), ЛП промежуточной плотности (ЛППП), ЛП высокой плотности (ЛПВП), а также хиломикроны. С клинической точки зрения (вероятность развития артериосклеротического поражения - атеросклероза) существенное значение имеет содержание в крови холестерина и способность ЛП фиксироваться в стенке артерий (атерогенность).
• ЛПВП - наименьшие по размеру (5-12 нм) ЛП - легко проникают в стенку артерий и также легко её покидают, т.е. ЛПВП не атерогенны.
• ЛПНП (18-25 нм), ЛППП промежуточной плотности (25-35 нм) и небольшая часть ЛПОНП (размер около 50 нм) достаточны малы для того, чтобы проникнуть в стенку артерий. После окисления эти ЛП легко задерживаются в стенке артерий. Именно эти категории ЛП атерогенны.
• Крупные по размеру ЛП - хиломикроны (75-1200 нм) и ЛПОНП значительных размеров (80 нм) - слишком велики для того, чтобы проникнуть в артерии и не расцениваются как атерогенные.
Осмотическое и онкотическое давление
Содержащиеся в плазме осмолиты (осмотически активные вещества), т.е. электролиты низкомолекулярных (неорганические соли, ионы) и высокомолекулярных веществ (коллоидные соединения, преимущественно
белки) определяют важнейшие характеристики крови - осмотическое и онкотическое давление. В медицинской практике эти характеристики важны не только по отношению к крови per se (например, представление об изотоничности растворов), но и для реальной ситуации in vivo (например, для понимания механизмов перехода воды через капиллярную стенку между кровью и межклеточной жидкостью [в частности механизмов развития отёков], разделённых эквивалентом полупроницаемой мембраны - стенкой капилляра). В этом контексте для клинической практики существенны эффективное гидростатическое и центральное венозное давление.
Осмотическое давление (π, см. подробнее в главе 3, в т.ч. на рис. 2- 9) - избыточное гидростатическое давление на раствор, отделённый от растворителя (воды) полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (в условиях in vivo ею является сосудистая стенка). Осмотическое давление крови может быть определено по точке замерзания (т.е. криоскопически) и в норме составляет 7,5 атм (5800 мм рт.ст., 770 кПа, 290 мосмоль/кг воды).
Онкотическое давление (коллоидно-осмотическое давление - КОД) давление, которое возникает за счёт удержания воды в сосудистом русле белками плазмы крови. При нормальном содержании белка в плазме (70 г/л) КОД плазмы - 25 мм рт.ст. (3,3 кПа), тогда как КОД межклеточной жидкости значительно ниже (5 мм рт.ст., или 0,7 кПа).
Эффективное гидростатическое давление - разница между гидростатическим давлением межклеточной жидкости (7 мм рт.ст.) и гидростатическим давлением крови в микрососудах. В норме эффективное гидростатическое давление составляет в артериальной части микрососудов 36-38 мм рт.ст., а в венозной - 14-16 мм рт.ст.
Центральное венозное давление - давление крови внутри венозной системы (в верхней и нижней полых венах), в норме составляющее от 4 до 10 см водного столба. Центральное венозное давление снижается при уменьшении ОЦК и повышается при сердечной недостаточности и застое в системе кровообращения.
Инфузионные растворы. Солевые инфузионные растворы для внутривенного введения должны иметь то же осмотическое давление, что и плазма, т.е. быть изоосмотическими (изотоническими, например, так называемый физиологический раствор - 0,85% раствор хлорида натрия).
Кислотно-щелочное равновесие, включая буферные системы крови, рассмотрено в главе 28.
КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ КРОВИ
К клеткам крови (устаревшее название - форменные элементы) относятся эритроциты, лейкоциты и тромбоциты, или кровяные пластинки (рис. 24-1). Клетки крови изучают микроскопически на мазках,
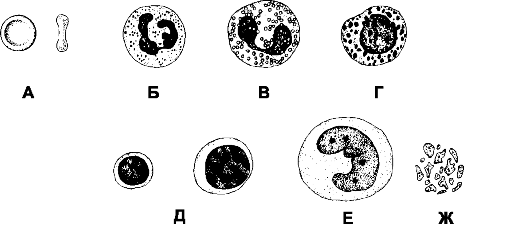 Рис. 24-1. Клетки крови [11]. Кровь содержит три разновидности клеток: эритроциты (безъядерные клетки, имеющие форму двояковогнутого диска), лейкоциты (ядерные клетки шаровидной формы, содержащие различного типа гранулы) и тромбоциты (фрагменты цитоплазмы расположенных в костном мозге гигантских клеток - мегакариоцитов). А - эритроцит. Б - нейтрофил. В - эозинофил. Г - базофил. Д - лимфоциты (малый и большой). Е - моноцит. Ж - тромбоциты
Рис. 24-1. Клетки крови [11]. Кровь содержит три разновидности клеток: эритроциты (безъядерные клетки, имеющие форму двояковогнутого диска), лейкоциты (ядерные клетки шаровидной формы, содержащие различного типа гранулы) и тромбоциты (фрагменты цитоплазмы расположенных в костном мозге гигантских клеток - мегакариоцитов). А - эритроцит. Б - нейтрофил. В - эозинофил. Г - базофил. Д - лимфоциты (малый и большой). Е - моноцит. Ж - тромбоциты
окрашенных по Романовскому-Гимзе, Райту и др.). Содержание в периферической крови взрослого человека эритроцитов у мужчин - 4,5- 5,7х1012/л (у женщин - 3,9-5х1012/л), лейкоцитов - 3,8-9,8х109/л (лимфоциты - 1,2-3,3х109/л, моноциты - 0,2-0,7х109/л, зернистые лейкоциты - 1,8-6,6х109/л), тромбоцитов - 190-405х109/л. В периферической крови циркулируют дефинитивные формы клеток, образование которых (кроветворение, или гемопоэз) происходит в красном костном мозге и органах лимфоидной системы (тимусе, селезёнке, лимфатических узлах и лимфоидных фолликулах). Из стволовой кроветворной клетки в красном костном мозге формируются эритроидные клетки (в кровь поступают эритроциты и ретикулоциты), миелоидные клетки (зернистые лейкоциты, в кровь поступают палочко- и сегментоядерные нейтрофильные лейкоциты, зрелые базофильные и эозинофильные лейкоциты), моноциты, кровяные пластинки и часть лимфоцитов, в органах лимфоидной системы - T- и В-лимфоциты.
Гемопоэз
Кроветворение - образование из стволовой кроветворной клетки клеток-предшественниц конкретных гемопоэзов, их пролиферация и дифференцировка, а также созревание клеточных элементов крови в условиях специфического микроокружения и под влиянием факто-
ров гемопоэза. В пренатальном периоде гемопоэз происходит в нескольких развивающихся органах (см. главу 20). Кроветворение после рождения, у детей, подростков и взрослого человека осуществляется в костном мозге плоских костей (череп, рёбра, грудина, позвонки, кости таза) и эпифизов трубчатых костей, а кроветворными органами для лимфоцитов являются селезёнка, тимус, лимфатические узлы, лимфоидные фолликулы в составе разных органов.
Зрелые клетки периферической крови развиваются из предшественников, созревающих в красном костном мозге. Унитарная теория кроветворения (рис. 24-2) предусматривает, что родоначальница всех клеточных элементов крови - стволовая кроветворная клетка. Её потомки - полипотентные клетки-предшественницы1 лимфоцитопоэза (CFU-Ly) и миелопоэза (CFU-GEMM). В результате деления CFU-Ly и CFU-GEMM их потомки остаются полипотентными или превращаются в коммитированные (предопределённые судьбой) унипотентные клетки-предшественницы, также способные делиться, но дифференцирующиеся (развивающиеся) только в одном направлении. Пролиферацию унипотентных клеток-предшественниц стимулируют колониестимулирующие факторы и интерлейкины (особенно интерлейкин-3).
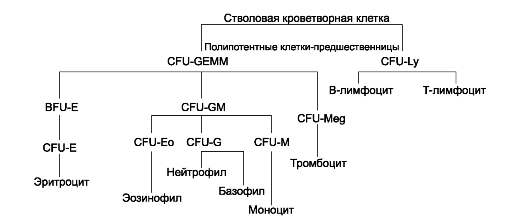 Рис. 24-2. Схема гемопоэза.; CFU-GEMM
- полипотентная клетка-предшественница миелопоэза; CFU-Ly -
полипотентная клетка-предшественница лимфоцитопоэза; CFU-GM -
полипотентная клетка-предшественница гранулоцитов и моноцитов; CFU-G -
полипотентная клетка-предшественница нейтрофилов и базофилов.
Унипотентные предшественники: BFU-E и CFU-E - эритроцитов; CFU-Eo -
эозинофилов; CFU-M - моноцитов; CFU-Meg - мегакариоцитов. CFU - Colony
Forming Unit - колониеобразующая единица (КОЕ), BFU - Burst Forming Unit
- взрывообразующая единица
Рис. 24-2. Схема гемопоэза.; CFU-GEMM
- полипотентная клетка-предшественница миелопоэза; CFU-Ly -
полипотентная клетка-предшественница лимфоцитопоэза; CFU-GM -
полипотентная клетка-предшественница гранулоцитов и моноцитов; CFU-G -
полипотентная клетка-предшественница нейтрофилов и базофилов.
Унипотентные предшественники: BFU-E и CFU-E - эритроцитов; CFU-Eo -
эозинофилов; CFU-M - моноцитов; CFU-Meg - мегакариоцитов. CFU - Colony
Forming Unit - колониеобразующая единица (КОЕ), BFU - Burst Forming Unit
- взрывообразующая единица
Эритропоэз. Начало эритроидного ряда - стволовая клетка эритропоэза, или взрывообразующая единица (BFU-E), из которой формируется унипотентный предшественник эритроцитов (CFU-E). Последний даёт начало проэритробласту. Дальнейшая дифференцировка приводит к увеличению содержания Hb и потере ядра. Из проэритробласта путём пролиферации и дифференцировки последовательно развиваются эритробласты: базофильный -» полихроматофильный -» оксифильный (нормобласт) и далее неделящиеся формы - ретикулоцит и эритроцит. От BFU-E до нормобласта - 12 клеточных поколений, а от CFU-E до позднего нормобласта - 6 или меньше клеточных делений. Длительность эритропоэза (от его стволовой клетки BFU-E до эритроцита) - 2 недели. Интенсивность эритропоэза контролирует эритропоэтин. Основной стимул для выработки эритропоэтина - уменьшение содержания кислорода в крови (рО2) - гипоксия (рис. 24-3). Гранулоцитопоэз (рис. 24-4). Гранулоциты образуются в костном мозге. Нейтрофилы и базофилы происходят из полипотентной клет-
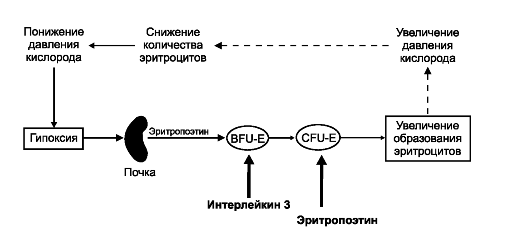 Рис. 24-3. Регуляция эритропоэза [11].
Пролиферацию взрывообразующей единицы эритропоэза (BFU-E) стимулирует
интерлейкин-3. Унипотентный предшественник эритроцитов CFU-E
чувствителен к эритропоэтину. Решающий стимул для образования
эритроцитов - гипоксия, запускающая синтез эритропоэтина в почке, а у
плода также в печени. Эритропоэтин выходит в кровь и поступает в костный
мозг, где стимулирует размножение и дифференцировку унипотентного
предшественника эритроцитов (CFU-E) и дифференцировку последующих клеток
эритроидного ряда. В результате количество эритроцитов в крови
увеличивается. Соответственно возрастает количество кислорода,
поступающего в почку, что тормозит образование эритропоэтина
Рис. 24-3. Регуляция эритропоэза [11].
Пролиферацию взрывообразующей единицы эритропоэза (BFU-E) стимулирует
интерлейкин-3. Унипотентный предшественник эритроцитов CFU-E
чувствителен к эритропоэтину. Решающий стимул для образования
эритроцитов - гипоксия, запускающая синтез эритропоэтина в почке, а у
плода также в печени. Эритропоэтин выходит в кровь и поступает в костный
мозг, где стимулирует размножение и дифференцировку унипотентного
предшественника эритроцитов (CFU-E) и дифференцировку последующих клеток
эритроидного ряда. В результате количество эритроцитов в крови
увеличивается. Соответственно возрастает количество кислорода,
поступающего в почку, что тормозит образование эритропоэтина
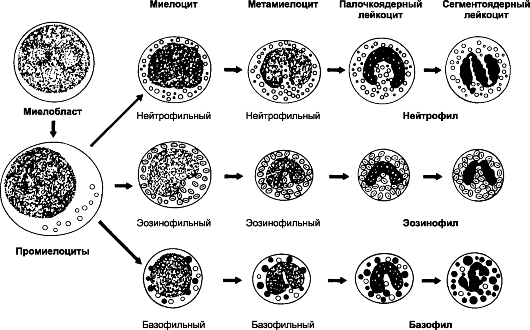 Рис. 24-4. Гранулоцитопоэз [11].
В ходе дифференцировки предшественников гранулоцитов выделяют:
миелобласт, промиелоцит, миелоцит, метамиелоцит, палочкоядерный и
сегментоядерный гранулоциты
Рис. 24-4. Гранулоцитопоэз [11].
В ходе дифференцировки предшественников гранулоцитов выделяют:
миелобласт, промиелоцит, миелоцит, метамиелоцит, палочкоядерный и
сегментоядерный гранулоциты
ки-предшественницы нейтрофилов и базофилов (CFU-G), а эозинофилы - из унипотентного предшественника эозинофилов (CFUEo). CFU-G и CFU-Eo - потомки полипотентной клетки-предшественницы гранулоцитов и моноцитов (CFU-GM). При развитии гранулоцитов можно выделить такие стадии: миелобласты→промиелоциты → миелоциты → метамиелоциты →палочкоядерные и сегментоядерные гранулоциты. Специфические гранулы появляются на стадии миелоцитов; с этого момента клетки называют в соответствии с типом образующихся из них зрелых гранулоцитов. Клеточные деления прекращаются на стадии метамиелоцита. Пролиферацию и дифференцировку клеток-предшественниц контролируют колониестимулирующие факторы (гранулоцитов и макрофагов - GM-CSF, гранулоцитов - G-CSF), интерлейкины 3 и 5 (предшественники эозинофилов).
• Моноцитопоэз. Моноциты и гранулоциты имеют общую клеткупредшественницу - колониеобразующую единицу гранулоцитов и моноцитов (CFU-GM), образующуюся из полипотентной клеткипредшественницы миелопоэза (CFU-GEMM). В развитии моноцитов выделяют две стадии - монобласт и промоноцит.
• Тромбоцитопоэз. Из мегакариобластов развиваются самые крупные (30-100 мкм) клетки костного мозга - мегакариоциты. При дифференцировке мегакариоцит увеличивается в размерах, его ядро становится дольчатым. Образуется развитая система демаркационных мембран, по которым происходит отделение («отшнуровка») тромбоцитов (рис. 24-5). Пролиферацию предшественников мегакариоцитов - мегакариобластов - стимулирует синтезируемый в печени тромбопоэтин.
• Лимфопоэз. Из стволовой кроветворной клетки (CFU-blast) происходит полипотентная клетка-предшественница лимфопоэза (CFULy), которая впоследствии даёт начало клеткам-предшественницам B-лимфопоэза, T-лимфопоэза и (частично) предшественницам NK- клеток. Ранние предшественники В-лимфоциты образуются в костном мозге, а Т-лимфоцитов - в тимусе. Дальнейшая дифференцировка включает в себя уровни про-B(T)-клеток, пре-B(T)-клеток, незрелых B(T)-клеток, зрелых («наивных») B(T)-клеток и (после контакта с Аг) - зрелых B(T)-клеток окончательных стадий дифференцировки. Продуцируемый клетками стромы костного мозга интерлейкин-7 способствует образованию Т- и В-лимфоцитов, воздействуя на их клетки-предшественницы. В отличие от других клеток крови, лимфоциты могут пролиферировать и вне костного мозга. Это происходит в тканях иммунной системы в ответ на стимуляцию.
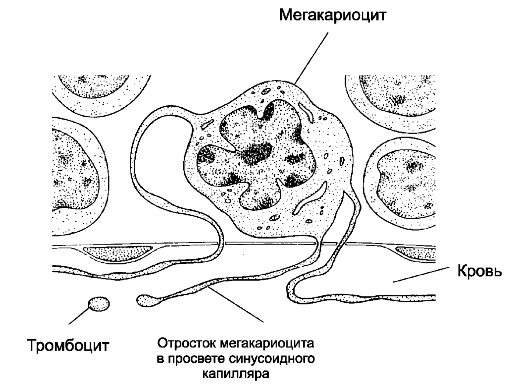 Рис. 24-5. Образование тромбоцитов [11].
Находящийся в костном мозге мегакариоцит образует протромбоцитарную
псевдоподию. Последняя проникает сквозь стенку капилляра в его просвет.
От псевдоподии отделяются тромбоциты и поступают в кровоток
Рис. 24-5. Образование тромбоцитов [11].
Находящийся в костном мозге мегакариоцит образует протромбоцитарную
псевдоподию. Последняя проникает сквозь стенку капилляра в его просвет.
От псевдоподии отделяются тромбоциты и поступают в кровоток
Эритроциты
Из красного костного мозга в кровь поступают преимущественно незрелые эритроциты - ретикулоциты. Они (в отличие от зрелых эритроцитов) содержат рибосомы, митохондрии и комплекс Гольджи. Окончательная дифференцировка в эритроциты происходит в течение 24-48 часов после выхода ретикулоцитов в кровоток. Количество поступающих в кровоток ретикулоцитов в норме равно количеству удаляемых эритроцитов. Ретикулоциты составляют около 1% всех циркулирующих красных клеток крови. Эритроциты (см. рис. 24- 1,А) - безъядерные клетки диаметром 7-8 мкм (нормоциты). Количество эритроцитов: у женщин - 3,9-4,9х1012/л, у мужчин - 4,0- 5,2х1012/л. Более высокое содержание эритроцитов у мужчин обусловлено стимулирующим эритропоэз влиянием андрогенов. Продолжительность жизни (время циркуляции в крови) - 100-120 дней.
Форма и размеры. Эритроцит в крови имеет форму двояковогнутого диска диаметром 7-8 мкм. Считают, что именно такая конфигурация создаёт наибольшую площадь поверхности по отношению к объёму, что обеспечивает максимальный газообмен между плазмой крови и эритроцитом. При любой другой форме эритроцитов говорят о пойкилоцитозе. Разброс размеров эритроцитов - анизоцитоз, клетки диаметром >9 мкм - макроциты, <6 мкм - микроциты. При ряде заболеваний крови изменяются размеры и форма эритроцитов, а также снижается их осмотическая резистентность, что приводит к разрушению (гемолизу) эритроцитов.
Возрастные изменения эритроцитов. При рождении и в первые часы жизни количество эритроцитов в крови повышено и составляет 6,0- 7,0х1012/л. У новорождённых наблюдают анизоцитоз с преобладанием макроцитов, а также повышенное содержание ретикулоцитов. В течение первых суток постнатального периода количество эритроцитов снижается, к 10-14 суткам достигает уровня взрослого и продолжает снижаться. Минимальный показатель наблюдается на 3-6-м месяцах жизни (физиологическая анемия), когда снижен уровень эритропоэтина. Это связано с уменьшением синтеза эритропоэтина в печени и началом его выработки в почке. На 3-4-м году жизни количество эритроцитов снижено (ниже, чем у взрослого), т.е. в 1 л их содержится менее 4,5х1012. Содержание эритроцитов достигает нормы взрослого в период полового созревания.
Плазмолемма и примембранный цитоскелет. Клеточная мембрана эритроцита довольно пластична, что позволяет клетке деформироваться и легко проходить по узким капиллярам (их диаметр 3-4 мкм). Главные трансмембранные белки эритроцита - белок полосы 3 и гликофорины. Белок полосы 3 (рис. 24-6) совместно с белками примембранного цитоскелета (спектрином, анкирином, фибриллярным актином, белком полосы 4.1) обеспечивают поддержание формы эритроцита в виде двояковогнутого диска. Гликофорины - мембранные гликопротеины, их полисахаридные цепи содержат Аг-детерминанты (например, агглютиногены А и В системы групп крови AB0).
Гемоглобин
Практически весь объём эритроцита заполняет дыхательный белок - гемоглобин (Hb). Молекула Hb - тетрамер, состоящий из 4 субъединиц - полипептидных цепей глобина (2 цепей α и 2 цепей β, γ, δ, ε, θ, ζ в разных комбинациях), каждая из которых ковалентно связана с одной молекулой гема. Гем построен из 4 молекул пиррола, образующих порфириновое кольцо, в центре которого находится атом железа (Fe2+). Основная функция Hb - перенос O2. Существует несколько типов Hb, образующихся на разных сроках развития организма, различающихся строением глобиновых цепей и сродством к
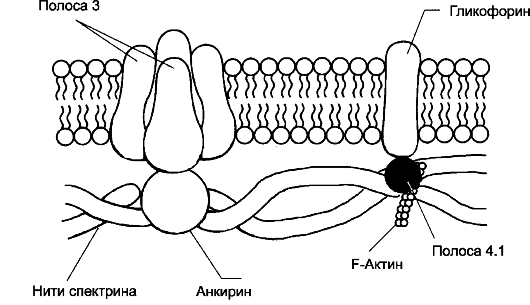 Рис. 24-6. Примембранный цитоскелет эритроцита [11].
Белок полосы 3 - главный трансмембранный белок. Спектрин-актиновый
комплекс формирует сетеподобную структуру примембранного цитоскелета. С
комплексом спектрин- актин, стабилизируя его, связан белок полосы 4.1.
Анкирин через белок полосы 3 соединяет спектрин-актиновый комплекс с
клеточной мембраной. Наименования полос белков характеризуют их
электрофоретическую подвижность
Рис. 24-6. Примембранный цитоскелет эритроцита [11].
Белок полосы 3 - главный трансмембранный белок. Спектрин-актиновый
комплекс формирует сетеподобную структуру примембранного цитоскелета. С
комплексом спектрин- актин, стабилизируя его, связан белок полосы 4.1.
Анкирин через белок полосы 3 соединяет спектрин-актиновый комплекс с
клеточной мембраной. Наименования полос белков характеризуют их
электрофоретическую подвижность
кислороду. Эмбриональные Hb (ζ- и ε-цепи) появляются у 19-днев- ного эмбриона, присутствуют в эритроидных клетках в первые 3- 6 мес беременности. Фетальный Hb (HbF - α2γ2) появляется на 8- 36 нед беременности и составляет 90-95% всего Hb плода. После рождения его количество постепенно снижается и к 8 мес составляет 1%. Дефинитивные Hb - основные Hb эритроцитов взрослого человека (96-98% - HbA (A1,) - α2β2, 1,5-3% - HbA2 - α2δ2). Известно более 1000 мутаций разных глобинов, значительно изменяющих свойства Hb, в первую очередь - способность транспортировать O2.
Формы гемоглобина. В эритроцитах Hb находится в восстановленной (HbH) и/или окисленной (HbO2) формах, а также в виде гликозилированного Hb. В ряде случае возможно присутствие карбоксигемоглобина и метгемоглобина.
• Оксигемоглобин. В лёгких при повышенном pO2 Hb связывает (ассоциирует) O2, образуя оксигемоглобин (HbO2), в этой форме HbO2 переносит O2 от лёгких к тканям, где O2 легко освобождается (диссоциирует), а HbO2 становится дезоксигенированным Hb (обозна-
чают как HbH). Для ассоциации и диссоциации O2 необходимо, чтобы атом железа гема был в восстановленном состоянии (Fe2+). При включении в гем трёхвалентного железа (Fe3+) образуется метгемоглобин - очень плохой переносчик O2.
• Метгемоглобин (MetHb) - Hb, содержащий Fe гема в трёхвалент- ной форме (Fe3+); не переносит О2; прочно связывает O2, так что диссоциация последнего затруднена. Это приводит к метгемоглобинемии и неизбежным нарушениям газообмена. Образование MetHb может быть наследственным или приобретённым. В последнем случае это результат воздействия на эритроциты сильных окислителей. К ним относят нитраты и неорганические нитриты, сульфаниламиды и местные анестетики (например, лидокаин).
• Карбоксигемоглобин - плохой переносчик кислорода. Hb легче (примерно в 200 раз), чем с O2, связывается с монооксидом углерода СО (угарный газ), образуя карбоксигемоглобин (O2 замещён CO).
• Гликозилированный Hb (HbA1(;) - HbA (A1), модифицированный ковалентным присоединением к нему глюкозы (норма HbA1C 5,8- 6,2%). К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества HbA1C. Этот Hb имеет худшее сродство к кислороду, чем обычный Hb.
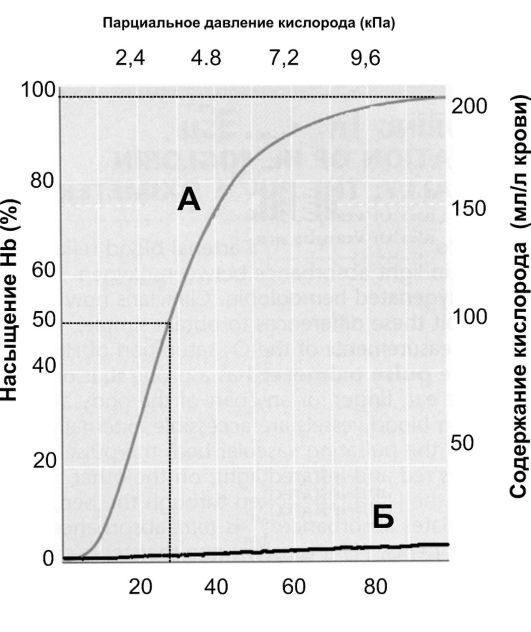
ТРАНСПОРТ КИСЛОРОДА. Кровь ежедневно переносит из лёг- ких в ткани около 600 л О2. Основной объём О2 транспортирует HbO2 (O2 обратимо ассоциирован с Fe2+ гема, это так называемый химически связанный O2 (неверный по существу, но - к сожалению - устоявшийся термин)). Незначительная часть O2 растворена в крови (физически растворённый O2). Содержание O2 в крови в зависимости от парциального давления O2 (Po2) представлено на рис. 24-10.
• Физически растворённый в крови газ. Согласно закону Генри, количество растворённого в крови O2 (любого газа) пропорционально Po2 (парциальному давлению любого газа) и коэффициенту растворимости конкретного газа. Физическая растворимость O2 в крови примерно в 20 раз меньше, чем растворимость СО2, но для обоих газов незначительна. В то же время физически растворённый в крови газ - необходимый этап транспорта любого газа (например, при перемещении O2 в эритроцит из полости альвеол).
• Кислородная ёмкость крови - максимальное возможное количество связанного с Hb О2 - теоретически составляет 0,062 ммоль О2 (1,39 мл О2) на 1 г Hb (реальное значение несколько меньше - 1,34 мл О2 на 1 г Hb). Измеренные же значения составляют для мужчин 9,4 ммоль/л (210 мл О2/л), для женщин - 8,7 ммоль/л (195 мл О2/л).
• Насыщение (сатурация, S) Hb О2 (So2) зависит от парциального давления кислорода (Po2) и фактически отражает содержание окси-
 Парциальное давление кислорода (мм рт. ст)
Парциальное давление кислорода (мм рт. ст)
Рис. 24-7. Содержание кислорода в крови [23]. А - ассоциированный с Hb O2. Б - физически растворённый в крови O2. Обратите внимание, что кривая А (в отличие от кривой Б) не имеет линейного характера, это так называемая S-образная (сигмовидная) кривая; такая форма кривой отражает то обстоятельство, что 4 субъединицы Hb связываются с O2 кооперативно. Это обстоятельство имеет важное физиологическое значение: при конкретных и разных (!) значениях Po2 в артериальной и в смешанной (венозной) создаются наиболее благоприятные условия для ассоциации Hb и O2 в капиллярах лёгкого и для диссоциации Hb и O2 в тканевых капиллярах. В то же время в плазме крови физически растворена только небольшая часть О2 (максимально 6%); физическую растворимость О2 описывает закон Генри: с увеличением Po2 содержание О2 линейно возрастает
• генированного Hb (HbО2, см. кривую А на рис. 24-7). So2 может принимать значения от 0 (HbО2 нет) до 1 (нет HbH). При половинном насыщении (S0.5) Po2 равно 3,6 кПа (27 мм рт.ст.), при S0 75 - 5,4 кПа, при S0.98 1 3,3 кПа. Другими словами (см. кривую А на рис. 24-7), зависимость между So2 и Po2 не является линейной (характерная S-образная кривая), что благоприятствует как связыванию О2 в лёгких (артериальная кровь) и транспорту О2, так и освобождению О2 в кровеносных капиллярах органов и тканей, так как насыщение артериальной крови кислородом (Sao2) составляет примерно 97,5%, а венозной крови (SvO2) - 75%. Аффинитет Hb к О2, т.е. насыщение Hb О2 при конкретном Po2 изменяет ряд факторов (температура, pH и Pco2, 2,3-бифосфогли- церат; рис. 24-8).
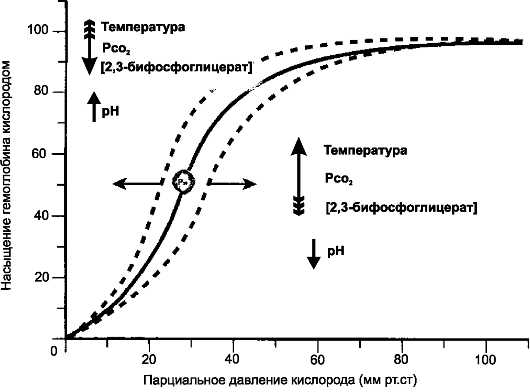 Рис. 24-8. Диссоциация оксигемоглобина в крови в зависимости от Po2 [4]. В зависимости от изменений (указаны стрелками) температуры, pH, Pco2 крови и концентрации 2,3-бифосфоглицерата в эритроцитах кривая насыщения гемоглобина O2
сдвигается вправо (что означает меньшее насыщение кислородом) или влево
(что означает большее насыщение кислородом). На кривой кружочком
отмечена позиция, соответствующая половинному насыщению (S05)
Рис. 24-8. Диссоциация оксигемоглобина в крови в зависимости от Po2 [4]. В зависимости от изменений (указаны стрелками) температуры, pH, Pco2 крови и концентрации 2,3-бифосфоглицерата в эритроцитах кривая насыщения гемоглобина O2
сдвигается вправо (что означает меньшее насыщение кислородом) или влево
(что означает большее насыщение кислородом). На кривой кружочком
отмечена позиция, соответствующая половинному насыщению (S05)
• pH, Pco2 и эффект Бора. Особенно существенно влияние pH: уменьшение водородного показателя (сдвиг в кислую сторону - в зону ацидоза) сдвигает кривую диссоциации Hb вправо (что способствует диссоциации О2), тогда как увеличение pH (сдвиг в щелочную сторону - в зону алкалоза) сдвигает кривую диссоциации Hb влево (что увеличивает аффинитет О2). Эффекты: же Pco2 на кривую диссоциации оксигемоглобина реализуются преимущественно через изменение значений водородного показателя: при поступлении CO2 в кровь происходит уменьшение pH, что способствует диссоциации О2 и его диффузии из крови в ткани. Напротив, в лёгких CO2 диффундирует из крови в альвеолы, что приводит к увеличению pH, т.е. способствует связыванию О2 с Hb. Этот влияние CO2 и H+ на аффинитет О2 к Hb известно как эффект Кристиана Бора (отец великого физика Нильса Бора). Таким образом, эффект Бора обусловлен преимущественно изменением pH при увеличении содержания CO2 и лишь частично - связыванием CO2 с Hb (см. далее). Физиологическое следствие эффекта Бора - облегчение диффузии O2 из крови в ткани и связывание O2 артериальной кровью в лёгких.
• Температура. Значение влияния температуры на аффинитет Hb к О2 у гомойотермныгх животных теоретически отсутствует, но может оказаться важным при ряде ситуаций. Так, при интенсивной мышечной нагрузке температура тела увеличивается, что приводит к сдвигу кривой диссоциации вправо (увеличивается поступление О2 в ткани). При понижении температуры (особенно пальцев, губ, ушной раковины) кривая диссоциации сдвигается влево, т.е. увеличивается аффинитет О2; следовательно, увеличения поступления О2, в ткани не происходит.
• 2,3-Бифосфоглицерат (БФГ) - промежуточный продукт гликолиза - содержится в эритроцитах примерно в той же молярной концентрации, что и Hb. БФГ связывается с Hb (в основном за счёт взаимодействия с β-субъединицей, т.е. с дефинитивнытми Hb, но не с фетальным Hb, в составе которого нет β-субъединицы). Связывание БФГ с Hb сдвигает кривую диссоциации Hb вправо (см. рис. 24-12), что способствует диссоциации О2 при умеренных значениях Po2 (например, в тканевых капиллярах), но практически не влияет на кривую диссоциации при высоких значениях Po2 (в капиллярах лёгкого). Существенно, что при усилении гликолиза (анаэробного окисления) концентрация БФГ в эритроцитах увеличивается, что является механизмом приспособления организма к гипоксии, наблюдающейся при заболеваниях лёгких, анемиях, подъёме на высоту. Так, в период адаптации к высокогорью (более 4 км над уровнем моря) концентрация БФГ уже через 2 дня возра-
стает почти в 2 раза (от 4,5 до 7,0 мМ). Понятно, что это снижает сродство Hb к О2 и увеличивает количество О2, освобождаемого из капилляров в ткани.
ТРАНСПОРТ CO2. Как и О2, СО2 транспортируется кровью как в физически растворённом состоянии, так и в химически связанном (в составе бикарбонатов и в соединении с белками, т.е. в форме карбаматов и в том числе в связи с Hb - карбгемоглобин). Во всех 3-х состояниях (растворённое, бикарбонат, карбаматы) СО2 присутствует и в эритроцитах (89%), и в плазме крови (11%). При химическом связывании СО2 образуется значительное количество протонов (H+).
• Примерно 2/3 СО2 (68%, в том числе 63% в эритроцитах) транспортируется кровью в виде бикарбоната (НСО3-). Пятую часть СО2 (22%, в том числе в виде карбгемоглобина - 21%) переносят карбаматы (СО2 обратимо присоединён к неионизированным концевым α-аминогруппам белков, образуя группировку R-NH-СОО^). 10% СО2 находится в растворённом состоянии (поровну в плазме и в эритроцитах). Крайне существенно то обстоятельство, что в реакциях химического связывания СО2 образуются ионы Н+:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3- R-NH2 + СО2 ↔ R-NH-CОО- + Н+ Из обоих равновесных реакций следует, что химическое связывание СО2 идёт с образованием ионов Н+. Таким образом, для химического связывания СО2 необходимо нейтрализовать Н+. Эту задачу решает гемоглобиновая буферная система.
• Гемоглобиновая буферная система (связывание ионов Н+) существенна для транспорта CO2 кровью (рис. 24-9, рис. 24-10).
• В капиллярах большого круга кровообращения HbO2 отдаёт кислород, а в кровь поступает CO2. В эритроцитах под влиянием карбоангидразы CO2 взаимодействует с H2O, образуется угольная кислота (H2CO3), диссоциирующая на HCO3- и H+. Ион H+ связывается с Hb (образуется восстановленный Hb - HHb), а HCO3- из эритроцитов выходит в плазму крови; взамен в эритроциты поступает эквивалентное количество Cl-. Одновременно часть CO2 связывается с Hb (образуется карбгемоглобин).
• В капиллярах лёгких (т.е. в условиях низкого pCO2 и высокого pО2) Hb присоединяет O2 и образуется оксигемоглобин (HbO2). В то же время в результате разрыва карбаминовых связей высвобождается CO2. При этом HCO3- из плазмы крови поступает в эритроциты (в обмен на ионы Cl-) и взаимодействует с H+, отщепившимся от Hb в момент его оксигенации. Образующаяся угольная кислота (H2CO3) под влиянием карбоангидразы расщепляется на CO2 и H2O. CO2 диффундирует в альвеолы и выводится из организма.
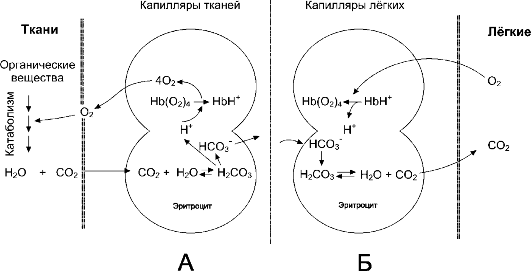 Рис. 24-9. ПЕРЕНОС О2 И СО2 С КРОВЬЮ [9]. А. Влияние СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора). Б. Оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2
Рис. 24-9. ПЕРЕНОС О2 И СО2 С КРОВЬЮ [9]. А. Влияние СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора). Б. Оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2
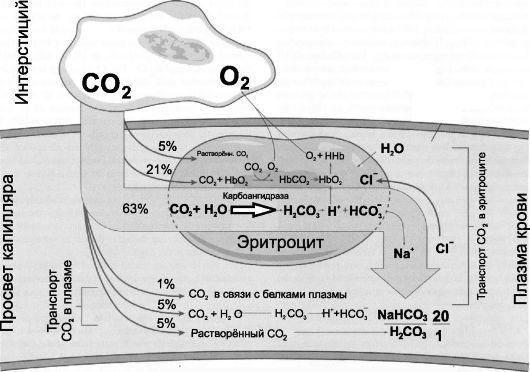 Рис. 24-10. Механизмы транспорта СО2 с кровью [4]
Рис. 24-10. Механизмы транспорта СО2 с кровью [4]
• Кривая диссоциации CO2 описывает связь между содержанием в крови CO2 и pCO2. В отличие от кривой диссоциации Hb и О2 (см. рис. 24-7), кривая диссоциации CO2 при физиологических значениях pCO2 (кровь артериальная - 40 мм рт.ст., венозная - 46 мм рт.ст.) имеет линейный характер. Более того, при любом значении pCO2 содержание CO2 в крови обратно пропорционально pО2 (насыщению Hb О2). Эта обратная зависимость между содержанием CO2 и парциальным давлением кислорода pО2) известна как эффект Холдейна. Как и эффект Бора, эффект Холдейна имеет важное физиологическое значение. Так, в капиллярах большого круга кровообращения по мере диффузии O2 из капилляров возрастает способность крови поглощать CO2, в результате CO2 поступает в кровь. Напротив, в капиллярах лёгкого при оксигенация крови её способность поглощать CO2 уменьшается, в результате CO2 «сбрасывается» в альвеолы.
МЕТАБОЛИЗМ ГЕМОГЛОБИНА. Удаление эритроцитов из кровотока происходит трояко: 1) путём фагоцитоза, 2) в результате гемолиза и 3) при тромбообразовании.
• Распад гемоглобина. При любом варианте разрушения эритроцитов Hb распадается на гем и глобины (рис. 24-11). Глобины, как и другие белки, расщепляются до аминокислот, а при разрушении гема освобождаются ионы железа, оксид углерода (СО) и протопорфирин (вердоглобин, из которого образуется биливердин, восстанавливающийся в билирубин). Билирубин в комплексе с альбумином транспортируется в печень, откуда в составе жёлчи поступает в кишечник, где происходит его превращение в уробилиногены. Превращение гема в билирубин можно наблюдать в гематоме: обусловленный гемом пурпурный цвет медленно переходит через зелё- ные цвета вердоглобина в жёлтый цвет билирубина.
• Гематины. При некоторых условиях гидролиз Hb приводит к образованию гематинов (гемомеланин, или малярийный пигмент и солянокислый гематин).
МЕТАБОЛИЗМ ЖЕЛЕЗА. Железо участвует в функционировании всех систем организма. Суточная потребность в железе составляет для мужчин 10 мг, для женщин 18 мг (в период беременности и лактации - 38 и 33 мг соответственно). Общее количество железа (преимущественно в составе гема Hb) в организме - около 3,5 г (у женщин - 3,0 г). Железо абсолютно необходимо для эритропоэза. Различают клеточное железо, внеклеточное железо и железо запасов (рис. 24-12).
Основная масса железа организма входит в состав гема (Hb, миоглобин, цитохромы). Часть железа запасается в виде ферритина (в гепатоцитах, макрофагах костного мозга и селезёнки) и гемосидерина
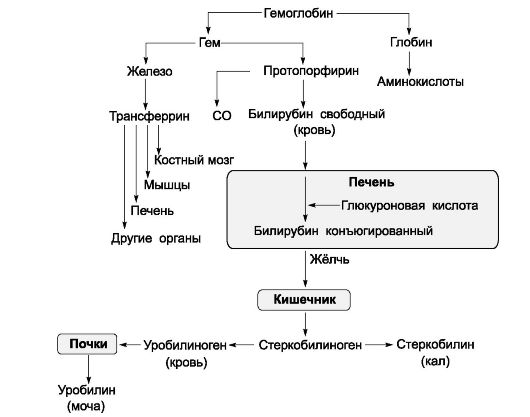 Рис. 24-11. Обмен гемоглобина и билирубина [16]
Рис. 24-11. Обмен гемоглобина и билирубина [16]
• (в клетках фон Купффера печени и макрофагах костного мозга). Некоторое количество находится в лабильном состоянии в связи с трансферрином. Железо, необходимое для синтеза гема, извлекается преимущественно из разрушенных эритроцитов. Источники железа - поступление с пищей и разрушенные эритроциты. Железо, поступающее с пищей, всасывается в кишечнике в двенадцатиперстной кишке и начальном отделе тощей кишки. Железо всасывается преимущественно в двухвалентной форме (Fe2+). Всасывание Fe2+ в ЖКТ ограничено и контролируется его концентрацией в плазме крови (соотношением белков - апоферритина (свободного от железа) и ферритина). Усиливают всасывание аскорбиновая, янтарная, пировиноградная кислоты, сорбит, алкоголь; подавляют - оксалаты, препараты кальция и содержащие кальций продукты (например, творог, молоко и т.д.). В среднем в
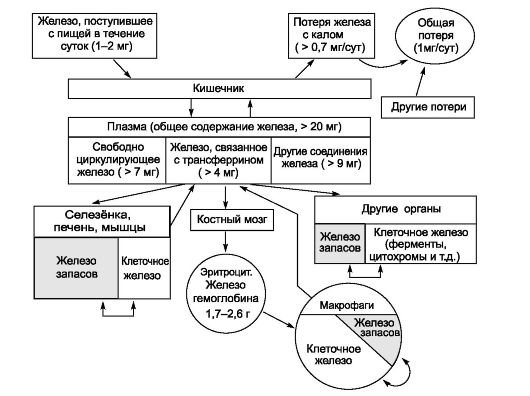 Рис. 24-12. Схема обмена железа (Fe) в организме здорового мужчины с массой тела 70 кг [16]
Рис. 24-12. Схема обмена железа (Fe) в организме здорового мужчины с массой тела 70 кг [16]
сутки всасывается 10 мг железа. В ЖКТ железо накапливается в эпителиальных клетках слизистой оболочки тонкого кишечника. Отсюда трансферрин переносит железо в красный костный мозг (для эритропоэза, это всего 5% всосавшегося Fe2+), в печень, селе- зёнку, мышцы и другие органы (для запасания).
• Железо погибших эритроцитов при помощи трансферрина поступает в эритробласты красного костного мозга (около 90%), часть этого железа (10%) запасается в составе ферритина и гемосидерина.
• Физиологическая потеря железа происходит с калом. Незначительная часть железа теряется с потом и клетками эпидермиса. Общая потеря железа - 1 мг/сут. Также физиологическими считают потери железа с менструальной кровью и с грудным молоком.
• Дефицит железа наступает, когда его потери превышают 2 мг/сут. При дефиците железа развивается самая распространённая анемия -
железодефицитная, т.е. анемия вследствие абсолютного снижения ресурсов железа в организме.
Эритроцитарные антигены и группы крови
В составе гликопротеинов и гликолипидов на поверхности эритроцитов существуют сотни антигенньгх детерминант, или антигенов (Аг), многие из которых определяют групповую принадлежность крови (группы крови). Эти Аг потенциально могут взаимодействовать с соответствующими им антителами (АТ), если бы такие АТ содержались в сыворотке крови. Однако такое взаимодействие в крови конкретного человека не происходит, так как иммунная система уже удалила клоны секретирующих эти АТ плазматических клеток (см. подробнее в главе 29). Если же соответствующие АТ попадают в кровь (например, при переливании чужой крови или её компонентов), то развивается реакция взаимодействия между эритроцитарными Аг и сывороточными АТ с зачастую катастрофическими последствиями (несовместимость по группам крови). В частности, при этом происходит агглютинация (склеивание) эритрощитов и их последующий гемолиз. Именно по этим причинам столь важно определение как групповой принадлежности переливаемой крови (донорская кровь), так и крови того лица, кому переливают кровь (реципиент), а также неукоснительное выполнение всех правил и процедур при переливании крови или её компонентов (в РФ порядок переливания крови регламентирован приказом МЗ РФ и приложенной к приказу инструкцией по применению компонентов крови).
Из сотен эритроцитарных Аг Международное общество переливания крови (The International Society of Blood Transfusion - ISBT) к системам групп крови по состоянию на 2003 г. отнесло следующие (в алфавитном порядке): ABO [в англоязынной литературе принято наименование ABO (буква «O»), в русскоязычной - AB0 (цифра «0»)], Cartwright, Chido/ Rodgers, Colton, Cost, Cromer, Diego, Dombrock, Duffy, Er, Gerbich, GIL, GLOB (Globoside), Hh, Ii, Indian, JMH (John Milton Hagen), Kell, Kidd, Knops, Kx, Landsteiner-Wiener, Lewis, Lutheran, MNS, OK, P, Raph, Rh, Scianna, Wright, Xg, Yt. В практике переливания крови (гемотрансфузия) и её компонентов обязательная проверка на совместимость по Аг систем AB0 (4 группы) и Rh (2 группы), итого по 8 группам. Остальные системы (они известны как редкие) к несовместимости по группам крови приводят значительно реже, но также должны учитываться при гемотрансфузиях и при тестировании возможности развития гемолитической болезни новорождённого (см. далее «Rh-система»).
АБ0-СИСТЕМЛ
Эритроцитарные Аг системы AB0 - A, B и 0 - относятся к классу гликофоринов. Их полисахаридные цепи содержат Аг-детерминан-
ты - агглютиногены А и В. Формирование агглютиногенов А и В происходит под влиянием гликозилтрансфераз, кодируемых аллелями гена АВ0. Этот ген кодирует три полипептида (А, В, 0), два из них (гликозилтрансферазы А и В) модифицируют полисахаридные цепи гликофоринов, полипептид 0 функционально не активен. В результате поверхность эритроцитов разных лиц может содержать либо агглютиноген А, либо агглютиноген В, либо оба агглютиногена (А и В), либо не содержать ни агглютиногена А, ни агглютиногена В. В соответствии с типом экспрессии на поверхности эритроцитов агглютиногенов А и В в системе AB0 выделено 4 группы крови, обозначаемых римскими цифрами I, II, III и IV. Эритроциты группы крови I не содержат ни агглютиногена А, ни агглютиногена В, её сокращён- ное наименование - 0(I). Эритроциты группы крови IV содержат оба агглютиногена - AB(IV), группы II - A(II), группы III - B(III). Первые три группы крови обнаружил в 1900 г. Карл Ландштайнер, а четвёртую группу немного позже Декастрелло и Штурли.
Агглютинины. В плазме крови к агглютиногенам А и В могут содержаться АТ (соответственно α- и β-агглютинины). Плазма крови группы 0(I) содержит α- и β-агглютинины; группы A(II) - β-агглютинины, B(III) - α-агглютинины, плазма крови группы AB(IV) агглютининов не содержит.
Таким образом, в крови конкретного человека АТ к эритроцитарным Аг системы AB0 одновременно не присутствуют (табл. 24-1), но при переливании крови от донора с одной группой к реципиенту с другой группой может возникнуть ситуация, когда в крови реципиента одновременно будут находиться и Аг, и АТ именно к этому Аг, т.е. возникнет ситуация несовместимости. Кроме того, такая несовместимость может возникнуть и по другим системам групп крови. Именно поэтому стало правилом, что переливать можно только одногруппную кровь. Если точнее, то переливают не цельную кровь, а компоненты, так как «показаний к переливанию цельной консервированной донорской крови нет, за исключением случаев острых мас-
Таблица 24-1. Содержание в крови разных групп (система AB0) агглютиногенов (Аг) и агглютининов (АТ)
Антигены | Антитела | |
0(1) | нет | α, β |
A(II) | A | β |
B(III) | B | α |
AB(IV) | A, B | нет |
сивных кровопотерь, когда отсутствуют кровезаменители или свежезамороженная плазма, эритроцитная масса или их взвесь» (из приказа МЗ РФ). И именно поэтому теоретическое представление об «универсальном доноре» с кровью группы 0(I) на практике оставлено. Rh-СИСТЕМА
Каждый человек может быть Rh-положительным либо Rh-отрица- тельным, что определяется его генотипом и экспрессируемыми Аг Rh-системы.
Антигены. 6 аллелей 3 генов системы Rh кодируют Аг: c, C, d, D, e, E. С учётом крайне редко встречающихся Аг системы Rh возможны 47 фенотипов этой системы.
Антитела системы Rh относятся к классу IgG (не обнаружены АТ только к Аг d).
Rh-положительные и Rh-отрицательные лица. Если генотип конкретного человека кодирует хотя бы один из Аг C, D и E, такие лица резус-положительны (на практике резус-положительными считают лиц, имеющих на поверхности эритроцитов Аг D - сильный иммуноген). Таким образом, АТ образуются не только против «сильного» Аг D, но могу образоваться и против «слабых» Аг c, C, e и E. Резус-отрицательны только лица фенотипа cde/cde (rr). Резус-конфликт (несовместимость) возникает при переливании Rh-положительной крови донора Rh-отрицательному реципиенту либо у плода при повторной беременности Rh-отрицательной матери Rh-положительным плодом (первая беременность и/или роды Rh-положительным плодом). В этом случае развивается гемолитическая болезнь новорождённого.
Лейкоциты
Лейкоциты - ядерные клетки шаровидной формы (см. рис 24-1). В цитоплазме лейкоцитов находятся гранулы. В зависимости от типа гранул, лейкоциты подразделяют на гранулоциты (зернистые) и агранулоциты (незернистые).
• Гранулоциты (нейтрофилы, эозинофилы, базофилы) содержат специфические (вторичные) и азурофильные (лизосомы) гранулы.
• Агранулоциты (моноциты, лимфоциты) содержат только азурофильные гранулы.
• Ядро. Гранулоциты имеют дольчатое ядро разнообразной формы, отсюда их коллективное название - полиморфноядерные лейкоциты. Лимфоциты и моноциты имеют недольчатое ядро, это - мононуклеарные лейкоциты.
• Подвижность. Лейкоциты используют кровоток как средство пассивного транспорта. Лейкоциты имеют сократительные белки (актин, миозин) и способны к активному перемещению, что позволя-
ет им выходить из кровеносных сосудов, проникая между эндотелиальными клетками (диапедез) и разрушая секретируемыми ими ферментами базальную мембрану эндотелия. Направленную миграцию лейкоцитов (хемокинез, хемотаксис) контролируют различные вещества (в том числе хемоаттрактанты).
• Функции. Лейкоциты участвуют в защитных реакциях, уничтожая микроорганизмы, захватывая инородные частицы и продукты распада тканей, осуществляя реакции гуморального и клеточного иммунитета.
Число лейкоцитов в крови. В 1 л крови взрослого здорового человека содержится 3,8-9,8х109 лейкоцитов. Изменяющаяся потребность в отдельных типах лейкоцитов отражается в увеличении (лейкоцитоз) или уменьшении (лейкопения) количества лейкоцитов в единице ОЦК. Например, при острых бактериальных инфекциях в крови увеличивается число нейтрофилов (нейтрофильный лейкоцитоз). При вирусных и хронических инфекциях происходит увеличение числа лимфоцитов (лимфоцитоз), при паразитарных инфекциях наблюдается эозинофилия.
• Физиологический лейкоцитоз - состояние, характеризующееся увеличением числа лейкоцитов в единице объёма крови выше нормы (>9х109/л). Среди физиологических лейкоцитозов выделяют функциональные и защитно-приспособительные.
-Ф- Функциональный лейкоцитоз обусловлен выполнением организмом определённой функции (например, лейкоцитоз во время беременности, увеличение числа лейкоцитов в крови после приёма пищи или после длительной физической работы).
❖ Защитно-приспособительный лейкоцитоз развивается при воспалительных процессах, повреждении клеток и тканей (например, после инфарктов или инсультов, травмы мягких тканей), стресс-реакции.
• Лейкопения - состояние, характеризующиеся уменьшением количества лейкоцитов в единице объёма крови ниже нормы (<4х109/л). Различают первичные (врождённые или наследственные) и вторичные (приобретённые, вследствие радиационного поражения, отравлений, применений ЛС) лейкопении.
Лейкоцитарная формула - процентное содержание в периферической крови отдельных форм лейкоцитов. Подсчёт лейкоцитарной формулы крайне важен для клинической практики, поскольку именно лейкоциты раньше и быстрее других элементов крови реагируют на внешние и внутренние изменения (в частности на воспаление).
• Относительные и абсолютные изменения в лейкоцитарной формуле. При изменениях относительного (процентного) содержания того
или иного вида лейкоцитов в лейкоцитарной формуле говорят либо об относительной нейтропении, эозинопении, лимфопении, моноцитопении (при уменьшении процентного содержания лейкоцитов соответствующего вида), либо об относительной нейтрофилии, эозонофилии, относительном моноцитозе, лимфоцитозе (при увеличении их относительного содержания).
• Изменения абсолютного содержания лейкоцитов в единице объёма крови обозначают как абсолютная нейтропения, эозинопения, лимфопения, моноцитопения (при уменьшении их абсолютного числа в единице объёма крови) или абсолютная нейтрофилия, эозинофилия, абсолютный моноцитоз или лимфоцитоз (в случае увеличения количества соответствующих разновидностей лейкоцитов).
• При характеристике изменений состава лейкоцитов необходимо оценивать как относительное, так и (обязательно!) абсолютное их содержание. Это определяется тем, что именно абсолютные величины отражают истинное содержание тех или иных видов лейкоцитов в крови, а относительные характеризуют только соотношение различных клеток между собой в единице объёма крови.
• Во многих случаях направленность относительных и абсолютных изменений совпадает. Часто встречается, например, относительная и абсолютная нейтрофилия или нейтропения.
• Отклонение относительного (процентного) содержания клеток в единице объёма крови не всегда отражает изменение их истинного, абсолютного количества. Так, относительная нейтрофилия может сочетаться с абсолютной нейтропенией (подобная ситуация возникает, если относительная нейтрофилия наблюдается в условиях значительной лейкопении: например, содержание нейтрофилов равно 80%, а общее число лейкоцитов составляет лишь 1,0х109/л).
• Для определения абсолютного количества того или иного вида лейкоцитов в крови необходимо рассчитать эту величину исходя из знания общего числа лейкоцитов и процентного содержания соответствующих клеток (в приведённом примере 80% от 1,0х109/л составит 0,8х109/л. Это более чем в два раза меньше 2,0х109/л - нижней границы нормального абсолютного содержания нейтрофилов).
Возрастные изменения клеток крови
• Эритроциты. При рождении и в первые часы жизни количество эритроцитов в крови повышено и составляет 6,0-7,0х1012/л. У новорож- дённых наблюдают анизоцитоз с преобладанием макроцитов, а также повышенное содержание ретикулоцитов. В течение первых суток постнатального периода количество эритроцитов снижается, к 10- 14 суткам достигает уровня взрослого и продолжает снижаться. Минимальный показатель наблюдается на 3-6-м месяцах жизни (фи-
зиологическая анемия), когда снижен уровень эритропоэтина. Это связано с уменьшением синтеза эритропоэтина в печени и началом его выработки в почке. На 3-4-м году жизни количество эритроцитов снижено (ниже, чем у взрослого), т.е. в 1 л их содержится менее 4,5х1012. Содержание эритроцитов достигает нормы взрослого в период полового созревания.
• Лейкоциты. Количество лейкоцитов у новорождённых повышено и составляет 10-30х109/л. Число нейтрофилов составляет 60,5%, эозинофилов - 2%, базофилов - 0,2%, моноцитов - 1,8%, лимфоцитов - 24%. В течение первых двух недель количество лейкоцитов снижается до 9-15х109/л, к 4 годам уменьшается до 7-13х109/л, а к 14 годам достигает уровня, характерного для взрослого. Соотношение нейтрофилов и лимфоцитов меняется, что обусловливает возникновение так называемых физиологических перекрестов.
❖ Первый перекрест. У новорождённого соотношение содержания этих клеток такое же, как у взрослого. В последующем содержание нейтрофилов падает, а лимфоцитов возрастает, так что на 3- 4 сутки их количество уравнивается. В дальнейшем количество нейтрофилов продолжает снижаться и к 1-2 годам достигает 25%. В этом же возрасте количество лимфоцитов составляет 65%.
❖ Второй перекрест. В течение следующих лет число нейтрофилов постепенно повышается, а лимфоцитов - понижается, так что у четырёхлетних детей эти показатели снова уравниваются и составляют по 35% общего количества лейкоцитов. Количество нейтрофилов продолжает повышаться, а лимфоцитов - снижаться, и к 14 годам эти показатели соответствуют таковым у взрослого.
Продолжительность жизни лейкоцитов
• Гранулоциты живут в циркулирующей крови 4-5 часов, а в тканях - 4-5 дней. В случаях серьёзной тканевой инфекции продолжительность жизни гранулоцитов укорачивается до нескольких часов, поскольку гранулоциты очень быстро поступают в очаг инфекции, выполняют свои функции и разрушаются.
• Моноциты через 10-12 часов пребывания в кровотоке поступают в ткани. Попав в ткани, они увеличиваются в размерах и становятся тканевыми макрофагами. В этом виде они могут жить месяцами, до тех пор, пока не разрушатся, выполняя функцию фагоцитоза.
• Лимфоциты поступают в систему кровообращения постоянно в процессе дренирования лимфы из лимфатических узлов. Несколько часов спустя они поступают обратно в ткани посредством диапедеза и затем снова и снова возвращаются с лимфой в кровь. Таким образом, осуществляется постоянная циркуляция лимфоцитов через ткань. Продолжительность жизни лимфоцитов составляет ме-
сяцы и даже годы в зависимости от потребностей организма в этих клетках.
МИКРОФАГИ И МАКРОФАГИ. Основная функция нейтрофилов и моноцитов заключается в фагоцитозе и последующем внутриклеточном разрушении бактерий, вирусов, повреждённых и закончивших жизненный цикл клеток, чужеродных агентов. Нейтрофилы (и в некоторой степени эозинофилы) - зрелые клетки, фагоцитирующие различный материал (другое название фагоцитирующих нейтрофилов - микрофаги). Моноциты крови - незрелые клетки. Только после попадания в ткани моноциты созревают в тканевые макрофаги и приобретают способность бороться с болезнетворными агентами. Нейтрофилы и макрофаги перемещаются в тканях посредством амебоидных движений, стимулируемых веществами, образуемыми в вос- палённой области. Это притяжение нейтрофилов и макрофагов к области воспаления называется хемотаксисом.
Нейтрофилы
Нейтрофилы - наиболее многочисленный тип лейкоцитов. Они составляют 40-75% общего количества лейкоцитов. Размеры нейтрофила: в мазке крови - 12 мкм; диаметр нейтрофила, мигрирующего в тканях, увеличивается почти до 20 мкм. Нейтрофилы образуются в костном мозге в течение 7 суток, через 4 суток выходят в кровоток и находятся в нём 8-12 часов. Продолжительность жизни - около 8 суток. Старые клетки фагоцитируются макрофагами.
• Пулы нейтрофилов. Выделяют три пула нейтрофилов: циркулирующий, пограничный и резервный.
❖ Циркулирующий - пассивно переносимые кровью клетки. При бактериальном инфицировании организма их количество возрастает в течение 24-48 часов в несколько (до 10) раз за счёт пограничного пула, а также за счёт ускоренного выхода резервных клеток из костного мозга.
❖ Пограничный пул состоит из нейтрофилов, связанных с эндотелиальными клетками мелких сосудов многих органов, особенно лёгких и селезёнки. Циркулирующий и пограничный пулы находятся в динамическом равновесии.
❖ Резервный пул - зрелые нейтрофилы костного мозга.
• Ядро. В зависимости от степени дифференцировки различают палочкоядерные и сегментоядерные (см. рис. 24-1, Б) нейтрофилы. В нейтрофилах у женщин один из сегментов ядра содержит вырост в форме барабанной палочки - тельце Барра, или половой хроматин (эта инактивированная X-хромосома заметна у 3% нейтрофилов в мазке крови женщин).
❖ Палочкоядерные нейтрофилы - незрелые формы клеток с подковообразным ядром. В норме их количество составляет 3-6% общего количества лейкоцитов.
❖ Сегментоядерные нейтрофилы - зрелые клетки с ядром, состоящим из 3-5 сегментов, соединённых тонкими перемычками.
❖ Ядерные сдвиги лейкоцитарной формулы. Поскольку при микроскопии мазка крови основным критерием для идентификации разных форм зрелости зернистых лейкоцитов является характер ядра (форма, размер, интенсивность окраски), сдвиги лейкоцитарной формулы обозначают как «ядерные».
♦ Сдвиг влево характеризуется увеличением количества молодых и незрелых форм нейтрофилов (см. рис. 24-4). При острых гнойно-воспалительных заболеваниях, помимо лейкоцитоза, увеличивается содержание молодых форм нейтрофилов, обычно палочкоядерных, реже - юных нейтрофилов (метамиелоцитов и миелоцитов), что указывает на серьёзный воспалительный процесс.
♦ Сдвиг вправо проявляется повышением числа сегментированных ядерных форм нейтрофилов.
❖ Индекс ядерного сдвига отражает отношение процентного содержания суммы всех молодых форм нейтрофилов (палочкоядерных, метамиелоцитов, миелоцитов, промиелоцитов, см. рис. 24- 4) к их зрелым формам. У здоровых взрослых людей индекс ядерного сдвига колеблется в диапазоне от 0,05 до 0,10. Увеличение его свидетельствует о ядерном сдвиге нейтрофилов влево, уменьшение - о сдвиге вправо.
• Гранулы нейтрофилов
❖ Азурофильные гранулы нейтрофилов содержат различные белки, разрушающие компоненты внеклеточного матрикса и обладающие антибактериальной активностью. В гранулах присутствуют катепсины, эластаза, протеиназа 3 (миелобластин), азуроцидин, дефензины, катионные белки, лизоцим, арилсульфатаза. Главный фермент азурофильных гранул - миелопероксидаза. Этот белок составляет 2-4% массы нейтрофила, катализирует образование хлорноватистой кислоты и других токсических агентов, значительно усиливающих бактерицидную активность нейтрофила.
❖ Специфические гранулы значительно мельче азурофильных, но вдвое многочисленнее. Гранулы содержат белки, обладающие бактериостатическими свойствами: лактоферрин, витамин B12-связывающие белки. Кроме того, в гранулах присутствуют лизоцим, коллагеназа, щелочная фосфатаза, катионные белки.
• Рецепторы. В плазмолемму нейтрофилов встроены рецепторы молекул адгезии, цитокинов, колониестимулирующих факторов, опсонинов, хемоаттрактантов, медиаторов воспаления. Связывание с этими рецепторами их лигандов приводит к активации нейтрофилов (выход из сосудистого русла, миграция в очаг воспаления, дегрануляция нейтрофилов, образование супероксидов).
• Функция нейтрофилов. В крови нейтрофилы находятся всего несколько часов (транзитом из костного мозга в ткани), а свойственные им функции выполняют за пределами сосудистого русла (выход из сосудистого русла происходит в результате хемотаксиса) и только после активации нейтрофилов. Главная функция - фагоцитоз тканевых обломков и уничтожение опсонизированных микроорганизмов. Фагоцитоз и последующее переваривание материала происходят параллельно с образованием метаболитов арахидоновой кислоты и респираторным взрывом. Фагоцитоз осуществляется в несколько этапов. После предварительного специфического распознавания подлежащего фагоцитозу материала происходит инвагинация мембраны нейтрофила вокруг частицы и образование фагосомы. Далее в результате слияния фагосомы с лизосомами образуется фаголизосома, после чего происходит уничтожение бактерии и разрушение захваченного материала. Для этого в фаголизосому поступают: лизоцим, катепсин, эластаза, лактоферрин, дефензины, катионные белки; миелопероксидаза; супероксид О2- и гидроксильньгй радикал ОН-, образующиеся (наряду с Н2О2) при респираторном взрыве. После единственной вспышки активности нейтрофил погибает. Такие нейтрофилы составляют основной компонент гноя («гнойные» клетки).
❖ Активация. Биологически активные соединения различного происхождения (например, содержимое гранул тромбоцитов, метаболиты арахидоновой кислоты (липидные медиаторы)), воздействуя на нейтрофилы, стимулируют их активность (многие из этих веществ в то же время - хемоаттрактанты, по градиенту концентрации которых происходит миграция нейтрофилов).
❖ Липидные медиаторы продуцируют активированные нейтрофилы, а также базофилы и тучные клетки, эозинофилы, моноциты и макрофаги, тромбоциты. В активированной клетке из мембранных фосфолипидов освобождается арахидоновая кислота, из которой образуются простагландины, тромбоксаны, лейкотриены и ряд других биологически активных веществ.
❖ Респираторный взрыв. Нейтрофилы в течение первых секунд после стимуляции резко увеличивают поглощение кислорода и быстро расходуют значительное его количество. Это явление известно как респираторный (кислородный) взрыв. При этом образуются
токсичные для микроорганизмов H2O2, супероксид O2- и гидроксильный радикал ОН-.
❖ Хемотаксис. Нейтрофилы мигрируют в очаг инфекции по градиенту концентрации многих химических факторов. Важное значение среди них имеют N-формилметаонилпептиды (например, хемоаттрактант f-Met-Leu-Phe), образующиеся при расщеплении бактериальных белков или белков митохондрий при повреждении клеток.
❖ Адгезия. Активированный нейтрофил прикрепляется к эндотелию сосуда. Адгезию к эндотелию стимулируют многие агенты: анафилатоксины, интерлейкин-1, тромбин, фактор активации тромбоцитов PAF, лейкотриены LTC4 и LTr34, фактор некроза опухоли α и др.
❖ Миграция. После прикрепления к эндотелию и выхода из сосуда нейтрофилы увеличиваются в размерах, удлиняются и становятся поляризованными, образуя широкий головной конец (ламеллоподия) и суженную заднюю часть. Нейтрофил, продвигая вперёд ламеллоподию, мигрирует к источнику хемоаттрактанта. При этом гранулы перемещаются к головному концу, их мембраны сливаются с плазмолеммой, и происходит выброс содержимого гранул (в том числе протеаз) из клетки - дегрануляция.
Эозинофилы
• Эозинофил - зернистый лейкоцит, участвующий в аллергических, воспалительных и антипаразитарных реакциях. Эозинофилы составляют 1-5% лейкоцитов, циркулирующих в крови. Их количество изменяется в течение суток и максимально утром. Эозинофилы в течение нескольких дней после образования остаются в костном мозге, затем циркулируют в крови 3-8 часов, большинство из них выходит из кровотока. Эозинофилы мигрируют в ткани, контактирующие с внешней средой (слизистые оболочки дыхательных и мочеполовых путей, кишечника). Размер эозинофила в крови >12 мкм, увеличивается после выхода в соединительную ткань до 20 мкм. Продолжительность жизни - предположительно 8-14 дней. Эозинофилы на своей поверхности имеют мембранные рецепторы Fc-фрагментов IgG, IgM и IgE, компонентов комплемента C1s, C3a, C3b, C4 и C5a, хемокина эотаксина, интерлейкинов. Миграцию эозинофилов в тканях стимулируют эотаксин, гистамин, фактор хемотаксиса эозинофилов ECF, интерлейкин-5 и др. После выполнения своих функций (после дегрануляции) или в отсутствие факторов активации эозинофилы погибают. Специфические гранулы. В цитоплазме эозинофила присутствуют
крупные и мелкие специфические гранулы (красно-оранжевые). Круп-
ные гранулы размером 0,5-1,5 мкм имеют овоидную форму и содержат удлинённый кристаллоид. Кристаллоид имеет структуру кубической решётки и состоит в основном из антипаразитарного агента - главного щелочного белка (MBP). В крупных гранулах также присутствуют нейротоксин (белок X), пероксидаза эозинофила EPO, гистаминаза, фосфолипаза D, гидролитические ферменты, кислая фосфатаза, коллагеназа, цинк, катепсин. Мелкие гранулы содержат арилсульфатазу, кислую фосфатазу, пероксидазу, катионный белок эозинофилов ECP. При аллергических и воспалительных реакциях содержимое гранул секретируется (дегрануляция).
• Метаболическая активность. Как и нейтрофилы, эозинофилы синтезируют метаболиты арахидоновой кислоты (липидные медиаторы), включая лейкотриен LTC4 и фактор активации тромбоцитов PAF.
• Активация. Эозинофилы активируются множеством факторов из самых различных клеток: интерлейкинами (ИЛ2, ИЛ3, ИЛ5), колониестимулирующими факторами GM-CSF и G-CSF, фактором активации тромбоцитов PAF, фактором некроза опухолей, интерферонами и факторами из паразитов.
• Хемотаксис. Активированные эозинофилы перемещаются по градиенту факторов хемотаксиса - бактериальных продуктов и элементов комплемента. Особенно эффективны в качестве хемоаттрактантов вещества, выделяемые базофилами и тучными клетками, - гистамин и фактор хемотаксиса эозинофилов ECF.
• Функции. Уничтожение паразитов, участие в аллергических и воспалительных реакциях. Эозинофилы способны к фагоцитозу, но менее выраженному, чем у нейтрофилов.
❖ Уничтожение паразитов. Эозинофилия возникает при многих паразитарных болезнях. Эозинофилы особенно активно уничтожают паразитов в местах их внедрения в организм, но менее эффективны в отношении паразитов, достигших области окончательной локализации. После активации АТ и компонентами комплемента эозинофилы выделяют содержимое гранул и липидные медиаторы, что оказывает повреждающее действие на паразитов. Секреция содержимого гранул запускается в течение нескольких минут и может продолжаться несколько часов.
❖ Участие в аллергических реакциях. Содержимое гранул эозинофилов инактивирует гистамин и лейкотриен LTC4. Эозинофилы вырабатывают ингибитор, блокирующий дегрануляцию тучных клеток. Медленно реагирующий фактор анафилаксии (SRS-A), выделяемый базофилами и тучными клетками, также ингибируется активированными эозинофилами.
❖ Участие в воспалительных реакциях. Эозинофилы отвечают хемотаксисом на многие сигналы, исходящие из эндотелия, макрофагов, паразитов и повреждённых тканей.
❖ Побочные эффекты эозинофилов. Секретируемые эозинофилом вещества могут повреждать нормальные ткани. Так, при постоянном высоком содержании эозинофилов в крови хроническая секреция содержимого гранул эозинофилов вызывает тромбоэмболические повреждения, некроз тканей (особенно эндокарда) и образование фиброзной ткани. IgE-стимуляция эозинофилов может вызывать обратимые изменения проницаемости сосудов. Продукты секреции эозинофилов повреждают бронхиальный эпителий, активируют комплемент и систему свёртывания крови.
Базофилы
Базофилы составляют 0-1% общего числа лейкоцитов циркулирующей крови. В крови базофилы диаметром 10-12 мкм находятся 1- 2 суток. Как и другие зернистые лейкоциты, базофилы при стимуляции могут покидать кровоток, но их способность к амебоидному движению ограничена. Продолжительность жизни и судьба в тканях неизвестна.
• Специфические гранулы довольно крупные (0,5-1,2 мкм), окрашиваются метахроматически (в иной цвет, чем краситель, от красновато-фиолетового до интенсивно-фиолетового). В гранулах содержатся различные ферменты и медиаторы. К наиболее значимым из них можно отнести гепаринсульфат (гепарин), гистамин, медиаторы воспаления (например, медленно реагирующий фактор анафилаксии SRS-A, фактор хемотаксиса эозинофилов ECF).
• Метаболическая активность. При активации базофилы вырабатывают медиаторы липидной природы. В отличие от тучных клеток, не обладают активностью PGD2-синтетазы и окисляют арахидоновую кислоту преимущественно до лейкотриена LTC4.
• Функция. Активированные базофилы покидают кровоток и в тканях участвуют в аллергических реакциях. Базофилы имеют высокоаффинные поверхностные рецепторы к Fc-фрагментам IgE, а IgE синтезируют плазматические клетки при попадании в организм Аг (аллергена). Дегрануляция базофилов опосредована молекулами IgE. При этом происходит перекрёстное связывание двух и более молекул IgE. Выделение гистамина и других вазоактивных факторов при дегрануляции и окисление арахидоновой кислоты вызывают развитие аллергической реакции немедленного типа (такие реакции характерны для аллергического ринита, некоторых форм бронхиальной астмы, анафилактического шока).
Моноциты и макрофаги
Моноциты (рис. 24-1,Е) - самые крупные лейкоциты (диаметр в мазке крови около 15 мкм), их количество составляет 2-9% от всех лейкоцитов циркулирующей крови. Образуются в костном мозге, выходят в кровоток и циркулируют около 2-4 сут. Моноциты крови - фактически незрелые клетки, находящиеся на пути из костного мозга в ткани. В тканях моноциты дифференцируются в макрофаги; совокупность моноцитов и макрофагов - система мононуклеарных фагоцитов.
• Активация моноцитов. Различные вещества, образующиеся в очагах воспаления и разрушения ткани, - агенты хемотаксиса и активации моноцитов. В результате активации увеличивается размер клетки, усиливается обмен веществ, моноциты выделяют биологически активные вещества (интерлейкин-1, колониестимулирующие факторы M-CSF и GM-CSF, Пг, интерфероны, факторы хемотаксиса нейтрофилов и др.).
• Функция. Главная функция моноцитов и образующихся из них макрофагов - фагоцитоз. В переваривании фагоцитированного материала участвуют лизосомные ферменты, а также формируемые внутриклеточно H2O2, OH-, O2-. Активированные моноциты/макрофаги продуцируют также эндогенные пирогены.
Пирогены. Моноциты/макрофаги продуцируют эндогенные пироге-
ны (интерлейкины 1, 6, 8, фактор некроза опухоли TNFa, α- интерферон) - полипептиды, запускающие метаболические изменения в центре терморегуляции (гипоталамус), что приводит к повышению температуры тела. Критическую роль играет образование простагландина E2. Образование эндогенных пирогенов моноцитами/макрофагами (а также рядом других клеток) вызывают экзогенные пирогены - белки микроорганизмов, бактериальные токсины. Наиболее распространённые экзогенные пирогены - эндотоксины (липополисахариды грамотрицательных бактерий).
Макрофаг - дифференцированная форма моноцитов - крупная (около 20 мкм), подвижная клетка системы мононуклеарных фагоцитов. Макрофаги - профессиональные фагоциты, они найдены во всех тканях и органах, это мобильная популяция клеток. Продолжительность жизни макрофагов - месяцы. Макрофаги подразделяют на резидентные и подвижные. Резидентные макрофаги присутствуют в тканях в норме, в отсутствие воспаления. Среди них различают свободные, имеющие округлую форму, и фиксированные макрофаги - звездообразной формы клетки, прикрепляющиеся своими отростками к внеклеточному матриксу или к другим клеткам.
• Свойства макрофага зависят от их активности и локализации. В лизосомах макрофагов содержатся бактерицидные агенты: миелопероксидаза, лизоцим, протеиназы, кислые гидролазы, катионные белки, лактоферрин, супероксид дисмутаза - фермент, способствующий образованию H2O2, OH-, O2-. Под плазмолеммой в большом количестве присутствуют актиновые микрофиламенты, микротрубочки, промежуточные филаменты, необходимые для миграции и фагоцитоза. Макрофаги мигрируют по градиенту концентрации многих веществ, поступающих из различных источников. Активированные макрофаги образуют цитоплазматические псевдоподии неправильной формы, участвующие в амебоидном движении и фагоцитозе.
• Функции. Макрофаги захватывают из крови денатурированные белки, состарившиеся эритроциты (фиксированные макрофаги печени, се- лезёнки, костного мозга). Макрофаги фагоцитируют обломки клеток и тканевого матрикса. Неспецифический фагоцитоз характерен для альвеолярных макрофагов, захватывающих пылевые частицы различной природы, сажу и т.п. Специфический фагоцитоз происходит при взаимодействии макрофагов с опсонизированной бактерией. Активированный макрофаг секретирует более 60 факторов. Макрофаги проявляют антибактериальную активность, выделяя лизоцим, кислые гидролазы, катионные белки, лактоферрин, H2O2, OH-, O2-. Противоопухолевая активность заключается в прямом цитотоксическом действии H2O2, аргиназы, цитолитической протеиназы, фактора некроза опухоли из макрофагов. Макрофаг - антигенпредставляющая клетка: он процессирует Аг и представляет его лимфоцитам, что приводит к стимуляции лимфоцитов и запуску иммунных реакций (см. подробнее в главе 29). Интерлейкин-1 из макрофагов активирует Т-лимфоциты и в меньшей степени - В-лимфоциты. Макрофаги продуцирует липидные медиаторы - ПгE2 и лейкотриены, фактор активации тромбоцитов PAF. Клетка также выделяет α-интерферон, блокирующий репликацию вирусов. Активированный макрофаг секретирует ферменты, разрушающие внеклеточный матрикс (эластазу, гиалуронидазу, коллагеназу). С другой стороны, факторы роста, синтезируемые макрофагом, эффективно стимулируют пролиферацию эпителиальных клеток (трансформирующий фактор роста TGFa, bFGF), пролиферацию и активацию фибробластов (фактор роста из тромбоцитов PDGF), синтез коллагена фибробластами (трансформирующий фактор роста TGFP), формирование новых кровеносных сосудов - ангиогенез (фактор роста фибробластов bFGF). Таким образом, основные процессы, лежащие в основе заживления раны (реэпителизация,
образование внеклеточного матрикса, восстановление повреждён- ных сосудов), опосредованы факторами роста, производимыми макрофагами. Вырабатывая ряд колониестимулирующих факторов (макрофагов - M-CSF, гранулоцитов - G-CSF), макрофаги влияют на дифференцировку клеток крови.
Лимфоциты
Лимфоциты (рис. 24-1Д) составляют 20-45% общего числа лейкоцитов крови. Кровь - среда, в которой лимфоциты циркулируют между органами лимфоидной системы и другими тканями. Лимфоциты могут выходить из сосудов в соединительную ткань, а также мигрировать через базальную мембрану и внедряться в эпителий (например, в слизистой оболочке кишечника). Продолжительность жизни лимфоцитов: от нескольких месяцев до нескольких лет. Лимфоциты - иммунокомпетентные клетки, имеющие огромное значение для иммунных защитных реакций организма (см. подробнее в главе 29). С функциональной точки зрения различают В-лимфоциты, Т-лимфоциты и NK-клетки.
• B-лимфоциты (произносят как «б») образуются в костном мозге и составляют менее 10% лимфоцитов крови. Часть В-лимфоцитов в тканях дифференцируются в клоны плазматических клеток. Каждый клон синтезирует и секретирует АТ только против одного Аг. Другими словами, плазматические клетки и синтезируемые ими АТ обеспечивают гуморальный иммунитет.
• T-лимфоциты Клетка-предшественница T-лимфоцитов поступает в тимус из костного мозга. Дифференцировка T-лимфоцитов происходит в тимусе. Зрелые Т-лимфоциты покидают тимус, их обнаруживают в периферической крови (80% и более всех лимфоцитов) и лимфоидных органах. Т-лимфоциты, как и В-лимфоциты, реагируют (т.е. узнают, размножаются и дифференцируются) на конкретные Аг, но - в отличие от B-лимфоцитов - участие Т-лимфоцитов в иммунных реакциях сопряжено с необходимостью узнавать в мембране других клеток белки главного комплекса гистосовместимости MHC. Основные функции Т-лимфоцитов - участие в клеточном и гуморальном иммунитете (так, Т-лимфоциты уничтожают аномальные клетки своего организма, участвуют в аллергических реакциях и в отторжении чужеродного трансплантата). Среди Т-лимфоцитов различают CD4+- и CD8+-лимфоциты. CD4+-лимфоциты (Т-хелперы) поддерживают пролиферацию и дифференцировку В-лимфоцитов и стимулируют образование цитотоксических Т-лимфоцитов, а также способствуют пролиферации и дифференцировке супрессорных Т-лимфоцитов.
• NK-клетки - лимфоциты, лишённые характерных для Т- и В-клеток поверхностноклеточных детерминант. Эти клетки составляют около 5-10% всех циркулирующих лимфоцитов, содержат цитолитические гранулы с перфорином, уничтожают трансформированные (опухолевые) и инфицированные вирусами, а также чужеродные клетки.
Кровяные пластинки
Тромбоцыты, или кровяные пластинки (рис. 24-13) - фрагменты расположенных в красном костном мозге мегакариоцитов. Размеры кровяных пластинок в мазке крови - 3-5 мкм. Количество тромбоцитов в циркулирующей крови - 190-405х109/л. Две трети кровяных пластинок находятся в крови, остальные депонированы в селезёнке. Продолжительность жизни тромбоцитов - 8 дней. Старые тромбоциты фагоцитируются в селезёнке, печени и костном мозге. Циркулирующие в крови тромбоциты могут при ряде обстоятельств активироваться, активированные тромбоциты участвуют в свёртывании крови и восстановлении целостности стенки сосуда. Одно из важнейших свойств активированных кровяных пластинок - их способность к взаимной адгезии и агрегации, а также адгезии к стенке кровеносных сосудов.
• Гликокаликс. Выступающие наружу части молекул интегральных белков плазматической мембраны, богатые полисахаридными боковыми цепями (гликопротеины), создают внешнее покрытие липидного бислоя - гликокаликс. Здесь же адсорбированы факторы коагуляции и иммуноглобулины. На наружных частях гликопротеиновых молекул находятся рецепторные места. После их соединения с агонистами индуцируется сигнал активации, передающийся к внутренним частям периферической зоны тромбоцитов.
• Плазматическая мембрана содержит гликопротеины, выполняющие роль рецепторов при адгезии и агрегации тромбоцитов. Так, гликопротеин Ib (GP Ib, Ib-IX) важен для адгезии тромбоцитов, он связывается с фактором фон Виллебранда и подэндотелиальной соединительной тканью. Гликопротеин IV (GP IIIb) - рецептор тромбоспондина. Гликопротеин IIb-IIIa (GP IIb-IIIa) - рецептор фибриногена, фибронектина, тромбоспондина, витронектина, фактора фон Виллебранда; эти факторы способствуют адгезии и агрегации тромбоцитов, опосредуя формирование между ними «мостиков» из фибриногена.
• Гранулы. Тромбоциты содержат 3 типа гранул (α-, δ-, λ) и микропероксисомы.
❖ α-Гранулы содержат различные гликопротеины (фибронектин, фибриноген, фактор фон Виллебранда), связывающие гепарин
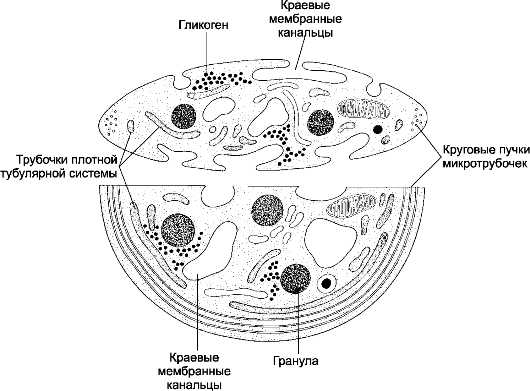 Рис. 24-13. Тромбоцит имеет
форму овального или округлого диска. В цитоплазме видны мелкие
скопления гликогена и крупные гранулы нескольких типов. Периферическая
часть содержит циркулярные пучки микротрубочек (необходимы для
сохранения овальной формы тромбоцита), а также актин, миозин, гельзолин и
другие сократительные белки, нужные для изменения формы тромбоцитов, их
взаимной адгезии и агрегации, а также для ретракции образовавшегося при
агрегации тромбоцитов сгустка крови. По периферии тромбоцита
расположены также анастомозирующие мембранные канальцы, открывающиеся во
внеклеточную среду и необходимые для секреции содержимого α-гранул. В
цитоплазме рассеяны узкие, неправильной формы мембранные трубочки,
составляющие плотную тубулярную систему; трубочки содержат
циклооксигеназу (необходима для окисления арахидоновой кислоты и
образования тромбоксана TXA2; ацетилсалициловая кислота
(аспирин) необратимо ацетилирует циклооксигеназу, локализованную в
трубочках плотной тубулярной системы, что блокирует образование
тромбоксана, необходимого для агрегации тромбоцитов; в результате
функция тромбоцитов нарушается, и время кровотечения удлиняется). [11]
Рис. 24-13. Тромбоцит имеет
форму овального или округлого диска. В цитоплазме видны мелкие
скопления гликогена и крупные гранулы нескольких типов. Периферическая
часть содержит циркулярные пучки микротрубочек (необходимы для
сохранения овальной формы тромбоцита), а также актин, миозин, гельзолин и
другие сократительные белки, нужные для изменения формы тромбоцитов, их
взаимной адгезии и агрегации, а также для ретракции образовавшегося при
агрегации тромбоцитов сгустка крови. По периферии тромбоцита
расположены также анастомозирующие мембранные канальцы, открывающиеся во
внеклеточную среду и необходимые для секреции содержимого α-гранул. В
цитоплазме рассеяны узкие, неправильной формы мембранные трубочки,
составляющие плотную тубулярную систему; трубочки содержат
циклооксигеназу (необходима для окисления арахидоновой кислоты и
образования тромбоксана TXA2; ацетилсалициловая кислота
(аспирин) необратимо ацетилирует циклооксигеназу, локализованную в
трубочках плотной тубулярной системы, что блокирует образование
тромбоксана, необходимого для агрегации тромбоцитов; в результате
функция тромбоцитов нарушается, и время кровотечения удлиняется). [11]
• белки (например, фактор 4 тромбоцитов), тромбоцитарный фактор роста PDGF и трансформирующий фактор роста β, плазменные факторы свёртывания VIII и V, а также тромбоспондин (способствует адгезии и агрегации тромбоцитов) и рецептор клеточной адгезии GMP-140. ❖ Другие гранулы. δ-Гранулы накапливают неорганический фосфат Pj, АДФ, АТФ, Ca2+, серотонин и гистамин (серотонин и гистамин не синтезируются в тромбоцитах, а поступают из плазмы). λ-Гранулы содержат лизосомные ферменты и могут участвовать в растворении тромба. Микропероксисомы обладают пероксидазной активностью. Функции тромбоцитов. В физиологических условиях тромбоциты находятся в неактивном состоянии, т.е. свободно циркулируют в крови, не адгезируют друг с другом и не прикрепляются к эндотелию сосуда (частично это связано с тем, что эндотелиальные клетки вырабатывают простациклин PGI2, препятствующий адгезии тромбоцитов к стенке сосуда). Однако при повреждении кровеносного сосуда тромбоциты вместе с плазменными факторами свёртывания крови образуют сгусток крови - тромб, предотвращающий кровотечение. Остановка кровотечения происходит в 3 этапа. 1. Сначала происходит сокращение просвета кровеносного сосуда. 2. Далее в повреж- дённом участке сосуда тромбоциты прикрепляются к стенке сосуда и, наслаиваясь друг на друга, образуют тромбоцитарную гемостатическую пробку (белый тромб). Эти события (изменение формы кровяных пластинок, их адгезия и агрегация) обратимы, так что слабо агрегированные тромбоциты могут отделяться от гемостатических тромбоцитарных пробок и возвращаться в кровоток. 3. Наконец, растворимый фибриноген превращается в нерастворимый фибрин, который формирует прочную трёхмерную сеть, в петлях которой расположены клетки крови, в том числе и эритроциты; это фибриновый - красный тромб.
Образованию фибринового тромба предшествует каскад протеолитических реакций, приводящий к активации фермента тромбина, который и превращает фибриноген в фибрин. Таким образом, на одном из этапов тромбообразования происходит свёртывание крови - гемокоагуляция - часть системы гемостаза, самое непосредственное отношение к которой имеют тромбоциты.
Гемостаз
В прикладном смысле термин «гемостаз» (от гр. haima кровь, stasis остановка) применяют для обозначения собственно процесса остановки кровотечения. Система гемостаза включает факторы и механизмы
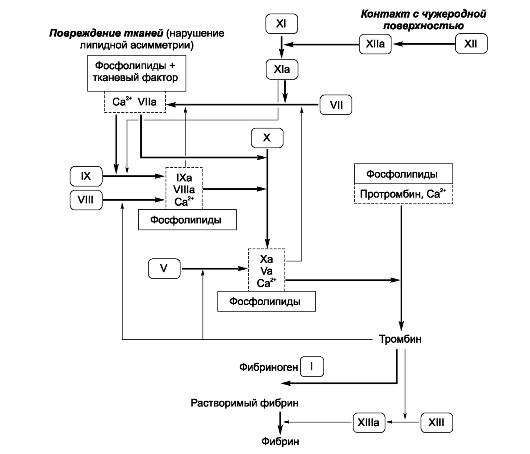 Рис. 24-14. Гемокоагуляционный каскад [8].
Активация фактора XII запускает внутренний (контактный) механизм;
высвобождение тканевого фактора, а активация фактора VII запускает
внешний механизм свёртывания. Оба пути приводят к активации фактора Х. В
прямоугольниках с закруг- лёнными углами - номера плазменных факторов
свёртывания. Ферментные комплексы - рядом расположенные прямоугольники
сплошного и прерывистого начертания границ
Рис. 24-14. Гемокоагуляционный каскад [8].
Активация фактора XII запускает внутренний (контактный) механизм;
высвобождение тканевого фактора, а активация фактора VII запускает
внешний механизм свёртывания. Оба пути приводят к активации фактора Х. В
прямоугольниках с закруг- лёнными углами - номера плазменных факторов
свёртывания. Ферментные комплексы - рядом расположенные прямоугольники
сплошного и прерывистого начертания границ
трёх категорий: свёртывающую, противосвёртываюигую и фибринолитическую.
• Свёртывающая система, а именно плазменные факторы свёртыва- ния (прокоагулянты), формируя сложный гемокоагуляционны1й каскад, обеспечивает коагуляцию фибриногена и тромбообразование (Рис. 24-14). Каскад реакций, ведущий к образованию тромбина,
может реализоваться двумя путями - внешним (на рисунке слева и сверху) и внутренним (на рисунке справа и сверху). Для инициации реакций внешнего пути необходимо появление тканевого фактора на внешней поверхности плазматической мембраны тромбоцитов, моноцитов и эндотелия. Внутренний путь начинается с активации фактора XII при его контакте с повреждённой поверхностью эндотелия. Понятие о внутреннем и внешнем путях свёртывания достаточно условно, т.к. каскад реакций свёртывания крови идёт преимущественно внешним путём, а не по двум относительно независимым путям.
• Противосвёртывающая система физиологических антикоагулянтов обусловливает торможение или блокаду свёртывания крови.
• Фибринолитическая система реализует лизис фибринового тромба.
• Плазменные факторы свёртывания - различные компоненты плазмы, реализующие образование сгустка крови. Факторы свёртыва- ния обозначают римскими цифрами (к номеру активированной формы фактора добавляют строчную букву «а»).
I - растворимый фибриноген, превращающийся в нерастворимый фибрин под влиянием тромбина (фактор IIа).
II - протромбин (профермент), превращающийся в протеазу тромбин (фактор IIa) под влиянием комплекса фактора Xa, фосфолипидов мембран тромбоцитов и других клеток, Са2+ и фактора Va.
III - тканевый фактор. Комплекс тканевого фактора, фосфолипидов, фактора VIIa и Са2+ запускает внешний механизм свёртыва- ния.
IV - Ca2+.
V - проакцелерин - предшественник акцелерина (Va) - белкаактиватора мембранного комплекса Xa-Va-Ca2+.
VII - проконвертин (профермент), VIta - протеаза, активирующая факторы X и IX.
VIII - неактивный антигемофильный глобулин А - предшественник фактора VIIIa (активного антигемофильного глобулина) - белка-активатора мембранного комплекса IXa-VIIIa-Ca2+. Недостаточность фактора VIII приводит к развитию классической гемофилии А, наблюдающейся только у мужчин.
IX - неактивный антигемофильный глобулин В (профермент, неактивный фактор Кристмаса) - предшественник активного антигемофильного фактора В (активный фактор Кристмаса) - протеазы, активирующей фактор X. Недостаточность фактора IX приводит к развитию гемофилии В (болезнь Кристмаса).
X - неактивный фактор Стюарта-Прауэр (активная форма - фактор Xa - протеаза, активирующая фактор II), недостаточность фактора Стюарта приводит к дефектам свёртывания.
XI - профермент контактного пути свёртывания крови - неактивный плазменный предшественник тромбопластина (активная форма - фактор XIa - сериновая протеаза, превращающая фактор IX в фактор IXa). Недостаточность фактора XI приводит к кровоточивости.
XII - неактивный фактор Хагемана - профермент контактного пути свёртывания крови, активная форма - фактор XIIa (активный фактор Хагемана) - активирует фактор XI, прекалликреин (профермент контактного пути свёртывания крови), плазминоген).
XIII - фибринстабилизирующий фактор (фактор Лаки-Лорана) - активированный тромбином фактор XIII (фактор ХШа), образует нерастворимый фибрин, катализируя образование амидных связей между молекулами фибрина-мономера, фибрином и фибронектином.
• Внешний путь занимает центральное место в свёртывании крови. Ферментные мембранные комплексы (см. ниже) образуются только при наличии на внешней поверхности плазматической мембраны тромбоцитов и эндотелиальных клеток тканевого фактора и отрицательно заряженных фосфолипидов, т.е. при формировании отрицательно заряженных (тромбогенных) участков и экспозиции апопротеина тканевого фактора. При этом тканевый фактор и поверхность клеточной мембраны становятся доступными для плазменных факторов.
-Ф- Активация ферментов. В циркулирующей крови содержатся проферменты (факторы II, VII, IX, X). Белки-кофакторы (факторы Vа, VIIIa, а также тканевый фактор - фактор III) способствуют превращению проферментов в ферменты (сериновые протеазы).
4? Ферментные мембранные комплексы. При включении каскадного механизма активации ферментов последовательно образуются 3 связанных с фосфолипидами клеточной мембраны ферментных комплекса. Каждый комплекс состоит из протеолитического фермента, белка-кофактора и ионов Са2+: VIIa-тканевый фактор- фосфолипид-Ca2+, IXa-VШa-фосфолипид-Ca2+ (теназный комплекс, активатор фактора X); Xa-Va-фосфолипид-Ca2+ (протромбиназный комплекс, активатор протромбина). Каскад ферментативных реакций завершается образованием мономеров фибрина и последующим формированием тромба.
-Φ- Ионы Ca2+. Взаимодействие ферментных комплексов с клеточными мембранами происходит с участием ионов Са2+. Остатки γ-карбоксиглутаминовой кислоты в факторах VIIa, IXа, Xа и протромбине обеспечивают взаимодействие этих факторов посредством Са2+ с отрицательно заряженными фосфолипидами клеточных мембран. Без ионов Са2+ кровь не свёртывается. Именно поэтому для предотвращения свёртывания крови снижают концентрацию Ca2+ деионизацией кальция цитратом (цитратная кровь) либо осаждением кальция в виде оксалатов (оксалатная кровь).
-Ф- Витамин К. Карбоксилирование остатков глутаминовой кислоты в проферментах прокоагулянтного пути катализирует карбоксилаза, коферментом которой является восстановленная форма витамина К (нафтохинона). Поэтому недостаточность витамина К тормозит свёртывание крови и сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями, а структурные аналоги витамина К (например, варфарин) применяют в клинической практике для предупреждения тромбозов.
• Контактный путь свёртывания крови начинается с взаимодействия профермента (фактора XII) с повреждённой эндотелиальной поверхностью сосудистой стенки. Такое взаимодействие приводит к активации фактора XII и инициирует образование мембранных ферментных комплексов контактной фазы свёртывания. Эти комплексы содержат ферменты калликреин, факторы XIa (плазменный предшественник тромбопластина) и XIIа (фактор Хагемана), а также белок-кофактор - высокомолекулярный кининоген.
• Противосвёртывающая система крови. Физиологические ингибиторы играют важную роль в поддержании крови в жидком состоянии и препятствуют распространению тромба за пределы повреждённо- го участка сосуда. Тромбин, образующийся в результате реакций свёртывания крови и обеспечивающий формирование тромба, вымывается током крови из тромба; в дальнейшем тромбин инактивируется при взаимодействии с ингибиторами ферментов свёрты- вания крови и в то же время активирует антикоагулянтную фазу, тормозящую образование тромба.
-Ф- Антикоагулянтная фаза. Эту фазу запускает тромбин (фактор II), вызывая образование ферментных комплексов антикоагулянтной фазы на неповреждённом эндотелии сосудов. В реакциях антикоагулянтной фазы, помимо тромбина, участвуют тромбомодулин эндотелиальных клеток, витамин К-зависимая сериновая протеаза - протеин С, активирующий протеин S и плазменные факторы свёртывания Va и VIIIa.
-Φ- Физиологические ингибиторы ферментов свёртывания крови (антитромбин III, гепарин, а2-макроглобулин, антиконвертин, α1- антитрипсин) ограничивают распространение тромба местом повреждения сосуда.
• Фибринолитическая система. Тромб может раствориться в течение нескольких дней после образования. При фибринолизе - ферментативном расщеплении волокон фибрина - образуются растворимые пептиды. Фибринолиз происходит под действием сериновой протеазы плазмина, точнее - при взаимодействии фибрина, плазминогена и тканевого активатора плазминогена.
• Лабораторные показатели системы гемостаза. Кровь здорового человека in vitro свёртывается за 5-10 мин. При этом образование протромбиназного комплекса занимает 5-8 мин, активация протромбина - 2-5 с и превращение фибриногена в фибрин - 2-5 с. В клинической практике для оценки гемостаза оценивают содержание разных компонентов системы свёртывания, антикоагулянтов и фибринолиза. К простейшим лабораторным методам относят определение времени кровотечения, тромбинового и протромбинового времени, активированного частичного тромбопластинового времени и протромбинового индекса.