Нормальная физиология : Учебник. - Р.С. Орлов, А.Д. Ноздрачёв, 2009. - 688 с
|
|
|
|
ГЛАВА 21. МЕТАБОЛИЗМ И ТЕРМОРЕГУЛЯЦИЯ
Живые организмы - термодинамически полуоткрытая система - находятся в постоянной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ и энергии.
Обмен веществ
Обмен веществ (рис. 21-1А) включает три этапа: поступление веществ в организм (дыхание и питание), метаболизм (катаболизм и анаболизм) и выделение конечных продуктов из организма.
• Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты: превращений органических веществ - СО2, Н2О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток. Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции).
• Анаболизм объединяет биосинтетические процессы, когда строительные блоки соединяются в сложные макромолекулы. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
• Интенсивность метаболизма. На интенсивность метаболизма влияют: о мышечная работа (↑); -онедавнее употребление пищи (↑); -овысокая и низкая температура окружающей среды (Т); о рост, масса и площадь поверхности тела (Т); - пол (Т у мужчин); - эмоциональное состояние (↑ или ↓); -о возраст (↓ после 30 лет жизни); о температура тела (прямо пропорционально ↑или ↓); о йодсодержащие гормоны щитовидной железы и адреналин (Т).
Баланс энергии
В организме насчитывается пять форм энергии: химическая, механическая, осмотическая, электрическая и тепловая. Клетки тела способны использовать энергию только из одного источника - химическую энергию, выделяющуюся при экзергонических реакциях. Химическая энергия организма может превращаться во все другие формы энергии (рис. 21-1Б).
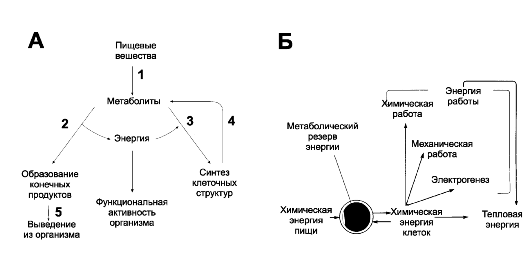 Рис. 21-1. А. Общая схема обмена веществ и энергии. 1
- пищеварение; 2 - катаболизм; 3 - анаболизм; 4 - распад
структурно-функциональный компонентов клеток; 5 - выведение из
организма. [9]. Б. Биологические превращения энергии
Рис. 21-1. А. Общая схема обмена веществ и энергии. 1
- пищеварение; 2 - катаболизм; 3 - анаболизм; 4 - распад
структурно-функциональный компонентов клеток; 5 - выведение из
организма. [9]. Б. Биологические превращения энергии
• В соответствии с первым законом термодинамики энергия не может возникать из ничего и исчезать бесследно. Этот закон применим к живым системам в том смысле, что энергия, получаемая организмом, должна быть сопоставимой с энергией, выделяемой им. Взаимоотношения между компонентами, вовлекаемыми в баланс между получаемой и затраченной энергией, могут быть представлены уравнением:
химическая энергия пищи = тепловая энергия + энергия работы (затраты на физическую активность) ± химический запас энергии
• Стандартная единица энергии в международной системе единиц (СИ) - джоуль (Дж, размерность - м2хкгхс-2), но издавна применяется и не входящая в СИ единица тепловой энергии - калория (кал), а в физиологии и медицине - килокалория (ккал). Калорию определяют как количество тепла, необходимое для нагрева 1 г воды на 1 градус Цельсия (1 калория = 4,187 Дж).
• Калориметрия
о Прямая калориметрия - непосредственное измерение тепла, выделяемого при сжигании пищевых веществ в специальных калориметрах (калориметрическая бомба), или тепла, выделяемого за определённый промежуток времени живыми организмами, поме- щёнными в сложное калориметрическое устройство.
о Калорическая величина основных компонентов пищи, измеренная в калориметрической бомбе, составляет в расчёте на 1 г вещества: для углеводов - 4,1 ккал/г, белков - 5,3 ккал/г, жиров - 9,3 ккал/г.
В организме при окислении углеводов и жиров образуется такое же количество энергии, как и при сжигании в калориметрической бомбе. При окислении белков образуется не 5,3 ккал/г, а только 4,1 ккал/г, так как в организме белки окисляются лишь частично. Кроме воды и углекислого газа, конечным продуктом обмена белков является мочевина, которая содержит значительное количество энергии.
• Непрямая калориметрия. Количество выделяемой энергии может быть подсчитано путём измерения количества конечных продуктов окисления в организме (H2O и CO2) и конечных продуктов белкового катаболизма или измерения потребляемого кислорода при помощи спирографа и специального аппарата, называемого «метаболической тележкой». Данное устройство можно использовать у постели больного и подключить последовательно с вентиляционной трубкой для измерения газообмена в лёгких. Этот способ называется непрямой калориметрией.
• Дыхательный коэффициент (ДК) - соотношение объёма выделяемого CO2 к объёму потребляемого O2 в единицу времени. ДК может быть рассчитан для реакций вне организма, для отдельного органа или ткани и для целого организма. В состоянии физического покоя ДК для углеводов составляет 1,0, для жиров - 0,70. Эти результаты определяются тем, что водород и кислород находятся в углеводах в одинаковых соотношениях к образуемой воде, а в различных жирах требуется дополнительное количество O2 для образования воды.
Основной обмен
Интенсивность метаболизма, определяемая в стандартных условиях: лёжа, в комфортных условиях температуры (18-20 °C), через 12-14 ч после приёма пищи называют основным обменом.
• Основной обмен у мужчины среднего возраста и массой 75 кг колеблется в пределах 1800-2000 ккал/день. У женщины основной обмен примерно на 10% ниже, чем у мужчины. Величина основного обмена в пересчёте на 1 кг массы тела у детей выше, чем у взрослых. С возрастом основной обмен понижается.
• Основной обмен коррелирует с площадью поверхности тела, что позволяет производить ориентировочные расчёты освобождения энергии в организме. Взаимоотношения между массой, ростом и поверхностью тела человека выражаются следующей формулой:
S = 0,007184xW0,425xH0,725, где S - площадь поверхности тела в м2; W - масса тела в кг; H - рост в см.
• Тревога и напряжение повышают основной обмен за счёт увеличения секреции адреналина и повышения тонуса мышц. Апатия, депрессия приводят к понижению основного обмена. Повышение температуры тела повышает основной обмен в среднем на 14% на каждый градус по Цельсию.
Промежуточный метаболизм
Конечные продукты пищеварения - аминокислоты, производные жиров и гексозы (глюкоза, фруктоза, галактоза) - абсорбируются и метаболизируются различными путями.
• Общий план метаболизма. Короткие цепочки фрагментов гексоз, аминокислот и продуктов жирового катаболизма из общего метаболического пула могут синтезироваться или поступать в цикл лимонной кислоты в процессе сортировки в конечном общем пути катаболизма, где они расщепляются до атомов водорода и CO2. Атомы водорода, окисляясь, образуют воду в цепи флавопротеиновых и цитохромных ферментов.
• Макроэргические соединения. Большая часть энергии, выделяемая при катаболизме, идёт на образование связей между фосфорной кислотой и некоторыми органическими веществами. При гидролизе этих связей выделяется много энергии (10-12 ккал/моль). Соединения с такими связями называются высокоэнергетическими (макроэргическими). Не все органические фосфаты принадлежат к этому классу. Многие вещества (например, глюкозо-6-фосфат) выделяют при гидролизе не более 2-3 ккал/моль.
о АТФ. Наиболее важным высокоэнергетическим фосфатом является АТФ. При гидролизе АТФ и превращения её в АДФ выделяемая энергия используется для таких процессов, как мышечное сокращение, активный транспорт, а также для синтеза многих химических соединений.
о Креатинфосфат. Энергетически богатое соединение креатинфосфат содержится в мышечных клетках. Ряд фосфорилированных соединений, производных пиримидиновых и пуриновых оснований, вьполняющих функцию донора энергии, включает ГТФ,
ЦТФ, УТФ, ИТФ.
о Ацетилкоэнзим А - высокоэнергетическое соединение, содержащее аденин, рибозу, пантотеновую кислоту и тиоэтаноламин. Образование одной молекулы ацетилкоэнзима А эквивалентно образованию молекулы АТФ.
• Биологическое окисление. Окисление - соединение вещества с O2, потеря водорода или потеря электронов. Биологическое окисление катализируют ферменты. Кофакторы или коферменты - дополнительные вещества, выполняющие функции переносчиков продуктов реакции. Многие коферменты акцептируют водород. Одной из наиболее общих реакций биологического окисления является реакция удаления водорода. Водород переносится во флавопротеин-цитохромную систему, соединяется с O2 и превращается в воду.
• Окислительное фосфорилирование. Образование АТФ связано с окислением посредством флавопротеин-цитохромной системы и носит название окислительного фосфорилирования. Окислительное фосфорилирование - хемоосмотический процесс, вовлекающий перенос протонов через мембрану митохондрий. Мембранная АТФ-синтаза превращает АДФ и неорганический фосфат в АТФ. Фосфорилирование зависит от адекватного поступления АДФ и находится под контролем механизма обратной связи. Чем быстрее используется АТФ в тканях, тем больше накапливается АДФ и, соответственно, увеличивается скорость окислительного фосфорилирования.
• Разобщение дыхания и фосфорилирования. Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтетазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. Примерами разобщителей могут быть некоторые ЛС (например антикоагулянт дикумарол) или метаболиты (например, билирубин и тироксин).
ОСНОВНЫЕ ВИДЫ ОБМЕНА ВЕЩЕСТВ
Обмен углеводов
В пищеварительном тракте конечными продуктами переваривания углеводов являются глюкоза, фруктоза и галактоза. Основной углевод, циркулирующий в крови - глюкоза [нормальный уровень глюкозы в плазме венозной крови - 70-110 мг% (3,9-6,1 ммоль/л), артериальной крови - на 15-20 мг% выше].
• Транспорт глюкозы через клеточную мембрану. Глюкоза присоединяется к белкам-переносчикам, которые транспортируют глюкозу через клеточную мембрану внутрь клетки посредством облегченной диффузии. Главный активатор трансмембранного переноса глюкозы - инсулин. Количество глюкозы, которое может поступить в клетки без инсулина (за исключением печени и мозга) слишком мало, чтобы обеспечить энергией нормальный уровень метаболизма. Под влиянием инсулина скорость и количество глюкозы, транспортируемой через клеточные мембраны, значительно возрастают.
• Фосфорилирование глюкозы. Поступившая в клетки глюкоза фосфорилируется ферментом глюкокиназой. Фосфорилирование глюкозы - процесс необратимый, за исключением клеток печени, эпителия почечных трубочек и эпителиальных клеток кишечника. В этих клетках имеется специальный фермент фосфатаза, способная реверсировать реакцию фосфорилирования. Следовательно, в большинстве клеток глюкоза не может диффундировать наружу.
• Накопление гликогена и гликогенолиз. После поступления в клетки глюкоза сразу же используется для образования энергии или накапливается в виде гликогена (большой полимер из молекул глюкозы). Все клетки тела способны запасать некоторое количество гликогена, но только гепатоциты, скелетные мышечные волокна и кардиомиоциты могут депонировать большие запасы гликогена.
Большие гликогеновые молекулы преципитируются в форме плотных гранул. Процесс образования гликогена - гликогенез. Гликогенолиз - процесс расщепления гликогена с образованием глюкозы. Гликогенолиз - не реверсия гликогенеза, так как отщепление молекулы глюкозы от гликогена осуществляется ферментом фосфорилазой. В состоянии покоя этот фермент находится в неактивированном состоянии. Активация фосфорилазы происходит под влиянием адреналина и глюкагона.
• Выделение энергии из глюкозы. При полном окислении одной молекулы глюкозы выделяется 686 тыс. калорий энергии и только 12 тыс. калорий необходимо для образования одной молекулы АТФ. Однако клетки содержат множество ферментов, которые вызывают постепенное расщепление молекулы глюкозы на многих последовательных этапах. Энергия в процессе утилизации глюкозы выделяется небольшими порциями в форме одной молекулы АТФ за один период. В итоге из каждой молекулы глюкозы может образоваться 38 молекул АТФ, из них 2 в ходе гликолиза, 2 в цикле лимонной кислоты и 34 при окислительном фосфорилировании. Таким образом, из общего количества энергии в 686 тыс. калорий, могущих выделиться при полном окисления молекулы глюкозы 456 тыс. калорий депонируется в форме АТФ, т.е. общее количество энергии, используемой на нужды организма, составляет 66%. Остающиеся 34% переходят в тепло.
• Регуляция расщепления глюкозы. Гликолиз и окислительное фосфорилирование - процессы регулируемые. Оба процесса постоянно контролируются в соответствии с потребностями клеток в АТФ. Этот контроль имеет отношение к механизмам обратной связи между концентрациями АТФ и АДФ. Одним из элементов контроля энергии является ингибирующее влияние АТФ на ферментативные процессы, протекающие на начальных этапах гликолиза. Излишки АТФ останавливают гликолиз с последующим торможением углеводного метаболизма. АДФ же, напротив, повышает активность гликолитических процессов. Как только АТФ используется тканями, ингибирующее влияние АТФ на ферменты гликолиза уменьшается. Одновременно с этим возрастает активность ферментов вследствие формирования АДФ. Когда клеточные запасы АТФ вновь переполняются, ферментативные процессы замедляются.
• Глюконеогенез. Когда запасы углеводов в организме становятся ниже нормального уровня, то умеренное количество глюкозы может образовываться из аминокислот и из глицериновой части жиров в процессе глюконеогенеза. Приблизительно 60% аминокислот в белках организма могут легко превращаться в углеводы. Низкий уро-
вень углеводов в клетках и уменьшение содержания глюкозы в крови - главные стимулы увеличения интенсивности глюконеогенеза.
Обмен жиров
К липидам относятся нейтральные жиры (триглицериды), фосфолитиды и холестерин. Химическая основа большей части липидов -жир- ные кислоты - длинные цепи гидрокарбоновых органических кислот. Три жирных кислоты (стеариновая, пальмитиновая и олеиновая) обязательно входят в состав триглицеридов. Холестерин не содержит жирных кислот, но его стероидное ядро образовано из продуктов расщепления жирных кислот, и холестерин по своим физическим и химическим свойствам напоминает другие липидные вещества. Триглицериды используются в организме для обеспечения энергией различных метаболических процессов. Некоторые липиды (в особенности холестерин, фосфолипиды и продукты распада этих веществ) участвуют в различных внутриклеточных функциях.
• Транспорт липидов. Практически все жиры, поступающие с пищей, абсорбируются в лимфу в форме хиломикронов - мельчайших жировых частиц, заключённых в жировую оболочку. Хиломикроны поступают в грудной проток и оттуда в венозную кровь. Хиломикроны удаляются из плазмы, когда они проходят по капиллярам жировой ткани и печени. Мембраны гепатоцитов и жировых клеток содержат липопротеиновую липазу. Этот фермент расщепляет триглицериды хиломикронов на жирные кислоты и глицерин. Жирные кислоты немедленно диффундируют в клетки, где вновь ресинтезируются в триглицериды. Для того чтобы жир, запасённый в жировых клетках, мог своевременно использоваться в организме, он должен поступить в другие ткани в виде свободных жирных кислот. Покидая жировые клетки, жирные кислоты в плазме крови ионизируются и образуют соединения с альбумином. Жирные кислоты, прикреплённые к белкам таким способом, называют свободными жирными кислотами.
• Липопротеины. В печени образуются липопротеины - частицы: значительно меньшего размера, чем хиломикроны, но имеющие тот же состав. Липопротеины содержат смесь триглицеридов, фосфолипидов, холестерина и белков. Различают три класса липопротеинов.
о Липопротеины очень низкой плотности (ЛПОНП), содержащие высокую концентрацию триглицеридов и умеренную концентрацию фосфолипидов и холестерина.
о Липопротеины низкой плотности (ЛПНП), содержащие немного триглицеридов и очень много холестерина.
о Липопротеины высокой плотности (ЛПВП), содержащие 50% белков с небольшим содержанием липидов.
Основная функция липопротеинов - транспорт липидов в различные ткани организма. Триглицериды синтезируются в печени, главным образом, из углеводов, и доставляются в жировую и другие ткани в форме ЛПОНП. ЛПНП образуются из остатков ЛПОНП, когда ЛПОНП передадут основную массу триглицеридов в жировую ткань, оставив большие концентрации холестерина и фосфолипидов в ЛПНП. ЛПВП транспортируют холестерин из периферических тканей в печень. Этот тип липопротеинов играет очень важную роль в предотвращении развития атеросклероза.
• Депонирование жиров. Большое количество жиров накапливается в жировой ткани. Первая функция жировой ткани - накопление триглицеридов для энергетических нужд организма. Вторая функция жировой ткани - обеспечение теплоизоляции тела. Адипоциты жировой ткани способны запасать почти чистые трилицериды в количестве 80-95% их объёма. В жировой ткани имеется большое количество липаз. Некоторые из этих ферментов катализируют расщепление триглицеридов, поступивших из хиломикронов и других липопротеинов. Другие липазы активируются гормонами и вызывают расщепление триглицеридов в жировых клетках, приводя к выделению свободных жирных кислот. Так как жирные кислоты обмениваются очень быстро, то триглицериды в жировых клетках обновляются через каждые 2-3 нед, делая жировую ткань очень динамичной.
• Печень и жировой обмен. Печень содержит много триглицеридов, фосфолипидов и холестерина. Во время голодания большое количество триглицеридов извлекается из жировой ткани и поступает в печень, где подвергается процессам расщепления. В норме количество триглицеридов в печени определяется скоростью использования липидов для продукции энергии. Функция печени в жировом обмене многозначна. Печень осуществляет: о преобразование жирных кислот в небольшие соединения, пригодные для образования энергии; о синтез триглицеридов из углеводов и белков; о синтез холестерина, фосфолипидов и других соединений из жирных кислот.
• Использование триглицеридов для образования энергии. Первой стадией использования триглицеридов для энергии является гидролиз триглицеридов на жирные кислоты и глицерин. Жирные кислоты и глицерин доставляются в ткани, где они окисляются, выделяя энергию. Почти все клетки организма, исключая ткань мозга, могут использовать жирные кислоты в качестве источника энергии практически в неизменном виде. В клетках происходит транспорт жирных кислот в митохондрии с помощью вещества-переносчика
карнитина. Проникнув в митохондрии, жирные кислоты отсоединяются от переносчика, расщепляются и окисляются.
• Гормональная регуляция жирового обмена. На процессы утилизации жира воздействует несколько гормонов.
о Адреналин и норадреналин увеличивают утилизацию жира во время интенсивной мышечной работы. Эти гормоны активируют гормон-чувствительные триглицеридные липазы, находящиеся в жировых клетках. Происходит быстрое расщепление триглицеридов и высвобождение жирных кислот. Различного рода стрессорные факторы, возбуждающие симпатическую систему, оказывают аналогичное воздействие.
о Кортикотропин (АКТГ), выделяемый передней долей гипофиза в ответ на стресс, стимулирует секрецию в корковом слое надпочечников глюкокортикоидов (кортизола). Кортизол и кортикотропин активируют гормон-чувствительную триглицеридную липазу, которая увеличивает выход жиров из жировой ткани.
о Гормон роста оказывает эффект, подобный действию АКТГ и кортизола, но выраженный в меньшей степени.
о Снижение концентрации инсулина активирует гормон-чувствительную липазу и вызывает быструю мобилизацию жирных кислот.
о Гормоны щитовидной железы вызывают быстрое высвобождение жирных кислот.
• Фосфолипиды. Различают три основных типа фосфолипидов: лецитины, кефалины и сфингомиелины. Фосфолипиды участвуют в образовании структурных элементов (главным образом мембран) и входят в состав липопротеинов крови. Тромбопластин, вещество необходимое для свёртывания крови, состоит из кефалинов. В нервной системе находится большое количество сфингомиелинов. Эти вещества действуют как изоляторы в миелиновой оболочке, окружающей нервные волокна.
• Холестерин входит в состав пищевых продуктов, в ЖКТ он всасывается и поступает в лимфу. Дополнительно к экзогенному холестерину, который каждый день абсорбируется из ЖКТ, большое количество эндогенного холестерина образуется в клетках. Эндогенный холестерин, циркулирующий в форме липопротеинов плазмы, образуется в печени. Холестерин входит в состав клеточных мембран. До 80% всего холестерина превращается в печени в холевую кислоту. Холевая кислота, соединяясь с другими веществами, образует жёлчные соли, которые способствуют пищеварению и абсорбции жиров. Холестерин используется в синтезе гормонов коркового слоя надпочечников (минерало- и глюкокортикоиды), яичника (эстроген и прогестерон), яичек (тестостерон).
Обмен белков
Три четверти плотной массы тела составляют белки. Более 20 аминокислот входят в состав белков. Аминокислоты агрегированы в длинные цепочки посредством пептидных связей. Сложные белковые молекулы могут иметь до 100 тыс. аминокислот. Некоторые белковые молекулы состоят из нескольких пептидных цепей, соединённых между собой водородными связями, электростатическими силами или сульфгидрильными, фенольными и другими группами.
• Заменимые и незаменимые аминокислоты. 10 из 20 аминокислот, присутствующих в организме, могут синтезироваться в клетках. Другие десять аминокислот не могут синтезироваться, они должны поступать в организм с пищей. Эта группа незаменимых аминокислот включает аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
• Транспорт и депонирование аминокислот. Конечным продуктом переваривания белков в ЖКТ являются аминокислоты. Нормальное содержание аминокислот в крови составляет от 35 до 65 мг%. Аминокислоты, находящиеся в крови, поступают в клетки в течение 5-10 мин (рис. 2). Молекулы аминокислот транспортируются через мембрану клеток посредством активного транспорта или облегченной диффузии. Сразу же после проникновения в клетку аминокислоты под влиянием внутриклеточных ферментов объединяются в клеточные белки, и поэтому концентрация свободных аминокислот в клетке низка. Многие внутриклеточные белки могут быстро превращаться в аминокислоты под влиянием лизосомальных пищеварительных ферментов и поступать обратно в кровь. Особое исключение из этого правила составляют белки хромосомного аппарата ядра и структурные белки (коллаген и сократительные белки). Эти белки не принимают участия в процессе обратимого превращения в аминокислоты. Если концентрация аминокислот в плазме становится ниже нормального уровня, то свободные аминокислоты выходят из клеток, пополняя их концентрацию в плазме. Одновременно внутриклеточные белки распадаются на аминокислоты. Каждый тип клеток имеет свой верхний предел для количества белка, который они могут депонировать. После реализации клетками своих потребностей в белках излишки аминокислот метаболизируют в жиры или в гликоген.
• Функция белков плазмы. Основные белки плазмы - альбумин, глобулин и фибриноген. Альбумины обеспечивают коллоидное осмотическое давление, глобулины участвуют в формировании иммунитета, фибриноген при гемокоагуляции полимеризуется в фибриновые нити.
• о Ежедневно в организме синтезируется и расщепляется 400 г белка. Даже во время голодания или тяжёлой истощающей болезни соотношение общего тканевого белка к общему содержанию белков плазмы остаётся относительно постоянным - 33:1. о Существует состояние обратимого равновесия между белками плазмы, аминокислотами плазмы и тканевыми белками (рис. 21-2). Это обстоятельство позволяет использовать внутривенное введение белков как один из наиболее эффективных способов лечения белковой недостаточности организма (парентеральное питание). Азотистый баланс. О равновесии белкового обмена организма судят по содержанию мочевины (азот мочевины), так как в норме потери белка с калом минимальны. Поэтому количество азота в моче является реальным показателем катаболизма белков. Если количество азота в моче равно количеству азота белков, поступающих с пищей, то человек находится в состоянии азотистого равновесия (баланса). Если в организм начинает поступать повышенное количество белка, то излишнее количество аминокислот дезаминируется и концентрация мочевины возрастает, поддерживая азотистый баланс. Однако в условиях повышенной секреции катаболических гормонов коры надпочечников или при недостаточной секреции инсулина, а также во время голодания или принудительном ограничении движений, потери азота превышают его поступление в организм и азотистый баланс становится отрицательным. Отсутствие в диете какой-либо из незаменимых аминокислот приводит к тому, что белок, для которого она предназначена, не синтезируется. Все другие аминокислоты, которые должны участвовать в синтезе данного
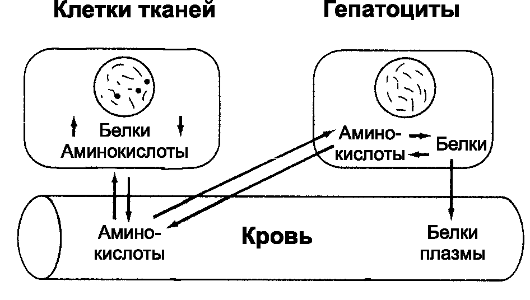 Рис. 21-2. Обратимое равновесие между белками тканей, белками плазмы и аминокислотами плазмы
Рис. 21-2. Обратимое равновесие между белками тканей, белками плазмы и аминокислотами плазмы
белка, дезаминируются, и их азот выделяется с мочой. В период роста или восстановления после перенесённой тяжёлой болезни, или в результате применения анаболических стероидов (таких как тестостерон), поступление азота превышает его выделение, и азотистый баланс становится положительным. В среднем для предотвращения потерь белка организм нуждается в 20-30 г белка ежедневно. Минимум белка, который должен поступать с пищей ежедневно, составляет 60-75 г, необходимых для сохранения белкового баланса.
• Гормональная регуляция белкового обмена
о Гормон роста увеличивает интенсивность белкового синтеза за счёт увеличения транспорта аминокислот через клеточные мембраны и ускорения процессов транскрипции и трансляции.
о Инсулин ускоряет транспорт некоторых аминокислот в клетки. Увеличивая потребление глюкозы клетками, инсулин уменьшает использование аминокислот для пополнения энергетических затрат.
о Тестостерон увеличивает накопление белков в организме, в особенности, сократительных белков мышц.
о Эстрогены увеличивают накопление белков, но менее значительно в сравнении с тестостероном.
о Глюкокортикоиды уменьшают количество белков во многих тканях, но увеличивают концентрацию аминокислот в плазме, количество печёночных и плазменных белков.
о Тироксин увеличивает интенсивность метаболизма во всех клетках и повышает обмен белков.
ПИТАНИЕ
Цель физиологии питания - определение качественного и количества состава пищи для обеспечения здоровья и работоспособности. Стабильность массы тела и его состава в течение продолжительного времени нуждаются в балансе между потребляемой и выделяемой человеком энергией. Поскольку разнообразные виды пищи содержат разные пропорции белков, углеводов, жиров, минералов и витаминов, должен быть установлен необходимый баланс для снабжения различных метаболических систем организма соответствующими питательными веществами.
Калорийность пищевых продуктов
• При основным обмене в покое около 2000 ккал/день в зависимости от энергозатрат требуется дополнительно 500-2500 ккал или более. Распределение калорий между углеводами, белками и жирами определяется частично физиологическими факторами и час-
тично вкусовыми предпочтениями и экономическими соображениями.
• Белок. Ежедневное потребление белка должно быть по крайней мере не менее 1 г/кг/массы тела. Необходимо, чтобы белок содержал незаменимые аминокислоты. Источником незаменимых аминокислот являются животные продукты (мясо, рыба и яйцо), содержащие аминокислоты в пропорциях, примерно соответствующих необходимым для синтеза белков. Некоторые растительные продукты также содержат белки, но создать необходимые пропорции всех необходимых незаменимых аминокислот в диете из одних растительных продуктов трудно.
• Жиры. Требуется около 100 г/сут. Преобладание в диете насыщенных жирных кислот (очищенных от холестерина) не представляет угрозы жировому обмену организма человека.
• Углеводы - наиболее «дешёвый» источник калорий, в большинстве диет они составляют 50% и более от калорийности принимаемой пищи.
• Расчёты. Когда возникает необходимость расчёта диеты, то на первом месте всегда находятся белки. Остающиеся калории делятся в зависимости от вкуса, экономических возможностей и других факторов. Например, мужчина 65 лет с умеренной физической активностью нуждается в 2800 ккал в день. Он должен получать с пищей не менее 65 г белка ежедневно (267 ккал), жиров 50-60 г в день (825 ккал). Остающиеся калории приходятся на 500 г углеводов в день. В табл. 21-1 показано содержание белка, жиров и углеводов в некоторых видах пищи.
Таблица 21-1. Содержание (%) белков, жиров, углеводов в пище и калорийность (на 100 г)
Продукт | Белки | Жиры | Углеводы | Калории |
Апельсин | 0,9 | 0,2 | 11,2 | 50 |
Булка | 9,0 | 3,6 | 49,8 | 268 |
Картофель | 2,0 | 0,1 | 19,1 | 85 |
Масло | 0,6 | 81,0 | 0,4 | 733 |
Молоко | 3,5 | 3,9 | 4,9 | 69 |
Морковь | 1,2 | 0,3 | 9,3 | 45 |
Мясо | 17.5 | 22,0 | 1,0 | 268 |
Курица | 21,6 | 2,7 | 1,0 | 111 |
Шоколад | 5,5 | 52,9 | 18,0 | 570 |
Яблоко | 0,3 | 0,4 | 14,9 | 64 |
Витамины
Витамины - не синтезируемые в организме соединения, необходимые в минимальных количествах для обеспечения нормального обмена. Термин «витамин» предложил Функ в связи с наличием у тиамина аминогруппы (хотя в дальнейшем выяснилось, что многие витамины не содержат аминогруппы и даже атома азота, сам термин сохранился). Витамины не являются пластическим материалом и не служат источником энергии. В настоящее время насчитывают 13 витаминов (точнее - групп, или семейств витаминов). Почти каждое семейство состоит из нескольких витаминов, их предложено называть витамерами. По свойству растворимости витамины подразделяют на жирорастворимые (витамины A, D, E и K) и водорастворимые (все остальные). В последние годы удалось получить водорастворимые формы некоторых жирорастворимых витаминов.
• Потребность в витаминах. Большинство витаминов поступает в организм с пищей. По-видимому, только биотин и витамин K способны синтезироваться в организме человека в достаточном количестве и практически полностью покрывать потребность в них. Некоторые водорастворимые витамины синтезируются микроорганизмами в кишечнике. Суточные нормы потребности приведены ниже при характеристике отдельных витаминов.
• Депонирование витаминов. Витамины содержатся в небольших количествах во всех клетках. В печени накапливается витамин A в количестве, достаточном для поддержания нормального уровня этого витамина в организме в течение 5-10 мес. Витамина D в печени достаточно для обеспечения ежедневных потребностей в течение 2- 4 мес. Водорастворимые витамины группы B (исключая B12) в организме практически не накапливаются (если они отсутствуют в пище несколько дней, то появляются симптомы их недостаточности). Витамин B12 может сохраняться в печени в связанном виде в течение года. Отсутствие витамина C в пище может вызвать появление симптомов дефицита этого витамина через несколько недель.
• Витамин A [ретинол (провитамин - β-каротен), ретиналь (провитамин - криптоксантин), ретиноевая кислота] находится в тканях в виде ретинола. С растительной пищей поступают провитамины (красные и жёлтые каротиноиды). Основные функции витамина A - участие в построении зрительных пигментов, в нормальном росте эпителия и костной ткани. Многие клетки имеют рецепторы к ретиноидам - производным витамина А - модификаторам многих клеточных функций. Суточная потребность (дозу измеряют в МЕ: 1 МЕ=0,3 мкг): для взрослых - 1,5 мг (5000 МЕ), для беременных - 2 мг (6600 МЕ), для кормящих женщин - 2,5 мг (8250 МЕ);
для детей до 1 года - 0,5 мг (1650 МЕ), 1-6 лет - 1 мг (3300 МЕ), старше 7 лет - 1,5 мг (5000 МЕ).
• Витамин B1 (тиамин) участвует в метаболизме в форме тиаминфосфата. После всасывания из ЖКТ тиамин фосфорилируется в тиаминпирофосфат - кофермент декарбоксилаз, участвующих в декарбоксилировании кетокислот (пировиноградной, α-кетоглутаровой), а также транскетолазы, участвующей в пентозофосфатном пути распада глюкозы. Суточная потребность - 1,5 мг. При недостатке витамина В1 в крови увеличивается содержание пирувата и лактата.
• Витамин B2 (рибофлавин) в тканях соединяется с АТФ, превращается в флавинмононуклеотид и флавинадениннуклеотид - коферменты дегидрогеназ и оксидаз, участвующих в окислительно-восстановительных процессах. Рибофлавин необходим для осуществления зрительной функции и синтеза гемоглобина. Суточная потребность -
1,8 мг.
• Витамин B3 (пантотеновая кислота) включен в обменные процессы в виде коэнзима A, участвующего в обмене углеводов и жиров. У человека не бывает дефицита пантотеновой кислоты, которая имеется почти во всех пищевых продуктах и может синтезироваться в организме. Суточная потребность - 10 мг.
• Витамин B6 (пиридоксол, пиридоксаль, пиридоксамин) - водорастворимый витамин, содержащийся в продуктах животного и растительного происхождения, предшественник некоторых коферментов, участвующих в азотистом и жировом обмене, в синтезе серотонина. Суточная потребность - 2 мг.
• Витамин B12 (кобаламин) действует как коэнзим для рибонуклеотидов, способствует росту и образованию эритроцитов. Активные коферментные формы витамина B12 - метилкобаламин и дезоксиаденозинкобаламин, основная функция которых заключается в переносе подвижных метильных групп (трансметилирование) и водорода. Суточная потребность - 2-5 мкг. Дефицит витамина B12 вызывает анемию и нарушение миелинизации проводящих путей в задних и боковых столбах спинного мозга.
• Витамин C (аскорбиновая кислота, дегидроаскорбиновая кислота) - водорастворимый витамин, содержащийся в продуктах растительного происхождения, - участвует во внутриклеточных окислительно-восстановительных процессах (обладает сильными восстановительными свойствами), необходим для синтеза коллагена, гиалуроновой и хондроитинсерной кислот, кортикостероидов, обмена тирозина, фенилаланина и фолиевой кислоты. Суточная потребность: для взрослых - 70-100 мг; для детей: 6 мес-1 год - 20 мг, 1-1,5 года -
35 мг, 1,5-2 года - 40 мг, 3-4 года - 45 мг, 5-10 лет - 50 мг, 11-13 лет - 60 мг.
• Витамины D (холекальциферол - D3, эргокальциферол - D2) - жирорастворимые стероиды - необходимы для развития костей и зубов, всасывания кальция и фосфатов в кишечнике. Биологически малоактивные формы провитаминов растительного (эргостерол, провитамин D2) и животного (провитамин D3) происхождения превращаются в коже (фотолиз под влиянием ультрафиолета), в печени (гидроксилирование) и затем в почках (повторное гидроксилирование) в биологически активную форму - кальцитриол (1,25-(OH)2- D3). Рецепторы витамина D3 - ядерные факторы транскрипции.
• Витамин E (α-токоферол, γ-токоферол) предотвращает окисление ненасыщенных жирных кислот, участвует в синтезе гема и белков, в тканевом дыхании. Суточная потребность - 15 МЕ. Недостаточность витамина E нарушает структуру и функцию митохондрий, лизосом и клеточных мембран, приводит к дегенерации сперматогенного эпителия и гибели плода.
• Витамин К [филлохиноны (K1), менахиноны (K2), менадион (K3)] - общее название жирорастворимых термостабильных соединений, обладающих биологической активностью филлохинонов - важен для свёртывания крови и метаболизма кальция. Суточная потребность - 70 мкг.
• Витамин H - биотин (биотин) входит в состав активного центра биотинзависимых ферментов, ответственных за включение CO2 в различные органические кислоты (реакции карбоксилирования). Суточная потребность - 120 мкг, обеспечивается синтезом витамина в кишечнике. Эффекты избыточного поступления биотина в организм изучены мало. В эксперименте показано наличие у биотина иммуностимулирующих свойств.
• Витамин PP - ниацин (никотиновая кислота, никотинамид) - водорастворимый витамин, содержащийся в мясных и рыбных продуктах - кофермент в форме никотинамиддинуклеотида (НАД) и никотинадениндинуклеотидфосфата (НАДФ). НАД и НАДФ, являясь акцепторами водорода и электронов, участвуют в окислительно-восстановительных процессах, т.е. принимают участие в клеточном дыхании. Суточная потребность: для взрослых - 18- 24 мг, для детей: 6 мес-1 год - 6 мг, 1-1,5 года - 9 мг, 1,5-2 года - 10 мг, 3-4 года - 12 мг, 5-6 лет - 13 мг, 7-10 лет - 15 мг, 11-13 лет - 19 мг.
• Фолиевая кислота [фолиевая кислота, фолацины (полиглутамилфолацины)]. В печени фолиевая кислота превращается в активную форму - фолиновую, или тетрагидрофолиевую кислоту и участву-
ет в синтезе пуринов, пиримидинов, в превращениях ряда аминокислот, в обмене гистидина, синтезе метионина, обмене холина. Суточная потребность - 0,1-0,2 мг. Приём фолатов абсолютно необходим в первом триместре беременности для предупреждения развития уродств плода.
Антивитамины. Под антивитаминами понимают химические вещества, предупреждающие биологические эффекты витаминов. Большинство антивитаминов имеют химическую структуру, сходную с таковой витаминов (например, пиридоксин и его конкурентный антагонист - дезоксипиридоксин). К антивитаминам относят также некоторые соединения (например, ферменты, разрушающие витамины), не являющиеся структурными антагонистами витаминов.
Минералы
В табл. 21-2 приведены сведения о количестве минералов, необходимых для ежедневного употребления.
• Натрий (Na+) - катион внеклеточной жидкости, определяющий КЩР и осмотическое давление; участвует в переносе разных веществ через клеточные мембраны, определяет формирование процесса возбуждения и проведение ПД. Повышенное употребление натрия способствует задержке воды в организме, увеличивает ОЦК, повышает АД.
• Калий (K+) - катион внутриклеточной жидкости, создающий МП, определяющий возбудимость клеточных мембран. Изменения концентрации калия внутри мышечных и нервных клеток влияют на функции мышечной и нервной системы.
• Хлор (Cl-) участвует в поддержании осмотического давления, в образовании соляной кислоты желудочного сока, в синаптическом торможении.
• Кальций (Ca2+) находится в организме в виде фосфата кальция в костях. Физиологическая роль Ca2+ в различных функциях организма обсуждается в соответствующих разделах. Излишне высокий уровень ионов Ca2+ во внеклеточной жидкости способен вызвать
Таблица 21-2. Ежедневная потребность в минералах
Минерал | Количество | Минерал | Количество |
Натрий | 3,0 г | Магний | 400 мг |
Кальций | 1,2 г | Йод | 150,0 мкг |
Калий | 1,0 г | Кобальт | неизвестно |
Хлор | 3,5 г | Медь | неизвестно |
Железо | 18,0 мг | Марганец | неизвестно |
Цинк | 15 мг |
остановку сердца. Очень низкая концентрация внеклеточных ионов Ca2+ порождает спонтанные разряды нервных волокон и тетанус.
• Фосфат (PO43-) - основной анион внутриклеточной жидкости. Фосфаты обладают способностью к образованию обратимых соединений со многими коэнзимами, имеют отношение к функции АТФ, АДФ, цАМФ и других веществ. Фосфаты находятся в больших количествах в костях.
• Железо (Fe2+) участвует в образовании Hb, небольшие количества находятся в печени и трубчатых костях. Переносчики электронов находятся в митохондриях. Железо абсолютно необходимо для транспорта кислорода к тканям и для внутриклеточных окислительных систем.
• Магний (Mg2+) необходим клеткам как катализатор многих ферментативных реакций. Повышение внеклеточной концентрации магния подавляет активность нервной системы и скелетных мышц. Низкая концентрация магния повышает возбудимость нервной системы, вызывает расширение кровеносных сосудов, нарушения ритма сердца.
• Йод необходим для образования T3 и T4. Более половины населения России проживает в условиях хронического йодного дефицита.
• Кобальт (Co2+) является составной частью витамина B12 Дефицит этого витамина вызывает анемию.
• Медь (Cu2+) участвует в окислительных процессах в клетках, входя в состав цитохромоксидазы, моноаминооксидазы, лизилоксидазы, супероксиддисмутазы. Дефицит меди вызывает анемию, дефекты окостенения и гиперхолестеринемию.
• Марганец (Mn2+) - кофактор многих ферментов (аргиназы, фосфатазы, РНК- и ДНК-полимеразы, пируваткарбоксилазы и др.); необходим для формирования костной структуры, поддержания репродуктивной функции и метаболизма соединительной ткани.
• Цинк (Zn2+) - интегральная часть карбоангидразы - фермента, участвующего в обмене CO2 в эритроцитах и других клетках.
• Хром (Cr2-) повышает чувствительность глюкозы к инсулину. Дефицит хрома вызывает резистентность к инсулину.
• Селен участвует в окислении восстановленного глутатиона и превращении тироксина в трийодтиронин.
• Фтор (F-). Небольшое количество фтора необходимо для формирования костей и зубной эмали. Повышенное употребление фтора вызывает флюороз, проявляющийся пятнистостью зубов и иногда увеличением их размеров.
Регуляция питания
Поддержание массы тела и постоянства его состава в течение продолжительного времени определяется равновесием между поступаю-
щей и расходуемой энергией. Потребление пищи зависит от многих факторов: окружающей среды, наследственности, привычек, традиций, уровня культуры, экономического положения, состояния физиологических систем контроля.
Голод и насыщение
• Чувство голода (потребность в приёме пищи) возникает в результате мотивации, направленной на устранение дискомфортных субъективных ощущений, возникших в результате недостатка питательных веществ в организме. К таким ощущениям относят «голодные боли в области желудка», связанные с ритмическими сокращениями желудка, тошнота, общая слабость и иногда головная боль.
• Насыщение. Приём пищи снимает чувство голода и приводит к состоянию насыщения. Субъективно насыщение проявляется чувством удовольствия, повышения настроения и ощущения приятного наполнения желудка. Различают насыщение первичное (сенсорное), вызываемое раздражением обонятельных, вкусовых рецепторов, механорецепторов полости рта, глотки, пищевода, желудка и двенадцатиперстной кишки. Вторичное (обменное, истинное) насыщение возникает после поступления продуктов расщепления пищевых веществ в кровь. Аппетит - эмоциональное ощущение, связанное со стремлением к потреблению пищи. Это ощущение может быть частью чувства голода, но может возникать и самостоятельно, независимо от физиологических потребностей. В последнем случае аппетит является проявлением врождённой или приобретённой индивидуальной склонности к определённому виду пищи и способствует выбору пищи необходимого качества.
• Гипоталамические центры голода и насыщения
❖ Латеральное ядро гипоталамуса выполняет функцию центра голода. Стимуляция этой области вызывает у подопытных животных неудержимое желание есть (гиперфагия). Разрушение ядер приводит к отказу от пищи.
❖ Вентромедиальное ядро гипоталамуса является центром насыщения. При электрическом раздражении ядра животные отказываются есть. Разрушение ядер порождает прожорливость, у животных развивается ожирение.
❖ Паравентрикулярное, дорсомедиальное и дугоообразное ядра гипоталамуса также принимают участие в регуляции пищевого поведения, регулируя секрецию гормонов, влияющих на баланс энергии и метаболизм (тироксин, глюкокортикоиды, инсулин).
❖ Сигналы к гипоталамусу. Гипоталамус получает сигналы от рецепторов желудка (сигнализация о его наполнении), регистриру-
• ет концентрацию находящихся в крови аминокислот, глюкозы и жирных кислот, а центры голода и насыщения содержат рецепторы для нейромедиаторов и гормонов, стимулирующих (нейропептид Y, меланин-концентрирующий гормон, эндорфины, галанин, глутамат, ГАМК, кортизол) или подавляющих (холецистокинин, инсулин, α-меланоцитостимулирующий гормон, кортиколиберин, лептин, серотонин, норадреналин, глюкагоноподобный пептид) пищевое поведение. Регуляция количества пищи, поступающей в организм, может быть подразделена на кратковременную и долговременную.
❖ Кратковременная регуляция заключается в возникновении чувства насыщения при приёме пищи, создаваемого рядом быстрых сигналов обратной связи (холецистокинин, инсулин, глюкагон, растяжение стенки желудка, сигналы от рецепторов ротовой полости).
❖ Долговременная регуляция - механизм поддержания трофического уровня клеток и тканей. Уменьшение в крови концентрации глюкозы, аминокислот или жирных кислот автоматически увеличивает их потребление. Эти факты привели к созданию глюкостатической, аминоацидостатической и липостатической теорий насыщения. Например, повышение концентрации глюкозы в плазме крови стимулирует активность нейронов вентромедиальных (центр насыщения) и паравентрикулярных ядер гипоталамуса и одновременно уменьшает частоту разрядов глюкозочувствительных нейронов центра голода.
Лептин - регулятор потребления пищи
Основные запасы энергии находятся в жировых клетках. Эти же клетки секретируют пептидный гормон лептин, проникающий через гематоэнцефалический барьер путём облегченной диффузии и взаимодействующий со своими рецепторами в дугообразном и паравентрикулярном ядрах гипоталамуса. Стимуляция лептином рецепторов гипоталамуса порождает различные эффекты, уменьшающие запасы жира. Таким образом, лептин сигнализирует в гипоталамус о необходимости корректировать пищевое поведение (увеличивать или уменьшать количество потребляемой пищи). Уменьшение массы жировой ткани и (как следствие) выработки лептина приводит к компенсаторному повышению чувства голода и снижению расхода энергии. Прямым следствием гиполептинемии является ожирение.
Расстройства питания
Из расстройств питания наибольшее социальное и клиническое значение имеет ожирение, поскольку оно сочетается с высоким риском развития сердечно-сосудистых заболеваний (основной причиной смертности) и сахарного диабета.
Ожирение
Ожирение - избыточное накопление жира в организме, при котором индекс массы тела (ИМТ) составляет 30 кг/м2 и выше.
• Индекс массы тела подсчитывают как отношение массы тела (выраженной килограммах) к росту (выраженному в метрах), возведён- ному в квадрат. Нормой следует считать ИМТ в пределах 18,5- 24,9 кг/м2. Ожирение следует отличать от избыточной массы тела, при которой ИМТ составляет 25-29,9 кг/м2. ИМТ менее 18,5 кг/м2 свидетельствует о дефиците массы тела.
• Степени ожирения. В зависимости от величины ИМТ выделяют три степени ожирения (табл. 21-3). Чем выше степень, тем выше риск для здоровья.
Таблица 21-3. Классификация ожирения
Класс | ИМТ (кг/м2) | Риск для здоровья |
Недостаточная масса | <18,5 | Повышен |
Нормальная масса | 18,5-24,9 | Минимальный |
Избыточная масса | 25-29,9 | Повышен |
Ожирение I | 30-34,9 | Высокий |
Ожирение II | 35-39,9 | Очень высокий |
Ожирение Ш | 40 и более | Крайне высокий |
• Типы ожирения. Выделяют мужской и женский типы ожирения. Описание типа распределения жира традиционно проводят посредством измерения отношения окружности талии к окружности бёдер (ОТБ).
❖ Мужской тип (андроидное, или абдоминальное), с преимущественным отложением жира в верхней части тела. ОТБ >0,85 для женщин, >0,95 для мужчин. Мужской тип ожирения чаще сочетается с инсулинорезистентностью, чем женский.
❖ Женский тип (гинекоидное, или ягодичное), с преимущественным отложением жира в нижней части тела. ОТБ <0,85 для женщин, <0,95 для мужчин. Женский тип ожирения лучше поддаёт- ся лечению диетой, чем мужской.
• Механизмы развития ожирения и факторы, способствующие ожирению, многообразны. К ним относят пищевое поведение, состояние адипоцитов, скорость окисления пищевых субстратов и инсулинорезистентность.
ТЕМПЕРАТУРА ТЕЛА И ЕЁ РЕГУЛЯЦИЯ
Температура тела является одним из важных параметров гомеостаза. Нормальная внутренняя температура в среднем равна 37 °C c колебаниями в пределах 0,6 °C. Поддержание этого оптимума температуры гомойотермного организма (вопреки колебаниям температуры окружающей среды) - необходимое условие эффективного функционирования физиологических систем. Гомойотермный (теплокровный) организм человека (по сравнении с пойкилотермными, или холоднокровными) обладает также двумя важными преимуществами: стабильным уровнем жизнедеятельности в оптимальных условиях существования и возможностью приспособления к меняющимся условиям существования, включая экстремальные. С термодинамической точки зрения гомойотермный организм человека (полуоткрытая система), поддерживает и регулирует температуру тела только при условии баланса между теплопродукцией и теплоотдачей.
Теплопродукция. Тепло образуется в процессе обмена веществ. Уровень теплообразования зависит от: ❖ основного обмена, ❖ мышечной активности (сократительный термогенез), включая мышечные сокращения при дрожи; ❖ эффекта гормонов (T4, адреналин, норадреналин, СТГ, тестостерон); ❖ симпатической стимуляции; ❖ несократительного термогенеза, т.е. образования тепла при разобщении окисления и фосфорилирования, в том числе в клетках бурого жира.
Теплоотдача. Основное тепло генерируется в печени, мозге, сердце и в скелетных мышцах во время их работы. Затем тепло передаётся к коже, где оно теряется в воздухе и окружающей среде. Скорость теплоотдачи зависит от двух факторов: скорости проведения тепла (в основном с кровотоком) от мест его образования к коже и скорости отдачи тепла кожей в окружающую среду.
• Кожа как теплоизолятор. Кожа и в особенности подкожная жировая ткань - тепловые изоляторы. Теплопроводность жировой ткани составляет лишь одну треть от теплопроводности других тканей. Поэтому кожа эффективна в поддержании постоянной внутренней температуры даже при температуре на поверхности кожи, близкой к температуре среды.
• Кожа как теплообменная система. Величина кровотока в коже варьирует от 0 до 30% всего сердечного выброса. Кожа - эффективная управляемая теплообменная система, в которой ток крови в коже - основной механизм переноса тепла от тела к коже.
Если температура тела превышает температуру среды, то тело будет отдавать тепло в среду. Отдача тепла в окружающую среду осуществляется излучением, теплопроведением, конвекцией и испарением.
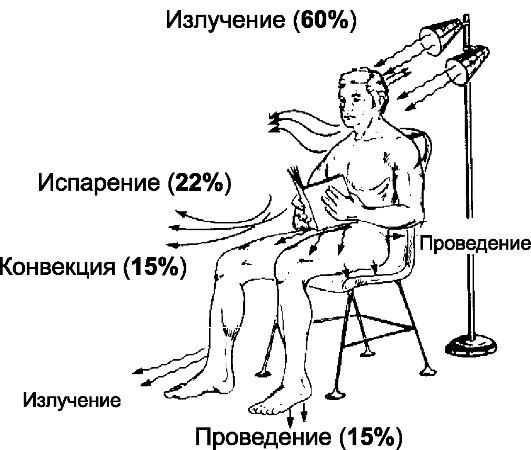 Рис. 21-3. Способы теплообмена с внешней средой
Рис. 21-3. Способы теплообмена с внешней средой
• Излучение. На рис. 21-3 показано, что обнажённый человек в условиях комнатной температуры теряет около 60% от отдаваемого тепла посредством излучения инфракрасных волн длиной от 760 нм.
• Конвекция (15% отдаваемого тепла) - потеря тепла путём переноса движущимися частицами воздуха или воды. Количество тепла, теряемого конвекционным способом, возрастает с увеличением скорости движения воздуха (вентилятор, ветер). В воде величина отдачи тепла путём проведения и конвекции во много раз больше, чем на воздухе.
• Проведение - контактная передача тепла (3% отдаваемого тепла) при соприкосновении поверхности тела с какими-либо физическими телами (стул, пол, подушка, одежда и др.).
Излучение, конвекция и проведение происходят, когда температура тела выше температуры окружающей среды. Если температура поверхности тела равна или ниже температуры окружающей среды, то эти способы потери тепла организмом становятся неэффективными.
• Испарение - необходимый механизм выделения тепла при высоких температурах. Испарение воды с поверхности тела приводит к потере 0,58 ккал тепла на каждый грамм испарившейся воды. Даже без видимого потоотделения вода испаряется с поверхности кожи и лёгких в пределах от 450 до 600 мл в день, вызывая потерю тепла порядка 12-16 ккал/час. Неощутимое испарение - результат непрерывной
диффузии молекул воды через кожу и дыхательные поверхности, оно не контролируется системой температурной регуляции. Повышение температуры среды выше температуры тела приводит к приросту температуры тела за счёт излучения и проведения. В этих условиях освобождение от излишков тепла и охлаждение осуществляются только потоиспарением. Движение воздуха около кожи усиливает скорость испарения и тем самым увеличивает эффективность потери тепла (охлаждающий эффект вентилятора). Потоотделение - один из важных приспособительных механизмов организма к изменениям условий внешней среды. В повседневной жизни встречаются два вида потоотделения - терморегуляторное (возникает на всей поверхности тела в ответ на повышение температуры окружающей среды и при физической нагрузке) и психогенное (в ответ на эмоциональный стресс, обычно локально, но иногда генерализованно).
• Эккриновые потовые железы (20 млн по всей поверхности кожи) выделяют раствор хлорида натрия, они равномерно распределены по поверхности тела и обеспечивают терморегуляцию.
• Апокриновые потовые железы (подмышечные и паховые) выделяют феромоны и принимают участие в создании запаха тела.
• Секреторный отдел потовой железы образует первичный секрет, по составу аналогичный плазме крови, но без белков. По мере движения секрета по направлению к коже большая часть электролитов реабсорбируется. Активация потовых желёз вызывает увеличение образования секрета, но интенсивность реабсорбции остаётся без изменений. Это приводит к потерям электролитов (прежде всего, хлорида натрия).
Выделение пота варьирует в зависимости от вида работы и окружающей температуры (рис. 21-4).
• Потоотделительный механизм начинает работать при температуре 32-34 °C, у новорождённых доношенных - при 35-37 °C, у недоношенных потоотделительный механизм не сформирован.
• Потоотделительный механизм адаптируется к температурным условиям среды. Пребывание в жарком климате неакклиматизированных людей вызывает у них выделение около 1 л пота в час. У акклиматизированных лиц выделяется от 2 до 3 л в час. Высокий уровень потоотделения увеличивает испарительные потери тепла, поддерживая нормальную температуру. С высоким уровнем потоотделения при акклиматизации связано уменьшение содержания хлорида натрия в поте, способствующее сохранению электролитного баланса (регулятор - альдостерон, который стимулирует реабсорбцию натрия из выводных протоков потовых желёз).
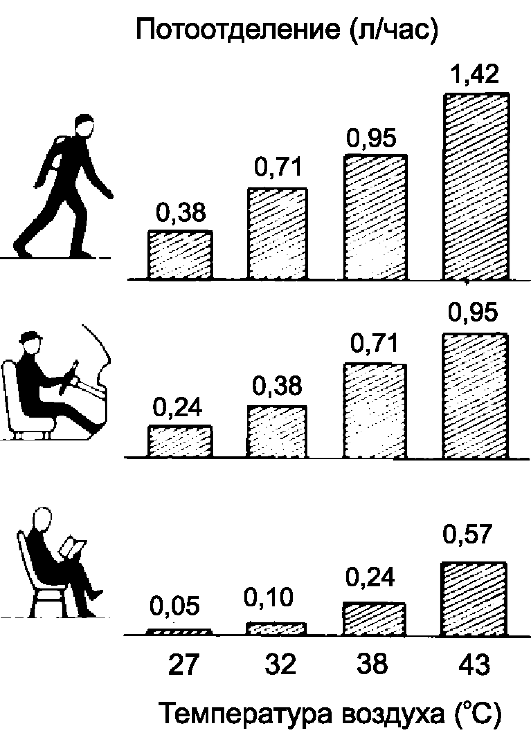 Рис. 21-4. Потоотделение при различной деятельности в условиях разных температур
Рис. 21-4. Потоотделение при различной деятельности в условиях разных температур
Регуляция температуры тела
Терморегуляторная система работает по принципу обратной связи и состоит из трёх компонентов: сенсорные рецепторы, центральный интегратор и система эффекторных органов (рис. 21-5).
• Сенсорные рецепторы
❖ Центральные нейроны. Передний гипоталамус и преоптическая область содержат термочувствительные нейроны, реагирующие преимущественно на охлаждение организма. Регуляция теплопродукции осуществляется в области задних отделов гипоталамуса.
❖ Кожные терморецепторы реагируют на минимальные изменения температуры - 0,005 °C и постоянно снабжают терморегуляторные центры текущей информацией о температуре и быстрых её изменениях.
• Гипоталамический термостат. Информация от центральных и периферических терморецепторов объединяется в терморегуляторном цен-
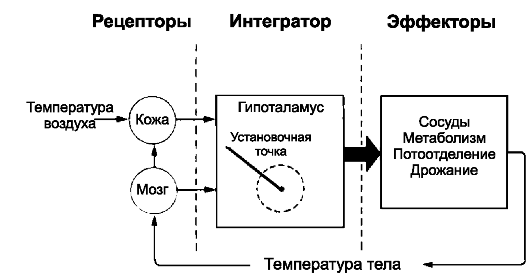 Рис. 21-5. Основные компоненты терморегуляторной системы
Рис. 21-5. Основные компоненты терморегуляторной системы
• тре - передней и преоптической областях гипоталамуса - «гипоталамическом термостате». Терморегуляторный центр постоянно поддерживает внутреннюю температуру 37,1 °C (установочная точка центра терморегуляции). Получение терморегуляторным центром информации об отклонении от установочной точки температуры формирует сигнал к эффекторным системам, обеспечивающим поддержание внутренней температуры тела. Эффекторы
❖ Механизм, понижающий температуру тела (рис. 21-6,А).
♦ Полное расширение сосудов кожи почти во всех областях тела увеличивает в 8 раз количество тепла, доставляемого к коже. Массивное сосудорасширение происходит при торможении симпатической активности заднего гипоталамуса.
♦ Потоотделение увеличивает величину потерь тепла за счёт испарения. Повышение температуры тела на 1 °С вызывает потоотделение, достаточное чтобы в 10 раз снизить уровень теплообразования.
♦ Торможение образования тепла за счёт блокирования химического термогенеза и дрожания.
❖ Механизм, повышающий температуру тела (рис. 21-6,Б).
♦ Сужение сосудов основных регионов тела. Вазоконстрикция достигается активацией симпатических центров заднего гипоталамуса.
♦ Пилоэрекция - реакция выпрямления волос тела. Для человека эта реакция не имеет такого большого значения, как для животных, образующих при выпрямлении шерсти «воздуш-
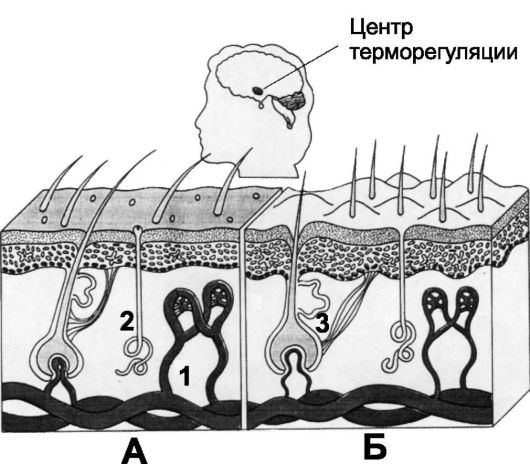 Рис. 21-6. Эффекторные механизмы понижения и повышения температуры.
Рис. 21-6. Эффекторные механизмы понижения и повышения температуры.
ный изолятор». У человека сохранились остатки этой системы («гусиная кожа»), но их эффективность ограничена.
♦ Значительное повышение теплопродукции, вызванное возбуждением симпатической системы, увеличением секреции T4 и мышечной дрожи.
Дрожь может увеличивать величину теплопродукции в 4-5 пять раз. Двигательный центр дрожи располагается в дорсомедиальной части заднего гипоталамуса. Он тормозится повышенной внешней температурой и возбуждается при её понижении. Импульсы из центра дрожи вызывают генерализованное повышение мышечного тонуса. Повышенный мышечный тонус приводит к возникновению ритмических рефлексов с мышечных веретён, что и вызывает дрожь.