Биохимия: учебник для вузов/ под ред. Е.С.Северина - 5-е изд., - 2009. - 768 с.
|
|
|
|
РАЗДЕЛ 6 ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма.
Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания перевариваются (расщепляются до простых веществ). При переваривании происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен.
Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм (рис. 6-1).
Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО2, Н2О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток.
Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции).
Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
I. БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы. Небиологические системы могут совершать работу за счёт тепловой энер-
гии, биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Изучением превращений энергии, сопровождающих химические реакции, занимается биоэнергетика, или биохимическая термодинамика.
А. СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ
ТЕРМОДИНАМИКИ
Живые организмы с точки зрения термодинамики - открытые системы. Между системой и окружающей средой возможен обмен энергии, который происходит в соответствии с законами термодинамики.
1. Законы термодинамики
Первый закон - закон сохранения энергии; его можно сформулировать так: общая энергия системы и окружающей среды - величина постоянная.
Внутри рассматриваемой системы энергия может переходить от одной её части к другой или превращаться из одной формы в другую.
Второй закон гласит, что все физические и химические процессы в системе стремятся к необратимому переходу полезной энергии в хаотическую, неуправляемую форму. Мерой перехода или неупорядоченности системы служит величина, называемая энтропией (S), она достигает максимума, когда система приходит в истинное равновесие с окружающей средой.
2. Свободная энергия
Каждое органическое соединение, поступающее в организм извне или входящее в состав живой материи, обладает определённым запасом внутренней энергии (Е). Часть этой внутренней энергии может быть использована для совершения полезной работы. Такую энергию системы называют свободной энергией (G).
При постоянных температуре и давлении соотношение между изменением свободной энер-
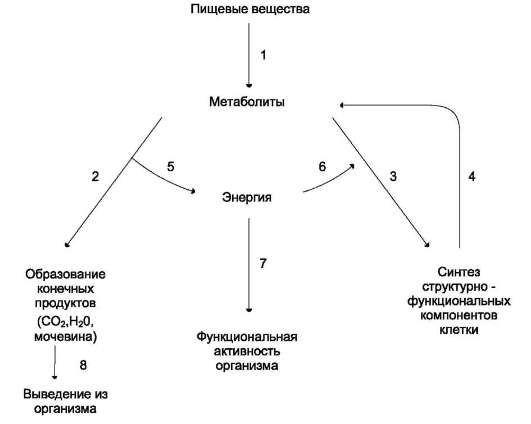
Рис. 6-1. Общая схема обмена веществ и энергии. 1 - пищеварение; 2 - катаболизм; 3 - анаболизм; 4 - распад структурно-функциональных компонентов клеток; 5 - экзергонические реакции; 6, 7 - эндерго-нические реакции; 8 - выведение из организма.
гии системы (ΔG) и изменением энтропии (ΔS) можно представить следующим уравнением:
ΔG
= ΔН - TxS, где ΔН - изменение энтальпии (внутренней энергии или
теплоты, содержащейся в системе); Т - абсолютная температура. В
условиях, при которых протекают биохимические реакции, АН приблизительно
равно ΔЕ (изменению внутренней энергии системы в результате реакции).
Для биологических систем измерение свободной энергии производят обычно
при стандартных условиях, когда рН 7,0, температура
При стандартных условиях все функции обозначают как ΔG0', ΔS0' и ΔН0'. Изменение стандартной свободной энергии (ΔG0') можно вычислить, зная константу равновесия (K'eq) химической реакции.
3. Эндергонические и экзергонические реакции
Направление химической реакции определяется значением AG. Если эта величина отрица-
тельна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоничес-кими. Если при этом абсолютное значение AG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если AG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эн-дергоническими.
Если абсолютное значение AG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При AG, равном нулю, система находится в равновесии (табл. 6-1).
4. Сопряжение экзергонических
и эндергонических процессов в организме
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзер-гонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтри-
Таблица 6-1. Соотношение между величинами K'eq и ΔG0' и направлением химических реакций

фосфата (АТФ), играющего роль сопрягающего фактора.
Рассмотрим подробнее энергетику сопряжённых реакций на примере фосфорилирования глюкозы.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза+ Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой (см. раздел 7), фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции
сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
Б. ХАРАКТЕРИСТИКА ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ. ЦИКЛ АТФ-АДФ
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами (табл. 6-2).
Как видно из табл. 6-2, разные фосфорили-рованные соединения обладают разным запасом свободной энергии. К группе высокоэнергетических фосфатов, помимо АТФ, относят енолфосфаты, ангидриды и фосфогуанидины. Соединения, расположенные в нижней части таблицы, составляют группу низкоэнергетических фосфатов. Центральное место среди этих соединений занимает АТФ (рис. 6-2).
Таблица 6-2. Свободная энергия гидролиза некоторых органических фосфатов
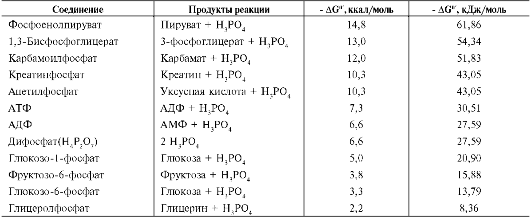
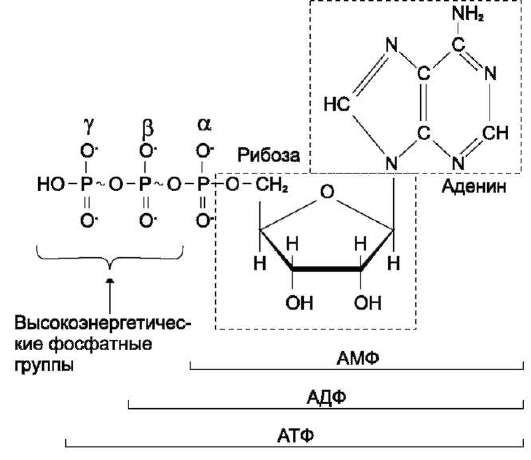
Рис. 6-2. Аденозинтрифосфорная кислота (АТФ).
В молекуле АТФ две высокоэнергетические (макро-эргические) связи β и γ; они обозначены на рисунке знаком ~ (тильда).
АТФ - молекула,
богатая энергией, поскольку она содержит две фосфоангидридные связи (β,
γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в
АДФ и ортофосфат Pi. При этом изменение свободной
энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в
норме (рН 7,0, температура
возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирова-ние глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифос-фатов, аналогов АТФ; к ним относят гуанозин-трифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.
Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений (рис. 6-3). Цикл АТФ-АДФ - основной механизм обмена энер-
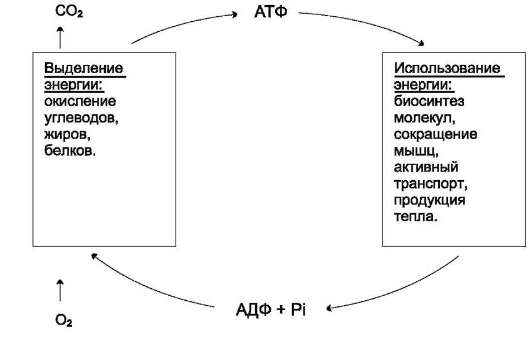
Рис. 6-3. Цикл АТФ-АДФ.
гии в биологических системах, а АТФ - универсальная «энергетическая валюта».
В. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов применим и к биохимическим системам. В любой окислитель-но-восстановительной реакции участвует акцеп-тор электронов (окислитель) и донор электронов (восстановитель). Например:
(1) Си + О → Cu2+O2-.
Суммарную реакцию (1) можно условно разделить на 2 полуреакции (2), (3):
(2) Cu - 2e → Cu2+. (3) О + 2е → О2-.
В каждой из них участвует окисленная и восстановленная форма одного соединения; их называют сопряжённой парой, или редокс-парой.
Разные редокс-пары обладают различным сродством к электрону. Те, у которых это сродство меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокс-пары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Е0'), величина которого непосредственно связана с изменением свободной энергии. Величину Е0' выражают в вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к электронам. Чем больше сродство, тем больше восстановительный потенциал.
Редокс-потенциалы Е0' связаны с изменением свободной энергии уравнением Нернста:
AG0' = - nF ΔЕ0 '
где n - число перенесённых в реакции электронов; F - постоянная Фарадея (23 061 ккал В-1моль-1); ΔЕо' - разность редокс-потенциалов электрон-донорной и электрон-акцепторной пар.
Величина ΔЕо' - стандартная величина окислительно-восстановительного потенциала; её определяют в стандартных условиях, когда кон-
Таблица 6-3. Стандартные окислительно-восстановительные потенциалы некоторых сопряжённых пар

центрации всех веществ равны
Г. ОСНОВНЫЕ ЭТАПЫ ТРАНСФОРМАЦИИ ЭНЕРГИИ КАТАБОЛИЧЕСКИХ ПРОЦЕССОВ
Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в виде тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например NADPH.
Д. ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нём участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О. В дыхательную цепь митохондрий входит большое число переносчиков (рис. 6-4).
За исключением убихинона (КоQ), все компоненты ЦПЭ - белки. В составе этих белков содержатся различные небелковые компоненты: FMN, Fе в составе железо-серных белков и в составе порфириновых колец, ионы Cu.
1. Первичные акцепторы водорода
Первичные акцепторы водорода окислительно-восстановительных реакций относят к 2 типам де-гидрогеназ: никотинамидзависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина (см. раздел 2).
Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADР+ (см. раздел 2). NAD+ и NADР+ - производные витамина РР. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апофер-ментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADР-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид (рис. 6-5).
Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа:
R-CHOH-R1 + NAD+ ↔ R-CO-R1 + NADH + H+.
Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ.
NADРН не является непосредственным донором электронов в ЦПЭ, а используется почти
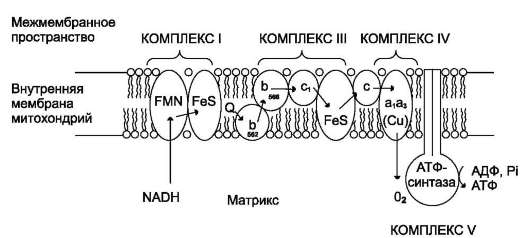
Рис. 6-4. Митохондриальная цепь переноса электронов. Комплекс I содержит FMN и не менее пяти железо-серных белков (FeS). Комплекс III включает две разные формы цитохрома b (с максимумами поглощения 562 и 566), один FeS-белок и цитохром с1. Комплекс IV содержит цитохромы а и а3 и два иона меди. Комплекс II (сукцинатдегидрогеназа) на рисунке не показан (см. рис. 6-13). Комплекс V - АТФ-синтаза.
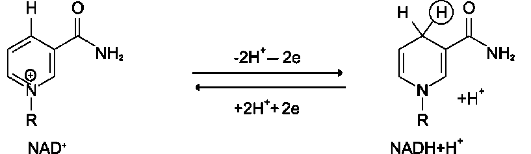
Рис. 6-5. Структурные формулы рабочей части коферментов NAD+ и NADP+. В окисленной форме никотинамид-ные коферменты обозначают как NAD+ и NADP+, так как они несут положительный заряд на атоме азота пиридинового кольца. В реакциях дегидрирования из двух атомов водорода, отщепляемых от окисляемого субстрата, никотинамидное кольцо присоединяет ион водорода и два электрона в форме гидрид-иона (:Н-). Второй ион переходит в среду. В обратной реакции NADH (NADPH) выступают в качестве доноров электронов и протонов.
исключительно в восстановительньгх биосинтезах (см. раздел 8). Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей реакцию:
NADPH + NAD+ ↔ NADP+ + NADH.
Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2 (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система (рис. 6-6).
FAD служит акцептором электронов от многих субстратов в реакциях типа:
R-CH2-CH2-R1 + E (FAD) ↔ R-CH=CH-R1 + E (FADH2),
где Е - белковая часть фермента.
Большинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукци-натдегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим
ферментам принадлежит NADH-дегидрогена-за, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.
2. Цепь переноса электронов от NADH и FADH2 на кислород
Перенос электронов от NADH к О2 включает ряд переносчиков, которые локализованы во внутренней мембране митохондрий. За исключением убихинона и цитохрома С, это сложные белковые комплексы.
NADH-дегидрогеназа (NADH-Q-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль простетической группы играет FMN. Единственный субстрат фермента - NADH, с которого 2 электрона и протон переносятся на FMN с образованием FMNH2. Второй протон поглощается из матрикса. Реакция протекает по уравнению:
NADH + H+ + Е (FMN) → NAD+ + Е (FMNH2).
С FMNH2 электроны переносятся затем на ряд железо-серных белков (FeS), играющих
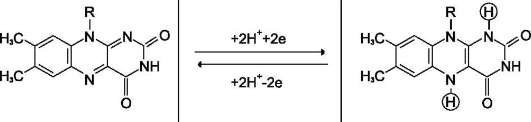
Рис. 6-6. Структурные формулы рабочей части коферментов FAD и FMN. В ходе реакции FAD и FMN присоединяют 2 электрона и, в отличие от NAD+, оба теряемых субстратом протона.
роль второй простетической группы в молекуле NADН-дегидрогеназы. Атомы железа в этих белках (негемовое железо) собраны в несколько групп, так называемых железо-серных центров. FeS-центры входят в состав многих белков (флавопротеинов, цитохромов), участвующих в окислительно-восстановительных реакциях. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в которых атом железа связан с атомом серы остатков цистеина или неорганической серы. Строение железо-серных центров показано на рис. 6-7.
NADН-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4. Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри-(Fe3+) состояния. От железо-серных центров электроны переносятся на кофермент Q (уби-хинон) (рис. 6-8).
Обозначение этого жирорастворимого хинона происходит от первой буквы английского названия хинона (quinone), а название убихинон отражает его широкую распространённость в природе (ubiquitous - вездесущий). Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10. В процессе переноса электронов с NADН-де-гидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADН-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинатдегидрогеназы. Убихинон участвует в реакциях типа:
Е (FMNH2) + Q → E (FMN) + QH2.
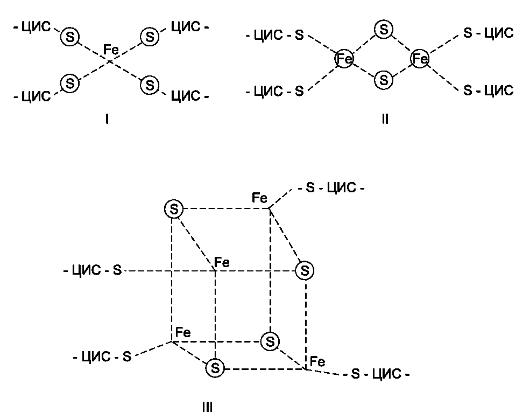
Рис. 6-7. Строение железо-серных центров. I - FeS-центр; атом железа связан координационными связями с четырьмя атомами серы, принадлежащими четырём остаткам цистеина в белке. II - Fe2S2-центр; каждый из двух атомов железа связан координационными связями с двумя атомами неорганической серы и двумя остатками цистеина в белке; III - Fe4S4-центр; четыре атома железа связаны с четырьмя атомами серы и четырьмя остатками цистеина в белке. Атомы железа в FeS-центрах могут находиться в окисленном (Fe3+) или восстановленном (Fe2+) состоянии.
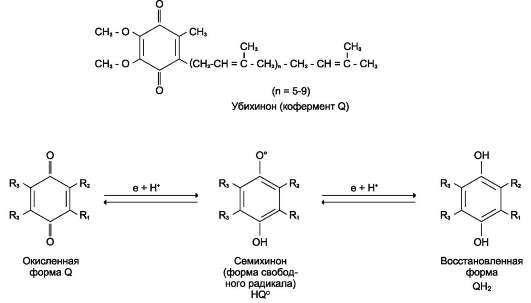
Рис. 6-8. Структура убихинона (кофермента Q). n - число изопреноидных звеньев. Убихинон может принимать один электрон и превращаться в семихинон или 2 электрона и полностью восстанавливаться в гидрохинон (убихинол).
Цитохромы или гемопротеины присутствуют во всех типах организмов. В клетках эукариотов они локализованы в митохондриальных мембранах и в ЭР. Известно около 30 различных цитохромов. Все цитохромы в качестве просте-тической группы содержат гем (см. раздел 1). Их многообразие обусловлено:
• различием боковых цепей в структуре гема;
• различием в структуре полипептидных цепей;
• различием в способе связи полипептидных цепей с гемом.
В зависимости от способности поглощать свет в определённой части спектра все цитохромы делят на группы а, b, с. Внутри каждой группы отдельные виды с уникальными спектральными свойствами обозначают цифровыми индексами
(b, b1, b2 и т.д.).
Структурные особенности разных видов цитохромов определяют различие в их окислительно-восстановительных потенциалах. В ЦПЭ участвуют 5 типов цитохромов (a, a3, b, с, с1).
За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов (табл. 6-4).
QН2-дегидрогеназа (коэнзим Q-цитохром с-редуктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QН2-дегид-рогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы гема, подобно FeS-центрам, переносят только по одному электрону. Таким образом, от молекулы 2 электрона переносятся на 2 молекулы цитохромов b. В качестве промежуточного продукта в этих реакциях переноса электронов возможно образование свободного радикала семихинона. В цитохромах типа b гем не связан ковалентно с белком, а в цитохромах с1 и с он присоединяется к белку при помощи тиоэфир-ных связей (рис. 6-9). Эти связи образуются путём присоединения 2 цистеиновых остатков к винильным группам гема.
Таблица 6-4. Компоненты митохондриальной цепи переноса электронов
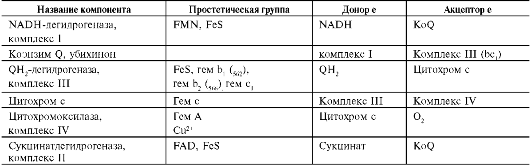
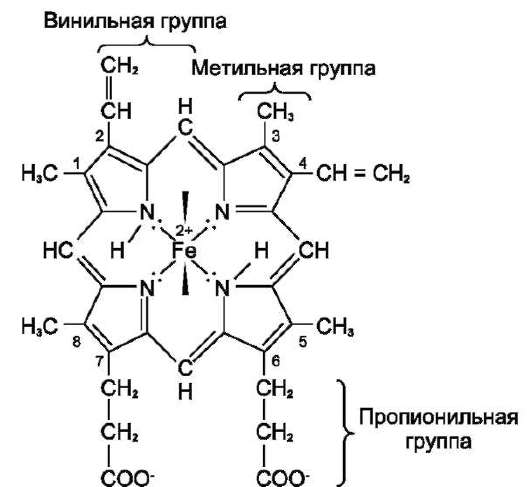
Рис. 6-9. Структура гема цитохромов b, с, с1.
Цитохром с - периферический водорастворимый мембранный белок с молекулярной массой 12 500 Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков, и молекулу гема, ковалентно связанную с полипептидом.
Цитохромоксидаза (комплекс IV) состоит из 2 цитохромов типа аа3, каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют характерную железопорфириновую простетическую группу, называемую гемом А и отличающуюся от гема цитохромов с и с1 (рис. 6-10). Он содержит формильную группу вместо одной из метильных групп и углеводородную цепь вместо одной из винильных групп.
Другая особенность комплекса а-а3 - наличие в нём ионов меди, связанных с белковой частью
в так называемых СиА-центрах. Перенос электронов комплексом a-а3, включает реакции:
Cu+ ↔ Cu2+ + е,
Fe2+ ↔ Fe3+ + e.
Комплекс цитохромов а-а3 непосредственно реагирует с молекулярным кислородом. Некоторые характеристики компонентов ЦПЭ приведены в табл. 6-4.
Е. ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности (векторно). В этой последовательности их стандартные окислительно-восстановительные потенциалы становятся более положительными по мере приближения к кислороду (табл. 6-3, рис. 6-11).
Каждое звено этой цепи специфично в отношении донора и акцептора электронов.
На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат α-гид-роксикислоты малат, изоцитрат, 3-гидрокси-бутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADH-дегидро-геназой (комплекс I).
Если субстратом служат такие соединения, как сукцинат или глицерол-3-фосфат, акцептором водорода служат FAD-зависимые дегидроге-назы. От NADH и FADH2 электроны и протоны
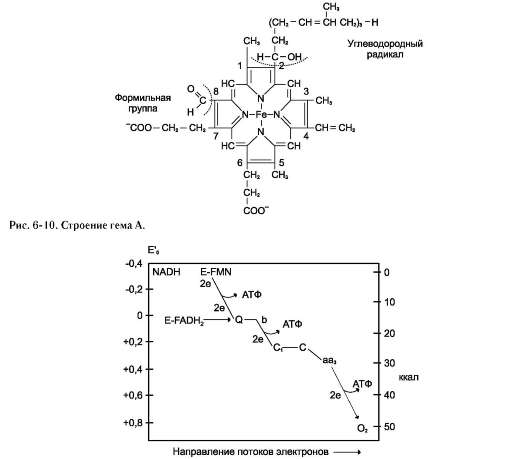
Рис. 6-11. Изменение свободной энергии при переносе электронов по ЦПЭ. E-FMN - комплекс I; E-FAD - комплекс II; b-c1 - комплекс III; aa3 - комплекс IV
передаются на убихинон и далее через цепь цитохромов к молекулярному кислороду.
До сих пор точно неизвестно, каким образом расположены все переносчики электронов дыхательной цепи. Однако установлено, что в расположении дыхательных комплексов существует определённая асимметрия: некоторые из белков-переносчиков находятся ближе к той стороне внутренней мембраны, которая обращена к матриксу, а другие - к противоположной; некоторые белки пронизывают мембрану насквозь (см. рис. 6-4).
Ингибиторы дыхательной цепи
Изучению последовательности переноса электронов способствовало исследование действия специфических ингибиторов, блокирующих определённые этапы этого процесса (рис. 6-12). Переносчики электронов, стоящие в цепи непосредственно перед блокированным этапом, становятся более восстановленными, а стоящие после этого этапа - более окисленными. Это можно обнаружить при помощи спектрофотометра, так как у окисленных и восстановленных форм переносчиков разные спектры поглощения.
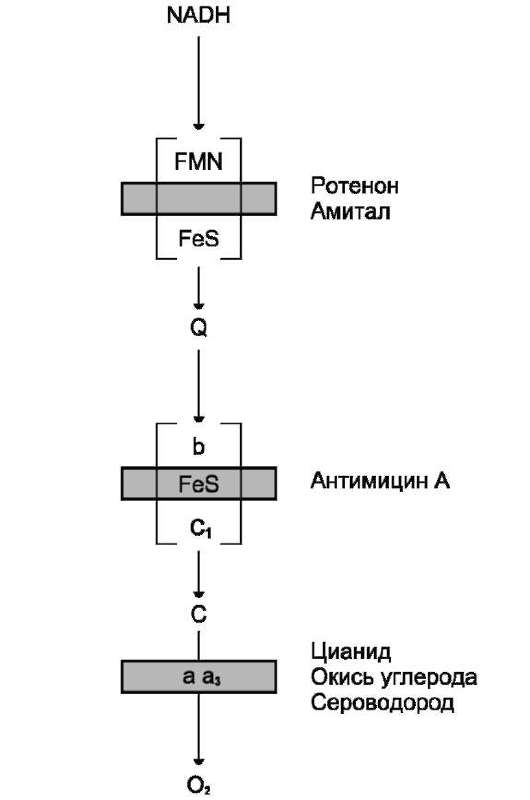
Рис. 6-12. Места действия ингибиторов ЦПЭ. Ингибиторы NADH-дегидрогеназы: ротенон - высокотоксичное вещество, содержащееся в некоторых водорослях и являющееся ядом для рыб; амитал - лекарственный препарат из группы барбитуратов. Ингибитор QH2-дегидрогеназы - антимицин А, токсичный антибиотик, продуцируемый одним из штаммов Streptomyces. Ингибиторы цитохромоксидазы - цианид, СО, H2S. Цианид наиболее токсичен для человека; он присоединяется к Fe3+ цитохромоксидазы и блокирует перенос электронов к кислороду.
II. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ АДФ
Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается снижением свободной энергии.
При сравнении величин электрохимических потенциалов переносчиков электронов (табл. 6-3) видно, что снижение свободной энергии происходит на каждом этапе ЦПЭ, и энергия электронов выделяется порциями.
Вместе с тем в дыхательной цепи можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии (рис. 6-11). Эти этапы способны обеспечить энергией синтез АТФ, так как количество выделяющейся свободной энергии приблизительно равно энергии, необходимой для синтеза АТФ из AДФ и фосфата. Экспериментально было подтверждено, что процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Первый процесс - перенос электронов от восстановленных коферментов NADH и FADH2 через ЦПЭ на кислород - экзергонический. Например:
NADH + H+ + 1/2 O2 → NAD+ + H2O + 52 ккал/моль(=220 кДж/моль).
Второй процесс - фосфорилирование AДФ, или синтез АТФ, - эндергонический:
АДФ + Н3РО4+7,3 ккал/моль (30,5 кДж/моль) = АТФ + Н2О.
Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
А. МЕХАНИЗМ СОПРЯЖЕНИЯ ОКИСЛЕНИЯ
И ФОСФОРИЛИРОВАНИЯ
Каким
же образом осуществляется сопряжение этих двух процессов? Наиболее
обоснованный ответ на этот вопрос даёт хемиосмотическая теория Митчелла,
предложенная им в
1. Протонный градиент и электрохимический потенциал
Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ.
Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при
котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный - на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования (рис. 6-11, 6-13).
Механизм транспорта протонов через мито-хондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса
III (рис. 6-14).
KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q-циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором - цитохром с. Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1, с которого электроны переносятся на цитохром с.
В мембране существует стационарный общий фонд Q/QH2, из которого каждая молекула QH2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-по-тенциала. Энергия электрохимического потенциала (ΔμН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
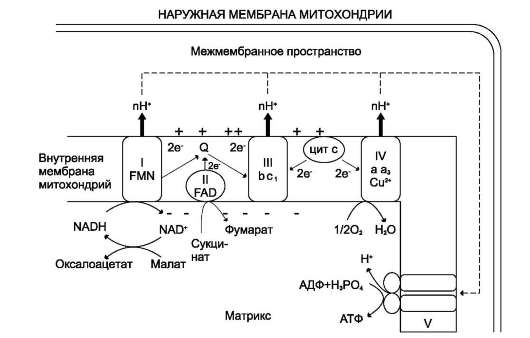
Рис. 6-13. Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинат дегидрогеназа; III - QH2-дегидрогеназа; IV - цитохромоксидаза; V - ЛТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
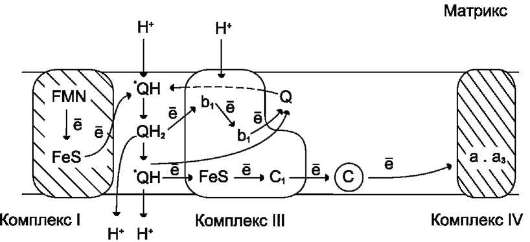
Рис. 6-14. Сопряжение переноса электронов через дыхательный комплекс III с транспортом H+ через мембрану. Восстановленный убихинон (QH2) взаимодействует с Fe3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (HQ*). Электрон от гема b1 переносится на Fe3+ гема b2. HQ* отдаёт второй электрон на FeS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. Окисленный Q диффундирует к внутренней стороне мембраны, где получает электрон от гема b2 и протон из матрикса, превращаясь в HQ*. HQ* получает электрон от комплекса I и протон из матрикса; в мембране образуется QH2, и весь процесс повторяется сначала.
2. Строение АТФ-синтазы и синтез АТФ
АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1 (рис. 6-15).
Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (3α, 3β, γ, ε, δ). Субъединицы α и β уложены попарно, образуя «головку»; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0.
Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμН+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμН+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из AДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал,
генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ.
3. Коэффициент окислительного фосфорилирования
Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование AДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
4. Дыхательный контроль
Окисление субстратов и фосфорилирование AДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду.
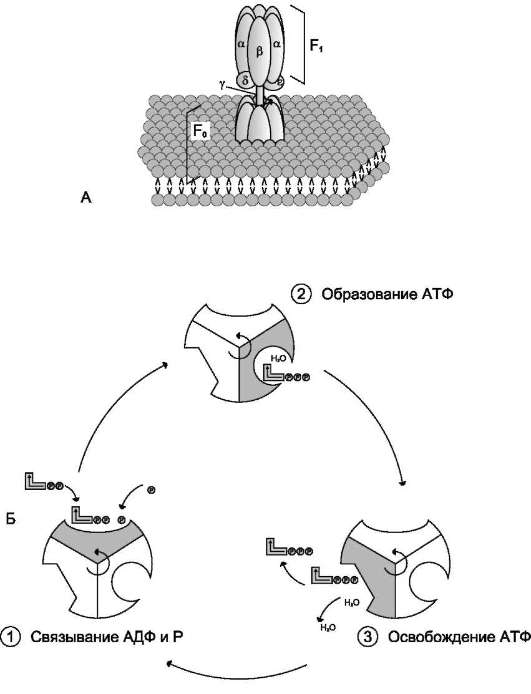
Рис. 6-15. Строение и механизм действия АТФ-синтазы. А - F0 и F1 - комплексы АТФ-синтазы. В состав F0 входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β («головка»), прикрывающие стержневую часть, которая состоит из 3 субъединиц γ, δ и ε. γ и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание AДФ, неорганического фосфата (Р) и АТФ. Б - Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 - связывание АДФ и Н3РО4; 2 - образование фосфоангидридной связи АТФ; 3 - освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ.
С другой стороны, расход АТФ и превращение его в AДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации AДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и AДФ, может меняться в десятки раз.
Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации AДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Б. ТРАНСПОРТ АТФ И АДФ ЧЕРЕЗ МЕМБРАНЫ
МИТОХОНДРИЙ
В большинстве эукариотических клеток синтез основного количества АТФ происходит внутри митохондрии, а основные потребители АТФ расположены вне её. С другой стороны, в матриксе митохондрий должна поддерживаться достаточная концентрация AДФ. Эти заряженные молекулы не могут
самостоятельно пройти через липидный слой мембран. Внутренняя мембрана непроницаема для заряженных и гидрофильных веществ, но в ней содержится определённое количество транспортёров, избирательно переносящих подобные молекулы из цитозоля в матрикс и из матрикса в цитозоль.
В мембране есть белок АТФ/AДФ-антипор-тер, осуществляющий перенос этих метаболитов через мембрану (рис. 6-16). Молекула АДФ поступает в митохондриальный матрикс только при условии выхода молекулы АТФ из матрикса.
Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ. Расчёты показывают, что на транспорт АТФ и AДФ расходуется около четверти свободной энергии протонного потенциала. Другие транспортёры тоже могут использовать энергию электрохимического градиента. Так переносится внутрь митохондрии неорганический фосфат, необходимый для синтеза АТФ. Непосредственным источником свободной энергии для транспорта Са2+ в матрикс также служит протонный потенциал, а не энергия АТФ.
В. РАЗОБЩЕНИЕ ДЫХАНИЯ
И ФОСФОРИЛИРОВАНИЯ
Некоторые химические вещества (протонофо-ры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства
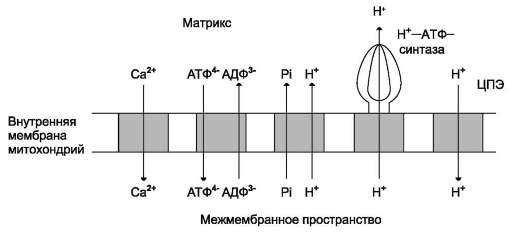
Рис. 6-16. Схема трансмембранного переноса веществ за счёт энергии АцН. Потоки различных веществ (АТФ, AДФ, Н3РО4, Са2+) проходят через специфические транспортёры, при этом затрачивается энергия электрохимического потенциала мембраны.
через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а увеличивается. В этом случае скорость окисления NADH и FADH2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - ли-пофильные вещества, легко проходящие через ли-пидныгй слой мембраны. Одно из таких веществ - 2,4-динитрофенол (рис. 6-17), легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт (см. раздел 14) или метаболиты, которые образуются в организме, билирубин - продукт катаболизма гема (см. раздел 13), тироксин - гормон щитовидной железы (см. раздел 11). Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
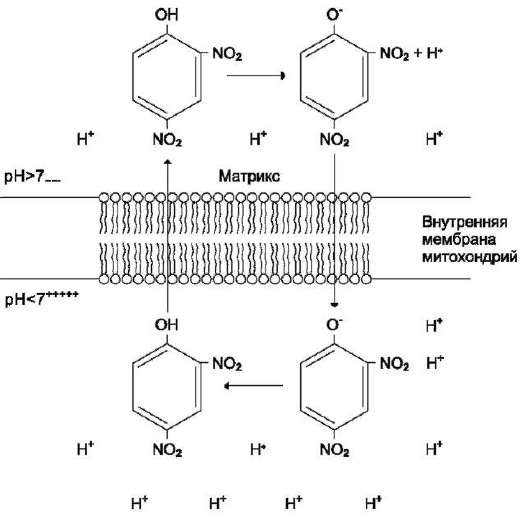
Рис. 6-17. Механизм разобщения дыхания и фос-форилирования. Протонированная форма 2,4-ди-нитрофенола переносит протоны через внутреннюю мембрану митохондрий и препятствует образованию протонного градиента.
Г. ТЕРМОРЕГУЛЯТОРНАЯ ФУНКЦИЯ ЦПЭ
Hа синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирова-ния может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зим-неспящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к ATФ/AДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями (рис. 6-18).
Hа внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью ATФ/AДФ-антипортера.
При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира
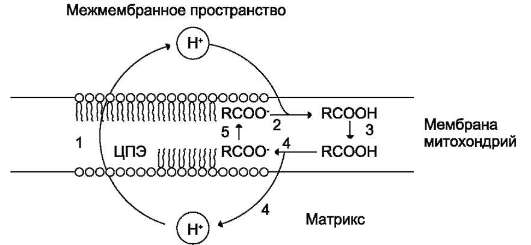
Рис. 6-18. Механизм разобщающего действия жирных кислот. 1- выкачивание протонов дыхательной цепью; 2 - протонирование аниона жирной кислоты; 3 - диффузия протонированной жирной кислоты к внутренней поверхности мембраны; 4 - диссоциация RCOOH с образованием RCOO- и иона Н+; 5 - перенос RCOO- посредством АТФ/АДФ-антипортера или разобщающего белка к наружной поверхности митохондри-альной мембраны.
из жировых депо (см. раздел 8). Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.
iii. заключительный этап катаболизма - основной источник доноров водорода для цпэ
Углеводы, жирные кислоты и большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до СО2 и Н2О. Прежде чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА (рис. 6-19). Именно в этой форме большая часть «топливных» молекул включается в цикл лимонной кислоты.
Ацетил-КоА образуется в специфических реакциях катаболизма жирных кислот и некоторых аминокислот (см. разделы 8 и 9). Однако главным источником ацетил-КоА служит пиро-виноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот (см. разделы 7, 9).
Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединённых в пируватдегидрогеназный комплекс (ПДК). Ацетильный остаток -
ацетил-КоА далее окисляется в цикле лимонной кислоты до СО2 и Н2О. В этих реакциях окисления принимают участие NAD- и FAD-зависимые дегидрогеназы, поставляющие электроны и протоны в ЦПЭ, по которой они передаются на О2.
А. ОКИСЛИТЕЛЬНОЕ
ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА
Окислительное декарбоксилирование пи-рувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный мат-рикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+ (рис. 6-20).
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSKoA → СН3-СО ~ SKоА + NADH + H+ + СО2.
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил-КоА. Один атом водорода оказывается в составе NADH, а другой в виде H+ поступает в среду. Реакция необратима, поскольку AG0'= -33,5 кДж/моль.
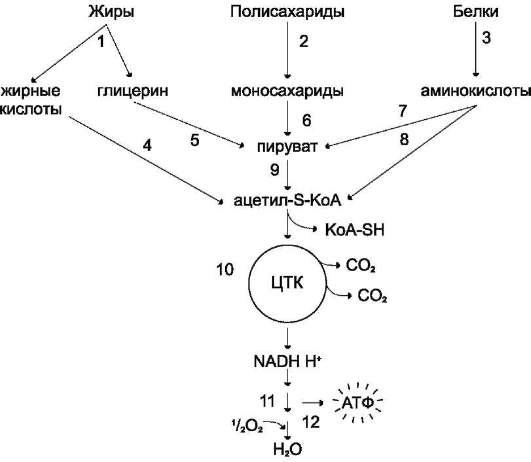
Рис. 6-19. Катаболизм основных пищевых веществ. 1-3 - пищеварение; 4-8 - специфические пути катаболизма; 9-10 - заключительный (общий путь) катаболизма; 11 - ЦПЭ; 12 - окислительное фосфори-лирование.
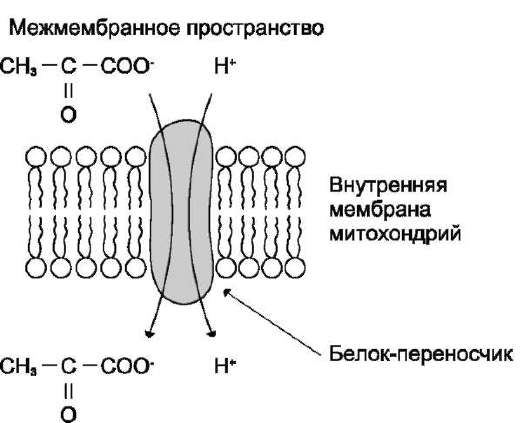
Матрикс
Рис. 6-20. Транспорт пирувата через митохондри-альную мембрану.
1. Строение пируватдегидрогеназного комплекса
Процесс окислительного декарбоксилиро-вания пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс.
В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидро-липоилдегидрогеназа (Е3), а также 5 кофермен-тов: тиаминдифосфат (ТДФ), липоевая кислота, FAD, NAD+ и KoA. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза (табл. 6-5).
Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6х106.
В центре комплекса располагается дигидро-липоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигид-ролипоилдегидрогеназы (Е3).
Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидро-липоилдегидрогеназа - FAD.
Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные «кронштейны», переносящие атомы водорода
Таблица 6-5. Пируватдегидрогеназный комплекс (ПДК) млекопитающих

и ацетильные группы от одной ферментной молекулы комплекса к другой.
2. Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА включает 5 стадий (рис. 6-21).
Стадия I. На этой стадии пируват соединяется
с ТДФ в составе Е1 и подвергается декар-
боксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + СО2.
В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце (рис. 6-22).
Стадия II. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием аце-тилтиоэфира липоевой кислоты (рис. 6-21).
Стадия III. Hа стадии III KoA взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, про-стетическая группа Е2 (рис. 6-23).
Стадия IV. Hа стадии IV дигидролипоилдегид-рогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3.
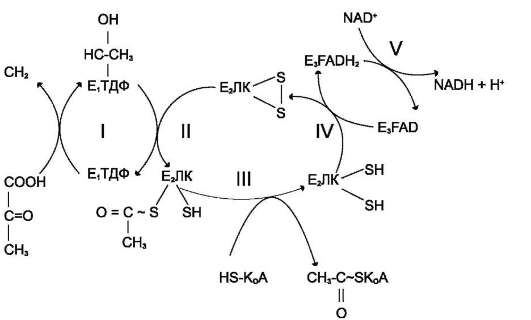
Рис. 6-21. Последовательность реакций, катализируемых ПДК. I - Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ; II - Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК); III - ацетилированная дигидролипоилтрансацетилаза взаимодействует с KoA с образованием восстановленной формы липоевой кислоты и ацетил-КоА; IV - окисленная форма транс-ацетилазы регенерируется при участии Е3; V - окисленная форма Е3 регенерируется при участии NAD+.
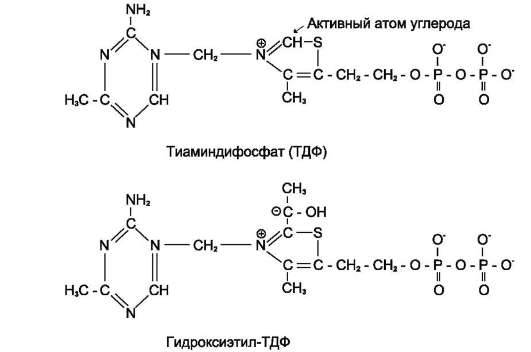
Рис. 6-22. Тиаминдифосфат (ТДФ) и гидроксиэтил-ТДФ. Рабочей частью ТДФ служит тиазоловое кольцо, к которому присоединяется продукт декарбоксилирования пирувата - гидроксиэтил.
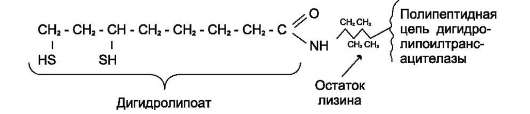
Рис. 6-23. Липоевая кислота в составе дигидролипоилтрансацетилазы (Е2). Липоевая кислота или липоильная группа могут существовать в окисленной (дисульфидной ЛК-SS) и восстановленной (ЛК-(SН)2) формах. В составе дигидролипоилтрансацетилазы липоевая кислота связана с белком через остаток лизина амидной связью. Липоевая кислота играет роль витамина или фактора роста у некоторых микроорганизмов, тогда как высшие животные способны её синтезировать.
Стадия V. Hа стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофер-мента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата
прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДHK. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока, или шаперонов (см. раздел 1), предотвращающих их преждевременный фолдинг до поступления в митохонд-риальный матрикс или внутреннюю мембрану митохондрий.
3. Связь окислительного декарбоксилирования пирувата с ЦПЭ
Окислительное декарбоксилирование пи-рувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфо-рилирования.
Так как отношения AДФ/ATФ и NADH/NAD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации AДФ и ускорению окисления NADH в дыхательной цепи. Повышение концентрации NAD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NADH снижает скорость этого процесса. Таким образом, изменения отношений AДФ/ATФ и NADH/ NAD+ - важнейшие сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксили-
рования пирувата. Каталитическая активность пируватдегидрогеназного комплекса снижается, когда в клетках имеется достаточно «топлива» в виде жирных кислот и ацетил-КоА.
Б. ЦИКЛ ЛИМОННОЙ КИСЛОТЫ
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка аце-тил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых де-гидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в аце-тил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций (рис. 6-24).
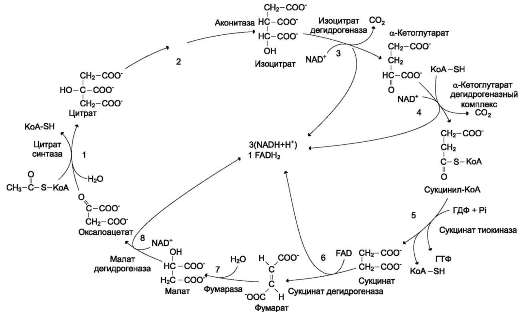
Рис. 6-24. Общая схема цитратного цикла. Цифры 1-8 обозначают реакции цитратного цикла. Цикл начинается с того, что ацетильный остаток конденсируется с оксалоацетатом, в результате чего образуется шестиуглеродное соединение - цитрат. На образование цитрата в каждом обороте цикла расходуется одна молекула оксалоаце-тата; в результате завершения цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков.
1. Последовательность реакций цитратного цикла
Образование цитрата
В реакции образования цитрата углеродный атом метильной группы ацетил-КоА связывается с карбонильной группой оксалоацетата (рис. 6-24); одновременно расщепляется тио-эфирная связь и освобождается коэнзим А (AG0'= -37,6 кДж/моль).
Равновесие реакции в клетке сильно сдвинуто вправо, о чём свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий.
Превращение цитрата в изоцитрат
Вторая реакция цитратного цикла - обратимое превращение цитрата в изоцитрат (рис. 6-24). Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции.
Окислительное декарбоксилирование изоцитрата
Эту реакцию катализирует изоцитратдегидро-геназа. Существуют 2 формы изоцитратдегидро-геназы: одна содержит в качестве кофермента NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и в цитоплазме, играет иную метаболическую роль. В результате действия этого фермента на изоцитрат образуется α-кетоглутарат (см. рис. 6-24).
Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. AДФ - аллостери-ческий активатор фермента.
Окислительное декарбоксилирование α-кето-глутарата
В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образо-
ванием в качестве конечных продуктов сукцинил-КоА, СО2 и NADH + H+. В результате этой реакции образуется сукцинил-КоА (см. рис. 6-24).
Реакцию катализирует α-кетоглутаратдегид-рогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК). Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигид-ролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD. Существенное отличие этой ферментной системы от ПДК - то, что она не имеет сложного механизма регуляции, какой характерен для ПДК. В частности, в этом комплексе отсутствуют регуляторные субъединицы. Равновесие реакции окислительного декарбок-силирования α-кетоглутарата сильно сдвинуто в сторону образования сукцинил-КоА, и её можно считать однонаправленной.
Превращение сукцинил-КоА в сукцинат
Сукцинил-КоА - высокоэнергетическое соединение. Изменение свободной энергии гидролиза этого тиоэфира составляет AG0'= -35,7 кДж/моль. В митохондриях разрыв тиоэфирной связи сукци-нил-КоА сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозин-трифос-
фата (ГТФ).
Сукцинил-КоА → Сукцинат (ΔG0 = -10,36 кДж/моль).
Эту сопряжённую реакцию (см. рис. 6-24) катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием
ГТФ.
С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием ATФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа.
ГТФ + АДФ ↔ ГДФ + АТФ.
Образование высокоэнергетической фосфо-ангидридной связи за счёт энергии субстрата (сукцинил-КoA) - пример субстратного фос-форилирования.
Дегидрирование сукцината
Образовавшийся на предыдущем этапе сук-цинат превращается в фумарат под действием сукцинатдегидрогеназы (см. рис. 6-24). Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD.
Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, а другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
Образование малата из фумарата
Образование малата происходит при участии фермента фумаратгидратазы (см. рис. 6-24). Этот фермент более известен как фумараза.
Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата.
Дегидрирование малата
В заключительной стадии цитратного цикла малат дегидрируется с образованием оксало-ацетата (см. рис. 6-24). Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Тем не менее, в интак-тных клетках эта реакция идёт слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазной реакции. В цитозоле содержится изоформа малат-дегидрогеназы, также NAD-зависимая, но не принимающая участие в цитратном цикле. Обе изоформы малатдегидрогеназы - димеры.
2. Общая характеристика и энергетическое значение цитратного цикла
Образованием оксалоацетата завершается один оборот цитратного цикла. В одном обороте цикла лимонной кислоты в 2 реакциях де-карбоксилирования (превращение изоцитрата в α-кетоглутарат и α-кетоглутарата в сукцинил-
КоА) происходит образование 2 молекул СО2. В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NADH+H+ и 1 молекулы FADH2 в составе сукцинатдегидрогеназы.
Наконец, на один оборот цикла затрачивается 2 молекулы воды: одна - на стадии образования цитрата, вторая - на стадии гидратации фумарата.
Восстановленные коферменты (3 молекулы NADH и 1 молекула FADH2), образованные в цикле лимонной кислоты, отдают электроны в ЦПЭ на кислород - конечный акцептор электронов. Восстановленный кислород взаимодействует с протонами с образованием воды.
На каждую молекулу NADH при образовании молекулы воды в процессе тканевого дыхания синтезируются 3 молекулы ATФ, а на каждую молекулу FADH2 - 2 молекулы АТФ (рис. 6-25).
Таким образом, каждый оборот цикла лимонной кислоты сопровождается синтезом 11 молекул АТФ путём окислительного фосфо-рилирования. Одна молекула АТФ образуется путём субстратного фосфорилирования.
В итоге на каждый ацетильный остаток, включённый в цитратный цикл, образуется 12 молекул
3. Регуляция общего пути катаболизма
Скорость синтеза АТФ строго соответствует энергетическим потребностям клетки. Это достигается согласованной регуляцией всех этапов заключительного пути катаболизма, включающего превращение пирувата в ацетил-КоА, цитратный цикл и ЦПЭ. В большинстве тканей, где главная функция общего пути катаболизма - обеспечение клетки энергией, важную роль в регуляции играет дыхательный контроль.
Увеличение скорости утилизации АТФ для совершения различных видов работы увеличивает концентрацию АДФ, что ускоряет окисление NADH в ЦПЭ и, следовательно, повышает скорость реакций, катализируемых NAD-зави-симыми дегидрогеназами. Окисление пирувата и ацетил-КоА может происходить только в том случае, если электроны и протоны от NADH и FADH2 поступают в ЦПЭ. Таким образом, отношения AДФ/ATФ и NADH/NAD+ - главные модуляторы скорости реакций общего пути катаболизма (ОПК).
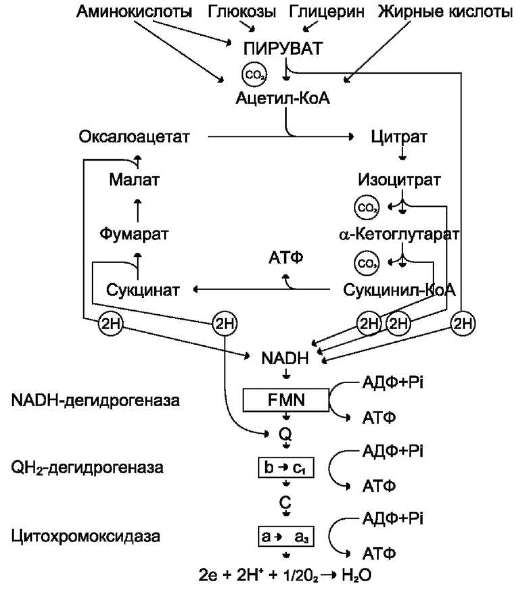
Рис. 6-25. Схема взаимосвязи общего пути катаболизма и ЦПЭ.
Как известно, скорость метаболических путей, которые должны обеспечивать постоянный уровень конечных продуктов, таких, как АТФ, регулируется на уровне реакций, катализируемых регуляторными ферментами. На заключительном этапе катаболизма наиболее важные регуляторные ферменты - пируватдегидроге-назный комплекс, цитратсинтаза, изоцитратде-гидрогеназа и α-кетоглутаратдегидрогеназный комплекс.
Регуляция пируватдегидрогеназного комплекса. Регуляция на уровне ПДК имеет важное значение для обеспечения цитратного цикла «топливными» молекулами ацетил-КоА.
Образование ацетил-КоА из пирувата - необратимый ключевой этап метаболизма. Животные не способны к превращению ацетил-КоА в глюкозу. Активность пируватдегидрогеназного комплекса регулируется различными способами: доступностью субстратов, ингибированием продуктами реакции, аллостерически и путём ковалентной модификации.
Ковалентная модификация ПДК осуществляется фосфорилированием и дефосфорили-рованием. В состав ПДК входят 2 регуляторных субъединицы. Одна из них, киназа ПДК, фос-форилирует ПДК в определённых участках по остаткам серина. При фосфорилировании ПДК инактивируется. Другая регуляторная субъединица, фосфатаза, дефосфорилирует фермент, превращая его в активную форму (рис. 6-26).
При повышении концентрации AДФ ПДК находится в нефосфорилированной активной форме. Этот эффект усиливается в некоторых клетках при повышении концентрации внутриклеточного Са2+, который активирует фосфатазу ПДК. Такой механизм активации ПДК особенно важен в мышцах и жировой ткани.
Продукты пируватдегидрогеназной реакции (ацетил-КоА и NADH) аллостерически активируют киназу ПДК. Активированная киназа фосфорилирует и инактивирует ПДК. Таким образом, при накоплении NADH и ацетил-КоА тормозится превращение пирувата в ацетил-
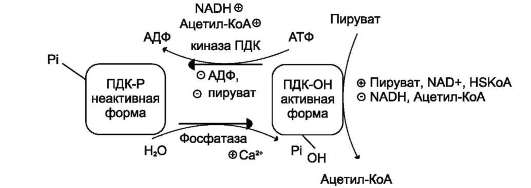
Рис. 6-26. Регуляция пируватдегидрогеназного комплекса. ПДК аллостерически активируется АДФ, NAD+, КоА, Cа2+ и пируватом; ацетил-КоА, NADH и АТФ активируют киназу и ингибируют ПДК. Фосфатаза активируется Cа2+.
КоА. Такая ситуация создаётся, например, в печени при голодании: из жировых депо в печень поступают жирные кислоты, из которых образуется ацетил-КоА. В присутствии высокомолекулярных жирных кислот ингибирование ПДК усиливается. Пируват при этом не окисляется и может быть использован для синтеза глюкозы (см. раздел 7).
Пируват аллостерически активирует нефос-форилированную форму ПДК, действуя согласованно с другими субстратами - NAD и KoA. Активация ПДК происходит также под влиянием инсулина. Один из эффектов инсулина - повышение концентрации внутримитохондриального Са2+. При повышении концентрации Са2+ ПДК активируется (см. рис. 6-26). Этот механизм особенно важен в жировой ткани, где ацетил-КоА необходим для синтеза жирных кислот (см. раздел 8). В клетках миокарда ПДК активируется адреналином, однако это влияние адреналина не связано с изменением концентрации цАМФ.
Регуляция цитратного цикла. В большинстве случаев скорость реакций в метаболических циклах определяется их начальными реакциями. В ЦТК важнейшая регуляторная реакция - образование цитрата из оксалоацетата и аце-тил-КоА, катализируемая цитратсинтазой. Эта реакция ускоряется при повышении концентрации оксалоацетата - субстрата реакции и тормозится продуктом реакции - цитратом. Когда отношение NADH/NAD+ снижается, скорость окисления малата в оксалоацетат возрастает. Повышение концентрации оксалоацетата ускоряет цитратсинтазную реакцию. Скорость реакции снижается при повышении концентрации АТФ,
сукцинил-КоА и длинноцепочечных жирных кислот. Однако точный механизм влияния этих метаболитов на цитратсинтазу недостаточно ясен (рис. 6-27).
Изоцитратдегидрогеназа, олигомерный фермент, состоит из 8 субъединиц. Присоединение изоцитрата к первой субъединице вызывает кооперативное изменение конформации других, увеличивая скорость присоединения субстрата. Фермент аллостерически активируется AДФ и Са2+, которые присоединяются к ферменту в разных аллостерических центрах. В присутствии AДФ конформация всех субъединиц меняется таким образом, что связывание изоцитрата происходит значительно быстрее. Таким образом, при концентрации изоцитрата, которая существует в митохондриальном матриксе, небольшие изменения концентрации AДФ могут вызвать значительное изменение скорости реакции. Увеличение активности изоцитратдегидрогеназы снижает концентрацию цитрата, что, в свою очередь, уменьшает ингибирование цитратсинтазы продуктом реакции. При повышении концентрации NADH активность фермента снижается.
α-Кетоглутаратдегидрогеназный комплекс, имеющий сходное строение с пируватдегидро-геназным, в отличие от последнего, не имеет в своём составе регуляторных субъединиц. Главный механизм регуляции α-кетоглутарат-дегидрогеназного комплекса - ингибирование реакции NADH и сукцинил-КоА.
α-Кетоглутаратдегидрогеназный комплекс, как и изоцитратдегидрогеназа, активируется Са2+, а при повышении концентрации АТФ скорости обеих реакций снижаются.
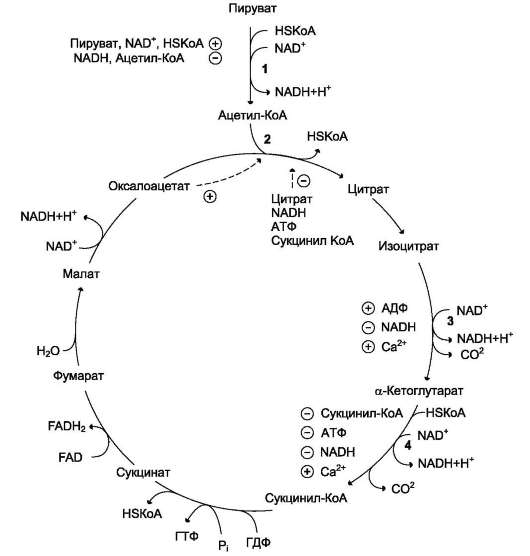
Рис. 6-27. Регуляция общего пути катаболизма. 1 - ПДК активируется пируватом, NAD+, KoA; ингибируется NADH и ацетил-КоА; 2 - цитратсинтаза (реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADH, АТФ и сукцинил-КоА); 3 - изоцитратдегидрогеназа аллостерически активируется АДФ, ионами кальция, ингибируется NADH; 4 - a-кетоглутаратдегидрогеназный комплекс ингибируется NADH, АТФ и сукцинил-КоА, а активируется ионами кальция.
В регуляции цитратного цикла существует множество дополнительных механизмов, обеспечивающих необходимый уровень метаболитов и их участие в других метаболических путях.
Компартментализация ферментов, участвующих в реакциях окислительного декар-боксилирования пирувата и цикла лимонной кислоты, играет важную роль в регуляции этих процессов.
Внутренняя мембрана митохондрий непроницаема для анионов и катионов, в том числе и для промежуточных продуктов цитратного цикла, которые могут быть перенесены через мембрану только при участии специальных белков. Поэтому ферменты цитратного цикла имеют больше возможностей для взаимодействия с продуктами предыдущих реакций, чем в случае свободного удаления этих продуктов из митохондрий.
Доступность субстратов возрастает также в результате образования ферментных комплексов. Малатдегидрогеназа и цитратсинтаза образуют непрочные комплексы, в которых цитратсинтаза может использовать оксалоацетат, непосредственно образующийся малатдегидрогеназой.
В ПДК и α-кетоглутаратдегидрогеназном комплексе субстраты непосредственно передаются от одного фермента к другому: только трансацилаза может взаимодействовать с промежуточным продуктом, связанным с ТДФ, а дигидролипоилдегидрогеназа - с дигидроли-поевой кислотой.
NAD+, NADH, КоА, ацетил-КоА и сукцинил-КоА не имеют транспортных белков в мембране митохондрий. Поэтому эти соединения не могут пройти через митохондриальную мембрану.
Накопление ацил-КоА производных, таких как ацетил-КоА или сукцинил-КоА, в митохон-дриальном матриксе ингибирует другие реакции, для которых необходим KoA.
Тесная связь цитратного цикла и ЦПЭ поддерживается благодаря использованию в этих реакциях общего фонда NAD+ и NADH.
В. АНАБОЛИЧЕСКИЕ ФУНКЦИИ ЦИТРАТНОГО ЦИКЛА
Цикл лимонной кислоты - один из амфи-болических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продук-
тов СО2 и Н2О, но и происходит образование субстратов для других метаболических путей
(рис. 6-28).
Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот (см. раздел 9).
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохонд-риальный фермент - пируваткарбоксилаза.
CH3 - CO - COOH + CO2 + АТФ->
HOOC - CO - CH2 - COOH + АДФ + H3PO4.
Пируваткарбоксилаза - сложный олигомер-ный фермент. Молекула фермента содержит 4 простетические группы, представленные био-тином (см. раздел 3), который ковалентно связан амидной связью с ε-аминогруппами остатков лизина, находящегося в активном центре фермента (рис. 6-29).
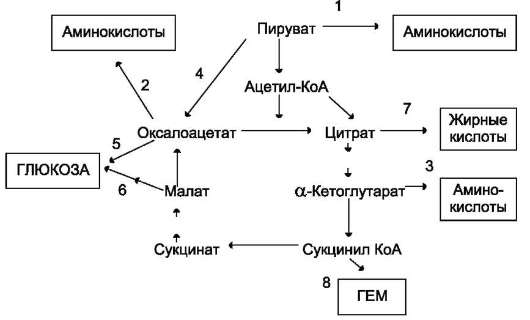
Рис. 6-28. Использование метаболитов ЦТК в синтезе различных соединений. Синтез заменимых аминокислот (1, 2, 3), глюкозы (4, 5, 6), жирных кислот (7), гема (8).
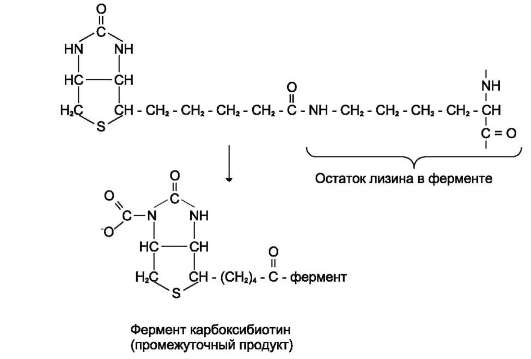
Рис. 6-29. Простетическая группа пируват карбоксилазы. Карбоксильная группа биотина образует амидную связь с ε-аминогруппой лизина в активном центре фермента. СО2 активируется, образуя N-карбоксипроизвод-ное биотина.
Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ.
Реакция протекает в 2 стадии. На первой стадии происходит активация СО2 путём присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом
АТФ.
АТФ + СО2+ Е-биотин + Н2О → AДФ + Н3РО4 + Е-биотин-СОО- + 2 Н+.
На второй стадии активированная карбоксильная группа переносится на пируват.
Е-биотин-СОО- + Пируват → Е-биотин + Окса-лоацетат.
Пируваткарбоксилаза - регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование окса-лоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного
скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ (см. разделы 8, 10, 11). Два метаболита цитратного цикла могут дегидрироваться при участии NADP-зависимых дегидрогеназ: малата и изоцитрата. Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик-фермент), катализирующая реакцию:
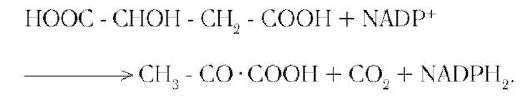
Малат и изоцитрат обеспечивают образование около половины общего фонда NADPH, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы (см. раздел 7).
Г. ГИПОЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности.
Клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и K+, для проведения нервного импульса; почки используют АТФ в процессе ре-абсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз (табл. 6-6).
Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд.
Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ.
Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки.
Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические». Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия.
Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобрё-тенные нарушения структуры гемоглобина (см.
разделы 1, 4).Частой причиной гипоэнергетичес-ких состояний могут быть нарушения процессов использования кислорода в клетках.
Причинами этих нарушений могут быть:
• действие ингибиторов и разобщителей в ЦПЭ;
• железодефицитные анемии;
• снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушаются перенос электронов и синтез АТФ;
• наследственные дефекты ферментов ЦПЭ и цитратного цикла.
Примерно 13 из 100 белков, участвующих в окислительном фосфорилировании, кодируются митохондриальной ДНК: 7 субъединиц комплекса I, субъединица комплекса III, 3 субъединицы комплекса IV и 2 субъединицы комплекса V, а также необходимые компоненты их трансляции. Остальные митохондриальные белки синтезируются в ядре.
Ядерная ДНК кодирует более 70 субъединиц белков, участвующих в окислительном фосфори-лировании. Нарушения окислительного фосфо-рилирования в основном связаны с мутациями в митохондриальной ДНК, которые случаются примерно в 10 раз чаще, чем в ядерной. Ткани с высокой потребностью в АТФ (ЦНС, скелетные мышцы, миокард, почки и печень) наиболее чувствительны к нарушениям окислительного фосфорилирования.
Дефекты митохондриальной ДНК наследуются по материнской линии, так как митохондрии из клеток сперматозоидов не проникают в оплодотворённую яйцеклетку. Мутации митохондриальной ДНК - частая причина, так как митохондрии не имеют такой же эффективной системы репарации ДНК, как ядро (см. раздел 4). Даже у здоровых индивидуумов
Таблица 6-6. Скорость потребления О2 и АТФ в некоторых тканях

соматические мутации снижают с возрастом возможности окислительного фосфорилирования. В этих случаях способность к синтезу АТФ ниже тканеспецифического уровня нормальных клеток.
iv. образование токсичных форм кислорода в цпэ
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигена-зы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот (см. раздел 9), синтезе жёлчных кислот и стероидов (см. разделы 8, 11), в реакциях обезвреживания чужеродных веществ в печени (см. раздел 12).
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
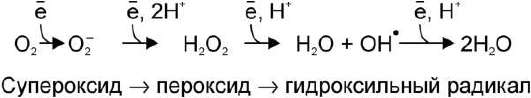
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки (рис. 6-30).
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их
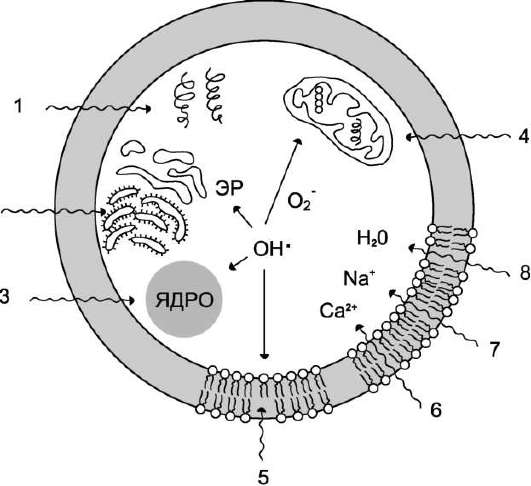
Рис. 6-30. Повреждающее действие свободных радикалов на компоненты клетки. 1 - разрушение белков; 2 - повреждение ЭР; 3 - разрушение ядерной мембраны и повреждение ДНК; 4 - разрушение мембран митохондрий; 5 - ПОЛ клеточной мембраны; 6, 7, 8 - проникновение в клетку воды и ионов.
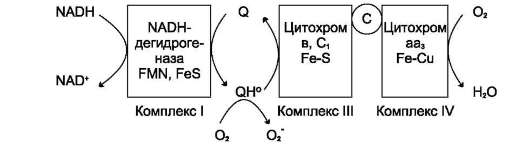
Рис. 6-31. Образование супероксида в ЦПЭ. «Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала. Комплекс II на рисунке не указан.
в новые свободные радикалы, инициируя цепные окислительные реакции (см. раздел 8).
Большая часть активньгх форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QН2-дегидрогена-зного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с (Н2 на кислород (рис. 6-31).
В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохро-моксидазы (комплекс IV) «утечка» электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Cu и восстанавливающих О2 без освобождения промежуточных свободных радикалов.
В фагоцитирующих лейкоцитах (грануло-цитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый «респираторный взрыв» с образованием активных форм кислорода (см. раздел 14).
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатионпероксидазы, а также с действием антиоксидантов (см. раздел 8).