Биохимия: учебник для вузов/ под ред. Е.С.Северина - 5-е изд., - 2009. - 768 с.
|
|
|
|
РАЗДЕЛ 4 БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ (МАТРИЧНЫЕ БИОСИНТЕЗЫ). ОСНОВЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
Нуклеиновые кислоты - высокомолекулярные соединения со строго определённой линейной последовательностью мономеров. Структура ДНК и РНК - способ «записи информации», обеспечивающий формирование в организме двух информационных потоков. Один из потоков осуществляет воспроизведение информации, заключённой в молекулах ДНК. Удвоение молекул ДНК называют «репликация». В результате этого процесса и последующего деления дочерние клетки наследуют геном родительской клетки, в котором содержится полный набор генов, или «инструкций» о строении РНК и всех белков организма.
Второй поток информации реализуется в процессе жизнедеятельности клетки. В этом случае происходит «считывание», или транскрипция, генов в форме полинуклеотидных последовательностей мРНК и использование их в качестве матриц для синтеза соответствующих белков. В последнем случае осуществляется «перевод» (трансляция) информации, заключённой в мРНК, на «язык» аминокислот. Этот поток информации от ДНК через РНК на белок получил название «центральная догма биологии». Он характерен для всех живых организмов, за исключением некоторых РНК-содержащих вирусов.
Матричная природа синтеза нуклеиновых кислот и белков обеспечивает высокую точность воспроизведения информации. Так, в ходе репликации дочерние молекулы ДНК синтезируются на нитях материнской ДНК. При образовании всех видов РНК, необходимых для синтеза белков, информация об их структуре «считывается» с определённых генов в молекулах ДНК. В синтезе новых молекул белков матрицей, содержащей информацию об их строении, являются мРНК.
Исправление ошибок, возникающих в структуре ДНК под воздействием факторов внешней и внутренней среды, осуществляет ещё один матричный синтез - репарация. Он является ва-
риантом ограниченной репликации и восстанавливает первоначальную структуру ДНК, используя в качестве матрицы участок неповреждённой нити ДНК. При размножении РНК-содержащих вирусов в клетках эукариотических организмов новые молекулы ДНК могут синтезироваться с помощью процесса, в ходе которого РНК служит матрицей для синтеза комплементарной ДНК, которая может включаться в геном высших организмов (обратная транскрипция).
I. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ НУКЛЕИНОВЫХ КИСЛОТ
В каждом живом организме присутствуют 2 типа нуклеиновых кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК). Молекулярная масса самой «маленькой» из известных нуклеиновых кислот - транспортной РНК (тРНК) составляет примерно 25 кД. ДНК - наиболее крупные полимерные молекулы; их молекулярная масса
варьирует от 1 000 до 1 000 000 кД. ДНК и РНК
состоят из мономерных единиц - нуклеотидов, поэтому нуклеиновые кислоты называют поли-нуклеотидами.
А. СТРОЕНИЕ НУКЛЕОТИДОВ
Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклео-зидтрифосфаты (НТФ) (рис. 4-1).
В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Нумерация атомов в основаниях записывается внутри цикла (рис.
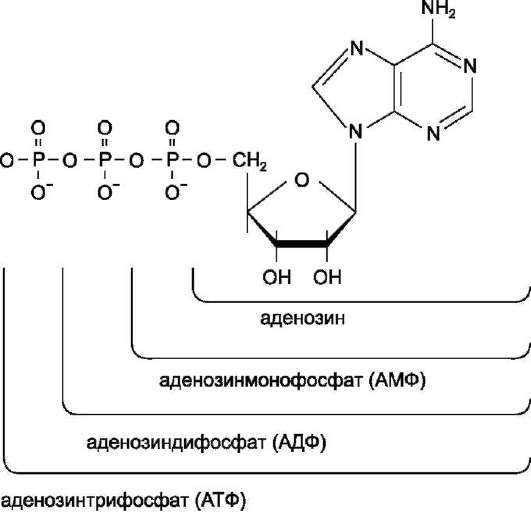
Рис. 4-1. Нуклеозидмоно-, ди- и трифосфаты аденозина. Нуклеотиды - фосфорные эфиры нуклеозидов. Остаток фосфорной кислоты присоединён к 5'-углеродному атому пентозы (5'-фосфоэфирная связь).
4-2). Номенклатура нуклеотидов приведена в табл. 4-1.
Пентозы в нуклеотидах представлены либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Чтобы отличить номера атомов в пентозах от нумерации атомов в основаниях, запись производят с внешней стороны цикла и к цифре добавляют штрих (') - 1', 2', 3', 4' и 5'
(рис. 4-3).
Пентозу соединяет с основанием N-глико-зидная связь, образованная С1-атомом пентозы (рибозы или дезоксирибозы) и N1-атомом пиримидина или N9-атомом пурина (рис. 4-4).
Нуклеотиды, в которых пентоза представлена рибозой, называют рибонуклеотидами, а нуклеиновые кислоты, построенные из рибонуклеоти-дов, - рибонуклеиновыми кислотами, или РНК. Нуклеиновые кислоты, в мономеры которых входит дезоксирибоза, называют дезоксирибо-
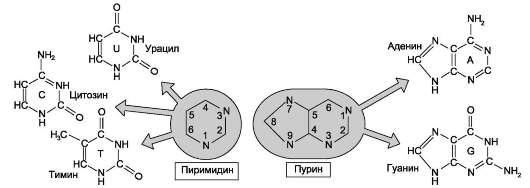
Рис. 4-2. Пуриновые и пиримидиновые основания.
Таблица 4-1. Номенклатура нуклеотидов
Азотистое основание | Нуклеозид | Нуклеотид | Трёхбуквенное обозначение | Однобуквенный код |
Аденин Гуанин Цитозин Урацил Тимин | Аденозин Гуанозин Цитидин Уридин Тимидин | Аденозинмонофосфат Гуанозинмонофосфат Цитидинмонофосфат Уридинмонофосфат Тимидинмонофосфат | АМФ ГМФ ЦМФ УМФ ТМФ | А G С U T |
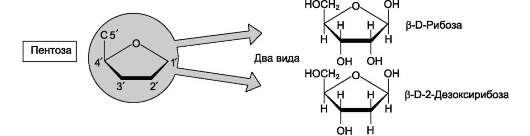
Рис. 4-3. Пентозы. Присутствуют 2 вида - β-D-рибоза в составе нуклеотидов РНК и β-D-2-дезоксирибоза в составе нуклеотидов ДНК.
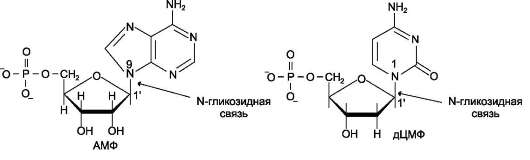
Рис. 4-4. Пуриновый и пиримидиновый нуклеотиды.
нуклеиновыми кислотами, или ДНК. Нуклеиновые кислоты по своему строению относят к классу линейных полимеров. Остов нуклеиновой кислоты имеет одинаковое строение по всей длине молекулы и состоит из чередующихся групп - пентоза-фосфат-пентоза- (рис. 4-5). Вариабельными группами в полинуклеотидных цепях служат азотистые основания - пурины и пиримидины. В молекулы РНК входят аденин (А), урацил (U), гуанин (G) и цитозин (С), в ДНК - аденин (А), тимин (Т), гуанин (G) и
цитозин (С). Уникальность структуры и функциональная индивидуальность молекул ДНК и РНК определяются их первичной структурой - последовательностью азотистых оснований в полинуклеотидной цепи.
Б. СТРУКТУРА ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ (ДНК)
Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи.
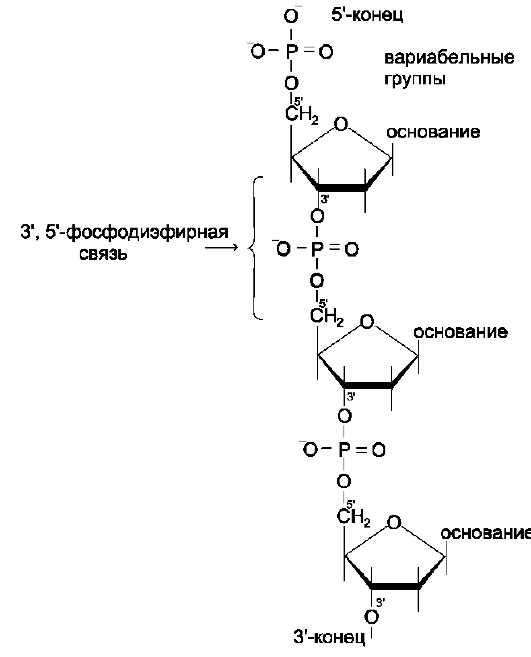
Рис. 4-5. Фрагмент цепи ДНК.
Каждая фосфатная группа в полинуклеотид-ной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-угле-родных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной.
Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-С-Т-Т-А-С-А- от 5'- к 3'-концу.
В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пи-
римидинового циклов способны образовывать водородные связи.
Вторичная структура ДНК. В
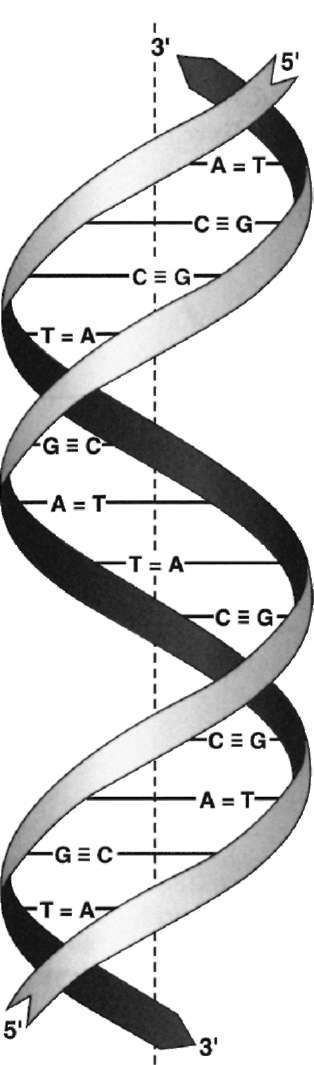
Рис. 4-6. Двойная спираль ДНК. Молекулы ДНК состоят из двух антипараллельных цепей с комплементарной последовательностью нуклеотидов. Цепи закручены относительно друг друга в правозакрученную спираль так, что на один виток приходится примерно 10 пар нуклеотидов.
ориентирована в направлении 3'-5', то вторая - в направлении 5'-3'. Поэтому на каждом из концов молекулы ДНК расположены 5'-конец одной цепи и 3'-конец другой цепи.
Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи) (рис. 4-7). При таком сочетании каждая пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эр-
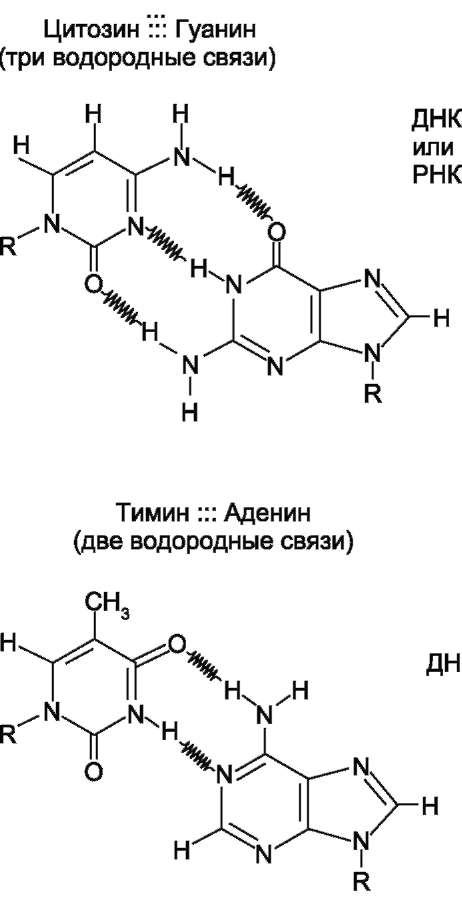
Рис. 4-7. Пурин-пиримидиновые пары оснований
в ДНК.
вин Чаргафф в
Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль.
Такая структура исключает контакт азотистых остатков с водой, но стопка оснований не может быть абсолютно вертикальной. Пары оснований слегка смещены относительно друг друга. В образованной структуре различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина.
Третичная структура ДНК
(суперспирализация ДНК)
Каждая молекула ДНК
упакована в отдельную хромосому. В диплоидных клетках человека
содержится 46 хромосом. Общая длина ДНК всех хромосом клетки составляет
Гистоны - белки с молекулярной массой 11-21 кД, содержащие много остатков аргинина и лизина. Благодаря положительному заряду гистоны образуют ионные связи с отрицательно заряженными фосфатными группами, расположенными на внешней стороне двойной спирали
ДНК.
Существует 5 типов гистонов. Четыре гисто-на Н2А, Н2В, Н3 и Н4 образуют октамерный белковый комплекс (Н2А, Н2В, Н3, Н4)2, который называют «нуклеосомный кор» (от англ. nucleosome core). Молекула ДНК «накручивается» на поверхность гистонового октамера, совершая
1,75 оборота (около 146 пар нуклеотидов). Такой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, её называют «нуклеосома». ДНК, связывающую нуклеосомные частицы, называют линкерной ДНК. В среднем линкерная ДНК составляет 60 пар нуклеотидных остатков. Молекулы гисто-на Н1 связываются с ДНК в межнуклеосомных участках (линкерных последовательностях) и защищают эти участки от действия нуклеаз (рис. 4-8).
В ядре каждой клетки присутствует около 60 млн молекул каждого типа гистонов, а общая масса гистонов примерно равна содержанию ДНК. Аминокислотные остатки лизина, аргинина и концевые аминогруппы гистонов могут модифицироваться: ацетилироваться, фосфо-рилироваться, метилироваться или взаимодействовать с белком убиквитином (негистоновый белок). Модификации бывают обратимыми и
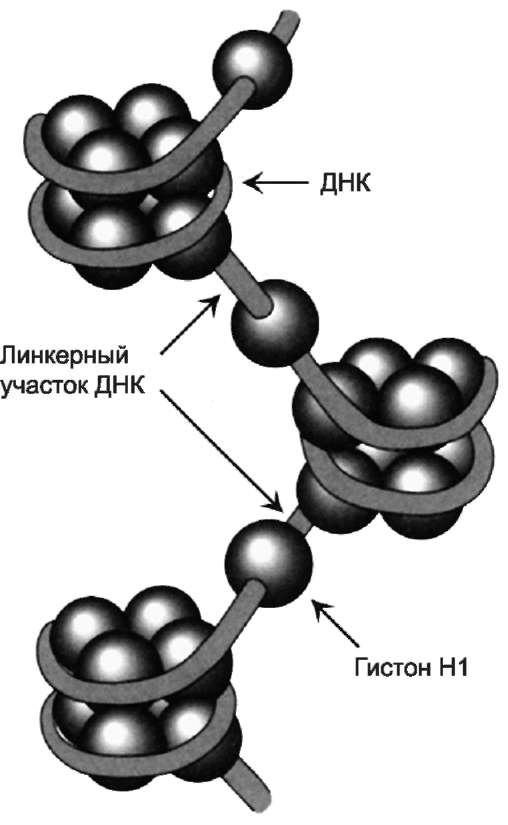
Рис. 4-8. Структура нуклеосом. Восемь молекул гистонов (Н2А, Н2В, Н3, Н4)2 составляют ядро нук-леосомы, вокруг которого ДНК образует примерно 1,75 витка.
необратимыми, они изменяют заряд и конфор-мацию гистонов, а это влияет на взаимодействие гистонов между собой и с ДНК.
Активность ферментов, ответственных за модификации, регулируется и зависит от стадии клеточного цикла. Модификации делают возможными конформационные перестройки хроматина.
Негистоновые белки хроматина
В ядре эукариотической клетки присутствуют сотни самых разнообразных ДНК-связывающих негистоновых белков. Каждый белок комплементарен определённой последовательности нуклеотидов ДНК (сайт ДНК). К этой группе относят семейство сайт-специфических белков типа «цинковые пальцы» (см. раздел 1). Каждый «цинковый палец» узнаёт определённый сайт, состоящий из 5 нуклеотидных пар. Другое семейство сайт-специфических белков - гомоди-меры. Фрагмент такого белка, контактирующий с ДНК, имеет структуру «спираль-поворот-спираль» (см. раздел 1). К группе структурных и регуляторных белков, которые постоянно ассоциированы с хроматином, относят белки высокой подвижности (НМG-белки - от англ. high mobility gel proteins). Они имеют молекулярную массу менее 30 кД и характеризуются высоким содержанием заряженных аминокислот. Благодаря небольшой молекулярной массе НМG-белки обладают высокой подвижностью при электрофорезе в полиакриламидном геле. К негистоновым белкам принадлежат также ферменты репликации, транскрипции и репарации. При участии структурных, регуляторных белков и ферментов, участвующих в синтезе ДНК и РНК, нить нуклеосом преобразуется в высококонденсированный комплекс белков и ДНК. Образованная структура в 10 000 раз короче исходной молекулы ДНК.
В. ГЕНЕТИЧЕСКАЯ СИСТЕМА МИТОХОНДРИЙ
Митохондрии - важнейшие органеллы клеток, осуществляющие синтез АТФ за счёт окисления субстратов. Митохондрии имеют собственный уникальный геном, наследуемый по материнской линии, так как он происходит из цитоплазмы яйцеклетки. Геном митохондрий сперматозоидов не попадает в оплодотворённую яйцеклетку.
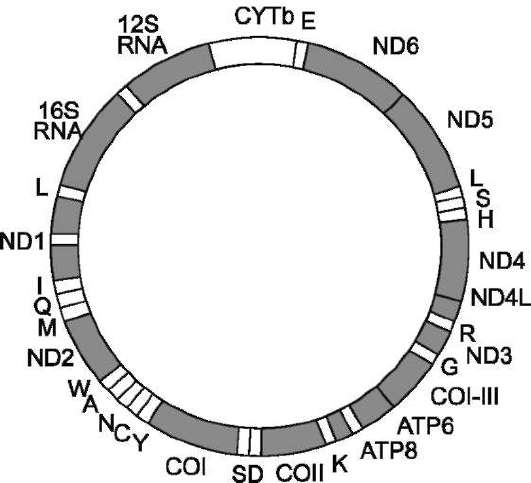
Рис. 4-9. Кольцевая молекула митохондриальной
ДНК. Гены ND1-ND6, ND41 кодируют субъединицы NADН-дегидрогеназного комплекса; ген COI-III - субъединицы цитохромоксидазы; ген CYTb - ци-тохром b. Гены ATP 8 и ATP 6 кодируют субъединицы АТФ-синтазы (NADH-дегидрогеназный комплекс, ци-тохромоксидаза, цитохром b - белки, участвующие в энергетическом обмене). Остальные гены кодируют рибосомные (12S RNA и 16S RNA) и транспортные РНК соответствующих аминокислот, обозначенные латинскими буквами.
Митохондриальный геном человека представлен одной кольцевой молекулой ДНК из 16 569 нуклеотидных пар (рис. 4-9). Он кодирует 13 белков, используемых на построение структурно-функциональных компонентов митохондрий.
В митохондриях отсутствуют ферменты, ответственные за репарацию, поэтому митохонд-риальный геном содержит немало ошибок. Митохондрии эукариотов имеют очень маленькие рибосомы с константой седиментации 55S, тогда как рибосомы прокариотов - 70S.
Г. СТРУКТУРА РИБОНУКЛЕИНОВЫХ КИСЛОТ
(РНК)
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нуклеотиды связаны между собой 3',5'-фосфо-диэфирными связями. Концы полинуклеотид-ных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа
5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гид-ролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется.
Вторичная структура РНК
Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - «шпильки», за счёт водородных связей между комплементарными азотистыми основаниями А-U и G-С. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Третичная структура РНК
Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спи-рализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибозы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Мg2+, связывающимися не только с фосфатными группами, но и с основаниями.
Основные типы РНК
В цитоплазме клеток присутствуют 3 типа рибонуклеиновых кислот - транспортные РНК (тРНК), матричные РНК (мРНК) и рибосо-мальные РНК (рРНК). Они различаются по первичной структуре, молекулярной массе, кон-формации, продолжительности жизни и, самое главное, по функциональной активности.
Транспортные РНК (тРНК)
Пространственную структуру любых тРНК, независимо от различий в последовательности
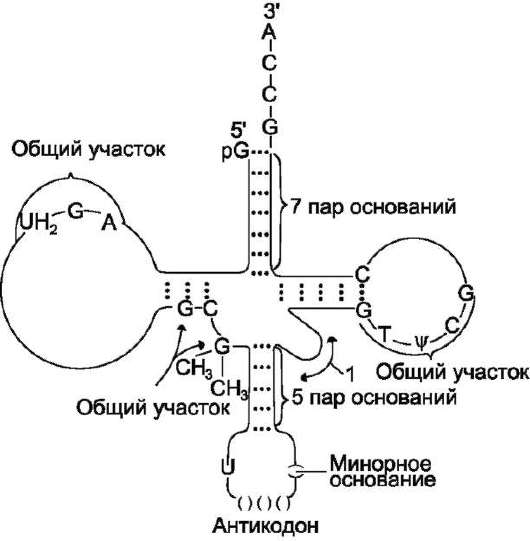
Рис. 4-10. Строение транспортных РНК. Спирали-зованные участки обозначены на рисунке пунктиром; «общие участки» одинаковы у всех тРНК; 1 - петля переменного размера; UН2 (дигидроурацил), ψ (псев-доурацил) - минорные основания; антикодону всегда предшествует U (урацил), а после него всегда стоит минорное основание.
нуклеотидов, описывают универсальной моделью «клеверного листа» (рис. 4-10). В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и анти-кодон - специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном
мРНК.
В состав нуклеотидов тРНК входят минорные основания (в среднем 10-12 оснований на молекулу). Они представлены метилированными
основаниями, изомерами и аналогами пирими-динов (рис. 4-11).
Минорные основания выполняют 2 функции: они делают тРНК устойчивыми к действию нук-леаз цитоплазмы и поддерживают определённую третичную структуру молекулы, так как не могут участвовать в образовании комплементарных пар, и препятствуют спирализации определённых участков в полинуклеотидной последовательности тРНК.
Матричные РНК (мРНК)
Первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5'- и З'-концов. Так, на 5'- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов - -UGA-, -UUA-, -UAG-. На З'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмо-нофосфатных остатков.
Рибосомальные РНК (рРНК)
Рибосомальные РНК имеют многочисленные спирализованные участки. Различают рРНК - 5S, 5,8S, 28S и 18S (S - коэффициент седиментации). Рибосомальные РНК содержат несколько модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2'-метилрибоза). рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков (рис. 4-12).
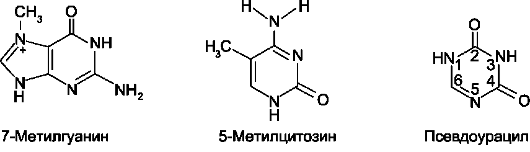
Рис. 4-11. Минорные основания тРНК.
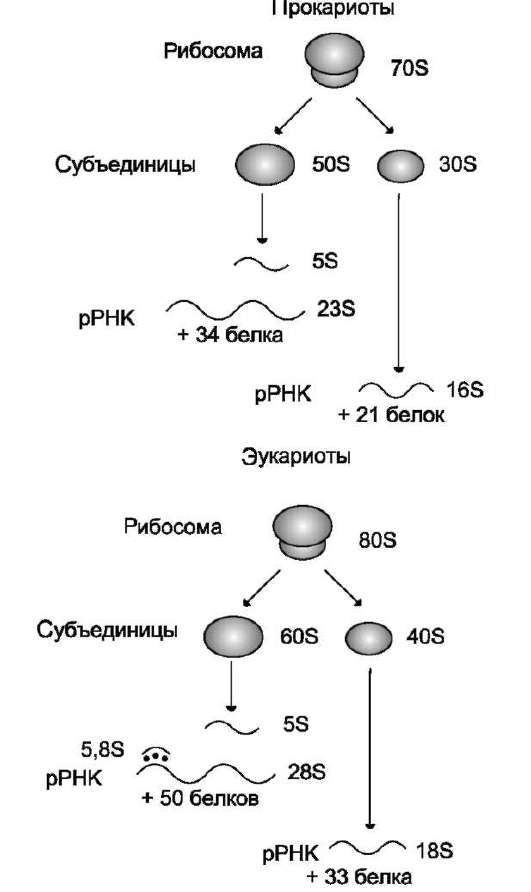
Рис. 4-12. Строение эукариотических и прокариоти-ческих рибосом. Величина S характеризует скорость оседания частиц при ультрацентрифугировании и пропорциональна их молекулярной массе. Рибосома прокариотов (70S) состоит из 50S и 30S субъединиц, эукариотов (80S) - состоит из субъединиц 60S и 40S. Рибосомы эукариотов и прокариотов различаются по молекулярной массе субъединиц, количеству молекул рРНК, массе рРНК, количеству и разнообразию белков, способных связывать специфические лиганды.
Д. ГИБРИДИЗАЦИЯ НУКЛЕИНОВЫХ КИСЛОТ
Вторичная структура нуклеиновых кислот образуется за счёт слабых взаимодействий - водородных и гидрофобных. Поэтому если водный раствор ДНК нагреть до 100 ?С, то связи, удерживающие две цепи двойной спирали вместе,
разрушаются. В результате разрыва водородных и гидрофобных связей цепи ДНК расходятся. Этот процесс называют «денатурация». Однако если раствор, содержащий денатурированную ДНК, очень медленно охлаждать, то могут получиться двухспиральные структуры, идентичные исходным. Такой процесс получил название «ренативация».
На явлении денатурации и ренативации основан метод, называемый «молекулярная гибридизация». Процесс гибридизации может осуществляться между двумя любыми цепями
нуклеиновых кислот (ДНК-ДНК, ДНК-РНК)
при условии, что они содержат комплементарные последовательности нуклеотидов. Такие гибридные структуры можно выделить центрифугированием в градиенте плотности сахарозы или наблюдать в электронном микроскопе (рис. 4-13).
Если раствор, содержащий образцы ДНК 1 и 2, выделенные из организмов разных видов, денатурировать, а затем провести ренатива-цию, то образуются двухспиральные структуры. Но наряду с исходными ДНК 1 и ДНК 2 образуются гибридные двойные спирали, содержащие цепь ДНК образца 1 и цепь ДНК образца 2, где присутствуют как спирализо-ванные, так и неспирализованные участки. В неспирализованных участках фрагменты цепей ДНК не комплементарны, т.е. в ходе гибридизации получаются несовершенные гибриды. Методом молекулярной гибридизации можно установить:
• сходство и различие первичной структуры разных образцов нуклеиновых кислот;
• различие ДНК, выделенных из организмов разных видов;
• идентичность ДНК всех органов и тканей одного организма.
При проведении гибридизации ДНК-РНК были выделены гибридные молекулы, содержащие одну цепь ДНК и одну цепь РНК. Если для эксперимента были взяты ДНК и РНК (первичный транскрипт), выделенные из одного организма, то образовывались совершенные гибриды, потому что молекула РНК комплементарна цепи ДНК. Гибридизацией ДНК-РНК было впервые установлено, что все виды РНК клетки имеют на молекуле ДНК комплементарные участки.
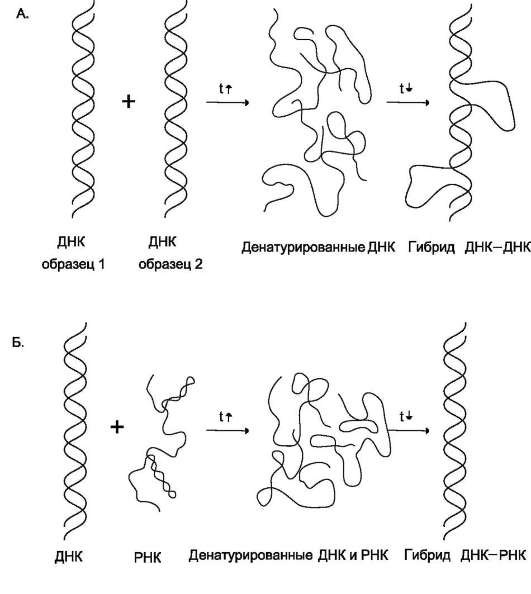
Рис. 4-13. Гибридизация нуклеиновых кислот. А - гибридизация ДНК-ДНК; Б - гибридизация ДНК-РНК.
ii. репликация
Живые организмы в течение S-фазы клеточного цикла, которая предшествует делению клетки, удваивают содержание ДНК таким образом, что каждая дочерняя клетка после деления получает набор хромосом, идентичный родительской клетке. Процесс удвоения хромосом называют репликацией (редупликацией).
Хромосома содержит одну непрерывную двух-цепочечную молекулу ДНК. При репликации каждая цепь родительской двухцепочечной ДНК служит матрицей для синтеза новой комплементарной цепи. Вновь образованная двойная спираль имеет одну исходную (родительскую) и одну вновь синтезированную (дочернюю)
цепь. Такой механизм удвоения ДНК получил название «полуконсервативная репликация» (рис. 4-14). Первичная структура дочерней цепи определяется первичной структурой родительской цепи, потому что в основе её образования лежит принцип комплементарности оснований (G = C и A = T).
Ферменты и белки, участвующие в репликации, должны работать быстро и точно. Эти условия выполняются с помощью особого муль-тиферментного комплекса.
Репликацию можно разделить на 4 этапа: образование репликативной вилки (инициация), синтез новых цепей (элонгация), исключение праймеров, завершение синтеза двух дочерних цепей ДНК (терминация).
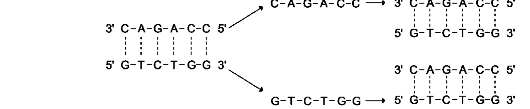
Рис. 4-14. Полуконсервативная репликация.
А. ИНИЦИАЦИЯ РЕПЛИКАЦИИ
Синтез ДНК у эукариотов происходит в S-фазу клеточного цикла. Инициацию репликации регулируют специфические сигнальные белковые молекулы - факторы роста. Факторы роста связываются рецепторами мембран клеток, которые передают сигнал, побуждающий клетку к началу репликации (см. раздел 11).
Синтез новых одноцепочечных молекул ДНК может произойти только при расхождении родительских цепей. В определённом сайте (точка начала репликации) происходит локальная денатурация ДНК, цепи расходятся и образуются две репликативные вилки, движущиеся в противоположных направлениях.
В образовании репликативной вилки принимает участие ряд белков и ферментов. Так, семейство ДНК-топоизомераз (I, II и III), обладая нуклеазной активностью, участвует в регуляции суперспирализации ДНК. Например, ДНК-то-поизомераза I разрывает фосфоэфирную связь в одной из цепей двойной спирали и ковалентно присоединяется к 5'-концу в точке разрыва (рис. 4-15). По окончании формирования репликатив-ной вилки фермент ликвидирует разрыв в цепи и отделяется от ДНК.
Разрыв водородных связей в двухцепочечной молекуле ДНК осуществляет ДНК-хеликаза. Фермент ДНК-хеликаза использует энергию АТФ для расплетения двойной спирали
ДНК.
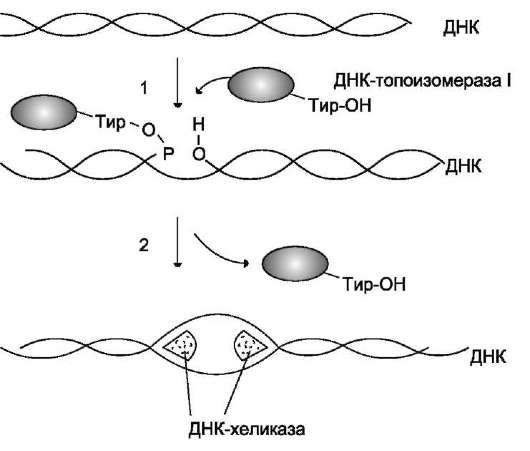
Рис. 4-15. Участие ДНК-топоизомеразы I в образовании репликативной вилки. 1 - фермент расщепляет одну цепь ДНК; между остатком тирозина молекулы фермента и фосфорным остатком цепи образуется ковалентная связь; 2 - происходит локальное раскручивание двойной спирали при участии ДНК-хеликазы; ДНК-топоизомераза I восстанавливает фосфоэфирную связь.
В результате происходит раскручивание участка суперспирализованной молекулы ДНК. В поддержании этого участка ДНК в раскрученном состоянии участвуют SSB-белки (от англ. single strand binding proteins, т.е. белки, связывающиеся с одноцепочечными нитями ДНК). SSB-белки, не закрывая азотистых оснований, связываются с одноцепочечной ДНК по всей длине разделившихся цепей и таким образом предотвращают их комплементарное скручивание и образование «шпилек». Они обладают большим сродством к одноцепочеч-ным участкам ДНК, независимо от первичной структуры цепей.
Б. ЭЛОНГАЦИЯ
Репликация ДНК осуществляется ДНК-зависимыми ДНК-полимеразами (рис. 4-16). Субстратами и источниками энергии для синтеза продукта служат 4 макроэргических соединения - дезоксирибонуклеозидтрифосфаты
дАТФ, дГТФ, дЦТФ и дТТФ, для активации которых необходимы ионы магния. Нейтрализуя отрицательный заряд нуклеотидов, они повышают их реакционную способность. Ферменты проявляют каталитическую активность только в присутствии предварительно раскрученной матричной двухцепочечной ДНК. Синтез цепей ДНК происходит в направлении 5'-3' растущей цепи, т.е. очередной нуклеотид присоединяется к свободному З'-ОН-концу предшествующего нуклеотидного остатка. Синтезируемая цепь всегда антипараллельна матричной цепи. В ходе репликации образуются 2 дочерние цепи, представляющие собой копии матричных цепей.
В синтезе эукариотических ДНК принимают участие 5 ДНК-полимераз (α, β, γ, δ, ε). ДНК-полимеразы различают по числу субъединиц, молекулярной массе, ассоциации с разными вспомогательными белками, ускоряющими процесс биосинтеза ДНК, и функциональному назначению. ДНК-полимеразы α (альфа), β (бета),
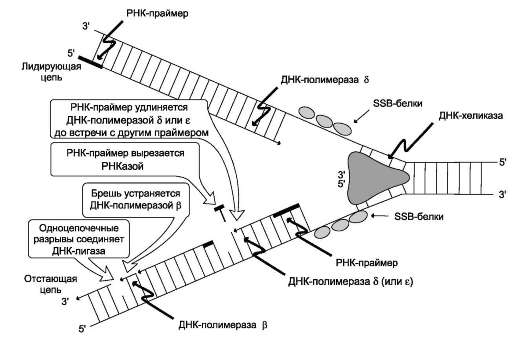
Рис. 4-16. Репликация.
δ (дельта), ε (эпсилон) участвуют в синтезе ДНК в ядре клеток, ДНК-полимераза γ (гамма) - в репликации митохондриальной ДНК.
ДНК-полимеразы β, δ, ε не могут инициировать образование дочерних цепей, так как не имеют сродства к одиночной нити ДНК. Инициирует репликацию ДНК-полимераза α, которая комплементарна определённому сайту одноце-почечной ДНК. Присоединяясь к нему, ДНК-полимераза α синтезирует небольшой фрагмент РНК - праймер, состоящий из 8-10 рибо-нуклеотидов. ДНК-полимераза α состоит из четырёх субъединиц. Каждая из субъединиц фермента выполняет определённую функцию: «узнавание» сайта репликации, синтез прайме-ра (8-10 рибонуклеотидов), синтез фрагмента цепи ДНК, около 50 дезоксирибонуклеотидов. Таким образом, ДНК-полимераза α синтезирует олигонуклеотид, содержащий примерно 60 нуклеотидньгх остатков; первые 8-10 представлены рибонуклеотидами (праймер), а остальные - дезоксирибонуклеотидами.
ДНК-полимераза δ
Олигонуклеотид, синтезированный ДНК-полимеразой α и образующий небольшой двух-цепочечный фрагмент с матрицей, позволяет присоединиться ДНК-полимеразе δ и продолжить синтез новой цепи в направлении от 5 - к 3 -концу по ходу раскручивания репликативной вилки.
ДНК-полимераза δ последовательно наращивает цепь, шаг за шагом присоединяя к ней соответствующие дезоксинуклеотиды. Выбор ДНК-полимеразой δ очередного нуклеотида определяется матрицей. Включение дезокси-рибонуклеозидмонофосфатов в растущую цепь ДНК сопровождается гидролизом макроэрги-ческих связей соответствующих нуклеозидтри-фосфатов и отщеплением пирофосфата (H4P2O7). Энергия макроэргических связей расходуется на образование 3',5'-фосфодиэфирной связи между последним нуклеотидом растущей цепи ДНК и присоединяемым нуклеотидом. Включение нуклеотида в синтезируемую цепь ДНК невозможно без предварительного связывания азотистого основания водородными связями с комплементарным нуклеотидом матричной цепи. ДНК-полимеразы (α, β, γ, δ, ε) могут синтезировать нуклеотидную цепь только в направ-
лении 5 - 3 , матричная цепь всегда считывается в направлении 3 - 5 .
В каждой репликативной вилке идёт одновременно синтез двух новых (дочерних) цепей. Направление синтеза цепи ДНК совпадает с направлением движения репликативной вилки лишь для одной из вновь синтезируемых цепей (лидирующая цепь). На второй матричной цепи синтез дочерней ДНК осуществляется двумя ферментами: ДНК-полимеразой α и ДНК-полимеразой ε в направлении 5 - 3 , но против движения репликативной вилки. Поэтому вторая цепь синтезируется прерывисто, короткими фрагментами, которые называют «фрагменты Оказаки» (по имени открывшего их исследователя). Дочерняя цепь ДНК, синтез которой происходит фрагментами, называют отстающей цепью. Каждый фрагмент Оказаки, примерно 100 нуклеотидных остатков, содержит праймер. Праймеры удаляет ДНК-полимераза β, постепенно отщепляя с 5 -конца фрагмента по одному рибонуклеотиду. К ОН-группе на 3 -конце предыдущего фрагмента ДНК-поли-мераза β присоединяет дезоксирибонуклеотиды в количестве, равном вырезанному праймеру и таким образом заполняет брешь, возникающую при удалении рибонуклеотидов.
Фермент ДНК-лигаза катализирует образование фосфодиэфирной связи между 3 -ОН-группой дезоксирибозы одного фрагмента цепи ДНК и 5 -фосфатом следующего фрагмента. Реакция протекает с затратой энергии АТФ. Таким образом, из множества фрагментов Оказаки образуется непрерывная цепь ДНК.
В. ОРИДЖИНЫ РЕПЛИКАЦИИ
ДНК хромосомы человека содержит примерно 150 млн пар нуклеотидов. Репликация такой большой молекулы со скоростью 50 нуклеотидов в минуту шла бы примерно 800 ч. Поэтому инициация синтеза ДНК происходит в нескольких сайтах хромосомы, которые называют сайтами инициации репликации, или ориджинами (от англ. origin - происхождение) репликации (рис. 4-17). Термин «сайт» используют для обозначения любого участка генома. Ориджины репликации имеют определённую нуклеотидную последовательность. Последовательность ДНК, ограниченную двумя
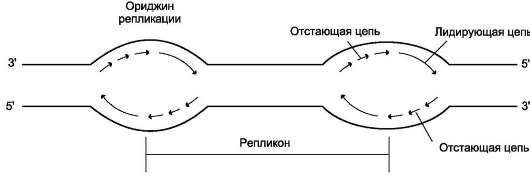
Рис. 4-17. Образование двух репликативных вилок, перемещающихся в противоположных направлениях от ориджина.
ориджинами репликации, называют единицей репликации, или репликоном. На ориджинах при участии ДНК-топоизомеразы I инициируется двунаправленная репликация. Образуются две репликативные вилки, перемещающиеся в противоположных направлениях до тех пор, пока не встретятся со следующим репликоном, т.е. репликация прекращается, когда встречаются две репликативные вилки.
Метилирование ДНК
После завершения репликации происходит метилирование нуклеотидных остатков вновь образованных цепей ДНК. Метильные группы присоединяются ко всем остаткам аденина в последовательности -GАТС-, при этом образуется N6-метиладенин, а также возможны метилирование цитозина в последовательности -GC-и образование N5-метилцитозина. Количество метилированных оснований равно примерно 1-8%. Модификация происходит при участии ферментов, использующих в качестве источника метильных групп S-аденозилмети-онин (SAM) (см. раздел 9). Присоединение метильных групп к остаткам аденина и цито-зина не нарушает комплементарности цепей
(рис. 4-18).
Наличие метильных групп в цепях ДНК необходимо для формирования структуры хромосом, а также для регуляции транскрипции генов. В течение непродолжительного времени в молекуле ДНК последовательности -GATC- метилированы по аденину только в матричной, но не в новой цепи. Это различие
используется ферментами репарации для исправления ошибок, которые могут возникать при репликации.
Г. СТРОЕНИЕ 3' И 5'-КОНЦОВ ЦЕПЕЙ ДНК. ТЕЛОМЕРНАЯ ДНК.
Специализированные структуры на концах эукариотических хромосом были открыты в
Таким образом, теломеры принимают участие в поддержании жизненно важных процессов в клетке: защищают хромосомы от деградации и служат механизмом, контролирующим число делений клетки и её запрограммированную
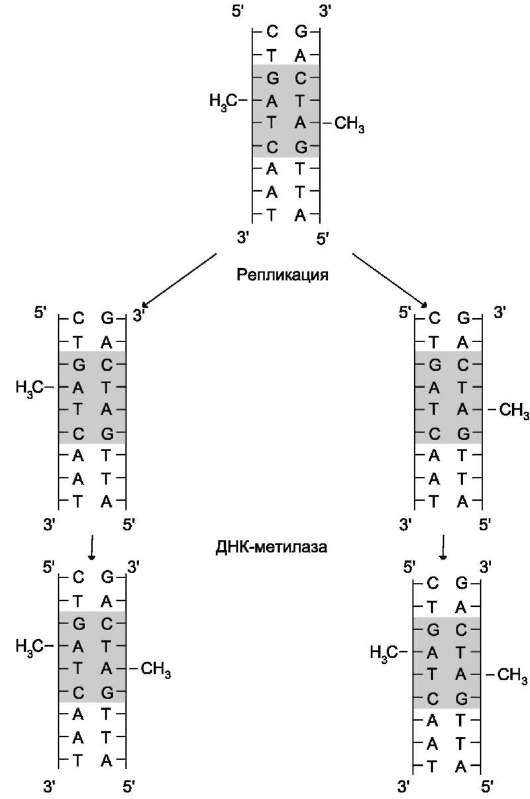
Рис. 4-18. Метилирование остатков аденина в последовательности -GATC-. В течение нескольких минут после репликации, пока не произошло метилирование, новая цепь ДНК отличается от матричной цепи.
гибель
(апоптоз). Фермент, способный увеличивать длину теломерных
последовательностей ДНК, был выделен Блэкберном и Грейдером в
(рис. 4-19, Б).
1. Связывание. Удлиняемый 3'-конец теломе-ры комплементарно соединяется с РНК-матрицей теломеразы.
2. Элонгация. Осуществляется достройка 3'-конца теломеры на матрице РНК. В результате синтезируется новый теломерный повтор. Эта реакция катализируется каталической субъединицей теломеразы.
3. Транслокация. Фермент перемещается по теломерной ДНК. При этом свободная часть
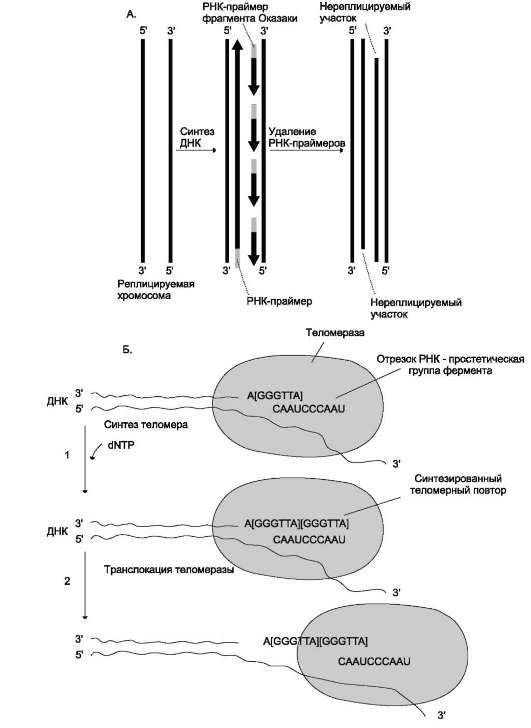
Рис. 4-19. Синтез теломерной ДНК. А. - на рисунке показано укорочение вновь синтезированных цепей ДНК после удаления праймеров; Б - в состав теломеразы входит короткая молекула РНК, содержащая в активном центре последовательность нуклеотидов, комплементарную теломерному повтору; элонгация - фермент прикрепляется за счёт взаимодействия РНК с существующей теломерой и добавляет последовательно по одному нуклеотиду фрагмент -GGGТТА-. Матрицей служит простетическая группа теломеразы - фрагмент РНК; транслокация - РНК-матрица перемещается по нити ДНК в составе теломеразы и постоянно комплементарно связана с концом вновь синтезированного теломерного повтора. Заново синтезированная теломерная ДНК служит матрицей для удлинения второй цепи ДНК, но уже входе репликации следующего цикла клеточного деления.
матричного участка РНК оказывается впереди З'-конца теломеры. Далее стадии повторяются, в результате чего З'-конец теломерной ДНК удлиняется на определенное число теломерных повторов.
Изучение теломеразы в различных типах опухолей показало достаточно выраженную зависимость между активностью фермента и злокачественностью. Высокий уровень теломе-разной активности был обнаружен в 90% злокачественных опухолей. Всё это делает теломеразу важным объектом диагностики злокачественных новообразований.
Д. КЛЕТОЧНЫЙ ЦИКЛ И ЕГО РЕГУЛЯЦИЯ
Процессы роста и деления клеток лежат в основе жизни любого организма. Но прежде чем совершить деление, клетка должна с высокой точностью копировать свой геном, синтезировать множество высоко- и низкомолекулярных соединений. Совокупность событий, обеспечивающих деление эукарио-тических клеток, называют «клеточный цикл». Продолжительность клеточного цикла зависит от типа делящихся клеток, у взрослого человека она может варьировать примерно от 8 ч и более, а для некоторых типов клеток до года и больше (рис. 4-20).
Все фазы клеточного цикла G1, S, G2, М могут различаться по длительности, но в особенности это касается фазы G1, длительность которой может быть равна практически нулю или быть столь продолжительной, что может казаться, будто клетки вообще прекратили деление. В этом случае говорят, что клетки находятся в состоянии покоя (фаза G0). Так, нейроны взрослого человека не делятся вообще. Клетки эпителия кишечника делятся на протяжении всей жизни человека, но даже у этих быс-тропролиферирующих клеток подготовка к делению занимает 24 ч. Клетки лёгких, почек, печени во взрослом организме начинают делиться только лишь в ответ на повреждение органов.
Внешние сигналы могут стимулировать или ингибировать прохождение клетки через цикл. Пролиферативные сигналы очень разнообразны, они зависят от типа клетки, стадии развития и других факторов. Такими сигналами
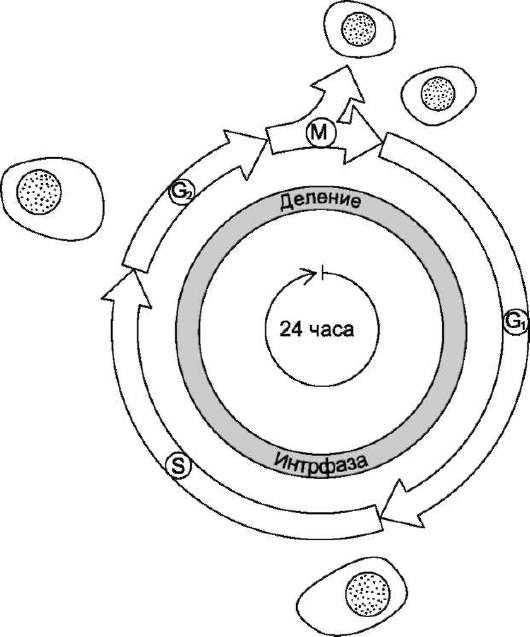
Рис. 4-20. Фазы клеточного цикла. После фазы М, в ходе которой происходит деление ядра (митоз) и цитоплазмы (цитокинез), дочерние клетки вступают в интерфазу нового цикла. Интерфаза начинается с фазы G1, в ходе которой активно происходят биосинтетические процессы, резко замедленные во время митоза. Фаза S - период синтеза ДНК; она заканчивается, когда содержание ДНК в ядре удвоится и хромосомы полностью реплицируются. Затем наступает фаза G2, в ходе которой происходят деление митохондрий и увеличение энергетических запасов клетки. Фаза G2 продолжается до начала митоза, т.е. фазы М. В фазе М ядерная оболочка разрушается, формируются два новых ядра, цитоплазма делится с образованием двух дочерних клеток, имеющих по одному ядру. На рисунке представлен 24-часовой цикл.
могут быть факторы роста, интерлейкины, гормоны, способные поддерживать или индуцировать пролиферацию определённых типов клеток. Сигнальные молекулы связываются специфическими мембранными рецепторами, активируют внутриклеточные пути передачи сигналов от рецептора к ядру и таким обра-
Таблица 4-2. Циклины и циклинзависимые киназы, регулирующие прохождение клеточного цикла

зом индуцируют транскрипцию определённых генов. Одними из первых активируются гены, кодирующие белки циклины. Белки были названы циклинами, потому что их концентрация в клетке периодически меняется по мере прохождения клеткой разных фаз клеточного цикла.
Все циклины делят на 2 подсемейства: G1-циклины (D, Е) и митотические циклины (А и В). Любой из циклинов представлен группой полиморфных белков, например циклин D представлен формами D1, D2, D3. У каждого типа циклинов есть гомологичный участок из 100 аминокислотных остатков - «циклиновый бокс», отвечающий за связывание с циклин-зависимой киназой (от англ. CDK - cyclin-dependent kinases). В клетках эукариотов существует примерно восемь различных CDK (CDK1-8), активирующихся различными цик-линами (табл. 4-2).
Циклинзависимые киназы, связывая циклин, переходят в активную форму и могут фосфо-рилировать специфические белки, например факторы транскрипции, белки-ингибиторы факторов транскрипции, которые регулируют синтез ферментов, обеспечивающих репликацию. Синтез каждого циклина начинается при подготовке к соответствующей фазе клеточного цикла, его концентрация в клетке повышается, а после окончания фазы резко падает до нуля. Завершившие свою работу комплексы циклинов и CDK связываются специфическими белками, ингибирующими их активность, и затем подвергаются разрушению.
iii. репарация
Процесс, позволяющий живым организмам восстанавливать повреждения, возникающие в ДНК, называют репарацией. Все репарационные механизмы основаны на том, что ДНК - двухцепочечная молекула, т.е. в клетке есть
2 копии генетической информации. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена.
Процесс репарации происходит в несколько этапов. На первом этапе выявляется нарушение комплементарности цепей ДНК. В ходе второго этапа некомплементарный нуклеотид или только основание устраняется, на третьем и четвёртом этапах идёт восстановление целостности цепи по принципу комплементарности. Однако в зависимости от типа повреждения количество этапов и ферментов, участвующих в его устранении, может быть разным.
Очень редко происходят повреждения, затрагивающие обе цепи ДНК, т.е. нарушения структуры нуклеотидов комплементарной пары. Такие повреждения в половых клетках не репарируются, так как для осуществления сложной репарации с участием гомологичной рекомбинации требуется наличие диплоидного набора хромосом.
А. СПОНТАННЫЕ ПОВРЕЖДЕНИЯ
Нарушения комплементарности цепей ДНК могут происходить спонтанно, т.е. без участия каких-либо повреждающих факторов, например в результате ошибок репликации, дезаминиро-вания нуклеотидов, депуринизации.
Ошибки репликации
Точность репликации ДНК очень велика, но примерно один раз на 105-106 нуклеотидных остатков происходят ошибки спаривания, и тогда вместо пары нуклеотидов А-Т, G-C в дочернюю цепь ДНК оказываются включёнными нуклеотиды, некомплементарные нуклеотидам матричной цепи. Однако ДНК-
полимеразы δ, ε способны после присоединения очередного нуклеотида в растущую цепь ДНК делать шаг назад (в направлении от 3 - к 5 - концу) и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной цепи ДНК. Этот процесс исправления ошибок спаривания (или коррекция) иногда не срабатывает, и тогда в ДНК по окончании репликации остаются некомплементарные пары, тем более, что ДНК-полимераза α лишена корректирующего механизма и «ошибается» чаще, чем другие полимеразы.
При неправильном спаривании в первичной структуре дочерней цепи ДНК необычные основания не появляются, нарушена только комплементарность. Система репарации некомплементарных пар должна происходить только на дочерней цепи и производить замену некомплементарных оснований только в ней. Ферменты, участвующие в удалении неправильной пары нуклеотидов, распознают матричную цепь по наличию метилированных остатков аденина в последовательностях ^GАТС-. Пока основания нуклеотидных остатков в дочерней цепи неметилированы, ферменты должны успеть выявить ошибку репликации и устранить её.
Распознавание и удаление (первый этап) некомплементарного нуклеотида происходят при участии специальных белков mut S, mut L, mut H. Каждый из белков выполняет свою специфическую функцию. Mut S находит неправильную пару и связывается с этим фрагментом. Mut H присоединяется к метилированному (по аденину) участку -GАТС-, расположенному вблизи некомплементарной пары. Cвязующим между mut S и mut H служит белок mut L, его присоединение завершает образование активного фермента. Формирование комплекса mut S, mut L, mut H на участке, содержащем ошибку, способствует проявлению у белка mut H эндонуклеазной активности. Ферментативный комплекс гидролизует фосфоэфирную связь в неметилированной цепи (рис. 4-21).
К свободным концам цепи присоединяется экзонуклеаза (второй этап). Отщепляя по одному нуклеотиду в направлении от 3 - к 5 -концу дочерней цепи, она устраняет участок, содержащий некомплементарную пару. Брешь застраивает ДНК-полимераза β (третий этап), соединение основного и вновь синтезиро-
ванного участков цепи катализирует фермент ДНК-лигаза (четвёртый этап). Для успешного функционирования экзонуклеазы, ДНК-поли-меразы β и ДНК-лигазы необходимо участие в репарации хеликазы и SSB-белков.
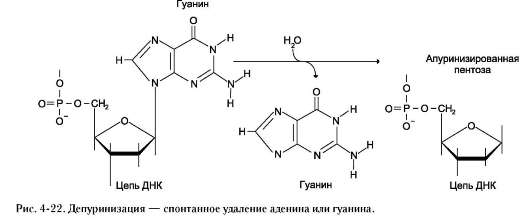
Депуринизация (апуринизация)
ДНК каждой клетки человека теряет за сутки около 5000 пуриновых остатков вследствие разрыва N-гликозидной связи между пурином и дезоксирибозой (рис. 4-22).
Тогда в молекуле ДНК на месте этих оснований образуется участок, лишённый азотистых оснований, названный АП-сайтом (АР-site, или апурино-вый сайт). Термин «АП-сайт» используют также в тех случаях, когда из ДНК выпадают пиримиди-новые основания и образуются апиримидиновые сайты (от англ. apurinic-apyrimidinic site).
Этот тип повреждений устраняет фермент ДНК-инсертаза (от англ. insert - вставлять), который может присоединять к дезоксирибозе основание в соответствии с правилом компле-ментарности. В этом случае нет необходимости разрезать цепь ДНК, вырезать неправильный нуклеотид и репарировать разрыв.
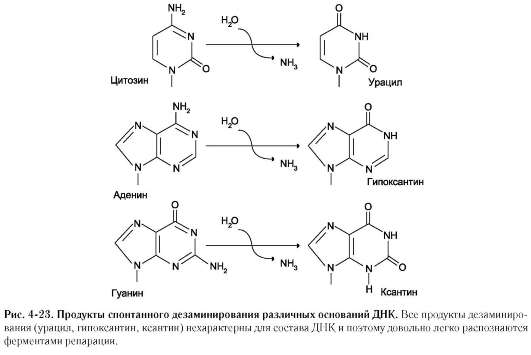
Дезаминирование
Реакции дезаминирования цитозина и превращение его в урацил (рис. 4-23), аденина в гипоксантин, гуанина в ксантин происходят значительно реже, чем депуринизация, и составляют 10 реакций на один геном в сутки.
Исправление этого вида спонтанного повреждения происходит в 5 этапов (рис. 4-24). В репарации принимает участие ДНК-N-гликози-лаза, гидролизующая связи между аномальным основанием и дезоксирибозой (первый этап), в результате образуется АП-сайт, который распознаёт фермент АП-эндонуклеаза (второй этап). Как только в цепи ДНК возникает разрыв, в работу вступает ещё один фермент - АП-эк-зонуклеаза, который отщепляет от цепи дезок-сирибозу, лишённую основания (третий этап). В цепи ДНК появляется брешь размером в один нуклеотид. Cледующий фермент ДНК-полимераза β к З'-концу разорванной цепи присоединяет нуклеотид по принципу комплементарности (четвёртый этап). Чтобы соединить два свободных конца (З'-конец встроенного нуклеотида и 5 -конец основной цепи), требуется ещё один фермент - ДНК-лигаза (пятый этап).
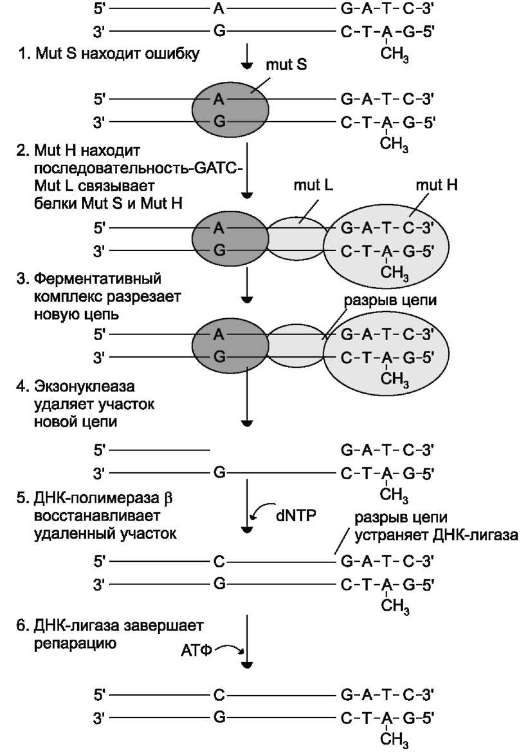
Рис. 4-21. Система репарации ошибок репликации. 1 - белок mut S «узнаёт» некомплементарную пару и присоединяется в этом участке ДНК; 2 - белок mut Н взаимодействует с метилированной по аденину последовательностью материнской цепи -GАТС- ; завершается формирование ферментативного комплекса после присоединения mut L; 3 - комплекс определяет вновь синтезированную цепь по отсутствию метилированного остатка аденина в последовательности -GАТС- и разрывает её; 4 - экзонуклеаза удаляет фрагмент дочерней цепи ДНК, содержащий ошибку; 5 - ДНК-полимераза β по принципу комплементарности застраивает брешь; 6 - ДНК-лигаза З'-конец вновь синтезированного фрагмента соединяет с основной цепью и завершает репарацию ошибки.
Нерепарируемо и поэтому опасно дезамини-рование метилированного цитозина. Продукт его спонтанного дезаминирования - тимин, нормальное для ДНК основание, которое не распознаётся ДНК-N-гликозилазой.
Б. ИНДУЦИРУЕМЫЕ ПОВРЕЖДЕНИЯ
Индуцируемые повреждения возникают в ДНК в результате воздействия разнообразных
мутагенных факторов как радиационной, так и химической природы.
Образование димеров пиримидиновых оснований
Под действием УФО двойная связь между С5 и С6 атомами углерода в составе пиримидиновых оснований (тимине и цитозине) может разрываться. Атомы углерода остаются связанными одной связью. Расстояние между параллельными плоскостями оснований полинуклеотидной
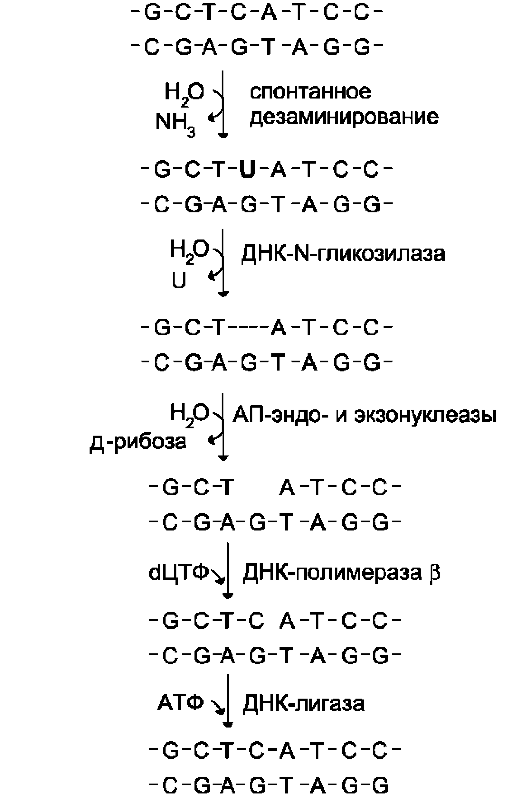
Рис. 4-24. Репарация АП-сайтов с участием ДНК-N-гликозилазы и АП-экзонуклеазы.
цепи, в которых произошёл разрыв, равно примерно З,4 Å. Это расстояние позволяет освободившимся валентностям между C-C атомами пиримидиновых оснований, расположенных последовательно в цепи ДНК, сформировать циклобутановое кольцо (рис. 4-25). В зависи-
мости от того, какие основания соединены в димер, их называют димерами тимина, цитозина или тимин-цитозиновыми димерами.
Удаление пиримидиновых димеров происходит под действием фотолиазы. Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. В фотолиазе есть участок, либо сам поглощающий фотоны (в синей части спектра), либо связывающийся с кофакторами, адсорбирующими свет. Таким образом, свет активирует фотолиазу, которая распознаёт димеры в облучённой ДНК, присоединяется к ним и разрывает возникшие между пиримидиновыми кольцами связи. После этого фермент отделяется от
ДНК.
Повреждения оснований ДНК химическими мутагенами
Азотистые основания в ДНК могут подвергаться разнообразным повреждениям: алкилированию, окислению, восстановлению или связыванию основания с формамидными группировками. Репарация начинается с присоединения ДНК-N-гликозилазы к повреждённому основанию. Cуществует множество ДНК-N-гликозилаз, специфичных к разным модифицированным основаниям. Ферменты гидролитически расщепляют N-гликозидную связь между изменённым основанием и дезоксирибозой, это приводит к образованию АП-сайта в цепи ДНК (первый этап). Репарация АП-сайта может происходить или только при участии ДНК-инсертазы, которая присоединяет к дезоксирибозе основание в соответствии с правилом комплементарности, или при участии всего комплекса ферментов,
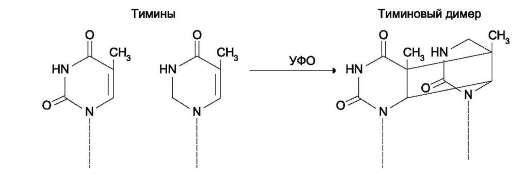
Рис. 4-25. Димер тимина (циклобутановое кольцо).
участвующих в репарации: АП-эндонуклеазы, АП-экзонуклеазы, ДНК-полимеразы β и ДНК-лигазы.
В. ДЕФЕКТЫ РЕПАРАЦИОННЫХ СИСТЕМ И НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ
Репарация необходима для сохранения на-тивной структуры генетического материала на протяжении всей жизни организма. Cнижение активности ферментов репарационных систем приводит к накоплению повреждений (мутаций)
в ДНК.
Причиной многих наследственных болезней человека выступает нарушение отдельных этапов процесса репарации.
Пигментная ксеродерма
У больных в системе репарации снижена активность ферментов, ответственных за удаление неправильных оснований, «застройку» бреши и другие функции. Дефект репарационной системы проявляется в сверхчувствительности к УФ-свету, что приводит к появлению красных пятен на коже, переходящих в незаживающие коросты и нередко в рак кожи.
Трихотиодистрофия
Заболевание связано с повышенной фоточувствительностью ДНК, вызванной снижением активности фермента, участвующего в удалении димеров тимина. Cимптомы заболевания: ломкость волос вследствие нехватки серы в белках волос и их луковиц; часто умственная и физическая отсталость; аномалии кожи и зубов.
iv. транскрипция
Транскрипция - первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции (рис. 4-26).
Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный принцип комплементарного спаривания оснований в молекуле РНК (G=C, A=U и Т=А). ДНК служит только матрицей и в ходе транскрипции не изменяется. Рибонук-леозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) - субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования З',5'-фосфодиэфирной связи между рибонуклеозидмонофосфатами.
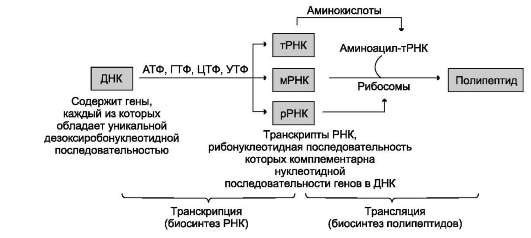
Рис. 4-26. Схема реализации генетической информации в фенотипические признаки. Реализацию потока информации в клетке можно представить схемой ДНК→РНК→белок. ДНК→РНК обозначает биосинтез молекул РНК (транскрипцию); РНК→белок означает биосинтез полипептидных цепей (трансляцию).
Синтез молекул РНК начинается в определённых последовательностях (сайтах) ДНК, которые называют промоторы, и завершается в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции - транскриптон. У эукариотов в состав транскриптона, как правило, входит один ген (рис. 4-27), у прокариотов несколько. В каждом транскриптоне присутствует неинформативная зона; она содержит специфические последовательности нуклеотидов, с которыми взаимодействуют регуляторные транскрипционные факторы.
Транскрипционые факторы - белки , взаимодействующие с определёнными регуляторны-ми сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транс-криптонах эукариотов составляет в среднем 1:9 (у прокариотов 9:1).
Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет осуществлять с разной активностью индивидуальное считывание (транскрипцию) разных генов.
В каждом транскриптоне транскрибируется только одна из двух цепей ДНК, которая называется матричной, вторая, комплементарная ей цепь, называется кодирующей. Синтез цепи РНК идёт от 5'- к З'-концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой нуклеиновой кислоте (рис. 4-28).
Транскрипция не связана с фазами клеточного цикла; она может ускоряться и замедляться в зависимости от потребности клетки или организма в определённом белке.
РНК-полимеразы
Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукари-отов обнаружены З специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК; РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. РНК-полимеразы - оли-гомерные ферменты, состоящие из нескольких субъединиц - 2α, β, β', σ. Субъединица σ (сигма) выполняет регуляторную функцию, это один из факторов инициации транскрипции. РНК-полимеразы I, II, III, узнающие разные промоторы, содержат разные по строению субъединицы σ.
А. СТАДИИ ТРАНСКРИПЦИИ
В процессе транскрипции различают З стадии: инициацию, элонгацию и терминацию.
Инициация
Активация промотора происходит с помощью большого белка - ТАТА-фактора, называемого так потому, что он взаимодействует со специфической последовательностью нуклеотидов промотора - ТАТААА- (ТАТА-бокс) (рис. 4-29).
Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимера-зой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка, в которой матрица доступна для инициации синтеза цепи РНК (рис. 4-30).
После того как синтезирован олигонуклеотид из 8-10 нуклеотидных остатков, σ-субъединица отделяется от РНК-полимеразы, а вместо неё к молекуле фермента присоединяются несколько факторов элонгации.
Элонгация
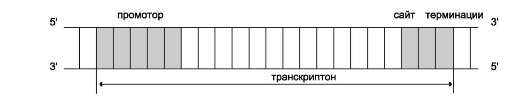
Рис. 4-27. Строение транскриптона.
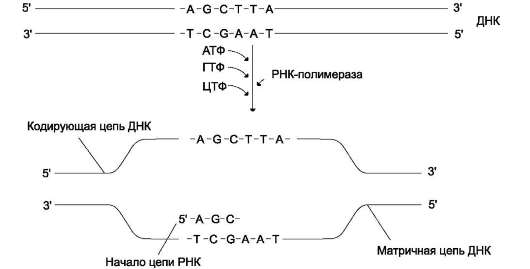
Рис. 4-28. Транскрипция РНК на матричной цепи ДНК. Синтез РНК всегда происходит в направлении 5'-3'.
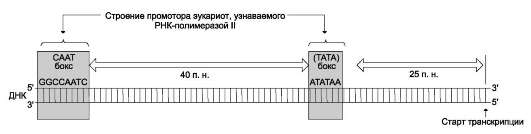
Рис. 4-29. Строение промотора эукариотов. Промоторные элементы - специфические последовательности нуклеотидов, характерные для любого промотора, связывающего РНК-полимеразу. Первый промоторный элемент - последовательность AТАТАА- (ТАТА-бокс) отделён от сайта начала транскрипции приблизительно на 25 пар нуклеотидов (п.н.). На расстоянии примерно 40 (иногда до 120) п.н. от него располагается последовательность GGCCAATC- (СААТ-бокс).
Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей ДНК. Синтез молекулы РНК идёт от 5'- к З'-концу комплементарно матричной цепи ДНК. На стадии элонгации, в области транскрипционной вилки, одновременно разделены примерно 18 нуклеотидных пар ДНК. Растущий конец цепи РНК образует временную гибридную спираль, около 12 пар нуклеотидных остатков, с матричной цепью ДНК. По мере продвижения РНК-полимеразы по матрице в направлении от З'- к 5'-концу впереди неё происходит рас-
хождение, а позади - восстановление двойной спирали ДНК.
Терминация
Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определённых участках матрицы - терминаторах (сайты терминации). Фактор тер-минации облегчает отделение первичного транскрипта (пре-мРНК), комплементарного матрице, и РНК-полимеразы от матрицы. РНК-
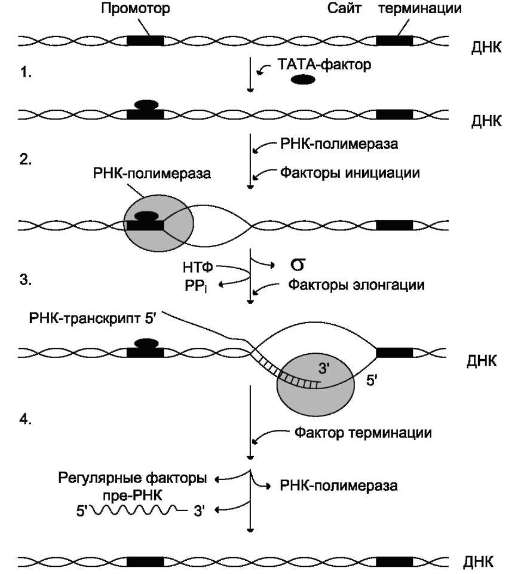
Рис. 4-30. Стадии транскрипции. 1 - присоединение TATA-фактора к промотору. Чтобы промотор был узнан РНК-полимеразой, необходимо образование транскрипционного комплекса ТАТА-фактор/ТАТА-бокс (промотор). ТАТА-фактор остаётся связанным с ТАТА-боксом во время транскрипции, это облегчает использование промотора многими молекулами РНК-полимеразы; 2 - образование транскрипционной вилки; 3 - элонгация; 4 - терминация.
полимераза может вступить в следующий цикл транскрипции после присоединения субъединицы σ.
Б. КОВАЛЕНТНАЯ МОДИФИКАЦИЯ (ПРОЦЕССИНГ) МАТРИЧНОЙ РНК
Первичные транскрипты мРНК, прежде чем будут использованы в ходе синтеза белка, подвергаются ряду ковалентных модификаций. Эти модификации необходимы для функционирования мРНК в качестве матрицы.
Модификация 5'-конца
Модификации пре-мРНК начинаются на стадии элонгации. Когда длина первичного транскрипта достигает примерно З0 нуклеотидных остатков, происходит кэширование его 5'-конца. Осуществляет кэширование гуанилилтрансфераза. Фермент гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифос-фатный остаток 5'-фосфатной группой к 5'-концу синтезированного фрагмента РНК с образованием 5',5'-фосфодиэфирной связи. Последующее метилирование остатка гуанина в составе ГТФ с образованием N7-метилгуанозина завершает формирование кэпа (рис. 4-31).
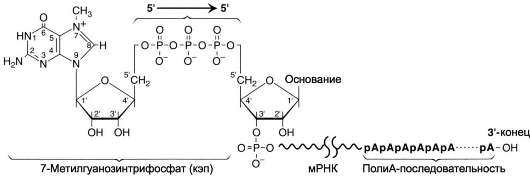
Рис. 4-31. Ковалентная модификация концевых нуклеотидных остатков первичного транскрипта мРНК.
Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5'-экзонуклеаз в цитоплазме. Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также необходимо для работы сложной ферментной системы, обеспечивающей удаление интронов.
Модификация З'-конца
З'-Конец большинства транскриптов, синтезированных РНК-полимеразой II, также подвергается модификации, при которой специальным ферментом полиА-полимеразой формируется полиА-последовательность (по-лиА-«хвост»), состоящая из 100-200 остатков адениловой кислоты.
Сигналом к началу полиаденилирования является последовательность -ААUААА- на растущей цепи РНК. Фермент полиА-полимераза, проявляя экзонуклеазную активность, разрывает З'-фосфоэфирную связь после появления в цепи РНК специфической последовательности -ААUААА-. К З'-концу в точке разрыва полиА-полимераза наращивает полиА-«хвост». Наличие полиА-последовательности на З'-конце облегчает выход мРНК из ядра и замедляет её гидролиз в цитоплазме.
Ферменты, осуществляющие кэпирование и полиаденилирование, избирательно связываются с РНК-полимеразой II, и в отсутствие полимеразы неактивны.
Сплайсинг первичных транскриптов мРНК
С появлением методов, позволяющих изучать первичную структуру молекул мРНК в цитоплазме и последовательность нуклеотидов кодирующей её геномной ДНК, было установлено, что они не комплементарны, а длина гена в несколько раз больше «зрелой» мРНК. Последовательности нуклеотидов, присутствующие в ДНК, но не входящие в состав зрелой мРНК, были названы некодирующими, или интроны, а последовательности, присутствующие в мРНК, - кодирующими, или экзоны. Таким образом, первичный транскрипт - строго комплементарная матрице нуклеиновая кислота (пре-мРНК), содержащая как экзоны, так и интроны. Длина интронов варьирует от 80 до 1000 нуклеотидов. Последовательности интронов «вырезаются» из первичного транскрипта, концы экзонов соединяются друг с другом. Такую модификацию РНК называют «сплайсинг» (от англ. to splice - сращивать). Сплайсинг происходит в ядре, в цитоплазму поступает уже «зрелая» мРНК.
Гены эукариотов содержат больше интронов, чем экзонов, поэтому очень длинные молекулы пре-мРНК (около 5000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цитоплазматической мРНК (от 500 до З000 нуклеотидов).
Процесс «вырезания» интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП). В состав мяРНП входит малая ядерная РНК (мяРНК), нуклеотидная цепь которой связана с белковым остовом, состоящим из не-
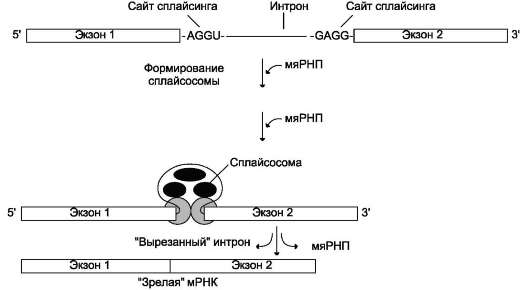
Рис. 4-32. Сплайсинг РНК. В процессе сплайсинга принимают участие различные мяРНП, которые формируют сплайсосому. мяРНП, взаимодействуя с РНК и друг с другом, фиксируют и ориентируют реакционные группы первичного транскрипта. Каталитическая функция сплайсосом обусловлена РНК-составляющими; такие РНК называют рибозимами.
скольких протомеров. В сплайсинге принимают участие различные мяРНП (рис. 4-32).
Нуклеотидные последовательности интронов функционально неактивны. Но на 5'- и 3'-кон-цах они имеют высокоспецифические последовательности - AGGU- и -GAGG- соответственно (сайты сплайсинга), которые обеспечивают их удаление из молекулы пре-мРНК. Изменение структуры этих последовательностей влияет на процесс сплайсинга.
На первой стадии процесса мяРНП связываются со специфическими последовательностями первичного транскрипта (сайты сплайсинга), далее к ним присоединяются другие мяРНП. При формировании структуры сплайсосомы 3'-конец одного экзона сближается с 5'-концом следующего экзона. Сплайсосома катализирует реакцию расщепления 3',5'-фосфодиэфирной связи на границе экзона с интроном. Последовательность интрона удаляется, а два экзона соединяются. Образование 3',5'-фосфодиэфир-ной связи между двумя экзонами катализируют мяРНК (малые ядерные РНК), входящие в структуру сплайсосомы. В результате сплайсинга из первичных транскриптов мРНК образуются молекулы «зрелой» мРНК.
Альтернативный сплайсинг первичных транскриптов мРНК
Для некоторых генов описаны альтернативные пути сплайсинга и полиаденилирования одного и того же транскрипта. Экзон одного варианта сплайсинга может оказаться интро-ном в альтернативном пути, поэтому молекулы мРНК, образованные в результате альтернативного сплайсинга, различаются набором экзонов. Это приводит к образованию разных мРНК и, соответственно, разных белков с одного первичного транскрипта. Так, в парафолликулярных клетках щитовидной железы (рис. 4-33) в ходе транскрипции гена гормона кальцитонина (см. раздел 11) образуется первичный транскрипт мРНК, который состоит из шести экзонов. Матричная РНК кальцитонина образуется путём сплайсинга первых четырёх экзонов (1-4). Последний (четвёртый) экзон содержит сигнал полиаденилирования (последовательность -AAUAAA-), узнаваемый полиА-полиме-разой в парафолликулярных клетках щитовидной железы. Этот же первичный транскрипт в клетках головного мозга в ходе другого (альтернативного) пути сплайсинга превращается в
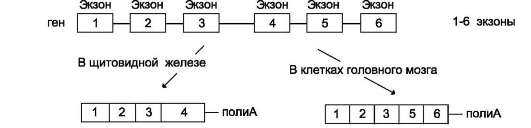
Рис. 4-33. Альтернативный сплайсинг гена кальцитонина. В клетках щитовидной железы сплайсинг первичного транскрипта приводит к образованию кальцитониновой мРНК, включающей 4 экзона и полиА-последовательность, которая образуется после расщепления транскрипта в первом участке сигнала полиаденилирования. В клетках мозга образуется мРНК, содержащая: экзоны 1, 2, 3, 5, 6 и полиА-последовательность, образованную после второго сигнала полиаденилирования.
мРНК кальцитонинподобного белка, отвечающего за вкусовое восприятие. Матричная РНК этого белка состоит из первых трёх экзонов, общих с кальцитониновой мРНК, но включает дополнительно пятый и шестой экзоны, не свойственные мРНК кальцитонина. Шестой экзон тоже имеет сигнал полиаденилирования -ААUААА-, узнаваемый ферментом полиА-полимеразой в клетках нервной ткани. Выбор одного из путей (альтернативный сплайсинг) и одного из возможных сайтов полиаденилирова-ния играет важную роль в тканеспецифической экспрессии генов.
Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изофор-мы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях на определённых стадиях их развития.
В. ПРОЦЕССИНГ ПЕРВИЧНЫХ ТРАНСКРИПТОВ РИБОСОМАЛЬНОЙ РНК И ТРАНСПОРТНОЙ РНК
Гены, кодирующие большую часть структурных РНК, транскрибируются РНК-полимера-зами I и III. Нуклеиновые кислоты - предшественники рРНК и тРНК - подвергаются в ядре расщеплению и химической модификации (процессингу).
Посттранскрипционные модификации первичного транскрипта тРНК (процессинг тРНК)
Первичный транскрипт тРНК содержит около 100 нуклеотидов, а после процессинга - 70-90 нуклеотидньгх остатков. Посттранскрип-
ционные модификации первичных транскриптов тРНК происходят при участии РНК-аз (рибо-нуклеаз). Так, формирование З'-конца тРНК катализирует РНК-аза, представляющая собой З'-экзонуклеазу, «отрезающую» по одному нук-леотиду, пока не достигнет последовательности -ССА, одинаковой для всех тРНК. Для некоторых тРНК формирование последовательности -ССА на З'-конце (акцепторный конец) происходит в результате последовательного присоединения этих трёх нуклеотидов. Пре-тРНК содержит всего один интрон, состоящий из 14-16 нуклеотидов. Удаление интрона и сплайсинг приводят к формированию структуры, называемой «антикодон», - триплета нуклеотидов, обеспечивающего взаимодействие тРНК с комплементарным кодоном мРНК в ходе синтеза белков (рис. 4-З4).
Посттранскрипционные модификации (процессинг) первичного транскрипта рРНК. Формирование рибосом
В клетках человека содержится около сотни копий гена рРНК, локализованных группами на пяти хромосомах. Гены рРНК транскрибируются РНК-полимеразой I c образованием идентичных транскриптов. Первичные транскрипты имеют длину около 13 000 нуклеоттидных остатков (45S рРНК). Прежде чем покинуть ядро в составе рибосомной частицы, молекула 45S рРНК подвергается процессингу, в результате образуется 28S рРНК (около 5000 нуклеотидов), 18S рРНК (около 2000 нуклеотидов) и 5,8S рРНК (около 160 нуклеотидов), которые являются компонентами рибосом (рис. 4-35). Остальная часть транскрипта разрушается в ядре.
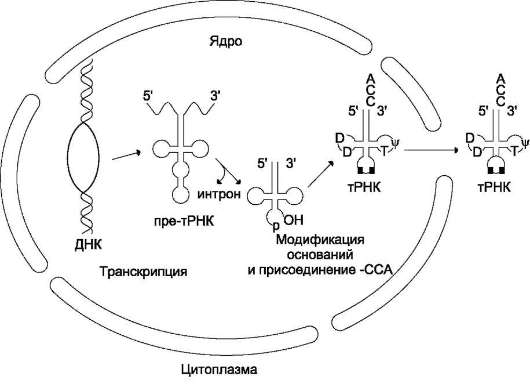
Рис. 4-34. Процессинг пре-тРНК. Определённые азотистые основания нуклеотидов тРНК в ходе процессинга метилируются под действием РНК-метилазы и превращаются, например, в 7-метилгуанозин и 2-метилгуанозин (минорные основания). В молекуле тРНК содержатся и другие необычные основания - псевдоуридин, дигид-роуридин, которые также модифицируются во время процессинга.
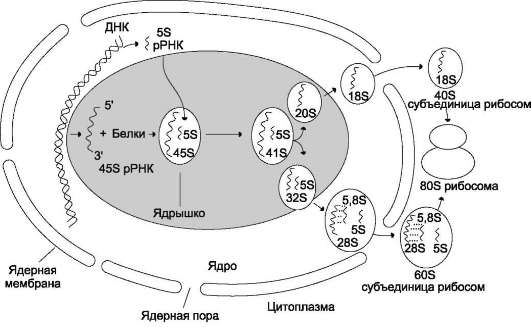
Рис. 4-35. Образование и выход из ядра субъединиц рибосом. В результате процессинга из молекулы предшественника 45S рРНК образуются три типа рРНК: 18S, входящая в состав малой субъединицы рибосом, а также 28S и 5,8S, локализующиеся в большой субъединице. Все три рРНК образуются в равных количествах, так как они происходят из одного и того же первичного транскрипта. 5S рРНК большой субъединицы рибосом транскрибируется отдельно от первичного транскрипта 45S рРНК. Рибосомальные РНК, образованные в ходе посттранскрипционных модификаций, связываются со специфическими белками, и образуется рибосома.
Рибосома - органелла клетки, участвующая в биосинтезе белка. Рибосома эукариотов (80S) состоит из двух, большой и малой, субъединиц: 60S и 40S. Белки рибосом выполняют структурную, регуляторную и каталитическую функции.
v. биосинтез белков (трансляция)
Перевод информации, заключённой в по-линуклеотидной последовательности мРНК, в аминокислотную последовательность белка требует определённого способа кодирования или шифрования, т.е. существования определённого закона, по которому чередование четырёх нуклеотидов в мРНК задаёт специфическую последовательность аминокислот в белке.
А. ГЕНЕТИЧЕСКИЙ КОД И ЕГО СВОЙСТВА
Необходимость кодирования структуры белков в линейной последовательности нуклеоти-дов мРНК и ДНК продиктована тем, что в ходе трансляции:
• нет соответствия между числом мономеров в матрице мРНК и продукте - синтезируемом белке;
• отсутствует структурное сходство между мономерами РНК и белка.
Это исключает комплементарное взаимодействие между матрицей и продуктом - принцип, по которому осуществляется построение новых молекул ДНК и РНК в ходе репликации и транскрипции.
Отсюда становится ясным, что должен существовать «словарь», позволяющий выяснить, какая последовательность нуклеотидов мРНК обеспечивает включение в белок аминокислот в заданной последовательности. Этот «словарь» получил название генетического, биологического, нуклеотидного, или аминокислотного кода. Он позволяет шифровать аминокислоты, входящие в состав белков, с помощью определённой последовательности нуклеотидов в ДНК и мРНК. Для него характерны определённые свойства.
Триплетность. Одним из основных вопросов при выяснении свойств кода был вопрос о числе нуклеотидов, которое должно определять включение в белок одной аминокислоты. Сразу было
понятно, что это число не может быть равным 1 или 2, так как в этом случае количество кодирующих элементов будет недостаточным для шифрования 20 аминокислот в белках. Число кодирующих последовательностей из четырёх нуклеотидов по три равно 43=64, что более чем в 3 раза превышает минимальное количество, которое необходимо для кодирования 20 аминокислот. В дальнейшем было установлено, что кодирующими элементами в шифровании аминокислотной последовательности действительно являются тройки нуклеотидов, или триплеты, которые получили название «кодоны».
Смысл кодонов
Смысл кодонов стал понятен в 60-х г. XX столетия, когда, используя бесклеточную систему синтеза белков (табл. 4-3) и синтетические поли-рибонуклеотиды с заданной последовательностью нуклеотидов в качестве матрицы, М. Ниренберг и Г. Маттеи синтезировали полипептиды определённого строения. Так, на матрице поли-У, состоящей только из остатков УМФ, был получен полифенилаланин, а на матрице поли-Ц - поли-пролин. Из этого следовало, что триплет -UUU кодирует Фен, а триплет -ССС - Про.
В последующих экспериментах использовали смешанные синтетические полирибонуклеотиды с известным составом. В результате этой работы удалось установить, что из 64 кодонов включение аминокислот в синтезирующуюся полипептидную цепь шифрует 61 триплет, а 3 остальных - UAA, UAG, UGA не кодируют включение в белок аминокислот и первоначально были названы бессмысленными, или нонсенс-кодонами. Однако в дальнейшем было показано, что эти триплеты сигнализируют о завершении трансляции, и поэтому их стали называть терминирующими, или стоп-кодонами.
Кодоны мРНК и триплеты нуклеотидов в кодирующей нити ДНК с направлением от 5' к З'-концу имеют одинаковую последовательность азотистых оснований, за исключением того, что в ДНК вместо урацила (U), характерного для мРНК, стоит тимин (Т).
Специфичность
Каждому кодону соответствует только одна определённая аминокислота. В этом смысле генетический код строго однозначен.
Таблица 4-3. Основные компоненты белоксинтезирующей системы

Примечания: eIF (eukaryotic initiation factors) - факторы инициации; eEF (eukaryotic elongation factors) факторы элонгации; eRF (eukaryotic releasing factors) - факторы терминации.
Вырожденность
В мРНК и ДНК имеет смысл 61 триплет, каждый из которых кодирует включение в белок одной из 20 аминокислот. Из этого следует, что в информационных молекулах включение в белок одной и той же аминокислоты определяют несколько кодонов. Это свойство биологического кода получило название вырожденности.
У человека одним кодоном зашифрованы только 2 аминокислоты - Мет и Три, тогда как Лей, Сер и Арг - шестью кодонами, а Ала, Вал, Гли, Про, Тре - четырьмя кодонами (табл. 4-4).
Избыточность кодирующих последовательностей - ценнейшее свойство кода, так как она повышает устойчивость информационного потока к неблагоприятным воздействиям внешней и внутренней среды. При определении природы аминокислоты, которая должна быть включена в белок, третий нуклеотид в кодоне не имеет столь важного значения, как первые два. Как видно из табл. 4-4, для многих аминокислот замена нуклеотида в третьей позиции кодона не сказывается на его смысле.
Линейность записи информации
В ходе трансляции кодоны мРНК «читаются» с фиксированной стартовой точки последова-
тельно и не перекрываются. В записи информации отсутствуют сигналы, указывающие на конец одного кодона и начало следующего.
Кодон AUG является инициирующим и прочитывается как в начале, так и в других участках мРНК как Мет. Следующие за ним триплеты читаются последовательно без каких-либо пропусков вплоть до стоп-кодона, на котором синтез полипептидной цепи завершается.
Универсальность
До недавнего времени считалось, что код абсолютно универсален, т.е. смысл кодовых слов одинаков для всех изученных организмов: вирусов, бактерий, растений, земноводных, млекопитающих, включая человека. Однако позднее стало известно одно исключение, оказалось, что митохондриальная мРНК содержит 4 триплета, имеющих другое значение, чем в мРНК ядерного происхождения. Так, в мРНК митохондрий триплет UGA кодирует Три, AUA - Мет, а AGA и AGG прочитываются как дополнительные стоп-кодоны.
Колинеарность гена и продукта
У прокариотов обнаружено линейное соответствие последовательности кодонов гена и последовательности аминокислот в белковом
Таблица 4-4. Генетический код
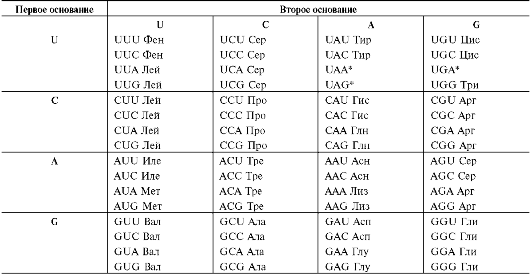
Примечания: U - урацил; C - цитозин; A - аденин; G - гуанин; * - терминирующий кодон.
продукте, или, как говорят, существует коли-неарность гена и продукта.
У эукариотов последовательности оснований в гене, колинеарные аминокислотной последовательности в белке, прерываются интронами. Поэтому в эукариотических клетках аминокислотная последовательность белка колинеарна последовательности экзонов в гене или зрелой мРНК после посттранскрипционного удаления интронов.
Б. ОСНОВНЫЕ КОМПОНЕНТЫ БЕЛОКСИНТЕЗИРУЮЩЕЙ СИСТЕМЫ
Как видно из табл. 4-3, для синтеза полипептидной цепи необходимо большое количество компонентов, совместное и согласованное взаимодействие которых приводит к образованию белка.
Аминокислоты
Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. Это требование прежде всего относится к незаменимым (т.е. не синтезирующимся в организме) аминокислотам,
так как недостаточное снабжение клетки хотя бы одной незаменимой аминокислотой приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок.
мРНК. Содержит информацию о структуре синтезируемого белка и используется в качестве матрицы.
тРНК. У человека около 50 различных тРНК обеспечивают включение аминокислот в белок. тРНК называют «адапторные молекулы», так как к акцепторному концу этих молекул может быть присоединена определённая аминокислота, а с помощью антикодона они узнают специфический кодон на мРНК. В процессе синтеза белка на рибосоме связывание антикодонов тРНК с кодонами мРНК происходит по принципу ком-плементарности и антипараллельности.

Однако оказалось, что число тРНК для каждой аминокислоты не совпадает с числом кодирующих её кодонов в мРНК, и, следовательно,
некоторые тРНК способны связываться больше чем с одним кодоном.
Исследование этого вопроса позволило установить следующее:
• первые два основания кодона и последние два основания антикодона образуют обычные прочные пары (гуанин-цитозин и аде-нин-урацил) и вносят наибольший вклад в специфичность декодирования;
• связывание третьего основания кодона с первым основанием антикодона происходит слабее, чем с первыми двумя, и это позволяет некоторым тРНК прочитывать больше чем один кодон.
Гипотеза, объясняющая характер кодон-анти-кодонового взаимодействия, получила название «гипотезы качания» (т.е. третье основание большинства кодонов имеет определённую степень свободы при образовании пары с соответствующим антикодоном и как бы «качается»).
Так, например, одна из аргининовых тРНК имеет антикодон 5'-I-C-G-3', который может узнавать 3 разных аргининовых кодона:

Аминоацил-тРНК синтетазы (аминоацил-тРНК лигазы)
В цитозоле клеток 20 различных аминокислот присоединяются α-карбоксильной группой к З'-гидроксильному акцепторному концу соответствующих тРНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-тРНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те тРНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК синтетаз входит 20 различных ферментов. Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения - аминоацил-АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК (рис. 4-36).
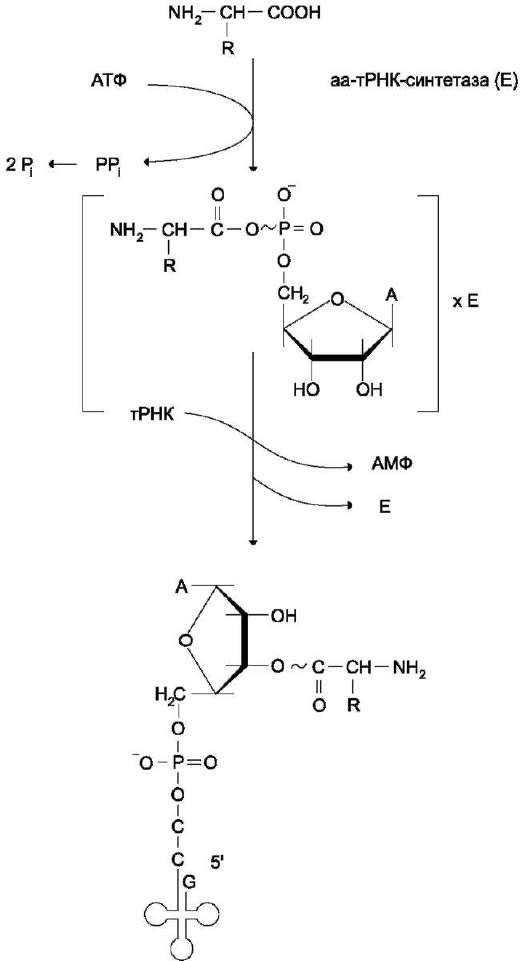
Рис. 4-36. Образование аминоацил-тРНК. Аминокислота взаимодействует с АТФ и активируется, образуя аминоацил-аденилат, который, не освобождаясь из связи с ферментом (Е), отдаёт активированную аминокислоту тРНК с образованием аминоацил-тРНК (аа-тРНК).
Суммарную реакцию, катализируемую ами-ноацил-тРНК синтетазами в присутствии ионов Mg2+, можно представить следующим образом:
Аминокислота +тРНК + АТФ → аминоацил-тРНК + АМФ + РР.
Для каждой аминокислоты существует свой фермент - своя аминоацил тРНК синтетаза: для глутамата - глутамил-тРНК синтетаза, гисти-дина - гистидил-тРНК синтетаза и т.д.
Аминокислоты присоединяются к 3'- или 2'-OH группам рибозы на З'-конце тРНК, где все тРНК имеют общую нуклеотидную последовательность -ССА.
Энергия, заключённая в макроэргической сложноэфирной связи аминоацил~тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка.
Пирофосфат, выделяющийся в ходе этой реакции, гидролитически расщепляется с образованием двух молекул ортофосфата и выделением энергии, что делает реакцию активации аминокислот необратимой.
Чрезвычайно высокая специфичность аа-тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвёртый - для присоединения молекулы Н2О, которая участвует в гидролизе неправильных аминоациладенилатов. За счёт существования в активном центре этих ферментов корректирующего механизма, обеспечивающего немедленное удаление ошибочно присоединённого аминокислотного остатка, достигается поразительно высокая точность работы: на 1300 связанных с тРНК аминокислот встречается только одна ошибка.
Аминокислота, присоединяясь к тРНК, в дальнейшем не определяет специфических свойств аа-тРНК, так как её структуру не узнаёт ни рибосома, ни мРНК. Участие в синтезе белка зависит только от структуры тРНК, а точнее, от комплементарного взаимодействия антикодона аминоацил-тРНК с кодоном мРНК.
Антикодон расположен в центральной (ан-тикодоновой) петле тРНК. Узнавание тРНК аа-тРНК синтетазами не всегда происходит только по антикодоновой петле. Активный центр некоторых ферментов обнаруживает комплементарное соответствие другим участкам пространственной структуры тРНК.
Рибосомы
Рибосомы представляют собой рибонуклео-протеиновые образования - своеобразные
«фабрики», на которых идёт сборка аминокислот в белки. Эукариотические рибосомы имеют константу седиментации 80S и состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки. В 40S субъединицу входит рРНК с константой седиментации 18S и 33 молекулы белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и 49 различных белков.
Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом.
В присутствии мРНК 40S и 60S субъединицы объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина.
В рибосоме есть 2 центра для присоединения молекул тРНК: аминоацильный (А) и пепти-дильный (Р) центры, в образовании которых участвуют обе субъединицы. Вместе центры А и Р включают участок мРНК, равный 2 ко-донам. В ходе трансляции центр А связывает аа-тРНК, строение которой определяет кодон, находящийся в области этого центра. В структуре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр Р занимает пепти-дил-тРНК, т.е. тРНК, связанная с пептидной цепочкой, которая уже синтезирована.
У эукариотов различают рибосомы 2 типов: «свободные», обнаруживаемые в цитоплазме клеток, и связанные с эндоплазматическим ре-тикулумом (ЭР). Рибосомы, ассоциированные с ЭР, ответственны за синтез белков «на экспорт», которые выходят в плазму крови и участвуют в обновлении белков ЭР, мембраны аппарата Гольджи, митохондрий или лизосом.
Митохондрии содержат свой набор рибосом. Митохондриальные рибосомы мельче, чем рибосомы эукариотов, прокариотов и имеют константу седиментации 55S. Они также состоят из двух субъединиц, но отличаются от эукари-отических рибосом количеством и составом рРНК и белков.
Белковые факторы
В каждой стадии белкового синтеза на рибосоме: инициации, элонгации и терминации участвует разный набор внерибосомных белко-
вых факторов. Эти белки связываются с рибосомой или её субъединицами на определённых стадиях процесса и стабилизируют или облегчают функционирование белоксинтезирующей машины.
АТФ и ГТФ как источники энергии
На включение одной аминокислоты в растущую полипептидную цепь клетка затрачивает 4 макроэргические связи: 2 из АТФ в ходе реакции, катализируемой аа-тРНК синтетазой (в процессе активации аминокислот АТФ расщепляется на АМФ и пирофосфат), и 2 молекулы ГТФ: одна используется на связывание аа-тРНК в А-центре рибосомы, а вторая затрачивается на стадию транслокации. К этому следует добавить использование макроэргических связей молекул: АТФ и ГТФ на инициацию и терминацию синтеза полипептидной цепи.
В. СИНТЕЗ ПОЛИПЕПТИДНОЙ ЦЕПИ НА РИБОСОМЕ
В ходе синтеза белка прочтение информации мРНК идёт в направлении от 5'- к З'-концу, обеспечивая синтез пептида от N- к С-концу.
Каждая эукариотическая мРНК кодирует строение только одной полипептидной цепи (т.е. она моноцистронна), в отличие от прока-риотических мРНК, которые часто содержат информацию о нескольких пептидах (т.е. они полицистронны). Эти различия вызваны тем, что у прокариотов ДНК лишена интронов, и РНК-полимераза транскрибирует участки, прочтение информации с которых подчиняется общему регуляторному механизму. Кроме того, на полицистронных мРНК синтез белка начинается до того, как заканчивается их собственный синтез, так как процессы транскрипции и трансляции не разделены. У эукариотов трансляция протекает в цитоплазме, куда из ядра поступают уже «зрелые» мРНК.
События на рибосоме включают этапы: инициации, элонгации и терминации.
1. Инициация
Инициация трансляции представляет собой событие, в ходе которого происходит образование комплекса, включающего Мет-тРНКiМет, мРНК и рибосому, где тРНКiМет - иници-
ирующая
метиониновая тРНК (рис. 4-37). В этом процессе участвуют не менее 10
факторов инициации, которые обозначают как eIF (от англ. eukaryotic initiation factors) с
указанием номера и буквы. Первоначально 40S субъединица рибосомы
соединяется с фактором инициации, который препятствует её связыванию с
60S субъединицей, но стимулирует объединение с тройным комплексом,
включающим Мет-тРНКiМет, eIF-2 и ГТФ. Затем этот
теперь уже более сложный комплекс связывается с 5'-концом мРНК при
участии нескольких eIF. Один из факторов инициации (eIF-
Достигнув начала кодирующей последовательности мРНК, 40S субъединица останавливается и связывается с другими факторами инициации, ускоряющими присоединение 60S субъединицы и образование 80S рибосомы за счёт гидролиза ГТФ до ГДФ и неорганического фосфата. При этом формируются А- и Р-цент-ры рибосомы, причём в Р-центре оказывается AUG-кодон мРНК с присоединённым к нему Мет-тРНКiМет.
В клетках есть 2 различающиеся по структуре тРНК, узнающие кодон AUG. Инициирующий кодон узнаёт тРНКiМет, а триплеты мРНК, кодирующие включение метионина во внутренние участки белка, прочитываются другой
тРНКМет.
2. Элонгация
По завершении инициации рибосома располагается на мРНК таким образом, что в Р-центре находится инициирующий кодон AUG с присоединённой к нему Мет-тРНКiМет, а в
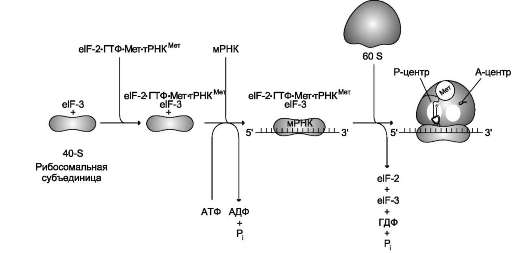
Рис. 4-37. Образование инициирующего комплекса в ходе синтеза белка у эукариотов. Мет-тРНКi.Мет объединяется с малой субъединицей рибосомы в форме тройного комплекса: Мет-тРНКМет, eIF-2 и ГТФ. Образовавшийся более сложный четырёхкомпонентный комплекс присоединяется к 5'-концу мРНК с помощью нескольких дополнительных факторов, и малая субъединица начинает скользить по мРНК до тех пор, пока антикодон Мет-тРНКМет не свяжется с инициирующим кодоном AUG. При этом в комплексе происходит изменение состава инициирующих факторов, и ускоряется присоединение 60S субъединицы рибосомы, сопровождающееся гидролизом ГТФ. Мет-тРНКiМет занимает на рибосоме Р-центр.
А-центре - триплет, кодирующий включение первой аминокислоты синтезируемого белка. Далее начинается самый продолжительный этап белкового синтеза - элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно «читает» мРНК в виде триплетов нуклеотидов, следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот.
Включение каждой аминокислоты в белок происходит в 3 стадии, в ходе которых:
• аа-тРНК каждой входящей в белок аминокислоты связывается с А-центром рибосомы;
• пептид от пептидил-тРНК, находящейся в Р-центре, присоединяется к α-NН2-группе аминоацильного остатка аа-тРНК А-центра с образованием новой пептидной связи;
• удлинённая на один аминокислотный остаток пептидил-тРНК перемещается из А-центра в Р-центр в результате транслокации рибосомы.
Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяет природу аа1-тРНКaa1, которая будет включена в А-центр. аа1-тРНКаа1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа1-тРНКаа1 и ГТФ. Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа-тРНКаа1 комплементарен и антипараллелен кодону мРНК в А-центре. Включение аа-тРНКаа1 в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата (рис. 4-38).
Образование пептидной связи происходит сразу же после отщепления комплекса EF-1 и ГДФ от рибосомы. Эта стадия процесса получила название реакции транспептидации (рис. 4-39).
В ходе этой реакции остаток метионина Мет-тРНКiМет связывается с α-аминогруппой первой аминокислоты, присоединённой к тРНКаа1 и расположенной в А-центре, образуется первая пептидная связь. Установлено, что пептидил-
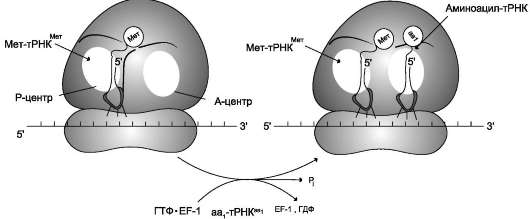
Рис. 4-38. Включение аа1-тРНКаа1 в рибосому. аа1-тРНКаа1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа1-тРНКаа1 и ГТФ. Антикодон аа1-тРНКаа1 комплементарен и антипараллелен кодону мРНК в А-центре. Связывание аа1-тРНКаа1 происходит за счёт энергии гидролиза ГТФ до ГДФ и Рi
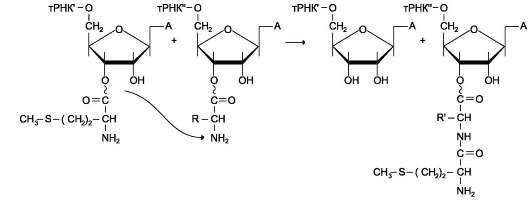
Рис. 4-39. Реакция транспептидации. Метионин от Мет-тРНК.Мет, находящегося в Р-центре, присоединяется к α-NН2-группе аминоацильного остатка аа1-тРНКаа1 А-центра с образованием новой пептидной связи.
трансферазная активность большой субъединицы рибосомы принадлежит 28S рРНК. К настоящему времени обнаружена целая группа РНК, обладающая свойствами ферментов. Эти каталитически активные РНК получили название рибозимов (см. раздел 2). Полагают, что рибозимы можно считать «реликтами» раннего периода эволюции, когда белки ещё не приобрели такого значения, как в последующие периоды.
Транслокация - третья стадия элонгации. К рибосоме присоединяется фактор элонгации EF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, из А-центра перемещается в Р-центр. Свободная от метионина тРНКiМет покидает рибосому, а в область А-центра попадает следующий кодон (рис. 4-40).
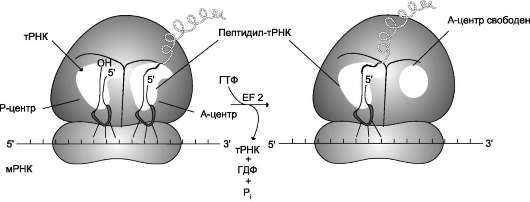
Рис. 4-40. Стадия транслокации. К рибосоме присоединяется фактор элонгации EF-2, и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. Пептидил-тРНК, не меняя своего положения относительно мРНК, из А-центра перемещается в P-центр.
По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в полипептидную цепь второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
3.Терминация
Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF (от англ. releasing factor) или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы (рис. 4-41).
Интересно отметить, что факторы трансляции, реализующие эффекты за счёт гидролиза ГТФ, являются членами суперсемейства G-белков, в которое входят G-белки, участвующие в тран-сдукции сигналов гормонов и других биологически активных веществ, и Ras-белки, функ-
ционирующие как факторы роста (см. разделы 11, 15). Все G-белки связывают и гидролизуют ГТФ. Когда они связаны с ГТФ, то активны и участвуют в соответствующих метаболических процессах, а когда в активном центре в результате гидролиза ГТФ превращается в ГДФ, эти белки приобретают неактивную конформацию.
Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза белка строго детерминирована мРНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задаёт структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды «нужные» аа-тРНК, освобождая в ходе элонгации деацилированные
тРНК.
Малая и большая субъединицы рибосомы в процессе трансляции выполняют разные функции: малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации, а большая субъединица ответственна за образование пептидных связей.
Г. ПОЛИРИБОСОМЫ
В процессе синтеза белка рибосома присоединяется к 5'-концу мРНК и перемещается в
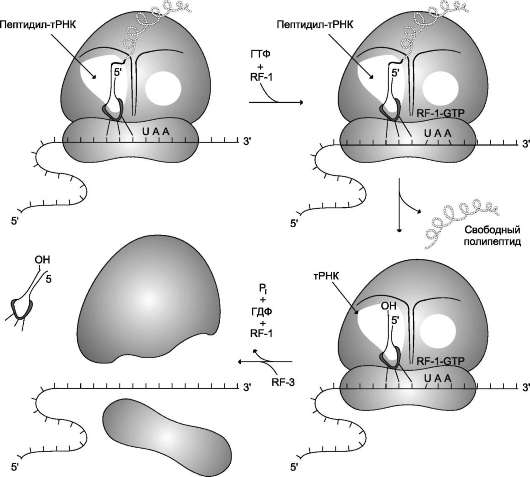
Рис. 4-41. Терминация синтеза белка.
направлении З'-конца. При этом 5'-конец мРНК освобождается, и к нему может присоединиться новая рибосома, на которой начинается рост ещё одной полипептидной цепи. Как правило, много рибосом одновременно участвует в син-тезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой, или полисомой (рис. 4-42).
Каждая рибосома занимает на мРНК участок длиной около 80 нуклеотидов, поэтому рибо-сомы располагаются на мРНК с интервалом примерно в 100 нуклеотидов. Чем длиннее полипептидная цепочка синтезируемого бел-
ка, тем больше рибосом может одновременно осуществлять синтез этого белка, значительно увеличивая таким образом эффективность ис-пользования матрицы.
Каждая рибосома способна катализировать об-разование около 100 пептидных связей в минуту. Полирибосомы могут существовать в виде час-тиц, плавающих в цитоплазме клеток, или могут быть связаны с ЭР. Свободные цитоплазматичес-кие полирибосомные частицы ответственны за синтез белков, выполняющих внутриклеточные функции. Полирибосомы, ассоциированные с ЭР, под электронным микроскопом имеют вид
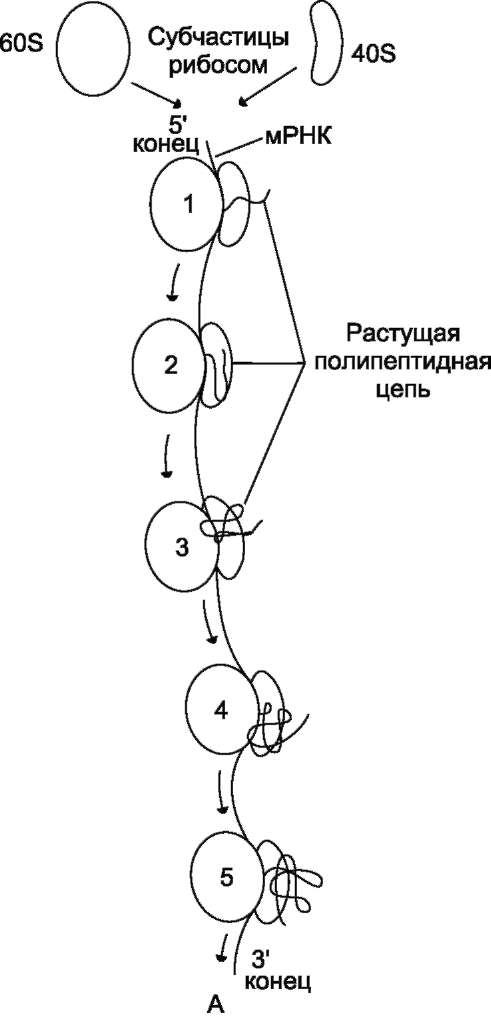
Рис. 4-42. Синтез белков на полирибосомном комплексе. Пять рибосом считывают информацию, содержащуюся в мРНК.
«шероховатой» поверхности. Белки, синтезиру-емые «шероховатым» ЭР, должны транспорти-роваться через мембрану для того, чтобы они достигли места окончательной локализации. Для них характерно присутствие на N-конце лидерной, или сигнальной, последовательности длиной от 15 до З0 аминокислотных остатков, которая содержит много аминокислот с гидро-фобными радикалами и обеспечивает прохож-дение белка через липидный бислой мембран. Некоторые из этих белков для дальнейшего транспорта упаковываются аппаратом Гольджи в секреторные гранулы.
Д. ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ ПОЛИПЕПТИДНОЙ ЦЕПИ
Полипептидные цепи могут подвергаться структурным модификациям, либо будучи ещё связанными с рибосомами, либо после завершения синтеза. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации.
Многие модификации осуществляются в ЭР. Здесь происходят фолдинг полипептидных цепей и формирование уникальной третичной или четвертичной структуры белков. Причём для поддержания нативной конформации молекул огромное значение имеет правильное формиро-вание дисульфидных связей.
Частичный протеолиз
Многие белки, секретируемые из клеток, первоначально синтезируются в виде моле-кул-предшественников, функционально неак-тивных. Удаление части полипептидной цепи специфическими эндопротеазами приводит к образованию активных молекул. Некото-рые белки-предшественники расщепляются в ЭР или аппарате Гольджи, другие - после секреции. Так, неактивные предшественники секретируемых ферментов - зимогены - об-разуют активный фермент после расщепления по определённым участкам молекулы: зимоген панкреатической железы трипсиноген превра-щается в активный трипсин после секреции в тонкий кишечник.
Наглядным примером последовательного двухстадийного протеолиза служит образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов. Первоначально N-концевой сигнальный пептид молекулы-предшественника удаляется в ЭР в процессе синтеза белка и образуется неактивный прогормон. Затем прогормон в секреторных гранулах, формирующихся в аппарате Гольджи, подвергается действию эндо- и/или экзопротеаз и превращается в активный гормон.
Ковалентные модификации
Структурные белки и ферменты могут активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метильных, олигосаха-ридных и некоторых других.
Фосфорилирование белков осуществляется по гидроксильным группам серина, треонина и, реже, тирозина ферментами из группы про-теинкиназ, тогда как дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы (см. раздел 2). Гликозилирование. Белки, входящие в состав плазматических мембран или секретирую-щиеся из клеток, подвергаются гликозили-рованию. Углеводные цепи присоединяются по гидроксильным группам серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и аппарате Гольджи. Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот: в тиреоглобулине йодируются остатки тирозина; в факторах свёртывания крови карбоксилируются остатки глутамата; в ЭР фибробластов гидроксилируются остатки пролина и лизина в цепях тропоколлагена.
vi. ингибиторы матричных биосинтезов
Существует большая группа веществ, ингиби-рующая синтез ДНК, РНК или белков. Некоторые из них нашли применение в медицине для лечения инфекционных болезней и опухолевых новообразований, а другие для человека оказались токсинами.
Действие ингибиторов матричных биосинтезов как лекарственных препаратов основано на модификации матриц: ДНК, РНК, белоксин-тезирующего аппарата (прежде всего, рибосом) или на инактивации ферментов. Центральное место среди них принадлежит антибиотикам - разнообразным по химическому строению органическим соединениям, синтезируемым микроорганизмами, главным образом, микроскопическими грибами и способным в малых количествах оказывать избирательное токсическое действие на другие микроорганизмы (табл. 4-5).
А. ИНГИБИТОРЫ РЕПЛИКАЦИИ - ПРОТИВООПУХОЛЕВЫЕ ПРЕПАРАТЫ
Антибиотики, взаимодействующие с ДНК, нарушают её матричную функцию и вызывают подавление процессов репликации и транскрипции. Их используют для лечения злокачественных новообразований и называют противоопухолевыми препаратами (см. раздел 15). Дауномицин, доксо-рубицин и некоторые другие взаимодействуют с молекулой ДНК таким образом, что циклическая структура этих антибиотиков встраивается («ин-теркалирует») между парами оснований G=C, а углеводный компонент занимает малую бороздку ДНК (рис. 4-4З). Это ведёт к локальному изменению структуры ДНК и ингибированию репликации и транскрипции.
К «интеркаляторам» относят также антибиотик актиномицин D, блокирующий синтез ДНК и РНК у про- и эукариотов. Это соединение слишком токсично, чтобы использовать его в клинических целях, но его широко используют в научно-исследовательской работе для изучения процессинга первичных транскриптов РНК.
Избирательность действия противоопухолевых антибиотиков невелика и обеспечивается более высокой по сравнению с нормальными клетками скоростью синтеза ДНК и РНК, а также повышенной проницаемостью клеточных мембран опухолевых клеток. В то же время эти соединения токсичны для быстроделящихся нормальных клеток организма, таких как стволовые клетки кроветворной системы, клетки слизистой оболочки желудка и кишечника, фолликулов волос. В последние годы проводятся исследования по созданию препаратов, обеспечивающих доставку ингибитора только в опухолевые клетки. Это достигается связыванием цитотоксических антибиотиков с белками, рецепторы к которым имеются главным образом на опухолевых клетках (см. раздел 15).
К препаратам, останавливающим репликацию, относят алкилирующие агенты и ингибиторы ДНК-топоизомеразы II (одной из изоформ топо-изомераз). Последние называют ингибиторами гираз, поскольку ДНК-гиразы - ферменты прокариотических клеток, ответственные за суперспирализацию ДНК; у эукариотов аналогичную функцию выполняют ДНК-топоизоме-разы. Известно, что транскрипция некоторых генов возможна лишь при определённом уров-
Рис. 4-43. Строение «интеркаляторов» - дауномицина и актиномицина D.
не суперспирализации матрицы. Соединения, вмешивающиеся в работу ДНК-гираз, могут ингибировать или активировать синтез РНК. К ингибиторам гираз принадлежат налидиксовая кислота, новобиоцин, номермицин и фторхино-лоны: норфлоксацин, пефлоксацин и др.
Б. ИНГИБИТОРЫ ТРАНСКРИПЦИИ И ТРАНСЛЯЦИИ - АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫ
К ингибиторам матричных синтезов, оказывающим противобактериальное действие, относят вещества, блокирующие синтез РНК или белка. В эту группу входит широко применяемый в клинике рифампицин, получаемый на основе природного антибиотика рифамицина. Антибиотики из семейства рифамицинов ингибируют только бактериальную ДНК-зависимую РНК-по-лимеразу, связываясь с β-субъединицей фермента
и препятствуя инициации транскрипции (рис. 4-44). Их применяют для лечения туберкулёза, так как эти препараты не влияют на работу ядерных РНК-полимераз эукариотических клеток. Однако они могут ингибировать синтез митохондриальных РНК, хотя дозы препарата, при которых блокируется образование мито-хондриальных РНК, выше тех, что используют в лечении инфекционного заболевания.
Большая группа антибиотиков является ингибиторами трансляции (рис. 4-45): тетрациклины, эритромицин, пуромицин, хлорамфеникол и аминогликозиды. Так, один из наиболее извес-тных аминогликозидов стрептомицин ингибирует инициацию синтеза белка у прокариотов и вызывает ошибки в прочтении информации, закодированной в мРНК. Его часто назначают при лечении инфекционных заболеваний сердца. К антибиотикам широкого спектра действия относят тетрациклины. Они связываются
Таблица 4-5. Антибиотики - ингибиторы матричных биосинтезов как лекарственные препараты
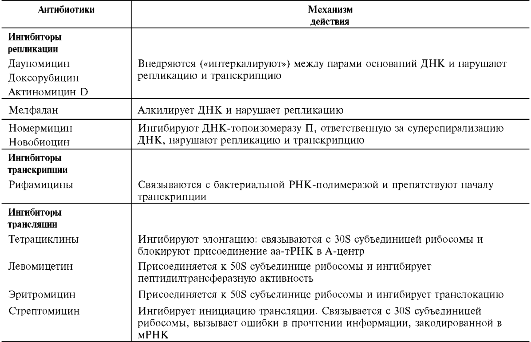
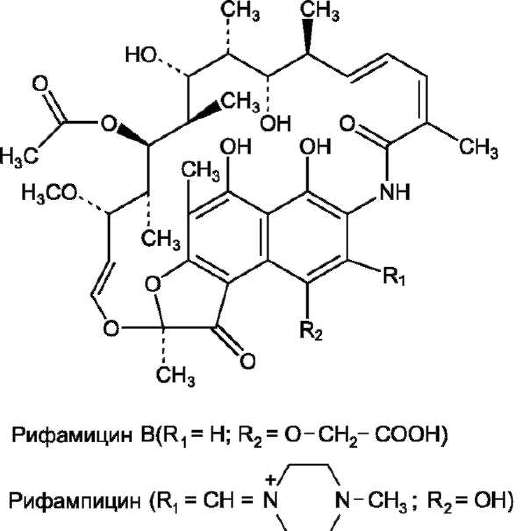
Рис. 4-44. Антибиотики из семейства рифамицинов.
с 30S субъединицей рибосомы и блокируют присоединение аминоацил-тРНК в А-центр рибосомы, тем самым нарушая элонгацию полипептидной цепи. Тетрациклины эффективны в отношении возбудителей многих болезней. Левомицетин (хлорамфеникол) также относят к антибиотикам широкого спектра действия. Он ингибирует синтез белка за счёт присоединения к 50S субъединице рибосомы, подавляя пепти-дилтрансферазную активность.
Пенициллины и цефалоспорины относят к группе β-лактамных антибиотиков, продуцируемых плесенью рода Penicillum и грибами рода Cephalosporium. В структуре этих молекул присутствует реакционноспособное β-лактамное кольцо, вызывающее ингибирование синтеза клеточных стенок у грамотрицательных и грам-положительных микроорганизмов. Действие этих антибиотиков направлено на фермент, обеспечивающий образование поперечных связей в структуре белков клеточной стенки
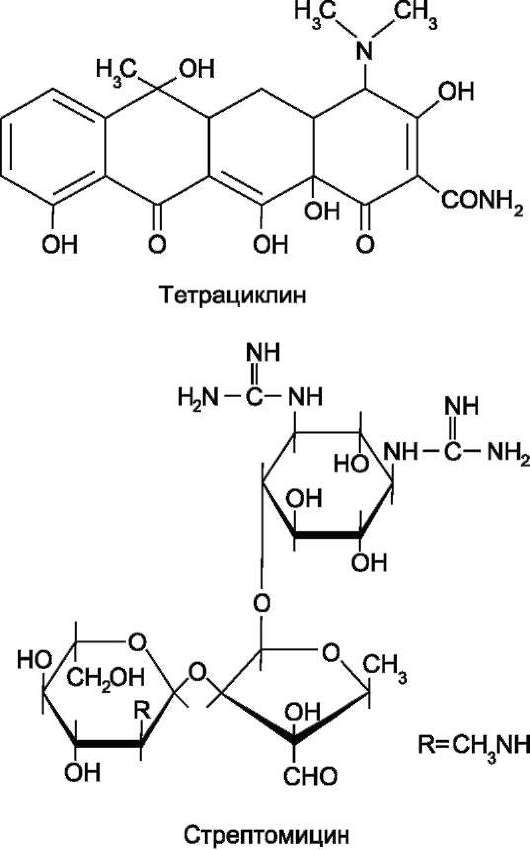
Рис. 4-45. Некоторые антибиотики-ингибиторы синтеза белков у прокариотов.
бактерий. Необратимое ингибирование активности этого фермента ведёт к образованию изменённых клеточных стенок и гибели бактерий в процессе размножения.
Надо сказать, что препараты антибактериальной группы отличаются высокой избирательностью и сравнительно мало токсичны для человека. Это объясняется различиями в структуре РНК-полимераз, РНК и белков рибосом в эукариотических и прокариотических клетках.
В. ВИРУСЫ И токсины - ИНГИБИТОРЫ МАТРИЧНЫХ СИНТЕЗОВ В ЭУКАРИОТИЧЕСКИХ КЛЕТКАХ
Вирусы
Генетический материал вирусов представлен молекулой ДНК или РНК. Он, как правило, невелик и содержит информацию лишь о некоторых специфических белках и ферментах,
необходимых для репродукции вируса (например, вирусов оспы, гриппа, полиомиелита, гепатита). Вскоре после заражения с высокой скоростью начинается синтез вирусных ДНК, РНК и белков с использованием ферментов и белков, субстратов и источников энергии клетки хозяина. При этом в инфицированных клетках прекращается синтез нуклеиновых кислот и белков, свойственных организму хозяина. Репродукция вирусных частиц идёт вплоть до гибели заражённой клетки.
Токсины
Причиной гибели людей при отравлении бледной поганкой Amanita phalloides является токсин - α-аманитин, который содержится в теле гриба и вызывает необратимую дисфункцию печени и почек. Высокая токсичность этого соединения для человека связана с тем, что оно ингибирует эукариотические РНК-полимеразы. Наибольшую чувствительность к яду обнаруживает РНК-полимераза II, катализирующая синтез мРНК. Для α-аманитина LD50 (доза per os, при которой погибает 50% лиц, получивших токсин) составляет 0,1 мг/кг массы тела.
Чрезвычайно токсичен белок рицин, выделенный из клещевины обыкновенной. Он представляет собой N-гликозилазу, которая удаляет один остаток аденина из 28S рРНК большой субъединицы рибосомы и ингибирует синтез белка у эукариотов. Рицин - белковый компонент касторового масла, иногда используемого в качестве слабительного средства. Из-за высокой токсичности рицина лечение касторовым маслом проводят короткими курсами, так как длительное употребление может вызвать нарушение работы кишечника, сопровождающееся непрекращающимся поносом и даже гибелью больного.
У человека развитие некоторых бактериальных инфекций осложняется ингибирова-нием матричных синтезов. Наиболее изученный пример - ингибирование синтеза белков в клетках слизистой оболочки зева и гортани энтеротоксином возбудителя дифтерии Corynebacterium diphteriae. Некоторые штаммы этого патогенного микроорганизма получают ген токсина от бактериального вируса, называемого β-фагом, который инфицирует бактерию и инду-цирует синтез токсина - одноцепочечного белка
с молекулярной массой 60 кД. В цитоплазме клеток хозяина под влиянием протеолитических ферментов токсин расщепляется на 2 фрагмента, один из которых является ферментом АДФ-ри-бозилтрансферазой. Этот фермент катализирует АДФ-рибозилирование и инактивацию фактора элонгации EF-2 по реакции:
EF-2 + NAD+ → АДФ-рибозил - EF-2 + никотинамид + Н+.
В условиях in vitro эта реакция обратима, но при рН и концентрации никотинамида, которые существуют в клетках, она становится необратимой. Модификация фактора EF-2 нарушает транслокацию рибосом, ведёт к прекращению биосинтеза белков в инфицированных клетках и к их гибели. С действием токсина связаны основные симптомы дифтерии.
Описаны и другие токсины бактериального и растительного происхождения, ингибирующие синтез и функциональную активность белков путём АДФ-рибозилирования или модификации
рРНК.
Г. ИНТЕРФЕРОНЫ
Интерфероны
- небольшие белки (гликопро-теины), состоящие примерно из 160
аминокислотных остатков. Они секретируются некоторыми клетками
позвоночных в ответ на заражение вирусами и препятствуют
распространению вирусной инфекции. Этот класс белков синтезируется в
исключительно малых количествах: от нанограммов (10-
Некоторые компоненты вирусных частиц (например, двухцепочечная РНК) индуцируют синтез по крайней мере 3 типов интерферонов. У человека имеются 14 генов, кодирующих α-интерфероны, которые продуцируются В-лимфоцитами и макрофагами, 5 генов β-ин-терферонов, обеспечивающих образование соответствующих белков фибробластами, и 1 ген γ-интерферона, экспрессия которого идёт в Т-лимфоцитах.
Связываясь с рецепторами на плазматической мембране заражённых клеток, эти белки, по-
добно белковым гормонам, стимулируют синтез ферментов, способных разрушать мРНК вирусов и прекращать синтез белков на рибосомах, препятствуя тем самым экспрессии вирусных генов в клетках эукариотов.
Исследование механизма действия интерфе-ронов показало, что они:
• ингибируют синтез белков, необходимых для репликации вирусов;
• стимулируют синтез фермента олигонук-леотидполимеразы, катализирующего образование небольших количеств коротких олигоаденилатов: 2',5'-олиго (А). Эти олигонуклеотиды являются активаторами рибонуклеазы - фермента, расщепляющего матричные и рибосомные РНК;
• стимулируют синтез протеинкиназы, которая фосфорилирует и, тем самым, инакти-вирует фактор инициации eIF2:
eIF2 + АТФ → eIF2-OPO3H2 + АДФ.
В результате синтез всех белков в инфицированных клетках прекращается. Клетки погибают, но вместе с ними останавливается размножение вирусов, и начинается выздоровление. Таким образом, жертвуя небольшим количеством клеток, организм защищает себя от болезни.
В настоящее время интерфероны, полученные промышленным путём с использованием техники клонирования генов, широко используют при лечении обычной простуды, гриппа, полиомиелита, ветряной оспы, герпеса, вируса гепатита и других инфекций. Хорошие результаты показывает использование интерферонов в терапии некоторых видов злокачественных опухолей, главным образом, гемобластозов (см. раздел 15).
vii. регуляция экспрессии генов у про- и эукариотов
Организмы адаптируются к меняющимся условиям окружающей среды путём изменения экспрессии (скорости транскрипции) генов. Этот процесс, в деталях изученный на бактериях и вирусах, включает взаимодействие специфических белков с участками ДНК в непосредственной близости от стартового участка транскрипции. При этом может происходить включение или выключение транскрипции. Эукариотические
клетки используют тот же самый принцип, хотя в регуляции реализуются и некоторые другие более сложные механизмы.
А. РЕГУЛЯЦИЯ АКТИВНОСТИ ГЕНОВ У ПРОКАРИОТОВ. ТЕОРИЯ ОПЕРОНА
Исследования на клетках E. coli позволили установить, что у бактерий существуют ферменты 3 типов:
конститутивные, присутствующие в клетках в постоянных количествах независимо от метаболического состояния организма (например, ферменты гликолиза); индуцируемые, их концентрация в обычных условиях мала, но может возрастать в 1000 раз и более, если, например, в среду культивирования клеток добавить субстрат такого фермента;
репрессируемые, т.е. ферменты метаболических путей, синтез которых прекращается при добавлении в среду выращивания конечного продукта этих путей.
1. Теория оперона
На основании генетических исследований индукции β-галактозидазы, участвующей в клетках E. coli, в гидролитическом расщеплении лактозы (рис. 4-46), Франсуа Жакоб и Жак Моно в
В экспериментах гипотеза оперона получила полное подтверждение, а предложенный в ней тип регуляции стали называть контролем синтеза белка на уровне транскрипции, так как в этом случае изменение скорости синтеза белков
осуществляется за счёт изменения скорости транскрипции генов, т.е. на стадии образования
мРНК.
У E. coli, как и у других прокариотов, ДНК не отделена от цитоплазмы ядерной оболочкой. В процессе транскрипции образуются первичные транскрипты, не содержащие интронов, а мРНК лишены «кэпа» и поли-А-конца. Синтез белка начинается до того, как заканчивается синтез его матрицы, т.е. транскрипция и трансляция протекают почти одновременно. Исходя из размера генома (4х106 пар нуклеотидов), каждая клетка E. coli содержит информацию о нескольких тысячах белков. Но при нормальных условиях роста она синтезирует около 600-800 различных белков, а это означает, что многие гены не транскрибируются, т.е. неактивны. Гены белков, функции которых в метаболических процессах тесно связаны, часто в геноме группируются вместе в структурные единицы (опероны). Согласно теории Жакоба и Моно, оперонами называют участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных структурных белков, и регу-ляторную зону, контролирующую транскрипцию этих генов. Структурные гены оперона экспрессируются согласованно, либо все они транскрибируются, и тогда оперон активен, либо ни один из генов не «прочитывается», и тогда оперон неактивен. Когда оперон активен и все его гены транскрибируются, то синтезируется полицистронная мРНК, служащая матрицей для синтеза всех белков этого оперона. Транскрипция структурных генов зависит от способности РНК-полимеразы присоединяться к промотору, расположенному на 5'-конце оперона перед структурными генами.

Рис. 4-46. Гидролиз лактозы β-галактозидазой.
Связывание РНК-полимеразы с промотором зависит от присутствия белка-репрессора на смежном с промотором участке, который называют «оператор». Белок-репрессор синтезируется в клетке с постоянной скоростью и имеет сродство к операторному участку. Структурно участки промотора и оператора частично перекрываются, поэтому присоединение белка-репрессора к оператору создаёт стерическое препятствие для присоединения РНК-полимеразы.
Большинство механизмов регуляции синтеза белков направлено на изменение скорости связывания РНК-полимеразы с промотором, влияя таким образом на этап инициации транскрипции. Гены, осуществляющие синтез регулятор-ных белков, могут быть удалены от оперона, транскрипцию которого они контролируют.
2. Индукция синтеза белков. Lac-оперон
Теория оперона была предложена на основании данных, полученных при изучении свойств лактозного оперона (lac-оперона) E. coli, т.е. оперона, в котором закодированы белки, участвующие в усвоении лактозы.
Клетки E. coli обычно растут на среде, используя в качестве источника углерода глюкозу. Если в среде культивирования глюкозу заменить на дисахарид лактозу, то по прошествии нескольких минут клетки адаптируются к изменившимся условиям. Они начинают продуцировать 3 белка, обеспечивающих утилизацию лактозы. Один из этих белков - фермент β-галактозидаза, катализирующий гидролитическое расщепление лактозы до глюкозы и галактозы.
В присутствии глюкозы клетки E. coli содержат менее 10 молекул этих ферментов на клетку. Перенос клеток на среду, содержащую лактозу, вызывает индукцию - увеличение количества молекул каждого из ферментов до 5000 (рис. 4-47).
Теория оперона объясняет это явление следующим образом. В отсутствие индуктора (лактозы) белок-репрессор связан с оператором. А поскольку участки оператора и промотора перекрываются, то присоединение репрессора к оператору препятствует связыванию РНК-полимеразы с промотором, и транскрипция структурных генов оперона не идёт. Когда в среде появляется индуктор, т.е. лактоза, то он присоединяется к белку-репрессору, изменяет
его конформацию и снижает сродство к оператору. РНК-полимераза связывается с промотором и транскрибирует структурные гены.
3. Репрессия синтеза белков. Триптофановый и гистидиновый опероны
Снижение концентрации фермента в бактериальной клетке может осуществляться путём репрессии синтеза ферментов. Сущность этого механизма регуляции заключается в следующем: когда клетки E. coli растут на среде, содержащей в качестве единственного источника азота соль аммония, то им приходится синтезировать все азотсодержащие вещества. Такие клетки, в частности, должны содержать все ферменты, необходимые для синтеза 20 различных аминокислот. Однако если добавить в среду культивирования одну из аминокислот, например триптофан или гистидин, то клетка перестанет вырабатывать весь набор ферментов, необходимых для синтеза этих аминокислот из аммиака и источника углерода. Репрессия синтеза ферментов, катализирующих последовательность реакций метаболического пути, приводящего к образованию конечного продукта, как это имеет место в случае ферментов синтеза гистидина или триптофана, называется репрессией конечным продуктом.
Это явление теория оперона объясняет следующим образом: при отсутствии в среде Гис или Три регуляторный белок-репрессор не имеет сродства к оператору и происходит синтез ферментов, осуществляющих образование этих аминокислот. Когда в среду добавляют, например, Гис, то эта небольшая молекула функционирует как «корепрессор» и присоединяется к белку-репрессору. В результате конформационных изменений в молекуле репрессора комплекс белка-репрессора и корепрессора (Гис) приобретает сродство к оператору, присоединяется к нему, и транскрипция оперона прекращается, т.е. прекращается считывание информации о строении 10 ферментов, участвующих в синтезе этой аминокислоты (рис. 4-48).
Следует иметь в виду, что репрессия и индукция синтеза белков у прокариотов реализуют принципы адаптации к меняющимся условиям существования и клеточной экономии: ферменты появляются в клетках, когда в них существует потребность, и перестают вырабатываться, если потребность исчезает.
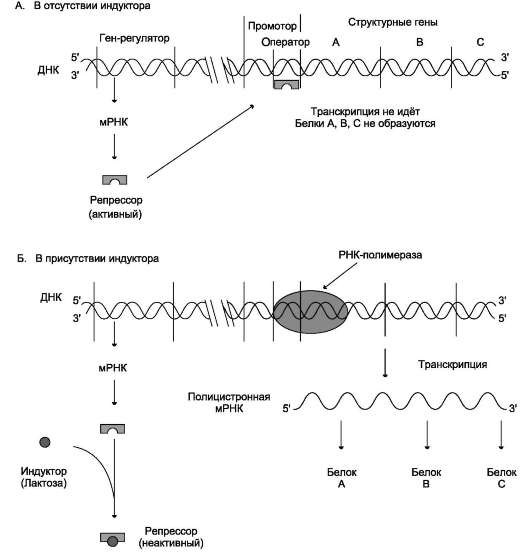
Рис. 4-47. Механизм индукции лактозного оперона. А - в отсутствии индуктора (лактозы) белок-репрессор связан с оператором. РНК-полимераза не может присоединиться к промотору, транскрипция структурных генов оперона не идёт; Б - в присутствии лактозы белок-репрессор присоединяет её, изменяет свою конформацию и теряет сродство к оператору. РНК-полимераза связывается с промотором и транскрибирует структурные гены: β-галактозидазы (А), катализирующей гидролиз лактозы до глюкозы и галактозы; галактозидпермеазы (В), осуществляющей транспорт лактозы и других галактозидов в клетки; тиогалактозидтрансацетилазы (С) - фермента, способного переносить ацетильную группу ацетил-КоА на тиогалактозу. Функция его в процессе утилизации лактозы пока неясна.
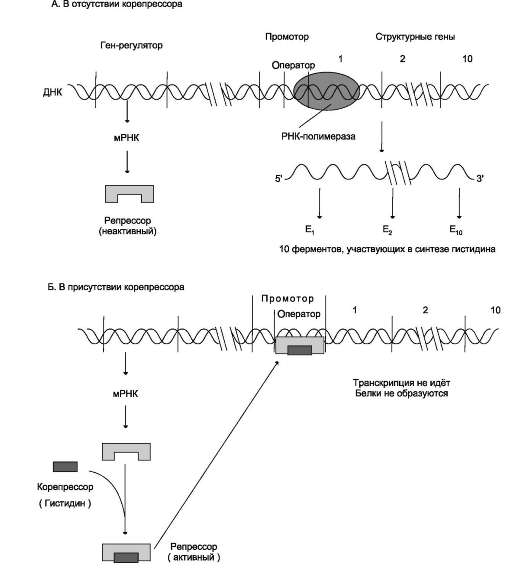
Рис. 4-48. Механизм репрессии синтеза ферментов, участвующих в образовании гистидина. А - в отсутствии корепрессора (гистидина) белок-репрессор не имеет сродства к оператору, РНК-полимераза присоединяется к промотору, и происходит транскрипция 10 структурных генов, кодирующих строение ферментов, участвующих в синтезе гистидина; Б - в присутствии гистидина в среде комплекс белка-репрессора с корепрессором, т.е. Гис, связывается с оператором, препятствует присоединению РНК-полимеразы к промотору и останавливает транскрипцию.
Б. МЕХАНИЗМЫ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ У ЭУКАРИОТОВ
Эукариотические организмы (и особенно млекопитающие) устроены значительно сложнее прокариотов и нуждаются в более сложном аппарате регуляции. Так, в организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям. В то же время различными методами исследования ДНК (прежде всего, методом молекулярной гибридизации) доказано, что количество и структура ДНК практически всех клеток организма одинаковы (за исключением лимфоцитов), т.е. все клетки организма содержат один и тот же геном. У высших организмов по сравнению с прокари-отическими существенно возрастает содержание ДНК на гаплоидную клетку: с 4,2х106 пар нуклеотидов у E. coli до 3,3х109 пар нуклеотидов в клетках человека.
1. Организация хроматина в дифференцированных клетках многоклеточного организма
В клетках млекопитающих наряду с адаптивной регуляцией, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды, существуют механизмы, которые сохраняют стабильную (существующую на протяжении всей жизни клетки и даже многих её генераций) репрессию одних генов и дерепрессию других.
В ядрах дифференцированных клеток хроматин имеет такую укладку, что только небольшое число генов (часто менее 1%) доступно для транскрипции. Различают участки гетерох-роматина, в которых ДНК упакована очень компактно и недоступна для транскрипции, и участки эухроматина, имеющие более рыхлую укладку и способные связывать РНК-полиме-разу. В разных типах клеток в область эухро-матина попадают разные гены, а это означает, что в разных тканях транскрибируются разные участки хроматина.
Стойкая репрессия генов гетерохроматина обеспечивается:
• пространственной укладкой ДНК, при которой гетерохроматин находится в высоко-конденсированном состоянии;
• метилированием дезоксицитидина ДНК-метилазами в 5'-CG-3' последовательностях
ДНК. Эта модификация сильно меняет конформацию хроматина и препятствует активной транскрипции;
• связыванием с гистонами и образованием нуклеосом, которые также снижают транскрипционную активность ДНК.
Исследования показали, что области эух-роматина, в которых расположены активно транскрибируемые гены, обладают некоторыми структурными особенностями:
• они более чувствительны к действию ДНК-аз, чем остальные участки ДНК;
• молекулы гистонов, связанные с ДНК в этих участках, модифицированы: ε-аминогруппа лизина метилирована или ацетилирована; метилированы некоторые остатки аргинина и гистидина в гистонах Н2А и Н2В, являющихся коровыми белками нуклео-сом. Некоторые молекулы Н2А образуют прочный комплекс с белком убиквитином. В гистоне Н1 фосфорилируются остатки серина. Результат этой серии ковалентных модификаций - снижение суммарного, положительного заряда гистонов и ослабление сродства нуклеосом к ДНК.
• к областям «активного» хроматина присоединяется группа негистоновых HMG-белков, или белков с высокой подвижностью при гель-электрофорезе. Эти белки содержат много положительно заряженных аминокислотных остатков, связывание с которыми ослабляет взаимодействие ДНК и гистонов и вызывает дополнительное повышение транскрипционной активности генов.
Разнообразие клеток и возросшая сложность клеточных процессов нуждаются в большом разнообразии механизмов регуляции. Показано, что разный набор и количество белков в эукари-отических клетках может регулироваться:
• изменением количества структурных генов;
• перестройкой генов в хромосомах;
• эффективностью транскрипции разных участков генома;
• характером посттранскрипционных модификаций первичных транскриптов;
• на уровне трансляции;
• с помощью посттрансляционных превращений вновь синтезированных полипептидных цепей.
2. Изменение количества генов
Геном эукариотов обнаруживает высокую пластичность, играющую важную роль в регуляции активности некоторых генов и увеличивающую разнообразие клеточных ответов. У млекопитающих реализуются следующие варианты изменений в структуре генов:
Амплификация (или увеличение числа) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Многие гены, кодирующие белки или РНК, необходимые организму в больших количествах (например, гистоны, рРНК, тРНК), постоянно присутствуют в амплифицированном состоянии. Так, у человека 20% общего генома состоит из участков, кодирующих рибосомные, транспортные и ядрышковые РНК, последние из которых обеспечивают посттранскрипционные модификации РНК. Амплифицированные участки могут располагаться друг за другом (тандемно) в хромосоме или образовывать внехромосом-ные фрагменты ДНК, называемые двойными мини-хромосомами, их размер колеблется от 100 до 1000 килобаз (1 килобаза = 1000 пар нуклеотидов). Описано более 20 генов, способных амплифицироваться при определённых условиях. К числу генов, для которых обнаружена амплификация, относят ген металлотионеина. Продукт экспрессии этого гена - низкомолекулярный белок металлотионеин, обладающий способностью связывать тяжёлые металлы (медь, цинк, кадмий, ртуть) и защищать клетки от отравления этими соединениями. Установлено, что в ответ на повышение концентрации тяжёлых металлов в крови в клетках происходит амплификация гена металлотионеина.
Другими примерами генов, количество которых увеличивается под влиянием лекарственных препаратов, являются ген дигидрофолатредук-тазы (см. разделы 9, 10) и ген Р-гликопротеина, ответственный за синтез белка, обеспечивающего множественную лекарственную устойчивость опухолевых клеток (см. раздел 16).
Утрата генетического материала - довольно редкий способ регуляции. Наиболее яркий пример потери всех генов за счёт разрушения ядра - процесс созревания эритроцитов. Нестабильны амплифицированные гены,
двойные хромосомы. Они, как правило, исчезают в последующих генерациях. Утрата генетического материала происходит в процессе созревания лимфоцитов и образования плазматических клеток разных клонов, синтезирующих секретируемые формы иммуноглобулинов.
3. Перестройка генов
У высших организмов, так же как и у прокариотов, отмечают процесс обмена, перемещения генов между хромосомами или внутри хромосомы, объединение генов с образованием изменённой хромосомы, которая после таких структурных изменений способна к репликации и транскрипции. Этот процесс получил название «генетическая рекомбинация».
У эукариотов рекомбинации наблюдают:
• при половом слиянии яйцеклетки и сперматозоида;
• при перемещении подвижных генетических элементов - транспозонов, в состав которых входят отдельные гены или группа генов, с исходной позиции в какое-либо другое место той же или другой хромосомы;
• при формировании в лимфоцитах «библиотеки» генов, кодирующих антитела или иммуноглобулины.
Рассмотрим более подробно механизмы, обеспечивающие образование в организме каждого человека около 10 млн (107) различных антител, т.е. количества значительно большего, чем число всех других белков, существующих у каждого индивидуума. Антитела с одинаковыми антигенсвязывающими свойствами синтезируются В-лимфоцитами, принадлежащими к одному определённому клону (т.е. группе клеток, возникшей из одной родоначальной клетки). При попадании в организм любого антигена среди имеющегося набора В-лимфоцитов всегда найдётся такой клон клеток, антитела которого имеют комплементарный ему активный центр. Антитела встроены в плазматическую мембрану В-лимфоцитов, и их антигенсвязывающие участки локализованы на поверхности клеток. Антиген, присоединяясь к активному центру антитела, вызывает пролиферацию клеток и превращение В-лимфоцитов в плазматические клетки, в которых идут активный синтез и секреция не связанных с мембраной антител.
Изучение вопроса о происхождении антител позволило сделать вывод о том, что огромное многообразие белков иммунной системы кодируется ограниченным количеством генетического материала, изменения в котором обеспечиваются рекомбинациями и соматическими мутациями (или изменениями в структуре ДНК, которые сохраняются при последующих делениях клеток).
Вспомним, что мономерные антитела - доменные белки, состоящие из двух идентичных тяжёлых (Н) цепей и двух идентичных лёгких (L) цепей. Лёгкие цепи имеют двухдоменную структуру и включают вариабельный (VL) и константный (CL) домены. Тяжёлая цепь состоит из 4-5 доменов: одного вариабельного (VH) и, как правило, трёх константных (CH). Иммуноглобулины - гликопротеины; их углеводная часть присоединяется к константной области Н-цепей. В связывании антигенов участвуют 2 активных центра антитела, образованные вариабельными областями Н-цепей (VH) и L-цепей (VL). L-цепи бывают двух типов: λ (лямбда) и κ (каппа), значительно различающиеся по первичной структуре С-областей.
Наличие в антителах С- и V-областей позволило предположить, что гены, обеспечивающие синтез L- и H-цепей, образуются в результате соединения двух участков гена, один из которых кодирует вариабельную область, а второй - константную. И действительно вскоре было установлено, что в зародышевых клетках и соматических клетках, не синтезирующих иммуноглобулины, участки гена, кодирующие V- и С-области L-цепей λ-типа, разделены протяжёнными нуклеотидными последовательностями, но сближены в зрелых В-лимфоцитах, синтезирующих Lλ Из этого следовал вывод о том, что в процессе дифференцировки В-лимфоцита из ДНК зародышевой клетки происходит «вырезание» протяжённого участка генетического материала, обеспечивающее сближение VL- и CL-областей с образованием полного гена L-цепи иммуноглобулина. Этот процесс перестройки в геноме получил название соматической рекомбинации, так как он связан с созреванием лимфоцитов и не передаётся по наследству.
Описано 3 разных семейства генных фрагментов, или сегментов, кодирующих строение L- и H-цепей Ig. Два семейства ответственны за синтез лёгких цепей: сегменты, кодирующие строение L-цепей типа λ, расположены в
хромосоме 22, генетический материал L-цепей типа κ (каппа) - в хромосоме 2, а информация
о всём разнообразии Н-цепей локализована в хромосоме 14.
Полные гены L-цепей λ и κ типов в ходе диффе-ренцировки собираются из 3 сегментов: вариабельного (VL), соединительного (JL) и константного (CL). Так, для L-цепей κ типа обнаружено около 300 сегментов, кодирующих N-концевой вариабельный (Vk) участок полипептидной цепи длиной в 95 аминокислотных остатков, 5 сегментов, в которых содержится информация об остальных 13 аминокислотах Vk области, и
1 сегмент константной области. В зародышевых клетках 300 сегментов Vk расположены в хромосоме последовательно на расстоянии 7 килобаз друг от друга. Каждый V-сегмент состоит из
2 экзонов, разделённых коротким интроном: лидирующий экзон (L) кодирует сигнальный пептид (20-25 аминокислотных остатков), а экзон Vk - основную часть вариабельного домена. Семейство VK-сегментов отделено от группы соединительных сегментов (Jk) участком ДНК размером в 20 килобаз. Между последним из JK-сегментов и Ск-экзоном, кодирующим домен константной области, расположен интрон размером в 2,4 килобазы (рис. 4-49).
В ходе дифференцировки В-клеток один из вариабельных VL-сегментов путём соматической рекомбинации переносится из отдалённого участка в участок той же хромосомы, рядом с одним из сегментов Jl. Например, сегмент V2 объединяется с соединительным мини-сегментом J4, и формируется полный ген L-цепи. Он состоит из 3 экзонов и 2 интронов, расположенных в гене в следующем порядке: 5'L-I1-V2-J4-J5-I2-C-3', где L - лидерная последовательность, кодирующая сигнальный пептид, I1 - интрон V2-сегмента, а I2 - интрон между семейством JL-сегментов и Ск-экзоном. После транскрипции гена в ходе сплайсинга из первичного транскрипта удаляются интроны I1, I2 и лишний сегмент J5, а все кодирующие последовательности соединяются в единую информационную молекулу зрелой мРНК. В процессе синтеза L-цепи на рибосоме лидерный участок, состоящий в основном из гидрофобных аминокислот, обеспечивает прохождение белка через мембрану ЭР и затем отщепляется. Образуется L-цепь, имеющая аминокислотный состав, характерный для L-цепи к-типа в молекуле Ig.
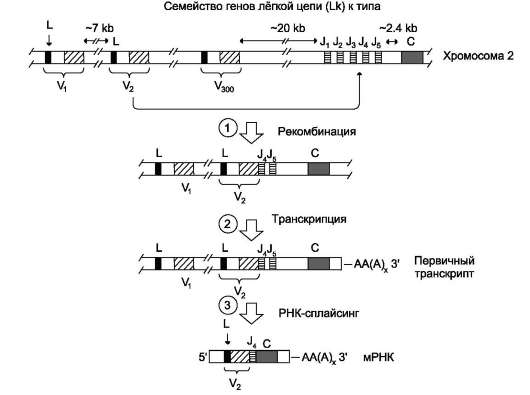
Рис. 4-49. Образование гена лёгкой цепи k (каппа) типа и его транскрипция. 1 - V-сегменты L-цепей состоят из двух экзонов и разделяющего их интрона. Экзоны кодируют сигнальный пептид (L) и почти весь вариабельный домен V. В ходе соматической рекомбинации сегмент гена вариабельной части L-цепи (V2) объединяется с одним из соединительных сегментов (J4); 2 - транскрибируется полный ген L-цепи, состоящий из трёх экзонов и двух интронов, расположенных в следующем порядке: 5'L-I1-, V2J4 I2J5-I3-C-3'; 3 - в ходе сплайсинга первичного транскрипта гена интрон I1 сегмента V2, I2, J5 сегмент и интрон I3, отделяющий V2J4 от С-области, удаляются.
Расчёты показывают, что из имеющихся сегментов к-гена в организме можно синтезировать 4500 полных генов, кодирующих L-цепи к-типа.
Формирование полных генов L-цепей λ-типа происходит сходно с L-цепями к-типа.
Ещё большее разнообразие вариантов возникает при сборке полных генов тяжёлых (Н) цепей Ig. Н-цепи кодируются четырьмя сегментами: VH, DH (от англ. diversity) сегментами разнообразия, JH и CH. У человека обнаружено около 500 VH, 15 DH и 4 JH сегментов.
Каждый VH сегмент содержит информацию об аминокислотной последовательности сигнального пептида и около 100 аминокислот VH домена. В сегменте DH закодирован участок полипептидной цепи, содержащий от 2 до 13 ами-
нокислот, а в сегменте JH - 4-6 аминокислот. Полный ген вариабельного домена образуется путём соединения VH, DH и JH сегментов.
При формировании полного гена вариабельной части Н-цепи Ig, состоящей из VH, D и JH сегментов, происходит 2 рекомбинационные состыковки: на первом этапе удаляется участок между выбранными Dx и Jy кодирующими последовательностями, а на втором - между Vi и DxJy сегментами. Экзонов, кодирующих константную область Н-цепей, описано 10: Сμ, Сσ, Сγ3, Сγ1, Сα1, Сγ2α, Сγ2β, Сγ4, Сε и Сα2, они определяют классы и подклассы иммуноглобулинов - IgM, IgG, IgA и т.д.
Первыми в иммунном ответе появляются IgM, поскольку к полному гену вариабельного домена ближе всех остальных С-экзонов находится
Сμ сегмент Н-цепи. Активированные В-клетки могут синтезировать мембранносвязанную и сек-ретируемую формы IgM. Кроме того, они могут переключаться с синтеза IgM на образование антител других классов. Перед каждым СН экзо-ном имеется участок ДНК, называемый «участок переключения», или «свич-сайт» (от англ. switch site), построенный из повторяющихся нуклеотидных последовательностей. Эти участки облегчают протекание дополнительной рекомбинации, в ходе которой удаляются С-сегменты между полным геном вариабельной области и С-сегментом того класса, который должен быть включён.
Исследование нуклеотидных последовательностей генов некоторых подклассов L-цепей к-типа и Н-цепей показало, что разнообразие структуры сегментов, закодированных в зародышевой клетке, увеличивают соматические мутации. Мутации происходят в дифференцированных клетках на участках Vl-Jl и VhDhJh сегментов в процессе или после рекомбинаций, делая, таким образом, количество антител практически неограниченным. Очень важно, что мутации происходят в областях, ответственных за узнавание антигенов, обеспечивая более полное соответствие активного центра антитела антигену.
Таким образом, перестройки генетического материала в процессе формирования полных генов Ig происходят в несколько этапов, каждый из которых приурочен к строго определённой стадии дифференцировки В-лимфоцитов. Из сегментов, которые кодируют различные участки полипептидной цепи, входящей в вариабельные домены, и одного из экзонов константного домена собираются полные гены тяжёлых и лёгких нитей Ig. Сборка L-цепей включает одну соматическую рекомбинацию, а сборка Н-цепей происходит с помощью двух соматических рекомбинаций. Когда В-лимфоциты синтезируют Ig не класса М, то это сопровождается ещё одним дополнительным рекомбинационным событием. Соматические мутации, происходящие в зрелых В-лимфоцитах, делают многообразие антител неисчерпаемым.
Аналогичные процессы наблюдают и в ходе дифференцировки Т-лимфоцитов.
4. Регуляция транскрипции
Регуляция транскрипции генов высших организмов сходна с регуляцией экспрессии генов прокариотов. Основное различие состоит в зна-
чительно большем количестве участков ДНК и регуляторных факторов, контролирующих этот процесс.
У животных и человека различные гены экс-прессируются в разные моменты времени и с разной интенсивностью. Здесь, так же, как у прокариотов, есть гены «домашнего хозяйства», транскрибирующиеся конститутивно, т.е. постоянно и во всех тканях. Это гены гликолиза, синтеза РНК и некоторых белков (например, альбумина). Существуют гены, транскрибирующиеся только в специализированных клетках, т.е. имеет место тканеспецифическая экспрессия. Например, экспрессия генов а- и β-цепей глобина происходит только в клетках-предшественниках эритроцитов. Многие гены подвергаются адаптивной регуляции и являются объектами индуцибельных воздействий или негативного контроля.
Ранее уже говорилось о том, что минимальный синтез любого белка поддерживается в том случае, если к ТАТА-участку промотора присоединяется ТАТА-связывающий белок, факторы транскрипции и РНК-полимераза, образующие инициирующий комплекс, осуществляющий синтез небольшого количества мРНК. Формирование комплекса - многоступенчатый процесс, от образования которого зависит скорость инициации транскрипции. Идентифицировано более 100 различных белков, способных взаимодействовать со специфическими регуляторными последовательностями ДНК, влияя главным образом на процесс сборки транскрипционного комплекса и скорость транскрипции (рис. 4-50).
Эти белки имеют один или несколько доменов, обеспечивающих выполнение регуляторных функций.
ДНК-связывающие домены, ответственные за узнавание и связывание регуляторных факторов со специфическими участками на молекуле ДНК;
Домены, активирующие транскрипцию за счёт связывания с белками основного инициа-торного комплекса: транскрипционными факторами, коактиваторами и РНК-поли-меразой;
Антирепрессорные домены, благодаря которым белки способны взаимодействовать с гисто-нами нуклеосом и освобождать транскри-
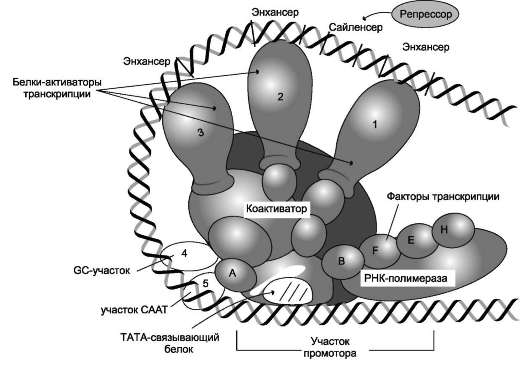
Рис. 4-50. Адаптивная регуляция транскрипции у эукариотов. Промоторы эукариотических генов находятся под контролем большого числа регуляторных участков на молекуле ДНК: ТАТА-, СААТ-, GC-последовательностей, энхансеров, сайленсеров-последовательностей, к которым присоединяются комплексы белков с различными лигандами (цАМФ, стероидными гормонами, метаболитами, ионами металлов и т.д.).
бируемые участки ДНК от связи с этими ингибиторными структурами; Домены, связывающие лиганды, присоединение которых к белку изменяет его конформацию и обеспечивает связывание с молекулой ДНК. Лиганды-индукторы транскрипции - стероидные гормоны, ретиноевая кислота, кальцитриол (производное витамина D3) и гормоны щитовидной железы. Лигандами-репрессорами могут быть конечные продукты метаболических путей, некоторые гормоны. Будучи липофильными молекулами, они проходят плазматическую, а иногда и ядерную мембраны, взаимодействуют с внутриклеточными рецепторами, присоединяясь к лиганд-связывающему участку (рис. 4-51). Присоединение лиганда к рецептору образует ДНК-связывающий участок, узнающий специ-
фическую последовательность в регуляторной зоне ДНК и индуцирующий транскрипцию определённых генов.
На молекуле ДНК на расстоянии 100-200 пар оснований от стартовой точки транскрипции имеются короткие специфические последовательности ДНК: СААТ - элемент (или бокс), CG-бокс и октамерный бокс (включающий 8 пар оснований), узнающие транскрипционные факторы. Эти элементы есть во всех клетках, и конститутивно экспрессируемые гены нуждаются только в них. В то же время для генов, подвергающихся адаптивной регуляции, обнаружены участки молекулы ДНК, которые удалены (до 1000 и более пар оснований) от промотора, но тоже участвующие в регуляции транскрипции. Эти нуклеотидные последовательности бывают 2 типов.
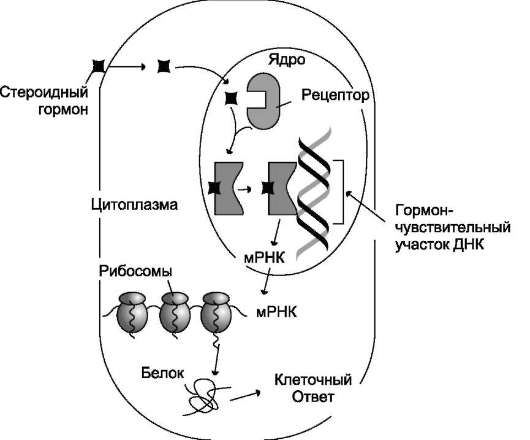
Рис. 4-51. Действие лиганда-индуктора транскрипции на клетку млекопитающих. Лиганд-индуктор, например стероидный гормон, связывается с внутриклеточным рецептором, находящимся в ядре или цитоплазме, и поступает в ядро. Комплекс гормон-рецептор присоединяется к определённому участку на молекуле ДНК и активирует транскрипцию гена. Образуется мРНК - матрица для синтеза белка, обеспечивающего определённый клеточный ответ.
Энхансеры - участки ДНК размером 10-20 пар оснований, присоединение к которым регуляторных белков увеличивает скорость транскрипции. Если участки ДНК, связываясь с белками, обеспечивают замедление транскрипции, то их называют сайленсерами.
Эти структурные элементы молекулы ДНК контролируют транскрипцию, даже если они:
• ориентированы на молекуле ДНК в любом направлении (от 5'- к 3'-концу или наоборот);
• связываются с одним или несколькими ре-гуляторными белками;
• располагаются перед или после гена, экспрессию которого они регулируют.
Элементы ответа, или cis-элементы - регуля-торные последовательности ДНК, общие для группы генов. Они обеспечивают координированную регуляцию транскрипции генов и, как правило, располагаются на расстоянии примерно в 250 пар оснований выше промотора
каждого гена. В остальном эти нуклеотидные последовательности имеют много общего с эн-хансерами. В данном варианте регуляции один и тот же индуктор, связываясь с соответствующим регуляторным белком, может активировать много разных генов, так как каждый из них в регуляторной области содержит один и тот же cis-элемент. Один из белков-продуктов этой группы генов может оказаться индуктором другой группы генов. Конечный результат регуляции - серия ответных реакций за счёт активации различных генов одним индуктором
(рис. 4-52).
К генам, регулируемым cis-элементами, относят гены, чувствительные к стероидным гормонам, гены белков теплового шока и многие другие. Например, при повышении температуры или после какого-либо другого клеточного стресса активируется синтез транскрипционного фактора, который индуцирует транскрипцию генов, кодирующих строение шаперонов.
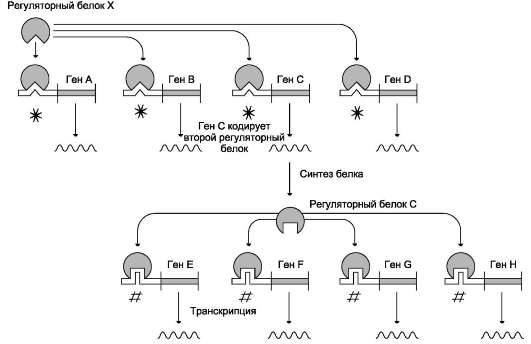
Рис. 4-52. Активация группы генов с помощью одного индуктора. Группа генов имеет общий регуляторный cis-элемент и активируется одним и тем же регуляторным белком. Один из белковых продуктов первой серии ответных реакций активирует вторую серию генов (* - cis-элементы к белку Х; # - cis-элементы к белку С).
Очевидно, что эффективность регуляции во многом зависит от структуры транскрипционных факторов и внутриклеточных рецепторов, непосредственно взаимодействующих с молекулой ДНК. Установлено, что большинство ДНК-связывающих белков принадлежит к трём семействам в зависимости от структуры домена, непосредственно взаимодействующего с двойной спиралью ДНК. Эти белки включают структуры типа «спираль-поворот-спираль», «цинковые пальцы» и «лейциновой молнии» (см. раздел 1). Как правило, эти структуры - небольшие фрагменты молекул белков, а сайт-специфическое связывание происходит за счёт взаимодействия между радикалами аминокислот этих участков и азотистыми основаниями молекулы ДНК.
5. Посттранскрипционная регуляция
В организме животных существенное значение в обеспечении разнообразия белков играет
постлранскригщионный процессинг РНК. Основные способы такой регуляции - альтернативный сплайсинг и изменение стабильности
РНК.
Альтернативный сплайсинг. Установлено, что многие эукариотические гены, будучи транскрибированы, образуют несколько вариантов зрелой мРНК в ходе процессинга (или созревания) первичного транскрипта, имеющего полиэкзонное строение.
Возможные варианты сплайсинга РНК представлены на рис. 4-53.
Наиболее часто в ходе сплайсинга происходит «вырезание» одного или нескольких экзонов. В других случаях в зрелой мРНК сохраняется часть интрона и включается в состав экзона с 5' или З'-конца. Сплайсинг может влиять на выбор промотора или участка полиаденили-рования.
Рис. 4-53. Часто встречающиеся варианты сплайсинга первичных транскриптов РНК. I. Вырезание одного из экзонов: а) синтез белка, содержащего полный набор экзонов (1-5); б) синтез белка, лишённого одного экзона (1, 2, 4, 5); II. Сохранение участка интрона: а) с 5'-конца; б) с З'-конца. III. Сохранение целого интрона. IV. Использование альтернативных промоторов (либо перед экзоном 1, либо перед экзоном 2). V. Использование альтернативных участков полиа-денилирования (например, при последовательном сшивании экзонов после экзона 3, а если экзон 3 не прочитывается, то после экзона 4).
С помощью альтернативного сплайсинга в процессе синтеза антител образуются мемб-раносвязанные и секреторные формы антител (рис. 4-54). Так, первоначально В-лимфо-циты продуцируют транскрипты, полиадени-лированные после второго стоп-кодона, а инт-рон, в котором имеется первый стоп-кодон, удаляется. В результате синтезируются IgM, связанные с клеточной мембраной, так как мРНК таких клеток содержит на 3'-конце эк-зон, кодирующий участок полипептидной цепи, состоящий из гидрофобных аминокислот.
С помощью этого участка происходит «заякори-вание» IgM в мембране. Когда В-лимфоциты превращаются в плазматические клетки, то в результате альтернативного сплайсинга образуется мРНК, в которой сохраняется интрон, содержащий первый стоп-кодон. Поэтому происходит более раннее полиаденилирование и исчезает экзон, кодирующий гидрофобный участок молекулы. Синтезируются укороченные молекулы антител, секретируемые в кровь.
«Редактирование» РНК. Описан ряд случаев, когда первичная структура мРНК изменяется («редактируется») после транскрипции. Последовательность нуклеотидов в таких генах одинакова, а транскрибируемая в разных тканях мРНК различается в результате появления в молекуле замен, вставок или выпадений нуклеотидов. Пример «редактирования» РНК - образование апопротеина В (апо-В) в клетках печени и тонкого кишечника (рис. 4-55). Апо-В - основной компонент липопротеинов, участвующих в транспорте триацилглицеролов из этих тканей в кровь. Хотя апопротеин В кодируется одним и тем же геном, вариант белка, образующийся в печени, называют апо-В-100, и он содержит 4563 аминокислотных остатка, тогда как белок, синтезированный в клетках кишечника, состоит из 2152 аминокислот. В гене, кодирующем этот белок, последовательность нуклеотидов в триплете 2153 - САА шифрует включение в полипептидную цепь остатка глутамина. В клетках кишечника в первичном транскрипте гена азотистое основание - цитозин (С) кодона 2153 дезаминируется и превращается в урацил (U). Возникает стоп-кодон - UAA, прекращающий трансляцию мРНК в середине молекулы и приводящий к синтезу укороченного белка. В результате образуется белок (В-48), длина которого составляет 48% от длины белка синтезируемого печенью.
Изменение стабильности мРНК. Для того, чтобы участвовать в синтезе белка, мРНК должна выйти из ядра в цитоплазму через ядерные поры. Установлено, что в ядре клеток обычно синтезируется больший набор гетерогенных РНК, чем тот, что выходит в цитоплазму. Многие продукты транскрипции подвергаются расщеплению нуклеазами, а те мРНК, что транспортируются из ядра в цитоплазму, защищаются от гидролитического разрушения, образуя комплексы с белками.
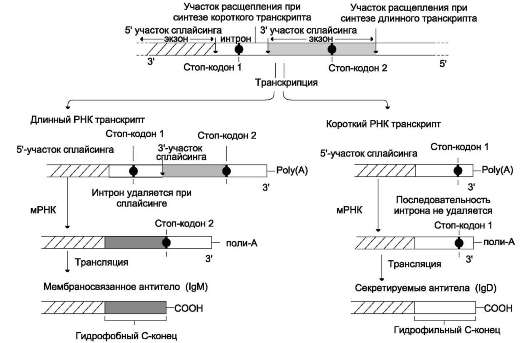
Рис. 4-54. Использование механизмов альтернативного сплайсинга и полиаденилирования в ходе синтеза мембранносвязанных и секреторных Ig. Если транскрипт подвергается полиаденилированию после второго стоп-кодона, присутствующего в экзоне гена IgM, то синтезируются белки, у которых на С-конце присутствует гидрофобный домен, обеспечивающий связывание с плазматической мембраной. При стимуляции В-лимфоцитов в клетках осуществляется альтернативный сплайсинг первичного транскрипта, при котором интрон, содержащий первый стоп-кодон, сохраняется. Образуются более короткие мРНК, полиаденилирование которых происходит после первого стоп-кодона.
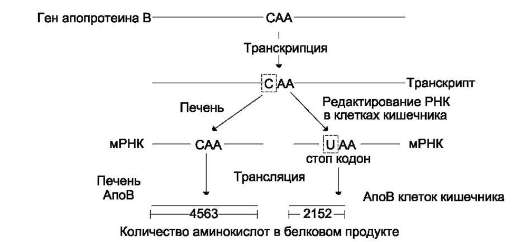
Рис. 4-55. «Редактирование» мРНК апопротеина В. В ходе транскрипции гена апопротеина В в печени образуется мРНК, служащая матрицей для синтеза белка, состоящего из 4563 аминокислотных остатков. В клетках тонкого кишечника экспрессия того же гена вызывает образование белка, состоящего из 2152 аминокислот. В РНК транскрипте цитозин кодона 2153 - САА превращается в урацил (U) и возникает стоп-кодон в середине молекулы мРНК. Это приводит к синтезу укороченного белка.
Время жизни эукариотических мРНК значительно больше (t1/2 составляет от нескольких часов до нескольких дней), чем t1/2 мРНК прокариотов, равное нескольким минутам. Очевидно, что стабильность молекул мРНК - фактор, изменение которого влияет на уровень трансляции. Стабилизация мРНК при фиксированной скорости транскрипции приводит к накоплению и увеличению количества образующегося белкового продукта.
Продолжительность жизни разных мРНК варьирует в достаточно широких пределах. Некоторые гены кодируют продукт с большой продолжительностью жизни. Так, в ходе транскрипции гена β-глобина образуется мРНК с t1/2, равной примерно 10 ч. Другие гены образуют мРНК с короткой продолжительностью жизни: мРНК, на которых синтезируются факторы роста, имеют t1/2 менее 1 ч. Показано, что поли(А)-фрагмент на 3'-конце мРНК увеличивает продолжительность жизни молекул. Чем длиннее поли(А)-фрагмент, тем больше время жизни мРНК.
Описано много примеров регуляции количества синтезирующихся белков за счёт изменения продолжительности функционирования мРНК. Так, стабильность мРНК-матриц для синтеза молекул гистонов сильно зависит от фазы клеточного цикла. В S-фазе гистоны постоянно синтезируются и используются для укладки вновь образованной ДНК в нуклеосомы. Гисто-новая мРНК в этот период стабильна в течение нескольких часов. После S-периода, когда ДНК уже не синтезируется, в клетках образуется небольшое количество гистонов, так как они не требуются для формирования нуклеосом. В этот период t1/2 для гистоновой мРНК составляет 10-15 мин.
6. Регуляция трансляции и посттрансляционных модификаций
Изменение скорости трансляции
Хотя изменение скорости образования белков на уровне трансляции не относят к числу основных способов регуляции количества и разнообразия белков, некоторые случаи такой регуляции известны. Наиболее изученный пример - синтез белков в ретикулоцитах. Известно, что на этом уровне дифференцировки кроветворные
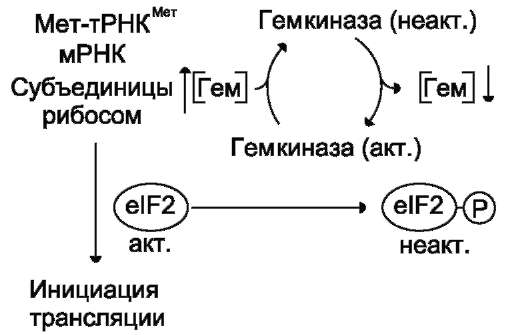
Рис. 4-56. Зависимость скорости синтеза глобина от концентрации гема. Когда внутриклеточный уровень гема высок, фактор инициации eIF2 не фосфорили-рован и активен, происходит синтез глобина. Если содержание гема в клетке снижается, фактор инициации фосфорилируется, инактивируется и синтез белка прекращается.
клетки лишены ядра, а следовательно, и ДНК. Регуляция синтеза белка-глобина осуществляется только на уровне трансляции и зависит от содержания гема в клетке (рис. 4-56). Если внутриклеточная концентрация гема высока, то глобин синтезируется; когда содержание гема снижается, то ингибируется и образование глобина. Остановка синтеза белка осуществляется за счёт фосфорилирования фактора инициации eIF2, который в фосфорилированной форме неактивен. Гем предотвращает фосфорилирование eIF2, связываясь со специфической протеинки-назой, которая получила название гемкиназы.
Некоторые мРНК содержат элементы вторичной структуры на 5'- или 3'-концах нетрансли-руемого участка мРНК, к которым могут присоединяться белки и ингибировать трансляцию. Например, синтез ферритина - белка, обеспечивающего хранение ионов железа в клетке, усиливается при повышении внутриклеточной концентрации железа (см. раздел 14). Обнаружено, что мРНК ферритина на 5'-конце имеет петли, к которым при низкой концентрации железа присоединяется регуляторный белок. Когда этот белок связан с мРНК, то трансляция не идёт. Если концентрация ионов железа в клетке повышается, то Fe3+ взаимодействует с белком, изменяет его конформацию и сродство к мРНК. мРНК освобождается от регуляторного белка, и на ней начинается синтез ферритина.
Различия в продолжительности жизни молекул белка
После того как белки синтезированы, время их жизни регулируется протеазами. Разные белки имеют разные t1/2: от нескольких часов до нескольких месяцев, а иногда и лет (табл. 4-6). В каждой клетке скорость расщепления белков варьирует в широких пределах. Ферменты, катализирующие регуляторные реакции метаболических путей, как правило, подвергаются быстрому расщеплению, поэтому скорость обновления этих молекул достаточно высока. Физиологическое состояние организма также влияет на продолжительность жизни белков. Кроме того, существует мощная система защиты, обеспечивающая быстрое расщепление дефектных белков.
Некоторые белки расщепляются лизосомными ферментами. В процессе аутофагии содержимое клетки, включая органеллы, окружается мембраной, сливается с лизосомой другой клетки и подвергается действию лизосомных ферментов. В результате гидролиза образующиеся мономеры поступают в цитоплазму для повторного использования.
Для других белков показано расщепление в цитоплазме протеазами. Так, подлежащие разрушению белки первоначально отмечаются клеткой путём присоединения белка под названием убиквитин. Этот небольшой белок, состоящий из 76 аминокислотных остатков, обнаружен у многих организмов.
Таблица 4-6. Период полураспада некоторых белков в клетках млекопитающих
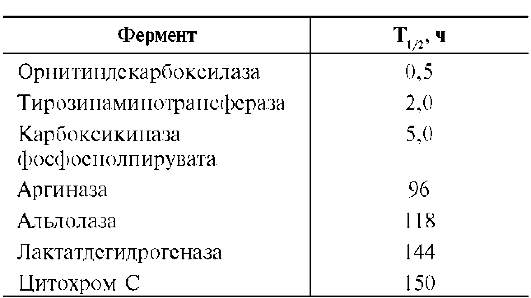
viii. механизмы генетической изменчивости. полиморфизм белков. наследственные болезни
Точная работа всех матричных биосинтезов - репликации, транскрипции и трансляции - обеспечивает копирование генома и воспроизведение фенотипических характеристик организма в поколениях, т.е. наследственности. Однако биологическая эволюция и естественный отбор возможны только при наличии генетической изменчивости. Установлено, что геном постоянно претерпевает разнообразные изменения. Несмотря на эффективность механизмов коррекции и репарации ДНК, часть повреждений или ошибок в ДНК остаётся. Изменения в последовательности пуриновых или пиримидиновых оснований в гене, не исправленные ферментами репарации, получили название «мутации». Одни из них остаются в соматических клетках, в которых они возникли, а другие обнаруживаются в половых клетках, передаются по наследству и могут проявляться в фенотипе потомства как наследственная болезнь.
Существенный вклад в генетическую изменчивость вносят перестройки хромосом в процессе мейоза. Как уже указывалось ранее, слияние яйцеклетки со сперматозоидом у эукариотов сопровождается генетическими рекомбинациями, в ходе которых происходит обмен участками ДНК между гомологичными хромосомами. Это приводит к появлению потомства с новой комбинацией генов.
Ген или части генов могут перемещаться из одного места хромосомы в другие. Эти подвижные элементы или фрагменты ДНК получили название транспозонов и ретротранспозонов.
Транспозоны - участки ДНК, удаляемые из одного локуса хромосомы и встраиваемые в другой локус той же или другой хромосомы. Ретротранспозоны не покидают исходного положения в молекуле ДНК, но могут копироваться, и копии встраиваются, подобно транспозонам, в новый участок. Включаясь в гены или участки около генов, они могут вызывать мутации и изменять их экспрессию.
Геном эукариотов подвергается изменениям и при заражении ДНКили РНК-содержащими вирусами, которые внедряют свой генетический материал в ДНК клеток хозяина.
А. МУТАГЕНЕЗ
Изменения в геноме могут быть разнообразны и затрагивать различные по протяжённости участки ДНК от хромосом и генов до отдельных нуклеотидов (табл. 4-7).
Наиболее драматичны геномные и хромосомные мутации, часто наблюдаемые на уровне соматических клеток. Если они имеют место в половых клетках, то для организма это имеет чаще всего летальные последствия. Частота мутаций в половых клетках высока. Существуют данные, указывающие на то, что в 20% случаев при беременности у эмбрионов наблюдают нарушения структуры хромосом. В 90% случаев это приводит к ненормальному развитию плода и элиминированию зародышей в результате спонтанных абортов. Выкидыши, происходящие в течение первых нескольких недель беременности, связаны с серьёзными нарушениями хромосом. В 50% случаев отмечается трисомия по аутосомам, т.е. вместо пары хромосом наблюдается три. Пример такой патологии - болезнь Дауна, при которой хромосома 21 присутствует в 3 экземплярах.
Некоторые генные мутации закрепляются в популяции, становятся наследственными и определяют эволюционные процессы. С мутациями такого типа связано появление различных наследственных патологий, сопровождающихся прекращением синтеза белка, кодируемого повреждённым геном, либо синтезом изменённого белка.
Генные, или точечные, мутации бывают в основном 3 видов:
замены, при которых одно азотистое основание в ДНК замещается на другое;
вставки, обеспечивающие внедрение в молекулу ДНК одного или нескольких дополнительных нуклеотидов; делеции (или выпадения) одного или нескольких нуклеотидов, при которых происходит укорочение молекулы ДНК. 1. Мутации по типу замены возникают в результате замены одного азотистого основания на другое, что вызывает изменение в одном из кодонов мутантного гена. Если кодирующий триплет, в котором находится изменённый нуклеотид, из-за вырожденности кода вызывает включение в белок той же аминокислоты, что исходный кодон (или кодон «дикого» типа), то такую мутацию называют «молчащей», и белковый продукт остаётся тем же.

Когда замена одного основания приводит к замене аминокислоты в мутантном белке, то такую мутацию называют «миссенс-мутация» . В ряде случаев, несмотря на произошедшую замену, белок сохраняет биологическую активность. Это, как правило, связано с тем, что изменённая аминокислота находится в участке белка, не имеющем функционального значения, и к тому же она по структуре и свойствам напоминает исходную аминокислоту. Такая мутация тоже будет «молчащей», а замена - эквивалентной.
Таблица 4-7. Классификация мутаций
Тип мутаций | Характер мутационных изменений | Примеры последствий |
Геномный | Изменение числа хромосом | Болезнь Дауна (появление дополнительной хромосомы 21) |
Хромосомные | Общее число хромосом не меняется. Наблюдают перестройки хромосом, обычно видимые при микроскопическом исследовании. | Мышечная дистрофия Дюшенна (делеции Х-хромосомы) |
Генные | Изменения затрагивают один кодон или небольшой отрезок гена и не обнаруживаются цитогенетически | Серповидно-клеточная анемия, вызванная заменой одного нуклеотида в гене β-цепи глобина |

Иногда аминокислота, оказавшаяся заменённой, располагается в области, важной для проявления функциональной активности белка, и её замещение приводит к образованию функционально неактивного продукта. Так, точечная мутация в кодоне серина (Сер - важнейший структурный компонент активного центра се-риновых протеаз: трипсина, химотрипсина и некоторых других ферментов) приводит к полной потере активности. Если подобный фермент участвует в реакциях главных метаболических путей, то такая «неэквивалентная» замена может стать летальной.

В ряде случаев мутантный белок, несмотря на входящую в него изменённую аминокислоту, сохраняет способность выполнять свою функцию, но может быть не столь эффективным, как белок «дикого» типа. В результате мутации у фермента может оказаться более высоким значение Кm или более низким значение Vmax, а иногда то и другое одновременно. Такие частично функционирующие белки называют мутантными белками с неполностью подавленной функцией.
Изредка в результате мутации белковый продукт гена оказывается лучше приспособленным к выполнению своей функции. Такие мутации дают потомству преимущества в борьбе за существование, а серия соответствующих мутаций может привести к появлению нового вида.
Наибольшим повреждающим действием обладают мутации, приводящие к образованию одного из терминирующих кодонов (нонсенс-мутация). В процессе синтеза белка работа рибосомы будет остановлена на мутантном триплете мРНК: UAA, UAG или UGA. Проявление нонсенс-мутаций зависит от их внутригенной локализации. Чем ближе мутация к 5'-концу
гена, т.е. к началу транскрипции, тем короче её белковый продукт, а следовательно, тем меньше он способен к осуществлению биологической функции.

2. Мутации по типу вставки или делеции нуклеотидов
Более опасны для клеток мутации по типу вставки или делеции (утраты) нуклеотидов.
Если мутация приводит к вставке или делеции в ген одной нуклеотидной пары или участка двухцепочечной молекулы ДНК с числом мономеров, не кратным 3 , то это вызывает изменение считывания всех последующих кодонов, так как происходит сдвиг «рамки считывания» ДНК и нарушение соответствия между кодонами в ДНК и аминокислотами в конечном продукте - белке (рис. 4-57).
Как видно из рис. 4-57, нарушения в прочтении информации начинаются с участка, в котором произошла мутация, так как именно в этом месте происходит сдвиг «рамки считывания» информации. Белковый продукт за точкой мутации будет иметь случайную последовательность аминокислот. Мутации со сдвигом рамки считывания часто приводят к появлению внутреннего терминирующего кодона, вызывающего преждевременное прекращение синтеза полипептидной цепи и образование укороченного продукта, лишённого биологической активности.
Мутации со сдвигом «рамки считывания» индуцируют ингибиторы матричных синтезов - «интеркаляторы». Их большие плоские молекулы, похожие на обычные азотистые основания или пары оснований, встраиваются между двумя соседними парами оснований, в результате в ДНК «как бы» появляется лишнее основание. В ходе репликации такой изменённой цепи ДНК в дочернюю нить в результате ошибочного спаривания с «интеркалированной» молекулой может встроиться дополнительный нуклеотид.
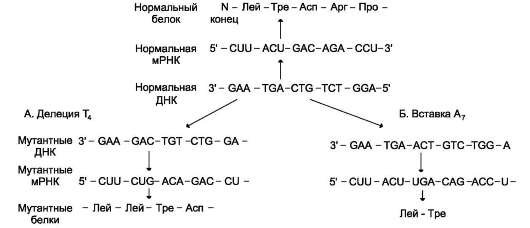
Рис. 4-57. Делеция (А) или вставка (Б) нуклеотида вызывают мутации со сдвигом «рамки считывания» информации.
Таблица 4-8. Основные виды генных мутаций
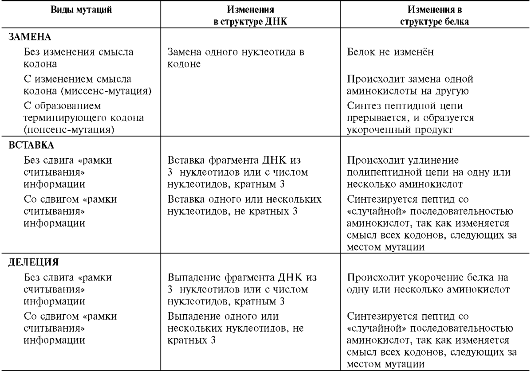
Иногда, хотя и крайне редко, теряется или включается в ДНК олигодезоксинуклеотид, состоящий из 3 или кратного 3 числа нуклео-тидов. Такие мутации называют делециями или вставками без сдвига «рамки считывания» ДНК. В образующемся белковом продукте в этом участке окажется пропущенной или, наоборот, включённой дополнительно одна или несколько аминокислот, тогда как вся остальная аминокислотная последовательность будет соответствовать исходной молекуле. Такие мутации, как правило, не приносят большого вреда.
Информация о разных типах мутаций и изменениях в структуре мутантных белков обобщены в табл. 4-8.
3. Частота мутаций
Считается, что средняя частота возникновения мутаций в структурных локусах (областях локализации гена в хромосоме или в молекуле ДНК) человека колеблется в пределах от 10-5 до 10-6 на одну гамету за каждое поколение. Однако эта величина может значительно варьировать для разных генов (от 10-4 для генов с высокой скоростью мутаций до 10-11 для наиболее устойчивых участков генома). Столь существенные колебания в частоте возникновения мутаций обусловлены характером мутационного повреждения, механизмом возникновения мутации, протяжённостью кодирующей области мутант-ного гена, функциями белка, закодированного в этом гене. Так, для гена гемоглобина скорость замещения одного основания другим лежит в интервале μ = 2,5х10-9-5х10-9 замен в гамете за одно поколение. Чтобы представить себе, что означают эти цифры, распространим эту скорость мутаций на весь геном человека - 3х109 пар оснований. Умножив размер генома на скорость μ, мы получим, что геном за одно поколение может получить от 7 до 15 мутаций, т.е. это значит, что каждая гамета содержит такое количество изменений в ДНК по сравнению с родительской ДНК. А поскольку у каждого индивидуума клетки диплоидны и получаются при слиянии 2 гамет, то мутаций тоже в 2 раза больше.
Спрашивается, каким же образом человечество справляется с такой мутационной нагрузкой? Отвечая на этот вопрос, следует помнить, что кодирующие части генов, изменения в
которых наиболее опасны, занимают не более 10% генома. Ситуация облегчается ещё и тем, что далеко не каждая мутация в кодирующей области имеет фенотипическое проявление. Многие попадают в 3'-положение кодонов и, таким образом, являются «молчащими», так как благодаря вырожденности генетического кода они не приводят к аминокислотным заменам, другие оказываются в доменах, несущественных для функционирования белков. Потомству передаются мутации, происходящие в гаметах, а их процент совсем невелик.
Б. ОРГАНИЗАЦИЯ ГЕНОМА ЧЕЛОВЕКА
Геном
эукариотических клеток (клеток человека в частности) содержит
значительно больше ДНК, чем геном прокариотов. У кишечной палочки E. coli ДНК содержит 3,8х106
пар нуклеотидов или около 3000 генов. При этом вся ДНК выполняет
определённые функции: кодирует белки, рРНК, тРНК или участвует в
регуляции образования генных продуктов. Общая длина ДНК гаплоидного
набора из 23 хромосом человека составляет 3,5х109 пар
нук-леотидов, что в 1000 раз превосходит размер генома прокариотов.
Этого количества ДНК достаточно для создания нескольких миллионов
генов. Однако, согласно многим независимым подсчётам, истинное число
структурных генов находится в области 100 000, а по данным
Международного консорциума и фирмы «Целера Геномикс», полученным при
секвенировании генома человека и опубликованным в
Функции «избыточной» ДНК до конца не ясны, полагают, что она участвует в регуляции экспрессии генов, процессинга РНК, выполняет структурные функции, повышает точность гомологичного спаривания и рекомбинации хромосом в процессе мейоза, способствует успешной репликации. Большая часть этой ДНК возникла в результате обратной транскрипции РНК и благодаря наличию подвижных элементов.
Часто повторяющиеся последовательности ДНК
Во фракции «избыточной» ДНК выделяют относительно короткие последовательности длиной от 2 до 10 пар нуклеотидов, повторяющиеся миллионы раз. Эти часто повторяющиеся последовательности получили название «сателлитной ДНК». Они составляют около 10% всего генома человека, рассеяны по всему генетическому материалу клетки, но преимущественно локализуются в центромерных и теломерных областях большинства хромосом.
Умеренно повторяющиеся последовательности
ДНК
Выделяют также группу умеренно повторяющихся последовательностей ДНК, очень гетерогенную по длине и числу копий, составляющую более 30% генома человека. Эта фракция включает ДНК, кодирующую структуру рРНК, тРНК и некоторых мРНК. Гены гистонов присутствуют в геноме в количестве нескольких сотен копий и также принадлежат к этому классу. Умеренно повторяющиеся последовательности ДНК включают участки, которые не транскрибируются, но важны в регуляции экспрессии генов: промоторы и энхансеры. В этой группе были обнаружены последовательности ДНК длиной примерно в 300 пар нуклеотидов, которые повторяются около миллиона раз (в среднем через каждые 5000 пар нуклеотидов) и рассеяны по всему геному человека.
Частые представители умеренно повторяющихся последовательностей - line-семейство (от англ. long interspersed elements), или семейство длинных рассеянных элементов, в которое входят ДНК последовательности длиной от 5000-8000 пар нуклеотидов, встречаются в геноме в количестве 850 000 копий.
Уникальные последовательности ДНК
Они представлены ДНК-последовательностями, которые присутствуют в геноме в количестве одной или нескольких копий, и транскрибируются, образуя мРНК, содержащие информацию о различных белках (рис. 4-58).
Типичный ген человека состоит примерно из 28 000 нуклеотидов и содержит в среднем 8 экзонов, его кодирующая последовательность составляет около 1340 пар нуклеотидов и шифрует белок, включающий 447 аминокислотных остатков. Самый крупный ген - ген мышечного
белка дистрофина, состоящий из 2,4х106 пар нуклеотидов, а наибольшее количество экзонов (234) присутствует в гене фибриллярного белка титина, ответственного за пассивную эластичность скелетных мышц.
Нередко уникальные последовательности образуют мультигенные семейства, располагающиеся в виде кластеров в определённых областях одной или нескольких хромосом. Примерами мульти-генных семейств могут служить гены рибосо-мальных, транспортных и малых ядерных РНК, гены α- и β-глобинов, тубулинов, миоглобина, актина, трансферина и многих других.
В мультигенных семействах наряду с функционально активными генами содержатся псевдогены - мутационно изменённые последовательности, не способные транскрибироваться или продуцирующие функционально неактивные генные продукты.
Псевдогены - одна из важных структурных особенностей генома человека. Эти уникальные последовательности очень сходны по структуре с определёнными генами. В связи с тем, что в генных семействах наряду с псевдогенами сохраняются неизменённые гены, жизнеспособность организма не нарушается. Для многих генов обнаружены псевдогены. Их количество варьирует от одной до нескольких десятков копий на геном, и, как правило, они расположены тан-демно. Иногда псевдогены и соответствующие им нормальные гены локализованы в разных хромосомах.
В. ПОЛИМОРФИЗМ БЕЛКОВ
Поскольку большинство нормальных клеток человека диплоидны, то они содержат две копии каждой хромосомы, одна из которых получена от отца, а вторая от матери. Эти две копии одной и той же хромосомы называют гомологичными (рис. 4-59). В ДНК каждой хромосомы содержится более тысячи генов. Соответствующие друг другу гены в гомологичных хромосомах называют аллелями. Аллели могут быть идентичными и содержат одинаковую последовательность нуклеотидов. В этом случае индивидуум, имеющий такие аллели, будет гомозиготен по данному признаку. Если аллели различаются по последовательности нуклеотидов в ДНК, то говорят о гетерозиготном наследовании гена. В этом случае индивидуум будет иметь 2 белко-
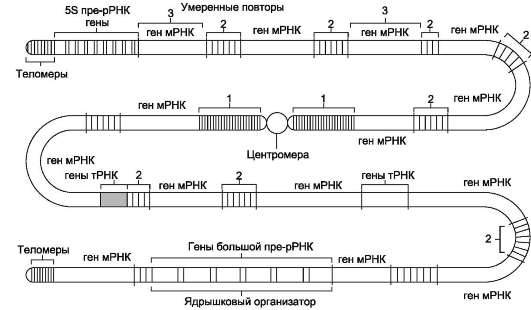
Рис. 4-58. Распределение уникальных, умеренно и часто повторяющихся последовательностей ДНК в гипотетической хромосоме человека. Уникальные последовательности (3) транскрибируются в виде мРНК. Эти гены встречаются в одной или нескольких копиях. Гены рРНК и тРНК представлены множеством копий, образующих кластеры в геноме. Гены большой пре-рРНК образуют ядрышковый организатор. Умеренно повторяющиеся последовательности (2) распределены по всему геному, а часто повторяющиеся последовательности (1) образуют кластеры в областях центромеры и концов хромосомы - теломеров.
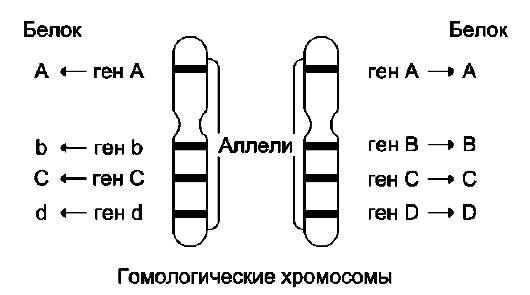
Рис. 4-59. Гомологичные хромосомы и соответствующие аллелям белковые продукты. На рисунке показано расположение 4 аллелей (АА, Bb, CC, dD) на гомологичных хромосомах. Аллели могут быть идентичны, как в случае генов АА и СС, или различаться (Bb, Dd). Белковые продукты будут идентичны для аллелей АА и СС, но будут различаться по аминокислотной последовательности в случае аллелей Bb и Dd.
вых продукта гена, различающихся по аминокислотной последовательности.
У каждого человека существует только 2 разных аллеля одного гена, тогда как в популяции людей вариантов аллелей может быть огромное множество. Как уже говорилось ранее, изменчивость структуры ДНК, а следовательно разнообразие аллелей, обусловлено мутационным процессом и рекомбинациями в гомологичных хромосомах половых клеток. Если в ходе мейоза рекомбинации сопровождаются обменом учас-тками ДНК, меньшими по размеру, чем ген, то такой процесс может приводить к появлению новых, прежде не существовавших аллелей. А поскольку рекомбинации - более частые события, чем мутации в кодирующих участках гена, то разнообразие вариантов аллелей обусловлено главным образом ими.
Существование в популяции 2 и большего числа аллелей одного гена называют «аллеломор-
физм», или «полиморфизм», а белковые продукты, образующиеся в ходе экспрессии этих вариантов гена - «полиморфы». Разные аллели встречаются в популяции с разной частотой. К полиморфам относят только те варианты, распространённость которых в популяции не меньше 1%.
В процессе эволюции отдельные гены ам-плифицируют с образованием копий, а их структура и положение могут изменяться в результате мутаций и перемещений не только внутри хромосомы, но и между хромосомами. Со временем это приводит к появлению новых генов, кодирующих белки, родственные исходному, но отличающиеся от него определёнными свойствами и занимающие в хромосомах разные генные локусы (или места).
К родственным белкам относят изобелки, представляющие собой варианты белков, выполняющие одну и ту же функцию и обнаруживаемые в пределах одного вида организмов. Так, в группе из 2000 генов человека, кодирующих факторы транскрипции и транскрипционные активаторы, идентифицировано 900, относящихся к семейству белков, имеющих «цинковые пальцы». Существует 46 генов фермента глице-ральдегид-3-фосфатдегидрогеназы, осуществляющего единственную окислительную реакцию в метаболическом пути катаболизма глюкозы до пирувата.
Выявлены семейства родственных белков, возникшие в ходе эволюции из одного «пред-кового» гена, или гена-предшественника. Такие семейства составляют:
• гены миоглобина и протомеров гемоглобинов;
• группа протеолитических ферментов: трипсин, химотрипсин, эластаза, плазмин, тромбин и некоторые другие белки и ферменты.
1. Гемоглобины человека
В ходе эволюции из единичных генов-предшественников возникли семейства генов α- и β-глобинов (рис. 4-60), на хромосомах 16 и 11 соответственно.
В процессе онтогенеза у людей образуются разные виды гемоглобинов, обеспечивающие наилучшую адаптацию к меняющимся условиям существования. HbE - эмбриональный, синтезируется у зародыша в первые месяцы развития, HbF - фетальный, обеспечивает дальнейшее внутриутробное развитие плода, а HbA и HbA2 осуществляют транспорт кислорода в организме взрослого человека. Эти белки представляют собой тетрамеры, состоящие из полипептидных цепей двух видов: α и β в HbA (2α2β), α и ε в HbE (2α2ε), а у остальных гемоглобинов β-цепи заменены на γ-полипептиды в HbF (2α2γ) или на δ-цепи в HbA (2α2δ).
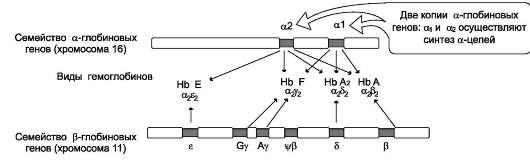
Рисунок 4-60. Схематическое расположение кластеров α- и β-глобиновых генов. Обнаружены две копии α-глобинового гена: α1 и α2, каждая из которых обеспечивает синтез α-глобиновой цепи. В семействе генов β-глобинов локус e экспрессируется в период раннего эмбрионального развития плода на начальных месяцах беременности (α2ε2). Гены γ экспрессируются в процессе внутриутробного развития плода (HbF, α2γ2). Гемоглобины взрослого человека - HbA (α2β2), составляющий 96%, и HbA2 (α2δ2), составляющий 2-2,5%, образуются в результате экспрессии генов β и δ. ψβ - псевдоген, имеющий последовательность нуклеотидов, гомологичную β-гену, но содержащий мутации, нарушающие его экспрессию.
Полиморфизм гемоглобинов в популяции людей очень велик. Наряду с генами, кодирую-щими изобелки и занимающими разные локусы на хромосоме, обнаружено большое число вариантов гемоглобина А, являющихся продуктами аллельных генов. Некоторые варианты НbА представлены в таблице 4-9.
Один из наиболее известных аллельных вариантов HbA - HbS, образующийся в результате замены остатка глутамата в положении 6 β-цепи HbA на валин (β6 Глу-Вал). По алле-
лям HbA и HbS всех людей можно разделить на 3 генотипически различающиеся группы: АА, AS и SS. Распространённость аллеля S по земному шару неравномерна. Часто людей с этим аллелем можно встретить в малярийных районах Африки и Азии (до 35%). К настоящему времени описано свыше 300 вариантов HbA, на основании этого признака всех людей можно разделить на 600 генотипических групп по наиболее часто встречающимся аллелям.
Таблица 4-9. Некоторые варианты гемоглобина А человека
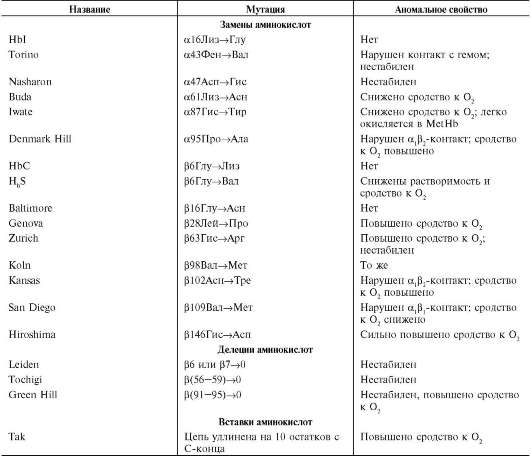
Примечание. Цитировано по учебнику А.Я. Николаева «Биологическая химия» (М.: Высшая школа, 1989).
2. Группы крови
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, - существование в популяции людей 3-х наиболее часто встречающихся аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0). Этот фермент принимает участие в синтезе олигосахарида, локализованного на наружной поверхности плазматической мембраны и определяющего антигенные свойства эритроцитов. Варианты фермента А и В имеют разную субстратную специфичность: вариант А катализирует присоединение к олигосахариду N-ацетилгалактозамина, а вариант В - галактозы. Вариант 0 кодирует белок, лишённый ферментативной активности.В результате структура олигосахаридов, расположенных на поверхности эритроцитов, будет разной (рис. 4-61).
Антитела к антигенам А и В обычно имеются в сыворотке крови людей, на поверхности эритроцитов которых отсутствует соответствующий антиген, т.е. индивидуумы с антигенами А на поверхности эритроцитов продуцируют в сыво-
ротку крови антитела к В-антигенам (анти-В), а люди с В-антигенами - антитела к антигенам А (анти-А). В сыворотке крови анти-А и анти-В обычно присутствуют в высоких титрах и при появлении соответствующих антигенов способны активировать ферменты системы комплемента.
При переливании крови руководствуются правилом, согласно которому кровь донора и реципиента не должна содержать антигены и антитела, реагирующие между собой: например, реципиенту, имеющему в сыворотке крови анти-А, нельзя переливать кровь от донора, содержащего на эритроцитах антигены А.
При нарушении этого правила происходит реакция антиген-антитело. Это вызывает агглютинацию (склеивание) эритроцитов и их разрушение ферментами комплемента и фагоцитами.
Как видно из табл. 4-10, у индивидуумов-гетерозигот, имеющих группу крови АВ (IV), на эритроцитах присутствуют А- и В-антигены, функционируют 2 варианта гликозилтранс-
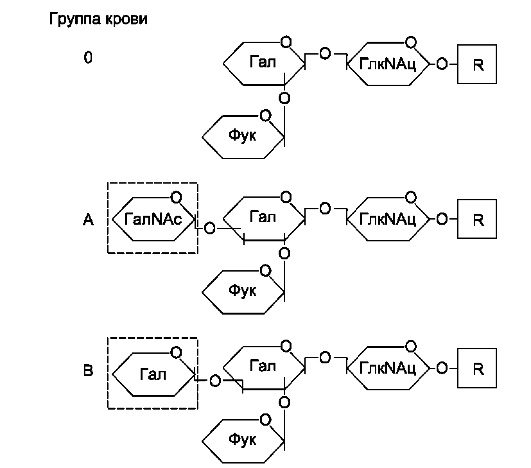
Рис. 4-61. Структура олигосахаридов, определяющих группу крови. Олигосахариды различаются концевыми мономерами. Олигосахарид А имеет на нередуцирующем конце N-ацетилгалактозамин (ГалNАц), олигосахарид В - галактозу (Гал), а олигосахарид 0 укорочен на один моносахаридный остаток. R представляет собой белок либо липид - церамид.
Таблица 4-10. Характеристика групп крови
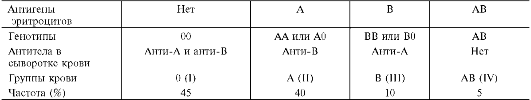
феразы (А и В), а следовательно антитела не образуются. Этих людей можно рассматривать как «универсальных» реципиентов, которым безопасно вводить эритроциты от доноров, имеющих любые группы крови. Однако люди с группой крови IV не могут безопасно получать сыворотку крови от этих доноров, так как она содержит антитела к А- и/или В-антигенам. В то же время индивидуумы, имеющие 0 (I) группу крови, - гомозиготы по неактивному варианту гликозилтрансферазы 0, и поверхность их эритроцитов лишена антигенов. Такие люди являются «универсальными» донорами эритроцитарной массы, так как их эритроциты можно вводить людям с группами крови А, В, 0 или АВ. В то же время сыворотка крови этих доноров содержит антитела к А- и В-антигенам и может использоваться только для пациентов 0 (I) группы крови.
3. Белки главного комплекса гистосовместимости и трансплантационная несовместимость
При формировании клеточного иммунного ответа узнавание Т-лимфоцитами чужеродного антигена происходит только если он расположен рядом с гликопротеинами, присутствующими на собственной клеточной мембране. Эти гликопротеины называют белками главного комплекса гистосовместимости, или МНС-белками (см. раздел 1). Существуют 2 класса этих белков: молекулы класса I и II. МНС-белки класса I обнаружены практически во всех содержащих ядро клетках, включая Т-киллеры, тогда как МНС-белки класса II найдены главным образом в клетках, участвующих в иммунном ответе, в антиген-представляющих В-клетках, макрофагах и некоторых специализированных эпителиальных клетках.
Строение МНС-белков кодирует семейство генов, расположенных на коротком плече хро-
мосомы 6 и занимающих участок ДНК длиной более 6000 пар нуклеотидов. Это семейство состоит из серии тесно сцепленных генов, ответственных за синтез МНС-белков и некоторых компонентов системы комплемента. Гены комплекса отличаются чрезвычайно высоким полиморфизмом. Число разных аллелей достигает нескольких миллионов. Белки МНС-системы считают самой полиморфной системой человека. Вариабельность МНС-белков обеспечивает трансплантационную несовместимость. Клетки трансплантата имеют набор этих белков, отличный от МНС-белков реципиента (во всех случаях, кроме генетически идентичных близнецов), и это приводит к развитию реакции клеточного иммунитета, в результате которой трансплантированная ткань отторгается.
Исследования показали, что полиморфизм различных белков настолько велик, что можно говорить о биохимической индивидуальности и уникальности каждого человека.
Г. НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ
Каждый генетический локус характеризуется определённым уровнем изменчивости, т.е. присутствием различных аллелей у разных индивидуумов. Аллели генов делят на 2 группы - нормальные, или аллели «дикого» типа, для которых функция гена не нарушена, и мутантные, приводящие к нарушению работы гена. «Плохой» аллель кодирует синтез белка, функция которого сильно нарушена и при гомозиготном наследовании фенотипически проявляется как наследственная болезнь. Наследственные болезни - следствие мутаций, произошедших в гаметах или зиготе. Такие мутации могут быть первичными, если возникли в гаметах или в процессе формирования зиготы, или вторичными, если мутантный ген возник раньше и
был передан последующему поколению по наследству.
Первичные мутации, как правило, не сопровождаются возникновением болезни, так как происходят обычно в одной из хромосом, и индивидуум, получивший такую мутацию, становится гетерозиготным носителем повреждения в гене. Мутантный ген в гетерозиготном состоянии часто не проявляется как болезнь и существенно не снижает жизнеспособность организма. Это способствует его распространению в популяции.
При вторичных мутациях, если каждый из родителей является носителем мутантного гена, будучи гетерозиготой, возможно рождение детей-гомозигот по дефектному аллелю. В таком случае развивается наследственная болезнь, часто сопровождающаяся очень тяжёлым течением.
Согласно данным Всемирной организации здравоохранения, около 2,4% всех новорождённых на земном шаре страдают теми или иными наследственными нарушениями. Около 40% ранней младенческой смертности и инвалидности с детства обусловлены наследственной патологией.
К настоящему времени на хромосомах человека выявлено около 800 генов, мутации в которых приводят к развитию различных наследственных болезней. Количество моногенных заболеваний (т.е. вызванных мутациями в определённом гене) ещё больше и равно примерно 950 в результате существования так называемых «аллельных серий», т.е. групп болезней, клинически сильно отличающихся друг от друга, но обусловленных мутациями в одном и том же гене. Например, мутации в гене рецептора с тирозинкиназной активностью ret могут вызывать 4 различных наследственных заболевания.
Более половины генов, в которых найдены мутации, вызывающие наследственные заболевания, охарактеризованы методами молекулярного анализа. Наибольшую по размеру группу составляют ферменты (31% от общего числа). За этой группой следуют белки, модулирующие функции белков и участвующие в правильном сворачивании полипептидных цепей (14%).
На каждой хромосоме в среднем идентифицировано около 30 структурных генов, мутации в которых вызывают наследственные болезни. Однако распределены эти гены по хромосомам неравномерно. Так, например, на хромосоме 2 их в 3 раза меньше, чем на хромосоме 1. На-
ибольшее число мутантных генов (более 100) установлено на Х-хромосоме.
Хорошо изученными наследственными заболеваниями, связанными с нарушением синтеза α- или β-цепей НЬ, являются талассемии. Синтез α- и β-цепей в норме регулируется таким образом, что все молекулы протомеров используются на синтез тетрамера α2β2. Талассемии возникают как результат мутаций, включающих замены или делеции одного или нескольких нуклеотидов, а иногда и целого гена, кодирующего структуру одного из протомеров. Эти болезни классифицируют по 4 типам: так, в случае, если одна из цепей не синтезируется, то их обозначают как α0- или β0-талассемии, а если синтез какой-либо из цепей снижен, то α+- или β+-талассемии.
α-Талассемии возникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности α-цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как «молчащего носителя» талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α-цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы НЬ, а тетрамеры γ4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки.
β-Талассемии развиваются в результате снижения синтеза β-цепей НЬ, для которых на каждой хромосоме имеется по одному гену. Синтез НЬА начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность НЬ проявляется в слабой степени и не требует специального лечения. Однако при полном выключении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам проводят либо периодическую трансфузию крови, либо пересадку костного мозга.
Со многими моногенными наследственными заболеваниями читатель познакомится практически во всех последующих разделах учебника. Здесь же хотелось бы только отметить, что наряду с болезнями, наследственная природа которых ярко выражена, существует множество болезней,
характеризующихся семейной предрасположенностью. Это такие широко распространённые заболевания, как сахарный диабет, подагра, атеросклероз, шизофрения и ряд других. В отличие от моногенных болезней, эти заболевания относят к мультифакторным. Поэтому исследования, направленные на выявление белков, аллельные формы которых ответственны за предрасположенность к заболеванию, являются задачами настоящего и будущего времени.
ix. использование днк-технологий в медицине
В настоящее время стало очевидным, что достижения в области молекулярной биологии способны сильно изменить практическую медицину. Они не только углубили наши знания об экспрессии генов и причинах многих болезней, но способствовали разработке новых подходов к их диагностике и лечению.
Было установлено, что полиморфизм генов широко распространён в популяции людей, показана взаимосвязь между изменениями в структуре ДНК и многими болезнями. Идентификация генов, нарушение работы которых приводит к развитию наследственных заболеваний, создала предпосылки для подробного анализа генетических и биохимических основ патогенеза этих заболеваний и разработки наиболее эффективных методов лечения.
Методами молекулярной медицины были созданы вакцины для предотвращения гепатитов, инсулин человека - для лечения сахарного диабета, фактор VIII - для восстановления нормального свёртывания крови и лечения гемофилии и многие другие препараты.
С помощью генной терапии оказалось возможным вводить в организм больного полноценно работающие гены и таким образом восстанавливать метаболические нарушения, вызванные мутантными генами. Таким путём осуществляется лечение детей с иммунодефицитом, вызванным дефектом аденозиндезаминазы, в стадии клинических испытаний находятся методы генокоррекции таких наследственных болезней, как семейная гиперхолестеринемия, гемофилия В, муковисцидоз и некоторые другие.
Для выявления дефектов в структуре ДНК она должна быть выделена из соответствующего
источника (биологической жидкости, биоп-тата, культуры клеток и т.д.) и «наработана» в количествах, достаточных для исследования. Для генно-терапевтических работ необходимы выделение нормальных генов и введение их в дефектные клетки таким образом, чтобы они экспрессировались, позволяя восстановить здоровье пациента.
В настоящем разделе будут даны основные представления о методах, используемых в решении проблем ДНК-диагностики наследственных болезней и генной терапии.
А. МЕТОДЫ ВЫДЕЛЕНИЯ ДНК
ДНК может быть выделена из любого типа тканей и клеток, содержащих ядра. Этапы выделения ДНК включают быстрый лизис клеток, удаление фрагментов клеточных органелл и мембран с помощью центрифугирования, ферментативное разрушение белков протеиназами и экстрагирование ДНК из раствора с помощью фенола и хлороформа. Затем ДНК осаждают, как правило, этанолом и после удаления на-досадочной жидкости растворяют в буферном растворе.
• Оценку качества экстрагированной ДНК проводят на основании измерения оптической плотности раствора ДНК в области белкового и нуклеинового спектров поглощения, т.е. при 280 и 260 нм, соответственно. Для чистых образцов ДНК соотношение оптических плотностей, полученных при 260/280 нм, должно быть больше 1,8.
• Молекула ДНК одной хромосомы среднего размера содержит 150х106 пар нуклеотидов и имеет длину около
Расщепление ДНК с помощью рестриктаз
Для фрагментирования используют рестрик-тазы (ферменты, расщепляющие ДНК) или рест-
рикционные эндонуклеазы (от англ. restriction endonucleases), выделенные из бактериальных клеток. Эти ферменты in vivo участвуют в узнавании и разрушении чужеродных для бактерий ДНК, расщепляя внутренние участки молекулы на сравнительно небольшие фрагменты. Рестрикта-зы узнают специфические последовательности из 4-6, реже 8-12 нуклеотидов в двухцепочечной молекуле ДНК (сайты рестрикции) и «разрезают» её в местах локализации этих последовательностей. Количество образующихся рестрик-ционных фрагментов ДНК при использовании одной рестриктазы зависит от количества сайтов рестрикции, а размер фрагментов определяется положением этих сайтов по всей длине исходной молекулы ДНК.
Известно более 500 различных типов рест-риктаз бактериального происхождения, причём каждый из этих ферментов узнаёт свою спе-
цифическую последовательность (рис. 4-62). С помощью набора рестриктаз можно разрезать молекулу ДНК на фрагменты желаемой длины. Например, для изучения первичной структуры (метод секвенирования) удобны фрагменты размером около 300 пар нуклеотидов. Следовательно, ДНК одной хромосомы в 150х106 пар нуклеотидов нужно разрезать на 500 000 фрагментов и каждый из фрагментов изучать отдельно.
Образующиеся в результате рестрикции фрагменты ДНК могут быть исследованы методом электрофореза в агарозном или полиакриламид-ном геле. Выявление ДНК в геле возможно в присутствии бромида этидия, связывающегося с фрагментами молекулы и дающего специфическое розовое окрашивание в ультрафиолетовой области спектра.
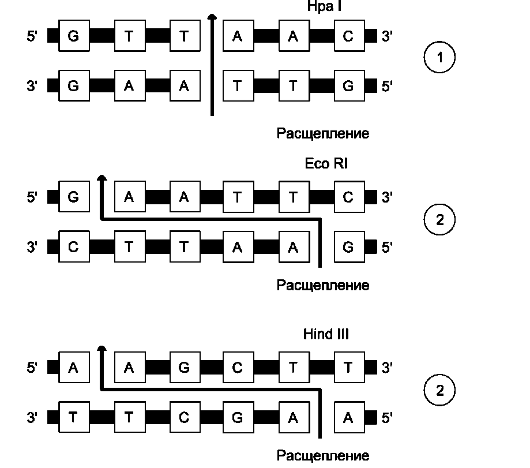
Рис. 4-62. Последовательность нуклеотидов в ДНК, узнаваемая тремя наиболее часто используемыми рест-риктазами. Рестрикцирующие нуклеазы получают из различных бактерий: HPA I - Haemophilus parainfluenzas; Eco RI - из Escherichia coli; Hind III - из Haemophilus influenzae. Рестриктазы типа 1 расщепляют ДНК с образованием «слепых» концов, а другие (типа 2) с образованием по месту разрыва одноцепочечных «липких» концов.
Б. ИДЕНТИФИКАЦИЯ СПЕЦИФИЧЕСКИХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
При обработке геномной эукариотической ДНК, в частности, ДНК человека, рестриктаза-ми образуется так много фрагментов различной длины, что их не удаётся удовлетворительно разделить с помощью электрофореза в по-лиакриламидном или агарозном геле. После электрофореза рестрикцированной геномной ДНК и проявления с помощью бромида этидия получается равномерное окрашивание по всей длине геля. Идентификация нужных фрагментов ДНК в таком геле возможна только путём гибридизации с мечеными ДНК-зондами. Синтез ДНК-зондов осуществляется в автоматизированных машинах, позволяющих синтезировать фрагменты однонитевой ДНК длиной свыше 100 нуклеотидных звеньев со строго определённой первичной структурой. Такие молекулы можно использовать для специфического связывания с исследуемыми участками гена.
Блот-гибридизация по Саузерну
Классическим методом идентификации интересующих участков ДНК стал метод блот-гиб-ридизации по Саузерну, предложенный в
К настоящему времени разработано много модификаций этого метода. Так, ДНК-зонд не всегда метят радиоактивными изотопами, нередко используют соединения, ковалентно связывающиеся с ДНК; их можно обнаружить по образованию окрашенного продукта или флюоресценции. Длина олигонуклеотидов в ДНК-зондах также может сильно варьировать,
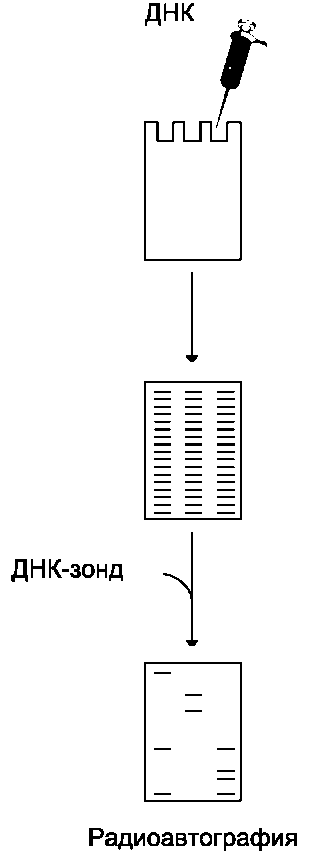
Рис. 4-63. Блот-гибридизация по Саузерну. Фрагменты ДНК разделяют с помощью электрофореза, денатурируют, переносят на нитроцеллюлозный фильтр и гибридизуют с ДНК-зондом.
будучи иногда очень короткой - в 15-20 пар нуклеотидов. Описаны методы дот- (пятно) или слот- (полоска) гибридизации, когда на твёрдый носитель наносят препараты ДНК или РНК без предварительной рестрикции или электрофореза и гибридизуют их с мечеными ДНК-зондами.
В. УСТАНОВЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ДНК-ФРАГМЕНТОВ (СЕКВЕНИРОВАНИЕ ДНК)
Наиболее часто для установления первичной структуры ДНК используют дидезоксисеквени-рование. В реакционных пробах, содержащих денатурированную однонитевую ДНК, ДНК-полимеразу, дезоксинуклеозидтрифосфаты (дНТФ) - дАТФ, дЦТФ, дГТФ и дТТФ, один из которых является радиоактивным, и праймер инициируют синтез ДНК в присутствии спе-
цифических дидезоксинуклеозидтрифосфатов (ддНТФ), или терминаторов, - ддАТФ, ддЦТФ, ддГТФ или ддТТФ. Синтез одновременно ведут в четырёх параллельных пробах, в каждую из которых наряду с компонентами реакционной смеси прибавляют один из 4 ддНТФ. ддНТФ будут конкурировать с нормальными дНТФ за включение в растущую полинуклеотидную цепь. При встраивании ддНТФ вместо соответствующего нуклеотида синтез ДНК прекращается. В результате в каждой из пробирок получается набор различающихся по длине меченых фрагментов ДНК с одним из специфических ди-дезоксинуклеотидов на конце. После одновременного разделения этих фрагментов в электрическом поле на 4 соседних дорожках и радиоавтографии размер синтезированных молекул может быть установлен, а это значит, что может быть определена локализация терминирующих дидезоксинуклеотидов. На основании этих
данных устанавливают последовательность нук-леотидов во вновь синтезированных фрагментах, комплементарных ДНК-матрице (рис. 4-64).
В настоящее время создают приборы для автоматического одновременного секвениро-вания большого числа проб с использованием меченных разными флюорохромами дидезок-синуклеотидов.
В то же время разрабатывают новые, более эффективные и экономичные методы секве-нирования. Сущность одного из них заключается в следующем: из 4 нуклеозидтрифосфатов (дАТФ, дГТФ, дТТФ, дЦТФ) создаётся набор олигонуклеотидов (например, октануклеотидов), включающий все возможные варианты последовательностей. Эти октануклеотиды иммобилизуют (пришивают) в ячейках, в результате чего создаётся так называемая олигонуклеотидная матрица. Секвенируемый фрагмент ДНК метят по фосфатному остатку и добавляют в ячейки
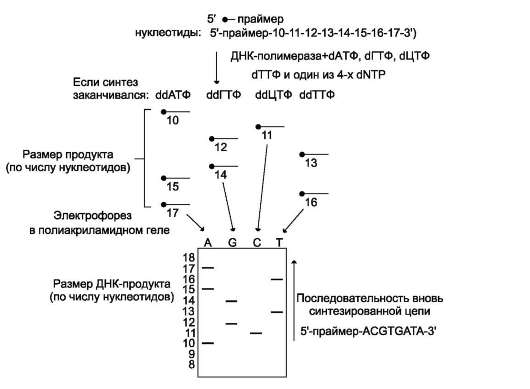
Рис. 4-64. Дидезоксисеквенирование последовательности ДНК. Используют 4 пробы, каждая из которых содержит ДНК-матрицу, праймер, ДНК-полимеразу, 4 дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ). Праймер либо один из нуклеотидов содержит радиоактивную метку, благодаря чему полосы могут быть обнаружены в геле с помощью радиоавтографии. Один из 4 дидезоксирибонуклеотидов (ддНТФ) добавляют в каждую пробирку. Остановка синтеза происходит в том случае, когда ддНТФ включается в растущую олигонуклеотидную цепь.
матрицы. Фрагмент ДНК гибридизуется только с теми октануклеотидами, последовательности которых комплементарны его участкам. Таким образом, определяется набор всех возможных октануклеотидов, присутствующих в исследуемом фрагменте ДНК. Далее при помощи специальной компьютерной обработки упорядочивается расположение октамеров в исследуемом фрагменте ДНК.
Г. ПОЛУЧЕНИЕ РЕКОМБИНАНТНЫХ ДНК И ИХ АМПЛИФИКАЦИЯ
Для работы с нуклеотидными последовательностями в генах и других участках ДНК необходимо иметь достаточное количество материала для исследования. Это непростая задача, особенно если источником ДНК служат ткани человека. Поэтому исследуемые фрагменты ДНК обычно предварительно амплифицируют (увеличивают количественно в миллионы раз), для того чтобы получать их в любое время и в неограниченном количестве. Исключительно ценным инструментом в решении этой проблемы оказалось использование рекомбинантных ДНК (т.е. ДНК, построенных из участков разного происхождения).
1. Получение рекомбинантных ДНК
Для получения таких молекул первоначально выделяют ДНК из 2 разных источников (рис. 4-65).
Каждую из них в отдельности фрагментируют, используя одну и ту же рестриктазу, расщепляющую ДНК с образованием «липких» концов. После процедуры нагревания и медленного охлаждения (отжига) наряду с исходными молекулами ДНКХ и ДНКу могут образовываться рекомбинантные молекулы, состоящие из фрагментов ДНКХ и ДНКу связанных между собой «липкими» концами. Ковалентное сшивание фрагментов осуществляют с помощью ДНК-лигазы в присутствии АТФ как источника энергии.
В технологии рекомбинантных ДНК, кроме фрагментов ДНК, выделенных из клеток, содержащих ядра, используют ДНК, полученную с помощью обратной транскриптазы. При добавлении в реакционную среду 4 разных дезокси-рибонуклеозидтрифосфатов фермент на матрице мРНК по принципу комплементарности синтезирует ДНК-копию, или кДНК. Так как ис-
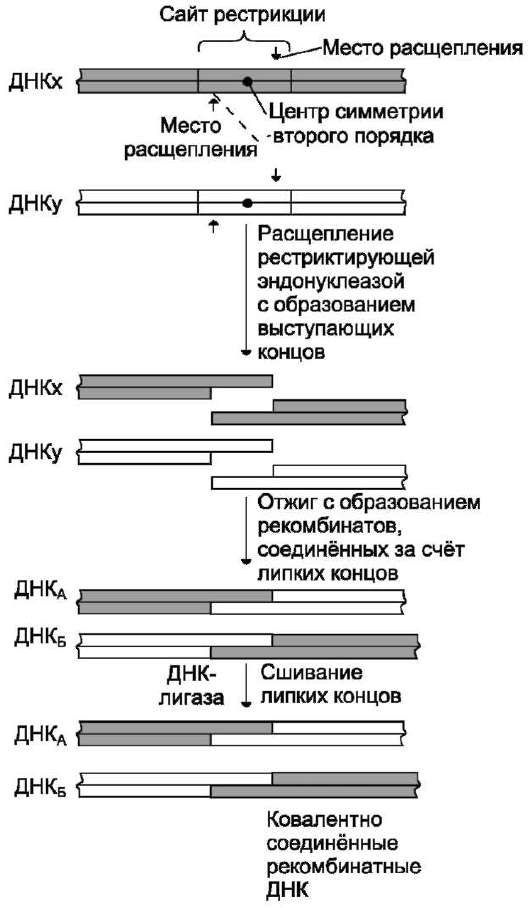
Рис. 4-65. Получение рекомбинантных ДНК. Два
образца ДНК: ДНКХ и ДНКY расщепляют одной и той же рестриктазой и получают фрагменты с «липкими» концами. При денатурации и последующем «отжиге» образуются рекомбинантные молекулы ДНКА и ДНКБ, первоначально соединённые друг с другом за счёт «липких» концов, затем сшиваемых ДНК-лигазой.
точником информации при образовании кДНК служит зрелая цитоплазматическая мРНК, то такая ДНК, в отличие от ДНК фрагментов, полученных при расщеплении геномной ДНК эукариотов, не содержит интронов.
2. Клонирование ДНК
Для получения значительных количеств интересующего нас материала проводят клонирова-
ние ДНК, предполагающее встраивание нужного нам фрагмента ДНК в векторную молекулу ДНК (или вектор). Вектор обеспечивает проникновение этой рекомбинантной, или химерной, ДНК в бактериальные клетки. В качестве векторов используют плазмиды, фаги, ретро- и аденовирусы. Особенно часто в качестве вектора служит плазмидная ДНК.
Плазмиды - небольшие кольцевые двухце-почечные молекулы ДНК, присутствующие в бактериальных клетках в различном количестве копий. Они имеют автономную систему контроля репликации, которая поддерживает их количество в клетках на определённом уровне - от нескольких единиц до нескольких сотен копий геномов на клетку.
Используемую для клонирования плазмидную ДНК и интересующую нас ДНК расщепляют по определённому участку рестриктазой, получают рекомбинантную ДНК, возвращают гибридную плазмиду в кольцевую форму и вводят в бактериальные клетки, т.е. осуществляют трансформацию бактерий. При размножении трансформированных бактерий происходит увеличение числа копий введённого в плазмиду фрагмента ДНК, т.е. таким способом чужеродный для бактерий генетический материал может быть получен в значительных количествах (рис. 4-66).
В качестве клонирующих векторов часто используют фаги. Если экзогенную ДНК вводят в эукариотические клетки, то эту процедуру называют трансдукцией.
3. Полимеразная цепная реакция
Метод полимеразной цепной реакции (ПЦР), предложенный в
тарны 3'-концам амплифицируемого участка на кодирующей и некодирующей нитях ДНК. Расстояние между праймерами определяет длину синтезируемых молекул. В качестве матрицы для синтеза продуктов ПЦР используют любой тип ДНК: геномную ДНК человека, различных видов про- и эукариотов, ДНК, выделенную из культур клеток, «библиотек» генов и других источников. Метод не требует больших количеств исследуемой ДНК, в принципе, достаточно даже одной молекулы, содержащейся в одном волосе на голове, одной капли крови или спермы.
Успех в разработке метода в значительной степени обусловлен использованием в качестве фермента термофильной ДНК-полимеразы, выделенной из бактерий, живущих в горячих источниках, и потому устойчивой к действию высоких температур.
Реакционная смесь для получения интересующей нас ДНК содержит исследуемую ДНК, субстраты реакции - 4 дНТФ, 2 праймера, термостабильную, или Taq-полимеразу и буфер, содержащий ионы Mg2+.
Один цикл полимеризации включает 3 этапа (рис. 4-67):
плавление: на этой стадии реакционную смесь нагревают до температуры 90-97 ?С. Исследуемая двуцепочечная ДНК денатурирует и переходит в однонитевую форму; гибридизация или отжиг ДНК с праймерами. В результате снижения температуры до 50- 60 ?С происходит комплементарное связывание праймеров с цепями матричной ДНК и образование двухцепочечного участка на каждой из нитей ДНК; элонгация, удлинение нитей ДНК, комплементарных матричной ДНК, катализирует Taq-полимераза в направлении от 5'- к З'-концу. Затем снова наступает этап плавления, когда за счёт повышения температуры синтез ДНК прекращается, и двунитевой участок между матричными и вновь синтезированными молекулами ДНК денатурирует. Во втором и последующих циклах праймеры гибридизируются с исходной матричной ДНК и с вновь синтезированными молекулами ДНК, количество которых нарастает в геометрической прогрессии. В последнем случае синтез ДНК заканчивается не из-за изменения температурного режима, а по достижении ДНК-полимеразой границы ампли-фицированного участка, что определяет строго
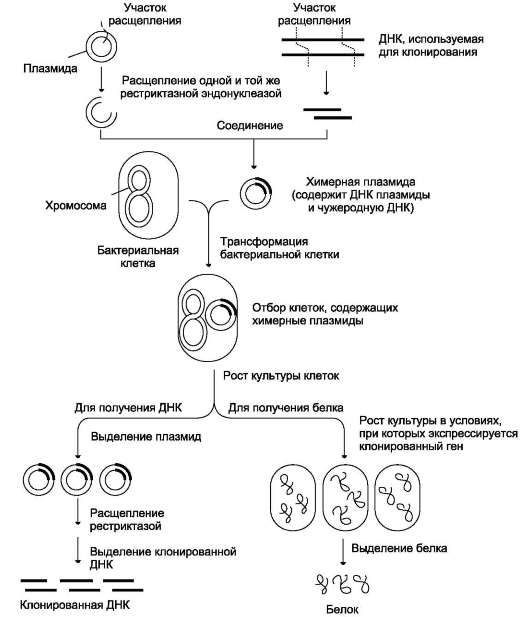
Рис. 4-66. Схема клонирования ДНК в бактериальных клетках.
определённый размер продукта с точностью до одного нуклеотида.
Каждый из этапов цикла имеет продолжительность от десятков секунд до 1-3 мин, в результате полный цикл длится от одной до нескольких минут.
Описанную процедуру амплификации ДНК проводят в автоматическом режиме в приборе -
циклизаторе, или термоциклере, амплификаторе ДНК. Такой прибор позволяет задавать нужное количество циклов и выбирать оптимальные временные и температурные параметры. За 25-30 циклов число синтезированных копий ДНК достигает нескольких миллионов.
С помощью ПЦР можно получить достаточное количество копий участков ДНК, в которых
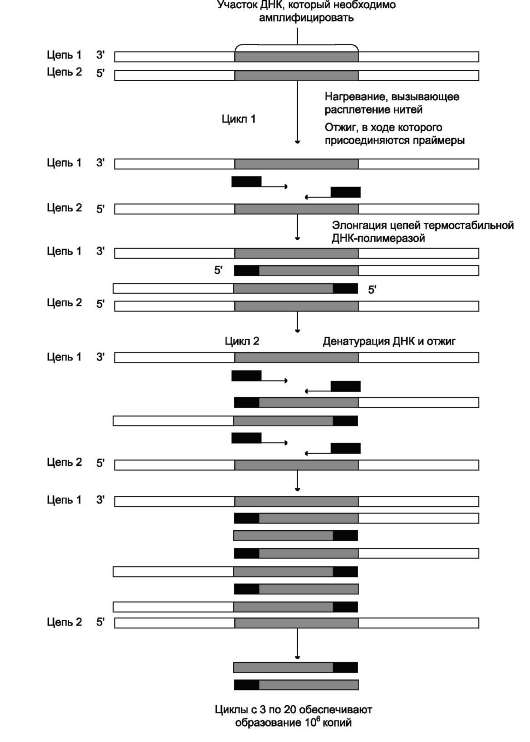
Рис. 4-67. Полимеразная цепная реакция.
предполагаются присутствие мутаций, полиморфизм сайтов, можно проводить ДНК-диагностику инфицированности пациентов вирусными, бактериальными и грибковыми возбудителями болезней.
Д. ДНК-ДИАГНОСТИКА ЗАБОЛЕВАНИЙ
Используя технику рекомбинантных ДНК, удаётся исследовать варианты генов, ответственных за развитие многих заболеваний. Этим способом идентифицированы точечные мутации, вызванные заменой одного азотистого основания, делециями или вставками, приводящими к появлению аллелей, кодирующих функционально неактивные белки. Дефектные «полиморфы» возникают как за счёт изменений в кодирующих участках гена, так и в результате мутаций в некодирующих областях, тесно примыкающих к генам и вызывающих нарушение их работы.
Разработанные
технологии позволяют вести целенаправленное картирование генов человека
в рамках международного проекта «Геном человека». Официально эта
научная программа с участием ведущих молекулярно-генетических
лабораторий США, стран Западной Европы, а также России и Японии
оформилась в
Остановимся на некоторых методах, широко используемых для идентификации моногенных болезней.
1. Полиморфизм длины рестрикционных фрагментов (ПДРФ)
Мутации, возникающие в участках узнавания определённых рестриктаз, делают эти участки ДНК нечувствительными к действию ферментов. Это может быть легко обнаружено по изменению длины рестрикционных фрагментов
ДНК. ПДРФ-анализ включает следующие этапы: выделение геномной ДНК, её рестрикцию специфической эндонуклеазой, электрофоре-тическое разделение образующихся фрагментов ДНК и идентификацию этих фрагментов путём блот-гибридизации по Саузерну. На электрофо-реграммах при отсутствии рестрикции в исследуемой ДНК выявляют один крупный фрагмент, соответствующий по длине последовательности ДНК между двумя соседними участками рестрикции для той же эндонуклеазы. При наличии рестрикции в полиморфном участке на электро-фореграмме будет присутствовать меньший по размерам фрагмент, равный расстоянию между полиморфным участком рестрикции и одним из ближайших постоянных участков рестрикции
(рис. 4-68).
ПДРФ-анализ может быть значительно упрощён в том случае, если возможна специфическая амплификация участка ДНК, содержащего полиморфный сайт рестрикции. Тестирование состояния этого локуса возможно путём проведения ПЦР и рестрикции амплифици-рованного фрагмента. При отсутствии сайта узнавания в исследуемой области ДНК размеры амплифицированного фрагмента не изменятся после его обработки рестриктазой. Если участок узнавания не изменён, обработка ферментом приведёт к образованию 2 маленьких фрагментов с той же суммарной длиной, что и исходный фрагмент.
При обследовании пациентов и членов их семей на носительство патологических генов широко используют этот метод, с помощью которого:
• идентифицируют делеции в гене дистрофи-на, на долю которых приходится около 60% всех мутаций, вызывающих миодистрофию Дюшенна;
• диагностируют гемофилию А, некоторые та-лассемии, ретинобластому и гранулематоз;
• контролируют здоровье детей в семьях, в которых родители являются гетерозигота-ми по гену серповидноклеточной анемии и другим дефектным генам.
2. Определение мутаций с помощью аллель-специфических проб
Многие мутации, вызывающие возникновение генных болезней, не попадают в участки, ответственные за узнавание ферментов рестрикции.
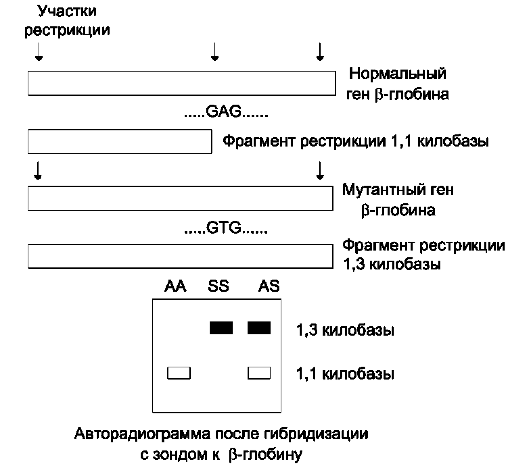
Рис. 4-68. Рестрикционный анализ ДНК гемоглобина человека, больного серповидноклеточной анемией (HbS). Миссенс-мутация, ответственная за возникновение серповидноклеточной анемии, связана с заменой в гене β-цепи глобина триплета GAG на GTG. При этом утрачивается участок рестрикции фермента Mstll, уз-нающего последовательность ССТNAGG, где N может быть любым основанием. При наличии мутации генный зонд гибридизуется с более крупным фрагментом ДНК размером 1,3 килобазы, имеющим при электрофорезе меньшую подвижность, чем продукт рестрикции нормального гена, длина которого равна 1,1 килобазы.
В этом случае, если последовательность оснований в области мутации известна, то её обнаруживают с помощью аллель-специфических оли-гонуклеотидов. Для этого синтезируют короткие олигонуклеотидные зонды, содержащие обычно около 19 нуклеотидов, комплементарные участку нормального и мутантного аллеля в ДНК. Область генома, содержащую исследуемый ген, амплифицируют с помощью ПЦР, и образцы полученной ДНК переносят на нитроцеллюлоз-ные фильтры (дотили слот-блоттинг). Пробы выдерживают с 32Р-зондами для выявления нормальной или мутантной последовательности. У гомозигот по исследуемой мутации ДНК будет гибридизоваться только с зондом, комплементарным мутантной последовательности. ДНК нормального гомозиготного индивидуума свяжется с зондом, соответствующим неизменённой нуклеотидной последовательности, тогда как с ДНК гетерозигот будут гибридизо-ваться оба зонда. На рисунке 4-69 представлены результаты генного зондирования 7 пациентов
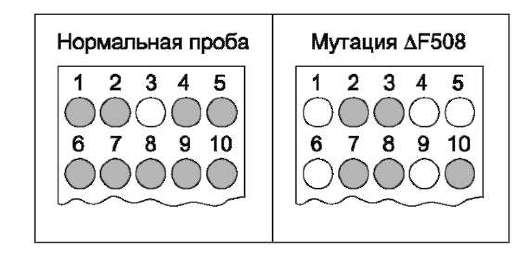
Рис. 4-69. Генное зондирование на носительство муковисцидоза. С помощью ПЦР амплифицируют геномную ДНК, и продукт переносят на 2 нейлоновых фильтра, один из которых гибридизуют с 32Р-зондом на нормальный аллель, а второй с 32Р-зондом на му-тантный аллель ΔF508. Образование гибридов обнаруживают радиоавтографически. Пробы 1-3 служили контролями: первая содержала продукты ПЦР ДНК от гомозигот по нормальному гену; вторая - от гетерозиготного носителя мутации ΔF508; третья - от больного муковисцидозом, гомозиготного по мутации AF508. Пробы 4-10 получены при обследовании 7 пациентов на носительство AF508: 4, 5, 6 и 9 оказались гомозиготами по нормальному гену, а 7, 8 и 10 - гетерозиготными носителями мутантного гена.
на носительство наиболее часто встречающейся делеции 3 нуклеотидов (ΔF508) в гене, ответственном за развитие муковисцидоза.
Олигонуклеотиды, аллель-специфичные по определённым мутациям, можно использовать в качестве праймеров в ПЦР при клиническом тестировании населения на наличие патологического гена. Если ДНК, полученная от пациента, амплифицирует с мутантным олигонук-леотидом, то следовательно пациент является носителем мутации. Если нуклеотидная последовательность в исследуемом гене не изменена, то олигонуклеотид, содержащий мутацию, не свяжется с ДНК-матрицей, и ПЦР не пойдёт.
Е. ИСПОЛЬЗОВАНИЕ ДНК-ТЕХНОЛОГИЙ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И ЛЕЧЕНИЯ РАЗЛИЧНЫХ БОЛЕЗНЕЙ
Вакцины - очищенные белки, антигенные детерминанты ряда возбудителей вирусных и бактериальных инфекций. В последнее время их получают, пользуясь техникой рекомбинан-тных ДНК. Первой вакциной, синтезированной этим способом, была вакцина против вируса гепатита В.
Белки, имеющие терапевтическое значение,
получают с использованием этой технологии во многих странах мира. Так, одним из первых синтезирован инсулин человека (рис. 4-70). В клетках E. coli, трансформированных плазми-дами, содержащими ДНК, которая кодировала А- и В-цепи инсулина, нарабатывают белковые продукты А- и В-цепей. После очистки их подвергают фолдингу и окислению, которое обеспечивает образование соответствующих дисульфидных мостиков.
Аналогичным способом получен гормон роста, используемый для лечения детей с недостаточностью этого гормона. Более сложные белки получены в культуре клеток млекопитающих. Так, дефекты в гене фактора VIII, кодирующего один из белков - участников свёртывающей системы крови, ответственны за возникновение гемофилии. До того как фактор VIII был получен методами генной инженерии, большое количество больных погибало от СПИДа или гепатита, которыми они заражались в результате введения выделенного из крови фактора VIII или переливания крови от доноров, являвшихся носителями этих болезней.
Тканевый активатор плазминогена (ТАП) -
протеаза, участвующая в процессе фибриноли-за и предотвращающая образование тромбов в кровеносном русле; получена с помощью ре-комбинантных ДНК. ТАП назначают больным с ишемической болезнью сердца для ускорения растворения тромбов, которые могут вызвать закупорку коронарных артерий и нарушить поступление кислорода в миокард.
Осуществлено получение рекомбинантных факторов роста, обеспечивающих восстановление гемостаза: эритропоэтина, интерлейкинов, колоний-стимулирующих факторов. Эти препараты используют в лечении больных анемией, после трансплантации костного мозга или химиотерапии, чтобы стимулировать образование клеток крови и снизить риск иммунодефицита. Разработаны методы получения белков человека с использованием трансгенных животных; эти белки получают в результате искусственного введения чужеродного гена в оплодотворённую яйцеклетку или в ранние зародыши млекопитающих (рис. 4-71). Генноинженерные мероприятия можно провести таким образом, чтобы интересующий нас белок человека секретиро-вался с белками молока.
Генная терапия - лечение наследственных, многофакторных и инфекционных заболеваний путём введения в соматические клетки пациентов генов, которые обеспечивают исправление генных дефектов или придают клеткам новые функции.
Первый клинический опыт применения генной терапии был осуществлён в
Для успешной генотерапии необходимо:
• обеспечить эффективную доставку чужеродного гена в клетки-мишени;
• создать условия для длительной экспрессии гена в этих клетках.
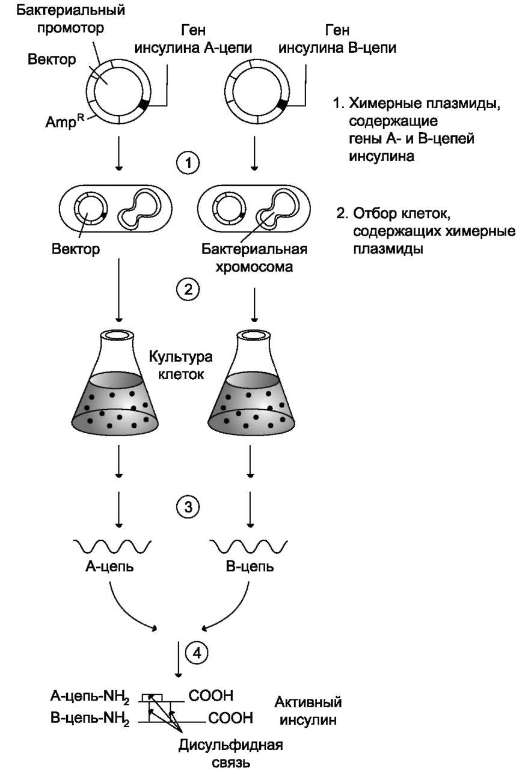
Рис. 4-70. Получение инсулина человека в клетках E. coli. 1 - трансформация клеток E. coli плазмидами, которые содержат гены, кодирующие структуру А- и В-цепей инсулина; 2 - синтез А- и В-цепей инсулина в процессе выращивания культуры трансформированных клеток E. coli; 3 - выделение и очистка А- и В-цепей инсулина; 4 - пространственная укладка А- и В-цепей инсулина и окисление остатков цистеина.
К настоящему времени разработаны химические, физические и биологические методы доставки чужеродного гена в клетки-мишени. Однако пока только вирусные векторы или генетические конструкции, включающие вирусные последовательности, способны к эф-
фективной доставке необходимого гена и его последующей длительной экспрессии. В результате из более чем 175 уже одобренных протоколов клинических испытаний по генотерапии более 120 основаны на применении ретрови-русных векторов.
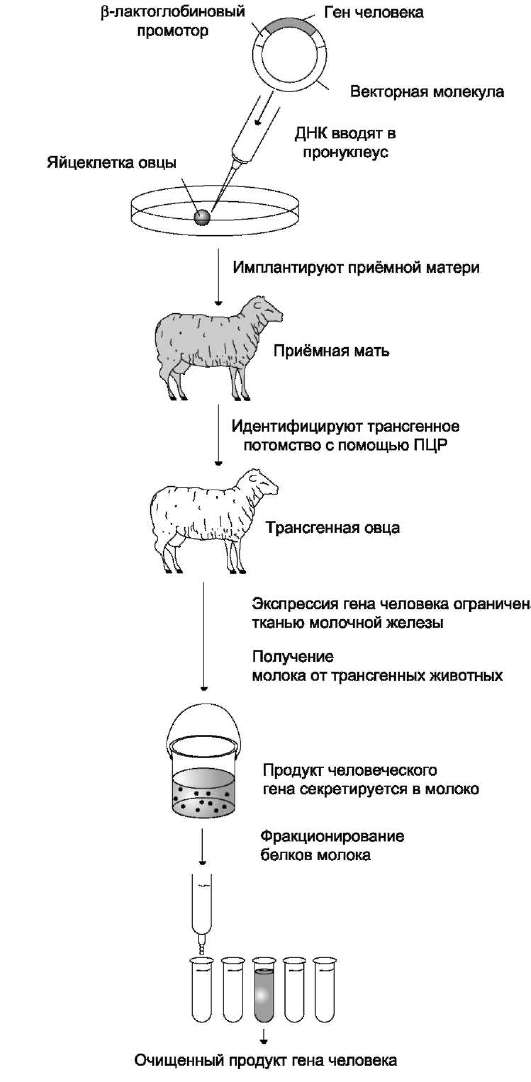
Рис. 4-71. Использование трансгенных животных для получения белков человека. Ген человека встраивают в вектор таким образом, чтобы он был под контролем β-лактоглобинового промотора, который активен только в клетках молочной железы. Присутствие у трансгенного потомства гена человека контролировали с помощью метода ПЦР, в которой использовали праймеры к гену человека. При фракционировании белков молока получают белковый продукт экспрессии гена человека.
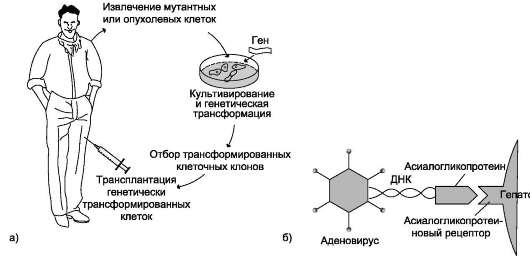
Рис. 4-72. Введение чужеродного гена ex vivo (а) и in vivo (б). А. Введение чужеродного «лечебного» гена в организм больного в составе клеток, содержащих этот ген. Б. Введение «лечебного» гена в составе конструкции, содержащей: ДНК, включающую этот ген; белок (например асиалогликопротеин), взаимодействующий с соответствующим рецептором на мембране клеток; вирусный вектор (аденовирус), обеспечивающий длительную экспрессию «лечебного» гена.
В геном пациента чужеродная ДНК может вводиться либо в культуре клеток (ex vivo), либо непосредственно в организм больного (in vivo). При осуществлении первого способа выделяют и культивируют специфический тип клеток пациента, вводят в него чужеродный ген, отбирают трансформированные клетки и реинфузируют их тому же больному (рис. 4-72).
Генная терапия in vivo основана на прямом введении в специализированные ткани больного клонированных и определённым образом упакованных последовательностей ДНК, поступающих с помощью рецепторов в определённые типы клеток. В этом способе гены вводят, как правило, в виде аэрозольных и инъецируемых форм. Наиболее часто аэрозольную генотерапию используют при лечении болезней лёгких (например, раке лёгких) и муковисцидоза.
Наряду с развитием исследований, касающихся лечения наследственных дефектов, геноте-рапию всё чаще используют для лечения нена-
следственных, главным образом, инфекционных и онкологических болезней (см. раздел 16).
Единственное и непременное ограничение таких работ состоит в том, чтобы все генотера-певтические мероприятия были направлены на конкретного больного и затрагивали только его соматические клетки.
Современный уровень знаний не позволяет проводить коррекцию генных дефектов на уровне половых клеток и клеток ранних доимплантаци-онных зародышей человека в связи с реальной опасностью засорения генофонда нежелательными генными конструкциями и внесения мутаций с непредсказуемыми результатами.
В целях предотвращения распространения дефектных генов в популяции людей и рождения детей с наследственными патологиями во многих странах мира работают генетические консультанты, а также проводят пренатальную диагностику, позволяющую оценить здоровье плода с использованием анализа ДНК на самых ранних стадиях развития.