Биохимия: учебник для вузов/ под ред. Е.С.Северина - 5-е изд., - 2009. - 768 с.
|
|
|
|
РАЗДЕЛ 5 БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
Все клетки имеют мембраны. Кроме того, почти во всех эукариотических клетках существуют органеллы, каждая из которых имеет свою мембрану. Мембраны ответственны за выполнение многих важнейших функций клетки. Согласованное функционирование мембранных систем - рецепторов, ферментов, транспортных механизмов помогает поддерживать гомеостаз клетки и в то же время быстро реагировать на изменения внешней среды.
К основным функциям мембран можно отнести:
• отделение клетки от окружающей среды и формирование внутриклеточных компарт-ментов (отсеков);
• контроль и регулирование транспорта огромного разнообразия веществ через мембраны;
• участие в обеспечении межклеточных взаимодействий, передаче внутрь клетки сигналов;
• преобразование энергии пищевых органических веществ в энергию химических связей молекул АТФ.
I. РОЛЬ МЕМБРАН В МЕТАБОЛИЗМЕ И ИХ РАЗНООБРАЗИЕ
Основные принципы структурной организации всех мембран одинаковы, однако одна из самых характерных особенностей - огромное их разнообразие. Мембраны органелл эукарио-тических клеток уникальны по своему составу и по характеру выполняемых функций.
Плазматическая мембрана
Плазматическая мембрана, окружающая каждую клетку, определяет её величину, обеспечивает транспорт малых и больших молекул из клетки и в клетку, поддерживает разницу концентраций ионов по обе стороны мембраны. Мембрана участвует в межклеточных контактах, воспринимает, усиливает и передаёт внутрь
клетки сигналы внешней среды. С мембраной связаны многие ферменты, катализирующие биохимические реакции.
Ядерная мембрана
Ядерная оболочка состоит из внешней и внутренней ядерных мембран. Ядерная оболочка имеет поры, через которые РНК проникают из ядра в цитоплазму, а регуляторные белки из цитоплазмы в ядро.
Внутренняя ядерная мембрана содержит специфические белки, имеющие участки связывания основных полипептидов ядерного матрикса - ламина А, ламина В и ламина С. Важная функция этих белков - дезинтеграция ядерной оболочки в процессе митоза.
Мембрана эндоплазматического ретикулума (ЭР)
Мембрана ЭР имеет многочисленные складки и изгибы. Она образует непрерывную поверхность, ограничивающую внутреннее пространство, называемое полостью ЭР. Шероховатый ЭР связан с рибосомами, на которых происходит синтез белков плазматической мембраны, ЭР, аппарата Гольджи, лизосом, а также секрети-руемых белков. Области ЭР, не содержащие рибосом, называют гладким ЭР. Здесь происходит завершающий этап биосинтеза холестерола, фосфолипидов, реакции окисления собственных метаболитов и чужеродных веществ с участием мембранных ферментов - цитохрома Р450, ци-тохром Р450 редуктазы, цитохром b5 редуктазы и цитохрома b5 (см. раздел 12).
Аппарат Гольджи
Аппарат Гольджи - важная мембранная органелла, отвечающая за модификацию, накопление, сортировку и направление различных веществ в соответствующие внутриклеточные компартменты, а также за пределы клетки. Специфические ферменты мембраны комплекса Гольджи, гликозилтрансферазы, гликозилируя белки по остаткам серина, треонина или амид-
ной группе аспарагина, завершают образование сложных белков - гликопротеинов.
Митохондриальные мембраны
Митохондрии - органеллы, окружённые двойной мембраной, специализирующиеся на синтезе АТФ путём окислительного фосфорилирования. Отличительная особенность внешней митохон-дриальной мембраны - содержание большого количества белка порина, образующего поры в мембране. Благодаря порину внешняя мембрана свободно проницаема для неорганических ионов, метаболитов и даже небольших молекул белков (меньше 10 кД). Для больших белков внешняя мембрана непроницаема, это позволяет митохондриям удерживать белки межмембранного пространства от утечки в цитозоль.
Для внутренней мембраны митохондрий характерно высокое содержание белков, около 70%, которые выполняют в основном каталитическую и транспортную функции. Транслоказы мембраны обеспечивают избирательный перенос веществ из межмембранного пространства в матрикс и в обратном направлении, ферменты участвуют в транспорте электронов (цепи переноса электронов) и синтезе АТФ. Подробно строение и функционирование ферментов цепи переноса электронов рассмотрено в разделе 6.
Мембрана лизосом
Мембрана лизосом играет роль «щита» между активными ферментами (более 50), обеспечивающими реакции распада белков, углеводов, жиров, нуклеиновых кислот, и остальным клеточным содержимым. Мембрана содержит
уникальные белки, например АТФ-зависимую протонную помпу (насос), которая поддерживает кислую среду (рН 5), необходимую для действия гидролитических ферментов (протеаз, липаз), а также транспортные белки, позволяющие продуктам расщепления макромолекул покидать лизосому. Большинство белков лизо-сомальной мембраны сильно гликозилированы, углеводные составляющие, находящиеся на внутренней поверхности мембраны, защищают их от действия протеаз.
А. СТРОЕНИЕ И СОСТАВ МЕМБРАН
Биологические мембраны представляют собой «ансамбли» липидных и белковых молекул, удерживаемых вместе с помощью нековалентных взаимодействий.
Основу мембраны составляет двойной липидный слой, в формировании которого участвуют фосфолипиды и гликолипиды. Липидный бислой образован двумя рядами липидов, гидрофобные радикалы которых спрятаны внутрь, а гидрофильные группы обращены наружу и контактируют с водной средой. Белковые молекулы как бы «растворены» в липидном бислое (рис.
5-1).
1. Структура и свойства липидов мембран
Мембранные липиды - амфифильные (амфи-патические) молекулы, т.е. в молекуле есть как гидрофильные группы (полярные «головки»), так и алифатические радикалы (гидрофобные «хвосты»), самопроизвольно формирующие бислой. В большинстве эукариотических клеток
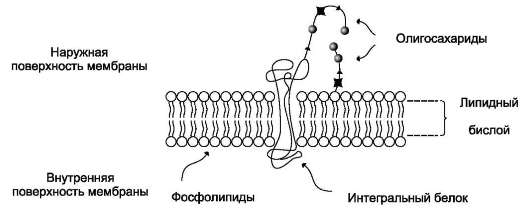
Рис. 5-1. Поперечный разрез плазматической мембраны.
они составляют около 30-70% массы мембраны (рис. 5-2). В мембранах присутствуют липиды трёх главных типов - фосфолипиды, гликоли-пиды и холестерол (холестерин).
Липидный состав мембран различен, содержание того или другого липида, по-видимому, определяется разнообразием функций, выполняемых этими липидами в мембранах.
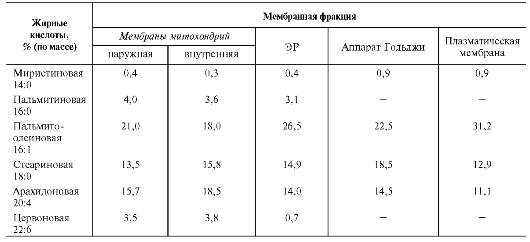
Фосфолипиды. Все фосфолипиды можно разделить на 2 группы - глицерофосфолипиды и сфингофосфолипиды. Глицерофосфолипиды относят к производным фосфатидной кислоты. Наиболее распространённые глицерофос-фолипиды мембран - фосфатидилхолины и фосфатидилэтаноламины (рис. 5-3). В мембранах эукариотических клеток обнаружено огромное количество разных фосфолипидов, причём они распределены неравномерно по разным клеточным мембранам. Эта неравномерность относится к распределению как полярных «головок» (табл. 5-1), так и ацильных остатков (табл. 5-2).
Каждый глицерофосфолипид, например фосфатидилхолин, представлен несколькими десятками фосфатидилхолинов, отличающихся друг от друга строением жирно-кислотных остатков.
На долю глицерофосфолипидов (полярная группа - инозитол) приходится лишь 2-8% всех фосфолипидов, содержащихся в клеточной мембране эукариотов. Инозитол в составе фосфа-тидилинозитолов может быть фосфорилирован по С4 (фосфатидилинозитол-4-монофосфат) или С4 и С5 (фосфатидилинозитол-4,5-бисфосфат). В состав фосфатидилинозитол-4,5-бисфосфатов входят в основном ацильные остатки стеариновой или пальмитиновой (по первому положению глицерола) и арахидоновой (по второму положению) жирных кислот.
Специфические фосфолипиды внутренней мембраны митохондрий - кардиолипины (дифосфатидилглицеролы), построенные на основе глицерола и двух остатков фосфатид-ной кислоты. Они синтезируются ферментами внутренней мембраны митохондрий и составляют около 22% от всех фосфолипидов мембраны.
В плазматических мембранах клеток в значительных количествах содержатся сфингомиели-ны (рис. 5-4). Сфингомиелины построены на основе церамида - ацилированного амино-спирта
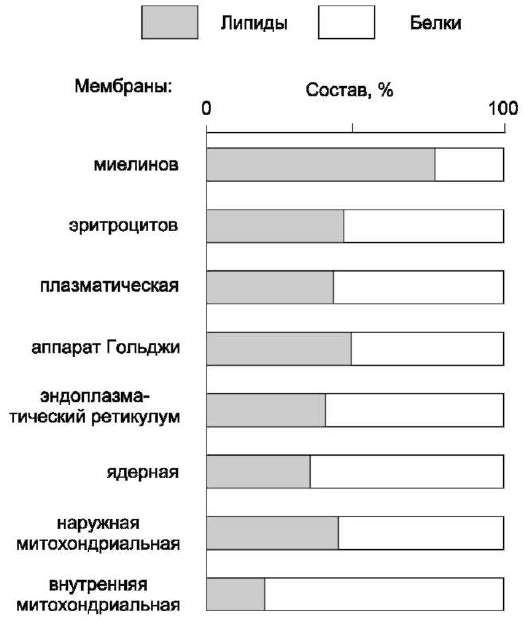
Рис. 5-2. Содержание липидов и белков в различных клеточных мембранах (%).
сфингозина. Полярная группа состоит из остатка фосфорной кислоты и холина, этаноламина или серина. Сфингомиелины - главные липиды миелиновой оболочки нервных волокон.
Гликолипиды. В гликолипидах гидрофобная часть представлена церамидом. Гидрофильная группа - углеводный остаток, присоединённый гликозидной связью к гидроксильной группе у первого углеродного атома церамида (рис. 5-5). В зависимости от длины и строения углеводной части различают цереброзиды, содержащие моно-или олигосахаридньгй остаток, и ганглиозиды, к ОН-группе которых присоединён сложный, разветвлённый олигосахарид, содержащий N-ацетилнейраминовую кислоту (NANA) (см. раздел 8).
Полярные «головки» гликосфинголипидов находятся на наружной поверхности плазматических мембран. В значительных количествах гликолипиды содержатся в мембранах клеток мозга, эритроцитов, эпителиальных клеток. Ганглиозиды эритроцитов разных индивидуумов различаются строением олигосахаридных цепей, проявляющих антигенные свойства.
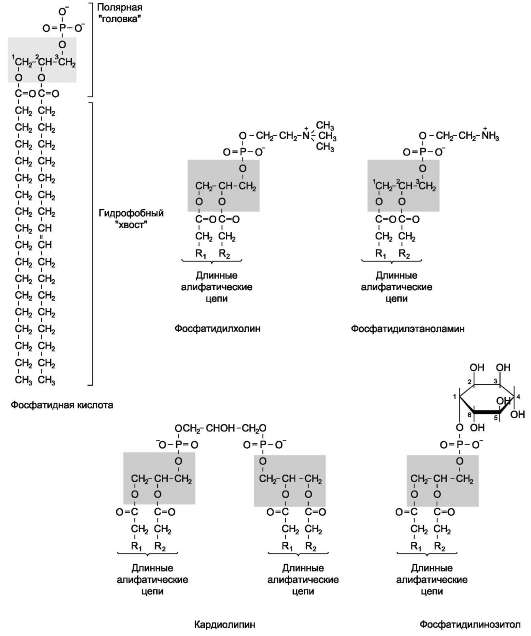
Рис. 5-3. Глицерофосфолипиды мембран.
Таблица 5-1. Фосфолипидный состав клеточных органелл и плазматической мембраны гепатоцитов
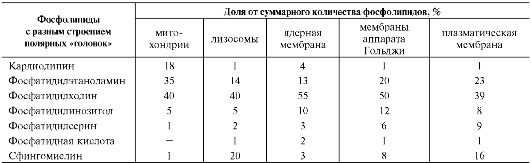
Таблица 5-2. Жирно-кислотный состав некоторых мембран печени
Холестерол. Холестерол присутствует во всех мембранах животных клеток. Его молекула состоит из жёсткого гидрофобного ядра и гибкой углеводородной цепи, единственная гидрок-сильная группа является «полярной головкой» (рис. 5-6).
Для животной клетки среднее молярное отношение холестерол/фосфолипиды равно 0,3-0,4, но в плазматической мембране это соотношение гораздо выше (0,8-0,9). Наличие холестерола в мембранах уменьшает подвижность жирных кислот, снижает латеральную диффузию ли-пидов и белков, и поэтому может влиять на функции мембранных белков.
В составе мембран растений холестерола нет, а присутствуют растительные стероиды - ситос-терол и стигмастерол.
2. Трансмембранная асимметрия липидов
Каждая мембрана клетки замкнута, т.е. имеет внутреннюю и внешнюю поверхности, различающиеся по липидному и белковому составам - эту особенность мембран называют трансмембранной (поперечной) асимметрией.
Липидная асимметрия возникает прежде всего потому, что липиды с более объёмными полярными «головками» стремятся находиться в наружном монослое, так как там площадь
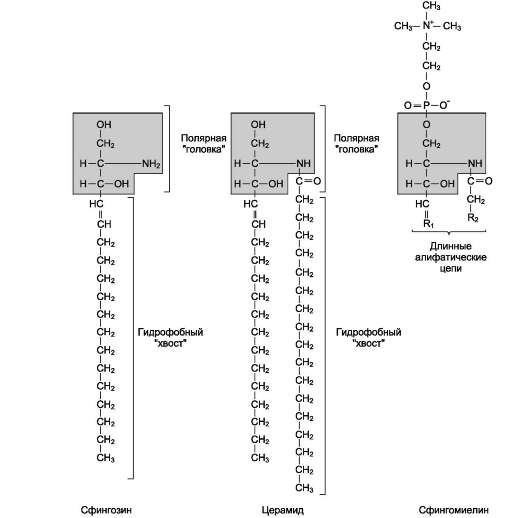
Рис. 5-4. Сфингофосфолипиды - производные церамида.
поверхности, приходящаяся на полярную «головку», больше. Фосфатидилхолины и сфин-гомиелины локализованы преимущественно в наружном монослое, а фосфатидилэтано-ламины и фосфатидилсерины в основном во внутреннем.
Липиды в некоторых биологических мембранах с довольно большой частотой мигрируют с одной стороны мембраны на другую, т.е. совер-
шают «флип-флоп» (от англ. flip-flop) перескоки (рис. 5-7). Перемещение липидных молекул затрудняют полярные «головки», поэтому липи-ды, находящиеся на внутренней стороне мембраны, имеют относительно высокую скорость трансмембранной миграции по сравнению с липидами наружной стороны мембраны, мигрирующих медленнее или вообще не совершающими «флип-флоп» перескоки.
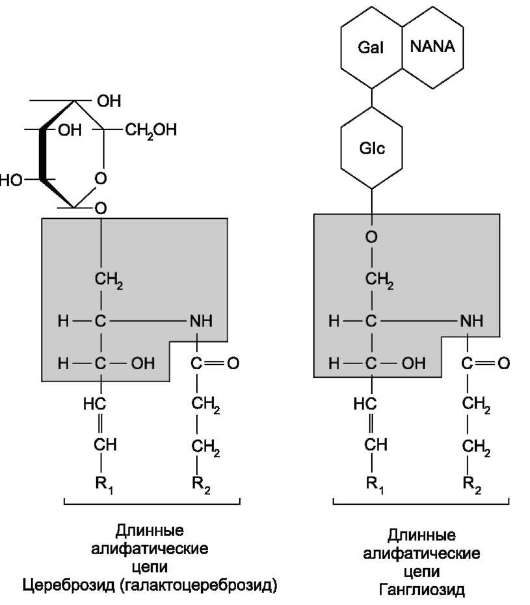
Рис. 5-5. Гликолипиды. Gal - галактоза; Gk - глюкоза; NANA (NeuAc) - N-ацетилнейраминовая или си-аловая кислота.
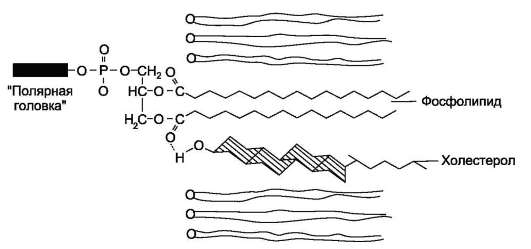
Рис. 5-6. Положение молекулы холестерола в мембране. Молекула холестерола располагается в липидном слое мембраны параллельно алифатическим цепям молекул фосфо- и гликолипидов. Гидроксильная группа холестерола контактирует с гидрофильными «головками» этих липидов.
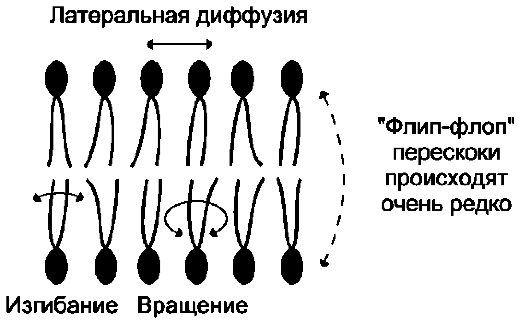
Рис. 5-7. Типы движений липидных молекул в бислое мембран.
3. Жидкостность мембран
Для мембран характерна жидкостность (текучесть), способность липидов и белков к латеральной диффузии. Скорость перемещения молекул зависит от микровязкости мембран, которая, в свою очередь, определяется относительным содержанием насыщенных и ненасыщенных жирных кислот в составе липидов. Микровязкость меньше, если в составе липидов преобладают ненасыщенные жирные кислоты, и больше при высоком содержании насыщенных жирных кислот.
Ацильные (алифатические) остатки ненасыщенных жирных кислот имеют так называемые «изломы» (см. раздел 8). Эти «изломы» препятствуют слишком плотной упаковке молекул в мембране и делают её более рыхлой, а следовательно и более «текучей». На текучесть мембран также влияют размеры углеводородных
«хвостов» липидов, с увеличением длины которых мембрана становится более «текучей».
4. Функции мембранных липидов
Фосфо- и гликолипиды мембран, помимо участия в формировании липидного бислоя, выполняют ряд других важных функций.
Липиды формируют среду для функционирования мембранных белков, принимающих в ней нативную конформацию. Выделенные из мембран ферменты, лишённые липидного окружения, как правило, не проявляют каталитической активности.
Некоторые мембранные липиды - предшественники вторичных посредников при передаче гормонального сигнала. Так, фосфати-дилинозитол-4,5-бисфосфат (ФИФ2) под действием фермента фосфолипазы С гидролизуется до диацилглицерола (ДАГ), активатора протеинки-назы С и инозитол-1,4,5-трифосфата (ИФ3) - регулятора кальциевого обмена в клетке (рис. 5-8). ДАГ, ИФ3, протеинкиназа С и Са2+ - участники инозитолфосфатной системы передачи сигнала.
Кроме того, некоторые липиды выполняют «якорную» функцию, например к фосфатидил-инозитолам через олигосахарид могут присоединяться специфические белки наружной поверхности клетки (рис. 5-9). Фосфатидилинозитол с присоединённым к нему олигосахаридом (глика-ном) называют фосфатидилинозитолгликаном.
Связь белков с этой молекулой (гликаном) осуществляется через фосфоэтаноламин. При-мер такого «заякоренного» белка - ацетилхо-
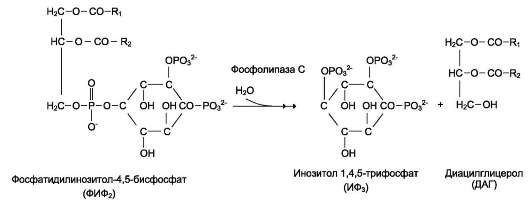
Рис. 5-8. Гидролиз фосфатидилинозитол-4,5-бисфосфата.
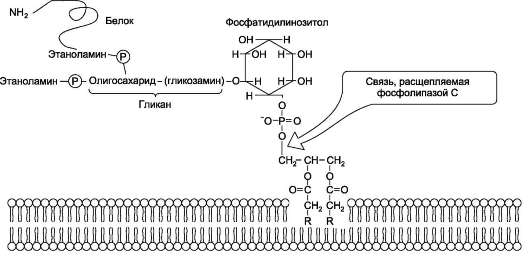
Рис. 5-9. «Якорная» функция фосфатидилинозитолгликанов.
линэстераза, катализирующая гидролиз ацетилхолина в синаптической щели. Этот фермент фиксируется на постсинаптической мембране, ковалентно присоединяясь к фосфатидилино-зитолгликану. Под действием фосфолипазы С может происходить отделение белков от внешней поверхности клетки.
Липиды могут быть аллостерическими активаторами мембранных ферментов. Например, β-гидроксибутиратдегидрогеназа, участвующая в окислении кетоновых тел (см. раздел 8), локализована на внутренней мембране митохондрий. Каталитическая активность фермента проявляется только в присутствии фосфатидилхолина.
Фермент протеинкиназа С катализирует реакции фосфорилирования белков по аминокислотным остаткам серина и треонина. В неактивной форме протеинкиназа С находится в цитозоле. Однако после стимуляции клетки (повышение в клетке концентрации кальция) фермент быстро активируется ионами кальция и оказывается связанным с мембраной. Функционально активная протеинкиназа С - комплекс, содержащий мономер фермента, молекулу диацилглицерола, один или более ионов Са2+ и четыре молекулы фосфатидилсерина.
Креатинкиназа, фермент катализирующий образование макроэргического соединения
креатинфосфата (см. раздел 9). Для проявления его активности требуется специфическое взаимодействие с кардиолипином внутренней мембраны митохондрий.
ii. белки мембран
Если основная роль липидов в составе мембран заключается в стабилизации бислоя, то белки отвечают за функциональную активность мембран. Одни из них обеспечивают транспорт определённых молекул и ионов, другие являются ферментами, третьи участвуют в связывании цитоскелета с внеклеточным матриксом или служат рецепторами для гормонов, медиаторов, эйкозаноидов, липопротеинов, оксида азота (NО). На долю белков приходится от 30 до 70% массы мембран. Белки определяют особенности функционирования каждой мембраны.
ОСОБЕННОСТИ СТРОЕНИЯ И ЛОКАЛИЗАЦИИ БЕЛКОВ В МЕМБРАНАХ
Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно
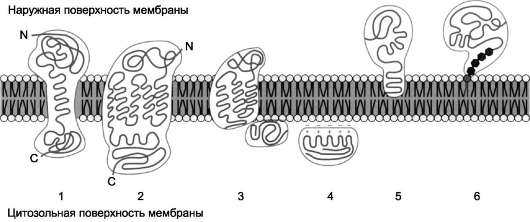
Рис. 5-10. Расположение (локализация) белков в мембранах. Трансмембранные белки, например: 1 - гли-кофорин А; 2 - рецептор адреналина. Поверхностные белки: 3 - белки, связанные с интегральными белками, например, фермент сукцинатдегидрогеназа; 4 - белки, присоединённые к полярным «головкам» липидного слоя, например, протеинкиназа С; 5 - белки, «заякоренные» в мембране с помощью короткого гидрофобного концевого домена, например, цитохром b5; 6 - «заякоренные» белки, ковалентно соединённые с липидом мембраны (например, фермент щелочная фосфатаза).
неполярные аминокислоты. Участки белка, находящиеся в области полярных «головок», обогащены гидрофильными аминокислотными остатками.
Белки мембран различаются по своему положению в мембране (рис. 5-10). Они могут глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки, либо разными способами прикрепляться к мембране - поверхностные белки.
Поверхностные белки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками ли-пидного слоя.
Белки, образующие комплексы с интегральными белками мембраны
Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника.
Примерами таких комплексов могут быть сахараза-изомальтаза и мальтаза-гликоамилаза (см. раздел 7). Возможно, связь этих пищева-
рительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран
Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными «головками» липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка - необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного «якоря»
«Якорем» может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов (см. раздел 12).
Роль мембранного «якоря» может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой - С14 или пальмитиновой - С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэ-фирную связь с цистеином или сложноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот «якорь» - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофо-рин), другие имеют несколько участков (доменов), последовательно пересекающих бислой (рис. 5-11).
Трансмембранные домены, пронизьгвающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют «вывернутыми» по сравнению с растворимыми в воде белками, в которых большинство гидро-
фобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности (рис. 5-12).
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2).
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гли-козилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина (рис. 5-13).
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности.
Например, фермент фосфолипаза А2, связываясь с цитоплазматической поверхностью мембраны, может латерально перемещаться по поверхности бислоя и гидролизовать несколько тысяч фосфолипидов в минуту до тех пор, пока не отделится от мембраны.
Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими
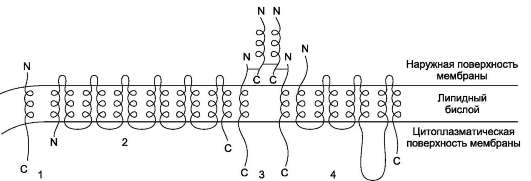
Рис. 5-11. Интегральные белки мембран, содержащие от 1 до 12 трансмембранных доменов. 1 - рецептор ЛПНП; 2 - ГЛЮТ-1 - транспортёр глюкозы; 3 - рецептор инсулина; 4 - адренорецептор.
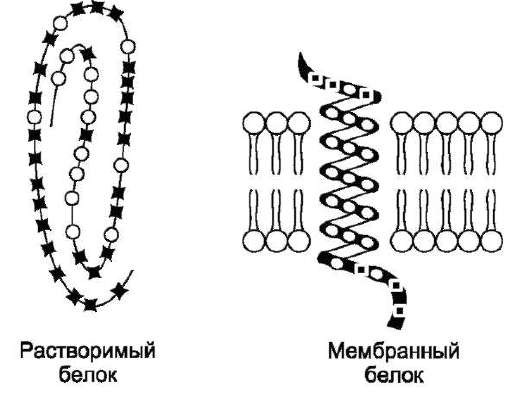
Рис. 5-12. Локализация неполярных (незакрашенные кружки) и полярных (закрашенные квадраты) аминокислот в растворимых и мембранных белках.
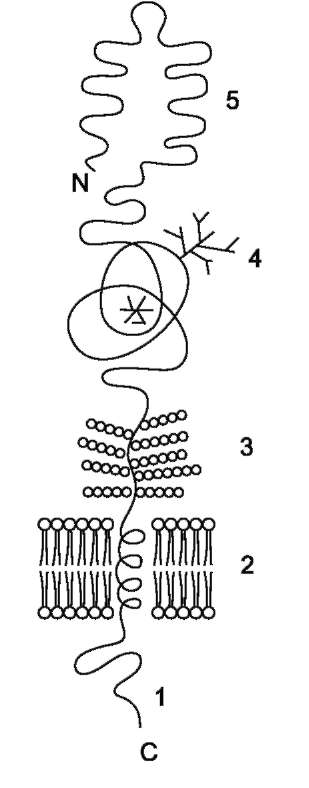
Рис. 5-13. Строение рецептора липопротеина низкой плотности (ЛПНП). 1 - внутриклеточный домен; 2 - трансмембранный домен; 3 - олигоса-харидные остатки, присоединённые к ОН-группам серина или треонина; 4 - олигосахаридные остатки, присоединённые через амидную группу аспарагина; 5 - ЛПНП-связывающий домен.
мембранными белками, элементами цитоскелета или внеклеточного матрикса.
Белки мембран не совершают перемещений с одной стороны мембраны на другую («флип-флоп» перескоки), подобно фосфолипидам.
iii. перенос веществ через мембраны
Любая молекула может пройти через липидный бислой, однако скорость пассивной диффузии веществ, т.е. перехода вещества из области с большей концентрацией в область с меньшей, может сильно отличаться. Для некоторых молекул это занимает столь длительное время, что можно говорить об их практической непроницаемости для липидного бислоя мембраны. Скорость диффузии веществ через мембрану зависит главным образом от размера молекул и их относительной растворимости в жирах.
Легче всего проходят простой диффузией через липидную мембрану малые неполярные молекулы, такие как О2, стероиды, тиреоидные гормоны, а также жирные кислоты. Малые полярные незаряженные молекулы - СО2, NН3, Н2О, этанол, мочевина - также диффундируют с достаточно большой скоростью. Диффузия глицерола идёт значительно медленнее, а глюкоза практически не способна самостоятельно пройти через мембрану. Для всех заряженных молекул, независимо от размера, липидная мембрана непроницаема.
Транспорт таких молекул возможен благодаря наличию в мембранах либо белков, формирующих в липидном слое каналы (поры), заполненные водой, через которые могут проходить вещества определённого размера простой диффузией, либо специфических белков-переносчиков, которые избирательно взаимодействуя с определёнными лигандами, облегчают их перенос через мембрану (облегчённая диффузия).
Кроме пассивного транспорта веществ, в клетках есть белки, активно перекачивающие определённые растворённые в воде вещества против их градиента, т.е. из меньшей концентрации в область большей. Этот процесс, называемый активным транспортом, осуществляется всегда с помощью белков-переносчиков и происходит с затратой энергии.
А. СТРОЕНИЕ И ФУНКЦИОНИРОВАНИЕ БЕЛКОВЫХ КАНАЛОВ
Каналы в мембране формируются интегральными белками, которые «прерывают» липидный бислой, образуя пору, заполненную водой. Стенки канала «выстилаются» радикалами аминокислот этих белков.
Если каналы различают вещества только по размеру и пропускают все молекулы меньше определённой величины, по градиенту концентрации, т.е. служат фильтрами, то их называют «неселективные каналы», или «поры». Такие поры есть в наружной мембране митохондрий, где молекулы белка-порина образуют широкие гидрофильные каналы. Через них могут проходить все молекулы с молекулярной массой 10 кД и меньше, в том числе и небольшие белки.
Селективные каналы, как правило, участвуют в переносе определённых ионов. Ионная селективность (избирательность) каналов определяется их диаметром и строением внутренней поверхности канала. Например, катионселек-тивные каналы пропускают только катионы, так как содержат много отрицательно заряженных аминокислотных остатков.
Открытие или закрытие селективных каналов регулируется либо изменением концентрации специфических регуляторов, таких как медиаторы, гормоны, циклические нуклеотиды, NО, G-белки, либо изменением трансмембранного электрохимического потенциала (рис. 5-14). Воздействие регуляторного фактора вызывает конформационные изменения каналообразую-щих белков, канал открывается и ионы проходят по градиенту концентрации. Транспорт веществ через каналы не приводит к конформационным изменениям белков и зависит только от разности
концентраций веществ по обе стороны мембраны. Поэтому скорость транспорта веществ через такие каналы может достигать 106-108 ионов в секунду.
Б. ОБЛЕГЧЁННАЯ ДИФФУЗИЯ ВЕЩЕСТВ
В мембранах клеток существуют белки-транс-локазы. Взаимодействуя со специфическим лигандом, они обеспечивают его диффузию (транспорт из области большей концентрации в область меньшей) через мембрану. В отличие от белковых каналов, транслоказы в процессе взаимодействия с лигандом и переноса его через мембрану претерпевают конформационные изменения. Кинетически перенос веществ облегчённой диффузией напоминает ферментативную реакцию. Для транслоказ существует насыщающая концентрация лиганда, при которой все центры связывания белка с лигандом заняты, и белки работают с максимальной скоростью Vmax. Поэтому скорость транспорта веществ облегчённой диффузией зависит не только от градиента концентраций переносимого лиганда, но и от количества белков-переносчиков в мембране.
Существуют транслоказы, переносящие только одно растворимое в воде вещество с одной стороны мембраны на другую. Такой простой транспорт называют «пассивный унипорт». Примером унипорта может служить функционирование ГЛЮТ-1 - транслоказы, переносящей глюкозу через мембрану эритроцита (рис. 5-15).
Некоторые транслоказы могут переносить два разных вещества по градиенту концентраций в одном направлении - пассивный симпорт, или в противоположных направлениях - пассивный антипорт (рис. 5-16).
Примером транслоказы, работающей по механизму пассивного антипорта, может служить
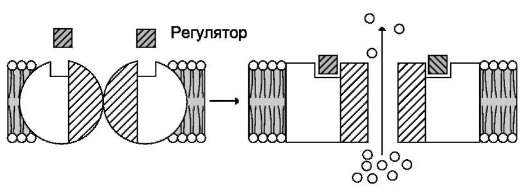
Рис. 5-14. Регулируемый канал. Заштрихованные квадраты - регуляторы, светлые кружки - переносимые
ионы.
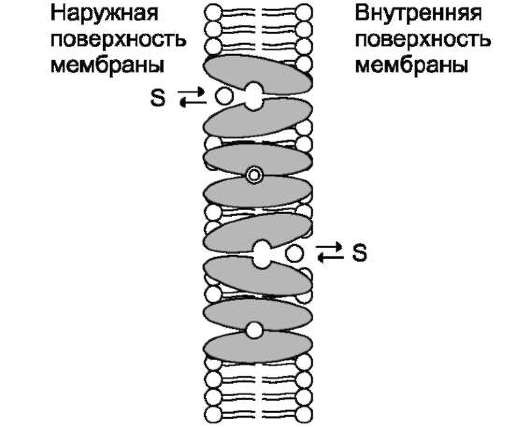
Рис. 5-15. Облегчённая диффузия (унипорт) глюкозы в эритроциты с помощью ГЛЮТ-1 (S - молекула глюкозы). Молекула глюкозы связывается переносчиком на наружной поверхности плазматической мембраны. Происходит конформационное изменение, и центр переносчика, занятый глюкозой, оказывается открытым внутрь клетки. Вследствие конформацион-ных изменений переносчик теряет сродство к глюкозе, и молекула высвобождается в цитозоль клетки. Отделение глюкозы от переносчика вызывает конформаци-онные изменения белка, и он возвращается к исходной конформации.
анионный переносчик мембраны эритроцитов (рис. 5-17).
Внутренняя митохондриальная мембрана содержит много транслоказ, осуществляющих пассивный антипорт (рис. 5-18). В процессе
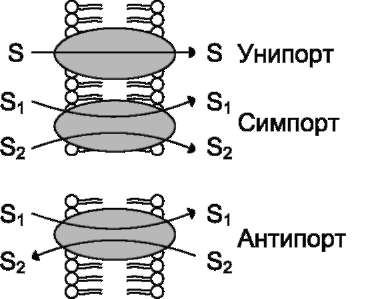
Рис. 5-16. Типы (виды) облегчённой диффузии с участием переносчиков (транслоказ). S1 S2 - разные молекулы.
такого переноса происходит эквивалентный обмен ионами, но не всегда эквивалентный обмен по заряду.
В. СТРОЕНИЕ И ФУНКЦИОНИРОВАНИЕ БЕЛКОВ-ПЕРЕНОСЧИКОВ, ОСУЩЕСТВЛЯЮЩИХ АКТИВНЫЙ ТРАНСПОРТ
Перенос некоторых лигандов (ионов, глюкозы, аминокислот) через мембраны происходит против градиента концентрации и сопряжён с затратой энергии (активный транспорт). Перенос лигандов через мембрану, связанный с затратой энергии АТФ, называют «первично-активный транспорт».
1. Первично-активный транспорт
Перенос некоторых неорганических ионов идёт против градиента концентрации при учас-
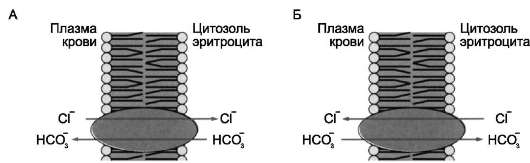
Рис. 5-17. Пассивный антипорт анионов НСО3- и С1- через мембрану эритроцитов. А - когда эритроцит находится в венозных капиллярах, анион НСО3-, образованный при диссоциации угольной кислоты, по градиенту концентрации выходит в кровь. В обмен на каждый транспортируемый из клетки ион НСО3- транслоказа переносит в эритроцит ион С1- ; Б - когда кровь достигает лёгких транслоказа производит обмен ионами в противоположных направлениях. Такая «челночная» система работает очень быстро и обеспечивает удаление СО2 из организма и в то же время сохранение оптимального значения рН в клетке.
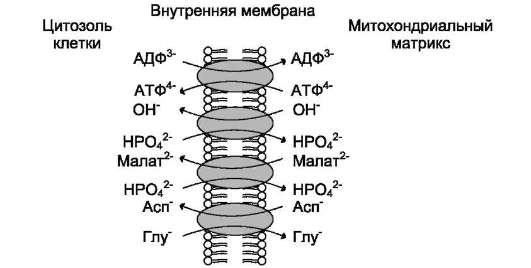
Рис. 5-18. Некоторые митохондриальные переносчики.
тии транспортных АТФ-аз (ионных насосов). Все ионные насосы одновременно служат ферментами, способными к аутофосфорилированию и аутодефосфорилированию. АТФ-азы различаются по ионной специфичности, количеству переносимых ионов, направлению транспорта. В результате функционирования АТФ-азы переносимые ионы накапливаются с одной стороны мембраны. Наиболее распространены в плазматической мембране клеток человека Na+,К+-АТФ-аза, Са2+-АТФ-аза и Н+,К+,-АТФ-аза слизистой оболочки желудка.
Na+, К+-АТФ-аза
Этот фермент-переносчик катализирует АТФ-зависимый транспорт ионов Na+ и К+ через плазматическую мембрану. Na+,К+-АТФ-аза состоит из субъединиц α и β; α - каталитическая большая субъединица, а β - малая субъединица (гликопротеин). Активная форма транслока-зы - тетрамер (αβ)2 (рис. 5-19).
Nа+,К+-АТФ-аза отвечает за поддержание высокой концентрации К+ в клетке и низкой концентрации Na+. Так как Na+,К+-АТФ-аза выкачивает три положительно заряженных иона, а закачивает два, то на мембране возникает электрический потенциал с отрицательным значением на внутренней части клетки по отношению к её наружной поверхности.
Са2+-АТФ-аза
В цитозоле «покоящихся» клеток концентрация Са2+ составляет ~10-7 моль/л, тогда как вне клетки она равна ~2?10-3 моль/л. Поддерживает
такую разницу в концентрации система активного транспорта ионов кальция; её основные компоненты - кальциевые насосы - Са2+-АТФ-азы и Nа+,Са2+ -обменники.
Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфори-лирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмоду-лином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами.
Работа Са2+-АТФ-азы цитоплазматичес-кой мембраны по стадиям представлена на рис. 5-20.
Нарушение активности Са2+-АТФ-азы при па-тологии. Одна из причин нарушения работы Са2+-АТФ-азы - активация перекисного окисления липидов (ПОЛ) мембран. Окислению подвергаются как ацильные остатки жирных кислот в составе фосфолипидов, так и SH-груп-пы в активном центре фермента. Нарушение структуры липидного окружения и структуры активного центра приводит к изменению кон-формации АТФ-азы, потере сродства к ионам кальция и способности к аутофосфорилиро-ванию. АТФ-аза перестаёт выкачивать ионы кальция из цитозоля клетки, повышается кон-
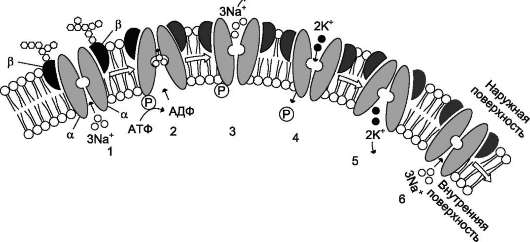
Рис. 5-19. Строение и функционирование Na+,К+-АТФ-азы плазматической мембраны. 1 - три иона натрия связываются специфическим центром транслоказы; 2 - изменение конформации транслоказы, вызванное присоединением 3Na+, приводит к активации каталитической субъединицы и увеличению сродства активного центра к субстрату (АТФ). Протекает реакция аутофосфорилирования по карбоксильной группе аспарагиновой кислоты; 3 - аутофосфорилирование изменяет заряд и конформацию транслоказы, она закрывается с внутренней стороны мембраны и открывается с наружной, уменьшается сродство к ионам натрия и они диссоциируют от переносчика; 4 - Na+, К+-АТФ-аза открытая с наружной стороны мембраны имеет специфический центр связывания для 2К+; Присоединение двух ионов калия к фосфорилированной транслоказе вызывает изменение конформации и появление аутофосфатазной активности. Протекает реакция аутодефосфорилирования; 5 - де-фосфорилирование изменяет заряд и конформацию транслоказы, она закрывается с наружной стороны мембраны и открывается с внутренней, уменьшается сродство к ионам калия и они диссоциируют от Na+, К+-АТФ-азы; 6 - АТФ-аза возвращается в первоначальное состояние.
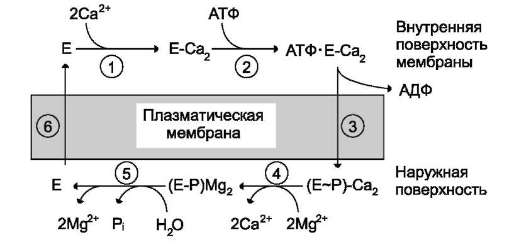
Рис. 5-20. Последовательность событий в процессе работы Са2+-АТФ-азы. 1 - связывание двух ионов кальция участком АТФ-азы, обращенной в цитозоль; 2 - изменение заряда и конформации фермента (АТФ-азы), вызванное присоединением двух ионов Са2+, приводит к повышению сродства к АТФ и активации аутофосфо-рилирования; 3 - аутофосфорилирование сопровождается конформационными изменениями, АТФ-аза закрывается с внутренней стороны мембраны и открывается с наружной; 4 - происходит снижение сродства центров связывания к ионам кальция и они отделяются от АТФ-азы; 5 - аутодефосфорилирование активируется ионами магния, в результате Са2+-АТФ-аза теряет фосфорный остаток и два иона Mg2+; 6 - АТФ-аза возвращается в исходное состояние.
центрация внутриклеточного кальция, Са2+ усиливает мышечное сокращение, возрастает тонус мышечной стенки, что приводит к повышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий.
2. Вторично-активный транспорт
Перенос некоторых растворимых веществ против градиента концентрации зависит от одновременного или последовательного переноса другого вещества по градиенту концентрации в том же направлении (активный симпорт) или в противоположном (активный антипорт). В клетках человека ионом, перенос которого происходит по градиенту концентрации, чаще всего служит Na+.
Примером такого типа транспорта может служить Nа+,Са2+-обменник плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+ против градиента концентрации выходят из клетки (рис. 5-21).
По механизму активного симпорта происходят всасывание глюкозы клетками кишечника и реабсорбция из первичной мочи глюкозы, аминокислот клетками почек (рис. 5-22).
Г. ПЕРЕНОС ЧЕРЕЗ МЕМБРАНУ МАКРОМОЛЕКУЛ И ЧАСТИЦ: ЭНДОЦИТОЗ И ЭКЗОЦИТОЗ
Траспортные белки обеспечивают перемещение через клеточную мембрану полярных молекул небольшого размера, но они не могут
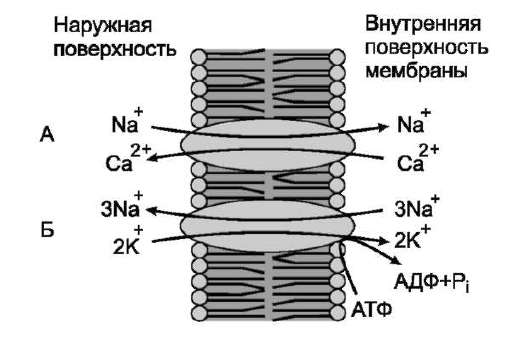
Рис. 5-21. Натрий-зависимый транспорт ионов кальция. А - Nа+-зависимый переносчик ионов кальция; Б - Na+, К+-АТФ-аза.
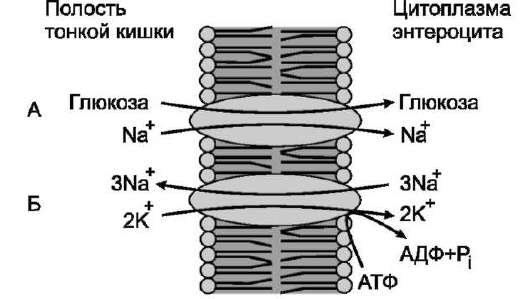
Рис. 5-22. Механизм активного симпорта. А - Na+
и глюкоза связываются в разных центрах трансло-казы. Ионы стремятся войти в клетку по градиенту концентрации и «тащат» глюкозу за собой, если концентрация Na+ вне клетки уменьшается, транспорт глюкозы в клетки снижается; Б - ионы натрия, проникающие в клетку вместе с глюкозой, «выкачиваются» обратно Na+,К+-АТФ-азой, поддерживающей градиент концентрации Na+ и контролирующей транспорт глюкозы.
транспортировать макромолекулы, например белки, нуклеиновые кислоты, полисахариды или ещё более крупные частицы. Механизмы, с помощью которых клетки могут усваивать такие вещества или удалять их из клетки, отличаются от механизмов транспорта ионов и полярных соединений.
Эндоцитоз
Перенос вещества из среды в клетку вместе с частью плазматической мембраны называют «эн-доцитоз». Путём эндоцитоза (фагоцитоза) клетки могут поглощать большие частицы, такие как вирусы, бактерии или обломки клеток. Захват больших частиц осуществляется в основном специализированными клетками - фагоцитами.
Поглощение жидкости и растворённых в ней веществ с помощью небольших пузырьков называют «пиноцитоз». Усвоение веществ механизмом эндоцитоза (пиноцитоза) характерно для всех клеток.
Цикл эндоцитоза начинается в определённых участках плазматической мембраны, называемых «окаймлённые ямки» (рис. 5-23). На долю окаймлённых ямок приходится всего 1-2% общей площади мембраны. Белок клатрин образует решётчатые структуры, связанные с углублениями на поверхности плазматической мембраны.
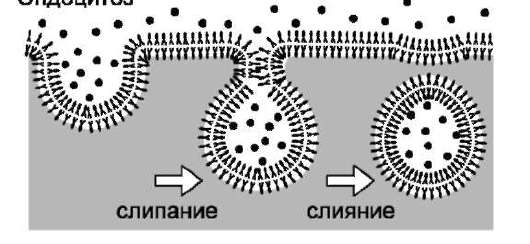
Рис. 5-23. Последовательность событий при образовании окаймлённого пузырька из окаймлённой ямки.
Окаймлённые ямки втягиваются в клетку, сужаются у основания, отделяются от мембраны, образуя окаймлённые пузырьки (пиноцитозные пузырьки). Время жизни окаймлённых ямок невелико, они формируются в течение минуты, затем совершают цикл эндоцитоза.
Вещества в составе пиноцитозных пузырьков не смешиваются с другими макромолекулами клетки. Они заканчивают свой путь в лизосомах, а мембранные компоненты пузырьков, содержащие клатрин, возвращаются в плазматическую мембрану.
Эндоцитоз, происходящий с участием рецепторов, встроенных в окаймлённые ямки, позволяет клеткам поглощать специфические вещества. Макромолекулы или частицы связываются рецепторами и накапливаются в окаймлённой ямке. Затем следует погружение
в клетку и отделение эндоцитозного пузырька, в составе которого находится поглощённое вещество, мембранные компоненты окаймлённой ямки и рецептор. В разные окаймлённые ямки могут быть встроены разные рецепторы.
Примером рецептор-зависимого эндоцитоза может служить поступление в клетку холестеро-ла в составе липопротеинов низкой плотности
(ЛПНП) (рис. 5-24).
Количество рецепторов в окаймлённой ямке плазматической мембраны варьирует в зависимости от потребности клетки в холестероле. Нарушение структуры рецепторов ЛПНП (мутации в гене) не позволяет им встраиваться в плазматическую мембрану в область окаймлённой ямки. Положение рецептора вне окаймлённой ямки не снижает его комплементарность к ЛПНП, но эндоцитоз комплекса рецептор-ЛПНП не происходит.
Экзоцитоз
Макромолекулы, например белки плазмы крови, пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы, синтезируются в клетках и затем секретируются в межклеточное пространство или кровь. Но мембрана непроницаема для таких макромолекул или комплексов, их секреция происходит путём экзоцитоза. Особенность экзоцитоза в том,
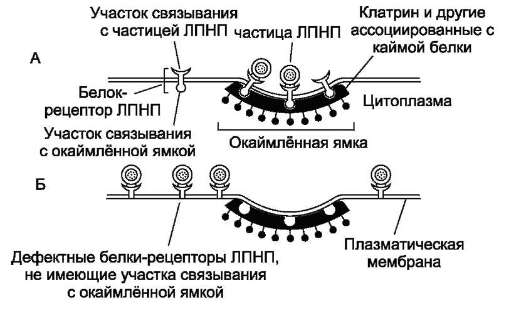
Рис. 5-24. Положение рецепторов ЛПНП в цитоплазматической мембране. А - положение рецепторов ЛПНП в окаймлённой ямке; Б - положение дефектных рецепторов ЛПНП вне окаймлённой ямки.
что секретируемые вещества локализуются в пузырьках и не смешиваются с другими макромолекулами или органеллами клетки. В ходе экзоцитоза содержимое секреторных пузырьков выделяется во внеклеточное пространство, когда они сливаются с плазматической мембраной.
В организме имеются как регулируемый, так и нерегулируемый пути экзоцитоза. Нерегулируемая секреция характеризуется непрерывным синтезом секретируемых белков, упаковкой их в транспортные пузырьки в аппарате Гольджи и переносом к плазматической мембране для секреции. Примером может служить синтез и секреция коллагена фибробластами для формирования межклеточного матрикса.
Для регулируемой секреции характерны хранение приготовленных на экспорт молекул в транспортных пузырьках и их слияние с плазматической мембраной только при воздействии на клетку специфического стимула. С помощью регулируемой секреции происходят выделение пищеварительных ферментов в период переваривания пищи, а также секреция гормонов, ней-ромедиаторов и других биологически активных веществ. Пример такого типа секреции - выброс пептидного гормона инсулина в кровь после еды. Стимулом к секреции инсулина, хранящегося в секреторных гранулах β-клеток островков Лангерханса поджелудочной железы, является повышение концентрации глюкозы в крови и β-клетках (рис.5-25).
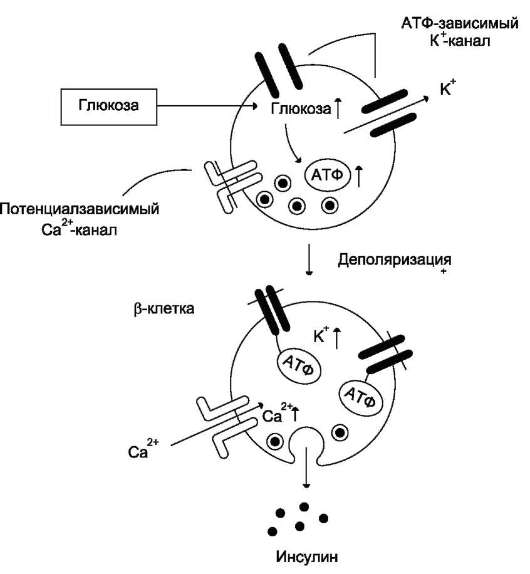
Рис. 5-25. Регуляция секреции инсулина. Повышение концентрации глюкозы приводит к увеличению соотношения АТФ/АДФ в β-клетке, закрытию АТФ-зависимых калиевых каналов, деполяризации, раскрытию потен-циалзависимых кальциевых каналов. Повышение концентрации ионов калия и кальция в β-клетке инициирует слияние секреторных пузырьков (инсулинсодержащих гранул) с мембраной и выделение содержимого пузырьков (инсулина) из клетки.
iv. участие мембран в межклеточных взаимодействиях
В плазматической мембране эукариотических клеток содержится множество специализированных рецепторов, которые, взаимодействуя с лигандами, вызывают специфические клеточные ответы. Одни рецепторы связывают сигнальные молекулы - гормоны, нейроме-диаторы, другие - питательные вещества и метаболиты, третьи - участвуют в клеточной адгезии. Этот класс включает рецепторы, необходимые для узнавания клетками друг друга и для их адгезии, а также рецепторы, ответственные за связывание клеток с белками внеклеточного матрикса, такими как фибронектин или коллаген.
Способность клеток к специфическому взаимному узнаванию и адгезии важна для эмбрионального развития. У взрослого человека адгезивные взаимодействия «клетка-клетка» и «клетка-матрикс» продолжают оставаться существенными для поддержания стабильности тканей. В многочисленном семействе рецепторов клеточной адгезии наиболее изучены интегрины, селектины и кадгерины.
Интегрины - обширное суперсемейство гомологичных рецепторов клеточной поверхности для молекул межклеточного матрикса, таких как коллаген, фибронектин, ламинин и др. Являясь трансмембранными белками, они взаимодействуют как с внеклеточными молекулами, так и с внутриклеточными белками цитос-келета. Благодаря этому интегрины участвуют в передаче информации из внеклеточной среды в клетку, определяя таким образом направление её дифференцировки, форму, митотическую активность, способность к миграции. Передача информации может идти и в обратном направлении - от внутриклеточных белков через рецептор во внеклеточный матрикс.
Идентифицировано примерно 20 разных членов семейства рецепторов в разных типах клеток.
• Примеры некоторых интегринов: рецепторы для белков внеклеточного мат-рикса. Они связываются с гликопротеиновы-ми компонентами внеклеточного матрикса, в частности с фибронектином, ламинином и витронектином (см. раздел 15);
• интегрины тромбоцитов (IIb и IIIa) участвуют в агрегации тромбоцитов, происходящей при свёртывании крови;
• лейкоцитарные белки адгезии. Для того чтобы мигрировать к месту инфекции и воспаления, лейкоциты должны вступить во взаимодействие с эндотелиальными клетками сосудов. Это взаимодействие может опосредовать связывание Т-лимфоцитов с фибробластами при воспалении.
Интегрины - гетеродимеры, а каждая субъединица (α, β) содержит один трансмембранный домен (рис. 5-26).
Индивидуальные интегрины строго специфичны. Центр связывания интегринов образован внеклеточными доменами α- и β-субъединиц. Ин-тегрины узнают и связываются с белками, содержащими определённую аминокислотную последовательность -Арг-Гли-Асп-, присутствующую в ряде матриксных белков (фибронектин, фибриноген, ламинин, коллаген I типа и другие). Эффект связывания усиливается в присутствии ионов Са2+ и Mg2+.
Кадгерины и селектины - семейства трансмембранных Са2+-зависимых гликопротеинов, участвующих в межклеточной адгезии. Три возможных способа участия рецепторов этого типа в межклеточной адгезии представлены на рис. 5-27.
Кадгерины разных тканей очень схожи, гомологичные аминокислотные последовательности составляют 50-60%. Каждый рецептор имеет один трансмембранный домен. В отсутствие Са2+ конформация кадгеринов меняется, и они становятся доступными для протеолитических ферментов, которые их расщепляют. Наиболее полно охарактеризованы 3 группы кадгериновых рецепторов:
• Е-кадгерин находится на поверхности многих клеток эпителиальных и эмбриональных тканей;
• N-кадгерин локализован на поверхности нервных клеток, клеток сердца и хрусталика;
• Р-кадгерин расположен на клетках плаценты и эпидермиса.
Кадгерины играют важную роль при начальной межклеточной адгезии, на стадиях морфо- и органогенеза. Они обеспечивают структурную целостность и полярность тканей, особенно эпителиального монослоя.
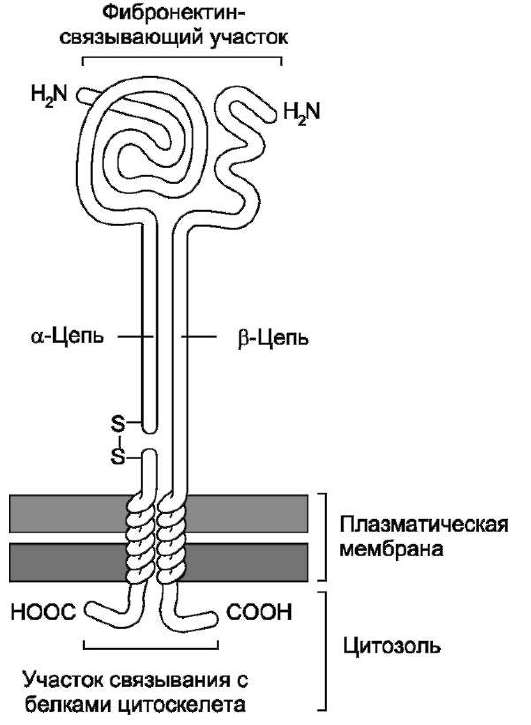
Рис. 5-26. Рецептор фибронектина. Рецептор фибро-нектина принадлежит к семейству интегринов. Каждая субъединица имеет единственный трансмембранный домен, короткий цитоплазматический и протяжённый N-внеклеточный домены. Обе субъединицы (α, β) интегрина гликозилированы и удерживаются вместе нековалентными связями. α-Субъединица синтезируется в виде одной полипептидной цепи, затем расщепляемой на малую трансмембранную цепь и большую внеклеточную цепь, соединённые дисульфидными мостиками. β-Субъединица содержит 4 повтора из 40 аминокислотных остатков каждый. α-Субъедини-цы богаты цистеином и содержат множество внут-рицепочечных дисульфидных связей (на рисунке не показаны). Связываясь с фибронектином снаружи и с цитоскелетом внутри клетки, интегрин действует как трансмембранный линкер.
В семействе селектиновых рецепторов наиболее хорошо изучены три белка: L-селектин, Р-селектин и Е-селектин. Внеклеточная часть селектинов состоит из 3 доменов: первый домен представлен 2-9 блоками повторяющихся аминокислотных остатков (комплементрегуля-торный белок), второй - домен эпидермального
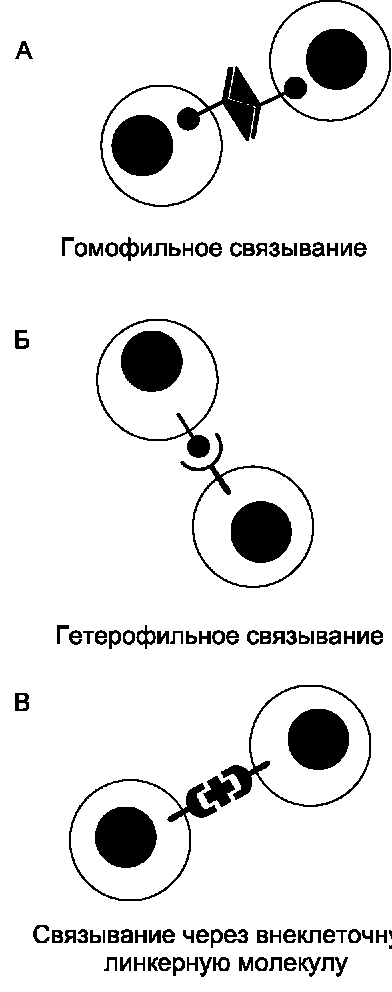
Рис. 5-27. Способы взаимодействия между молекулами клеточной поверхности в процессе межклеточной адгезии. А - рецепторы одной клетки могут связываться с такими же рецепторами соседних клеток (гомофильное связывание); Б -рецепторы одной клетки могут связываться с рецепторами другого типа соседних клеток (гетерофильное связывание); В - рецепторы клеточной поверхности соседних клеток могут связываться друг с другом с помощью поливалентных линкерных молекул.
фактора роста (ЭФР), третий - N-концевой лектиновый домен (рис. 5-28). Селектины L, Р, Е различаются количеством блоков в компле-ментрегуляторном белке. Лектины - семейство белков, специфически взаимодействующих с определёнными последовательностями углеводных остатков в составе гликопротеинов,
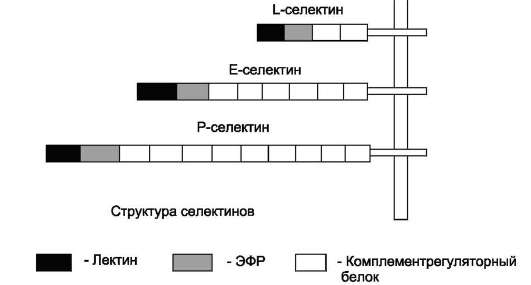
Рис. 5-28. Структура селектинов.
протеогликанов и гликолипидов внеклеточного матрикса.
Углеводные структуры - поливалентные линкерные молекулы, которые могут быть суль-фатированы, фукозилированы и сиализированы, т.е. могут содержать остатки серной кислоты, фукозы и сиаловой кислоты. Связывание ли-гандов с рецепторами происходит в области N-концевого лектинового домена.
v. трансмембранная передача сигнала
Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из внешней среды. «Узнавание» сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора.
Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
• взаимодействие рецептора с сигнальной молекулой (первичным посредником);
• активация мембранного фермента, ответственного за образование вторичного посредника;
• образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАГ или Са2+;
• активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказывают влияние на активность внутриклеточных процессов. Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
А. СИГНАЛЬНЫЕ МОЛЕКУЛЫ - ГОРМОНЫ, МЕДИАТОРЫ, ЭЙКОЗАНОИДЫ, ФАКТОРЫ РОСТА, ОКСИД АЗОТА (NO)
Сигнальными молекулами могут быть неполярные и полярные вещества. Неполярные вещества, например стероидные гормоны, проникают в клетку, проходя через липидный бислой. Полярные сигнальные молекулы в клетку не проникают, но связываются специфическими рецепторами клеточных мембран. Такое взаимодействие вызывает цепь последовательных событий в самой мембране и внутри клетки. К полярным сигнальным молекулам относят белковые гормоны (например, глюкагон, инсулин, паратгормон), нейромедиаторы (например, ацетилхолин, глицин, γ-аминомасляная кислота), факторы роста, цитокины, эйкозаноиды.
Б.РЕЦЕПТОРЫ
По локализации различают мембранные, цитоплазматические и ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах миллисекунд) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы. Рецепторы первого типа - интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал (рис. 5-29).
Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы, обладающие собственной тирозинки-назной или гуанилатциклазной активностью, и рецепторы, взаимодействующие через G-белок с мембранным ферментом. Связывание лиганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т.е. через мембрану переносится информация, а не заряды или какие-либо растворённые молекулы.
В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро.
Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т.д.) клеток-мишеней.
1. Рецепторы адреналина - адренорецепторы
Адренорецепторы различают по распределению в организме - центральные и периферические. Центральные адренорецепторы, локализованные в различных областях мозга, участвуют в регуляции функций ЦНС, периферические - контролируют работу внутренних органов.
Все адренорецепторы классифицируют на два типа - α- и β-, но каждый тип имеет несколько подтипов, наиболее распространённые из них - α:-, α2-, β1- и β2-рецепторы. В зависимости от своего анатомического расположения клетки одного типа, например гладко-
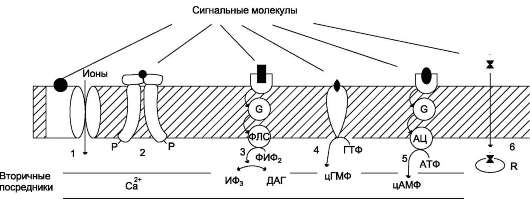
Рис. 5-29. Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 - связанные с ионными каналами, например рецептор ГАМК; 2 - с каталитической активностью (рецептор инсулина); 3 - передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 - с каталитической активностью (гуа-нилатциклаза, рецептор ПНФ); 5 - передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 - связывающие гормон в цитозоле или ядре, например рецептор кортизола.
мышечные клетки сосудов или адипоциты, содержат разные типы рецепторов.
Несмотря на значительное подобие между α- и β-рецепторами и их подтипами, они кодируются разными генами. Адренорецепторы принадлежат к семейству белков, имеющих 7 трансмембранных α-спиралей (которые принято называть доменами). Длина N- и С-концов, а также длина 1-4 доменов различается у разных типов и подтипов рецепторов (рис. 5-30).
Адренорецепторы - гликопротеины, включающие в свой состав различные углеводные фрагменты. Гликозилированию подвергаются расположенные в области N-конца остатки аспарагиновой кислоты.
β-Адренорецепторы встречаются практически во всех тканях организма. Количество β-адреноре-цепторов, приходящееся на клетку, варьирует
от 300 до 4000.
Центр связывания адреналина образован аминокислотными остатками третьего, пятого и шестого доменов. Другой функционально важный центр - область взаимодействия с G-белками, участвующими в формировании клеточного ответа. Остатки серина и треонина в области третьего внутреннего домена и С-конца адренорецептора могут фосфорилироваться под действием протеинкиназы А или специфичес-
кой киназой β-адренорецептора. Фосфорили-рование приводит к изменению конформации рецептора и снижению сродства к G-белку или препятствует связыванию с G-белком.
α-Адренорецепторы различают по локализации (например, гепатоциты имеют а1-рецепторы, адипоциты - α2-адренорецепторы) и механизму трансформации биологического сигнала. Эффекторные системы, связанные с α1- и α2-адренорецепторами, включают G-белки разного типа - Gplc-белки (G-белок стимулирующий) и Gj-белки (G-белок ингибирующий) и соответственно ферменты - фосфолипазу С или аденилатциклазу.
2. Рецепторы с тирозинкиназной активностью
Тирозиновые протеинкиназы - ферменты, фосфорилирующие специфические белки по тирозину, подразделяют на 2 типа - мембранные (рецепторные) и цитоплазматические. Внутриклеточные тирозиновые протеинкина-зы принимают участие в процессах передачи сигнала в ядро. Рецепторные тирозиновые протеинкиназы участвуют в трансмембранной передаче сигналов.
Примером рецепторной тирозиновой проте-инкиназы может служить рецептор инсулина (рис. 5-31). Рецептор инсулина - тирозиновая
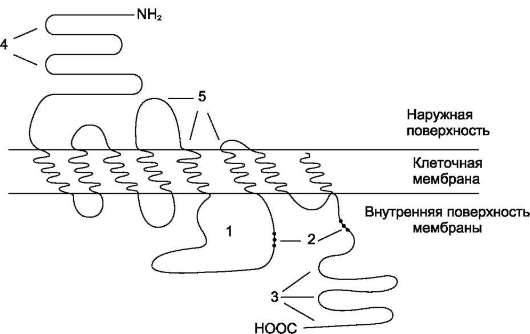
Рис. 5-30. Мембранная организация β2-адренорецептора. 1 - фрагмент рецептора, участвующий в связывании Gs-белка; 2, 3 - участки возможного фосфорилирования протеинкиназой А (2) и киназой β-адренорецептора (3); 4 - участок гликозилирования; 5 - участок связывания адреналина.
протеинкиназа, фосфорилирующая белки по ОН-группам тирозина.
Рецептор состоит из двух α- и двух β-субъ-единиц, связанных дисульфидными связями и нековалентными взаимодействиями. α- и β-Субъединицы - гликопротеины с углеводной частью на наружной стороне мембраны. Вне мембраны на её поверхности находятся α-субъединицы. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. β-Субъединицы пронизывают мембранный бис-лой и не участвуют в связывании инсулина.
Каталитический центр тирозиновой протеин-киназы находится на внутриклеточных доменах β-субъединиц. В отсутствие гормона инсулино-вые рецепторы не проявляют тирозинкиназной активности. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причём субстратом служит сама ти-розиновая протеинкиназа (β-субъединицы), т.е. происходит фосфорилирование β-субъединицы по нескольким тирозиновым остаткам. Фосфорилирование β-субъединиц происходит по механизму межмолекулярного трансфосфорили-рования, т.е. одна β-цепь фосфорилирует другую β-цепь той же молекулы рецептора. Это, в свою очередь, приводит к изменению субстратной специфичности тирозиновой протеинкиназы; теперь она способна фосфорилировать другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационны-ми изменениями рецептора инсулина после связывания гормона и аутофосфорилирования.
Ключевой белок, фосфорилируемый тирози-новой протеинкиназой, - субстрат инсулино-вого рецептора-1 (от англ. insulin receptor substrate, IRS-I). Фосфорилированный IRS-I активирует ферменты, например тирозиновую фосфопроте-инфосфатазу, и белки, участвующие в регуляции клеточных процессов.
Дефосфорилирование рецептора под действием тирозиновой фосфопротеинфосфатазы возвращает его в неактивное состояние. Сродство рецептора к инсулину снижается при его фосфорилировании протеинкиназой А по аминокислотным остаткам серина и треонина.
3. Рецепторы с гуанилатциклазной активностью
Гуанилатциклаза катализирует образование цГМФ из ГТФ, одного из важных посредников внутриклеточной передачи сигнала (рис. 5-32,
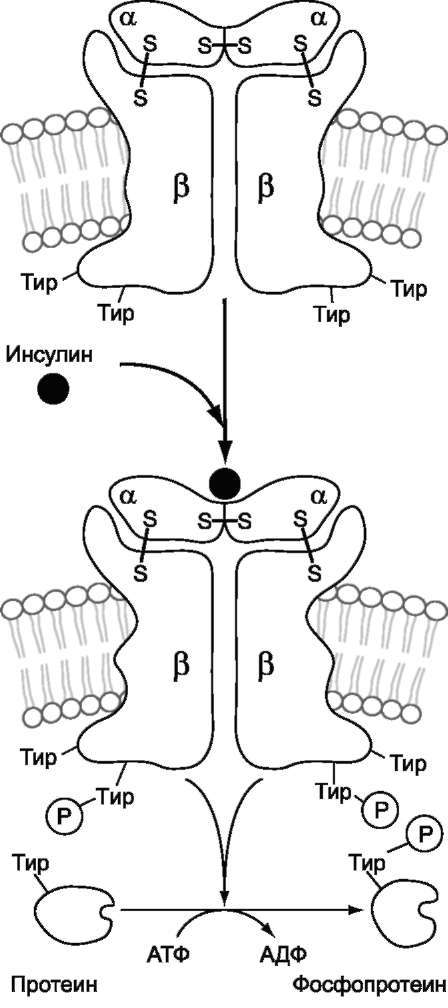
Рис. 5-31. Активация рецептора инсулина - тиро-зиновой протеинкиназы.
5-33). Гуанилатциклаза находится в клетке, как в мембранносвязанном состоянии, так и в цитозольном.
Соотношения этих двух форм фермента в различных тканях разное. Например, в клетках тонкого кишечника 90% гуанилатциклазы находится в мембранах, а в лёгких и печени - лишь 20%. Цитозольная и мембранносвязанная гуани-латциклазы различаются не только по локализации, но и по молекулярной массе, активности, способу регуляции.
Цитозольная форма гуанилатциклазы состоит из двух субъединиц (α и β) и содержит в своём составе простетическую группу - гем. В области гема связывается активатор этой формы гуани-латциклазы - оксид азота (N0), образующийся
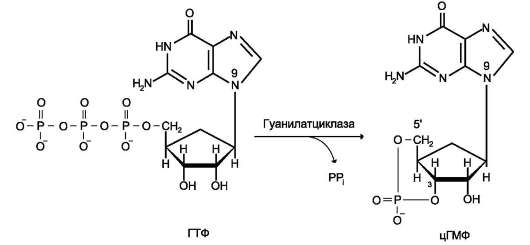
Рис. 5-32. Образование 3',5'-циклического ГМФ (цГМФ).
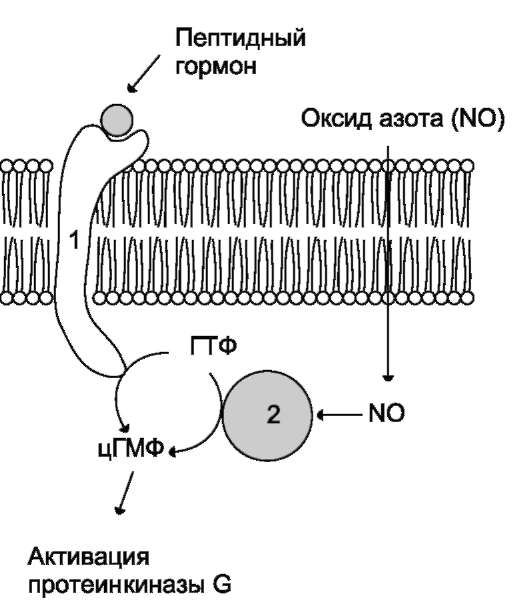
Рис. 5-33. Регуляция активности мембранной (1) и цитозольной (2) гуанилатциклазы.
из аргинина под действием фермента синтазы оксида азота (см. раздел 9).
Мембранносвязанная гуанилатциклаза - трансмембранный гликопротеин. Внутриклеточный домен гуанилатциклазы проявляет каталитическую активность, внеклеточный домен служит рецептором. Присоединение активатора к рецептору вызывает изменение конформации
в мембранном и цитозольном доменах и, как следствие, активацию гуанилатциклазы. В тканях человека присутствуют 3 типа мембранносвя-занных гуанилатциклаз, в активации которых принимают участие специфические регуляторы - предсердный натрийуретический фактор (ПНФ), натрийуретический пептид из мозга и кишечный пептид гуанилин.
В клетках тканей выявлены 3 основных типа внутриклеточных рецепторных белков, с которыми взаимодействует цГМФ: цГМФ-зависимая протеинкиназа (протеинкиназа G), цГМФ-регу-лируемые ионные каналы и цГМФ-регулируе-мая фосфодиэстераза, специфичная к цАМФ (катализирует превращение цАМФ в АМФ).
цГМФ играет важную роль в регуляции Са2+-гомеостаза в различных типах клеток. Повышение концентрации цГМФ приводит к понижению концентрации Са2+ как в результате активации Са2+-АТФ-аз, так и за счёт подавления рецепторзависимого поступления этого иона в цитоплазму клетки. Эти эффекты опосредованы действием протеинкиназы G на мембранные белки, участвующие в обмене Са2+.
В. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ G-БЕЛКОВ
G-белки (ГТФ-связывающие белки) - универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мем-
браны, катализирующим образование вторичных посредников гормонального сигнала. G-белки - олигомеры, состоящие из α, β и γ-субъединиц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъедини-цам. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G-белка имеет специфические центры:
• связывания ГТФ или ГДФ;
• взаимодействия с рецептором;
• связывания с βγ-субъединицами;
• фосфорилирования под действием проте-инкиназы С;
• взаимодействия с ферментом аденилатцик-лазой или фосфолипазой С.
В структуре G-белков отсутствуют α-спи-ральные, пронизывающие мембрану домены. G-белки относят к группе «заякоренных» белков (рис. 5-34).
Регуляция активности G-белков
Различают неактивную форму G-белка - комплекс αβγ-ГДФ и активированную форму αβγ-ГТФ. Активация G-белка происходит при взаимодействии с комплексом активатор-рецептор, изменение конформации G-белка снижает сродство α-субъединицы к молекуле ГДФ и увеличивает к ГТФ. Замена ГДФ на ГТФ в активном центре G-белка нарушает компле-ментарность между α-ГТФ и βγ-субъединицами. Рецептор, связанный с сигнальной молекулой, может активировать большое количество молекул G-белка, таким образом обеспечивая усиление внеклеточного сигнала на этом этапе (рис. 5-35).
Активированная α-субъединица G-белка (α-ГТФ) взаимодействует со специфическим белком клеточной мембраны и изменяет его активность. Такими белками могут быть ферменты аденилатциклаза, фосфолипаза С, фосфодиэс-тераза цГМФ, Na+-каналы, К+-каналы.
Следующий этап цикла функционирования G-белка - дефосфорилирование ГТФ, связанного с α-субъединицей, причём фермент,
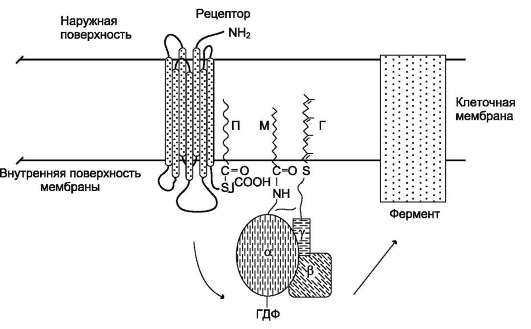
Рис. 5-34. Положение G-белков в мембране. Для ассоциации G-белков важно ацилирование α-протомеров алифатическими радикалами жирных кислот, миристиновой кислоты (М) или изопреновой. γ-Cубъединица G-белка имеет геранил-геранильную группу (Г), связанную тиоэфирной связью с остатком цистеина С-конца.
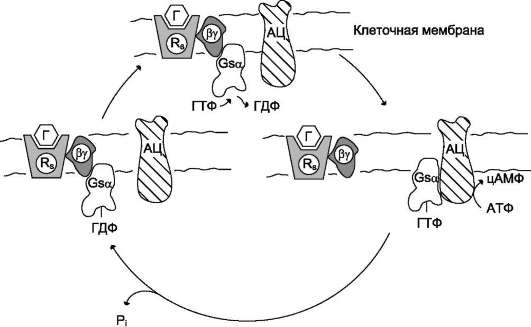
Рис. 5-35. Цикл функционирования G-белка. Rs - рецептор; Г - гормон; АЦ - аденилатциклаза.
катализирующий эту реакцию, - сама α-субъ-единица.
Дефосфорилирование приводит к образованию комплекса α-ГДФ, который не комплементарен специфическому белку мембраны (например, аденилатциклазе), но имеет высокое сродство к βγ-протомерам. G-белок возвращается к неактивной форме - αβγ-ГДФ. При последующей активации рецептора и замене молекулы ГДФ на ГТФ цикл повторяется снова. Таким образом, α-субъединицы G-белков совершают челночное движение, перенося стимулирующий или ингибирующий сигнал от рецептора, который активирован первичным посредником (например, гормоном), на фермент, катализирующий образование вторичного посредника.
Некоторые формы протеинкиназ могут фосфо-рилировать α-субъединицы G-белков. Фосфори-лированная α-субъединица не комплементарна специфическому белку мембраны, например аденилатциклазе или фосфолипазе С, поэтому не может участвовать в передаче сигнала.
Г. АДЕНИЛАТЦИКЛАЗА
Фермент аденилатциклаза, катализирующий превращение АТФ в цАМФ (рис. 5-36), - ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток.
Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 транс-мембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цито-плазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ - вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А.
На активность аденилатциклазы оказывают влияние как внеклеточные, так и внутриклеточные регуляторы. Внеклеточные регуляторы (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатцик-лазу. αs-Субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, αi-субъединица (ингибирующая) инги-бирует фермент. В свою очередь, аденилатцик-лаза стимулирует проявление ГТФ-фосфатазной активности α-субъединиц. В результате дефос-форилирования ГТФ образуются субъединицы αs-ГДФ и αi-ГДФ, не комплементарные адени-латциклазе.
Из 8 изученных изоформ аденилатциклазы 4 - Са2+-зависимые (активируются Са2+). Ре-гуляция аденилатциклазы внутриклеточным кальцием позволяет клетке интегрировать ак-
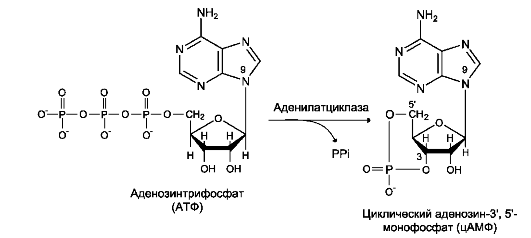
Рис. 5-36. Образование циклического аденозинмонофосфата (цАМФ).
тивность двух основных вторичных посредников цАМФ и Са2+.
Д. ФОСФОЛИПАЗЫ
Фосфолипазы - ферменты класса гидролаз, катализирующие катаболизм глицерофосфоли-пидов. Различают фосфолипазы секреторные, входящие в состав панкреатического сока, и клеточные фосфолипазы. Клеточные фосфолипазы А1, А2, D, С различаются по специфичности к отщепляемой группе. Все фосфолипазы - каль-цийзависимые ферменты (рис. 5-37).
Фосфолипаза С - фермент, гидролизующий фосфоэфирную связь в глицерофосфолипидах. В клетках человека идентифицировано 10 изо-форм фосфолипазы С, различающихся по молекулярной массе, локализации, способу регуляции, субстратной специфичности. В структуре всех изоформ фосфолипазы С отсутствуют гидрофобные домены, которые могли бы обеспечить их взаимодействие с мембраной. Однако некоторые формы фосфолипазы С связаны с мембраной с помощью гидрофобного «якоря» - ацильного остатка миристиновой кислоты или за счёт взаимодействия с поверхностью бислоя. Каталитическая активность всех изоформ фос-фолипазы С зависит от ионов кальция.
Большинство фосфолипаз С специфично в отношении фосфатидилинозитолов и практически не гидролизует другие типы фосфолипи-дов. Активный фермент может гидролизовать
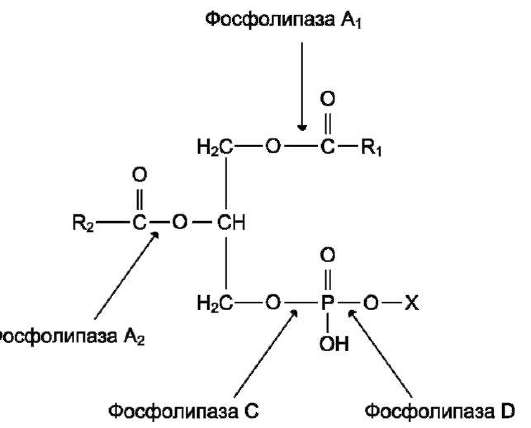
Рис. 5-37. Действие фосфолипаз.
до 50% от общего количества фосфатидилино-зитолов клеточной мембраны. При гидролизе фосфатидилинозитол-4,5-бисфосфата (ФИФ2) образуются продукты диацилглицерол (ДАГ) и инозитол-1,4,5-трифосфат (ИФ3), служащие вторичными посредниками в трансмембранной передаче сигнала по инозитолфосфатному пути.
Е. ПРОТЕИНКИНАЗЫ
Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные
рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) протеинкиназы по аминокислотным остаткам серина, треонина, тирозина. Протеинкиназы могут быть субъединицей мембранного рецептора, например тирозиновая протеинкиназа рецептора инсулина, активность которой регулируется гормоном. Другая группа - протеинкиназы, регулируемые вторичными вестниками гормонального сигнала (цАМФ, цГМФ, Са2+, ДАГ), например протеинкиназа А, протеинкиназа С, протеинкиназа G, кальмоду-линзависимые протеинкиназы и др.
1. Протеинкиназы А
Протеинкиназы А (цАМФ-стимулируемые) участвуют в аденилатциклазной системе передачи сигнала. Протеинкиназа А состоит из 4 субъединиц R2C2- двух регуляторных субъединиц (R2) и двух каталитических (C2) (см. рис. 5-41). Комплекс R2C2 не обладает ферментативной активностью.
Комплекс R2C2 разными способами прикрепляется к мембране. Некоторые формы протеинкиназы А «заякориваются» с помощью алифатического остатка миристиновой кислоты каталитических субъединиц. Во многих тканях протеинкиназа А связана с «заякоренным» белком АКАР8 (от англ. cAMP-dependent protein kinase anchoring proteins). АКАРs имеет центр связывания для регуляторных субъединиц протеинкиназы А. С помощью белка АКАРs протеинкиназа А связывается с мембраной в области локализации ферментов, катализирующих образование цАМФ (аденилатциклаза) или его гидролиз (фосфодиэстераза), а также белков, в регуляции активности которых фермент принимает участие, например потенциалзависимые Са2+-каналы.
Регуляторные субъединицы протеинкиназы А имеют специфические центры для связывания цАМФ. Присоединение цАМФ к регуляторным субъединицам приводит к изменению кон-формации последних и снижению сродства к каталитическим субъединицам С, происходит диссоциация по схеме:
цАМФ4 + R2C2 → цАМФ4 R2 + C + С.
Субъединицы С представляют собой активную форму протеинкиназы А, которая катализирует реакции фосфорилирования белков по серину и треонину. Каталитические субъединицы С у разных типов протеинкиназ А не идентичны, они различаются прежде всего специфичностью в отношении белков-субстратов.
2. Протеинкиназы С
Протеинкиназы С участвуют в инозитолфос-фатной системе передачи сигнала. Фермент состоит из двух функционально различных доменов - регуляторного и каталитического. Регуляторный домен содержит 2 структуры («цинковые пальцы»), образованные фрагментами пептидной цепи, богатыми цистеином, и содержащими 2 иона цинка (см. раздел 1). «Цинковые пальцы» участвуют в связывании диацилглицерола. Другой фрагмент регулятор-ного домена имеет высокое сродство к Са2+. Повышение концентрации кальция в цитозоле увеличивает сродство протеинкиназы С к фос-фатидилсерину мембраны. Транслокация про-теинкиназы С к мембране позволяет ферменту связаться с ДАГ, который ещё больше повышает сродство протеинкиназы С к ионам кальция (рис. 5-38). Наиболее распространённые изоформы протеинкиназы С активируются Са2+, диацилглицеролом и фосфатидилсерином.
Каталитический домен имеет центр, связывающий АТФ и белок-субстрат. Активная форма фермента протеинкиназы С фосфорилирует белки по остаткам серина и треонина. Снижение концентрации ионов кальция в клетке нарушает связь протеинкиназы С с фосфатидилсерином и диацилглицеролом, фермент переходит в неактивную форму и отделяется от мембраны.
3. Протеинкиназы G
В отличие от протеинкиназы А, протеин-ки-наза G присутствует не во всех тканях, её обнаруживают в лёгких, мозжечке, гладких мышцах и тромбоцитах. Изоформы протеинкиназы G могут быть связаны с мембраной или находиться в цитоплазме. Растворимая протеинкиназа G состоит из двух идентичных субъединиц, каждая из которых имеет два центра для связывания цГМФ. Присоединение цГМФ к регуляторным центрам вызывает конформационные изменения
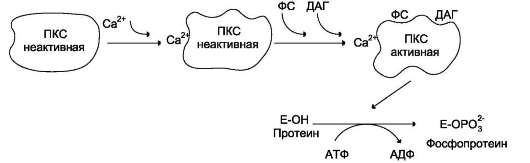
Рис. 5-38. Регуляция активности протеинкиназы С (ПКС). ФС - фосфатидилсерин; ДАГ - диацилглицерол.
субъединиц и повышает каталитическую актив-ность фермента (рис. 5-39). Протеинкиназа G, подобно протеинкиназе А и С, специфична в отношении определённых белковых субстратов, которые она фосфорилирует по остаткам серина и треонина.
Ж. ФОСФОДИЭСТЕРАЗЫ
Фосфодиэстеразы - ферменты, катализирующие превращение цАМФ (рис. 5-40) или цГМФ в неактивные метаболиты АМФ или ГМФ. Фос-фодиэстеразы, снижая концентрации вторичных посредников, разрывают цепь превращений, вызванных активатором рецептора.
Фосфодиэстеразы присутствуют в клетках тканей в 2 формах: в форме растворимого белка и мембранносвязанного. Формы фермента, связанные с мембраной, в разных тканях составляют 5-40%. В одной и той же ткани могут
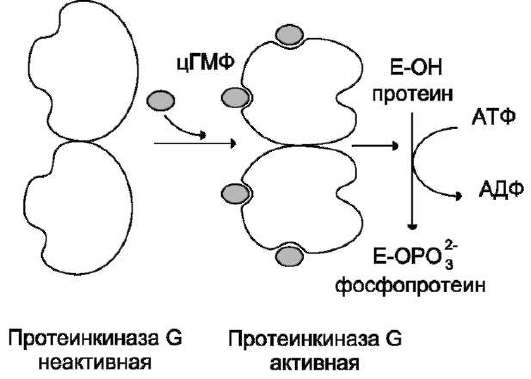
Рис. 5-39. Регуляция активности протеинкиназы G (ПKG).
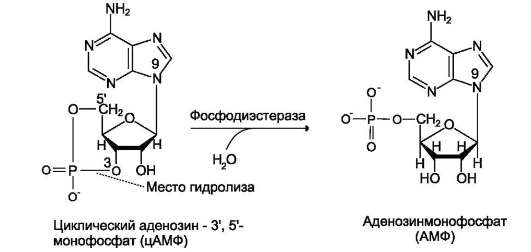
Рис. 5-40. Превращение цАМФ в АМФ.
присутствовать разные формы фосфодиэстера-зы, различающиеся по сродству к субстратам, молекулярному весу, заряду, регуляторным свойствам и локализации в клетке.
Фосфодиэстеразы циклических нуклеотидов не обладают абсолютной специфичностью, поэтому, как правило, одна и та же форма фермента способна гидролизовать как цАМФ, так и цГМФ. Однако скорости гидролиза этих двух нуклеотидов под действием одной и той же фосфодиэстера-зы могут значительно различаться. Это зависит от того, какая фосфодиэстераза присутствует в клетке - более специфичная в отношении цАМФ или более специфичная к цГМФ, от соотношения концентраций цАМФ и цГМФ в клетке и от действия регуляторов фосфодиэстеразы.
В большинстве тканей присутствует фос-фодиэстераза-1, более специфичная к цАМФ, активируемая Са2+ , комплексом 4 Са2+-кальмо-дулин и цГМФ.
З. АДЕНИЛАТЦИКЛАЗНАЯ СИСТЕМА
При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул - гормонов, нейромедиаторов, эйкозаноидов.
Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs-ре-цептор сигнальной молекулы, которая активирует аденилатциклазу, и Ri-рецептор сигнальной молекулы, которая ингибирует аденилатциклазу; Gs-стимулирующий и Gi-ингибирующий адени-латциклазу белки; ферменты аденилатциклаза (АЦ) и протеинкиназа А (ПКА) (рис. 5-41).
Последовательность событий, приводящих к активации аденилатциклазы:
• связывание активатора аденилатциклазной системы, например гормона (Г) с рецептором (Rs), приводит к изменению конформа-ции рецептора и увеличению его сродства к Gs -белку. В результате образуется комплекс [Г][R][G-ГДФ];
• присоединение [Г][R] к G-ГДФ снижает сродство α-субъединицы Gs-белка к ГДФ и увеличивает сродство к ГТФ. ГДФ замещается на ГТФ;
• это вызывает диссоциацию комплекса. Отделившаяся субъединица α, связанная с молекулой ГТФ, обладает сродством к аденилатциклазе:
[Г][R][G-ГТФ] → [Г][R] + α-ГТФ + βγ;
• взаимодействие α-субъединицы с аденилат-циклазой приводит к изменению конформа-ции фермента и его активации, увеличивается скорость образования цАМФ из АТФ;
• конформационные изменения в комплексе [α-ГТФ][АЦ] стимулируют повышение ГТФ-фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов реакции - неорганический фосфат (Pi) отделяется от α-субъединицы, а комплекс [α-ГДФ] сохраняется; скорость гидролиза определяет время проведения сигнала;
• образование в активном центре α-субъеди-ницы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βγ-субъединицам. Gs-белок возвращается к неактивной форме;
• если рецептор связан с активатором, например гормоном, цикл функционирования Gs белка повторяется.
Активация протеинкиназы А (ПКА)
• Молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами ПКА.
• Присоединение цАМФ к регуляторным субъединицам (R) вызывает диссоциацию комплекса на комплекс цАМФ4 R2 и С + С.
• Активная протеинкиназа А фосфорилирует специфические белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, а это приводит к изменению скорости и направления регулируемых ими процессов в клетке.
• Концентрация цАМФ в клетке может регулироваться, она зависит от соотношения активностей ферментов аденилатциклазы и фосфодиэстеразы.
Большую роль в регуляции внутриклеточной сигнальной системы играет белок АКАРs. «Заякоренный» белок АКАРs участвует в сборке ферментных комплексов, включающих не только протеинкиназу А, но и фосфодиэстеразу и фосфопротеинфосфатазу.
Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая ре-
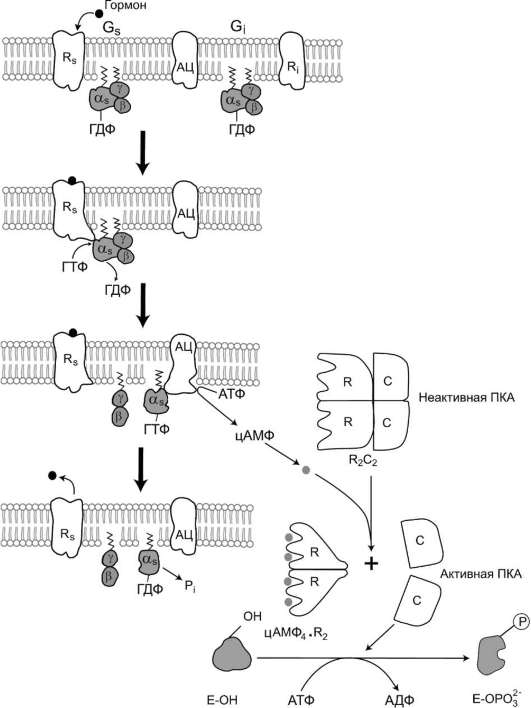
Рис. 5-41. Аденилатциклазная система.
цептор, может «включать» несколько G-белков, и затем каждый активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 102-103 раз. Образующийся цАМФ «включают» другой фермент - протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой А ещё больше усиливает сигнал, в результате суммарное усиление равно 106-107 раз. Таким образом, по механизму
каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул.
Но для любой из систем трансмембранной передачи сигнала клетка имеет другую систему, подавляющую этот сигнал. Каждый из этапов в ферментном каскаде находится под контролем специальных подавляющих этот сигнал механизмов. Например, длительное действие гормона приводит к десенсибилизации мемб-
ранных рецепторов: они либо инактивируются, либо вместе с гормоном погружаются в клетку посредством эндоцитоза. В результате десенсибилизации рецепторов степень активации аденилатциклазной системы снижается. Если в клетке длительное время повышена концентрация цАМФ (повышена активность протеинки-назы А), может происходить фосфорилирование кальциевых каналов, что приводит к повышению концентрации Са2+ в клетке. Кальций активирует Са2+-зависимую фосфодиэстеразу, катализирующую превращение цАМФ в АМФ. В результате инактивации протеинкиназы А (R2C2) снижается скорость фосфорилирования специфических ферментов. Завершает «выключение» системы фосфопротеинфосфатаза, дефосфорилирующая фосфопротеины.
Влияние бактериальных токсинов на активность аденилатциклазы (АДФ-рибозилирование G-белков)
Для изучения функционирования G-белков аденилатциклазной системы были использованы экзогенные бактериальные яды - холерный и коклюшный токсины. Токсины в экспериментальных условиях повышают активность аденилатциклазы практически во всех клетках организма; так, холерный токсин может стимулировать секрецию тиреоидных гормонов клетками щитовидной железы, стероидных гормонов клетками надпочечников, распад жиров в жировых клетках. Реакция разных клеток на холерный токсин вызвана повышением уровня цАМФ в этих клетках.
Холерный токсин - олигомерный белок. Одна из субъединиц - фермент АДФ-рибозил-трансфераза; проникая в клетку, она катализирует присоединение АДФ-рибозы к а8-субъеди-нице комплекса [а8-ГТФ][АЦ] (этап активации аденилатциклазы).
NAD++ [α s-ГТФ][АЦ] → [АДФ-рибозил-αsГТФ]АЦ + никотинамид + Н+.
АДФ-рибозилирование ингибирует проявление ГТФ-фосфатазной активности αs-субъ-единицы, не происходит дефосфорилирование ГТФ. Цикл функционирования Gs-белка останавливается на этапе активации фермента аденилатциклазы, отвечающего за образование цАМФ из АТФ. Фермент аденилатциклаза
сохраняет повышенную активность в течение длительного времени.
Субъединица коклюшного токсина, проникая в клетку, катализирует АДФ-рибозилирование а1-субъединицы активированного Gi-белка (αiβγ-ГТФ).
NAD++ [α iβγ-ГТФ] - [АДФ-рибозил- αiβγ-ГТФ] + никотинамид + Н+.
Модифицированная а1-субъединица сохраняет высокое сродство к βγ-субъединицам, т.е. Gj-белок теряет способность диссоциировать на а1-ГТФ и βγ-субъединицы. Таким образом, ингибирующий сигнал (а1-ГТФ) не достигает аденилатциклазы, значит в этом случае возможна только её активация при связывании с а8-ГТФ. Действие коклюшного токсина на клетки тканей всегда приводит к повышению уровня цАМФ.
Симптомы холеры и коклюша развиваются в результате действия токсинов, вырабатываемых соответствующими микроорганизмами.
И. ИНОЗИТОЛФОСФАТНАЯ СИСТЕМА
Функционирование инозитолфосфатной системы трансмембранной передачи сигнала (рис. 5-42) обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля.
Последовательность событий, приводящих к активации фосфолипазы С:
• связывание сигнальной молекулы, например гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Gplc-белку;
• образование комплекса [Г][R][Gр1с-ГДФ] приводит к снижению сродства а-протомера G p1с-белка к ГДФ и увеличению сродства к гТФ. ГДФ заменяется на ГТФ;
• это вызывает диссоциацию комплекса; отделившаяся а-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С;
• а-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфоли-пазы-С происходит гидролиз липида мембраны фосфатидилинозитол-4,5-бисфосфата
(ФИФ2);
• в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инози-тол-1,4,5-трифосфат (ИФ3). Другой продукт
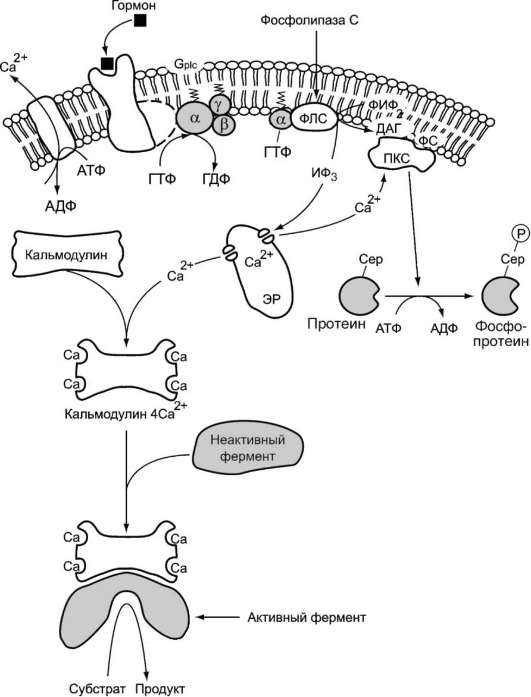
Рис. 5-42. Инозитолфосфатная система.
реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС);
• инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2+-канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала - Са2+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Активация протеинкиназы С
• Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия
Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС) и белком кальмо-дулином, таким образом сигнал, принятый рецептором клетки, раздваивается. Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами «кислого» фосфолипида мембраны, фосфатидилсерина (ФС). Диацилг-лицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция.
• На внутренней стороне мембраны образуется ферментативный комплекс - [ПКС][Са2+] [ДАГ][ФС] - активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину.
Участие белка кальмодулина в инозитолфосфат-ной передаче сигнала
В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са2+, он имеет 4 центра для связывания Са2+. Комплекс [кальмодулин][4 Са2+] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации.
Саморегуляция системы
Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАГ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилирова-нием протеинкиназой С.
Концентрация Са2+ в клетке снижается до исходного уровня при действии Са2+-АТФ-аз цитоплазматической мембраны и ЭР, а также Nа+/Са2+- и Н+/Са2+-транслоказ (активный антипорт) клеточной и митохондриальной мембран.
Функционирование транслоказ Са2+ и Са2+-АТФ-аз может активироваться:
• комплексом [кальмодулин][4 Са2+];
• протеинкиназой А (фосфорилированием);
• протеинкиназой С (фосфорилированием). Понижение концентрации Са2+ в клетке и
диацилглицерола в мембране приводит к изменению конформации протеинкиназы С, снижению её сродства к фосфатидилсерину, фермент диссоциирует в цитозоль (неактивная форма).
Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеин-фосфатазы переходят в дефосфорилированную форму.
К. ПЕРЕДАЧА СИГНАЛА С ПОМОЩЬЮ ВНУТРИКЛЕТОЧНЫХ РЕЦЕПТОРОВ
Передача сигнала липидорастворимых стеро-идных гормонов и тироксина возможна только при прохождении этих гормонов через плазмати-ческую мембрану клеток-мишеней (рис. 5-43).
Рецепторы гормонов могут находиться в цитозоле или в ядре. Цитозольные рецепторы связаны с белком-шапероном (часто это группа белков-шаперонов). Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНК-связывающий домен, характери-зующийся наличием двух структур «цинковых пальцев».
Последовательность событий, приводящих к активации транскрипции:
• гормон проходит через двойной липидный слой клеточной мембраны;
• взаимодействие гормона с рецептором (R) приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон-рецептор;
• комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотид-ной последовательностью в ДНК - энхан-сером или сайленсером;
• увеличивается (при взаимодействии с энхан-сером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы;
• соответственно увеличивается или уменьшается скорость транскрипции структурных генов;
• увеличивается или уменьшается скорость трансляции;
• изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы.
Л. СПЕЦИФИЧНОСТЬ СИГНАЛИЗАЦИИ
Для исследователей, имеющих представление о количестве сигнальных молекул, о соответствующем количестве рецепторов, о трансмемб-
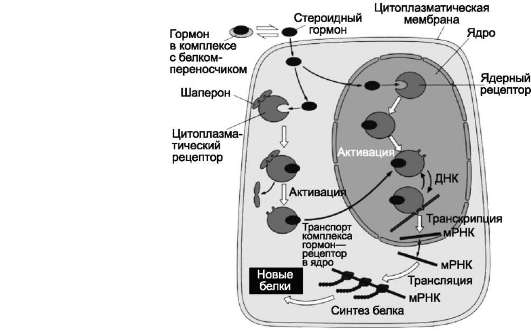
Рис. 5-43. Передача сигнала на внутриклеточные рецепторы.
ранных системах передачи сигналов, вторичных посредниках, остаётся загадкой, как протеин-киназы выбирают соответствующий фермент метаболического пути для фосфорилирования. Исследователи для объяснения этого явления предлагают «гипотезу мишени» (от англ. targeting hypothesis). По этой гипотезе специфичность протеинкиназ и фосфопротеинфосфатаз достигается путём образования компартментов на мембране, в состав которых входят не только сами протеинкиназы и фосфопротеинфосфата-
зы, но и специфические белки-субстраты. Наличие остатка миристиновой или пальмитиновой кислоты в структуре белков-субстратов - условие их «заякоривания» в соответствующем мембранном компартменте.
Однако в большинстве случаев процесс активации какого-либо метаболического процесса находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, поэтому важным фактором ответа клеток служит взаимосвязь этих систем.