Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Глава 9. ЭЛЕКТРОХИМИЧЕСКОЕ РАВНОВЕСИЕ. ИОНОМЕТРИЯ
...Обыкновенная форма, в которой выделяется химическая энергия, есть динамическое электричество.
Н. Н. Бекетов
9.1. ОСНОВЫ ПОТЕНЦИОМЕТРИИ
Способность генерировать электронные потенциалы - одно из наиболее удивительных свойств биологических систем. Какую бы часть организма мы не взяли, она обязательно несет определенную электрическую полярность. Электрическая активность биологических объектов - это очень важная функция, которая играет существенную и весьма универсальную роль в жизнедеятельности организмов.
В конце XIX - начале XX века появляются представления о природе биоэлектрических потенциалов (БЭП). Чаговцем (1986) была выдвинута гипотеза о БЭП как о диффузных потенциалах. Бернштейн связал их возникновение со свойствами мембраны клеток. Мембранная теория получила развитие в работах Ходжкина. Гальвани истолковал БЭП как свидетельство существования в мышцах животных электричества. В настоящее время изучение электрохимических явлений в биологических системах занимает важный раздел физиологии, биофизической химии.
Потенциометрия - это электрохимический метод исследования биохимических процессов, основанный на измерении окислительно-восстановительньх потенциалов.
Потенциометрия широко используется для определения концентрации ионов s-элементов и галогенов в биологических жидкостях и тканях организма, лежит в основе электрокардиографии, энцефалографии и других клинических методов, основанных на регистрации биопотенциалов. Потенциал, возникающий на границе раздела металл-раствор, называют электродным.
Потенциометрические методы основаны на измерении потенциалов электродов, являющихся функцией активности ионов в растворе.
Измерение производят на потенциометрической установке. В основе ее лежит гальванический элемент, состоящий из индикаторного электрода и электрода сравнения, подключенных к усилителю и измерителю электрического тока.
Электродвижущую силу (ЭДС) рассчитывают по формуле:
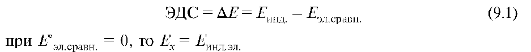
Электрод, потенциал которого зависит от концентрации и состава исследуемых ионов в растворе, называется индикаторным электродом. При потенциометрических исследованиях используют установки, которые различаются природой индикаторного электрода. Правильный выбор измерительного электрода является основной задачей в потен-циометрии.
9.2. ТИПЫ ИНДИКАТОРНЫХ ЭЛЕКТРОДОВ
Электроды подразделяются на обратимые и необратимые. Если изменить направление электрического тока во внешней цепи на противоположное, то на обратимом электроде протекает тот же самый процесс в обратном направлении, а на необратимом - другой процесс.
По механизму возникновения потенциала различают ионно-металлические электроды - это электроды межфазного обмена ионами, редокс-электроды - это электроды межфазного обмена электронами (к ним относятся и газометаллические электроды); мембранные электроды.
Выделяют электроды 1-го, 2-го и 3-го рода.
Обратимые ионно-металлические или газометаллические электроды носят название электродов первого рода. Электроды первого рода обратимы для катионов Си2+, Zn2+, Cd2+, H+ и анионов для О2-, С1- и др.
Ионо-металлический электрод представляет металл, находящийся в растворе своей соли. Например, для определения электродного потенциала Zn2+/Zn° пары применяется электрод из цинка. Его потенциал зависит от активности катиона в растворе.
Все газометаллические электроды конструктивно устроены одинаково. Они представляют собой инертный металл (Ag, Au, Pt) с развитой поверхностью, хорошо проводящей электрический ток и обладающий каталитическими свойствами по отношению к электродному процессу. Платиновая пластинка электролитически покрывается слоем мелкоди-
сперсной платины с целью увеличения адсорбции газа поверхностью металла. Платина одновременно контактирует с газом и раствором, содержащим соответствующие ионы. В стандартном кислородном электроде платиновая пластинка погружена в раствор щелочи (NaОН, КОН), с активностью гидроксид-ионов, равной 1 М. Давление чистого кислорода (или его парциальное давление в смеси газов над раствором) составляет 101,3 кПа.
Электроды второго рода являются обратимыми для анионов С1-, Вr-, I- и отражают их активность в растворе. На существование обратимости в этих электродах было впервые указано Нернстом, он же дал и теорию этих электродов. Они представляют металлы, покрытые слоем нерастворимых солей этих металлов, погруженные в раствор соли с тем же анионом, как и у нерастворимой соли. Примером может служить ртутный электрод, покрытый слоем каломели (Hg2C12), или серебряный электрод, покрытый слоем хлористого серебра (AgC1), погруженные в раствор хлористого калия. При прохождении тока в одном направлении, когда электрод является анодом, выделяющийся ион хлора, соединяясь с металлом электрода, образует нерастворимую соль, т.е. как бы хлор «осаждается током на электроде»; когда же электрод становится катодом, хлориды нерастворимой соли переходят в раствор. Эта качественная сторона явлений не дает, конечно, полной картины происходящих процессов и говорит о том, что в таком электроде хлор является как бы металлом, отличающимся только знаком электричества его иона, что важно только для общей характеристики явления.
Еще сложнее теория обратимых электродов 3-го рода. Эти электроды предложены Лютером, как обратимые для металлов, выделяющих водород из воды и, следовательно, не могущих служить в металлическом состоянии электродами. Примером будет служить свинцовая пластинка, покрытая слоем смеси солей сернокислого свинца и сернокислого кальция, погруженная в раствор, содержащий хлористый кальций и насыщенный сернокислым свинцом и сернокислым кальцием.
Мембранные электроды (ионоселективные электроды) - это электрохимические системы, разделенные на две части мембраной, избирательно чувствительной к определенному виду ионов. Потенциал возникает на границе тонкого слоя токопроводящего материала и раствора в результате ионного обмена между мембраной и раствором. Потенциал зависит только от концентрации определяемого иона (рис. 9.1).
В последнее время широко применяют молекулярно-селективные электроды (ферментные электроды), представляющие собой ионо-селективные электроды, на наружной поверхности которых нанесен
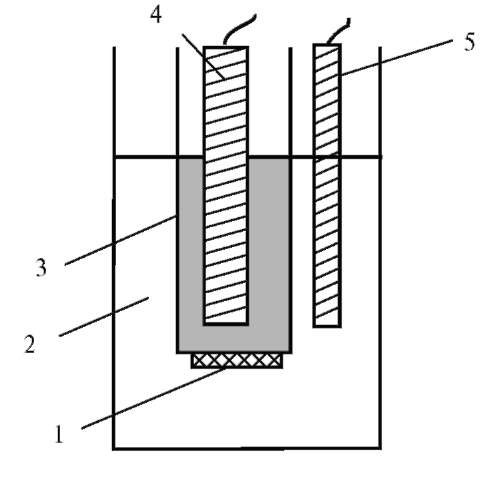
Рис. 9.1. Ионоселективный электрод: 1 - ионоселективная мембрана; 2 - исследуемый раствор; 3 - стандартный раствор; 4 - внутренний электрод сравнения; 5 - внешний электрод сравнения
иммобилизованный фермент, способный катализировать превращение одного единственного субстрата из многих сотен и даже тысяч близких по химической природы веществ. Под действием фермента происходит реакция с определенным субстратом, в результате которой образуется ион, к которому чувствителен данный электрод. Такие электроды называются ферментными. Например, селективный электрод на мочевину состоит из стеклянного электрода, покрытого специфическим ферментом уреазой, под действием которого мочевина гидролизуется до катиона аммония, концентрация которого фиксируется селективным на ион водорода стеклянным электродом. Принцип действия ферментных электродов рассмотрим на примере пенициллин-селективного электрода. Пенициллин под действием фермента пенициллиназы, который наносят на поверхность стеклянного электрода, подвергается гидролизу с образованием пенициллиновой кислоты, концентрация которой соответствует концентрации пенициллина и определяет pH анализируемого раствора. Концентрация иона водорода определяется с помощью стеклянного электрода, на поверхности которого нанесен фермент. В клинической практике применяют ферментные электроды для определения глюкозы, аминокислот, витаминов и других биологически активных веществ.
9.3. МЕТОДЫ ОПРЕДЕЛЕНИЯ PH. СТЕКЛЯННЫЙ ЭЛЕКТРОД. ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД
Для определения концентрации ионов водорода разработан ряд методов: визуально-колориметрический, фотоколориметрический, кондуктометрический и потенциометрический. Наиболее широко применяется потенциометрический метод. В качестве индикаторного электрода применяют стеклянный, хингидронный и водородный электроды. В настоящее время наиболее широко используют стеклянный электрод. В качестве электрода сравнения применяют хлорсеребряный или каломельный. ЭДС определяется уравнением Е = φ(инд.эл.) - φ(эл.сравн.) Определение pH можно выполнить любым потенциометром или pH-метром со шкалой непосредственного отсчета pH.
Электрод сравнения служит для определения потенциала индикаторного электрода. Потенциал электрода сравнения постоянен.
Стеклянный электрод - это мембранный селективный электрод на [Н+], состоящий из стеклянной трубки, заканчивающейся тонкостенным шариком из специального стекла. Внутри содержится 0,1 М раствор соляной кислоты, для токоотвода помещают хлорсеребряный электрод, потенциал которого постоянен (φ1). Когда электрод помещают в раствор соляной кислоты, в поверхностный слой электродного стекла интенсивно проникают из исследуемого раствора ионы водорода, вытесняя из стекла ионы натрия и калия. Способность к ионному обмену зависит от химического состава стекла и состава раствора. В результате обмена ионов водорода между стеклом и раствором образуется двойной электрический слой. На внутренней поверхности стекла потенциал постоянен (φ2), так как концентрация [Н+] в 0,1 М растворе HC1 постоянна, а (φ3) переменная величина и зависит от концентрации [Н+] в исследуемом растворе. Потенциал стеклянного электрода зависит от сорта стекла, поэтому перед применением его калибруют по буферным растворам с определенной концентрацией ионов водорода. Стеклянные электроды не чувствительны к окислительно-восстановительным процессам, не адсорбируют белки, индифферентны к поверхностно-активным веществам, поэтому они прочно вошли в практику медицины. Устройство стеклянного электрода представлено на рис. 9.2.
Условная запись гальванической цепи любой потенциометрической установки для определения pH, содержащей в качестве измерительного электрода стеклянный, а в качестве электрода сравнения - хлорсере-бряный, имеет вид:
Рис. 9.2. Устройство стеклянного электрода
Электрод сравнения - это электрод второго рода и представляет собой металлический электрод, погруженный в насыщенный раствор малорастворимого соединения этого металла (соли или оксида) и соль
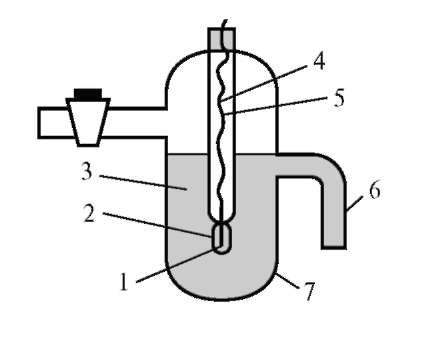
Рис. 9.3. Хлорсеребряный электрод: 1 - серебро; 2 - серебра хлорид;
3 - насыщенный раствор серебра хлорида в растворе калия хлорида;
4 - медный проводник; 5 - стеклянный чехол; 6 - соединительный отвод; 7 - сосуд
хорошо растворимого электролита с одноименным анионом. Как правило, используют хлорсеребряный электрод (рис. 9.3).
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой слоем хлорида серебра и погруженной в насыщенный раствор хлорида калия. При работе электрода электродный потенциал определяется полуреакцией, протекающей на поверхности серебряной проволоки: AgCl(т) + ē ↔ Ag°(т) + Cl-(р) (1). Зависимость электродного потенциала от активности иона серебра и хлорид ионов описывается уравнением Нернста. Концентрация
ионов серебра определяется уравнением (1) и диссоциацией AgC1: AgC1 ↔ Ag+ + C1- (2). Ks(AgC1) = [Ag+][C1-] (3). [C1-] - постоянна, хлориды в большом избытке. Кs(AgС1) - константа растворимости
(AgC1).
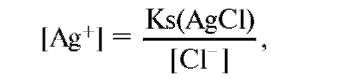
следовательно, [Ag+] постоянна и потенциал будет постоянным и равным при комнатной температуре +0,22 В.
9.4. ПРЯМЫЕ И КОСВЕННЫЕ МЕТОДЫ
ПОТЕНЦИОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Прямой метод в потенциометрии применяют при определении электродного потенциала, и он является источником информации о концентрации иона в растворе. Для определения концентрации ионов металлов в качестве индикаторного электрода применяют электрод первого рода (пластину из металла, концентрация которого определяется). Например, для определения концентрации иона меди применяют в качестве индикаторного электрода медную пластину.
При титровании систем, содержащих малорастворимые или коллоидные частицы, используют косвенные методы потенциометрического титрования, основанные на измерении ЭДС в процессе титрования с помощью потенциометрических установок, которые различаются типом индикаторного электрода, определяющегося потенциалопреде-ляющим ионом.
Потенциалопределяющий ион зависит от реакции, лежащей в основе титрования. В методе нейтрализации в основе титрования лежит реакция нейтрализации: Н+ + ОН- = Н2О (кислотно-основное титрование).
В процессе титрования изменяется концентрация ионов водорода, и этот ион определяет потенциал титруемой системы. Поэтому в качестве индикаторного электрода применяют стеклянный электрод.
В процессе титрования индикаторный электрод и электрод сравнения погружают в титруемый раствор. При титровании в точке эквивалентности происходит резкое изменение потенциала - скачок титрования, что обусловлено изменением концентрации в растворе потенциал-определяющего иона Н+. Зависимость изменения ЭДС в ходе титрования от объема добавленного титранта изображают графически. Такую зависимость называют кривой потенциометрического титрования.
В осадительном методе титрования основная химическая реакция сопровождается образованием малорастворимого вещества. Например, AgNO3 + NaC1 = AgCl↓ + NaNO3. Потенциалопределяющим ионом является Ag+. Серебро используется в качестве индикаторного электрода. ЭДС в процессе титрования определяется концентрацией Ag+ в растворе. Кривая потенциометрического титрования имеет следующий вид
(рис. 9.4).
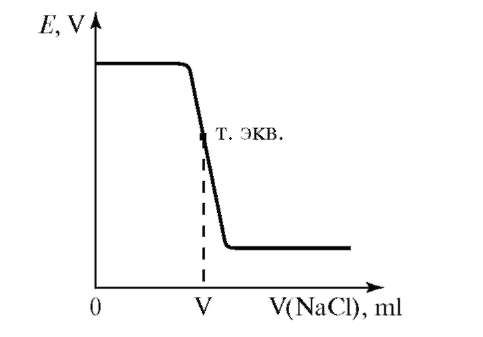
Рис. 9.4. Кривая потенциометрического титрования при осадительном методе
Чем меньше Ks соли, образующейся в процессе титрования, тем больше скачок титрования. ЭДС в процессе титрования будет уменьшаться.
В оксидиметрическом методе в основе титрования лежит окислительно-восстановительная реакция. Потенциал титруемого раствора определяется парой, образующейся в процессе титрования системы.
Окисленная и восстановленная формы пары находятся в растворе, поэтому в качестве индикаторного электрода применяют платину. Рассмотрим процесс титрования на примере определения концентрации раствора FeSO4 стандартным раствором КMnO4. Потенциал титруемого раствора определяется парой, образующейся в растворе в процессе титрования: МпО4- + 8Н+ + 5ē → Мn2+ + 4Н2О; φ°(МnО4-/ /Мn2+) = +1,51В и восстановителя: φ°(Fе3+/Fe2+) = +0,77 B. В начале титрования в растворе находятся ионы Fe2+; Fe3+; Мn2+. Потенциал титруемой системы определяется парой Fe2+/Fe3+. При дальнейшем титровании концентрация Fe2+ уменьшается, а концентрация Fe3+ и Мn2+ увеличивается. Вторая точка - середина титрования вблизи от точки эквивалентности с небольшим избытком МnО4-. Состав раствора: Fe3+; Мп2+; МnО4-. Потенциал титруемой системы определяется парой МnО4-/Мn2+ и равен +1,5 В. Наблюдаем скачок потенциала
в конце титрования. При этом концентрация МnО4- увеличивается (рис. 9.5). Потенциалы будут определяться следующими уравнениями
(1, 2):
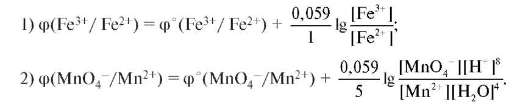
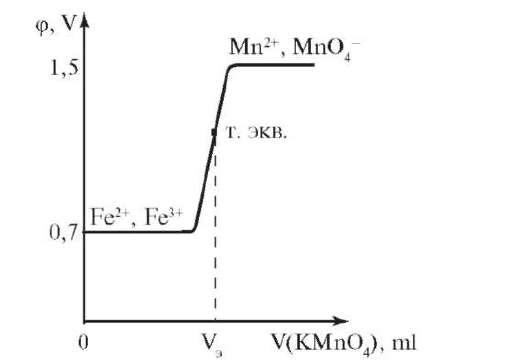
Рис. 9.5. Кривая потенциометрического титрования при оксидиметрии
Для определения точки эквивалентности по результатам титрования строят график зависимости Е (рис. 9.6) от объема добавленного титран-та. Проецируют точку перегиба кривой титрования на ось абсцисс, точнее можно определить по графику изменения потенциала на единицу добавляемого объема титранта ЭДС/ΔV в зависимости от общего объема титранта.
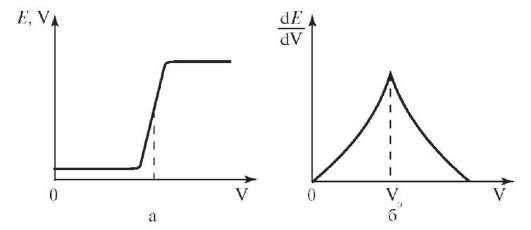
Рис. 9.6. Определение точки эквивалентности в потенциометрии: а - интегральная кривая; б - дифференциальная кривая
9.5. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. В чем заключается сущность потенциометрии и кондуктометрии? Сформулируйте принцип выбора измерительного электрода в потен-циометрии.
2. Дайте определение гальванического элемента.
3. Составьте схему электрической и химической цепи гальванического элемента для определения окислительно-восстановительного потенциала пар Zn2+/Zn° и Со3+/Со2+. Объясните механизм его возникновения. Напишите реакции, протекающие на электродах, общую схему реакции.
4. Запишите уравнение Нернста для хлорсеребряного электрода, докажите, что он является электродом сравнения. Какая реакция будет протекать на хлорсеребряном электроде, если в гальваническом элементе он является катодом?
5. Объясните выбор индикаторного электрода для потенцио-метрического титрования, в основе которого лежат следующие реакции:
а) нейтрализации;
б) окислительно-восстановительная;
в) реакции, протекание которых сопровождается образованием малорастворимого вещества.
Нарисуйте кривую потенциометрического титрования для определения точки эквивалентности процесса титрования. Укажите потен-циалопределяющий ион.
6. Нарисуйте и объясните ход кривой потенциометрического титрования:
а) раствора сульфата железа (II) раствором КМnО4 в кислой среде;
б) раствора азотнокислого серебра раствором хлорида натрия. Обоснуйте выбор индикаторного электрода.
7. В чем заключается преимущество потенциометрического титрования перед другими методами титрования?
8. Какие электроды можно использовать в качестве индикаторных электродов при потенциометрическом титровании кислот и оснований?
9. В чем заключается принцип выбора индикаторных электродов для потенциометрического титрования?
10. От каких факторов зависит величина резкого изменения ЭДС при потенциометрическом титровании?
11. Каковы преимущества дифференциальной кривой потенциоме-трического титрования перед интегральной кривой?
12. В чем заключается разница между прямыми и косвенными методами потенциометрического титрования?
13. Выберите индикаторный электрод для определения концентрации физиологического раствора натрия хлорида. Составьте схему химической цепи гальванического элемента.
9.6. ТЕСТОВЫЕ ЗАДАНИЯ

2. Электрическая проводимость ниже:
а) у костной ткани;
б) кожи;
в) желудочного сока;
г) крови.
3. Зависимость потенциала электрода от активности ионов в растворе определяется уравнением:
а) Фарадея;
б) Вант-Гоффа;
в) Гиббса;
г) Нернста.
4. При механическом повреждении клеточной мембраны возникает потенциал:
а) диффузионный;
б) окислительно-восстановительный;
в) мембранный;
г) электродный.
5. Потенциометрическое определение pH биологических жидкостей основано на измерении:
а) электрической проводимости анализируемого раствора;
б) оптической плотности анализируемого раствора;
в) потенциала индикаторного электрода в анализируемом растворе;
г) потенциала электрода сравнения в анализируемом растворе.
6. Редокс-потенциал возникает на границе раздела фаз:

7. Внутренняя поверхность клеточных мембран заряжена:
а) положительно;
б) отрицательно;
в) не заряжена;
г) имеет переменный знак заряда.
8. Какие частицы являются носителями заряда в проводниках I рода?
а) ионы;
б) электроны;
в) ионы и электроны;
г) радикалы.
9. Стеклянный электрод относится к электродам:
а) металлическим;
б) ионно-селективным;
в) газовым;
г) окислительно-восстановительным.
10. Каломельный электрод относится к электродам:
а) мембранным;
б) 1-го рода;
в) 2-го рода;
г) 3-го рода.