Нормальная физиология : Учебник. - Р.С. Орлов, А.Д. Ноздрачёв, 2009. - 688 с
|
|
|
|
ГЛАВА 2. МЕМБРАННЫЕ ПРОЦЕССЫ
Биологические мембраны, находящиеся на границе клетки и внеклеточного пространства, а также на границе мембранных органелл клетки и цитозоля существенно важны для функционирования как клетки в целом, так и её органелл. Клеточные мембраны имеют принципиально сходную молекулярную организацию. В этой главе биологические мембраны рассмотрены преимущественно на примере плазматической мембраны (плазмолеммы), отграничивающей клетку от внеклеточной среды.
Плазматическая мембрана
• Любая биологическая мембрана (рис. 2-1) состоит из фосфолипидов (~50%) и белков (до 40%). В меньших количествах в состав мембраны входят другие липиды, холестерол и углеводы. Фосфолипиды. Молекула фосфолипида состоит из полярной (гидрофильной) части (головка) и аполярного (гидрофобного) двой-
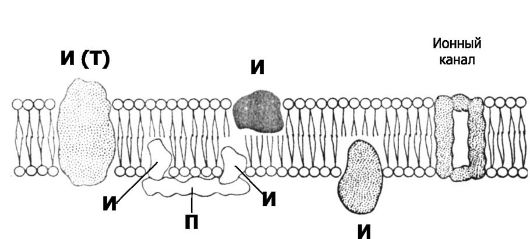 Рис. 2-1. Биологическая мембрана состоит
из двойного слоя фосфолипидов, гидрофильные части которых (головки)
направлены к поверхности мембраны, а гидрофобные части (хвосты,
стабилизирующие мембрану в виде бислоя) внутрь мембраны. И - интегральные белки погружены в мембрану. Т - трансмембранные белки пронизывают всю толщу мембраны. П - периферические белки расположены либо на наружной, либо на внутренней поверхности мембраны
Рис. 2-1. Биологическая мембрана состоит
из двойного слоя фосфолипидов, гидрофильные части которых (головки)
направлены к поверхности мембраны, а гидрофобные части (хвосты,
стабилизирующие мембрану в виде бислоя) внутрь мембраны. И - интегральные белки погружены в мембрану. Т - трансмембранные белки пронизывают всю толщу мембраны. П - периферические белки расположены либо на наружной, либо на внутренней поверхности мембраны
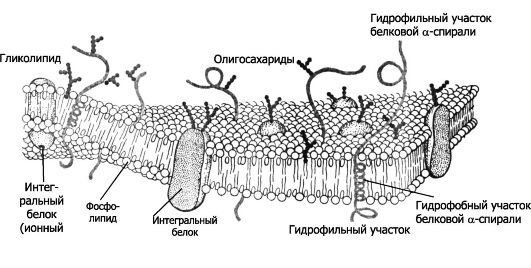
Рис. 2-2. Плазматическая мембрана
• ного углеводородного хвоста. В водной фазе молекулы фосфолипидов автоматически агрегируют хвост к хвосту, формируя каркас биологической мембраны (рис. 2-1 и 2-2) в виде двойного слоя (бислой). Таким образом, в мембране хвосты фосфолипидов (жирные кислоты) направлены внутрь бислоя, а содержащие фосфатные группировки головки обращены кнаружи. Белки биологических мембран подразделяют на интегральные (в том числе трансмембранные) и периферические (рис. 2-1 и 2-2).
❖ Интегральные мембранные белки встроены в липидный бислой. Их гидрофильные аминокислоты взаимодействуют с фосфатными группами фосфолипидов, а гидрофобные аминокислоты - с цепями жирных кислот. К интегральным мембранным белкам относятся белки адгезии, некоторые рецепторные белки (мембранные рецепторы).
❖ Трансмембранный белок - молекула белка, проходящая через всю толщу мембраны и выступающая из неё как на наружной, так и на внутренней поверхности. К трансмембранным белкам относятся поры, ионные каналы, переносчики, насосы, некоторые рецепторные белки.
❖ Поры и каналы - трансмембранные пути, по которым между цитозолем и межклеточным пространством (и в обратном направлении) перемещаются вода, ионы и молекулы метаболитов.
❖ Переносчики осуществляют трансмембранное перемещение конкретных молекул (в том числе в сочетании с переносом ионов или молекул другого типа).
❖ Насосы перемещают ионы против их концентрационного и энергетического градиентов (электрохимический градиент) при помощи энергии, освобождаемой при гидролизе АТФ.
❖ Периферические мембранные белки находятся на одной из поверхностей клеточной мембраны (наружной или внутренней) и нековалентно связаны с интегральными мембранными белками.
❖ Примеры периферических мембранных белков, связанных с наружной поверхностью мембраны - рецепторные белки и белки адгезии.
❖ Примеры периферических мембранных белков, связанных с внутренней поверхностью мембраны, - белки цитоскелета, белки системы вторых посредников, ферменты и другие белки.
• Углеводы (преимущественно олигосахариды) входят в состав гликопротеинов и гликолипидов мембраны, составляя 2-10% её массы (рис. 2-2). С углеводами клеточной поверхности взаимодействуют лектины. Цепи олигосахаридов выступают на наружной поверхности мембран клетки и формируют поверхностную оболочку - гликокаликс.
Проницаемость мембраны
Мембранный бислой разделяет две водные фазы. Так, плазматическая мембрана отделяет межклеточную (интерстициальную) жидкость от цитозоля, а мембраны лизосом, пероксисом, митохондрий и других мембранных внутриклеточных органелл их содержимое от цитозоля. Биологическая мембрана - полупроницаемый барьер.
• Полупроницаемая мембрана. Биологическую мембрану определяют как полупроницаемую, т.е. барьер, не проницаемый для воды, но проницаемый для растворённых в ней веществ (ионы и молекулы).
• Полупроницаемые тканевые структуры. К полупроницаемым тканевым структурам относят также стенку кровеносных капилляров и различные барьеры (например, фильтрационный барьер почечных телец, аэрогематический барьер респираторного отдела лёгкого, гематоэнцефалический барьер и многие другие, хотя в состав таких барьеров - помимо биологических мембран (плазмолемма) - входят и немембранные компоненты. Проницаемость таких тканевых структур рассмотрена в разделе «Трансклеточная проницаемость» главы 4.
Физико-химические параметры межклеточной жидкости и цитозоля существенно различны (см. табл. 2-1), также различны параметры каждого мембранного внутриклеточного органоида и цито-
золя. Наружная и внутренняя поверхности биологической мембраны полярны и гидрофильны, но неполярная сердцевина мембраны гидрофобна. Поэтому неполярные вещества могут проникать через липидный бислой. В то же время именно гидрофобный характер сердцевины биологической мембраны определяет принципиальную невозможность непосредственного проникновения через мембрану полярных веществ.
• Неполярные вещества (например, водонерастворимые холестерол и его производные) свободно проникают через биологические мембраны. В частности, именно по этой причине рецепторы стероидных гормонов расположены внутри клетки.
• Полярные вещества (например, ионы Na+, K+, Cl-, Ca2+; различные небольшие, но полярные метаболиты, а также сахара, нуклеотиды, макромолекулы белка и нуклеиновых кислот) сами по себе не проникают через биологические мембраны. Именно поэтому рецепторы полярных молекул (например, пептидных гормонов) встроены в плазматическую мембрану, а передачу гормонального сигнала к другим клеточным компартментам осуществляют вторые посредники.
Избирательная проницаемость - проницаемость биологической мембраны по отношению к конкретным химическим веществам) - важна для поддержания клеточного гомеостаза, оптимального содержания в клетке ионов, воды, метаболитов и макромолекул. Перемещение конкретных веществ через биологическую мембрану называют трансмембранным транспортом (чрезмембранный транспорт).
Трансмембранный транспорт
Избирательная проницаемость осуществляется при помощи пассивного транспорта, облегчённой диффузии и активного транспорта.
Пассивный транспорт
Пассивный транспорт (пассивная диффузия) - движение небольших неполярных и полярных молекул в обоих направлениях по градиенту концентрации (разность химического потенциала) или по электрохимическому градиенту (транспорт заряженных веществ - электролитов) осуществляется без затрат энергии и характеризуется низкой специфичностью. Простую диффузию описывает закон Фика. Пример пассивного транспорта - пассивная (простая) диффузия газов при дыхании.
• Концентрационный градиент. Определяющий фактор диффузии газов - их парциальное давление (например, парциальное дав-
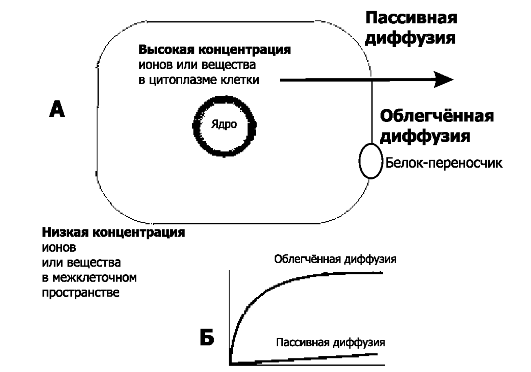 Рис. 2-3. Пассивный транспорт путём диффузии через плазматическую мембрану. А -
направление транспорта вещества как при простой, так и при облегчённой
диффузии происходит по градиенту концентрации вещества по обе стороны
плазмолеммы. Б - кинетика транспорта. По ординате - количество
диффундировавшего вещества, по ординате - время. Простая диффузия не
требует непосредственных затрат энергии, является ненасыщаемым
процессом, её скорость линейно зависит от градиента концентрации
вещества
Рис. 2-3. Пассивный транспорт путём диффузии через плазматическую мембрану. А -
направление транспорта вещества как при простой, так и при облегчённой
диффузии происходит по градиенту концентрации вещества по обе стороны
плазмолеммы. Б - кинетика транспорта. По ординате - количество
диффундировавшего вещества, по ординате - время. Простая диффузия не
требует непосредственных затрат энергии, является ненасыщаемым
процессом, её скорость линейно зависит от градиента концентрации
вещества
• ление кислорода - Po2 и парциальное давление диоксида углерода - PCO2). Другими словами, при простой диффузии поток незаряженного вещества (например, газов, стероидных гормонов, анестетиков) через липидный бислой прямо пропорционален разности концентрации этого вещества по обе стороны мембраны (рис. 2-3). Электрохимический градиент (Δμχ,). Пассивный транспорт заряженного растворённого вещества Х зависит как от разности концентраций вещества в клетке ([Х]В) и вне (снаружи) клетки ([Х]С), так и от разницы электрического потенциала вне (ψС) и внутри клетки (ψВ). Другими словами, Δμχ учитывает вклад как концентрационного градиента вещества (разность химического потенциала), так и вклад электрического потенциала по обе стороны мембраны (разность электрического потенциала). Таким обра-
зом, движущей силой пассивного транспорта электролитов является электрохимический градиент - разность электрохимического потенциала (Δμχ) по обе стороны биологической мембраны.
Облегчённая диффузия
Для облегчённой диффузии веществ (рис. 2-3) необходимы встроенные в мембрану белковые компоненты (поры, переносчики, каналы). Облегчённая диффузия происходит по градиенту концентрации для неполярных веществ или по электрохимическому градиенту для полярных веществ.
• Поры. По определению, заполненный водой канал поры всегда открыт (рис. 2-4). Поры формируют разные белки (порины, перфорины, аквапорины, коннексины и др.). В некоторых случаях образуются гигантские комплексы (например, ядерные поры), состоящие из множества разных белков.
• Переносчики (транспортёры) осуществляют транспорт через биологические мембраны множества различных ионов (Na+, Cl-, H+, HCO3- и др.) и органических веществ (глюкоза, аминокислоты, креатин, норадреналин, фолаты, лактат, пируват и др.). Транс- портёры специфичны: каждый конкретный переносчик переносит через липидный бислой, как правило и по преимуществу, одно вещество. Различают однонаправленный (унипорт), сочетанный
(симпорт) и разнонаправленный (антипорт) транспорт (рис. 2-5). Вторичный активный транспорт. Переносчики, реализующие как сочетанный (симпорт), так и разнонаправленный (антипорт) трансмембранный перенос с точки зрения энергетических затрат функционируют так, что энергия, накапливающаяся при переносе одного вещества (обычно Na+), затрачивается на транспорт другого вещества. Такой тип трансмембранного переноса называют вторичным активным транспортом (см. ниже).
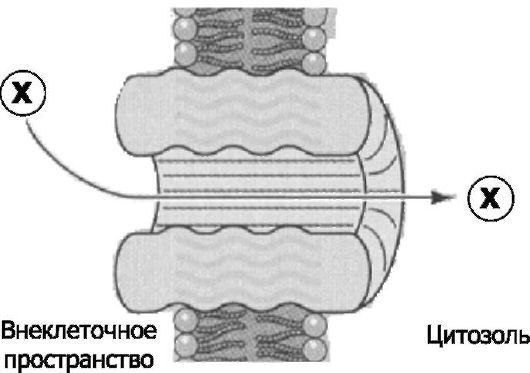 Рис. 2-4. Пора в плазмолемме [2].
Канал поры всегда открыт, поэтому химическое вещество Х проходит через
мембрану по градиенту его концентрации или (если вещество Х заряжено) по
электрохимическому градиенту. В данном случае происходит перемещение
вещества Х из внеклеточного пространства в цитозоль
Рис. 2-4. Пора в плазмолемме [2].
Канал поры всегда открыт, поэтому химическое вещество Х проходит через
мембрану по градиенту его концентрации или (если вещество Х заряжено) по
электрохимическому градиенту. В данном случае происходит перемещение
вещества Х из внеклеточного пространства в цитозоль
Ионные каналы состоят из связанных между собой белковых СЕ, формирующих в мембране гидрофильную пору (рис. 2-6). Через открытую пору по электрохимическому градиенту диффундируют ионы. Свойства ионных каналов (в том числе специфичность и проводимость) определяют как аминокислотная последовательность конкретного полипептида, так и конформационные изменения, происходящие с разными частями полипептидов в составе интегрального белка канала.
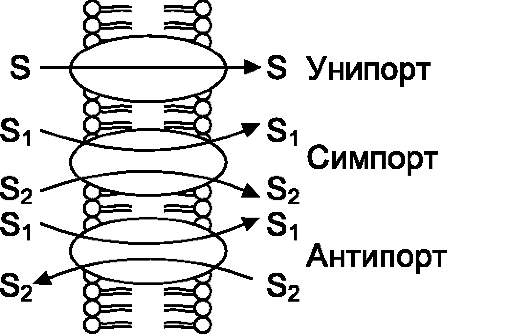 Рис. 2-5. Модель вариантов трансмембранного переноса разных молекул [9]
Рис. 2-5. Модель вариантов трансмембранного переноса разных молекул [9]
Специфичность. Ионные каналы специфичны (селективны) по отношению к конкретным катионам и анионам (например, для Na+ (натриевый канал), K+ (калиевый канал), Ca2+ (кальциевый канал), Cl- (хлорный канал) и др.).
Проводимость определяется количеством ионов, способных пройти через канал в единицу времени. Проводимость канала изменяется в зависимости от того, открыт канал или закрыт. Ворота. Канал может находиться либо в открытом, либо в закрытом состоянии (рис. 2-7). Поэтому модель канала предусматривает наличие устройства, открывающего и закрывающе-
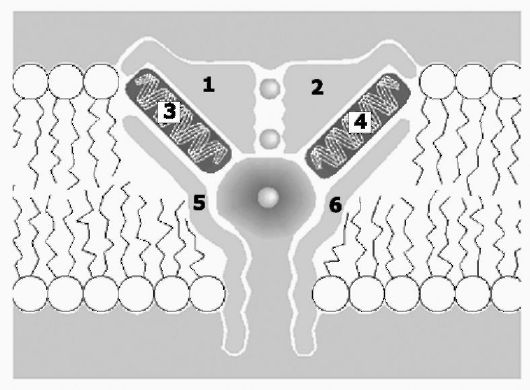 Рис. 2-6. Модель калиевого канала. Интегральный
белок (на рисунке цифрами помечены фрагменты белка) пронизывает всю
толщу липидного бислоя, формируя заполненную водой пору канала (на
рисунке в канале видны 3 иона калия, нижний из ионов находится в полости
поры)
Рис. 2-6. Модель калиевого канала. Интегральный
белок (на рисунке цифрами помечены фрагменты белка) пронизывает всю
толщу липидного бислоя, формируя заполненную водой пору канала (на
рисунке в канале видны 3 иона калия, нижний из ионов находится в полости
поры)
го канал - воротный механизм, или ворота канала (по аналогии с открытыми и закрытыми воротами).
❖ Функциональные компоненты. Помимо ворот, модель ионного канала предусматривает существование таких функциональных компонентов, как сенсор, избирательный фильтр и пора открытого канала.
♦ Сенсор. Каждый канал имеет один (иногда больше) сенсоров к разным типам сигналов: изменениям мембранного потенциала (МП), вторым посредникам (с ци-
топлазматической стороны мембраны), разным лигандам (с внеклеточной стороны мембраны). Эти сигналы регулируют переход между открытым и закрытым состоянием канала. Классификация каналов по чувствительности к разным сигналам. По этому признаку каналы подразделяют на потенциалозависимые, механочувствительные, лиганд-зависимые, рецептор-зависимые, G-белок-зависимые, Са2+-зависимые.
♦ Избирательный фильтр определяет, какие именно типы ионов (анионы или катионы) или конкретные ионы (например, Na+, К+, Ca2+, Cl-) имеют доступ в пору канала.
♦ Пора открытого канала. После приобретения интегральным белком канала конформации, соответствующей открытому состоянию канала, формируется трансмембранная пора, внутри которой перемещаются ионы.
❖ Состояния канала. Благодаря наличию ворот, сенсора, избирательного фильтра и поры ионные каналы могут быть в состояниях покоя, активации и инактивации.
♦ Состояние покоя - канал закрыт, но готов к открытию в ответ на химические, механические или электрические стимулы.
♦ Состояние активации - канал открыт и пропускает ионы.
♦ Состояние инактивации - канал закрыт и не способен к активации. Инактивация возникает тотчас после открытия канала в ответ на действие стимула и длится от нескольких до
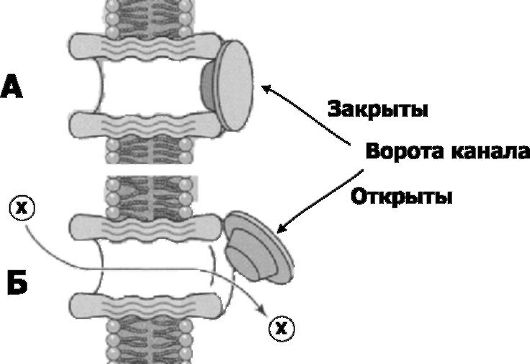 Рис. 2-7. Модель воротного механизма ионного канала [2]. А. Ворота канала закрыты, ион Х не может пройти через мембрану. Б. Ворота канала открыты, ионы Х проходят через мембрану по поре канала
Рис. 2-7. Модель воротного механизма ионного канала [2]. А. Ворота канала закрыты, ион Х не может пройти через мембрану. Б. Ворота канала открыты, ионы Х проходят через мембрану по поре канала
нескольких сотен миллисекунд (в зависимости от типа канала).
❖ Примеры. Наиболее распространённые каналы - для Na+, K+, Ca2+, Cl-, НСО-3.
♦ Натриевые каналы присутствуют практически в любой клетке. Поскольку трансмембранная разность электрохимического потенциала для Na+ (ΔμNa) отрицательна, при открытом состоянии Na+-канала ионы натрия устремляются из межклеточного пространства в цитозоль (слева на рис. 2-8).
■ В электровозбудимых структурах (например, скелетные МВ, кардиомиоциты, ГМК, нейроны) натриевые каналы генерируют ПД, точнее - начальный этап деполяризации мембраны. Потенциаловозбудимые натриевые каналы - гетеродимеры; в их состав входят большая α-субъединица (Mr около 260 кД) и несколько β-субъединиц (Mr 32-38 кД). Свойства канала определяет трансмембранная α-СЕ.
■ В канальцах нефрона и в кишечнике Na+-каналы концентрируются на верхушке эпителиальных клеток, поэтому Na+ входит в эти клетки из просвета и далее поступает в кровь, обеспечивая реабсорбцию натрия в почке и всасывание натрия в ЖКТ.
♦ Калиевые каналы (рис. 2-6) - интегральные мембранные белки; эти каналы обнаружены в плазмолемме всех клеток. Трансмембранная разность электрохимического потенциала для K+ (Δμκ) близка к нулю (или слегка положительна), поэтому при открытом состоянии К+-канала ионы калия перемещаются из цитозоля во внеклеточное пространство («утечка» калия из клетки, справа на рис. 2-8). Функции К+-каналов: поддержание МП покоя (отрицателен по внутренней поверхности мембраны), регуляция объёма клетки, участие в завершении ПД, модуляция электрической возбудимости нервных и мышечных структур, секреция инсулина из β-клеток островков Лангерханса.
♦ Кальциевые каналы - белковые комплексы, состоящие из нескольких СЕ (αχ, α2, β, γ, δ). Поскольку трансмембранная разность электрохимического потенциала для Ca2+ (ΔμCa) существенно отрицательна, то при открытом состоянии Ca2+-канала ионы кальция устремляются из внутриклеточных мембранных «депо кальция» и межклеточного пространства в цитозоль. При активации каналов происходит деполяризация мембраны, а также взаимодействие лигандов с их рецепторами. Ca2+-каналы подразделяют на потенциалоза-
висимые и на управляемые рецепторами (например, адренергическими).
♦ Анионные каналы. Многие клетки содержат разные типы анионоселективных каналов, через которые происходит пассивный транспорт Cl- и в меньшей степени - НСО-3. Поскольку трансмембранная разность электрохимического потенциала для Cl- (Δμα) умеренно отрицательна, при открытом анионном канале ионы хлора диффундируют из цитозоля в межклеточное пространство (справа на рис. 2-8).
Активный транспорт
Активный транспорт - энергозависимый трансмембранный перенос против электрохимического градиента. Различают первичный
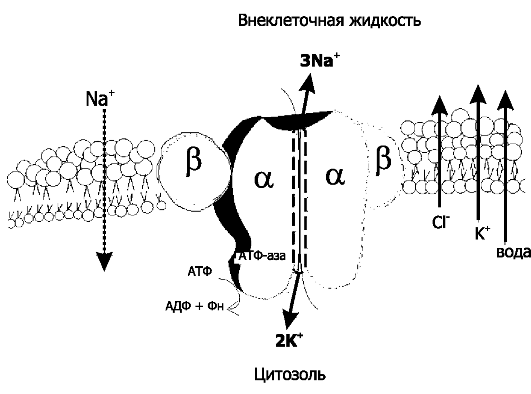
Рис. 2-8. Na+,K+-насос [7]. Модель ?+,К+-АТФазы, встроенной в плазматическую мембрану. Na+,К+-насос - интегральный мембранный белок, состоящий из 4 СЕ (формирующие канал 2 каталитические субъединицы α и 2 гликопротеина β).Na+,К+-насос осуществляет транспорт катионов против электрохимического градиента (μχ) - транспортирует Na+ из клетки в обмен на К+ (при гидролизе одной молекулы АТФ 3 иона Na+ выкачиваются из клетки, и 2 иона К+ закачиваются в неё). Слева и справа от насоса при помощи стрелок показаны направления трансмембранного потока ионов и воды в клетку (Na+) и из клетки (К+, Cl- и вода) в силу различий их
 и вторичный активный транспорт. Первичный активный транспорт осуществляют насосы (различные АТФазы), вторичный - симпор- тёры (сочетанный однонаправленный транспорт) и антипортёры (встречный разнонаправленный транспорт).
и вторичный активный транспорт. Первичный активный транспорт осуществляют насосы (различные АТФазы), вторичный - симпор- тёры (сочетанный однонаправленный транспорт) и антипортёры (встречный разнонаправленный транспорт).
• Первичный активный транспорт обеспечивают следующие насосы - натрий, калиевые АТФазы, протонные и калиевые АТФазы, Са2+-транспортирующие АТФазы, митохондриальные АТФазы, лизосомальные протонные насосы и др.
❖ Натрий, калиевая АТФаза (рис. 2-8) регулирует трансмембранные потоки основных катионов (Na+, К+) и опосредованно - воды (что поддерживает постоянный объём клетки), обеспечиваетNa+-связанный трансмембранный перенос (симпорт и антипорт) множества органических и неорганических молекул, участвует в создании МП покоя и генерации ПД нервных и мышечных элементов.
❖ Протонная и калиевая АТФаза (Н+,К+-насос). При помощи этого фермента париетальные клетки желёз слизистой оболочки желудка участвуют в образовании соляной кислоты (электронейтральный обмен 2 внеклеточных ионов К+ на 2 внутриклеточных иона Н+ при гидролизе одной молекулы АТФ).
❖ Са2+-транспортирующие АТФазы (Са2+-АТФазы) выкачивают ионы кальция из цитоплазмы в обмен на протоны против значительного электрохимического градиента Са2+.
♦ Митохондриальная АТФаза типа F (F0F1) - АТФ-синтаза внутренней мембраны митохондрий - катализируют конечный этап синтеза АТФ. Кристы митохондрий содержат АТФсинтазу, сопрягающую окисление в цикле Кребса и фосфорилирование АДФ до АТФ. АТФ синтезируется при обратном токе протонов в матрикс через канал в АТФ-синтезирующем комплексе (так называемое хемиосмотическое сопряжение).
♦ Лизосомальные протонные насосы (Н+-АТФазы типа V (от Vesicular)), встроенные в мембраны, окружающие лизосомы (также комплекс Гольджи и секреторные пузырьки), транспортируют Н+ из цитозоля в эти мембранные органеллы. В результате в них понижается значение pH, что оптимизирует функции этих структур.
• Вторичный активный транспорт. Известны 2 формы активного вторичного транспорта: сочетанный (симпорт) и встречный (антипорт) (см. рис. 2-5).
❖ Симпорт реализуют интегральные мембранные белки. Перенос вещества Х против его электрохимического градиента (μχ) в
большинстве случаев происходит за счёт поступления в цитозоль из межклеточного пространства по градиенту диффузии ионов натрия (т.е. за счёт ΔμNa), а в ряде случаев - за счёт поступления в цитозоль из межклеточного пространства по градиенту диффузии протонов (т.е. за счёт ΔμΗ). В итоге и ионы (Na+ или Н+), и вещество Х (например, глюкоза, аминокислоты, неорганические анионы, ионы калия и хлора) перемещаются из межклеточного вещества в цитозоль.
❖ Антипорт (встречный, или обменный транспорт), как правило, перемещает анионы в обмен на анионы и катионы в обмен на катионы. Движущая сила обменника формируется за счёт поступления в клетку Na+.
Поддержание внутриклеточного ионного гомеостаза
Избирательная проницаемость биологических мембран, осуществляемая при помощи пассивного транспорта, облегчённой диффузии и активного транспорта, направлена на поддержание важных для функционирования клеток параметров ионного гомеостаза [Na+], [К+], [Ca2+] и других ионов, а также pH ([Н+]) и воды (табл. 2-1) и множества других химических соединений.
• Гомеостаз [Na+] и [K+] подразумевает поддержание асимметричного и значительного трансмембранного градиента этих катионов, обеспечивает электрическую поляризацию клеточных мембран, а также накопление энергии для трансмембранного переноса разных химических веществ.
❖ Значительный и асимметричный трансмембранный градиент. Для
[Na+] и [К+] характерен значительный и асимметричный транс- Таблица 2-1. Концентрация веществ (ммоль/л) в цитозоле и вне
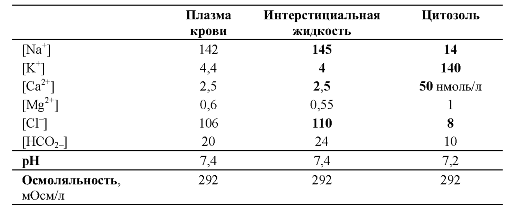 мембранный градиент этих катионов: внеклеточная [Na+] примерно в 10 раз выше [Na+] цитозоля, тогда как внутриклеточная [К+] примерно в 30 раз выше внеклеточной [К+]. Поддержание этого градиента почти полностью обеспечивает Na+,К+-АТФаза (рис. 2-8).
мембранный градиент этих катионов: внеклеточная [Na+] примерно в 10 раз выше [Na+] цитозоля, тогда как внутриклеточная [К+] примерно в 30 раз выше внеклеточной [К+]. Поддержание этого градиента почти полностью обеспечивает Na+,К+-АТФаза (рис. 2-8).
❖ Поляризация мембраны. Na+,К+-насос обладает электрогенностью: его работа приводит к поддержанию мембранного потенциала (МП), т.е. положительного заряда наружной (внеклеточной) поверхности мембраны и отрицательного заряда внутренней (внутриклеточной) поверхности мембраны. Величина заряда (Vm), измеренная на внутренней поверхности мембраны, составляет около -60 мВ.
❖ Трансмембранный электрохимический градиент Na+, направленный внутрь клетки, способствует пассивному входу Na+ в цитозоль и - главное! - накоплению при этом энергии. Именно эту энергию клетки используют для решения ряда важных задач - обеспечения вторичного активного транспорта и трансклеточного переноса, а в возбудимых клетках - генерации потенциала действия (ПД).
♦ Трансклеточный перенос. В эпителиальных клетках, образующих стенку разных трубок и полостей (например, канальцев нефрона, тонкого кишечника, серозных полостей и др.), на верхушечной поверхности эпителия расположены Na+- каналы, а в плазмолемму базальной поверхности клеток вмонтированы Na+,К+-насосы. Такая асимметрия расположения Na+-каналов и Na+-насосов позволяет перекачивать ионы натрия сквозь клетку, т.е. из просвета канальцев и полостей во внутреннюю среду организма.
♦ Потенциал действия (ПД). В электровозбудимых клеточных элементах (нейроны, кардиомиоциты, скелетные МВ, ГМК) пассивный вход Na+ в цитозоль через потенциалозависимые Na+-каналы критичен для генерации ПД (подробнее см. в главе 5).
• Гомеостаз [Ca2+]. Поскольку Са2+ цитозоля выступает в качестве второго (внутриклеточного) посредника, регулирующего множество функций, то [Ca2+] в цитозоле клетки в состоянии покоя минимальна (<100 нМ, или 10-7 M). В то же время внеклеточная [Ca2+] около 1 мМ (10-3 M). Таким образом, разница трансмембранного электрохимического градиента для Ca2+ (ΔμCa) гигантская - 4 порядка величины μCa! Другими словами, между цитозолем и внеклеточной средой (а также между цитозолем и внутриклеточными депо кальция, в первую очередь - цистерна-
ми эндоплазматической сети) существует весьма значительный трансмембранный градиент Ca2+. Именно поэтому поступление Ca2+ в цитозоль происходит практически мгновенно: в виде «выброса» Ca2+ из кальциевых депо или «вброса» Ca2+ из межклеточного пространства. Поддержание столь низкой [Ca2+] в цитозоле поддерживают Са2+-АТФазы, Na+-Ca2+-обменники и Ca2+-бу- ферные внутриклеточные системы (митохондрий и Ca2+-связы- вающие белки).
• Гомеостаз [Cl-]. Во всех клетках [Cl-] в цитозоле примерно в 10 раз меньше [Cl-] вне клетки. Эту ситуацию поддерживают анионные каналы (Cl- пассивно проходит в цитозоль), Na/К/О- котранспортёр и C^-HCO^-обменник (Cl- поступает в клетку), а также К/Cl-котранспортёр (выход К+ и Cl- из клетки).
• pH. Для поддержания pH существенна [Н+], а также [НСО-3] и PCO2. Внеклеточное значение pH составляет 7,4 (при [НСО-3] около 24 мМ и PCO2 примерно 40 мм рт.ст.). В то же время внутриклеточное значение pH равно 7,2 (сдвинуто в кислую сторону, при этом [CO2] одинаково по обе стороны мембраны, а вычисленное значение [НСО-3] должно составить около 16 мМ, тогда как реально составляет 10 мМ). Следовательно, клетка должна иметь системы, выбрасывающие из неё Н+ или захватывающие НСО-3. К таким системам относятся ?+-Н+-обменник, Na+- Cl--HCO-3-обменник и Na+-HCO-3-котранспортёр. Все перечисленные транспортные системы чувствительны к изменениям pH: они активируются при закислении цитозоля и блокируются при сдвиге внутриклеточного pH в щелочную сторону.
Транспорт воды и поддержание клеточного объёма
По определению, сама по себе полупроницаемая мембрана (а ею и является биологическая мембрана) не проницаема для воды. Более того, трансмембранный перенос воды - всегда пассивный процесс (через водные аквапориновые каналы как раз и происходит простая диффузия воды, но никаких специальных насосов для активного транспорта воды не обнаружено), осуществляемый через трансмембранные поры и каналы в составе других переносчиков и насосов. Тем не менее распределение воды между клеточными компартментами, цитозолем и органоидами клетки, между клеткой и интерстициальной жидкостью и её транспорт через биологические мембраны имеет огромное значение для гомеостаза клеток (в том числе для регулирования их объёма). Поток воды через биологические мембраны (осмос) определяет разность осмотического и гидростатического давлений по обе стороны мембраны.
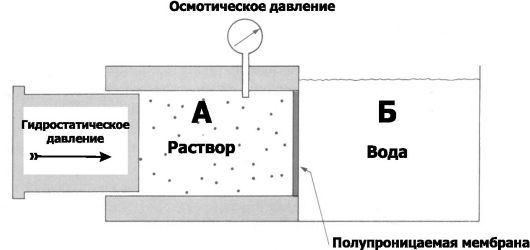 Рис. 2-9. Осмотическое давление [4].
Полупроницаемая мембрана разделяет отсеки А (раствор) и Б (вода).
Осмотическое давление раствора измеряют в отсеке А. На раствор в отсеке А
действует гидростатическое давление. При равенстве осмотического и
гидростатического давлений устанавливается равновесие (вода не проникает
через полупроницаемую мембрану). Осмотическое давление (π) описывает
уравнение Вант Гоффа
Рис. 2-9. Осмотическое давление [4].
Полупроницаемая мембрана разделяет отсеки А (раствор) и Б (вода).
Осмотическое давление раствора измеряют в отсеке А. На раствор в отсеке А
действует гидростатическое давление. При равенстве осмотического и
гидростатического давлений устанавливается равновесие (вода не проникает
через полупроницаемую мембрану). Осмотическое давление (π) описывает
уравнение Вант Гоффа
• Осмос - поток воды через полупроницаемую мембрану из компартмента с меньшей концентрацией растворённых в воде веществ в компартмент с большей их концентрацией. Другими словами, вода перетекает оттуда, где её химический потенциал (Δμ) выше, туда, где её химический потенциал ниже, так как наличие раство- рённых в воде веществ уменьшает химический потенциал воды.
• Осмотическое давление (рис. 2-9) определяют как давление раствора, прекращающее его разведение водой через полупроницаемую мембрану. Численно осмотическое давление при равновесном состоянии (вода перестала проникать через полупроницаемую мембрану) равно гидростатическому давлению.
• Осмотический коэффициент (Φ). Значение Φ для электролитов в физиологических концентрациях обычно менее 1 и по мере разведения раствора Φ приближается к 1.
• Осмоляльность. Термины «осмоль» и «осмоляльность» - внесистемные единицы. Осмоль (Осм) - молекулярная масса раство- рённого вещества в граммах, делённая на число ионов или частиц, на которые оно диссоциирует в растворе. Осмоляльность (осмотическая концентрация) - степень концентрации раствора, выраженная в осмолях, а осмоляльность раствора (Фк) выражают в осмолях на литр (i - количество ионов, образующихся в растворе при диссоциации вещества, с - молярная концентрация вещества (в молях растворённого вещества в 1 л раствора)).
• Осмотичность растворов. В зависимости от осмоляльности растворы могут быть изоосмотическими, гипер- и гипоосмотическими. Оценка осмотичности растворов (или цитозоля и межклеточной жидкости) имеет смысл только при сравнении двух растворов (например, А и Б, цитозоля и межклеточной жидкости, инфузионных растворов и крови). В частности, вне зависимости от осмоляльности двух растворов между ними происходит осмотическое перемещение воды до достижения равновесного состояния. Такая осмотичность известна как эффективная осмотичность (тоничность для раствора электролитов).
Изоосмотический раствор А: осмотическое давление растворов А и Б одинаково.
Гипоосмотический раствор А: осмотическое давление раствора А меньше осмотического давления раствора Б. Гиперосмотический раствор А: осмотическое давление раствора А больше осмотического давления раствора Б.
• Кинетика транспорта воды через мембрану линейна, не насыщаема и является функцией суммы движущих сил транспорта Δμ (вода, сумма) ма), а именно разницы: химического потенциала по обе стор'оны мембраны (Δμ.вода) и разницы гидростатического давления (Δμ давление воды) по обе стороны мембраны.
• Осмотическое набухание и осмотическое сморщивание клеток. Состояние клеток при изменении осмотичности раствора электролита, в котором взвешены клетки, рассмотрено на рис. 2-10.
• Регуляция объёма клеток. На рис. 2-10 рассмотрен простейший случай - взвесь эритроцитов в растворе NaCl. В этом модельном эксперименте in vitro получены такие результаты: если осмотическое давление раствора NaCl увеличивается, то вода покидает клетки путём осмоса, а клетки сморщиваются; если осмотическое давление раствора NaCl уменьшается, вода поступает в клетки, и клетки набухают. Но ситуация in vivo сложнее. В частности, клетки находятся не в растворе единственного электролита (NaCl), а в реальном окружении множества ионов и молекул с разными физико-химическими характеристиками. Так, плазматическая мембрана клеток непроницаема для многих вне- и внутриклеточных веществ (например, белков), а также и потому, что в рассмотренном выше случае не учитывался заряд мембраны. Распределение заряженных частиц по обе стороны мембраны описывает уравнение Гиббса-Доннана.
Заключение. Ниже суммированы данные о регуляции распределения воды между компартментами, разделёнными полупроницаемой мембраной (в том числе между клетками и внеклеточным веществом).
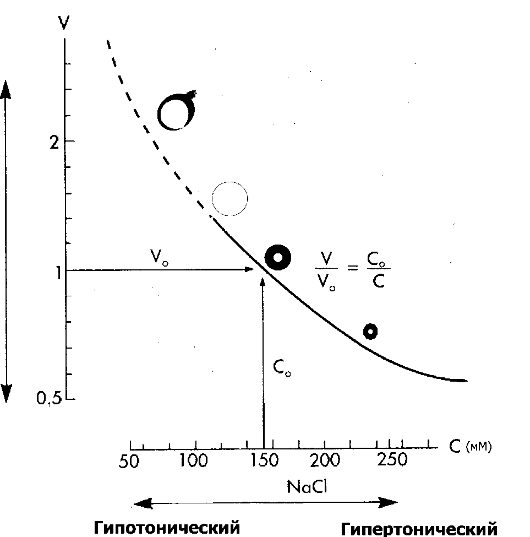 Рис. 2-10. Состояние взвешенных в растворе NaCl эритроцитов [4].
По абсциссе: концентрация (С) NaCl (мМ), по ординате: объём клеток (V).
При концентрации NaCl 154 мМ (308 мМ осмотически активных частиц) объём
клеток такой же, как и в плазме крови (изотоничный эритроцитам раствор NaCl, С0, V0), При увеличении концентрации NaCl (гипертоничный раствор NaCl) вода выходит из эритроцитов, и они сморщиваются. При уменьшении концентрации NaCl (гипотоничный раствор
NaCl) вода входит в эритроциты, и они набухают. При гипотоничности
раствора, примерно в 1,4 превышающей значение изотоничного раствора,
происходит разрушение мембраны (лизис)
Рис. 2-10. Состояние взвешенных в растворе NaCl эритроцитов [4].
По абсциссе: концентрация (С) NaCl (мМ), по ординате: объём клеток (V).
При концентрации NaCl 154 мМ (308 мМ осмотически активных частиц) объём
клеток такой же, как и в плазме крови (изотоничный эритроцитам раствор NaCl, С0, V0), При увеличении концентрации NaCl (гипертоничный раствор NaCl) вода выходит из эритроцитов, и они сморщиваются. При уменьшении концентрации NaCl (гипотоничный раствор
NaCl) вода входит в эритроциты, и они набухают. При гипотоничности
раствора, примерно в 1,4 превышающей значение изотоничного раствора,
происходит разрушение мембраны (лизис)
• Поскольку клетка содержит не проходящие через мембрану отрицательно заряженные белки, доннановские силы приводят к набуханию клетки.
• Клетка реагирует на внеклеточную гиперосмоляльность накоплением в ней органических растворённых веществ.
• Градиент тоничности (эффективная осмоляльность) обеспечивает осмотический ток воды через мембрану.
• Вливание изотоничных солевых и бессолевых растворов (5% глюкозы), а также введение NaCI (эквивалентно изотоничному солевому раствору) увеличивает объём межклеточной жидкости, но имеет разные эффекты на объём клеток и внеклеточную осмоляльность. В нижеследующих примерах все расчёты проведены из следующих на-
чальных значений: вся вода организма - 42 л (60% организма мужчины массой 70 кг), внутриклеточная вода - 25 л (60% всей воды), внеклеточная вода - 17 л (40% всей воды). Осмоляльность внеклеточной жидкости и внутриклеточной воды составляет 290 мОсм.
❖ Изотоничные солевые растворы. Вливание изотоничного солевого раствора (0,9% NaCI) увеличивает объём межклеточной жидкости, но не влияет на объём внутриклеточной жидкости.
❖ Изотоничные бессолевые растворы. Приём 1,5 л воды или вливание изотоничного бессолевого раствора (5% глюкозы) увеличивает как объём межклеточной, так и внутриклеточной жидкости.
❖ Хлорид натрия. Введение в организм NaCI (эквивалентно изотоничному солевому раствору) увеличивает объём межклеточной воды, но уменьшает объём внутриклеточной воды.
❖ Содержание Na+ во всей воде организма определяет объём внеклеточной жидкости, а вся вода организма определяет её осмоляльность.
Мембранный электрогенез
Различная концентрация ионов по обе стороны плазмолеммы всех клеток (см. табл. 2-1) приводит к появлению трансмембранной разности электрического потенциала - Δμ - мембранного потенциала (МП, или Vm).
Мембранный потенциал
• МП покоя - разность электрических потенциалов между внутренней и наружной поверхностью мембраны в состоянии покоя, т.е. при отсутствии электрического или химического раздражителя (сигнала). В состоянии покоя поляризация внутренней поверхности клеточной мембраны имеет отрицательную величину, поэтому значение МП покоя тоже отрицательно.
❖ Величина МП существенно зависит от типа клеток и их размеров. Так, МП покоя плазмолеммы нервных клеток и кардиомиоцитов варьирует от -60 мВ до -90 мВ, плазмолеммы скелетного МВ - -90 мВ, ГМК около -55 мВ, эритроцитов примерно -10 мВ. Изменения величины МП описывают специальные термины: гиперполяризация (увеличение величины МП), деполяризация (уменьшение величины МП), реполяризация (увеличение величины МП после деполяризации).
❖ Природа МП определяется трансмембранными ионными градиентами (формируются непосредственно за счёт состояния ионных каналов, активности переносчиков, а опосредованно за счёт активности насосов, в первую очередь -Na+/К+-АТФазы) и
проводимостью мембраны. Проводимость мембраны для ионов рассчитывают экспериментально. ❖ Трансмембранный ионный ток. Сила тока (I), текущего через мембрану, зависит от концентрации ионов по обе стороны мембраны, МП и проницаемости мембраны для каждого иона. Если мембрана проницаема для K+, Na+, Cl- и других ионов, их суммарный ионный ток является суммой ионного тока каждого из ионов:
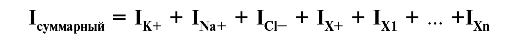 Потенциал действия (ПД) рассмотрен в главе 5.
Потенциал действия (ПД) рассмотрен в главе 5.
Транспортные мембранные пузырьки
• Транспортные процессы клетки происходят не только через полупроницаемую мембрану, но и при помощи транспортных мембранных пузырьков, отделяющихся от плазмолеммы или сливающихся с ней, а также отделяющихся от различных внутриклеточных мембран и сливающихся с ними (рис. 2-11). При помощи таких мембранных пузырьков клетка поглощает из внеклеточной среды воду, ионы, молекулы и частицы (эндоцитоз), выделяет секреторные продукты (экзоцитоз) и осуществляет внутри клетки транспорт между органоидами. Все эти процессы основаны на исключительной лёгкости, с которой в водной фазе фосфолипидный бислой мембран выделяет («отшнуровывает») такие пузырьки (липосомы, суммарно называемые эндосомами) в цитозоль и сливается с ними. В ряде случаев идентифицированы мембранные белки, способствующие слиянию фосфолипидных бислоёв. Эндоцитоз (эндо - внутренний, внутрь + греч. kytos - клетка + греч. osis - состояние, процесс) - поглощение (интернализация) клеткой веществ, частиц и микроорганизмов (рис. 2-11А). Варианты эндоцитоза - пиноцитоз, опосредуемый рецепторами эндоцитоз и фагоцитоз.
❖ Пиноцитоз (греч. pino - пить + греч. kytos - клетка + греч. osis - состояние, процесс) - процесс поглощения жидкости и растворённых веществ с образованием небольших пузырьков. Пиноцитозные пузырьки формируются в специализированных областях плазматической мембраны - окаймлённых ямках (см. на рис. 2-12).
❖ Опосредуемый рецепторами эндоцитоз (рис. 2-12) характеризуется поглощением из внеклеточной жидкости конкретных макромолекул. Ход процесса: связывание лиганда и мембранного рецептора - концентрирование комплекса лиганд-рецептор на поверхности окаймлённой ямки - погружение в клетку внутри
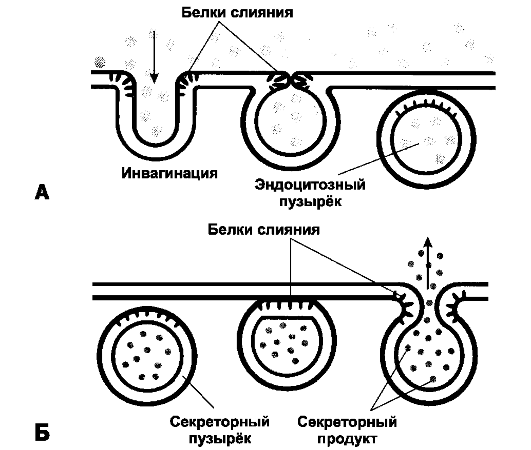 Рис. 2-11. Эндоцитоз (А) и экзоцитоз (Б)
[11]. При эндоцитозе участок плазматической мембраны впячивается и
замыкается. Образуется эндоцитозный пузырёк, содержащий поглощённые
частицы. При экзоцитозе мембрана транспортных или секреторных пузырьков
сливается с плазматической мембраной, и содержимое пузырьков
высвобождается во внеклеточное пространство. В слиянии мембран участвуют
специальные белки
Рис. 2-11. Эндоцитоз (А) и экзоцитоз (Б)
[11]. При эндоцитозе участок плазматической мембраны впячивается и
замыкается. Образуется эндоцитозный пузырёк, содержащий поглощённые
частицы. При экзоцитозе мембрана транспортных или секреторных пузырьков
сливается с плазматической мембраной, и содержимое пузырьков
высвобождается во внеклеточное пространство. В слиянии мембран участвуют
специальные белки
окаймлённого пузырька. Подобным образом клетка поглощает трансферрин, холестерол вместе с ЛПНП и многие другие молекулы.
• ❖ Фагоцитоз (греч. phagein - поедать, пожирать + греч. kytos - клетка + греч. osis - состояние, процесс) - поглощение крупных частиц (например, микроорганизмов или остатков клеток). Фагоцитоз (рис. 2-13) осуществляют специальные клетки - фагоциты (макрофаги, нейтрофильные лейкоциты). В ходе фагоцитоза образуются большие эндоцитозные пузырьки - фагосомы. Фагосомы сливаются с лизосомами и формируют фаголизосомы. Фагоцитоз индуцируют сигналы, воздействующие на рецепторы в плазмолемме фагоцитов. Подобными сигналами служат АТ (также компонент комплемента C3b), опсонизирующие фагоцитируемую частицу (такой фагоцитоз известен как иммунный). Экзоцитоз (экзо - наружный, наружу + греч. kytos - клетка +
греч. osis - состояние, процесс), или секреция - процесс, когда
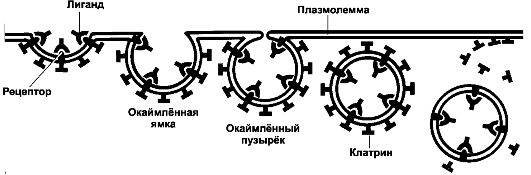 Рис. 2-12. Опосредуемый рецепторами эндоцитоз [11].
Многие внеклеточные макромолекулы (трансферрин, ЛПНП, вирусные частицы и
др.) связываются со своими рецепторами в плазмолемме. Образуются
клатриновые окай- млённые ямки, а затем - окаймлённые пузырьки,
содержащие комплекс лиганд-рецептор. Окаймлённые пузырьки после освобождения от клатрина - эндосома. Внутри эндосом лиганд отщепляется от рецептора
Рис. 2-12. Опосредуемый рецепторами эндоцитоз [11].
Многие внеклеточные макромолекулы (трансферрин, ЛПНП, вирусные частицы и
др.) связываются со своими рецепторами в плазмолемме. Образуются
клатриновые окай- млённые ямки, а затем - окаймлённые пузырьки,
содержащие комплекс лиганд-рецептор. Окаймлённые пузырьки после освобождения от клатрина - эндосома. Внутри эндосом лиганд отщепляется от рецептора
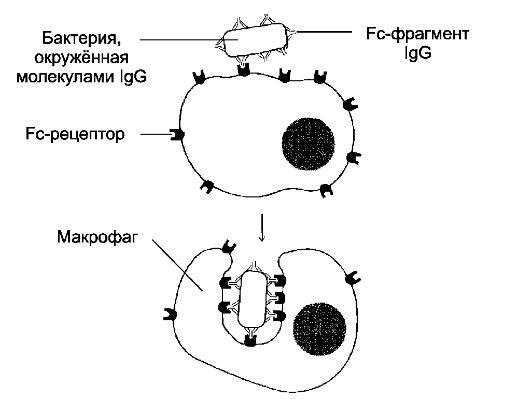 Рис. 2-13. Фагоцитоз [11].
Бактерия, покрытая молекулами IgG, эффективно фагоцитируется макрофагом
или нейтрофилом. Fab- фрагменты IgG связываются с антигенными
детерминантами на поверхности бактерии, после чего те же молекулы IgG
своими Fc- фрагментами взаимодействуют с рецепторами Fc-фрагментов,
расположенными в плазматической мембране фагоцита, и активируют
фагоцитоз
Рис. 2-13. Фагоцитоз [11].
Бактерия, покрытая молекулами IgG, эффективно фагоцитируется макрофагом
или нейтрофилом. Fab- фрагменты IgG связываются с антигенными
детерминантами на поверхности бактерии, после чего те же молекулы IgG
своими Fc- фрагментами взаимодействуют с рецепторами Fc-фрагментов,
расположенными в плазматической мембране фагоцита, и активируют
фагоцитоз
внутриклеточные секреторные пузырьки (например, синаптические) и секреторные пузырьки и гранулы сливаются с плазмолеммой, а их содержимое освобождается из клетки (рис. 2-11Б). Процесс секреции может быть спонтанным и регулируемым.