Нормальная физиология : Учебник. - Р.С. Орлов, А.Д. Ноздрачёв, 2009. - 688 с
|
|
|
|
ГЛАВА 25. ОРГАНЫ ДЫХАНИЯ
Дыхание - газообмен кислорода и углекислого газа между клетками организма и внешней средой состоит из следующих этапов: внешнее дыхание (происходит в органах дыхания), транспорт газов во внутренней среде организма (происходит в крови) и тканевое дыхание.
• Внешнее дыхание - поступление газов (вдох) и отведение воздуха (выдох) из внешней среды по дыхательным путям к респираторному отделу лёгких и двусторонняя диффузия газов через аэрогематический барьер (т.е. между полостью альвеол и просветом кровеносных капилляров межальвеолярных перегородок). Функция внешнего дыхания рассмотрена в этой главе.
• Транспорт газов в крови рассмотрен в главе 24.
• Тканевое дыхание - двусторонняя диффузия газов из просвета кровеносных капилляров к митохондриям клеток внутренних органов - рассмотрено в главах 23 и 24. Термин «тканевое дыхание» имеет и более широкое значение - утилизация O2 в метаболизме клеток, точнее - окислительное фосфорилирование (взрослый человек в состоянии покоя на 1 кг массы в 1 мин потребляет 3,5 мл кислорода).
Внешнее дыхание
Внешнее дыхание - основная функция аппарата дыхания. Помимо функции внешнего дыхания, органы дыхания выполняют множество сопряжённых и дополнительных функций (регуляция КЩР, голосообразование, обоняние (см. главу 12), кондиционирование воздуха), а также эндокринную, метаболическую и иммунологические функции.
• Аппарат дыхания состоит из дыхательных путей, респираторного отдела лёгких, грудной клетки (включая её костно-хрящевой каркас и нервно-мышечную систему), сосудистой системы лёгких, а также нервных центров регуляции дыхания.
• Функция внешнего дыхания - вентиляция и перфузия ткани лёгких. -Ф- Вентиляция лёгких (V) - функция воздухоносных путей.
-Φ- Перфузия респираторного отдела (Q) - важная характеристика функции внешнего дыхания.
Лёгочная вентиляция
Функцию внешнего дыхания осуществляют лёгкие, состоящие из воздухоносных путей и респираторного отдела (респираторная поверхность).
• Воздухоносные пути (рис. 25-1, А): здесь происходит активный перенос воздуха путём конвекции (за счёт разности давлений) из атмосферы к респираторной поверхности и в обратном направлении. Начиная от трахеи, трубки воздухоносных путей разделяются дихотомически (надвое), образуя последовательно бронхи (и бронхиолы): главные - долевые - сегментарные - дольковые - ацинарные (терминальные) - респираторные. Активный перенос воздуха осуществляется за счёт работы дыхательных мышц, обеспечивающих дыхательные движения с частотой (f) от 12 за 1 мин. Другими словами, функция воздухоносных путей - вентиляция лёгких (V) Выдох в норме при спокойном дыхании является пассивным.
-Ф- Вдох (I, от англ. inspiration - инспирация) в покое в среднем продолжается 2 сек. При вдохе дыхательные мышцы нагнетают атмосферный воздух в дыхательные пути, производя работу по преодолению как сопротивления в дыхательных путях, так и сопротивления структур грудной клетки. При вдохе происходит активное увеличение объёма грудной полости и пассивное увеличение объёма лёгких. Часть энергии сокращения мышц при вдохе накапливается в упругих эластических структурах грудной клетки и лёгких.
-Ф- Выдох (E, от англ. expiration - экспирация) в покое в среднем продолжается 3 сек. В состоянии покоя выдох осуществляется пассивно (в том числе за счёт растянутых эластических структур). При нагрузках на организм, когда возрастает потребность в кислороде, необходима дополнительная работа дыхательных мышц. При выдохе происходит уменьшение объёма грудной полости и объёма лёгких.
-Ф- Дыхательные мышцы подразделяют на осуществляющие вдох (инспираторные, мышцы вдоха) и выдох (экспираторные, мышцы выдоха), а инспираторные дыхательные мышцы - на основные и вспомогательные. ♦ Инспираторные мышцы
■ Основные (обеспечивают вдох в состоянии покоя): диафрагма, наружные межрёберные, внутренние межхрящевые. При
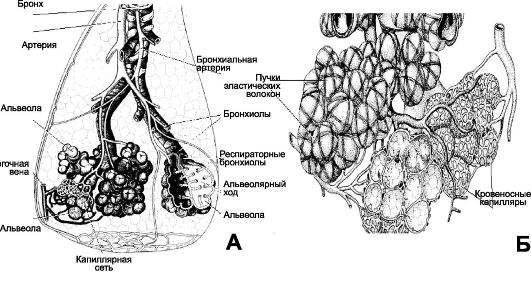 Рис. 25-1. Воздухопроводящий и респираторный отделы лёгкого [11]. А. Схема сосудистого и бронхиального дерева дольки лёгкого. В
верхней части рисунка - воздухоносные пути, в нижней части -
респираторный отдел в виде 2 ацинусов. Ветвления артерий и вен малого
круга кровообращения практически повторяют ход разветвлений
воздухоносных путей. Б. Группа альвеол в составе ацинуса, окружённая кровеносными капиллярами системы малого круга кровообращения и множеством эластических структур.
Рис. 25-1. Воздухопроводящий и респираторный отделы лёгкого [11]. А. Схема сосудистого и бронхиального дерева дольки лёгкого. В
верхней части рисунка - воздухоносные пути, в нижней части -
респираторный отдел в виде 2 ацинусов. Ветвления артерий и вен малого
круга кровообращения практически повторяют ход разветвлений
воздухоносных путей. Б. Группа альвеол в составе ацинуса, окружённая кровеносными капиллярами системы малого круга кровообращения и множеством эластических структур.
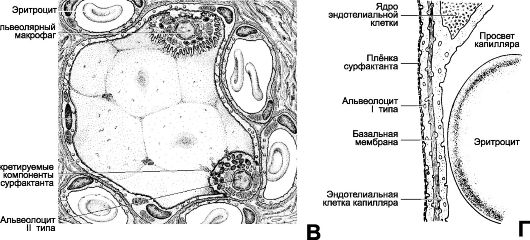 Рис. 25-1. Продолжение. В. Альвеола находится
в окружении 5 срезов через кровеносные капилляры, расположенные в
межальвеолярных перегородках. Поверхность альвеол образована плоскими
клетками (респираторные альвеолоцигы), входящими в состав
аэрогематического барьера. Помимо множества респираторных альвеолоцитов
(альвеолоциты типа I), в стенку альвеолы вмонтированы единичные эпителиальные клетки, синтезирующие компоненты сурфактанта (альвеолоциты типа II), а на поверхности альвеолы находятся альвеолярные макрофаги. Г. Аэрогематический барьер образован
(слева направо, из полости альвеолы до просвета кровеносного капилляра)
плёнкой сурфактанта, респираторным альвеолоцитом, его базальной
мембраной, базальной мембраной эндотелиальной клетки и эндотелиальной
клеткой. Между базальными мембранами альвеолоцита и эндотелия
присутствуют компоненты межклеточного матрикса (в том числе эластические
структуры), но диффузия газов наиболее эффективно происходит именно
через аэрогематический барьер, его толщина в минимальном варианте
составляет около 0,5 мкм
Рис. 25-1. Продолжение. В. Альвеола находится
в окружении 5 срезов через кровеносные капилляры, расположенные в
межальвеолярных перегородках. Поверхность альвеол образована плоскими
клетками (респираторные альвеолоцигы), входящими в состав
аэрогематического барьера. Помимо множества респираторных альвеолоцитов
(альвеолоциты типа I), в стенку альвеолы вмонтированы единичные эпителиальные клетки, синтезирующие компоненты сурфактанта (альвеолоциты типа II), а на поверхности альвеолы находятся альвеолярные макрофаги. Г. Аэрогематический барьер образован
(слева направо, из полости альвеолы до просвета кровеносного капилляра)
плёнкой сурфактанта, респираторным альвеолоцитом, его базальной
мембраной, базальной мембраной эндотелиальной клетки и эндотелиальной
клеткой. Между базальными мембранами альвеолоцита и эндотелия
присутствуют компоненты межклеточного матрикса (в том числе эластические
структуры), но диффузия газов наиболее эффективно происходит именно
через аэрогематический барьер, его толщина в минимальном варианте
составляет около 0,5 мкм
дыхании в состоянии покоя купол диафрагмы смещается вертикально примерно на 2 см, при форсированном дыхании перемещения купола диафрагмы могут достигать 10 см. Таким образом, движения диафрагмы вниз и вверх увеличивают или уменьшают вертикальные размеры грудной полости, а приподнимание или опускание рёбер соответственно увеличивает или уменьшает диаметр грудной клетки в переднезаднем и боковом направлениях.
■ Вспомогательные мышцы (лестничные, грудино-ключичнососцевидные, трапециевидные, большие и малые грудные и ряд других) включаются в обеспечение вдоха при значительных запросах организма к потреблению кислорода.
♦ Экспираторные мышцы: внутренние межрёберные, а также внутренние и наружные косые, прямые и поперечные мышцы живота. При сокращении брюшных мышц возрастает давление в брюшной полости, это приподнимает диафрагму и приводит к уменьшению объёма грудной полости.
♦ Тип дыхания. Изменение объёма грудной клетки у мужчин и женщин происходит преимущественно за счёт перемещений диафрагмы (брюшной, или диафрагмальный тип дыхания). Ранее полагали, что для женщин характерен так называемый грудной (рёберный) тип дыхания, при котором значительный вклад в увеличение объёма грудной клетки вносят сокращения наружных межрёберных мышц.
-Ф- Сопротивление (R). Работа, выполняемая дыхательными мышцами, направлена на преодоление всех видов сопротивления (сопротивление движению воздуха в дыхательньх путях (около 80%), сопротивление тканей, т.е. структур лёгкого и органов грудной и брюшной полостей (около 20%), а также сил гравитации). Различают вязкое (неэластичное) и упругое (эластическое) сопротивление. На долю вязкого сопротивления приходится примерно 60%, упругого - около 40% от всего сопротивления.
♦ Вязкое сопротивление обусловлено аэродинамическим сопротивлением воздухоносных путей (примерно 90% всего вязкого сопротивления) и неэластическими свойствами органов и тканей (около 10%).
■ Аэродинамическое сопротивление воздухоносных путей зависит от характера и скорости потока в просвете путей и от суммарной площади поперечного сечения путей.
■ Характер потока (рис. 25-2) может быть ламинарным, турбулентным или сочетать свойства того и другого (промежуточный тип). Характеристики ламинарного потока описы-
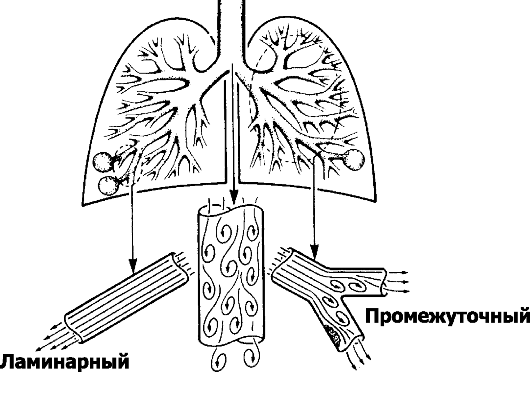
Рис. 25-2. Характер потока в воздухоноснтых путях. Ламинарный поток перемещается спокойно, скорость движения воздуха небольшая, наблюдается в мелких воздухоносных путях. Турбулентность потока возникает при значительной скорости его перемещения (например, в крупных воздухоносных путях) вследствие трения о стенки трубок, в местах изменения конфигурации трубок (сужения, перегибы, разветвления). Промежуточный тип движения наблюдается в крупных и средних бронхах, особенно в местах их разветвлений и сужений
вает закон Пуазейля (поток воздуха - V или объём вдоха [дыхательный объём, см. ниже] - VЕ) прямо пропорционален разности давлений - ΔΡ и обратно пропорционален сопротивлению - R). На практике потоки воздуха измеряют (пневмотахометрия, флоуметрия) при помощи пневмотахометра (флоуметр). ■ Суммарная площадь поперечного сечения воздухоносных путей увеличивается по мере уменьшения калибра трубок. В воздухоносных путях трубки разделяются дихотомически, от трахеи (единственная трубка) до альвеолярных ходов (см. рис. 25-1,А) и альвеол (суммарное количество около 350 млн) начитывают 23 последовательных поколения трубок. Так, на уровне поколения 0 (трахея) суммарная площадь сечения около
2,5 см2, на уровне терминальных бронхиол (поколение 16) - 180 см2, респираторных бронхиол (от 18-го поколения) - около 1000 см2 и далее >10 000 см2. Соответственно резко уменьшается скорость потока. Бронхиолы (трубки без хряща в их стенке) начинаются от 11-го поколения. Начиная с 17- го поколения появляются альвеолы (респираторный отдел лёгкого). Суммарный объём трубок от трахеи до терминальных бронхиол включительно (т.е. трубок, не принимающих участие в газообмене, проводящие воздухоносные пути) составляет анатомически мёртвое пространство (около 150 мл у мужчин, более 125 у женщин). Суммарный объём всех трубок вместе с альвеолами составляет величину около 5800 мл (общая ёмкость лёгких).
♦ Упругое сопротивление определяется эластичностью органов и тканей (в первую очередь эластическими структурами в составе лёгкого, вмонтированными практически во все воздухоносные пути, их особенно много на уровне альвеол) и силами поверхностного натяжения на границе раздела фаз (преимущественно на покрытой сурфактантом поверхности альвеол). На долю эластических структур приходится примерно 40%, на долю поверхностного натяжения около 60% от всего упругого сопротивления.
-Ф- Давление в дыхательном аппарате. При осуществлении дыхательного цикла в альвеолах и во внутриплевральном пространстве лёгких изменяется давление. Наибольшее значение как для осуществления вдоха и выдоха, так и для оценки параметров функции внешнего дыхания имеют альвеолярное (PA), внутриплевральное (PPL) и транспульмональное (PTP) давление (рис. 25-3).
♦ Альвеолярное давление (PA) - давление воздуха внутри лё- гочных альвеол. PA - динамический (изменяющийся) параметр, характеризующий потоки воздуха, зависящий от сопротивления в лёгком и напрямую не контролируемый сознанием.
■ Дыхательная пауза. В состоянии покоя (вне вдоха и выдоха) давление во всех частях дыхательной системы и во всех альвеолах равно атмосферному (PB), то есть PA составляет 0 см водн.ст.; другими словами, движения воздуха нет.
■ Вдох. Во время вдоха PA уменьшается до -1 см водн.ст., и поток воздуха течёт к альвеолам.
■ Выдох. На выдохе PA увеличено до +1 см водн.ст., поток воздуха течёт от альвеол во внешнюю среду.
♦ Внутриплевральное давление (PPL) - давление жидкости в узком пространстве между висцеральной и париетальной плеврой. Зна-
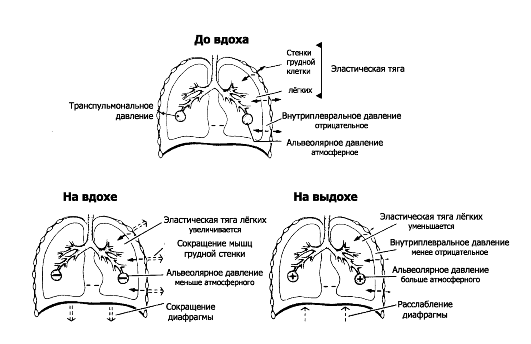 Рис. 25-3. Направления сил в течение дыхательного цикла
Рис. 25-3. Направления сил в течение дыхательного цикла
• чение PPL контролируется мозгом посредством сокращения дыхательных мышц. PPL имеет 2 компонента - статический (-PTP) и динамический (PA). PPL создаётся направленной внутрь эластической тягой лёгких и уравновешивающей её эластической тягой грудной клетки, направленной наружу. PPL в покое составляет -4-5 см водн.ст. (0,3-0,5 кПа). Во время вдоха сила тяги грудной клетки наружу увеличивает отрицательное PPL, доводя его до -7,5 см вод. ст. ♦ Транспульмональное давление (PTP) - разность между альвеолярным и внутриплевральным давлением (PA - PPL). PTP - статический параметр, не влияющий на потоки воздуха и прямо не контролируемый мозгом. Нормально РТ1> составляет на выдохе -3-4 см водн.ст., на вдохе -9-10 см водн.ст., при глубоком вдохе до -20 см водн.ст. Респираторный отдел (см. рис. 25-1, Б-Г): здесь путём диффузии осуществляется перенос газов к респираторной поверхности альвеол и газообмен через аэрогематический барьер (т.е. между полостью альвеол и кровью, находящейся в кровеносных капиллярах межальвеолярных перегородок). Газообмен респираторного отдела в существенной степени зависит от параметров кровотока через капилляры межальвеолярных перегородок, т.е. от их перфузии кровью. Перфузия респираторного отдела (Q) - важная характеристика функции внешнего дыхания.
-Ф- Воздухоносные пути респираторного отдела респираторные бронхиолы - альвеолярные ходы - преддверие - альвеолярные мешочки - полость альвеол) соответствуют поколениям трубок 17- 23 с очень небольшой скоростью потока в них. Другими словами, перемещение газов в них происходит не путём конвекции (как в воздухоносных путях более крупного калибра), а путём диффузии.
-Ф- Альвеолы - полусферические структуры диаметром от 70 мкм до 300 мкм. Суммарная площадь всех альвеол (около 300 млн) от 50 м2 до 100 м2, их максимальный объём от 5 л до 6 л, что составляет не менее 97% объёма лёгких.
-Ф- Аэрогематический барьер. Между полостью альвеолы и просветом капилляра происходит газообмен. Структуры, образующие минимальной толщины аэрогематический барьер: альвеолярные клетки I типа (0,2 мкм), общая базальная мембрана (0,1 мкм), уплощён- ная часть эндотелиальной клетки капилляра (0,2 мкм). В сумме это составляет 0,5 мкм. Реально в состав барьера входят выстилающая альвеолярную поверхность плёнка сурфактанта и межклеточное вещество (интерстиций) между базальными мембранами
альвеолоцитов и капилляров, что увеличивает путь газообмена до нескольких микрометров. -Ф- Сурфактант - эмульсия фосфолипидов, белков и углеводов; 80% составляют глицерофосфолипиды, 10% - холестерол и 10% - белки. Общее количество сурфактанта в лёгких крайне невелико. На 1 м2 альвеолярной поверхности приходится около 50 мм3 сурфактанта. Толщина его плёнки составляет 3% общей толщины аэрогематического барьера. Эмульсия образует на поверхности альвеол мономолекулярный слой. Главный поверхностно-активный компонент сурфактанта - дипальмитоилфосфатидилхолин - ненасыщенный фосфолипид, составляющий более 50% фосфолипидов сурфактанта. Сурфактант содержит ряд уникальных белков, способствующих адсорбции дипальмитоилфосфатидилхолина на границе двух фаз. Среди белков сурфактанта выделяют SP-A, SP-B, SP-C, SP-D. Белки SP-B, SP-C и глицерофосфолипиды сурфактанта ответственны за уменьшение поверхностного натяжения на границе воздух-жидкость. Белки SP-A и SP-D участвуют в местных иммунных реакциях, опосредуя фагоцитоз. Рецепторы SP-A имеются в альвеолоцитах II типа и в макрофагах.
♦ Поверхностное натяжение (T) окружённого водой пузырька газа радиусом r стремится уменьшить объём газа в пузырьке и увеличить его давление (P). Состояние равновесия между действующими силами описывает уравнение Лапласа:
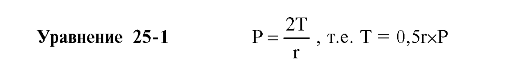 ♦ T
альвеол без сурфактанта примерно равно 50 дин/см, T альвеол с
нормальным количеством сурфактанта на их поверхности колеблется от 5 до
30 дин/см.
♦ T
альвеол без сурфактанта примерно равно 50 дин/см, T альвеол с
нормальным количеством сурфактанта на их поверхности колеблется от 5 до
30 дин/см.
♦ Сурфактант необходим для начала дыхания при рождении ребенка. До рождения лёгкие находятся в спавшемся состоянии. Ребёнок после рождения делает несколько сильных дыхательных движений, лёгкие расправляются, а сурфактант удерживает их от спадения (коллапса). Недостаток или дефекты сурфактанта вызывают тяжёлое заболевание (синдром дыхательного дистресса). Поверхностное натяжение в лёгких у таких детей высокое, поэтому многие альвеолы находятся в спавшемся состоянии.
-Ф- Кровоснабжение лёгких осуществляется из двух источников - лёгочных артерий лёгочного ствола, начинающегося от правого
желудочка (малый круг кровообращения) и бронхиальных артерий (ветви грудной части аорты, большой круг кровообращения).
♦ Лёгочные артерии содержат дезоксигенированную венозную кровь, их разветвления следуют вместе с разветвлениями воздухоносных путей и распадаются на капилляры межальвеолярных перегородок. После газообмена кровь собирается в бассейн лёгочных вен.
♦ Бронхиальные артерии содержат оксигенированную кровь, кровоснабжают по преимуществу проводящие воздухоносные пути. Венозная кровь оттекает в бассейн лёгочных вен и в значительно меньшей степени в непарную вену.
Оценка функции внешнего дыхания
Для характеристики функции внешнего дыхания применяют значительное количество показателей, позволяющих оценивать разные стороны вентиляции лёгких и перфузии респираторного отдела (в том числе при обструктивных и рестриктивных заболеваниях лёг- ких). При исследовании функции внешнего дыхания изучают лёгоч- ные объёмы и ёмкости (V), объёмные скорости потока (V) и диффузионную ёмкость (D).
• Лёгочные объёмы (V) определяют с помощью спирометра. Ряд параметров спирограммы выражают в относительных величинах (%%), диапазоном нормы считают 80-120%. Для оценки лёгочной вентиляции используют значения нижерассмотренных 4 статичных легочных объёмов (рис. 25-4): дыхательного объёма, резервного объёма вдоха, резервного объёма выдоха и остаточного объёма лёгкого. -Ф- Дыхательный объём (ДО; VE, или VT - tidal volume) - объём воздуха, поступающий в лёгкие за один вдох или выходящий из лёгких при последующем выдохе при спокойном дыхании (норма 0,4-0,5 л, у детей - 3-5 мл/кг). Поскольку организм потребляет больше O2 (~250 мл/мин), чем образует CO2 (~200 мл/ мин), объём воздуха на вдохе примерно на 4% больше объёма воздуха на выдохе. Поэтому для более точных исследований измеряют объём выдоха - expired lung volume (VE).
♦ Альвеолярный объём (АО, VA) - часть ДО (VE), участвующая в газообмене.
♦ Анатомически мёртвое пространство - часть пространства дыхательных путей, заполненная воздухом, не участвующим в газообмене - остаток от (ДО - АО [VE - VA]) - примерно 30% от ДО (VE), около 155 мл.
-Φ- Резервный объём вдоха (РОвд; IRV - inspiratory reserve volume) - дополнительный объём воздуха (1,9-2,5 л), который можно вдохнуть после нормального вдоха.
^ Резервный объём выдоха (РОвыд; ERV - expiratory reserve volume) - дополнительный объём воздуха (1,1-1,5 л), который можно выдохнуть после окончания нормального выдоха.
^ Остаточный объём лёгкого (ООЛ; RV - residual volume) - объём воздуха (1,5-1,9 л), остающийся в лёгких после максимального выдоха.
• Лёгочные ёмкости (рис. 25-4) являются суммой двух или более лё- гочных объёмов.
^ Ёмкость вдоха (Евд; IC - inspiratory capacity - Евд = ДО + Ровд) равна сумме дыхательного объёма (ДО [VE]) и резервного объёма вдоха (Ровд [IRV]) - количество воздуха, которое можно максимально вдохнуть после нормального выдоха. Е составляет 2,3- 3,0 л.
Функциональная остаточная ёмкость (ФОЕ; FRC - functional residual capacity) - объём воздуха, остающийся в лёгких в конце нормального выдоха (около 2,5 л): ФОЕ = ООЛ + РОВЫД. (FRC = ERV + RV). ФОЕ (FRC) в норме составляет 2,6-3,4 л. Жизненная ёмкость лёгких (ЖЕЛ, VC - vital capacity) равна сумме дытательного объёма (ДО [VE]), резервного объёма вдоха (РОвд [IRV])
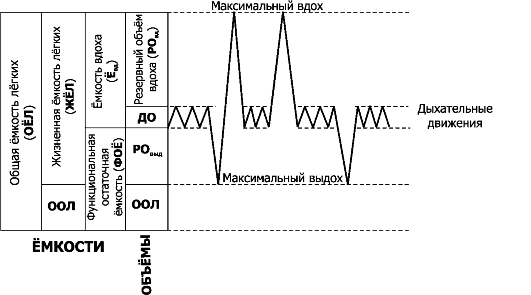 Рис. 25-4. Спирограмма лёгочных объёмов и ёмкостей [21]. Справа показана запись нескольких дыхательных движений с различной глубиной вдоха и выдоха, влево от записи дыхательных движении (первая колонка) названы разные лёгочные объёмы. ДО - дыхательный объём, РОвыд - резервный объём выдоха, ООЛ - остаточный объём лёгких. Левые 3 колонки - названия разных ёмкостей
Рис. 25-4. Спирограмма лёгочных объёмов и ёмкостей [21]. Справа показана запись нескольких дыхательных движений с различной глубиной вдоха и выдоха, влево от записи дыхательных движении (первая колонка) названы разные лёгочные объёмы. ДО - дыхательный объём, РОвыд - резервный объём выдоха, ООЛ - остаточный объём лёгких. Левые 3 колонки - названия разных ёмкостей
и резервного объёма выдоха (РО [ERV]). Это максимальный объём воздуха (от 3,4 л до 4,5 л), изгоняемый из лёгких вслед за максимальным вдохом: ЖЕЛ = ДО + РО + РОвыд (VC = VE + IRV +
ERV).
-Φ- Форсированная жизненная ёмкость лёгких - ФЖЕЛ (forced vital capacity - FVC), 4,6 л) - аналогична ЖЕЛ (VC) при максимально возможном вдохе и выдохе с максимальной силой и скоростью (см. ниже «Динамические лёгочные объёмы и ёмкости»).
-Ф- Общая ёмкость лёгких (ОЕЛ, TLC - total lung capacity) - максимальный объём воздуха (от 4,9 л до 6,4 л), находящийся в лёгких после максимального вдоха - равна сумме жизненной ёмкости лёгких - ЖЕЛ (VC) и остаточного объёма лёгких -
ООЛ (RV).
Отношение остаточного объёма лёгкого к общей ёмкости лёгких -
• ООЛ/ОЕЛ (RV/TLC) в норме <0,25. Увеличение этого показателя вследствие увеличения ООЛ (RV) происходит при обструктивных заболеваниях, а вследствие уменьшения ОЕЛ (TLC) - при рестриктивных заболеваниях. -ФВышеперечисленные статические лёгочные объёмы и ёмкости отражают эластические свойства лёгких и грудной клетки. Динамические лёгочные объёмы и ёмкости отражают проходимость дыхательных путей. Получение некоторых из нижеперечисленных показателей требует применения не только спирометрии, но и других подходов (например, теста с разведением гелия). -Ф- Минутный объём дыхания (МОД, VE) - количество воздуха, проходящего через воздухоносные пути каждую минуту. МОД равен дыхательному объёму (ДО), умноженному на частоту дыхательных движений в минуту (ЧДД): МОД = ДОхЧДД (VE = VTxf). Так как ДО (VT) в норме составляет примерно 0,5 л, а нормальная ЧДД (f) от 12 до 15 в минуту, то МОД составляет 6- 8 л/мин.
-Ф- Максимальная вентиляция лёгких (МВЛ) - максимальное количество воздуха, которое может быть провентилировано через лёг- кие за 1 мин - произведение частоты дыхательных движений - ЧДД (f) на ёмкость вдоха - Евд (IC): МВЛ = ЧДДхЕвд (fxIC). Средние значения МВЛ у мужчин - 140 л/мин, у женщин - 130 л/мин.
-Φ- Объём форсированного выдоха за 1 с (ОФВ1, FEV1 - forcedexpiratory volume in one second) - объём воздуха, изгоняемый с максимальным усилием из лёгких в течение первой секунды выдоха после глубокого вдоха; т.е. часть ФЖЕЛ (FVC), выдыхаемая за первую секунду. Прежде всего ОФВ1 (FEV1) отражает
состояние крупных дыхательных путей и часто выражается в процентах от жизненной ёмкости лёгких (ЖЕЛ, VC). Нормальное значение ОФВ1 (FEV1) = 75% ЖЕЛ (VC).
❖ Индекс Тиффно - отношение объёма форсированного выдоха за 1 с (ОФВ1, FEV1) к жизненной ёмкости лёгких (ЖЕЛ, VC; ОФВ1 часто также выражают в процентах от форсированной жизненной ёмкости лёгких - ФЖЕЛ, FVC). Значение индекса Тиффно прямо пропорциональное силе выдоха и в норме составляет около 80%; значение этого индекса важно для выявления обструктивных нарушений, но также помогает в диагностике рестриктивных расстройств. Снижение ОФВ1 (FEV1) без снижения ФЖЕЛ, т.е. ОФВ1/ФЖЕЛ (FEV1/FVC) <70% свидетельствует об обструкции; снижение обоих показателей (ОФВ1 и ФЖЕЛ, т.е. ОФВ1/ФЖЕЛ >80%) указывает на рестриктивную патологию.
❖ Максимальная объёмная скорость в средней части экспираторного маневра - МОС25%-75% (average mid-maximal expiratory flow - FEF25-75) - скорость потока форсированного выдоха в его середине, т.е. между 25% и 75% ФЖЕЛ (FVC); иначе обозначают как максимальный поток середины выдоха (mid-maximal expiratory flow - MMEF). МОС25%-75% прежде всего отражает состояние мелких дыхательных путей и не зависит от мышечных усилий, этот показатель более информативен, чем ОФВ1 (FEV1) при выявлении ранних обструктивных нарушений.
❖ Пик объёмной скорости выдоха (мощность выдоха, peak expiratory flow rate - PEFR) - максимальная объёмная скорость, которую пациент может развить при форсированном выдохе - показатель проходимости дыхательных путей на уровне трахеи и крупных бронхов. Зависит от мышечного усилия пациента.
❖ Резерв дыхания (РД) характеризует возможность увеличения лё- гочной вентиляции (в норме 85-90%) и рассчитывается по разности максимальной вентиляции лёгких (МВЛ) и минутного объё- ма дыхания (МОД, VE).
• Другие исследования функции лёгких
❖ Диффузионная способность (диффузионная ёмкость, Дс) - показатель эффективности переноса газа из альвеол в лёгочный капиллярный кровоток, отражает состояние альвеолярно-капиллярной мембраны - аэрогематического барьера.
❖ Кривая податливости (растяжимости). Эластичность лёгких (способность растянутого материала возвращаться в исходное нерастянутое положение) определяет соотношение изменений лёгоч- ных объёмов (V) и изменения транспульмонального давления
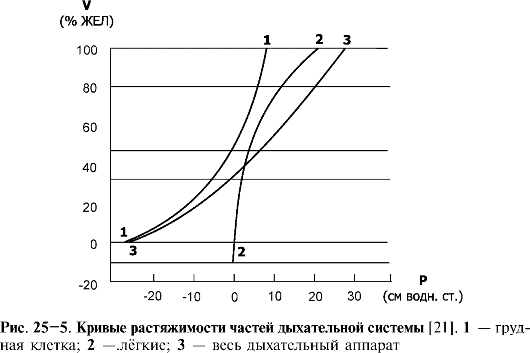 ♦ Кривая «давление-объём». Зависимость
транспульмонального давления от объёма частей дыхательной системы
отображается в виде кривой растяжимости лёгких (рис. 25-5).
♦ Кривая «давление-объём». Зависимость
транспульмонального давления от объёма частей дыхательной системы
отображается в виде кривой растяжимости лёгких (рис. 25-5).
♦ Податливость, или растяжимость (C) - количественный показатель, характеризующий упругие свойства лёгких, определяется по наклону кривых «давление-объём» (P-V) над уровнем дыхательного объёма. Общая податливость обоих лёгких (C) у взрослого человека составляет около 200 мл воздуха на 1 см водн.ст. Это означает, что при увеличении транспульмонального давления (Ртп) на 1 см водн.ст. объём лёгких увеличивается на 200 мл.
♦ Изменения эластической тяги лёгкого имеют обратное влияние на кривую податливости.
❖ Объёмная скорость выдоха - максимальная скорость прохождения воздушного потока в дыхательных путях во время форсированного (максимального) выдоха.
❖ Коэффициент лёгочной вентиляции (КЛВ, в норме 1/7) - отношение дыхательного объёма (ДО, VE,) к сумме объёмов резервного выдоха (РОвыд, ERV) и остаточного объёма воздуха (ООЛ, RV).
Таблица 25-1. Парциальное давление газов (мм рт.ст.) в воздухоносных путях и крови [4]
po2 | pco2 | ph2o | pn2 | p 1 суммарное | |
Вдыхаемый воздух (сухой) | 159 | 0 | 0 | 601 | 760 |
Воздух в бронхах (увлажнённый) | 150 | 0 | 47 | 563 | 760 |
Воздух в альвеолах* | 102 | 40 | 47 | 571 | 760 |
Артериальная кровь | 90 | 40 | 47 | 571 | 760 |
Венозная кровь | 40 | 46 | 47 | 571 | 705** |
* При дыхательном коэффициенте (R) 0,8; ** - суммарное давление газов в венозной крови меньше, чем в артериальной, так как Po2 уменьшено больше, чем увеличено Po2.
Альвеолярная вентиляция
• Газы в альвеолах. В воздухоносные пути извне поступает воздух (смесь газов), содержащий в основном азот и кислород и значительно меньше диоксида углерода, аргона и других инертных газов. Поскольку вдыхаемый воздух увлажняется, парциальное (частичное; при условии, что доля конкретного газа в смеси газов равна 1) давление кислорода (Po2) в воздухоносных путях уменьшается (табл. 25-1).
• Дыхательный коэффициент (R) - отношение Oco2 (скорость поступающего в альвеолы из крови [т.е. образующегося при метабо- лизме] диоксида углерода) к Oo2 (скорость вдыхаемого кислорода). Значение R зависит от преобладания в пище углеводов (практически углеводное питание) или жиров и варьирует от 0,7 до 1,0 (обычно - 0,8).
• Уравнение альвеолярного газа (уравнение идеального альвеолярного кислорода) позволяет рассчитать Po2 (уравнение 25-6) и Pco2 (уравнение 25-7) в полости альвеол:
Уравнение 25-2
Pa02 = P1O2 - (РдС02 +■ R) = (Pb - Ph2o) FjO2 - (Paco2 + R) Уравнение 25-3
PACO2 = FACO2 X (Pb - ph20)'
где Pao2 - Po2 в альвеолах; PjO2 - Po2 вдыхаемого воздуха; Paco2 - Pco2 в альвеолах; R - дъжательный коэффициент; Pb - барометрическое давление; Ph2o - давление водяных паров; FjO2 - доля вдыхаемого кислорода; Faco2 - доля диоксида углерода в полости альвеол.
• Уравнение альвеолярного диоксида углерода позволяет рассчитать альвеолярную вентиляцию (VA):
• 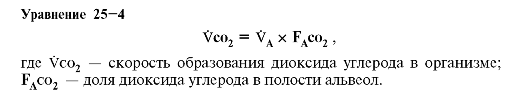 Характеристики альвеолярной вентиляции
Характеристики альвеолярной вентиляции
❖ Альвеолярная и лёгочная вентиляция. В отличие от лёгочной вентиляции, осуществляемой только при вдохе, альвеолярная вентиляция происходит постоянно.
❖ Paco2 и альвеолярная вентиляция Зависимость между альвеолярной вентиляцией и Paco2 обратная и не зависит от выдыхаемого диоксида углерода.
❖ Влияние гравитации. В положении стоя альвеолы в верхушечной части лёгких до начала вдоха расширены больше, чем в нижних долях, так как зависящее от тяжести лёгкого внутриплевральное давление Ppl на верхушке лёгкого меньше, чем в его основании [величина внутриплеврального давления (Ppl) через транспульмональное давление (PTP) определяет величину альвеолярного давления (PA) (Ppl = PA - PTP)]. Поэтому альвеолярная вентиляция больше в верхушечных частях лёгкого
❖ Влияние сопротивления и податливости. В разных ацинусах (в том числе в зависимости от длины ведущих к ним воздухоносных путей) сопротивление и податливость различны, что также определяет различную величину альвеолярной вентиляции:
Уравнение 25-5
τ = RxC,
где τ = постоянная времени; R - сопротивление воздухоносных путей; C - податливость.
Перфузия
Перфузия - процесс, в ходе которого дезоксигенированная кровь лёгочных артерий проходит через лёгкие и оксигенируется. Другими словами, между полостью альвеолы и просветом капилляра межальвеолярных перегородок происходит газообмен путём простой диффузии газов по градиенту их концентрации (в соответствии с законом Фика). В частности, чем меньше структур между полостью альвеолы и просветом капилляра, тем эффективнее диффузия. Диффузионный путь при газообмене оценивают в 0,2-3,0 мкм. Таким образом, для оценки лёгочного газообмена важны характеристики перфузии (Q),
альвеолярной вентиляции (VA), а также вентиляционно-перфузион- ные отношения (VA/Q) .
• Лёгочные артерии (диаметр около 3 см, внутрисосудистое давление от 9 до 24 мм рт.ст.) содержат дезоксигенированную венозную кровь, их разветвления (артерии [их диаметр <200 мкм], артериолы [диаметром от 10 мкм до 200 мкм]) следуют вместе с разветвлениями воздухоносных путей и распадаются на капилляры межальвеолярных перегородок. Эти внутрилёгочные капилляры имеют внутренний диаметр около 8 мкм и длину около 10 мкм (этот отрезок эритроцит проходит примерно за 0,75 с, обмениваясь за это время газами примерно с 2-3 альвеолами). После газообмена кровь собирается в бассейн лёгочных вен (вены - в отличие от артерий - располагаются отдельно от разветвлений воздухоносных путей). -Ф- Общий объём лёгочной циркуляции около 500 мл (10% от всей крови).
-Ф- Лёгочное сосудистое сопротивление. На характеристики лёгочно- го кровотока влияют гравитация (g), альвеолярное давление (PA), градиент артериального и венозного кровотока (Pa - Pv) и лё- гочное сосудистое сопротивление (RPV):
Уравнение 25-6
Rpv = (Ppa - Pla) + qt ,
где Ppa - давление в лёгочной артерии (правом желудочке); Pla - давление в левом предсердии; QT - скорость потока (сердечный выброс).
♦ Нормально RPV составляет 1,0 мм рт.ст./л/мин [(14 мм рт.ст. - 8 мм рт.ст.)/6 л/мин]. Другими словами, сопротивление в малом круге кровообращения примерно на порядок величины меньше, чем в большом круге кровообращения.
Таблица 25-2. Среднее давление в кровеносных сосудах лёгкого взрослого мужчины в положении лёжа на спине [4]
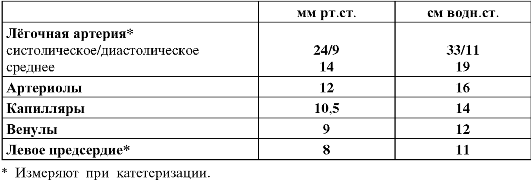 ♦ Малая величина RPV
позволяет значительно увеличить при необходимости перфузию лёгких (в
основном за счёт увеличения внутреннего диаметра сосудов и мобилизации
временно выключенных сосудов, но не за счёт увеличение
внутриартериального давления). ^ Внутрисосудистое давление (табл.
25-2). Диаметр артерий и артериол малого круга кровообращения больше
диаметра сосудов аналогичного калибра в большом круге кровообращения, а
стенка лёгочных сосудов значительно тоньше и податливее, поэтому
сопротивление току крови существенно невелико. Перепад внутрисосудистого
давления между лёгочной артерией и левым желудочком составляет всего 6
мм рт.ст., что облегчает работу правого желудочка по перфузии лёгких. В
то же время это обстоятельство может привести к застою крови в лёгочной
циркуляции с нарушениями фильтрации через стенку капилляров и развитием
отёка лёгкого (см. рис. 25-6).
♦ Малая величина RPV
позволяет значительно увеличить при необходимости перфузию лёгких (в
основном за счёт увеличения внутреннего диаметра сосудов и мобилизации
временно выключенных сосудов, но не за счёт увеличение
внутриартериального давления). ^ Внутрисосудистое давление (табл.
25-2). Диаметр артерий и артериол малого круга кровообращения больше
диаметра сосудов аналогичного калибра в большом круге кровообращения, а
стенка лёгочных сосудов значительно тоньше и податливее, поэтому
сопротивление току крови существенно невелико. Перепад внутрисосудистого
давления между лёгочной артерией и левым желудочком составляет всего 6
мм рт.ст., что облегчает работу правого желудочка по перфузии лёгких. В
то же время это обстоятельство может привести к застою крови в лёгочной
циркуляции с нарушениями фильтрации через стенку капилляров и развитием
отёка лёгкого (см. рис. 25-6).
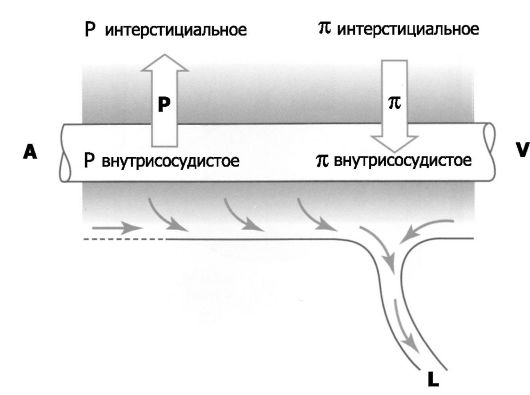 Рис. 25-6. Баланс интерстициальной жидкости межальвеолярных перегородок (иллюстрация
к уравнению Старлинга) [4]. Нормально разные силы, действующие на
содержание жидкости в интерстиции, приводят к фильтрации жидкости из
кровеносных капилляров (A-V). Из интерстиция эта жидкость оттекает по
лимфатическим сосудам (L). A - артериальный конец капилляра; V -
венозный конец капилляра; P - гидростатическое давление; π - коллоидное
осмотическое (онкотическое) давление
Рис. 25-6. Баланс интерстициальной жидкости межальвеолярных перегородок (иллюстрация
к уравнению Старлинга) [4]. Нормально разные силы, действующие на
содержание жидкости в интерстиции, приводят к фильтрации жидкости из
кровеносных капилляров (A-V). Из интерстиция эта жидкость оттекает по
лимфатическим сосудам (L). A - артериальный конец капилляра; V -
венозный конец капилляра; P - гидростатическое давление; π - коллоидное
осмотическое (онкотическое) давление
❖ Капилляры
♦ Объём крови в капиллярах взрослого человека в состоянии покоя около 75 мл (при этом заполнены не все капилляры). При необходимости (например, при физической нагрузке) объём крови, находящейся в лёгочных капиллярах, возрастает до 200 мл (при этом «открываются» дополнительные капилляры).
♦ Суммарная площадь эндотелия кровеносных капилляров оценивается в 70 м2, что примерно совпадает с площадью поверхности альвеол.
♦ Капилляры и PA. Внутриплевральное (PPL) и интерстициальное давление (см. рис. 25-6) не влияют на капиллярный кровоток. В то же время значения альвеолярного давления (PA) существенно важны для состояния капиллярного кровотока, вплоть до его прекращения.
• Лимфоотток. Из интерстициального пространства межальвеолярных перегородок интерстициальная жидкость, образующая за счёт фильтрации из кровеносных капилляров, оттекает не только по лёгочным венам, но и по лимфатическим сосудам (рис. 25-6). Этот объём лимфооттока в норме составляет примерно 30 мл/час.
• Интерстициальная жидкость. На динамичный объём интерстициальной жидкости межальвеолярных перегородок влияет ряд факторов, описываемых уравнением Старлинга:
•  Парциальное давление газов лёгочного
кровотока (см. табл. 25-3), а также pH крови - параметры, важные для
оценки функции лёг- ких. Они указывают на состояние газообмена между
лёгкими и кровью.
Парциальное давление газов лёгочного
кровотока (см. табл. 25-3), а также pH крови - параметры, важные для
оценки функции лёг- ких. Они указывают на состояние газообмена между
лёгкими и кровью.
❖ Po2 при отсутствии патологии снижается с возрастом вследствие утраты лёгкими эластичности (Po2 в норме составляет 90 мм рт.ст. в 20 лет и около 70 мм рт.ст. к 70 годам). Уменьшение Po2 ниже нормы указывает на гипоксемию (пониженное содержание кислорода в крови), но насыщение тканей кислородом существенно не снижается до тех пор, пока Po2 не упадёт ниже 60 мм рт.ст.
❖ Pco2 (в норме 35-45 мм рт.ст.) отражает состояние альвеолярной вентиляции; гиперкапния (высокое Pco2) указывает на гиповентиляцию (пониженную вентиляцию лёгких).
❖ pH (в норме 7,35-7,45). Сопоставление артериального pH с Pco2 помогает отличить респираторные нарушения от метаболических. Так, если рСО2 и pH обратно пропорциональны (один показатель снижается при увеличении другого), кислотно-щелочной дисбаланс (см. главу 29) имеет респираторную природу.
• Перфузия и гравитация. Поскольку значения лёгочного сосудистого сопротивления и внутрисосудистого давления в системе лёгочной циркуляции низки, сила гравитации оказывает существенное влияние на параметры перфузии. Вне зависимости от положения стоя или лёжа, каждый ±1 см расстояния по вертикали от положения лёгочного ствола изменяет гидростатическое давление (внутрисосудистое давление) на ±0,74 мм рт.ст. Это обстоятельство справедливо и для лёгочных артерий (Pa), и для лёгочных вен (Pv). На величину лёгочного кровотока существенно влияет также альвеолярное давление (PA). Говоря иными словами, в разных областях лёгкого параметры перфузии значительно отличаются. В связи с этим области лёгкого подразделены на 3 зоны с разной перфузией (рис. 25-7).
❖ Зона 1 (PA > Pa > Pv): верхушка лёгкого, где возможно отсутствие перфузии (например, при искусственной вентиляции лёг-
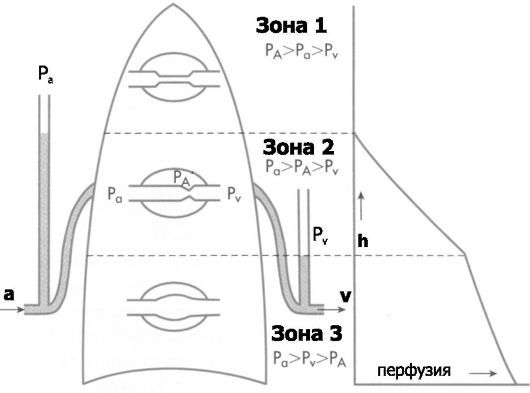 Рис. 25-7. Зоны лёгкого, отличающиеся по параметрам перфузии [4]. Слева: схема лёгкого, по центру: границы зон и их номера справа: величина перфузии. PA
- альвеолярное давление; Pa - артериальное давление; Pv - венозное
давление; a - артериальный кровоток; v - венозный кровоток; h -
расстояние области лёгкого от положения начала лёгочного ствола
Рис. 25-7. Зоны лёгкого, отличающиеся по параметрам перфузии [4]. Слева: схема лёгкого, по центру: границы зон и их номера справа: величина перфузии. PA
- альвеолярное давление; Pa - артериальное давление; Pv - венозное
давление; a - артериальный кровоток; v - венозный кровоток; h -
расстояние области лёгкого от положения начала лёгочного ствола
кого), но нормально такая ситуация не встречается. Критично для прекращения перфузии состояние, когда PA >Pa.
❖ Зона 2 (Pa > PA > Pv): верхняя треть лёгкого. Поскольку PA > Pv, то часть капилляров может находиться в спавшемся состоянии (нет перфузии).
❖ Зона 3 (Pa > Pv > PA): нижние две трети лёгкого. Здесь перфузию определяет разность между Pa и Pv. Значение PA практически значения не имеет.
• Регуляция лёгочного кровотока
❖ Кислород (точнее - изменение Pao2) вызывает либо вазодилатацию, либо вазоконстрикцию.
♦ Вазодилатация. Под влиянием повышения Pao2 (например, при помещении в камеру с повышенным содержанием кислорода - гипербарическая оксигенация или при вдыхании 100% кислорода - кислородная подушка) лёгочное сосудистое сопротивление (RPV) уменьшается, а перфузия увеличивается.
♦ Вазоконстрикция. Под влиянием пониженного Pao2 (например, при подъёме в горы) RPV увеличивается, а перфузия уменьшается.
❖ Биологически активные вещества (вазоконстрикторы и вазодилататоры), воздействующие на ГМК кровеносных сосудов, многочисленны, но их эффекты локальны и кратковременны. Диоксид углерода (повышенное Paco2) также имеет незначительный, преходящий и локальный сосудосуживающий эффект на просвет кровеносных сосудов.
♦ Лёгочные вазодилататоры: простациклин, оксид азота, ацетилхолин, брадикинин, дофамин, β-адренергические лиганды.
♦ Вазоконстрикторы: тромбоксан A2, α-адренергические лиганды, ангиотензины, лейкотриены, нейропептиды, серотонин, эндотелин, гистамин, Пг, повышенное Paco2.
Вентиляционно-перфузионные отношения
Для оценки лёгочного газообмена, помимо характеристики перфузии (Q) и вентиляции (V), также важно вентиляционно-перфузионное отношение (VA/Q). Это отношение оценивают для отдельной альвеолы (в этом случае значение V заменяют на VA - альвеолярная вентиляция), для лёгких в целом (в этом случае значение Q равно значению сердечного выброса) и для участка лёгочной ткани. В целом в лёгких VA/Q составляет 0,8 (в норме допускается физиологический дисбаланс V/Q, эквивалентный 2% шунтирования лёгочной артериальной крови напрямую в лёгочную венозную циркуляцию без газообмена).
Контроль вентиляции
Общая схема регуляции дыхания (вентиляции) приведена на рис. 25-8. Функцию нервной регуляции дыхания выполняют дыхательные нейроны - множество нервных клеток, расположенных в стволовой части мозга. Контроль дыхательных движений (эфферентная нервная импульсация к дыхательным мышцам) осуществляется как непроизвольно (автоматический ритм дыхательных нейронов стволовой части мозга, на рисунке - «генератор ритма»), так и произвольно (в этом случае эфферентная нервная импульсация поступает к дыхательным мышцам, минуя дыхательные нейроны ствола мозга; на рисунке: «высшие отделы ЦНС» - «спинной мозг» - «дыхательные мышцы»). Адекватное функционирование этих и других контуров регуляции дыхания обеспечивает нормальное дыхание (эупноэ).
Регуляция дыхания направлена на выполнение двух задач: во-первых, автоматическая генерация частоты и силы сокращения дыхательных мышц, во-вторых, подстройка ритма и глубины дыхательных движений к реальным потребностям организма (в первую очередь, к изменениям метаболических параметров в виде∆Po2, ∆Pco2 и ΔρΗ артериальной крови и ∆Pco2 и ΔρΗ межклеточной жидкости мозга).
• Система регуляции дыхания состоит из 3 основных блоков: рецепторного (хемо- и барорецепторы, регистрирующие и передающие информацию в мозг), регуляторного, или контролирующего (совокупность дыхательных нейронов) и эффекторного (дыхательные мышцы, непосредственно осуществляющие вентиляцию лёгких). На рис. 25-8 представлены образующие систему регуляции дыхания блоки - контролирующие (нервные центры), исполнительные (дыхательные мышцы), рецепторные (хемо- и механорецепторы) и связи между этими блоками. Таким образом, вся система регуляции дыхания состоит из нескольких взаимосвязанных регуляторных контуров. Нервные центры расположены в стволе мозга (в основном, в составе продолговатого мозга). Схема регуляции дыхания предусматривает наличие генератора ритма дыхательных движений и центра интеграции сенсорной информации. Под терминами «генератор ритма» и «интегратор сенсорной информации» следует понимать абстрагированные интегральные понятия, а не конкретные нервные структуры, так как соответствие анатомических структур рассматриваемым понятиям установлено далеко не во всех случаях. ❖ Генератор ритма включает нейроны, расположенные преимущественно в составе продолговатого мозга, а также моста и некоторых других отделов ствола мозга. Разные группы нейронов генерируют разного спектра пачки импульсов - потенциалы действия (ПД) - на разных фазах дыхательных движений, в то числе
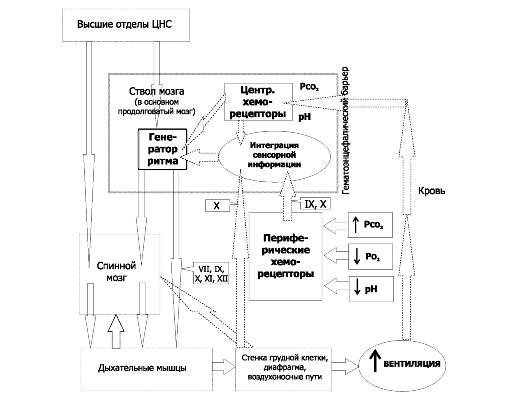 Рис. 25-8. Нервный контроль вентиляции [2].
Связи между контролирующими (нервные центры), исполнительными
(дыхательные мышцы) и чувствительными (хемо- и механорецепторы) блоками
даны стрелками (в том числе пунктирными для восходящей - афферентной -
импульсации, а точечными для нисходящей - эфферентной - импульсации).
Римскими цифрами обозначены черепные нервы (VII - лицевой, иннервирует
мимические мышцы; IX - языкоглоточный, повреждение нерва сопровождается
нарушением глотания, анестезией верхней трети глотки, снижением нёбных и
глоточных рефлексов; X - блуждающий, содержит двигательные,
чувствительные и вегетативные волокна; XI - добавочный, иннервирует
грудино-ключично-сосцевидную и трапециевидную мышцы; XII - подъязычный,
иннервирует мышцы языка, грудино-подъязычную, грудино-щитовидную и
лопаточноподъязычную мышцы). В правой части схемы стрелки относятся к
крови в кровеносной системе. Жирным прямоугольником выделены структуры
ствола мозга, паренхима которого отделена от циркулирующей крови
гематоэнцефалическим барьером (см. рис. 25-11)
Рис. 25-8. Нервный контроль вентиляции [2].
Связи между контролирующими (нервные центры), исполнительными
(дыхательные мышцы) и чувствительными (хемо- и механорецепторы) блоками
даны стрелками (в том числе пунктирными для восходящей - афферентной -
импульсации, а точечными для нисходящей - эфферентной - импульсации).
Римскими цифрами обозначены черепные нервы (VII - лицевой, иннервирует
мимические мышцы; IX - языкоглоточный, повреждение нерва сопровождается
нарушением глотания, анестезией верхней трети глотки, снижением нёбных и
глоточных рефлексов; X - блуждающий, содержит двигательные,
чувствительные и вегетативные волокна; XI - добавочный, иннервирует
грудино-ключично-сосцевидную и трапециевидную мышцы; XII - подъязычный,
иннервирует мышцы языка, грудино-подъязычную, грудино-щитовидную и
лопаточноподъязычную мышцы). В правой части схемы стрелки относятся к
крови в кровеносной системе. Жирным прямоугольником выделены структуры
ствола мозга, паренхима которого отделена от циркулирующей крови
гематоэнцефалическим барьером (см. рис. 25-11)
либо преимущественно во время вдоха (инспираторные нейроны), либо преимущественно во время выдоха (экспираторные нейроны). Карта расположения инспираторных и экспираторных нейронов в составе структур продолговатого мозга приведена на рис. 25-9.
♦ Входящие сигналы. Генератор ритма получает нисходящую из коры головного мозга импульсацию, а также нервные сигналы от нервных клеток интегратора сенсорной информации и непосредственно от центральных хеморецепторов.
♦ Выходящие сигналы. Нервная импульсация от генератора ритма направляется к иннервирующим дыхательные мышцы двигательным нервным клеткам соответствующих ядер черепных нервов (VII, IX-XII) и к мотонейронам передних рогов спинного мозга (их аксоны в составе спинномозговых нервов направляются к дыхательным мышцам).
♦ Механизм ритмической активности генератора не установлен. Предложено несколько моделей, учитывающих индивидуальные особенности электрогенной мембраны групп однотипных нервных клеток (например, наличие разных ионных каналов), спектр синаптических связей (в том числе осуществляемых при помощи разных нейромедиаторов), наличие пейсмейкерных (со свойствами водителя ритма) дыхательных нейронов (таковые обнаружены) или пейсмейкерных свойств локальных нейронных сетей. Нет ясности и в вопросе о том, является ли ритмическая активность свойством ограниченной группы нервных клеток или свойством всей совокупности дыхательных нейронов.
• -Ф- Интегратор сенсорной информации получает чувствительную информацию от разнообразных хемо- и механорецепторов, расположенных в органах дыхания и дыхательных мышцах, по ходу магистральных кровеносных сосудов (периферические хеморецепторы), а также в продолговатом мозге (центральные хеморецепторы). Помимо этих прямых сигналов, интегратор получает множество информации, опосредованной различными структурами мозга (в том числе и от высших отделов ЦНС). Импульсация от нервных клеток интегратора, направляясь к нейронам генератора ритма, модулирует характер разрядов от них. Чувствительные структуры, сигналы от которых прямо или опосредованно (через интегратор сенсорной информации) влияют на ритмическую активность генератора ритма, включают периферические и центральные хеморецепторы, барорецепторы стенки артерий, механорецепторы лёгких и дыхательных мышц. Наиболее суще-
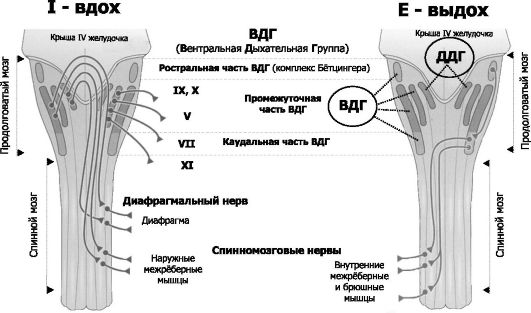 Рис. 25-9. Инспираторные (слева, Inspiration) и экспираторные (справа, Expiration) группы нейронов и их связи с дыхательными мышцами [2].
Дорсальный (сзади) вид на продолговатый и спинной мозг (мозжечок
удалён). Римскими цифрами обозначены черепные нервы. Вся совокупность
дыхательных нейронов подразделяется с анатомической точки зрения на
вентральную и дорсальную дыхательные группы (ВДГ и ДДГ соответственно). И
ВДГ, и ДДГ представлены билатерально, т.е. дублированы. Дорсальная дыхательная группа (ДДГ)
содержит преимущественно инспираторные нервные клетки (в том числе
нейроны важного комплекса ядер вегетативной нервной системы - ядер
одиночного пути, получающих сенсорную информацию от внутренних органов
грудной и брюшной полостей по нервным волокнам языкоглоточного и
блуждающего нервов). Вентральная дыхательная группа (ВДГ)
содержит как инспираторные, так и экспираторные нейроны. В
ростро-каудальном направлении ВДГ состоит из ростральной части -
комплекс Бётцингера (содержит в основном экспираторные нервные клетки и в
том числе позадилицевого ядра), промежуточной (содержит преимущественно
инспираторные нейроны двойного и околодвойного ядер) и каудальной
(экспираторные нейроны позадидвойного ядра) частей. Направление импульсации от дыхательных нейронов: 1.
от нервных клеток ДРГ к ВДГ, а также к премоторным нейронам, далее к
мотонейронам и к основным инспираторным мышцам; 2. от промежуточной
части ВДГ в конечном итоге к основным и вспомогательным инспираторным
мышцам; 3. от каудальной части ВДГ к дополнительным экспираторным мышцам
Рис. 25-9. Инспираторные (слева, Inspiration) и экспираторные (справа, Expiration) группы нейронов и их связи с дыхательными мышцами [2].
Дорсальный (сзади) вид на продолговатый и спинной мозг (мозжечок
удалён). Римскими цифрами обозначены черепные нервы. Вся совокупность
дыхательных нейронов подразделяется с анатомической точки зрения на
вентральную и дорсальную дыхательные группы (ВДГ и ДДГ соответственно). И
ВДГ, и ДДГ представлены билатерально, т.е. дублированы. Дорсальная дыхательная группа (ДДГ)
содержит преимущественно инспираторные нервные клетки (в том числе
нейроны важного комплекса ядер вегетативной нервной системы - ядер
одиночного пути, получающих сенсорную информацию от внутренних органов
грудной и брюшной полостей по нервным волокнам языкоглоточного и
блуждающего нервов). Вентральная дыхательная группа (ВДГ)
содержит как инспираторные, так и экспираторные нейроны. В
ростро-каудальном направлении ВДГ состоит из ростральной части -
комплекс Бётцингера (содержит в основном экспираторные нервные клетки и в
том числе позадилицевого ядра), промежуточной (содержит преимущественно
инспираторные нейроны двойного и околодвойного ядер) и каудальной
(экспираторные нейроны позадидвойного ядра) частей. Направление импульсации от дыхательных нейронов: 1.
от нервных клеток ДРГ к ВДГ, а также к премоторным нейронам, далее к
мотонейронам и к основным инспираторным мышцам; 2. от промежуточной
части ВДГ в конечном итоге к основным и вспомогательным инспираторным
мышцам; 3. от каудальной части ВДГ к дополнительным экспираторным мышцам
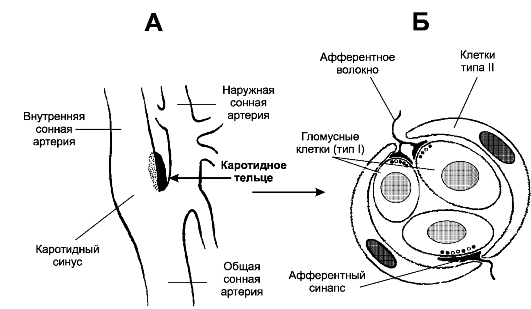 Рис. 25-10. Каротидный (сонный) синус и каротидное (сонное) тельце [11]. А. Каротидный синус -
расширение просвета внутренней сонной артерии тотчас у места её
ответвления от общей сонной артерии. В стенке артерии области расширения
присутствуют многочисленные барорецепторы, регистрирующие значения АД и
передающие эту информацию в ЦНС по нервным волокнам, проходящим в
составе синусного нерва (Херинга) - ветви языкоглоточного нерва. Каротидное тельце находится в области бифуркации общей сонной артерии. Б. Клубочек каротидного тельца состоит
из 2-3 клеток типа I (гломусные клетки), окружённых поддерживающими
клетками (тип II). Клетки типа I образуют синапсы с терминалями
афферентных нервных волокон
Рис. 25-10. Каротидный (сонный) синус и каротидное (сонное) тельце [11]. А. Каротидный синус -
расширение просвета внутренней сонной артерии тотчас у места её
ответвления от общей сонной артерии. В стенке артерии области расширения
присутствуют многочисленные барорецепторы, регистрирующие значения АД и
передающие эту информацию в ЦНС по нервным волокнам, проходящим в
составе синусного нерва (Херинга) - ветви языкоглоточного нерва. Каротидное тельце находится в области бифуркации общей сонной артерии. Б. Клубочек каротидного тельца состоит
из 2-3 клеток типа I (гломусные клетки), окружённых поддерживающими
клетками (тип II). Клетки типа I образуют синапсы с терминалями
афферентных нервных волокон
ственное значение на деятельность генератора ритма имеет осуществляемый периферическими и центральными хеморецепторами контроль pH и газов крови.
^ Периферические хеморецепторы (каротидные и аортальные тельца) регистрируют в артериальной крови pH, PO2 (PaO2) и PCO2, они особенно чувствительны к уменьшению PaO2 (гипоксемии) и в меньшей степени - к увеличению PCO2 (гиперкапнии) и уменьшению pH (ацидозу).
♦ Каротидное тельце (рис. 25-10) состоит из скоплений клеток (клубочков, гломусов), погружённых в густую сеть кровеносных капилляров (интенсивность перфузии телец наибольшая в организме, в 40 раз больше перфузии головного мозга). Каждый клубочек содержит 2-3 хемочувствительные гломусные
клетки, образующие синапсы с терминальными разветвлениями нервных волокон синусного нерва - ветви языкоглоточного нерва. В тельцах также находятся нервные клетки симпатического и парасимпатического отделов вегетативной нервной системы. На этих нейронах и на гломусных клетках заканчиваются преганглионарные симпатические и парасимпатические нервные волокна, а на гломусных клетках также постганглионарные нервные волокна из верхнего шейного симпатического узла [терминали этих волокон содержат светлые (ацетилхолин) или гранулярные (катехоламины) синаптические пузырьки].
■ Гломусные клетки связаны друг с другом при помощи щелевых контактов, их плазмолемма содержит потенциалозависимые ионные каналы, клетки могут генерировать ПД и содержат разные синаптические пузырьки, содержащие ацетилхолин, дофамин, норадреналин, вещество P и метионин- энкефалин.
■ Механизм регистрации ∆Po2, ∆Pco2 и ∆pH окончательно не установлен, но приводит к блокаде К+-каналов, что вызывает деполяризацию плазмолеммы гломусных клеток, открытию потенциалозависимых Ca2+-каналов, внутриклеточному увеличению [Ca2+] и секреции нейромедиаторов.
■ Синапсы между гломусными клетками и афферентами синусного нерва. Под влиянием освобождаемых из гломусных клеток нейромедиаторов в терминалях генерируется постсинаптический потенциал и далее ПД. Эти чувствительные нейроны в свою очередь образуют синапсы с дыхательными нейронами ядра одиночного пути в составе ДДГ (см. рис. 25-9).
♦ Аортальные (парааортальные) тельца рассыпаны по внутренней поверхности дуги аорты и содержат гломусные хемочувствительные клетки, образующие синапсы с афферентами блуждающего нерва.
-Ф- Центральные хеморецепторы (нервные клетки стволовой части мозга) регистрируют в межклеточной жидкости мозга pH и PCO2, они особенно чувствительны к увеличению PCO2 (гиперкапнии), а часть из них к уменьшению pH (ацидозу). Существенно, что центральные хеморецепторы расположены кнутри от гематоэнцефалического барьера, т.е. они отделены от крови в системе общей циркуляции и, в частности, находятся в более кислой среде, чем наблюдаемая в крови.
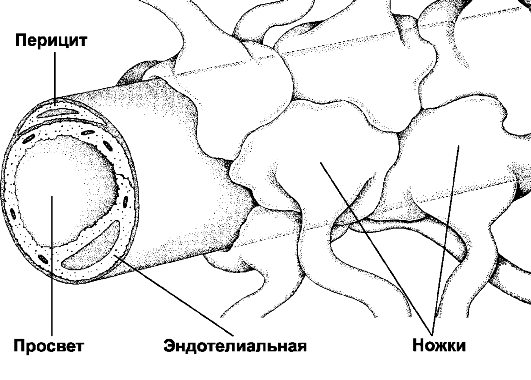
Рис. 25-11. Гематоэнцефалический барьер образован эндотелиальными клетками кровеносных капилляров мозга. Базальная мембрана, окружающая эндотелий и перициты, а также астроциты, ножки которых полностью охватывают капилляр снаружи, не являются компонентами барьера. [11]
♦ Гематоэнцефалический барьер (рис. 25-11) изолирует мозг от временных изменений состава крови. Непрерывный эндотелий капилляров, клетки которого связаны между собой цепочками плотных контактов - основа гематоэнцефалического барьера. Гематоэнцефалический барьер функционирует как фильтр. Наибольшей проницаемостью обладают вещества нейтральные (например, O2 и CO2,) и растворимые в липидах (например, никотин, этиловый спирт, героин), но проницаемость ионов (например, Na+, Cl-, H+, HCO-3) низка.
♦ Чувствительные к ацидозу (хемочувствительные к APco2 и ΔρΗ) нейроны, активность которых влияет на лёгочную вентиляцию, обнаружены в вентролатеральной части продолговатого мозга, в двойном ядре, ядрах одиночного пути продолговатого мозга, а также в гипоталамусе и в голубоватом месте и в ядрах шва моста. Многие из этих хемочувствительных нейронов относятся к серотонинергическим нервным клеткам.
• V Барорецепторы стенки артерий и вен. Эти механорецепторы реагируют на изменения давления в просвете и в стенке сосудов,
• они образованы терминалями волокон, проходящих в составе блуждающего и языкоглоточного нерва. Барорецепторы особенно многочисленны в дуге аорты, сонных артериях (см. рис. 25- 10А), лёгочном стволе, лёгочных артериях и в стенке крупных вен большого и малого круга кровообращения. Барорецепторы участвуют в рефлекторной регуляции кровообращения и дыхания, увеличение АД может привести к рефлекторной гиповентиляции или даже остановке дыхания (апноэ), а понижение АД способно вызвать гипервентиляцию. V Рецепторы воздухоносных путей и респираторного отдела регистрируют изменения объёмов лёгких, наличие посторонних частиц и раздражающих веществ и проводят информацию по нервным волокнам блуждающего и языкоглоточного (от верхних отделов воздухоносных путей) нервов к нейронам дорсальной дыхательной группы (см. рис. 25-9). К рецепторам этой группы относятся медленно адаптирующиеся рецепторы растяжения, быстро адаптирующиеся ирритантные рецепторы и J-рецепторы.
♦ Медленно адаптирующиеся рецепторы растяжения расположены среди ГМК стенки воздухоносных путей. Они реагируют на увеличение объёма лёгочной ткани (раздувание ткани лёг- кого), регистрируя растяжение стенки воздухоносных путей, и проводят пачки импульсов по миелинизированным нервным волокнам. Особенность этих механорецепторов - медленная адаптируемость (при возбуждении рецепторов импульсная активность продолжается длительное время). Эти рецепторы возбуждаются при расширении просвета воздухоносных путей (бронходилатации) и запускают рефлекс Херинга-Бройера (при раздувании лёгкого происходит уменьшение дыхательного объё- ма и увеличение частоты дыхания; другими словами, рефлекс Херинга-Бройера направлен на подавление длительности вдоха и увеличение продолжительности выдоха). Одновременно и рефлекторно возникает тахикардия (увеличение ЧСС).
♦ Быстро адаптирующиеся (ирритантные) рецепторы расположены между эпителиальными клетками слизистой оболочки крупных воздухоносных путей. Они (как и медленно адаптирующие рецепторы растяжения) реагируют на сильное раздувание лёгочной ткани, но главным образом на действие поступающих при вдохе раздражающих ткани едких газов (например, аммиака), табачного дыма, пыли, холодного воздуха, а также на наличие в стенке воздухоносных путей гистамина (освобождается из тучных клеток при аллергических реакциях), Пг и брадикининов (поэтому их также называют ирритантны-
ми - раздражающими - рецепторами). Возбуждение от рецепторов распространяется по миелинизированным афферентным нервным волокнам блуждающего нерва. Особенность этих рецепторов - быстрая адаптируемость (при возбуждении рецепторов импульсная активность практически прекращается в течение одной секунды). При возбуждении ирритантных рецепторов увеличивается сопротивление воздухоносных путей, рефлекторно возникает задержка дыхания и кашель.
♦ J-рецепторы (от англ. «juxtacapillary» - околокапиллярные) расположены в межальвеолярных перегородках, являются как хемо- так и механорецепторами. J-рецепторы возбуждаются при перерастяжении ткани лёгкого, а также при воздействии различных экзо- и эндогенных химических соединений (капсаицин, гистамин, брадикинин, серотонин, Пг). Пачки импульсов от этих рецепторов направляются в ЦНС по безмиелиновым нервным волокнам (C-волокна) блуждающего нерва. Стимуляция этих рецепторов приводит к рефлекторной задержке дыхания с последующим появлением частого и поверхностного дыхания, сужению просвета воздухоносных путей (бронхоконстрикции), увеличению секреции слизи, а также к падению АД и урежению ЧСС (брадикардии).
• V Внелёгочные рецепторы
♦ Рецепторы лица и носовой полости. Их стимуляция при погружении в воду рефлекторно вызывает остановку дыхания, брадикардию, чихание.
♦ Рецепторы носоглотки и глотки. При их возбуждении развивается сильное инспираторное усилие («шмыгание»), перемещающее посторонний материал из носоглотки в глотку. Эти рецепторы важны и для глотания, когда одновременно закрывается гортанная щель (впрочем, новорождённые могут дышать и глотать одновременно).
♦ Рецепторы гортани. Их раздражение рефлекторно вызывает остановку дыхания (апноэ), кашель и сильные экспираторные движения, необходимые для предупреждения попадания постороннего материала в дыхательные пути (аспирация).
♦ Механорецепторы суставов и мышц (в том числе нервно-мышеч- ные веретёна). Поступающая от них информация необходима для рефлекторной регуляции мышечного сокращения. Возбуждение этих рецепторов в какой-то степени обусловливает ощущение одышки (диспноэ), возникающей в том случае, когда дыхание требует больших усилий (например, при обструкции дыхательных путей).
♦ Болевые и температурные рецепторы. Изменения вентиляции могут возникать в ответ на раздражение различных афферентных нервов. Так, в ответ на боль часто наблюдается задержка дыхания, за которой следует гипервентиляция.
• ЦНС и лёгочная вентиляция. ЦНС функционирует не только в качестве генератора ритма (см. рис. 25-8) и модулятора этого центрального генератора («интегратор сенсорной информации» на рисунке), не только влияет на активность генератора ритма в связи с выполнением других функций воздухоносных путей (голосообразование и обоняние), но и модулирует параметры ритма дыхания при выполнении других функций, контролируемых ЦНС (например, жевание, глотание, рвота, дефекация, терморегуляция, различные эмоции, пробуждение от сна и так далее). К таким отделам ЦНС относятся в частности ретикулярная формация моста, лимбическая доля большого мозга, гипоталамус промежуточного мозга, кора большого мозга.
V Сон и дыхание. Дыхание во время сна контролируется менее строго, чем во время бодрствования; в то же время сон оказывает мощный эффект на параметры дыхания и в первую очередь на чувствительность хеморецепторов к ΔΡCO2 и на ритм дыхания.
Функция внешнего дыхания и гомеостаз
Адекватное выполнение функции внешнего дыхания существенно важно для поддержания множества параметров гомеостаза и в первую очередь - КЩР, насыщения крови кислородом (Pao2) и содержания в крови диоксида углерода - CO2 (Paco2). Эти вопросы (в том числе и буферные системы крови) рассмотрены в главе 29. Наряду с мощными и быстродействующими химическими системами в организме функционируют органные механизмы компенсации и устранения сдвигов КЩР. К наиболее эффективным физиологическим механизмам регуляции КЩР относят процессы, протекающие в лёгких и почках. Лёгкие обеспечивают устранение или уменьшение сдвигов КЩР пу- тём изменения объёма альвеолярной вентиляции. Система внешнего дыхания в течение нескольких минут способна устранить или уменьшить сдвиги рН и предотвратить развитие ацидоза или алкалоза: увеличение вентиляции лёгких в два раза повышает рН крови примерно на 0,2; снижение вентиляции на 25% может уменьшить рН на 0,3-0,4.
• Снижение рН в жидкостях организма (плазма крови, спинномозговая жидкость) является мощным стимулом увеличения частоты и глубины дыхательных движений. Вследствие этого лёгкие выделяют избыток CO2 (образующийся при диссоциации угольной кис-
лоты). В результате содержание H+ (HCO3- + H+ = H2CO3 - H2O + CO2) в плазме крови и других жидкостях организма снижается.
• Повышение рН в жидких средах организма снижает возбудимость инспираторных нейронов. Это приводит к уменьшению альвеолярной вентиляции и к гиперкапнии. В связи с этим в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с образованием H+, - показатель рН снижается.
Гипоксия. Дыхание (внешнее дыхание в лёгких, транспорт газов в крови и тканевое дыхание) направлено на снабжение клеток, тканей, органов и организма кислородом. Недостаточное выполнение функции дыхания приводит к развитию кислородного голодания - гипоксии.
Терминология. Гипоксия (кислородное голодание, кислородная недостаточность) - состояние, возникающее в результате недостаточного обеспечения организма кислородом и/или нарушения усвоения кислорода в ходе тканевого дыхания. Гипоксемия (уменьшение по сравнению с должным уровней напряжения и содержания кислорода в крови) нередко сочетается с гипоксией. Аноксия (отсутствие кислорода и прекращение процессов биологического окисления) и аноксемия (отсутствие кислорода в крови) в целостном живом организме не наблюдаются, эти состояния относятся к экспериментальным или специальным (перфузия отдельных органов) ситуациям.
Дыхательные адаптивные механизмы
Приспособление (адаптация) системы дыхания к мышечной работе, к условиям необычной среды (пониженному и повышенному барометрическому давлению, гипоксии, загрязненной среде и т.д.), а также правильная диагностика и лечение дыхательных расстройств определяются глубиной понимания основных физиологических принципов дыхания и газообмена. Ряд респираторных заболеваний - результат неадекватной вентиляции, в то время как другие - результат затруд- нённой диффузии через аэрогематический барьер.
• Действие повышенного барометрического давления (гипербария). Давление при погружении в воду увеличивается на 1 атм на каждые 10 м глубины (соответственно увеличивается количество растворён- ных газов). Создание барокамер позволило изучить эффект и повышенного барометрического давления, и высоких давлений газов на тело человека без глубоководных погружений.
V Кислород. При PO2 около 3000 мм рт.ст. (около 4 атм) общее количество не связанного с Hb, а физически растворённого в крови кислорода составляет 9 мл/100 мл крови. Мозг особенно чувствителен к острому кислородному отравлению. После 30-
минутной экспозиции в среде с давлением O2 в 4 атм возникают судорожные припадки с последующей комой. Токсическое влияние O2 на нервную систему вызвано действием т.н. активных форм кислорода (синглетного - 1O2, супероксидного радикала - O2-, пероксида водорода - Н2О2, гидроксильного радикала - OH-).
V Азот. Во время водолазного погружения парциальное давление N2 возрастает, в результате этот плохо растворимый газ накапливается в тканях. Во время подъёма азот медленно удаляется из тканей. Если декомпрессия происходит слишком быстро, образуются пузырьки азота. Большое количество пузырьков сопровождается болями, особенно в области суставов (кессонная болезнь). В тяжё- лых случаях могут возникать нарушения зрения, глухота и даже параличи. Для лечения декомпрессионной болезни пострадавшего помещают в специальную камеру с высоким давлением.
• Загрязнённая атмосфера. Рост числа автомобилей и промышленньгх предприятий делает загрязнённую атмосферу привычной средой обитания. К основным загрязнителям воздуха относятся различные окислы азота, серы, озон, угарный газ, углеводороды и пыль. Содержание загрязнений в воздухе значительно увеличивается при температурной инверсии, когда нагретый поверхностный воздух не может подниматься в верхние слои атмосферы (смог).
Другие функции органов дыхания
Помимо внешнего дыхания, органы дыхания выполняют ряд дополнительных функций. К ним относятся обоняние, голосообразование, защитная и метаболическая функции.
Обоняние. Организация и функции обонятельного анализатора рассмотрены в главе 12.
Звукообразование речь
Гортань рострально отделена от глотки надгортанником, каудально ограничена первым хрящевым полукольцом трахеи и выполняет две функции - предотвращает попадание пищи в трахею путём смещения надгортанника и смыкания голосовой щели и обеспечивает звукообразование.
• Голосовые связки - верхние и нижние складки слизистой оболочки в средней части гортани - образуют соответственно ложные и истинные голосовые связки. Пространство между истинными голосовыми связками - голосовая щель. Во время дыхания голосовая щель открыта. Напряжение голосовых связок регулируют мышцы гортани, натягивающие маленькие хрящи, находящиеся на задней сторо-
не гортани, и большой черпаловидный хрящ. При сокращении мышц голосовые связки приближаются друг к другу, и проходящий через голосовую щель воздух заставляет их вибрировать. Чем быстрее воздух проходит через голосовую щель, тем громче звук. Чем ближе связки находятся друг к другу, тем звук выше; чем слабее они натянуты, тем звук ниже.
• Звукообразование - сложный процесс координации деятельности дыхательных мышц, мышц гортани, голосовых связок, губ и языка. Голосовые связки могут производить широкий диапазон музыкальных звуков (тоны), а резонанс звуков (наличие обертонов) зависит в первую очередь от околоносовых пазух. Качество звуков определяется также от формой грудной клетки, гортани, носоглотки, языка и губ.
• Голоса детей обоих полов имеют одинаковый диапазон звуков. При пубертате голоса мальчиков «ломаются», так как под воздействием тестостерона объём гортани увеличивается, а голосовые связки удлиняются.
Кондиционирование воздуха
Воздухоносные пути функционируют как установка для кондиционирования воздуха. Характеристики внешнего воздуха (температура, влажность, загрязнённость различными частицами [в том числе с аллергенными свойствами - пыльца растений, домашняя пыль с клещами и др.], наличие микроорганизмов, раздражающих летучих соединений и так далее) варьируют весьма значительно. Но к респираторной поверхности альвеол (практически к внутренней среде организма) должен поступать увлажнённый воздух температуры внутренней среды и не содержащий в идеале посторонних частиц. Функцию доведения воздуха до необходимых кондиций и выполняют воздухоносные пути. При этом особо важное значение имеют площадь поверхности воздухоносных путей и мощная сеть кровеносных сосудов слизистой оболочки (особенно носовых ходов), слизистая плёнка на поверхности эпителия и координированная активность мерцательных ресничек, альвеолярные макрофаги и компоненты иммунной системы органов дыхания.
• Полости носа и носоглотка
V Посторонние частицы диаметром >15 мкм задерживаются волосами преддверия носа, а частицы диаметром >10 мкм осаждаются слизью на поверхности носовых ходов и носоглотки.
V Согревание вдыхаемого воздуха происходит главным образом в носовых ходах, чему способствует наличие в их слизистой оболочке тонкостенных полостей, выстланных эндотелием и окружён- ных ГМК. Обычно эти полости находятся в спавшемся состоя-
• нии, но способны, растягиваясь, накапливать значительное количество крови, что увеличивает толщину слизистой оболочки, существенно уменьшая диаметр носовых ходов и тем самым облегчая тепловой обмен между кровью и воздухом. В эти тонкостенные полости кровь поступает по артериолам, имеющим сфинктеры и регулирующим приток, а оттекает по венулам с большим количеством циркулярно ориентированных ГМК (сфинктеры, регулирующие отток). В зависимости от реальной ситуации (терморецепторы постоянно регистрируют температуру воздуха), к артериолам и венулам поступают по двигательным нервным окончаниям вегетативного отдела нервной системы импульсы, регулирующие степень сокращения ГМК этих сосудов. Трахея и бронхи. Здесь происходят: осаждение посторонних частиц, дальнейшее увлажнение воздуха и направленный наружу так называемый мукоцилиарный транспорт - постоянное движение слизи по поверхности эпителия.
V Посторонние частицы диаметром <10 мкм фиксируются слизью, находящейся на поверхности трахеи и бронхов, а также бронхиол.
V Плёнка слизи толщиной от 5 до 10 мкм располагается островками над слоем жидкости (толщина от 2 до 5 мкм), окружающей мерцательные реснички эпителия. Слизь имеет свойства геля, характеризуется небольшой вязкостью и значительной эластичностью, содержит 96% воды и электролитов, гликопротеины и молекулы белка (в том числе лизоцим и лактоферрин).
♦ Слизь секретируют бокаловидные клетки в составе поверхностного эпителия трахеи и бронхов, а также секреторные клетки желёз, находящихся под эпителием.
♦ Воздухоносные пути взрослого человека ежесуточно секретируют около 100 мл слизи, из них 90 мл абсорбируется эпителиальными клетками, а около 10 мл, передвигаясь по поверхности эпителия, достигает глотки, где и проглатывается.
♦ Плёнка слизи, находящаяся на поверхности эпителия, не откашливается. Откашливаемое содержимое просвета воздухоносных путей - мокрота. Мокрота, помимо секретируемой всеми железами воздухоносных путей слизи, содержит различные дегенерирующие клетки, а также микроорганизмы.
♦ Секреция слизи из желёз находится под парасимпатическим (ацетилхолин), симпатическим (адреналин и норадреналин) и пептидергическим контролем (VIP) контролем. Секреция слизи существенно возрастает под влиянием выделяющихся из
• тучных клеток гистамина, а также поступающих из разных источников ряда производных арахидоновой кислоты. Мукоцилиарный транспорт - система постоянной очистки (клиренса) воздухоносных путей (трахеи и бронхов). Загрязнённая вдыхаемыми частицами плёнка слизи удаляется из воздухоносных путей при её постоянном перемещении по направлению к выходу из дыхательной системы (в глотку) с последующим проглатыванием (в носоглотке слизь перемещается также по направлению к глотке). Такое постоянное движение слизистой плёнки обеспечивается за счёт направленных к глотке синхронных и волнообразных колебаний ресничек (см. рис. 3-8), находящихся на поверхности реснитчатых клеток. Эта система клиренса достаточно эффективна: осаждённые в плёнке слизи частицы удаляются за минуты и часы (скорость мукоцилиарного транспорта в трахее и главных бронхах составляет 5-20 мм/мин, по мере уменьшения калибра трубок скорость уменьшается и в мелких бронхах и в бронхиолах варьирует от 0,5 до 1,0 мм/мин). Сами реснички в покое окружены жидкостью, лишь верхушка реснички погружена в плёнку слизи.
V Мерцательные реснички совершают скоординированные, всегда однонаправленные и локально синхронные биения с частотой 900- 1200 в минуту. Каждое биение состоит из быстрого сгибания вертикально ориентированной реснички и медленного её разгибания. В начале сгибания верхушки ресничек с силой перемещаются внутри плёнки слизи, толкая её в направлении сгибания, после сгибания и при разгибании ресничка оказывается в слое жидкости и лишь при полном разгибании верхушка реснички погружается в плёнку слизи.
V Транспорт ионов и воды. Реснитчатые клетки эпителия при помощи ионоспецифичных каналов транспортируют из межклеточных пространств стенки воздухоносных путей на поверхность эпителия Cl-, а с поверхности эпителия - Na+ (чрезэпителиальный транспорт). Одновременно с этими ионами перемещается и вода. Баланс между секрецией Cl- и абсорбцией Na+ прямо влияет на толщину слоя жидкости, окружающей мерцательные реснички, и тем самым определяет активность ресничек, прямо пропорциональной толщине слоя жидкости.
V Регуляция клиренса. Клетки эпителия (как поверхностного, так и в составе желёз) воздухоносных путей имеют рецепторы для многих биологически активных веществ. В зависимости от вида активированных рецепторов реакция эпителиальных клеток может быть различной, а именно стимуляция активного ионного транспорта и увеличение частоты биения ресничек происходит
• через рецепторы: Р2-адренергические, М3-холинергические, VIP, NK1 (тахикининов), относящегося к кальцитониновому гену пептида, фактора активации тромбоцитов PAF и брадикинина. Брадикинин, а также гистамин стимулируют выделение ПгЕ2, (бронходилататор), гистамин - оксида азота (NO), а фактор некроза опухоли, интерлейкин-1 и γ-интерферон индуцируют синтез оксида азота (NO) и разных цитокинов. Бронхиолы и респираторный отдел. В стенке бронхиол нормально отсутствуют бокаловидные клетки (у курильщиков табака и при хронических бронхитах бокаловидные клетки обнаруживаются вплоть до респираторных бронхиол) и железы, а по мере приближения к респираторной поверхности исчезают и реснитчатые клетки. Поэтому в этих мелких воздухопроводящих трубках отсутствует система мукоцилиарного транспорта, и частицы диаметром <0,5 мкм в виде аэрозоля достигают респираторной поверхности. Тем не менее и здесь функционирует система очистки воздуха (клиренса), обеспечиваемого альвеолярными макрофагами, клетками Клара, сурфактантом, а также перемещением воздуха при дыхательных движениях (что способствует удалению взвешенных частиц).
V Альвеолярные макрофаги расположены на поверхности альвеол, с помощью длинных отростков они прикрепляются к поверхности эпителия и активно перемещаются по ней. Функции альвеолярных макрофагов многообразны.
♦ Фагоцитоз. Макрофаги фагоцитируют остатки сурфактанта, погибшие клетки, микроорганизмы, частицы аэрозоля и пылевые частицы.
♦ Антимикробная и противоопухолевая активность макрофагов опосредована кислородными радикалами, протеазами и различными цитокинами.
♦ Антитрипсин. Альвеолярные макрофаги секретируют а1-антитрипсин - гликопротеин из семейства сериновых протеаз, защищающий эластин альвеол от расщепления эластазой лейкоцитов. Мутация гена а1-антитрипсина - причина врож- дённой эмфиземы лёгких (поражение эластического каркаса альвеол).
♦ Антигенпредставляющая функция выражена слабо. Более того, альвеолярные макрофаги вырабатывают факторы, ингибирующие функцию T-лимфоцитов, что снижает иммунный ответ.
♦ Пути миграции. Нагруженные фагоцитированным материалом макрофаги мигрируют в различных направлениях: вверх по бронхиолам и мелким бронхам, где макрофаги попадают в
слизистую плёнку и внутрь - в межальвеолярные перегородки, где они составляют 10-15% всех клеток перегородок.
V Сурфактант имеет несколько функций. 1. Предотвращает контакт поверхности альвеолоцитов с посторонними частицами и инфекционными агентами, попадающими в альвеолы с вдыхаемым воздухом. 2. Обволакиваемые сурфактантом частицы аэрозоля транспортируются из альвеол в бронхиальную систему, из которой они удаляются мукоцилиарным транспортом. 3. Сурфактант опсонизирует микроорганизмы, что облегчает их фагоцитоз альвеолярными макрофагами. 4. Сурфактант снижает поверхностное натяжение и тем самым стабилизирует мелкие дыхательные пути.
V Клетки Клара расположены в терминальных бронхиолах между реснитчатыми клетками и формируют дистальные (безреснитчатые) участки эпителия. Эти клетки секретируют гликозаминогликаны, определяющие консистенцию секрета бронхиол, а также служат источником липопротеинов для сурфактанта терминальных бронхиол. Наконец, клетки Клара участвуют в инактивации поступающих с вдыхаемым воздухом токсинов при помощи холестерол монооксигеназы (цитохром P450).
Просвет воздухоносных путей
• Воздухоносные пути не спадаются, а их просвет постоянно изменяется и регулируется в связи с реальной ситуацией. Спадение просвета воздухоносных путей предотвращает присутствие в их стенке плотных структур, образованных в начальных отделах костной, а далее - хрящевой тканью. Изменение величины просвета воздухоносных путей обеспечивают также складки слизистой оболочки, ГМК (тонус ГМК) и эластические структуры стенки. На состояние просвета бронхиального дерева значительное влияние оказывает и тонус ГМК кровеносных сосудов, находящихся в тесном контакте с бронхиальным деревом. Тонус ГМК воздухоносных путей регулируют нейромедиаторы, гормоны, метаболиты арахидоновой кислоты. Эффекты зависят от присутствия соответствующих рецепторов. ГМК стенки воздухоносных путей имеют м-холинорецепторы, рецепторы гистамина, а- и β-адренорецепторы и др. Нейромедиаторы секретируются из терминалей нервных окончаний вегетативного отдела нервной системы (для блуждающего нерва - ацетилхолин; для нейронов симпатического ствола - норадреналин).
V Бронхоконстрикция. Сужение просвета воздухоносных путей вызывают ацетилхолин, вещество P, нейрокинин A, гистамин, ПгD2, тромбоксан TXA2, лейкотриены LTC4, LTD4, LTE4.
V Бронходилатация. Расширение просвета воздухоносных путей вызывают VIP, адреналин, брадикинин, ПгЕ2.
• Тонус ГМК бронхиальных сосудов
V Вазоконстрикция. Сокращение ГМК бронхиальных сосудов вызывают адреналин, лейкотриены LTC4, LTD4, LTE4, ангиотензин II, эндотелин.
V Вазодилатация. Расслабляющий эффект на ГМК сосудов бронхов оказывают гистамин, брадикинин, VIP, ПгГ_)2, тромбоксан TXA2, оксид азота (NO), простациклин I2.
Иммунная защита
Слизистая оболочка воздухоносных путей участвует в защитных иммунных реакциях. В составе эпителия присутствуют отдельные лимфощиты и антигенпредставляющие клетки Лангерханса (рис. 25-12), тогда как собственный слой слизистой оболочки содержит значительное количество различных иммунокомпетентных клеток (T- и В-лимфоциты; синтезирующие Ig плазматические клетки; макрофаги и дендритные клетки). Особенности иммунной системы дыхательных путей: специальные антигенпредставляющие клетки (дендритные и Лангерханса), постоянное присутствие в эпителии лимфоцитов, трансэпителиальный перенос на поверхность эпителия IgA, выраженность аллергических реакций немедленного типа (тип I реакций гиперчувствительности), при которых происходит дегрануляция тучных клеток и освобождение из них гистамина и других медиаторов, оказывающих мощный бронхоконстрикторный эффект и значительно усиливающих секрецию желёз.
• Антигенпредставляющие клетки. Дендритные клетки и клетки Лангерханса (рис. 25-12) - главные антигенпредставляющие клетки лёгкого. Их особенно много в верхних дыхательных путях. С уменьшением калибра бронхов число этих клеток уменьшается. Как антигенпредставляющие, лёгочные клетки Лангерханса и дендритные клетки экспрессируют молекулы MHC I и MHC II. Эти клетки имеют рецепторы Fc-фрагмента IgG, фрагмента С3Ы-комплемента, интерлейкин-2; клетки синтезируют ряд цитокинов, включая интерлейкины 1 и 6, фактор некроза опухоли α (TNFa); стимулируют T-лимфоциты, проявляя повышенную активность в отношении Аг (аллергенов), впервые оказавшихся в организме.
• Плазматические клетки. Клоны этих клеток дифференцируются из В-лимфоцитов и ответственны за синтез АТ (IgG, IgE, IgA). IgG попадают в кровь и циркулируют в ней в составе фракции γ-глобулинов, IgE принимают участие в местных аллергических реакциях, IgA транспортируются через эпителиальные клетки при помощи опос-
 Рис. 25-12. Иммунокомпетентные клетки стенки бронха [11].
Над однослойным эпителием схематически даны Аг (треугольники) и АТ (в
виде буквы Y). В нижней части рисунка изображены просветы кровеносного
капилляра (слева) и лимфатического сосуда (справа). В собственном слое
слизистой оболочки (средняя часть рисунка) слева направо: лимфоцит,
дендритная клетка (ДК), тучная клетка, плазматическая клетка,
лимфоциты. Дендритные клетки в паренхиму лёгких поступают с кровью.
Часть из них мигрирует в эпителий внутрилёгочных воздухоносных путей и
дифференцируется в клетки Лангерханса (КЛ). Последние захватывают Аг и
переносят его в регионарные лимфатические узлы
Рис. 25-12. Иммунокомпетентные клетки стенки бронха [11].
Над однослойным эпителием схематически даны Аг (треугольники) и АТ (в
виде буквы Y). В нижней части рисунка изображены просветы кровеносного
капилляра (слева) и лимфатического сосуда (справа). В собственном слое
слизистой оболочки (средняя часть рисунка) слева направо: лимфоцит,
дендритная клетка (ДК), тучная клетка, плазматическая клетка,
лимфоциты. Дендритные клетки в паренхиму лёгких поступают с кровью.
Часть из них мигрирует в эпителий внутрилёгочных воздухоносных путей и
дифференцируется в клетки Лангерханса (КЛ). Последние захватывают Аг и
переносят его в регионарные лимфатические узлы
• редованного рецепторами эндоцитоза (см. главу 2 и рис. 2-12) и последующего экзоцитоза на поверхность воздухоносных путей и здесь нейтрализуют Аг. Тучные клетки морфологически и функционально сходны с базофилами крови, но это различные клеточные типы. Тучная клетка, как и базофил, происходит из предшественника в костном мозге, но окончательную дифференцировку проходит в соединительной ткани. Их особенно много в коже, в слизистой оболочке органов дыхательной и пищеварительной систем, вокруг кровеносных сосудов. Тучные клетки содержат многочисленные крупные гранулы
(модифицированные лизосомы). В плазмолемму встроены различные рецепторы, в том числе рецепторы к Fc-фрагменту IgE.
V Гранулы. Тучные клетки синтезируют и накапливают в гранулах разнообразные биологически активные вещества, медиаторы и ферменты: гепарин (гепаринсульфат), гистамин, триптазу, химазу, эластазу, дипептидазу, активатор плазминогена, кислые гидролазы, фактор хемотаксиса эозинофилов (ECF), фактор хемотаксиса нейтрофилов (NCF). Основной компонент гранул - отрицательно заряженный сульфатированный гликозаминогликан гепарин, синтезируемый и запасаемый исключительно тучными клетками Секретируемый клеткой гепарин связывает циркулирующий в крови антитромбин III, резко усиливая его противосвёртывающую активность. Гистамин вызывает сокращение ГМК, гиперсекрецию слизи, увеличение проницаемости сосудов с развитием отёка. Триптаза способствует расщеплению фибриногена, конверсии компонента комплемента С3 в анафилатоксин С3а, активации коллагеназы, деградации фибронектина. Триптаза, химаза, карбоксипептидаза В, другие протеазы и кислые гидролазы, выделяясь из дегранулирующей клетки, вызывают разрушение тканевого матрикса. При активации тучных клеток (наряду с секрецией содержимого гранул) образуются метаболиты арахидоновой кислоты - Пг, тромбоксан TXA2 и лейкотриены. Эти медиаторы обладают вазо- и бронхоактивными свойствами. Из мембранных фосфолипидов также образуется фактор активации тромбоцитов (PAF), относящийся к наиболее сильным спазмогенам.
V Функции. Тучные клетки участвуют в воспалительных и аллергических реакциях.
V Дегрануляция. Аг-связывающие Fab-фрагменты молекулы IgE специфически реагируют с Аг, попавшим в организм. Сформированный иммунный комплекс взаимодействует с рецепторами Fc-фрагментов IgE, встроенных в клеточную мембрану тучной клетки. Это взаимодействие и является сигналом для дегрануляции с высвобождением гистамина и других биологически активных веществ и развёртыванием острой аллергической реакции в виде резкого расширения просвета венул и увеличение проницаемости их стенки (развивается отёк). Одновременно усиливается секреторная активность клеток и просвет воздухоносных путей заполняется слизью, а также происходит сокращение ГМК стенки воздухоносных путей и уменьшение их просвета. Подобную картину можно наблюдать при аллергических реакциях (например, при бронхиальной астме, аллергическом рините, крапивнице).
Метаболические функции лёгких
В лёгких метаболизирует ряд биологически активных веществ.
• Ангиотензины. Декапептид ангиотензин I (обладает слабой сосудосуживающей активностью) конвертируется в мощный вазоконстриктор - октапептид ангиотензин II. Конверсию катализирует ан- гиотензин-превращающий фермент эндотелиальных клетках капилляров альвеол.
• Инактивация. Многие биологически активные вещества частично или полностью инактивируются в лёгких. Так, брадикинин инактивируется на 80% при помощи ангиотензин-превращающего фермента. С помощью соответствующих ферментов в лёгких инактивируются ПгE1 ПгE2, ПгF2α (но не ПгA1, ПгA2, ПгI2), лейкотриены, серотонин и норадреналин. В лёгких инактивируется также серотонин, но не ферментативно, а путём выведения из крови.
• Производные арахидоновой кислоты. Некоторые вазоактивные и бронхоактивные вещества метаболизируют в лёгких и могут освобождаться в кровоток. Наиболее важными среди них являются метаболиты арахидоновой кислоты: лейкотриены, вызывающие сужение воздухоносных путей и участвующие в воспалительных реакциях, и Пг (мощные вазоконстрикторы или вазодилататоры).