Нормальная физиология : Учебник. - Р.С. Орлов, А.Д. Ноздрачёв, 2009. - 688 с
|
|
|
|
ГЛАВА 20. БЕРЕМЕННОСТЬ И НОВОРОЖДЁННЫЙ
События, происходящие с яйцеклеткой до оплодотворения (развитие фолликула, овуляция) и после оплодотворения (дробление и имплантация), рассмотрены на рис. 20-1.
Периоды развития. В пренатальном (дородовом) развитии выделяют следующие периоды: начальный (1-я неделя развития, развивается концептус), зародьппевьй (2-я-8-я недели включительно, развивается эмбрион) и гаподный (от 9-й недели и до конца беременности, развивается плод). Сроки развития нового организма отсчитывают от момента оплодотворения.
Имплантация
Успешное наступление беременности после оплодотворения зависит от имплантации зародыша в стенку матки. Без этого события концептус будет вымыт из полости матки при следующей менструации. Имплантация происходит путём взаимодействия клеток эндометрия (эпителиальные и децидуальные) и клеток трофобласта. В ходе имплантации последовательно развёртываются фазы прилегания (аппозиции), слипания (адгезии) и погружения (инвазии).
Взаимодействия между эндометрием и бластоцистой
• Питание развивающегося проэмбриона при нахождении в полости матки и при имплантации осуществляется за счёт секретируемых железами эндометрия (под влиянием прогестерона жёлтого тела) белками, холестеролом, β-липопротеинами и гликопротеинами.
• Клетки эндометрия вырабатывают необходимые для имплантации компоненты межклеточного вещества, а также (в особенности позднее и на протяжении всей беременности) ряд гормонов и цитокинов (факторы роста фибробластов, соматомедин C, β-эндорфин, лейцин-энкефалин, пролактин, релаксины, а также ренин).
• Клетки трофобласта, помимо необходимых для имплантации компонентов межклеточного вещества и литических ферментов, секретируют также потенциальные иммуносупрессоры, гормоны и цитокины.
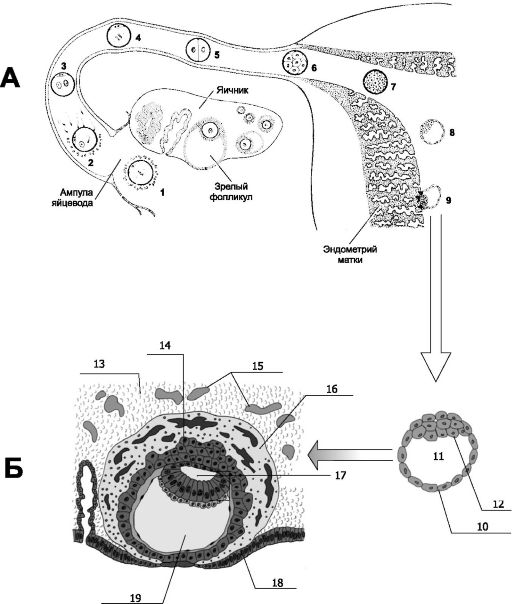 Рис. 20-1. КЛЮЧЕВЫЕ СОБЫТИЯ РАЗВИТИЯ ФОЛЛИКУЛА, ОВУЛЯЦИИ, ОПЛОДОТВОРЕНИЯ И ИМПЛАНТАЦИИ [18]. А. Развитие концептуса от оплодотворения до имплантации. Овуляция
наступает на 14-й день овариально-менструального цикла, в течение 1 сут
происходит оплодотворение. В течение 3 сут от момента оплодотворения
концептус продвигается по маточной трубе, на 4 сут попадает в полость
матки и через 5,5-6 сут имплантируется в эндометрий. В ходе перемещения
по маточной трубе происходит дробление, и в полости матки оказывается
бластоциста,
Рис. 20-1. КЛЮЧЕВЫЕ СОБЫТИЯ РАЗВИТИЯ ФОЛЛИКУЛА, ОВУЛЯЦИИ, ОПЛОДОТВОРЕНИЯ И ИМПЛАНТАЦИИ [18]. А. Развитие концептуса от оплодотворения до имплантации. Овуляция
наступает на 14-й день овариально-менструального цикла, в течение 1 сут
происходит оплодотворение. В течение 3 сут от момента оплодотворения
концептус продвигается по маточной трубе, на 4 сут попадает в полость
матки и через 5,5-6 сут имплантируется в эндометрий. В ходе перемещения
по маточной трубе происходит дробление, и в полости матки оказывается
бластоциста,
готовая к имплантации. 1 - овоцит тотчас после овуляции; 2 - оплодотворение через 12-24 часа после овуляции; 3 - стадия мужского и женского пронуклеусов (время жизни нового организма отсчитывается от этой стадии); 4 - начало дробления; 5 - 2-клеточная стадия (30 часов); 6 - морула, состоящая из 12-16 бластомеров (3 сут); 7 - продвинутая морула в полости матки (4 сут); 8 - ранняя бластоциста (4,5-5 сут); 9 - имплантация бластоцисты (5,5-6 сут). Б. Имплантация. Справа (под стрелкой, направленной сверху вниз) - предимплантационная бластоциста (прозрачной оболочки уже нет): 10 - трофобласт; 11 - бластоцель; 12 - внутренняя клеточная масса. Слева (левее стрелки, направленной справа налево): погружённая в эндометрий бластоциста. Внутренняя часть трофобласта представлена цитотрофобластом (14). В наружной части трофобласта (синцитиотрофобласт - 16) имеется большое количество лакун. 13 - децидуальная ткань; 14 - цитотрофобласт; 15 - расширенные кровеносные сосуды матки; 16 - формирование синцитиотрофобласта с лакунами; 17 - полость амниона; 18 - эпителий эндометрия; 19 - полость желточного мешка
Эмбрион и плод
Срок гестации. Календарную продолжительность беременности (срок гестации) исчисляют от первого дня последней менструации. Приблизительно через 2 нед после этого дня происходят овуляция и оплодотворение. Поэтому реальная продолжительность беременности меньше календарной на 2 нед.
Периодизация. До 10-й недели гестации (8 нед после оплодотворения) продукт зачатия называют эмбрионом, а после 10-й недели и до рождения - плодом.
Система «мать-плод». Развитие эмбриона и плода происходит при тесном метаболическом взаимодействии с организмом матери. Такое взаимодействие осуществляется через кровь. В состав системы «мать- плод» (см. рис. 20-3 и 20-4) входят: 1) собственно развивающийся организм; 2) находящиеся в составе пупочного канатика (пуповины) кровеносные сосуды, разветвляющиеся в ворсинчатом хорионе (часть плаценты); 3) плацента (как плодная её часть - ворсинчатый хорион, так и материнская часть - примыкающая к ворсинчатому хориону децидуальная оболочка); 4) кровеносные сосуды матки. С функциональной точки зрения выделяют плацентарный барьер на пути «материнская кровь - кровь плода».
Провизорные органы. В эмбриональном периоде развиваются амнион, желточный мешок, аллантоис и хорион. Они образуют оболочки зародыша, связывают его с организмом матери и выполняют некоторые специальные функции.
Амнион (рис. 20-2) - образующий складки объёмистый мешок, заполненный амниотической жидкостью и на брюшной стороне при- креплённый к телу зародыша. Сформированный амниотический мешок содержит жидкость, защищающую зародыш при сотрясении, позволяющая плоду совершать движения и предотвращающая слипание плода с окружающими тканями. Амниотическая жидкость полностью замещается в течение 24 часов. 75% объёма амниотической жидкости пополняется за счёт выделяемой почками плода мочи, 25% составляет секреция жидкости из дыхательной системы плода. Более половины амниотической жидкости удаляется при её заглатывании через ЖКТ
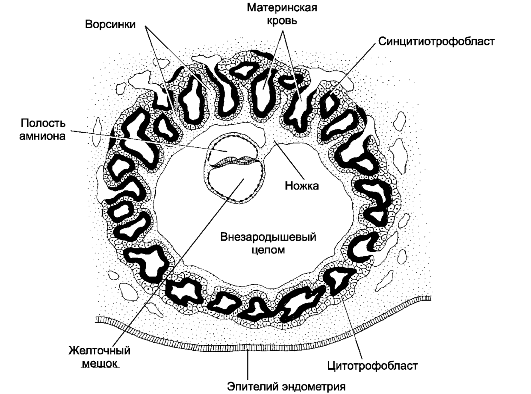 Рис. 20-2. Трёхнедельный эмбрион на стадии гаструлы [11].
Сформированы полость амниона и желточный мешок. Клетки трофобласта,
образующие плаценту, вступают в контакт с кровеносными сосудами матки.
Зародыш связан с трофобластом происходящей из внезародышевой мезодермы
ножкой тела. В ножку тела прорастает аллантоис, здесь протекает
ангиогенез, и в дальнейшем формируется пупочный канатик с проходящими в
его составе пупочными (аллантоисными) сосудами: двумя пупочными
артериями и одной пупочной веной
Рис. 20-2. Трёхнедельный эмбрион на стадии гаструлы [11].
Сформированы полость амниона и желточный мешок. Клетки трофобласта,
образующие плаценту, вступают в контакт с кровеносными сосудами матки.
Зародыш связан с трофобластом происходящей из внезародышевой мезодермы
ножкой тела. В ножку тела прорастает аллантоис, здесь протекает
ангиогенез, и в дальнейшем формируется пупочный канатик с проходящими в
его составе пупочными (аллантоисными) сосудами: двумя пупочными
артериями и одной пупочной веной
плода, 15% - через лёгкие, около трети - через стенку амниотического мешка.
Желточный мешок (рис. 20-2) - вынесенная за пределы зародыша часть первичной кишки. Стенка желточного мешка состоит из двух слоёв: внутренний слой образован внезародышевой энтодермой, а наружный - внезародышевой мезодермой. В период наибольшего развития желточного мешка его кровеносные сосуды отделены от стенки матки тонким слоем ткани, что делает возможным поглощение из матки питательных веществ и кислорода. Внезародышевая мезодерма служит местом эмбрионального гемопоэза. Здесь формируются кровяные островки, в которых из стволовых кроветворных клеток дифференцируются клетки крови. Внезародышевая энтодерма желточного мешка служит источником первичных половых клеток; они мигрируют в зачатки гонад, где дифференцируются в гаметы. Позднее складки амниона сдавливают желточный мешок; образуется узкая перемычка, соединяющая его с полостью первичной кишки, - желточный стебелёк. Эта структура удлиняется и вступает в контакт с ножкой тела, содержащей аллантоис. Желточный стебелёк и ножка аллантоиса вместе со своими сосудами образуют пупочный канатик, отходящий от зародыша в области пупочного кольца. Желточный стебелёк обычно полностью зарастает к концу 3-го месяца развития плода. Приблизительно в 2% случаев (чаще у мужчин) часть желточного стебелька, прилегающая к кишке, образует дивертикул Меккеля - слепой отросток подвздошной кишки.
Аллантоис. Задняя стенка желточного мешка к 16-му дню развития формирует небольшой вырост - аллантоис, образованный внезародышевыми энтодермой и мезодермой. Дистальная часть аллантоиса по мере роста быстро расширяется и превращается в мешок, соеди- нённый с кишкой при помощи ножки. У человека аллантоис рудиментарен, но участвует в формировании сосудистой сети плаценты.
Хорион. Соединение трофобласта и внезародышевой мезодермы приводит к образованию хориона (рис. 20-2). Хорион является плодной частью плаценты. При формировании хориона различают предворсинчатый (7-8-й день развития) период и период образования ворсинок (по 90-й день).
• Предворсинчатый период соответствует фазе инвазии бластоцисты в эндометрий (рис. 20-1Б), когда в ткани эндометрия появляются полости (лакуны), заполненные кровью матери. Эти лакуны разделены перегородками из клеток трофобласта.
• Период образования ворсинок (ворсинчатый хорион). Перегородки из клеток трофобласта последовательно образуют первичные, вторичные, третичные и комплексные ворсинки. С 3-й недели разви-
тия появляются третичные ворсинки с кровеносными сосудами, содержащими кровь плода. Ворсинки, обращённые к децидуальной оболочке, кровоснабжаются не только из сосудов, происходящих из хориальной мезодермы, но и из сосудов аллантоиса. Период соединения ветвей пупочных сосудов с местной сетью кровообращения совпадает с началом сердечных сокращений (21-й день развития), и в третичных ворсинках начинается циркуляция эмбриональной крови. Васкуляризация ворсинок хориона заканчивается, как правило, на 10-й неделе беременности. К этому же сроку формируется плацентарный барьер, находящийся между кровеносными капиллярами ворсинок и лакунами, заполненными материнской кровью. Общая поверхность ворсинок достигает 14 м2, что обеспечивает высокий уровень обмена между беременной и плодом.
Плацента
Плацента связывает плод с организмом матери и состоит из плодной (ворсинчатый хорион) и материнской (децидуальная оболочка) частей (рис. 20-3). В плаценте ворсины хориона, содержащие кровеносные капилляры плода, омываются кровью беременной, циркулирующей в межворсинчатом пространстве. Кровь плода и кровь беременной разделены плацентарным барьером - трофобластом, стромой
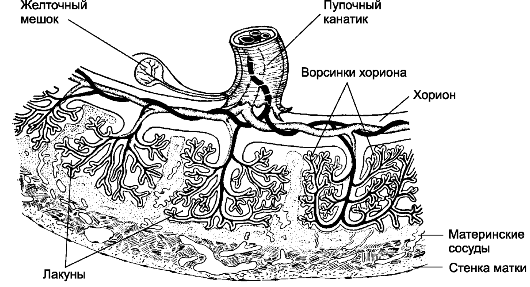 Рис. 20-3. Плацента [11].
С увеличением срока беременности ворсинки становятся разветвлённее. В
сформированной плаценте присутствуют скопления разветвлённых ворсинок
Рис. 20-3. Плацента [11].
С увеличением срока беременности ворсинки становятся разветвлённее. В
сформированной плаценте присутствуют скопления разветвлённых ворсинок
ворсин и эндотелием капилляров плода. Перенос веществ через плацентарный барьер осуществляется за счёт пассивной диффузии (кислород, углекислый газ, электролиты, моносахариды), активного транспорта (железо, витамин С) или опосредованной переносчиками облегчённой диффузии (глюкоза, Ig).
Кровоток в плаценте
Пуповина, или пупочный канатик (рис. 20-2, 20-3) - шнуровидное образование, содержащее две пуповинные артерии и одну пуповинную вену, несущие кровь от плода к плаценте и обратно. По пуповинным артериям течёт венозная кровь от плода к ворсинкам хориона в составе плаценты. По вене к плоду притекает артериальная кровь, обогащённая кислородом в кровеносных капиллярах ворсинок. Общий объёмный кровоток через пуповину составляет 125 мл/ кг/мин (500 мл/мин).
Артериальная кровь беременной впрыскивается непосредственно в межворсинчатое пространство (лакуны, см. рис. 20-2 и 20-3) под давлением и толчками из примерно сотни расположенных перпендикулярно по отношению к плаценте спиральных артерий. Лакуны полностью сформированной плаценты содержат около 150 мл омывающей ворсинки материнской крови, полностью замещаемой 3-4 раза в минуту. Из межворсинчатого пространства венозная кровь оттекает через расположенные параллельно плаценте венозные сосуды.
Плацентарный барьер. В состав плацентарного барьера (материнская кровь о кровь плода) входят: синцитиотрофобласт о цитотрофобласт о базальная мембрана трофобласта о соединительная ткань ворсинки о базальная мембрана в стенке капилляров ворсинки о эндотелий капилляров ворсинки. Именно через эти структуры происходит обмен между кровью беременной и кровью плода. Именно эти структуры реализуют защитную (в том числе иммунную) функцию плода.
Функции плаценты
Плацента выполняет множество функций, включая транспорт питательных веществ и кислорода от беременной к плоду, удаление продуктов жизнедеятельности плода, синтез белков и гормонов, иммунологическую защиту плода.
• Транспортная функция Перенос кислорода и диоксида углерода происходит путём пассивной диффузии.
-Ф- O2. Парциальное давление кислорода (Po2) артериальной крови спиральных артериол при pH 7,4 равно 100 мм рт.ст. при насы-
щении Hb кислородом 97,5%. В то же время Po2 крови в венозной части капилляров плода составляет 23 мм рт.ст. при насыщении Hb кислородом 60%. Хотя Po2 материнской крови в результате диффузии кислорода быстро уменьшается до 30-35 мм рт.ст., даже этой разницы в 10 мм рт.ст. достаточно для адекватного снабжения кислородом организма плода. Эффективной диффузии кислорода от матери к плоду способствуют дополнительные факторы.
♦ Hb плода имеет большее сродство к кислороду, чем дефинитивного Hb беременной (кривая диссоциации HbF сдвинута влево). При одинаковых Po2 Hb плода связывает на 20-50% больше кислорода, чем Hb матери.
♦ Концентрация Hb в крови плода выше (это увеличивает кислородную ёмкость), чем в крови матери. Таким образом, несмотря на то, что насыщение кислородом крови плода редко превышает 80%, гипоксии тканей плода не возникает.
♦ pH крови плода ниже pH цельной крови взрослого человека. При увеличении концентрации ионов водорода сродство кислорода к Hb уменьшается (эффект Бора), поэтому кислород легче переходит из крови матери в ткани плода.
-О- CO2 диффундирует через структуры плацентарного барьера по направлению концентрационного градиента (примерно 5 мм рт.ст.) между кровью пуповинных артерий (48 мм рт.ст.) и кровью лакун (43 мм рт.ст.). Кроме того, Hb плода имеет меньшее сродство к CO2, чем дефинитивный Hb матери.
• Мочевина, креатинин, стероидные гормоны, жирные кислоты, билирубин. Их перенос происходит путём простой диффузии, но плацента слабо проницаема для образующихся в печени глюкуронидов билирубина.
• Глюкоза - облегчённая диффузия.
• Аминокислоты и витамины - активный транспорт.
• Белки (например, трансферрин, гормоны, некоторые классы Ig), пептиды, липопротеины - опосредованный рецепторами эндоцитоз.
• Электролиты - Na+, K+, Cl-, Ca2+, фосфат - пересекают барьер путём диффузии и с помощью активного транспорта. Иммунологическая зашита
• Транспортируемые через плацентарный барьер материнские АТ класса IgG обеспечивают пассивный иммунитет плода.
• Организм беременной не отторгает иммунологически чужеродный плод из-за локального угнетения реакций клеточного иммунитета женщины и отсутствия гликопротеинов главного комплекса гистосовместимости (HLA) в клетках хориона.
Детоксикация некоторых ЛС.
Эндокринная функция. Плацента - эндокринный орган. Плацента синтезирует множество гормонов и других биологически активных веществ, имеющих важное значение для нормального течения беременности и развития плода (ХГТ, прогестерон, хорионический соматомаммотропин, фактор роста фибробластов, трансферрин, пролактин, релаксины, кортиколиберин, эстрогены и другие; см. рис. 20-4,
рис. 20-10).
• Хорионический гонадотропин (ХГТ) поддерживает непрерывную секрецию прогестерона в жёлтом теле до тех пор, пока плацента не начнёт синтезировать прогестерон в количестве, достаточном для нормального течения беременности. Активность ХГТ быстро возрастает, удваиваясь каждые 2-3 дня и достигая пика на 80-й день (80 000-100 000 МЕ/л), затем снижается до 10 000-20 000 МЕ/л и остаётся на этом уровне до конца беременности. ХГТ продуцируют только клетки синцитиотрофобласта. ХГТ можно обнаружить в сыворотке крови беременной через 8-9 дней после оплодотворения. Количество секретируемого ХГТ напрямую связано с массой цитотрофобласта. На ранних сроках беременности это обстоятельство используют для диагностики нормальной и патологической беременности. Содержание ХГТ в крови и в моче беременной можно определить биологическим, иммунологическим и радиологическим методами. Иммунологические (в том числе радиоиммунологические) тесты специфичнее и чувствительнее биологических методов. При снижении концентрации ХГТ вдвое по сравнению с нормальными значениями можно ожидать нарушения имплантации (например, эктопическую беременность или неразвивающуюся маточную беременность). Повышение концентрации ХГТ выше нормальных значений часто связано с многоплодной беременностью или пузырным заносом.
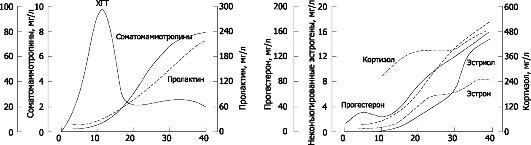 Рис. 20-4. Содержание гормонов в плазме крови при беременности [13]
Рис. 20-4. Содержание гормонов в плазме крови при беременности [13]
• Прогестерон. В первые 6-8 недель беременности главный источник прогестерона - жёлтое тело (содержание в крови беременной =60 нмоль/л). Со II триместра беременности основным источником прогестерона становится плацента (содержание в крови >150 нмоль/л). Жёлтое тело продолжает синтезировать прогестерон, но в последнем триместре беременности плацента вырабатывает его в 30-40 раз больше. Концентрация прогестерона в крови продолжает увеличиваться вплоть до конца беременности (содержание в крови >500 нмоль/л, примерно в 10 раз больше, чем вне беременности), когда плацента синтезирует 250 мг прогестерона в сутки. Для определения содержания прогестерона используют радиоиммунный метод, а также уровень прегнандиола - метаболита прогестерона - хроматографически.
• Эстрогены. При беременности содержание эстрогенов в крови беременной (эстрон, эстрадиол, эстриол) существенно повышено (рис. 20-6) и превышает значения вне беременности примерно в 30 раз. При этом эстриол составляет 90% всех эстрогенов (=1,3 нмоль/л на 7-й неделе беременности, >70 нмоль/л к концу беременности). К концу беременности экскреция эстриола с мочой достигает 25-30 мг/сут. Синтез эстриола происходит при интеграции метаболических процессов беременной, плаценты и плода. Большую часть эстрогенов секретирует плацента, но в ней происходит не синтез этих гормонов de novo, а лишь ароматизация стероидных гормонов, синтезированных надпочечниками плода. Эстриол - показатель нормальной жизнедеятельности плода и нормального функционирования плаценты. С диагностическими целями содержание эстриола определяют в периферической крови и суточной моче. Высокие концентрации эстрогена вызывают увеличение мышечной массы матки, размеров молочной железы, наружных половых органов.
• Релаксины - гормоны из семейства инсулинов - в течение беременности оказывают расслабляющее действие на миометрий, перед родами приводят к расширению маточного зева и повышению эластичности тканей лонного сочленения.
• Соматомаммотропины 1 и 2 (плацентарные лактогены) образуются в плаценте спустя 3 нед после оплодотворения и могут быть определены в сыворотке крови женщины радиоиммунным методом с 6 нед беременности (=35 нг/мл, =10 000 нг/мл в конце беременности). Эффекты соматомаммотропинов, как и эффекты гормона роста, опосредуют соматомедины.
• Пролактин. Во время беременности существует три потенциальных источника пролактина: передняя доля гипофиза матери и плода, децидуальная ткань матки. У небеременной женщины содержание про-
лактина в крови находится в диапазоне 8-25 нг/мл, при беременности постепенно возрастает до 100 нг/мл к концу беременности. Основная функция пролактина - подготовка молочных желёз к лактации.
• Рилизинг-гормоны. В плаценте происходит синтез всех известных гипоталамических рилизинг-гормонов и соматостатина.
Развитие плода
Эмбриональный период заканчивается после 10-й недели гестации (8-й недели после оплодотворения). Плодный период характеризуется ростом и развитием структур, сформировавшихся в эмбриональном периоде.
Гемодинамика плода
Оксигенированная и обогащённая питательными веществами кровь поступает от плаценты к плоду по пуповинным венам. Кровеносная система плода рассмотрена на рис. 20-5, а также на рис. 20-15. Наличие шунтов, направляющих оксигенированную кровь в артериальный кровоток, особенно к головному мозгу, - характерная особенность кровообращения плода.
• Венозный проток (ductus venosus) соединяет портальный синус и нижнюю полую вену, что позволяет части пуповинной и портальной крови (с помощью сфинктера) обходить печень (60%). Эта кровь, идущая в правый желудочек, оксигенирована не так хорошо, как кровь, поступающая непосредственно от плаценты.
• Овальное окно (foramen ovale) - внутрисердечный (артериальный) шунт, сбрасывающий кровь справа налево. Нижняя полая вена сообщается с обоими предсердиями через овальное окно.
• Артериальный (боталлов) проток - ductus arteriosus - анастомоз между левой лёгочной артерией и дугой аорты. Высокое сосудистое сопротивление в лёгочном дереве, обусловленное усиленным вазомоторным тонусом и коллапсом лёгких, в пять раз выше общего системного сопротивления. Давление в лёгочной артерии выше, чем в аорте, и кровь направляется в проток и в аорту.
❖ Простагландины, особенно простагландин Е, внутриутробная и неонатальная асфиксия поддерживают нормальное функционирование артериального протока. Инфузии простагландинов Е1 и Е2 способствуют расширению артериального протока.
❖ Ингибиторы синтеза простагландинов, ацетилхолин, гистамин и катехоламины способствуют закрытию артериального протока. Индометацин - сильный ингибитор циклооксигеназы. У недоношенных детей установлена эффективность консервативного лечения открытого артериального протока индометацином.
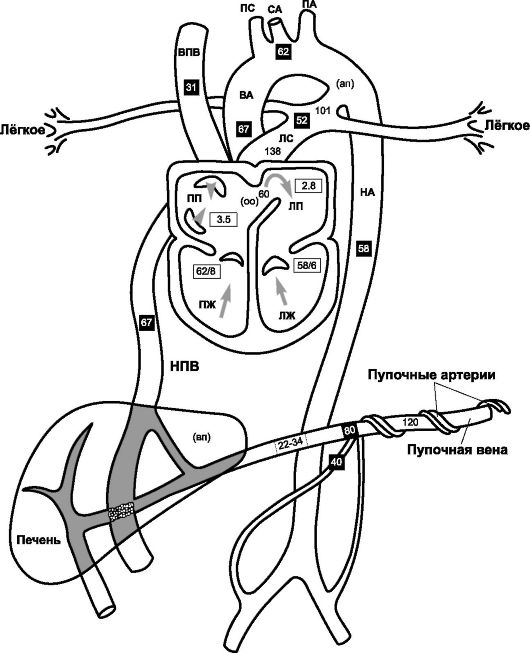 Рис. 20-5. Гемодинамика плода. Цифры в чёрных квадратах - насыщение О2
(%); цифры в белых квадратах - давление (мм рт.ст.); цифры вне
квадратов - удельный объёмный кровоток (мл/кг/мин); ВА - восходящая
аорта; НА - нисходящая аорта; (ап) - артериальный проток; (вп) -
венозный проток; (оо) - овальное окно; НПВ - нижняя полая вена; ЛП -
левое предсердие; ЛЖ - левый желудочек; ЛС - лёгочный ствол; ПП - правое
предсердие; ПЖ - правый желудочек; ВПВ - верхняя полая вена; ПС -
плечеголовной ствол; СА - левая общая сонная артерия; ПА - левая
подключичная артерия
Рис. 20-5. Гемодинамика плода. Цифры в чёрных квадратах - насыщение О2
(%); цифры в белых квадратах - давление (мм рт.ст.); цифры вне
квадратов - удельный объёмный кровоток (мл/кг/мин); ВА - восходящая
аорта; НА - нисходящая аорта; (ап) - артериальный проток; (вп) -
венозный проток; (оо) - овальное окно; НПВ - нижняя полая вена; ЛП -
левое предсердие; ЛЖ - левый желудочек; ЛС - лёгочный ствол; ПП - правое
предсердие; ПЖ - правый желудочек; ВПВ - верхняя полая вена; ПС -
плечеголовной ствол; СА - левая общая сонная артерия; ПА - левая
подключичная артерия
• Кровь поступает в правое предсердие из венечного синуса (5%), верхней полой вены (20%) и нижней полой вены (75%). Часть (45%) шунтируется в левое предсердие, а оставшаяся часть (55%) поступает в правый желудочек. Из правого желудочка кровь направляется в лёгкие (10%) и в артериальный проток (90%). Кровь из артериального протока поступает в нисходящую аорту, подчревные и пупочные артерии.
• Кровь из левого предсердия поступает в левый желудочек, восходящую аорту и сонные артерии.
Сердечный выброс у плода составляет 200 мл/кг/мин, что выше сердечного выброса взрослого. Выброс правого желудочка выше, чем левого; это отражается на ЭКГ плода. Распределение крови следующее: плацента - 40%, туловище - 37%, лёгкие - 5%, надпочечники - 2%, головной мозг - 3%, сердце - 4%, остальные органы -
9%.
Артериальное давление (АД) постепенно увеличивается на протяжении внутриутробного развития до 75/55 мм рт.ст. к концу гестации. Венозное давление в пупочной вене - 22-34 мм рт.ст; его значительное снижение приводит к гибели плода. ЧСС плода - 120-160/мин. Основные факторы регуляции внутрисосудистого давления у плода: тонус ГМК стенки сосудов, стимуляция вегетативной нервной системой, биогенные амины и метаболиты-вазодилататоры. Сокращения скелетных мышц, сила тяжести и дыхательные движения практически не влияют на параметры кровотока плода.
Транспорт кислорода к тканям плода
Аэробный метаболизм у плода преобладает над гликолизом. Сердце плода может выдерживать кислородную недостаточность дольше, чем сердце взрослого, так как в миокарде плода больше запасов гликогена.
• Увеличение кислородной ёмкости крови плода достигается многими путями.
❖ pH крови плода ниже pH цельной крови взрослого. При увеличении концентрации ионов водорода сродство кислорода к Hb уменьшается (эффект Бора), поэтому кислород легче переходит из крови в ткани плода.
❖ 2,3-бифосфоглицерат крови - в отличие от дефинитивных Hb - плохо связывается с ε-цепями HbF; в результате не нарушаются связывание и высвобождение кислорода.
❖ Содержание Hb в крови плода высокое, что увеличивает кислородную ёмкость. Таким образом, несмотря на то, что насыщение кислородом крови плода (рис. 20-5) редко превышает 70%, гипоксии тканей при этих значениях не возникает.
❖ Парциальное давление кислорода (рО2) в крови межворсинчатого пространства ниже, чем в крови беременной, что облегчает транспорт кислорода из крови женщины в кровь плода.
❖ Тканевое Po2 низкое (менее 15 мм рт.ст.), что способствует транспорту кислорода по градиенту концентрации.
• Гемоглобин плода. Кроветворение начинается в желточном мешке на 1-й неделе беременности, на 5-й неделе - в печени и селезён- ке и на 11-й неделе - в костном мозге. Сначала образуется эмбриональные Hb (типы Портленд, Gower [Гоуэр] I и Gower II). Эти Hb - комбинация α, β, γ, δ, θχ, ε или ζ. HbF (α2γ2) появляется на третьем месяце и отличается от дефинитивного Hb взрослого (HbA1 [α2β2] и HbA2 [ α2δ2]) присутствием двух γ-цепей вместо двух β-цепей. Дефинитивный Hb появляется во II триместре беременности, но к концу беременности 70% Hb составляет HbF. Переключение с фетального на дефинитивньгй Hb начинается в 3-м триместре беременности и заканчивается на 6-м месяце постнатальной жизни. Однако следы HbF присутствуют и в эритроцитах у взрослых. Содержание Hb у плода высокое - 160-180 г/л. Кривая диссоциации HbF сдвинута влево относительно кривой взрослого. При заданных pH и температуре Po2 крови плода ниже, чем крови беременной, что облегчает транспорт кислорода через плаценту.
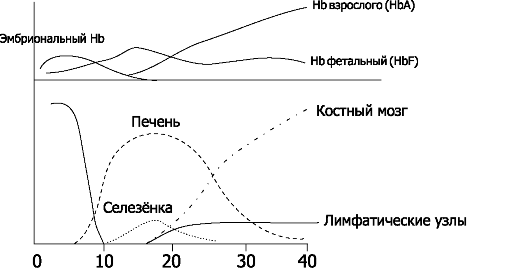 Рис. 20-6. Органы кроветворения плода и типы гемоглобина, образующегося во время внутриутробного развития [13]. По абсциссе - сроки беременности в неделях
Рис. 20-6. Органы кроветворения плода и типы гемоглобина, образующегося во время внутриутробного развития [13]. По абсциссе - сроки беременности в неделях
Метаболизм плода
• Масса плода к концу беременности увеличивается на 30 г/сут и достигает в среднем 3400 г (см. табл. 20-1). На массу тела при
рождении влияют расовая принадлежность, социально-экономический статус, порядковый номер беременности, генетические факторы, курение беременной, наличие у неё сахарного диабета, пол плода.
• Вода. Развивающийся организм состоит преимущественно из воды. С ростом плода количество внеклеточной жидкости уменьшается. В ранние сроки гестации 90-95% массы тела плода составляет вода, а к её концу - 70-75%. Когда масса плода достигает 800 г, начинается накопление липидов.
• Плод синтезирует белки из аминокислот крови беременной. Основной сахар крови плода - глюкоза, проходящая через плаценту с помощью облегчённой диффузии.
• Ферменты в раннем эмбриональном и плодном периодах связаны в первую очередь с образованием энергии, синтезом белка и липопротеинов, а также с органной и функциональной дифференцировкой. Активность ферментных систем меняется в зависимости от срока гестации. Так, в тканях плода преобладает М-форма лактатдегидрогеназы (активна при низких значениях Po2, что важно для осуществления реакций анаэробного гликолиза).
Сердечно-сосудистая система
• Сердечные сокращения у эмбриона появляются на 4-5-й неделях гестации.
• Фетоплацентарный объём крови к концу беременности составляет приблизительно 120 мл/кг.
Дыхательная система
• Дыхательные движения у плода появляются на 11-й неделе гестации. Поступление («вдыхание») амниотической жидкости в лёгкие на 16-22-й неделях гестации необходимо для их нормального развития. Нарушение этого процесса может привести к гипоплазии лёгких. В то же время дыхательные движения заторможены в последние три месяца беременности, что предохраняет лёгкие от наполнения органическими остатками из амниотической жидкости.
• Сурфактант - поверхностно-активное вещество, уменьшающее поверхностное натяжение в альвеолах и предотвращающее их спадение после рождения. Сурфактант образуют пневмоциты II типа. Функциональное созревание лёгких сопровождается увеличением содержания сурфактанта. При дефиците сурфактанта развивается болезнь гиалиновых мембран, или респираторный дистресс-синдром, наблюдаемый преимущественно у недоношенных.
Пищеварительная система
• Перистальтика тонкой кишки появляется на 11-й неделе беременности. С 16-й недели беременности плод может совершать глотательные движения. Плод заглатывает амниотическую жидкость и экскретирует меконий (амниотическая жидкость и остатки эпителия ЖКТ). ЖКТ функционально созревает за 2-3 мес до родов.
• Печень плода активно абсорбирует ЛС, но метаболизирует их медленно, так как механизмы детоксикации и инактивации развиты слабо (созревают только к концу внутриутробного развития). В течение последнего триместра в печени накапливается большое количество гликогена, в это же время созревают ферментные системы, обеспечивающие образование глюкозы.
Мочевыделительная система
При развитии эмбриона и плода последовательно формируются три почки: пронефрос, мезонефрос и метанефрос. Первая из них рудиментарна и не функционирует, вторая действует на ранних стадиях развития, метанефрос формирует постоянную почку.
• Постоянная почка (метанефрос) развивается из метанефрогенной бластемы (источник канальцев нефрона) и метанефрического дивертикула (источник собирательных трубочек и более крупных мочевыводящих путей) начиная с 5-й недели развития. Канальцы, объединяясь с капиллярным клубочком, формируют нефроны. Проксимальные концы нефрона образуют капсулу, в которую глубоко внедряется капиллярный клубочек. Дистальные концы нефрона соединяются с одной из собирательных трубочек. Далее канальцы удлиняются, в результате чего образуются проксимальные извитые канальцы, петля Хенле и дистальные извитые канальцы.
❖ Функции
♦ Образование мочи. Моча плода гипотонична относительно плазмы, содержит мало белка и глюкозы, слегка кислая (pH 6,0).
♦ Поддержание объёма амниотической жидкости - одна из главных функций мочевыделительной системы плода. Примерно с 9-й недели развития плод выделяет мочу в амниотическую полость (10 мл/кг/час), а также поглощает амниотическую жидкость в объёме до 0,5 л в день.
♦ Выведение мочевины. Азотистые остатки из организма плода удаляются путём диффузии через плаценту в кровь матери. Следовательно, почки матери служат для удаления и материнских, и плодных азотистых остатков. Мочевина легко проходит через плаценту. Часть мочевины попадает в кровь матери, поглощаясь из амниотической жидкости; часть попадает в кровь
плода после абсорбции из ЖКТ и затем через плаценту - в кровь матери.
Нервная система
• Развитие нервной системы происходит в течение всего периода гестации и продолжается после рождения до 2-го года жизни. Для развития ЦНС необходимо нормальное функционирование щитовидной железы.
• Способность воспринимать звуки появляется у плода на 24-26-й неделях гестации. С 28-й недели беременности глаза плода способны воспринимать свет.
Иммунная система
• В-лимфоциты появляются в печени плода на 9-й неделе гестации, а в крови - на 12-й неделе. Т-лимфоциты появляются в вилочковой железе плода на 14-й неделе гестации.
• Практически все IgG попадают к плоду от беременной. Транспорт IgG (опосредованный рецепторами) к плоду начинается на 16-й неделе гестации, однако основное количество IgG поступает к плоду в последние 4 нед беременности (именно поэтому концентрация IgG в крови у недоношенных очень низка). Другие Ig из организма матери не проходят через плацентарный барьер, но плод может синтезировать IgM в ответ на инфекцию.
• Организм плода может синтезировать некоторые соединения, необходимые для защиты от бактериального, вирусного и грибкового инфицирования (например, компоненты комплемента, лизоцим, γ- интерферон.
Эндокринная система
Эндокринные структуры плода (гипофиз, щитовидная железа, кора надпочечников, поджелудочная железа и гонады) начинают синтезировать гормоны с 11-14 недели гестации. В то же время необходимо иметь в виду, что к плоду через плаценту поступают многие гормоны, циркулирующие в организме беременной.
• Щитовидная железа плода. В конце I триместра беременности в организме плода начинается синтез йодсодержащих гормонов, появляющихся в амниотической жидкости. Лишь небольшая часть тиреоидных гормонов попадает к плоду от беременной. Содержание реверсивного T3 (rT3) амниотической жидкости намного выше концентрации rT3 крови беременной; следовательно, преобладающий йодсодержащий гормон плода - rT3.
• Половой фенотип
❖ Плод мужского пола. Клетки Ляйдига яичек плода мужского пола под контролем гонадотропинов (хорионического и гипофизарного) секретируют тестостерон, индуцирующий формирование семявыносящего протока, придатка яичка, семенных пузырьков. Клетки Сертоли яичек плода секретируют мюллеров ингибирующий фактор, вызывающий регрессию мюллеровых протоков у плода мужского пола.
❖ Плод женского пола. Формирование по женскому фенотипу идёт автономно, под влиянием гормонов плаценты и беременной. При отсутствии мюллерова ингибирующего фактора мюллеров проток развивается в маточные трубы, матку и верхнюю треть влагалища. При отсутствии тестостерона вольфов проток дегенерирует. Яичники начинают функционировать в пубертате.
• Половые стероидные гормоны - эстрогены и прогестерон - не синтезируются тканями плода, так как плод не экспрессирует двух важных гормонов 3β-гидроксистероид дегидрогеназа и ароматаза) синтеза эстрогенов и прогестерона. Синтез этих гормонов осуществляется в организме беременной и в плаценте.
Организм женщины при беременности
В ответ на потребности, создаваемые беременностью, в организме женщины возникают адаптационные процессы (рис. 20-7). Эти потребности определяются увеличивающимися массой плода и объёмом амниотической жидкости, необходимостью питания плода и плаценты в форме глюкозы, аминокислот, кислорода, выведения продуктов обмена плода и защиты плода от различных изменений в организме беременной (например, голодания или приёма потенциально опасных ЛС). Адаптация затрагивает все системы организма беременной. Качество, уровень и время наступления адаптации в отдельных системах организма различны, индивидуально вариабельны и регулируются преимущественно гормонами (особенно важны повышенные уровни прогестерона и отчасти эстрогенов).
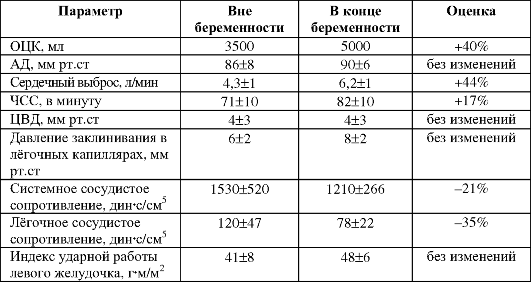
Масса тела женщины к концу одноплодной беременности увеличивается в среднем на 14 кг (около 5 кг приходится на внутриматочное содержимое, около 9 кг на материнский организм (табл. 20-1).
Сердечно-сосудистая система. Характеристики сердечно-сосудистой системы беременной женщины приведены на рис. 20-10 и в табл.
20-4.
• Объём циркулирующей крови (ОЦК, рис. 20-8А, табл. 20-2). ОЦК беременной увеличивается в течение I, II и в начале III триместров беременности (особенно значительно в течение II триместра) на
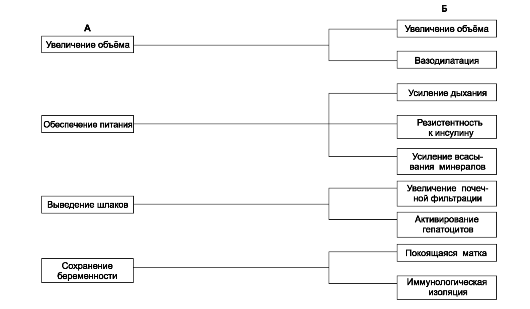 Рис. 20-7. Адаптация организма женщины к беременности [18]. А - запросы плода; Б - реакции материнского организма
Рис. 20-7. Адаптация организма женщины к беременности [18]. А - запросы плода; Б - реакции материнского организма
Таблица 20-1. Увеличение массы тела беременной, в кг (усреднённые значения). [13]
 40-45%
при одноплодной беременности (Т75% и Т100% при двойне и тройне
соответственно) и достигает плато в течение последних нескольких недель
беременности. ОЦК возрастает за счёт увеличения объёма плазмы (Т50%) и в
несколько меньшей степени за счёт увеличения эритроцитарной массы
(=33%) Изменения объёма плазмы крови практически повторяют значения ОЦК,
эритроцитарная масса начинает увеличиваться примерно с 12-й недели.
Предполагаемые механизмы увеличения ОЦК таковы:
40-45%
при одноплодной беременности (Т75% и Т100% при двойне и тройне
соответственно) и достигает плато в течение последних нескольких недель
беременности. ОЦК возрастает за счёт увеличения объёма плазмы (Т50%) и в
несколько меньшей степени за счёт увеличения эритроцитарной массы
(=33%) Изменения объёма плазмы крови практически повторяют значения ОЦК,
эритроцитарная масса начинает увеличиваться примерно с 12-й недели.
Предполагаемые механизмы увеличения ОЦК таковы:
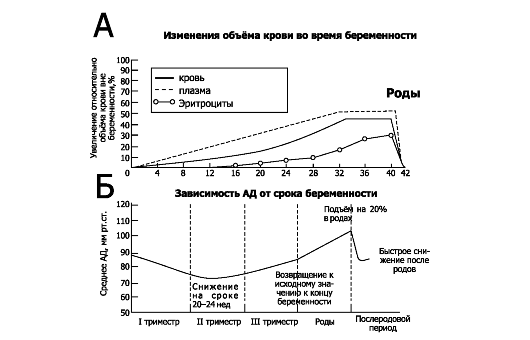 Рис. 20-8. ГЕМОДИНАМИКА ОРГАНИЗМА БЕРЕМЕННОЙ [13]. А. Изменения объёма крови. Б. Артериальное давление на разных сроках беременности
Рис. 20-8. ГЕМОДИНАМИКА ОРГАНИЗМА БЕРЕМЕННОЙ [13]. А. Изменения объёма крови. Б. Артериальное давление на разных сроках беременности
Таблица 20-2. Изменения гемодинамики во время беременности [13]
 -Φ-
Повышенное содержание прогестерона и эстрогенов приводит к
вазодилатации, что уменьшает общее периферическое сосудистое
сопротивление. В результате уменьшаются АД, перфузия почек, фильтрация и
образование первичной мочи. Результат: увеличение ОЦК.
-Φ-
Повышенное содержание прогестерона и эстрогенов приводит к
вазодилатации, что уменьшает общее периферическое сосудистое
сопротивление. В результате уменьшаются АД, перфузия почек, фильтрация и
образование первичной мочи. Результат: увеличение ОЦК.
-ФПлацентарные эстрогены увеличивают синтез ангиотензиногена в печени, а сочетанное действие эстрогенов и прогестерона стимулирует синтез ренина в почках. Ренин расщепляет ангиотензиноген до ангиотензина I, который затем конвертируется в ангиотензин II в лёгких и в других тканях. Повышенное содержание ангиотензина II действует на клубочковую зону коры надпочечников, стимулируя секрецию альдостерона. Альдостерон же способствует задержке жидкости путём увеличения реабсорбции натрия и воды в дистальных извитых канальцах почек.
-ФПри беременности искажается зависимость между секрецией АДГ и осмоляльностью плазмы крови, что способствует увеличению
ОЦК.
• Общее периферическое сопротивление сосудов. На ранних сроках беременности в результате повышения концентрации прогестерона уменьшается общее периферическое сопротивление сосудов, что неизбежно сопровождается снижением АД. В ответ на это происходит увеличение сердечного выброса на 30-50%.
• Сердечный выброс существенно возрастает в I триместре (Т35%- 40%), а далее постепенно достигает максимального значения к концу беременности (Т=45%). Увеличение сердечного выброса происходит за счёт увеличения ЧСС, но главным образом за счёт увеличения ударного объёма. При этом увеличивается перфузия сосудов почек, матки, миокарда, молочных желёз, кожи, но не изменяется перфузия кровеносных сосудов головного мозга, ЖКТ и мышц. Положение тела влияет на величину сердечного выброса (в особенности в конце беременности): сердечный выброс больше в положении лёжа на боку, чем в положении лёжа на спине, так как при этом дно матки давит на нижнюю полую вену, препятствуя венозному возврату к сердцу.
• Артериальное давление (рис. 20-8Б). Увеличение ОЦК сочетается со снижением чувствительности периферических сосудов к сосудосуживающему эффекту ангиотензина II. Это приводит к снижению АД в начале II триместра беременности у большинства женщин, несмотря на высокий уровень циркулирующего ангиотензина II. Далее АД неуклонно повышается, достигая к III триместру значений, регистрируемых до беременности. Значения АД (особенно в конце беременности) существенно зависят от положения тела: так,
АД в плечевой артерии наибольшее в положении сидя и наименьшее в положении лёжа на боку. Кровь
• Эритроциты. В результате увеличения ОЦК развивается гемодилюционная (вследствие разведения) анемия. Повышение образования эритропоэтина приводит к компенсаторному увеличению абсолютного количества эритроцитов (рис. 20-8А), но анемия при этом полностью никогда не корригируется. Показатель СОЭ при беременности всегда увеличен.
• Лейкоциты. Беременность иногда сопровождается умеренным увеличением содержания лейкоцитов (лейкоцитозом), однако лейкоцитарная формула при этом остаётся неизменённой.
• Тромбоциты. Умеренную тромбоцитопению (содержание тромбоцитов менее 150х109/л) наблюдают у 10% беременных. Тромбоцитопения, вероятно, обусловлена гемодилюцией и редко становится клинически значимой.
• Свёртываемость крови. При беременности наблюдают состояние гиперкоагуляции (повышенная свёртываемость крови) в связи с повышением концентрации прокоагулянтов - факторов свёртыва- ния крови (I (фибриноген), VII, VIII, IX и X). Состояние гиперкоагуляции препятствует чрезмерной кровопотере в родах, но в то же время предрасполагает к возникновению тромбоэмболий.
• Кислород и углекислота. При беременности происходит уменьшение парциального давления углекислого газа в артериальной крови (paCO2). paO2 не меняется, но кривая диссоциации оксигемоглобина смещается вправо (см. рис. 20-9Б).
• pH крови (среднее значение - 7,4) не изменяется. Дыхательная система. Функция внешнего дыхания представлена на
рис. 20-9А. Во время беременности гормональные и механические факторы приводят к увеличению альвеолярной вентиляции (VA).
• Уровень стояния диафрагмы вследствие эффектов прогестерона поднимается примерно на 4 см. В то же время костовертебральный угол (угол, образованный поясничным отделом позвоночника и нижним краем XII ребра) значительно расширяется, как и поперечный диаметр грудной клетки (Т2 см). Хотя изменения этих параметров оказывают противоположный эффект на остаточный объём (ОО) воздуха в лёгких, преобладает влияние подъёма диафрагмы, что и приводит к снижению ОО и функциональной остаточной ёмкости (ФОЕ).
• Другие параметры спирограммы (жизненная ёмкость лёгких [ЖЕЛ], форсированная жизненная ёмкость лёгких [ФЖЕЛ], объём форсированного выдоха за 1 с [ОФВ1], индекс Тиффно [отношение ОФВ1
• 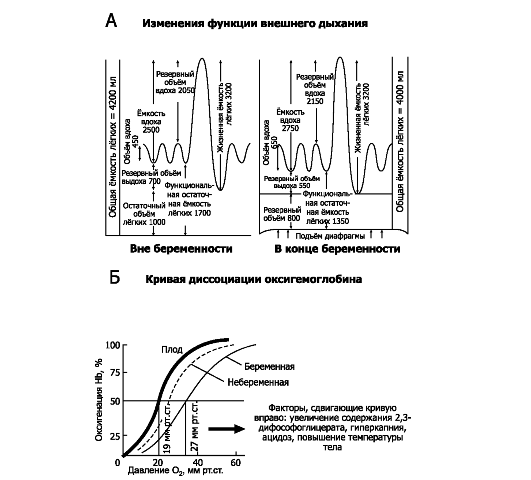 Конечный результат способствует доставке кислорода к плоду
Конечный результат способствует доставке кислорода к плоду
Рис. 20-9. Функции дыхания у беременной [13]. А. Функция внешнего дыхания. Б. Кривая диссоциации оксигемоглобина
к ФЖЕЛ], а также максимальная вентиляция лёгких [МВЛ] и растяжимость лёгких существенно (статистически достоверно) не меняются.
• Общее лёгочное сопротивление падает, облегчая движение воздуха по воздушным путям.
• Форсированный выдох. Из-за увеличения объёма содержимого брюшной полости во время беременности мышцы живота менее эффективны в осуществлении форсированного выдоха.
• Дыхательный объём. Хотя беременность мало влияет на частоту дыхания, при беременности заметно увеличивается дыхательный объём (ДО) - примерно на 40% - и тем самым усиливается альвеоляр-
ная вентиляция (VA). Это увеличение ДО и VA - наиболее ранние физиологические изменения во время беременности, начинающиеся спустя 6 нед после зачатия. Они могут отражать прямое стимулирующее влияние прогестерона и меньшее влияние эстрогена на дыхательный центр головного мозга.
• Физиологически влияние увеличения VA во время беременности проявляется падением PCO2 артериальной крови матери от 40 мм рт.ст. до 30 мм рт.ст., несмотря на возрастание продукции CO2 вследствие метаболизма плода. Побочный эффект этого обстоятельства заключается в развитии умеренного алкалоза, компенсируемого почками беременной посредством снижения бикарбоната [HCO3-] в плазме крови.
• Многие беременные ощущают укорочение дыхания (диспноэ). Причины этого симптома остаются неясными.
Таким образом, адаптация дыхательной системы во время беременности обеспечивает адекватную оксигенацию плода и беременной и способствует транспорту углекислого газа из тканей плода.
Почки и мочевыводящие пути
• На ранних сроках беременности скорость клубочковой фильтрации увеличивается на 50%, что сопровождается увеличением клиренса креатинина и снижением концентраций креатинина и мочевины в сыворотке крови на 25%.
• Повышение скорости клубочковой фильтрации увеличивает потери Na+. Для обеспечения реабсорбции Na+ концентрация альдостерона компенсаторно повышается в 2-3 раза.
• Увеличение скорости клубочковой фильтрации ведёт к уменьшению реабсорбции глюкозы. При нормально протекающей беременности у 15% женщин отмечают глюкозурию.
• Объём мочи, содержащейся в почечных лоханках и мочеточниках, может удваиваться во второй половине беременности, что вызвано расширением этих мочевыводящих путей в результате сдавления мочеточников увеличенной маткой и расслабляющего эффекта прогестерона на ГМК. Это расширение приводит к застою мочи и повышает риск развития острых инфекций мочевой системы во время беременности.
Пищеварительная система
• Моторика. Прогестерон способствует расслаблению ГМК по всей длине ЖКТ, что приводит к замедлению пассажа химуса. В частности, замедлено опорожнение желудка, возможно усиление гастроэзофагеального рефлюкса. Желчный пузырь также сокращается слабее, что способствует застою желчи в пузыре и образованию холестериновых камней. Наблюдающиеся при беременности неболь-
шие нарушения в работе органов ЖКТ (тошнота, рвота, запоры и изжога) вызваны той же причиной. Тошнота в утренние часы возникает более чем у 70% беременных. Симптоматика обычно исчезает после 17-й неделе беременности.
• Всасывание кальция в кишечнике усиливается.
Печень. При беременности в печени происходит усиление синтеза различных веществ, включая белки, прокоагулянты, жирные кислоты и предшественники стероидов. Активность окислительного пути, вовлекающего цитохром P450, также активирована. За эти изменения ответственны высокие концентрации циркулирующих эстрогенов. Среди прокоагулянтов особенно сильно увеличивается концентрации фактора I (фибриногена), факторов VII, VIII, IX и X. Высокие концентрации белков коагулирующей системы предотвращают интенсивную кровопотерю у женщины во время родов. Однако эта ситуация способствует и повышенному риску тромбофлебита и тромбоэмболии при беременности и в послеродовом периоде. Повышенная активность цитохрома P450 может сильно повлиять на метаболизм ЛС, что требует тщательного контроля их концентрации в плазме.
Эндокринная система. Беременность влияет на функцию большинства эндокринных же- лёз женщины: возрастает активность передней доли гипофиза, особенно увеличивается выделение АКТГ, ТТГ и пролактина; увеличивается секреция йодсодержащих гормонов щитовидной железы, кортизола и альдостерона. Особенно велико содержание прогестерона и эстрогенов (рис. 20-4 и рис. 20-10).
• Эстрогены регулируют синтез и секрецию многих гормонов.
• Резистентность к инсулину.
При беременности из-за высокой концентрации плацен-
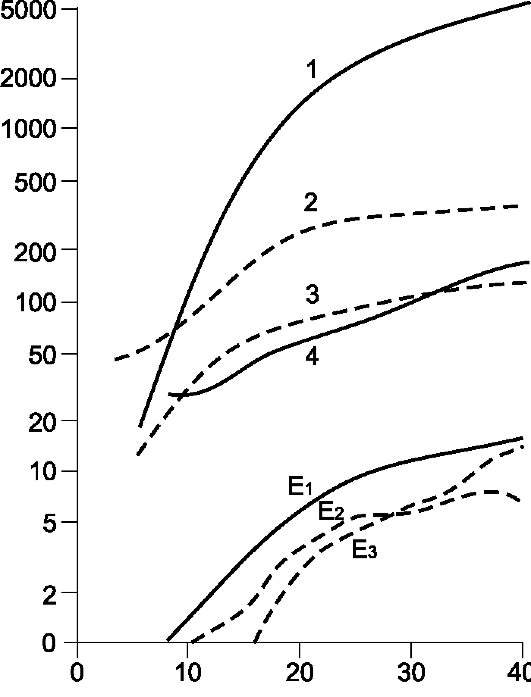 Рис. 20-10. Содержание гормонов в плазме крови при беременности. По оси
Рис. 20-10. Содержание гормонов в плазме крови при беременности. По оси
ординат - концентрация гормона в плазме (нг/мл); по оси абсцисс - срок беременности в неделях. 1 - плацентарный лактоген; 2 - кортизол; 3 - пролактин; 4 - прогестерон; E1 - эстрон; E2 - эстрадиол; E3 - эстриол
тарных контринсулярных гормонов (в первую очередь, плацентарного лактогена) развивается относительная резистентность к инсулину клеток-мишеней матери, что приводит к уменьшению поглощения глюкозы её периферическими тканями. Эти механизмы способствуют постоянному поступлению глюкозы к плоду, но в то же время у многих беременных после приёма пищи развивается более длительная гипергликемия, даже несмотря на повышенную концентрацию инсулина. В частности, это обстоятельство способствует появлению чувства более быстрого насыщения. Иммунная система. При беременности активность клеточного иммунитета снижается, что можно расценить как компенсаторный механизм, обусловливающий толерантность тканей женщины к тканям плода. На поверхности клеток трофобласта отсутствуют молекулы главного комплекса гистосовместимости класса II и идентифицированы уникальные Аг. Клиническим проявлением ослабленного иммунного ответа становится то, что беременные более подвержены вирусным инфекциям. У них также выше частота тяжёлых и затяжных заболеваний.
Костно-мышечная система и кожа
• При беременности концентрация циркулирующего а-меланотропина увеличена в результате повышенной экспрессии гена проопиомеланокортина. Меланотропины, а также АКТГ вызывают усиление пигментации кожи щёк (хлоазма, или «маска беременности»), сосков и в области белой линии живота.
• Повышение концентрации эстрогенов может вызвать такие изменения кожи, как паукообразные гемангиомы (сосудистые «звёз- дочки») и пальмарная эритема, а также выпадение волос, что связано с синхронизацией циклов роста волосяных фолликулов.
• При беременности часто наблюдают изменение осанки (усиление поясничного лордоза) и тянущие боли в области поясницы.
Антенатальная охрана плода
Цель антенатальной (дородовой) охраны - рождение здорового ре- бёнка и поддержание здоровья женщины во время беременности. Службы антенатальной охраны ориентированы на выявление любых отклонений от нормальных физиологических показателей. Методы антенатальной охраны включают определение предполагаемой даты родов, проведение периодических обследований и лабораторных исследований.
• Предполагаемая дата родов
-Ф- Расчёт. Предполагаемую дату родов можно рассчитать, прибавив 9 месяцев и 7 дней (правило Негеле) к дате первого дня после-
дней менструации. Этот расчёт предполагает 28-дневный менструальный цикл с овуляцией, наступающей примерно на 14-й день цикла. При нерегулярном менструальном цикле расчёт не- надёжен.
-Ф- Пероральные контрацептивы. Этот расчёт ненадёжен также для женщин, принимавших противозачаточные пероральные препараты, если беременность наступила в первый цикл после прекращения их приёма. В этом случае овуляция может произойти позднее чем через 2 нед после начала последней менструации.
Питание
• Увеличение массы тела. Допустимое увеличение массы тела во время беременности составляет 9-14 кг (около 5 кг приходится на внутриматочное содержимое, около 9 кг - на материнский организм). Питание во время беременности должно быть сбалансированным. Беременной нецелесообразно советовать низкокалорийную диету. С другой стороны, ожирение неблагоприятно влияет на течение беременности и родов.
-Ф- Изменение массы, вызываемое беременностью, распределяется приблизительно следующим образом: плод - 3400 г; плацента с плодными оболочками - 680 г; амниотическая жидкость - 900 г; увеличение массы матки - 1130 г; увеличение объёма крови - 1600 г; молочные железы - 900 г; увеличение количества жидкости в нижних конечностях - 900-1300 г (см. также табл. 20-3).
-Ф- Недостаточная прибавка массы тела может быть настораживающим признаком; каждая беременная должна прибавить по меньшей мере 6,8-9 кг. Если прибавка в массе тела составляет менее 4,5 кг к 20 нед беременности, то рацион питания следует радикально пересмотреть.
• Энергетическая ценность. Потребность беременной со средней массой тела составляет около 2400 ккал/день. Это на 300 ккал/день больше, чем вне беременности.
• Белок. Во время беременности происходит накопление белка (до 350 г) для подготовки к потерям, происходящим во время родов. При недостаточном поступлении белков во время беременности замедляется рост плода, увеличиваются перинатальная заболеваемость и смертность. При беременности каждые сутки необходимо дополнительное к обычному рациону поступление в организм не менее 30 г животного белка (у взрослой женщины 1,3 г/день на кг массы, у юной - 1,5 г/день на кг массы тела). Большую часть должны составлять белки животного происхождения, содержащие дос-
таточное количество аминокислот для синтеза новых белков. Рекомендуют мясо, молоко, яйца, сыр, домашнюю птицу и рыбу.
• Углеводы. Во время беременности потребность в углеводах составляет приблизительно 350-400 г/сут. Рацион должен включать достаточное количество фруктов, ягод, свежих овощных соков, компотов. При недостатке углеводов расходуются белки и гликоген. При избыточном поступлении углеводов снижается сопротивляемость организма к инфекциям, повышается риск развития пищевой аллергии у будущего ребёнка.
• Жиры должны входить в рацион в количестве 85-100 г/сут в виде сливочного масла, сметаны и растительного масла. Растительное масло содержит незаменимые жирные кислоты, нормализующие проницаемость стенок капилляров; незаменимые аминокислоты; витамин Е, необходимый во время беременности. Минеральные вещества
• Железо. При беременности (и в особенности во вторую её половину) существенно возрастает дополнительная потребность в железе (не менее 800 мг, 30-60 мг ежедневно), необходимом преимущественно для синтеза Hb организмом матери и плода.
-ФЕжесуточное содержание железа в полноценной диете взрослой женщины репродуктивного возраста вне беременности составляет примерно 15-20 мг, из которых всасывается только 2 мг (всасывается только железо в двухвалентной форме).
-ФПри беременности каждые сутки должно всасываться не менее 7 мг. Железо содержится в печени, красном мясе, яблоках, чёр- ной смородине, сушёных фруктах. Тем не менее при беременности необходима ежедневная дополнительная добавка не менее 60 мг железа в двухвалентной форме (например, 200 мг сульфата железа).
-Ф- У многих женщин детородного возраста - в связи с потерей крови во время менструаций - снижены запасы железа. Так, в России не менее 20% женщин детородного возраста страдают железодефицитной анемией. Во время беременности запасы железа могут истощиться ещё больше.
-ФЕсли женщина во время беременности страдает анемией, в два раза возрастает риск гипотрофии, внутриутробной гипоксии и асфиксии новорождённого, повышаются перинатальная заболеваемость и смертность; к полутора годам жизни у половины детей развивается анемия.
• Кальций. Всасывание кальция в кишечнике усиливается. Повышенное количество кальция необходимо для развития плода и формирования его скелета. Концентрация ПТГ и кальцитриола в плаз-
ме крови при беременности и лактации повышено (содержание кальцитриола увеличивается в результате стимулирования ПТГ синтеза 25-гидроксихолекальциферола [кальцидиол] в печени и за счёт возрастания активности 1α-гидроксилазы, конвертирующей кальцидиол в кальцитриол). У мужчин и небеременных женщин конверсия кальцитриола в кальцитриол лимитируется 1 α-гидроксилазой, экспрессирующейся только в почках. У беременных этот фермент образуется также в децидуальной ткани и плаценте, что даёт возможность получать необходимое количество активной формы витамина D3 для оптимизации всасывания кальция в кишечнике.
❖ Рекомендуемое потребление кальция составляет 1200 мг/день. Для получения такого количества кальция достаточно пить 1,14 л молока (предпочтительнее снятого) каждый день. Другие источники кальция - творог и молочная пища, включая сыр.
❖ Если беременная получает достаточное количество кальция, происходит лишь минимальная мобилизация кальция из её костей. В противном случае минерализация скелета плода будет проходить за счёт кальция, высвобождаемого из костей беременной. Это может привести к развитию остеопороза.
❖ Судороги икроножных мышц (чаще возникающие ночью) - классический симптом дефицита кальция у беременной.
• Натрий. Ограничивать потребление натрия не следует, так как прогестерон способствует его выведению из организма. Не оправдано также применение диуретиков во время беременности.
Витамины
• Фолиевая кислота находится во многих продуктах и в первую очередь необходима для образования гема. Для обеспечения синтеза Hb, а также для других целей в организм матери ежедневно должно поступать не менее 800 мкг фолиевой кислоты.
❖ Дефицит фолиевой кислоты негативно влияет на эритропоэз и может привести к развитию мегалобластной анемии.
❖ Не менее 70% дефектов нервной трубки, развивающихся у эмбриона и плода, может быть предупреждено при приёме фолиевой кислоты не только в течение первых 12 нед беременности, но и в период предполагаемого зачатия.
❖ Дефицит фолатов может также привести к артериальной гипертензии во время беременности и к отслойке плаценты.
• Витамин B12 содержится в натуральном виде только в продуктах животного происхождения (мясо, рыба). У вегетарианцев содержание витамина B12 может быть низким, беременные женщины-вегетарианки должны принимать его дополнительно.
• Витамин С. Во время беременности 80 мг витамина С - рекомендуемая суточная доза. Большие дозы (1 г и более) витамина С, принимаемые для профилактики обычной простуды, могут оказывать вредное воздействие на плод.
Режим
• Физическая нагрузка. Беременной нет необходимости ограничивать гигиеническую гимнастику при условии, что она не вызывает чрезмерной усталости. Строгие ограничения показаны при артериальной гипертензии беременной, угрозе преждевременных родов и при многоплодной беременности.
• Поездки. Не описано вредных воздействий путешествий; герметичный салон в самолёте не представляет опасности. Беременная должна активно двигаться каждые 2 часа, чтобы предотвратить венозный застой в нижних конечностях и развитие тромбофлебита.
• Работа кишечника. Во время беременности женщины часто страдают запорами, так как прогестерон вызывает релаксацию гладких мышц ЖКТ, а матка сдавливает кишечник. Женщина может избежать запоров путем приёма большого количества жидкости, упражнений, лёгких слабительных и продуктов, наполняющих толстую кишку грубой клетчаткой.
• Половая жизнь. Половые сношения не приносят вреда в течение всей беременности, если нет осложнений (разрыв плодных оболочек, преждевременные схватки, несостоятельность шейки матки). Следует помнить, что Пг семенной жидкости и оргазм женщины могут приводить к сокращениям матки при половом акте. Отечественные акушеры рекомендуют воздержание от половых сношений в первые 2-3 месяца беременности.
• Курение. Курящие женщины часто рожают детей с меньшей массой тела (в среднем на 250 г), а перинатальная смертность увеличена. Необходимо рекомендовать женщине полностью бросить курить во время беременности. Считают доказанными следующие вредные последствия курения: способность оксида углерода частично инактивировать Hb плода и беременной, сосудосуживающий эффект никотина, вызывающий, в частности, снижение кровотока через плаценту, а также снижение аппетита.
• Алкоголь нельзя употреблять во время беременности; он нарушает рост плода, приводит к развитию аномалий головного мозга и скелета, врождённым порокам сердца. Женщины, страдающие алкоголизмом, имеют угрозу рождения ребёнка с комплексом врождён- ных пороков, известным как «алкогольный синдром плода». Подробнее см. в последующем разделе «Тератология».
• Лекарственные препараты. Любые ЛС, принимаемые во время беременности, проходят через плаценту и попадают в организм плода; если какое-либо ЛС необходимо применять, преимущества лечения должны перевешивать риск применения ЛС. В современных справочниках для любого ЛС в обязательном порядке приводятся сведения о возможном негативном влиянии ЛС на плод при беременности, а также о поступлении ЛС, принимаемых кормящей женщиной, в организм ребёнка. По этой причине врач, рекомендующий применение конкретного ЛС беременной женщине или кормящей матери, обязан убедиться в безопасности применения ЛС. Ниже приведены отдельные примеры ЛС, оказывающих негативное воздействие на плод. Более подробные сведения даны в последующем разделе «Тератология».
-Ф- Ацетилсалициловая кислота (например, аспирин) оказывает негативное воздействие на свёртывающую систему плода, а также нарушает связывание билирубина с белками. Применение аспирина, особенно в поздние сроки, противопоказано.
-Ф- Гидантоин может привести к нарушению роста плода, развитию аномалий скелета и ЦНС («гидантоиновый синдрома плода»).
-Ф- Ретиноевая кислота приводит к возникновению врождённых пороков головного мозга, уха и сердца.
-Ф- Тетрациклин вызывает образование тёмных пигментных пятен на поверхности зубов ребёнка (поражаются только молочные зубы).
-Ф- Другие ЛС. Противопоказаны антиконвульсанты, антикоагулянты, антитиреоидные препараты, противоопухолевые препараты, йодсодержащие вещества, свинец, литий, ртуть, противозачаточные препараты.
Медико-генетическое консультирование
Медико-генетическое консультирование необходимо семьям, имеющим случаи наследственных заболеваний, т.е. при повышенной вероятности рождения ребёнка с врождённой патологией. Задачи медико-генетического консультирования: выявление генетических заболеваний и определение возвратного риска.
• Выявление генетических заболеваний. В первую очередь необходима точная диагностика, позволяющая определить природу заболевания и провести дифференциальную диагностику состояний, имеющих сходную клиническую картину; соответственно выбирают адекватную лечебную тактику.
• Определение возвратного риска. При установлении точного диагноза становится возможным рассчитать вероятность повторного случая заболевания, отсюда необходимость пренатальной диагностики.
❖ Если семейная пара уже имеет ребёнка с идентифицированным наследственным заболеванием, риск появления повторного случая (возвратный риск) состоит из уже известного для данного заболевания риска плюс общепопуляционный риск (3% для всех других врождённых дефектов).
❖ Возвратный риск для врождённых пороков, вызванных воздействием факторов окружающей среды (например, алкоголя, радиации), в некоторых случаях может быть сведён к нулю путём исключения влияния этих тератогенных факторов на плод во время беременности. Однако следует учитывать, что для любой беременности существует вероятность возникновения врождён- ного порока, равная 3%.
Тератогенные агенты
К тератогенным агентам относятся ионизирующее излучение, лекарственные препараты (особенно химиотерапевтические в онкологии), тератогенные вещества, алкоголь, наркотики, гипертермия, экстрагенитальные заболевания беременной, возбудители инфекционных заболеваний.
• Ионизирующее излучение. Никаких пороговых доз в отношении проникающей радиации не существует. Речь может идти только о сложившейся практике оценки в статистическом контексте (А.Д.Сахаров). Непонимание этого обстоятельства, к сожалению, широко распространено. Так, дозу облучения 5-10 рад считают безвредной, при 10-25 рад - возможно повреждающее действие на плод; более 25 рад - часто возникают структурные пороки развития, задержка роста и гибель плода. После воздействия такой дозы рекомендуют прерывание беременности (медицинский аборт).
• Лекарственные препараты. Повреждения плода, вызванные ЛС, составляют около 1% общего количества всех аномалий развития. В отношении потенциального риска тератогенного воздействия на плод Американская Федеральная Комиссия по пищевым продуктам и ЛС (FDA) предложила все ЛС подразделять на 5 категорий:
A. ЛС совершенно безвредны для плода (например, витамины).
B. Опыты на животных не выявили тератогенности, но нет контрольных исследований на беременных. В эту категорию также входят ЛС, оказывающие повреждающее воздействие на животных, но не на человека (например, пенициллин, дигоксин, адреналин, тербуталин).
C. Исследования на животных показали или тератогенное, или эмбриотоксическое воздействие ЛС на плод, но исследования на людях не проводились. Эти ЛС можно применять только в тех
случаях, когда польза от их применения перевешивает потенциальный риск для плода (фуросемид, гуанидин, верапамил и β-адреноблокаторы).
D. Есть доказательства тератогенности ЛС, но польза от их применения превышает риск для плода (например, фенитоин).
X. Исследования на животных и людях выявили очевидную опасность для плода. ЛС этой категории противопоказаны беременным или женщинам, желающим забеременеть (например, изотретиноин).
• Тератогенные вещества и воздействия. По сравнению с общим количеством ЛС и медикаментов, их не очень много. Применения оп- ределённых широко употребляемых средств следует избегать даже в том случае, если пациентка только собирается зачать ребёнка. К таким ЛС относят изомер витамина А изотретиноин или высокие дозы самого витамина А (более 8000 ЕД/сут), алкоголь, кофеин и некоторые половые стероиды. Живую вирусную вакцину, например, против краснухи, никогда не следует назначать пациентке, если не исключена вероятность беременности, либо если женщина планирует забеременеть в ближайшие три месяца. Однако даже если эти препараты употреблялись, исход чаще бывает благоприятным. К ЛС и химическим соединениям, вызывающим врождённые аномалии относятся алкоголь, тестостерон, прогестины, аминоптерин и метиламиноптерин, бусульфан, хлорамбуцил, циклофосфамид, дифенилгидантоин, изотретиноин, свинец, литий, органическая ртуть, полихлорированные бифенилы, стрептомицин, тетрациклин, талидомид, тиомочевина, триметадион, варфарин, вальпроевая кислота.
❖ Алкоголь - один из наиболее распространённых тератогенов. В настоящее время нет данных о безопасной дозе потребления алкоголя во время беременности. Наиболее безопасен полный отказ от алкоголя во время беременности.
❖ Наркотики: марихуана (повышена частота выкидышей и преждевременных родов), героин и метадон (развитие «синдрома отмены» у новорождённого, что в 3-5% случаев приводит к гибели ребёнка), фенилциклидин, или ангельская пыль (развитие дефектов лица у плода), кокаин (отслойка плаценты).
❖ Экстрагенитальные заболевания матери, особенно сахарный диабет, фенилкетонурия, эпилепсия.
❖ Возбудители инфекционных заболеваний, в особенности вирус краснухи, цитомегаловирус, вирус простого герпеса 2 типа, токсоплазма, Treponema pallidum (возбудитель сифилиса), вирус ветряной оспы, энтеровирусы (вирус Коксаки).
РОДЫ
Роды - процесс, посредством которого плод и поддерживающие его плацента и оболочки выходят из матки во внешний мир. Роды обеспечивают регулярные сокращения матки, вызывающие истончение и раскрытие шейки матки. Роды включают три ключевых процесса: (1) переключение долговременных, редких и слабых сокращений матки на частые, интенсивные и регулярные; (2) размягчение и раскрытие шейки матки; (3) разрыв плодных оболочек. Хотя роды можно считать начавшимися при появлении любого из этих трёх процессов, но физиологическими (нормальными) называют роды, протекающие при одновременном осуществлении всех трёх процессов. Возможность прохождения плода через малый таз определяют три вариабельных фактора - родовые силы (сокращения матки), плод и родовые пути (скелет и мягкие ткани малого таза, обусловливающие сопротивление прохождению плода).
• Родовые силы. Маточные сокращения характеризуются частотой, амплитудой и продолжительностью сокращений. Адекватная сократительная деятельностью матки - 3-5 сокращений за 10 мин. Показатель сократительной деятельности матки - скорость раскрытия шейки матки и опускания предлежащей части.
• Плод. Два основных показателя, влияющие на течение родов, - членорасположение плода (степень сгибания или разгибания головки) и его размеры. Когда головка плода находится в оптимальном положении сгибания, она входит в малый таз самым малым возможным диаметром (diameter suboccipitobregmenticus, 9,5 см). Массу плода можно оценить клинически или с помощью УЗИ. Погрешность обоих способов (при сравнении с фактической массой плода при рождении) составляет 15-20%.
• Родовые пути
❖ Скелет малого таза образуют крестец, подвздошные, седалищные и лобковые кости. Типичный женский таз - гинекоидный.
❖ Мягкие ткани малого таза (шейка матки, мышцы тазового дна) оказывают сопротивление во время родов.
Фазы родов
Роды подразделяют на четыре физиологические фазы (рис. 20-11).
• Покой. В течение фазы 0 миометрий находится в состоянии покоя. Как и при беременности, состояние покоя ГМК матки поддерживают прогестерон, простациклины, оксид азота, а также релаксины, относящиеся к ПТГ и кальцитонину пептиды, адреномедуллин и VIP.
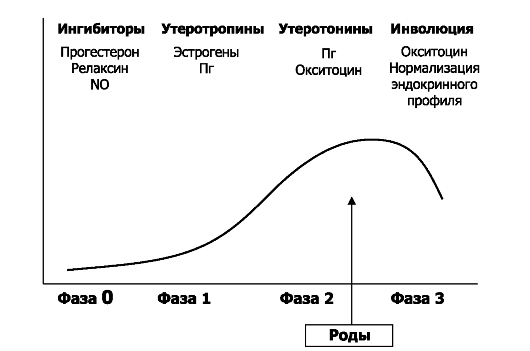 Рис. 20-11. Физиологические фазы родов [18]. По оси ординат: сократимость матки; по оси абсцисс: фазы и время. Фазы родов: 0 - покоя; 1 - активации; 2 - стимуляции; 3 -
инволюции. NO - оксид азота; Пг - простагландины. Соответственно
конкретной фазе родов приведены названия гормонов, эффекты которых
наиболее выражены в этой фазе (подробнее см. в тексте)
Рис. 20-11. Физиологические фазы родов [18]. По оси ординат: сократимость матки; по оси абсцисс: фазы и время. Фазы родов: 0 - покоя; 1 - активации; 2 - стимуляции; 3 -
инволюции. NO - оксид азота; Пг - простагландины. Соответственно
конкретной фазе родов приведены названия гормонов, эффекты которых
наиболее выражены в этой фазе (подробнее см. в тексте)
• Активация. В фазе 1 под влиянием эстрогенов появляются факторы, необходимые для усиления сократимости матки (см. также рис. 20-12). К этим факторам относят рецепторы Пг и окситоцина, мембранные ионные каналы и коннексин-43 - главный компонент щелевых межклеточных контактов. Щелевые контакты обеспечивают электрическое сопряжение миоцитов миометрия, что максимально координирует волны сокращений, идущие от дна к шейке матки.
• Стимуляция. В фазе 2 окситоцин, ПгЕ2 и ПгE2а индуцируют сокращения миометрия. В эту фазу шейка матки раскрывается, а плод и следующие за ним плацента с плодными оболочками изгоняются из полости матки.
• Инволюция. В фазу 3 наблюдаются поддерживающие сокращения матки, необходимые для обеспечения гемостаза и уменьшения размеров увеличенной после родов матки.
Механизмы и регуляция родов
С 6-го месяца беременности матка развивает периодические медленные, ритмические и безболезненные сокращения (сокращения Брек-
стона Хикса). По мере прогрессирования беременности частота и интенсивность этих сокращений возрастают. В определённый момент сокращение матки (схватка) развивает такую силу и так повышает её возбудимость, что через несколько минут возникает другое сокращение. Если второе сокращение мощнее первого, то оно ещё более повышает возбудимость матки и приводит к ещё более мощным сокращениям. Теория положительной обратной связи предполагает, что если растяжение шейки матки головкой плода становится достаточным, то это вызывает сильное увеличение сократимости тела матки, что проталкивает плод вперёд, а это ещё более растягивает шейку матки и вызывает ещё больший эффект положительной обратной связи. Этот процесс, повторяясь, завершается рождением плода. Таким образом, к концу беременности матка становится более возбудимой, в результате появляются схватки, направленные на изгнание плода. Увеличение возбудимости и сократимости матки регулируют преимущественно гормональные факторы, эффекты и взаимодействие которых рассмотрены на рис. 20-12.
Основные положения: ❖ роды инициируют сигналы от плаценты и плода; ❖ простагландины инициируют маточные сокращения;
• простагландины и окситоцин поддерживают схватки; ❖ инволюция матки происходит в результате резкого изменения эндокринной ситуации, наступающей после родов.
Сигнал начала родов. В качестве сигнала к началу родов рассматривают достижение плодом критического размера, относительное увеличение соотношения эстрогенов к прогестерону, циркадианный ритм и кортиколиберин.
• Размер плода. Когда размеры плода достигают некоторого критического значения, увеличенное растяжение (перерастяжение) ГМК миометрия приводят к увеличению их сократимости. В результате сокращения Брекстона Хикса перерастают в схватки (см. выше).
• Эстрогены. Беременность у человека сопровождается исключительно выраженным гиперэстрогенным состоянием. Основной источник эстрогенов во время беременности - плацента. Концентрация эстрогенов в крови повышается соответственно сроку гестации (см. рис. 20-4). В то же время концентрация прогестерона, увеличивающего порог возбудимости ГМК миометрия) в конце беременности не растёт. Плацентарные эстрон и 17b-эстрадиол синтезируются преимущественно из С19-андрогенов, образующихся в организме беременной (тестостерон и андростендион), в то время как эстриол образуется почти исключительно из дегидроэпиандростерона (ДЭАС) плода (рис. 20-12). Эстрогены не инициируют напрямую сокращения матки, но приводят к увеличению в миометрии количества
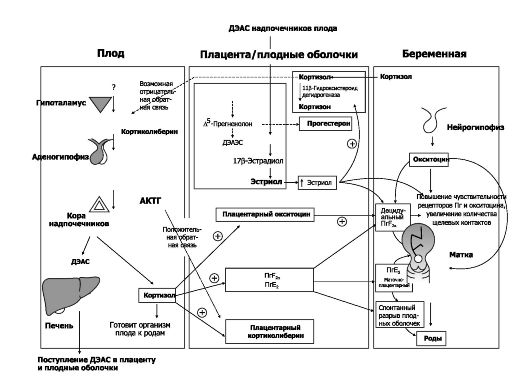 Рис. 20-12. Механизмы запуска родов [18]. А - плод. Б - плодные оболочки и плацента. В - организм беременной
Рис. 20-12. Механизмы запуска родов [18]. А - плод. Б - плодные оболочки и плацента. В - организм беременной
рецепторов к простагландинам и окситоцину, а также щелевых контактов, что и повышает способность миометрия к сокращениям.
• Околосуточный ритм. Известно, что пик наступления родов (в том числе чувствительность миометрия к окситоцину и Пг) статистически достоверно приходится на сроки от полуночи до 5 ч. утра, т.е. имеет выраженную суточную периодичность. Природа сигнала, опосредующего эту периодичность, туманна.
• Кортиколиберин. Содержание плацентарного кортиколиберина в плазме крови беременной прогрессивно увеличивается, достигая пика перед родами. Одновременно в последние дни беременности в печени снижается синтез связывающего кортиколиберин белка, что резко увеличивает содержание в организме женщины свободного кортиколиберина. Не исключено, что именно плацентарный кортиколиберин является сигналом, запускающим роды. Простагландины. Каким бы не был стимул, инициирующий наступление родов, каскад событий в миометрии, приводящих к его сокращению, понятен значительно лучше. Для протекания родов существенно важны синтезируемые децидуальной тканью и плодными оболочками Пг, особенно ПгЕ и ПгБ. Ткани матки особенно богаты арахидоновой кислотой, служащей предшественником всех Пг. В матке экспрессируются циклооксигеназы - циклооксигеназа-1 и цикло- оксигеназа-2, - участвующие в образовании Пг. Глюкокортикоиды, как известно, активируют циклооксигеназу-2. Доказательства роли Пг в родах основаны на следующих наблюдениях: (1) концентрация Пг в амниотической жидкости, крови и моче беременной увеличивается непосредственно перед наступлением родов; (2) введение Пг при беременности вызывает роды; (3) Пг способствуют раскрытию шейки матки, могут индуцировать сокращения миометрия и повышать его чувствительность к окситоцину; (4) ингибиторы биосинтеза Пг (например, индометацин) могут ослаблять сокращения матки, что способствует пролонгированию беременности.
Ионы кальция. Сокращение миоцитов миометрия, как и других ГМК, запускает повышение содержания ионов кальция внутри клетки. Пг активируют как перенос кальция через клеточную мембрану миоцитов, так и выход кальция в цитозоль из внутриклеточных депо. Кроме того, Пг активируют формирование щелевых межклеточных контактов в миоцитах.
Окситоцин. Гормон задней доли гипофиза окситоцин имеет большое значение в родах. Окситоцин действует через собственные рецепторы и активирует регуляторные G-белки. Они в свою очередь стимулируют фосфолипазу С и синтез ИТФ, что в конечном итоге
приводит к повышению содержания внутриклеточного кальция. Этим повышением концентрации кальция, а также усилением синтеза Пг (особенно ПгБ2а децидуальной оболочкой) и реализуются эффекты окситоцина. Наиболее изученная роль окситоцина - способствование изгнанию плода во 2-м периоде родов, когда шейка матки уже полностью раскрыта (рефлекс Фергюсона).
Родовые спастические боли. Боли (как следствие гипоксии миометрия) возникают из-за компрессии кровеносных сосудов матки (импульсация в ЦНС поступает по чувствительным волокнам подчревного нерва). Во втором периоде родов усиление болей происходит из-за растяжения шейки матки, влагалища и структур промежности (чувствительные волокна соматических нервов). Рефлекторные сокращения мышц передней брюшной стенки возникают в ответ на болевые сигналы, сопровождающие сильные сокращения матки, и они в значительной мере помогают осуществлению родового акта.
ПОСЛЕРОДОВЫЙ ПЕРИОД
Послеродовой период начинается после окончания родов и продолжается 4-6 нед. В течение этого периода репродуктивная система женщины возвращается к тому состоянию, которое было до беременности.
• Отторжение децидуальной оболочки после родов приводит к появлению физиологических выделений из половых путей - лохии.
• Сразу после родов происходит сокращение матки, её дно оказывается на уровне пупка. К концу 2-й недели послеродового периода пропальпировать дно матки выше лобкового симфиза не удаётся. К 6-й неделе послеродового периода размеры матки становятся такими же, как до беременности.
• После родов передняя брюшная стенка приобретает свой прежний вид, за исключением стрий живота (признаки растяжения), выраженность которых со временем уменьшается.
• У большинства женщин менструальные кровотечения возобновляются к концу 6-й недели послеродового периода.
• Перед выпиской необходимо ввести родильнице Rh0-(анти-D)-Ig, если кровь у неё Rh-отрицательная, а у новорождённого - Rh- положительная. При отсутствии у родильницы АТ к вирусу краснухи ей проводят иммунизацию с помощью вакцины против кори, эпидемического паротита и краснухи.
• Возобновление половой жизни допустимо через 2-3 нед после родов.
Молочные железы и лактация
Развитие молочной железы
• Эмбрион и плод. Молочные железы становятся различимыми с 4-й недели гестации в виде почек - узелков из эпителиальной ткани, появляющихся по протяжению так называемых молочных линий (эти линии проходят с двух сторон от середины ключицы до паховой области, после рождения в области молочных линий могут находиться дополнительные молочные железы или соски). Эпителиальный узелок погружается в подлежащую мезенхиму, где они разрастаются и превращаются в удлиняющиеся и разветвляющиеся клеточные тяжи. Эти тяжи становятся выводными (молочными) протоками железы (рис. 20-13А).
• Детский возраст. К моменту рождения молочная железа рудиментарна и практически состоит только из выводных протоков. Желе-
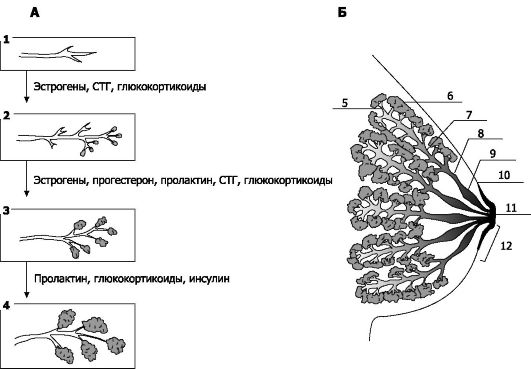 Рис. 20-13. Молочная железа. А - гормональный контроль развития; Б - лактирующая железа. 1 - закладка выводных протоков; 2 - развитие выводных протоков; 3 - рост секреторных отделов и разделение железы на дольки; 4 -
секреция молока; 5 - проточек; 6 - альвеола; 7 - внутридольковый
проток; 8 - молочный проток; 9 - молочный синус; 10 - граница ареолы; 11
- сосок; 12 - ампула
Рис. 20-13. Молочная железа. А - гормональный контроль развития; Б - лактирующая железа. 1 - закладка выводных протоков; 2 - развитие выводных протоков; 3 - рост секреторных отделов и разделение железы на дольки; 4 -
секреция молока; 5 - проточек; 6 - альвеола; 7 - внутридольковый
проток; 8 - молочный проток; 9 - молочный синус; 10 - граница ареолы; 11
- сосок; 12 - ампула
зы новорождённого под влиянием проникших через плаценту материнских эстрогенов могут секретировать несколько капель молока («ведьмино молоко»). Далее железа становится неактивной до момента пубертата.
• Пубертат. В пубертатном периоде синергичное влияние эстрогенов, гормона роста, пролактина и глюкокортикоидов стимулирует развитие выводных протоков (рис. 20-13А). Возникающий после менархе циклический синтез прогестерона индуцирует дальнейший рост протоков и дифференцировку рудиментарных концевых секреторных отделов на концах протоков. Железа продолжает расти в течение нескольких лет после менархе. В течение этого времени млечные протоки прогрессивно разветвляются и удлиняются, в них образуется просвет. Между протоками накапливается жировая ткань. Однако развитие концевых отделов (альвеол) не идёт дальше рудиментарной стадии до наступления беременности.
• Эндокринный контроль. Роль половых стероидных гормонов в развитии и функционировании молочной железы практически ясна (см. рис. 20-13А). Другие гормоны также участвуют в эндокринном контроле состояния молочной железы. Инсулин, видимо, важен для регуляции пролиферации эпителиальных клеток и формировании альвеолярной дольковой архитектуры. Для полной цитологической и функциональной дифференцировки эпителиальных клеток альвеол необходимо наличие кортизола, инсулина и пролактина. Инсулиноподобный фактор роста 1 и эпидермальный фактор роста также могут быть вовлечены в этот процесс, так как в клетках молочной железы обнаружены рецепторы для этих факторов.
• Гинекомастия - доброкачественное увеличение молочных желёз у мужчин, иногда сопровождается лактацией. Гинекомастия возникает в результате эндокринных влияний (физиологическая гинекомастия) и нарушений и проявляется гипертрофией ткани молочной железы. Различают следующие варианты физиологической гинекомастии.
-Ф- У новорождённых гинекомастия связана с влиянием материнских эстрогенов, проникающих через плаценту; проходит через несколько дней/недель.
-ФПубертатная гинекомастия (чаще односторонняя, исчезает самостоятельно). Во время полового созревания у мальчиков 12-15 лет гинекомастия вызвана повышенной секрецией гонадотропинов.
-ФСтарческая (возрастная, может развиться после 65 лет) гинекомастия (почти всегда двусторонняя) связана с уменьшением продукции тестостерона.
-ФФизиологическая гинекомастия проходит без лечения.
Молочная железа репродуктивного возраста
Зрелая молочная железа вне беременности состоит из 15-25 отдельных долей, располагающихся радиально вокруг соска (рис. 20-13Б). Доли отграничены прослойками волокнистой соединительной ткани, содержащей жировую клетчатку. Каждая доля подразделяется на множество долек, соединённых с соском млечным протоком (общим выводным протоком), который выстлан многослойным плоским неороговевающим эпителием. Рыхлая соединительная ткань (строма) сопровождает протоки, предотвращая их расширение во время лактации.
Беременность. С началом беременности под влиянием прогестерона в сочетании с эстрогенами, пролактином и хорионическим соматомаммотропином (плацентарный лактоген) происходят быстрый рост и разветвление концевых секреторных отделов железы (рис. 20-13А), сильно возрастает кровоснабжение. Эти два процесса возникают вскоре после зачатия, и женщина чувствует некоторое напряжение (нагрубание) молочных желёз, что проходит в течение I триместра. К 8-й неделе беременности начинается дифференцировка концевых отделов железы. Эти секреторные отделы - полые альвеолы - выстланы кубическим эпителием, поверх которого расположен слой отростчатых миоэпителиальных клеток. Секреторная функция начинается со II триместра. В растягивающихся альвеолах обнаруживают богатый Ig секрет.
• Пролактин. Под влиянием пролактина в мембране альвеолярных клеток увеличивается плотность рецепторов как к пролактину, так и к эстрогенам, но лактогенный эффект пролактина подавляют высокие концентрации эстрогенов и прогестерона.
• Эстрогены. Высокий уровень эстрогенов ингибирует связывание пролактина со своими рецепторами в мембране альвеолярных клеток.
Лактирующая молочная железа
После рождения ребёнка в крови матери резко снижается уровень эстрогенов и прогестерона. Это приводит к усилению синтеза и секреции пролактина и началу секреции молока. В первые 2-3 дня после родов молочная железа вырабатывает молозиво (colostrum). Образование зрелого молока начинается через несколько дней после родов.
• Молозиво - жидкость лимонного цвета. В отличие от молока, молозиво содержит больше белка и минеральных веществ, но меньше углеводов и жиров (табл. 20-3). Кроме того, в молозиве обнаруживаются клеточные фрагменты, а также целые клетки, фагоцитировавшие жир, - молозивные тельца.
• Молоко. В период лактации альвеолярные клетки секретируют жиры, казеин, α-лактоальбумин, лактоферрин, сывороточный альбумин,
лизоцим. В состав молока (табл. 20-3) также входят вода и соли. Зрелое молоко содержит высокие концентрации лактозы, витаминов (кроме витамина К), иммуноглобулинов (обеспечивают гуморальный иммунитет новорождённого).
• -Ф- Состав женского молока. Молоко состоит более чем из ста компонентов. В основном это жировая эмульсия в жидкой фазе, изотоничная по отношению к плазме. Зрелое молоко человека содержит 3-5% жира, до 1% белка, 7% лактозы, 0,2% неорганических веществ и даёт 60-75 ккал на 100 мл. Главный класс липидов женского молока - триглицериды, среди них преобладают пальмитиновая и олеиновая кислоты. Главные белки молока - казеин, α-лактальбумин, лактоферрин, иммуноглобулин А, лизоцим и альбумин. Казеин и α-лактальбумин - специфические белки молока. α-Лактальбумин - часть ферментного комплекса лактозосинтетазы. Свободные аминокислоты, мочевина, креатинин, креатин также присутствуют в молоке. Лактоза - главный углевод молока. Группа неорганических веществ молока включает натрий, калий, кальций, магний, фосфор и хлор. Состав женского молока продолжают изучать, в нём обнаружено большое количество пептидных гормонов, включая эпидермальный фактор роста, соматостатин и инсулиноподобные факторы роста 1 и 2. Образование молока. Разные компоненты молока образуются различными путями.
-Ф- Экзоцитоз секреторных пузырьков. Лактальбумин, казеин и другие белки синтезируются в шероховатой эндоплазматической сети и вместе с Ca2+ и фосфатами поступают в цистерны комплекса Голь-
Таблица 20-3. Состав (на 100 мл) женского молозива и молока, коровьего молока [2]
Компоненты | Молозиво | Женское молоко | Коровье молоко |
Белок (г) | 2,7 | 0,9 | 3,3 |
Казеин (% от белка) | 44 | 44 | 82 |
Жиры (г) | 2,9 | 4,5 | 3,7 |
Лактоза (г) | 5,7 | 7,1 | 4,8 |
Пищевая ценность (ккал) | 54 | 70 | 69 |
Кальций (мг) | 31 | 33 | 125 |
Железо (мкг) | 10 | 50 | 50 |
Фосфор (мг) | 14 | 15 | 96 |
Клетки (макрофаги, нейтрофилы, лимфоциты) | 7-8х106 | 1-2х106 | - |
джи. В этом комплексе лактозосинтетаза катализирует образование лактозы. Эти компоненты молока оказываются в образующихся в комплексе Гольджи секреторных пузырьках, вода входит в пузырьки путём осмоса благодаря наличию в них лактозы, служащей осмотически активным сахаром. В конечном итоге содержимое секреторных пузырьков секретируется в просвет альвеол. -Ф- Трансклеточный транспорт одновалентных катионов и воды. Вода проходит через клетку по градиенту концентрации лактозы (~200 мМ), в то время как ионы следуют по электрохимическому градиенту.
-Ф- Иммуноглобулины (преимущественно IgA) входят в клетку путём опосредованного рецепторами эндоцитоза: связывание Ig с собственным рецептором, погружение этого комплекса в цитоплазму, транспорт в комплекс Гольджи или к верхушечной мембране клетки, выход в просвет альвеолы.
-Ф- Липиды. Короткоцепочечные жирные кислоты синтезируются в гладком эндоплазматическом ретикулуме, длинноцепочечные жирные кислоты поступают в секреторные клетки из межклеточного пространства. Жирные кислоты формируют внутриклеточные капельки, высвобождаемые через апикальную часть клетки в просвет альвеолы.
-Ф- Межклеточный путь. Различные клетки, некоторые ионы и часть воды поступают в просвет альвеол, минуя секреторные клетки (по межклеточным пространствам).
Нейроэндокринная регуляция лактации
Во время кормления ребёнка раздражение чувствительных нервных окончаний соска молочной железы при сосании передаётся в ЦНС по восходящим путям (рис. 20-13) до содержащих активин нейронов ядра одиночного пути (nucleus tractus solitarii) и далее - до крупноклеточной части супраоптического и паравентрикулярного ядер. Эта афферентная импульсация в сочетании с нисходящими влияниями со стороны высших отделов головного мозга в конечном итоге достигает гипоталамуса и приводит к различным нейроэндокринным эффектам, относящимся к изменению режима секреции пролактина, окситоцина и гонадолиберина, определяющих и лактацию, и функцию яичников (овариальный цикл).
• Пролактин. В нейросекреторных нейронах дугового ядра (n. arcuatus) афферентная импульсация подавляет секрецию дофамина. Поскольку дофамин в аденогипофизе блокирует секрецию пролактина, то угнетение секреции дофамина увеличивает секрецию пролактина. Таким образом, кормление приводит к резкому, но кратковремен-
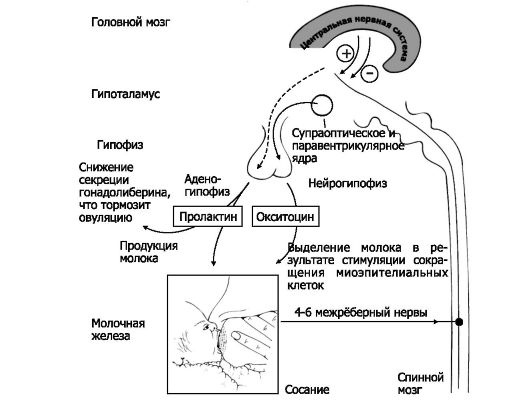 Рис. 20-14. Нейроэндокринные рефлексы, инициируемые сосанием груди
Рис. 20-14. Нейроэндокринные рефлексы, инициируемые сосанием груди
ному возрастанию секреции пролактина. Этот транзиторный всплеск секреции пролактина приводит к образованию молока для следующего кормления.
• -Ф- У кормящих грудью женщин концентрация пролактина остаётся повышенной в течение 4-6 нед после родов, после чего уровень пролактина уменьшается до показателей, характерных для небеременных женщин. Приблизительно в течение 2 мес после родов сосание ребёнка вызывает всплески секреции пролактина, но этот рефлекс неуклонно затухает даже в том случае, если ежедневная секреция молока превышает 1 л. -ФКурение ингибирует выброс пролактина, что вызывает снижение секреции молока. Окситоцин. Афферентная импульсация к паравентрикулярному (n. paraventricularis) и супраоптическому (n. supraopticus) ядрам гипоталамуса стимулирует синтез, транспорт и секрецию окситоцина. Окситоцин вызывает сокращение миоэпителиальных клеток секреторных отделов молочной железы и тем самым способствует продвижению молока в выводные протоки. У кормящих матерей
спонтанная секреция окситоцина происходит также во время игры с ребёнком или при его плаче.
• Гонадолиберин. В нейронах дугового ядра (n. arcuatus) афферентная импульсация подавляет синтез и секрецию гонадолиберина. В результате ингибируется секреция ФСГ и лютропина, т.е. блокируется овариальный цикл. Другими словами, лактация предупреждает овуляцию и нормальный менструальный цикл. Если же родильница не сама вскармливает ребёнка, овариально-менструальный цикл восстанавливается примерно через 10 нед.
ФИЗИОЛОГИЯ НОВОРОЖДЁННОГО
Период новорождённости (неонатальный период) продолжается 4 нед. В течение этого периода происходит адаптация организма ново- рождённого к условиям самостоятельного существования. Адаптация касается всех органов и систем, но в наибольшей степени относится к перестройке кровообращения, началу функционирования органов дыхания и ЖКТ, необходимости гомеостатического поддержания таких жизненно важных функций как постоянство температуры тела, кислотно-щелочное равновесие (КЩР) и других параметров гомеостаза, ранее обеспечивавшихся плацентой (например, функций почек, печени, иммунной системы).
Дыхание
• Начало дыхания. Ребенок начинает дышать в первые секунды после рождения. Стимулом для активации дыхательной системы является гипоксия (мощный активатор дыхательного центра) во время родов и внезапное охлаждение тела (лица при большинстве родов, происходящих при головном предлежании). Нормальное дыхание устанавливается в течение 1 мин. Новорождённый способен выдержать не более 9 мин без дыхания, прежде чем возникнут необратимые повреждения мозга.
• Расправление лёгких. Поверхностное натяжение наполненных жидкостью лёгких держит альвеолы в спавшемся состоянии. Для преодоления этого поверхностного натяжения и открытия альвеол требуется в момент вдоха приблизительно 25 мм рт.ст. отрицательного давления в лёгких. У новорождённого мощные первые вдохи создают отрицательное внутриплевральное давление (более 60 мм рт.ст. После расправления альвеол дыхание становится более эффективным при умеренной интенсивности дыхательных движений.
• Лёгочный кровоток (см. рис. 20-5 и рис. 20-15). В результате расправления лёгких сосудистое сопротивление в них падает, а лёгоч- ный кровоток увеличивается. По этим причинам давление в левом предсердии начинает превышать давление в правом, что приводит
к закрытию овального окна. Одновременно происходит сужение артериального протока, венозного протока и пупочной вены. Они прекращают функционировать и превращаются в артериальную связку, венозную связку и круглую связку печени соответственно, а внутрибрюшные части пупочных артерий становятся латеральными пупочными связками.
• Газы крови. Высокий уровень основного обмена и незрелость нервной регуляции дыхания приводят к широким колебаниям содержания газов в крови в течение первой недели жизни.
Система кровообращения
После рождения происходят значительные изменения кровообращения (рис. 20-15).
• Реконструкция сосудистой системы происходит как в силу потери плаценты, так и в связи с началом самостоятельного дыхания и резкого падения лёгочного сосудистого сопротивления при одновременном увеличении общего сосудистого сопротивления. Пупочные сосуды, артериовенозный проток, овальное отверстие и венозный проток закрываются (сначала функционально, затем анатомически) в первые минуты после рождения. Дистальные участки пупочных артерий атрофируются в течение 3-4 дней после рождения и превращаются в пупочные связки, а из пупочной вены образуется круглая связка печени. Венозный проток функционально закрывается в течение 10-90 ч после рождения, хотя анатомическое закрытие с формированием венозной связки происходит только ко 2-3-й неделям жизни.
• Общее сопротивление сосудистой системы новорождённого из-за утраты плацентарного кровообращения с очень низким сопротивлением удваивается, что приводит к увеличению давления в аорте, левом желудочке и левом предсердии.
• Объем крови новорождённого составляет около 300 мл при АД 70/ 50 мм рт.ст. Если младенец после рождения останется прикреплён- ным к плаценте на несколько минут, то в его кровеносную систему дополнительно поступит около 75 мл крови (25% объёма). Такая перегрузка кровью может вызвать подъём давления в левом предсердии и привести к переполнению сосудов лёгкого кровью с последующим развитием отёка лёгких.
• Сопротивление в лёгочных сосудах пятикратно уменьшается из-за расширения лёгких, вызванного первым вдохом, вследствие чего понижается давление в лёгочной артерии, правом желудочке и правом предсердии.
Почка новорождённого. У новорождённого почка имеет выраженный дольчатый вид. Дольчатость в дальнейшем исчезает в результате роста, но не формирования de novo нефронов (нефроногенез заверша-
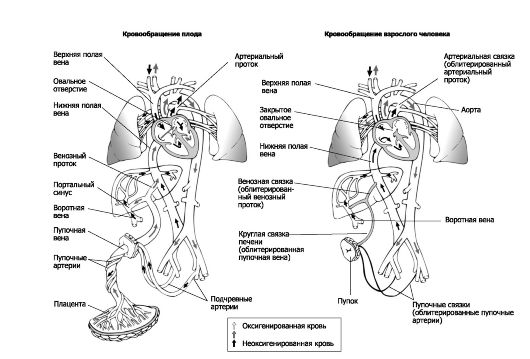 Рис. 20-15. Кровообращение плода и взрослого [13]
Рис. 20-15. Кровообращение плода и взрослого [13]
ется к 36-й неделе развития, к этому сроку в каждой почке около 1 млн нефронов). Практически любой аспект функционирования почек при рождении имеет серьёзные ограничения. Чем более недоношен младенец, тем тяжелее и дольше проявляются эти ограничения.
• Водный баланс. На 1 кг массы тела новорождённый имеет в 7 раз больше жидкости, чем взрослый человек, а скорость метаболизма новорождённого в 2 раза выше, чем у взрослого. Эти факторы осложняют регуляцию водного баланса, содержания электролитов, pH и коллоидно-осмотического давления.
• Клубочковая фильтрация. При рождении скорость клубочковой фильтрации крайне низка - около 20-30 мл/1,73 м2/мин.; удваивается к двухнедельному возрасту и достигает уровня взрослых примерно к году или к двум годам жизни (115-125 мл/мин.).
• Реабсорбция натрия. Почки новорождённого не способны к адекватному выделению Na+, что происходит из-за относительной нечувствительности дистального отдела нефрона к альдостерону. Этим также объясняется неполноценность выделения K+ и H+ у новорождённых.
• Способность к концентрации и разведению. Почки новорождённого могут доводить концентрацию мочи до уровня 600-700 мОсм/кг (несколько больше половины нормального для взрослых уровня). Способность к разведению достаточна (до 50 мОсм/кг), хотя жидкость выделяется медленнее ввиду низкой скорости клубочковой фильтрации.
-Ф- Способность к концентрации мочи определяют измерением осмоляльности мочи спустя 18-24 ч после прекращения потребления жидкости и повторно после введения 5 ЕД вазопрессина. При таких условиях у 90% здоровых людей осмоляльность мочи достигает 900 мОсм/кг (или удельного веса 1,023).
-Ф- Способность к разведению мочи определяют измерением осмоляльности мочи и её объёма спустя 5 часов после водной нагрузки из расчёта 20 мл/кг массы тела. У здоровых людей осмоляльность мочи достигает 100 мОсм/кг (или удельного веса 1,003), а объём мочи превышает 80% водной нагрузки.
• Закисление мочи. Снижение реабсорбции гидрокарбоната и секреции ионов H+ приводит к ограничению способности почек к закислению мочи. В результате у новорождённых часто отмечают лёгкий метаболический ацидоз при уровне бикарбоната сыворотки 20-22 мЭкв/л.
-Ф- Способность к образованию кислой мочи. рН мочи при голодании в норме ниже 5,5. Способность к образованию кислой мочи оценивают при введении 100 мг хлорида аммония на 1 кг массы тела с целью уменьшения концентрации бикарбоната плазмы
ниже 20 мЭкв/л. При этих условиях моча в норме закисляется (т.е. рН мочи падает ниже 5,5). Метаболизм
• Масса тела и воды. Новорождённый теряет до 10% массы тела (в основном за счёт воды) в течение первой недели жизни, но восстанавливает массу тела (тоже за счёт воды) примерно к 2 нед. Вода составляет 75% от массы тела (60% у взрослого мужчины, 50% у взрослой женщины). Скорость обмена воды у новорождённого в несколько раз выше, чем у взрослого и составляет около 110 мл/кг. Такая особенность водного баланса важна с той точки зрения, что небольшие изменения поступления и выведения воды из организма могут привести к серьёзным последствиям.
• Скорость основного обмена новорождённого (55 ккал/кг, через 7 дней - 100 ккал/кг) значительно выше, чем у взрослого (около 30 ккал/кг). По этой причине у новорождённого также выше сердечный выброс и лёгочная вентиляция.
• Обмен углеводов. К плоду глюкоза поступает из организма матери. Незадолго до рождения под влиянием глюкокортикоидов в печени и ряде других органов плода происходит накопление гликогена.
-Ф- Гликогенолиз. Запасы гликогена в печени новорождённого истощаются примерно в течение первых 12 часов жизни. Именно глюкоза, поступающая в кровоток из печени, является основным энергетическим источником в первые десятки часов жизни. Глюкоза, расщепляемая в ходе гликогенолиза в скелетных мышцах и миокарде, расходуется в основном для нужд этих органов.
-Ф- Глюкоза. В первые сутки жизни новорождённого наблюдается гипогликемия (и гипоинсулинемия), но в дальнейшем содержание глюкозы и инсулина в плазме крови быстро достигает значений, характерных для взрослого. В эти же сроки в крови увеличено содержание глюкагона и адреналина, необходимых для мобилизации глюкозы.
• Жировой обмен. На долю жира у новорождённого приходится около 500 г (примерно 15% от массы тела). Происходящий сразу после рождения выброс адреналина из мозговой части надпочечников активирует гормон-чувствительную липазу в жировой ткани. Эта липаза расщепляет триглицериды, в результате чего в кровоток поступают глицерол (в печени служит субстратом для синтеза глюкозы - глюконеогенеза) и свободные жирные кислоты (метаболизируют в митохондриях с ежедневным освобождением 27 ккал/кг массы тела). Теплопродукция
Потери тепла новорождённым происходят преимущественно путём испарения воды с поверхности кожи. Несколько меньшее значение
имеют потери вследствие излучения, проведения и конвекции. Развивающаяся вследствие потерь тепла гипотермия - серьёзная проблема новорождённости. Основной источник образования тепла у но- ворождённого - клетки бурого жира, в которых белок теромогенин разобщает окислительное фосфорилирование.
• Митохондрии клеток бурого жира могут метаболизировать жирные кислоты с образованием тепла. При этом митохондрии (в ответ на трийодтиронин [T3] и увеличение концентрации Ca2+ в цитозоле) усиленно захватывают воду и набухают, при этом усиливается разобщение окислительного фосфорилирования и происходит выделение тепла.
• Термогенин - протонный канал, встроенный во внутреннюю мембрану митохондрий. Термогенин не препятствует обратному току протонов (протоны предварительно транспортированы в межмембранное пространство митохондрий) в обход системы АТФ-синтета- зы. Таким образом, энергия, генерируемая протонным током, не используется для синтеза АТФ, а рассеивается в виде тепла. Норадреналин из симпатического отдела вегетативной нервной системы и адреналин из мозговой части надпочечников усиливают экспрессию разобщающего белка и стимулирует теплопродукцию.
• Холодовой стресс приводит к выбросу из мозговой части надпочечников адреналина и из аденогипофиза - ТТГ. ТТГ усиливает секрецию йодсодержащих гомонов щитовидной железы (T4 и T3). Адреналин в различных органах (в том числе и в клетках бурого жира) активирует фермент, превращающий T4 в T3, T3 приводит к набуханию митохондрий клеток бурого жира и сопутствующему разобщению окисления и фосфорилирования.
Питание и функции ЖКТ
Молозиво (первые несколько дней жизни), а далее материнское молоко полностью удовлетворяют метаболические потребности растущего организма, а ЖКТ плода к рождению практически готов именно к естественному вскармливанию. Более того, материнское молоко содержит факторы, способствующие заселению ЖКТ новорождённого молочнокислыми бактериями, предупреждающими рост вирулентных штаммов Escherichia coli. В зависимости от достаточности и сбалансированности диеты кормящей женщины вскармливание ребёнка материнским молоком может продолжаться до 12 мес. Все вопросы, связанные с питанием ребёнка в эти сроки (в том числе прикорм, коровье молоко, искусственные смеси и так далее), решает педиатр.
• У новорождённых (относительно детей более старшего возраста) наблюдается дефицит амилазы поджелудочной железы, поэтому ограничено расщепление крахмала.
• Всасывание жиров у новорождённых происходит хуже, чем у детей старшего возраста; поэтому могут возникнуть проблемы, связанные с высоким содержанием жира в молоке и искусственных смесях.
• При недостаточной инсоляции матери или новорождённого возможно развитие дефицита витамина D.
Печень
Поскольку функции печени (в том числе конъюгирование билирубина, синтез белков, глюконеогенез) в течение первой недели жизни ещё не стабилизированы, возможно развитие ряда отклонений (физиологическая желтуха новорождённого, эпизоды гипогликемии и др.).
• В течение первой недели жизни между редкими кормлениями возможно развитие эпизодов гипогликемии.
• Концентрация билирубина в крови в течение первых 3 дней жизни может быть увеличена, что приводит к развитию физиологической гипербилирубинемии (желтушность кожи и склер).
• Поскольку функция синтеза белков плазмы крови в течение первой недели жизни ещё не достигла необходимых значений, не исключено развитие осложнений, связанных с дефицитом плазменных факторов свёртывания.
Иммунная система
Ключевая роль в защите плода и новорождённого от инфекций принадлежит материнским АТ (пассивный иммунитет), так как плод синтезирует только IgM, а синтез других Ig (IgG, IgA, IgE), обеспечивающих активный иммунитет плода и новорождённого, даже к году жизни достигает только половины значений, характерных для детей более старшего возраста и взрослых.
• IgG. Кровь доношенного ребёнка при рождении содержит значительное количество материнских IgG, предупреждающих развитие большинства детских инфекций, в том числе дифтерии, кори, полиомиелита. Однако общее содержание IgG в крови новорождён- ного прогрессивно уменьшается и достигает минимума примерно к третьему месяцу жизни. Позднее содержание IgG постепенно увеличивается, но крайне медленно.
-ФМатеринские АТ против Аг кори обеспечивают пассивный иммунитет примерно в течение 12 мес.
-ФМатеринские АТ против Аг коклюша не обеспечивают пассивного иммунитета уже после первого месяца жизни.
• gA. Материнские молозиво и молоко содержат значительное количество секреторного IgA, что необходимо для защиты новорождён- ного от некоторых кишечных инфекций.