Биохимия: учебник для вузов/ под ред. Е.С.Северина - 5-е изд., - 2009. - 768 с.
|
|
|
|
РАЗДЕЛ 9 ОБМЕН И ФУНКЦИИ АМИНОКИСЛОТ
Значение аминокислот для организма в первую очередь определяется тем, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Объясняется это тем, что белки входят во все основные структурные компоненты клеток, тканей и органов тела человека и животных, выполняют ферментативные функции, участвуют в переносе веществ через мембраны и т.д. Важную роль в координации работы всех систем клеток играют белковые гормоны.
Аминокислоты непосредственно участвуют в биосинтезе не только белков, но и большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны - производные аминокислот. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклеотидов, гема, креатина, холина и других веществ.
Катаболизм аминокислот может служить источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет и др.) и преимущественно белковом питании. Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме.
I. ИСТОЧНИКИ И ПУТИ ИСПОЛЬЗОВАНИЯ АМИНОКИСЛОТ В КЛЕТКАХ
Фонд свободных аминокислот организма составляет примерно
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений (рис. 9-1).
Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триаци-лглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных.
В организме человека в сутки распадается на аминокислоты около
II. БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ БЕЛКОВ
А. АЗОТИСТЫЙ БАЛАНС
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество
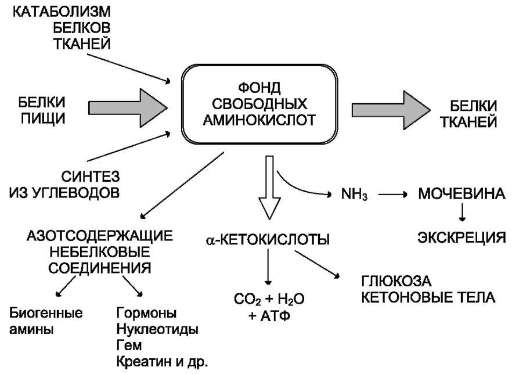
Рис. 9-1. Источники и пути использования аминокислот.
поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжёлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний.
При безбелковой диете азотистый
баланс становится отрицательным. Соблюдение подобной диеты в течение
недели приводит к тому, что количество выделяемого азота перестаёт
увеличиваться и стабилизируется примерно на величине 4 г/сут. Такое
количество азота содержится в
Б. ПОЛНОЦЕННОСТЬ БЕЛКОВОГО ПИТАНИЯ
В ходе эволюции человек утратил способность синтезировать почти половину из двад-
цати аминокислот, входящих в состав белков. К их числу относят те аминокислоты, синтез которых включает много стадий и требует большого количества ферментов, кодируемых многими генами. Следовательно, те аминокислоты, синтез которых сложен и неэкономичен для организма, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
Две аминокислоты - аргинин и гистидин - у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспа-рагин, глутаминовую кислоту, глутамин, серин, пролин, аланин.
Как показано выше, основным источником аминокислот для клеток организма являются
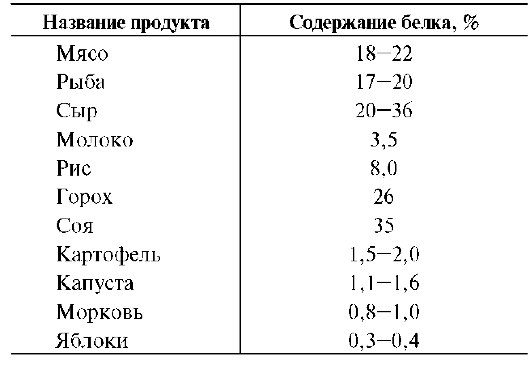
белки пищи. В различных пищевых продуктах содержание белка колеблется в широких пределах (табл. 9-1).
Из таблицы видно, что распространённые продукты растительного происхождения содержат мало белка (кроме гороха и сои). Наиболее богаты белками продукты животного происхождения (мясо, рыба, сыр). Белки не являются незаменимыми пищевыми факторами, они являются источниками содержащихся в них незаменимых аминокислот, необходимых для нормального питания.
Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Белки значительно различаются по аминокислотному составу. Некоторые их них содержат полный набор незаменимых аминокислот в оптимальных соотношениях, другие не содержат одной или нескольких незаменимых аминокислот. Растительные белки, особенно пшеницы и других злаковых, полностью не перевариваются, так как защищены оболочкой, состоящей из целлюлозы и других полисахаридов, которые не гидролизуются пищеварительными ферментами. Некоторые белки по аминокислотному составу близки к белкам тела человека, но не используются в качестве пищевых, так как имеют фибриллярное строение, малорастворимы и не расщепляются протеазами ЖКТ. К ним относят белки волос, шерсти, перьев и другие. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка
Таблица 9-1. Количество белка в некоторых пищевых продуктах
условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы (биологическая ценность - 36) содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот.
В. НОРМЫ БЕЛКА В ПИТАНИИ
Для поддержания азотистого равновесия достаточно употреблять 30-50 г белков в сутки. Однако такое количество не обеспечивает сохранения работоспособности и здоровья человека. Принятые нормы белкового питания для взрослых и детей учитывают климатические условия, профессию, условия труда и другие факторы. Взрослый человек при средней физической нагрузке должен получать 100-120 г белков в сутки. При тяжёлой физической работе эта норма увеличивается до 130-150 г. Детям до 12 лет достаточно 50-70 г белков в сутки. При этом подразумевается, что в пищу входят разнообразные белки животного и растительного происхождения.
Г. БЕЛКОВАЯ НЕДОСТАТОЧНОСТЬ
Известно, что даже длительное исключение из рациона человека жиров или углеводов не вызывает тяжёлых расстройств здоровья. Однако безбелковое питание (особенно продолжительное) вызывает серьёзные нарушения обмена и неизбежно заканчивается гибелью организма. Исключение даже одной незаменимой аминокислоты из пищевого рациона ведёт к неполному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста и нарушениями функций нервной системы.
Конкретные проявления недостаточности одной из аминокислот были выявлены у крыс, которым скармливали белки, лишённые определённой аминокислоты. Так, при отсутствии цистеина (или цистина) возникал острый некроз печени, гистидина - катаракта; отсутствие метионина приводило к анемии, ожирению и циррозу печени, облысению и геморрагии в почках. Исключение лизина из рациона молодых крыс сопровождалось анемией и внезапной гибелью (этот синдром отсутствовал у взрослых животных).
Недостаточность белкового питания приводит к заболеванию, получившему в Центральной Африке название «квашиоркор», что в переводе означает «золотой (или красный) мальчик». В настоящее время это название часто используют и в других частях света при сходных симптомах. Заболевание развивается у детей, которые лишены молока и других животных белков, а питаются исключительно растительной пищей, включающей бананы, таро, просо и, чаще всего, кукурузу. Квашиоркор характеризуется задержкой роста, анемией, гипопротеинемией (часто сопровождающейся отёками), жировым перерождением печени. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Часто это заболевание сопровождается атрофией клеток поджелудочной железы. В результате нарушается секреция панкреатических ферментов и не усваивается даже то небольшое количество белков, которое поступает с пищей. Происходит поражение почек, вследствие чего резко увеличивается экскреция свободных аминокислот с мочой. Без лечения смертность детей составляет 50-90%. Даже если дети выживают, длительная недостаточность белка приводит к необратимым нарушениям не только физиологических функций, но и умственных способностей. Заболевание исчезает при своевременном переводе больного на богатую белком диету, включающую большие количества мясных и молочных продуктов. Один из путей решения проблемы - добавление в пищу препаратов лизина.
III. ПЕРЕВАРИВАНИЕ БЕЛКОВ
В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их коли-
чество входит в состав белков, которые гидроли-зуются в ЖКТ под действием ферментов протеаз (пептидгидролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
А. ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ
Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопро-теин, который называют «внутренним фактором» (фактором Касла). Этот белок связывает «внешний фактор» - витамин В12, предотвращает его разрушение и способствует всасыванию.
1. Образование и роль соляной кислоты
Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гаст-ринов (см. раздел 11), которые, в свою очередь, вызывают секрецию НС1 и профермента - пепсиногена. НС1 образуется в обкладочных клетках желудочных желёз в ходе реакций, представленных на рис. 9-2.
Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы (карбо-натдегидратазы):
н2о + со2 → н2со3 → нсо3- + н+
Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1-, и
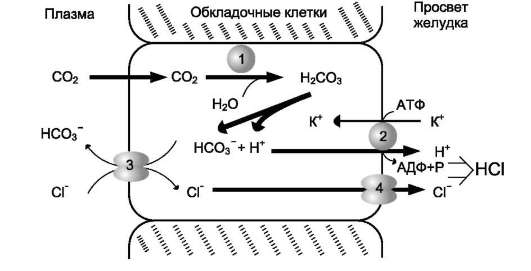
Рис. 9-2. Секреция соляной кислоты в желудке. 1 - карбоангидраза; 2 - Н+/К+- АТФ-аза; 3 - белки-переносчики анионов; 4 - хлоридный канал.
ионов Н+, которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н+/К+-АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 106 раз. Ионы С1- поступают в просвет желудка через хлоридньгй канал.
Концентрация НС1 в желудочном соке может достигать
Под действием НС1 происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НС1 обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
2. Механизм активации пепсина
Под действием гастринов в главных клетках желудочных желёз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НС1 он превращается в активный пепсин (молекулярная масса 32,7 кД) с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 амино-
кислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НС1 активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты.
3. Возрастные особенности переваривания белков в желудке
У детей грудного возраста в желудке находится фермент реннин (химозин), вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка.
Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НС1 и пепсина.
В слизистой оболочке желудка человека найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника.
4. Нарушения переваривания белков в желудке
При различных заболеваниях ЖКТ в желудке нарушается выделение НС1 и пепсиногена, при этом переваривание белков заметно снижается. Наиболее часто встречаются патологические изменения кислотности желудочного сока. Нарушение образования пепсина отмечают реже и выявляют при более значительных поражениях желудка.
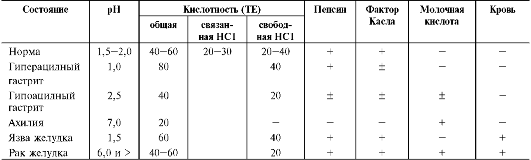
Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка (табл. 9-2). Повышенная кислотность желудочного сока обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность бывает при некоторых видах гастритов. Полное отсутствие НС1 и пепсина (желудочная ахилия) наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания витамина В12 (см. раздел 3). Анацидность (рН желудочного сока >6,0) свидетельствует о значительной потере слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка.
Кислотность желудочного сока выражается в титрационных единицах (ТЕ) - количество
Общая кислотность желудочного сока - совокупность всех кислотореагирующих веществ желудочного сока, представляет собой секрет желудка, собираемый в течение 1 ч. Значения общей кислотности в норме составляют
40-60 ТЕ.
Связанная соляная кислота - НС1, связанная с белками и продуктами их переваривания. Значения связанной НС1 у здоровых людей - 20-30 ТЕ.
Свободная НС1 - соляная кислота, не связанная с компонентами желудочного сока. Значения свободной НС1 в норме - 20-40 ТЕ. рН желудочного сока в норме - 1,5-2,0.
Молочная кислота в норме в желудочном соке отсутствует. Она образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате размножения молочнокислых бактерий или при злокачественных опухолях желудка, в клетках которых глюкоза окисляется анаэробным путём.
При диагностике заболеваний желудка, кроме биохимических анализов, обязательно проводят рентгенологические и эндоскопические исследования, а также биопсию.
Б. ПЕРЕВАРИВАНИЕ БЕЛКОВ В КИШЕЧНИКЕ
Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную
Таблица 9-2. Компоненты желудочного сока в норме и при патологических состояниях
кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НС1 желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ~7,0.
Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина (см. раздел 11), который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
1. Активация панкреатических ферментов
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрип-синоген, проэластаза, прокарбоксипептидазы
А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбоксипеп-тидазы А и В.
Активация трипсиногена происходит под действием фермента эпителия кишечника энтеро-пептидазы. Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп)4-Лиз присуща большинству известных трипсиногенов разных организмов - от рыб до человека.
Образовавшийся трипсин активирует химотрип-синоген, из которого получается несколько активных ферментов (рис. 9-3). Химотрипси-ноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между
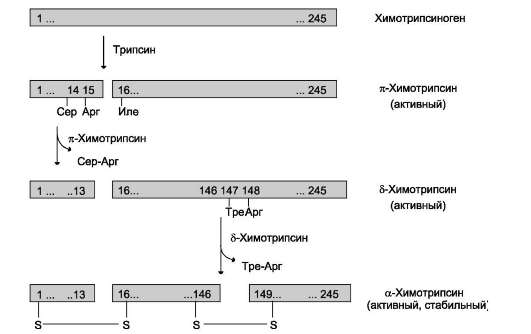
Рис. 9-3. Активация химотрипсиногена.
Молекула химотрипсиногена состоит из 245 аминокислотных остатков и имеет пять дисульфидных мостиков. На схеме показаны участки фермента, подвергающиеся протеолизу. α-Химотрипсин - активная стабильная форма фермента - состоит из трёх полипептидных цепей, ковалентно связанных между собой двумя дисульфидными мостиками и нековалентно - за счёт водородных связей и гидрофобных взаимодействий.
15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Затем под действием π-химотрипсина отщепляется дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. Отщепление дипептида тре(147)-арг(148) завершает образование стабильной формы активного фермента - α-химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками.
Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбоксипеп-тидазы А и В.
2. Специфичность действия протеаз
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три).
Карбоксипептидазы А и В - цинксодержа-щие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина.
Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептида-за - Zn2+- или Мп2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам. Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипеп-тиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
В. ЗАЩИТА КЛЕТОК ОТ ДЕЙСТВИЯ ПРОТЕАЗ
Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что:
• эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены.
• в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс.
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия.
Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены.
Г. ТРАНСПОРТ АМИНОКИСЛОТ В КЛЕТКИ
Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30- 50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4). Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Na+-зависимых механизмов симпорта, подобно переносу глюкозы (см. раздел 7).
Различная скорость проникновения аминокислот через мембраны клеток указывает на
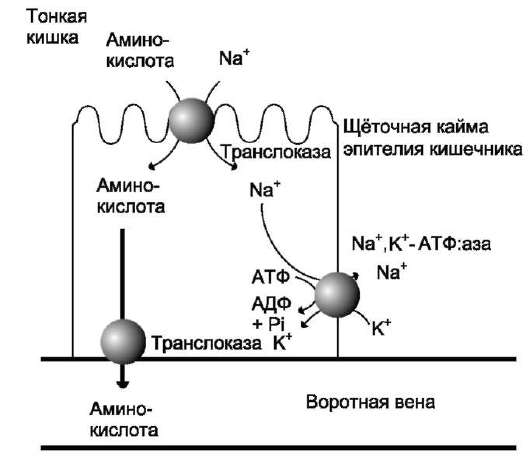
Рис. 9-4. Механизм всасывания аминокислот в кишечнике.
L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Na+, К+-АТФ-азы.
наличие транспортньгх систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:
• нейтральных, с короткой боковой цепью (аланин, серин, треонин);
• нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолей-цин);
• с катионными радикалами (лизин, аргинин);
• с анионными радикалами (глутаминовая и аспарагиновая кислоты);
• иминокислот (пролин, оксипролин). Причём к числу Na+-зависимых относятся
переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фе-
нилаланин, лейцин) и аминокислот с катион-ными радикалами (лизин).
Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина.
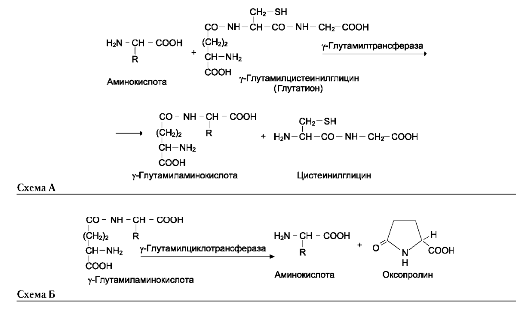
Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глута-мильного цикла (рис. 9-5).
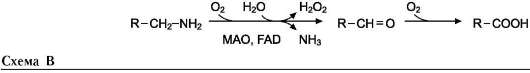
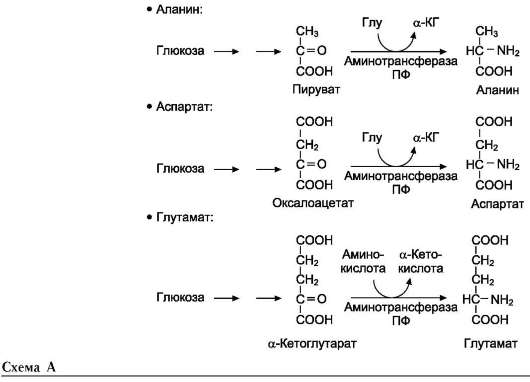
В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связан-ный фермент γ-глутамилтрансфераза. Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион представляет собой трипептид - γ-глутамилцистеинилглицин, который находится во всех тканях животных. Реакция протекает следующим образом (см. схему А на след. стр.).
Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глу-тамильного остатка под действием фермента γ-глутамилциклотрансферазы (см. схему Б).
Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цистеин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ.
Д. НАРУШЕНИЕ ПЕРЕВАРИВАНИЯ БЕЛКОВ И ТРАНСПОРТА АМИНОКИСЛОТ
Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного
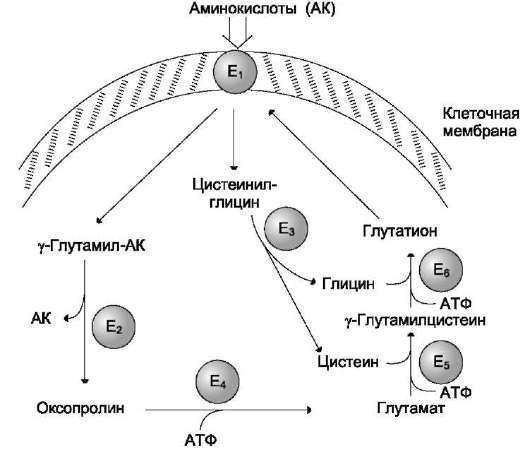
Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтранс-феразы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. E1 - γ-глутамилтрансфераза; E2 - γ-глутамилциклотрансфераза; E3 - пептидаза; E4 - оксопролиназа; E5 - γ-глутамилцистеинсинтетаза; E6 - глутатионсинтетаза.
белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают.
У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции. Очевидно, подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей.
Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии (нетропической спру) происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен.
Такие заболевания, как цистинурия, болезнь Хартнапа и некоторые другие, возникают вслед-
ствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы (рис. 9-5, реакция 4). При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках.
iv. катаболизм аминокислот
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются катаболизму и анаболизму, а также специфическим реакциям, в результате которых синтезируются биологически активные соединения.
Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы. Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
А. ТРАНСАМИНИРОВАНИЕ
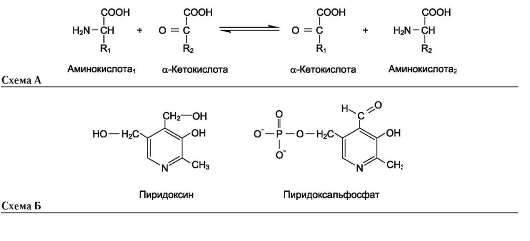
Трансаминирование - реакция переноса а-аминогруппы с аминокислоты на α-кетокисло-ту, в результате чего образуются новая кетокисло-та и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр~1,0), поэтому процесс трансаминирования легко обратим (см. схему А).
Реакции катализируют ферменты аминотранс-феразы, коферментом которых служит пиридок-сальфосфат (ПФ) - производное витамина В6 (пиридоксина, см. раздел 3) (см. схему Б).
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариотов. Причём митохондриальные и цитоплазматичес-кие формы ферментов различаются по физико-химическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
1. Механизм реакции
Аминотрансферазы - классический пример ферментов, катализирующих реакции, протекающие по механизму типа «пинг-понг» (см. раздел 2). В таких реакциях первый продукт должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться.
Активная форма аминотрансфераз образуется в результате присоединения пиридоксальфос-фата к аминогруппе лизина прочной альди-минной связью (рис. 9-6). Лизин в положении 258 входит в состав активного центра фермента. Кроме того, между ферментом и пиридоксаль-фосфатом образуются ионные связи с участием заряженных атомов фосфатного остатка и азота в пиридиновом кольце кофермента.
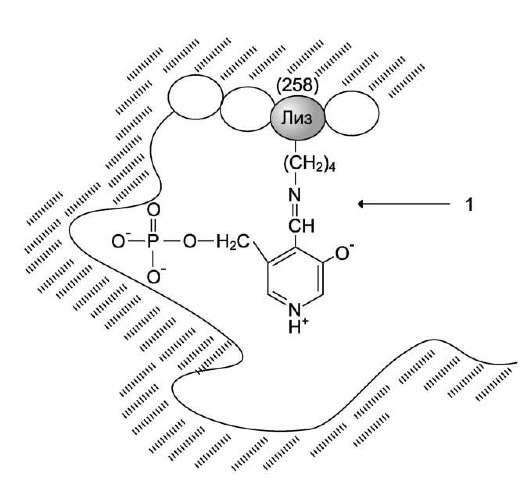
Рис. 9-6. Присоединение пиридоксальфосфата к активному центру аминотрансферазы. Цифрой «1» обозначена альдиминная связь.
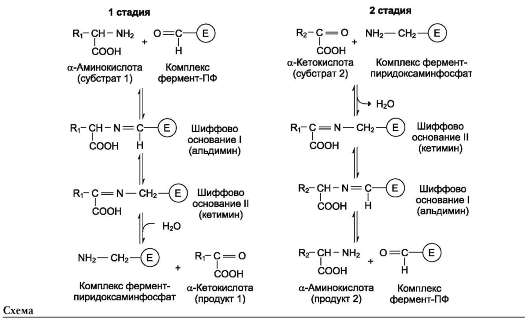
Пиридоксальфосфат в данном случае служит переносчиком аминогрупп. При этом наиболее важную роль играет его альдегидная группа, которая может обратимо присоединять различные амины с образованием шиффовых оснований. Реакции трансаминирования проходят в 2 стадии, во время которых пиридоксальфосфат претерпевает обратимые превращения между свободной альдегидной формой (ПФ) и ами-нированной формой (пиридоксаминфосфат). Последовательность реакций трансаминирова-ния представлена ниже.
• На первой стадии к пиридоксальфосфату в активном центре фермента с помощью альдиминной связи присоединяется аминогруппа от первого субстрата - аминокислоты. Образуются комплекс фермент-пири-доксаминфосфат и кетокислота - первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований.
• На второй стадии комплекс фермент-пири-доксаминфосфат соединяется с кетокислотой (вторым субстратом) и снова через промежуточное образование 2 шиффовых оснований передаёт аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота - второй продукт реакции. Если альдегидная группа пиридоксальфосфата не занята аминогруппой субстрата, то она образует шиффово основание (альдимин) с ε-аминогруппой радикала лизина в активном центре фермента (см. схему на след. стр.).
2. Органоспецифичные аминотрансферазы АЛТ и АСТ
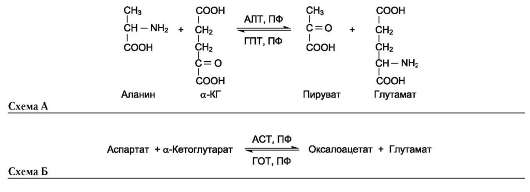
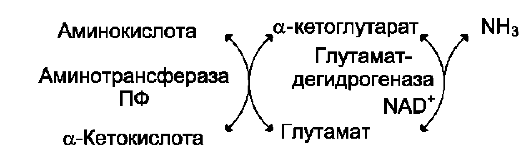
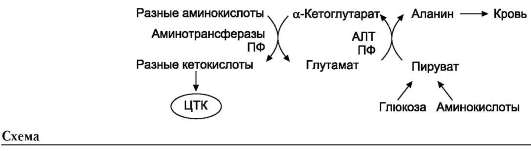
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глу-тамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:
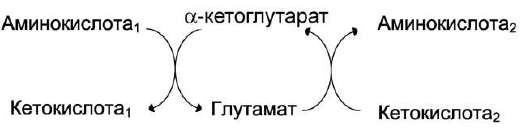
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных ами-нотрансфераз. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ), по обратной реакции - глутамат-пируватаминотранс-фераза (ГПТ) и аспартатаминотрансфераза (АСТ), по обратной реакции - глутамат-оксалоацетата-минотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию трансами-нирования между аланином и α-кетоглутаратом (см. схему А на след. стр.).
Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
АСТ (АсАТ) катализирует реакцию трансами-нирования между аспартатом и α-кетоглутаратом
аналогично предыдущей (см. схему Б на след. стр.).
В результате образуются оксалоацетат и глу-тамат. АСТ имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени.
Так как наибольшее количество АЛТ и АСТ сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз амин-ный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая АСТ. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
3. Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминиро-вание - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансами-нирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокис-лоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При тран-саминировании общее количество аминокислот в клетке не меняется.
4. Диагностическое значение определения аминотрансфераз в клинической практике
В клинической практике широко используют определение активности АСТ и АЛТ в сыворотке крови для диагностики некоторых заболеваний.
В норме в крови активность этих ферментов очень мала и составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку АСТ и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество АСТ значительно превышает количество АЛТ, а в
печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса». В норме этот коэффициент равен 1,33?0,42. При инфаркте миокарда активность АСТ в крови увеличивается в 8- 10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко активность АСТ увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматичес-кая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ~8-10 раз по сравнению с нормой, а АСТ - в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы АСТ.
Б. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дальнейшие превращения продуктов дезаминирования аминокислот представлены на рис. 9-7.
Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток использу-
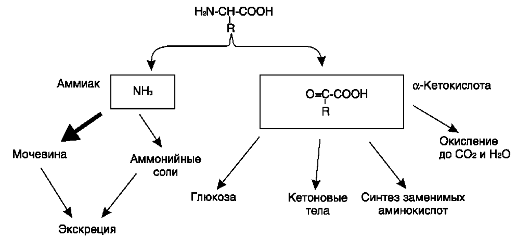
Рис. 9-7. Судьба продуктов дезаминирования аминокислот.
ется для образования аминокислот в реакциях трансаминирования, в процессах глюконеоге-неза, кетогенеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминиро-вания аминокислот:
• окислительное;
• непрямое (трансдезаминирование);
• неокислительное;
• внутримолекулярное.
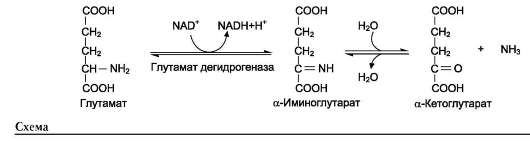
1. Окислительное дезаминирование
Наиболее активно в тканях происходит деза-минирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат (см. схему ниже).
Окислительное дезаминирование глутамата -
обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Синтез глутаматдегидрогеназы может индуцироваться стероидными гормонами (кортизолом).
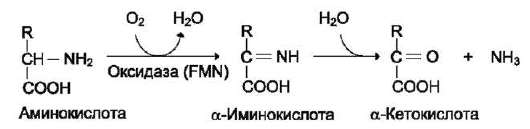
Оксидаза L-аминокислот
В печени и почках обнаружен фермент окси-даза L-аминокислот, способный дезаминировать некоторые L-аминокислоты (см. схему в конце стр.).
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры (рис. 9-8).
2. Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно де-заминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглу-тарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегид-рогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое деза-минирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматде-гидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезами-нирования:
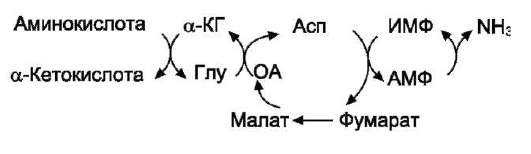
Можно выделить 4 стадии процесса:
• трансаминирование с α-кетоглутаратом, образование глутамата;
• трансаминирование глутамата с оксалоаце-татом (фермент АСТ), образование аспар-тата;
• реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
• гидролитическое дезаминирование АМФ. Перенос аминогруппы от аспартата и синтез
АМФ происходят следующим образом (см. схему А на с. 18).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 18).
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате
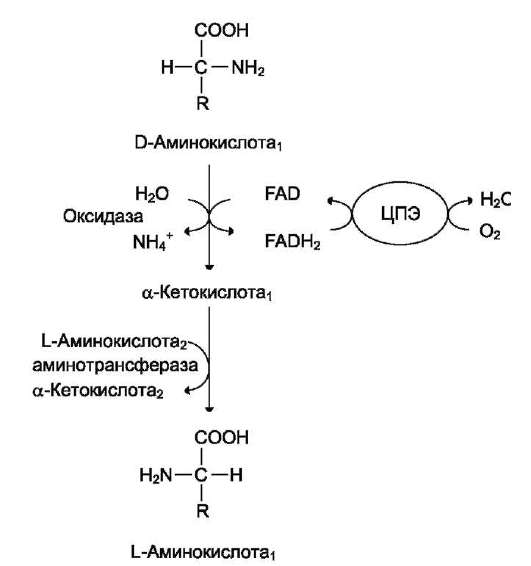
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.
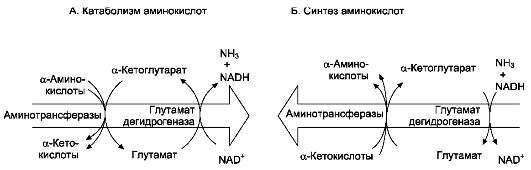
Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на a-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминиро-ванию под действием глутаматдегидрогеназы, в результате чего получаются a-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых a-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования a-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей a-кетокислотой, что приводит к синтезу новой аминокислоты.
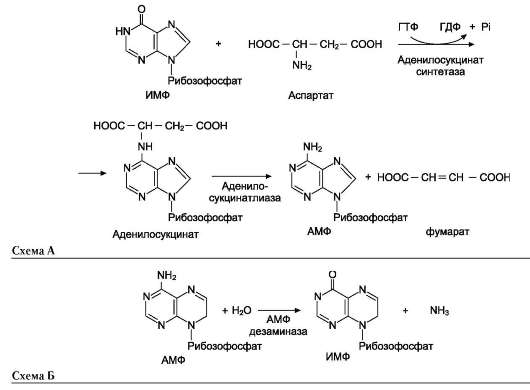
которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисле-ние среды в клетках, вызванное образованием лактата.
3. Неокислительное дезаминирование
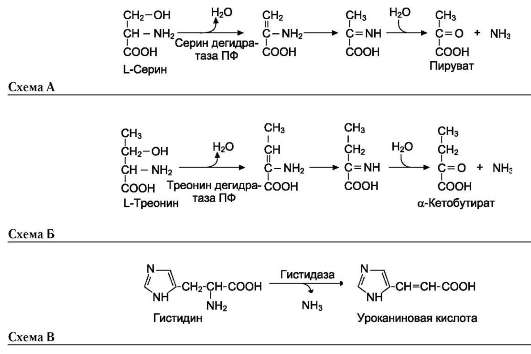
В печени человека присутствуют специфические ферменты, катализирующие реакции деза-минирования аминокислот серина, треонина и гистидина неокислительным путём.
Неокислительное дезаминирование серина катализирует сериндегидратаза (см. схему А на след. стр.).
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина (см. схему Б на след. стр.).
Эти ферменты пиридоксальфосфатзависимые.
Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидин-ам-миаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже (см. схему В на след. стр.).
v. обмен аммиака
А. ИСТОЧНИКИ АММИАКА В КЛЕТКАХ
Катаболизм аминокислот в тканях происходит постоянно со скоростью ~100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака.
Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Основные источники аммиака в клетках представлены в табл. 9-3.
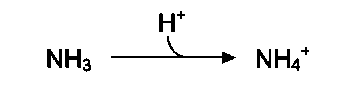
Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 0,4-0,7 мг/л (или 25-40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико (~ 1%).
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение
концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммо-ниемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом.
• Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем. Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции тран-саминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК,
Таблица 9-3. Основные источники аммиака
что вызывает ускорение реакции синтеза ок-салоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
• Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
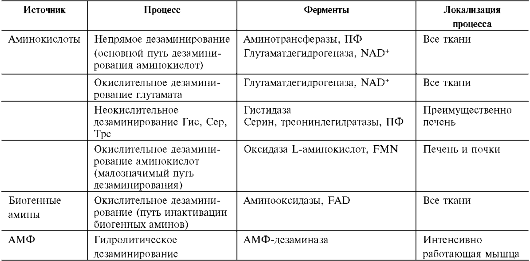
• Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромеди-аторов, в частности синтез γ-аминомасляной кислоты (ГАМК), основного тормозного
• медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги. Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Б. СВЯЗЫВАНИЕ (ОБЕЗВРЕЖИВАНИЕ)
АММИАКА
Высокая интенсивность процессов дезамини-рования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:
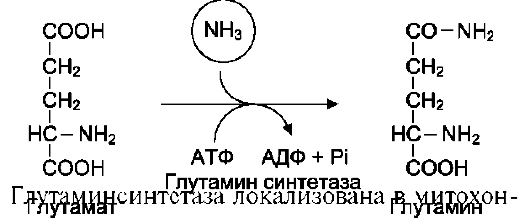
дриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически инги-бируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
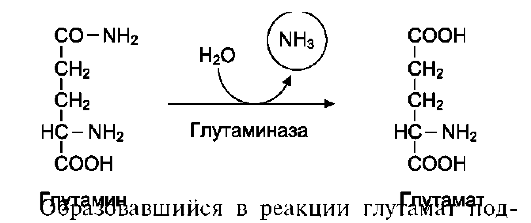
вергается трансаминированию с пируватом. α-Аминогруппа глутаминовой кислоты переносится в состав аланина (рис. 9-10). Большие количества аланина поступают из кишечника в
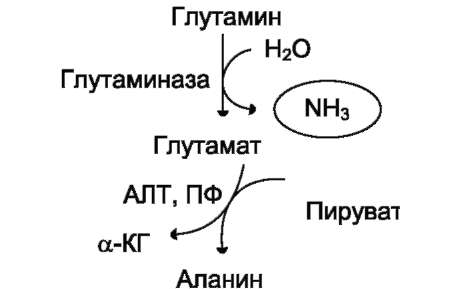
Рис. 9-10. Метаболизм азота глутамина в кишечнике.
кровь воротной вены и поглощаются печенью Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
В почках также происходит гидролиз глута-мина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и K+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нук-леотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
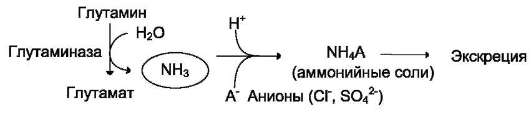
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
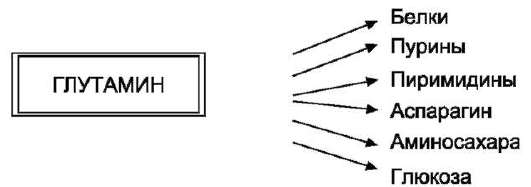
Рис. 9-12. Пути использования глутамина в организме.
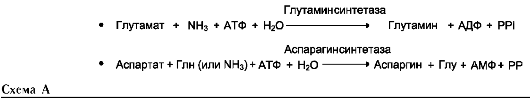
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.
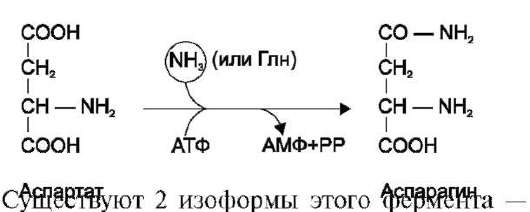
глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэр-гических связей), чем синтез глутамина.
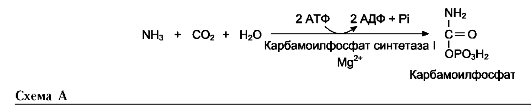
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфосфатсинтетазы I . Кар-
бамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезами-нирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
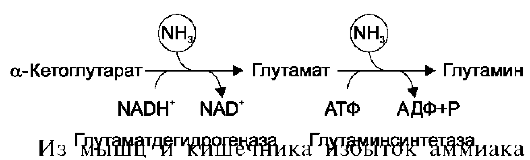
выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребле-
ния глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконе-огенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл, работа которого сопряжена с работой глюкозо-лактатного цикла (см. раздел 7).
Совокупность основных процессов обмена аммиака в организме представлена на рис. 914. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеназа и глу-таминсинтетаза.
В. ОРНИТИНОВЫЙ цикл
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота (рис. 9-15). Экскреция мочевины в норме составляет ~25 г/сут.
При повышении количества потребляемых с пищей белков экскреция мочевины увеличива-
ется. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.П. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
В 40-х годах ХХ века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название «орнитиновый цикл», или «цикл Кребса-Гензелейта».
1. Реакции синтеза мочевины
Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с
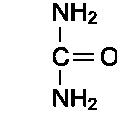
образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I (см. схему А ниже).
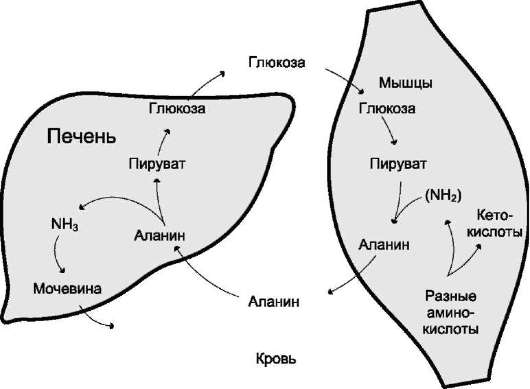
Рис. 9-13. Глюкозо-аланиновый цикл.
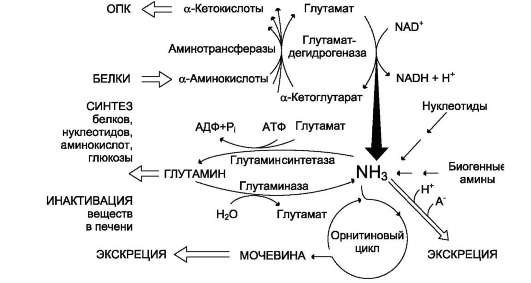
Рис. 9-14. Обмен аммиака. Основной источник аммиака - аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени. Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака.
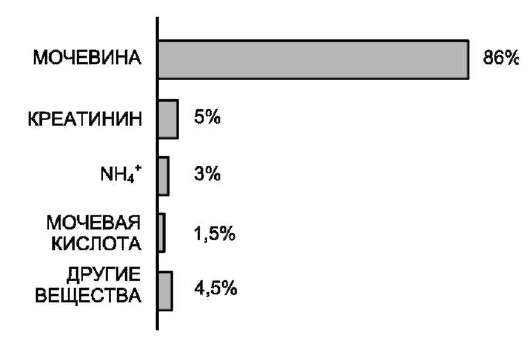
Рис. 9-15. Количество азотсодержащих веществ в моче (%) при нормальном белковом питании.
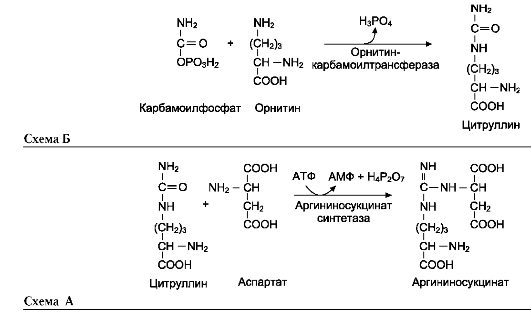
Далее под действием орнитин-карбамоил-трансферазы карбамоильная группа карбамо-илфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота - цитруллин (см. схему Б на след. стр.).
В следующей реакции аргининосукцинат-синтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат - источник второго атома азота мочевины (см. схему А на след. стр.).
Далее фермент аргининосукцинатлиаза (арги-ниносукциназа) расщепляет аргининосукцинат
на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина (см. схему Б ниже).
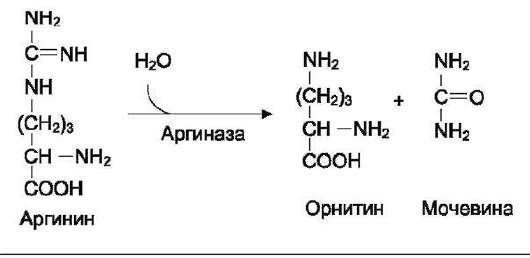
Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мп2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения (рис. 9-16).
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3РО4) + АМФ + Н4Р2О7
Аммиак, используемый карбамоилфосфатсин-тетазой I, поставляется в печень с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутаминовой кислоты в печени, существенно меньше.
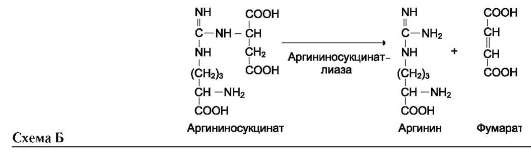
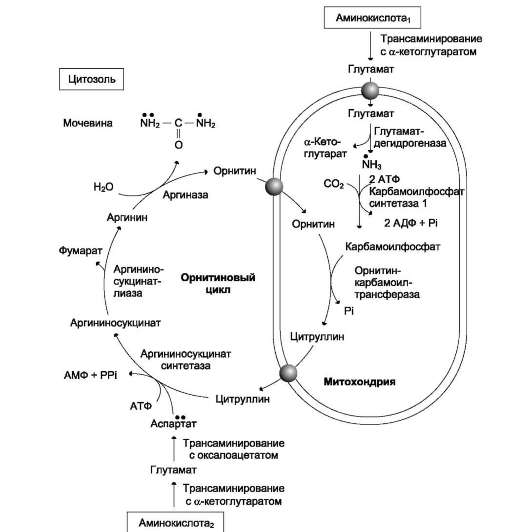
Рис. 9-16. Орнитиновый цикл Кребса-Гензелейта.
• Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: ? одна аминогруппа - в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля.
Аспартат, необходимый для синтеза арги-ниносукцината, образуется в печени путём транс-аминирования аланина с оксалоацетатом. Аланин поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансамини-рования образуется аспартат (рис. 9-17). Таким
образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле из аланина, используется для глюконеогенеза.
Ещё одним источником аспартата для орни-тинового цикла является трансаминирование глутамата с оксалоацетатом.
2. Энергетический баланс процесса
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул
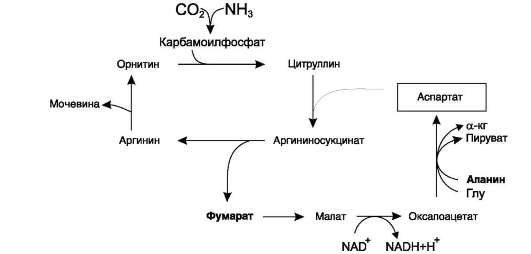
Рис. 9-17. Цикл регенерации аспартата, сопряжённый с орнитиновым циклом.
АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат:
• при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ (рис. 9-18);
• при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - ещё 3 молекулы
АТФ.
Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины (рис. 9-18). Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три - в цито-золе. Цитруллин, образующийся в митохондрии, должен быть перенесён в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путём активного транспорта за счёт градиента ионов натрия, создаваемого К+,Na+-АТФ-азой, что тоже сопряжено с энергозатратами.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются не только в печени, но и в других клетках. В энтероцитах, например, имеется карбамоилфосфатсинтетаза I и орнитинкарбамоилтранс-фераза, следовательно, может синтезироваться
цитруллин. В почках обнаружены аргинино-сукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гид-ролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
3. Биологическая роль орнитинового цикла Кребса-Гензелейта
Орнитиновый цикл в печени выполняет 2 функции:
• превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
• синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса - синтез кар-бамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния,
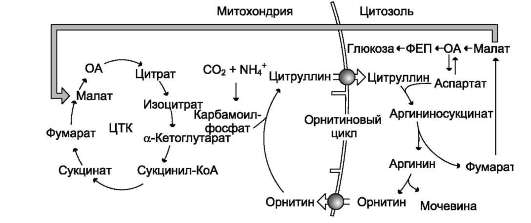
Рис. 9-18. Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла.
При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины.
4. Гипераммониемия
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака
в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла (табл. 9-4).
В литературе описаны случаи всех этих довольно редких энзимопатий, среди которых отмечено больше всего случаев гипераммониемии II типа.
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию.
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосукцинат-синтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоил-трансферазы происходит накопление карбамоил-фосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пири-мидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
• тошнота, повторяющаяся рвота;
• головокружение, судороги;
• потеря сознания, отёк мозга (в тяжёлых случаях);
• отставание умственного развития (при хронической врождённой форме).
Таблица 9-4. Наследственные нарушения орнитинового цикла и основные их проявления
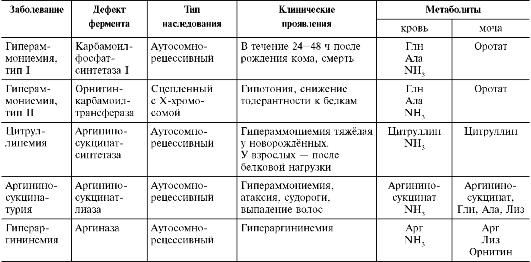
Все симптомы гипераммониемии - проявление действия аммиака на ЦНС (см. выше подраздел IV, Б).
Для диагностики различных типов гиперам-мониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Основной диагностический признак - повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
• путём связывания и выведения NH3 в составе фенилацетилглутамина и гиппуровой кислоты;
• повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций (рис. 9-19).
Вводимый больным с дефектом карбамоил-фосфатсинтетазы I в качестве пищевой добавки фенилацетат в результате его конъюгации с глута-мином образует фенилацетилглутамин, который экскретируется почками. Состояние больных при этом улучшается, так как происходит активация синтеза глутамина и снижение концентрации аммиака в крови (рис. 9-19, А).
Аналогичное действие оказывает введение бензоата, который связывает молекулу глицина. Образующаяся гиппуровая кислота выводится с мочой (рис. 9-19, Б). В составе гиппурата происходит выделение азота из организма. Недостаток глицина компенсируется либо путём синтеза его из серина, либо за счёт образования из NH3 и СО2 в реакции, катализируемой гли-цинсинтетазой. При этом образование глицина сопровождается связыванием одной молекулы аммиака.
При гипераммониемии II типа (дефект орни-тинкарбамоилтрансферазы) введение больших доз цитруллина стимулирует синтез мочевины из аспартата (рис. 9-19, В), что также приводит к выведению азота из организма. Введение больших доз аргинина при аргининосукцинатурии (дефект аргининосукцинатлиазы) стимулирует регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
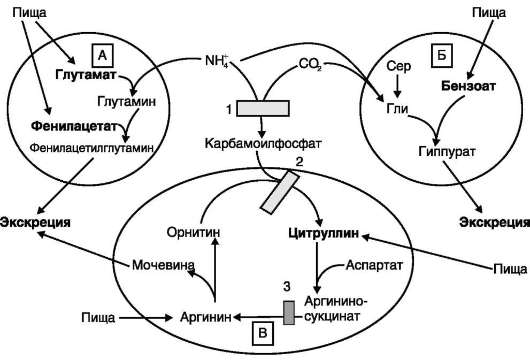
Рис. 9-19. Пути выведения аммиака при включении в диету глутамата и фенилацетата (А), бензоата (Б), цит-руллина и аргинина (В). На рисунке обозначены ферментные блоки: 1 - дефект карбамоилфосфатсинтетазы I; 2 - дефект орнитинкарбамоилтрансферазы; 3 - дефект аргининосукцинатлиазы.
Г. ОБМЕН АММИАКА И АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ И ТКАНЯМИ
В
катаболизме аминокислот и образовании аммиака участвуют многие ткани. В
клетках происходит связывание аммиака. Из организма азот выводится
почками в виде двух конечных продуктов азотистого обмена - аммонийных
солей (~ 0,5 г/сут), которые образуются в почках, и мочевины (~25
г/сут), которая содержит до 90% выводимого азота. Синтез мочевины
происходит в печени в орнитиновом цикле, причём на образование 1 моля
мочевины используется 1 моль аммиака и 1 моль аспарагиновой кислоты.
Таким образом, для синтеза
Транспорт азота из тканей в печень происходит, в основном, в составе 3 соединений: глутамина, аланина, аммиака (небольшое количество в несвязанном виде).
Кроме глутамина и аланина, в крови присутствуют и другие свободные аминокислоты, причём содержание их и направление транс-
порта зависят от приёма пищи и использования эндогенных белков. Наибольшее количество свободных аминокислот поступает из мышц и кишечника, причём до 50% составляют аланин и глутамин. Существует направленный поток аминокислот из этих тканей в печень, который усиливается в абсорбтивный период при белковом питании.
Основное количество глутамина поставляют в кровь мышцы и мозг. Из кровеносного русла его поглощают печень и почки, где он подвергается действию глутаминазы. Почки - основной источник серина и частично аланина, которые сорбируются из плазмы печенью. Головной мозг, в отличие от всех других тканей, способен поглощать и окислять большие количества аминокислот с разветвлённой боковой цепью (валин, лейцин, изолейцин).
После приёма пищи из кишечника в плазму крови поступает много аминокислот, причём преобладают аминокислоты с разветвлённой боковой цепью (до 20% от общего количества), которые затем поглощаются, в основном, печенью, мышцами и мозгом (рис. 9-20). В мышцах происходит усиленный катаболизм
этих аминокислот, причём они выступают основными донорами аминогруппы в синтезе аланина из пирувата (см. выше «глюкозо-ала-ниновый цикл»).
В постабсорбтивном периоде основными источниками свободных аминокислот служат мышцы. Они поставляют в основном аланин и глутамин (рис. 9-21). Аланин поглощается печенью, глутамин - кишечником и почками. В кишечнике азот глутамина переносится в ала-
нин или серин и в их составе транспортируется в печень, где активируется процесс глюконеоге-неза. Интенсивность глюконеогенеза из этих аминокислот намного выше, чем из всех других. Таким образом, аланин и серин - основные гликогенные аминокислоты. Аминокислоты с разветвлённой боковой цепью (валин, лейцин, изолейцин и др.), которые освобождаются из мышц, направляются в мозг, где окисляются и служат важным источником энергии.
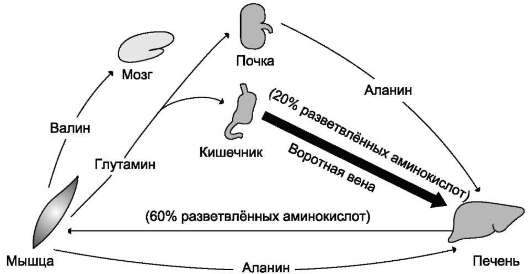
Рис. 9-20. Обмен аминокислот между тканями и органами в абсорбтивном периоде. В абсорбтивный период основным источником свободных аминокислот служит кишечник. Большую часть поступивших аминокислот составляют гидрофобные аминокислоты с разветвлённой цепью. Экзогенные полярные аминокислоты из воротной вены сорбируются и используются, в основном, печенью. Разветвлённые аминокислоты поглощаются из кровотока клетками мозга или мышц.
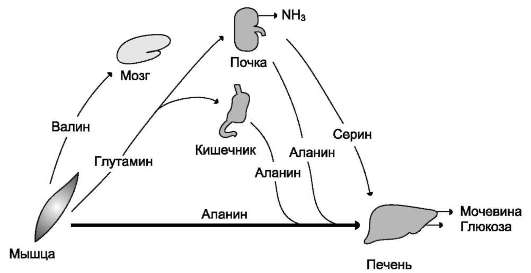
Рис. 9-21. Обмен аминокислот между тканями и органами в постабсорбтивном периоде. В постабсорбтивный период свободные аминокислоты поступают преимущественно из мышц, в которых усиливается катаболизм белков. Аминокислоты используются в процессе глюконеогенеза в печени. В крови повышен уровень аланина, серина и глутамина.
vi. пути обмена безазотистого остатка аминокислот
В
ходе катаболизма аминокислот происходит отщепление аминогруппы и
выделение аммиака. Другим продуктом дезаминирования аминокислот служит
их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот
происходит практически постоянно. За сутки в норме в организме человека
распадается примерно
Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируватки-назы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.
При недостатке глюкозы в организме фос-фоенолпируват включается в глюконеогенез (см. раздел 7). Это происходит при голодании, длительной физической работе, при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании.
А. ГЛИКОГЕННЫЕ И КЕТОГЕННЫЕ АМИНОКИСЛОТЫ
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кето-глутарат, сукцинил-КоА, фумарат, оксалоацетат
(рис. 9-22).
Аминокислоты, которые превращаются в пи-руват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в
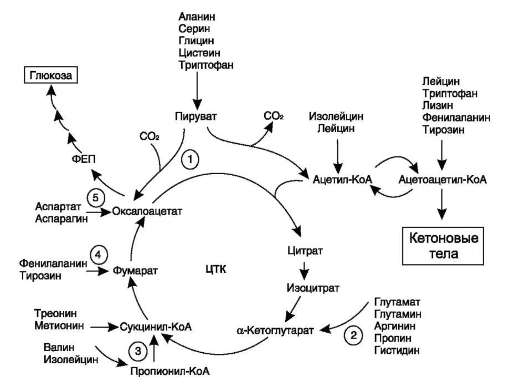
Рис. 9-22. Включение безазотистого остатка аминокислот в общий путь катаболизма.
Таблица 9-5. Классификация аминокислот по судьбе безазотистого остатка
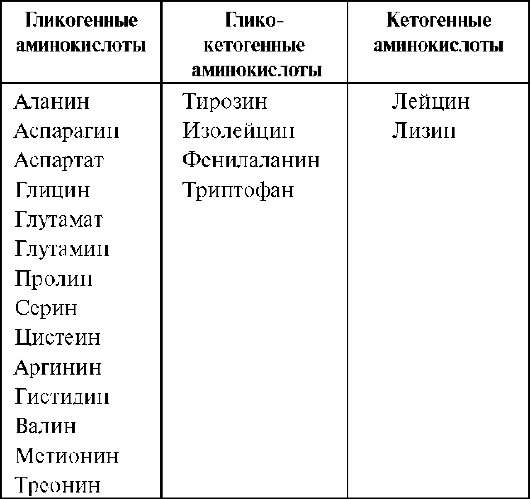
процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитрат-ного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или глико-кетогенными (рис. 9-22, табл. 9-5).
Б. АНАПЛЕРОТИЧЕСКИЕ РЕАКЦИИ
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеро-тическими. На рисунке 9-22 выделены пять анаплеротических реакций:
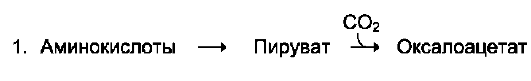
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → а-Кетоглутарат
Превращение происходит во многих тканях под действием глутаматдегидрогеназы или ами-нотрансфераз.

Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8).
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируват-карбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции.
vii. биосинтез заменимых аминокислот
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про (рис. 9-23). Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты (см. схему А на с. 492).
Глутамат также образуется при восстановительном аминировании α-кетоглутарата глута-матдегидрогеназой.
Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфи-болическими.
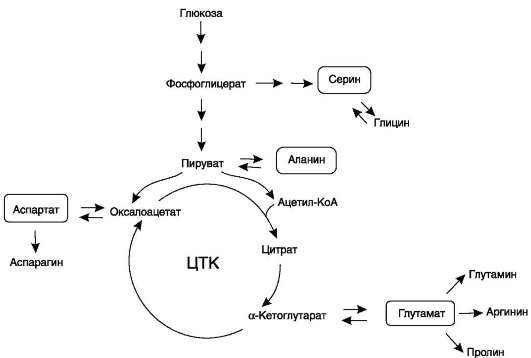
Рис. 9-23. Пути биосинтеза заменимых аминокислот.
Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп (см. схему А).
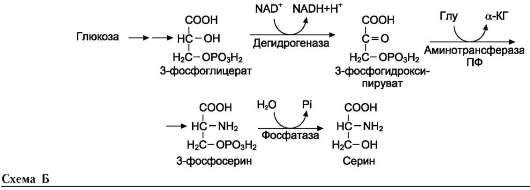
• Серин образуется из 3-фосфоглицерата - промежуточного продукта гликолиза, который окисляется до 3-фосфогидроксипирува-та и затем трансаминируется с образованием серина (см. схему Б).
• Существует 2 пути синтеза глицина:
1) из серина с участием производного фо-лиевой кислоты в результате действия сериноксиметилтрансферазы:
2) в результате действия фермента глицин-синтазы в реакции:
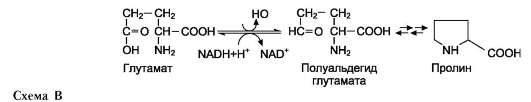
• Пролин синтезируется из глутамата в цепи обратимых реакций. Эти же реакции используются и при катаболизме пролина (см. схему В на след. стр.). Кроме восьми перечисленных заменимых аминокислот, в организме человека могут синтезироваться ещё четыре аминокислоты.
Частично заменимые аминокислоты Арг и Гис
синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей.
• Синтез аргинина происходит в реакциях ор-нитинового цикла (см. выше подраздел IV);
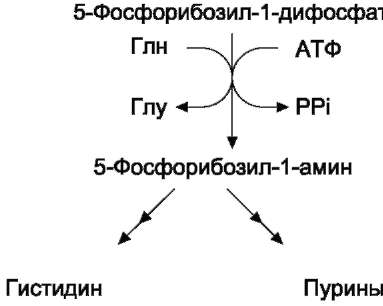
• Гистидин синтезируется из АТФ и рибо-зы. Часть имидазольного цикла гистидина -N=CH-NH- образуется из пуринового ядра аденина, источником которого служит АТФ, остальная часть молекулы - из атомов рибозы. При этом образуется 5-фосфорибо-зил-амин, который кроме синтеза гистидина необходим для синтеза пуринов.
Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно (см. подразделы VIII и IX).
Образование других аминокислот также возможно при наличии соответствующих α-кетокис-лот, которые могут трансаминироваться с глу-таматом. Таким образом, незаменимой частью молекулы аминокислот является их углеродный скелет. Источником таких незаменимых α-кето-кислот служат только белки пищи. Исключение составляют лизин и треонин, которые не подвергаются трансаминированию, их α-кетоаналоги с пищей практически не поступают и в организме не синтезируются. Единственный источник этих аминокислот - пищевые белки.
viii. обмен отдельных
аминокислот
Кроме общих путей обмена, характерных для большинства аминокислот, существуют и специфические пути превращения почти всех аминокислот, входящих в состав белков. Рассмотрим обмен некоторых аминокислот, пути превращения которых приводят к синтезу биологически активных продуктов и во многом определяют физиологические состояния в организме человека.
А. ОБМЕН СЕРИНА И ГЛИЦИНА
Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза -
3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты.
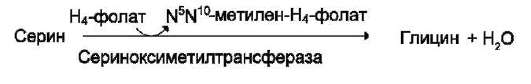
Глицин - также заменимая аминокислота, основным источником которой служит серин. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат (см. схему А).
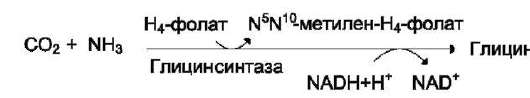
Реакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата (см. схему Б).
Эта реакция обратима и катализируется гли-цинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени. По последним данным глицинрасщепляющая ферментная система несколько отличается от глицинсинтазы и содержит 4 белка: Р-белок, включающий кофермент ПФ, Н-белок, содержащий липоевую кислоту, Т-белок с коферментом Н4-фолат, L-белок, являющийся дигидролипо-илдегидрогеназой с коферментом NAD+.
1. Пути метаболизма серина и глицина
Аминокислоты серин и глицин выполняют в организме человека разнообразные и очень важные функции. Роль серина и глицина в синтезе многих биологически важных соединений представлена на рис. 9-24.
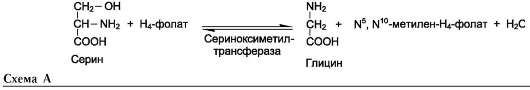
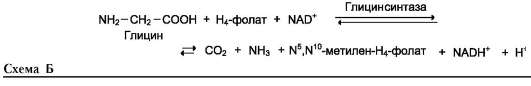
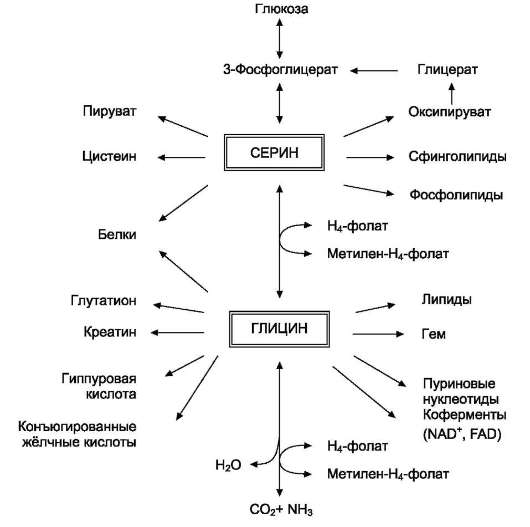
Рис. 9-24. Биологическая роль серина и глицина.
На рисунке видно, что обе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нуклеотидов, коферментов, гема, сложных липидов, креатина и других соединений. Многие из этих реакций представлены в соответствующих разделах учебника.
2. Роль фолиевой кислоты в обмене аминокислот
В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах (см. раздел 3). Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот (см. схему А на след. стр.).
Фолиевую кислоту (фолат) называют также птероилглутаминовой кислотой. Птерины широко распространены в природе. Некоторые из
них, например ксантоптерин, являются пигментами глаз и крыльев насекомых (бабочек).
Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат) (см. схему Б на след. стр.).
Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH.
Н4-фолат - акцептор β-углеродного атома се-рина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат (см. схему В на след. стр.).
3. Образование и использование одноуглеродных фрагментов
Особое значение реакций катаболизма се-рина и глицина заключается в том, что они
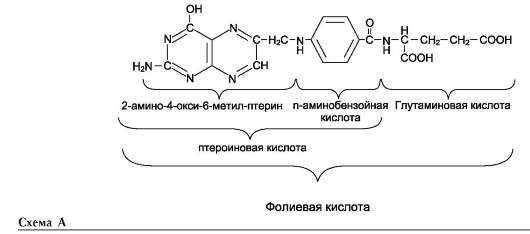
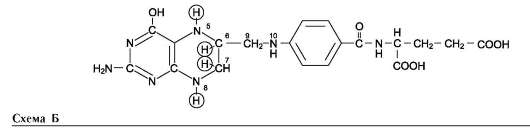
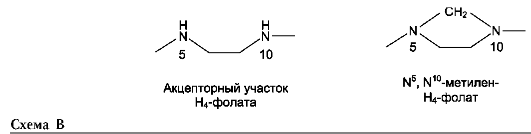
сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен-Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формиль-ную (-НС=О), метильную (-СН3) и формими-ногруппу (-СН=NН) (рис. 9-25).
Ещё один источник формильного и фор-мимино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций (см. схему на с. 498).
Конечными продуктами катаболизма гисти-дина являются глутамат, и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат.
Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метиони-на, синтезе различных формиминопроизводных (формиминоглицина и т.д.) (рис. 9-26).
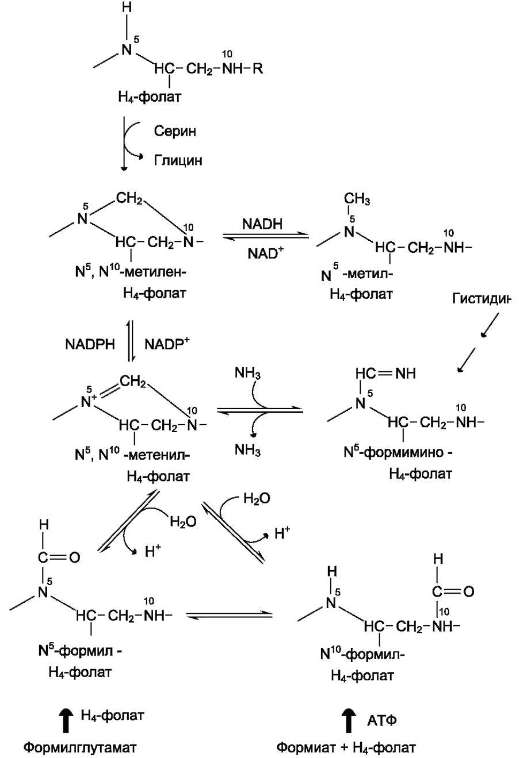
Рис. 9-25. Образование производных Н.-фолата.
Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
4. Недостаточность фолиевой кислоты
Недостаточность фолиевой кислоты у человека возникает редко (см. раздел 3). Ги-
повитаминоз фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов. Такое же нарушение наблюдается и при недостаточности витамина В12, использование которого связано с обменом фолиевой кислоты (см. подраздел IX).
Первое проявление дефицита фолиевой кислоты - мегалобластная (макроцитарная)
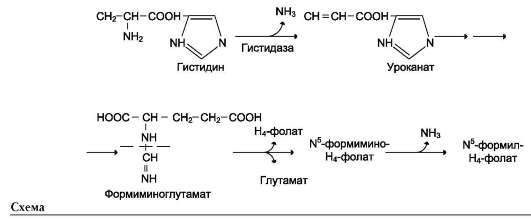
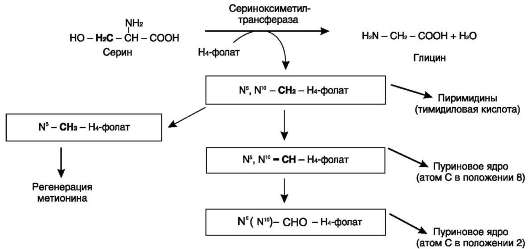
Рис. 9-26. Образование и использование производных Н4-фолата.
анемия. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина этих симптомов - нарушение синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритро-поэза.
Мегалобластная анемия возникает чаще всего в результате недостаточности фолиевой кислоты и/или витамина В12.
5. Механизм антибактериального действия сульфаниламидных препаратов
Фолиевая кислота является витамином для человека и животных. Однако многие патогенные бактерии способны синтезировать это соединение, используя парааминобензойную кислоту (ПАБК) - одну из составных частей фолата. ПАБК поступает в бактериальные клетки из внешней среды. Сульфаниламидные лекарственные препараты - производные сульфаниламида (белого стрептоцида), похожи по строению на парааминобензойную кислоту. Отличаются они только радикалами (см. схему на след. стр.).
Эти препараты подавляют синтез фолиевой кислоты у бактерий, потому что:
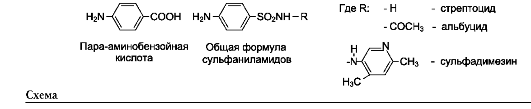
• конкурентно ингибируют бактериальные ферменты синтеза фолата, так как являются структурными аналогами парааминобен-зойной кислоты - одного из субстратов процесса;
• могут использоваться как псевдосубстраты из-за относительной субстратной специфичности ферментов, в результате чего синтезируется соединение, похожее на фолиевую кислоту, но не выполняющее её функции.
В обоих случаях в клетках бактерий нарушается обмен одноуглеродных фрагментов и, следовательно, синтез нуклеиновых кислот, что вызывает прекращение размножения бактерий.
В клетках больного сульфаниламидные лекарственные вещества не вызывают подобных изменений, поскольку человек получает с пищей готовую фолиевую кислоту.
6. Наследственные нарушения обмена глицина
В настоящее время известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность какого-либо фермента или дефект системы транспорта этой аминокислоты. Некоторые из этих нарушений представлены ниже.
Гиперглицинемия характеризуется повышенной концентрацией глицина в крови вследствие дефекта глицинрасщепляющей ферментной системы. Наиболее тяжёлое проявление гипер-глицинемии - резкое повреждение мозга, судороги, гипотония, нарушение дыхания.
Глицинурия характеризуется повышенным выделением глицина с мочой (до 1 г/сут) при нормальном содержании его в крови. Один из симптомов этого заболевания - образование оксалатных камней в почках, причём содержание оксалата в моче находится в пределах нормы. Избыток оксалата имеет эндогенное происхождение. Скорее всего, он получается из глицина, при дезаминировании которого обра-
зуется глиоксилат - предшественник оксалата. Метаболический дефект, очевидно, состоит в нарушении метаболизма глиоксилата - невозможности его превращения снова в глицин из-за дефекта глицинаминотрансферазы. Причиной глицинурии является, очевидно, нарушение реабсорбции глицина в почках. Наследуется как доминантный признак, сцепленный, вероятно, с Х-хромосомой.
Первичная гипероксалатурия характеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления его с пищей. В дальнейшем прогрессирует двустороннее образование оксалатных камней в мочевыводящих путях, развиваются нефрокальциноз и инфекция мочевыводящих путей. Больные погибают в детском возрасте от почечной недостаточности или гипертонии.
Б. ОБМЕН СЕРОСОДЕРЖАЩИХ АМИНОКИСЛОТ
В состав белков человека входят 2 аминокислоты, содержащие серу, - метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой.
1. Особенности обмена метионина
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
Метильная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение.
Метильная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредс-
твенным донором этого одноуглеродного фрагмента служит активная форма аминокислоты.
Реакция активации метионина
Активной формой метионина является S-аде-нозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А).
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин «активный метионин»). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ.
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAГ).
Примеры реакций трансметилирования
Синтез фосфатидилхолина из фосфатидилэтиноламина
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфоли-пидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов (см. раздел 8) (см. схему Б).
Синтез карнитина
Карнитин - переносчик жирных кислот через мембрану митохондрий (см. раздел 8) (см. схему А на с. 501).
Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидин-ацетат при действии глицинамидинотрансферазы (см. схему Б на с. 501).
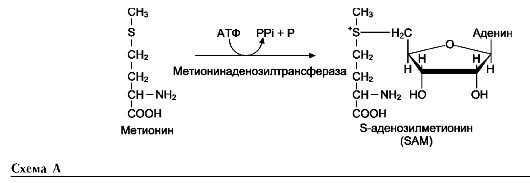
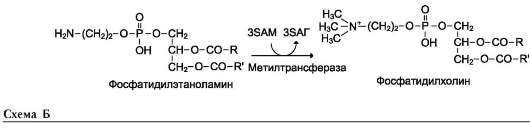
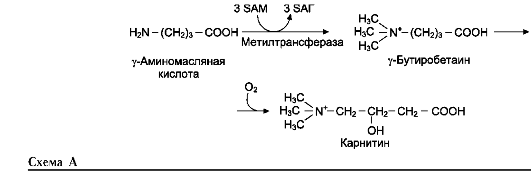
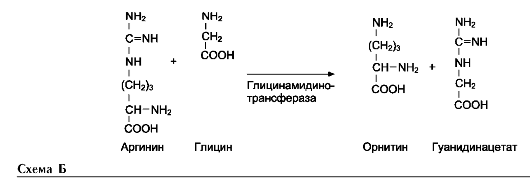
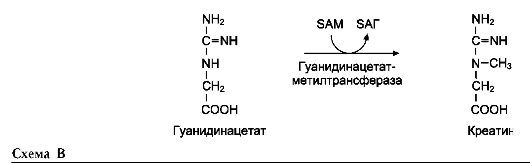
Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования (см. схему В на с. 501).
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат. (см. схему А на с. 502).
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изофермен-тные формы креатинкиназы (см. раздел 2).
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в началь-
ный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение кре-атинина у каждого индивидуума постоянно и пропорционально общей мышечной массе (см. схему Б на с. 502).
Определение содержания креатина и креа-тинина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт
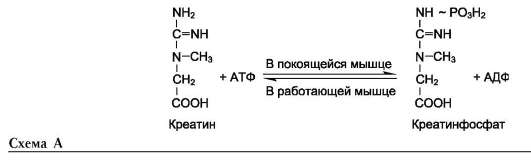
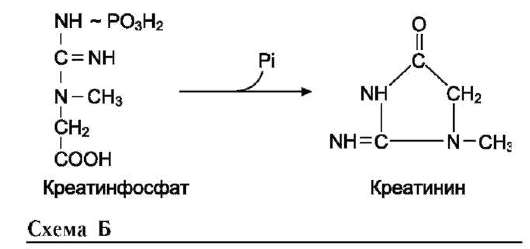
миокарда, миопатии, мышечные дистрофии и др.
Реакции трансметилирования используются также для:
• синтеза адреналина из норадреналина;
• синтеза анзерина из карнозина;
• метилирования азотистых оснований в нук-леотидах и др. (см. раздел 10);
• инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты (см. подразд. IX, раздел 12).
Регенерация метионина
Реакции метилирования играют важную роль в организме и протекают очень интенсивно. Это вызывает большой расход метионина, так как он является незаменимой аминокислотой (в клетках метионин синтезироваться не может). В связи с этим большое значение приобретает возможность регенерации мети-онина с участием заменимых аминокислот (Сер, Гли). В результате отщепления метальной группы SАМ превращается в S-адено-зилгомоцистеин (SAГ), который при действии гидролазы расщепляется на аденозин и гомоцистеин.
S-аденозилгомоцистеин + Н2О Аденозин + Гомоцистеин
Гомоцистеин может снова превращаться в метионин под действием гомоцистеинметил-транс-феразы. Донором метильной группы в этом случае служит N5-метил-Н4-фолат:
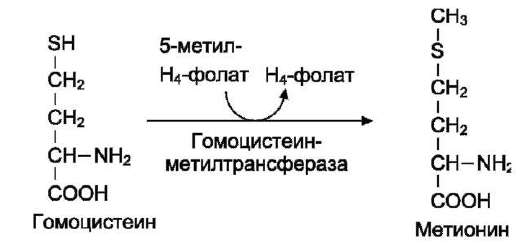
Промежуточным переносчиком метильной группы в этой реакции служит производное витамина В12 - метилкобаламин, выполняющий роль кофермента.
Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метио-нине и гомоцистеине обеспечиваются только метионином пищи. Общая схема метаболизма метионина, связанная с обменом одноуглерод-ных фрагментов, представлена на рис. 9-27.
Первичным донором одноуглеродных фрагментов является серин. Образовавшийся N5,N10-метилен-Н4-фолат восстанавливается до N5-ме-тил-Н4-фолата, передающего метильную группу на кобаламин (витамин В12). Метилкобаламин непосредственно участвует в регенерации ме-тионина. Гомоцистеин может использоваться также для синтеза цистеина.
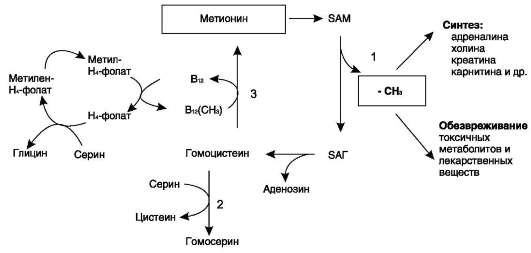
Рис. 9-27. Метаболизм метионина. 1 - реакции трансметилирования; 2 - синтез цистеина; 3 - регенерация метионина.
2. Обмен цистеина
Вторая серосодержащая аминокислота - цисте-ин. Она условно заменима, так как для её синтеза необходим атом серы, источником которого служит незаменимая аминокислота метионин.
Для синтеза цистеина необходимы 2 аминокислоты:
Серин - источник углеродного скелета;
Метионин - первичный источник атома S (см. схему А).
Синтез цистеина из гомоцистеина происходит в 2 стадии под действием пиридоксальзависимых ферментов цистатионинсинтазы и цистатионин-лиазы (см. схему Б на с. 504).
При нарушении использования гомоцистеина в организме из него образуется гомоцистин:
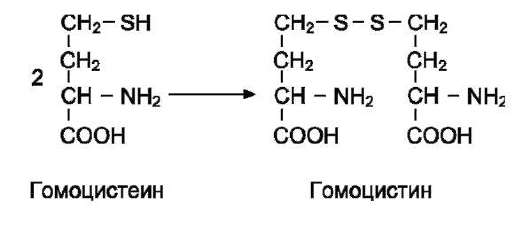
Гомоцистин может накапливаться в крови и тканях, выделяться с мочой, вызывая гомо-цистинурию. Возможной причиной является наследственное нарушение обмена гомоцистеина либо гиповитаминоз фолиевой кислоты, а также витаминов В12 и В6. Из других биохимических нарушений можно отметить цистатионинурию, также часто возникающую при недостаточности витаминов группы В.
Биологические функции цистеина разнообразны и очень важны для организма. Так, цистеин, входящий в состав белков, играет необычайно важную роль в их фолдинге, поскольку тиогруппы цис способны образовывать прочную дисульфид-ную связь. При этом 2 остатка цистеина формируют молекулу цистина (см. схему В на с. 504).
Окислительная реакция протекает либо с участием кофермента NAD+ под действием фермента цистеинредуктазы, либо неферментативно. Дисульфидные связи стабилизируют пространственную структуру полипептидной цепи или связывают между собой 2 цепи (например, А- и В-цепи гормона инсулина). Очень многие белки и ферменты в активном центре содержат SH-груп-
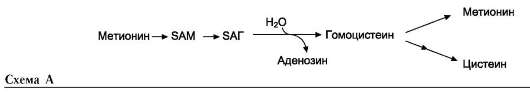
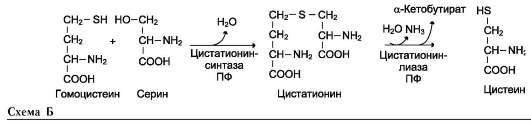
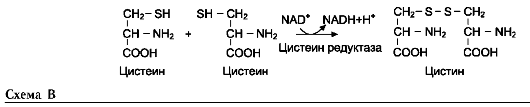
пы, участвующие в катализе. При их окислении ферментативная активность падает (см. разделы 1, 2). Восстановление SH-групп часто происходит с использованием глутатиона - атипичного три-пептида, содержащего γ-глутаминовую кислоту, цистеин и глицин (см. схему Г).
Глутатион способен существовать в 2 формах - восстановленной (Г-SH) и окисленной (Г-S-S-Г) и служит активным антиоксидантом в организме человека.
Ещё одним важным путём использования цис-теина можно считать синтез таурина в животных тканях, который происходит путём декарбокси-лирования производных цистеина - цистеино-вой и цистеинсульфиновой кислот:
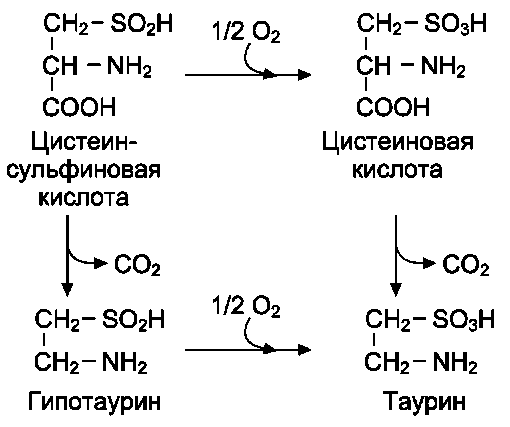
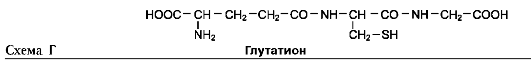
Таурин необходим для синтеза парных жёлчных кислот в печени. Кроме того, он очень важен в клетках как антиоксидант и используется для снижения ПОЛ и связывания гипохлорит-аниона (в форме хлораминового комплекса).
Цистеин также служит предшественником тиоэтаноламинового фрагмента HS-КоА (ко-фермента А).
Катаболизм цистеина происходит окислительным путём (см. схему А на с. 505).
Сульфит, который получается в реакции, превращается в сульфат и выводится с мочой, либо превращается в эфиро-серные кислоты, которые также экскретируются почками. Цис-теин - практически единственный источник сульфатов мочи.
Пути использования цистеина представлены на схеме (см. схему Б на с. 505).
В. МЕТАБОЛИЗМ ФЕНИЛАЛАНИНА И ТИРОЗИНА
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин
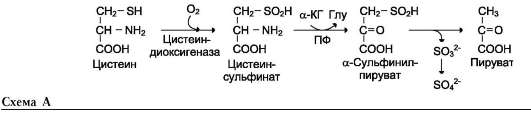

используются для синтеза многих биологически активных соединений. В разных тканях метаболизм этих аминокислот происходит по-разному
(рис. 9-28).
1. Метаболизм фенилаланина
Основное количество фенилаланина расходуется по 2 путям:
• включается в белки;
• превращается в тирозин. Превращение фенилаланина в тирозин прежде
всего необходимо для удаления избытка фени-лаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает.
Основной путь метаболизма фенилаланина начинается с его гидроксилирования (рис. 9-29), в результате чего образуется тирозин. Эта реакция катализируется специфической моноокси-геназой - фенилаланингидроксилазой, кофер-ментом которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоп-терин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + Н+.
2. Особенности обмена тирозина в разных тканях
Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в
синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и катаболизируется до СО2 и Н2О.
Катаболизм тирозина в печени
В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумара-та и ацетоацетата (см. схему А на с. 507):
1. Трансаминирование тирозина с α-кетоглутаратом катализирует тирозинаминотрансфера-за (кофермент ПФ) - индуцируемый фермент печени млекопитающих. В результате образуется п-гидроксифенилпируват.
2. В реакции окисления п-гидроксифенил-пирувата в гомогентизиновую кислоту происходит декарбоксилирование, гидрок-силирование ароматического кольца и миграция боковой цепи. Реакцию катализирует фермент п-гидроксифенилпируватдиоксигеназа, кофакторами которого выступают витамин С и Fe2+.
3. Превращение гомогентизиновой кислоты в фумарилацетоацетат сопровождается расщеплением ароматического кольца. Эта реакция катализируется диоксигеназой гомо-гентизиновой кислоты, в качестве кофермента содержащей Fe2+.
Обмен фенилаланина и тирозина связан со значительным количеством реакций гидрокси-лирования, которые катализируют оксигеназы.
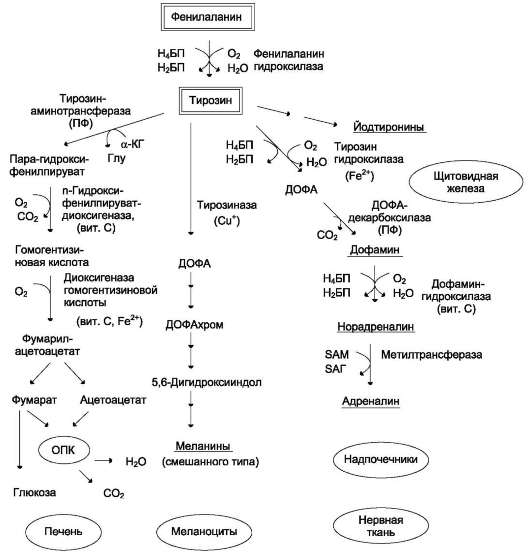
Рис. 9-28. Пути превращения фенилаланина и тирозина в разных тканях. Н4БП - тетрагидробиоптерин; Н2БП - дигидробиоптерин; ПФ - пиридоксальфосфат; SAM - S-аденозилметионин.
Ферменты оксигеназы (гидроксилазы) используют молекулу О2 и кофермент-донор водорода (чаще - Н4БП). Для катализа оксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Cu+), а для многих ещё и витамин С. Оксигеназы делят на 2 группы:
Монооксигеназы - один атом О2 присоединяют к продукту реакции, другой используют для образования Н2О; Диоксигеназы - оба атома О2 используют для образования продукта реакции.
Почти все процессы расщепления ароматических колец в биологических системах катализируются диоксигеназами, подклассом ферментов, открытым японским биохимиком Осами Хайяши.
В результате разрыва бензольного кольца образуется малеилацетоацетат, который в процессе цис- и транс-изомеризации превращается в фумарилацетоацетат.
4. Гидролиз фумарилацетоацетата при действии фумарилацетоацетатгидролазы приводит к обра-
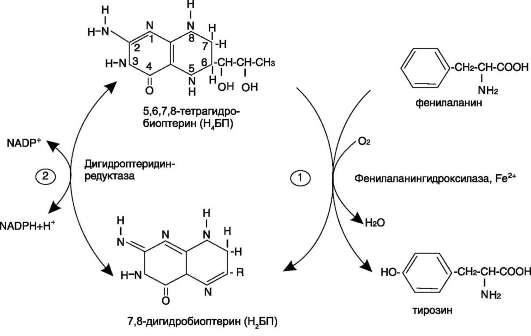
Рис. 9-29. Реакции гидроксилирования фенилаланина (1) и регенерации Н4БП (2).
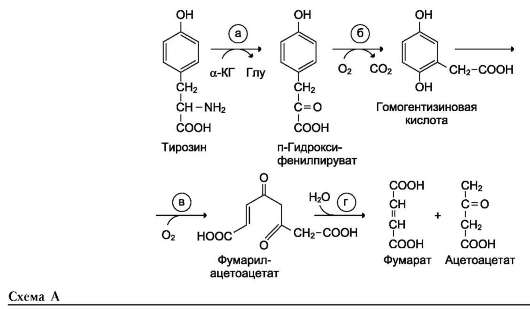
зованию фумарата и ацетоацетата. Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат - кетоновое тело, окисляемое до конечных продуктов с выделением энергии.
Превращение тирозина в меланоцитах
В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумела-нины (чёрного и коричневого цвета) - нерастворимые высокомолекулярные гетерополи-меры 5,6-дигидроксииндола и некоторых его предшественников. Феомеланины - жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Находятся они, в основном, в составе волос. Меланины присутствуют в сетчатке глаз. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов.
Синтез меланинов - сложный, многоступенчатый, разветвлённый процесс. Краткая схема синтеза представлена на рис. 9-28.
Первую реакцию - превращение тирозина в ДОФА - катализирует тирозиназа, использующая в качестве кофактора ионы Cu+ (см. схему
А на с. 509).
Превращение тирозина в щитовидной железе
В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайод-тиронин) и трийодтиронин. Эти гормоны представляют собой йодированные остатки тирозина, которые попадают в клетки щитовидной железы через базальную мембрану (см. раздел 11).
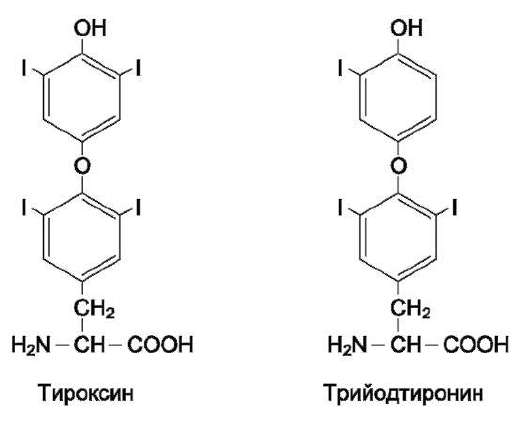
Превращения тирозина в надпочечниках и нервной ткани (синтез катехоламинов)
В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов (дофамина, норадреналина и адреналина) (см. схему Б на с. 509).
При образовании катехоламинов, которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин (ДОФА). Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами:
Тирозиназа в меланоцитах является Си+-зави-
симым ферментом (см. выше). Тирозингидроксилаза (1) в надпочечниках и кате-холаминергических нейронах не нуждается в ионах меди. Это - Fe2+-зависимый фермент, аналогично фенилаланингидроксилазе в качестве кофермента использующий Н4БП. Физиологическая роль тирозингидрок-силазы чрезвычайно велика, так как этот фермент является регуляторным и определяет скорость синтеза катехоламинов. Активность тирозингидроксилазы значительно изменяется в результате: Аллостерической регуляции (ингибитор - норадреналин);
Фосфорилирования/дефосфорилирования: в результате фосфорилирования с участием протеинкиназы А снижаются Кт для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы. Количество фермента регулируется на уровне транскрипции. ДОФА-декарбоксилаза (2) (кофермент - ПФ) катализирует образование дофамина, который при участии дофамингидроксилазы (3) (монооксигеназы) превращается в нор-адреналин. Для функционирования фермента необходимы ионы Си+, витамин С и тетрагидробиоптерин. В мозговом веществе надпочечников фенил-этаноламин-N-метилтрансфераза (4) катализирует метилирование норадреналина, в результате чего образуется адреналин. Источником метильной группы служит SАМ.
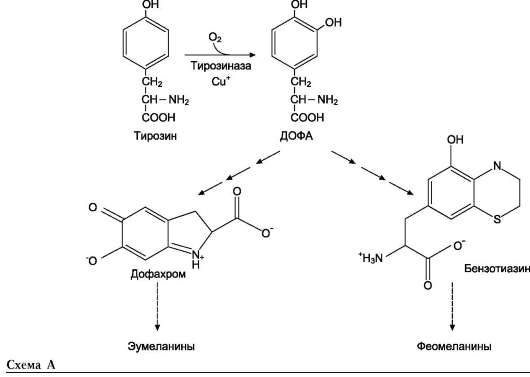
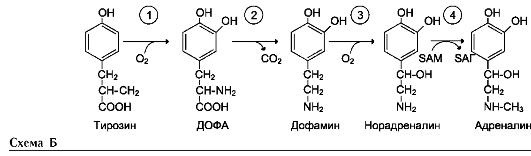
Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин - гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов - регуляция деятельности ССС (см. раздел 11).
3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
Известно несколько наследственных заболеваний, связанных с дефектом ферментов обмена фенилаланина и тирозина в разных тканях.
Фенилкетонурия
В печени здоровых людей небольшая часть фенилаланина (~10%) превращается в фенил-лактат и фенилацетилглутамин (рис. 9-30).
Этот путь катаболизма фенилаланина становится главным при нарушении основного пути - превращения в тирозин, катализируемого фенил-аланингидроксилазой. Такое нарушение сопровождается гиперфенилаланинемией и повышением в крови и моче содержания метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглу-
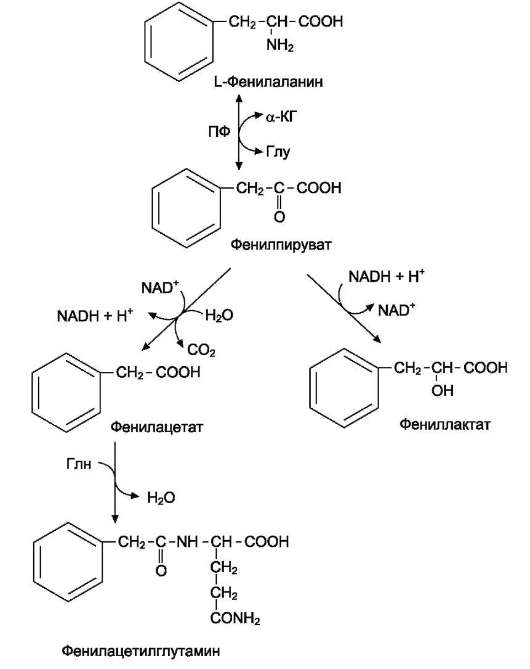
Рис. 9-30. Альтернативные пути катаболизма фенилаланина. При дефекте фенилаланингидроксилазы накопившийся фенил-аланин подвергается трансаминированию с a-кетоглутаратом. Образовавшийся фенилпируват превращается либо в фениллактат, либо в фенилацетилглутамин, которые накапливаются в крови и выделяются с мочой. Эти соединения токсичны для клеток мозга.
тамина. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурия (ФКУ). Выделяют 2 формы ФКУ:
Классическая ФКУ - наследственное заболевание, связанное с мутациями в гене фени-лаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 2030 раз (в норме - 1,0-2,0 мг/дл), в моче - в 100-300 раз по сравнению с нормой (30 мг/дл). Концентрация фенилпирувата
и фениллактата в моче достигает 300- 600 мг/дл при полном отсутствии в норме.
Наиболее тяжёлые проявления ФКУ - нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет. Частота заболевания - 1:10 000 новорождённых. Заболевание наследуется по аутосомно-рецессивному типу.
Тяжёлые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата,
фениллактата. Большие концентрации фени-лаланина ограничивают транспорт тирозина и триптофана через гематоэнцефалический барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина). Вариантная ФКУ (коферментзависимая гипер-фенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм Н4БП. Клинические проявления - близкие, но не точно совпадающие с проявлениями классической ФКУ. Частота заболевания - 1-2 случая на 1 млн новорождённых. Н4БП необходим для реакций гидроксилирова-ния не только фенилаланина, но также тирозина и триптофана, поэтому при недостатке этого кофермента нарушается метаболизм всех 3 аминокислот, в том числе и синтез нейро-медиаторов. Заболевание характеризуется тяжёлыми неврологическими нарушениями и ранней смертью («злокачественная» ФКУ). Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фе-нил-аланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону «пожизненной диеты».
Для диагностики ФКУ используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче. Дефектный ген, ответственный за фенилкетону-рию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину. Для этого обследуемому дают натощак ~10 г фенилаланина в виде раствора, затем через часовые интервалы берут пробы крови, в которых определяют содержание тирозина. В норме концентрация тирозина в крови после фенилаланиновой нагрузки значительно выше, чем у гетерозиготных носителей гена фенилкетонурии. Этот тест используется в генетической консультации для определения риска рождения больного ребёнка. Разработана схема скрининга для выявления новорождённых детей с ФКУ. Чувствительность теста практически достигает 100%.
В настоящее время диагностику мутантного гена, ответственного за ФКУ, можно проводить с помощью методов ДНК-диагностики (рест-рикционного анализа и ПЦР).
Тирозинемии
Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирозину-рии. Различают 3 типа тирозинемии.
Тирозинемия типа 1 (тирозиноз). Причиной заболевания является, вероятно, дефект фермента фумарилацетоацетатгидролазы, катализирующего расщепление фумари-лацетоацетата на фумарат и ацетоацетат (рис. 9-28). Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождённых. Клинические проявления - диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6-8 мес из-за развивающейся недостаточности печени. Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.
Тирозинемия типа II (синдром Рихнера-Хан-хорта). Причина - дефект фермента ти-розинаминотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений.
Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента п-гидроксифе-нилпируватдиоксигеназы, превращающего п-гидроксифенилпируват в гомогентизи-новую кислоту (рис. 9-28). В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенил-аланина. При лечении назначают бедную белком диету и витамин С.
Алкаптонурия («чёрная моча»)
Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты (рис. 9-28). Для этой
болезни
характерно выделение с мочой большого количества гомогентизиновой
кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты
алкаптоны. Это метаболическое нарушение было описано ещё в XVI веке, а
само заболевание охарактеризовано в
Альбинизм
Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов.
Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Нарушение синтеза катехоламинов (рис. 9-28) может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Болезнь Паркинсона
Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы:
• заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др.
• подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина.
Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
ix. азотсодержащие
соединения - производные
аминокислот
Большую роль в организме человека играют непептидные азотсодержащие соединения - производные аминокислот. К ним можно отнести гормоны надпочечников (норадреналин, адреналин), щитовидной железы (тироксин, трийодтиронин), а также медиаторы ЦНС (аце-тилхолин, ГАМК и др.), медиатор воспаления (гистамин) и другие соединения.
А. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Арг, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
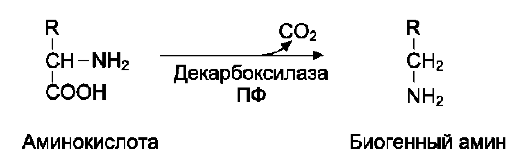
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидин-декарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза E. coli и др. Механизм реакции
напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования шиффова основания ПФ и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксили-ровании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
1. Синтез и биологическая роль серотонина
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксилирует также фенилаланин) (см. схему ниже).
Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрес-сантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
2. Синтез и биологическая роль ацетилхолина
Ацетилхолин синтезируется в нервной ткани и служит одним из важнейших возбуждающих нейромедиаторов вегетативной нервной системы. Его предшественник - аминокислота серин:
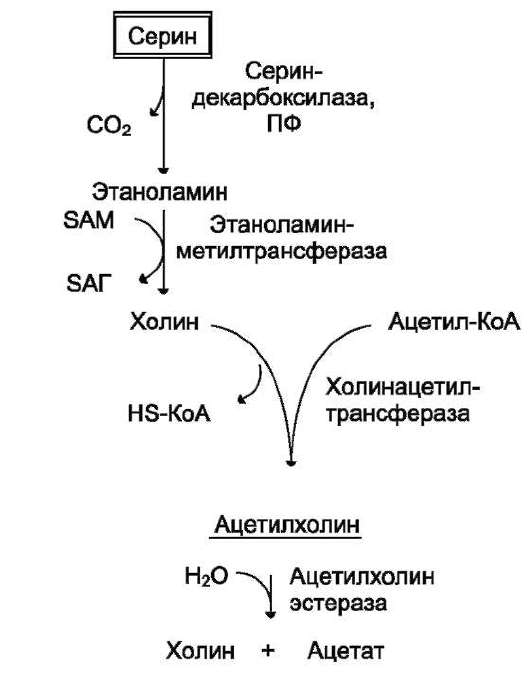
3. Синтез и биологическая роль γ-аминомасляной кислоты
В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга (см. схему на с. 514).
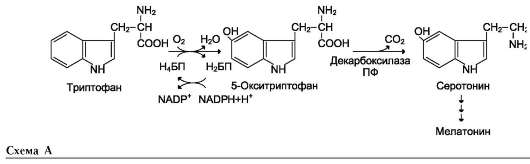
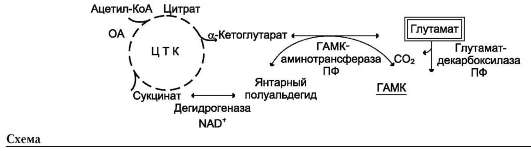
Цикл превращений ГАМК в мозге включает три сопряжённые реакции, получившие название ГАМК-шунта. Первую катализирует глутамат-декарбоксилаза, которая является пиридоксаль-зависимым ферментом. Эта реакция является регуляторной и обусловливает скорость образования ГАМК в клетках мозга. Продукт реакции - ГАМК. Последующие 2 реакции можно считать реакциями катаболизма ГАМК. ГАМК-амино-трансфераза, также пиридоксальзависимая, образует янтарный полуальдегид, который затем подвергается дегидрированию и превращается в янтарную кислоту. Сукцинат используется в цитратном цикле. Инактивация ГАМК возможна и окислительным путём под действием
МАО.
Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга.
ГАМК в виде препаратов гаммалон или ами-налон применяют при сосудистых заболеваниях головного мозга (атеросклероз, гипертония), нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга, а также заболеваниях ЦНС, связанных с резким возбуждением коры мозга (например, эпилепсии).
4. Другие медиаторы ЦНС: глицин, глутамат
Свободные аминокислоты играют исключительно важную роль в головном мозге как предшественники белков и таких биологически активных веществ, как нейропептиды, гормоны, биогенные амины и др. Некоторые аминокислоты могут участвовать в синаптической передаче,
выполняя функцию нейромедиаторов. Очень важна для головного мозга и энергетическая роль аминокислот. Содержание свободных аминокислот в головном мозге достигает ~35 мкмоль/г ткани, что значительно выше, чем в плазме крови (~3,5 мкмоль/л) и в спинномозговой жидкости. Преобладают глутаминовая кислота, глутамин, аспарагиновая кислота, глицин, ГАМК, N-ацети-ласпартат и др. Аминокислоты глицин и глутамат - важнейшие нейромедиаторы.
Глутамат содержится в головном мозге в очень больших количествах (до ~10 мкмоль/г ткани) и выполняет разнообразные функции:
• один из основных возбуждающих медиаторов в коре, гиппокампе, полосатом теле и гипоталамусе;
• участвует в регуляции процессов памяти;
• составная часть ряда малых и средних ре-гуляторных пептидов мозга, таких как глу-татион. В виде пироглутамата (циклическая форма) входит в целый ряд нейропепти-дов - люлиберин, тиролиберин, нейротен-зин, бомбезин и др.
• велика его энергетическая роль, так как глута-мат служит поставщиком α-кетоглутарата - компонента цитратного цикла;
• участвует в обезвреживании аммиака с образованием глутамина, который в больших количествах поступает через мембраны в нейроны, где присутствует фермент глутами-наза. Под действием этого фермента вновь образуется глутамат, который используется для синтеза ГАМК. Учитывая, что биомембраны менее проницаемы для глутамата, чем для глутамина, его можно расценивать как глиально-нейрональный переносчик глутамата (а значит, и ГАМК).
Нарушение глутаматергической системы происходит при целом ряде патологических
нарушений ЦНС: эпилепсии, расстройствах вестибулярной системы, ишемии и др. Глутамат и его аналоги используют как лекарственные средства при хронической недостаточности аминокислотного обмена, вегетососудистой дис-тонии, эпилепсии (в качестве предшественника ГАМК - тормозного медиатора).
Другая аминокислота-нейромедиатор - глицин. Концентрация глицина в плазме крови невысока, поэтому в мозг поступают недостаточные количества этой аминокислоты. Значительная часть глицина синтезируется из глюкозы, которая поступает из крови (реакции синтеза рассмотрены выше).
Глицин - важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга. Высокий уровень глицина в плазме крови и моче обычно свидетельствует о нарушении функций мозга.
Разрушение глицина может происходить тремя путями:
• превращением глицина в серин под действием сериноксиметилтрансферазы;
• расщеплением глицина на аммиак, оксид углерода и метилен-Н4-фолат;
• окислением под действием оксидазы аминокислот (см. выше подраздел IV).
Гиперглицинемия развивается в раннем возрасте и сопровождается эпизодической рвотой, подавлением двигательной активности, нарушением электроэнцефалограммы и часто завершается летальным исходом. Гиперглицинемия может быть следствием нарушения обычных путей разрушения глицина в нервных клетках.
Б. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ - ПРОИЗВОДНЫЕ ГИСТИДИНА
Аминокислота гистидин в разных тканях подвергается действию различных ферментов и включается в два разных метаболических пути:
• катаболизм до конечных продуктов;
• синтез гистамина (рис. 9-31).
В печени и коже гистидин подвергается деза-минированию под действием фермента гисти-дазы с образованием уроканиновой кислоты. Конечным продуктом катаболизма гистидина служит глутамат, NH3 и производные Н4-фо-лата (N5-формимино-Н4-фолат и N5-формил-Н4-фолат). Наследственный дефект гистидазы
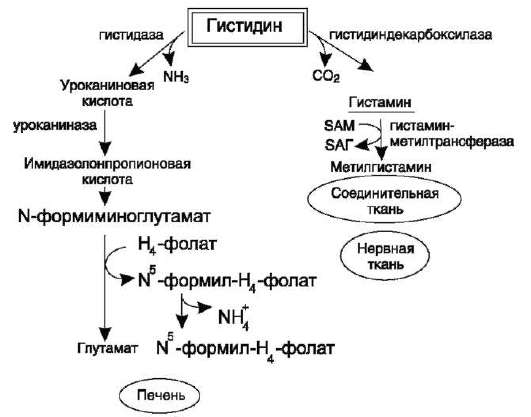
Рис. 9-31. Схема обмена гистидина в разных тканях.
вызывает накопление гистидина и развитие гистидинемии, которая проявляется задержкой в умственном и физическом развитии детей. Наследственный дефект уроканиназы в печени может вызвать уроканинемию, при которой в крови повышается уровень уроканата. Симптомы этого патологического состояния во многом аналогичны симптомам других энзимопатий и проявляются отставанием умственного и физического развития.
Ферменты гистидаза и уроканиназа гепатоспеци-фичны, поэтому их определение используют в клинике для диагностики поражений печени.
1. Синтез и биологическая роль гистамина
Гистамин образуется путём декарбоксилиро-вания гистидина в тучных клетках соединительной ткани (см. схему А на с. 516).
Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции:
• стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
• повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
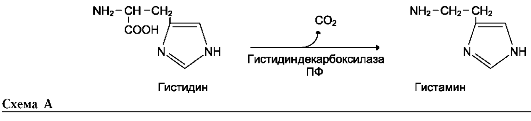
• сокращает гладкую мускулатуру лёгких, вызывает удушье;
• участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани;
• вызывает аллергическую реакцию;
• выполняет роль нейромедиатора;
• является медиатором боли.
2. Синтез и биологическая роль карнозина и анзерина
В
мышцах и головном мозге синтезируются гистидиновые дипептиды карнозин и
анзерин, причём в скелетных мышцах их содержание особенно велико и
достигает величин порядка 100-200 мг/100 г ткани. Карнозин был
обнаружен в
Карнозин образуется из β-аланина и гисти-дина под действием карнозинсинтетазы (см. схему Б).
Далее в присутствии SAM идёт реакция метилирования карнозина под действием фермента N-метилтрансферазы и образуется анзерин. β-Аланин, необходимый для синтеза, получается при катаболизме пиримидиновых нуклеотидов.
Карнозин может поступать из мышц в кровь и поглощаться почками и энтероцитами. В крови и почках человека присутствует Zn-зависимый
фермент карнозиназа, способный гидролизовать карнозин на β-аланин и гистидин.
Физиологическое действие гистидиновых дипептидов изучалось российским биохимиком С.Е. Севериным в 60-х годах и исследуется до настоящего времени многими учёными. Карно-зин увеличивает амплитуду сокращения скелетных мышц и активирует работу ионных насосов мышечных клеток, стимулирует АТФ-азную активность миозина. Содержание гистидиновых пептидов в гладкой и сердечной мускулатуре во много раз ниже, чем в скелетной. Они создают до 40% буферной ёмкости быстрых мышц и позволяют накапливать много лактата. Избыток лактата в отсутствие гистидиновых пептидов приводит к ацидозу и контрактуре. Карнозин и анзерин обладают антиоксидантной активностью, ингибируют NO-зависимую гуанилатцик-лазу, замедляют процессы старения человека, влияя на скорость апоптоза.
В. РОЛЬ АРГИНИНА И ОРНИТИНА В СИНТЕЗЕ БИОЛОГИЧЕСКИ АКТИВНЫХ МОЛЕКУЛ
Обмен аминокислоты аргинина связан с реакциями орнитинового цикла, которые можно рассматривать как путь синтеза аргинина. Под действием аргиназы в цикле происходит и распад аргинина на орнитин и мочевину.
Аргинин выполняет в организме важные функции:
• используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих. В мышцах беспозвоночных аналогичную энергетическую функцию способен выполнять аргинин-фосфат.
• служит источником NO в организме;
• служит предшественником орнитина, из которого синтезируются полиамины.
1. Аргинин - источник МО в организме
Аминокислота аргинин служит в организме источником оксида азота (N0). Образование N0 в клетках катализирует сложный Са2+-зависимый фермент NO-синтаза. В состав фермента входит гем, необходимы два флавиновых кофермента FAD и FMN, Н4БП, а также ионы Zn2+.
Образование NO происходит во всех клетках и тканях. В настоящее время в разных клетках обнаружены три изоферментные формы NO-син-тазы: нейрональная и эпителиальная - конститутивные, и индуцибельная, которая преобладает в печени, мышцах, миокарде.
Оксид азота - важная сигнальная молекула, активирующая гуанилатциклазу и стимулирующая быстрое образование цГМФ. Это вызывает снижение силы сердечных сокращений, регулирует тонус сосудов. Кроме этого, NO-радикал участвует в регуляции скорости апоптоза, предотвращает агрегацию тромбоцитов и тромбоз, регулирует секрецию медиаторов и гормонов, обладает антиканцерогенной активностьют (рис. 9-32).
2. Образование спермидина и спермина, их биологическая роль
Аргинин под действием аргиназы превращается в аминокислоту орнитин, которая не входит в состав белков организма. Из орнитина синтезируются полиамины спермидин и спермин (см. схему А на с. 518).
Реакция проходит под действием орнитинде-карбоксилазы в присутствии пиридоксальфос-фата. Далее под действием спермидинсинтазы и сперминсинтазы происходит включение остатков аминопропана. Донором этих групп служит производное SAM - S-аденозилметилтиопро-пиламин (см. схему Б на с. 518).
Спермидин, спермин и путресцин обнаружены в ядрах клеток всех органов человека. Они имеют большой положительный заряд, легко связываются с отрицательно заряженными молекулами ДНК и РНК, входят в состав хроматина и участвуют в репликации ДНК, стимулируют транскрипцию и трансляцию. Их концентрация сильно возрастает при интенсивной пролиферации тканей.
Фермент орнитиндекарбоксилаза - регулируемый. Он отличается очень коротким T1/2 - всего 10 мин. Гормон роста, кортикостероиды, тестостерон быстро увеличивают его количество
в 10-200 раз.
Катаболизм полиаминов до СО2 и Н2О происходит под действием полиаминоксидазы в печени. Часть их в ацетилированном виде экс-кретируется почками.
Основные биогенные амины и их аминокислоты-предшественники представлены в табл. 9-6.
К биогенным аминам относят и катехола-мины (дофамин, норадреналин и адреналин). Дофамин, в частности, является медиатором среднего отдела мозга. Норадреналин - возбуждающий медиатор в гипоталамусе, а также медиатор синаптической нервной системы и разных отделов головного мозга. Адреналин - гормон, активно синтезирующийся при стрессе и регулирующий основной обмен, а также усиливающий сокращение сердечной мышцы.
Г. ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ
Для осуществления биологической функции в нервных клетках требуется определённая концентрация биогенных аминов. Избыточное
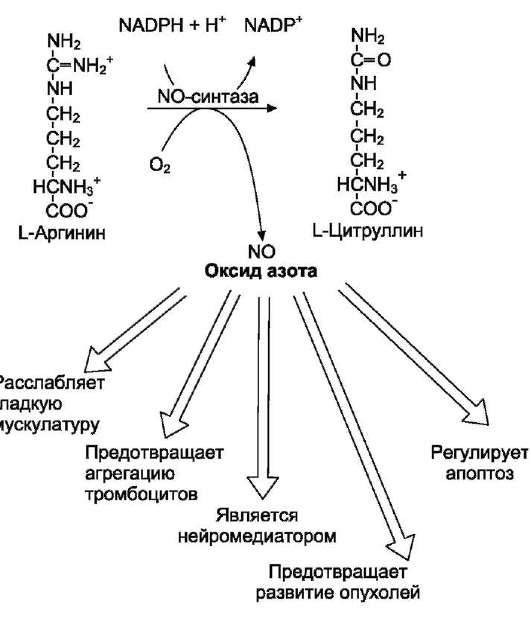
Рис. 9-32. Биосинтез и биологическая роль оксида азота.
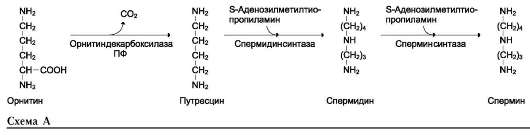
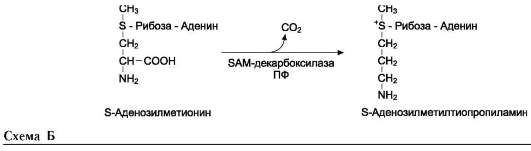
Таблица 9-6. Предшественники и биологическая роль некоторых биогенных аминов
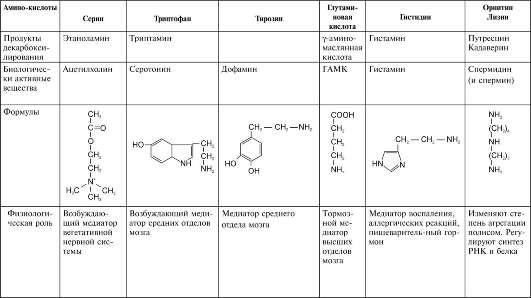
накопление их может вызывать различные патологические отклонения. В связи с этим большое значение приобретают механизмы инактивации биогенных аминов.
Инактивация биогенных аминов происходит двумя путями:
1) метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инак-тивироваться различные биогенные амины,
но чаще всего происходит инактивация гис-тамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в орто-положении (см. схему А). Реакция инактивации гистамина также преимущественно происходит путём метилирования (см. схему Б).
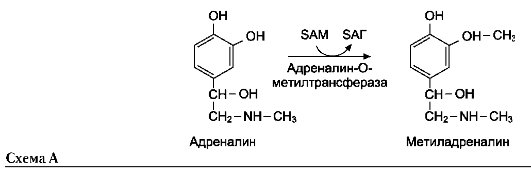
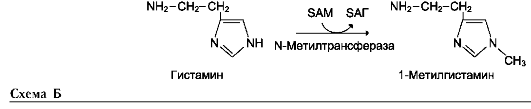
2) окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путём чаще происходит инактивация дофамина, норадрена-лина, серотонина, ГАМК. При этом происходит
окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками (см. схему В).