Биохимия: учебник для вузов/ под ред. Е.С.Северина - 5-е изд., - 2009. - 768 с.
|
|
|
|
РАЗДЕЛ 1 СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
В живых клетках происходит синтез множества органических молекул, среди которых главную роль играют полимерные макромолекулы - белки, нуклеиновые кислоты, полисахариды.
Особая роль в жизнедеятельности живых организмов принадлежит белкам. От родителей детям передаётся генетическая информация о специфической структуре и функциях всех белков данного организма. Синтезированные белки выполняют многообразные функции: ускоряют химические реакции, выполняют транспортную, структурную, защитную функции, участвуют в передаче сигналов от одних клеток другим и таким образом реализуют наследственную информацию. Поэтому белки называют также протеинами (от греч. proteos - первый).
На долю белков внутри клетки приходится более половины их сухого вещества. В организме человека насчитывают около 50 000 индивидуальных белков. Видовая и индивидуальная специфичность набора белков в данном организме определяет особенности его строения и функционирования. Набор белков в дифференцирующихся клетках одного организма определяет морфологические и функциональные особенности каждого типа клеток.
Как и любой полимер, белок состоит из мономерных единиц, или «строительных блоков». В белках организма человека такими мономерами служат 20 из нескольких сотен известных в природе аминокислот. Аминокислоты, находящиеся в белках, связаны друг с другом пептидными связями. Линейная последовательность аминокислот в белке уникальна для каждого индивидуального белка; информация о ней содержится в участке молекулы ДНК, называемой геном.
Полипептидные цепи за счёт внутримолекулярных взаимодействий образуют пространственные структуры - конформации белков. На определённом участке белковой молекулы из радикалов аминокислот формируется активный центр, который может специфично (комплементарно) связываться с молекулами-лигандами.
Взаимодействие белков с лигандами лежит в основе их функционирования. Изменения последовательности аминокислот в белках могут приводить к изменению пространственной структуры и функций данных белков и развитию заболеваний.
I. СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ, ВХОДЯЩИХ
В СОСТАВ БЕЛКОВ. ПЕПТИДНЫЕ
СВЯЗИ, СОЕДИНЯЮЩИЕ АМИНОКИСЛОТЫ В ЦЕПИ
Белки - полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Аминокислоты можно рассматривать как буквы алфавита, при помощи которых, как в слове, записывается информация. Слово несёт информацию, например о предмете или действии, а последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка.
А. СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
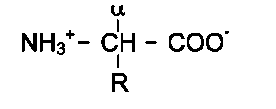
В водных растворах при нейтральном значении рН α-аминокислоты существуют в виде биполярных ионов.
В отличие от 19 остальных α-аминокислот, пролин - иминокислота, радикал которой связан как с α-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.

19 из 20 аминокислот содержат в α-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
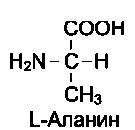
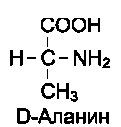
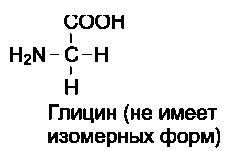
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и нефер-ментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-амино-кислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому.
2. Классификация аминокислот
по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (табл. 1-1).
В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH2), тиольная (-SH), амид-ная (-CO-NH2) гидроксильная (-ОН) и гуани-
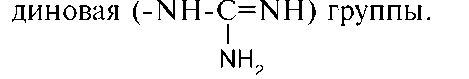
Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия (табл. 1-2).
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серин впервые был выделен из фиброина шёлка (от лат. serieum - шелковистый), а глицин получил свое название из-за сладкого вкуса (от греч. glykos - сладкий).
3. Классификация аминокислот по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофоб-
Таблица 1-1. Классификация основных аминокислот белков по их химическому строению

Таблица 1-2. Примеры названий аминокислот по заместительной номенклатуре и соответствующее тривиальное название
ным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
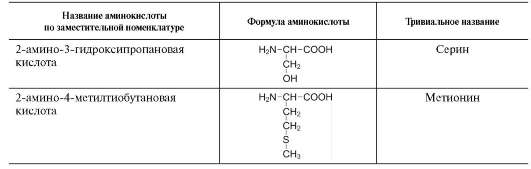
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серин, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цис-теин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глу-таминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У
лизина вторая аминогруппа, способная присоединять Н+, располагается в ε-положении алифатической цепи, а у аргинина положительный заряд приобретает гуанидиновая группа. Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп - отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы - катионы (см. схему ниже).
Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
4. Изменение суммарного заряда аминокислот в зависимости от рН среды
При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд (табл. 1-3).
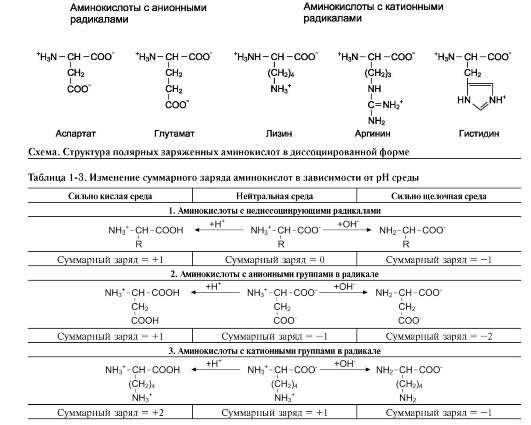
Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН-групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.
5. Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечис-
ленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты - производные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и про-лина - 5-гидроксилизин и 4-гидроксипролин.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства, необходимые для выполнения ими специфических функций. Так, γ-карбоксиглутаминовая кислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбок-
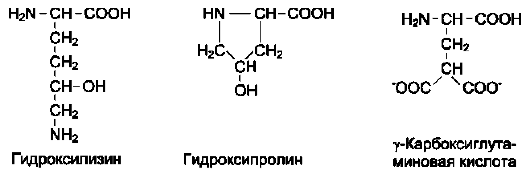
Модифицированные кислоты, найденные в составе белков
сильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
Значение гидроксильных групп в составе лизина и пролина описано в разделе 15.
6. Химические реакции, используемые для обнаружения аминокислот
Способность аминокислот вступать в те или иные химические реакции определяется наличием в их составе функциональных групп. Так как все аминокислоты, входящие в состав белков, содержат у α-углеродного атома амино-и карбоксильную группы, они могут вступать в характерные для всех аминокислот химические реакции. Наличие каких-либо функциональных групп в радикалах индивидуальных аминокислот определяет их способность вступать в специфичные для данных аминокислот реакции.
Нингидриновая реакция на α-аминокислоты
Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию.
Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от α-аминогруппы аминокислоты. В результате образуется пигмент красно-фиолетового цвета. Одновременно происходит декар-боксилирование аминокислоты, что приводит к образованию СО2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков (см. схему ниже).
Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации α-аминокислот.
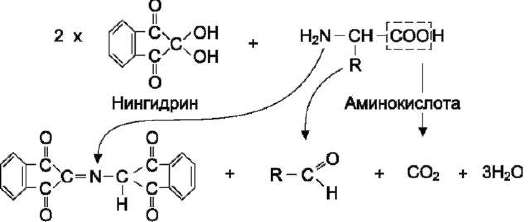
Нингидриновая реакция, используемая для определения α-аминокислот
Специфические реакции на отдельные аминокислоты
Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп.
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина - с помощью реакции Миллона.
Б. ПЕПТИДНАЯ СВЯЗЬ. СТРОЕНИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА ПЕПТИДОВ
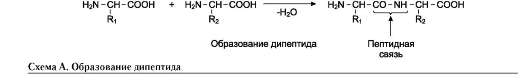
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды (см. схему А).
1. Строение пептида
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д.
Пептиды, содержащие более 10 аминокислот, называют «полипетиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин «белок»
часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном.
Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную α-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CО- носит название «пептидный остов» (см. схему Б).
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты. Например, тетрапептид Сер-Гли-Про-Ала читается как серилглицилпроли-лаланин.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения ами-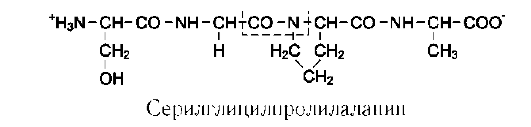
нокислот. Сер-Гис-Про-Ала и Ала-Про-Гис-Сер - два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот.
2. Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу (рис. 1-1).
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве (рис. 1-2).
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной
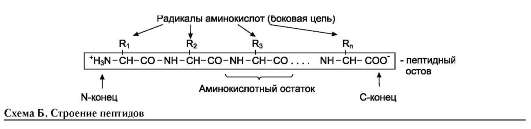
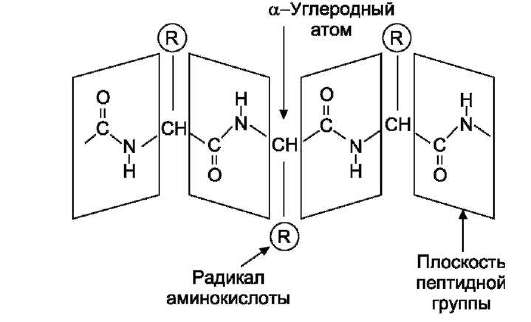
Рис. 1-1. Плоскости расположения пептидных групп и α-углеродных атомов в пространстве.
кислотой, при температуре более 105 ?С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеоли-тических ферментов (от англ. protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пепти-дов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).
3. Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Количество аминокислотных остатков в структуре биологически активных пептидов может варьировать от 3 до 50. К одним из самых «маленьких» пептидов можно отнести тиреотро-пин-рилизинг-гормон и глутатион (трипептиды), а также энкефалины, имеющие в своём составе 5 аминокислот. Однако большинство биологически активных пептидов имеет в своём составе более 10 аминокислот, например нейропептид Y (регулятор аппетита) содержит 36 аминокислот, а кортиколиберин - 41 аминокислоту.
Некоторые из пептидов, в частности большинство пептидных гормонов, содержат пептидные связи, образованные α-аминогруппой и α-карбоксильной группой соседних аминокис-
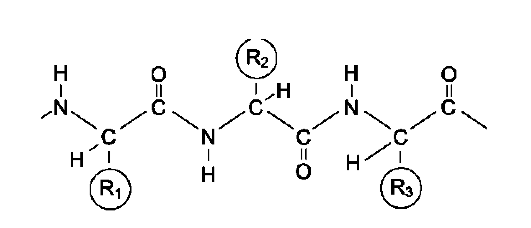
Рис. 1-2. Транс-конфигурация пептидных связей.
Функциональные группы -СО- и -NH-, образующие пептидные связи, не ионизированы, но полярны, и могут участвовать в образовании водородных связей.
лот. Как правило, они синтезируются из неактивных белковых предшественников, в которых специфические протеолитические ферменты разрушают определённые пептидные связи.
Ангиотензин II - октапептид, образующийся из крупного белка плазмы крови ангиотензино-гена в результате последовательного действия двух протеолитических ферментов.
Первый протеолитический фермент ренин отщепляет от ангиотензиногена с N-конца пептид, содержащий 10 аминокислот, называемый ан-гиотензином I. Второй протеолитический фермент карбоксидипептидилпептидаза отщепляет от С-конца ангиотензина I 2 аминокислоты, в результате чего образуется биологически активный ангиотензин II, участвующий в регуляции АД и водно-солевого обмена в организме (см. схему А).
Однако в некоторых биологически активных пептидах могут содержаться либо необычные аминокислоты, либо существовать необычные связи между аминокислотами, не встречающиеся в белках.
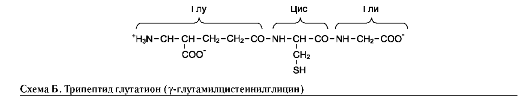
Пример пептида, содержащего необычную для белков связь между аминокислотами, - три-пептид глутатион, построенный из глутамата, цистеина и глицина (см. схему Б).
N-концевая аминокислота глутамат связана со второй аминокислотой цистеином не через α-карбоксильную группу, а через γ-карбоксиль-ную группу его радикала. Глутатион - широко распространённый пептид организма человека. Он может быть использован в окислительно-восстановительных реакциях как донор и ак-

цептор водорода и необходим для работы ряда ферментов.
Функции пептидов зависят от их первичной структуры. Ангиотензин I по структуре очень похож на ангиотензин II (имеет только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью.
Изменение в аминокислотном составе пептидов часто приводит к потере одних и возникновению других биологических свойств. В качестве примера можно рассмотреть структуру и свойства двух пептидных гормонов - ок-ситоцина и вазопрессина.
В гипоталамусе окситоцин и вазопрессин образуются в результате частичного (ограниченного) протеолиза более крупных белковых предшественников. Из гипоталамуса по нервным волокнам эти гормоны внутри секреторных гранул перемещаются в нервные окончания аксонов, находящихся в задней доле гипофиза. После действия специфических стимулов эти гормоны выделяются в кровь (см. схему А).
Окситоцин и вазопрессин в своей структуре имеют много общего:
• оба содержат 9 аминокислотных остатков;
• 7 аминокислотных остатков из 9 идентичны;
• 2 остатка цистеина соединены дисульфидной связью;
• на С-конце пептидов α-карбоксильная группа глутамата амидирована.
Несмотря на небольшие отличия в последовательности аминокислот (замены аминокислот в положениях 3 и 8) эти гормоны сильно отличаются по физиологическому действию. Так, окситоцин выделяется в кровь во время кормления ребёнка, вызывает сокращение мио-эпителиальных клеток протоков молочных желёз и стимулирует выделение молока. Кроме того, окситоцин влияет на гладкую мускулатуру матки во время родов, вызывая её сокращение.
В отличие от окситоцина, основное физиологическое действие вазопрессина - увеличение реабсорбции воды в почках при уменьшении АД или объёма крови (поэтому другое название этого гормона - антидиуретический). Кроме того, вазопрессин вызывает сужение ГМК сосудов.
Интересно отметить, что наличие в положении 8 основной аминокислоты важно для проявления антидиуретической активности, а аминокислоты
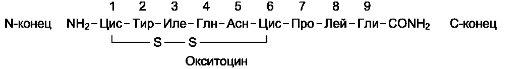
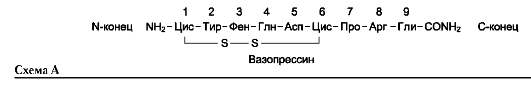
с гидрофобным радикалом в положении 3 - для сокращения ГМК.
Так как пептиды - мощные регуляторы биологических процессов, их можно использовать как лекарственные препараты. Основное препятствие для терапевтического использования - их быстрое разрушение в организме. Одним из важнейших результатов исследований является не только изучение структуры пептидов, но и получение синтетических аналогов природных пептидов с целенаправленными изменениями в их структуре и функциях.
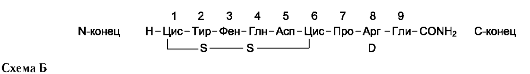
Например, синтезирован пептид 1-дезами-но-8-D-аргинин-вазопрессин (ДАВ), структура которого представлена на схеме Б.
В структуре этого пептида (по сравнению с вазопрессином) нет аминогруппы на N-кон-це, и вместо L-аргинина в положении 8 стоит D-аргинин. Такой синтетический пептид обладает только антидиуретической активностью и химически устойчив, т.е. при введении в организм вызывает длительную реакцию. Такой искусственный аналог гормона (по сравнению с природным) более эффективен при лечении гормональной недостаточности.
Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию:
• пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимули-рующий гормон, глюкагон и др.);
• пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтес-тинальный пептид, желудочный ингибиру-ющий пептид и др.);
• пептиды, регулирующие тонус сосудов и АД (брадикинин, калидин, ангиотензин II);
• пептиды, регулирующие аппетит (лептин, нейропептид Y, меланоцитстимулирующий гормон, β-эндорфины);
• пептиды, обладающие обезболивающим действием (энкефалины и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
• пептиды, участвующие в регуляции высшей нервной деятельности, в биохимических процессах, связанных с механизмами сна, обучения, памяти, возникновения чувства страха и т.д.
Однако такое деление пептидов крайне условно. Появились данные о том, что многие пептиды обладают широким спектром действия. Так, меланоцитстимулирующий гормон, помимо стимуляции пигментообразования, участвует в регуляции аппетита (вместе с лептином подавляет потребление пищи и является антагонистом нейропептида Y). В то же время β-эндорфины, кроме анальгезирующего эффекта, - синергис-ты нейропептида Y, т.е. усиливают потребление пищи. Описанный выше вазопрессин, кроме антидиуретического и сосудосуживающего действия, имеет свойство улучшать память.
ii. структура белков
Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединённых прочными пептидными связями. За счёт внутримолекулярных взаимодействий белки образуют определённую пространственную структуру, называемую «конформация белков». Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1-3). Существуют общие правила, по которым идёт формирование пространственных структур белков.
А. ПЕРВИЧНАЯ СТРУКТУРА
Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность аминокислотных остатков в полипептидной цепи называют «первичная структура белка».
Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка (см. раздел 4).
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Б. МЕТОДЫ ИЗУЧЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
Изучение первичной структуры белков имеет важное общебиологическое и медицинское значение. Изучая порядок чередования аминокислотных остатков в индивидуальных белках и сопоставляя эти знания с особенностями пространственного расположения молекулы, можно выявить общие фундаментальные закономерности формирования пространственной структуры белков.
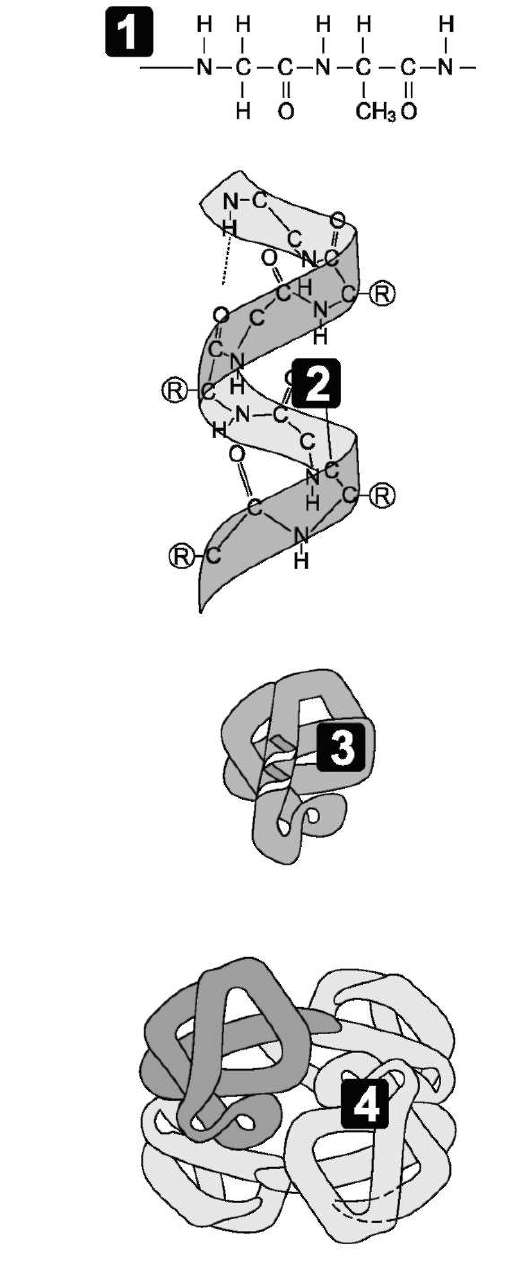
Рис. 1-3. Этапы формирования конформаwии белков.
1 - первичная структура; 2 - вторичная структура; 3 - третичная структура; 4 - четвертичная структура.
Кроме того, многие генетические болезни - результат нарушения в аминокислотной последовательности белков. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания.
Установление первичной структуры белков включает 2 основных этапа:
• определение аминокислотного состава изучаемого белка;
• определение аминокислотной последовательности в белке.
1. Определение аминокислотного состава белка
Первый этап в определении первичной структуры белков заключается в качественной и количественной оценке аминокислотного состава данного индивидуального белка. Необходимо помнить, что для исследования нужно иметь определённое количество чистого белка, без примесей других белков или пептидов.
Кислотный гидролиз белка
Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НC1 при температуре около 110 ?С в течение 24 ч. В результате такой обработки разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты. Кроме того, глутамин и аспарагин гидролизуются до глутаминовой и аспарагиновой кислот (т.е. разрывается амидная связь в радикале и от них отщепляется аминогруппа).
Разделение аминокислот с помощью ионообменной хроматографии
Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Такая синтетическая смола содержит прочно связанные с ней отрицательно заряженные группы (например, остатки сульфоновой кислоты -SO3-), к которым присоединены ионы Na+ (рис. 1-4).
В катионообменник вносят смесь аминокислот в кислой среде (рН 3,0), где аминокислоты в основном представляют катионы, т.е. несут положительный заряд. Положительно заряженные аминокислоты присоединяются к отрицательно заряженным частицам смолы. Чем больше
суммарный заряд аминокислоты, тем прочнее её связь со смолой. Так, аминокислоты лизин, аргинин и гистидин наиболее прочно связываются с катионообменником, а аспарагиновая и глутаминовая кислоты - наиболее слабо.
Высвобождение аминокислот из колонки осуществляют вымыванием (элюированием) их буферным раствором с увеличивающейся ионной силой (т.е. с увеличением концентрации NaCl) и рН. При увеличении рН аминокислоты теряют протон, в результате уменьшается их положительный заряд, а следовательно и прочность связи с отрицательно заряженными частицами смолы.
Каждая аминокислота выходит из колонки при определённом значении рН и ионной силы. Собирая с нижнего конца колонки раствор (элюат) в виде небольших порций, можно получить фракции, содержащие отдельные аминокислоты.
Количественный анализ полученных фракций
Количество каждой из аминокислот в данном белке определяют, нагревая отдельные фракции аминокислот с нингидрином, образующим соединение красно-фиолетового цвета. Интенсивность окраски в пробе пропорциональна количеству находящейся в ней аминокислоты, поэтому по спектрофотометрическому измерению света, поглощённого нингидриновыми производными, можно определить содержание каждой аминокислоты в гидролизате данного белка.
В настоящее время процесс разделения и количественного определения аминокислот в гидролизате белка полностью автоматизирован и осуществляется в специальном приборе - аминокислотном анализаторе.
2. Определение аминокислотной последовательности в белке
Определение N-концевой аминокислоты
в белке и последовательности аминокислот
в олигопептидах
Фенилизотиоционат (ФИТЦ) - реагент, используемый для определения N-концевой аминокислоты в пептиде. Он способен реагировать с α-аминогруппой и α-карбоксильной группой свободных аминокислот, а также с N-концевой аминокислотой в пептидах (см. схему ниже).
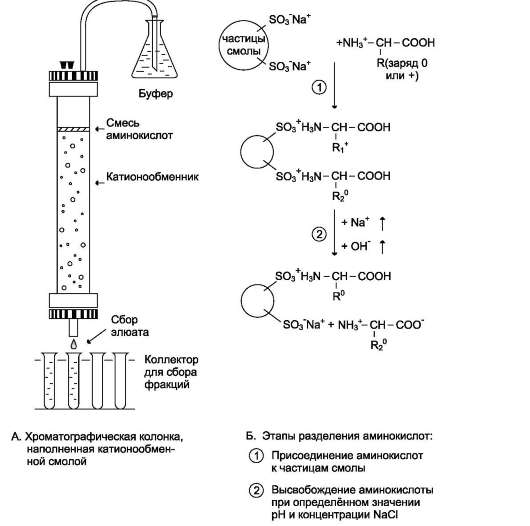
Рис. 1-4. Разделение аминокислот с помощью ионообменной хроматографии. А. Хроматографическая колонка, наполненная катионообменной смолой. Б. Этапы разделения аминокислот: 1 - присоединение аминокислот к частицам смолы; 2 - высвобождение аминокислот при определённом значении рН и концентрации NaCl.
В результате взаимодействия с N-концевой аминокислотой полипептида образуется фе-нилтиогидантионовое производное, в котором дестабилизирована пептидная связь между α-карбоксильной группой N-концевой аминокислоты и α-аминогруппой второй аминокислоты в пептиде. Эта связь избирательно гидролизуется без повреждения других пептидных связей.
После реакции выделяют комплекс ФИТЦ-АК1, идентифицируют его хроматографическими
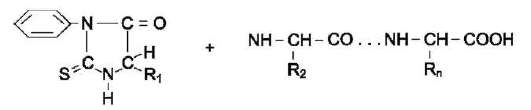
методами. ФИТЦ можно использовать вновь с укороченным пептидом, полученным в предыдущем цикле, для определения следующей аминокислоты. Этот процесс ступенчатого расщепления пептида с N-конца был автоматизирован и
реализован в приборе - секвенаторе, с помощью которого можно определять последовательность аминокислотных остатков в олигопептидах, состоящих из 10-20 аминокислот.
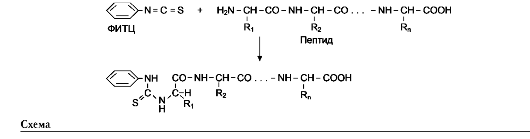
Многие полипептиды имеют первичную структуру, состоящую более чем из 100 аминокислот. Так как с помощью секвенаторов наиболее продуктивно определяют аминокислотную последовательность лишь небольших пептидов, молекулы полипептида расщепляют по специфическим местам на фрагменты.
Используя несколько разных расщепляющих агентов (ими могут быть ферменты или химические вещества) в разных пробах очищенного полипептида, можно получить частично перекрывающие друг друга фрагменты с установленной аминокислотной последовательностью. С их помощью можно воссоздать правильный порядок фрагментов и получить полную последовательность аминокислот в полипептидной цепи.
Ферментативное расщепление полипептида по специфическим участкам
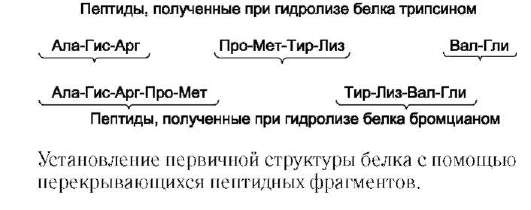
Для специфического расщепления пептидных связей в белке можно использовать несколько разных ферментов. Наиболее широко используют ферментативный гидролиз полипептида протеолитическим ферментом - трипсином, который относят к группе пищеварительных ферментов (его вырабатывает поджелудочная железа). Фермент обладает высокой специфичностью действия. Он расщепляет пептидные связи, в образовании которых участвует карбоксильная группа остатков лизина или аргинина.
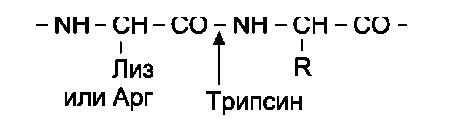
Исходя из установленного количества остатков лизина и аргинина, можно предсказать количество получаемых при гидролизе трипсином фрагментов. Так, если в полипептидной цепи имеется 6 неконцевых остатков аргинина и лизина, то при расщеплении трипсином можно получить 7 фрагментов.
Затем в каждом фрагменте устанавливают аминокислотную последовательность.
Химическое расщепление полипептида по специфическим участкам
В некоторых случаях предпочтителен не ферментативный, а химический гидролиз. Так, реагент бромциан расщепляет только пептидные связи, в которых карбоксильная группа принадлежит остатку метионина. Зная количество остатков метионина в полипептидной цепи, легко установить количество получаемых фрагментов. Далее для каждого фрагмента в секвенаторе также устанавливают аминокислотную последовательность.
Получение аминокислотной последовательности полипептида с помощью перекрывающихся фрагментов
Для успешного установления последовательности полученных фрагментов полипептида необходимо получить пептиды с перекрывающимися аминокислотными последовательностями. Это достигают обработкой отдельных проб данного полипептида разными реагентами, расщепляющими белок в разных местах. Необходимо провести столько расщеплений, чтобы получить набор пептидов, обеспечивающих перекрывание всех участков, необходимых для определения последовательности исходного полипептида.
В. КОНФОРМАЦИЯ БЕЛКОВ
Линейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую «конформация». Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа кон-формации полипептидных цепей: вторичную и третичную структуры.
1. Вторичная структура белков
Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-структура.
α-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток α-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате α-спираль «стягивается» множеством водородных связей. Несмотря на то что данные связи относят к разряду сла-
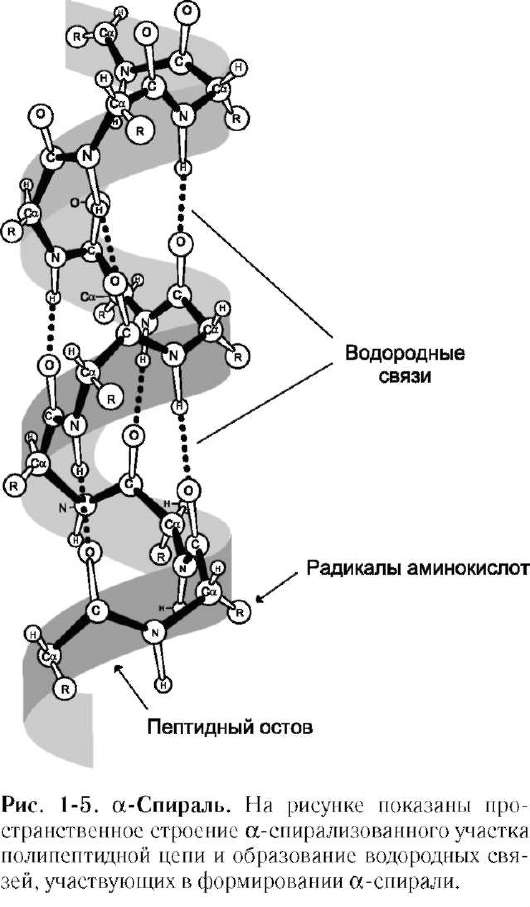
бых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
α-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования α-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы аминокислот находятся на наружной стороне α-спирали и направлены от пептидного остова в стороны. Они не участвуют в
образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование α-спирали. К ним относят:
• участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
• участки с близко расположенными объёмными радикалами, механически нарушающими формирование α-спирали, например метионин, триптофан.
Кольцевая структура пролина имеет фиксированный угол, близкий по значению углу поворота α-спирали несмотря на отсутствие водорода у атома азота и невозможность образования водородной связи. Поэтому пролин обычно располагается в тех участках белка, где имеется петля или изгиб. Большое количество пролина обнаружено в коллагене (каждая 4-я аминокислота) имеющем форму спирали уже на уровне его первичной структуры.
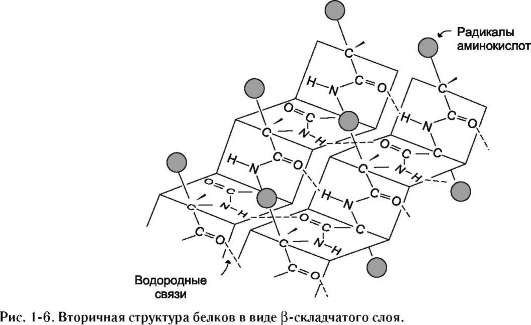
β-Структура
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. β-Структура образует фигуру, подобную листу,
сложенному «гармошкой», - β-складчатый слой (рис. 1-6).
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
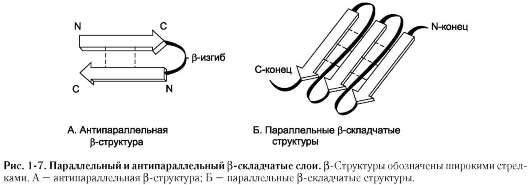
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя (рис. 1-7).
В отличие от α-спиралей, разрыв водородных связей, формирующих β-структуры, не вызывает удлинения данных участков полипептидных цепей.
Как α-спираль, так и β-структуры обнаружены в глобулярных и фибриллярных белках.
Нерегулярные вторичные структуры
В белках отмечают области с нерегулярной вторичной структурой, которые часто называют беспорядочными клубками. Они представлены петлеобразными и кольцеобразными структурами, имеющими меньшую регулярность укладки, чем описанные выше α-спираль и β-структура. Однако и они не так сильно варьируют от одной
молекулы белка к другой. В каждом индивидуальном белке они имеют свою фиксированную конформацию, определяемую аминокислотным составом данного участка цепи и окружающих его участков.
Термином «беспорядочный клубок» также часто называют денатурированный белок, образовавшийся после разрыва слабых внутримолекулярных связей и потерявший свою упорядоченную структуру.
Содержание разных типов вторичных структур в белках
Содержание рассмотренных выше типов вторичных структур в разных белках неодинаково. По наличию α-спиралей и β-структур глобулярные белки можно разделить на 4 категории.
• К первой категории относят белки, в структуре которых обнаружены только α-спирали.
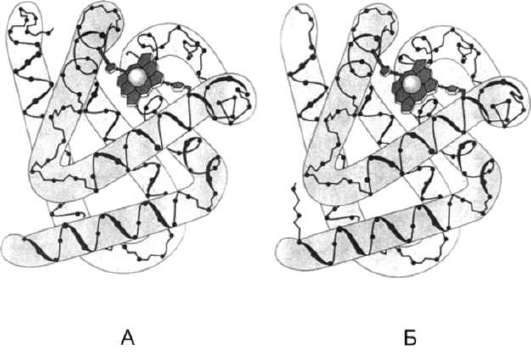
Рис. 1-8. Восемь α-спиралей в структуре миоглоби-на (А) и β-цепи гемоглобина (Б).
• К ним принадлежат такие белки, как мио-глобин и гемоглобин (рис. 1-8). Ко второй категории относят белки с α-спиралями и β-структурами, иногда образующими однотипные сочетания, встречающиеся в разных индивидуальных белках (рис. 1-9). Характерные сочетания α-спиралей и β-структур, обнаруженные во многих ферментах, можно рассмотреть на примере строения доменов лактатдегидрогеназы (ЛДГ) и фосфоглицераткиназы (ФГК). Домен - участок полипептидной цепи, который самостоятельно от других участков той же цепи образует структуру, во многом напоминающую глобулярный белок. В одном из доменов лактатдегидрогеназы в центре расположены β-структуры полипептидной цепи в виде скрученного листа, и каждая β-структура связана с
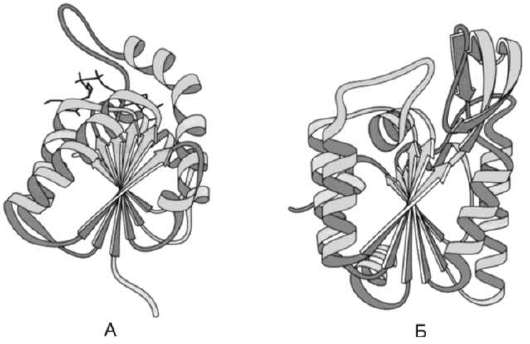
Рис. 1-9. α-Спирали и β-структуры в домене лактат-дегидрогеназы (А) и фосфоглицераткиназы (Б).
α-спиральным участком, находящимся на поверхности молекулы. Как видно из рис. 1-9, сходный домен имеется также в молекуле фосфоглицераткиназы.
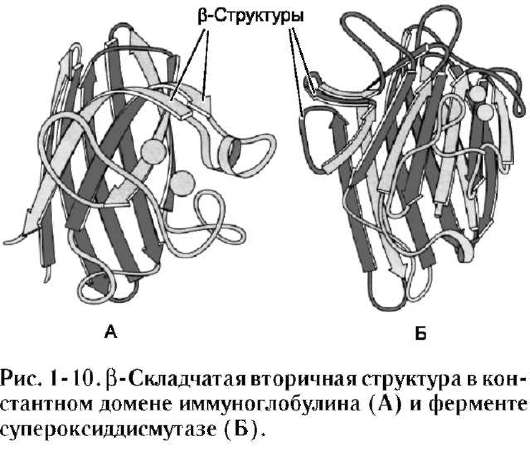
• В третью категорию включены белки, имеющие только β-структуры. Такие структуры обнаружены в иммуноглобулинах, в ферменте супероксиддисмутазе (рис. 1-10).
• В четвёртую категорию включены белки, имеющие в своём составе лишь незначительное количество регулярных вторичных структур.
2. Третичная структура белков
Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи, участвующие в формировании третичной структуры белков
Гидрофобные взаимодействия
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между
близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Ионные и водородные связи
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей (рис. 1-11). Ионные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагино-вой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина. Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -СОNH2, SH-группы) и любыми другими гидрофильными группами. Белки, функционирующие в неполярном (липидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные
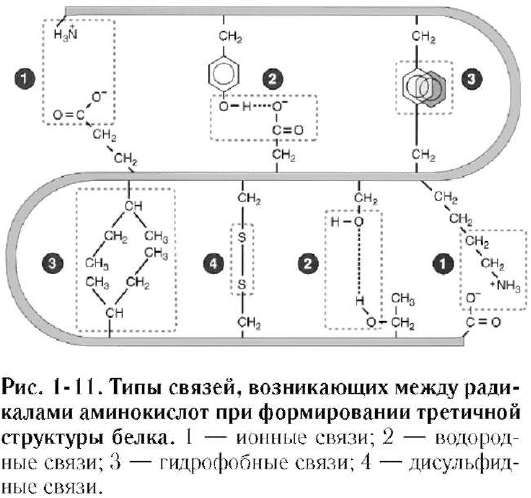
радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
Ковалентные связи
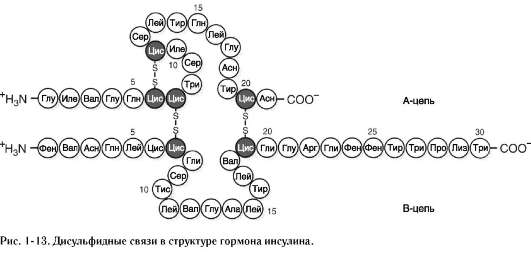
Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SН-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов (рис. 1-12).
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи
распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют кон-формацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Инсулин - белковый гормон; содержит 51 аминокислоту, состоит из двух полипептидных цепей (цепь А содержит 21 аминокислоту, цепь В - 30 аминокислот). Инсулин синтезируется в β-клетках поджелудочной железы и секретирует-ся в кровь в ответ на повышение концентрации глюкозы в крови. В структуре инсулина имеются 2 дисульфидные связи, соединяющие 2 полипептидные цепи А и В, и 1 дисульфидная связь внутри цепи А (рис. 1-13). Структура иммуноглобулинов рассмотрена в подразделе 6 Д.
Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для

данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют «нативная структура».
3. Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфор-мации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и кон-формации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке.
4. Денатурация белков
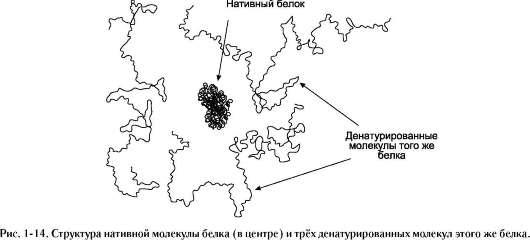
Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформа-ции сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается.
В денатурированном белке гидрофобные ра-ди-калы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка.
Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами (рис. 114). Термическая обработка мясной пищи перед употреблением не только улучшает её вкусовые качества, но и облегчает её ферментативное переваривание в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке, а также оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей.
5. Факторы, вызывающие денатурацию белков
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
• высокая температура (более 50 ?С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
• интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
• органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конфор-мационным изменениям. Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид, которые образуют водородные связи с ами-но- и карбонильными группами пептидного остова и некоторыми функциональными группами радикалов аминокислот. Происходит разрыв связей, участвующих в форми-
ровании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;
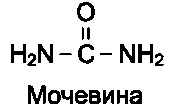
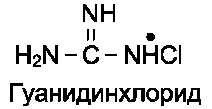
кислоты и щелочи, изменяя рН среды, вызывают перераспределение связей в молекуле белка;
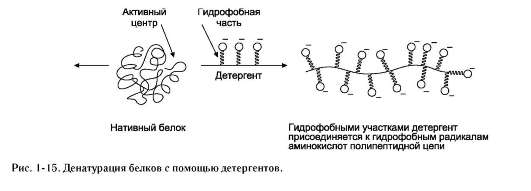
соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), изменяя их конформацию и активность; детергенты - вещества, содержащие гидрофобный углеводородный радикал и гид-
рофильную функциональную группу (такие вещества называют амфифильными). Гидрофобные радикалы белков взаимодействуют с гидрофобными частями детергентов, что изменяет конформацию белков. Денатурированный под действием детергентов белок обычно остаётся в растворённом виде, так как гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла (рис. 1-15).
6. Медицинские аспекты конформационной лабильности белков
Склонность большинства белков к денатурации в процессе их выделения, хранения и использования серьёзно затрудняет их получение и применение в медицине.
Для правильного обращения с белковыми лекарственными препаратами к ним прикладывают инструкцию, в которой указывают условия их хранения и использования. Так, большинство белковых препаратов необходимо хранить в холодильнике при температуре не выше 10 ?С, растворять сухие препараты охлаждённой до комнатной температуры кипячёной водой во избежание их денатурации.
7. Применение денатурирующих агентов в биологических исследованиях и медицине
В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений из раствора обычно удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту. После её добавления в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием. Трихлоруксусную кислоту можно также использовать для денатурации ферментов в целях прекращения ферментативной реакции.
В медицине денатурирующие агенты часто используют для стерилизации медицинских инструментов и материала, а также в качестве антисептиков. Например, в автоклавах при высокой температуре стерилизуют медицинские инструменты и материалы.
Фенол и его производные (крезол, резорцин) относят к известным антисептикам ароматического ряда. Обладающие высокой гидрофобностью, они эффективно действуют на вегетативные формы бактерий и грибы, вызывая денатурацию их белков. Эффективность антисептических свойств уменьшается с увеличением растворимости препарата в воде.
Раствор крезола в калийном мыле известен как препарат лизол, применяемый в качестве дезинфицирующего средства.
Берёзовый дёготь - одна из основных составных частей мази Вишневского, содержит в своем составе фенол. Препарат, используемый
для лечения ран, обладает высоким антимикробным действием.
Значительное количество антисептиков представлено солями тяжёлых металлов. Их антимикробное действие связано с тем, что уже в довольно низких концентрациях они взаимодействуют с белками микроорганизмов, блокируют их SH-группы и изменяют их конформацию. Из-за высокой токсичности большинство лекарств, содержащих соли тяжёлых металлов, применяют в качестве поверхностных антисептиков.
Так, высокой антимикробной активностью обладает сулема - дихлорид ртути (HgCl2). Её используют для обработки рук и дезинфекции помещений. Случайное или преднамеренное отравление препаратами ртути вызывает тяжёлые некротические поражения слизистой оболочки пищеварительного тракта и некротические изменения в почках. Антимикробными свойствами обладают и препараты серебра, такие как ляпис (AgNO3), колларгол (серебро коллоидальное), применяемые для обработки слизистых оболочек при инфекционных заболеваниях.
Г. СУПЕРВТОРИЧНАЯ СТРУКТУРА БЕЛКОВ
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают как «структурные мотивы». Они имеют специфические названия: «α-спираль-поворот-α-спираль», «структура α/β-бочонка», «лейциновая застёжка-молния», «цинковый палец» и др. Специфическое пространственное расположение α-спиралей и β-структур формируется за счёт межрадикальных взаимодействий.
1. Супервторичная структура типа α/β-бочонка
Такая структура действительно напоминает бочонок, где каждая β-структура (обозначенная на рис. 1-16 стрелкой) расположена внутри и связана с α-спиральным участком полипеп-
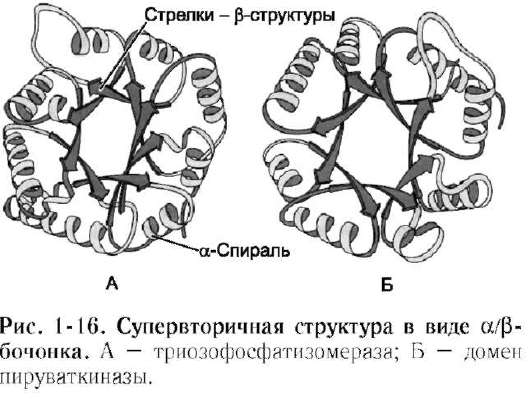
тидной цепи, находящимся на поверхности молекулы.
Супервторичную структуру в виде α/β-бочонка имеют некоторые ферменты, например триозо-фосфатизомераза и один домен пируваткиназы (рис. 1-16).
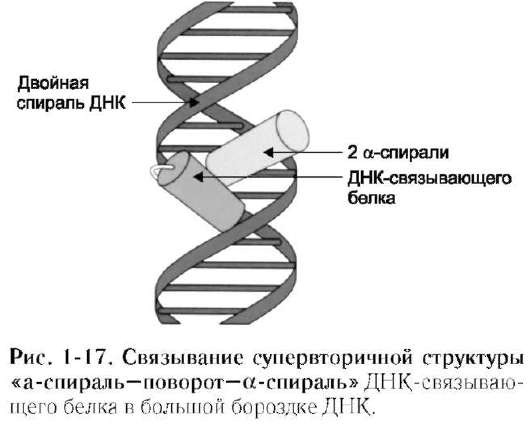
2. Структурный мотив «α-спиральповорот-α-спираль»
Этот «структурный мотив» обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки - большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят две α-спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая α-спираль располагается поперёк бороздки, а более длинная α-спираль - в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК (рис. 1-17).
3. Супервторичная структура в виде «цинкового пальца»
Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. «Цинковый палец» - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя - гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина (рис. 1-18).
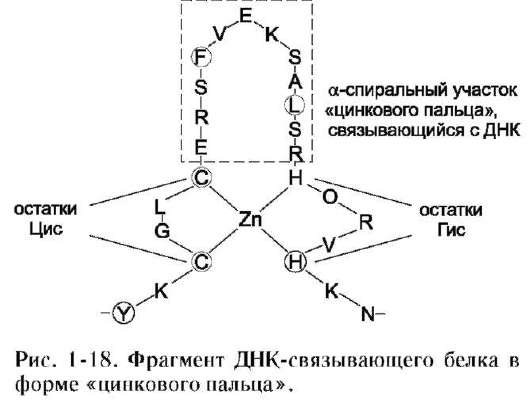
Два близко лежащих остатка цистеина отделены от двух других остатков гистидина (или цистеина) аминокислотной последовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует α-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность взаимодействия ДНК-связывающего белка с определённой областью ДНК зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца».
4. Супервторичная структура
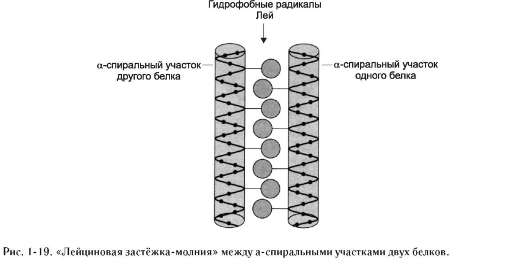
в виде «лейциновой застёжки-молнии»
Некоторые ДНК-связывающие белки олиго-мерны, т.е. содержат в своём составе несколько
полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния».
На поверхности каждой из двух взаимодействующих полипептидных цепей или белков имеется α-спиральный участок, содержащий по крайней мере 4 остатка лейцина. Лещиновые остатки располагаются через каждые 6 аминокислот один от другого. Так как каждый виток α-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка.
Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе (рис. 1-19).
Примером соединения белков с помощью «лейциновой застёжки-молнии» могут служить гистоны. Гистоны - ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот - аргинина и лизина. Молекулы гистонов объединяются в комплексы, состоящие из 8 мономерных белков с помощью «лейциновых застёжек», несмотря на то, что все мономеры имеют сильный положительный заряд.
д. доменная структура белков
Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка. Так, лёгкая цепь иммуноглобулина G состоит из двух доменов. В некоторых случаях доменами называют отдельные структурные участки полипептидной цепи.
Домены обычно можно выделить, действуя на белок протеолитическими ферментами, легко разрывающими пептидные связи на участке полипептидной цепи, расположенной между доменами. После этого некоторые домены могут сохранять свои биологические свойства.
е. четвертичная структура белков
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1. Количество протомеров в структуре олигомерных белков
В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димер-ные, тетрамерные белки).
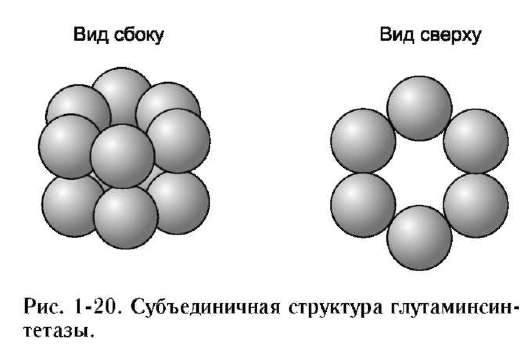
Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; фермент внутренней мембраны митохондрий цитохромоксидаза - 13 протоме-ров, а глутаминсинтетаза - 12 протомеров (рис. 1-20). Имеются также крупные многофункциональные комплексы, содержащие в своём составе несколько десятков полипептидных цепей, например пируватдегидрогеназный комплекс состоит из 312 протомеров.
Некоторые олигомерные белки содержат идентичные протомеры (например, гексоки-наза), другие состоят из разных протомеров. Так, в составе гемоглобина присутствуют 2 α- и 2 β-протомера, а в составе лактатдегидрогена-зы, имеющей 4 протомера, 2 типа мономеров (Н и М) в разных тканях могут находиться в разных сочетаниях (например, 4Н либо 3Н+1М и т.д.).
Олигомерные белки имеют большую молекулярную массу. Белки с молекулярной массой
более 50 000 Д практически всегда содержат несколько мономерных полипептидных цепей. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок. Комплементарность протомеров
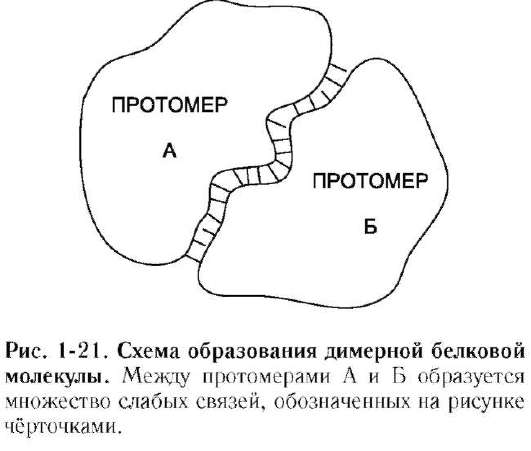
«Узнавание» и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом.
Специфичность связывания контактных участков определяется их комплементарнос-тью. Комплементарность - пространственное и химическое соответствие взаимодействующих поверхностей. Впадины и выступы на поверхности одной молекулы должны совпадать с выступами и впадинами на поверхности другой молекулы, как два куска неровно разорванной бумаги. Кроме того, функциональные группы радикалов аминокислот на одной контактирующей поверхности должны образовывать слабые химические связи с радикалами аминокислот на другой поверхности (рис. 1-21). В области контактных поверхностей обычно содержится много гидрофобных радикалов аминокислот, в результате объединения которых формиру-
ется гидрофобное ядро олигомерного белка. Гидрофильные радикалы могут образовывать водородные и ионные связи.
Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены.
Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул.
III. ФОРМИРОВАНИЕ ТРЁХМЕРНОЙ СТРУКТУРЫ БЕЛКА В КЛЕТКЕ
Формирование трёхмерной структуры белков - важнейший биологический процесс, так как от пространственной структуры белков зависит их биологическая функция.
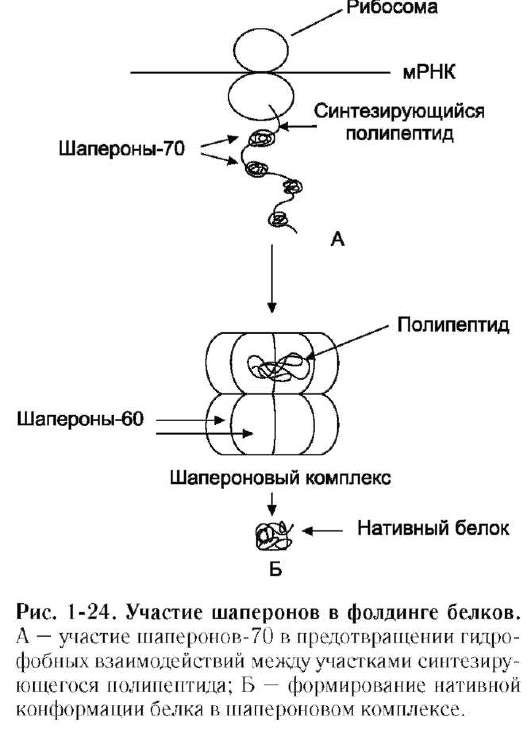
Процесс сворачивания полипептидной цепи в правильную пространственную структуру получил название «фолдинг белков». Индивидуальные белки, продукты одного гена, имеют идентичную аминокислотную последовательность и приобретают в одинаковых условиях клетки одинаковую конформацию и функцию. Это положение подтверждается способностью некоторых белков после денатурации (при которой происходит разрыв слабых связей, но не повреждается первичная структура белков) спонтанно восстанавливать свою уникальную конформацию и функцию.
Однако в клетке концентрация белков настолько высока, что существует большая вероятность взаимодействия белков с несформированной конформацией. На их поверхности располагаются гидрофобные радикалы, склонные к объединению. Поэтому для многих белков, имеющих высокую молекулярную массу и сложную пространственную структуру, фолдинг протекает при участии специальной группы белков, которые называют «шапероны» (от франц. shaperon - няня).
А. РЕНАТИВАЦИЯ БЕЛКОВ
Долгое время считалось, что процесс денатурации белков необратим. Однако оказалось,
что некоторые очищенные и денатурированные белки способны в опытных условиях восстанавливать конформацию при удалении денатурирующих агентов.
Ренативация рибонуклеазы
В начале 60-х г. XX века обнаружили, что процесс денатурации белков может быть обратимым. Это открытие было сделано при изучении денатурации рибонуклеазы - фермента, расщепляющего связи между нуклеотидами в РНК. Рибонуклеаза - глобулярный белок, содержащий одну полипептидную цепь, состоящую из 124 аминокислотных остатков. Его конформацию стабилизируют 4 дисульфидные и множество слабых связей.
Обработка рибонуклеазы β-меркаптоэтанолом (формула β-меркаптоэтанола - НО-СН2-СН2-SH)
приводит к разрыву дисульфидных связей и восстановлению SH-групп
цистеиновых остатков, что нарушает компактную структуру белка.
Добавление
Однако если путём диализа очистить рибонук-леазу от денатурирующих агентов и β-меркап-тоэтанола, ферментативная активность белка постепенно восстанавливается. Этот процесс называется ренатурацией, или ренативацией белка. Сульфгидрильные группы денатурированного фермента под действием кислорода воздуха окисляются, в результате вновь возникают 4 дисульфидные связи, характерные для натив-ной структуры белка. Из 105 возможных способов связывания восьми SH-групп остатков цистеина реализуется только один вариант, характерный для нативной конформации белка (рис. 1-22).
Возможность ренативации впоследствии была доказана и для других белков, в частности миог-лобина. Сохранность первичной структуры белка - необходимое условие для восстановления его конформации. На основании этих опытов был выведен фундаментальный принцип молекулярной биологии: аминокислотная последо-
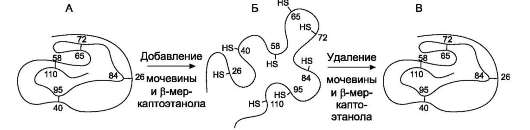
Рис. 1-22. Денатурация и ренативация рибонуклеазы. А - нативная молекула рибонуклеазы, в третичной структуре которой имеются 4 дисульфидные связи; Б - денатурированная молекула рибонуклеазы; В - нативная молекула рибонуклеазы, в структуре которой вновь образованы 4 дисульфидные связи между теми же остатками цистеина.
вательность белков определяет их конформацию и специфическую функцию.
Формирование пространственной структуры белка - самопроизвольный процесс, при котором белок стремится принять в данных условиях конформацию с наименьшей свободной энергией. Изменение условий окружающей среды или изменение первичной структуры данного белка могут привести к изменению его конформации и функции.
Б. СТРУКТУРА И ФУНКЦИОНАЛЬНАЯ РОЛЬ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
В процессе синтеза полипептидных цепей, транспорта их через мембраны, при сборке олигомерных белков возникают промежуточные нестабильные конформации, склонные к агрегации. На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционно-способные аминокислотные остатки одних белков должны быть отделены от таких же групп других белков.
Во всех известных организмах от прокариотов до высших эукариотов обнаружены белки, способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии. Они способны стабилизировать их конформа-цию, обеспечивая фолдинг белков. Эти белки получили название «шапероны».
1. Классификации шаперонов (Ш)
В соответствии с молекулярной массой все ша-пероны можно разделить на 6 основных групп:
• высокомолекулярные, с молекулярной массой от 100 до 110 кД;
• Ш-90 - с молекулярной массой от 83 до
90 кД;
• Ш-70 - с молекулярной массой от 66 до
78 кД;
• Ш-60;
• Ш-40;
• низкомолекулярные шапероны с молекулярной массой от 15 до 30 кД.
Среди шаперонов различают: конститутивные белки (высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма), и индуцибельные, синтез которых в нормальных условиях идёт слабо, но при стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны относят к «белкам теплового шока», быстрый синтез которых отмечают практически во всех клетках, которые подвергаются любым стрессовым воздействиям. Название «белки теплового шока» возникло в результате того, что впервые эти белки были обнаружены в клетках, которые подвергались воздействию высокой температуры.
2. Роль шаперонов в фолдинге белков
При синтезе белков N-концевая область полипептида синтезируется раньше, чем С-конце-вая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Ш-70.
Ш-70 - высококонсервативный класс белков, который присутствует во всех отделах
клетки: цитоплазме, ядре, ЭР, митохондриях. В области карбоксильного конца единственной полипептидной цепи шаперонов есть участок, образованный радикалами аминокислот в форме бороздки. Он способен взаимодействовать с участками белковых молекул и развёрнутых полипептадных цепей длиной в 7-9 аминокислот, обогащенных гидрофобными радикалами. В синтезирующейся полипептидной цепи такие участки встречают примерно через каждые 16 аминокислот.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомерного комплекса, состоящего из 14 субъединиц (рис. 1-23).
Ш-60 образуют 2 кольца, каждое из которых состоит из 7 субъединиц, соединённых друг с другом. Субъединица Ш-60 состоит из 3 доменов: апикального (верхушечного), промежуточного и экваториального. Верхушечный домен имеет ряд гидрофобных остатков, обращённых в полость кольца, сформированного субъединицами. Экваториальный домен имеет участок связывания с АТФ и обладает АТФ-азной активностью, т.е. способен гидролизовать АТФ до АДФ и Н3РО4.
Шапероновый комплекс имеет высокое сродство к белкам, на поверхности которых
есть элементы, характерные для несвёрнутых молекул (прежде всего участки, обогащённые гидрофобными радикалами). Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки происходит перебор возможных конформаций белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация.
Высвобождение белка со сформированной нативной конформацией сопровождается гидролизом АТФ в экваториальном домене. Если белок не приобрёл нативной конформации, то он вступает в повторную связь с шапероновым комплексом. Такой шаперонзависимый фол-динг белков требует затрат большого количества энергии.
Таким образом, синтез и фолдинг белков протекают при участии разных групп шаперонов, препятствующих нежелательным взаимодействиям белков с другими молекулами клетки и сопровождающих их до окончательного формирования нативной структуры (рис. 1-24).
3. Роль шаперонов в защите белков клеток от денатурирующих стрессовых воздействий
Шапероны, участвующие в защите клеточных белков от денатурирующих воздействий, как уже
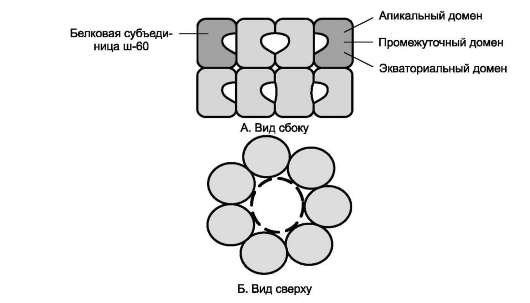
Рис. 1-23. Структура шаперонового комплекса, состоящего из 14 белковых молекул Ш-60.
говорилось выше, относят к белкам теплового шока (БТШ) и в литературе часто обозначают как HSP (от англ. heat shock protein).
При действии различных стрессовых факторов (высокая температура, гипоксия, инфекция, УФО, изменение рН среды, изменение моляр-ности среды, действие токсичных химических веществ, тяжёлых металлов и т.д.) в клетках усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично денатурированных белков, они могут препятствовать их полной денатурации и восстанавливать на-тивную конформацию белков.
Установлено, что кратковременные стрессовые воздействия увеличивают выработку БТШ и повышают устойчивость организма к длительным стрессовым воздействиям. Так, кратковременная ишемия сердечной мышцы в период бега при умеренных тренировках значительно повышает устойчивость миокарда к длительной ишемии, вызванной стенокардией или закупоркой сосудов сердца тромбом. В настоящее время перспек-
тивными исследованиями в медицине считают поиски фармакологических и молекулярно-био-логических способов активации синтеза БТШ в клетках.
4. Болезни, связанные с нарушением фолдинга белков
Расчёты показали, что лишь небольшая часть теоретически возможных вариантов полипептидных цепей может принимать одну стабильную пространственную структуру. Большинство же таких белков может принимать множество конформаций с примерно одинаковой энергией Гиббса, но с различными свойствами. Первичная структура большинства известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной конформации.
Однако некоторые растворимые в воде белки при изменении условий могут приобретать конформацию плохо растворимых, способных к агрегации молекул, образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат. amylum - крахмал). Так же как и крахмал, амилоидные отложения выявляют при окраске ткани йодом. Это может происходить:
• при гиперпродукции некоторых белков, в результате чего увеличивается их концентрация в клетке;
• при попадании в клетки или образовании в них белков, способных влиять на конфор-мацию других молекул белка;
• при активации протеолиза нормальных белков организма, с образованием нерастворимых, склонных к агрегации фрагментов;
• в результате точечных мутаций в структуре белка.
В результате отложения амилоида в органах и тканях нарушаются структура и функция клеток, наблюдают их дегенеративные изменения и разрастание соединительнотканных или глиальных клеток. Развиваются болезни, называемые амилоидозами. Для каждого вида амило-идоза характерен определённый тип амилоида. В настоящее время описано более 15 таких болезней.
Болезнь Альцхаймера
Болезнь Альцхаймера - наиболее часто отмечаемый β-амилоидоз нервной системы, как правило, поражающий лиц преклонного возраста и характеризующийся прогрессирующим
расстройством памяти и полной деградацией личности. В ткани мозга откладывается β-ами-лоид - белок, образующий нерастворимые фибриллы, нарушающие структуру и функции нервных клеток. β-амилоид - продукт изменения конформации нормального белка организма человека. Он образуется из более крупного предшественника частичным протеолизом и синтезируется во многих тканях. β-Амилоид, в отличие от своего нормального предшественника, содержащего много а-спиральных участков, имеет вторичную β-складчатую структуру, агрегирует с образованием нерастворимых фибрилл, устойчив к действию протеолитических ферментов.
Причины нарушения фолдинга нативных белков в ткани мозга ещё предстоит выяснить. Возможно, с возрастом уменьшается синтез шаперонов, способных участвовать в формировании и поддержании нативной конформации белков, или увеличивается активность протеаз, что приводит к увеличению концентрации белков, склонных изменять конформацию.
Прионовые болезни
Прионы - особый класс белков, обладающих инфекционными свойствами. Попадая в организм человека или спонтанно возникая в нём, они способны вызывать тяжёлые неизлечимые заболевания ЦНС, называемые прионовыми болезнями. Название «прионы» происходит от аббревиатуры английской фразы proteinaceous infectious particle - белковая инфекционная частица.
Прионовый белок кодируется тем же геном, что и его нормальный аналог, т.е. они имеют идентичную первичную структуру. Однако два белка обладают различной конформацией: прионовый белок характеризуется высоким содержанием β-слоёв, в то время как нормальный белок имеет много а-спиральных участков. Кроме того, прионовый белок обладает устойчивостью к действию протеаз и, попадая в ткань мозга или образуясь там спонтанно, способствует превращению нормального белка в прионовый в результате межбелковых взаимодействий. Образуется так называемое «ядро полимеризации», состоящее из агрегированных прионовых белков, к которому способны присоединяться новые молекулы нормального белка.
В результате в их пространственной структуре происходят конформационные перестройки, характерные для прионовых белков.
Известны случаи наследственных форм прионовых болезней, вызванных мутациями в структуре данного белка. Однако возможно и заражение человека прионовыми белками, в результате чего возникает заболевание, приводящее к гибели больного. Так, куру - прионовая болезнь аборигенов Новой Гвинеи, эпидемический характер которой связан с традиционным каннибализмом в этих племенах и передачей инфекционного белка от одной особи к другой. В связи с изменением образа их жизни данное заболевание практически исчезло.
В настоящее время
интерес к прионовым болезням возрос в связи с заражением людей прионами
при употреблении мясопродуктов, полученных от животных, являющихся
носителями прионов, вызывающих «бешенство коров» (болезнь
Кройтц-фельдта-Якоба). Несмотря на то, что прионовые белки человека и
животных различаются лишь незначительно, долгое время полагали, что
существуют межвидовые барьеры на пути передачи болезни. Однако
последние данные показали, что эти барьеры не абсолютны, и что
существует принципиальная возможность передачи болезни от одного вида
другому. Так, в Великобритании к середине
IV. ФУНКЦИОНИРОВАНИЕ БЕЛКОВ
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конфор-мацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют «лиганд». Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
А. АКТИВНЫЙ ЦЕНТР БЕЛКОВ И ИЗБИРАТЕЛЬНОСТЬ СВЯЗЫВАНИЯ ЕГО С ЛИГАНДОМ
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении («кармане»), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с ли-гандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25).
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиган-
да и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
1. Характеристика активного центра
Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует «рельеф» активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют «ансамблем» аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точеч-
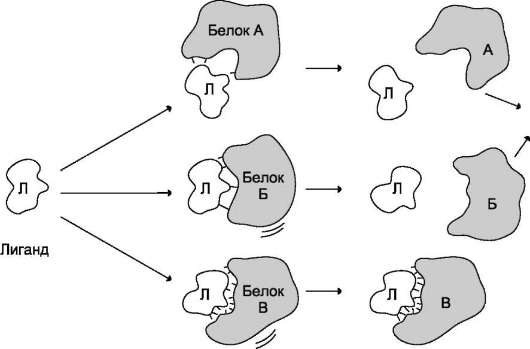
Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом.
ных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе гема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами. Например, про-теолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами
этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфо-рилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в «ловушке», что облегчает его дальнейшее фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
• Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
• существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
• существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные
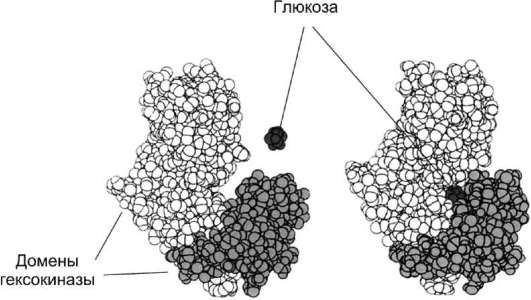
Рис. 1-26. Связывание гексокиназы с глюкозой.
с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют «простетическая группа». Ми-оглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодер-жащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2).
Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярных лигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими ли-гандами. Например, белок кальмодулин после связывания с четырьмя ионами Са2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.
3. Сродство активного центра лиганду
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду. Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
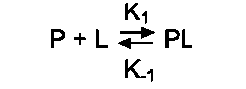
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости
связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
[Р] [L] К1 = [PL] К--1
Отсюда:
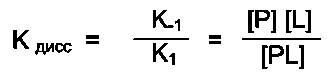
Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс, тем больше молекул лиганда связано с белком, тем больше комплементарность между P и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиган-да к белку имеется обратно пропорциональная связь.
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс , называемую константой связывания (Ксв) или ассоциации.
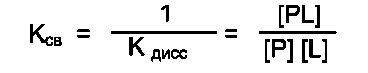
Между Ксв. и сродством лиганда к белку существует прямо пропорциональная зависимость.
Зависимость насыщения белка лигандом от концентрации лиганда при постоянной концентрации белка
При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [PL]. Эта зависимость носит характер гиперболической кривой (рис. 1-27). Кривая стремится к максимуму, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [PL]/[P0]x100 (где Р0 - концентрация белка до добавления лиганда).
При полунасыщении белка лигандом концентрации [PL] и [P] равны, и из уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т.е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Поэтому
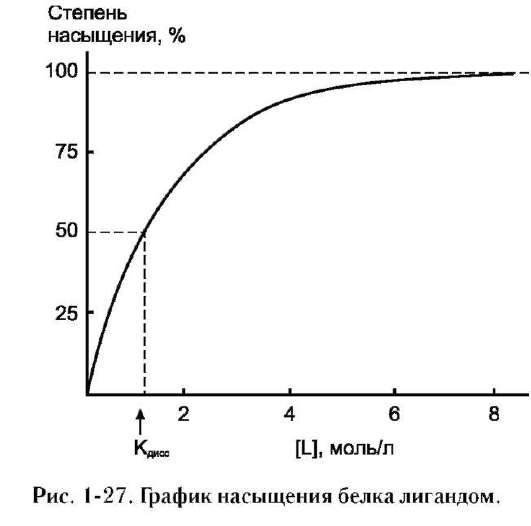
по кривой насыщения можно найти Кдисс и
оценить сродство данного белка лиганду. Зависимость между образованием комплекса [PL] и концентрацией белка при избытке лиганда
Как было сказано выше, при возрастающей концентрации лиганда насыщение белка ограничено его концентрацией. При избытке лиганда все молекулы белка находятся в составе комплекса [PL]. Однако, если увеличивать концентрацию белка, то количество [PL] начнёт увеличиваться пропорционально концентрации белка. Концентрацию комплекса [PL] можно регистрировать, например с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе (рис. 1-28).
Б. ВЕЩЕСТВА, ВЛИЯЮЩИЕ НА ФУНКЦИОНИРОВАНИЕ БЕЛКОВ
Хотя взаимодействие лиганда с активным центром белка высокоспецифично, всегда можно подобрать другое вещество, которое так же будет взаимодействовать с белком. Лиганд, взаимодействующий с белком и нарушающий его функцию, называют «ингибитор белка». Если это вещество по структуре похоже на лиганд, его называют структурным аналогом лиганда; оно также взаимодействует с активным центром белка. Аналог,
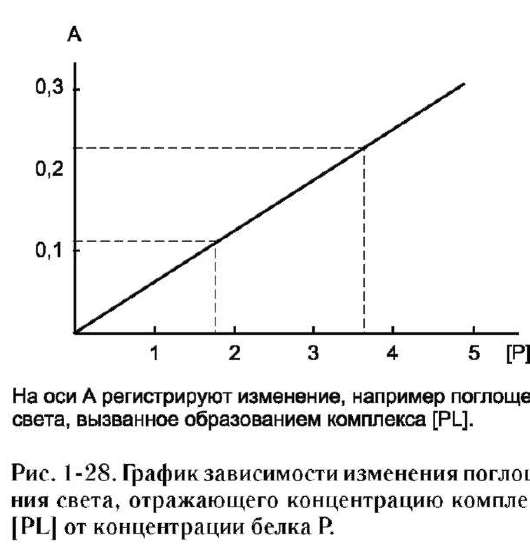
замещающий естественный лиганд в активном центре белка и снижающий его функцию, называют «конкурентный ингибитор белка».
1. Лекарственные препараты
как модуляторы белковых функций
Аналоги естественных лигандов белков используют в медицине в качестве лекарственных средств. Широкое применение такие лекарства нашли в регуляции передачи возбуждения через синапсы.
Передача сигнала от нерва к нерву или от нерва к эффекторному органу осуществляется через синапсы с помощью химических молекул, называемых нейромедиаторами. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на пост-синаптической мембране. Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался. В фармакологии такие вещества называют «антагонисты» и «агонисты» соответственно.
Ингибиторы белков-рецепторов в холинэргических синапсах
В качестве примера можно рассмотреть лекарства, нарушающие проведение нервного импуль-
са через холинергические синапсы, где в качестве нейромедиатора используется ацетилхолин. Хо-линергические белки-рецепторы неоднородны по своей структуре и способны связываться с другими, кроме ацетилхолина, лигандами. Их делят на 2 большие группы:
• М-холинорецепторы, названные так из-за их способности избирательно взаимодействовать с мускарином (токсин мухомора);
• Н-холинорецепторы, избирательно связывающие никотин.
В нервно-мышечных синапсах присутствуют Н-холинорецепторы, взаимодействие которых с ацетилхолином вызывает сокращение мышц. Для расслабления мышц в эндоскопических исследованиях, а также при разнообразных хирургических операциях используют структурные аналоги ацетилхолина, служащие ингибиторами функций данных рецепторов. Пример такого вещества - дитилин, относящийся к группе лекарственных веществ, называемых миорелаксан-тами (вызывающими мышечное расслабление). Первоначально эти свойства были обнаружены у яда кураре, в связи с чем данные препараты называют также курареподобными. (см. схему А). Дитилин относится к миорелаксантам деполяризующего действия.
В отличие от ацетилхолина, быстро разрушающегося в синаптической щели ферментом-аце-тилхолинэстеразой, дитилин из-за значительно более медленного его разрушения ферментом, вызывает стойкую деполяризацию мембраны и нарушение проведения нервного импулса, что и вызывает мышечное расслабление.
Наиболее известный специфический ингибитор М-холинорецепторов - атропин. Атропин - алкалоид, содержащийся в некоторых растениях: красавке, белене, дурмане. Он присоединяется к М-холинорецепторам, находящимся на мембране эффекторных клеток, в области окончаний парасимпатических нервов. Атропин препятствует их взаимодействию с ацетилхолином (антагонист природного лиганда), тем самым устраняя эффекты раздражения парасимпатических нервов.
Так как ацетилхолин, связываясь с М-холи-норецепторами, вызывает сокращение многих гладких мышц, атропин (как лекарственный препарат) снимает мышечные спазмы (спазмолитик). Кроме того, он снижает стимулируемую ацетилхолином секрецию желёз (бронхиальных, пищеварительных, потовых).
М-холинорецепторы присутствуют в разных отделах ЦНС. Передозировка атропина может вызвать двигательное и речевое возбуждение.
Лекарственные вещества - стимуляторы белковых функций
Однако некоторые структурные аналоги ли-гандов рецепторных белков не являются ингибиторами, а вызывают такие же или более сильные физиологические эффекты, чем природные лиганды. Их более сильный и длительный эффект часто связан с тем, что модифицированные лиганды медленнее инактивируются и разрушаются в организме. Например, мезатон по структуре похож на нейромедиаторы симпатической нервной системы (норадреналин и
адреналин). Мезатон повышает тонус сосудов и АД, поэтому его используют при гипотонии и коллапсе. Он менее подвержен действию инак-тивирующих его ферментов, поэтому оказывает более длительный и сильный эффект, чем его природные аналоги (см. схему А).
2. Яды - специфические лиганды определённых белков
Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками, ингибируют их и тем самым вызывают нарушения биологических функций.
Например, α-нейротоксины кобры и крайта специфически взаимодействуют с холинергичес-кими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподоб-ное действие. α-Нейротоксины - небольшие белки с молекулярной массой около 7000 Д (65-70 аминокислотных остатков). Их третичную структуру стабилизируют 4 или 5 специфических дисульфидных связей (в зависимости от вида токсина). Сродство нейротоксинов к холи-нергическим рецепторам очень высоко (Кдисс = 10-11). Очевидно, между токсином и рецептором образуется множество связей, что и приводит к их практически необратимому соединению.
Необходимо помнить, что между лекарствами и ядами часто существует прозрачная граница, и эффект их действия зависит от дозы вводимого вещества. Так, лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т.е. вызывать серьёзные нарушения обмена веществ и функций организма, а яды в микродозах часто используют как лекарственные препараты. Например, атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах - сон, переходящий в кому. Известное гипотензивное средство клофелин при передозировке вызывает коллапс.
V. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА
Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
А. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА
Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
1. Клеточная локализация и функция
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
2. Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
Гем - молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных
кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть гема называется протопорфири-ном. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В геме 4 атома азота пир-рольных колец протопорфирина IX связаны четырьмя координационными связями с Fe2+, находящимся в центре молекулы (рис. 1-29).
Апомиоглобин - белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 α-спиралей. α-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву α-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных ра-
дикалов, за исключением двух остатков Гис, располагающихся в активном центре.
3. Связывание гема с апомиоглобином
Гем - специфический лиганд апомиогло-бина, присоединяющийся к белковой части в углублении между двумя α-спиралями F и E. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца гема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях рН, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости гема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в геме может образовывать 6 координационных связей, 4 из которых удерживают Fe2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fe2+ и атомом азота имидазольного кольца Гис F8 (рис. 1-30).
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда - О2 к миоглобину.
Аминокислотное окружение гема создаёт условия для довольно прочного, но обратимого
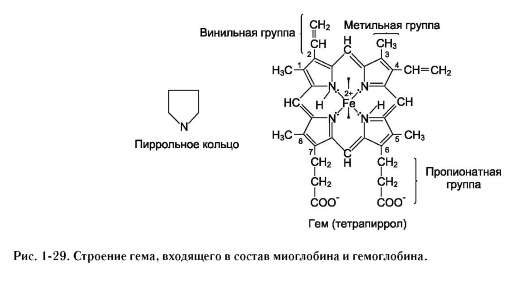
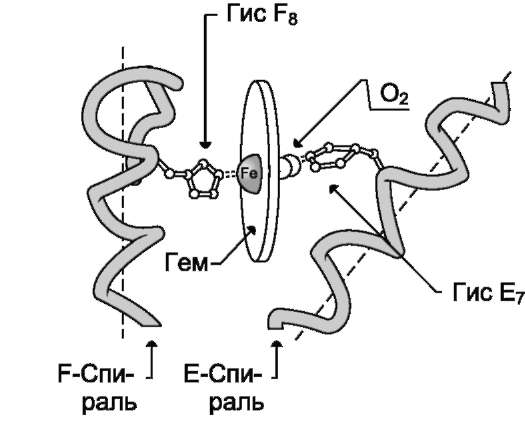
Рис. 1-30. Расположение гема в активном центре апомиоглобина и протомеров апогемоглобина.
связывания О2 с Fe2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe2+ в Fe3+. Трёхвалентное железо в составе гема не способно присоединять О2.
Б. СТРУКТУРА И ФУНКЦИИ ГЕМОГЛОБИНА
Гемоглобины - родственные белки, находящиеся в эритроцитах человека и позвоночных животных. Эти белки выполняют 2 важные функции:
• перенос О2 из лёгких к периферическим тканям;
• участие в переносе СО2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Кровь ежедневно должна переносить из лёгких в ткани около
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2. и интенсивность метаболизма. С другой стороны, О2 - сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина - его способность регулировать сродство к О2 в зависимости от тканевых условий.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную
структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
1. Гемоглобины человека Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β (2α2β).
Гемоглобин А2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозили-рованный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2ξ2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 γ-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
2. Строение гемоглобина А
Строение протомеров гемоглобина
Конформация отдельных протомеров гемоглобина удивительно напоминает конформацию миоглобина, несмотря на то, что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка. Протомеры гемоглобина, так же как и апомиоглобин, состоят
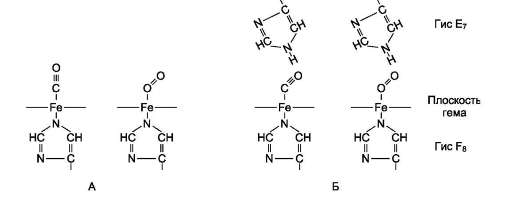
Рис. 1-31. Пространственное расположение СО и О2, связанных со свободным гемом (А) и гемом в составе гемоглобина или миоглобина (Б).
из 8 спиралей, свёрнутых в плотную глобулярную структуру, содержащую внутреннее гидрофобное ядро и «карман» для связывания гема. Соединение гема с глобином (белковой частью) аналогично таковому у миоглобина - гидрофобное окружение гема, за исключением 2 остатков Гис Е7 и Гис F8 (рис. 1-31). Однако тетрамерная структура гемоглобина представляет собой более сложный структурно-функциональный комплекс, чем миоглобин.
Роль гистидина Е7 в функционировании миоглобина и гемоглобина
Гем имеет высокое сродство к оксиду углерода (СО). В водной среде свободный от белковой части гем связывается с СО в 25 000 раз сильнее, чем О2. Высокая степень сродства гема к СО по сравнению с О2 объясняется разным пространственным расположением комплексов Fe2+ гема с СО и О2 (рис. 1-31, А).
В комплексе Fe2+ гема с СО атомы Fe2+, углерода и кислорода расположены на одной прямой, а в комплексе Fe2+ гема с О2 атомы железа и кислорода расположены под углом, что отражает их оптимальное пространственное расположение.
В миоглобине и гемоглобине над Fe2+ в области присоединения О2 расположен Гис Е7, нарушающий оптимальное расположение СО в центре связывания белков и ослабляющий его взаимодействие с гемом. Напротив, тот же Гис Е7 создаёт оптимальные условия для связывания О2 (рис. 1-31, Б). В результате сродство гема
к СО в белках всего в 200 раз превышает его сродство к О2.
Снижение сродства гемсодержащих белков к СО имеет важное биологическое значение. СО образуется в небольших количествах при катаболизме некоторых веществ, в частности гема. Этот эндогенно образующийся СО блокирует около 1% гемсодержащих белков. Если бы сродство гема к СО не уменьшалось под влиянием белкового окружения, эндогенный оксид углерода мог бы вызывать серьёзные отравления.
Четвертичная структура гемоглобина
Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая α-цепь контактирует с двумя β-цепями (рис. 1-32).
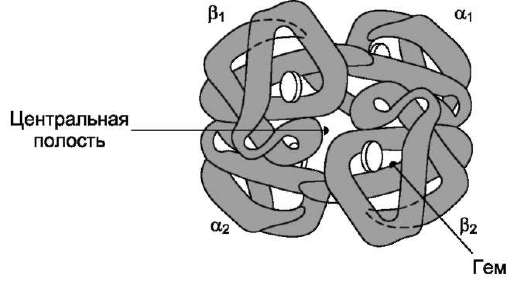
Рис. 1-32. Строение гемоглобина.
Так как в области контакта между α1- и β1-, а также между α2- и β2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры α1β1 и α2β2. Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга.
Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется «центральная полость», проходящая сквозь всю молекулу гемоглобина.
3. Связывание гемоглобина с О2 в лёгких и его диссоциация из комплекса в тканях
Основная функция гемоглобина - доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксиге-моглобина - НЬ(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
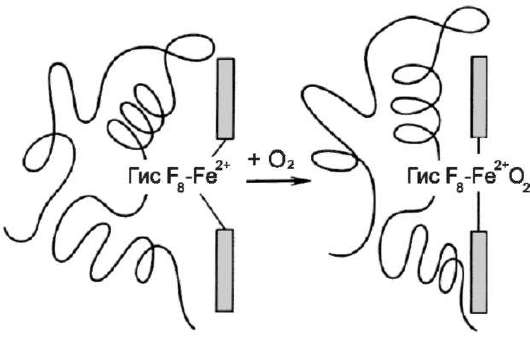
Рис. 1-33. Изменение положения Fe2+ и белковой части гемоглобина при присоединении О2.
Кооперативные изменения конформации протомеров
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец гема и атомом азота Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания (рис. 1-33).
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Так как протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2. Четвёртая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1-34).
Изменение конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
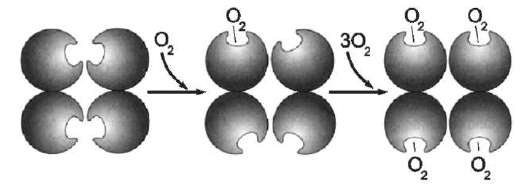
Рис. 1-34. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2.
Кривые диссоциации О2 для миоглобина и гемоглобина
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации О2 для миоглобина и гемоглобина (рис. 1-35).
Отношение занятых О2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки О2 при различных значениях парциального давления кислорода.
Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы (схема ниже).
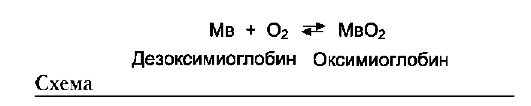
Процессы образования и распада оксимиог-лобина находятся в равновесии, и это равновесие смещается влево или вправо в зависимости от того, добавляется или удаляется кислород из системы. Миоглобин связывает кислород, который в капиллярах тканей высвобождает гемоглобин, и сам миоглобин может освобождать О2 в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании О2 в результате физической нагрузки.
Миоглобин имеет очень высокое сродство к О2. Даже при парциальном давлении О2, равном 1-2 мм рт. ст., миоглобин остаётся связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина. Из графика на рис. 1-35 видно, что гемоглобин имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше О2 отдают протоме-ры, тем легче идёт отщепление последующих молекул О2.
В капиллярах покоящихся мышц, где давление О2 составляет около
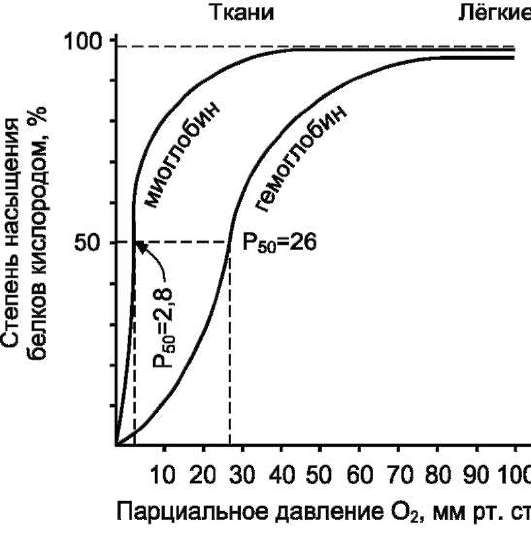
Рис. 1-35. Кривые диссоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода.
гемоглобина обратно в лёгкие. При физической работе давление О2 в капиллярах мышц падает до 10-20 мм рт. ст. Именно в этой области (от 10 до
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин - присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин - присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2.
4. Перенос Н+ и СО2 из тканей в лёгкие с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления.
СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента
карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
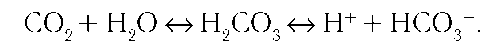
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-аминогруппам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2+ + Н2О ↔ Н2СО3 ↔ Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б).
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизиро-ванным концевым α-аминогруппам. R-NH2+ + СО2 = R-NH-СОО- + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
5. 2,3-Бифосфоглицерат - аллостерический регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточ-
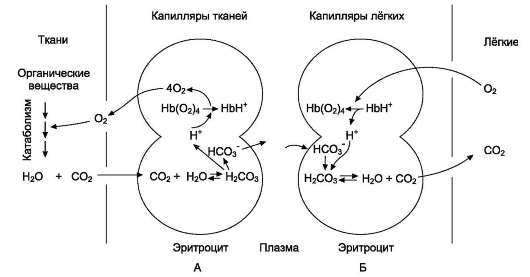
Рис. 1-36. Перенос H+ и СО2 с кровью. Эффект Бора. А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б - оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
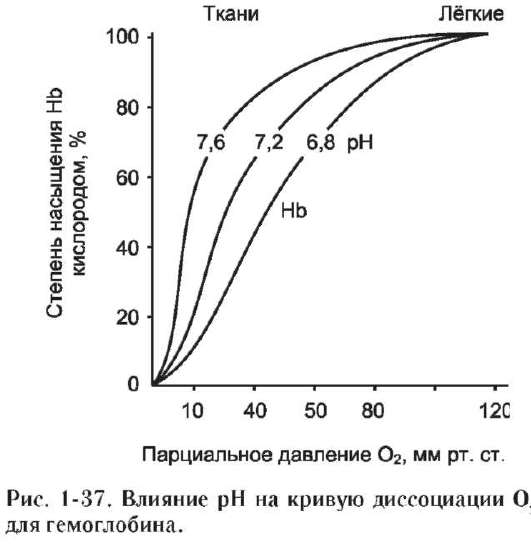
ного продукта окисления глюкозы 1,3-бифос-фоглицерата.
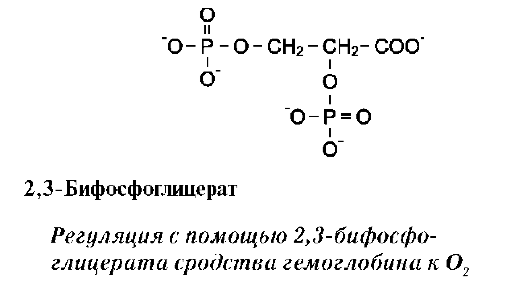
В нормальных условиях 2,3-бифосфоглицера присутствует в эритроцитах примерно в той ж концентрации, что и гемоглобин. БФГ, присо-единяясь к гемоглобину, также может менят его сродство к О2.
В центре тетрамерной молекулы гемоглобин есть полость, образованная аминокислотными остатками всех четырёх протомеров. Централь-ная полость - место присоединения БФГ.
Размеры центральной полости могут меняться отщепление О2 от оксигемоглобина вызывае его конформационные изменения, которы способствуют образованию дополнительны ионных связей между димерами α1β1 и α2β2 В результате пространственная структура дезокси гемоглобина становится более жёсткой, напряжён ной, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 β-цепей и положительно заряженные α-аминогруппы N-концевого валина β-цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дез-оксигемоглобина и снижает сродство белка к О2 (рис. 1-38).
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с гемом, где происходит связывание О2. Такой лиганд называется «аллостерический», а центр, где связывается аллостерический лиганд, - «аллостерический центр» (от греч. «аллос» - другой, иной, «стерос» - пространственный).
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв ионных связей между димерами α1β1 и α2β2 приводит к «расслаблению» белковой молекулы, уменьшению центральной полости и вытеснению
БФГ.
ткани
Нв(О2)4 + БФГ ↔ Нв-БФГ + 4О2
лёгкие
Изменение концентрации БФГ как механизм адаптации организма к гипоксии. Концентрация БФГ в эритроцитах людей, живущих в определённых климатических условиях, - величи-
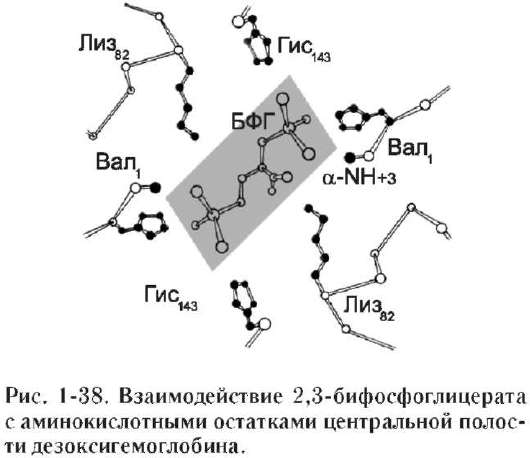
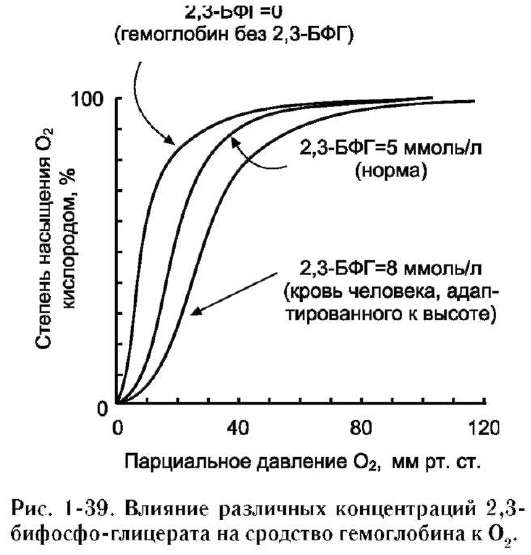
на постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более
Такую
же адаптацию наблюдают у больных с заболеваниями лёгких, при которых
развивается общая гипоксия тканей. Так, у больных с тяжёлой
обструктивной эмфиземой лёгких парциальное давление в них снижается от
100 до
Клиническое значение концентрации БФГ в консервированной крови
В крови, консервированной в некоторых средах, например цитрат-декстрозной, за 10 дней концентрация БФГ снижается с 4,5 до
нормальную концентрацию его в эритроцитах, так как, имея высокий отрицательный заряд, БФГ не может проникать через мембраны эритроцитов. Поэтому в настоящее время в кровь добавляют вещества, способные проникать через мембрану эритроцитов и поддерживать в них нормальную концентрацию БФГ.
6. Регуляторные свойства олигомерного белка гемоглобина
Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиганда: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина.
Как мы уже рассматривали выше, в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию ре-гуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и функцию к изменениям, происходящим в окружающей среде.
7. Особенности строения
и функционирования гемоглобина плода
Фетальный гемоглобин (HbF) заменяет эмбриональный гемоглобин, начиная синтезироваться в печени через 2 нед после её формирования у плода. С 6 мес развития плода до его рождения это основной гемоглобин эритроцитов. После рождения ребёнка он интенсивно начинает замещаться на гемоглобин А.
В физиологических условиях HbF имеет более высокое сродство к О2, чем НЬА, что создаёт оптимальные условия для транспорта О2 из крови
матери в кровь плода. Это свойство HbF обусловлено тем, что он слабее, чем НЬА связывается с 2,3-БФГ. Физиологические особенности HbF связаны с особенностями его строения: вместо β-глобиновых цепей в НЬА, он содержит две γ-цепи (β-подобные). Связывание 2,3-БФГ с НЬА происходит при участии положительно заряженных радикалов аминокислот двух β-цепей, некоторые из которых отсутствуют в первичной структуре γ-цепей. В среде, лишённой 2,3-БФГ, НЬА и HbF проявляют одинаковое высокое сродство к О2.
в. наследственные нарушения первичной структуры и функций гемоглобина а - наследственные гемоглобинопатии
Важность первичной структуры белков для формирования их конформации и функции можно проследить на примерах наследственных заболеваний, связанных с изменением первичной структуры гемоглобина. В настоящее время известно около 300 вариантов НЬА, имеющих в первичной структуре α- или β-цепей лишь небольшие изменения. Некоторые из них почти не влияют на функцию белка и здоровье человека, другие снижают функцию белка и особенно в экстремальных ситуациях снижают возможность адаптации человека, третьи - вызывают значительные нарушения функций НЬА и развитие анемии, что приводит к тяжёлым клиническим последствиям.
В аномальных гемоглобинах изменения могут затрагивать аминокислоты:
• находящиеся на поверхности белка;
• участвующие в формировании активного центра;
• замена которых нарушает общую трёхмерную конформацию молекулы;
• изменяющие четвертичную структуру белка и его регуляторные свойства.
1. Замена аминокислоты на поверхности гемоглобина А
Ещё в
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
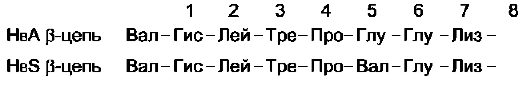
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа (рис. 1-40).
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемог-
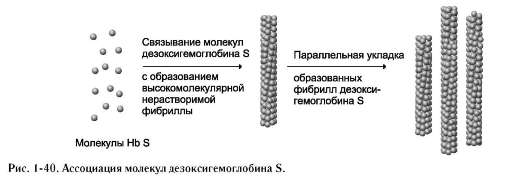
лобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемогло-бина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутанnных гена β-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
Для диагностики наличия HbS в эритроцитах человека используют метод электрофореза, основанного на движении заряженных белков в электрическом поле. Так как в HbS отрицательно заряженные группы глутамата в β-цепях заменены незаряженным валином, HbS в щелочной среде будет двигаться медленнее, чем НЬА.
Высокая частота гена HbS среди жителей Африки (до 40% населения в некоторых районах) обусловлена тем, что гетерозиготы менее чувствительны к малярии, чем люди с нормальным гемоглобином А. Plasmodium falciparum - возбудитель малярии, облигатную часть своего жизненного цикла он проводит в эритроцитах. Так как эритроциты гетерозиготных по HbS людей имеют более короткий срок жизни, чем нормальные эритроциты, возбудитель малярии не успевает закончить необходимую стадию развития. Это
создаёт избирательное преимущество для гетерозиготных по HbS людей в тех областях, где малярия вызывает гибель многих людей.
Серповидно-клеточная анемия - первый описанный пример молекулярной болезни.
Почти все встречающиеся замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S - редкое исключение.
2. Изменения аминокислотного состава в области активного центра гемоглобина
Между гемом и белковой частью гемоглобина существует около 60 межатомных контактов. Большинство мутаций, нарушающих в той или иной мере эти контакты, приводят к развитию гемоглобинопатии и анемии.
Гемоглобин М - вариант гемоглобина А, где в результате мутации в гене α- или β-цепи происходит замена Гис Е7 или Гис F8 тирозином. В результате Fe2+ окисляется в Fe3+ и стабилизируется в этой форме. Гемоглобин, содержащий в геме Fe3+, называют метгемог-лобином (отсюда и название - гемоглобин М). Вместо О2 к Fe3+ присоединяется Н2О. Обычно изменения затрагивают либо α-, либо β-цепи, в результате гемоглобин может переносить не более двух молекул О2. У гетерозиготных людей отмечают цианоз, связанный с нарушением транспорта О2, а гомозиготность по этому гену приводит к летальному исходу. Гемоглобин Хаммерсмита - вариант гемоглобина А, где в положении D1 вместо фенил-аланина (гидрофобной аминокислоты) находится серин (гидрофильная аминокислота). Фен D1 входит в неполярное окружение гема. Замена его на гидрофильную аминокислоту приводит к нарушению прочности связывания гема с глобином; в «гидрофобный карман», где размещается гем, способна проникать вода, окисляющая Fe2+ до Fe3+, в результате чего развивается анемия.
3. Изменения аминокислотного состава, деформирующие третичную структуру гемоглобина
Во всех нормальных гемоглобинах и в миог-лобине в месте пересечения двух α-спиралей В и Е находится аминокислота глицин. Так как глицин вместо радикала содержит атом водоро-
да, в этом месте две спирали плотно прилегают друг к другу.
В гемоглобине Ривердейла-Бронкса (вариант гемоглобина А) вместо глицина в положении В6 находится аминокислота аргинин, имеющая объёмный радикал. В результате он не умещается в столь узком пространстве, молекула меняет конформацию и становится нестабильной.
4. Замены аминокислот в области контактов ди-меров α1β1, α2,β2, нарушающие аллостерические регуляторные функции гемоглобина
Почти все варианты гемоглобина А, где происходит замена аминокислот в области контакта димеров α1,β1, α2,β2, проявляют пониженную кооперативность и нарушенное сродство гемоглобина к О2.
Так, гемоглобин Кемпси - вариант гемоглобина А, где в положении G1 β-цепи аспараги-новая кислота заменена на аспарагин. В норме аспарагиновая кислота участвует в образовании водородной связи, стабилизирующей дезокси-гемоглобин. В результате замены эта связь не образуется, что нарушает стабильность конфор-мации дезоксигемоглобина, и сродство гемоглобина к О2 повышается. У больных развивается анемия с выраженным цианозом.
Таким образом, первичная структура белка определяет особенности его конформации, строения активного центра и функций. Изменение одной аминокислоты только в одном белке может быть причиной нарушений функций данного белка и развития наследственной патологии.
VI. МНОГООБРАЗИЕ БЕЛКОВ
В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Белки построены из 20 химически различных аминокислот, каждая из которых может занимать любое положение в полипептидной цепи. Кроме того, белки различаются количеством аминокислот, из которых они построены.
Однако большинство таких белков в среде должны принимать множество конформаций с приблизительно одинаковой энергией, но разными химическими свойствами и функциями. Поэтому в эволюции, по-видимому, была отобрана лишь небольшая часть возможных
вариантов белков, которые способны принимать единственную стабильную конформацию.
Таким образом, первичная структура известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной из возможных конформаций, которая и определяет особенности функционирования данного белка.
Возникновение новых белков часто связано с незначительными изменениями в структуре уже имеющихся белков. Кроме того, благодаря генетическим механизмам, о которых будет сказано в разделе 4, белок с полезными свойствами или основная структурная часть этого белка могут входить в состав других белков. Такие белки, имеющие схожую последовательность аминокислот и родственные функции, объединяют в семейства родственных белков.
А. КЛАССИФИКАЦИИ БЕЛКОВ
До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
• по форме молекул (глобулярные или фибриллярные);
• по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
• по химическому строению (наличие или отсутствие небелковой части);
• по выполняемым функциям (транспортные, защитные, структурные белки и др.);
• по локализации в клетке (ядерные, цито-плазматические, лизосомальные и др.);
• по локализации в организме (белки крови, печени, сердца и др.);
• по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
• по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с T1/2 менее 1 ч, до очень медленно обновляющихся белков, T1/2 которых исчисляют неделями и месяцами);
• по схожим участкам первичной структуры и родственным функциям (семейства белков).
Б. КЛАССИФИКАЦИЯ БЕЛКОВ ПО ФОРМЕ МОЛЕКУЛ
Это одна из самых старых классификаций, которая делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков - рассмотренные выше миоглобин и гемоглобины.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией.
1. Строение и функции коллагенов
Коллагены - семейство родственных фибриллярных белков, секретируемых клетками соединительной ткани. Коллагены - самые распространённые белки не только межклеточного матрикса, но и организма в целом, они составляют около 1/4 всех белков организма человека. В межклеточном матриксе молекулы коллагена образуют полимеры, называемые фибриллами коллагена (более подробно это описано в разделе 15). Фибриллы коллагена обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в 10 000 раз превышающую их собственный вес. По прочности коллагеновые фибриллы превосходят прочность стальной проволоки того же сечения. Именно поэтому большое количество коллагеновых волокон, состоящих из коллагено-вых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
Необычные механические свойства коллагенов связаны с их первичной и пространственной
структурами. Молекулы коллагена состоят из трёх полипептидных цепей, называемых α-цепями. Идентифицировано более 20 α-цепей, большинство которых имеет в своём составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи.
Первичная структура α-цепей коллагена необычна, так как каждая третья аминокислота в полипептидной цепи представлена глицином, около 1/4 аминокислотных остатков составляют пролин или 4-гидроксипролин, около 11% - аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, а гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержатся также модифицированные аминокислоты - гид-роксилизин и гидроксипролин. Полипептидную цепь коллагена можно представить как последовательность триплетов Гли-Х-Y, где Х и Y могут быть любыми аминокислотами, но чаще в положении Х стоит пролин, а в положении Y - гидроксипролин или гидроксилизин. Каждая из этих аминокислот имеет большое значение для формирования коллагеновых фибрилл.
Пролин благодаря своей структуре вызывает изгибы в полипептидной цепи, стабилизируя левозакрученную спиральную конформацию. На один виток спирали приходится 3 аминокислотных остатка, а не 3,6, как это характерно для вторичной структуры глобулярных белков. Спираль пептидной цепи коллагена стабилизирована не за счёт водородных связей (так как пролин их не образует), а силами стерического отталкивания пирролидиновых колец в остатках пролина. В результате расстояние между аминокислотными остатками по оси спирали увеличивается, и она оказывается более развёрнутой по сравнению с туго закрученной α-спиралью глобулярных белков.
Спирализованные полипептидные цепи, перевиваясь друг около друга, образуют трёхце-почечную правозакрученную суперспиральную молекулу, часто называемую тропоколлагеном (рис. 1-41). Цепи удерживаются друг около друга за счёт водородных связей, возникающих между амино- и карбоксильными группами пептидного остова разных полипептидных цепей, входящих в состав трёхспиральной молекулы. «Жёсткие»
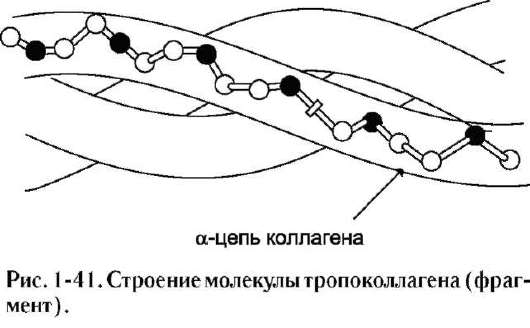
аминокислоты - пролин и гидроксипролин - ограничивают вращение полипептидного стержня и увеличивают тем самым стабильность тройной спирали. Глицин, имеющий вместо радикала атом водорода, всегда находится в месте пересечения цепей; отсутствие радикала позволяет цепям плотно прилегать друг к другу.
В результате такого скручивания пептидных остовов полипептидных цепей и наличия удлинённой структуры два других радикала из триады аминокислот Гли-Х-Y оказываются на наружной поверхности молекулы тропоколлагена. Некоторые комплементарные участки молекул тропоколлагена могут объединяться друг с другом, формируя коллагеновые фибриллы, причём эти участки расположены таким образом, что одна нить тропоколлагена сдвинута по отношению к другой примерно на 1/4 (рис. 1-42). Между радикалами аминокислот возникают ионные, водородные и гидрофобные связи.
Важную роль в формировании коллагеновых фибрилл играют модифицированные аминокислоты: гидроксипролин и гидроксилизин. Гидроксильные группы гидроксипролина соседних цепей тропоколлагена образуют водородные
связи, укрепляющие структуру коллагеновых фибрилл. Радикалы лизина и гидроксилизина необходимы для образования прочных поперечных сшивок между молекулами тропоколлагена, ещё сильнее укрепляющие структуру коллаге-новых фибрилл. Кроме того, к гидроксильной группе гидроксилизина могут присоединяться углеводные остатки (гликозилирование коллагена), функция которых пока неясна.
Таким образом, аминокислотная последовательность полипептидных цепей коллагена позволяет сформировать уникальную по своим механическим свойствам структуру, обладающую огромной прочностью. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней (см. раздел 15).
2. Строение и функция эластина
В отличие от коллагена, образующего прочные фибриллы, способные выдержать большие нагрузки, эластин (также белок межклеточного матрикса) обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются к свёрнутой конформации.
Эластин содержит в составе около 800 аминокислотных остатков, среди которых преобладают аминокислоты с неполярными радикалами, такие как глицин, валин, аланин. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин.
Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи
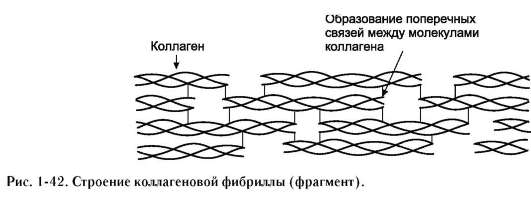
эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матриксе разные конформации с примерно равной свободной энергией (рис. 143). Это как раз тот случай строения первичной структуры, когда отсутствие одной стабильной упорядоченной конформации приводит к возникновению необходимых белку свойств.
Более подробно особенности строения и функционирования эластина рассмотрены в разделе 15.
В. КЛАССИФИКАЦИЯ БЕЛКОВ ПО ХИМИЧЕСКОМУ СТРОЕНИЮ
1. Простые белки
Некоторые белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют «простые белки». Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд (более подробно гистоны описаны в разделе 4). Рассмотренный выше белок межклеточного матрикса эластин также относят к простым белкам.
2. Сложные белки
Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют «сложные белки». Прочно связанная с белком небелковая часть носит название про-стетической группы.
Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название
гемопротеины. В состав гемопротеинов, кроме уже рассмотренных выше белков гемоглобинов и миоглобина, входят ферменты - цитохромы, каталаза и пероксидаза. Гем, присоединённый к разным белковым структурам, выполняет в них характерные для каждого из белков функции (например, в составе гемоглобина переносит О2, а в составе цитохромов - электроны).
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют «холопротеин».
Г. КЛАССИФИКАЦИЯ БЕЛКОВ
ПО ФУНКЦИЯМ
Белки выполняют в клетках множество биологических функций. По признаку сходства выполняемых белками функций их можно разделить на следующие большие группы.
1. Ферменты
Ферменты - специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Так как ферменты, как и любые белки, имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы. В настоящее время известно около 2000 различных ферментов, ускоряющих различные химические реакции. Например, протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот -
аргинина или лизина. Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклео-тидами в полинуклеотидной цепи.
Благодаря набору ферментов в клетках превращения поступающих в них веществ протекают не хаотично, а в строго определённых направлениях.
2. Регуляторные белки
К регуляторным белкам относят большую группу белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени. Например, гормон инсулин выделяется в кровь при повышении концентрации глюкозы в крови после еды и, стимулируя использование глюкозы клетками, снижает концентрацию глюкозы до нормы, т.е. восстанавливает гомеостаз.
Кроме того, к регуляторным относят белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию. Например, белок кальмодулин в комплексе с четырьмя ионами Са2+ может присоединяться к некоторым ферментам, меняя их активность.
Регуляторные ДНК-связывающие белки, присоединяясь в определённые моменты к специфичным участкам ДНК, могут регулировать скорость считывания генетической информации (они описаны в разделе 4).
3. Рецепторные белки
Сигнальные молекулы (гормоны, нейромеди-аторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуля-торных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.
4. Транспортные белки
Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, белок плазмы крови альбумин переносит жирные кислоты и билирубин (продукт распада
гема), а гемоглобин эритроцитов участвует в переносе О2 от лёгких к тканям. Стероидные гормоны переносятся в крови специфическими транспортными белками.
Транспортные белки участвуют также в переносе гидрофильных веществ через гидрофобные мембраны. Так как транспортные белки обладают свойством специфичности взаимодействия с лигандами, их набор в клеточной мембране определяет, какие гидрофильные молекулы могут пройти в данную клетку. С помощью белков-переносчиков в клетку проникают глюкоза, аминокислоты, ионы и другие молекулы.
5. Структурные белки
Некоторые белки, расположенные определённым образом в тканях, придают им форму, создают опору, определяют механические свойства данной ткани. Например, как уже говорилось выше, главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий высокую прочность. Другой структурный белок (эластин) благодаря своему уникальному строению обеспечивает определённым тканям свойство растягиваться во всех направлениях (сосуды, лёгкие).
6. Защитные белки
Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и уничтожается клетками иммунной системы.
Защитными свойствами обладают белки свёртывающей системы крови, например фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.
7. Сократительные белки
Некоторые белки при выполнении своих функций наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц. Другой пример таких белков - тубулин, из которого построены клеточные органеллы - микротрубочки. Микротрубочки в период деле-
ния клетки регулируют расхождение хроматид. Микротрубочки - важные элементы ресничек и жгутиков, с помощью которых клетки передвигаются.
Однако существует большое количество белков, имеющих уникальные функции, которые не вошли в эту довольно простую классификацию.
Д. СЕМЕЙСТВА РОДСТВЕННЫХ БЕЛКОВ
В ходе эволюции в пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Гомологичными называют последовательности, имеющие много сходных черт. Они содержат во многих положениях одни и те же аминокислоты, называемые инвариантными, а в некоторых положениях могут находиться разные, но близкие по физико-химическим свойствам аминокислотные остатки.
Эти белки имеют поразительно схожие кон-формации: количество и взаиморасположение α-спиралей и/или β-структур, большинство поворотов и изгибов полипептидных цепей сходно или идентично. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков.
Пример семейства родственных белков - семейство миоглобина, куда включены, кроме самого миоглобина, и все виды гемоглобина.
1. Семейство сериновых протеаз
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах).
Для всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных
структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты (рис. 1-44). Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами.
Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами.
Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов. В процессе активации на-тивных белков сериновые протеазы гидролизуют одну или две особенные пептидные связи из сотен связей, имеющихся в белковом субстрате. Это связано с тем, что в нативном белке фермент узнаёт не только аминокислоты, непосредственно формирующие пептидную связь, но и некоторые аминокислотные остатки, окружающие связь, подвергающуюся ферментативному гидролизу.
Более подробно о сериновых протеазах можно прочесть в разделах 9, 14.
2. Суперсемейство иммуноглобулинов
В работе иммунной системы огромную роль играют белки, относящиеся к суперсемейству иммуноглобулинов. Это суперсемейство включает по крайней мере три больших семейства белков, участвующих в иммунной защите организма: семейство иммуноглобулинов, семейство Т-клеточных антигенраспознающих рецепторов и белки главного комплекса гистосовместимости I и II классов, которые в литературе обозначают МНС (от англ. major histocompatibility complex). В это суперсемейство включено также семейство адгезивных белков, участвующих в узнавании определённых типов клеток и их межклеточных взаимодействиях.
Основной критерий включения белков в суперсемейство иммуноглобулинов - их доменная организация, достоверная гомология аминокислотных последовательностей и пространственных структур отдельных доменов. Кроме того, белки этого суперсемейства имеют схожие функции: иммуноглобулины взаимодействуют с чужеродными структурами, находящимися в крови, лимфе, межклеточной жидкости или секретах желёз, а рецепторы Т-лимфоцитов и белки главного комплекса гистосовместимости - с антигенами, находящимися на поверхности клеток данного организма.
3. Семейство иммуноглобулинов
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов.
Все иммуноглобулины характеризуются общим планом строения, который мы рассмотрим на примере строения IgG.
Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ. light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидны-ми связями. Поэтому молекулу IgG относят к мономерам.
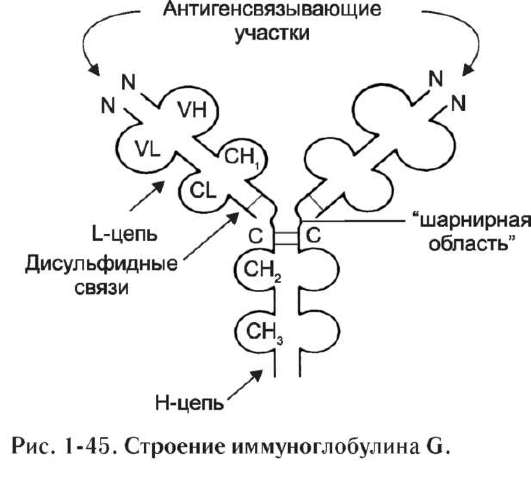
Лёгкие цепи IgG состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоёв с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ко-валентно дисульфидной связью примерно в середине домена (рис. 1-45).
Тяжёлые цепи IgG имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СН3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СН1 и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют «шарнирной областью»; он придаёт молекуле гибкость.
Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют «биваленты». В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных доменов обеих цепей, а всего лишь 20-30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальные способности каждого клона антител
взаимодействовать с соответствующим (комплементарным) антигеном.
Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител.
Классы иммуноглобулинов. Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ε, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A, D, E, G и M. Особенности строения тяжёлых цепей придают их «шарнирным участкам» и С-концевым областям характерную для каждого класса кон-формацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками).
Иммуноглобулины М - первый класс антител, синтезирующийся в развивающихся В-лимфо-цитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами в кровь.
Мембранно-связанная форма иммуноглобулинов
М. Созревающие В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых анти-ген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-кон-цевой («хвостовой») области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков.
Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов
будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител.
Секреторная форма иммуноглобулинов М. Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1-46).
В тяжёлых цепях их мономеров отсутствует гидрофобная «хвостовая» часть. Пентамерная молекула содержит 10 участков связывания с антигеном, что облегчает вероятность прикрепления неизвестного ранее антигена к иммуноглобулину (рис. 1-47).
Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его «хвостовой» области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют
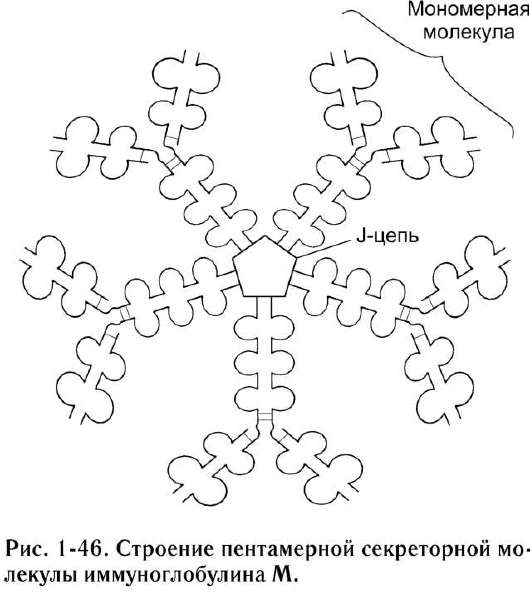
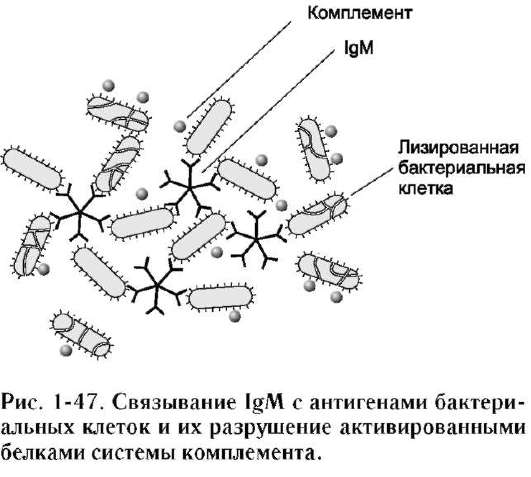
около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм.
У человека обнаружено 4 подкласса IgG: IgG1, IgG2, IgG3, IgG4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgG1, а в наименьшем - IgG2). Степень гомологии между этими подклассами очень высока (около 90-95%).
IgG не только эффективно связывают и инакти-вируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее
уничтожение. Конформационные изменения в «хвостовой» области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-кон-цевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах (рис. 1-48).
IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме ди-мера, где мономеры соединены дополнительной пептидной цепью J (рис. 1-49).
На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию про-теолитических ферментов, и свободный димер высвобождается во внеклеточное пространство
(рис. 1-50).
Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками
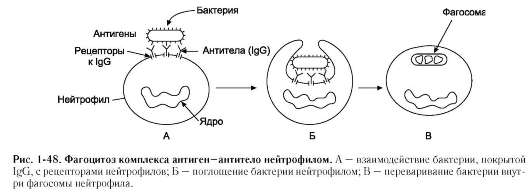
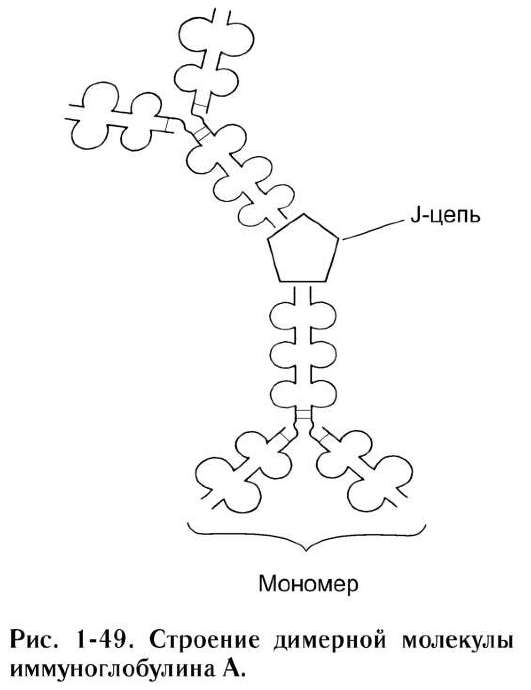
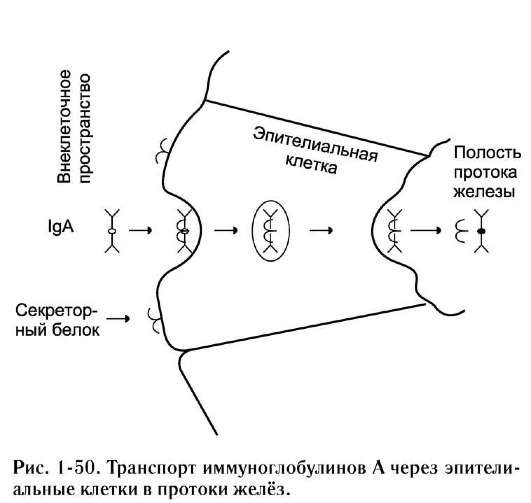
системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые
цепи e содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфо-цитами IgE связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток (рис. 1-51).
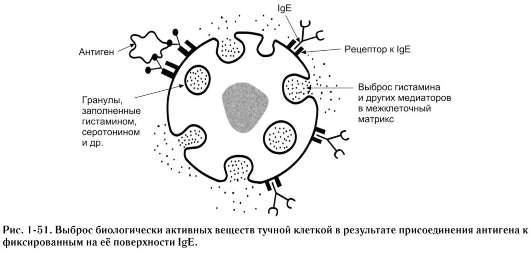
После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgB может предшествовать развитию аллергических реакций.
Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.
4. Семейство Т-клеточных антигенраспознающих рецепторов
Если антитела, вырабатываемые В-лимфоцита-ми, связывают антигены в жидкостях организма (так называемый гуморальный иммунитет), то Т-лимфоциты взаимодействуют с антигенами на поверхности заражённых вирусами и изменённых в результате опухолевой трансформации собственных клеток организма (клеточный иммунитет). Т-лимфоциты узнают антигены только в комплексе с молекулами МНС I или II класса, также присутствующими на клеточной поверхности.
Рецепторы Т-лимфоцитов - гетеродимеры, т.е. состоят из α- и β-цепей. Каждая цепь имеет два им-муноглобулиноподобных домена: вариабельный (V) и константньгй (С) (рис. 1-52). С-концевые участки каждой цепи встроены в плазматическую мембрану. Единственный антигенсвязывающий участок располагается между двумя вариабельными доменами Va и Vβ. Количество рецепторов Т-лимфоцитов с разными антигенсвязывающими участками сопоставимо с разнообразием иммуноглобулинов.
Семейство белков главного комплекса гистосов-местимости
Белки главного комплекса гистосовмести-мости были открыты при изучении вопросов внутривидовой пересадки тканей, откуда и произошло их название. Их называют также белками МНС (см. выше), или белками HLA (от англ. human lymphocyte antigen - человеческие лимфоцитарные антигены), так как впервые они были обнаружены на лимфоцитах человека.
Существует два основных класса молекул МНС: I и II. Молекулы МНС класса I расположены на поверхности практически всех клеток организма человека, а белки МНС класса II только на определённых клетках иммунной системы, называемых антигенпредставляющими клетками. К ним, в первую очередь, относят макрофаги и В-лимфоциты, контактировавшие с антигеном.
Молекулы МНС класса I - гетеродимеры. Они имеют одну полипептидную α-цепь, связанную нековалентными связями с небольшим внеклеточным белком β2-микроглобулином. Полипептидная α-цепь имеет три внеклеточных глобулярных домена (α1 α2, α3), трансмембранный участок и карбоксильный конец, локализованный в цитоплазме (рис. 1-53, А). α3-Домен и
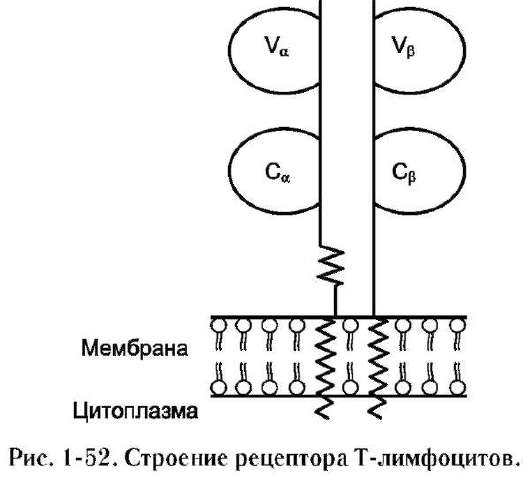
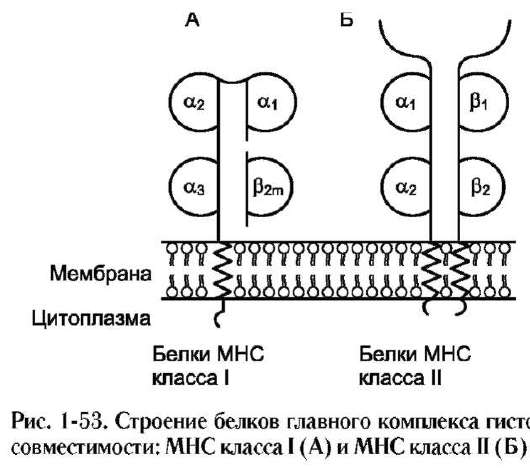
β2-микроглобулин имеют конформацию, напоминающую структуру иммуноглобулинов. Домены α1 и α2 содержат вариабельные участки, способные связывать «развёрнутый» антиген (чаще всего пептидный фрагмент чужеродного белка), расположенный на поверхности клеток.
Молекулы МНС класса II - также гетеродимеры. Они состоят из двух полипептидных цепей - α и β, имеющих по одному консервативному иммуноглобулинподобному домену и по одному вариабельному домену на N-концевых участках. Связывание антигенов происходит в области вариабельных доменов а- и β-цепей (рис. 1-53,
Б).
Чужеродные белки в клетке человека (например, белки вирусных частиц), в лизосомах подвергаются ограниченному протеолизу, и небольшие фрагменты этих белков вместе с белками МНС класса I или II экспонируются на поверхности клеточной мембраны.
Комплексы пептид-белок МНС узнаются рецепторами Т-лимфоцитов. В результате происходит специфическое взаимодействие (рис. 1-54), активация Т-лимфоцита и развитие иммунной реакции. Так, взаимодействие цитотоксического Т-лимфоцита с комплексом антиген-МНС I на
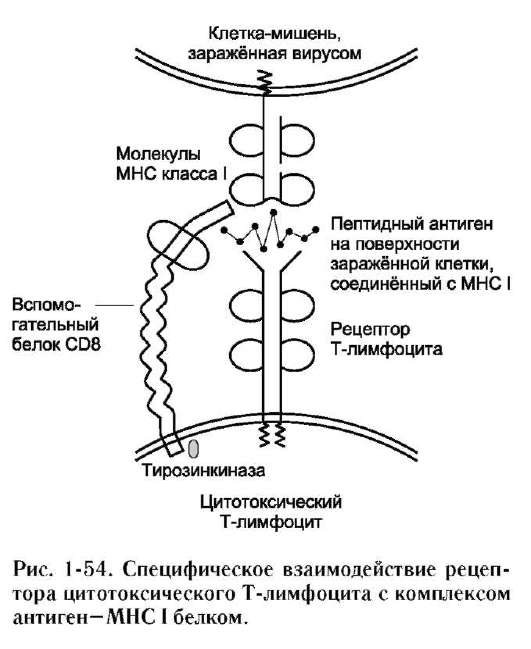
поверхности заражённой вирусом клетки приводит к высвобождению лимфоцитом специальных белков, вызывающих повреждение и гибель заражённой клетки.
е. изофункциональные белки
Изофункциональные белки - семейства белков, выполняющих почти одинаковую или близкую функцию, но небольшие особенности строения и функционирования некоторых членов этого семейства могут иметь важное физиологическое значение. Пример таких белков - изоформы гемоглобина человека: НЬА, НЬА2 HbF и другие, рассмотренные выше. Все они представляют собой тетрамеры, но состоят из разного набора протомеров α, β, γ, δ. Гемоглобины выполняют одинаковую функцию - присоединяют О2 и переносят его в ткани. Однако каждый из них обладает функциональными особенностями. Так, гемоглобин F имеет большее сродство к О2, чем НЬА, и благодаря этому обеспечивает диффузию О2 от НЬА из крови матери к HbF в крови плода.
Изобелки - множественные формы белка, обнаруживаемые в организмах одного вида. Белки, выполняющие одинаковые функции в организмах разных биологических видов, носят название «гомологичные белки». Например, цитохром С - митохондриальный белок, участвующий в биологическом окислении, присутствует у многих видов животных. Цитохромы С курицы и утки отличаются лишь двумя аминокислотными остатками в первичной структуре, выполняют одинаковую функцию, но так как они принадлежат разным видам, то их относят к гомологичным белкам.
К изобелкам относят также множество изоформ структурного белка коллагена (см. раздел 15). Многие ферменты имеют несколько изоформ и носят название изоферментов (см. раздел 2).
VII. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И МЕТОДЫ ИХ ВЫДЕЛЕНИЯ
Важное место в биохимических исследованиях занимает выделение индивидуальных белков из органов и тканей. Очищенные индивидуальные белки нужны для изучения их первичной структуры, получения кристаллов белков с целью исследования их пространствен-
ной структуры методом рентгеноструктурного анализа, установления взаимосвязи между первичной, пространственной структурой белка и его функцией.
Некоторые очищенные индивидуальные белки используют в медицине как лекарственные препараты, например гормон инсулин применяют для лечения сахарного диабета, а пищеварительные ферменты поджелудочной железы назначают при нарушении её функций в качестве заместительной терапии. Кроме того, очищенные ферменты часто используют в биохимических исследованиях в качестве химических реактивов для определения веществ в биологических жидкостях.
Большинство методов, используемых для очистки индивидуальных белков, основано на различиях их физико-химических свойств, а также возможности специфично связываться с лигандом.
А. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
1. Различия белков по форме молекул
Как уже говорилось выше, по форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
2. Различия белков по молекулярной массе
Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
3. Суммарный заряд белков
Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспара-гиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбок-сильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Арг и Гис.
Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН- с протонами, образующимися при диссоциации NH3+ с образованием воды, приводит к уменьшению положительного заряда белков:
-NH3+ +ОН- → -NH2 + Н2О.
Значение рН, при котором белок приобретает суммарный нулевой заряд, называют «изоэлектрическая точка» и обозначают как pI . В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектри-ческом состоянии.
Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.
Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате
растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (-). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
5. Растворимость белков
Растворимость белков в воде зависит от всех перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Б. МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ
Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
• дробление биологического материала и разрушение клеточных мембран;
• фракционирование органелл, содержащих те или иные белки;
• экстракцию белков (перевод их в растворённое состояние);
• разделение смеси белков на индивидуальные белки.
1. Методы разрушения тканей и экстракции белков
Для разрушения биологического материала используют методы: гомогенизации ткани, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком.
Гомогенизация биологического материала
Ткань, находящуюся в буферном растворе с определённым значением рН и концентрацией солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда.
Метод замораживания и оттаивания ткани
В результате попеременного замораживания и оттаивания образующиеся кристаллы льда разрушают оболочки клеток.
После разрушения ткани нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля клетки. Искомый белок будет содержаться в одной из этих фракций.
Экстракция белков, связанных с мембранами, и разрушение олигомерных белков на протомеры
Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия.
Механизм действия детергентов описан в разделе «Денатурация белков» (см. рис. 1-15). При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протоме-рами в олигомерных белках.
Удаление из раствора небелковых веществ
Нуклеиновые кислоты, липиды и другие небелковые вещества можно удалить из раствора, используя их особенные физико-химические свойства. Так, липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина.
2. Методы очистки белков
Наиболее трудоёмкий этап получения индивидуальных белков - их очистка от других белков, находящихся в растворе, полученном из данной ткани. Часто изучаемый белок присутствует в небольших количествах, составляющих доли процента от всех белков раствора.
Так как белки обладают конформационной лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах.
На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка.
Очистка белков избирательной денатурацией
Большинство белков денатурирует и выпадает в осадок уже при кратковременном нагревании раствора до 50-70 ?C или подкислении раствора до рН 5. Если выделяемый белок выдерживает эти условия, то с помощью избирательной денатурации можно удалить большую часть посторонних белков, отфильтровав выпавшие в осадок белки, или осадить их центрифугированием.
Высаливание
Метод очистки белков, основанный на различиях в их растворимости при разной концен-
трации соли в растворе. Соли щелочных и щё-лочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.
Чаще всего для разделения белков методом высаливания используют разные концентрации водных растворов соли сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания.
Гель-фильтрация, или метод молекулярных сит
Для разделения белков часто используют хро-матографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства.
Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хромато-графическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с «порами», через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной «пор».
Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы.
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул (рис. 1-55).
Так как гелевая структура сефадекса легко деформируется под давлением, гели стали за-
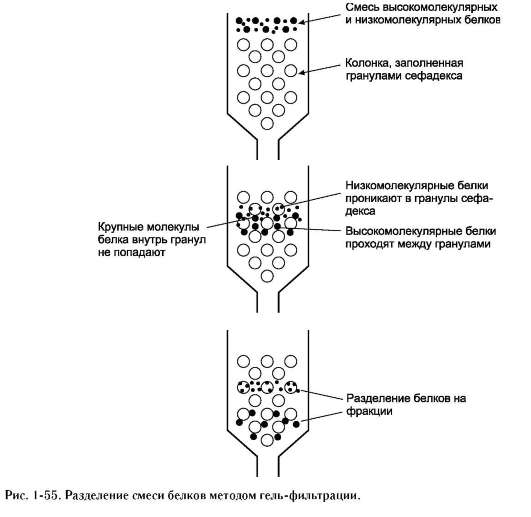
менять более жёсткими матрицами (сефактил, тойоперл), представляющими сферические гранулы с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии (о других хроматографических методах будет сказано ниже).
Ультрацентрифугирование
Метод
разделения также основан на различии в молекулярных массах белков.
Скорость седиментации веществ в процессе вращения в ультрацентрифуге,
где центробежное ускорение достигает 100 000-500
ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой (рис. 1-56). После расслоения белковых фракций дно кюветы прокалывают иглой и по каплям собирают содержимое небольшими порциями в пробирки.
Электрофорез белков
Метод основан на том, что при определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду.
Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-).
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакрила-мидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, α1-глобулины, α2-гло-булины, β-глобулины и γ-глобулины (рис. 1-57). Электрофорез тех же белков в полиакриламид-ном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе.
Ионообменная хроматография
Так же как и электрофорез, метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора
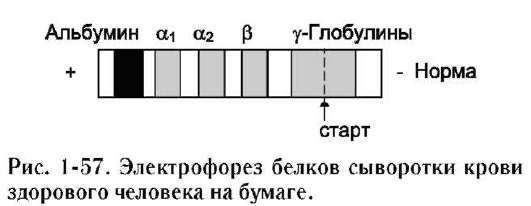
белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий.
В качестве неподвижной фазы используют ионообменники - полимерные органические вещества, содержащие заряженные функциональные группы.
Различают положительно заряженные ани-онообменники, среди которых наиболее часто используют диэтиламиноэтилцеллюлозу (ДЭАЭ-целлюлозу), содержащую катионные группы, и отрицательно заряженные катионообменники, например карбоксиметилцеллюлозу (КМ-цел-люлозу), содержащую анионные группы.
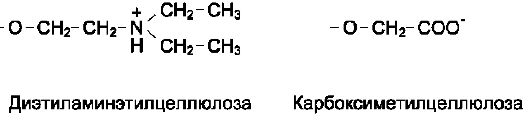
Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионо-обменник. При пропускании раствора белка через колонку прочность связывания белка с анионообменником зависит от количества отрицательно заряженных карбоксильных групп в молекуле. Белки, адсорбированные на анионо-обменнике, можно смыть (элюировать) буферными растворами с различной концентрацией соли, чаще всего NaCI, и разными значениями рН. Ионы хлора связываются с положительно заряженными функциональными группами анионообменника и вытесняют карбоксильные группы белков. При низких концентрациях соли элюируются белки, слабо связанные с анионообменником. Постепенное увеличение концентрации соли или изменение рН, что меняет заряд белковой молекулы, приводит к выделению белковых фракций, в одной из которых находится искомый белок.
Аффинная хроматография, или хроматография по сродству
Это наиболее специфичный метод выделения индивидуальных белков, основанный на избирательном взаимодействии белков с лигандами, прикреплёнными (иммобилизированными) к
твёрдому носителю. В качестве лиганда может быть использован субстрат или кофермент, если выделяют какой-либо фермент, антигены для выделения антител и т.д. Через колонку, заполненную иммобилизованным лигандом, пропускают раствор, содержащий смесь белков. К лиганду присоединяется только белок, специфично взаимодействующий с ним; все остальные белки выходят с элюатом (рис. 1-58). Белок, адсорбированный на колонке, можно снять, промыв её раствором с изменённым значением рН или изменённой ионной силой. В некоторых случаях используют раствор детергента, разрывающий гидрофобные связи между белком и лигандом.
Аффинная хроматография отличается высокой избирательностью и помогает очистить выделяемый белок в тысячи раз.
3. Очистка белков от низкомолекулярных примесей
Для
удаления низкомолекулярных соединений, в частности сульфата аммония
после высаливания, применяют диализ. Метод основан на том, что через
полупроницаемую мембрану, пропускающую низкомолекулярные вещества, не
проходят белки, имеющие более высокую молекулярную массу. В стакан
большой ёмкости (около
Скорость выхода соли из мешочка в буферный раствор пропорциональна градиенту его концентраций по обе стороны от мембраны. По мере выхода соли из мешочка буферный раствор в стакане меняют.
Для очистки белков от низкомолекулярных примесей используют также метод гель-фильтрации (см. выше).
Для определения частоты (гомогенности) выделенного белка применяют методы с высокой разрешающей способностью, например электрофорез в полиакриламидном геле, высокоэффективная хроматография высокого давления. От чистоты лекарственного белкового препарата зависят его биологическая эффективность и аллергенность (т.е. способность вызывать аллергические реакции). Чем качественнее очищен препарат, тем меньше вероятность осложнений при его применении.
VIII. ИЗМЕНЕНИЯ БЕЛКОВОГО СОСТАВА ОРГАНИЗМА
Белковый состав организма здорового взрослого человека относительно постоянен, хотя возможны изменения количества отдельных белков в органах и тканях в зависимости от состава пищи и режима питания, от физиологической активности человека, биологических ритмов.
А. ИЗМЕНЕНИЕ БЕЛКОВОГО СОСТАВА КЛЕТОК В ПРОЦЕССЕ ИХ ДИФФЕРЕНЦИРОВКИ
В процессе развития многоклеточного организма, особенно на стадиях дифференцировки клеток, белковый состав значительно изменяется. Для каждого типа специализированных клеток характерно появление специфических белков, которые определяют особенности их биологических функций. Так, только в эритроцитах есть гемоглобин, осуществляющий транспорт кислорода к тканям, а в клетках сетчатки
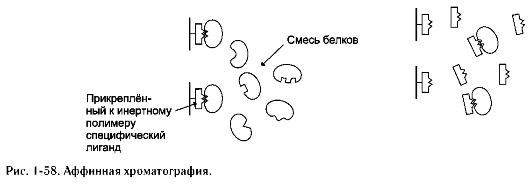
глаза - белок родопсин, необходимый для улавливания фотонов света. Кроме того, специализированные клетки отличаются и количеством белков, присутствующих практически во всех или во многих клетках организма.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопа-тии.
Б. НАСЛЕДСТВЕННЫЕ ПРОТЕИНОПАТИИ
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. Примеры наследственных протеинопатий - гемоглобинопатии, рассмотренные выше. В зависимости от роли дефектного белка в жизнедеятельности организма, от степени нарушения конформации и функции белков, от гомоили гетерозиготности индивидуума по этому белку наследственные протеинопатии могут вызывать болезни, протекающие с различной степенью тяжести, вплоть до летального исхода ещё до рождения или в первые месяцы после рождения.
В. ПРИОБРЕТЕННЫЕ ПРОТЕИНОПАТИИ
Любая болезнь сопровождается изменением белкового состава организма, т.е. развивается приобретённая протеинопатия. При этом первичная структура белков не нарушается, а обычно происходит количественное изменение белков, особенно в тех органах и тканях, в которых развивается патологический процесс. Например, при панкреатитах снижается выработка ферментов, необходимых для переваривания пищевых веществ в ЖКТ.
В некоторых случаях приобретённые проте-инопатии развиваются в результате изменения условий, в которых функционируют белки. Так,
при изменении рН среды в щелочную сторону (алкалозы различной природы) изменяется конформация гемоглобина, увеличивается его сродство к О2 и снижается доставка О2 тканям (гипоксия тканей).
Иногда в результате болезни повышается уровень метаболитов в клетках и сыворотке крови, что приводит к модификации некоторых белков и нарушению их функции. Так, повышенные концентрации глюкозы в крови при сахарном диабете приводят к неферментативному присоединению её к белкам (гликозилированию белков). Примером может служить повышение уровня гликозилированного гемоглобина в эритроцитах, что увеличивает его сродство к О2 и снижает транспорт О2 в ткани. Гликозилиро-вание белков хрусталика глаза (кристаллинов) приводит к его помутнению и развитию катаракты.
Кроме того, из клеток повреждённого органа в кровь могут выходить белки, которые в норме определяются там лишь в следовых количествах. При различных заболеваниях часто используют биохимические исследования белкового состава крови для уточнения клинического диагноза. Например, при панкреатите в крови повышается активность панкреатической амилазы (фермента, участвующего в расщеплении крахмала), которая в норме не должна попадать в кровь, а по протоку поджелудочной железы выделяется при пищеварении в двенадцатиперстную кишку (см. раздел 2).
В некоторых случаях биохимические данные об изменении белкового состава крови или мочи могут стать ведущими при постановке диагноза. Например, при миеломе (злокачественном перерождении плазматических клеток, синтезирующих иммуноглобулины) в крови и моче появляются белки Бенс-Джонса, которые в низких концентрациях присутствуют и в крови здоровых людей. Эти белки представляют собой лёгкие цепи иммуноглобулина G, синтез которых усиливается в злокачественно перерождённых клетках.