Туберкулез у детей и подростков / Под ред. В.А. Аксеновой. - 2007. - 272 с.
|
|
|
|
ГЛАВА 7 СПЕЦИФИЧЕСКАЯ ВАКЦИНОПРОФИЛАКТИКА ТУБЕРКУЛЕЗА У ДЕТЕЙ И ПОДРОСТКОВ
Вакцинация, направленная на формирование искусственного иммунитета к различным инфекционным заболеваниям, стала самым массовым профилактическим мероприятием медицины ХХ в. В зависимости от вирулентности микроорганизмов, роли иммунной системы в патогенезе вызываемых ими инфекционных заболеваний и, наконец, специфичности в одних случаях вакцинация предотвращает возникновение заболевания (оспа, столбняк, полиомиелит), в других - преимущественно влияет на его течение. Главным критерием при определении методики массовой иммунизации против какого-либо заболевания является ее биологическая целесообразность в конкретных эпидемиологических условиях. Чем меньше специфическая эффективность вакцины, тем большее значение придается отрицательным последствиям ее применения (осложнениям). В результате улучшение эпидемиологической ситуации закономерно приводит к пересмотру тактики вакцинации. Яркое тому подтверждение - история вакцинопрофилактики туберкулеза и современное отношение к иммунизации вакциной БЦЖ в различных странах.
7.1. ИСТОРИЯ ВАКЦИНОПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА
В конце XIX столетия Роберту Коху удалось выделить палочковидный микроб и доказать, что этот микроб является возбудителем страшной болезни - туберкулеза. В отличие от других микробов эта палочка, названная в честь первооткрывателя палочкой Коха (сейчас ее принято называть микобактерия туберкулеза), требует для своего роста в лабораторных условиях специальных питательных сред и длительного времени - месяц и более. В организме человека микобактерии развиваются также очень медленно, поэтому между заражением и проявлением болезни проходит достаточно длительный срок. Это нередко приводит к тому, что источник заражения, если это не семейный контакт, трудно установить. Роберт Кох показал, что
если животных заразить очень маленьким количеством ослабленных микобактерий туберкулеза, болезнь может не развиться или наступит самоизлечение, однако все его попытки создать вакцину против туберкулеза не привели к желаемому результату. Эту задачу решили в начале ХХ столетия французские исследователи Кальметт и Герен. Поняв, что вакцина из убитых микобактерий практически неэффективна, эти ученые в 1908 г. взяли выделенные от больной туберкулезом телки микобактерии туберкулеза бычьего вида и в течение 13 долгих лет снижали их вирулентность, т.е. степень патогенности - способности вызывать заболевание. В итоге они получили микобактерии, которые при введении животным в дозе, в тысячи раз превышающей заражающую дозу, не только не вызывали развитие туберкулеза, но и защищали от заболевания в ответ на последующее введение заражающей дозы микобактерий туберкулеза человеческого вида. Полученный аттенуированный, утративший способность вызывать заболевание штамм микобактерий был назван в честь его родителей BCG - аббревиатура Bacillus Calmette-Guerin, т.е. Бацилла Кальметта-Герена (в русской аббревиатуре БЦЖ). В 1921 г. вакциной БЦЖ был привит первый ребенок - новорожденная девочка из семьи больных туберкулезом. Прививку девочка получила энтерально в 3 приема по 2 мг на прием на 3-й, 4-й и 7-й день жизни. Вакцинация не вызвала никаких осложнений, и девочка, несмотря на тесный контакт с бактериовыделителем, осталась совершенно здоровой. Этот успех был подтвержден при вакцинации нескольких десятков, а затем и сотен детей, так как вскоре начали прививать всех детей из групп риска. Кальметт сообщил, что из 969 вакцинированных БЦЖ детей из самого тесного внутрисемейного контакта с туберкулезом в период с 1921 по 1927 г. умерло от этого заболевания и неспецифических заболеваний 3,9% детей. В то же время среди невакцинированных только от туберкулеза умерло 32,6% детей.
А. Кальметт писал: «Для того чтобы вызвать у свободных от туберкулеза субъектов то особенное состояние устойчивости к реинфекциям, которое характеризует противотуберкулезный иммунитет, необходимо с самого раннего возраста, даже тотчас после рождения, насытить их лимфатические органы небольшим количеством бацилл, возможно, менее вирулентных, но живых, ибо мертвые бациллы и бациллярные экстракты не обладают никакими защитными свойствами. По-видимому, в этом то и заключается трудно преодолимое препятствие, послужившее камнем преткновения для стольких исследователей».
О значении, которое придавалось вакцинопрофилактике, свидетельствует тот факт, что эта проблема обсуждалась в Гигиеническом комитете Лиги Наций в 1928 г. и на Международной конференции по туберкулезу в 1930 г. в г. Осло. Обе авторитетные инстанции подтвердили безвредность вакцины и рекомендовали ее для самого широкого применения в мире с целью предупреждения туберкулеза.
В дальнейшем судьба противотуберкулезной вакцины складывалась непросто: были сторонники, но были и те, которые выступали против внедрения в практику вакцинации БЦЖ. Так, многих специалистов насторожили работы, которые опубликовал Реггей (1929 г., США), утверждавший, что БЦЖ может диссоциировать на S- и R-формы, первая из которых вирулентна для морских свинок. В последующем Реггей и Kraus пересмотрели свои позиции.
В 1930 г. вакцинация БЦЖ подверглась жестокому испытанию: в Любеке среди 252 новорожденных, вакцинированных против туберкулеза, большая их группа заболела, и 76 детей умерли от туберкулеза. «Любекская трагедия» вновь заставила звучать голоса скептиков, породила в умах врачей вполне понятную тревогу, однако как выяснилось, причиной катастрофы послужила небрежность сотрудников лаборатории Deicke в Любеке, в результате чего произошло загрязнение вакцины туберкулезной культурой человеческого вида. Проведенное расследование отвело от вакцины БЦЖ порочащую тень.
В 1925 г. профессор Л.А. Тарасевич привез культуру БЦЖ из Франции в Москву, где была создана специальная комиссия. Изучение нового штамма микобактерий в СССР проводили в трех институтах: в Государственном контрольном институте вакцин и сывороток под руководством Л.А. Тарасевича и А.И. Тогуновой, Московском институте инфекционных болезней им. И.И. Мечникова и Харьковском санитарно-биологическом институте.
Первой и самой важной задачей, решение которой определяло возможность и целесообразность применения нового препарата, явилось изучение безвредности и биологической активности полученной культуры. Обширные данные, полученные при изучении этого вопроса, подтвердили, что БЦЖ в отличие от микобактерий туберкулеза не обладает токсическим действием на культуры тканей, а при вскрытии вакцинированных животных ни в одном случае не было обнаружено генерализованного туберкулеза даже при введении культу-
ры БЦЖ в дозе 100 мг. В то же время Л.А. Тарасевич (1926), и А.И. Тогунова (1932), показали, что вакцина БЦЖ в больших дозах может вызвать образование специфических, преимущественно эпителиоидно-фиброзных, бугорков, что связано с наличием так называемой остаточной вирулентности штамма БЦЖ. Авторы, однако, подчеркивали доброкачественный характер этих изменений.
Остаточная вирулентность позволяет микобактериям вегетировать в организме человека главным образом в лимфатической системе, вызывая ограниченные специфические морфологические изменения с последующим их рассасыванием и формированием противотуберкулезного иммунитета.
К этому времени была подтверждена невозможность усиления, т.е. реверсии, вирулентности штамма БЦЖ.
Как и в других государствах, в СССР вначале вакцину применяли в жидком виде энтерально - через рот. Однако срок годности жидкой вакцины составлял всего 2 нед, так как количество живых клеток в ней к этому сроку значительно снижалось. Такой короткий срок был недостаточным для успешного применения вакцины БЦЖ в нашей большой стране, да и холодильников для ее хранения практически не было. Срок годности жидкой вакцины был увеличен до 2 мес, а с годами метод введения вакцины через рот был заменен накожным методом. Отечественные исследователи в 1944 г. первыми в мире получили сухую вакцину БЦЖ, жизнеспособность которой сохранялась более года, и внедрили метод ее производства в практику. Это дало возможность с 1948 г. ввести в стране массовую вакцинацию и ревакцинацию против туберкулеза, а с 1962 г. повсеместно перейти на более эффективный внутрикожный метод введения препарата.
В 1948 г. S. Rosenthal на 1-м Международном Конгрессе по вакцинации БЦЖ в Париже предложил, чтобы все лаборатории мира применяли для производства вакцины стандартный высушенный из замороженного состояния парижский штамм БЦЖ. С этого времени началось участие ВОЗ в контроле качества вакцины БЦЖ. Система контроля качества вакцины БЦЖ периодически подвергается пересмотру под эгидой ВОЗ, совершенствуются методы ее производства.
В большинстве стран, производящих вакцину БЦЖ, применяет свой штамм БЦЖ, используют свою технологию изготовления препарата. В ВОЗ зарегистрировано 16 дочерних штаммов (так
называемых субштаммов) БЦЖ. Наиболее распространено восемь из них: французский, датский, шведский, бразильский штамм «Моро», японский, российский, американский, чехословацкий. Все они - дочерние штаммы BCG, полученного Кальметом и Гереном. Эти субштаммы значительно различаются между собой по морфологии, характеристике роста, сенсибилизирующей активности, антигенному составу, остаточной вирулентности и иммуногенности. Это связано с тем, что в каждой стране имелись свои питательные среды для их выращивания, в которых использовались свои продукты, например мясные, так как в те годы еще не были разработаны синтетические питательные среды.
Несмотря на несомненные успехи в борьбе с туберкулезом, достигнутые благодаря прогрессу вакцинации, химиотерапии, а также огромное количество экспериментальных и клинических научных исследований в этой области, до настоящего времени ряд аспектов данной проблемы все еще не решен. Надо полагать, что резкий скачок в деле противотуберкулезной вакцинации может произойти в том случае, если удастся окончательно понять сущность иммуноло - гических реакций, играющих роль в противотуберкулезной защите, и научиться целенаправленно на них воздействовать.
Недостаток знаний об иммунологических изменениях в организме человека, вызываемых БЦЖ, и некоторые сомнения в ее эффективности вызывают большие дискуссии ученых разных стран.
Многие авторы поднимают вопрос об эффективности вакцины и определении иммунного ответа человеческого организма на БЦЖ.
Как справедливо отметил Р. Smith в 1982 г. нет такого продукта микобактерий, который не давал бы защитного эффекта в руках хотя бы одного исследователя. A. Crowle (1966), анализируя результаты многочисленных исследований по иммунизации вакцинами из фракций микобактерий, пришел к заключению, что в составе туберкулезных микобактерий имеется четыре рода веществ:
1) иммуногенные защитные антигены;
2) неиммуногенные вещества, оказывающие адъювантное действие;
3) иммунологические инертные субстанции;
4) вещества, снижающие сопротивляемость, иначе «поощряющие инфекцию».
Поэтому в настоящее время принцип производства новых вакцин заключается в сохранении первых двух групп и удалении двух вторых.
K. Kaufmann в своем исследовании высказал мнение о необходимости выработки новой стратегии вакцинации против туберку-
леза путем создания нового поколения вакцин. Автор считает, что поскольку защита от туберкулеза в значительной мере осуществляется Т-лимфоцитами, то стратегия вакцинации должна преследовать цель стимуляции этих клеток. Новейшие экспериментальные модели на животных указали на то, что для успешной защиты от инфекции необходимы протекторные Т-лимфоциты, поскольку эти клетки участвуют в патогенезе туберкулеза. Автор приходит к выводу, что поиски должны идти в направлении создания рекомбинантной вакцины БЦЖ. В 90-х годах XX столетия распространение туберкулеза среди больных СПИДом побудило многих исследователей к разработке более эффективных вакцин. Было создано более 200 кандидатов на роль противотуберкулезной вакцины. Это были векторные, рекомбинантные ДНК вакцины, субъединичные антигены микобактерий с различными депо и др., однако ни одна из них не имела такого же уровня защитного действия, как вакцина БЦЖ. В нынешнем столетии только 4 вакцины-кандидата успешно преодолели первую фазу клинических испытаний - исследование безопасности и реактогенности и были допущены к следующей фазе - испытанию эффективности. Пятая вакцина-кандидат допущена к первой фазе клинических испытаний. В основном цель этих вакцин - бустер-эффект вакцинации БЦЖ, проведенной в период новорожденности.
До тех пор, пока ДНК-рекомбинантная или другая вакцина реализуется и будет испытана ее эффективность, пройдет, как полагают, 10-15 лет. В это время необходимо продолжение вакцинации обычной вакциной БЦЖ, которую следует совершенствовать. Работа в этом направлении включает усиление иммуногенности штамма при возможном снижении его остаточной вирулентности, стандартизацию соотношения живых и убитых клеток в дозе вакцины.
Как при работе с новыми вакцинами, так и при усовершенствовании вакцины БЦЖ исследователи постоянно сталкиваются с трудностью оценки эффективности вакцины в эксперименте, так как испытание одних и тех же штаммов или готовых вакцин в различных лабораториях дает неоднозначный ответ. Иными словами не удается разработать достоверные тесты оценки, позволяющие прогнозировать индукцию иммунной резистентности вакцинируемых к инфицированию M. tuberculosis или их диссеминации.
В последние годы появились работы о конкурентном влиянии на иммунную систему вакцинируемых детей многочисленных
нетуберкулезных микобактерий - M. avium, M. fortuitum и др., имеющих общие и родственные антигены с микобактериями туберкулеза. Возможны как сочетанное воздействие, так и предшествующие вакцинации БЦЖ экспозиции иммунной системы ребенка к нетуберкулезным микобактериям. В результате этого иммунная система ребенка не в состоянии реагировать на БЦЖ, так как поверхностные антигены БЦЖ как бы заблокированы антигенами нетуберкулезных микобактерий.
Наибольшую дискуссию в литературе вызывает проблема защитной роли БЦЖ в заболевании туберкулезом. В зарубежной литературе спектр мнений о вакцинации БЦЖ имеет широкие границы - от сомнения в ее отдельных качествах до полного отрицания эффективности дальнейшего применения противотуберкулезной иммунизации.
Согласно данным исследований, эффективность применяемых в настоящее время вакцин составляет 60-90% в отношении защиты от генерализованных форм туберкулеза сроком до 15-20 лет. Публикуемые материалы, несмотря на различные подходы к оценке эффективности БЦЖ, отражают в основном тенденцию в развитых странах с низкой заболеваемостью туберкулезом - к отказу от массовой вакцинации и переходу на выборочную вакцинацию детей из групп повышенного риска заболевания туберкулезом, т.е. иммигрантов, иностранных рабочих, лиц, прибывших из стран с высокой распространенностью туберкулезной инфекции. При этом большинство авторов доказывает большую защитную роль БЦЖ от генерализованных форм туберкулеза и отсутствие влияния иммунизации на распространенность инфекции, т.е. инфицированность микобактериями туберкулеза. Поэтому вакцинация наиболее показана детям раннего возраста в странах, эндемичных по туберкулезу. В этих случаях ВОЗ рекомендует вакцинировать новорожденных.
V. Sрringett, I. Sutherland (1990), проведя исследования о применении вакцины в Англии, отмечают, что важен вопрос не о целесообразности, а о сроках отмены вакцинации школьников, так как вследствие продолжающегося снижения заболеваемости туберкулезом на 9% в год абсолютные преимущества программы уменьшаются с той же скоростью, как и количество зарегистрированных случаев, в то время как недостатки вакцинации продолжают находиться на постоянном уровне.
Служба общественного здравоохранения США высказала мнение о том, что необходимо учитывать распространенность инфекции у детей в возрасте от 10 до 14 лет: если распространенность инфекции выше 5%, следует применять вакцинацию при рождении, при распространенности инфекции 2-5% следует вакцинировать детей при поступлении в школу, при распространенности инфекции ниже 2% -вакцинировать детей в возрасте от 12 до 14 лет.
Французские исследователи J. Grosset, V. Jarliev, H. Lecoeur (1987), теоретически обосновали, что количество случаев туберкулеза, предотвращенного вакцинацией БЦЖ в группе, насчитывающей 100 000 человек, изменяется соответственно от 1200 до 120 и до 12, если риск инфицирования изменяется от 1% до 0,1% и до 0,01%, в то время как количество осложнений после БЦЖ остается постоянным - 100, как остаются постоянными и расходы на проведение вакцинации. Преимущества вакцинации преобладают над ее недостатками в случае, когда годовой риск инфицирования составляет 1%, в то время как преимущества и недостатки бывают равноценными, если годовой риск инфицирования составляет 0,1%, и, наконец, при снижении риска инфицирования до 0,01% ощутимо преобладают нежелательные последствия вакцинации.
Среди исследований, проведенных в нашей стране, в отличие от зарубежных авторов почти не встречаются факты, подвергающие сомнению эффективность противотуберкулезных прививок. Все авторы свидетельствуют о высокой эффективности БЦЖ, снижающей заболеваемость среди привитых по сравнению с непривитыми. В настоящее время вакцинация БЦЖ продолжает оказывать свое положительное влияние на эпидемиологию туберкулеза. По-прежнему остаются актуальными повышение качества прививок и возможно больший охват ими населения. Поскольку раннее введение вакцины БЦЖ обеспечивает защиту от самых опасных клинических форм туберкулеза (в частности, от милиарного туберкулеза и туберкулезного менингита), считается, что усилия должны быть направлены на широкий охват прививками детей в раннем возрасте. Нами проанализированы данные за период с 1978 по 2004 г. о детях, у которых развился туберкулезный менингит. На рис. 1 четко видно снижение данной патологии (с 83 в 1978 г. до 16 зарегистрированных случаев в 2004 г.), что безусловно говорит в пользу противотуберкулезной вакцины.
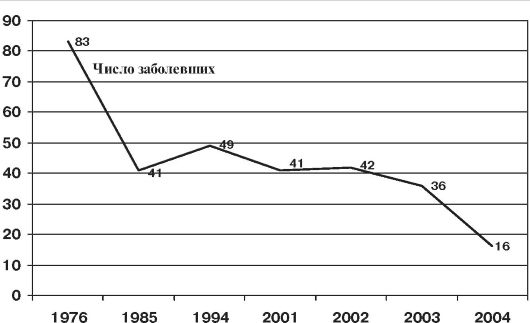 Рис. 1. Регистр осложнений противотуберкулезной иммунизации ГСМТ (2006)
Рис. 1. Регистр осложнений противотуберкулезной иммунизации ГСМТ (2006)
Ряд авторов, признавая профилактическое действие вакцинации БЦЖ, уточняет целесообразность ее применения в изменяющихся эпидемиологических условиях. Они считают, что при благоприятных эпидемиологических условиях и правильно поставленном выявлении «виража» с применением контролируемой химиопрофилактики в группах риска возможно увеличение интервалов между прививками БЦЖ.
Е.Ф. Чернушенко и соавт. (1991), экспериментально изучили иммунные реакции при 1-2-3-кратном введении вакцины БЦЖ и установили, что при вакцинации БЦЖ изменения в иммунной системе носят волнообразный характер, различающийся при однократном и повторном введении. Так, однократная вакцинация сопровождается активацией местных иммунных реакций, увеличением содержания ц-АМФ, особенно ц-ГМФ, в лимфоцитах, снижением их соотношения, повышением активности ферментов, усилением цитотоксических реакций и приводит к увеличению продолжительности жизни после инфицирования вакцинированных животных вирулентными микобактериями туберкулеза. Повторное введение вакцины лишь незначительно усиливает выраженность указанных изменений. Трехкратная вакцинация либо не изменяет функциональную активность иммуноцитов и обменных
процессов в них, либо ведет к ее снижению, при этом происходит также уменьшение интенсивности противотуберкулезного иммунитета.
В.П. Сухановский (1996) выступал против вакцинации в период новорожденности, так как, по его мнению, ранняя вакцинация БЦЖ с целью возбуждения реакции повышенной чувствительности замедленного типа (ПЧЗТ) нарушает порядок становления основных патогенетических реакций (завершенный фагоцитоз - антителообразование - ПЧЗТ) и существенно снижает устойчивость грудного ребенка к воздействию различных микроорганизмов, не обеспечивая при этом и должной защиты от туберкулеза. Однако, по рекомендации ВОЗ, при неблагоприятной эпидемиологической обстановке по туберкулезу целесообразно вакцинировать ребенка как можно раньше, т.е. до его встречи с вирулентными или атипичными микобактериями туберкулеза. Существует мнение, что в противном случае вакцинация БЦЖ малоэффективна. Это было подтверждено в Индии, когда вакцинировали взрослых инфицированных людей и получили нулевой результат защитного действия БЦЖ.
7.2. ЗНАЧЕНИЕ ВАКЦИНОПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА В СОВРЕМЕННЫХ УСЛОВИЯХ
В настоящее время вакцинация БЦЖ завоевала признание во многих странах мира. Она является обязательной в 64 странах и официально рекомендована в 118 странах и территориях. За последние 70 лет иммунизация против туберкулеза проведена сотням миллионов людей в большинстве стран мира. За это время накопился огромный фактический материал, позволяющий объективно определить меру влияния данного мероприятия на туберкулезную инфекцию. Конечно, в высокоразвитых странах, где заболеваемость туберкулезом невелика, вакцинируют только группы риска, например эмигрантов из стран с высокой заболеваемостью туберкулезом в районах их плотного проживания или лиц, которые могут заразиться туберкулезом от больных. К сожалению, у нас в России другая ситуация.
Тот факт, что инфицированность населения достигает 85-90%, а заболеваемость туберкулезом исчисляется сотыми и тысячными долями процента, дает основание для признания микобактерий туберкулеза микробами со слабо выраженной патогенностью.
Организм, обладающий достаточной естественной резистентностью, в большинстве случаев в состоянии самостоятельно справиться
с туберкулезной инфекцией (независимо от наличия или отсутствия на момент инфицирования специфического иммунитета). Известно, однако, что доля инфекционного начала в первичных формах туберкулеза значительно выше, чем в его вторичных формах. К тому же проявления первичной туберкулезной инфекции в большинстве случаев совпадают с младшим детским возрастом, который, в частности, характеризуется сниженной общей сопротивляемостью к инфекционным воздействиям, недостаточной дифференцированностью нейрогуморальных механизмов, склонностью к генерализации патологического процесса.
Следовательно, с биологической точки зрения детский возраст является наиболее уязвимым для туберкулезной инфекции. Повышение специфической резистентности в этих условиях оказывается эффективным средством профилактики туберкулеза. В настоящее время не вызывает сомнений целесообразность вакцинации БЦЖ детей раннего возраста в странах с неблагоприятной эпидемиологической ситуацией по туберкулезу. В то же время эффективность использования противотуберкулезной иммунизации в старших возрастных группах зарубежными авторами оценивается весьма скептически.
С 1962 г. в нашей стране внедрена методика многократной иммунизации вакциной БЦЖ детей и подростков. Главным недостатком предложенной схемы было отсутствие биологического обоснования сроков и кратности ревакцинаций; так называемые «декретированные возраста» определялись эпидемиологической опасностью миграции детей в организованных коллективах (в 7 лет - при поступлении в школу; в 11-12 лет - при переходе из начальной школы в среднюю; в 17 лет - при окончании средней школы). Выраженная положительная динамика эпидемиологических показателей по детскому туберкулезу в 60-70 годы позволила отечественным авторам сделать выводы об эффективности и обоснованности применяемых противотуберкулезных мероприятий, среди которых ревакцинации БЦЖ отводилось значительное место. В результате за прошедшие 30 лет не было ни одного эпидемиологического исследования, способного дать объективную оценку воздействия многократной иммунизации вакциной БЦЖ на эпидемиологию детского туберкулеза.
Материалы этого исследования подтверждают мнение зарубежных авторов, что противотуберкулезная вакцинация не может препятствовать (даже с общебиологических позиций) инфицированию туберкулезом. Однако существование системы многократных противотуберкулезных
прививок БЦЖ безусловно влияет на информированность фтизиатрической службы об уровне инфицированности. В течение первых 3 лет после ревакцинации практически любая положительная проба Манту расценивается как поствакцинальная аллергия (исключение составляют только выраженные и гиперергические реакции). В результате данные об инфицированности зависят в большей мере не от ее истинного уровня, а от охвата декретируемых возрастов противотуберкулезной иммунизацией. Увеличение интервалов между противотуберкулезными прививками способствовало нарастанию числа лиц с отрицательными реакциями на туберкулин при уменьшении сомнительной и положительной чувствительности к туберкулину. Следовательно, большинство сомнительных и положительных реакций на туберкулин в школьном возрасте обусловлены поствакцинальной аллергией; в этих условиях невозможно объективно судить об уровне инфицированности декретированных контингентов. Реальный уровень инфицирования туберкулезом школьников значительно ниже, чем указываемый большинством авторов исследований, проводившихся в условиях трехкратной ревакцинации БЦЖ детей и подростков. Это заключение основывается на анализе динамики чувствительности к туберкулину у одних и тех же детей в течение пяти лет эксперимента. Следует отметить, что в странах, где уровень заболеваемости туберкулезом невысок, вакцинацию БЦЖ не проводят или проводят только в группах риска, так как считают, что более обоснованным своевременно определить по туберкулиновой пробе (Манту, Тайн-тесту или др.) момент инфицирования микобактериями и начать профилактическое лечение.
Одной из причин длительного сохранения схемы 3-кратной ревакцинации БЦЖ у нас в стране являлось широко распространенное мнение о влиянии данного мероприятия на заболеваемость детей туберкулезом. Полученные в ходе нашего исследования данные позволяют утверждать, что в условиях удовлетворительной эпидемиологической ситуации полная или частичная отмена повторных прививок вакциной БЦЖ не вызвала роста заболеваемости туберкулезом детского населения. Анализ особенностей течения туберкулеза у детей и подростков позволил установить, что в школьном возрасте преобладают (в 80%) малые и неосложненные его формы. Следовательно, проведение ревакцинации в этом возрасте не может значительно улучшить клиническую структуру заболеваемости. Немногочисленные случаи торпидного течения туберкулеза, преимущественно у младших школьников, были обусловлены наличием кальцинатов в лимфатических узлах, что
свидетельствовало о возникновении заболевания еще в дошкольном возрасте. Осложненное течение заболевания с наклонностью к прогрессированию процесса отмечалось преимущественно в подростковом и раннем детском возрасте, что совпадает с мнением большинства авторов. Однако при многократной ревакцинации БЦЖ именно подростковый возраст оказывается контингентом, в котором проведение противотуберкулезной иммунизации искусственно сокращается: лишь единицы подростков подвергаются ревакцинации БЦЖ, у остальных этому препятствует наличие сомнительных и слабоположительных реакций на пробу Манту, отражающих наличие поствакцинальной аллергии после предыдущих иммунизаций.
Многочисленные исследования отечественных авторов и ежедневная практика фтизиопедиатров показывают, что одной из самых острых проблем организации противотуберкулезной помощи является несовместимость многократных ревакцинаций БЦЖ и активного выявления туберкулеза с помощью туберкулинодиагностики. Несмотря на разработанные в предыдущие годы рекомендации по определению этиологии чувствительности к туберкулину с помощью клинико-иммунологических методов исследования или организационных подходов, проблема эта теоретически и практически не решена. При многократной ревакцинации БЦЖ установить момент первичного инфицирования довольно сложно; сам факт инфицирования туберкулезом нередко констатируется при ретроспективной оценке чувствительности к туберкулину через 2-4 года после первичного инфицирования.
Одним из наиболее значимых отрицательных биологических воздействий многократной ревакцинации БЦЖ является гиперсенсибилизация организма детей. Известно, что отрицательный результат пробы Манту с 2ТЕ ППД-Л в большей степени может свидетельствовать об отсутствии инфицирования туберкулезом, нежели об отсутствии поствакцинальной аллергии. Даже через год после иммунизации БЦЖ проба Манту с 2 ТЕ может оказаться отрицательной; при этом использование других разведений туберкулина позволяет выявить поствакцинальную аллергию у большинства из этих детей. Следовательно, ревакцинации БЦЖ могут подвергаться дети, имеющие поствакцинальную аллергию после предыдущей иммунизации вакциной БЦЖ. Необоснованно частые повторные введения аллергена вызывают гиперсенсибилизацию иммунной и нейроэндокринной системы, что не только небезразлично для организма в целом, но и вряд ли способствует повышению специфического иммунитета. Многократно проводимые в школьном возрасте ревак-
цинации БЦЖ последовательно могут увеличивать удельный вес лиц, положительно реагирующих на туберкулин.
Предрасположенность к туберкулезу в определенной степени обусловлена генетическими факторами. Это подтверждается разной чувствительностью к инфекции у отдельных расовых групп, исследованиями у близнецов, а также изучением локуса HLA. Представляется вполне вероятным существование различий также и в реакциях на БЦЖ. В ряде экспериментальных исследований эта гипотеза получила подтверждение. Эксперименты на мышах позволили идентифицировать генетический локус на хромосоме 1, контролирующий резистентность к БЦЖ, а также к сальмонеллам и лейшманиям. Особый интерес представляют данные о высокой степени синтении этого региона мышиной хромосомы 1 с регионом хромосомы 2 у человека, позволяющей рассматривать его как копию этого гена. В настоящее время этот мышиный ген удалось клонировать, установить его последовательность и подтвердить его гомологичность с нижним эукариотным нитратным транспортером. Эти сведения могут иметь отношение к результатам исследований Chan и соавт. (1992), продемонстировавших способность макрофагов мыши, активированных 7-интерфероном или а-фактором некроза опухоли, продуцировать окись азота, которая оказывает токсическое воздействие на вирулентные M.tuberculosis. Отмечена более высокая эффективность вакцинации БЦЖ у европеоидного населения Джорджии и Алабамы по сравнению с негритянским населением этих штатов. Правда, при этом остались невыясненными и достоверность отмеченных различий, их связь именно с генетическими, а не иными факторами. В последнее время в Англии было проведено два исследования методами случай-контроль по изучению эффективности вакцинации БЦЖ у иммигрантов из Азии. Цель их состояла в проверке гипотезы о генетических различиях, определивших плохие результаты. Результаты обоих исследований подтвердили более высокий протективный эффект вакцинации БЦЖ у проживающих в Англии выходцев из Азии по сравнению с жителями Чинглепута.
Новые вопросы возникают в отношении вакцины БЦЖ у ВИЧинфицированных лиц. Описаны отдельные случаи диссеминированных БЦЖ-итов у детей, сведения о ВИЧ-инфицировании которых были получены уже после введения вакцины БЦЖ. У некоторых из этих детей были высеяны микобактерии бычьего типа. Правда, осталось неясным, относятся ли эти бактерии к БЦЖ или являются результатом инфицирования вирулентными M. bovis вне зависимости
от вакцинации. Успокаивающим следует считать тот факт, что случаи диссеминированных БЦЖ-итов наблюдаются редко, особенно с учетом очень большого числа детей, вакцинируемых БЦЖ ежегодно. Одним из объяснений возникновения этих осложнений может быть аттенуация штамма БЦЖ, однако наиболее вероятными представляются неправильный отбор и неверная трактовка осложнений, якобы связанных с вакциной БЦЖ. Последнее касается прежде всего стран Африки, где многие тысячи ВИЧ-инфицированных детей ежегодно вакцинируются БЦЖ. По материалам ряда исследований, введение вакцины БЦЖ не повышает частоту осложнений у ВИЧ-положительных детей по сравнению с ВИЧ-отрицательными. Эти наблюдения позволяют надеяться на существование временного промежутка, в течение которого возможна безопасная вакцинация БЦЖ у новорожденных, пока у них не развился иммунодефицит, существенно повышающий опасность возникновения диссеминированного БЦЖ-ита. В связи с этим согласно рекомендациям ВОЗ, вакцинация БЦЖ должна проводиться новорожденным, если у них отсутствуют явные признаки иммунодефицита. В то же время, генерализованная БЦЖ-инфекция исторически была болезнью младенцев, но случаи заболевания теперь встречаются у взрослых и более старших детей, коинфицированных ВИЧ. Случаи заболевания отмечались также после ревакцинации людей, у которых была анергия после первоначального применения вакцины БЦЖ. Генерализованная БЦЖ-инфекция после прививки живой вакциной рассматривается как следствие нарушения иммунитета у ребенка.
7.3. МЕТОДИКА ПРОВЕДЕНИЯ ПРИВИВКИ ПРОТИВ ТУБЕРКУЛЕЗА В СОВРЕМЕННЫХ УСЛОВИЯХ (АКТИВНАЯ СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА ТУБЕРКУЛЕЗА)
В России массовая вакцинация против туберкулеза новорожденных проводится двумя препаратами - вакциной туберкулезной (БЦЖ) и вакциной туберкулезной для щадящей первичной иммунизации (БЦЖ-М) - лиофилизатами с целью приготовления суспензий для внутрикожного введения.
Биологические и иммунологические свойства. Препараты вакцин БЦЖ и БЦЖ-М представляют собой живые микобактерии вакцинного штамма BCG-1, лиофилизированные в 1,5% растворе глютами-
ната натрия - пористая порошкообразная масса или таблетки белого или кремового цвета, гигроскопична. Вакцина БЦЖ-М - препарат с уменьшенным вдвое весовым содержанием микобактерий БЦЖ в прививочной дозе в основном за счет убитых клеток.
Живые микобактерии штамма BCG-1, размножаясь в организме привитого, приводят к развитию длительного специфического иммунитета к туберкулезу. Иммунитет, индуцированный вакциной БЦЖ, формируется примерно через 6 нед после иммунизации. Механизм защиты после прививки против туберкулеза заключается в ограничении гематогенного распространения бактерий из места первичной инфекции. Подавление гематогенного распространения возбудителей туберкулеза снижает риск развития заболевания и реактивации процесса. Главным критерием при определении методики массовой иммунизации является ее биологическая целесообразность в конкретных эпидемиологических условиях. Общепризнано, что с биологической точки зрения детский возраст является наиболее уязвимым для туберкулезной инфекции, поэтому в настоящее время в странах с неблагоприятной эпидемиологической ситуацией по туберкулезу не вызывает сомнений целесообразность вакцинации против туберкулеза детей раннего возраста. Обе эти вакцины готовят из одного и того же посевного материала - M. bovis штамм BCG-1 Russia.
Отечественный субштамм БЦЖ (BCG-1 Russia или, как его еще называют в ряде публикаций, «Москва») занимает при высокой иммуногенности среднее положение по остаточной вирулентности среди других субштаммов. Это означает, что при высоких защитных свойствах приготовленная из отечественного субштамма вакцина обладает невысокой реактогенностью, она должна вызывать не более 0,06% поствакцинальных лимфаденитов.
Качество туберкулезной вакцины (БЦЖ) зависит не только от используемого субштамма, но и от технологии ее изготовления. Живая вакцина БЦЖ состоит как из живых, так и из убитых клеток. Часть из них отмирает в процессе выращивания бактерий и изготовления препарата до высушивания, другая, более значительная, - в процессе лиофилизации. Если соотношение живых и убитых клеток в препарате высокое, то в случае применения меньших доз вакцины можно получить удовлетворительный результат и минимум нежелательных реакций. Это положение было взято за основу при разработке отечественной вакцины БЦЖ-М.
Одна ампула вакцины БЦЖ, запаянная под вакуумом, содержит 1,0 мг вакцины, что составляет 20 доз, или 0,5 мг вакцины, т.е. 10 доз. Прививочная доза содержит 0,05 мг препарата (500 000-1 500 000 жизнеспособных клеток) в 0,1 мл растворителя. Одна ампула вакцины БЦЖ-М, запаянная под вакуумом, содержит 0,5 мг вакцины, что составляет 20 доз, каждая по 0,025 мг препарата (50 0 0 00 -75 0 0 00 жизнеспособных клеток, т.е. нижний лимит живых бактерий такой же, как и в прививочной дозе вакцины БЦЖ).
Основными тестами, по которым контролируют в нашей стране препараты вакцины БЦЖ и БЦЖ-М, являются.
1. Специфическая безвредность. Авирулентный российский штамм БЦЖ-1, как и другие субштаммы, обладает некоторой стабильной остаточной вирулентностью, достаточной для обеспечения размножения микобактерий БЦЖ в организме привитого. Однако проверка препарата по этому тесту является, с одной стороны, постоянным контролем за отсутствием тенденции к усилению вирулентности штамма, а с другой - мерой предотвращения случайного попадания на производство вирулентного штамма микобактерий.
2. Отсутствие посторонней микрофлоры. Технология производства вакцины БЦЖ не предусматривает использование консерванта, поэтому возможность контаминации препарата должна контролироваться особенно тщательно.
3. Общее содержание бактерий. Тест является важным показателем стандартности препарата, недостаточное количество бакмассы может привести к низкой напряженности противотуберкулезного иммунитета, а увеличенное содержание бактерий - к нежелательным поствакцинальным осложнениям.
4. Число жизнеспособных бактерий в препарате (специфическая активность вакцины). Снижение количества жизнеспособных особей в препарате приводит к нарушению соотношения числа живых и убитых бактерий, что в свою очередь приводит к недостаточному защитному эффекту вакцины. Увеличение числа жизнеспособных клеток может привести к повышенному количеству осложнений на введение вакцины.
5. Дисперсность. Вакцина БЦЖ после растворения имеет вид грубодисперсной суспензии, однако содержащий большое количество конгломератов бактерий, что может вызвать осложненную местную реакцию и лимфадениты у привитых, поэтому показатель дисперсности должен быть не ниже 1,5.
6. Термостабильность. Вакцина БЦЖ достаточно термостабильна. При хранении в термостате в течение 28 дней сохраняется не менее 30% жизнеспособных клеток БЦЖ. Этот тест позволяет подтвердить, что при условии правильного хранения препарата вакцина будет сохранять первоначальную жизнеспособность в течение всего срока годности, указанного на этикетке.
7. Растворимость. При добавлении в ампулу растворителя в течение 1 мин вакцина должна раствориться.
8. Наличие вакуума. Вакцина находится в ампуле под вакуумом. Согласно инструкции по применению препарата персонал, проводящий вакцинацию, обязан проверить целостность ампулы и состояние таблетки и уметь правильно ее вскрывать.
В нашей стране вакцины БЦЖ и БЦЖ-М производят предприятия «Медгамал» НИИ эпидемиологии и микробиологии им.Н.Ф. Гамалея (Москва) и ФГУП «Микроген» «филиал «Аллерген» (Ставрополь). Каждая серия препарата на производстве проходит контроль по всем вышеуказанным тестам. На предприятиях существуют отделы биотехнологического контроля, которые также проверяют каждую серию вакцины и дают разрешение на ее выпуск. В последние годы с учетом того, что туберкулезная вакцина является препаратом календаря прививок и предназначена для новорожденных детей, каждую серию вакцин по отдельнымтестамконтролируеттакжеНациональныйорганконтроля- ФГУН ГИСК им. Л.А. Тарасевича, в котором выборочно около 10% серий проверяют по всем тестам. Все вышеизложенное обеспечивает высокое качество отечественных вакцин БЦЖ и БЦЖ-М.
Форма выпуска. В ампулах, содержащих 0,5 или 1,0 мг препарата БЦЖ (10 или 20 доз соответственно) и 0,5 мг препарата БЦЖ-М (20 доз), в комплекте с растворителем (0,9% раствором натрия хлорида) по 1,0 или 2,0 мл в ампуле для вакцины БЦЖ соответственно и 2,0 мл в ампуле для вакцины БЦЖ-М.
В одной коробке содержится 5 ампул вакцины БЦЖ или БЦЖ-М и 5 ампул 0,9% раствора натрия хлорида (5 комплектов).
Условия хранения и транспортирования. Препарат следует хранить при температуре не выше +8 С. Срок годности вакцин БЦЖ - 2 года и БЦЖ-М - 1 год. Транспортировка всеми видами транспорта при температуре не выше +8 С.
7.3.1 Техника проведения прививки
Прививки против туберкулеза должен проводить специально обученный медицинский персонал родильного дома, отделения
выхаживания недоношенных, детской поликлиники и фельдшерско-акушерского пункта.
Первичную вакцинацию осуществляют здоровым доношенным новорожденным детям на 3-7 день жизни.
Ревакцинации подлежат дети в возрасте 7 и 14 лет, с отрицательной реакцией на пробу Манту с 2 ТЕ ППД-Л.
Первую ревакцинацию детей (вакцинированных при рождении) проводят в возрасте 6-7 лет (учащиеся 1-х классов); вторую ревакцинацию детей производят в возрасте 14-15 лет (учащиеся 9-х классов и подростки средних специальных учебных заведений на первом году обучения).
Вакцинацию новорожденных выполняют в утренние часы в специально отведенной комнате после осмотра детей педиатром. Проведение прививок на дому запрещается. В поликлиниках отбор детей, подлежащих прививкам, предварительно проводит врач (фельдшер) с обязательной термометрией в день прививки, с учетом медицинских противопоказаний и данных анамнеза, с обязательным клиническим исследованием крови и мочи. Во избежание контаминации недопустимо совмещение в один день прививки против туберкулеза с другими парентеральными манипуляциями, включая забор крови на фенилкетонурию и врожденный гипотиреоз. При несоблюдении требований, предъявляемых к проведению вакцинации, риск поствакцинальных осложнений увеличивается.
Дети, которым не была проведена вакцинация в первые дни жизни, делают прививки в течение первых 2-х мес в детской поликлинике или в другом профилактическом учреждении без предварительной туберкулинодиагностики. Детям старше 2-месячного возраста перед иммунизацией необходима предварительная постановка пробы Манту с 2ТЕ очищенного туберкулина в стандартном разведении. Прививки делают детям с отрицательной реакцией на туберкулин. Реакцию считают отрицательной при полном отсутствии инфильтрата (гиперемии) или при наличии уколочной реакции (1мм). Интервал между пробой Манту и иммунизацией должен быть не менее 3 дней (день учета реакции на пробу Манту) и не более 2 нед. Другие профилактические прививки могут быть выполнены с интервалом не менее 1 мес до или после прививки против туберкулеза. Вакцину БЦЖ применяют внутрикожно в дозе 0,05 мг в 0,1 мл растворителя, вакцину БЦЖ-М - в дозе 0,025 мг в 0,1 мл растворителя. Ампулы с вакциной перед вскрытием тщательно просматривают.
Препарат не подлежит применению:
• при отсутствии этикетки или при неправильно заполненной этикетке на ампуле;
• при истекшем сроке годности;
• при наличии трещин и насечек на ампуле;
• при изменении физических свойств (сморщивание таблетки, изменение цвета и т.д.);
• при наличии посторонних включений или неразбивающихся хлопьев в разведенном препарате.
Сухую вакцину разводят непосредственно перед употреблением стерильным 0,9% раствором натрия хлорида, приложенным к вакцине. Растворитель должен быть прозрачным, бесцветным и не иметь посторонних примесей.
Поскольку вакцина в ампуле находится под вакуумом, то сначала, обтерев спиртом шейку и головку ампулы, надпиливают и осторожно, с помощью пинцета, отламывают место запайки (головку). Только после этого можно надпиливать и отламывать шейку ампулы, завернув надпиленный конец в стерильную марлевую салфетку.
В ампулу с вакциной переносят стерильным шприцем с длинной иглой необходимое количество 0,9% раствора натрия хлорида. Вакцина должна полностью растворяться в течение 1 мин после 2-3-кратного встряхивания. Не допускается выпадение осадка или образование хлопьев, не разбивающихся при встряхивании. Разведенную вакцину необходимо предохранять от действия солнечного и дневного света (цилиндр из черной бумаги) и употреблять сразу после разведения. Для иммунизации у каждого ребенка применяют отдельный одноразовый стерильный шприц вместимостью 1,0 мл с плотно пригнанными поршнями и тонкими иглами (N0415) с коротким срезом. Перед каждым набором вакцину обязательно тщательно перемешивают с помощью шприца 2-3 раза.
Для одной прививки стерильным шприцем набирают 0,2 мл (2 дозы) разведенной вакцины, затем выпускают через иглу в ватный тампон 0,1 мл вакцины, чтобы вытеснить воздух и подвести поршень шприца под нужную градуировку - 0,1 мл недопустимо выпускать вакцину в воздух или защитный колпачок иглы, так как это приводит к контаминации окружающей среды и рук вакцинатора живыми микобактериями. Одним шприцем вакцина может быть введена только одному ребенку.
Вакцину вводят строго внутрикожно на границе верхней и средней трети наружной поверхности левого плеча после предварительной обработки кожи 70% спиртом. Иглу вводят срезом вверх в поверхностный слой
кожи. Сначала вводят незначительное количество вакцины, чтобы убедиться, что игла вошла точно внутрикожно, а затем - всю дозу препарата (всего 0,1 мл). Введение препарата под кожу недопустимо, так как при этом формируется холодный абсцесс. При правильной технике введения должна образоваться папула беловатого цвета не менее 7-8 мм, исчезающая обычно через 15-20 мин. Запрещают наложение повязки и обработку места введения вакцины йодом и другими дезинфицирующими растворами.
В комнате для прививок проводится разведение и хранение вакцины в холодильнике (под замком). Лица, не имеющие отношения к иммунизации БЦЖ и БЦЖ-М, в прививочную комнату не допускаются. Запрещается применять шприцы и иглы с истекшим сроком годности и безигольные инъекторы. После каждой инъекции шприц с иглой и ватные тампоны замачивают в дезинфицирующем растворе (5% хлорамин), после чего централизованно уничтожается.
В исключительных случаях разведенная вакцина может быть использована при строгом соблюдении стерильности и защиты от действия солнечного и дневного света в течение 2 ч. Неиспользованную вакцину уничтожают кипячением или погружением в дезинфицирующий раствор (5% раствор хлорамина). Запрещается применение для других целей инструментов, предназначенных для проведения прививок против туберкулеза.
Реакция на введение вакцины. На месте внутрикожного введения вакцины БЦЖ и БЦЖ-М развивается специфическая реакция в виде инфильтрата диаметром 5-10 мм с небольшим узелком в центре и с образованием корочки по типу оспенной, в ряде случаев отмечается пустуляция. Иногда в центре инфильтрата появляется небольшой некроз с незначительным серозным отделяемым.
У новорожденных нормальная прививочная реакция появляется через 4-6 нед. У ревакцинированных местная прививочная реакция развивается через 1-2 нед. Место реакции следует предохранять от механического раздражения, особенно во время водных процедур. Не следует накладывать повязки или обрабатывать место реакции, о чем родители должны быть предупреждены. Реакция подвергается обратному развитию в течение 2-3 мес, иногда и в более длительные сроки. У 90-95% привитых на месте прививки должен образоваться поверхностный рубчик диаметром до 10 мм. Наблюдение за привитыми детьми проводят врачи и медицинские сестры общей лечебной сети, которые через 1, 3 и 12 мес после иммунизации должны проверить прививочную реакцию с регистрацией размера и характера местной реакции:
• папула,
• пустула с образованием корочки (с отделяемым или без него),
• рубчик,
• пигментация и т.п.
Противопоказания к вакцинации БЦЖ и БЦЖ-М. К введению БЦЖ-М - масса тела при рождении менее 2000 г. К введению БЦЖ.
I. Недоношенность. Масса тела при рождении менее 2500 г.
II. Острые заболевания.
1. Внутриутробная инфекция.
2. Гнойно-септические заболевания.
3. Гемолитическая болезнь новорожденных, среднетяжелой и тяжелой формы.
4. Тяжелые поражения нервной системы с выраженной неврологической симптоматикой.
5. Генерализованные кожные поражения.
III. Первичное иммунодефицитное состояние, злокачественные новообразования.
IV. Генерализованная БЦЖ-инфекция, выявленная у других детей в семье.
V. ВИЧ-инфекция:
а) у ребенка с клиническими проявлениями вторичных заболеваний;
б) у матери новорожденного, если она не получала во время беременности антиретровирусную терапию.
Детям, освобожденным от прививок в родильном доме, проводят щадящую вакцинацию препаратом БЦЖ-М через 1-6 мес после выздоровления. При назначении иммунодепрессантов и лучевой терапии прививку проводят через 12 мес после окончания лечения.
Вакциной БЦЖ-М прививают:
• в родильном доме - недоношенных новорожденных с массой тела 2000-2500 г, при восстановлении первоначальной массы тела - за день перед выпиской на дом;
• в отделениях выхаживания недоношенных новорожденных лечебных стационаров (второй этап выхаживания) - детей с массой тела 2300 г и более - перед выпиской из стационара домой;
• в детских поликлиниках - детей, не получивших прививку в родильном доме по медицинским противопоказаниям и подлежащих вакцинации в связи со снятием противопоказаний;
• на территориях с удовлетворительной эпидемиологической ситуа-
цией по туберкулезу - всех новорожденных, на территориях с заболеваемостью туберкулезом до 80 на 100 000 по решению местных органов здравоохранения - всех новорожденных.
Противопоказания к ревакцинации детей и подростков
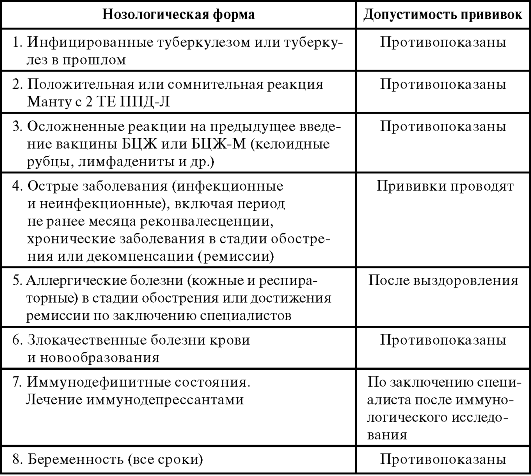 При контакте с инфекционными больными в семье, детском учреждении и т.д. прививки проводят по окончании срока карантина.
При контакте с инфекционными больными в семье, детском учреждении и т.д. прививки проводят по окончании срока карантина.
Лица, временно освобожденные от прививок, должны быть взяты под наблюдение и учет и привиты после полного выздоровления или снятия противопоказаний. В случае необходимости проводят соответствующие клинико-лабораторные обследования. В каждом отдельном случае, который не содержится в настоящем перечне, иммунизацию против туберкулеза проводят по разрешению соответствующего врача-специалиста.
7.4. ОСЛОЖНЕНИЯ ПОСЛЕ ВАКЦИНАЦИИ И РЕВАКЦИНАЦИИ ПРОТИВ ТУБЕРКУЛЕЗА
7.4.1. Частота и причины возникновения
Противотуберкулезная вакцина - препарат из живых аттенуированных бактерий БЦЖ, поэтому избежать поствакцинальных осложнений не удается. Осложнения при вакцинации БЦЖ известны давно и по существу сопутствуют ей с начала ее массового применения.
До 1962 г. применялась пероральная, а затем накожная вакцина БЦЖ; в качестве осложнений описывались шейные лимфадениты, причем эти осложнения носили распространенный характер и встречались в довоенные годы у значительного числа детей в различных городах СССР. Позже в качестве осложнений пероральной вакцины БЦЖ были описаны грануляционные отиты. Переход на накожный, а затем на внутрикожный метод введения вакцины изменил структуру поствакцинальных осложнений.
По классификации, предложенной Международным Союзом по борьбе с туберкулезом (ВОЗ, 1984), осложнения, возникающие при вакцинации БЦЖ подразделяют на 4 категории:
• 1-я категория: локальные поражения (подкожные инфильтраты, холодные абсцессы, язвы) и регионарные лимфадениты;
• 2-я категория: персистирующая и диссеминированная БЦЖ инфекция без летального исхода (волчанка, оститы);
• 3-я категория: диссеминированная БЦЖ-инфекция, генерализованное поражение с летальным исходом, которое отмечается при врожденном иммунодефиците;
• 4-я категория: пост-БЦЖ-синдром (узловатая эритема, кольцевидная гранулема, сыпи).
В последние годы широко обсуждается проблема отрицательного действия вакцины из-за возможного возникновения поствакцинальных осложнений. Исследование, проведенное в 6 странах Европы, выявило широкие различия в риске возникновения осложнений после введения вакцины в разных странах - от очень низкого (0,001%) в Румынии и Германии до очень высокого (0,62-1,72%) в Венгрии и Югославии. В нашей стране частота регистрируемых осложнений намного ниже, чем в других европейских странах, что связано с качеством вакцины, а также с недостаточной диагностикой этого заболевания, так как дети с осложнениями после введения вакцины не всегда попадают на прием к фтизиатру. Вопросы клинического наблюдения
и лечения поствакцинальных осложнений решают врачи общей клинической сети, как педиатры, так и хирурги.
Осложнения диагностируются у детей в различные сроки от момента введения туберкулезной вакцины. В первые 6 мес после прививки диагностируются 68,7% осложнений, в срок от 6 до 12 мес - 11,6%, через год и позже после прививки - 19,7%.
Таким образом, в условиях тяжелой эпидемической ситуации по туберкулезу дети с осложнениями после иммунизации туберкулезной вакциной вызывают особую тревогу, поэтому при проведении комплекса организационных действий по своевременному выявлению заболевания, последующему лечению и диспансерному наблюдению за детьми с данной патологией важно соблюдать этапность врачебных мероприятий со стороны как педиатров, так и фтизиатров.
Алгоритм действия врача включает следующие этапы обследования ребенка после введения ему противотуберкулезной вакцины.
При осмотре педиатром в условиях детской поликлиники необходимо помнить, что каждый ребенок, привитый внутрикожно туберкулезной вакциной, до заживления местной прививочной реакции осматривается педиатром возрасте 1, 3 и 6 мес. При осмотре педиатр обращает внимание на место введения вакцины и состояние регионарных (шейных, подмышечных, над- и подключичных) лимфатических узлов. Значительное - свыше 10 мм, изъязвление на месте введения вакцины, увеличение свыше 10 мм одного из указанных периферических лимфатических узлов или длительное, свыше 6 мес, незаживление местной прививочной реакции - являются показанием для направления ребенка на консультацию к детскому фтизиатру.
Согласно приказу МЗ РФ от 22 ноября 1995 г. ?324 и указанию МЗ РФ от 6 июня 1994 г. N 13-01/13-20 при Российском НИИ фтизиопульмонологии МЗ РФ (ныне НИИ ФП ММА имени И.М. Сеченова) создан Республиканский центр по осложнениям противотуберкулезной вакцинации. Все случаи осложнений после прививки вакциной БЦЖ у детей и подростков Российской Федерации регистрируются и анализируются в данном центре. Так, в 1995 г. в России зарегистрировано 442 случая осложнений после прививки против туберкулеза, в 1996 г. - 496, из них 369 детей привито в 1995 г. Из 369 осложнений после вакцинации и ревакцинации БЦЖ на различныхтерриторияхРоссии 54,5% составлялилимфадениты, 27,9% - холодные абсцессы, 7,3% - инфильтраты, 8,1% - язвы, 1,9% -
келоидные рубцы, 0,3% - оститы. В структуре осложнений, развившихся после вакцинации в поликлинике и после ревакцинации, чаще отмечались холодные абсцессы (50,8 и 33,0% соответственно), а после вакцинации в родильном доме - лимфадениты (71,4%).
Наиболее часто осложнения встречались у детей раннего возраста. Показатель частоты поствакцинальных осложнений составил 21,1 на 100 тыс. привитых (0,021%) в 1995 г. Большую группу составили дети с осложнениями после вакцинации - 30,7 (0,031%), а после ревакцинации - 10,9 (0,011%). Показатели частоты осложнений по структуре среди всех привитых выглядели следующим образом: лимфадениты-11,5(0,01%),холодныеабсцессы - 5,9(0,06%),язвы- 1,7 (0,002%), инфильтраты - 1,5 (0,002%), келоидные рубцы - 0,4 (0,0004%), оститы - 0,06 (0,00006%).
Анализ показателей частоты осложнений после вакцинации и ревакцинации БЦЖ как в целом по России, так и в регионах свидетельствует о важности оценки состояния вакцинопрофилактики для обоснования мероприятий по снижению поствакцинальной патологии. Изучение этих показателей на всех территориях выявило резкое их различие между территориями, как среди вакцинированных и ревакцинированных, так и по видам осложнений. Это объясняется прежде всего уровнем организации противотуберкулезной службы по вакцинопрофилактике на каждой территории (подготовка кадров, проводящих прививку против туберкулеза, контроль за ее проведением). Кроме того, число осложнений растет по мере улучшения их регистрации.
По литературным данным, возникновение лимфаденитов зависит от качества вакцины, ее дозы, возраста вакцинируемого и техники внутрикожного введения вакцины. Холодные абсцессы, как правило, являются результатом нарушения техники введения вакцины, когда препарат попадает под кожу, однако нельзя полностью отрицать и влияние качества вакцины на возникновение этого осложнения. При несвоевременном обнаружении холодного абсцесса он вскрывается самопроизвольно и на его месте образуется язва, поэтому данное осложнение обусловлено теми же причинами, что и предыдущее. Инфильтраты формируются при бурно протекающей местной прививочной реакции. Келоидные рубцы являются следствием реактивности организма привитого, в их возникновении большую роль играют нарушение техники введения и выбор места введения вакцины. При появлении осложнений
в виде остита имеет значение активное выявление, штамм БЦЖ, технология приготовления вакцины. Диссеминированная БЦЖинфекция как осложнение на вакцинацию связана с иммунодефицитом прививаемого и является чрезвычайно редким осложнением.
Таким образом общепризнано, что причинами возникновения поствакцинальных осложнений являются: биологические свойства штамма БЦЖ, количество жизнеспособных единиц в прививочной дозе, нарушения техники введения вакцины, неправильный отбор детей на вакцинацию, возраст ребенка, измененная реактивность детей, сопутствующая патология и т.д.
В России анализ всех причин осложнений после прививки против туберкулеза у детей позволил получить более полную и новую информацию. Так, осложнения чаще встречались при использовании вакцин БЦЖ, риск возникновения осложнений снижался в 2 раза при применении вакцины БЦЖ-М. Факторами риска в возникновении осложнений после прививки против туберкулеза являлись сопутствующая патология у ребенка (42,3%) и нарушение техники внутрикожного введения вакцины (37,8%). У детей с осложнениями, развившимися после вакцинации в поликлинике, в 77,3% случаях отмечена сопутствующая патология до прививки и в момент развития местной прививочной реакции, а у детей с осложнениями, развившимися после ревакцинации, в 67,1% случаев выявлено нарушение техники внутрикожного введения вакцины. Дети с сопутствующей патологией до прививки и в момент развития местной прививочной реакции нами отнесены к группе риска развития поствакцинальных осложнений, в связи с этим их необходимо вакцинировать препаратом для щадящей иммунизации - вакциной БЦЖ-М.
Таким образом, чрезвычайно актуальным в настоящее время представляется работа с медицинским персоналом по улучшению техники внутрикожного введения вакцины и контролю за проведением вакцинопрофилактики. Необходимо более широко использовать для вакцинации в родильном доме, а также в отделениях выхаживания недоношенных новорожденных лечебных стационаров и в детских поликлиниках вакцину БЦЖ-М.
7.4.2. Клинические проявления
В России анализ основных клинических признаков и характера течения всех выявленных осложнений у детей показал, что в основ-
ном все они развивались в виде воспалительных изменений на месте прививочной реакции или в регионарных лимфатических узлах. Осложнения в виде келоидных рубцов возникли в результате патологического заживления местной прививочной реакции. Тяжелые осложнения, вызванные БЦЖ, крайне редки и риск их гораздо ниже.
Осложнения воспалительного характера проявляются, как правило, в период развития местной прививочной реакции. Значительно реже они возникают в более отдаленные сроки - через 1-2 года, крайне редко через 3-4 года после вакцинации. В целях своевременного выявления осложнения педиатр информирует мать о нормальной реакции на введение вакцины. Ребенка, получившего вакцину, до заживления местной прививочной реакции периодически осматривает участковый педиатр.
Лимфадениты. Из осложнений воспалительного характера чаще поражаются лимфатические узлы аксиллярной (подмышечной) области, выявляемые в основном у детей раннего возраста. Подмышечные лимфадениты - наиболее тяжелый вид осложнения. Их появление различно по времени, чаще они возникают в период развития местной прививочной реакции - от 1 до 4 мес с момента введения вакцины. Возможно и более позднее увеличение и нагноение лимфатических узлов. Заболевание начинается постепенно. Мать, купая ребенка, обращает внимание на увеличение лимфатического узла в левой подмышечной области, иногда в надили подключичной областях. Постепенно лимфатический узел продолжает увеличиваться. Ко времени обращения к врачу узел достигает размера фасоли или лесного ореха. Консистенция пораженного лимфатического узла вначале мягкая, эластическая, позже - плотная. Пальпация лимфатического узла безболезненна, кожа над ним не изменена или слегка розоватого цвета, местно температура нормальная. Эти признаки позволяют врачу, особенно при поздно возникшем осложнении, правильно определить этиологию заболевания.
Чем меньше ребенок, тем быстрее развиваются клинические проявления, через 1-2 мес размер лимфатического узла достигает величины грецкого ореха. При отсутствии лечения в центре узла наблюдается размягчение, быстро приводящее к тотальной казеизации лимфатического узла, прорыву казеозных масс, образованию свища с умеренным или обильным гнойным отделяемым. Как правило, даже при свищевых формах, особенно в первый месяц заболевания, жалобы у ребенка отсутствуют, позже при отсутствии лечения возможно раз-
витие симптомов интоксикации (субфебрильная температура, нарушение аппетита, вялость, раздражительность, плохая прибавка массы тела, анемия, увеличение печени). При назначении лечения быстро, уже через 2-2,5 нед, жалобы исчезают.
Для исключения ошибок в диагностике, несмотря на характерную клиническую картину поствакцинального лимфаденита, используют лабораторные методы исследования. В центре, т.е. в месте наиболее выраженного размягчения лимфатического узла, проводят пункцию, извлекают его содержимое. Приготовленные мазки необходимы для цитологического и бактериоскопического методов исследования. Кроме того, пунктат в стерильной пробирке исследуют бактериологически (посев на неспецифическую флору и микобактерии туберкулеза).
При цитологическом исследовании пунктата в поле зрения определяются лейкоциты, разрушенные нейтрофилы и глыбки казеоза. Последние подтверждают правильность диагноза. Эпителиоидные клетки встречаются редко. Бактериоскопическое исследование мазка методом люминесцентной микроскопии нередко обнаруживает в поле зрения немногочисленные кислотоупорные микобактерии (БЦЖ). Посев на неспецифическую флору через 5-6 дней дает отрицательный результат. Посев на МБТ через 2-3 мес сопровождается ростом микобактерий, при типировании подтверждается их принадлежность к БЦЖ.
Инфильтрат формируется в месте введения вакцины с нагноением в центре или его отсутствием; размер инфильтрата от 15 до 30 мм Крайне редко отмечаются инфильтраты большего размера. Появление инфильтрата может сочетаться с реакцией регионарных лимфатических узлов, которые увеличиваются до 10 мм, консистенция их мягкоэластическая. При благоприятном течении через 2 нед от начала лечения реакция лимфатических узлов стихает и они либо перестают определяться, либо уменьшаются до I-II размеров. Постановка диагноза не вызывает затруднений, так как возникают инфильтраты в течение первого или второго месяца после прививки.
Холодный абсцесс (скрофулодерма) - опухолевидное образование, кожа над которым не изменена или имеет бледно-розовое окрашивание, температура местно не повышена, пальпация безболезненна, в центре определяется флюктуация (размягчение). Холодный абсцесс нередко сочетается с реакцией подмышечных лимфатических узлов слева, которые увеличиваются до 10 мм, становятся тестоватой консистенции. Наряду с клиническими проявлениями правильность диагно-
за подтверждается лабораторными методами исследования пунктата, который получают из места наибольшего размягчения абсцесса.
По нашим данным, у детей с осложнениями после вакцинации в родильном доме лимфадениты зарегистрированы в 77,1% случаев, а холодные абсцессы - в 19,1%. У детей же с осложнениями после вакцинации в поликлинике холодные абсцессы наблюдали в 63% случаев, а лимфадениты - в 37%. Таким образом, осложнения в виде холодных абсцессов у детей, привитых в поликлинике, по сравнению с вакцинированными в роддомах встречаются в 3,3 раза чаще. Говоря о холодных абсцессах, мы подразумеваем нарушение техники введения вакцины, что свидетельствует о более низкой подготовке медперсонала в поликлиниках.
В случае несвоевременного диагностирования холодного абсцесса, он самопроизвольно вскрывается, и на его месте образуется язва.
Язва как вид осложнения характеризуется значительными размерами - от 10 до 20-30 мм в диаметре, края ее подрыты, инфильтрация вокруг выражена слабо, что отличает ее от инфильтрата с изъязвлением в центре, дно покрыто обильным гнойным отделяемым. И в этом случае диагностика не вызывает затруднений. Исследования по приведенной выше схеме подтверждают связь возникновения язвы с введением вакцины. Посев содержимого язвы на неспецифическую флору часто дает отрицательный результат, также подтверждающий этиологию заболевания.
Келоидный рубец (от греч. keleis - опухоль и eidos - вид, сходство). По своим морфологическим и гистохимическим свойствам келоидный рубец после БЦЖ ничем не отличается от келоидной ткани, возникшей самопроизвольно или по другим причинам, чаще после травмы. Ведущей клеточной формой в соединительной ткани келоидных рубцов являются функционально активные фибробласты с хорошо развитым гранулярным эндоплазматическим ретикулумом и пластинчатым комплексом. Причины развития келоидной ткани вообще и на месте постпрививочного рубца в частности до настоящего времени не известны, однако имеется ряд факторов, предрасполагающих к их возникновение. К ним относятся период препубертатного и пубертатного развития ребенка, наследственная предрасположенность (недостаточная состоятельность развития соединительной ткани), травма, длительно не заживающая местная прививочная реакция. Нельзя исключить и влияние самой вакцины БЦЖ, повторно вводимой при ревакцинациях.
Как правило, келоидные рубцы наблюдаются у детей школьного возраста после ревакцинации и крайне редко - после первич-
ной вакцинации. Келоидный рубец представляет собой опухолевидное образование различной величины, возвышающееся над уровнем кожи, имеет плотную, иногда хрящевидную консистенцию. Основной признак - наличие капилляров в толще келоида, которые хорошо видны при его осмотре. Форма рубца округлая, эллипсовидная, иногда звездчатая. Поверхность рубца гладкая (глянцевидная). Окраска различная - от бледно-розовой, интенсивно розовой с синюшным оттенком до коричневатой. При диагностике келоидных рубцов их следует дифференцировать от гипертрофических рубцов. Последние почти не возвышаются над уровнем кожи, белого или слегка розоватого цвета, поверхность их неровная, в толще никогда не определяется сеть капилляров.
Кроме того, правильной диагностике помогает динамика развития: келоидный рубец, как правило, медленно, но непрерывно увеличивается, сопровождаясь зудом в его окружении. Гипертрофический рубец не вызывает зуда и постепенно рассасывается. В процессе наблюдения врачу следует выяснить характер рубца - растущий это или нерастущий келоидный рубец, так как в 2-5% случаях рост келоидов прекращается самостоятельно. Размер этих рубцов не превышает 10 мм в диаметре. Ответ на этот вопрос может дать только наблюдение за ребенком и подростком в течение 2 лет после ревакцинации БЦЖ. При диагностировании нерастущего келоидного рубца, пациент не ранее чем через 2 года от момента выявления снимается с диспансерного учета. Рост келоидов медленный. За год рубец увеличивается на 2-5 мм. Постепенно появляется чувство зуда в его области. Чем длительнее существует келоидный рубец, своевременно не диагностированный, тем сильнее выражено чувство зуда. В дальнейшем к зуду присоединяются неприятные болевые ощущения, распространяющиеся на плечо.
БЦЖ-оститы. Хромота и нежелание ходить являются наиболее ранними проявлениями болезни. Острое начало связано с прорывом бессимптомного костного очага в полость сустава. При поражении сустава определяются припухлость, сглаженность контуров, локальное повышение кожной температуры без гиперемии - «белая опухоль» с ригидностью и атрофией мышц конечности, нарастающая локальная болезненность при пальпации и осевой нагрузке, ограничение объема движений, может быть выпот в полость сустава (определяется по наличию флюктуации, баллотированию надколенника, вынужденному положению конечности), нарушение походки. При далеко зашедшем поражении наблюдается контрактура суставов,
натечные абсцессы, свищи. Ухудшается общее состояние, отмечается умеренное повышение температуры тела.
Ткань и кость как органы у ребенка отличаются высокой биологической активностью, а также имеют свои особенности архитектоники костных балок, костных сосудов с характерной для детей максимальной васкуляризацией костных пластинок, с «концевым» характером эпифизарных сосудов, особым богатством костного мозга миелоидными элементами. Все это определяет преимущественную локализацию костных поражений в эпиметафизарных отделах костей, большую протяженность разрушения, а также неизбежную деформацию кости, наступающую, как правило, по эпифизарным хрящевым зонам, - эпифизеолизы.
При подозрении на БЦЖ-остит дополнительно получают обзорные рентгенограммы пораженного отдела в двух проекциях или проводят компьютерное томографическое исследование, что позволяет выявить характерные признаки патологии, регионарный остеопороз, атрофию кости, очаги деструкции в эпиметафизарных отделах длинных трубчатых костей с тенями плотных включений, секвестров, контактную деструкцию суставных поверхностей, сужение суставной щели, уплотнение теней мягких тканей суставов. Необходимо также провести рентгенографическое обследование всех членов семьи, включая не только мать и отца пациента, но и бабушек, дедушек и прочих родственников, контактировавших с ребенком).
Диагностика БЦЖ-оститов до настоящего времени остается сложной прежде всего из-за особенностей течения болезни и трудности лабораторного подтверждения возбудителя, идентификация которых требует исследований, доступных не всем лабораториям и не всегда дающих положительный ответ. Это обусловлено не только техническим обеспечением лабораторных исследований, но и свойствами микобактерий, активность которых снижается под действием ранее принимаемых противотуберкулезных препаратов.
Быстрый и весьма простой метод видовой идентификации был разработан A. Telenti и соавт. С помощью ПЦР амплифицируют фрагмент гена, кодирующего белок теплового шока 65 кД, общий для большинства микобактериальных видов, размером 439 нуклеотидных пар. Затем этот фрагмент подвергают обработке с помощью двух рестрикционных фрагментов - Bste II и Hae III. При электрофорезе в геле 4% агарозы наблюдается характерный набор полос, исходя из результатов рестрикции двумя фрагментами. Получают
фрагменты ДНК микобактерий размерами (нуклеотидных пар). С помощью ПЦР может быть проведена видовая идентификация, в том числе идентификация штамма M. bovis BCG. Для этого анализируют наличие или отсутствие некоторых генов в геномных областях RD1, RD9 и RD10. RD1 отсутствует в M. bovis (BCG), но присутствует в вирулентных штаммах M. bovis. Применение ПЦР с использованием 3 -праймерной системы, позволяющей определить отсутствующий в M. bovis BCG участок ДНК, открыло возможность дифференцирования культуры M. bovis BCG от M. tuberculosis и M. bovis. При этом амплификат лизированный в тритоне Х100 культуры M. bovis BCG демонстрирует в стандартном агарозном гельэлектрофорезе фрагмент ДНК около 200 нуклеотидных пар, тогда как другие виды микобактерий туберкулезного комплекса - фрагмент около 150 нуклеотидных пар.
Интересна методика определения ДНК-микробиочипов. Данная технология была предложена компанией Affimetrix (США). В этой системе проводят аналогичную ПЦР-амплификацию вариабельной области 16БгРНК с образованием ампликонов, меченных флюоресцеином, и последующей гибридизацией с ДНК-зондами (олигонуклеотидами) при высокой плотности их фиксации в микроучастках. Анализ регистрируется сканированием флюоресцирующих участков. Была продемонстрирована идентификация 54 видов микобактерий, в том числе и M. bovis BCG. Однако даже при таких новейших методиках выделить возбудителя - по-прежнему задача не из легких.
По данным многолетних исследований, проведенных в разных странах мира (Швеция, Чехия, Финляндия, Чили), частота костных осложнений вакцинации БЦЖ значительно колеблется - от 3,2 до 36,9 на 100 тыс. вакцинированных. Сводная статистика свидетельствует о том, что частота БЦЖ-оститов тем выше, чем более совершенны в них системы национального учета осложнений вакцинации, уровень профилактической работы, а также свойства применяемой вакцины.
Так, по данным литературы, в 1971 г. в Швеции из 27 больных БЦЖ-оститами только у 4 (14,8%) диагноз был подтвержден бактериологически. В Финляндии - средняя частота бактериологического подтверждения БЦЖ - оститов за 1960-1988 г. составила 56%, а за 1976-1979 гг. - 67%. В Санкт-Петербурге частота бактериологического подтверждения диагноза БЦЖ-остита с учетом результатов методов посева и ПЦР составляет 30%. Так как же поставить диагноз БЦЖостит?
Разработаны критерии, на основании которых возможна постановка этого диагноза:
1) наличие факта вакцинации БЦЖ на первом году жизни, возраст ребенка до 2 лет (включительно);
2) отсутствие контакта с туберкулезным больным;
3) несоответствие обширной деструкции кости при рентгенографическом обследовании и спокойного малосимптомного течения процесса;
4) отсутствие локального процесса в легких и других органах при обследовании;
5) наличие хотя бы одного из следующих признаков:
- выделение бактериального штамма БЦЖ из костного очага;
- выявление кислотоустойчивых микобактерий в мазках из костного очага;
- гистологическое подтверждение туберкулезного поражения кости.
Совокупность всех этих критериев дает основание ставить диагноз БЦЖ-остита.
Следует отметить, что у детей раннего возраста происходит быстрое нарастание деструктивных изменений в костной ткани, следовательно, важно как можно скорее госпитализировать ребенка в специализированное учреждение для проведения оперативного лечения. Ранняя диагностика заболевания требует от педиатров общей лечебной сети знания этой патологии. Дети с опухолевидными образованиями и деструктивными изменениями в костной ткани, подтвержденными рентгенографически, в обязательном порядке должны консультироваться детским фтизиатром, онкологом и другими специалистами.
Чаще1 всего у детей поражаются трубчатые кости.
Беспокоит тот факт, что по-прежнему встречаются БЦЖ-оститы с поражением костей стопы. При расследовании этих случаев отмечены грубые нарушения инструкции по применению препарата, а именно - проведение других манипуляций в день вакцинации БЦЖ (в частности, забор крови на фенилкетонурию).
Генерализованные БЦЖ-иты. Это самое тяжелое осложнение вакцинации БЦЖ, возникающее у новорожденных с иммунодефицитными состояниями.
1. Локализация костных осложнений весьма разнообразна: встречаются поражения грудины, ребер, наиболее часто поражаются трубчатые кости.
Зарубежные авторы приводят частоту генерализованного БЦЖ-ита - 0,06-1,56 на 1 млн привитых. Это редкие поствакцинальные осложнения, которые связаны с диссеминацией и генерализацией БЦЖ-инфекции и сопровождаются поражением различных групп лимфатических узлов, кожи, костно-суставной системы, протекают по типу тяжелого общего заболевания с полиморфной клинической симптоматикой, обусловленной туберкулезным поражением различных органов и систем. На вскрытии обнаруживают милиарные бугорки и очаги казеозного некроза, из которых удается выделить микобактерии вакцинного штамма БЦЖ, а также гнойные очаги в печени и других органах. Доказано, что подобные осложнения встречаются у детей с иммунодефицитными состояниями. Так, по данным Н.Н. Вундцеттель, Л.В. Пичугиной при иммунологическом обследовании 9 детей с генерализованной БЦЖ-инфекцией выявлены следующие нарушения: хроническая гранулематозная болезнь - 7 детей, гипер-IgM-синдром - у 1 ребенка и тотальная комбинированная иммунологическая недостаточность - у 1 ребенка.
7.5. ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ
Лечение поствакцинальных осложнений (за исключением генерализованных) рекомендуется проводить амбулаторно под наблюдением фтизиопедиатра. Госпитализация ребенка как в туберкулезный, так и в общесоматический стационар нежелательна. При отсутствии детского фтизиатра (ребенок из села или из района, где нет специалиста) ребенок может быть госпитализирован желательно в бокс при общесоматическом стационаре.
Независимо от выявленного вида осложнения врачу необходимо назначить противотуберкулезные антибактериальные препараты. Однако количество препаратов, их доза, сочетание, длительность приема могут быть индивидуальными и зависеть от выраженности осложнения, возраста ребенка, переносимости препаратов.
Все дети с осложнениями после прививки против туберкулеза наблюдаются в диспансере по V группе учета.
Лечение лимфаденитов. Детям с лимфаденитами несвищевой (закрытой) формы назначают два противотуберкулезных препарата: изониазид - 15-20 мг/кг в сутки (чем меньше ребенок, тем выше доза изониазида) и рифампицин - 10 мг/кг в сутки; витамин В6 через 30 мин после приема изониазида в дозах, соответствующих возрасту,
поливитамины. Суточную дозу стрептомицина вводят в одной инъекции внутримышечно, изониазид распределяют на два (или три - при больших дозах) приема внутрь до еды, рифампицин - в один прием за 40 мин до еды.
При свищевой форме лимфаденита у ребенка используют три противотуберкулезных препарата: стрептомицин - 20 мг/кг в сутки, изониазид - 15-20 мг/кг в сутки и рифампицин - 10 мг/кг в сутки; витамин В6 через 30 мин после приема изониазида в дозах, соответствующих возрасту, поливитамины. Суточную дозу стрептомицина вводят в одной инъекции внутримышечно, изониазид распределяют на два или три (при больших дозах) приема внутрь до еды, рифампицин - в один прием за 40 мин до еды. У детей до 3 лет суточную дозу изониазида увеличивают до 20 мг/кг в сутки. Причем 15 мг/кг дают внутрь, а 5 мг/кг - в виде 10% раствора изониазида, которым обкалывают лимфатический узел. Дозу изониазида вводят в одной инъекции. Обкалывание выполняют через день. Всего на один курс назначают 10 инъекций. При свищевой форме лимфаденита с большим количеством гноя последний эвакуируют шприцем до введения изониазида. Если продолжается скопление гноя в лимфатическом узле, через 2 нед курс инъекций повторяют. Кроме того, на 5-7 дней могут быть использованы компрессы с раствором, приготовленным из 0,45 мг рифампицина, 15 мл димексида и 85 мл дистиллированной воды. Длительное применение компрессов, особенно у детей раннего возраста, может сопровождаться мацерацией кожи вокруг участка поражения.
Через 1,5-2 мес от начала лечения при выраженной положительной динамике процесса, а именно - уменьшении лимфатического узла, явлений инфильтрации, гноевыделения стрептомицин отменяют и в дальнейшем продолжают терапию двумя вышеназванными препаратами в указанных дозировках до полного излечения.
При отсутствии улучшения через 3 мес от начала лечения необходимо решить вопрос об оперативном вмешательстве - удалении казеозно-измененных лимфатических узлов. Операция должна проходить на фоне интенсивной терапии тремя противотуберкулезными препаратами (стрептомицин, изониазид и рифампицин). После операции в течение одного месяца ребенок продолжает получать три препарата. Затем стрептомицин отменяют и продолжают лечение двумя препаратами до полного заживления послеоперационной раны. При множественном поражении нескольких групп лимфатических узлов, над- и подключичных, аксиллярных вопрос о хирургическом вмешательстве
для исключения диссеминации процесса решается только после положительной динамики.
Противопоказанием к назначению стрептомицина является изменение со стороны слухового аппарата. Изониазид дети и подростки переносят хорошо. В редких случаях он вызывает аллергическую реакцию в виде сыпи на коже лица, рук, иногда туловища. Тогда изониазид заменяют фтивазидом в суточной дозе 40 мг/кг. При назначении рифампицина отмечаются реакции со стороны печени в виде повышения трансаминаз, тошноты, рвоты, поэтому необходимо раз в месяц детям, принимающим противотуберкулезные препараты, проводить биохимическое исследование крови. Рифампицин детям до 3 лет можно назначать в свечах, при этом дозу препарата увеличивают. При непереносимости этого препарата можно заменить его протионамидом 12,5 мг/кг в сутки или этамбутолом 25 мг/кг в сутки. Перед приемом протионамида принимают висмут в той же дозе. Этамбутол назначают детям только после осмотра окулистом при отсутствии патологии со стороны глаз. Окулист должен осматривать ребенка ежемесячно в процессе приема данного препарата.
Течение лимфаденитов длительное. Интеркуррентные, особенно инфекционные заболевания могут вызвать обострение даже на фоне лечения. В 50% случаев наступает полное рассасывание лимфатических узлов в 40-45% лимфатические узлы уменьшаются до размера и в 8-9% случаев наряду с уплотнением узлов наблюдается частичная их кальцинация.
Сформировавшийся крупный (свыше 10 мм), кальцинат подлежит удалению, так как у маленьких детей могут развиться симптомы интоксикации. За месяц до хирургического вмешательства назначают два препарата - изониазид по 15 мг/кг в сутки и рифампицин по 10 мг/кг в сутки. Во время операции в рану вводят стрептомицин 20 мг/кг и затем в течение одного месяца ребенок должен получать три противотуберкулезных препарата, т.е. присоединяют инъекции стрептомицина. После отмены стрептомицина ребенок продолжает получать два препарата до полного заживления раны в течение не менее 1,5-2 месяцев.
Лечение инфильтратов с изъязвлением в центре. При инфильтратах больших размеров от 20 до 30 мм назначают на один месяц три противотуберкулезных препарата: стрептомицин - 20 мг/кг в сутки, изониазид - 15 мг/кг в сутки, рифампицин - 10 мг/кг в сутки; витамин В6 в сутки через 30 мин после приема изониазида в дозах, соответс-
твующих возрасту. В дальнейшем оставляют два препарата до полного рассасывания инфильтрата.
Длительность течения этого вида осложнения - от 2 до 3-х мес в зависимости от их проявления. Исход - полное рассасывание с образованием рубца различной выраженности.
С целью диагностики или лечения пунктирование инфильтратов противопоказано.
Лечение холодных абсцессов. При небольших абсцессах (до 20 мм в диаметре) в центре, т.е. в месте наиболее выраженной флюктуации, производят пункцию с эвакуацией его содержимого и последующим введением через эту же иглу стрептомицина - 20 мг/кг в сутки. При крупных абсцессах (свыше 20 мм) в центре скальпелем делают надрез - 3-4 мм. После отхождения гноя на место поражения для снятия явлений экссудации накладывают повязку с гипертоническим раствором, меняя ее каждый день. Через неделю заметно уменьшается гнойное отделяемое, и компрессы отменяют. Крупные абсцессы (свыше 20 мм) лечат в течение 15-30 дней тремя противотуберкулезными препаратами: стрептомицин - 20 мг/кг в сутки, изониазид - 15 мг/кг в сутки, рифампицин - 10 мг/кг в сутки. Через месяц наступает уменьшение его размеров за счет рассасывания; стрептомицин отменяют, и ребенок продолжает получать два препарата до полного излечения. Течение холодного абсцесса - 2-4 мес, исход - рассасывание с остающимся рубцом, размер которого зависит от размера участка поражения.
Лечение язв. Назначают два противотуберкулезных препарата - изониазид - 15 мг/кг в сутки и рифампицин - 10 мг/кг в сутки. При разрастании на дне язвы грануляций рекомендуется использовать местное лечение. Два раза в день дно язвы присыпают порошком изониазида, доза которого определяется величиной язвы - от 0,1 до 0,3 г. За 3 часа до сна язву необходимо покрыть гидрокортизоновой мазью. Для более длительного сохранения мази на область плеча накладывают марлевый валик (язва должна быть в его центре), который прибинтовывается к плечу. При соскальзывании валика его необходимо вновь хорошо зафиксировать. Течение процесса обусловлено размером язвы. При небольших (до 20 мм) язвах уже через 1,5-2 мес наступают рассасывание и рубцевание. При крупных язвах разрастающиеся грануляции тормозят явления репарации, и процесс протекает длительно, до 4 мес. Заживление язвы сопровождается развитием грубого гипертрофического рубца.
Лечение келоидных рубцов. В основе лечения лежит рассасывающая терапия, которая является чаще полиативной. Радикальные методы лечения отсутствуют. Особо следует подчеркнуть, что при любых (по размеру и состоянию активности) обнаруженных келоидных рубцах категорически противопоказано их хирургическое удаление, так как последнее через 3 мес после вмешательства ведет к бурному, ничем не останавливаемому росту келоида. Не рекомендуется использовать и криотерапию, которая также вызывает травму рубца. Показанием к назначению рассасывающей терапии является активность рубца, которая проявляется в постепенном увеличении его размеров, плотности, чувства зуда и покалывания в области рубца, иногда иррадиирующих болей в левое плечо. Кроме того, звездчатая, неправильная его форма всегда свидетельствует об активности рубца.
Существует два методавоздействияна келоидные рубцы. Первый- внутримышечное введение (ежедневно) небольших доз пирогенала с последующим обкалыванием рубца (через день) гидрокортизоном и лидазой. Схема введения пирогенала: 1-й день - 50 минимальных пирогенных доз в/м в ягодицу; 2-й день - 50 доз; 3-й день - 70 доз, 4-й день - 70 доз; 5-й день - 100 доз; 6-й день - 100 доз; 7-й день - 120 доз, 8-й день - 120 доз, 9-й день - 150 доз, 10-й день - 150 доз и так до 30 дней детям до 14 лет. Подросткам на 10-й день вводят 200 м.п.д. и так до 30 дней.
Пирогенал повышает проницаемость сосудов и основного вещества соединительной ткани, способствуя некоторому рассасыванию келоидного рубца. Лечение проводят в период полного здоровья ребенка. До начала введения пирогенала исследуют кровь и мочу пациента, измеряют артериальное давление. В основном дети и подростки хорошо переносят лечение.
Очень редко пирогенал вызывает подъем температуры тела до субфебрильных, а иногда и фебрильных цифр. В таких случаях прежде всего необходимо исключить интеркуррентные заболевания (ОРЗ, ангину или другие, в основном инфекционные). При подъеме температуры тела в связи с введением пирогенала последний отменяют на 2-3 дня, затем вновь продолжают инъекции с дозы, на которой остановились, прервав лечение. Полная непереносимость пирогенала является противопоказанием для его введения. После окончания лечения пирогеналом следует 3-недельный перерыв, затем - лечение лидазой и гидрокортизоном. Обкалывания проводят через
день по схеме: обкалывание вокруг келоидного рубца в 2 инъекции, под рубец; 1-й день - 64 ед. лидазы и гидрокортизон - 1 см (25 мг), 3-й день - 64 ед. лидазы; 5-й день - 64 ед. лидазы; 7-й день - 64 ед. лидазы и гидрокортизон - 1 см (25 мг); 9-й день - 64 ед. лидазы; 11-й день - 64 ед. лидазы; 13-й день - 64 ед. лидазы и гидрокортизон - 1 см (25 мг); 15-й день - 64 ед. лидазы; 17-й день - 64 ед. лидазы; 19-й день - 64 ед. лидазы и гидрокортизон - 1 см (25 мг). Противопоказанием к лечению лидазой является непереносимость, которая сопровождается появлением болезненного плотного инфильтрата различной величины в месте введения лидазы. На появившийся инфильтрат накладывается тепловой компресс, через 1-2 дня инфильтрат рассасывается. В таких случаях обкалывание (4 раза) проводят только гидрокортизоном.
Нередко используются нестероидные противоспалительные средства (диклофенак), а также мази «Медерма», «Контрактубекс» в комплексе с физиотерапевтическим воздействием.
При небольших (до 20 мм) рубцах и нерезко выраженной его активности (редкий зуд, отсутствие покалывания в его области, неплотная консистенция, бледное окрашивание) достаточно провести один курс лечения, однако обязательно длительное наблюдение.
Через полгода или год в зависимости от интенсивности роста при продолжающемся увеличении рубца рекомендуется использовать другой метод - ультразвуковое воздействие на келоид с последующим электрофорезом тиосульфата натрия.
Схема лечения: фонофорез гидрокортизона (состав мази - эмульсия гидрокортизона 25,0 мл, ланолин и вазелин по 25,0 мг) на область келоидного рубца по лабильной методике. Интенсивность УЗ от 0,2 до 0,8 Вт/см, продолжительность от 3 мин с постепенным увеличением времени до 10 мин. Сразу после окончания ультразвукового воздействия ежедневно применяют электрофорез 5% раствора тиосульфата натрия. Электродную прокладку, смоченную раствором тиосульфата натрия, накладывают на рубец и соединяют с отрицательным полюсом. Вторую прокладку располагают в области этого же плеча на 5-8 см ниже. Плотность тока 0,03 - 0,08 мА/см. Время воздействия 10-15 мин. Таким образом, пациент в один и тот же день получает лечение УЗ и электрофорезом. Всего проводят по 15 процедур УЗ и электрофореза на курс.
Тиосульфат натрия обладает противовоспалительным, антиаллергическим действием и в то же время является антиоксидан-
том - соединением, способным тормозить перекисное окисление липидов, которому принадлежит ведущая роль в формировании зрелой соединительной ткани. Фонофорез гидрокортизона (УЗ) с последующим электрофорезом тиосульфата натрия способствует некоторому рассасыванию, размягчению келоидных рубцов и препятствует дальнейшему росту рубца. Электрофорез проводят в присутствии медицинской сестры для предотвращения возможного (при более длительном воздействии, чем указано) ожога кожи. Врач должен внимательно следить за состоянием келоидного рубца. В случае появления экскориации на рубце после электрофореза необходимо сделать перерыв в лечении на 1-4 дня, затем продолжить процедуры.
Дети и подростки хорошо переносят лечение. Побочные реакции отсутствуют. До приема процедур измеряют артериальное давление. Противопоказания к использованию фоно- и электрофореза практически отсутствуют. Исключением, как и при первом методе, являются инфекционные заболевания, нарушения по тем или иным причинам общего состояния ребенка, не связанного с келоидным рубцом. При крупных (свыше 20 мм) келоидных рубцах бывает недостаточно проведения одного или двух курсов терапии, поэтому каждые полгода в течение 2-4 лет пациентам повторяют курсы лечения, чередуя первый метод со вторым до остановки роста рубца или значительном его замедлении. При увеличении рубца за год на 2-4 мм и снижении его активности можно повторно использовать метод ультразвукового воздействия в сочетании с электрофорезом.
Особого внимания врача требуют дети и подростки, у которых ранее, несмотря на абсолютные противопоказания, келоидные рубцы были удалены. В этих случаях рубцы становятся крупными, иногда бугристыми, неправильной формы, высоко поднимающиеся над уровнем кожи, очень плотные с выраженным чувством зуда в области рубца и болями, иррадиирующими в плечо. Больных из-за интенсивности зуда беспокоит бессонница. Таким больным рекомендуется проводить 5-10 курсов лечения, причем 5 курсов - чередуя один метод лечения с другим. Эффект от лечения достигается медленно и выражается в уменьшении или прекращении зуда, болей, снижении интенсивности окрашивания рубца. При достижении хотя бы небольшого положительного результата далее при повторных курсах используют только метод ультразвукового воздействия
в сочетании с электрофорезом, сократив время между повторными курсами до 3-х мес.
Цель терапии считается достигнутой в случае прекращения роста рубца. Случаи полного рассасывания келоидного рубца весьма редки.
Лечение оститов и генерализованных БЦЖ-итов проводят 3-4 противотуберкулезными препаратами. Детям с оститами назначают терапию в соответствии с общепринятыми методами лечения костного туберкулеза. Показано оперативное лечение в ранние сроки, так как у детей до 3 лет быстро нарастает деструкция кости. Противотуберкулезную терапию начинают от момента постановки диагноза; в среднем она составляет 10-12 мес непрерывного курса от даты оперативного лечения. При антибактериальной терапии обязательно показаны остеотропные препараты, гепатопротекторы, при необходимости железосодержащие. Рекомедован массаж, местно - электрофорез с тубазидом, а также с кальцием, фосфором; ЛФК, санаторно-курортная реабилитация (санаторий «Кирицы» Рязанской области).
Детям с генерализованным поражением органов БЦЖ-этиологии необходимо проводить иммунологическое обследование для уточнения характера иммунодефицита (хроническая гранулематозная болезнь и пр.) с последующим наблюдением у иммунолога. Противотуберкулезную терапию проводят 4 препаратами в комплексе с препаратами, необходимыми для лечения основного заболевания.
Детям с БЦЖ-оститами и генерализованными БЦЖ-итами после проведенного основного курса химиотерапии показано сезонное противорецидивное лечение двумя противотуберкулезными препаратами (изониазид, рифампицин).