Детские болезни в 2-х томах: том 1 : учебник / Под ред. И.Ю. Мельниковой, - 2009.
|
|
|
|
РАЗДЕЛ IV АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
МЕХАНИЗМЫ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ И ОБЩИЕ ПРИНЦИПЫ ПОДХОДОВ К ТЕРАПИИ У ДЕТЕЙ
Высокую распространенность аллергических заболеваний регистрируют среди детского и взрослого населения. По результатам исследований, количество пациентов, страдающих данными заболеваниями, неуклонно растет.
Ведущий механизм аллергических заболеваний, развивающих- ся в детском возрасте - атопический, или реагиновый (I тип по классификации Джелла и Кумбса). Развитие аллергических реакций происходит вследствие синтеза специфических к аллергенам антител, относящихся к классу IgE.
Атопия - генетически обусловленная предрасположенность к выработке IgE-антител в ответ на попадание в организм небольших количеств аллергенов, как правило, белковой природы. Атопическая аномалия конституции - главный фактор, определяющий повышение риска возникновения таких аллергических заболеваний, как БА, АР или конъюнктивит, атопический дерматит. Существует определенная (семейная) предрасположенность к аллергическим заболеваниям. Риск развития аллергического заболевания любого органа также зависит от наличия в семье больных данной патологией.
Ребенок-атопик нередко рождается с повышенным количеством IgE, синтезированным во внутриутробном периоде. Большинство аллергических заболеваний могут дебютировать очень рано, в том числе в первые месяцы жизни ребенка.
Общность патогенетических механизмов объясняет тот факт, что в большинстве случаев диагностируют сочетание нескольких аллергических заболеваний у одного и того же ребенка. Так, 90 % детей, больных БА, страдают также аллергическим ринитом (вначале, как правило, возникает ринит, а астма формируется на фоне текущего
ринита), а у 70 % больных поллинозом обнаруживают сопутствующую сенсибилизацию к бытовым аллергенам.
При атопических заболеваниях существует выраженная тенденция к формированию новых видов сенсибилизации, особенно при первичном контакте ребенка с новым аллергеном. Характерно также вовлечение новых органов в патологический процесс и возникновение новых клинических форм. Прогрессирующее течение атопических заболеваний подчиняется определенным законам. Первый в жизни ребенка вид сенсибилизации - пищевая, а первая клиническая форма - атопический дерматит (развивается чаще всего в период с первого по шестой месяцы жизни ребенка). С 1-го года жизни у детей отмечают формирование сенсибилизации к аллергенам домашней пыли и эпидермальным аллергенам животных. Эти ингаляционные аллергены приводят к возникновению аллергического ринита или конъюнктивита, а попадая на кожу, провоцируют обострения атопического дерматита. По достижении детьми 2-летнего возраста диагностируют стремительное увеличение заболеваемости БА. Позднее, в возрасте 5-6 лет, формируется пыльцевая сенсибилизация. Клинические симптомы пыльцевой сенсибилизации - манифестация поллиноза; возникновение приступов астмы и обострений атопического дерматита в летнее время; развитие вторичной пищевой аллергии на фрукты, овощи и орехи. Классическая эволюция увеличения чувствительности организма к тому или иному аллергену и изменение клинических форм единой атопической болезни получили название «атопического марша».
Определение в сыворотке крови повышенного содержания IgE подтверждает атопический генез заболевания. Возрастная норма содержания общего IgE представлена в таблице.
Возрастная норма содержания общего IgE
Возраст | Новорожденные | 3-6 мес | 1 год | 5 лет | 10 лет | Дети старше 12 лет и взрослые |
Содержание IgE в КЕ/л | 0-2 | 3-10 | 8-20 | 10-50 | 15-60 | 20-100 |
При атопических заболеваниях количество общего IgE может в 2-10 раз превышать возрастную норму, однако увеличение концентрации IgE более 2 000 КЕ/л обнаруживают редко. Высокий уро-
вень IgE прогностически неблагоприятен, так как свидетельствует о готовности к формированию новых видов сенсибилизации и новых клинических форм болезни.
Результаты анализов на содержание общего и специфического IgE у детей нередко не соответствуют действительности. По сравнению с другими иммуноглобулинами, IgE имеет очень небольшой период циркуляции в крови (не более двух дней) и самую низкую концентрацию, но характеризуется чрезвычайно высокой биологической активностью при связывании с высокоаффинными рецепторами тучных клеток кожи и слизистых оболочек. Сенсибилизация тучных клеток сохраняется в течение 3 мес после связывания IgE с высокоаффинным рецептором на их поверхности. Таким образом, концентрация IgE в сыворотке крови не отражает его истинную активность. При сенсибилизации только к одному или двум аллергенам концентрация общего IgE может находиться в пределах нормальных значений. Ложноположительные специфические IgE определяют при высоком уровне общего IgE. Наличие специфических IgE может отражать сенсибилизацию, не имеющую значимости в генезе заболевания (скрытая сенсибилизация без клинических проявлений).
Диагностические ошибки, допускаемые при работе с ребенкоматопиком.
• Отрицание атопии при нормальном уровне IgE.
• Назначение элиминационной диеты на основании результатов исследования количества специфического IgE (или специфического IgG).
• Неоправданно частое (более одного раза в год) проведение анализов на содержание IgE в сыворотке крови (особенно у ребенка младшего возраста).
Клинико-анамнестические маркеры атопии, требующие обязательной оценки (независимо от возможностей исследования количества IgE в сыворотке крови и результатов этого анализа).
• Наличие сопутствующих атопических заболеваний.
• Прямые клинические признаки гиперчувствительности к пищевым, бытовым, эпидермальным или пыльцевым аллергенам (например, приступы чиханья, ринореи, зуда носа непосредственно после контакта с домашними животными).
• Отягощенная наследственность по атопическим заболеваниям.
• Эозинофилия периферической крови, назального секрета, мокроты.
• Положительные кожные пробы с аллергенами (исследование проводит только аллерголог-иммунолог).
Аллергические заболевания - хронические заболевания, протекающие с чередованиями обострений и ремиссий. Лечение всех аллергических заболеваний включает различные сочетания фармакотерапии и немедикаментозных воздействий (в зависимости от периода заболевания).
Уменьшение контакта с причинно-значимым аллергеном и, если это возможно, полная элиминация аллергена, имеет огромное значение для достижения ремиссии заболевания, уменьшения объема лекарственной терапии, а также для профилактики формирования новых видов сенсибилизации. Меры, принимаемые для элиминации бытовых и пыльцевых аллергенов, представлены в табл. 1 (приложение на СБ).
Обучение пациентов и родителей занимает важное место в терапии аллергических заболеваний. Темы обучения
• Ориентация родителей на проведение грамотного и раннего лечения.
• Предоставление сведений об аллергических заболеваниях и их воспалительном характере.
• Разъяснение причин обострений.
• Обучение навыкам контроля окружающей среды.
• Обучение основным принципам наблюдения за состоянием ребенка.
• Обоснование терапии.
• Профилактика стероидофобии. Цели обучающих программ
• Повышение эффективности взаимодействия врача и пациента (или его семьи).
• Формирование доверия врачу.
• Улучшение выполнения врачебных рекомендаций. Родители, изучившие специальные программы, осознают свою
подготовленность при возникновении обострений аллергических заболеваний у ребенка, достигают лучших результатов при проведении лечебных процедур своим детям, а также отмечают удовлетворенность медицинской помощью. Обучающие программы проводят в рамках астма-школ, аллергошкол или непосредственно на приеме у врача.
Специфическая иммунотерапия (аллерген-специфическая иммунотерапия) - введение (подкожное или пероральное) минимальной
дозы причинно-значимого аллергена или смеси аллергенов. Затем дозу вводимого аллергена постепенно увеличивают. Процедуру про- водит только специалист (аллерголог-иммунолог). Специфическая иммунотерапия - единственный метод лечения аллергических заболеваний, воздействующий на все патогенетические механизмы. В отличие от фармакотерапии, специфическая иммунотерапия приводит в ряде случаев к стойкой ремиссии заболевания, сохраня- ющейся и после окончания лечения. Иммунотерапия также предупреждает расширение спектра сенсибилизации, усугубление тяжести заболевания, развитие новых клинических форм. Специфическую иммунотерапию проводят детям старше пяти лет для лечения поллиноза, аллергического ринита и БА. При выборе воздействующего аллергена необходимо подтвердить его причинную роль (основанием для подозрений считают клиническую картину) методом кожных проб. Наиболее часто проводят иммунотерапию с аллергенами пыльцы, домашней пыли и клещей домашней пыли. Для достижения наилучших результатов лечения иммунотерапию следует начать как можно раньше, когда симптомы заболевания, как правило, обусловлены одним или двумя причинными аллергенами, а патологические изменения в органах-мишенях обратимы.
Классификация аллергических заболеваний.
Существует классификация аллергических заболеваний, основанная на локализации патологического процесса (например, болезни органов дыхания; болезни кожи и подкожной клетчатки).
В
Глава 1
Атопический дерматит
Определение
Атопический дерматит - хроническое заболевание, развивающееся у лиц с генетической предрасположенностью к атопии, имеющее рецидивирующее течение с определенной возрастной динамикой. Клинические симптомы атопического дерматита - зудящие экзематозные и лихе- ноидные высыпания, гиперчувствительность к аллергенным и неаллергенным стимулам; основной лабораторный признак - повышение уровня сывороточного IgE (определяют у большинства пациентов).
Код по МКБ-10
Болезни кожи и подкожной клетчатки (класс XII). L20 Атопический дерматит.
L20.0 Почесуха Бенье (диффузный нейродермит). L20.8 Другие атопические дерматиты. L20.9 Атопический дерматит неуточненный.
Эпидемиология
По эпидемиологическим данным, распространенность атопического дерматита у детей составляет 10-28%.
Профилактика
Первичная профилактика атопического дерматита (т.е., предотвращение формирования заболевания) заключается в прицельной работе с детьми, имеющими факторы риска:
- отягощенная наследственность по любому атопическому заболеванию в семье;
- перенесенная токсическая эритема новорожденных. Меры первичной профилактики:
- налаживание и сохранение грудного вскармливания при условии соблюдения матерью гипоаллергенной диеты (диету подбирают индивидуально);
- при отсутствии грудного вскармливания использование в питании ребенка гипоаллергенных продуктов, а именно смесей на
основе частично гидролизованного белка коровьего молока с более поздним и осторожным введением таких прикормов, как кисломолочные продукты, яйцо, рыба;
- ранняя ориентация семьи на налаживание гипоаллергенного быта, исключение контакта ребенка с ингаляционными аллер- генами, в том числе с аллергенами домашних животных.
Скрининг
Скрининговые тесты не проводят; не рекомендуют предложенное ранее исследование пуповинной крови на содержание общего IgE в связи с большой частотой ложноотрицательных результатов этого анализа.
Классификация
Рабочая классификация атопического дерматита включает несколько позиций, важных для правильного подбора терапии.
• Период заболевания:
- обострение (выраженные, прогрессирующие клинические проявления);
- неполная ремиссия (минимальные, остаточные кожные проявления);
- ремиссия (бессимптомный период).
• Распространенность кожного процесса:
- локальный атопический дерматит (поражение нескольких участков кожи в местах типичной локализации атопического дерматита, например локтевых и подколенных сгибов);
- распространенный атопический дерматит (распространение поражения более 5 % поверхности тела);
- диффузный атопический дерматит (поражение, охватывающее практически всю кожу).
• Степень тяжести атопического дерматита:
- легкая;
- средней тяжести;
- тяжелая.
Этиология
Возникновение атопического дерматита в раннем возрасте, как правило, связывают с пищевой аллергией. Клинические признаки атопического дерматита иногда развиваются в первые дни и недели
жизни ребенка. Одним из первых в жизни ребенка аллергенов считают белки коровьего молока (сенсибилизацию к ним определяют более чем у 90 % детей первого года жизни с атопическим дермати- том). Часто атопический дерматит возникает после окончания грудного вскармливания или при переводе ребенка на питание молочной смесью (в возрасте 2-6 мес). К сожалению, связь обострений и ремиссий с характером питания у детей старшего возраста не столь очевидна, так как большинство аллергенных продуктов (злаки, яйца, молоко) присутствуют в рационе ребенка ежедневно.
Ведущая роль белков коровьего молока в развитии атопического дерматита обусловлена его высокой сенсибилизирующей способностью. Пищевыми аллергенами считают также протеины яиц, злаков, сои, рыбы. Сенсибилизацию к одному единственному продукту обнаруживают редко.
Значимость пищевой сенсибилизации с возрастом уменьшается. К двенадцати годам пищевую сенсибилизацию считают важным этио- логическим фактором атопического дерматита у половины пациентов.
Главные признаки формирования новых видов сенсибилизации (бытовой, эпидермальной).
• Отсутствие четкой связи обострений атопического дерматита с употреблением в пищу различных продуктов.
• Улучшение состояния кожи при перемене места жительства и ухудшение при возвращении домой.
• Усиление зуда ночью (контакт кожи с аллергенами пылевых клещей и пера подушки).
• Сопутствующая патология, обусловленная реакцией на ингаляционные аллергены (аллергический ринит, БА).
Патогенез
Заболевание в большинстве случаев обусловлено IgE-зависимы- ми механизмами, характеризуется формированием аллергического воспаления с инфильтрацией кожи Т-лимфоцитами, эозинофилами и другими клетками. Важное последствие воспаления - снижение резистентности защитных механизмов кожи к бактериальным, грибковым или вирусным инфекциям.
Клиническая картина
Для атопического дерматита характерно хроническое рецидивирующее течение. Атопический дерматит, развивающийся у детей и
взрослых, - единое заболевание. Изменение клинических признаков атопического дерматита происходит по мере взросления пациента. Основной симптом «младенческой» фазы заболевания - экзема. Отмечают истинный полиморфизм высыпаний на коже. Существует определенная последовательность образования первичных и вторичных элементов экземы: на фоне эритемы появляются папулы, а также пузырьки; затем наблюдают их быстрое разрушение с образованием эрозий. При этом диагностируют симптом мокнущей кожи. В дальнейшем на участках мокнущей кожи образуются корки; разрешение процесса происходит через шелушение. Нередко отмечают возобновление образования микровезикул и эрозий (рецидивирование).
Типичные локализации высыпаний у младенцев.
• Лицо (с преобладанием высыпаний на щеках и лбу), за исключением носогубного треугольника.
• Волосистая часть головы.
• Разгибательные поверхности голеней, бедер, предплечий (симметрично).
• Спина.
Высыпания сопровождаются зудом и сухостью кожи. При возникновении зуда ребенок грудного возраста, как правило, становится очень беспокойным. Распеленатый ребенок начинает вертеть головой и потирать ножки одна о другую. Только по достижении 6-8-месяч- ного возраста ребенок приобретает навык направленно чесать рукой нужное место.
В возрасте 9-18 мес происходит трансформация детской экземы в нейродермит. Поражение локализуется на лице (блефарит, хей- лит, периоральная область), шее, в локтевых и подколенных сгибах, на запястьях, вплоть до диффузного поражения кожи. Высыпания представлены папулами и бляшками; присутствуют вторичные элементы: шелушение, лихенификация, экскориации, трещины. Зуд приобретает более интенсивный характер; нередко отмечают биопсирующие расчесы. Вследствие неадекватного лечения развиваются атрофические изменения кожи (истончение эпидермиса и дермы, гипопигментация).
Типичные признаки атопического дерматита - складки ДеньеМоргана (дополнительные складки кожи на нижнем веке), блефарит, трещины кожи за ушами, хейлит и географический язык, экзема сосков (односторонняя или двусторонняя).
Выделяют легкое, средней тяжести и тяжелое течение атопического дерматита. При атопическом дерматите легкого течения отмечают слабо выраженную гиперемию, папулезные элементы, небольшое шелушение и сухость кожи; характерны короткие обострения и длительные ремиссии.
При атопическом дерматите средней тяжести наблюдают множественные очаги поражения с большим количеством высыпаний, симптом мокнущей кожи, нередко присутствует лихенификация. Обнаруживают увеличение регионарных лимфатических узлов. Умеренный зуд. Обострения развиваются 3-4 раза в год, нередко диагностируют вторичную бактериальную, вирусную или грибковую инфекцию кожи. Периоды «чистой кожи» короткие или отсутствуют совсем.
Для тяжелого течения атопического дерматита характерны большая площадь поражения кожи; выраженные морфологические при- знаки; резкий, мучительный зуд, резистентность к различным терапевтическим мероприятиям.
Для оценки степени тяжести и объективной регистрации выраженности атопического дерматита используют систему SCORAD (SCORing of Atopic Dermatitis), разработанную Европейской рабочей группой. Балльная оценка суммирует площадь поражения кожи, тяжесть основных клинических проявлений и субъективных симптомов атопического дерматита (зуд и нарушение сна). Применение SCORAD позволяет документировать картину атопического дерматита у пациента, оценивать динамику процесса под влиянием терапии.
Методика использования шкалы SCORAD
Шкала состоит из трех блоков, характеризующих площадь и интенсивность поражения кожи, а также субъективные симптомы - зуд и нарушение сна (иллюстрация представлена отдельно в виде файла «Иллюстрация SCORAD. jpg»).
• А - площадь поражения кожи. На схематический рисунок наносят очаги атопического дерматита, расположенные на передней и задней поверхности тела ребенка. Площадь оценивают по правилу «девяток», представленному на схеме. Площадь ладони ребенка считают равной 1 % поверхности тела. В скобках даны значения для детей младше двух лет.
• В - интенсивность поражения. Оценивают выраженность шести основных клинических признаков атопического дерматита: эрите-
ма; отек или папула; корка или мокнущая кожа; экскориации; лихенификация; сухость кожи вне очагов поражения. Интенсивность каждого симптома оценивают по балльной шкале, при этом ноль баллов означает отсутствие симптома, 1 балл - признак выражен слабо, 2 балла - выражен умеренно, 3 балла - резко выражен. Для оценки используют участок кожи с максимальной интенсивностью какого-либо симптома. На оценочный лист выносят оценку каждого признака, далее оценки суммируют.
• С - субъективные симптомы. Оценивают зуд и нарушение сна, обусловленные атопическим дерматитом, а не другими причинами. Родителям и ребенку предлагают на 10-сантиметровой шкале указать точку, соответствующую степени зуда (в среднем) за последние три дня, и степени нарушения сна за последние три ночи. Каждый симптом оценивают в баллах (от 0 до 10), а затем суммируют оценки.
Индекс SCORAD рассчитывают по формуле
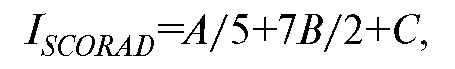
где А - площадь пораженной кожи (в %); В - сумма баллов интенсивности клинических симптомов атопического дерматита; С - сумма баллов субъективной оценки зуда и нарушения сна.
Минимальное количество баллов (0 баллов) по шкале характеризует полное отсутствие клинических симптомов атопического дерматита, максимально возможное - 103 балла. Как правило, легкому течению атопического дерматита соответствует оценка от 1 до 20 баллов по шкале SCORAD; атопическому дерматиту средней тяжести - от 20 до 40 баллов; тяжелому течению - более 40 баллов (шкалу используют в период обострения).
Симптомы поражения органов пищеварения, обусловленные развитием сопутствующего аллергического гастроэнтероколита, диагностируют у 80-97 % пациентов (т. е. практически у всех детей с атопическим дерматитом). У грудных детей отмечают срыгивания, неустойчивый стул (чередование запоров и поносов с выделением слизи), беспричинный плач. Детей годовалого возраста (и старше) беспокоят тошнота и иногда рвота (как правило, после еды), боли в животе, функциональные нарушения (дискинезии, запоры).
Патологию ушей, горла и носа наблюдают у 50-60 % детей, больных атопическим дерматитом. Первые признаки аллергического ринита - водянистые выделения из носа, сопение и храп, связанные
с отеком слизистой оболочки носовой полости, отмечают в грудном возрасте. В конце 1-го (или начале 2-го) года жизни возникают рецидивирующие приступы сухого кашля, стеноз гортани. В последую- щем у 40 % детей развивается БА.
Осложнения
Для атопического дерматита характерно присоединение вторичной кожной инфекции. Нередко диагностируют рецидивирующие стафилодермии и стрептодермии, остроконечные кондиломы и бородавки, кандидоз кожи. Часто обнаруживают присутствие контагиозного моллюска в коже (признак заболевания - жемчужно-белые или розовые блестящие узелки размером 1-15 мм с пупковидным вдавлением в центре). Грозным осложнением считают герпетиформную экзему Капоши, вызванную вирусом простого герпеса (ВПГ).
Диагностика
Диагноз «атопический дерматит» ставят на основании клинических признаков. Критерии диагностики сформулировали Hanifin и Raika в
Физикальные исследования
Для постановки диагноза необходимо наличие не менее трех основных и как минимум одного дополнительного критерия. Основные критерии
• Типичная для данного возраста морфология и локализация высыпаний.
• Зуд кожи различной интенсивности.
• Хроническое рецидивирующее течение.
• Повышение общего IgE или обнаружение аллерген-специфических IgE-антител в сыворотке крови.
Дополнительные критерии
• Дебют заболевания в раннем возрасте, как правило, на первом году жизни.
• Сухость кожи.
• Трещины за ушами.
• Хейлит.
• Экзема сосков.
• Складки Денье-Моргана.
Лабораторные исследования
Для постановки диагноза атопического дерматита необходимо, кроме регистрации характерных клинических симптомов, доказать атопическую природу заболевания. Лабораторные тесты, проводимые (особенно у детей первого года жизни) с целью обнаружения общих и специфических IgE, нередко не позволяют получить достоверной информации о состоянии пациента. Роль атопии в генезе заболевания можно подтвердить клинически (подробнее - см. раздел «Механизмы аллергических заболеваний»).
Лечение
Атопический дерматит развивается в первые месяцы жизни ребенка (вначале признаки заболевания минимальны), характеризуется наличием ремиссий и обострений, а с возрастом приобретает хроническое течение. Мнение о том, что симптомы атопического дерматита, наблюдаемые на первом году жизни ребенка, бесследно исчезнут и не нуждаются в активной терапии, в корне ошибочно. Своевременно начатое лечение (при минимальных симптомах) обеспечит обратную трансформацию атопического дерматита (вплоть до клинического выздоровления); предотвратит развитие тяжелых, непрерывно рецидивирующих форм заболевания; предотвратит дальнейшее прогрес- сирование атопической болезни в целом и формирование аллергического ринита и БА.
Комплекс лечебных мероприятий
• Исключение воздействия провоцирующих факторов: индивидуальный подбор диеты и элиминационные мероприятия.
• Уход за кожей.
• Системная и наружная фармакотерапия.
• Обучение родителей больного ребенка основным принципам ухода за ним.
• Обучение родителей базовым лечебным мероприятиям, а также предоставление информации об атопическом дерматите.
Диетотерапия
Общий принцип диетотерапии при атопическом дерматите - индивидуальный подбор диеты при условии сохранения полноценности питания.
Для ребенка первого года жизни оптимально грудное вскармливание. Кормящая мать должна соблюдать диету, исключающую молоко,
кисломолочные продукты, а также другие продукты с высокой сенсибилизирующей способностью (например, яйца и рыбу). Врачу следует обратить внимание на то, что многие женщины для повышения лак- тации употребляют молоко, сгущенное молоко, грецкие орехи, мед, пивные дрожжи, апилак*. При улучшении состояния кожи ребенка меню матери постепенно расширяют, при этом регистрируют реакцию кожи ребенка на каждый новый введенный продукт.
Наиболее сложно организовать питание детей первого года жизни (находящихся на искусственном вскармливании) с аллергией на белки коровьего молока. Адаптированные смеси на основе коровьего, козьего молока или сои не рекомендуют использовать для кормления детей с атопическим дерматитом и детей, входящих в группу риска. Эти смеси содержат полноценный белок, и сенсибилизация к нему возникает очень быстро. Кисломолочные смеси обладают очень слабой степенью модификации белка и не производят необходимого терапевтического эффекта.
При невозможности продолжить грудное вскармливание ребенка, имеющего высокий риск развития атопической болезни (например, второй ребенок в семье, где старший ребенок болен атопическим дерматитом), переводят на питание смесью на основе частичного гидролизата коровьего молока (профилактическая смесь-гидролизат): «Нан ГА», «Хипп ГА», «Хумана ГА».
При обнаружении симптомов атопического дерматита необходимо перевести ребенка на вскармливание лечебным гидролизатом (смесь, содержащая полностью расщепленные белки коровьего молока).
Гидролизаты получают в результате расщепления белков до олигопептидов и свободных аминокислот. Смеси-гидролизаты - адапти- рованные и полноценные заменители грудного молока, содержащие комплекс микроэлементов, витаминов, незаменимых аминокислот (в соответствии с требованиями ВОЗ). Разрушение первичной структуры белка приводит к потере аллергенности. Молекулярная масса частиц смеси отражает степень гидролиза. Частицы с минимальной аллергенностью имеют молекулярную массу менее 3,5 килодальтон. Однако высокое содержание свободных аминокислот (масса менее одного килодальтона) ухудшает всасывание в кишечнике и придает смеси горько-соленый вкус.
Смеси-гидролизаты различают по субстрату гидролиза.
• Гидролизаты казеина (смеси «Нутрамиген*», «Прегестимил*», «Фрисопеп АС») характеризуются небольшой молекулярной мас-
сой. Их назначают детям с атопическим дерматитом средней степени тяжести, а также при тяжелом течении заболевания.
• Гидролизаты сывороточных белков коровьего молока более физиологичны; их вкус и запах лучше, чем у гидролизатов казеина. При наличии клинических признаков лактазной недостаточности (боли и вздутие живота, неустойчивый, периодически пенистый, водянистый стул) рекомендуют безлактозные смеси, например «Алфаре», «Нутрилон пепти ТСЦ». При отсутствии лактазной недостаточности детям назначают смеси, содержащие низкое («Фрисопеп») и физиологическое («Туттели - Пептиди») количество лактозы.
Правила перевода ребенка на смесь-гидролизат
• Смесь гидролизат необходимо готовить и дозировать так же как любую другую адаптированную смесь.
• Гидролизат вводят в пищу постепенно, заменяя предшествующую смесь: во время каждого кормления сначала дают по 10-20 мл гидролизата, а затем «старую» смесь.
• Родителей предупреждают о возможном учащении стула, об изменении цвета стула у ребенка на зеленоватый или коричневый (это не патологический признак).
• Гидролизат можно добавлять в готовую безмолочную кашу. Дети грудного возраста быстро привыкают к своеобразному вкусу
и запаху смеси и охотно пьют ее. После перевода на гидролизат положительную клиническую динамику со стороны ЖКТ отмечают через 5-7 дней; заметное ослабление зуда и улучшение состояния кожи наступают медленнее - обычно в течение 2-3 недель. Вскармливание гидролизатом проводят примерно до 12-18-месяч- ного возраста (как при использовании обычных адаптированных молочных смесей). Прикормы вводят в обычные сроки, их готовят на воде или на овощных отварах. При наличии аллергии к белкам коровьего молока целесообразно в качестве первого мясного прикорма использовать мясо кролика, индейку, нежирную свинину. Говядину пробуют давать только детям, достигшим годовалого возраста. Введение молочных продуктов в питание ребенка возможно не ранее чем через 6-12 мес после достижения стабильной клинической ремиссии. Часто безмолочную диету необходимо соблюдать в течение нескольких лет, так как любая попытка ввести молочный продукт немедленно ведет к обострению атопического дерматита. Как правило, существенное улучшение переносимости пищевых аллергенов
наступает после трех лет. Дольше всех сохраняется сенсибилизация к белкам яйца, молока и рыбы. Обладающие сильной аллергенностью продукты, например шоколад и какао, мед, рыбу, грибы и орехи, цитрусовые и клубнику вводят в рацион с большой осторожностью. При составлении меню необходимо учитывать, что ребенку с атопическим дерматитом противопоказаны любые продукты, содержащие консерванты, красители, усилители вкуса или загустители.
Немедикаментозное лечение
Элиминационные мероприятия
В поддержании воспалительного процесса при атопическом дерматите значительную роль играют не только пищевые, но и бытовые, а также нередко и пыльцевые аллергены. Уменьшение контакта с ингаляционными аллергенами рекомендуют всем пациентам с АД независимо от возраста и известного на данный момент спектра сенсибилизации.
Уход за кожей
Сухость кожи - важная составляющая патогенеза атопического дерматита, поэтому регулярное очищение и увлажнение кожи рассматривают как вспомогательную базисную терапию данного заболевания. Ребенка моют ежедневно, за исключением случаев распространенной вторичной гнойной инфекции, когда вопросы о гигиене решают индивидуально. Для мытья применяют специальные нейтральные моющие средства, не вызывающие аллергических реакций и не усиливающие сухость кожи. При выраженной сухости кожи показано купание с использованием масляной эмульсии (не смывают после купания). После мытья кожу нежно промокают полотенцем и немедленно наносят увлажняющий крем на все места сухости кожи. После впитывания увлажняющего крема наносят лечебные кремы. Утром также наносят увлажняющий крем. При резко выраженной сухости кожи крем наносят несколько раз в день, например при дерматите кистей - после каждого мытья рук. Увлажняющие кремы и моющие средства для больных атопическим дерматитом входят в состав различных линий лечебной косметики («Биодерма», «Урьяж», «Авен», «Мюстелла»). Увлажненная кожа создает ребенку ощущение комфорта, при этом отмечают уменьшение зуда и расчесывания.
Ребенку с атопическим дерматитом не рекомендуют находиться под воздействием прямых солнечных лучей. Играть следует в
полутени. Открытые части тела защищают от солнечного ожога фотозащитными кремами с высоким фактором защиты (20 и выше). Фотозащитный крем наносят перед выходом на улицу (через 30- 40 мин после использования лечебных кремов).
Медикаментозное лечение Системная фармакотерапия
При атопическом дерматите применяют гистаминоблокаторы, входящие в состав краткосрочных и длительных схем лечения. Седативные гистаминоблокаторы в основном используют в острую фазу атопического дерматита, а гистаминоблокаторы II поколения предпочтительнее назначать в качестве базисной противовоспалительной терапии.
Гистаминоблокаторы I поколения
Гистаминоблокаторы I поколения (супрастин*, фенистил*, тавегил*) оказывают выраженное противозудное действие, кроме того, побочные седативные и снотворные эффекты данных препаратов полезны в данной ситуации. Грудным детям (до шестимесячного возраста) можно назначать только супрастин* и фенистил* (детям старше одного месяца жизни).
Недостатки гистаминоблокаторов I поколения:
- развитие тахифилаксии - снижения лечебного эффекта при длительном введении вещества, поэтому примерно через 10 дней терапии препарат нужно менять;
- необходимость частого приема лекарственного средства (2-3 раза в сутки).
Детям старше одного года для купирования резкого зуда назначают атаракс* (гидроксизин - предшественник цетиризина), обладающий выраженным противозудным действием. Препарат используют 2 раза в день или только перед сном, курс лечения составляет 10-14 дней.
Гистаминоблокаторы II поколения
Гистаминоблокаторы II поколения (зиртек*, ксизал*, кларитин*, эриус*). Наиболее часто используют зиртек* (назначают детям старше шести месяцев). Препарат используют в течение длительного времени (курс лечения составляет от трех месяцев до года и дольше) для достижения не только антигистаминного, но и противовоспалительного эффекта.
Для улучшения процессов расщепления и всасывания пищевых продуктов, нормализации состава микрофлоры кишечника, коррек-
ции функциональных нарушений (например, при запорах), а также для санации глистной инвазии проводят коррекцию нарушений деятельности ЖКТ.
Наружная фармакотерапия
Топические ингибиторы кальциневрина и топические глюкокортикоиды - современные эффективные и безопасные противо- воспалительные средства, применяемые для лечения атопического дерматита у детей.
Топические ингибиторы кальциневрина
Элидел-крем* - препарат, содержащий топический ингибитор кальциневрина пимекролимус, назначают детям старше трех месяцев. Механизм действия пимекролимуса - подавление транскрипции цитокинов в активированных Т-лимфоцитах и других участвующих в развитии воспалительного процесса клетках путем обратимого ингибирования ключевого фермента кальциневрина. Элидел* купирует симптомы атопического дерматита, уменьшает число обострений и потребность в применении топических глюкокортикоидов. Препарат характеризуется низкой системной абсорбцией, может быть использован на любых участках тела в течение длительного времени. Крем используют 2 раза в день после нанесения и впитывания увлажняющих средств. Обычно клинический эффект наблюдают в первые 3-7 дней применения. Местные побочные эффекты - ощущение тепла или жжения, гиперемия в месте нанесения (отмечает примерно один пациент из десяти) проходят, как правило, самостоятельно, не требуют прекращения лечения элиделом*.
Топические глюкокортикоиды
Топические глюкокортикоиды эффективно подавляют аллергическое воспаление. Препараты используют один раз в день, вечером, после нанесения и впитывания увлажняющего крема. Клинический эффект наблюдают в течение первых дней терапии.
Ограничение применения глюкокортикоидов у детей.
• Детям назначают только слабо или умеренно действующие глюкокортикоиды.
• Существуют возрастные ограничения и ограничение длительности непрерывного применения. Так, метилпреднизолона ацепонат (адвантан*) можно применять для лечения грудных детей, достигших четырехмесячного возраста (непрерывное использование возможно не более четырех недель); мометазона фуроат (элоком*) назначают пациентам старше двух лет (непрерывное применение возможно не более двух недель).
• Не рекомендуют наносить глюкокортикоидные препараты на губы, периорбитальную область, шею, подмышечные и паховые складки, а также под повязки или подгузники.
• Общая площадь нанесения препарата не должна превышать 20 % поверхности тела.
При игнорировании указанных рекомендаций возрастает риск развития таких местных и системных нежелательных эффектов глю- кокортикоидов, как атрофия кожи, акне, телеангиэктазия, пигментные аномалии, угнетение надпочечников.
При соблюдении правил приема глюкокортикоидов данные препараты не оказывают вредного воздействия (в том числе при прове- дении повторных курсов). При этом длительность бессимптомных периодов у пациента должна превышать время лечения данными препаратами. После достижения терапевтического эффекта, в зависимости от тяжести заболевания и вероятности быстрого рецидивирования, возможна полная отмена топической терапии; продолжение применения глюкокортикоидов по интермиттирующей схеме (через день) с последующей отменой; а также использование нестероидных препаратов (например, элидела*).
При тяжелом упорном течении атопического дерматита иногда проводят короткие (7-10 дней) курсы системных глюкокортикоидов.
Режимы дозирования и возрастные ограничения применения препаратов различных групп для лечения атопического дерматита представлены в табл. 2 (см. Приложение на CD).
Лечение вторичной инфекции
В зависимости от степени выраженности инфекционного процесса, назначают либо местное, либо системное лечение. Для местной терапии бактериальной инфекции используют растворы красителей (фукорцин*, бриллиантовый зеленый), топические препараты с антибиотиками (фуцидин*, бактробан*). Терапию проводят в течение 7-10 дней до полного исчезновения признаков инфекции. При подозрении на грибковую инфекцию, применяют наружную форму клотримазола (лосьон или крем, содержащий 1% действующего вещества). Противовоспалительную терапию атопического дерматита (элидел* или топические глюкокортикоиды) начинают одновременно с антибактериальным лечением. Купирование аллергического воспаления «закрывает ворота» инфекции и способствует более эффективной реализации местного противоинфекционного иммунитета. При
подозрении на смешанный характер инфекции в качестве стартового препарата назначают тридерм*, содержащий глюкокортикостероид, антибиотик и клотримазол. При вирусной инфекции кожи (контагиозный моллюск, папилломы, бородавки) в первую очередь проводят эрадикацию вирусной инфекции. Герпетиформную экзему Капоши считают показанием для экстренной госпитализации ребенка.
Дальнейшее ведение
В связи с тем, что атопический дерматит - заболевание с хроническим рецидивирующим течением, в терапии особое внимание уделяют долговременному контролю над течением заболевания, не ограничиваясь быстрым купированием обострений.
В соответствии с алгоритмом терапии атопического дерматита необходимо использовать достаточные количества средств, увлажняющих кожу. Параллельно начинают обучение родителей больного ребенка грамотному ограничению воздействия провоцирующих факторов. В период обострения атопического дерматита для быстрого уменьшения зуда и воспаления назначают короткий курс топических глюкокортикоидов или элидел*. При этом в зависимости от выраженности процесса на те или иные участки кожи можно наносить различные средства, учитывая, что противовоспалительное действие элидела ниже, чем у топических глюкокортикоидов. После достижения ремиссии уход за кожей обязательно продолжают. Наружную терапию возобновляют при самых первых признаках ухудшения. При атопическом дерматите с персистирующим течением или с частыми обострениями, элидел* можно назначать в качестве длительной поддерживающей терапии. В случае неэффективности элидела, проводят курс топических глюкокортикоидов. У многих пациентов элидел* производит эффект при каждом обострении, а потребность в глюкокортикоидах отсутствует.
Прогноз
Атопический дерматит - хроническое заболевание. У многих детей в возрасте одного-трех лет симптомы болезни исчезают под влиянием терапии или спонтанно, улучшается толерантность к пищевым аллергенам. Однако даже при длительной ремиссии трудно говорить о полном выздоровлении от атопического дерматита, так как при стечении обстоятельств заболевание может снова рецидивировать в любом возрасте. Высокий риск формирования новых ато-
пических заболеваний подтверждают многочисленные клинические наблюдения. У детей с мокнущей экземой в анамнезе (в основном на первом году жизни), к пятнадцати годам полная ремиссия забо- левания наступила в 55 % случаев, а у 45 % пациентов излечения от атопического дерматита не произошло. У 44 % детей данной группы развилась БА (из них у половины сохранился атопический дерматит). И лишь у 18 % детей к пятнадцати годам зарегистрировали полное отсутствие атопии.
Диспансеризация
Дети с тяжелым течением атопического дерматита находятся на диспансерном учете у детского аллерголога.
Глава 2
Аллергический ринит и риноконъюнктивит
Определение
Аллергический ринит и риноконъюнктивит (АР) - заболевание, обусловленное IgE-опосредованным воспалением слизистой оболочки носа (и конъюнктивы). АР возникает после контакта с аллергеном и имеет характерную клиническую картину.
Код по МКБ-Х
J30 Вазомоторный и аллергический ринит.
J30.1 Аллергический ринит, вызванный пыльцой растений.
J30.3 Другие аллергические риниты.
J30.4 Аллергический ринит неуточненный.
Эпидемиология
Распространенность АР в детском возрасте составляет 10-25 %. Как правило, АР - нетяжелое заболевание. Тем не менее АР и риноконъюнктивит - хроническое респираторное заболевание, оказывающее выраженное влияние на социальную жизнь ребенка и успеваемость в школе, а также ассоциированное с риском формирования БА и ухудшающее течение сопутствующей астмы.
Профилактика
Первичная профилактика АР (т. е., предотвращение формирования заболевания) заключается в прицельной работе с детьми, имеющими факторы риска:
- отягощенная наследственность по любому атопическому заболеванию в семье;
- наличие атопического дерматита или другого атопического заболевания у ребенка.
Меры первичной профилактики:
- своевременная и полноценная терапия имеющихся аллергических заболеваний;
- ранняя ориентация семьи на налаживание гипоаллергенного быта, исключение контакта ребенка с ингаляционными аллер-
генами, в том числе с аллергенами домашних животных, борьба с пассивным курением.
Вторичная профилактика АР - предотвращение появления новых видов сенсибилизации, эффективной мерой служит своевременное лечение АР с применением аллерген-специфической иммунотерапии (проводит специалист аллерголог-иммунолог).
Скрининг
Скрининговые тесты не проводят.
Классификация
Традиционная классификация включает две формы АР: круглогодичный и сезонный; это позволяет описывать характер данного заболевания в течение года. Традиционно под определением «сезонный ринит» понимают АР пыльцевой этиологии, в то время как термин «круглогодичный ринит» может означать как ринит бытовой этиологии с постоянными выраженными симптомами, так и ринит с поливалентной сенсибилизацией (бытовой и пыльцевой).
Новая классификация, предложенная международной группой экспертов ARIA («Аллергический ринит и его влияние на астму»,
Классификация АР по продолжительности периода выраженных клинических признаков
• Интермиттирующий АР: длительность симптомов составляет менее четырех дней в неделю или менее четырех недель в год.
• Персистирующий АР: длительность симптомов составляет более четырех дней в неделю и более четырех недель в год.
Классификация АР по выраженности клинических симптомов
• Легкий АР (у больного не нарушены сон, дневная деятельность, успеваемость в школе, симптомы не носят мучительного характера).
• АР средней тяжести и тяжелый АР (пациента беспокоят нарушение сна, физической активности, дневной деятельности; заболевание оказывает отрицательное влияние на обучение; симптомы АР мучительные, для постановки диагноза достаточно одного из признаков).
Этиология
Как правило, АР развивается при попадании аллергенов непосредственно на слизистую оболочку полости носа. К таким аллергенам относят компоненты домашней пыли (например, микроклещей Dermatophagoides pteronyssinus, Dermatophagoides farinae, Eurogliphus maynei), перхоть, шерсть, перо и слюну домашних животных, плесневые грибы, корм для рыбок (дафния), разлагающиеся органические фрагменты (шерсть, бумагу, волосы), тараканов. АР часто возникает при попадании пыльцевых аллергенов. Пищевые аллергены и лекарственные препараты имеют меньшее значение, хотя могут вызывать обострение АР. Загрязнение воздуха (табачный дым, выхлопные газы) способствуют более тяжелому течению АР.
Патогенез
Первый контакт клеток иммунной системы с аллергенами запускает механизм синтеза IgE. Далее иммуноглобулины фиксируются на поверхности тучных клеток слизистой оболочки носа. Повторное попадание аллергена и связывание его с молекулами IgE приводит к дегрануляции тучных клеток и развитию немедленной аллергической реакции (длительностью примерно 30-40 мин). Острую аллергическую реакцию связывают с непосредственным воздействием медиаторов, главным образом гистамина. Клиническими признаками развившейся аллергической реакции служат интенсивный зуд, чиханье, отделение большого количества водянистого секрета. Более медленно реализуется отсроченная атопическая реакция, ее главные механизмы - повышение сосудистой проницаемости, активация и миграция клеток (эозинофилов, Т-лимфоцитов, тучных клеток) из сосудов в слизистую оболочку. При этом развивается аллергическое воспаление. При персистирующем рините симптомы обусловлены взаимодействием вновь поступающих аллергенов с текущим воспалением. В периоды, когда контакт с аллергенами минимальный, воспаление слизистой оболочки сохраняется даже при отсутствии симптомов ринита. Понимание концепции «минимального персистирующего воспаления» необходимо для грамотной терапии АР.
В результате хронического воспаления формируется гиперреактивность слизистой оболочки носа - усиление реакции на относительно слабые воздействия неаллергенного характера. Больные жалуются на приступы чиханья, обильные выделения из носа или
заложенность в ответ на запахи, физическую нагрузку, холодный воздух.
Клиническая картина
АР может возникнуть в любом возрасте, в том числе в первые месяцы жизни ребенка. Основные симптомы АР - ринорея, нару- шение носового дыхания, зуд носа, чиханье. Симптомы обратимы (спонтанно или под влиянием терапии).
Основой для выделения двух клинических вариантов течения АР служит наличие преобладающего симптома (чихания или заложенности носа).
Аллергический ринит: преобладающий симптом - чиханье
Основные жалобы: пароксизмальное чиханье (как правило, по утрам); водянистая ринорея; зуд носа, лица и глаз, вариабельная заложенность носа. Данный вариант АР часто диагностируют в сочетании с аллергическим конъюнктивитом.
Аллергический ринит: преобладающий симптом - заложенность носа
Чиханье и зуд практически не беспокоят пациентов. Преобладает отек слизистой оболочки носа, нередко значительно выраженный, усиливающийся в ночные часы; скудная ринорея, преимущественно в направлении носоглотки (задняя ринорея), сопровождающаяся раздражением в глотке и неприятным чувством стекания слизи (постназальный синдром). При наличии у детей кашля (особенно в ночное время) следует заподозрить постназальный синдром.
Иногда пациенты отмечают заметное преобладание одной из двух форм течения АР, однако при обследовании нередко обнаруживают сочетание обеих форм. При этом, как правило, чиханье беспокоит больного в дневные часы, а заложенность носа - ночью.
Осложнения
Заложенность носа (неприятный симптом) может стать причиной ухудшения аппетита или полного отказа от еды (сосания у ребен- ка грудного возраста); снижения обоняния; развития аномального прикуса; неспособности сосредоточиться; может вызывать головные боли; нарушения сна.
АР может вызвать поражение анатомически и функционально связанных с полостью носа областей: придаточных пазух носа, слуховых труб, конъюнктивы, ткани глоточной миндалины. Все перечисленные изменения (иногда сочетаются у одного пациента) указывают
при формулировке клинического диагноза: аллергический риноконъюнктивит, риносинусит, риноаденоидит.
Классические клинические признаки гайморита обнаруживают только у детей старше трех лет, фронтита - после десяти лет, аденоидита - в возрасте полутора-двух лет.
Диагностика
Диагноз АР ставят на основании типичных жалоб и клинической картины заболевания.
Анамнез
При сборе анамнеза оценивают причинную связь обострений с воздействием аллергенов. Отмечают прямые признаки сенсиби- лизации: приступы чиханья; зуд носа; ринорею в момент уборки квартиры, перестановки мебели, разборки платяных или книжных шкафов, игры с домашними животными, при посещении библиотеки, цирка, зоопарка. Косвенным, но не менее значимым, признаком сенсибилизации считают эффект элиминации-провокации. При бытовой сенсибилизации родители отмечают резкое улучшение состояния ребенка при выезде из своей квартиры (на дачу) и отчетливое ухудшение в самые первые дни после возвращения. При пыльцевой сенсибилизации существует сезонность обострений; ухудшение, как правило, наступает после прогулки или выезда в парк, лес или поле.
При осмотре отмечают легкую бледность и одутловатость лица; синие круги под глазами (следствие венозного застоя); приоткрытый рот; сухие потрескавшиеся губы; мацерацию кожи лица вокруг ноздрей; интенсивное почесывание носа, вследствие чего нередко образуется поперечная морщинка на кончике носа. Пациенты жалуются на обильные водянистые, прозрачные выделения из носа.
Лабораторные исследования
В цитограмме носового секрета и при изучении периферической крови обнаруживают большое количество эозинофилов. Исследования проводят в период обострения ринита (только при отсутствии вторичной бактериальной инфекции).
Инструментальные исследования Риноскопия
При передней риноскопии отмечают симметричный отек нижней и средней носовых раковин, бледность слизистой оболочки, прозрач- ное слизистое отделяемое.
Аллергологическая диагностика
Аллергологическая диагностика включает кожные скарификационные пробы с бытовыми и пыльцевыми аллергенами; эндоназальные провокационные пробы с аллергенами; исследование сыворотки крови на содержание общего и специфического IgE. Обследование выполняют в условиях аллергологического кабинета.
Рентгенологическое или ультразвуковое исследование
Проводят при подозрении на патологию придаточных пазух носа. Исследование функций внешнего дыхания
Риноманометрию или флоуметрию вдоха через нос применяют для оценки проходимости носовой полости, в том числе в динамике: до начала лечения и на фоне проводимой терапии.
У каждого пациента с АР необходимо исключить наличие БА. Для этого следует проводить спирометрическое исследование с про- бой с бронхоспазмолитиком.
Пример формулировки клинического диагноза
Формулируя диагноз, указывают степень тяжести и характер течения АР в соответствии с классификацией. Для более полной характеристики заболевания целесообразно указать установленный или предполагаемый спектр сенсибилизации и период заболевания (обострение или ремиссия).
Клинический диагноз
Аллергический ринит (сенсибилизация к клещам домашней пыли), легкое персистирующее течение, период обострения.
Дифференциальная диагностика
Обычно диагностика клинической формы АР с чиханьем не представляет сложностей. Для дифференциальной диагностики с рецидивирующим инфекционным ринитом необходимо обратить внимание на частые рецидивы заболевания, однотипность клинической картины при каждом обострении, отсутствие лихорадки, что характерно для аллергического заболевания, и своевременно заподозрить связь с воздействием аллергенов.
Дифференциальную диагностику АР с преобладанием заложенности носа проводится с более широким кругом заболеваний, из которых наиболее важны: гиперплазия аденоидов, анатомические аномалии, полипы, инородные тела полости носа, новообразования, исходящие из полости носа, пазух носа и черепных костей, гранулематоз Вегенера.
Лечение
Основные терапевтические мероприятия при АР.
• Уменьшение контакта с аллергенами (по возможности).
• Фармакотерапия.
• Специфическая иммунотерапия.
• Обучение пациентов и родителей.
• Хирургическое вмешательство.
Немедикаментозное лечение
Элиминационные мероприятия
Элиминационные мероприятия позволяют добиться существенного улучшения течения заболевания у детей. Их проводят всем больным АР, в том числе тем, у кого не удалось выявить причинно значимый аллерген. Для ограничения контакта с бытовыми аллергенами разработаны специальные рекомендации (рекомендации приведены в табл.
Специфическая иммунотерапия
Специфическую иммунотерапию с аллергенами домашней пыли, клещей домашней пыли и пыльцы проводит только аллерголог- иммунолог. Если после первого курса иммунотерапии получен поло-
жительный клинический эффект, целесообразно продолжать иммунотерапию в течение 3-5 лет.
Медикаментозное лечение
При фармакотерапии АР используют несколько групп препаратов. Чаще всего назначают лекарственные средства, вводимые интраназально или принимаемые внутрь. Режим дозирования и возрастные ограничения применения препаратов различных групп для терапии АР представлены в таблице (см. Приложение на CD).
Следует учитывать, что после прекращения приема препарата эффект не сохраняется на протяжении долгого времени, а следовательно, при персистирующем АР необходимо проводить длительные курсы лечения. Основные характеристики используемых препаратов сведены в таблицы, облегчающие практический подход к терапии АР.
Влияние различных лекарственных средств на симптомы аллергического
ринита и конъюнктивита
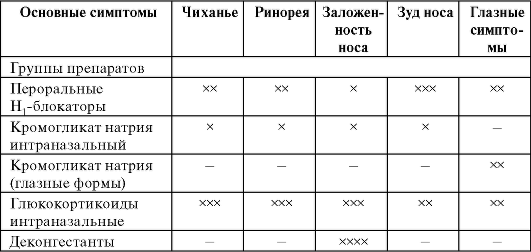
X - отмечена степень положительного эффекта.
Выбор препарата или комбинации препаратов зависит от тяжести заболевания, выраженности симптомов и целей терапии. Например, некоторые препараты способны быстро купировать беспокоящие пациента симптомы, а другие обладают в основном противовоспалительным действием (как правило, при длительном применении). Наиболее эффективными для купирования всех симптомов АР считают интраназальные глюкокортикоиды. Антигистаминные
лекарственные средства для приема внутрь, так же как и кромогликат натрия, оказывают существенно меньший эффект на симптом заложенности носа. Деконгестанты (препараты, снимающие отек слизистой оболочки носа), быстро и эффективно купируют заложенность носа, но не предназначены для длительного приема.
Практический подход к фармакотерапии аллергического ринита у детей

Гистаминоблокаторы II поколения
В таблице описан ступенчатый подход к терапии АР у детей. Hj-гистаминоблокаторы II поколения (неседативные) для приема внутрь характеризуются быстрым действием (эффект отмечают через 15-30 мин после проглатывания первой дозы), отсутствием значимых побочных эффектов, удобным режимом приема (один, иногда два раза в день). Препараты поступают в системный кровоток и купируют симптомы не только АР, но и симптомы сопутствующих аллергических заболеваний: зуд кожи и глаз. Длительность использования данных лекарственных средств любая - от однократных приемов (в зависимости от потребности) при редких приступах заболевания (или при необходимости, например когда ребенку нужно посетить библиотеку или родственников, имеющих домашнее животное), до непрерывных курсов продолжительностью несколько месяцев. После 3-4 нед непрерывного приема, препараты начинают производить не только антигистаминный, но и слабый противовоспалительный эффект; это позволяет закрепить положительный результат лечения.
Гистаминоблокаторы II поколения не оказывают седативного действия. При длительном приеме тахифилаксия не возникает. Целесообразно выбирать препараты, содержащие активно действующее вещество, а не «пролекарство» (только в процессе метаболиз-
ма приобретает способность производить требующийся эффект). Цетиризин (зиртек*), левоцетиризин (ксизал*), фексофенадин (тел- фаст*), дезлоратадин (эриус*) - лекарственные средства, оказывающие прямое действие.
К недостаткам гистаминоблокаторов следует отнести слабое влияние на заложенность носа. Для повышения эффективности лечения гистаминоблокаторы назначают в комбинации с интраназальными топическими глюкокортикоидами.
Кромогликат натрия
Кромогликат натрия обладает умеренным противовоспалительным действием, оказывает терапевтический эффект в отношении всех симптомов АР. Раствор (2 %) кромогликата натрия входит в состав назального спрея и глазных капель (их можно закапывать и в нос). Препарат характеризуется медленным действием (эффект лечения оценивают через две-три недели). Еще один недостаток кромогликата натрия - неудобный режим приема (препарат следует использовать не менее трех раз в день; а оптимально - четыре раза в сутки). Продолжительность применения кромогликата натрия составляет 3-6 мес. Родителей информируют о медленном развитии терапевтического эффекта препарата. Для терапии сезонного АР (поллиноза) кромогликат натрия назначают заранее (за две недели до начала сезона цветения растений, вызывающих обострение заболевания).
Несмотря на ряд существенных недостатков (умеренная эффективность, медленное действие, неудобный режим дозирования), кромогликат натрия относят к первому ряду препаратов, используемых для терапии АР у детей, в связи с исключительным профилем безопасности. Детям с легким АР и АР средней степени тяжести кромогликат натрия назначают как стартовое топическое противовоспалительное средство (в комбинации с гистаминоблокатором, принимаемым внутрь), а при отсутствии отчетливого эффекта через три недели после начала терапии переходят на топические интраназальные глюкокортикоиды. Глазные формы кромогликата натрия характеризуются более выраженным эффектом и быстрым действием, чем назальные.
Глюкокортикоиды
Необходимость назначения глазных форм глюкокортикоидов возникает редко.
Применение интраназальных глюкокортикоидов редко приводит к развитию местных нежелательных действий (они, как правило,
незначительны); при этом существует лишь теоретическая вероятность возникновения системных побочных эффектов, характерных для глюкокортикоидов (отмечают при нарушении режима дозирования). Данные препараты относят ко второму ряду лекарственных средств, назначаемых при АР. Интраназальные глюкокортикоиды (насобек*, тафен назаль*, фликсоназе*, назонекс*) - наиболее эффективные препараты, используемые для купирования всех симптомов АР, включая заложенность носа; способствуют быстрому восстановлению обоняния; оказывают благотворное влияние на сопутствующие симптомы аллергического конъюнктивита; снижают гиперреактивность слизистой оболочки носа. Глюкокортикоиды относят к лекарственным средствам быстрого действия, причем отчетливый эффект наблюдают через 3-6 сут после начала использования, а первые признаки положительного действия отмечают через двенадцать часов. Препараты характеризуются удобным режимом приема (один или два раза в день); их назначают курсом продолжи- тельностью от 3-4 нед и более.
В случае тяжелого АР и АР средней тяжести интраназальные глюкокортикоиды используют как стартовую терапию (в комбинации с гистаминоблокатором, принимаемым внутрь). Курс лечения составляет 3-6 нед (терапевтические дозы), затем в течение месяца проводят ступенчатое снижение дозы лекарственного средства. В результате возможна либо полная отмена препарата, либо применение его поддерживающей индивидуально подобранной эффективной дозы (до одного года подряд), либо переход на длительную терапию кромогликатом натрия. Нередко терапевтический эффект интраназальных глюкокортикоидов сохраняется в течение нескольких месяцев после их отмены, поэтому возможно проведение нескольких коротких курсов в течение года.
При наличии вторичной бактериальной инфекции курс интраназальных глюкокортикоидов назначают только после предварительно- го лечения (в течение 3-6 дней) обнаруженной инфекции.
Интраназальные глюкокортикоиды вызывают развитие только местных побочных эффектов, не требующих отмены и прекращения курса лечения (все симптомы кратковременны). К ним относят сухость и жжение в носу, чиханье, скудное носовое кровотечение.
Противопоказания.
• Грибковые, бактериальные и вирусные инфекции дыхательных путей в острой фазе.
• Активная форма туберкулеза легких.
• Недавно перенесенное оперативное вмешательство или травма носа (до заживления раны).
Глазные формы топических глюкокортикоидов - препараты дексаметазона (капли 0,1 %) применяют при неэффективности кромо- гликата натрия. Дексаметазон используют в сочетании с гистаминоблокатором (применяют внутрь) только при наличии резкого зуда и отека конъюнктивы и при полном отсутствии бактериальной и вирусной (в том числе, герпетической) инфекции. Курс лечения, как правило, недлительный. При применении дексаметазона у пациентов с герпесом роговицы возможно развитие перфорации роговицы (как один из побочных эффектов).
Системные (принимаемые внутрь или вводимые внутримышечно) глюкокортикоиды в педиатрической практике для лечения АР не используют.
Топические интраназальные и глазные гистаминоблокаторы не имеют существенных преимуществ перед препаратами, принимаемыми внутрь, как по терапевтическому эффекту, так и по быстро- действию. Данные лекарственные средства назначают, как правило, в дополнение к основной схеме лечения для купирования приступов сильного зуда, чиханья, а также для профилактики за 5-15 мин до возможного контакта с аллергеном (посещение библиотеки, урок физкультуры в зале). К недостаткам препаратов относят появляющийся во рту после использования назального спрея горький вкус.
Деконгестанты
Деконгестанты - α-адреномиметики для интраназального применения (називин* и некоторые другие) - быстро (в течение нескольких минут) и эффективно купируют заложенность носа. Их назначают в дополнение к основной терапии, особенно в первые дни лечения (до формирования стойкого эффекта интраназальных глюкокортикоидов). Как правило, деконгестанты включают в схему терапии при резко выраженной заложенности носа и при наличии синусита или тубоотита. Недостатками деконгестантов считают их парадоксальное действие («медикаментозный ринит») и развитие тахифилаксии при длительном применении (более 10 дней подряд).
Побочные действия (сердцебиение, возбуждение, беспокойство, головная боль, бессонница) отмечают только при передозировке пре- паратов. Виброцил* - препарат для интраназального применения,
содержащий комбинацию гистаминоблокатора и α-адреномиметика, используемый так же как и простые деконгестанты. Однако виброцил* действует более эффективно.
Хирургическое лечение
Хирургическое вмешательство выполняют некоторым больным (при тщательно проведенном анализе показаний) в случае невозможности восстановления носового дыхания консервативным путем (при наличии необратимых форм гипертрофического ринита или анатомических аномалий). Аденотомию у детей с АР также производят по строгим показаниям, например: при полном отсутствии носового дыхания и неэффективности полноценной консервативной терапии, включающей интраназальные глюкокортикоиды, и появлении осложнений (апноэ во сне, снижение слуха). Аденотомию выполняют только вне сезона цветения растений, вызывающих приступы АР (на этот момент ребенок должен быть полностью здоров). После аденотомии существует определенная вероятность развития БА.
Дальнейшее ведение
АР, как и другие атопические заболевания, характеризуется хроническим рецидивирующим течением, поэтому в терапии особое внимание уделяют долговременному контролю над течением заболевания, не ограничиваясь быстрым купированием обострений.
Прогноз
АР - хроническое заболевание. С осторожностью следует подходить к регистрации выздоровления от АР. Заболевание может возобновиться в любой момент, независимо от длительности периода ремиссии. Длительные, стойкие ремиссии заболевания наиболее часто наблюдают в случае полного прекращения контакта с причинно значимым аллергеном (удаление домашнего животного, смена места жительства). Последовательная, грамотно выполняемая терапия АР не только способствует достижению длительных периодов ремиссии заболевания, снижению назальной (и сопутствующей бронхиальной) гиперреактивности, но и предупреждает развитие БА. Отсутствие терапии, как правило, приводит к прогрессированию заболевания.
Диспансеризация
Диспансерное наблюдение проводят:
- аллерголог: дети с тяжелым течением АР, с сочетанием АР с БА, дети с АР, получающие специфическую иммунотерапию;
- отоларинголог: дети с тяжелым течением АР, дети, перенесшие хирургическое вмешательство.
ПОЛЛИНОЗ
Определение
Поллиноз - группа заболеваний, обусловленных развитием аллергической реакции на пыльцу растений.
Код по МКБ-Х
J30 Вазомоторный и аллергический ринит.
J30.1 Аллергический ринит, вызванный пыльцой растений.
Эпидемиология
Распространенность поллиноза зависит от некоторых природных и социальных факторов, поэтому в различных подгруппах детского населения количество детей, имеющих пыльцевую аллергию, не одинаково.
Наибольшую распространенность поллиноза регистрируют в теплых странах, где определяют высокую концентрацию пыльцы в воздухе вследствие продолжительного периода цветения растений.
Как показали результаты различных исследований, у жителей мегаполисов поллиноз диагностируют в 4-6 раз чаще, чем у людей, живущих в сельских областях (например, вдали от вредного произ- водства). Развитие симптомов ринита или конъюнктивита, отмечаемое во время поездок семьи с ребенком за город или в парк, - характерный признак пыльцевой аллергии. В то же время жители городов контактируют с более агрессивной пыльцой, так как пыльцевые зерна покрыты оболочкой из остатков дизельного топлива, продуктов сгорания и взвешенных в воздухе частиц. Эти частицы абсорбируют пыльцу и способствуют попаданию аллергенов в дыхательные пути в повышенных количествах. При этом наблюдают усиление и искажение реакций на аллергены со стороны антиген-представляющей клетки. При связывании пыльцы с дизельным топливом химическая
структура белка пыльцы может измениться. Как правило, процесс сопровождается увеличением аллергенности.
Мальчики болеют поллинозом в 2 раза чаще девочек. Чаще болеют дети, родившиеся в теплое время года, а не зимой. Заболевание дебю- тирует относительно поздно, первые признаки поллиноза возникают примерно к 5-8 годам (типичный возраст). Поэтому среди детей, больных поллинозом, преобладают школьники, доля детей младше трех лет невелика и составляет примерно 7 %. Лишь в единичных случаях симптомы пыльцевой аллергии отмечают в первый в жизни ребенка сезон цветения растений.
По данным эпидемиологических исследований, в средних широтах и севернее распространенность поллиноза среди детского насе- ления достигает 10 %. Так, в Санкт-Петербурге поллинозом болеют 6,3 % детей школьного возраста.
Профилактика
Первичная профилактика поллиноза (т. е. предотвращение формирования заболевания) заключается в прицельной работе с детьми, имеющими факторы риска:
- отягощенную наследственность по любому атопическому заболеванию в семье;
- наличие у ребенка атопического дерматита, АР (без пыльцевой сенсибилизации), БА.
Меры первичной профилактики: своевременная и полноценная терапия имеющихся аллергических заболеваний.
Вторичная профилактика - предотвращение появления новых видов сенсибилизации, что привело бы к усилению клинических проявлений поллиноза и удлинению сезона обострения; эффективной мерой служит своевременное лечение с применением аллерген-специфической иммунотерапии (проводит специалист аллерголог-иммунолог).
Предсезонная профилактика, направленная на облегчение клинических проявлений обострения, проводится ежегодно до начала сезона цветения и включает:
- специфическую иммунотерапию;
- заблаговременное начало фармакотерапии до начала сезона цветения.
Скрининг
Скрининговые тесты не проводят.
Классификация
Классификации поллиноза как таковой не существует, так как поллиноз - группа заболеваний, каждое из которых имеет собственную классификацию (аллергический ринит/конъюнктивит, БА).
Этиология
Развитию поллиноза способствует попадание пыльцы некоторых видов (их сравнительно немного) растений на слизистые оболочки. Пыльца приблизительно пятидесяти (из существующих на Земле тысячи видов) ветроопыляемых растений обладает высокой аллергенностью. Растение с аллергенной пыльцой должно быть широко распространено в данной географической зоне. Большинство растений, вызывающих поллиноз, относят именно к группе ветроопыляемых. Ветроопыляемые растения имеют ряд приспособлений, способствующих эффективному опылению. Так, легкая и, следовательно, летучая пыльца вырабатывается в огромном количестве, разносится ветром на большие расстояния. Как правило, пыльца имеет небольшие размеры (диаметр не более 35 мкм), что позволяет ей проникать в дыхательные пути. Пыльца насекомоопыляемых растений (одуванчик, подсолнух, мимоза) нелетучая, но может вызывать симптомы поллиноза при непосредственном контакте с ней. Сроки начала и продолжитель- ность сезона цветения и, соответственно, сезонных обострений поллиноза зависят от географической широты и состава флоры в регионе. Существуют «календари цветения» и службы палинологического мониторинга, предоставляющие информацию, позволяющую сориентироваться при определении причинно значимых для пациента видов пыльцы.
В средней полосе и северных регионах выделяют три периода цветения и три пика поллиноза.
• Цветение деревьев. Поллиноз вызывает цветение березы, ольхи, лещины (цветение начинается в начале апреля, достигает максимума к началу мая), клена, тополя, дуба (цветут в мае). Сенсибилизацию определяют у 56 % пациентов.
• Цветение таких луговых трав, как райграс, тимофеевка, ежа, лисохвост, мятлик (цветение продолжается с начала июня до конца августа). Сенсибилизацию обнаруживают у 75 % пациентов.
• Цветение так называемых сорняков, например полыни и лебеды. В южных областях огромное значение в этиологии поллиноза
имеет амброзия (период цветения - август и первая половина сентября).
Сроки цветения растений год от года изменяются мало, так как зависят преимущественно от продолжительности светового дня. В то же время особенности погоды (ранняя или поздняя весна, заморозки, дожди) влияют на количество пыльцы в воздухе.
Как и при других атопических заболеваниях, сенсибилизацию к одному единственному пыльцевому аллергену наблюдают редко, как правило, в самом начале заболевания. Эта кратковременная (и благоприятная для проведения специфической иммунотерапии) фаза продолжается не более одного-двух сезонов цветения. Затем быстро формируется поливалентная сенсибилизация. Причем у 83 % детей обострения поллиноза провоцируют две группы растений (например, деревья и травы, или травы и «сорняки»), а более чем у половины больных отмечают сенсибилизацию практически ко всем растениям, входящим в состав указанных групп. При длительно текущем заболевании (более 6-10 лет) у70 % детей формируется и бытовая сенсибилизация, изменяющая картину поллиноза, а следовательно, требующая разработки индивидуального лечения.
В период цветения концентрация пыльцы в воздухе изменяется: максимальное ее количество определяют в середине сезона, а в начале и в конце календарного сезона цветения пыльцы, как правило, гораздо меньше. На концентрацию пыльцы в воздухе влияют погодные условия. Количество пыльцы увеличивается при повышении температуры воздуха, атмосферного давления, скорости ветра и снижается при высокой влажности, дожде и безветрии. В течение суток растения подчиняются циркадным ритмам выброса пыльцы: большинство растений активно выбрасывают пыльцу в утренние часы. От колебания концентрации пыльцы в воздухе зависит состояние больных поллинозом.
Патогенез
Поллиноз - типичное атопическое заболевание, в 100 % случаев обусловленное IgE-зависимым механизмом. Пыльцевые зерна несут не только аллергенные белки, но и ферментативные системы, облегчающие проникновение пыльцевого зерна в эпителий (фактор проницаемости). Первый контакт иммунных клеток с антигенами пыльцы запускает механизм синтеза IgE, затем происходит фиксация IgE на поверхности тучных клеток в коже и слизистых оболочках. Повторное попадание аллергена и связывание его с молекулами IgE приводит
к дегрануляции тучных клеток и развитию острой аллергической реакции (длительность 30-40 мин). Признаки острой аллергической реакции - интенсивный зуд, гиперемия, выделение большого количества водянистого секрета, спазм гладкой мускулатуры бронхов. Более медленно формируется отсроченная атопическая реакция. Главные механизмы отсроченной реакции - повышение сосудистой проницаемости, активация и миграция клеток (эозинофилов) с развитием аллергического воспаления и тканевой гиперреактивности (назальной, конъюнктивальной, бронхиальной). Поздняя атопическая реакция имеет большое значение в формировании пыльцевой БА.
Клиническая картина
Аллергический процесс может захватывать одну или несколько характерных локализаций, поэтому пациент может предъявлять сразу несколько жалоб. Наиболее часто отмечают поражение слизистой оболочки полости носа и конъюнктивы. Другие симптомы поллиноза, как правило, сочетаются с типичным пыльцевым ринитом или риноконъюнктивитом.
Основные группы признаков, характерных для поллиноза
• Поражение слизистой оболочки полости носа. Клинические симптомы включают зуд носа и лица, приступы чиханья, выделение водянистой слизи, отек (заложенность носа, сухость, чувство жжения), нарушение сна, головную боль, мацерацию кожи около ноздрей, одутловатость лица. Вторичное инфицирование развивается редко, как правило, на фоне длительно текущего процесса. Развернутая клиническая картина пыльцевого ринита может формироваться как постепенно, так и стремительно в течение суток (иногда немного дольше), имитируя острую вирусную инфекцию. Поражение распространяется на придаточные пазухи носа, слуховые трубы и конъюнктиву глаз.
• Пыльцевой конъюнктивит. Ребенка беспокоят зуд, слезотечение, резь в глазах, светобоязнь, ощущение «песка в глазах». При осмотре отмечают отек и сосудистое инъецирование конъюнктивы, а также отеки век. При подозрении на поражение роговицы и более глубоких сред глаза (резкая боль в глазу, корнеальная инъекция сосудов от роговицы к периферии, снижение остроты зрения) пациента направляют на срочную консультацию к окулисту. Вторичное инфицирование с развитием слизисто-гнойного отделяемого, склеивающего веки, у детей наблюдают часто.
• Пыльцевой ринит и риноконъюнктивит нередко сочетается с симптомами пыльцевого ларингита - кашлем, осиплостью голоса, ощущением «комка» и першением в горле, кратковременным затруднением вдоха, рецидивирующим стенозом гортани. Признак поражения трахеи - приступообразный, навязчивый кашель, зачастую вызывающий рвоту.
• Пыльцевая БА. У 30 % больных БА существует пыльцевая сенсибилизация. Пыльцевая астма может сформироваться двумя путями. Впервые возникший приступ поллиноза очень редко развивается параллельно с БА (клинические признаки поллиноза и астмы в сезон дебюта заболевания диагностируют в 4 % случаев). Обычно через 2-3 года после возникновения пыльцевого риноконъюнктивита пациенты отмечают (в сезон цветения) присоединение кашля, а еще через 2-3 года формируется типичная астма пыльцевой этиологии. Нередко регистрируют и второй вариант развития пыльцевой астмы. При этом впервые возникший АР приобретает постоянный (круглогодичный) характер, затем происходит формирование бытовой астмы, а через несколько лет отмечают присоединение пыльцевой сенсибилизации и появление приступов в весенне-летнее время. Наличие приступов астмы в весенне-летний период дает основание подозревать пыльцевую сенсибилизацию (подтверждают при проведении аллергологического обследования). Особого внимания заслуживают дети (с еще не установленным диагнозом БА), в весенне-летнее время имеющие склонность к «простудным» заболеваниям, протекающим с вовлечением нижних дыхательных путей (клиническая картина простого или обструктивного бронхита).
• Поражение кожи. Лето - благоприятное время года для детей с кожными аллергическими заболеваниями. При атопическом дерматите наблюдают спонтанную ремиссию в летние месяцы. Парадоксальное обострение атопического дерматита, появление кожного зуда, уртикарных высыпаний весной и летом (особенно на открытых участках кожи) - показания к проведению обследования для исключения пыльцевой сенсибилизации.
• «Пыльцевая интоксикация» - своеобразный комплекс симптомов поражения ЦНС. Больного беспокоит неопределенное недомогание, слабость, головокружения. При этом АД и частота сердечных сокращений могут быть в пределах нормы. Сочетание интоксикации с катаральным синдромом убедительно имитиру-
• ет ОРВИ. Иногда определяют и небольшой подъем температуры, особенно у детей младшего возраста. Нарушение сна и снижение концентрации внимания отражаются на успеваемости в школе. При сборе анамнеза следует учитывать, что больной часто недооценивает нарушение деятельности нервной системы и не ощущает рассеянности и замедления реакции. К сожалению, назначение при поллинозе антигистаминных лекарственных средств I поколения, обладающих седативным действием и усугубляющих симптомы пыльцевой интоксикации - довольно распространенная ошибка, допускаемая при лечении данного заболевания. Перекрестная пищевая аллергия развивается в результате сходного строения первичной и третичной структуры белков пыльцы и других частей (плодов) соответствующего растения и других растений, принадлежащих чаще к одному и тому же семейству. Поэтому иммунная система пациента распознает белки пищевых продуктов как близкие по структуре аллергены пыльцы. У 55 % больных поллинозом диагностируют пищевую аллергию (как правило, не сезонную, а круглогодичную) на фрукты, овощи, орехи. Признаки аллергии представляют полиорганные реакции с поражением ЖКТ, кожи, дыхательной системы, глаз. Часто отмечают «синдром оральной аллергии», включающий зуд и жжение во рту; зуд и отек губ; уртикарную сыпь вокруг рта сразу после разжевывания и проглатывания продукта. Благодаря немедленному развитию таких реакций пациенты обычно хорошо знают, какие продукты они не переносят.
Перекрестная пищевая аллергия у больных поллинозом
Сенсибилизация | Продукты, вызывающие клинически значимые перекрестные реакции |
Пыльца деревьев | Орехи, яблоки, вишня, черешня, персики, абрикосы, сливы, морковь (сырая), киви, помидоры, сырой картофель (брызги сока, попадающие на лицо при чистке картофеля), березовый сок, зеленый горошек, мед, фитопрепараты, груши, сельдерей, петрушка, соя, малина |
Пыльца луговых трав (злаки) | Мед, фитопрепараты, мучные продукты |
Пыльца сорняков | Дыни, арбузы, семена подсолнечника, халва, горчица, мед, фитопрепараты, майонез, кабачки, баклажаны, подсолнечное масло, шпинат, свекла, топинамбур, цикорий, абсент, вермут |
Диагностика
Анамнез
Важнейший признак заболевания - отчетливая сезонность возникновения симптомов. При сборе анамнеза обращают внимание «простудные» заболевания, рецидивирующие в весенне-летнее время, на фоне благоприятной эпидемиологической обстановки, т. е. в случаях, когда другие дети здоровы.
По статистическим данным, распространенность поллиноза значительно ниже, чем по данным эпидемиологических исследований; это отчасти связано с несвоевременной диагностикой. Правильный диагноз поллиноза ставят, как правило, с опозданием на 2-5 лет. Доля диагностических ошибок в детском возрасте очень велика, так как симптомы поллиноза напоминают ОРИ, особенно если заболевание возникает остро, сопровождается интоксикацией и субфебрильной температурой. При пыльцевом конъюнктивите чаще, чем при рините, происходит вторичное инфицирование; при этом обнаруживают бактериальный конъюнктивит и назначают местную антибактериальную терапию (которая оказывает хороший эффект), а основной диагноз, как правило, пропускают. Запоздалая диагностика пыльцевой аллергии ведет к многократному лечению ребенка антибактериальными и иммуностимулирующими препаратами. Аллергическое заболевание из года в год прогрессирует, расширяется спектр сенсибилизации, формируется пыльцевая БА. Задача любого врача, работающего с ребенком, - вовремя заподозрить аллергическую (пыльцевую) этиологию заболевания. Важнейший признак - сезонность возникновения клинических симптомов и наличие сведений об атопии у ребенка (и в семье).
Анамнестические данные, позволяющие заподозрить поллиноз
• Существование склонности к простудным заболеваниям (ОРВИ) в весенне-летний период.
• Наличие упорных повторяющихся приступов кашля и удушья, насморка, зуда и отека глаз, развитие зудящих высыпаний на коже (весной или летом).
• Возникновение непереносимости таких продуктов, как, яблоки, лесные орехи, мед или семечки.
Лабораторные исследования
Наличие большого количества эозинофилов в крови и назальном секрете (эозинофилия) свидетельствует об аллергической природе заболевания.
Эффективность противоаллергической терапии также однозначно указывает на этиологию недомогания.
Инструментальные исследования
Для проведения аллергологического обследования и решения вопроса о назначении специфической иммунотерапии пациента следует направить на консультацию к аллергологу (после окончания сезона цветения, в октябре-ноябре). Исследование содержания общего IgE для подтверждения атопического генеза заболевания необходимо выполнять в сезон цветения (так как синтез IgE повышен именно в это время).
Пример формулировки клинического диагноза
Развернутая формулировка клинического диагноза включает сведения о спектре сенсибилизации (точно или предположительно), топический диагноз, период заболевания. При наличии БА ее считают основным диагнозом.
Клинический диагноз (примеры)
• Поллиноз, сенсибилизация к пыльце деревьев и луговых трав, риноконъюнктивит, период обострения.
• БА, атопическая (пыльцевая сенсибилизация), легкое интермиттирующее течение, период ремиссии.
Дифференциальная диагностика
Наиболее часто приходится проводить дифференциальную диагностику поллиноза и ОРВИ, причем как в случае первичной диагностики поллиноза, так и у больного с уже известной пыльцевой аллергией, когда следует решать вопрос, с чем связано появление катарального синдрома в весенне-летнее время: с обострением поллиноза, с началом ОРВИ, или с обеими причинами одновременно.
Лечение
Исключить контакт с пыльцой невозможно, однако некоторые мероприятия могут принести больному существенное облегчение. Рекомендации по налаживанию гипоаллергенного быта приведены в табл. 1 (см. Приложение на CD).
Немедикаментозное лечение
При пыльцевой аллергии противопоказаны лекарственные травы и препараты на основе растительного сырья. При назначении диеты
следует учитывать наличие симптомов непереносимости фруктов, овощей, орехов. Недопустимо запрещать ребенку все растительные продукты, представленные в таблице по перекрестной аллергии, так как ребенок в этом случае будет лишен большинства фруктов и овощей (как правило, родители отказываются от соблюдения данной рекомендации). Однако родителей следует ознакомить со списком продуктов, наиболее часто вызывающих аллергическую реакцию у детей. Необходимо полностью исключить только продукты, обладающие наибольшей аллергенностью - мед, орехи, киви, горчицу (противопоказано также ставить ребенку горчичники). Термическая обработка улучшает переносимость аллергенных продуктов, поэтому при развитии орального синдрома после употребления яблок и моркови рекомендуют готовить печеные яблоки и блюда из отварной моркови.
Медикаментозное лечение
Пациенту, впервые обратившемуся в сезон цветения, назначают терапию, соответствующую топике и тяжести поражения (принципы фармакотерапии описаны в главах, посвященных АР и БА).
У пациента с установленным диагнозом поллиноза фармакологическое лечение на следующий сезон цветения планируют заранее (лечение желательно начать до появления в воздухе большого количества пыльцы).
Гистаминоблокаторы
В группу гистаминоблокаторов II поколения входят такие препараты, как, зиртек*, ксизал*, телфаст* и эриус*. Антигистаминные препараты обладают свойством быстродействия (купируют патологи- ческие симптомы спустя 15-30 мин после первого применения); это обусловливает возможность выбора режима назначения. В наиболее легких случаях (приступы чиханья и зуда носа 2-3 раза в неделю) данные лекарственные средства употребляют по мере надобности (один раз в сутки); в более тяжелых - препарат назначают на весь сезон цветения (прием начинают сразу после появления первых симптомов поллиноза). Гистаминоблокаторы купируют зуд, слезотечение, чиханье и обострения атопического дерматита. В то же время применение антигистаминных препаратов в качестве монотерапии приводит к полному исчезновению всех симптомов поллиноза только у некоторых пациентов. В большинстве случаев необходимо использовать комбинацию гистаминоблокаторов и топических препаратов.
Кромогликат натрия
Курс лечения интраназальными и глазными препаратами кромогликата натрия начинают за две недели до предполагаемого начала цветения растения, вызывающего обострение поллиноза, и продолжают в течение всего сезона.
Интраназальные глюкокортикоиды
Терапевтический эффект топических интраназальных глюкокортикоидов развивается через 3-6 дней после первого применения, однако положительные изменения можно почувствовать уже через 12-24 ч. В зависимости от желания и возможностей пациента врач подбирает наиболее оптимальный способ применения интраназальных глюкокортикоидов. Плановый прием препаратов начинают за несколько дней до цветения растений либо только при возникновении первых клинических симптомов пыльцевого ринита, кроме того, переход на интраназальные глюкокортикоиды производят в случае неэффективности интраназального кромогликата.
Существуют различные схемы терапии.
• После окончания двухнедельного (или месячного) курса лечения глюкокортикоидами (в стабильной дозе) производят ступенчатое снижение дозы с полной отменой препарата к концу сезона цветения.
• После окончания двухнедельного (или месячного) курса лечения глюкокортикоидами (в стабильной дозе) производят ступенчатое снижение дозы, а затем осуществляют постепенный переход на кромогликат натрия.
Выбор схемы лечения зависит от тяжести клинических симптомов поллиноза и продолжительности сезона цветения.
Хирургическое лечение
В сезон цветения не проводят профилактических вакцинаций и плановых оперативных вмешательств.
Дальнейшее ведение
В осенне-зимний период детям, начиная с пятилетнего возраста, проводят специфическую иммунотерапию (по показаниям).
Прогноз
Лишь у 40 % детей заболевание протекает без ухудшения, а выраженность клинических признаков с течением времени изменяется
незначительно (например, в связи с колебаниями количества пыльцы в воздухе). У 60 % пациентов поллиноз прогрессирует; при этом отмечают расширение спектра сенсибилизации (с удлинением сезона обострения заболевания) и диагностируют поражение различных органов. Эволюция поллиноза в пыльцевую БА не неизбежна, но риск развития пыльцевой астмы через несколько сезонов цветения у ребенка, страдающего поллинозом, очень высок. Специфическая иммунотерапия - единственный метод лечения, снижающий риск формирования бронхиальной астмы или позволяющий удлинить период до появления первых симптомов астмы.
Диспансеризация
На диспансерном наблюдении у аллерголога находятся дети, получающие лечение методом специфической иммунотерапии.
Глава 3
Бронхиальная астма
Определение
БА - заболевание, вызванное хроническим аллергическим воспалением бронхов и бронхиол, сопровождающееся их гиперреактивностью. Основные симптомы БА - периодически возникающие приступы затрудненного дыхания или удушья в результате распространенной бронхиальной обструкции, обусловленные спазмом бронхов, гиперсекрецией слизи, отеком стенки бронхов. Бронхиальная обструкция (под влиянием лечения или спонтанно) обратима.
Код по МКБ-10
J45 Астма.
J45.0 Астма с преобладанием аллергического компонента.
J45.1 Неаллергическая астма.
J45.8 Смешанная астма.
J45.9 Астма неуточненная.
J46 Астматический статус (status asthmaticus).
Эпидемиология
БА - одно из самых распространенных хронических заболеваний детского возраста, приводящее (в ряде случаев) к значительным физическим, эмоциональным и социальным ограничениям в жизни больных. Начавшись в детском возрасте, БА, как правило, прогрессирует с течением времени, нередко становясь причиной инвалидности, а иногда и летального исхода. Астма (особенно ее тяжелая форма) резко снижает качество жизни пациента.
Распространенность БА среди детского населения составляет не менее 5 %. В детском возрасте астмой чаще заболевают мальчики. Диагноз БА детям обычно ставят с опозданием на 4-5 лет, особенно при легком течении заболевания. Таким образом, значительному количеству детей с легкой формой БА на основании ошибочного диагноза (например, рецидивирующий обструктивный бронхит, аллергический обструктивный бронхит) назначают и неадекватную терапию.
Профилактика
Выделяют несколько уровней профилактики БА.
• Первичная профилактика - профилактика реализации атопии, т. е. продукции аллерген-специфических IgE, у генетически предрасположенных плодов и детей раннего возраста. Мероприятия первичной профилактики в основном находятся на стадии теоретического изучения и разработки. Большое внимание уделяется грамотному ведению беременности, налаживанию грудного вскармливания, борьбе с пассивным курением, ограничению контакта с аллергенами домашней пыли и животных.
• Вторичная профилактика - профилактика формирования БА у детей с сформировавшейся сенсибилизацией и атопическими заболеваниями (атопический дерматит, АР):
- своевременное и адекватное лечение имеющихся атопических заболеваний;
- специфическая иммунотерапия имеющихся атопических заболеваний.
• Третичная профилактика - предотвращение прогрессирования сформировавшейся БА, профилактика развития необратимых изменений бронхов, инвалидизации и летального исхода. Мероприятия заключаются в проведении адекватного степени тяжести комплексного лечения БА, включающего элиминационные мероприятия, образовательные программы для пациентов, фармакотерапию, реабилитационные мероприятия.
Скрининг
Скрининговые тесты не проводят. Важным инструментом раннего выявления формирующейся БА следует считать проведение спирометрического исследования с пробой с бронхоспазмолитиком у детей группы риска (т. е., у больных АР).
Классификация
БА классифицируют по степени тяжести (существует четыре формы заболевания), определяющей объем необходимой терапии.
• Легкая интермиттирующая БА.
• Легкая персистирующая БА.
• БА средней тяжести.
• Тяжелая БА.
Заболевание характеризуется волнообразным течением. Выделяют три периода БА: приступ, обострение и ремиссию.
• Приступ БА - острое состояние (ограничено по времени) экспираторного удушья, затрудненного дыхания и/или свистящего дыхания и спастического кашля при существенном для данного больного снижении показателя пиковой скорости выдоха (ПСВ).
• Обострение БА - период времени (дни, недели или даже месяцы), характеризующийся наличием клинически и субъективно выраженного либо скрытого синдрома бронхиальной обструкции. В этот период отмечают повторение острых приступов БА (различных по тяжести и длительности).
• Ремиссия - период клинического благополучия. Ремиссия может быть неполной (отсутствие клинических признаков болезни при сохранении функциональных нарушений). Ремиссия может наступать спонтанно или под влиянием терапии (фармакологическая ремиссия).
Этиология
Формирование БА связывают с сочетанием внешних и внутренних факторов. Доказано существование наследственной (полигенной) предрасположенности к БА, атопии и гиперреактивности бронхов. Семейный характер заболевания не вызывает сомнений. В случае если оба родителя болеют БА, риск развития данной патологии у ребенка возрастает в семь раз. Наиболее важными факторами внешней среды, способствующими реализации наследственной предрасположенности, считают аллергены, респираторные инфекции, неблагоприятную экологическую ситуацию, курение в семье.
Патогенез
Основа патогенеза БА (вне зависимости от степени тяжести заболевания) - хроническое аллергическое воспаление брон- хов. Атопический механизм БА определяют более чем у 90 % детей, страдающих данным заболеванием. Несмотря на проведение неоднократных обследований, у некоторых пациентов, преимущественно с «трудной», плохо контролируемой астмой, ведущие механизмы хронического воспаления обнаружить не удается вследствие невозможности подтверждения атопии.
Ранние и поздние атопические реакции на попадание аллергена в дыхательные пути помимо патофизиологических нарушений (спазм
бронхов, отек, гиперсекреция), приводят к формированию хронического воспалительного процесса бронхиальной стенки. К морфологическим признакам воспаления относят обнаруживаемую в просвете бронхов слизь, содержащую различные клетки; дисплазию и десквамацию эпителия; увеличение числа бокаловидных желез; инфильтрацию слизистой оболочки лимфоцитами и гранулоцитами, с преобладанием эозинофилов. Через несколько лет после возникновения БА (особенно при отсутствии противовоспалительной терапии) развиваются необратимые изменения (ремоделирование) бронхов, например утолщение базальной мембраны эпителия. Воспаление бронхов сохраняется и при легком течении БА, и в период ремиссии.
Гиперреактивность бронхов - патологически высокая чувствительность бронхов, возникающая в ответ на ряд раздражителей, не вызывающих такой реакции в нормальных условиях. Гиперреактивность определяют генетические механизмы, ее резкое усиление отмечают на фоне аллергического воспаления.
Клиническая картина
Дебютом БА становится первый в жизни ребенка синдром бронхиальной обструкции, который наиболее часто расценивается как острый обструктивный бронхит. Зачастую типичный приступ удушья возникает у ребенка через много лет после первого синдрома бронхиальной обструкции. У трети детей, больных астмой, первый синдром бронхиальной обструкции развивается в первые два года жизни. У 80% детей астматические приступы регистрируют в трех- пятилетнем возрасте. Раннее начало особенно характерно для тяжелых форм БА.
Факторы, провоцирующие обострения БА у детей
• Аллергены. Наибольшее значение имеют аллергены, попадающие непосредственно на слизистые оболочки полости носа и бронхов (аллергены домашней пыли, животных или пыльца). Пищевые аллергены (молоко, рыба или ее запах, мед) и лекарственные средства также могут стать причиной развития астматического приступа.
• Респираторные инфекции.
• Физическая нагрузка.
• Метеорологические факторы (резкие изменения погоды, перепады температуры воздуха и атмосферного давления).
• Стресс, отрицательные и положительные эмоциональные переживания.
Клинические признаки астмы очень разнообразны. Типичный симптом БА - приступ затрудненного дыхания, обусловленный распространенным бронхоспазмом. Приступ может начаться остро, в течение нескольких минут после контакта с аллергеном. Часто, особенно у детей младшего возраста, перед приступом в течение некоторого времени (от нескольких минут до трех суток) регистрируют особые признаки-предвестники (усиление симптомов АР или зуда кожи, сухой кашель, ребенок капризничает, хуже ест и спит, или, наоборот, сонлив). В момент приступа отмечают клинически симптомы, характерные для синдрома бронхиальной обструкции и дыхательной недостаточности. Ребенок принимает вынужденное положение (ортопноэ), бледен, возбужден, гиперактивен. Нередко возникают акроцианоз и кашель (непродуктивный, приступообразный, навязчивый). Регистрируют тахикардию и тахипноэ с удлине- нием фазы выдоха (характерны дистантные хрипы). Грудная клетка вздута, видна работа основной и вспомогательной дыхательной мускулатуры (втяжение яремной ямки, межреберных промежутков).
Первые проявления БА у детей, как правило, отличаются от клинической картины типичного приступа. Рецидивирует слабо и умеренно выраженный синдром бронхиальной обструкции (без очевидной связи с воздействием аллергена). У значительной части детей синдром бронхиальной обструкции провоцируют вирусные инфекции.
Грудному ребенку поставить диагноз БА наиболее трудно (с этим связано отсутствие статистических данных о распространенности БА у детей данного возраста).
Осложнения
При проведении адекватной терапии осложнения БА у детей развиваются редко. Как правило, осложнения диагностируют при тяжело протекающем заболевании. К ним относят ателектазы, медиастинальную и подкожную эмфизему, спонтанный пневмоторакс, легочное сердце, эмфизему легких.
Диагностика
Остро развившийся клинически очерченный приступ удушья, купированный введением Р2-адреномиметика, не представляет сложности для диагностики.
Диагноз БА ставят на основании нозологической диагностики (используют данные анамнеза), клинической картины, исследования
функции внешнего дыхания (у детей старше пяти лет). При формулировании диагноза указывают степень тяжести астмы и период течения болезни.
Критерии диагностики БА
• Рецидивирующий обратимый синдром бронхиальной обструкции и/или приступы удушья. Признаки, позволяющие дифференцировать впервые возникший приступ БА и обструктивный бронхит.
- Наличие атопии.
- Эозинофилия крови (обычно определяют в период реконвалесценции, а не в острую стадию).
- Острое, внезапное развитие бронхиальной обструкции.
- Провоцирующая роль аллергенов (например, ослабление бронхиальной обструкции при перемене места жительства или в стационаре и возобновление патологических симптомов после возвращения в свою квартиру).
- Отсутствие лихорадки и характерной для вирусной инфекции цикличности течения.
- Быстрый выраженный эффект b2-адреномиметиков.
При наличии в анамнезе трех и более приступов бронхиальной обструкции вероятность формирования БА у годовалого ребенка составляет 50 %, а у ребенка старше четырех лет - 95 %.
• Диффузный бронхоспазм.
Для подтверждения диффузного бронхоспазма проводят аускультацию, оценивают эффект бронхоспазмолитиков. Детям старше 4- 5 лет для подтверждения БА выполняют спирометрию и пробы с бронхоспазмолитиками. Увеличение объема форсированного выдоха за первую секунду (ОФВ1) на 12 % (и более) после ингаляции b2-адре- номиметика свидетельствует об обратимости диффузного бронхоспазма.
• Гиперреактивность дыхательных путей. Данное состояние обнаруживают, как правило, при сборе анамнеза. Гиперреактивность - повышенная чувствительность слизистой оболочки бронхов в ответ на воздействие факторов не аллергенной природы: развитие бронхоспазма после физической нагрузки, эмоциональных потрясений (смех или плач, волнение, страх), вдыхания резких запахов (краска, дым, парфюмерия). Нередко бронхоспазм возникает вследствие изменения метеорологической обстановки. Гиперреактивность бронхов - основная причина выраженной
лабильности бронхиальной проходимости (отмечают быстрое начало и разрешение приступа, суточные колебания ПСВ не менее чем на 15 %).
Анамнез
При сборе анамнеза обращают внимание на наличие атопии и перенесенные рецидивирующие обструктивные бронхиты, протекав- шие однотипно, без повышения температуры, при отсутствии характерной для вирусной инфекции цикличности течения (например, синдром бронхиальной обструкции беспричинно рецидивирует в тот период, когда ожидают излечения от ОРВИ). У детей раннего возраста БА может протекать без выраженного удушья, однако отмечают большую продолжительность приступов (не менее 5-10 дней) за счет преобладания отека и гиперсекреции над бронхоспазмом. Иногда пациентов мучают приступы упорного спазматического кашля без удушья.
Физикальные исследования
При аускультации следует обращать внимание на неравномерное ослабление проведения дыхания, а также на рассеянные сухие свис- тящие, жужжащие или влажные разнокалиберные хрипы.
При перкуссии грудной клетки отмечают легочный звук (иногда присутствует коробочный оттенок).
В аускультативной картине обострения у детей младшего возраста преобладают влажные разнокалиберные хрипы («влажная» астма), что ведет к ошибочной диагностике вирусной инфекции или пневмонии. В этой ситуации важно обратить внимание на такие признаки бронхообструктивного синдрома, как вздутие грудной клетки, удлинение фазы выдоха, ослабление проведения дыхания.
Лабораторные исследования
В крови и мокроте определяют большое количество эозинофилов.
Инструментальные исследования
Мониторинг состояния больного ребенка должен включать функциональные методы обследования. Пикфлоуметрия
Ребенка старше четырех лет можно научить правильному выполнению выдоха для измерения ПСВ с помощью пикфлоуметра.
Пикфлоуметр - портативный (механический или электронный) прибор индивидуального пользования, измеряющий ПСВ. Для ребенка младше восьми лет оптимальным считают пикфлоуметр со шкалой от 0 до 400 л/мин, для ребенка старше девяти лет - со шкалой от 0 до 800 л/мин. Пикфлоуметрию необходимо выполнять регулярно, в течение длительного периода времени, в том числе в момент ремиссии. ПСВ измеряют 2 раза в день до приема лекарств. Каждое измерение состоит минимум из трех попыток. Наибольшее значение (после проведения трех попыток) заносят в график ПСВ. В начале наблюдения показатели ПСВ сравнивают с нормативами, разработанными для детей (см. Приложение на СD). Нормативы пиковой скорости выдоха у детей
Нормативы разработаны Д. С. Коростовцевым и Д. В. Брейкиным на основании исследования ПСВ у 2283 здоровых детей в возрасте от 4 до 16 лет, проживающих в Санкт-Петербурге.
Значения ПСВ (л/мин) у мальчиков в зависимости от роста
(центильная таблица)
Перцентиль - характеристика набора данных, выражающая ранг элемента в процентах (от 0 до 100%).
Значения ПСВ (л/мин) у девочек в зависимости от роста (центильная таблица)
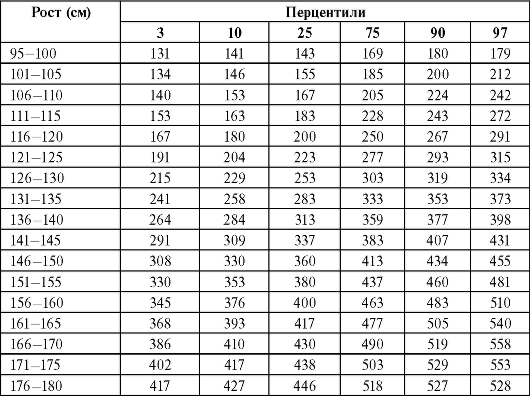
Для каждого ребенка, страдающего БА, следует определить индивидуальную норму ПСВ (она может быть несколько ниже или выше табличного значения).
Цели мониторинга ПСВ
• Подтверждение диагноза БА. Для выявления бронхиальной гиперреактивности оценивают колебания ПСВ за сутки или за неделю (у здоровых детей лабильность ПСВ составляет 5-10 %, у астматиков колебания ПСВ превышают 15-20 %). Измерив ПСВ на приеме, проводят пробу с b2-адреномиметиком (при невозможности выполнения спирометрии). Пробу считают положительной при увеличении ПСВ на 15 % после приема лекарственного средства.
• Определение степени тяжести БА.
• Врачебный контроль состояния больного, подбор и оценка эффективности базисной терапии. Определение длительности обострения и полноты ремиссии.
• Самоконтроль. Родители должны знать, какие значения ПСВ указывают на необходимость срочно проконсультироваться с врачом, и уметь распознавать приближающееся обострение БА при снижении показателя ПСВ.
Достоинства пикфлоуметрии.
• Постоянный контроль, позволяющий уловить колебания бронхиальной проходимости в течение суток и каждый день.
• Доступность.
• Отсутствие противопоказаний.
Показатели, используемые при анализе графика ПСВ
• Показатель лабильности ПСВ за неделю (1 день, 7 или 10 дней) вычисляют по формуле:
Клаб-ти=(ПСВтах -ПСВтт) - 100 %/ПСВтах,
где Клаб-ти - коэффициент (показатель) лабильности; ПСВтах - максимальное значение ПСВ, измеренное за семь дней; ПСВт1п - минимальное значение ПСВ, измеренное за семь дней.
• Система зон на графике.
- Зеленая зона (расположена между значением индивидуального максимума и значением, равным 80 % от величины индивидуального максимума). Зона благополучия. Лабильность ПСВ невысока. Признаки обострения отсутствуют.
- Желтая зона (расположена между значениями, равными 80 % и 60 % величины индивидуального максимума). Текущий период обострения. Отмечают покашливание, эпизодически свистящее дыхание, нарушения сна, снижение переносимости физической нагрузки. Рекомендовано использование бронхолитиков. Астма не компенсирована. Терапию следует пересмотреть. Возможна госпитализация.
- Красная зона (менее 60 %). Критически низкие значения ПСВ, соответствующие приступу или выраженному затяжному обос- трению. Требуется срочное обращение за медицинской помощью или госпитализация. Иногда проводят курс лечения системными глюкокортикоидами.
Дифференциальная диагностика
Дифференциальную диагностику БА проводят с заболеваниями, протекающими с синдромом бронхиальной обструкции.
• Инфекционный бронхит или бронхиолит.
• Облитерирующий бронхиолит.
• Муковисцидоз.
• Врожденные пороки развития сердечно-сосудистой системы.
• Врожденные пороки развития дыхательной системы.
• Бронхолегочная дисплазия.
• Аспирация инородных тел.
• Образования в грудной клетке (туберкулезный бронхоаденит, опухоли).
Диагностика степени тяжести БА
Диагностику степени тяжести БА у ребенка при отсутствии противовоспалительной терапии проводят на основании оценки кли- нических данных и функциональных показателей, выполненной за прошедший год в целом. Со временем у детей может произойти как ремиссия (полная или частичная) БА, так и ее прогрессирование. Переоценку степени тяжести БА проводят не реже чем раз в год.
Критерии определения степени тяжести БА приведены в табл. 3 (см. Приложение на CD).
Клинические признаки, подлежащие учету при определении степени тяжести БА.
• Частота возникновения приступов, их длительность и выраженность.
• Наличие ночных приступов.
• Переносимость физической нагрузки.
• Характеристика периодов ремиссии.
Все признаки необходимо анализировать вместе. Например, при оценке частоты применения бронхолитиков следует учитывать, что многие больные (и их родители) используют b2-адреномиметик только при развитии тяжелых приступов астмы. При оценке частоты симптомов следует выделять развернутые приступы затрудненного дыхания (их хорошо запоминают родители) и так называемые экви- валенты приступов (эпизоды кашля, слабо выраженного дискомфорта в грудной клетке), возникающие значительно чаще. Таким образом, при проведении анализа степени тяжести БА учитывают совокупность всех признаков, в первую очередь ориентируясь на наиболее тяжелые.
• Легкая интермиттирующая форма астмы характеризуется редкими эпизодами затрудненного дыхания, приступ удушья исчезает самопроизвольно или при использовании бронхолитика. Периоды обострения короткие, ремиссии длительные, спонтанные. Функциональные показатели в период ремиссии в пределах нормы.
• При легком персистирующем течении приступы затрудненного дыхания или эквиваленты отмечают менее одного раза в день, ночные симптомы отсутствуют или развиваются крайне редко. Приступ удушья купируют бронхолитиками. Несмотря на наличие слабо выраженных симптомов, персистирующий характер заболевания указывает на постоянную активность аллергического воспаления. По функциональной характеристике и прогнозу легкую персистирующую астму правильнее соотнести с БА средней тяжести, чем с легкой интермиттирующей формой заболевания.
• При астме средней степени тяжести отмечают длительные обострения, когда на фоне более или менее выраженной обструкции бронхов развиваются приступы затрудненного дыхания (различные по силе); в период обострения переносимость физических нагрузок ограничена. Течение обострений упорное; для купирования приступов нередко назначают глюкокортикоиды, а для полного исчезновения обострения (в целом) пациент нуждается в проведении длительного курса противовоспалительной терапии.
• Астма тяжелого течения характеризуется длительными обострениями, ремиссии кратковременные или отсутствуют (отмечают сохранение некоторых симптомов астмы на фоне общего улучшения). Выраженность удушья варьирует: нередко приступы тяжелые, не купирующиеся в домашних условиях, требующие назначения глюкокортикоидов. При отсутствии плановой терапии формируются осложнения, вызываемые постоянной бронхиальной обструкцией и дыхательной недостаточностью: снижение толерантности к физической нагрузке, отставание роста и физического развития, деформация грудной клетки, нервно-психические расстройства (астенизация или депрессия). В результате активно текущего аллергического воспаления возникают необратимые изменения бронхов, приводящие к необратимому снижению легочной функции и отсутствию полного эффекта от лечения, проводимого в полном объеме.
Функциональные критерии тяжести БА у детей (по сравнению с взрослыми) менее надежны, имеют вспомогательное значение при диагностике заболевания.
• Спирометрическое исследование можно выполнить только детям, достигшим пятилетнего (а иногда только семилетнего) возраста.
• Снижение функциональных показателей даже при астме тяжелого течения у детей выражено слабее, чем у взрослых.
• Функциональные показатели слабо коррелируют с тяжестью состояния (выраженностью клинической картины).
• В связи с лабильностью тонуса бронхов у ребенка, при исследовании функции внешнего дыхания в течение дня по спирограмме можно определить и нормальные и патологические показатели (высока вероятность получения ложноотрицательных результатов).
Оценку степени тяжести БА выполняют с учетом объема необходимого лечения (алгоритм представлен в табл.
Лечение
Возникновение астматических приступов можно предотвратить, но полностью вылечить данное заболевание невозможно. Цель лечения БА - контроль над ее течением.
• Достижение минимальной выраженности (или полного отсутствия) симптомов, включая ночные приступы.
• Минимальное количество (или отсутствие) обострений.
• Отсутствие экстренных обращений за медицинской помощью.
• Минимальная потребность (или ее отсутствие) в применении Р2-адреномиметиков короткого действия.
• Отсутствие ограничений в повседневной активности, включая физические упражнения.
• Нормальные показатели ПСВ и суточная лабильность ПСВ, составляющая менее 15 %.
• Минимальное количество побочных эффектов терапии (или их отсутствие).
Основные направления терапии БА
• Элиминация причинно значимых аллергенов.
• Контролирующая (базисная) терапия и мониторинг состояния.
• Терапия острого периода болезни.
• Специфическая иммунотерапия.
• Обучение пациентов.
Немедикаментозное лечение
Помимо мероприятий по устранению контакта с аллергенами и провоцирующими факторами (пассивное курение и т. д.) при БА широко применяют немедикаментозные методы лечения: дыхательную гимнастику, в том числе с применением методики биологической обратной связи, массаж и лечебную физкультуру, спелеотерапию, психотерапию.
Медикаментозное лечение
Режим дозирования и возрастные ограничения применения препаратов различных групп, назначаемых при терапии БА, представ- лены в табл. 2 (см. Приложение на CD).
Контролирующая (базисная) терапия представляет собой регулярное длительное применение препаратов, купирующих аллергическое воспаление в слизистой оболочке дыхательных путей.
Группы базисных препаратов
• «Кромоны» - кромогликат натрия (интал*, кромогексал*) и недокромил натрия (тайлед минт*) - препараты, обладающие умеренным противовоспалительным действием. Назначают ингаляции, производимые с помощью дозирующего аэрозольного ингалятора (интал*, тайлед минт*) или через небулайзер (кромогексал*). Минимальный курс лечения составляет три месяца, максимальный - несколько лет подряд. В связи с низкой вероятностью возникновения побочных действий (препараты безопасны), «кромоны» целесообразно назначать как стартовую терапию при астме легкой и средней степени тяжести; при этом переход на ингаляционные глюкокортикоиды осуществляют лишь при неэффективности данных лекарственных средств.
• Ингаляционные глюкокортикоиды - наиболее эффективные препараты, применяемые для контроля БА, их назначают при персистирующей форме заболевания (любой тяжести). Длительная терапия глюкокортикоидами резко снижает частоту и тяжесть обострений, количество обращений за скорой меди-
цинской помощью и госпитализаций, бронхиальную гиперреактивность, объем бронхоспазмолитической терапии, летальность и скорость процессов ремоделирования бронхов. Применение низких и средних доз препаратов не оказывает нежелательных действий, связанных с подавлением функции коры надпочечников и экзогенным гиперкортицизмом. Побочные эффекты глюкокортикоидов - местные - кандидоз слизистой зева или пищевода, охриплость голоса. Для профилактики развития побочных эффектов ингаляции выполняют через спейсер, после каждого приема лекарств полощут горло водой. В настоящее время наиболее часто назначают препараты флутиказона (флик- сотид*), будесонида (пульмикорт*), беклометазона (беклазон*). Существуют фиксированные комбинации ингаляционных глюкокортикоидов с b2-адреномиметиками пролонгированного действия (действующими около 12 ч). Серетид* содержит флутиказон и салметерол, а симбикорт* - будесонид и фор- мотерол. Такая комбинация обладает синергичностью, давая возможность повысить эффективность базисной терапии (не увеличивая при этом дозу глюкокортикоидов), снизить потребность в b2-адреномиметиках короткого действия и обеспечить ребенку защиту от внезапного развития приступа на весь день и всю ночь.
• Системные глюкокортикоиды (преднизолон). Назначают детям в отдельных случаях при развитии тяжелых приступов БА, когда в связи с выраженной бронхиальной обструкцией ингаляционный путь введения препаратов не производит необходимого эффекта. Курс лечения начинают с приема препарата в дозе 25-30 мг, затем производят снижение количества принимаемого глюкокортикоида (ступенчато). Продолжительность курса составляет 10-25 дней. На 2-3-й день назначают терапию, включающую прием ингаляционных глюкокортикоидов препаратов в полном объеме.
• Ингибиторы лейкотриеновых рецепторов: зафирлукаст (аколат*), монтелукаст (сингуляр*). Оказывают противовоспалительное и бронхорасширяющее (слабое и нестойкое) действие. Преимущества: хорошая переносимость и удобная для приема внутрь форма, хороший терапевтический эффект в отношении сопутствующего АР (это полезно и при лечении астмы). К недостаткам относят высокую стоимость.
• Антигистаминные препараты II поколения применяют не менее трех месяцев подряд (до года и более). Препараты обладают слабым противовоспалительным эффектом (отмечают при длительном использовании), заметным при лечении легко протекающей БА. Преимущества: удобная для приема внутрь форма, безопасность, хороший терапевтический эффект в отношении сопутствующего АР.
Базисные препараты назначают в соответствии со ступенчатым подходом (монотерапия или комбинации лекарственных средств).
• I ступень терапии (легкое интермиттирующее течение БА).
- Применяют только бронхоспазмолитики короткого действия (по мере надобности, без базисной терапии).
- Антигистаминные препараты II поколения.
• II ступень терапии (легкое персистирующее течение БА).
- «Кромоны».
- В отдельных случаях низкие дозы ингаляционных глюкокортикоидов.
• III ступень терапии (БА средней тяжести).
- «Кромоны» назначают в качестве пробного стартового курса (эффективность лечения оценивают через месяц).
- Ингаляционные глюкокортикоиды (низкие дозы).
- Ингаляционные глюкокортикоиды (средние дозы).
- Фиксированные комбинации низких доз глюкокортикоидов с b2-адреномиметиком длительного действия.
• IV ступень терапии (тяжело протекающая БА).
- Глюкокортикоиды (средние дозы).
- Глюкокортикоиды (высокие дозы).
- Фиксированные комбинации средних и высоких доз глюкокортикоидов с b2-адреномиметиком длительного действия.
- Сочетание средних и высоких доз ингаляционных глюкокортикоидов с теофиллином медленного высвобождения (теотард*) или антилейкотриеновыми препаратами, или системными глюкокортикоидами.
Ориентировочные дозы различных ингаляционных глюкокортикоидов, назначаемые детям
Ингаляционный глюкокортикоид | Средние дозы | Высокие дозы | ||
Дети до 12 лет | Дети старше 12 лет | Дети до 12 лет | Дети старше 12 лет | |
Беклометазон | 250-500 | 500-800 (1000) | Более 500 | Более 800-1000 |
Ингаляционный глюкокортикоид | Средние дозы | Высокие дозы | ||
Дети до 12 лет | Дети старше 12 лет | Дети до 12 лет | Дети старше 12 лет | |
Будесонид | 200-600 | 600-1000 | Более 600 | Более 1000 |
Флутиказон | 200-400 | 250-500 | Более 400 | Более 500 |
Тактика проведения базисной терапии БА у детей
Препараты базисной терапии назначают в соответствии со степенью тяжести заболевания. Полноценный терапевтический эффект базисных препаратов развивается достаточно медленно. Например, положительный эффект «кромонов» возможно оценить не ранее чем через месяц непрерывного применения, эффект ингаляционных глюкокортикоидов - не ранее чем через три недели. После достижения требуемого терапевтического эффекта (ремиссии или контролируемого течения БА), курс базисной терапии продолжают не менее трех месяцев, затем производят постепенное снижение дозы базисного препарата, подбирая минимальный эффективный объем терапии. Например, при начальной дозе, составляющей 400 мкг беклометазона, дозу препарата уменьшают на 50 мкг каждые две недели с последующим переходом на «кромоны». Резкая отмена глюкокортикоидной терапии приводит к обострению БА в первые несколько недель после прекращения использования препарата. Такие обострения связаны не с «привыканием» к препарату, а с исчезновением достигнутого при приеме базисных препаратов эффекта. Под действием аллергенов снова происходит обострение аллергического воспаления.
При недостаточной эффективности базисного лечения, объем терапии увеличивают на одну ступень, при этом, как правило, необходимо пересмотреть степень тяжести БА.
Пациенты, у которых обострения астмы провоцируются ОРВИ, рекомендуется усиливать базисную терапию астмы на ступень вверх с первого дня простудного заболевания, а через 7-10 дней, т. е., после выздоровления от ОРВИ, возвращаться к первоначальному объему терапии.
Точная диагностика степени тяжести БА и подбор необходимого объема базисной терапии нередко требуют времени.
Способы подбора терапии
• «Step-up». Вначале назначают минимальную дозу, повышая ее в случае недостаточной эффективности лечения. Путь «step-up» более экономичен и позволяет реализовать концепцию минимального эффективного вмешательства.
• «Step-down». Вначале назначают более высокие дозы с последующим ступенчатым снижением, при этом подбирают минимальное эффективное количество препаратов. Путь «step-down» позволяет быстрее облегчить состояние ребенка; кроме того, назначение сразу эффективного лечения укрепляет доверие пациента врачу. Выбор пригодного к использованию ребенком устройства для ингаляции
Большинство детей без предварительных тренировок не умеют правильно пользоваться дозирующим аэрозольным ингалятором (не синхронизируют вдох и подачу аэрозоля) и ингалятором с сухой порошковой формой (не могут обеспечить вдох достаточной силы). Для проведения эффективной ингаляции детям, особенно младшего возраста, необходимо применять спейсеры - устройства, облегчающие подачу лекарства (это пластиковые камеры с клапанами, ингаляция препарата происходит при спокойном дыхании). При использовании спейсера большее количество лекарственного вещества попадает в бронхи и меньшее оседает на слизистых оболочках полости рта (что особенно важно для профилактики кандидоза при приеме глюкокортикоидов). В небулайзере (ингалятор) под действием сжатого воздуха происходит образование аэрозоля (тумана) из раствора или суспензии препарата; это позволяет эффективно доставлять бронхорасширяющие, противовоспалительные, муколитические вещества в бронхи детям раннего возраста при приступе БА, наличии одышки и выраженной обструкции бронхов.
Алгоритм терапии при остром приступе астмы
Понятие степени тяжести течения БА - не синоним степени тяжести астматического приступа (и обострения астмы). Например, у ребенка с тяжело протекающей БА большинство приступов, регистрируемых в течение года, легкие, но иногда возникают умеренно выраженные и единичные тяжелые приступы, требующие госпитализации. Поэтому терапию каждого приступа астмы начинают с оценки его тяжести.
Оценку тяжести приступа проводят по совокупности признаков, ориентируясь, в первую очередь, на клинические симптомы, указывающие на большую тяжесть приступа. Например, если большинс- тво признаков соответствует приступу средней тяжести, а один из признаков - тяжелому приступу, то надо регистрировать тяжелый приступ.
Оценка степени тяжести приступа бронхиальной астмы
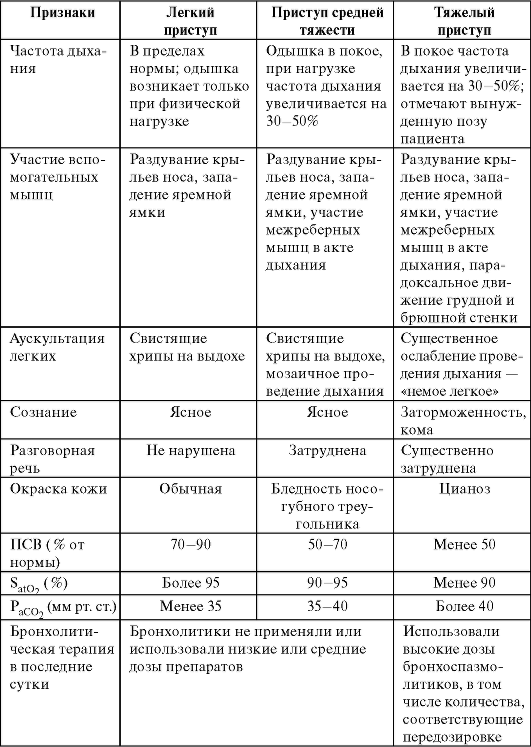
Если признаки тяжелого приступа отсутствуют, терапию начинают с назначения b2-адреномиметика (сальбутамол, фенотерол) или комбинированного бронхолитика (беродуал*, содержащий фенотерол и бромид ипратропия). Принимать данные препараты предпочтительно через небулайзер. Оценивают эффект ингаляции через 20 мин. После купирования приступа (состояние пациента улучшилось, стабильное, ПСВ составляет более 80 % нормального значения) продолжают выполнять ингаляции бронхолитика каждые 4-6 ч, контролируя состояние ребенка в течение суток; в дальнейшем необходимо проконсультироваться со специалистом (аллергологом или пульмонологом), произвести коррекцию базисной терапии, пикфлоумониторинг и обучение семьи.
При недостаточной эффективности однократного приема бронхоспазмолитика, ингаляцию можно повторить еще 2 раза с интерва- лом в 20 мин (т. е. три ингаляции в течение часа).
Мероприятия, выполняемые при недостаточном эффекте терапии, проведенной в течение первого часа (состояние нестабильное, симптомы сохраняются, значение ПСВ составляет менее 80 %).
• Назначение системных глюкокортикоидов в разовой дозе 1- 2 мг/ кг парентерально.
• Проведение ингаляции будесонида (пульмикорт суспензия) через небулайзер (0,5-1 мг каждые 6 ч).
• Продолжение ингаляций бронхоспазмолитика каждые 20 мин в течение второго часа интенсивной терапии.
• Госпитализация.
Принципы лечения больных в стационаре
• Назначение бронхоспазмолитиков (через небулайзер).
• Применение системных и ингаляционных глюкокортикоидов.
• Оксигенотерапия.
• Осуществление контроля эффективности всех этапов лечения (измерение ПСВ с помощью пикфлоуметра).
При наличии признаков тяжелого приступа все требуемые мероприятия начинают одновременно.
• Если значение ПСВ составляет более 50 % (при данном состоянии ингаляционное введение препаратов вероятно, будет эффективным), проводят ингаляцию b2-адреномиметика (сальбутамол, фенотерол) или комбинированного бронхолитика беродуал (фенотерол и ипратропия бромид) через небулайзер.
• Если ПСВ менее 50 % (как правило, ингаляционный путь введения препаратов, не производит необходимого эффекта; нередко
произвести ингаляцию невозможно), вводят бронхоспазмолитики (адреналин* 0,1 % в дозе 0,01 мг/кг, но не более 0,4 мл, подкожно или внутримышечно) и системные глюкокортикоиды (разовая доза составляет 2 мг/кг, парентерально).
• Госпитализация.
• Оксигенотерапия.
В дальнейшем специалисты тщательно обследуют ребенка, перенесшего тяжелый (или средней тяжести) приступ БА (например, ана- лизируют адекватность базисной терапии; выясняют степень понимания родителями сущности болезни, необходимости ее лечения и ежедневного мониторирования в домашних условиях; проводят обучение; составляют для родителей «кризис-план» в письменной форме).
Назначать системные глюкокортикоиды при остром приступе астмы следует без промедления.
Показания к применению системных глюкокортикоидов при остром приступе БА
• Тяжелый приступ астмы.
• Приступ средней тяжести у пациента с тяжелым течением астмы (у которого базисную терапию проводят с использованием высоких доз ингаляционных глюкокортикоидов или системных глюкокортикоидов).
• Приступ средней тяжести при отсутствии в течение часа эффекта от применения бронхолитиков через небулайзер.
• Передозировка адреномиметиков или теофиллина в течение последних суток (регистрируют во время сбора анамнеза или при осмотре в первую очередь обращают внимание на такие признаки передозировки, как тахикардия, тошнота, рвота, отсутствие быстрого выраженного эффекта от очередной ингаляции бронхоспазмолитика).
Дальнейшее ведение
БА - хроническое рецидивирующее заболевание, которое, как правило, требует длительных курсов базисной терапии и длительно- го мониторинга состояния. После купирования острого приступа и обострения болезни необходимо решить несколько вопросов:
- проводится ли комплексное лечение заболевания, включающее элиминационные мероприятия, фармакотерапию и немедика- ментозные методы лечения, обучение родителей;
- проводится ли адекватное лечение сопутствующих аллергических заболеваний;
- проводится ли мониторинг состояния (пикфлоуметрия);
- возможно ли проведение специфической иммунотерапии (показания и противопоказания оценивает аллерголог-иммунолог);
- достигнута ли ремиссия заболевания по клиническим признакам и по нормализации показателей функции внешнего дыхания;
- сколько должен длиться курс базисной терапии.
Как правило, ребенок должен получать базисную терапию в подобранной эффективной дозе не менее 3 мес от начала ремиссии. В дальнейшем возможны: а) продолжение базисной терапии, если есть основания ожидать обострения заболевания после ее отмены, например по анализу сезонных особенностей течения заболевания в прошлый год; б) постепенное снижение дозировок и количества применяемых препаратов, вплоть до полной отмены базисного лече- ния; в) возобновление терапии при наступлении обострения. Таким образом, вырабатывается индивидуальный план терапии.
При длительном наблюдении больного БА ежегодно проводят:
- пересмотр степени тяжести БА, если характер течения болезни изменился;
- оценку физического развития;
- пересмотр индивидуальной нормы ПСВ, которая будет увеличиваться соответственно увеличению роста ребенка.
БА считается заболеванием, которое полностью излечить невозможно. Поэтому диагноз БА не снимают, даже в случае стойкой длительной ремиссии заболевания.
Прогноз
Существует мнение, что дети выздоравливают от БА (перерастают астму). На самом деле у 30-50 % детей (особенно у мальчиков) к подростковому возрасту формируется длительная ремиссия заболевания. В действительности возникшую в детском возрасте БА диагностируют у 60-80 % взрослых. Исход БА у детей во многом зависит от степени тяжести заболевания. При астме легкого течения прогноз более благоприятен. К понятию «выздоровление» при БА следует относиться с большой осторожностью, так как длительная клиническая ремиссия может прекратиться в любой момент. Даже при отсутствии приступов на протяжении многих лет подряд у большинства пациентов определяют бронхиальную гиперреактивность; при этом существует риск возникновения нового обострения БА.
Летальные исходы БА у детей регистрируют относительно редко. Вероятность смерти всегда существует (у любого ребенка, страдающего данным заболеванием) и возрастает параллельно с увеличением степени тяжести БА. Значение показателя летальности при БА тяжелого течения составляет 1-3 %.
Факторы, определяющие увеличение риска развития летального исхода БА
• Тяжелое течение БА (примерно у 90 % умерших детей регистрировали тяжелую степень заболевания).
• Критический возраст (12-16 лет).
• Повторные вызовы неотложной помощи, частые госпитализации, астматический статус, ИВЛ в анамнезе.
• Психологические и психиатрические проблемы (например, навязчивые страхи, депрессия), эпилепсия и другие органические поражения ЦНС.
• Неадекватность плановой терапии, хроническая передозировка бронхоспазмолитиков, недооценка степени тяжести БА, несоблюдение семьей рекомендаций по плановой терапии и элиминации, отсутствие мониторинга течения астмы.
• Низкий социальный, культурный и экономический уровень семьи.
• Курение.
Увеличение количества детей с тяжелым течением БА регистрируют каждый год; причины формирования трудно контролируемого заболевания и способы его предотвращения до конца не изучены.
Факторы, способствующие возникновению БА тяжелого течения
• Генетические факторы, предопределяющие тяжелое течение БА (генетические дефекты глюкокортикоидного рецептора).
• Наличие сопутствующей патологии респираторной системы.
• Врожденные пороки и дисплазии бронхиального дерева.
• Психоэмоциональный фон.
• Неблагоприятная экологическая обстановка (массивный контакт с аллергенами, загрязнение воздуха, курение, инфекции).
• Отсутствие диагноза астмы и, следовательно, отсутствие адекватной терапии.
Своевременная диагностика БА и раннее начало базисной противовоспалительной терапии - единственная возможность предотвра- щения развития тяжелого (резистентного к проводимому лечению) течения БА, а также формирования необратимых изменений бронхов
(которые в первую очередь приводят к снижению параметров вентиляции).
Диспансеризация
Дети с БА состоят на диспансерном учете у педиатра и специалистов. В случае нетипичной, трудно контролируемой астмы, необходимости дифференциально-диагностического поиска целесообразно наблюдение пульмонологом. Дети с БА любой степени тяжести в сочетании с другими аллергическими заболеваниями, наблюдаются аллергологом-иммунологом. Кратность осмотров в течение года не может быть регламентирована одинаково для любого ребенка с БА, так как у всех пациентов заболевание различно по тяжести, по характеру течения и по ответу на терапию. Исследование функции внешнего дыхания с пробой с бронхоспазмолитиком проводят детям с любой степенью тяжести БА не реже 1 раза в год, а при астме тяжелого течения - не реже 3-4 раз в год.
Глава 4
Крапивница
Определение
Крапивница - группа заболеваний, характеризующаяся наличием общего основного симптома - уртикарной сыпи.
Код по МКБ-10
L50 Крапивница.
L50.0 Аллергическая крапивница.
L50.1 Идиопатическая крапивница.
Эпидемиология
Крапивницу считают распространенным заболеванием. По статистическим данным, у 10-20 % людей (детей и взрослых) хотя бы один раз в жизни возникал эпизод крапивницы. Распространенность крапивницы у детей младшего возраста составляет 2-6 %.
Профилактика
В связи с тем, что крапивница - гетерогенная группа заболеваний, профилактические мероприятия (профилактика рецидивов крапивницы) зависят в первую очередь от этиологии заболевания и заключаются в исключении провоцирующих воздействий, если удалось выявить провоцирующие факторы.
Скрининг
Скрининговые тесты не проводят.
Классификация
Общепринятой классификации крапивницы не существует. В клинической практике наиболее важной считают классификацию по длительности заболевания.
• Острая крапивница (продолжается не более шести недель).
• Хроническая крапивница (рецидивирует в течение долгого времени - более шести недель).
Этиология
Причины возникновения крапивницы чрезвычайно разнообразны. Нередко крапивница развивается в ответ на попадание в орга- низм различных веществ (аллергическая реакция), а иногда данное состояние свидетельствует о наличии другого заболевания (или может быть первым его признаком).
Причины крапивницы
• Истинные аллергические реакции, обусловленные IgE-зависи- мым механизмом. Наиболее значимыми аллергенами при крапивнице считают пищевые (молоко и молочные продукты, мед, яйца, рыба, грибы, орехи и некоторые другие продукты); эпидермальные (шерсть и перхоть животных); пыльцевые аллергены и близкие к ним по структуре белки плодов растений; а также лекарственные препараты (антибиотики пенициллинового ряда, жаропонижающие средства, фитопрепараты, горчичники).
• Реакции, вызванные применением лекарственных препаратов, рентгеноконтрастных веществ, пищевых добавок (красители, усилители вкуса); употреблением продуктов питания, содержащих большое количество гистамина или напрямую способствующих дегрануляции тучных клеток (их называют гистаминолибераторами: клубника и цитрусовые, квашеная капуста и томаты, шоколад, бананы, сыр и колбаса). Данные реакции развиваются без иммунологического механизма, но их, как правило, невозможно клинически отличить от аллергических проявлений.
• Паразитарная инфекция (гельминтоз, лямблиоз).
• Укусы насекомых (пчел, ос, комаров, клопов или блох). Уртикарную сыпь иногда обнаруживают при чесотке.
• Бактерии, вирусы, грибы. Для детей наибольшее значение имеют вирусы гепатита А и В (острую крапивницу диагностируют в продромальном периоде), ВЭБ, хронические очаги инфекции ЛОРорганов, множественный кариес, H. pylori.
• Прочие заболевания (один из клинических признаков - крапивница): неопластические процессы, системные васкулиты, болезни ЖКТ, сывороточная болезнь, аутоиммунный тиреоидит и некоторые другие.
• При воздействии физических факторов нередко развивается холодовая, тепловая или дермографическая крапивница (возникает при надавливании). Отнести данные состояния к самостоятельным заболеваниям пока невозможно: существует мнение, что
указанные типы крапивницы - только обострения другого типа крапивницы, провоцируемые физическими факторами.
• Реакция ВНС на повышение температуры тела (при физической нагрузке, перегреве, стрессе) - холинергическая крапивница - крупные зудящие участки гиперемии с множественными мелкими (1-
• В ряде случаев причину крапивницы установить не удается, несмотря на тщательно проводимое обследование. Такую крапивницу называют идиопатической.
Патогенез
Независимо от этиологии основной механизм крапивницы - дегрануляция тучных клеток с высвобождением медиаторов, в первую очередь гистамина, а также простагландинов, лейкотриенов, цитокинов. Дегрануляцию могут вызвать различные физические воздействия, контакт с аллергенами, образование аутоантител к рецепторам тучных клеток или к IgE и другие факторы. Под действием медиаторов повышается проницаемость капилляров, и происходит быстрое формирование отека в области эпидермиса и сосочкового слоя дермы. При этом отмечают появление волдырей, эритемы или кожного зуда. Отек, локализованный в более глубоких слоях дермы и в подкожной клетчатке, в клинической практике характеризуют как ангионевротический отек, или отек Квинке (не сопровождается зудом). Отек Квинке может локализоваться и на слизистых оболочках.
Клиническая картина
Крапивницу регистрируют у людей разного возраста, в том числе у грудных детей, но чаще - у детей старше пяти лет.
Важно помнить: острая крапивница и отек Квинке могут быть предвестниками анафилактического шока.
Уртикарную сыпь обнаруживают на любых участках тела. Признаки острого обострения крапивницы - подъем температуры до фебрильных цифр, нарушение общего самочувствия; немного позже отмечают образование волдырей. При крапивнице различной степени тяжести количество волдырей варьирует от одного до нескольких десятков, размеры волдырей - от совсем маленьких (
Кожный зуд - наиболее мучительный симптом крапивницы, снижающий качество жизни пациентов. Обычно зуд усиливается в ночное время, нарушает сон и приводит к плохому самочувствию на следующее утро. При рецидивирующей крапивнице пациентов нередко беспокоит только зуд (чувство жжения кожи) без образования волдырей.
Отек Квинке
Отек Квинке развивается в сочетании с крапивницей (в 40-50 % случаев) или изолированно (11-20 % случаев). Типичные локализации процесса - лицо, губы, веки. Отек - плотный, безболезненный, имеет цвет нормальной кожи (или немного бледнее). Зуд, как правило, отсутствует, однако пациенты нередко ощущают «распирание» кожи. Отек век чаще односторонний. Отек Квинке может располагаться и на слизистых оболочках: гортани (характерные признаки - осиплость голоса, лающий кашель, стридорозное дыхание и асфиксия) или пищеварительного тракта (симптомы - чувство кома в горле, дисфагия, рвота, боли в животе). При поллинозе отеки Квинке и крапивницу обнаруживают преимущественно на открытых участках кожи. Отек полностью исчезает в течение 72 ч.
Если время существования волдырей превышает сутки, высыпания не проходят бесследно (отмечают эволюцию элементов с разви- тием петехиальных высыпаний или эритемы синюшного оттенка), следует заподозрить васкулит.
Пигментная крапивница
При осмотре кожи обращают внимание на пигментированные участки. Пигментная крапивница (мастоцитоз) - редкое заболева- ние. Первые признаки, возникают, как правило, у грудных детей (до годовалого возраста) - пятнисто-папулезные высыпания. При механическом раздражении (расчесывании элементов сыпи, мытье ребенка губкой) образуются волдыри. Этот феномен можно спровоцировать при осмотре (симптом Унны-Дарье). После исчезно- вения сыпи на коже обнаруживают пигментированные следы. При помощи биопсии кожи определяют инфильтрацию тучными клетками. Заболевание при благоприятном течении спонтанно проходит к пубертатному периоду. При системном мастоцитозе помимо пигментной крапивницы диагностируют инфильтрацию костей, органов пищеварительного тракта, селезенки и лимфатических узлов тучными клетками. Пациентов беспокоят головные боли, головокружения и артралгии.
Наследственный ангионевротический отек
Наследственный ангионевротический отек - заболевание, обусловленное дефицитом ингибитора С1-эстеразы, в результате происходит неконтролируемая активация системы комплемента под действием провоцирующих факторов (стресс, травмы, хирургические и стоматологические вмешательства, инфекции). У пациентов диагностируют рецидивирующие отеки различной степени выраженности (от локальных до угрожающих жизни отеков слизистых оболочек глотки, гортани или пищеварительного тракта). Отеки не сопровождаются крапивницей и зудом, развиваются (в отличие от аллергических) постепенно, в течение суток (иногда немного дольше). Назначение адреналина* и глюкокортикоидов эффекта не оказывает. Для купирования отека применяют препарат ингибитора С1-эстеразы (в России не зарегистрирован), а при его отсутствии - свежезамороженную плазму.
Диагностика
При осмотре и сборе анамнеза устанавливают количество, локализацию, размеры волдырей, длительность существования волдыря, характер дермографизма, а также выясняют наличие и характер пос- ледствий разрешившихся волдырей.
Причинный фактор легко установить при немедленных аллергических реакциях, когда крапивница возникает непосредственно после употребления аллергенного продукта или контакта с аллергеном. Так, у детей (1-2-го года жизни) с высокой степенью сенсибили- зации к белку коровьего молока немедленно развиваются крапивница и признаки системной реакции (тошнота, рвота, слабость) после употребления молочных продуктов. При локализации высыпаний на стопах необходимо узнать, не носит ли ребенок носочки из собачьей или кошачьей шерсти.
Если сразу установить провоцирующий фактор не удается (наиболее трудно при хронической крапивнице), следует выполнить поиск возможной причины данного заболевания. Объем обследования определяют на основании данных анамнеза и клинической картины.
Дифференциальная диагностика
У детей исключают вирусный гепатит, инфекционный мононуклеоз, гельминтозы, проводят поиск хронических очагов инфекции носоглотки и органов ЖКТ.
Лечение
Способ лечения крапивницы зависит от тяжести и стадии заболевания.
Немедикаментозное лечение
Терапия крапивницы обязательно включает устранение причинного фактора (если он известен).
Медикаментозное лечение
Режим дозирования и возрастные ограничения применения препаратов различных групп для терапии крапивницы представлены в табл. 2 (см. Приложение на CD).
Терапия острой крапивницы и отека Квинке
Лекарственные средства, применяемые при крапивнице и способы их введения.
• Гистаминоблокаторы II поколения для приема внутрь (зиртек*, ксизал*, телфаст*, эриус*). Дозы препаратов назначают с учетом возраста; курс лечения составляет не менее 5-7 дней (при слабой и умеренно выраженной крапивнице без признаков системной реакции).
• Для лечения грудных детей (до 6 мес) можно использовать только гистаминоблокаторы I поколения (супрастин*, капли фенистил*).
• Одновременно c гистаминоблокаторами I поколения начинают лечение возможной причины крапивницы. Например, при пищевой аллергии - назначают сорбенты (смекта*, активированный уголь) и очистительную клизму. Гель фенистил* хорошо дополняет терапию, его наносят непосредственно на волдырь при первых признаках зуда (2-4 раза в сутки).
• Внутримышечно 2-3 раза в день вводят гистаминоблокаторы I поколения (супрастин*, тавегил*) при острой, распространенной крапивнице умеренной выраженности и отеке Квинке лица. После купирования крапивницы (в 1-2-и сутки) назначают гистаминоблокаторы, применяемые внутрь. Если регистрируют неполный эффект, в терапию включают глюкокортикоиды, например преднизолон (вводят внутримышечно, суточная доза составляет 2 мг/кг, ее разделяют на 2-3 введения).
• Адреналин* (0,1 %) вводят внутримышечно при острой выраженной крапивнице, отеке Квинке гортани, признаках системной
реакции (слабость, бледность, тошнота, снижение АД, бронхоспазм). Разовая доза адреналина* составляет 0,02 мг/кг, не более 1 мл, внутримышечно. Разовую дозу препарата предварительно разводят физиологическим раствором хлорида натрия в соотношении один к пяти (максимальное соотношение - один к десяти). Терапевтический эффект отмечают через 10 мин. После адреналина* внутримышечно вводят глюкокортикоиды (преднизолон в дозе 2 мг/кг). Пациенту необходима госпитализация. Лечение хронической крапивницы
• Длительная базисная терапия гистаминоблокаторами II поколения (зиртек*, ксизал*, телфаст*, эриус*). Лечение проводят не менее двух месяцев.
• Препараты, применяемые дополнительно при мучительном зуде (назначают параллельно с непрерывным приемом базисного препарата).
- Короткие (7-10 дней) курсы гистаминоблокаторов I поколения.
- Гель фенистил* наносят 2-4 раза в день непосредственно на волдырь, начиная с момента его образования (в том числе при ночных пробуждениях).
- Детям старше одного года в комплексной терапии зуда используют атаракс* (гидроксизин, вещество-предшественник цетиризина), обладающий выраженным противозудным действием. Курс лечения составляет 10-30 дней; применять препарат следует 2 раза в день.
• При неэффективности комбинированной терапии назначают глюкокортикоиды, предпочтительно пролонгированного действия (дипроспан*). Эффект одной инъекции препарата сохраняется в течение месяца.
Дальнейшее ведение
При острой крапивнице, после купирования эпизода уртикарных высыпаний, необходимо как можно быстрее и активнее провести дифференциально-диагностический поиск для выявления причины заболевания.
При хронической крапивнице дифференциально-диагностический поиск проводят параллельно с длительной терапией обострений. Из всего арсенала средств для фармакотерапии крапивницы наилучшей переносимостью обладают гистаминоблокаторы II поколения.
Максимальная безопасная длительность их применения не определена. Наиболее продолжительные контролируемые клинические испытания проводились с препаратом Зиртек (цетиризин) у детей с атопическим дерматитом, и показано отсутствие значимых побочных эффектов при непрерывном приеме препарата в течение 18 мес.
При хронической идиопатической крапивнице возможны спонтанные ремиссии заболевания продолжительностью от нескольких недель до нескольких лет, что позволяет делать перерывы в терапии.
Прогноз
Нередко крапивница свидетельствует о развитии других заболеваний (их успешное лечение приводит к полному исчезновению кра- пивницы). Аллергическая крапивница, не рецидивирующая после исключения контакта с провоцирующим фактором, характеризуется благоприятным исходом. Менее оптимистичен прогноз хронической идиопатической крапивницы. Например, если пациент страдает длительно текущей хронической крапивницей (более шести месяцев), то последующие 10 лет постоянное рецидивирование заболевания регистрируют у 40 % человек. Таким образом, для увеличения шансов пациента на выздоровление необходимо быстрое и тщательное обследование для обнаружения причины крапивницы, а также своевременная и адекватная терапия.
Диспансеризация
Пациенты с хронической крапивницей состоят на диспансерном учете у педиатра и специалиста: аллерголога-иммунолога или дерма- толога.