Детские болезни в 2-х томах: том 1 : учебник / Под ред. И.Ю. Мельниковой, - 2009.
|
|
|
|
РАЗДЕЛ III ЗАБОЛЕВАНИЯ ДЕТЕЙ РАННЕГО ВОЗРАСТА
Глава 1
Рахит и рахитоподобные заболевания
РАХИТ
Синонимы
Рахит активный, младенческий.
Определение
Рахит - это нарушение минерализации растущей кости, обусловленное временным несоответствием между потребностями рас- тущего организма в фосфатах и кальции и недостаточностью систем, обеспечивающих их доставку в организм ребенка. Кальций, витамин D и фосфаты являются эссенциальными для растущего организма.
Код по МКБ-Х
E55.0 Рахит активный.
Эпидемиология
Случаи рахита описаны во всех странах мира, включая страны Африки и Азии. Учитывая костные проявления рахита, его частота среди детей раннего возраста колеблется, по данным разных авторов, от 1,6 до 35%. В последние годы нарушения минерализации нередко выявляются у детей подросткового возраста, особенно при дефектах питания, а также у темнокожих жителей южных регионов, переехавших в Европейские страны.
Профилактика
Различают антенатальную и постнатальную, специфическую и неспецифическую профилактику рахита. К антенатальной неспецифической профилактике относят правильный режим дня (ежедневные обязательные прогулки, не менее 2 ч в день) и диету беременной. Диета должна содержать достаточное количество витаминов, минеральных веществ и микроэлементов. Специфическую профилактику рахита начинают с 32 нед беременности. Здоровым беременным с целью профилактики нарушений фосфатно-кальциевого обмена витамин D назначают в дозе 200 МЕ (максимум 400 МЕ) в сутки с 32-й недели беременности только в зимний и весенний периоды года в течение 8 нед. Беременным группы риска, имеющим соматические и генитальные заболевания, витамин D назначают также с 32 нед независимо от сезона года.
Постнатальная неспецифическая профилактика рахита у детей включает рациональный режим с достаточной инсоляцией и естест- венное вскармливание ребенка.
Для недоношенных детей вопрос о назначении витамина D решают только после оптимизации пищевых дотаций фосфатов и каль- ция, так как у детей, рожденных раньше срока, не выявлено гиповитаминоза D, а в основе остеопении у этих детей лежит в основном первичный дефицит кальция и фосфатов.
Здоровым доношенным детям специфическую профилактику рахита проводят с 3-4 нед жизни по 400-500 МЕ витамина D в сутки в осенний, зимний и весенний периоды с перерывами на месяцы интенсивной инсоляции (с мая по октябрь). Профилактику проводят в течение первых двух лет жизни.
Детям с высоким риском заболеваемости рахитом назначают витамин D в дозе 1000 МЕ ежедневно. Специфическую профилактику рахита лучше всего проводить водным раствором витамина D3. Водорастворимая форма витамина D3 содержит в 1 капле 500 МЕ.
Профилактика рахита витамином D противопоказана при органическом перинатальном повреждении нервной системы, идеопатической кальциурии, гипофосфатазии. Детям с малыми размерами большого родничка или его ранним закрытием проводят отсроченную профилактику, начиная с 3-4 мес жизни.
Классификация
Выделяют начальный период, разгара, реконвалесценции и остаточные явления рахита. По тяжести процесса различают рахит
легкий (I степень), средней тяжести (II степень) и тяжелый (III степень). Течение может быть острое и подострое.
Этиология и патогенез
Развитию рахита у детей способствуют следующие факторы.
1. Высокие темпы роста детей в раннем возрасте и повышенная потребность в минеральных компонентах, особенно у недоношенных детей.
2. Дефицит кальция и фосфатов в пище, связанный с дефектами питания.
Обмен кальция и фосфатов имеет особое значение в антенатальном периоде жизни. Повышенный риск недостаточности кальция у беременных и, как следствие, у плода возникает, если женщина не употребляет по разным причинам молочные продукты (вегетарианство, аллергия на белки молока, лактазная недостаточность и др.), при ограничении в питании мяса, рыбы, яиц (дефицит белка), при избытке в пище клетчатки, фосфатов, жира, приеме энтеросорбентов. Остеопения, по данным УЗ-остеометрии, выявлена у 10% ново- рожденных здоровых матерей и у 42% детей у женщин с гестозом.
В грудном молоке содержание кальция колеблется от 15 до 40 мг/дл и дети первых месяцев жизни за сутки получают от 180 до 350 мг кальция. В то же время необходимое количество кальция для детей первых 6 месяцев составляет не менее 400 мг в сутки. Содержание фосфатов в грудном молоке колеблется от 5 до 15 мг/дл и дети первых месяцев жизни за сутки получают от 50 до 180 мг фосфатов. Для детей первого полугодия необходимое количество фосфатов должно составлять не менее 300 мг. Дефицит кальция и фосфатов в рационе и нарушение их соотношения возможны при несоблюдении принципов рационального питания детей, находящихся на искусственном вскармливании.
В патогенезе рахита имеет значение дефицит в пищевом рационе витаминов А, С, группы В (особенно В1, В2, В6), фолиевой кислоты, таких микроэлементов, как цинк, медь, железо, магний, марганец и др.
3. Нарушение всасывания кальция и фосфатов в кишечнике, повышенное выведение их с мочой или нарушение утилизации в кости, обусловленные незрелостью транспортных систем в раннем возрасте или заболеваниями кишечника, печени и почек. У детей с низкой массой тела при рождении развитие рахита связано с дефицитом фосфатов на фоне усиленного роста и недостаточного количества этого иона в пище, причем успешное излечение рахита обеспечивалось увеличением фосфатов в пище и повышением их в
крови. Гипокальциемия, вторичный гиперпаратиреоидизм, низкая тубулярная реабсорбция фосфатов и последующая гипофосфатемия развиваются при синдроме мальабсорбции.
4. Снижение уровня кальция и фосфатов в крови и нарушение минерализации кости при длительном алкалозе, дисбалансе цинка, магния, стронция, алюминия, обусловленных разными причинами.
5. Нарушение физиологического соотношения остеотропных гормонов - паратгормона и тиреокальцитонина, связанного со снижением продукции паратгормона (чаще наследственно обусловленный гипопаратиреоз).
6. Экзоили эндогенный дефицит витамина D, а также более низкий уровень метаболита витамина D, как модулятора обмена фосфатов и кальция, в весенние месяцы года. Витамин D поступает в организм ребенка в виде двух соединений: эргокальциферола (витамина D2) из пищи и холекальциферола (витамина D3), образующегося в коже под влиянием ультрафиолетовых лучей. Известно, что дети, редко бывающие на воздухе, недостаточно обеспечены витамином D. Основной формой витамина D, циркулирующего в крови, является его промежуточный продукт обмена - 25-оксихолекальциферол (25-ОН D3), который образуется в печени. Затем этот метаболит в проксимальных канальцах почек под действием гидроксилаз трансформируется в конечные продукты, основными из которых являются 1,25 - и 24,25-диоксихолекальцифе- рол. Оба метаболита - 1,25-(ОН)2 D3 и 24,25-(ОН)2 D3 активируют процессы дифференцировки и пролиферации хондроцитов и остеобластов, а также выработку остеокальцина, главного неколлагенового белка кости. Он синтезируется остеобластами и считается чувствительным индикатором костеобразования. Именно 1,25-(ОН)2 D3 вместе с паратгормоном и тиреокальцитонином обеспечивают фосфорно-кальциевый гомеостаз, процессы минерализации и роста костей. И очевидно, что не столько экзогенный дефицит, сколько врожденные и приобретенные нарушения функции кишечника (всасывание), печени и почек (метаболизм) вносят весомый вклад в развитие эндогенного гиповитаминоза D. В раннем постнатальном периоде у детей имеет место незрелость ферментативных систем, осуществляющих метаболизм витамина D и реализацию тканевых эффектов его метаболитов. 24,25- (ОН)2 D3 обычно активен в условиях нормокальциемии, обеспечивая нормальный остеогенез, а также детоксикацию избытка витамина.
Роль метаболитов витамина D не ограничивается только регуляцией уровня кальция в организме, поскольку их рецепторы обнару-
жены не только в тонкой кишке и костях, но и в почках, поджелудочной железе, скелетных мышцах, гладких мышцах сосудов, клетках костного мозга, а также в лимфоцитах, моноцитах, макрофагах. Известна иммунорегуляторная функция витамина D.
Возможность развития экзогенного гиповитаминоза D маловероятна, так как потребность человека в этом витамине (и взрослого, и ребенка) составляет всего 200 МЕ в сутки. В то же время его развитие возможно при отсутствии инсоляции (инвалиды, асоциальные семьи), хронических заболеваниях почек, при использовании противосудорожных препаратов, нечувствительности рецепторов органовмишеней к метаболитам витамина D. К уменьшению содержания 25-(ОН) D3 может вести гепатоцеллюлярная дисфункция, а также нарушение всасывания витамина D при различных врожденных или приобретенных заболеваниях кишечника.
При определении уровня 25-(ОН)D его снижение ниже критического уровня (<10 нг/мл) обнаружено только у 7,5% обследованных детей как с клиническими проявлениями рахита, так и без них. Клиническую картину так называемого классического рахита нельзя однозначно считать проявлением экзогенного гиповитаминоза D. Рахит и гиповитаминоз D - неоднозначные понятия, а развитие костных признаков рахита у детей раннего возраста обусловлено быстрыми темпами роста, высокой скоростью моделирования скелета и дефицитом в растущем организме фосфатов и кальция при несовершенстве путей их транспорта, метаболизма и утилизации (гетерохрония созревания). Поэтому неслучайно в настоящее время рахит нередко относят к пограничным состояниям у детей раннего возраста.
Не менее важной проблемой в педиатрии является развитие остеопении. Признаки остеопении наиболее часто встречаются у недоношенных и детей, родившихся у женщин, имевших гестоз. Частота клинико-рентгенологических признаков остеопении, подтвержденной данными УЗИ кости, достигала у них 33%. Причиной остеопении явилось снижение кальция и фосфора в грудном молоке, когда их содержание было у большинства женщин в 2-2,5 раза ниже оптимального уровня, а также снижение уровня белка в грудном молоке.
7. Сниженная двигательная и опорная нагрузка и вторичные в связи с этим нарушения обмена кальция, ограниченная естествен- ная инсоляция у неврологических больных с врожденным вывихом бедра, интернированных детей.
В подростковом возрасте, когда происходит очередное ускорение роста, может возникнуть дефицит минеральных компонентов, прежде всего кальция, и развиться рахит. Это состояние проявляется карпопедальным спазмом, болями в ногах, слабостью, деформациями нижних конечностей. У 30% подростков выявляют характерные для рахита рентгенологические изменения в метафизарных зонах. Наиболее часто подобные случаи встречаются в африканских странах, где дефицит кальция в пище является основной причиной развития рахита. У выходцев из южных регионов, живущих в странах Европы, алиментарные нарушения дополняются дефицитом витамина D.
Клинические и параклинические признаки
В настоящее время принято, что для диагноза рахита I степени обязательным является наличие костных изменений: податливость и болезненность при пальпации костей черепа, «краниотабес», утолщения на ребрах в местах перехода хряща в кость - «четки». Выявление только симптомов нарушения вегетативной деятельности (потливость, беспокойство, раздражительность ) не является основанием для диагноза , как это было принято ранее. Лабораторным подтверждением рахита I степени является незначительная гипофосфатемия и увеличение активности щелочной фосфатазы в крови.
II (среднетяжелая) степень рахита характеризуется выраженными изменениями со стороны костей: лобные и теменные бугры, «четки», деформации грудной клетки, умеренная, чаще варусная деформа- ция нижних конечностей. Рентенологически отмечается расширение метафизов трубчатых костей, их чашеобразная деформация. При биохимическом исследовании крови - снижение фосфатов и кальция, увеличение активности щелочной фосфатазы в крови.
III (тяжелая) степень рахита характеризуется грубыми деформациями черепа, грудной клетки и нижних конечностей, задержкой развития статических функций. При рентгенологическом исследовании отмечается грубая перестройка рисунка и разрежение костей, расши- рение и размытость зоны метафизов, возможны переломы без смещения (по типу «зеленой веточки»). В крови определяется выраженное снижение уровня фосфатов и кальция. Помимо костных изменений у больных определяется тахикардия, одышка, увеличение печени.
Начальные признаки рахита чаще определяются в первые месяцы жизни - признаки остеомаляции в виде небольшой податливости
краев большого родничка и швов черепа («краниотабес»). К концу первого полугодия (период разгара) эти процессы усиливаются и появляются признаки остеоидной гиперплазии - деформации черепа (лобные и теменные бугры), грудной клетки («четки» и «гаррисонова борозда»), определяется мышечная гипотония. Когда дети начинают вставать, быстро развиваются варусные деформации нижних конечностей. В это период наиболее выражены рентгенологические признаки - расширение и неровность метафизарной щели, бокаловидная деформация эпиметафизарных отделов костей («браслетки»), нечеткость ядер окостенения, определяются остеопороз и грубый трабекулярный рисунок диафизарных отделов. Наиболее выраженные клинические и рентгенологические признаки рахита развиваются в основном при гипофосфатемии, реже при гипокальциемии. При исследовании крови определяется выраженная гипофосфатемия, небольшая гипокальциемия и значительное повышение активности щелочной фосфатазы. В периоде реконвалесценции (через 3-4 нед от начала лечения) исчезают признаки остеомаляции, появляется четкая линия обызвествления в метафизарной зоне, нормализуется уровень фосфатов, сохраняется лишь небольшая гипокальциемия и умеренной повышение активности щелочной фосфатазы.
Течение рахита у детей может быть острым или подострым. При остром течении в клинической картине преобладают признаки остео- маляции у детей первых шести месяцев жизни, позже чаще развивается подострое течение с манифестацией симптомов остеоидной гиперплазии.
В зависимости от причины развития рахитического процесса выделяют 3 формы заболевания: кальцийдефицитный, фосфатдефицитный и витамин D-дефицитный рахит. Причинами дефицита кальция и развития кальцийдефицитного состояния является недостаток кальция в пище, особенно при длительном кормлении детей грудным молоком, нарушении всасывания кальция при синдроме мальабсорбции. Дефициту кальция способствует вегетарианство. В начале развития кальцийдефицитного рахита уменьшается уровень кальция в сыворотке, затем после ответа паратгормона уровень кальция нормализуется и снижается уровень фосфатов из-за повышенного их выведения с мочой (разные биохимические стадии одного процесса). Уровень щелочной фосфатазы при этом повышен, содержание 25(ОН)2 D - нормальное. При выраженной гипокальциемии одновременно с костными проявлениями могут быть мышечные спазмы,
снижение чувствительности, парестезии, тетания, гиперрефлексия, ларингоспазм, удлиненный β-7-интервал на ЭКГ.
Фосфатдефицитный рахит развивается вследствие недостаточного поступления фосфатов, чаще как главная причина остеопении у недоношенных, при повышенной потребности в фосфатах при быстром росте и нарушении всасывания в кишечнике. Рахит, связанный с недостатком фосфатов, возможен при почечной тубулярной недостаточности вследствие или незрелости почечных канальцев и повышенных потерях фосфатов с мочой, или нарушении реабсорбции фосфатов при гиперпаратиреоидизме на фоне гипокальциемии, которая быстро компенсируется вымыванием кальция из кости. Гипофосфатемия развивается при метаболическом ацидозе, острой почечной недостаточности, онкогенной остеомаляции, длительном применении глюкокортикоидов и др. В настоящее время нарушения метаболизма фосфатов в значительной степени связываются с изменением фактора роста фибробластов 23 (FGF23), внеклеточным фосфо-гликопротеином матрикса и другими метаболитами, известными как фосфатонины.
Наиболее характерным признаком фосфатдефицитного рахита является снижение уровня фосфатов в крови, нормальный уровень кальция, повышение активности щелочной фосфатазы, неизмененный уровень метаболитов витамина D. Именно дефицит фосфатов, а не кальция и не витамина D коррелирует со степенью рахитических костных изменений и степенью рентгенологических признаков рахита.
Экзоили эндогенный дефицит витамина D, как модулятора обмена фосфатов и кальция, также приводит к рахиту, однако это возможно лишь у детей с недостаточной солнечной экспозицией (асоциальные семьи, интернированные дети и др.), а также в случаях нарушений метаболизма витамина D. Профилактическая доза витамина D 400 МЕ в сутки.
Диагностика
Диагностика рахита основана на выявлении характерных проявлений со стороны костной системы. Установить тяжесть и период рахита позволяет биохимическое определение в крови содержания кальция, фосфатов и активности щелочной фосфатазы, а также рентгенологическое исследование костей предплечья. Уровень 25(ОН^ в крови является единственным надежным показателем обеспеченности детского
организма витамином D. В норме концентрация этого метаболита у здоровых детей находится в пределах 15-40 нг/мл, повышаясь летом, благодаря инсоляции, до 25-40 нг/мл, и снижаясь зимой и ранней весной до 15-25 нг/мл. Уменьшение этого метаболита до 10 нг/мл свидетельствует о маргинальной обеспеченности организма витамином D. Уровень 5 нг/мл и ниже соответствует состоянию D-авитаминоза.
Дифференциальный диагноз
В практике педиатра встречаются заболевания, фенотипически копирующие тяжелые формы рахита. К ним относится витамин D- резистентные формы - витамин D-зависимый рахит I иII типа, витамин D-резистентный рахит (фосфат - диабет), болезнь Фанкони - Дебре де Тони, почечный тубулярный ацидоз. Для дифференциальной диагностики с витамин D-резистентными формами рахита необходимо определение креатинина в крови и моче (для подсчета тубулярной реабсорбции фосфатов), а также парциальных функций проксимальных и дистальных канальцев. В некоторых случаях необходима дифференциация с гидроцефалией, гипотиреозом, синдромом мальабсорбции, вторичными изменениями костной системы при использовании противосудорожных средств, глюкокортикоидов, гепарина.
Лечение
Цель лечебных мероприятий при рахите - воздействие витамином D на органы-мишени для оптимизации фосфатно-кальциевого обмена.
Немедикаментозное лечение
Эффективность лечения витамином D повышают сбалансированное питание, пребывание на воздухе, массаж, гимнастика, гигиени- ческие ванны.
Медикаментозное лечение
Препараты витамина D необходимо назначать с учетом клинических проявлений, степени тяжести и динамики болезни: при рахите I степени - 1000-1500 МЕ в течение 30 дней, при рахите II степени - 2000-2500 МЕ в течение 30 дней, при рахите III степени - 3000-4000 МЕ в течение 45 дней. При достижении результата переходят на профилактические дозы витамина D в течение двух лет жизни и в зимнее время на 3-м году жизни.
Наиболее целесообразно для профилактики и лечения рахита использовать водный раствор витамина D3 - в 1 капле 500 МЕ, вигантол - в 1 капле 660 МЕ и отечественные масляные растворы витамин D2 - в 1 капле 1400-1600 МЕ.
Прогноз
При легком рахите прогноз благоприятный. При среднетяжелых и особенно тяжелых формах остаются заметные деформации черепа, грудной клетки и нижних конечностей, возможно формирование рахитического таза и отставание в росте.
Диспансеризация
Дети, перенесшие рахит II и III степени, подлежат диспансеризации. Их осматривают ежеквартально в течение 3 лет. В течение второго года жизни в осенне-зимний период проводят вторичную профилактику, а на 3-м году жизни только в зимний период. В это время детям с рахитом можно проводить профилактическую вакцинацию.
Гипервитаминоз D
Проводимая ранее профилактика рахита высокими дозами витамина D, особенно методом «витаминных толчков», породила болезнь, более опасную, чем сам рахит. Порог токсичности витамина D имеет большие индивидуальные колебания. При гипервитаминозе D 1,25 (ОН)2D3 активирует функцию остеобластов, что вызывает гиперкальциемию, усугуб- ляющуюся повышением всасывания кальция в кишечнике, его реабсорбцию в почках, а также остеопороз. Избыток 1,25(ОН)2D3 приводит к повреждению клеточных и субклеточных мембран. При разрушении лизосом высвобождаются и поступают в клетки ферменты-гидролазы, нарушается активность органов и систем, в том числе печени и почек, что ухудшает их метаболическую и экскреторную функции, нарушается кислотно-щелочной баланс. Гиперкальциемия ведет к кальцинозу органов и тканей, повреждаются крупные сосуды и клапаны сердца.
В клинической картине при гипервитаминозе D у детей первого года жизни имеют место срыгивания, рвота, снижение аппетита, недостаточная прибавка или падение веса, полиурия, полидипсия, обезвоживание. Для детей старшего возраста характерны головные боли, слабость, боль в суставах, повышение АД, реже - нарушения сердечного ритма и судороги.
Осложнения гипервитаминоза D - дисметаболический пиелонефрит, нефролитиаз, нефрокальциноз, ангиокальциноз.
Передозировка витамина D во время беременности приводит, в зависимости от срока поражения, к выкидышам, индукции гиперкальциемии плода и выражается в задержке внутриутробного развития по типу дисплазии или гипотрофии. Для гиперкальциемической эмбриофетопатии специфичны стеноз аортального клапана, метаболический фиброэластоз, дисплазия зубных зачатков.
Лабораторные критерии гипервитаминоза D:
• повышение фосфатов и кальция в крови и моче. Наиболее достоверным признаком является гиперкальциурия - более 3 мг/кг массы;
• компенсаторное увеличение кальцитонина;
• снижение паратгормона;
• увеличение 25ОНD более 70 нг/мл.
Лечение гипервитаминоза D включает отмену витамина D, УФО, инсоляции. Назначаются витамины А, Е, ксидифон, инфузионная терапия в режиме гиперфузии в сочетании с диуретиками (фуросемид). В тяжелых случаях показано назначение фенобарбитала, препаратов кальцитонина (миокальцик, сибакальцин) под контролем уровня кальция крови и мочи. Терапия гипервитаминоза D должна проводиться в стационаре, предпочтительнее в отделениях нефрологического профиля.
РАХИТОПОДОБНЫЕ НАСЛЕДСТВЕННЫЕ ЗАБОЛЕВАНИЯ
Определение
Рахитоподобные наследственные заболевания (тубулопатии), или генетически детерминированные остеопатии - это группа генетически детерминированных заболеваний, приводящих к нарушению обмена кальция и фосфора с последующей деформацией костей скелета. К этой группе заболеваний относят:
• наследственный гипофосфатемический витамин D-резистент- ный рахит (ВДРР);
• почечный тубулярный ацидоз (ПТА);
• болезнь Фанкони-Дебре-де Тони (ФДТ);
• витамин D-зависимый рахит (ВДЗР); Наиболее часто встречаются два типа ВДРР.
I тип - сцепленная с Х-хромосомой гипофосфатемия. Этот классический вариант фосфат-диабета характеризуется резким снижением реабсорбции фосфатов в проксимальных канальцах почек. Клиника манифестирует в первые годы жизни и проявляется задержкой роста, тяжелыми варусными деформациями нижних конечностей, а также рентгенологическими изменениями костей скелета, гипофосфатемией с гиперфосфатурией при нормальном содержании кальция в крови.
II тип - форма гипофосфатемического рахита, несцепленная с Х-хромосомой, наследуемая аутосомно-доминантно или аутосомнорецессивно. Дебют заболевания в возрасте 1-2 года без задержки роста, но с деформацией скелета и рентгенологической остеомаляцией. Биохимические критерии те же.
Болезнь ФДТ, связанная с нарушением транспорта метаболитов в проксимальных канальцах, наследуется по аутосомно-рецессивному типу. Характерно отставание в физическом развитии уже на первом году жизни, боли в костях на фоне рахитических изменений скелета; биохимическими маркерами являются гипераминоацидурия, гиперфосфатурия, калиурия, глюкозурия на фоне полиурии, а также метаболический ацидоз. На практике чаще встречается неполная форма в виде аминофосфатного диабета, требующая тщательного дифференциального диагноза с рахитом детей раннего возраста.
ПТА - клинический синдром, характеризующийся постоянным метаболическим ацидозом, низким уровнем бикарбонатов и увеличением концентрации хлора в сыворотке крови. Наиболее часто диагностируются 2 основных типа ПТА.
I тип - обусловлен дефектом ацидогенетической функции дистальных канальцев. Наследуется аутосомно-рецессивно. Для него характерны отставание в росте, остеопороз и рахитические изменения эпи- и метафизарных зон, кризы полиурии и обезвоживания, гиперкальциурия, нефрокальциноз с сопутствующим интерстици- альным нефритом. Обязательный признак - щелочная моча, гипоизостенурия и дефицит оснований в крови.
II - тип, или проксимальный тип ПТА, связан с неспособностью проксимальных канальцев реабсорбировать бикарбонаты при сохранности ацидогенетической функции дистальных канальцев. Заболевание манифестирует периодической рвотой, подъемами температуры неясного генеза, отставанием в физическом развитии, рано появляются рахитические изменения скелета, возможно развитие нефрокальциноза.
ВДЗР (витамин D-зависимый рахит) развивается при наследственно-обусловленном нарушении образования 1,25(ОН)2D в почечных канальцах. Основные признаки проявляются в первые месяцы жизни в виде рахитических деформаций скелета, выраженной мышечной гипотонии на фоне гипокальциемии и сниженного, реже нормального уровня фосфата в крови и повышения активности щелочной фосфатазы; в моче определяется гиперфосфатурия и гипераминоацидурия. Наследуется аутосомно-рецессивно.
В дифференциальной диагностике может помочь тип деформаций нижних конечностей. Так, варусная деформация чаще характерна для ВДРР и возможна при ФДТ. Деформации вальгусного и смешанного типа могут встречаться при дистальном типе почечного тубулярного ацидоза (ПТА) и ФДТ. Такое разделение больных на две группы позволяет сузить число возможных форм рахитоподобных заболеваний при данном типе деформаций и облегчает этим выявление характерных признаков уже на амбулаторном приеме.
Дифференциальный диагноз
Дифференциальный диагноз рахитоподобных заболеваний представлена в таблице.
Лечение
Немедикаментозное лечение
При всех рахитоподобных заболеваниях большое значение имеет немедикаментозное лечение: диета, сбалансированная по солям кальция, фосфора, магния, белка, лечебная физкультура, массаж, ортопедическое лечение при остеопорозе.
Медикаментозное лечение
При ВДРР положительное влияние на показатели обмена фосфатов оказывает сочетанное применение препаратов витамина D (от 30000 до 50000 МЕ в сутки) и раствора неорганических фосфатов (в виде одно- и двузамещенного фосфата натрия). Длительность лечения определяется степенью тяжести, периодом заболевания, а также уровнем фосфатов в крови. Применение этой комбинации препаратов непрерывно в течение 2-5 лет позволяет поддерживать содержание фосфатов в крови на постоянном уровне в пределах 1-1,5 ммоль/л, что достаточно для постепенного стихания активных проявлений заболевания и предупреждения прогрессирования деформаций.
Таблица. Дифференциальный диагноз рахитоподобных заболеваний у детей (Красновская М.А., Пирогова З.И., 1998)
Признаки | Витамин D-зависимый рахит | Семейный гипофосфатемический D-резистентный рахит - фосфат-диабет | Болезнь Де ТониДебре-Фанкони (глюкозо-фосфатемический диабет) | Почечный тубулярный ацидоз |
Тип наследования | Аутосомно-рецессивный | Доминантный, сцепленный с Х-хромосомой Аутосомно- рецессивный, аутосомно-рецисивный (частота 1:12 ООО) | Аутосомнорецессивный, аутосомно-рецес- сивный Генетический дефект неизвестен | Аутосомно-рецессивный 1 и 2-й типы. С глаукомой и остеопорозом и семейная аутосомно-доминантная форма |
Сроки манифестации | 5-6 мес | 2-3 года | 5-6 мес или 2-3 г | |
Этиопатогенез | I тип. Отсутствие или снижение активности 1,25 дегидр о оксихо лека льциферола из-за отсутствия фермента 1-гидроксилазы почек II тип. Обусловлен нечувствительностью рецепторов органов-мишеней к 1,25 дегидрооксихолекальциферолу, синтез данного мета- болита не нарушен | Дефект реабсорбции фосфатов в канальцах почек, в связи с биохимическим дефектом превращения в 25-гидрокси- кальциферол в печени или с нарушением структуры белков, участвующих в транспорте фосфора в канальцах почек | Нарушен канальцевый транспорт аминокислот, неорганических фосфатов и глюкозы. Снижена канальцевая реабсорбция натрия, калия, воды, что обусловлено дисплазией нефронов | Не установлен. Нарушено образование фер- ментных систем, осуществляющих фильтрацию и реабсорбцию бикарбонатов, задержка развития нефронов, тканевая дисплазия |
Признаки | Витамин D-зависимый рахит | Семейный гипофосфатемический D-резистентный рахит - фосфат-диабет | Болезнь Де ТониДебре-Фанкони (глюкозо-фосфатемический диабет) | Почечный тубулярный ацидоз |
Первые клинические признаки | Изменения со стороны ЦНС и ВНС - раздраже- ние, нарушение сна, плаксивость | Варусные деформации нижних конечностей, рахитические браслетки, «утиная» походка | Беспричинные подъемы температуры, полидип- сия, полиурия | Изменения со стороны ЦНС - нарушение сна, беспокойство, раздражительность. Полиурия, полидипсия, мышечная гипотония |
Специфические признаки | Изменениескелета: краниотабес, лобные и теменные бугры, четки, варусная деформация нижних конечностей и нижней трети голеней, остеопороз | Прогрессирующий характер варусных деформаций нижних конечностей | Периодические подъемы температуры, про- грессирующие варусные или вальгусные деформации, костные деформации, увели- чение печение, запоры | Полиурия, полидипсия, увеличение печени, запоры, вальгусные деформации |
Физическое и психическое развитие | Отставание веса и роста, некоторая задержка моторного развития | Дефицит роста от 2 до | Сочетание низкого роста и резко пониженного питания | Сочетание низкого роста и пониженной массы, нормальное психическое развитие |
Признаки | Витамин D-зависимый рахит | Семейный гипофосфатемический D-резистентный рахит - фосфат-диабет | Болезнь Де ТониДебре-Фанкони (глюкозо-фосфатемический диабет) | Почечный тубулярный ацидоз |
Особенности костной системы и рентге- нологические данные | Костные деформации преимущественно нижних конечностей, системный остеопороз, особенно метафизов, истончение кортикального слоя | Варусные деформации нижних конечностей, грубые деформации метафизов, искривление трубчатых костей | Выраженный остеопороз, трабекулярная исчерченость дистальных и пр оксима льных отделов диафизов | Вальгусная деформация нижних конечнос- тей, системный остеопороз, смазанность, нечеткость контуров, концентрическая атрофия кости |
Биохимический анализ крови | ||||
Концентрация фосфора | Снижена | Значительно снижена | Снижена | Снижена |
Концентрация кальция | Снижена | Норма | Снижена | Норма |
Активность щелочной фосфатазы | Повышена | Повышена | Повышена | Повышена |
КОС | Компенсированный | Компенсированный метаболический ацидоз | Метаболический ацидоз | Выраженный ацидоз |
Биохимический анализ мочи | ||||
Концентрация фосфора | Повышена | Повышена | Повышена или в норме | Повышена или в норме |
Признаки | Витамин D-зависимый рахит | Семейный гипофосфатемический D-резистентный рахит - фосфат-диабет | Болезнь Де ТониДебре-Фанкони (глюкозо-фосфатемический диабет) | Почечный тубулярный ацидоз |
Концентрация кальция | Норма или повышена | Норма | Повышена | Повышена |
Изменения со стороны мочевыделительной системы | Норма, аминоацидурия, часто протеинурия, лейкоцитурия | Норма, относительная аминоацидурия | Снижение аммониоацидогенетической функции почек, глюкозурия | Снижение ацидогенетической функции почек, вторичный пиелонефрит, нефрокальциноз |
Изменения со стороны сердечнососудистой системы | Норма | Норма | АД снижено, на ЭКГ определяют изменения в миокарде | АД снижено, на ЭКГ определяют изменения в миокарде. |
При лечении болезни ФДТ необходима коррекция не только показателей обмена фосфатов, но и нормализация кислотно-щелочного состояния и уровня калиемии. Назначается витамин D (20000- 30000 МЕ в сутки) в сочетании с раствором фосфатов, цитратной смесью и препаратами калия. Длительность курсов такого лечения и перерывов между ними определяется самочувствием больных, а также биохимическими и рентгенологическими данными.
При дистальном типе ПТА борьба с ацидозом - основа лечения. Для этого целесообразно применение цитратной смеси следующего состава: лимонная кислота -
В последние годы при лечении ВДЗР успешно используется 1- альфа -оксихолекальциферол, производимый под названием оксиде- вит. Доза оксидевита подбирается индивидуально, составляя от 0,25 до 1 мкг в сутки на срок от 2 до 6 недель. При лечении обязателен контроль за уровнем кальция в крови и моче.
Хирургическая коррекция деформаций нижних конечностей должна проводиться только после тщательного обследования больных и лишь после нормализации электролитных нарушений и кислотно-щелочного состояния. Оперативное вмешательство не следует проводить раньше 9-10 летнего возраста из-за опасности рецидива деформаций. В связи с возможностью гиперкальциемии у иммобилизированных больных в пред- и послеоперационном периоде препараты витамина D и фосфатов временно должны быть отменены. Их следует назначать под контролем уровня фосфатов и кальция в крови после того, как больные начинают ходить. Успешное хирургическое лечение деформаций нижних конечностей возможно лишь при обязательном контакте в работе педиатра и ортопеда.
Глава 2
Хронические расстройства питания ДИСТРОФИЯ
Определение
Дистрофия - хроническое расстройство питания и трофики тканей ведущих систем организма, нарушающее гармоничное развитие ребенка.
*Код по МКБ-Х.
Классификация
Выделяют три вида дистрофии.
• Гипотрофия: дефицит массы тела по отношению к росту. При прогрессировании патологического процесса возникает отставание роста.
• Гипостатура: равномерное отставание массы и роста от возрастных норм.
• Паратрофия:
- с равномерно избыточными массой тела и ростом от возрастных норм;
- с преобладанием массы тела над ростом.
Наиболее частая клиническая форма дистрофии - гипотрофия. Различают врожденную (пренатальную), приобретенную (постна- тальную) и смешанную форму гипотрофии. В соответствии с классификацией МКБ-Х термин «пренатальная гипотрофия» замещен на «задержка внутриутробного развития» (см. Раздел «Неонатология»).
Кроме экзогенно обусловленных дистрофий существует группа эндогенных гипотрофий. Некоторые из них сопутствуют врожденным порокам органов и систем, врожденным эндокринопатиям или нейропатиям и не вызывают затруднений в диагностике. Другие гипотрофии, возник- шие в результате первичных мальабсорбций, распознать сложнее.
Этиология
Задержка внутриутробного развития чаще всего обусловлена заболеваниями матери или связана с внутриутробной гипоксией, инфекцией плода, геномными и хромосомными мутациями.
Причиной приобретенной гипотрофии принято считать экзогенные и эндогенные факторы.
• Экзогенные факторы:
- количественный и качественный недокорм;
- инфекционные и соматические заболевания [острые респираторные вирусные инфекции (ОРВИ), заболевания ЖКТ, пиелонефрит, сепсис и другие заболевания, обусловленные недокормом при ухудшении аппетита].
• Эндогенные факторы:
- пренатальные и неонатальные повреждения ЦНС;
- эндокринные и нейроэндокринные расстройства (гипотиреоз, адроногенитальный синдром, гипофизарный нанизм);
- врожденные пороки различных систем организма (ЦНС, ВПС, дыхательной, пищеварительной и других систем);
- наследственные или врожденные ферментопатии (дисахаридазная недостаточность, целиакия, муковисцидоз, экссудативная энтеропатия);
- первичные иммуннодефицитные состояния;
- наследственные нарушения обмена веществ (галактоземия, гомоцистинурия, ФКУ и другие заболевания).
Вызвать появление гипостатуры могут инфекционные заболевания затяжного, рецидивирующего течения, а также нарушения режима дня ребенка. Развитие гипостатуры - процесс более длительный во времени, чем развитие гипотрофии, поэтому гипостатуру чаще выявляют у детей старше полугода жизни.
Причиной возникновения паратрофий является перекорм либо нерациональное питание с избытком углеводов или белка. В неко- торых случаях нерациональное питание беременной с избытком углеводов при недостатке белка, витаминов и минеральных веществ подготавливает почву для развития паратрофии у ребенка.
Патогенез
В основе гипотрофии - недостаток пищевых веществ, вызывающий снижение образования энергии. Возрастающий дефицит приво- дит к снижению основного обмена веществ, для его восстановления необходимо усиленное расходование запасов гликогена. Клинически это выражено в прогрессирующем исхудании ребенка. В дальнейшем происходит трата пластического материала - белка, возникает белково-энергетическая недостаточность организма - замедление
роста и созревания всех органов и систем, включая ЦНС и ВНС. Снижаются выработка ферментов и их активность, в результате больше всего страдает пищеварительная система. Отмечают нарушения полостного, мембранного пищеварения. Клинически это проявляется чередованием поносов и запоров. Существенно страдает дезинтоксикационная и синтетическая функция печени (возможны гипопротеинемия, гипоальбуминемии, гипераминоацидурии, гипо- липидемия, гипофосфолипидемия, гиперхолестеринемия и другие симптомы). При нарушении углеводного обмена отмечают гипогликемию, плоские гликемические кривые, нарушение витаминного баланса, водного и минерального обмена. Нарушение всех видов обмена приводит к накоплению в организме недоокисленных продуктов, развитию метаболического ацидоза и эндогенного токсикоза. Страдает клеточный и гуморальный иммунитет, что приводит к возникновению септических и токсико-септических состояний.
Клиническая картина
Гипостатура характеризуется отставанием в массе и росте. При оценке антропометрических данных обнаруживают отставание роста ребенка от возрастных нормативов, однако масса тела относительно фактического роста близка к норме. Данное явление вызвано длительной пищевой недостаточностью, иногда начавшейся в пренатальном периоде и продолжавшейся в постнатальном.
При гипостатуре, как и при гипотрофии, клиническая картина характеризуется признаками нарушения питания с расстройс- твом функции органов и систем. Гипостатуру следует отличать от гипоплазии, связанной с конституциональными (наследственными) особенностями. У детей с гипоплазией общие признаки нарушения трофики отсутствуют.
Клинические проявления паратрофии обусловлены несбалансированным питанием с избытком углеводов и недостатком белка. Масса и длина тела соответствуют или превышают возрастные нормативы. Кожные покровы бледные, пастозные. Подкожно-жировая клетчатка распределена неравномерно, превалирует на бедрах и животе. Стул обильный, пенистый.
Таблица. Клиническая картина гипотрофии (Строганова Л.А., Александрова Н.И., 1996)
I степень | II степень | III степень | |
Кожа | Бледная. Снижение эластичности | Бледная, сухая, легко собирается в складки. | Серая, сухая, собирается в складки |
Истончение подкожножирового слоя | Умеренно выражено на животе | Выраженное на животе, на конечностях | Полное исчезновение жира на теле |
Тургор тканей | Умеренно снижен | Значительно снижен. Дряблые складки кожи на конечностях, шее | Резко снижен, кожа висит складками |
Весовая кривая | Уплощена, прибавки в массе тела уменьшены | Плоская, прибавки в массе тела отсутствуют | Кахексия |
Рост (длина тела) | Соответствует возрасту | Отставание на 1-3 см | Значительное отставание от нормы |
Дефицит массы тела по отношению: к возрастной норме в % | 10-15% | 16-30% | Более 30% |
Дефицит массы тела по отношению к норме по центильным таблицам | От Р25до Р10 | От РЮдо РЗ | Ниже РЗ |
Дефицит массы тела по отношению к росту по центильным таблицам | От Р25до Р10 | От РЮдо РЗ | Ниже РЗ |
Индекс Чулицкой (упитанности) | 15-20 | 10-0 | <0 |
Аппетит | Не нарушен или несколько снижен | Снижен значительно | Резко снижен вплоть до анорексии |
Срыгивание и рвоты | Не характерны | Возможны | Бывают часто |
I степень | II степень | III степень | |
Характер стула | Не изменен | Неустойчивый (разжиженный, не переварен- ный, реже - запоры) | - |
Секреторная и ферментативная функция желудка и кишечника | В пределах нормы или умеренно снижена (в 2 раза) | Значительно снижена (в 3-4 раза) | Резко снижена (в 5-10 раз по сравнению с нормой) |
Дисбактериоз | Отсутствует или I степени | II степени | III степени |
Белкового | - | Гипопротеинемия. Дисбаланс аминокислот | Выраженные изменения: гипопротеинемия. Отрицательный азотистый баланс |
Жирового | Снижение содержания в крови общих липидов | Снижение содержания в крови фосфолипидов | Глубокие нарушения липидного обмена |
Углеводного | Не нарушен | Гипогликемия | Гипогликемия. Нарушение гликогеносинтеза |
Минерального | Умеренные гипонатриемия и гипокалиемия | Отчетливые гипонатриемия и гипокалиемия | Отчетливые гипонатриемия и гипокалиемия |
Витаминного | Умеренные гипонатриемия и гипокалиемия | Выраженные гипонатриемия и гипокалиемия | Резкое нарушение фосфорилирования витами- нов |
Изменение нервно-рефлекторной возбудимости | Повышенное беспокойство, отрицательные эмоции | Снижение, угнетение, вялость | Превалирует угнетение |
I степень | II степень | III степень | |
Физиологические рефлексы | Не нарушены | Гипорефлексия | Резко выраженная гипорефлексия |
Состояние мышечного тонуса | Не нарушен | Гипотония или дистония | Резкая гипотония или гипертония |
Психомоторное развитие | Соответствует возрасту | Отстает | Исчезают ранее приобретенные навыки |
Нарушение сна | Не нарушен | Уменьшены глубина и продолжительность сна | Значительно нарушены все фазы сна |
Терморегуляция | Не нарушена | Отчетливо нарушена | Значительно нарушена |
Иммунитет | Умеренно снижен | Значительно снижен | Резко снижен |
Заболеваемость | Незначительно повышена | Частые заболевания затяжного и рецидивиру- ющего течения | Частые заболевания, иногда стертое, ати- пичное течение. В ряде случаев возможен исход в септическое и токсическое состояние |
Лечение
Лечение гипотрофии проводят комплексно, с учетом этиопатогенеза, правильного проведения диетотерапии, медикаментозной терапии, включающей ферментотерапию и витаминотерапию, коррекцию биоценоза кишечника.
Немедикаментозное лечение Диетотерапия
Назначение оптимального питания возможно только при гипотрофии I степени в условиях сохранившейся толерантности к пище. В этом случае объемным методом, в зависимости от возраста, необходимо определить количество недостающего питания. Если ребенок находится на грудном вскармливании, то недостающее количество пищи можно увеличить поддержкой грудного вскармливания. При отсутствии женского молока назначают адаптированные смеси («НАН-1», «НАН-2»), недоношенным - «ПреНАН». Гипотрофии степени обнаруживают при тяжелых ВПС, почек, и других органов. В этих случаях следует считаться со значительными нарушениями обменных процессов. В связи с этим диетотерапию проводят поэтапно. Вначале следует выяснить толерантность к пище: при гипотрофии степени на 1 этапе проводят разгрузку. Рассчитывают суточный объем пищи и назначают 1/2 или 2/3 суточного объема грудного молока или адаптированной смеси, при III степени - 1/3 рассчитанного суточного объема пищи, недостающее количество пищи восполняют допаиванием чая, назначают каротиновую смесь или высокогидрализатные смеси («Альфаре»). В течение 3-7 дней, постепенно увеличивая объем, достигают суточной нормы питания. При этом проводят подсчет ингредиентов на
Медикаментозное лечение
При тяжелой гипотрофии (II-III степени) на 1-м этапе лечения проводят инфузионную терапию с целью уменьшения гипопротеинемии. По достижении 2/3 суточного объема питания показана фер- ментотерапия в течение 2-3 нед. Для коррекции биоценоза кишечника назначают пребиотики и пробиотики. Для улучшения функции печени назначают метионин, глутаминовую кислоту, липоевую кислоту и другие препараты. Для обеспечения окислительно-восстановительных процессов применяют аскорбиновую кислоту, витамин В, кокарбоксилазу, рибофлавин парентерально. Общестимулирующее действие оказывает витамин В12.
В тяжелых случаях гипотрофии используют анаболические стероиды. При обнаружении инфекции применяют антибиотики.
Лечение паратрофии: у детей первых месяцев жизни, в случаях, когда паратрофия возникла в результате количественного перекорма грудным молоком, рекомендовано ограничить время кормления ребенка до 10-15 мин, отменить ночное кормление, заменить сладкий чай овощным отваром. Детям с предшествующим углеводным перекормом следует ограничить употребление легкоусвояемых углеводов. При всех вариантах паратрофии в качестве первого прикорма рекомендуют овощное пюре.
Дальнейшее ведение
Необходимо диспансерное наблюдение. Дети, перенесшие дистрофии, наблюдаются участковым педиатром 1 раз в 2 нед. Следует анализировать аппетит, стул, антропометрические и объективные данные ребенка. Проводят расчет питания, назначают массаж, гимнастику.
Критерии выздоровления: нормальные показатели трофики ребенка, хороший эмоциональный тонус, антропометрические показатели соответствуют возрасту, отсутствие функциональных изменений внутренних органов.
ГИПОВИТАМИНОЗЫ И ГИПЕРВИТАМИНОЗЫ
Гиповитаминозы
Развитие гиповитаминозов у детей связано как с экзогенными, так и эндогенными факторами. Экзогенные гиповитаминозы чаще всего обусловлены алиментарными причинами, а эндогенные - либо недостаточным всасыванием витаминов в ЖКТ, либо с нарушением их усвоения. Выделены основные клинические проявления гиповитаминозов у детей.
Профилактика гиповитаминозов состоит в организации правильного питания в зависимости от возраста. Потребность ребенка в вита- минах увеличивается при инфекционных заболеваниях, гастроэнтерологической патологии, болезнях печени, почек, органов дыхания, при назначении антибиотиков, сульфаниламидных преапаратов.
Гиповитаминозы
Витамины | Продукты, богатые витаминами | Клиническая картина | Лабораторные показатели | Лечение |
С, аскорбиновая кислота | Шиповник, цитрусовые, ягоды (клюква, черная смородина), овощи | Цинга. Гингивит. Кровоточивость десен. Петехии на коже, гематомы. Анемия. Вялость, утомляемость, анорексия, субфебрилитет | Снижение витамина С в плазме крови, в моче. Снижение резистентности капилляров. Рентгенография костей: истончение костных балок, деструкция, периостальные кальцификаты | Парентеральное введение аскорбиновой кислоты: 200мг/сут. В дальнейшем по 300- 500 мг в день |
Bj, тиамин | Пища животного и растительного про- исхождения (молоко, мясо, яйцо, злаковые, ржаной хлеб, бобовые) | Поражение нервной системы, полиневриты, параличи, мышечная слабость. Парестезии, судороги. Потеря аппетита, запо- ры. СН. Аритмии. Срыгивания. Рвота | Содержание витамина В: в плаз- ме меньше 14,8 ммоль/л и в суточной моче | Парентеральное введение (в/м витамин В: 5-10мгдо 50 мг в день) |
Витамины | Продукты, богатые витаминами | Клиническая картина | Лабораторные показатели | Лечение |
В2, рибофлавин | Печень, почки, яичный желток, дрожжи, сыр, творог, горох | Анемия, «заеды», трещины в углах рта, сухой красный язык, красная кайма губ | Содержание витамина В2 в суточной моче менее 100 мкг | 0,003- |
В3, пантотеновая кислота | Печень, почки, яичный желток, молоко, горох, мясо | Повреждение кожи, замедление роста, анорексия, раздражительность, анемия | - | |
В5, или РР, никотиновая кислота | Продукты животного и растительного пр оисхождения. Злаковые, бобовые, отруби | Анорексия, интоксикация. Пенящийся стул в результате брожения углеводов. Изменения полости рта: трещины языка, черно -кори чневый налет, переходящий в гиперемию | - | Продукты, содержащие триптофан. В зависимости от возраста 50-100 мг витамина РР в день, до 10-20 инъекций на курс |
В6, пиридоксин | Мясо, рыба, дрожжи, яичный желток, бобовые, злаковые | Судороги у новорожденных. Сухая шелушащаяся кожа, раздражительность. Повышенная возбудимость. Анемия, гипотрофия | Ксануренурия (более 0,005г/сут). Зеленый цвет мочи при добавлении 10 % хлорного железа | При судорогах 2 мл 5 % раствора пири- доксина внутримышечно. 0,005- |
Витамины | Продукты, богатые витаминами | Клиническая картина | Лабораторные показатели | Лечение |
В12, цианокобаламин | Мясо, рыба, печень, почки, сыр | Метало бластическая анемия, атрофический гастрит, поражение спинного мозга | Содержание витамина В12 менее 400 мкг/л | 5-8 мкг/кг внутримышечно через день |
Р, рутин | Чай, шиповник, лимонные и апельсиновые корки, орехи, шпинат | Боли в ногах, слабость, вялость, утомляемость, кожные кровоизлияния | Низкая резистентность капилляров | 100-150 мг рутина всут+ 100-300 мг аскорбиновой кислоты |
Bis | Печень, пивные дрожжи, рис, ядра абрикосовых косточек | Чувствительность к фотосенсибилизации, высыпания на коже в виде крапивницы | - | 10-25мг в сут. По 50 мг пангамата кальция |
В9, фолиевая кислота | Зеленые листья (овощи, зелень), бобовые, свекла, печень, яйца, сыр | Глоссит. Анемия. Отставание в физическом развитии. Поносы | Содержание φ о лиев ой кислоты в крови менее 20мг/л | 0,01- |
А, ретинол | Яйца, печень, сливочное масло, молоко. Провитамин А - морковь, шиповник, помидоры, малина, облепиха | Сухая кожа, гнойнички на коже, частые ОРВИ, пневмонии, отиты, светобоязнь, задержка прибавки массы тела | Содержание витамина А в сыворотке крови менее 0,7 мкмоль/л. Содержание каротина менее 1,5 мкмоль/л | 5000-10 000 МЕ витамина А по 2 раза в день. В тяжелых случаях доза составляет 500- 1000 МЕна1кг/сут |
Витамины | Продукты, богатые витаминами | Клиническая картина | Лабораторные показатели | Лечение |
Е,токоферол | Зеленый горошек, злаковые, салат, овощи | Анемия, мышечная слабость, гипотрофия | Содержание витамина Ε в крови менее бмг/л, | Недоношенным детям 25-50 мг витамина Ε в сутки |
Н,биотин | Куриное яйцо, печень, мясо, горох, треска | Дерматит, потеря аппетита, отечность языка, гиперстезия, анемия | Содержание биотина в крови менее 8 мкг/л | 100-300 мкг биотина в сутки |
D, холекальциферол | Список дан в главе «Рахит» | - | - | - |
К, филлохинон | Печень, яйца, горох, шпинат, томаты | Петехии, экхимозы (на коже и слизистых), кишечные кровотечения, микрогематурия, кровотечение из мест уколов | Уровень протромбина ниже 70 % | При кровотечениях в/м 0,5-1 мл 1% раствора викасола*, затем 0,003- |
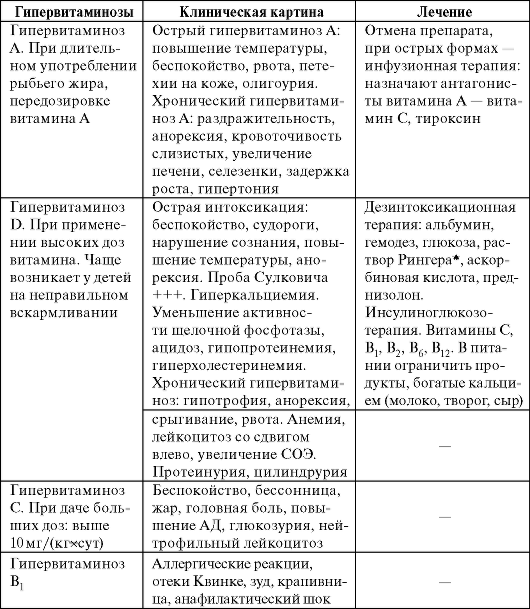
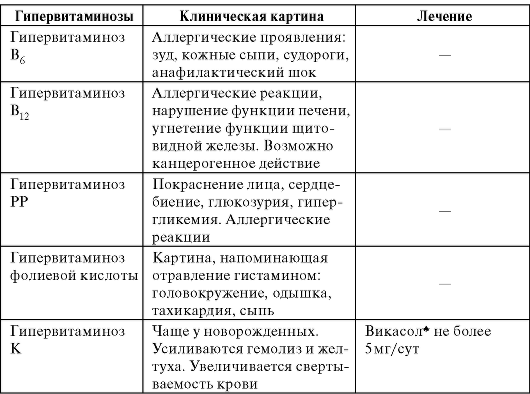
Гипервитаминозы
Данные состояния проявляются при длительном бесконтрольном применении витаминов, чаще всего - А и D. Нередко при паренте- ральном применении витаминов В1, В6 PP встречаются аллергические реакции. Клиническая картина и лечение гипервитаминозов представлена в таблице.
Гипервитаминозы
Глава 3
Анемии
Определение
Анемия - патологическое состояние, которое характеризуется снижением уровня гемоглобина и/или количества эритроцитов в единице объема крови. Количество эритроцитов менее объективный показатель анемии, чем уровень гемоглобина. Данное состояние следует диагностировать при уровне гемоглобина ниже следующих нормативных показателей:
• 110 г/л у детей от 6 мес до 5 лет;
• 115 г/л от 5 до 11 лет;
• 120 г/л от 12 до 14 лет;
• 120 г/л у девочек старше 15 лет;
• 130 г/л у мальчиков старше 15 лет.
Классификация
Клиническая классификация анемий
По степени тяжести выделяют (в зависимости от концентрации гемоглобина):
• легкой степени (110-90 г/л);
• средней степени тяжести (90-70 г/л);
• тяжелой (ниже 70 г/л).
В зависимости от среднего объема эритроцитов:
• микроцитарные (менее 80 фл);
• нормоцитарные (81-94 фл);
• макроцитарные (более 95 фл).
По среднему содержанию гемоглобина в эритроцитах:
• гипохромные (менее 27 пг);
• нормохромные (28-33 пг);
• гиперхромные (более 33 пг).
По состоянию регенераторной активности костного мозга (определяют по концентрации ретикулоцитов):
• гипорегенераторные (менее 1 %);
• норморегенераторные (1-3 %);
• гиперрегенераторныеv гиперрегенраторные (более 3 %).
Этиопатогенетическая классификация анемий
Дефицитные анемии:
- железодефицитные;
- витаминодефицитные (дефицит витамина B, C, фолиевой кислоты и др.);
- белководефицитные;
- минералодефицитные. Постгеморрагические анемии:
- вследствие острой кровопотери;
- вследствие хронических кровопотерь. Гипо- и апластические анемии.
• Врожденные формы.
- С поражением эритро-, лейко- и тромбоцитопоэза:
ι с врожденными аномалиями развития (тип Фанкони);
ι без врожденных аномалий развития (тип Эстрена-Дамешека).
- С парциальным поражением гемопоэза - избирательная эритроидная аплазия (тип Блекфена-Даймонда).
• Приобретенные формы.
- С поражением эритро-, лейкоцитов или тромбоцитопоэза: ι острая апластическая;
ι подострая гипопластическая;
ι хроническая гипопластическая с гемолитическим компонентом на фоне аутоиммунизации.
- Парциальная гипопластическая с избирательным поражением гемопоэза.
Гемолитические анемии.
• Наследственные:
- мембранопатии (микросфероцитоз, элиптоцитоз, стоматоцитоз, ксероцитоз, пароксизмальная ночная гемоглобинурия и др.);
- ферментопатии (дефекты цикла Эмбдена - Мейергофа, пентозофосфатного цикла, обмена нуклеотидов, метгемоглобинемия);
- дефекты структуры и синтеза гемоглобина (серповидно-клеточная (серповидноклеточная болезнь и другие гемоглобинозы с аномальными гемоглобинами, талассемии, эритропорфирии).
• Приобретенные:
- иммунные и иммунопатологические (изоиммунные - при переливании несовместимой крови, гемолитической болезни новорожденных, Rh- и АВ0-конфликте, аутоиммунные, гаптеновые медикаментозные и др.);
- инфекционные [цитомегаловирусная (ЦМВ), менингококковая инфекция и др.];
- витаминодефицитные (витамин E-дефицитная анемия недоношенных и анемии, обусловленные отравлением тяжелыми металлами, ядом змей и т. п.);
- ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) разной этиологии;
- при различных тяжелых патологических состояниях (например, диффузные заболевания соединительной ткани).
Предварительный диагноз анемии должен быть сформулирован следующим образом: микросфероцитарная гипохромная регенера- торная анемия средней степени тяжести.
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
Определение
Железодефицитная анемия (ЖДА) - состояние, которое характеризуется снижением содержания железа в сыворотке крови, костном мозге и депо в связи с его потерей или увеличенной потребностью, повышенной железосвязывающей способностью сыворотки крови. Вследствие этого развивается нарушение синтеза гемоглобина со снижением его уровня в единице объема крови и уменьшением средней концентрации в каждом эритроците, с развитием гипохромной анемии и трофических расстройств в тканях организма.
Код по МКБ-Х
D50.0 Железодефицитная анемия вторичная вследствие потери крови (хроническая).
D50.8 Другие железодефицитные анемии.
Эпидемиология
ЖДА - самая распространенная болезнь в мире. По данным ВОЗ, до 20 % населения земного шара страдают этим заболеванием.
ЖДА страдают 26-60 % детей раннего возраста. Максимальный уровень заболеваемости приходится на 2-е полугодие жизни, а самый низкий наблюдают на 3-м году. Высокую частоту анемизации в 1, 3, 6-й месяцы жизни объясняют интенсивностью роста детей и большими потребностями в железе в этот период их развития.
К группе высокого риска по возникновению анемии следует отнести следующих детей:
- с атопическим дерматитом, вследствие повышенных потерь железа с эпителием, в том числе и кишечника;
- крупных детей с интенсивными весоростовыми прибавками на 1-м году жизни (более
Этиология
Основные причины возникновения дефицита железа в организме ребенка и, следовательно, способствующие развитию ЖДА:
- нарушения функции плаценты, токсикозы;
- нарушение маточно-плацентарного кровообращения;
- невынашивание плода и многоплодие;
- фетоматеринские кровотечения.
• Повышенная потребность организма в железе при ускоренных темпах физического развития ребенка (избыточные прибавки в весе и / или росте).
• Алиментарный дефицит железа наблюдают при:
- раннем переводе на искусственное вскармливание;
- позднем введении прикормов (особенного мясного);
- несбалансированном питании (с преобладанием мучной, молочной или вегетарианской пищи при недостаточном упот- реблении мяса).
• Снижение абсорбции железа в кишечнике определяют:
- при врожденных и приобретенных синдромах мальабсорбции, воспалительных заболеваниях кишечника;
- при функциональных расстройствах органов ЖКТ (усиление перистальтики кишечника).
• Избыточные потери железа в результате:
- преждевременной перевязки пуповины;
- интранатальных кровотечений различной (в том числе и ятрогенной) этиологии;
- оккультных (скрытых кровотечений) в результате различных причин (в том числе и глистной инвазии кровососущими пара- зитами).
Патогенез
Патогенез ЖДА тесно связан с особенностями метаболизма железа в организме и проходит три стадии железодефицитного состояния
(ВОЗ, 1977).
• Прелатентный дефицит железа характеризуется истощением тканевых запасов железа, с одной стороны, и сохранением адекватного транспортного уровня железа, с другой.
• Латентный дефицит железа сопровождается снижением содержания как тканевых запасов, так и уровня транспортного железа, но при этом уровень эритроцитов и гемоглобина остается нормальным.
• ЖДА, для которой характерно опустошение тканевых депо железа, резко выраженное снижение транспортного пула железа, снижение уровня гемоглобина при очень умеренном снижении количества эритроцитов. При ЖДА определяют более выраженный, чем при латентном дефиците железа, сидеропенический синдром.
Патоморфология
Железо - один из наиболее распространенных и значимых микроэлементов человеческого организма. Без него невозможен перенос кислорода, железо активно участвует в процессах окисления, синтезе белка, влияет на количество и функциональные свойства клеток иммунокомпетентнойиммуннокомпетентной системы. Этот облигатный биометалл участвует в процессах митоза клеток, биосинтеза ДНК. Дефицит железа ведет к иммунодефициту: уменьшается содержание Т-лимфоцитов, снижается реакция бласттрансформации лимфоцитов на различные митогены, нарушаются процессы перекисного окисления липидов, что ведет к накоплению диеновых конъюгатов. Гипосидеремия приводит к нарушению клеточных органелл, при этом уменьшается плотность митохондрий в клетках печени, мышц и эритроидных клетках. Одновременно нарушается катаболизм катехоламинов, повышается их концентрация в тканях ЦНС, что приводит к активации адренергических влияний. Гипоксия вызывает гипервентиляцию легких, увеличение частоты сердечных сокращений, объема циркулирующей крови. Все эти изменения, имеющие вначале компенсаторный характер, в дальнейшем приводят к органическим повреждениям. Так, развиваются миокардиодистрофия, хронический гастрит, энцефалопатия и др.
Метаболизм железа в организме
Метаболизм железа - сложный процесс, который включает в себя хранение, использование, транспорт, разрушение и повторное его использование (реутилизация). Основная суточная потеря железа связана со слущиванием эпителия ЖКТ, дыхательных и мочевыводящих путей, десквамацией клеток кожи и ее придатков (выпадение и стрижка волос и ногтей), выделением микроэлемента с потом и мочой, но все эти потери следует признать минимальными. Они возрастают многократно у девушек и женщин репродуктивного возраста в связи с регулярными менструальными кровопотерями.
Клиническая картина
Субъективные проявлениями ЖДА:
- общая и мышечная слабость, недомогание, снижение работоспособности, ослабление аппетита;
- извращение вкуса (желание есть некоторые несъедобные вещества, например мел; или малосъедобные продукты - сырое тесто, крупу);
- потребность в кислой, острой, соленой пище;
- сухость и пощипывание кончика языка, нарушение глотания с ощущением инородного тела в горле;
- извращение обоняния (появляется пристрастие к неприятному запаху, например бензина, керосина);
- отмечают сердцебиение, одышку, обмороки, бессонницу и др.
Диагностика
Физикальное исследование
При объективном обследовании у больных можно обнаружить:
- бледность кожных покровов, которые иногда приобретают зеленоватый оттенок (именно такая окраска оправдывала ста- ринное название болезни - «хлороз»);
- «синева» склер, атрофия сосочков языка, иногда трещины на его кончике и по краям, участки покраснения со слущенным эпителием («географический» язык);
- афтозные изменения слизистой оболочки полости рта; трещины губ, трещины в углах рта - хейлит («заеды»), повреждение зубной эмали;
- сухость кожи, волос; ломкость ногтей;
- жжение и зуд вульвы; выраженная мышечная слабость, не соответствующая степени тяжести анемии;
- кожа при ЖДА становится сухой, иногда на ней появляются трещины;
- изредка можно наблюдать легкую желтизну ладоней и носогубного треугольника, связанную с нарушением обмена каротина при дефиците железа в организме.
Все эти клинические признаки заболевания бывают более выраженными при ЖДА тяжелой степени. Типичным признаком желе- зодефицитного состояния является поражение ЖКТ, что создает неверное представление о том, что первичным звеном в патогенезе заболевания является поражение желудка с якобы последующим развитием дефицита железа в организме. Атрофические изменения возникают в слизистой оболочке не только пищеварительного тракта, но и в системе дыхания, половых органах.
У больных с ЖДА, как правило, отсутствует общая желтушность кожных покровов, нет кожного геморрагического синдрома, увеличения селезенки и лимфатических узлов. Изменения со стороны сердеч- но-сосудистой системы свойственны такому понятию, как миокардиодистрофия, и проявляют себя такими симптомами, как приглушение сердечных тонов, систолический шум на верхушке сердца функционального характера, различными отклонениями на ЭКГ.
Лабораторные исследования
Существует значительный набор методов и средств, позволяющих с помощью современных анализаторов надежно верифицировать ЖДА. Используемые методы и критерии диагностики данного заболевания могут быть представлены в следующем виде.
Общеклинический анализ периферической крови:
- снижение уровня гемоглобина и в меньшей степени количества эритроцитов в единице объема крови (конкретные показатели в зависимости от степени тяжести анемии приведены выше);
- снижение цветового показателя и, следовательно, среднего содержания гемоглобина в одном эритроците (международная аббревиатура - МСН; выражается в пикограммах (пг); норма - 27-35 пг);
- уменьшение размеров эритроцита и его объема;
- анизо- и пойкилоцитоз эритроцитов с преобладанием микроцитоза;
- гипохромия эритроцитов;
- количество ретикулоцитов в норме или несколько повышено;
- содержание лейкоцитов в норме или несколько снижено, в основном за счет нейтрофилов;
- количество тромбоцитов в норме или несколько повышено;
- лейкоцитарная формула обычная. Биохимический анализ крови:
- снижение содержания сывороточного железа менее 14,3 мкмоль/л (норма 0,7-1,7 мг/л или 12,5-30,4 мкмоль/л);
- снижение содержания ферритина в сыворотке крови;
- снижение процента насыщения трансферрина железом (коэффициент насыщения плазмы менее 18 %);
- снижение запасов железа по десфераловому тесту;
- повышение (свыше 78 мкмоль/л) общей (ОЖСС)1 и латентной (ЛЖСС) железосвязывающей способности сыворотки крови; крови.
- повышение содержания протопорфирина в эритроцитах. ОЖСС сыворотки крови при ЖДА всегда повышена, в отличие от
других гипохромных анемий, связанных не с дефицитом железа, а с нарушением его включения в молекулу гемоглобина или перераспределением железа из эритроидных клеток в клетки макрофагальной системы, например при воспалительных процессах.
Инструментальные исследования
Для выявления основного заболевания, обусловившего развитие анемии, необходимо комплексное обследование пациента.
- Исследование ЖКТ (проведение фиброгастродуоденоскопии, определение кислотности желудочного сока).
- Исследование кала на наличие паразитов, особенно кровососущих.
- Исследование кала на скрытую кровь (реакция Грегерсена).
- Рентгенологическое исследование пищеварительного тракта на выявление расширенных вен пищевода, опухоли и других опасных заболеваний хирургического профиля.
- Гинекологическое обследование девочек и девушек.
- Ректороманоскопия для выявления язвенного колита, геморроя или опухоли.
1 Железосвязывающая способность сыворотки - то количество железа, которое мог бы связать имеющийся в плазме трансферрин (в норме 41-49 мкмоль/л или 3,5- 4,0 мг/л, или 350-400 мкг %).
Лечение
Лечебная тактика при ЖДА должна основываться на точном знании характера и причин заболевания, иметь этиопатогенетическую направленность, следовать определенным принципам. К ним относят:
- коррекцию дефицита железа и восстановление его запасов в организме, которые невозможно возместить только диетотерапией, без применения лекарственных железосодержащих препаратов;
- терапию ЖДА следует проводить преимущественно пероральными препаратами железа;
- лечение ЖДА не прекращают после нормализации уровня гемоглобина, ибо перед врачом стоит важная задача создания депо железа в организме;
- гемотрансфузии при ЖДА проводят только по жизненным показаниям.
Медикаментозное лечение
Главное место в терапии ЖДА у детей раннего возраста отводится специфическому лечению препаратами железа. Для получения терапевтического эффекта следует выполнять следующие рекомендации:
- солевые препараты железа лучше применять натощак или между приемами пищи;
- при плохой переносимости препарата следует подобрать другой препарат, но не отказываться от лечения;
- препараты железа следует назначать в адекватной дозе;
- терапию с использованием указанной дозы элементарного железа следует проводить до достижения нормального уровня гемоглобина и затем еще не менее 2 мес в половинной дозе для создания депо железа в организме.
Используют следующие препараты железа.
• Монокомпонентные:
- содержащие железа сульфат (например, гемофер-пролонгатум*);
- содержащие железа глюконат (например, железа глюконат);
- содержащие железа фумарат (например, ферретаб*);
- содержащие железа хлорид (например, гемофер*).
- содержащие железа (III) гидроксид полимальтозат: (например, мальтофер*).
• Комбинированные - препараты, содержащие соединения железа, микроэлементы и поливитамины.
• Препараты железа для парентерального применения - феррум лек* [железа (III) гидроксид сахарозный комплекс].
Парентеральное введение препаратов железа, возможно лишь по специальным показаниям.
В соответствии с рекомендациями ВОЗ и указаниями Министерства здравоохранения Российской Федерации от
Критерии эффективности ферротерапии:
- нарастание уровня гемоглобина на 10 г/л в неделю;
- появление ретикулярного криза (увеличение количества ретикулоцитов в 2 раза на 10-14-й день);
- повышение сывороточного железа до 1000 мкг/л. Побочные и нежелательные реакции при приеме препаратов
железа в основном связаны с превышением рекомендуемых ВОЗ и Министерством Здравоохранения Российской Федерации доз и чаще всего проявляются нетяжелыми диспепсическими нарушениями. Наиболее часто побочные явления наблюдают при лечении солевыми ферропрепаратами: металлический привкус, потемнение эмали зубов, диспепсические расстройства (тошнота, диарея, чувство переполнения желудка, рвота, запор). В редких случаях может развиться некроз слизистой оболочки кишечника.
Профилактика
Предупреждение железодефицитных состояний у беременных и кормящих. Этому прежде всего способствует рациональное сбалан- сированное питание и соблюдение соответствующего режима.
Естественное вскармливание детей, своевременное введение прикормов. Выявление детей, имеющих риск заболевания анемией, к которым можно отнести:
- детей 1-2-го года жизни от матерей, страдающих анемией;
- недоношенных и маловесных;
- рано получающих смешанное или искусственное вскармливание;
- с явлениями атопического дерматита;
- длительно и часто болеющих;
- детей с врожденными и приобретенными заболеваниями кишечника.
Детям, имеющим риск заболевания анемией, показаны меры специфической ее профилактики. Начиная с 8 нед необходимо назначать препараты железа в дозе 1-1,5 мг/кг массы тела в сутки (по элементарному железу). Курс терапии - 1,5-2 мес.