Клинический атлас патологии глазного дна. Кацнельсон Л.А., Лысенко В.С., Балишанская Т.И. - 4-е изд., стер. - 2013. -120 с.: ил.
|
|
|
|
Глава 1. Метод флюоресцентной ангиографии
С 1961 г. после работ Novotny и Alvis (1961), показавших возможность серийного фотографирования контрастированных флюоресцеином сосудов глазного дна, метод исследования, получивший название флюоресцентной ангиографии глазного дна (ФАГД), приобрёл особое значение в вопросах диагностики и патогенеза различных поражений сетчатки и хориоидеи. ФАГД преодолела ранее недосягаемый барьер и позволила изучать микроциркуляцию глаза in vivo. Флюорес-цеин, введённый внутривенно, контрастирует сосуды переднего отдела глаза, хориоидеи и сетчатки, что можно зарегистрировать фотографически или с помощью цифровой камеры.
Для флюоресцеинангиографического исследования применялись различные модели фотографических камер с регистрацией ангиографичес-кого изображения глазного дна на фотопленку. В последнее время технический прогресс, связанный с созданием цифровых ретиноангиогра-фов, позволил использовать цифровую обработку снимков. Камера сохраняет ангиографическую картину глазного дна, появляющуюся на экране монитора, которую с помощью специальной программы можно модифицировать, изменяя контрастность, яркость и четкость изображения (рис. 1-1, 1-2). Кроме того, цифровые фундус-камеры позволяют фиксировать флюоресценцию низкой интенсивности на поздних фазах ангиографии. Ангиограммы сохраняются в банке данных компьютера, которыми можно в любое время воспользоваться. Использование соответствующих принтеров позволяет получить зарегистрированные ангиограммы на фотобумаге через несколько минут после проведения исследования. На сегодняшний день по возможности получения качественной исчерпывающей диагностической информации по патологии глазного дна на первое место выступает лазерный сканирующий Heidelberg ретиноангиограф. Прибор производит съемку глазного дна путем лазерного сканирования. В результате значительно улучшается качество изображения. Ретинограф может производить съемку с частотой до 16 кадров в 1 секунду,
т. е. можно уже говорить о киноангиографии. Прибор имеет три источника лазерного излучения для регистрации отражения в ближней инфракрасной области (длина волны 820 нм), флюоресценции флюоресцеина (длина волны 488 нм), и флюоресценции индоцианина зеленого (длина волны 790 нм). Имеется возможность проведения одновременной съемки ангиограмм с флюорес-цеином и индоцеианином при одновременном внутривенном введении обоих красителей.
Метод флюоресцентной ангиографии
При флюоресцентной ангиографии любой камерой удовлетворительные результаты получаются лишь тогда, когда оптимально сбалансированы светоизлучение вспышки, проницаемость возбуждающего фильтра, спектр активации и флюоресценции красителя, отражательная способность сетчатки и спектр пропускания барьерного фильтра.
Флюоресцеин - слабая двухосновная кислота из группы ксантенов, используется в виде натриевой соли, хорошо растворимой в воде. Обладает очень высокой эмиссионной способностью, 95 % поглощённого синего света (максимум абсорбции 480-500 нм) трансформируется в свет флюоресценции (максимум эмиссионной кривой соответствует 525-530 нм). При введении в кровь 80-85 % флюоресцеина связывается с альбуминами плазмы. Однако эти связи слабые и лабильные, значительно зависят от температуры и рН крови. Благодаря небольшим размерам молекулы и низкой молекулярной массе флю-оресцеин легко проникает через большинство биологических мембран путём диффузии. Окрашивание кожи и слизистых оболочек достигает максимума через 10 мин. после введения, освобождение тканей от флюоресцеина происходит в течение 24-48 ч.
Распределение флюоресцеина в тканях глаза изучал ряд исследователей (Ashton, Machemer, 1965; Cunha-Vaz, 1966) с использованием анги-ографических и гистологических методов. Вы-
явлено, что структуры, образующие гематооф-тальмический барьер, в норме не пропускают флюоресцеин. К ним относятся сосуды сетчатки, имеющие плотный слой эндотелиальных клеток, связанных между собой особо прочными межклеточными соединениями и слой пигментного эпителия, где практически отсутствуют ин-терцеллюлярные пространства. В то же время флюоресцеин свободно проникает через фенес-трированную стенку хориокапилляров и накапливается в экстравазальных пространствах хори-
оидеи, окрашивает мембрану Бруха (базальная пластинка сосудистой оболочки глаза) и склеру. Слой пигментного эпителия задерживает переднюю диффузию флюоресцеина из хориока-пиллярного слоя. Функционирующие в норме барьеры для проникновения флюоресцеина в сетчатку разрушаются при патологических состояниях, что имеет принципиальное значение для интерпретации флюоресцентных ангиограмм (табл. 1-1).
Таблица 1-1. Проницаемость структур глаза для флюоресцеина
МЕТОДИКА ИССЛЕДОВАНИЯ
Для получения хороших ангиограмм существенное значение имеют использование современной фундус-камеры с высокой скоростью съемки, контакт с пациентом, прозрачность сред глаза, концентрация, количество и способ введения флюоресцеина. Перед ангиографией необходимо подготовить прибор к работе: выполнить функциональную проверку готовности нажатием педали переключателя или пусковой кнопки. Целесообразно объяснить пациенту смысл исследования и порядок его проведения. Флюоресцеин, обычно 5 мл 10 % раствора, вводят в локтевую вену, максимальная концентрация красителя в сосудах глазного дна должна достигаться как можно быстрее. До введения флюоресцеина делают снимок без фильтра, затем в красном и зелёном свете, в синем свете производится контрольный снимок, после этого быстро вводят флюоресцеин, и через 5-7 с начинается серийная фотосъёмка (около 20 кадров). Отдельные снимки делают
с увеличением интервала. При флюоресцентном исследовании возбуждающий и барьерный светофильтры подбирают таким образом, чтобы они полностью поглощали все лучи, исходящие от источника возбуждения (рис. 1-3). Если это условие выполнено, то на снимке получается изображение, «созданное» только флюоресцеином.
Большинство исследователей, изучавших влияние флюоресцеина на организм, отмечают отсутствие у него токсичности, но не исключены аллергические реакции и аномальная чувствительность к препарату (Rosen, 1969; Wessing, 1969). По данным МНИИ глазных болезней им. Гельмгольца, при проведении 1500 исследований аллергическая сыпь отмечена у 4 больных, коллаптоидное состояние - у 5, пирогенная реакция - у 2 и рвота - у 7 обследуемых. В 5- 10 % случаев бывает кратковременная тошнота. Все явления быстро исчезли и ни одно не привело к серьёзным последствиям, но в литературе описаны случаи инфаркта миокарда, отёка лёгких, отёка гортани, гипертонического криза, что
заставляет принимать меры предосторожности. Противопоказано проведение ФАГД лицам с аллергическим шоком в анамнезе, а также страдающим бронхиальной астмой, тромбофлебитом. В кабинете ангиографии должны быть средства неотложной помощи. Целесообразно провести внутрикожную пробу с флюоресцеином по типу реакции Манту перед исследованием.
Интерпретация флюоресцентных ангиограмм может быть достоверной только при глубоком знании особенностей клиники разнообразных поражений глазного дна и применении к ним данных ФАГД.
Из количественных методик оценки ФАГД следует отметить углубление метода калибро-метрии. Контрастированный ретинальный сосуд имеет чёткие границы, вследствие чего точность измерения его диаметра повышается. В МНИИ глазных болезней им. Гельмгольца Т. И. Бали-шанская и Т. И. Форофонова предложили собственную модификацию флюоресцентной калиб-рометрии, при которой точность расчёта калибра сосудов сетчатки значительно выше, чем при обычных исследованиях. При флюоресцентной калиброметрии диаметр сосуда увеличивается на 10-15 % в связи с тем, что флюоресцеин окрашивает слой плазмы, расположенный между центральным слоем крови и стенкой сосуда.
В интерпретации ФАГД в норме значительное место занимает определение фаз прохождения флюоресцеина по сосудам глазного дна. Л. А. Кацнельсон, Т. И. Форофонова (1990) предложили выделять раннюю хориоидальную фазу (первое появление флюоресцеина в хориоидее или цилиоретинальной артерии), время хорио-идальной перфузии (между ранней хориоидаль-ной фазой и пиком хориоидальной флюоресценции), раннюю ретиноартериальную фазу, время ретиноартериальной перфузии (от ранней артериальной фазы до полного контрастирования артериальной системы сетчатки), раннюю ретино-венозную фазу (пристеночное контрастирование вен), позднюю ретиновенозную фазу, время рети-новенозной перфузии (от ранней венозной фазы до полного контрастирования венозной сети).
У здоровых людей в возрасте от 16 до 60 лет время ранней хориоидальной фазы составляет 8,9+0,34 с, время хориоидальной перфузии - 6,1+0,65 с, ранняя артериальная фаза - 10-12 с, время ретиноартериальной перфузии - 9,7+0,45 с, ранняя ретиновенозная фаза - 11,2+0,45 с,
время ретиновенозной перфузии - 5,7+0,13 с (рис. 1-4-1-9). Точный расчёт времени прохождения флюоресцеина затруднителен, так как время «рука-сетчатка» зависит от скорости введения флюоресцеина, скорости фотографирования, особенностей циркуляции крови.
Во всех случаях следует отграничивать хорио-идальную фазу от следующей за ней ранней артериальной. Смещение их по времени свидетельствует о задержке хориоидальной циркуляции, что может иметь диагностическое значение.
Качественная интерпретация ангиограмм основывается на анализе уменьшения и увеличения флюоресценции (гипо- и гиперфлюоресценция). Гипофлюоресценция может быть обусловлена блокированием флюоресценции каким-либо веществом или тканью, которые не прозрачны для жёлто-зелёных лучей (геморрагии, кисты сетчатки, пигмент и др.) (рис. 1-10-1-12) или недостаточностью кровоснабжения (окклюзия сосудов, аваскулярные ишемические зоны, атрофия диска зрительного нерва) (рис. 1-13, 1-14). Гиперфлюоресценция вызывается дефектами пигментного эпителия, который не экранирует хориоидальную флюоресценцию, экстравазаль-ным выходом флюоресцеина через патологически изменённую стенку сосуда или накоплением флюоресцеина в патологических очагах
(рис. 1-15-1-17).
Гиперфлюоресценцию необходимо дифференцировать с ауто- и псевдофлюоресценцией. Аутофлюоресценция обусловлена присутствием естественных флюорохромов, когда структуры глаза флюоресцируют без окраски флюоресцеи-ном (например, друзы диска зрительного нерва) (рис. 1-18). Псевдофлюоресценция вызывается способностью некоторых тканей (склера, мие-линовые волокна) настолько интенсивно отражать свет, что это может имитировать флюоресценцию. Очаги ауто- и псевдофлюоресценции видны на контрольных снимках ещё до введения флюоресцеина, в связи с чем их часто объединяют под названием «доинъекционная флюоресценция».
Исследование микроциркуляции диска зрительного нерва с помощью ФАГД помогает дифференциальной диагностике при его отёке, рет-робульбарных невритах, псевдозастое, друзах, васкулитах, новообразованиях и другой патологии. При глаукоме ишемия диска зрительного нерва выявляется до видимых клинически при-
знаков его поражения, но визуальная оценка нарушения флюоресценции диска трудна и недостоверна. В связи с этим Т. И. Форофонова предложила модификацию метода денситомет-рии флюоресцентных ангиограмм, названную денситометрическим сканированием. Возрастающая интенсивность микроциркуляции диска выражается в виде кривой. ФАГД показала также, что офтальмоскопически определяемые изменения цвета диска (покраснение или побледнение) далеко не всегда связаны с его патологией.
Приведём краткие характеристики ангиогра-фической картины при некоторых заболеваниях сетчатки и зрительного нерва (Л. А. Кацнельсон, 1981). При нарушении связи мембраны Бруха и пигментного эпителия сетчатки происходит скопление серозного экссудата с локальной отслойкой пигментного эпителия Отслоенный пигментный эпителий имеет куполообразный вид, натягивается и истончается, на флюоресцентных ангиограммах отслойка пигментного эпителия проявляется в виде круглого очага гиперфлюоресценции с чёткими границами, так как в неповреждённых участках пигментный эпителий плотно связан с мембраной Бруха. При длительно существующих отслойках пигментного эпителия нарушаются процессы его метаболизма и образуется одна или несколько точек, через которые серозная жидкость поступает в субретинальное пространство, вызывая серозную отслойку ней-роэпителия. Связь между пигментным и ней-роэпителием значительно слабее, поэтому отслойка нейроэпителия имеет нечёткие границы и по площади может значительно превышать область отслойки пигментного эпителия.
При центральной серозной хориопатии выявление на ангиограмме точки фильтрации значительно повышает вероятность успешной лазер-коагуляции.
Окончатый дефект пигментного эпителия возникает при отсутствии пигмента, экранирующего хориоидальную флюоресценцию. Основные причины - атрофия пигментного эпителия и врождённое уменьшение пигмента. Гиперфлюоресценция при дефекте пигментного эпителия зависит от состояния как пигментного эпителия, так и хо-риокапилляров. Характерные изменения на анги-ограмме: гиперфлюоресценция появляется в ранней фазе, соответствующей контрастированию хориоидеи; флюоресценция усиливается параллельно увеличению концентрации флюоресцеина
в хориоидее; не определяется увеличения зоны флюоресценции или изменения её формы в поздних фазах ангиографии; флюоресценция уменьшается в фазе выхода флюоресцеина.
Окончатые дефекты пигментного эпителия наблюдаются при дистрофиях сетчатки и маку-лярных разрывах, друзах, ангиоидных полосах, хронических отслойках пигментного эпителия и нейроэпителия и др.
Друзы - скопления метаболитов между пигментным эпителием и мембраной Бруха. Они вызывают микроотслойки пигментного эпителия, из которых со временем развиваются окон-чатые дефекты пигментного эпителия. Большие друзы могут блокировать флюоресценцию в ранней фазе ангиографии, но в артериовеноз-ной фазе гиперфлюоресценция проявляется. Обычно при ФАГД определяется больше друз, чем при офтальмоскопии.
Окончатый дефект пигментного эпителия на ангиограмме даёт полный разрыв сетчатки в макулярной области, а при ламеллярных истончениях сохраняются наружные слои сетчатки и не происходит депигментации и атрофии пигментного эпителия. Отмечаемое при макулярных отверстиях валикообразное утолщение сетчатки по краю разрыва является своеобразной отслойкой пигментного эпителия, дающей слабую флюоресценцию в артерио-венозной фазе.
Кистовидный отёк макулы выявляется на ан-гиограмме выходом флюоресцеина из перифове-альных ретинальных капилляров, окружающих бессосудистую зону. Флюоресценция постепенно распространяется от центра к периферии отёка, заполняя кистозные полости, что хорошо определяется в поздней фазе ангиографии в виде своеобраз ной розетки.
При центральной дисциформной хориорети-нальной дистрофии ангиографическая картина зависит от стадии и течения процесса. Отслойка пигментного эпителия является одним из ранних симптомов. Позже происходит прорастание хориоидальных сосудов в субретинальное пространство с формированием субретинальной не-оваскулярной мембраны. В хориоидальной фазе ангиографии мембрана контрастируется в виде колеса со спицами. В поздних фазах детали не-оваскулярной мембраны утрачиваются, так как вся её зона интенсивно флюоресцирует. Стенка новообразованного сосуда не становится барьером для флюоресцеина, свободно пропуская его.
На стадии рубцевания новообразованные сосуды облитерируются и замещаются фиброзной тканью. Выявляются дефекты пигментного эпителия и участки гипофлюоресценции в результате пигментации и геморрагии.
При наследственных поражениях макуляр-ной области (болезнь Штаргардта) на ангиог-рамме выявляются единичные точечные дефекты пигментного эпителия, что при прогрессирова-нии атрофии пигментного эпителия приводит к картине ареолярной центральной атрофии хориоидеи.
Своеобразную ангиографическую картину имеет секторальная форма передней ишемичес-кой нейропатии: неповреждённая часть зрительного нерва даёт нормальную флюоресценцию на ранних фазах ФАГ, но так как капилляры его сохранной части эктазированы, их стенки повышенно проницаемы, что ведёт к гиперфлюоресценции здоровой части диска на поздних фазах ФАГД. Поражённый сектор слабо контрастиру-ется в поздней фазе ангиографии или не контрас-тируется совсем. Изучение хориоидальной циркуляции показало дефект заполнения в секторе, соответствующем локализации процесса.
Многообразные флюоресцеинангиографичес-кие проявления сосудистых поражений глазного дна (диабетическая ретинопатия, тромбозы центральной вены сетчатки и её ветвей и др.) требуют отдельного рассмотрения.
Укажем лишь, что выявление неперфузируе-мых зон сетчатки (фокальная капиллярная окклюзия) в большинстве случаев возможно только при ФАГД, поскольку именно эти участки инициируют развитие новообразованных сосудов, а те в свою очередь приводят к необратимым тяжёлым осложнениям вплоть до слепоты и гибели глаза. Значение ФАГД в этих случаях трудно переоценить. Своевременная лазерная коагуляция в большинстве случаев позволяет предотвратить тяжёлые последствия.
Наряду с ФАГД можно проводить флюоресцентную ангиографию переднего отрезка глаза: радужной оболочки, перилимбальной сети и сосудов конъюнктивы. Так можно получить дополнительную информацию о васкулярных изменениях при сосудистых заболеваниях глаза (рис. 1-19, 1-21).
Развитие метода ФАГД связано со стремлением к его техническому усовершенствованию. Использование стереосепаратора позволяет по-
лучить стереоангиограмму, по которой можно оценить выстояние патологического очага.
В последние годы задействовано новое поколение офтальмологических приборов: фундус-ка-мера FF-450 с базовой системой BAS-420 фирмы «Цейсе» (Германия), камера IMAGE net-640 фирмы «Топкон» (Япония), система «САРИ тм» ТОО фирмы «ЭКОМ» (Россия). Непрерывность регистрации прохождения красителя на мониторе и возможность последующей компьютерной обработки видеозаписи существенно увеличивают объём получаемой информации.
Весьма перспективна количественная оценка проницаемости гематоофтальмического барьера с помощью флюоресцеина как индикатора (флюорофотометрия).
Для исследования хориоидальной циркуляции целесообразно применение в качестве красителя индоцианина зелёного. Он возбуждается и излучает в инфракрасном диапазоне, при этом ликвидируется экранирующее действие пигментного эпителия.
Интересные данные получены при флюоресцентной ангиографии переднего отрезка глаза, в частности перилимбальной зоны, при иридоангиографии.
Таким образом, флюоресцентная ангиография позволила перейти от статического наблюдения клинической картины заболевания к динамическому анализу особенностей микроциркуля-торных нарушений, оказав революционизирующее влияние на изучение патогенеза заболеваний глазного дна, их диагностику и лечение.
ЗАДАЧИ ФАГД
1. Дифференциальная диагностика и уточнение диагноза.
2. Определение тактики лечения больного и показаний к лазерной коагуляции (ишемичес-кие зоны, неоваскуляризация, активные точки фильтрации, субретинальные неоваскулярные мембраны, кистевидные отёки, центральные разрывы).
3. Точная локализация процесса и определение его распространённости.
4. Контроль за течением заболевания и эффективностью лечения.
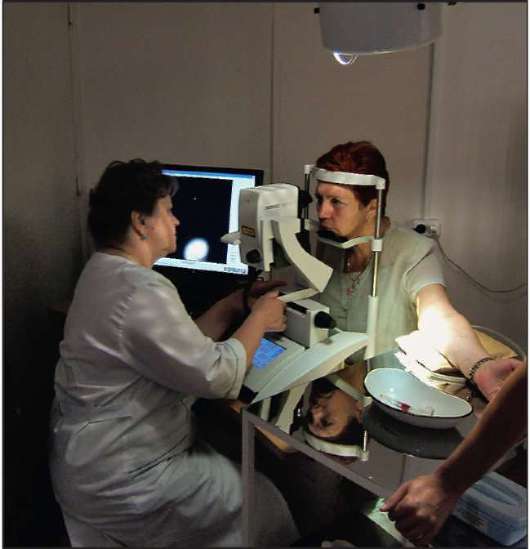
Рис. 1-1. Фундус-камера Heidelberg Retinoangiograph HRA-2.
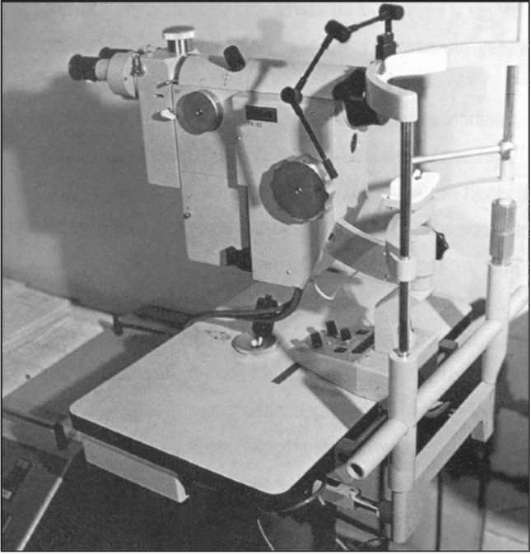
Рис. 1-2. Фундус-камера FK-50.
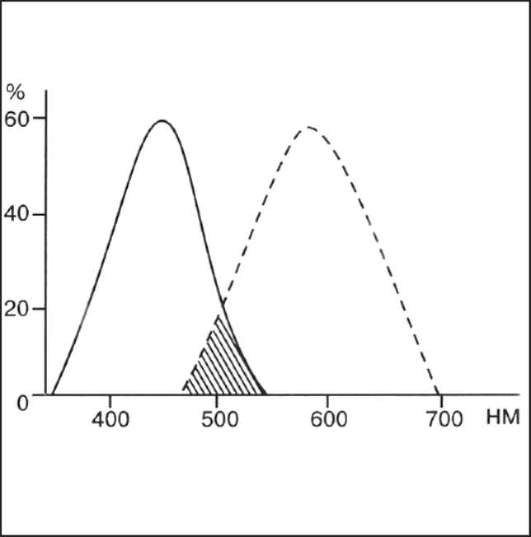
Рис. 1-3. Спектр пропускания фильтров. Сплошная линия - кривая возбуждения синего фильтра (или эмиссия), пунктирная - кривая барьерного жёлтого фильтра, заштрихованная часть - псевдофлюоресценция.
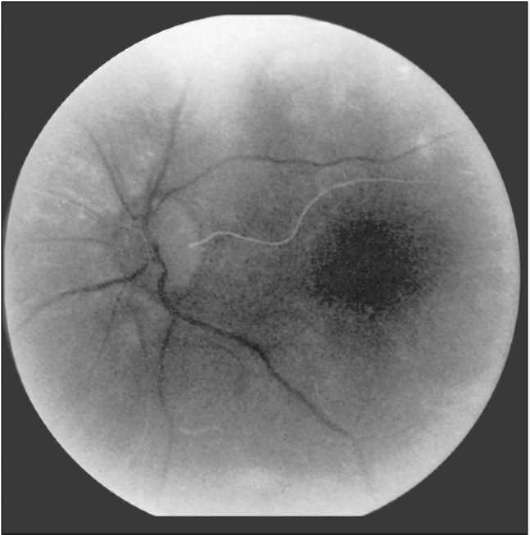
Рис. 1-4. Хориоидальная фаза ФАГД с цилиоретиналь-ной артерией.
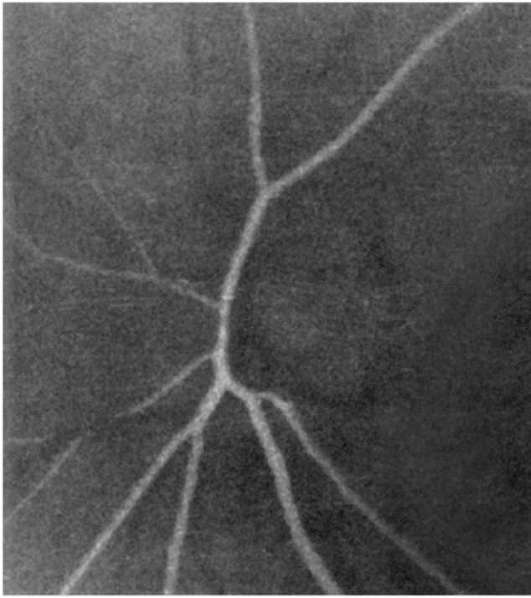
Рис. 1-5. Артериальная фаза ФАГД.
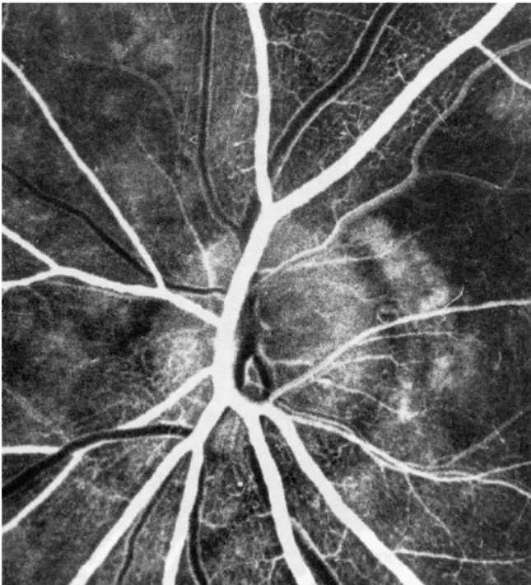
Рис. 1-6. Артериовенозная фаза ФАГД.
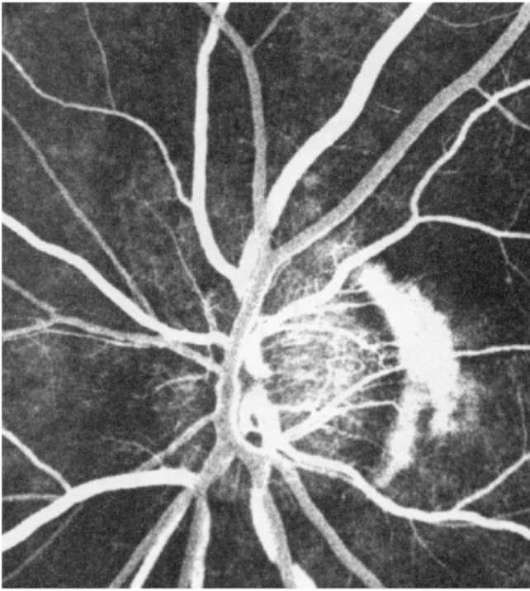
Рис. 1-7. Венозная фаза ФАГД.
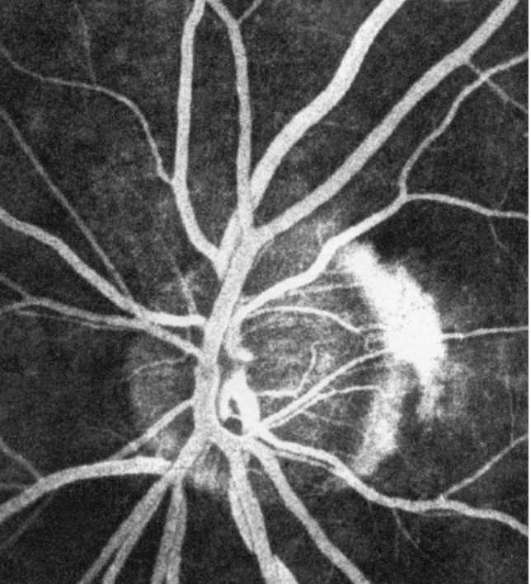
Рис. 1-8. Поздняя фаза (рециркуляция) ФАГД.
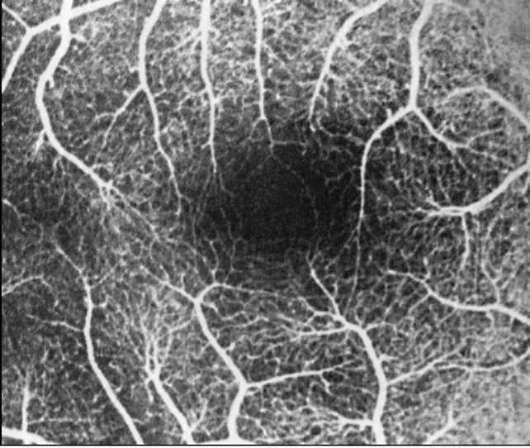
Рис. 1-9. ФАГД. Артериовенозная фаза. Парафовеаль-ная сосудистая сеть в норме.
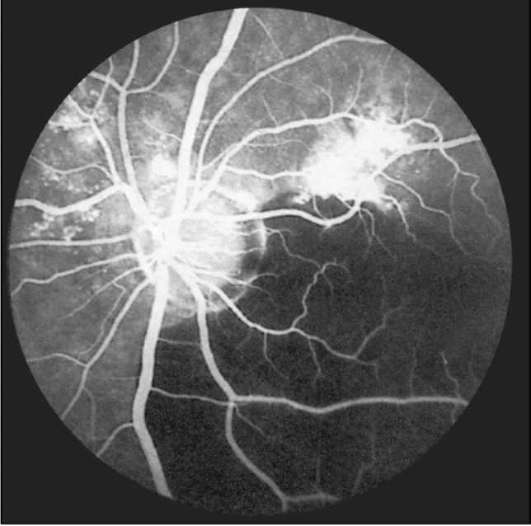
Рис. 1-10. ФАГД. Поздняя фаза. Гипофлюоресценция в зоне преретинальной геморрагии.

Рис. 1-11. ФАГД. Поздняя фаза. Гипофлюоресценция пигментного невуса.
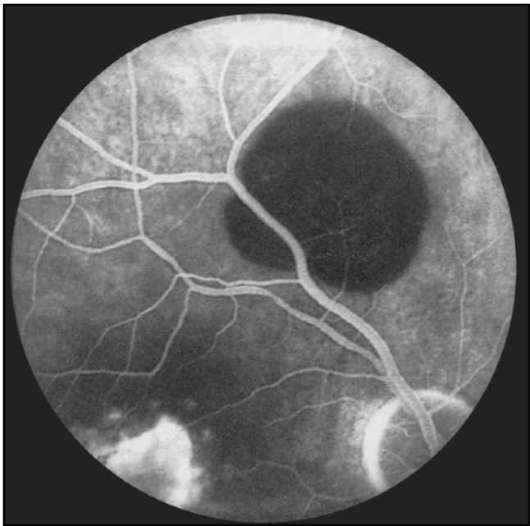
Рис. 1-12. ФАГД. Поздняя фаза. Гипофлюоресценция в области кисты сетчатки в верхней половине глазного дна.
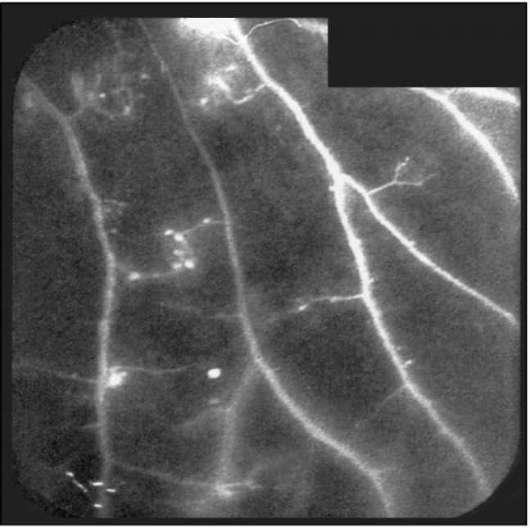
Рис. 1-13. ФАГД. Поздняя фаза. Гипофлюоресценция ишемических зон сетчатки.
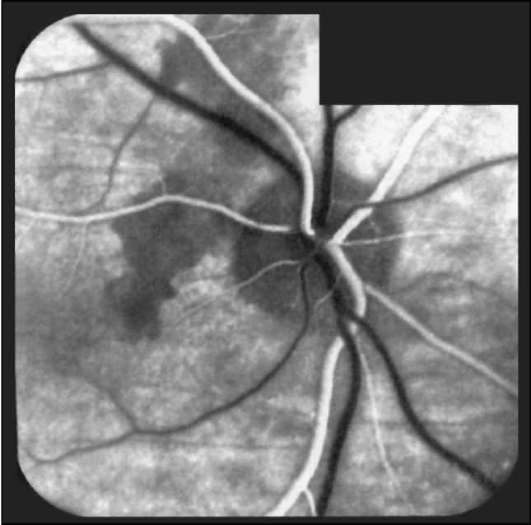
Рис. 1-14. ФАГД. Артериальная фаза. Гипофлюоресцен-ция диска зрительного нерва при его атрофии.
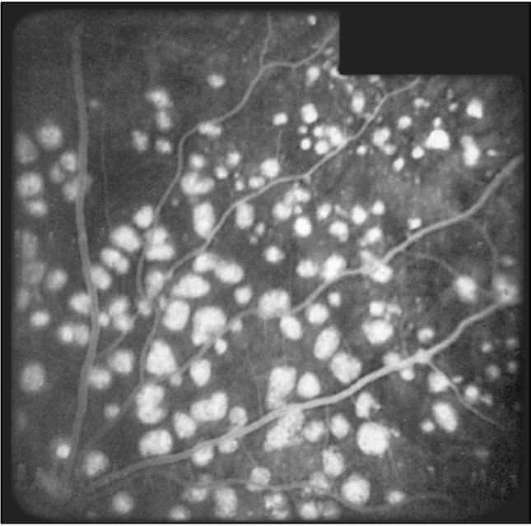
Рис. 1-15. ФАГД. Поздняя фаза. Гиперфлюоресценция, обусловленная дефектами пигментного эпителия.
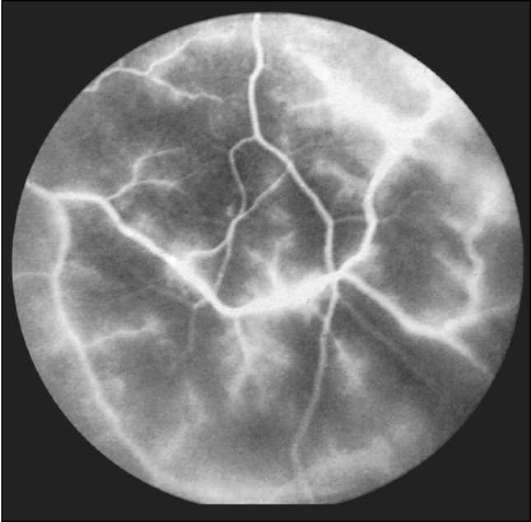
Рис. 1-16. ФАГД. Поздняя фаза. Гиперфлюоресценция, обусловленная повышенной проницаемостью стенок ретинальных сосудов.
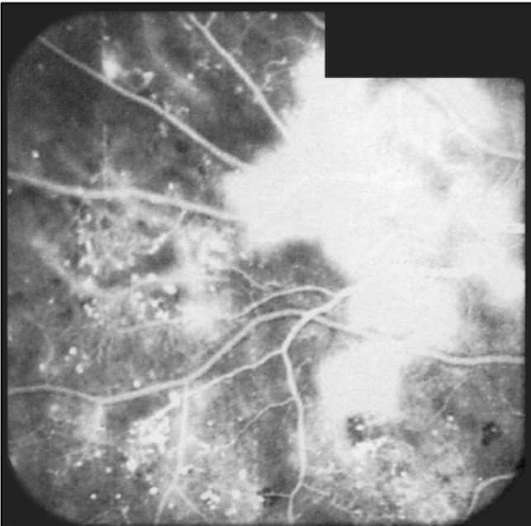
Рис. 1-17. ФАГД. Поздняя фаза. Гиперфлюоресценция в области I неоваскуляризации сетчатки.
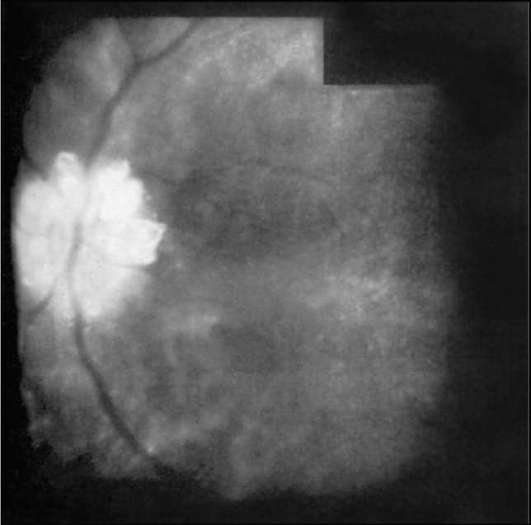
Рис. 1-18. Аутофлюоресценция поверхностных друз диска зрительного нерва.

Рис. 1-19. ФАГД перилимбальной конъюнктивы больного гипертонической болезнью.
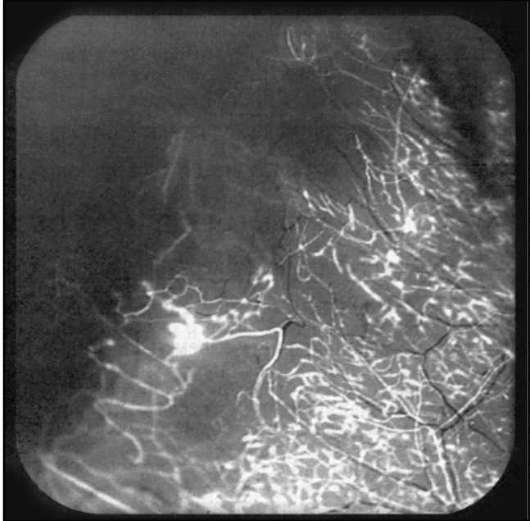
Рис. 1-20. Флюоресцентная ангиография перилимбаль-ной конъюнктивы при гипертонической болезни. Видны окклюзированные сосуды конъюнктивы, замедленные контрастирования верхней половины лимбальных сосудов и разорванность лимбальных аркад.
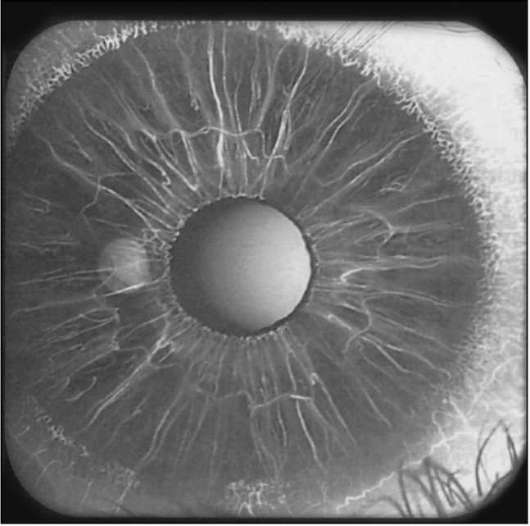
Рис. 1-21. Флюоресцентная иридоангиограмма.