Эндокринная регуляция. Биохимические и физиологические аспекты : учеб. пособие / А.Н. Смирнов ; под ред. В.А. Ткачука - 2009. - 368 с.
|
|
|
|
ГЛАВА 3 ГОНАДЫ
Гонады - железы внешней (половые клетки) и внутренней (половые гормоны) секреции, причем половые гормоны прямо и опосредованно влияют на развитие половых клеток, а также создают условия для коитуса, оплодотворения, а у женских особей также для имплантации зародыша, вынашивания плода и выкармливания новорожденных. Принципиальное различие в функционировании мужских и женских гонад заключается в ациклической работе семенников и циклической работе яичников. Точнее, у ряда видов млекопитающих цикличность имеет место и в функционировании семенников, но эта цикличность связана с сезонностью размножения, т.е. определяется внешними факторами, такими, как освещенность, температура окружающей среды, доступность пищи и т.д. У самок же внутри сезонной цикличности имеет место внутренняя цикличность функционирования яичников, определяемая периодической сменой системы обратной связи между яичниками и гипоталамо-гипофизарной системой с отрицательной на положительную. Система положительной обратной связи базируется на относительной независимости от гонадотропинов развития так называемых доминантных фолликулов яичников и на функционировании в женском мозгу (наряду с тоническим центром секреции гонадолиберина, осуществляющим отрицательную обратную связь) циклического центра секреции гонадолиберина, активируемого предовуляторным выбросом эстрогенов. Функции семенников в мужском организме полностью зависят от гонадотропинов, а циклический центр секреции гонадотропинов заблокирован андрогенами семенников во внутриутробном/перинатальном периоде развития.
ЯИЧНИКИ
Периодически сменяющая друг друга секреция яичниками эстрогенов и прогестерона обеспечивает соответственно подготовку к оплодотворению яйцеклетки и инициацию беременности. Оба типа
гормонов оказывают влияние на состояние различных отделов репродуктивного тракта и поведение, обеспечивающие соответствующие фазы реализации репродуктивной функции. Таким образом, базовым циклом является овариальный цикл, а продуцируемые яичниками гормоны определяют влагалищный, или астральный, цикл, отражающий состояние эпителия влагалища, и маточный (у приматов - менструальный) цикл, отражающий состояние прежде всего эндометрия матки и железистого аппарата (рис. 3-1).
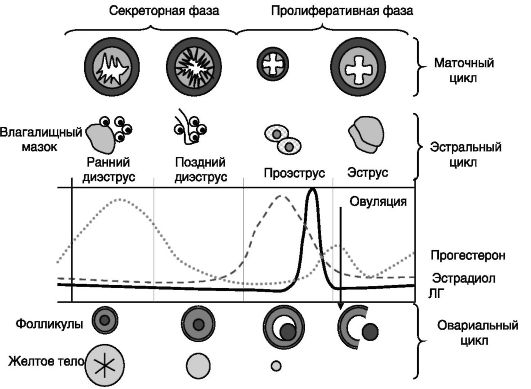 Рис. 3-1. Соотношение овариального, астрального и маточного циклов
Рис. 3-1. Соотношение овариального, астрального и маточного циклов
Стероидогенез в развивающемся фолликуле яичника (модель «два типа клеток - два гонадотропина»)
Развитие примордиального фолликула (пролиферация гранулезных (зернистых) клеток, дифференцировка внутренней и внешней оболочки) в половом цикле до стадии образования полости (антральный фолликул)) происходит без участия гонадотропинов гипофиза. Внутренними стимулами вовлечения примордиального фолликула
в фолликулогенез могут служить фактор стволовых клеток (stem cell factor, SCF), фактор 9 роста и дифференцировки (growth and differentiation factor 9, GDF9), основной фактор роста фибробластов (basic fibroblast growth factor, bFGF, оФРФ). Ингибитором развития фолликулов (независимых и зависимых от гонадотропинов стадий) выступает АМГ (рис. 3-2). АМГ продуцируется гранулезными клетками первичных и преантральных фолликулов и действует паракринно. У мышей с нокаутом гена АМГ количество примордиальных фолликулов, остающихся в яичниках к старости, оказывается более низким, чем у мышей дикого типа, и такие животные прекращают циклировать раньше, чем нормальные. И наоборот, гиперакспрессия АМГ ведет к задержке старения яичников.
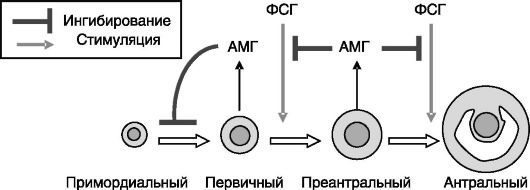 Рис. 3-2. АМГ
ингибирует рост примордиальных фолликулов и снижает эффективность
стимулирующего действия ФСГ на рост преантральных и малых антральных
фолликулов
Рис. 3-2. АМГ
ингибирует рост примордиальных фолликулов и снижает эффективность
стимулирующего действия ФСГ на рост преантральных и малых антральных
фолликулов
Стероидогенная активность вступающих на путь развития фолликулов низка, а их количество велико. В последующий период развивается лишь один (у одноплодных животных) или несколько (у многоплодных животных) из этих фолликулов. Это связано с разделением функций и паракринными взаимодействиями между двумя типами стероидогенных клеток фолликула - клеток теки (оболочки) и гранулезы (зернистой ткани). Ароматаза, превращающая андрогенные стероиды (С19) в эстрогены (С18), локализована исключительно в клетках гранулезы. В то же время ключевой фермент образования андрогенов из С21-предшественников - СYР17 (цитохром P-450scc, 17-альфа-гидроксилаза) локализован исключительно в клетках теки. Его активность регулируется ЛГ гипофиза через зависимые от цАМФ
механизмы и паракринными факторами, поступающими из клеток гранулезы, стимулированных фолликулостимулирующим гормоном (ФСГ) гипофиза. Рецепторы ФСГ (ФСГ-Рц) локализованы исключительно в гранулезных клетках и опосредуют действие ФСГ на пролиферацию и дифференцировку этих клеток преимущественно через цАМФ/ПК-А-зависимый механизм. Ответ клеток гранулезы на ФСГ потенцируется поступающими из клеток теки андрогенами с участием А-Рц гранулезных клеток (рис. 3-3).
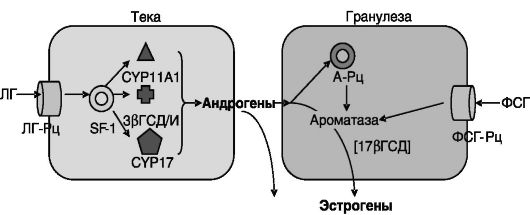 Рис. 3-3. Раздельная
регуляция функций клеток теки и гранулезы в яичниках: SF-1 -
стероидогенный фактор; ГСД - гидроксистероиддегидрогеназа; CYP11A1 -
десмолаза
Рис. 3-3. Раздельная
регуляция функций клеток теки и гранулезы в яичниках: SF-1 -
стероидогенный фактор; ГСД - гидроксистероиддегидрогеназа; CYP11A1 -
десмолаза
При вовлечении фолликула в предовуляторное развитие под действием ФСГ клетки гранулезы начинают экспрессировать рецепторы ЛГ (ЛГРц), сопряженные с активностью ароматазы и продукцией ингибина, точнее, индукцией субъединицы альфа, формирующей ингибин альфа/ бета. Стимулирующее действие ЛГ на продукцию ингибина усиливается поступающими из клеток теки андрогенами и образующимися из них эстрогенами. Ингибин, в свою очередь, потенцирует индуцированный ЛГ синтез андрогенов в клетках теки: возникает система положительной обратной связи внутри фолликула, обеспечивающей его дальнейшее развитие и усиление стероидогенеза в условиях низкого уровня ЛГ в позднюю фолликулярную фазу цикла. Фолликулы с меньшей чувствительностью к гонадотропинам и соответственно с менее эффективной системой внутренней положительной обратной связи подвергаются атрезии (механизм доминантного фолликула). С ростом фолликула снижается также продукция клетками гранулезы активина, оказывающего тормозное действие на стимуляцию клеток теки ЛГ (рис. 3-4).
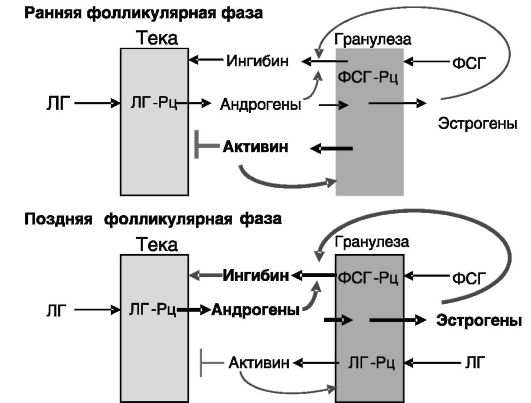 Рис. 3-4. Формирование доминантного фолликула за счет системы положительной обратной связи между клетками гранулезы и теки (ингибин)
Рис. 3-4. Формирование доминантного фолликула за счет системы положительной обратной связи между клетками гранулезы и теки (ингибин)
С ростом фолликула повышается также уровень ИФР-I - еще одного паракринного фактора клеток гранулезы, стимулирующего продукцию андрогенов в клетках теки и их пролиферацию. Секреция ИФР-I клетками гранулезы усиливается под действием гонадотропинов и СТГ. Чувствительность клеток фолликула к гонадотропинам возрастает с ростом фолликула за счет взаимной стимуляции этими гормонами соответствующих рецепторов и действия пара/ауток- ринных факторов яичника. Ингибин, активин и ИФР-I участвуют в аутокринной регуляции клеток гранулезы через соответствующие рецепторы (InhR, ActR, ИФР-Рц). При этом активин и ИФР-I стимулируют, а ингибин тормозит активность ароматазы (системы ультракороткой обратной связи). Сходно с активином действуют образующиеся в гранулезных клетках эстрогены: они потенцируют действие ФСГ на гранулезу и тормозят стимулирующее действие ЛГ на продукцию андрогенов в клетках теки. Дополнительный контроль осуществляется с помощью ИФРСБ, продуцируемых клетками гранулезы. Секреция ИФРСБ стимулируется эстрогенами, прогестероном, простагландинами и тормозится СТГ, ФСГ, ИФР-I, инсулином.
Участие ИФРСБ в отборе доминантного фолликула заключается в высвобождении ИФР-I из комплексов после деградации ИФРСБ-4 и ИФРСБ-5 в результате протеолиза под действием специфичной протеиназы РАРР-А (pregnancy-associated plasma protein-А, белка-А плазмы, ассоциированного с беременностью). Активность РАРР-А индуцируется ФСГ и обнаруживается в будущем доминантном фолликуле еще до возникновения его морфологических отличий от других крупных фолликулов. Высвободившийся ИФР-I синергично с ФСГ стимулирует продукцию эстрогенов (рис. 3-5).
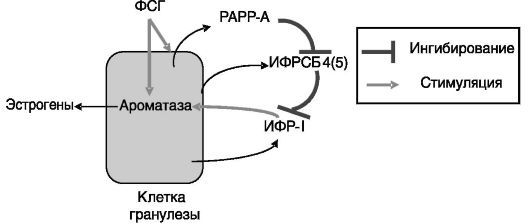 Рис. 3-5. Отбор доминантного фолликула. Система ИФР-I
Рис. 3-5. Отбор доминантного фолликула. Система ИФР-I
Продуцируемый клетками фолликула, в том числе гранулезными, ИФРСБ-4 может действовать негативно на стероидогенез и самостоятельно, т.е. независимо от ИФР-I. В регуляции развития и функций фолликула принимают участие многие другие контролирующие факторы (ТФР-α, ТФР-β, катехоламины и др.), однако их роль изучена пока недостаточно полно.
Отбор доминантного фолликула идет, по-видимому, по наименьшему порогу чувствительности к ФСГ. Продуцируемые этим фолликулом эстрогены подавляют секрецию гипофизом ФСГ, что предотвращает развитие других фолликулов. Эффект эстрогенов дублируется и усиливается секрецией доминантным фолликулом в системный кровоток ингибина и снижением секреции активина.
Биосинтез прогестерона в фолликулярную фазу цикла осуществляется преимущественно в гранулезных клетках. Его продукция стимулируется ФСГ, ЛГ, СТГ (прямо и через ИФР-I), эстрогенами.
Овуляция и формирование желтого тела
Предовуляторный выброс эстрогенов по системе положительной обратной связи стимулирует лавинообразное нарастание секреции ЛГ, индуцирующего разрыв стенки доминантного фолликула с выходом яйцеклетки и ее поступлением в яйцевод (фаллопиеву трубу) с формированием на месте овулировавшего фолликула желтого тела. Овуляция - сложный процесс, включающий перепрограммирование (трансформацию) гранулезных клеток стенки фолликула (муральных клеток) в лютеальные клетки (в том числе снижение экспрессии ароматазы, повышение экспрессии Р-450sсс, StAR для переключения с синтеза эстрогенов на синтез прогестерона), прорастание сосудов через базальную перегородку фолликула, повторное вхождение ооцита в клеточный цикл, секрецию клетками гранулезы, окружающими ооцит (кумулус), внеклеточного матрикса, который вместе с этими клетками сопровождает ооцит при его перемещении в яйцевод до оплодотворения. У приматов, включая человека, и жвачных животных главным стимулом развития данных процессов и последующего функционирования желтого тела является ЛГ. У грызунов, кролика, свиньи существенную роль в поддержании желтого тела играют также ПРЛ (прежнее название - лютеотропный гормон) и эстрогены. (Предполагается, что у человека ПРЛ выполняет преимущественно функцию ограничителя половой активности: выбрасываемый при оргазме ПРЛ подавляет стремление к повторному коитусу.) Секретируемый желтым телом прогестерон также способствует поддержанию желтого тела. Следует отметить, что в отличие от большинства других эндокринных образований, функционирование желтого тела, по-видимому, не контролируется системой отрицательной обратной связи.
Одними из пара/аутокринных посредников овуляторного действия ЛГ могут служить лиганды семейства эпидермального фактора роста (ЭФР) - эпирегулин, амфирегулин, бетацеллюлин, чья экспрессия стимулируется ЛГ, которые способны воспроизводить ряд эффектов ЛГ и блокада действия которых подавляет стимулирующее действие ЛГ на процессы овуляции.
Другим посредником ЛГ может служить прогестерон. Этот гормон, действующий в данном случае в качестве ауто/паракринного фактора, способствует овуляции и оказывает антиапоптотическое действие на клетки желтого тела, обеспечивая продление жизни желтого тела у приматов. Регрессия желтого тела у приматов в конце лютеиновой фазы цикла, как полагают, связана со снижением чувствительности
желтого тела к ЛГ и соответственно с падением продукции прогестерона. У грызунов же и у многих других видов лютеолиз индуцируется факторами, поступающими из матки.
Биосинтез прогестерона в желтом теле осуществляют два типа лютеальных клеток: более крупные клетки - производные гранулезных клеток овулировавшего фолликула и более мелкие - производные теки. Эти клетки наследуют фенотип исходных клеток в плане чувствительности к ЛГ (низкая и высокая соответственно).
Преобладающими источниками холестерина для синтеза прогестерона в желтом теле служат липопротеины высокой плотности - ЛВП (грызуны, жвачные) и ЛНП (приматы, свинья). Этапы биосинтеза включают гидролиз запасенных в жировых каплях эфиров холестерина с жирными кислотами под действием гормончувствительной липазы, доставку холестерина к внутренней мембране митохондрий стероидогенным белком быстрой регуляции (StAR), отщепление боковой цепи цитохромом Р-450sсс и окисление 3β-гидроксила до кетогруппы с переброской двойной связи из кольца B в кольцо А, катализируемое 3β-гидроксистероиддегидрогеназой/изомеразой (3β-ГСД/И).
Лимитирующим элементом биосинтеза является активность StAR, экспрессия которого индуцируется предовуляторным выбросом ЛГ, хотя индуцируются и другие факторы стероидогенеза. И наоборот, угасание функции желтого тела в конце лютеиновой фазы связывают с ингибированием экспрессии StAR под действием лютеолитических факторов (у ряда видов - простагландина F2a из матки). Стимуляция экспрессии StAR под действием ЛГ включает аккумуляцию в клетках цАМФ, активацию ПК-А и усиление взаимодействия с регуляторной областью гена StAR стероидогенного фактора (SF-1) - транскрипционного фактора надсемейства ядерных рецепторов. У мыши данную функцию SF-1 выполняет, видимо, другой белок того же семейства, гомолог 1 рецептора печени (LRH-1). Помимо прогестерона, желтым телом продуцируются андрогены (малыми клетками) и эстрогены (крупными клетками).
СЕМЕННИКИ
Для регуляции функций семенников (эндокринной и сперматогенеза) справедлива модель «два типа клеток - два гонадотропина». Основной функцией клеток Лейдига является продукция андрогенов. Основной регулятор клеток Лейдига - ЛГ гипофиза. Клетки Сертоли обеспечивают созревание сперматогониев и регулируются
ФСГ гипофиза и андрогенами (в данном случае андрогены выступают в качестве паракринного фактора), причем ФСГ выступает в роли пермиссивного фактора для действия андрогенов (рис. 3-6). Одним из наиболее ранних эффектов ФСГ на клетки Сертоли является индукция синтеза компонентов (c-fos и jun-B) димерного транскрипционного фактора AP-1. Негативным регулятором клеток Лейдига служит ПРЛ гипофиза. Действие ФСГ на дифференцировку половых клеток включает индукцию экспрессии в этих клетках активирующей формы модулятора цАМФ-чувствительных элементов (CREM) - представителя семейства транскрипционных факторов, опосредующих действие цАМФ на геном. Паракринный посредник этого эффекта ФСГ через клетки Сертоли пока неизвестен.
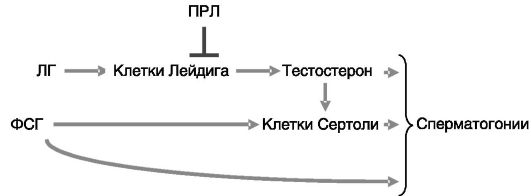 Рис. 3-6. Основные гормональные регуляторы семенников
Рис. 3-6. Основные гормональные регуляторы семенников
Помимо поддержания развития сперматогониев (у человека цикл их развития - 64 дня) за счет трофических влияний, секреции бикарбоната, фактора роста семенных канальцев, формирования гематотестикулярного барьера клетки Сертоли играют важную роль в регуляции дозревания сперматозоидов (преобретение продольной подвижности) в эпидидимисе путем секреции андрогенсвязывающего белка (АСБ, вариант сексстероидсвязывающего глобулина плазмы крови), обеспечивающего высокую концентрацию андрогенов (5α- дигидротестостерона и тестостерона) в этом органе.
Согласно одной из гипотез, в головной части эпидидимиса АСБ интернализуется сперматозоидами и связывается с ядерной мембраной, где происходит восстановление ассоциированного с АСБ 5а-дигидротестостерона в 3а-андростандиол под действием 3а-гид- роксистероиддегидрогеназы. Образующийся в этой реакции окисленный кофактор НАД(Ф) вызывает в клетке формирование большого
количества дисульфидных связей, что сопровождается конденсацией хроматина, являющейся одним из элементов созревания сперматозоидов (рис. 3-7). После оплодотворения яйцеклетки обратные реакции ведут к деконденсации хроматина.
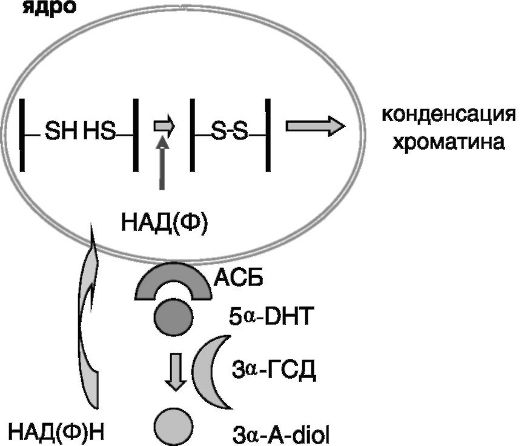 Рис. 3-7. Гипотеза
об участии АСБ семенников и связанного с ним 5а- дигидротестостерона
(5a-DHT) в индукции созревания сперматозоидов в эпидидимисе:
Рис. 3-7. Гипотеза
об участии АСБ семенников и связанного с ним 5а- дигидротестостерона
(5a-DHT) в индукции созревания сперматозоидов в эпидидимисе:
3a-A-diol - 3а-андростандиол; 3а-ГСД - 3а-гидроксистероиддегидрогеназа
Клетки Сертоли продуцируют также эндо/паракринные факторы системы ауторегуляции функций семенников: ингибин, активин, ИФР-I, гонадотропина (лютеинизирующего гормона) рилизинг-гормон (ЛГРГ) и эстрогены, образующиеся из поступающих извне андрогенов под действием ароматазы. Активность ароматазы стимулируется ФСГ. Эстрогены и ЛГРГ осуществляют негативную обратную связь внутри семенников, подавляя функции клеток Лейдига и, в частности, их чувствительность к ЛГ. Ингибин подавляет, а активин стимулирует продукцию тестостерона клетками Лейдига. Кроме того, активин действует и как аутокринный регулятор клеток Сертоли. ИФР-I повышает чувствительность клеток Лейдига к ЛГ и выполняет также роль аутокринного регулятора этих клеток при действии ЛГ. Эффекты ИФР-I негативно регулируются ИФРСБ, продуцируемыми клетками Лейдига. Эффекты ингибина и активина дифференциально регулируются внеклеточным
связывающим белком фоллистатином (мономерным гликопротеином, 4 изоформы), продуцируемым клетками Сертоли.
Фоллистатин локализован рядом с половыми клетками и клетками Лейдига в комплексе с сульфополисахаридами (гепарином, гепараном-S) внеклеточного матрикса. За счет высокого сродства к активину, сопоставимого со сродством рецепторов, фоллистатин ингибирует его эффекты. Сродство фоллистатина к ингибину существенно ниже, что приводит к увеличению соотношения эффективных концентраций ингибина/активина в присутствии фоллистатина.
Система обратной связи семенников с гипоталамо-гипофизарной системой контролирует паттерн секреции гонадотропинов. Тестостерон снижает амплитуду и частоту выбросов ЛГ, действуя на гипоталамическом (возможно, через повышение оборота гамма-аминомасляной кислоты - ГАМК) и гипофизарном (снижение реакции гонадотрофов на ЛГРГ) уровнях. Эстрадиол подавляет базальную секрецию ФСГ независимо от действия ЛГРГ и увеличивает секрецию ПРЛ (ингибирующего клетки Лейдига). Ингибин избирательно снижает синтез бета-субъединицы ФСГ в гипофизе и увеличивает эффект ЛГРГ на ЛГ. Активин оказывает обратное действие. Прерывистость паттерна секреции ЛГРГ играет важную роль в поддержании нормального уровня гонадотропинов: при перманентном введении ЛГРГ происходит десенситизация гипофиза к нему и соответственно к снижению секреции ЛГ и ФСГ.
Продуцируемый клетками Сертоли активин стимулирует пролиферацию половых клеток, а ингибин подавляет ее. Между половыми клетками и клетками Сертоли существует обратная связь. Секреция ингибина клетками Сертоли прекращается после разрушения половых клеток (при крипторхизме - неопущении яичка в мошонку высокая лабильность лизосом сперматоцитов и сперматид при 37oC приводит к разрушению этих клеток; при облучении они разрушаются за счет свободнорадикальных реакций). Функционирование клеток Сертоли контролируется также миоэпителиальными клетками семенных канальцев, регулируемыми андрогенами и осуществляющими продвижение незрелых сперматозоидов к эпидидимису.
В регуляции функций семенников принимают участие многие другие эндо/паракринные факторы. Показано, что ТФР-β1 ингибирует стимулирующее действие ИФР-I на рецепторы ЛГ клеток Лейдига за счет снижения уровня рецепторов ИФР-I. Тиреоидные гормоны оказывают множественные влияния на семенники: в клетках Сертоли они снижают активность ароматазы, увеличивают продукцию ИФР-I, снижают
секрецию АСБ, но увеличивают экспрессию и активность транспортера глюкозы GLUT-1 . В отсутствие тиреоидных гормонов гормонпродуцирующая и сперматогенная функции семенников подавляются.
Выброс семени происходит с участием окситоцина.
Система отрицательной обратной связи в семенниках через продукцию эстрогенов клетками Сертоли может быть ограничена. У мыши это ограничение имеет форму экспрессии в семенниках эстрогенсульфотрансферазы - фермента, инактивирующего эстрогены путем их конъюгации с активированной серной кислотой. Нокаут гена данного фермента ведет к развитию морфофункциональных нарушений в семенниках и снижению оплодотворяющей способности таких животных. Вместе с тем и недостаточность эстрогенов (у мышей с нокаутированным геном ароматазы) или их эффективности (у мышей с нокаутированным геном Э-Рц-а) ведет к подавлению фертильности, что свидетельствует о функциональной значимости эстрогенов в регуляции функции семенников. Системы регуляции и саморегуляции семенников представлены на рис. 3-8.
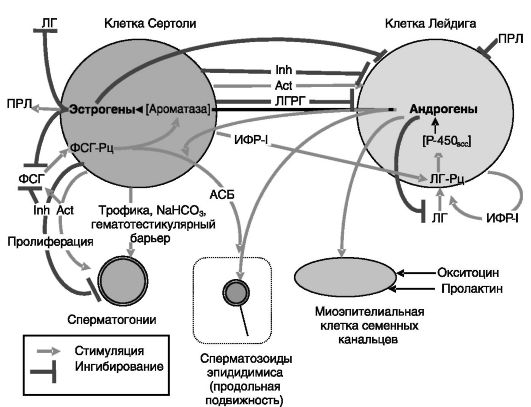 Рис. 3-8. Регуляция и саморегуляция работы семенников
Рис. 3-8. Регуляция и саморегуляция работы семенников
СЕЗОННОСТЬ РАЗМНОЖЕНИЯ
Многие виды размножаются сезонно, например весной-летом (хомячок) или осенью-зимой (овца). Даже у животных (крыса) и человека, способных к круглогодичному размножению, наблюдаются колебания рождаемости на протяжении года. Одной из важнейших детерминант, определяющих сезонность репродуктивной функции, служит продолжительность светового дня. Проводником влияния фотопериода является мелатонин (рис. 3-9, 3-10).
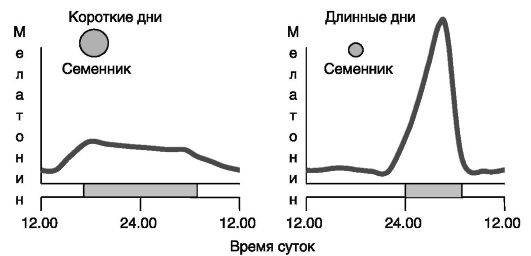 Рис. 3-9. Длительность фотопериода, продукция мелатонина и репродуктивная функция у барана
Рис. 3-9. Длительность фотопериода, продукция мелатонина и репродуктивная функция у барана
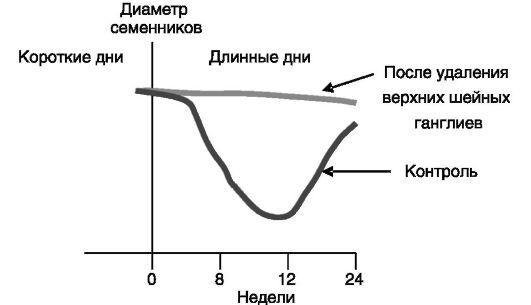 Рис. 3-10. Денервация эпифиза блокирует сезонные изменения репродуктивной функции у барана
Рис. 3-10. Денервация эпифиза блокирует сезонные изменения репродуктивной функции у барана
Главные «биологические часы» у млекопитающих локализованы в гипоталамическом супрахиазматическом ядре (SCN) и состоят из плотно упакованных ~ 20 000 нейронов. Работа этих «часов» основывается на системе отрицательной обратной связи транскрипции/ трансляции нескольких «часовых» генов. Позитивными регуляторами являются транскрипционные факторы CLOCK и BMAL1 (Brain and muscle ARNT-like 1). Негативными регуляторами служат 3 белка группы PERIOD (PER1-3) и 2 белка группы CRYPTOCHROME (CRY1-2; рис. 3-11). Аутоингибирование экспрессии PER и CRY усиливается гетеродимеризацией этих белков.
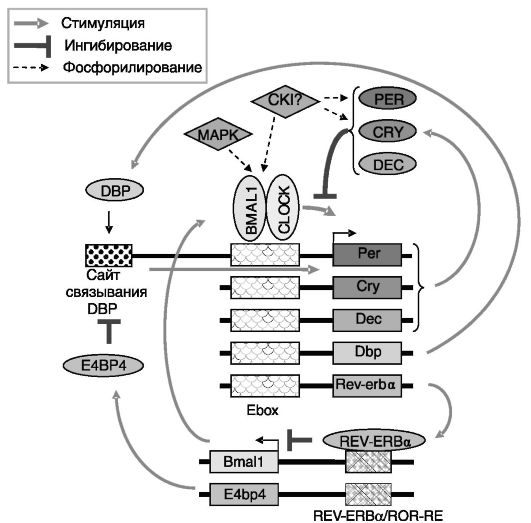 Рис. 3-11. Молекулярная основа работы «биологических часов»
Рис. 3-11. Молекулярная основа работы «биологических часов»
Гетеродимер CLOCK/BMAL1 путем взаимодействия с транскрипционным элементом E box активирует транскрипцию ряда генов, включая PER и CRY. Белки PER и CRY за счет ингибирования транслокации CLOCK/BMAL1 из цитоплазмы в клеточное ядро и подавления их транскрипционной активности снижают собственную экспрессию. Регулируемая деградация PER и CRY ведет к растормаживанию активности CLOCK/BMAL1, и цикл повторяется.
Работа этого «часового механизма» модулируется взаимодействующим с PER белком TIM (TIMELESS). Аналогичную PER и CRY
функцию выполняют транскрипционные факторы DEC1 и DEC2 (differentially expressed in chondrocytes 1 and 2). Одним из стимулируемых CLOCK/BMAL1 генов является Rev-erba. Его относящийся к классу ядерных рецепторов белковый продукт, REV-ERBa, подавляет экспрессию гена своего индуктора Bmal1, что обеспечивает противофазность экспрессии позитивного и негативных регуляторов. Дополнительную устойчивость работе часов придают антагонистично действующие на экспрессию Per1 транскрипционные факторы DBP (Albumin D box-binding protein) и E4BP4 (adenovirus E4 promoter-binding protein), экспрессия которых соответственно прямо и опосредованно контролируется CLOCK/BMAL1.
Белковые компоненты данного «часового механизма» контролируют экспрессию множества эффекторных генов, в частности, через энхансерный элемент E box, REV-ERBa/ROR-чувствительный элемент, сайт связывания DBP.
Модуляция работы «часов» осуществляется с помощью посттрансляционных модификаций формирующих их белков, например фосфорилированием и убиквитинилированием, а также образованием гомо/гетеродимеров.
Поступающая из сетчатки по ретиногипоталамическому тракту информация об освещенности трансформируется в выброс терминалями глутамата и PACAP на нейроны супрахиазматического ядра. Это приводит к активации ряда протеинкиназ (CaMKII, MAPK, ПК-GII), фосфорилирующих транскрипционные факторы, включая CLOCK/BMAL1 и CREB, что увеличивает экспрессию генов PER1 и PER2. Это, в свою очередь, смещает стрелки «часов», причем PER2 переводит стрелки назад (более раннее наступление ночи), а PER1 - вперед (более позднее наступление ночи). Необходимо отметить, что экспрессия генов PER приурочена к темноте, хотя индуцируется светом.
В периферических тканях имеются собственные «часы» с теми же элементами, но регулируются они другими стимулами.
Сезонный календарь тесно связан с циркадным ритмом, управляемым рассмотренным выше часовым механизмом, и важным нейроэндокринным фактором сезонности характера жизнедеятельности является мелатонин. Секреция мелатонина контролируется освещением посредством двух механизмов: ретино-гипоталамосимпатической иннервации пинеалоцитов (ингибирование) и через супрахиазматическое ядро (модуляция). У фотопериодичных грызунов преобладающим способом модуляции секреции мелатонина является регуляция N-ацетилтрансферазы на транскрипционном уровне, а у копытных - индуцированная светом деградация фермента. Расшифрован один из механизмов декодирования сигнала мелатонина - его преобразование в сезонный ритм секреции ПРЛ лактотрофами гипофиза (рис. 3-12).
Главным фактором для сезонных изменений секреции ПРЛ (увеличение летом, снижение зимой) служит длительность секреции мелатонина (отражающая продолжительность ночи). Сенсорами «продолжительности» являются так называемые календарные клет-
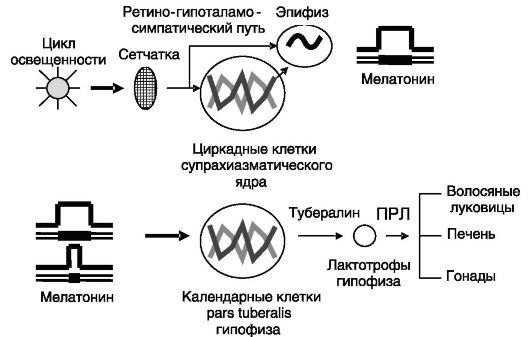 Рис. 3-12. Трансформация фотопериодичности в сезонные изменения секреции ПРЛ
Рис. 3-12. Трансформация фотопериодичности в сезонные изменения секреции ПРЛ
ки приближенной к срединному возвышению гипоталамуса части аденогипофиза (pars tuberalis). В ответ на продолжительное действие мелатонина (длинной зимней ночью) эти календарные клетки снижают секрецию паракринных рилизинг-факторов ПРЛ, и его секреция уменьшается.
Календарные клетки содержат собственные «часы», ход которых в разных клетках синхронизируется мелатонином. В отсутствие мелатонина (например, в условиях постоянного освещения) синхронность работы клеток постепенно утрачивается, усредненный между клетками уровень экспрессии белков «часов» перестает колебаться на протяжении суток, и как следствие секреция ПРЛ возрастает.
Механизм декодирования продолжительности действия мелатонина на календарные клетки гипофиза включает стимуляцию мелатонином аккумуляции в клетках цАМФ, активацию ПК-A, фосфорилирование ей транскрипционного фактора CREB и индукцию этим фактором транскрипции гена раннего индуцируемого цАМФ репрессора (ICER), причем чем продолжительнее действие мелатонина, тем чувствительнее к нему данная система (т.е. происходит аутосенситизация). У фотопериодичных грызунов декодировка мелатонинового сигнала основывается преимущественно на амплитудной модуляции экспрессии генов, участвующих в работе часового механизма календарных клеток, а у овец - на фазовом контроле (рис. 3-13).
На мышах с нокаутированным геном рецептора 1 мелатонина (MT1) показано, что мелатонин стимулирует в календарных клетках экспрессию PЕR1, CRY1, CLOCK и BMAL1. Уровень PER2, по-видимому, стимулируется опосредованно, за счет подавления его деградации в гетеродимерах с PER1 и CRY1. Гипотетические паракринные посредники pars tuberalis (называемые тубералином) действия мелатонина на секрецию ПРЛ гипофизом пока не идентифицированы. Поэтому остается неизвестным и конкретный механизм влияния часовых генов на сезонный ритм ПРЛ.
Необходимо отметить, что действие мелатонина на календарные клетки гипофиза осуществляется эндокринным путем, т.е. через общий кровоток, а не через гипоталамо-гипофизарную двойную капиллярную сеть, о чем свидетельствует сохранение ингибирования мелатонином длинной ночи секреции ПРЛ у животных с разрушением срединного возвышения гипоталамуса. Сезонность активности других эндокринных функций гипофиза, в частности продукции
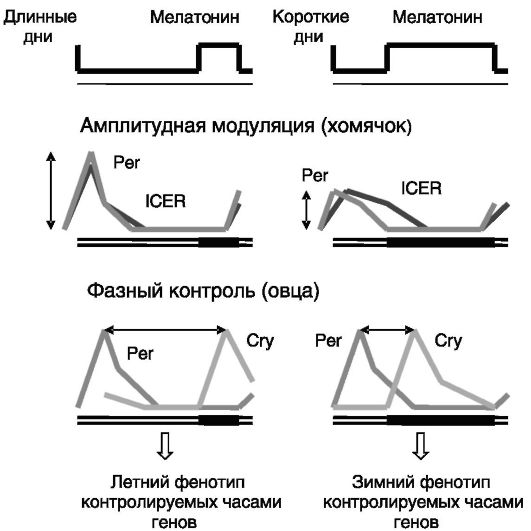 Рис. 3-13. Декодирование сигнала мелатонина календарными клетками гипофиза
Рис. 3-13. Декодирование сигнала мелатонина календарными клетками гипофиза
При фазном контроле экспрессия PER обеспечивается снятием ингибирующего действия мелатонина, а экспрессия CRY - стимулирующим действием мелатонина. Образование гетеродимеров PER/CRY в зимний и летний период различается.
гонадотропинов, зависит от целостности срединного возвышения, что предполагает действие мелатонина на эти функции посредством модуляции секреции рилизинг-гормонов гипоталамуса. Есть основания предполагать, что сенсоры действия мелатонина на гонадотропную функцию гипофиза локализованы в дорсальной части медиобазального гипоталамуса, нейроны которого богаты рецепторами мелатонина: имплантация мелатонина в эту область гипоталамуса овец приводит к стимуляции секреции гонадотропинов, хотя, возможно, сенсоры мелатонина могут находиться в нескольких структурах мозга.
Рекомендуемая литература
Гормональная регуляция размножения у млекопитающих / под ред. К. Остин, Р. Шорт. - М.: Мир, 1987.
Akingbemi B.T. Estrogen regulation of testicular function. Reprod Biol Endocrinol. 2005;3:51.
Christenson L.K., Devoto L. Cholesterol transport and steroidogenesis by the corpus luteum. Reprod Biol Endocrinol. 2003;1:90.
Conti M, Hsieh M, Park J.Y., Su Y.Q. Role of the epidermal growth factor network in ovarian follicles. Mol Endocrinol. 2006;20(4):715-723.
Durlinger A.L., Visser J.A., Themmen A.P. Regulation of ovarian function: the role of anti-Mullerian hormone. Reproduction. 2002;124(5):601- 609.
Ginther O. Beg M.A., Bergfelt D.R.J. et al. Follicle selection in monovular species. Biol Reprod. 2001;65(3):638- 647.
Hirota T., Fukada Y. Resetting mechanism of central and peripheral circadian clocks in mammals. Zoolog Sci. 2004;21(4):359-368.
Itman C, Mendis S, Barakat B, Loveland K.L. All in the family: TGF-beta family action in testis development. Reproduction. 2006;132(2):233-246.
Lincoln G.A., Andersson H, Loudon A. Clock genes in calendar cells as the basis of annual timekeeping in mammals--a unifying hypothesis. J Endocrinol. 2003;179(1):1-13.