Эндокринная регуляция. Биохимические и физиологические аспекты : учеб. пособие / А.Н. Смирнов ; под ред. В.А. Ткачука - 2009. - 368 с.
|
|
|
|
ГЛАВА 12. ВОДНО-СОЛЕВОЙ ОБМЕН
Работа любой клетки зависит от соотношения концентраций отдельных ионов внутри и снаружи клетки, а также от общей осмолярности. Ведущую роль в поддержании ионного баланса играет регуляция уровня натрия, калия и воды, которая имеет место в любой клетке. Функция поддержания водно-солевого баланса крови в значительной мере реализуется почками.
У человека за сутки из первичной мочи в кровь возвращается 1,7 кг NaCl и 180 л воды. В проксимальных отделах нефрона абсорбируется 60-70% соли и воды и около 90% HCO3-. Эти процессы регулируются ангиотензином II, эндотелином, симпатической иннервацией, паратгормоном, дофамином и т.д. Абсорбция осуществляется с участием Na+/H+-обменника люминальной мембраны и Na+/К+-АТФазы базолатеральной мембраны. В восходящем колене петли Генле абсорбция NaCl (20 - 30%) происходит с участием Na+2Cl-К+-котранспортера и Na+/К+-АТФазы базолатеральной мембраны. Вода здесь не всасывается. Скорость транспорта регулируется простагландинами, паратгормоном, глюкагоном, кальцитонином, вазопрессином, адреналином. В дистальном нефроне происходит абсорбция 5-10% NaCl с участием Na+Cl-котранспортера люминальной мембраны и Na+/К+-АТФазы базолатеральной мембраны. Ведущим регулятором процесса является альдостерон. В собирательных трубочках абсорбируется 10-15% воды, что контролируется вазопрессином и отчасти натриуретическими факторами. Абсорбция нескольких (до 5) процентов NaCl с участием эпителиальных Na+ каналов люминальной мембраны и Na+/K+- АТФазы базолатеральной мембраны контролируются альдостероном и натрийуретическими факторами. Всасывание воды происходит с участием аквапорина 2 люминальной мембраны и аквапоринов 3 и 4 базолатеральной мембраны за счет осмотического градиента. Экскреция NaCl колеблется от 0,1 до 3%, а воды от 0,3 до 15% от содержания в первичном фильтрате. Основные транспортеры натрия и воды в разных отделах нефрона показаны на рис. 12-1.
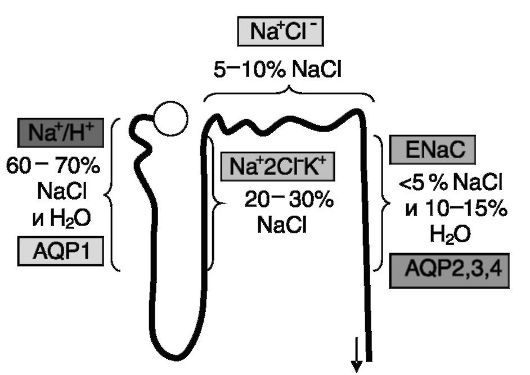 Рис. 12-1. Реабсорбция NaCl и воды в разных отделах нефрона осуществляется с участием разных транспортеров Na+ и H2O
Рис. 12-1. Реабсорбция NaCl и воды в разных отделах нефрона осуществляется с участием разных транспортеров Na+ и H2O
ТРАНСПОРТ НАТРИЯ В ПОЧКАХ
Na+-К+-АТФаза. На реабсорбцию натрия в почках человека за сутки требуется 2 кг АТФ, расходуемого на работу Na-К-АТФазы. Способность клеток к реабсорбции прямо коррелирует с количеством Na-К-АТФазы в базолатеральной мембране (до 50 млн насосов на клетку). (В обычной клетке всего несколько сотен или тысяч насосов.) Работа Na-К-АТФазы обеспечивает реабсорбцию или экскрецию многих других заряженных и незаряженных соединений.
Для активности Na-К-АТФазы необходимо присутствие внутриклеточного Na+ и внеклеточного К+. Лимитирующим фактором служит концентрация Na+. К+ может быть заменен аммонием, что служит механизмом экскреции аммония. На одну гидролизуемую молекулу ATP приходится три перемещенных через мембрану иона Na и два перемещенных в обратном направлении иона К, и эта асимметрия ведет к возникновению мембранного потенциала.
Модель функционирования Na-К-АТФазы предусматривает наличие двух основных конформаций белка, E1 и E2. E1 характеризуется высоким сродством к АТФ и Na+ и низким к К+, а E2 - обратным соотношением сродства к катионам. Фосфорилирование фермента закрывает доступ для ионов, и последующее высвобождение АДФ приводит к конформационному переходу E1→E2. Это сопровождается высвобож-
дением Na+ наружу клетки и связыванием внеклеточного К+, которое стимулирует дефосфорилирование фермента и закрытие дальнейшего доступа для ионов. Далее происходит спонтанный переход E2→ E1 с высвобождением К+ внутрь клетки. Природными ингибиторами Na-К-АТФазы являются сердечные гликозиды (дигиталис, уабаин), которые связываются с ферментом в конформации E2, ингибируя тем самым связывание К+ и как следствие ингибируя последующее дефосфорилирование фермента и его конформационный переход в E1.
Na-К-АТФаза построена из двух субъединиц, α и β, в соотношении 1:1. Основные функции выполняет более крупная каталитическая α-субъединица, которая включает 10 трансмембранных доменов (M1-M10). Связывание АТФ и фосфорилирование происходят по длинной цитоплазматической петле M4-M5. Пора для ионов, видимо, формируется M4, M5 и M6. N-концевой домен участвует в формировании ворот для ионов. M1-M4 участвуют в связывании уабаина. Внеклеточная петля M7-M8 взаимодействует с β-субъединицей фермента. Внутриклеточные фрагменты могут служить субстратами для ряда протеинкиназ.
Субъединица β, содержащая один трансмембранный домен, выступает в роли шаперона: она обеспечивает укладку цепи новосинтезированной α-субъединицы, ее доставку к плазматической мембране и стабилизацию в мембране. В почках экспрессируется также γ-субъединица - маленький белок с одним трансмембранным доменом, влияющий на сродство фермента к АТФ, Na+ и К+.
К настоящему времени клонировано 4 типа α-субъединиц (α1-α4) и 3 типа β-субъединиц. Обнаружены также 2 сплайсинговых варианта γ-субъединиц.
Фосфорилирование Na-К-АТФазы протеинкиназами может влиять на активность фермента. В частности, фосфорилирование ПК-A α1-субъ- единицы у крысы повышает активность фермента. Фосфорилирование ПК-C может влиять на сродство фермента к Na+ и эндоцитоз. Активация рецепторных тирозинкиназ повышает активность фермента.
Высокая активность Na-К-АТФазы обнаруживается в тонком восходящем колене петли Генле и дистальной собирательной трубочке; ниже активность в проксимальном канальце и еще ниже в собирательной трубочке.
Na-К-АТФаза служит преобладающей движущей силой для перемещения ионов и воды в нефроне, но механизмы транспорта и их регуляция различаются в разных отделах нефрона (рис. 12-2).
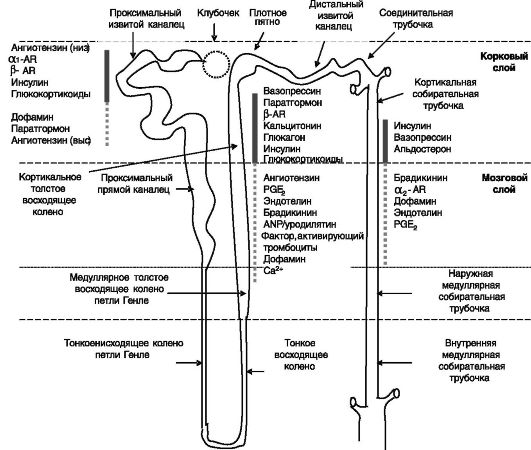 Рис. 12-2. Архитектура нефрона и основные области действия гормонов на транспорт натрия:
Рис. 12-2. Архитектура нефрона и основные области действия гормонов на транспорт натрия:
сплошная линия - стимуляция: пунктир - ингибирование реабсорбции
Локализация рецепторов гормонов
Рецептор ПТГ/ПТГ-рП экспрессируется в проксимальных канальцах и кортикальной части восходящего колена петли Генле. В проксимальных канальцах рецептор локализован на апикальной и базолатеральной мембранах клеток. На базолатеральной мембране рецептор сопряжен с аденилатциклазой и фосфолипазой Cβ.
Рецепторы дофамина фармакологических типов и D2 выявлены в проксимальных канальцах > кортикальной части собирательной трубочки > восходящем колене. Локализованы на апикальной и базолатеральной мембранах клеток. Сопряжены с аденилатциклазой и фосфолипазой Cβ.
α1 AR (3 изоформы) локализованы в проксимальных канальцах и восходящем колене петли Генле. Сопряжены с фосфолипазой Cβ. α2 AR (3 изоформы) имеют сходную локализацию и сопряжены с ингибированием аденилатциклазы и активацией фосфолипазы Cβ. β AR (3 изоформы) экспрессируются в проксимальных канальцах, восходящем колене петли Генле и во вставочных клетках собирательных трубочек. Сопряжены с аденилатциклазой.
Рецепторы ангиотензина AT1 и AT2 выявлены в проксимальных канальцах, восходящем колене петли и в собирательных трубочках, на апикальной и базолатеральной поверхностях клеток. AT1 сопряжены с фосфолипазой Cβ и (негативно) с аденилатциклазой. AT2 активируют фосфолипазу A2. Нередко конечные эффекты через 2 типа рецепторов противоположны (что может включать активацию тирозинкиназ AT1 и активацию тирозинфосфатаз AT2.
Рецептор вазопрессина V2 экспрессируется в восходящем колене петли и в собирательных трубочках. В последнем случае локализован на базолатеральной и апикальной поверхностях клеток. Сопряжен с аденилатциклазой. Рецептор V1 выявлен в собирательных трубочках и сопряжен с фосфолипазой Cβ.
ГК-Рц выявлен вдоль всего нефрона с преобладанием в клубочках и проксимальных канальцах, М-Рц преимущественно в дистальных извитых канальцах и собирательных трубочках.
Транспорт натрия в проксимальных канальцах
В проксимальных канальцах реабсорбируется более 70% натрия, калия, хлорида, бикарбоната, фосфата и воды, практически вся глюкоза и аминокислоты (рис. 12-3).
цАМФ через ПК-A стимулирует перемещение Na-К-АТФазы из ранних эндосом в базолатеральную мембрану. цАМФ координированно снижает активность апикального Na+/H+ обменника (NHE-3) и базолатерального Na+-HCO3-котранспортера (NBC-1). Эффект включает фосфорилирование обменника ПК-A. Конечным результатом сочетанного действия цАМФ на транспортеры является смещение с реабсорбции бикарбоната натрия на хлорид натрия.
Na+-HCO3-котранспортер NBC-1 (sodium bicarbonate cotransporter; рис. 12-4) экспрессируется в форме нескольких сплайсинговых вариантов. Специфичная для почек изоформа 2 содержит измененную по сравнению с изоформой 1 (экспрессируемой, в частности, в поджелу-
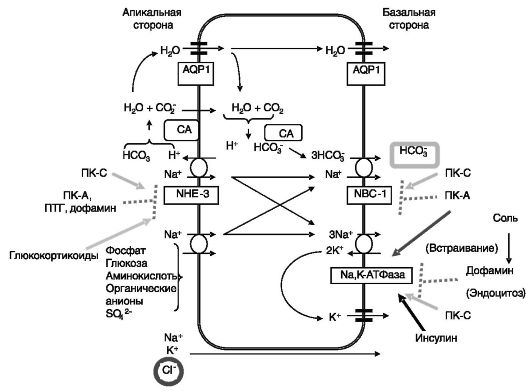 Рис. 12-3. Транспорт натрия в проксимальных канальцах
Рис. 12-3. Транспорт натрия в проксимальных канальцах
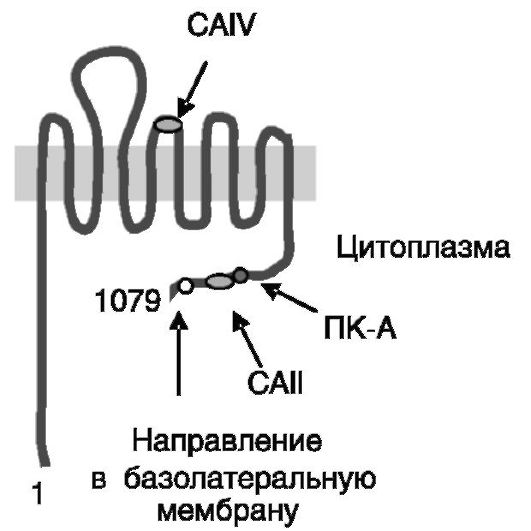 Рис. 12-4. Na+-ЖЮ3-котранспортер NBC-1: CAII и CAIV - сайты связывания карбоангидраз II и IV; ПК-A - сайт фосфорилирования протеинкиназой A
Рис. 12-4. Na+-ЖЮ3-котранспортер NBC-1: CAII и CAIV - сайты связывания карбоангидраз II и IV; ПК-A - сайт фосфорилирования протеинкиназой A
дочной железе) N-концевую последовательность, что определяет тканевые различия в регуляции активности котранспортера. Взаимодействие NBC-1 с внутриклеточной карбоангидразой II (CAII) и заякоренной на наружной поверхности клетки карбоангидразой IV (CAIV) максими-
зирует ток аниона через котранспортер. NBC-1 является электрогенным котранспортером. Его фосфорилирование (Ser1026) ПК-А ведет к смещению соотношения переносимых ионов HCO3- /Na+ с 3:1 до 2:1, что сопровождается деполяризацией базолатеральной мембраны. В результате меняется направление движения бикарбоната с его выхода из клетки на вход. Механизмы стимулирующего действия протеинкиназы C на активность NBC-1 не исследованы. Недостаточность NBC-1 сопровождается ацидозом проксимальных канальцев.
Активация ПК-C сопровождается повышением активности Na+- К+-АТФазы за счет увеличения ее сродства к Na+, а также активацией Na+/H+ обменника и Na+-HCO3-котранспортера. Конечным результатом этих эффектов является увеличение обратного захвата бикарбоната и натрия.
Концентрация ангиотензина в области проксимальных канальцев в 100-1000 раз выше, чем в системной циркуляции, за счет действия локальной системы синтеза ангиотензина. При низких концентрациях ангиотензин стимулирует реабсорбцию натрия и воды, а при высоких - снижает. Оба эффекта опосредуются рецепторами AT1. Стимулирующий эффект включает повышение активности Na+-К+- АТФазы, Na+/H+-обменника и Na+-HCO3-котранспортера. Эффект связан со снижением уровня цАМФ и повышением активности ПК-C.
Норадреналин и адреналин через α1-AR стимулируют реабсорбцию натрия и воды. Эффект преимущественно связан с повышением активности Na-К-АТФазы и Na+/H+-обменника. Через β-AR катехоламины оказывают сходное действие.
Дофамин может поступать к клеткам проксимальных канальцев из нервных окончаний, а также может синтезироваться в самих почечных клетках. Его синтез возрастает при солевой нагрузке. Дофамин снижает реабсорбцию натрия и воды, действуя преимущественно через апикальную мембрану. Эффект включает быстрое перемещение Na-К-АТФазы с клеточной поверхности во внутриклеточные эндосомы при участии ПК-C, фосфолипазы A2 и Р1К. По-видимому, фосфорилирование Na-К-АТФазы ПК-C служит сигналом к интернализации фермента. Дофамин снижает также активность Na+/H+-обменника.
ПТГ ингибирует реабсорбцию бикарбоната, натрия и жидкости. Два последних эффекта вторичны по отношению к первому. ПТГ вызывает снижение активности Na+/H+-обменника за счет фосфорилирования и последующего эндоцитоза. В целом, ПТГ смещает реабсорбцию с NaHCO3 на NaCl.
Инсулин повышает реабсорбцию натрия и воды. Эффект по меньшей мере отчасти связан с повышением сродства Na+-K+-ATPaзы к натрию, по-видимому, благодаря фосфорилированию фермента по тирозину.
Хронический избыток глюкокортикоидов повышает экскрецию аммиака, фосфата и кислоты. Одним из путей экскреции аммиака служит замена протона ионом аммония при работе ?+/Н+-обменника NHE3. Выведение избытка аммиака, образующегося в условиях длительной активации коры надпочечников (стресс, голодание, физическая активность) одновременно обеспечивает удаление этого токсичного продукта и выведение связываемых им протонов, которые также накапливаются при указанных состояниях. Активность Na+/Н+-обменника NHE3 под действием глюкокортикоидов увеличивается за счет повышения экспрессии его гена, а на более ранней стадии действия - за счет увеличения активности предсуществующего белка. Данный эффект глюкокортикоидов обусловлен стимуляцией экспрессии в проксимальных канальцах индуцируемой сывороткой и глюкокортикоидами протеинкиназы 1 (Sgkl), которая, взаимодействуя с NHE3 с участием содержащего домены PDZ белка «лесов» NHERF2 (sodium-hydrogen exchanger regulatory factor 2), повышает его активность. Предполагается, что NHE3 подвергается фосфорилированию протеинкиназой Sgk1, ведущему к встраиванию этого транспортера в плазматическую мембрану (рис. 12-5).
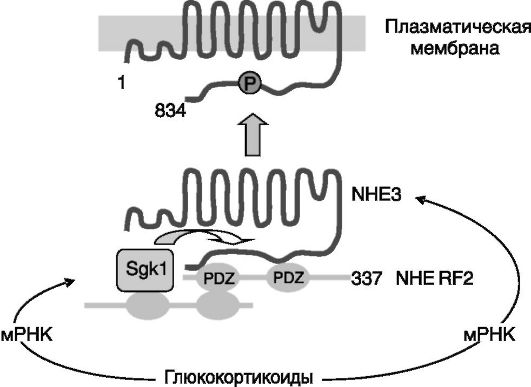 Рис. 12-5. Предполагаемый механизм стимулирующего действия глюкокортикоидов на активность Na+/H+-обменника NHE3 в проксимальных отделах нефрона
Рис. 12-5. Предполагаемый механизм стимулирующего действия глюкокортикоидов на активность Na+/H+-обменника NHE3 в проксимальных отделах нефрона
Транспорт ионов в восходящем колене петли Генле
Основные транспортеры ионов в восходящем колене нефрона и их регуляция показаны на рис. 12-6.
В восходящем колене петли Генле реабсорбируется около 15% натрия, происходит реабсорбция калия, бикарбоната, кальция и магния. Формирующаяся здесь моча является гипотоничной. Перенос через апикальную поверхность Na+ по градиенту концентрации (возникающему за счет очень интенсивной работы Na-K-АТФа- зы) с помощью электронейтрального Na+-К+-2Сl--котранспортера BSC-1 (Bumetanide-sensitive sodium-(potassium)-chloride cotransporter), или NKCC2 (Na-K-2Cl cotransporter; рис. 12-7), обеспечивает движение калия и хлорида против градиента их концентрации. Движение К+ и СГ ведет к деполяризации базолатеральной мембраны и гиперполяризации апикальной мембраны, что служит движущей силой
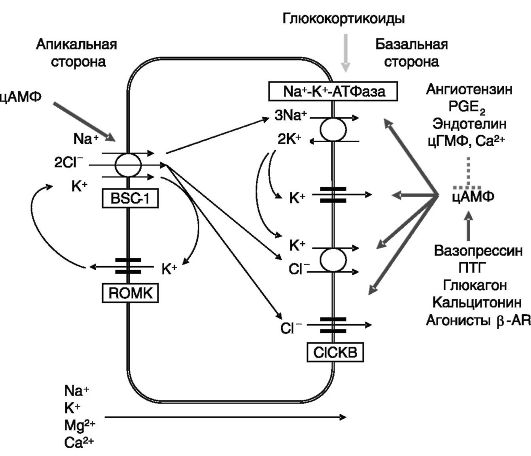 Рис. 12-6. Транспорт ионов в восходящем колене петли Генле
Рис. 12-6. Транспорт ионов в восходящем колене петли Генле
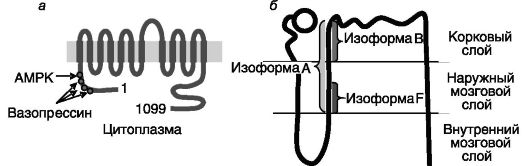 Рис. 12-7. Предполагаемая топология и выявленные сайты регуляторного фосфорилирования Na+-K+-2Cl--котранспортера апикальной мембраны BSC-1/NKCC2 (а); локализация изоформ BSC-1/NKCC2 в нефроне (б)
Рис. 12-7. Предполагаемая топология и выявленные сайты регуляторного фосфорилирования Na+-K+-2Cl--котранспортера апикальной мембраны BSC-1/NKCC2 (а); локализация изоформ BSC-1/NKCC2 в нефроне (б)
для перемещения двухвалентных катионов по парацеллюлярному пути. Основным внутриклеточным стимулятором реабсорбции ионов в этом отделе нефрона служит цАМФ, концентрация которого возрастает под действием вазопрессина, паратгормона, глюкагона, кальцитонина, агонистов β-AR. Вследствие редуцированности гормональных эффектов, снижение уровня какого-либо из этих гормонов не сказывается на работе этого отдела нефрона, поскольку другие гормоны продолжают стимуляцию реабсорбции. Регуляция происходит преимущественно за счет ингибирования аденилатциклазы или других этапов цАМФ-зависимого пути под действием ангиотензина, PGE2, эндотелина, цГМФ, внеклеточного кальция. цАМФ координированно повышает активность Na-K-АТФазы, Na+-K+- 2Cl--котранспортера и каналов для К+ и Cl-. Стимулирующее действие вазопрессина на активность транспортера BSC-1/NKCC2 включает фосфорилирование N-концевой области белка по нескольким сайтам, что обеспечивает перемещение транспортера из внутриклеточных везикул в плазматическую мембрану клетки. Участвующая в этом процессе ПК не установлена. Помимо кратковременной регуляции активности Na+-K+-2Cl- котранспортера может происходить его долговременная регуляция на транскрипционном уровне. Интересно отметить, что BSC-1/NKCC2 экспрессируется в виде нескольких сплайсинговых вариантов, белковые продукты которых различаются по кинетике транспорта ионов и представленности в мозговом и корковом слоях: высокоаффинная изоформа B локализуется исключительно в корковом слое (где концентрация NaCl наименьшая), низкоаффинная изоформа F - во внешнем мозговом
слое, а среднеаффинная изоформа A-в обоих слоях. Инактивирующие мутации гена BSC-1/NKCC2 служат причиной синдрома Бартера - формы почечной недостаточности плодов иноворожденных с потерей соли, метаболическим алкалозом, гиперкальциурией.
Транспорт соли в данном отделе нефрона ингибируется PGE2 за счет стимуляции Gai (здесь экспрессируется изоформа 6 аденилатциклазы, чувствительная к ингибирующему действию субъединицы αi G- белков; здесь экспрессируется рецептор простагландинов EP3, сопряженный с Gai). Ангиотензин II и брадикинин ингибируют транспорт соли за счет стимуляции аккумуляции внутриклеточного кальция, который, с одной стороны, ингибирует аденилатциклазу 6, а с другой - активирует фосфодиэстеразу циклических нуклеотидов. Кроме того, Ca2+ активирует фосфолипазу A2, продукт ферментативной активности которой арахидоновая кислота подвергается окислению до 20-гидроксиэйкозатетраеновой кислоты (20-HETE), ингибирующей Na-К-АТФазу и Na+-К+-2Cl-котранспортер. Натриуретические пептиды и уродилатин ингибируют транспорт соли через клетки посредством стимуляции аккумуляции цГМФ. Эндотелин ингибирует, а инсулин стимулирует транспорт соли с участием неклассических протеинкиназ C. Дофамин ингибирует транспорт соли, по-видимому, через активацию РКС Глюкокортикоиды стимулируют экспрессию Na-К-АТФазы и Na+-К+-2Cl-котранспортера.
Транспорт ионов в собирательных трубочках
Основные транспортеры ионов и воды в собирательных трубочках и их регуляция показаны на рис. 12-8.
Реабсорбция натрия в главных клетках связана с секрецией калия посредством двухступенчатого механизма: откачки натрия из клеток и закачки в них калия с помощью Na,К-АТФазы базолатеральной мембраны, что служит движущей силой для вхождения Na+ и выхода К+ через апикальную мембрану. Вход Na+ в клетки осуществляется преимущественно через ENaC (эпителиальный натриевый канал), построенный из гомологичных α-, β- и γ-субъединиц в соотношении 2:1:1. Секреция К+ через апикальную мембрану происходит через каналы аномального выпрямления ROМК. Реабсорбция воды осуществляется с участием индуцируемого вазопрессином аквапорина 2 (AQP-2) апикальной мембраны и конститутивных аквапоринов
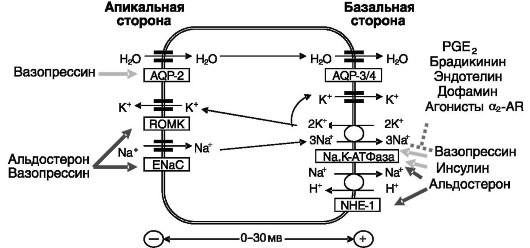 Рис. 12-8. Транспорт ионов и воды в собирательных трубочках
Рис. 12-8. Транспорт ионов и воды в собирательных трубочках
3 и 4 базолатеральной мембраны. Движущей силой для транспорта воды служит реабсорбция натрия в данном отделе нефрона. Na+/H+- обменник NHE-1 базолатеральной мембраны участвует в регуляции внутриклеточного pH.
Позитивными регуляторами реабсорбции натрия в данном отделе нефрона служат альдостерон, вазопрессин и (после приема пищи) инсулин. Негативные регуляторы - дофамин, α2-адреномиметики и простагландины. Альдостерон повышает реабсорбцию натрия и стимулирует выведение калия и протонов. Кроме того, он облегчает действие вазопрессина на реабсорбцию воды. Эффект альдостерона включает отставленную индукцию транскрипции преимущественно α-субъединицы Na,K-АТФазы и более быструю активацию предсуществующего фермента посредством неизвестного механизма. Не исключено, что альдостерон может выступать в качестве аллостерического регулятора Na,K-АТФазы. Второй, но функционально наиболее значимой точкой приложения действия альдостерона служит ENaC апикальной поверхности клеток, который, как считается, является лимитирующим элементом системы реабсорбции натрия. В отношении этого объекта также обнаружено двойное действие гормона: стимуляция транскрипции субъединиц (преимущественно а-субъединицы) и активация предсуществующего белка. Внутриклеточные C-концевые домены всех трех гомологичных между собой типов субъединиц ENaC (рис. 12-9, а) содержат пролилтирозиловые (PY) мотивы xPPxY, узнаваемые триптофановыми (WW) доменами убиквитинп-
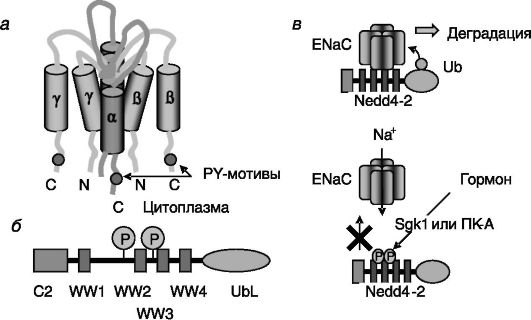 Рис. 12-9. Регуляция активности эпителиального натриевого канала ENaC: а - субъединичный состав канала; б - доменная организация убиквитинпротеинлигазы Nedd4-2; в - гормоны, индуцируя фосфорилирование Nedd4-2, блокируют инактивацию ENaC
Рис. 12-9. Регуляция активности эпителиального натриевого канала ENaC: а - субъединичный состав канала; б - доменная организация убиквитинпротеинлигазы Nedd4-2; в - гормоны, индуцируя фосфорилирование Nedd4-2, блокируют инактивацию ENaC
ротеинлигазы Nedd4-2 (рис. 12-9, б). Взаимодействие с Nedd4-2 ведет к ковалентному присоединению к ENaC убиквитина, стимулирующего деградацию транспортера натрия в лизосомах/протеосомах. Альдостерон, действуя на уровне транскрипции, быстро (уже через 30 мин) увеличивает экспрессию индуцируемой сывороткой и глюкокортикоидами киназы 1 (Sgk1), которая фосфорилирует Nedd4-2 и тем самым блокирует взаимодействие этой убиквитинпротеинлигазы с ENaC. В результате скорость деградации ENaC снижается, и транспорт натрия через апикальную мембрану клеток дистальных извитых канальцев и собирательных трубочек увеличивается (рис. 12-9, в). Стимулирующее действие инсулина на реабсорбцию натрия также включает цепочку Sgk1 Nedd4-2 ENaC. Продукт активируемой инсулином PI3K, фосфатидилинозитид-3,4,5-трифосфат (PI-3,4,5- P3), активирует зависимую от него киназу 1 или 2 (PDK1/2), которая фосфорилирует и тем самым активирует Sgk1. Вазопрессин повышает активность ENaC также путем индукции фосфорилирования Nedd4- 2, но эффекторной киназой в этом случае является цАМФ-зависимая киназа - ПК-A (см. рис. 12-9, в).
Одна из форм наследуемой гипертензии - синдром Лиддля - обусловлена мутациями PY мотивов в β- или γ-субъединицах ENaC. Такой мутантный натриевый канал не узнается убиквитинпротеинлигазой Nedd4-2 и в результате долго остается встроенным в апикальную мембрану клеток, обеспечивая усиленную реабсорбцию натрия. Для синдрома характерны гипокалиемия, метаболический алкалоз, пониженный уровень ренина и альдостерона в плазме крови. Противоположные симптомы наблюдаются при псевдогипоальдостеронизме типа 1 (PHA-1), который может вызываться инактивирующими мутациями всех трех субъединиц ENaC.
Помимо создания движущей силы для экскреции калия (акти- вацииNa,K-АТФазы и натриевого канала), альдостерон оказывает и более прямое влияние на транспорт калия, стимулируя экспрессию калиевого канала наружного медуллярного слоя ROMK (renal outer medullary potassium channel) и его встраивание в апикальную мембрану. Последний эффект определяется индукцией альдостероном экспрессии протеинкиназы Sgk1, фосфорилирующей ROMK, что является необходимым условием для встраивания канала в плазматическую мембрану. По тому же сайту (Ser44) ROMK фосфорилируется активируемой вазопрессином ПК-A, что служит одним из механизмов стимулирующего действия вазопрессина на экскрецию калия.
PGE2, секретируемый интерстициальными клетками, служит элементом системы отрицательной обратной связи в действии вазопрессина. Индукцированный вазопрессином через рецептор V1 PGE2 посредством нескольких механизмов снижает активность Na,K-АТФазы.
Брадикинин, действующий сходно с PGE2, по-видимому, также служит элементом системы отрицательной обратной связи в действии вазопрессина. Ингибирующее действие на эффекты вазопрессина оказывают также эндотелин, дофамин и агонисты a2-AR. Инсулин стимулирует активность Na,K-АТФазы без изменения количества белка в плазматической мембране.
АКВАПОРИНЫ И ИХ РЕГУЛЯЦИЯ
Аквапорины (AQP) представляют собой белки, формирующие в плазматической мембране клетки поры, проницаемые для воды. К настоящему времени клонировано более 10 представителей семейства аквапоринов человека. Все они содержат по 6 трансмембранных
α-спиральных доменов (рис. 12-10) и функционируют в форме гомотетрамеров, каждая из субъединиц которых формирует отдельную пору. По центру тетрамера проходит канал, который может служить неселективным каналом для катионов.
Аквапорины являются наиболее быстродействующими из известных каналов, обеспечивая прохождение до 3 млрд молекул воды через один канал за секунду. Высокая скорость определяется чередованием гидрофильных аминокислотных остатков и гидрофобных сегментов в канале, в результате чего молекула воды быстро проскакивает мимо гидрофобных сегментов. В почках экспрессируется по меньшей мере 7 типов аквапоринов. AQP1 экспрессируется в проксимальном нефроне и нисходящем колене петли Генле. AQP2, 3 и 4 - в собирательных трубочках. AQP6 - во внутриклеточных везикулах вставочных клеток собирательных трубочек, а AQP8 - во внутриклеточных везикулах главных клеток проксимального нефрона и собирательных трубочек. Функции AQP6 и 8 не известны. AQP7 экспрессируется в реснитчатом эпителии проксимального нефрона и, видимо, участвует в абсорбции воды.
Быстрые изменения в абсорбции воды осуществляются путем стимуляции вазопрессином перемещения содержащих AQP2 внутриклеточных везикул к апикальной мембране клеток. Долгосрочная адаптация включает изменения экспрессии AQP2 и 3. В отсутствие
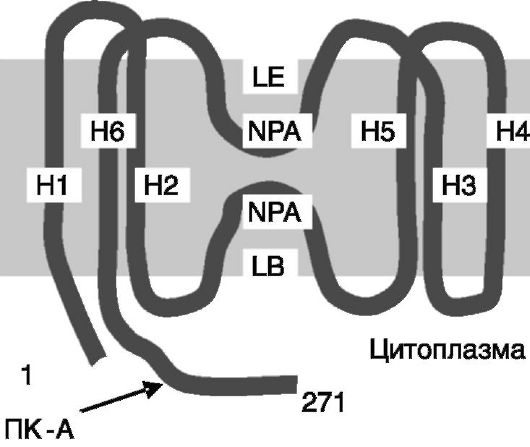 Рис. 12-10. Полипептидная
цепь аквапоринов формирует канал для воды с участием петель LE и LB,
окруженных гидрофобными трансмембранными доменами H1-H6.
Рис. 12-10. Полипептидная
цепь аквапоринов формирует канал для воды с участием петель LE и LB,
окруженных гидрофобными трансмембранными доменами H1-H6.
Стрелкой отмечен сайт фосфорилирования ПК-A в AQP2. NPA - повторяющийся мотив Asn-Pro-Ala
вазопрессина AQP2 эндоцитируется из мембраны. При ряде заболеваний, связанных с избыточной задержкой воды (коронарная недостаточность, беременность, синдром неадекватной секреции антидиуретического гормона), наблюдается повышение экспрессии AQP2 и его перемещения к апикальной поверхности клеток.
При нокауте гена AQP3 у мышей развивается полиурия, а экспрессия AQP2 снижается. Потребление воды возрастает более чем в 10 раз. Проницаемость базолатеральной мембраны для воды снижается более чем в 3 раза. Дополнительный нокаут гена AQP4 еще больше снижал способность к концентрированию мочи, хотя изолированный нокаут гена AQP4 не вызывал серьезных изменений в способности к концентрированию мочи. Кроме почек, AQP3 экспрессируется в дыхательных путях, глазу, мочевом пузыре, коже и желудочно-кишечном тракте.
Нокаут гена рецептора вазопрессина типа 2 (V2) у мыши ведет к потере способности почек концентрировать мочу, полиурии и полидипсии.
В мозгу вазопрессин через рецептор типа V1a астроцитов и, возможно, AQP4 стимулирует перемещение воды. Нокаут гена AQP4 у мыши спасает животных от отека мозга, вызванного ишемией или гипонатриемией, а у интактных животных ишемия и травма стимулируют экспрессию AQP4 (и AQP9) в мозгу.
Функционирование аквапоринов (по крайней мере AQP1) в качестве ионных каналов может регулироваться их прямым взаимодействием с цГМФ, сайты связывания которого локализованы во внутриклеточной C-концевой области AQP1. Показано также взаимодействие AQP1 с рецепторной тирозинкиназой EphB2.
Активность аквапоринов в качестве каналов для воды может регулироваться рядом факторов, включая pH (рост которого снижает активность AQP0 в глазном хрусталике, повышает активность AQP3 и снижает активность AQP6 в почках).
В слюнных железах секреция воды индуцируется парасимпатической и симпатической импульсацией через M3 мускариновые холинорецепторы и α1-AR соответственно. Активация рецепторов обоих типов через G-белок типа 11 (группа q) обеспечивает активацию фосфолипазы Cβ, продукт каталитической активности которой, инозитол-1,4,5-трифосфат (IP3), открывает кальциевые каналы внутриклеточных депо кальция. Повышение уровня внутриклеточного кальция прямо и опосредованно через стимуляцию рианодиновых рецепторов (RyR) активирует кальмодулин, служащий стимулятором кальмодулинзависимой протеинкиназы II (CaMK II), которая
необходима для быстрой (15 с - 1 мин) индукции встраивания AQP5 в апикальную мембрану железистых клеток (рис. 12-11). В отличие от AQP2 для встраивания AQP5 в плазматическую мембрану его фосфорилирования ПК-A не требуется.
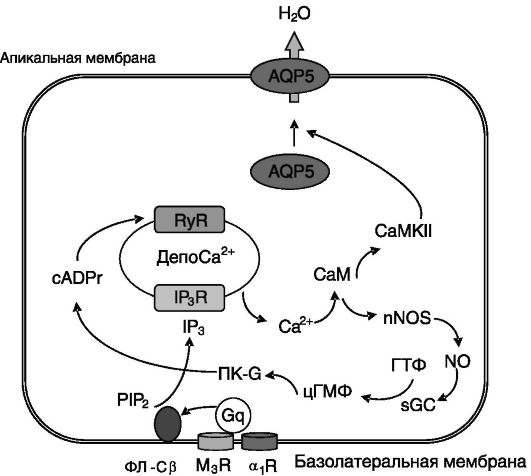 Рис. 12-11. Регуляция встраивания аквапорина 5 (AQP5) в плазматическую мембрану клеток околоушной слюнной железы:
Рис. 12-11. Регуляция встраивания аквапорина 5 (AQP5) в плазматическую мембрану клеток околоушной слюнной железы:
M3R - мускариновый рецептор 3 ацетилхолина; ФЛ-Cβ - фосфолипаза Cβ; Gq - G-белок группы q; PIP2 - фосфатидилинозитид-4,5-бифосфат; IP3 - инозитол-1,4,5-трифосфат; IP3R - рецептор IP3; CaM - кальмодулин; CaMKII - кальмодулинзависимая киназа II; sGC - растворимая гуанилатциклаза; cADPr - циклическая аденозиндифосфатрибоза
Механизмы регуляции функционирования аквапорина-2 в почках
Вазопрессин через рецептор типа V2 активирует Gs-белок, который, в свою очередь, активирует аденилатциклазу типа VI. Аккумулирующийся цАМФ активирует ПК-A, которая прямо фос-
форилирует AQP2 по остатку Ser256, что служит сигналом для перемещения везикул с AQP2 к апикальной поверхности клеток. Для перемещения необходимо также заякоривание ПК-A в субклеточных компартментах через специальные заякоривающие белки. Помимо роста цАМФ, вазопрессин индуцирует временное повышение Cai2+, которое (с участием кальмодулина) необходимо для перемещения везикул с AQP2. Рост Cai2+ опосредован действием цАМФ (через ПК-A?) на чувствительные к рианодину депо кальция. Перемещение везикул AQP2 происходит в результате деполимеризации F-актина и функционирования микротрубочек. Деполимеризация происходит в результате снятия тормозного воздействия малых G-белков группы Rho после их фосфорилирования протеинкиназой A (рис. 12-12). Слияние содержащих AQP2 везикул с плазматической мембраной происходит
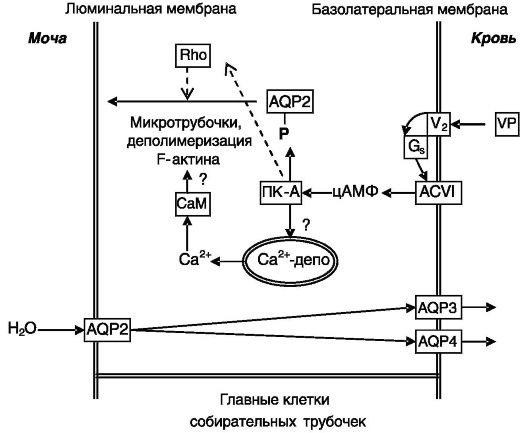 Рис. 12-12. Механизмы регуляции проницаемости для воды собирательных трубочек почек:
Рис. 12-12. Механизмы регуляции проницаемости для воды собирательных трубочек почек:
VP - вазопрессин; V2 - рецептор 2 вазопрессина; Gs - G-белок s-типа; ACVI - аденилатциклаза типа VI
с участием белков групп v- и t-SNARE (т.е. локализующихся в везикулах и мембранах-мишенях). Удаление AQP2 из апикальной мембраны происходит путем эндоцитоза содержащих AQP2 окаймленных клатрином ямок, отпочковывание которых от плазматической мембраны в виде покрытых клатрином везикул осуществляется с участием ГТФазы динамина. Данный конститутивный процесс не зависит от фосфорилирования AQP2. Вызывающие несахарный диабет мутации AQP2 препятствуют транспортировке белка в апикальную мембрану.
Стимуляция AQP2 происходит также под действием ANP и NO. Оба фактора индуцируют аккумуляцию в клетках цГМФ, который через активацию ПК-G стимулирует фосфорилирование AQP2 по остатку Ser256, что является необходимым условием стимуляции перемещения AQP2. Функциональное значение стимулирующего действия ANP и NO на AQP2 неизвестно, поскольку конечный физиологический эффект обоих факторов является обратным (увеличение объема мочи).
В энтероцитах кишечника аквапорины играют не столь существенную роль, как в почках, и около 50% всасывания воды кишечником (т.е. около 4 л в сутки) определяется котранспортером Na+-глюкозы.
Другие объекты действия вазопрессина
Натриевые каналы. Помимо аквапоринов, вазопрессин регулирует в собирательных трубочках работу эпителиальных натриевых каналов (ENaC=TRPV5), а именно повышает содержание α-, β- и γ-субъединиц ENaC. Эффект развивается медленно и, следовательно, касается долгосрочной регуляции реабсорбции натрия. Быстрый стимулирующий эффект достигается путем индукции фосфорилирования протеинубиквитинлигазы, инактивирующей ENaC (см. выше).
Транспортеры мочевины. Вазопрессин стимулирует также экспрессию транспортера мочевины UT-A2 в нисходящем колене петли Генле и активирует UT-A1 в концевом отделе собирательной трубочки (см. ниже).
Патология, связанная с аквапоринами
Мутации AQP0 в области, формирующей пору для воды, сопровождаются наследственной катарактой. Предполагается, что AQP0 формирует гомофильные контакты между соседними клетками хрусталика. Мутация AQP1, экспрессируемого в почках, эритроцитах и
многих других клетках, приводящая к отсутствию экспрессии данного белка, не сопровождается серьезными клиническими последствиями, исключая условия стресса и необходимость ограничения потребления воды. Клиническая картина у мышей с нокаутированным геном AQP1 существенно отличается от наблюдаемой у человека: у животных развивается сильная полиурия. При нефрогенном мочеизнурении обнаружены мутации AQP2, затрагивающие структуру поры для воды или способность белка к транспортировке в плазматическую мембрану. Недостаточность экспрессии AQP2 также сопровождается мочеизнурением, а избыточная продукция AQP2 - к удержанию воды в организме (и соответственно отекам) при сердечной недостаточности и беременности.
ТРАНСПОРТЕРЫ МОЧЕВИНЫ
Мочевина составляет порядка 40 - 50% от всех компонентов мочи, и относительно плазмы крови она подвергается 60-кратному концентрированию в почках человека, на что затрачивается значительная доля энергозатрат почки. Концентрирование мочевины играет большую роль в сохранении воды в организме, в связи с чем факторы, регулирующие реабсорбцию воды (прежде всего вазопрессин), параллельно контролируют и перемещения мочевины в почках. Эти перемещения включают выход части мочевины из терминальных отделов собирательных трубочек в межклеточное пространство внутреннего медуллярного слоя почки и ее постоянное возвращение в этот слой путем рециркуляции, делая эту область гиперосмотичной, что облегчает реабсорбцию воды (рис. 12-13). Прохождение мочевины через клетки обеспечивается облегченной диффузией с помощью встраиваемых в плазматическую мембрану белковых транспортеров, представленных несколькими сплайсинговыми вариантами продуктов двух генов, UT-A и UT-B. Предполагается существование и «активного» транспорта мочевины, но подобные транспортеры пока не идентифицированы.
Вазопрессин служит внешним по отношению к почке фактором регуляции концентрирования мочи. В почке имеются и системы ауторегуляции концентрирования. Одним из компонентов таких систем служит белок, связывающий элемент, чувствительный к осмотическому давлению (osmotic response element-binding protein,
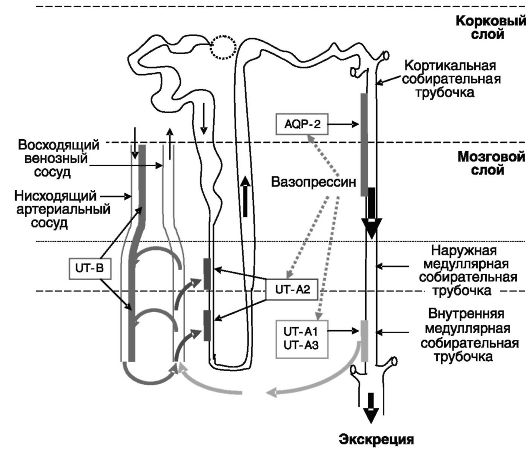 Рис. 12-13. Транспорт
и концентрирование мочевины в нефроне Транспортер мочевины UT-B
локализуется на клетках эндотелия нисходящего артериального сосуда.
Эндотелий восходящего венозного сосуда не является преградой для
мочевины. Транспортер UT-A2 локализуется на эпителиальных клетках
тонкого нисходящего колена петли Генле. Транспортеры UT-A1 и UT-A3
находятся на эпителиальных клетках терминальной части собирательных
трубочек. Вазопрессин через стимуляцию аквапорина-2 вызывает
концентрирование мочевины в собирательных трубочках, через стимуляцию
UT-A1 индуцирует поступление мочевины во внутренний медуллярный слой и
через стимуляцию UT-A2 повышает рециркуляцию мочевины.
Рис. 12-13. Транспорт
и концентрирование мочевины в нефроне Транспортер мочевины UT-B
локализуется на клетках эндотелия нисходящего артериального сосуда.
Эндотелий восходящего венозного сосуда не является преградой для
мочевины. Транспортер UT-A2 локализуется на эпителиальных клетках
тонкого нисходящего колена петли Генле. Транспортеры UT-A1 и UT-A3
находятся на эпителиальных клетках терминальной части собирательных
трубочек. Вазопрессин через стимуляцию аквапорина-2 вызывает
концентрирование мочевины в собирательных трубочках, через стимуляцию
UT-A1 индуцирует поступление мочевины во внутренний медуллярный слой и
через стимуляцию UT-A2 повышает рециркуляцию мочевины.
OREBP). Этот транскрипционный фактор экспрессируется преимущественно во внутреннем медуллярном слое. Его транскрипционная активность регулируется осмолярностью среды. При поступлении в организм достаточного количества воды осмолярность
среды снижается, и OREBP выходит из клеточного ядра в цитоплазму. Обратный процесс наблюдается при недостаточном поступлении воды. Мишенями для OREBP служат гены, обеспечивающие секрецию ряда осмолитических органических соединений (сорбита, бетаина и т.д.), которые защищают клетки от гипертонического стресса. Другая группа генов-мишеней перекрывается с мишенями для вазопрессина и включает гены аквапорина-2, UT-A1 и, возможно, UT-A2 (рис. 12-14). Таким образом, в условиях недостаточного поступления воды концентрирование мочи
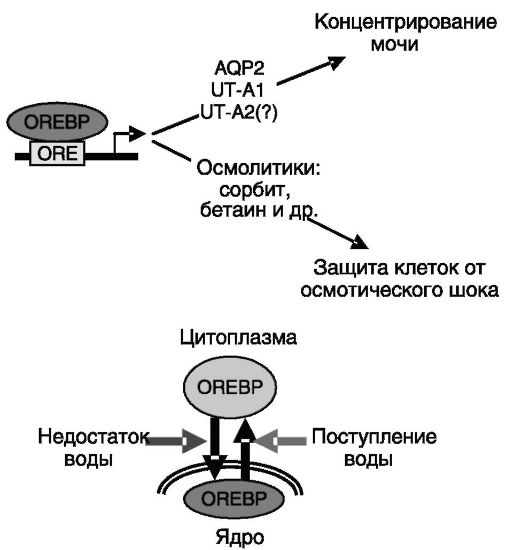 Рис. 12-14. Ауторегуляция концентрирования мочи с участием транскрипционного фактора OREBP
Рис. 12-14. Ауторегуляция концентрирования мочи с участием транскрипционного фактора OREBP
возрастает, а вода из мочи возвращается в кровь. Блокирование активности OREBP сопровождается полиурией и полидипсией. Механизм влияния осмотического давления на активность OREBP не установлен.
Общая схема регуляции обмена соли и воды представлена на рис.
12-15.
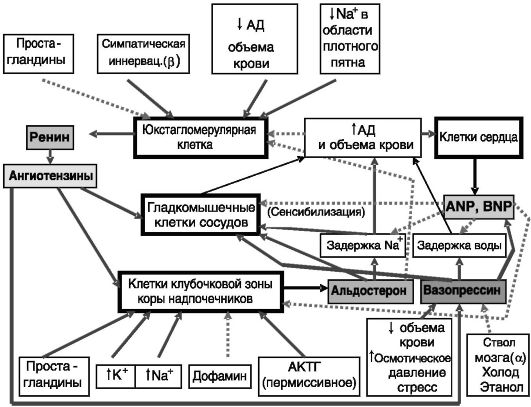 Рис. 12-15. Общая
организация системы регуляции водно-солевого обмена: АД - артериальное
давление; простые стрелки - стимуляция; пунктирные стрелки -
ингибирование
Рис. 12-15. Общая
организация системы регуляции водно-солевого обмена: АД - артериальное
давление; простые стрелки - стимуляция; пунктирные стрелки -
ингибирование
ОБМЕН КАЛЬЦИЯ
Кальций является одним из наиболее представленных в организме минеральных соединений. В форме фосфата составляет основу минерального компонента костной ткани. Необходим для сокращения мышечных волокон, внутриклеточного перемещения и экзоцитоза секреторных везикул, включая синаптические пузырьки. Служит внутриклеточным посредником действия многих сигнальных соединений. Участвует в процессах деления клеток и их апоптоза.
Концентрация кальция в крови поддерживается на постоянном уровне с высокой точностью за счет баланса между всасыванием в кишечнике, реабсорбцией из мочи в почках и минерализацией/деми- нерализацией кости. Этот баланс обеспечивается с помощью самого кальция как сигнального соединения, а также ряда гормонов, наибо-
лее значимыми из которых являются ПТГ, кальцитонин и 1,25-диок- сивитамин D3 (рис. 12-16).
1а,25-дигидроксивитамин D3
Регуляция биосинтеза и деградации. Гормонально активная форма витамина D3, 1,25-(OH)2-D3, образуется в два этапа. Первый этап сводится к гидроксилированию витамина D3 в положении 25, происходящему в печени и катализируемому по меньшей мере 6 цитохромами P-450: CYP27A1, CYP2R1, CYP3A4, CYP2J3, CYP2C11, CYP2D25. У человека выявлена форма рахита, связанная с мутацией CYP2R1. Образовавшийся 25-OH-D3 обладает высоким сродством к транспортному белку плазмы крови витамин D-связывающему белку (DBP),
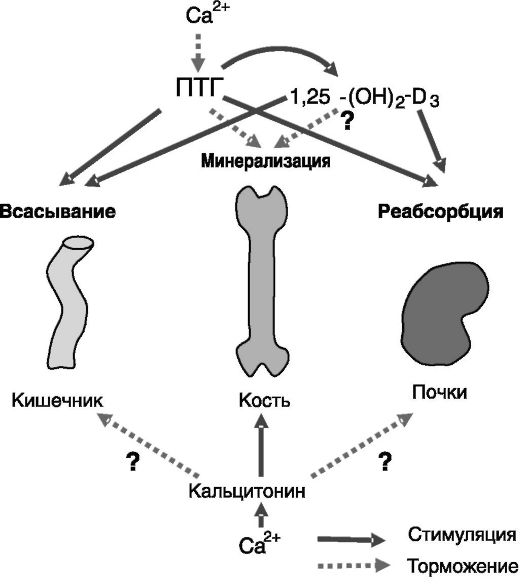 Рис. 12-16. Классическая схема системы ауторегуляции уровня кальция крови. Знаками вопроса отмечены воздействия, не получившие подтверждения
Рис. 12-16. Классическая схема системы ауторегуляции уровня кальция крови. Знаками вопроса отмечены воздействия, не получившие подтверждения
или транскальциферину, также секретируемому печенью, создающему значительный резерв предшественника 1,25-(OH)2-D3. DBP может также обеспечивать преимущественную доставку 25-OH-D3 к месту его дальнейшего активирующего метаболизма - в клетки эпителия проксимальных канальцев почек. Такая преимущественная доставка определяется тем, что комплексы 25-OH-D3 с DBP фильтруются в первичную мочу в клубочках и подвергаются реабсорбции в проксимальных канальцах путем эндоцитоза с помощью мегалина - белка семейства рецептора ЛНП. В отсутствие мегалина возрастает экскреция 25-OH-D3 и DBP и развивается повреждение костной ткани (рис. 12-17).
Вторым этапом биосинтеза 1,25-(OH)2-D3 является гидроксилирование 25-OH-D3 в положении 1α, катализируемое митохондриальным цитохромом P-450, CYP27B1. Недостаточность фермента вызывает одну из форм рахита - рахит с ложной недостаточностью витамина D. Данный фермент экспрессируется не только в проксимальном отделе нефрона, но и в дистальных канальцах и собирательных трубочках, а также в ряде других органов: в кератиноцитах кожи, децидуальных клетках матки, трофобластах и синцитиотрофобластах, паращитовидной железе, островках поджелудочной железы, мозговом слое надпочечников, ободочной кишке, мозжечке, коре мозга. Упоминавшийся выше эндоцитоз комплексов 25-OH-D3 с DBP клетками проксималь-
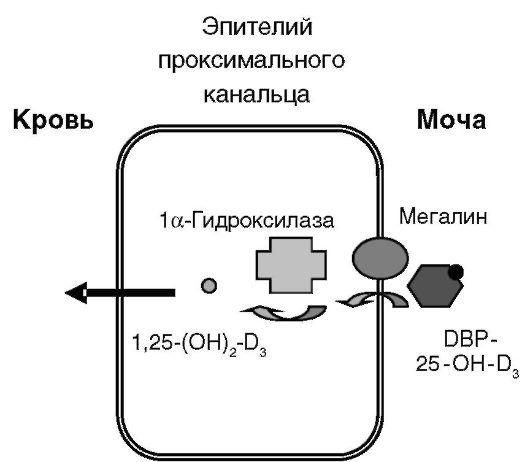 Рис. 12-17. Механизм преимущественного синтеза 1,25-(OH)2-D3 в проксимальных канальцах почек
Рис. 12-17. Механизм преимущественного синтеза 1,25-(OH)2-D3 в проксимальных канальцах почек
ных канальцев почек, по-видимому, определяет преимущественное образование системного 1,25-(OH)2-D3 именно в данном отделе нефрона. Образующийся в других отделах нефрона и других органах 1,25- (OH)2-D3 выполняет предположительно ауто/паракринную функцию.
Экспрессия 1а-гидроксилазы проксимальных канальцев стимулируется ПТГ, кальцитонином и ингибируется высоким уровнем кальция, провоспалительными цитокинами и продуктом катализа, 1,25-(OH)2-D3 (рис. 12-18). Позитивный контроль со стороны паратгормона включает цАМФ-зависимое фосфорилирование и активацию транскрипционного фактора CREB. Негативный контроль факторами воспаления включает активацию транскрипционного фактора NF-kB, взаимодействующего с промотором гена фермента. Фермент с иной локализацией может иметь другую регуляцию. Так, в предстательной железе ни ПТГ, ни кальций не влияют на экспрессию гена 1а-гидроксилазы, хотя 1,25-(OH)2-D3 сохраняет способность ингибировать экспрессию.
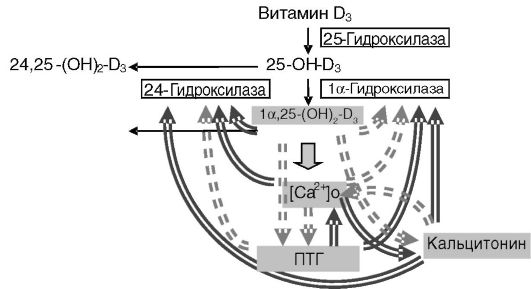 Рис. 12-18. Взаимосвязи эндокринных компонентов системы регуляции обмена кальция:
Рис. 12-18. Взаимосвязи эндокринных компонентов системы регуляции обмена кальция:
простые стрелки - превращения витамина D3; двойные стрелки - стимуляция; двойные пунктирные стрелки - ингибирование
Другим способом регуляции уровня гормонально активной формы витамина D3 является альтернативное гидроксилирование прогормона, 25-OH-D3, и инактивирующее гидроксилирование гормона 1,25- (OH)2-D3 в положении 24, катализируемое цитохромом P-450, CYP24. Образующиеся продукты, 24,25-(OH)2-D3 и 1,24,25-(OH)3-D3, обладают
слабой гормональной активностью. 24-Гидроксилаза экспрессируется приблизительно в тех же органах и клетках, что и 1а-гидроксилаза, а также в клетках-мишенях для 1,25-(OH)2-D3. Регуляция активности фермента происходит преимущественно на транскрипционном уровне и в целом обратна регуляции 1а-гидроксилазы. В регуляции системного уровня 1,25-(OH)2-D3 существенную роль играет 24-гидрок- силаза проксимальных отделов нефрона. 1,25-(OH)2-D3 значительно повышает транскрипцию гена 24-гидроксилазы за счет наличия в промоторе двух чувствительных к витамину D элементов. ПТГ подавляет активность фермента за счет снижения стабильности его мРНК. В дистальных отделах нефрона, а также в ряде других органов стимулирующее действие 1,25-(OH)2-D3 может, напротив, усиливаться ПТГ. В кишечнике экспрессия фермента подавляется кальцитонином.
Рецепция 1,25-(OH)2-D3 Рецептор 1,25-(OH)2-D3 (VDR) относится с суперсемейству ядерных рецепторов. VDR взаимодействует с витамин D-чувствительными элементами (VDRE) регуляторных областей компетентных генов, представленных прямыми гексануклеотидными повторами, разделенными спейсером из трех нуклеотидов. В отсутствие лиганда с VDRE связываются гомодимеры VDR. В присутствии лиганда связи между мономерами рецептора ослабевают, и на VDRE формируются гетеродимеры из VDR и рецептора X ретиноидов (RXR). Хотя в данном комплексе RXR не взаимодействует со своим лигандом (9-цис-ретиноевой кислотой), но конформация RXR под действием VDR меняется так, как если бы RXR был связан с лигандом. В результате оба партнера по димеризации взаимодействуют с корегуляторами и участвуют в регуляции транскрипции. VDR экспрессируется во всех органах и тканях, связанных с обменом кальция, а также во многих других тканях. Регуляция экспрессии VDR тканеспецифична. В почках экспрессия VDR позитивно регулируется собственным лигандом (1,25-(OH)2-D3) и кальцием, а также эстрогенами. Аналогично действуют 1,25-(OH)2-D3 и кальций в паращитовидной железе. В кишечнике ни 1,25-(OH)2-D3, ни кальций, по-видимому, не влияют на экспрессию VDR. В хондроцитах и остеобластах экспрессия VDR стимулируется паратгормоном.
Паратгормон
ПТГ секретируется паращитовидными железами в ответ на снижение уровня внеклеточного кальция и 1,25-(OH)2-D3 в системном кровотоке. Негативная регуляция со стороны 1,25-(OH)2-D3 обеспе-
чивается наличием в регуляторной области гена ПТГ двух негативных витамин D-чувствительных элементов (nVDRE). Взаимодействие с ними комплексов RXR/VDR/1,25-(OH)2-D3 приводит к вытеснению из комплексов с ДНК позитивно действующего транскрипционного фактора NF-Y. Негативная регуляция со стороны кальция определяется действием мембранного рецептора кальция, CaR . В результате связывания кальция CaR активирует взаимодействующий с промотором гена транскрипционный фактор CREB, который, в свою очередь, рекрутирует коактиватор p300. p300 и/или ассоциированная с ним ацетилтрансфераза ацетилируют белок APE1, что способствует его прочному связыванию с негативными кальцийчувствительными элементами (nCaRE) промотора гена ПТГ. Связанные с APE1 гистондеацетилазы способствуют конденсации хроматина, препятствующей транскрипции (рис. 12-19).
Рецепторы паратгормона. Клонировано 2 рецептора ПТГ, ПТГ-Рц1 и ПТГ-Рц2, относящиеся к надсемейству рецепторов, сопряженных с G-белками. ПТГ-Рц1 в одинаковой мере связывает ПТГ и ПТГ-рП и экспрессируется в органах и тканях, связанных с обменом кальция, а также служащих объектами регуляции со стороны пара/аутокринного фактора ПТГ-рП. ПТГ-Рц связывает только паратгормон (и тубероинфундибулярный пептид 39) и экспрессируется преимущественно в мозгу,
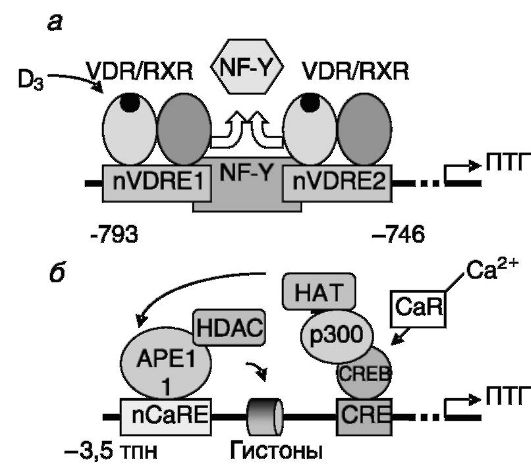 Рис. 12-19. Негативная регуляция экспрессии гена ПТГ:
Рис. 12-19. Негативная регуляция экспрессии гена ПТГ:
а - 1,25-(OH)2-D3 вызывает вытеснение позитивного регулятора NF-Y; б - Ca2+ через ацетилирование белка APE1 вызывает конденсацию хроматина
поджелудочной железе, семенниках, плаценте, а также в клетках сосудов. Особенностью функционирования ПТГ-Рц1 является его способность активировать фосфолипазу без участия G-белков. Эта способность реализуется через регуляторные факторы натрий/водородного обменника (NHERFs), которые одновременно взаимодействуют с рецептором и фосфолипазой. Параллельно через G-белки рецептор может регулировать другие сигнальные пути в клетке. Ген ПТГ-Рц1 содержит по меньшей мере 3 промотора, что создает дополнительные возможности для тканеспецифичной регуляции экспрессии ПТГ-Рц1. В костной ткани и почках активен преимущественно проксимальный промотор P3.
Сенсор кальция
Уровень кальция крови [Ca2+]0 поддерживается с высокой точностью (отклонения 1 - 2%) благодаря наличию на плазматической мембране клеток паращитовидной железы, C-клеток щитовидной железы, почек, кишечника, костной ткани сенсора [Ca2+]0, связанного с регуляцией обмена кальция. Этот сенсор (рецептор кальция, CaR) представляет собой интегральный мембранный белок надсемейства рецепторов, сопряженных с G-белками. В отличие от рецепторов большинства других сигнальных соединений CaR связывает лиганд с весьма низким сродством (Kd в миллимолярной области), что соответствует нормальным концентрациям кальция в крови. Экспрессия гена CaR может регулироваться кальцием, 1,25-(OH)2-D3, ПТГ. Внутриклеточные фрагменты CaR содержат сайты фосфорилирования ПК-C, что предполагает возможность регуляции активности данного рецептора собственным лигандом на посттрансляционном уровне.
Система проведения сигнала с участием CaR включает ингибирование активности аденилатциклазы, стимуляцию активности фосфолипаз C, A2 и D, увеличение концентрации внутриклеточного кальция и активацию ПК-C. Активность CaR направлена на поддержание гомеостаза кальция крови, но может быть связана и с иными функциями разнообразных клеток, экспрессирующих этот сенсор кальция.
Обмен кальция в костной ткани
Костная ткань подвергается постоянному процессу обновления (ремоделирования), заключающемуся в рассасывании каждые 2 - 3 года небольших фрагментов кости с почти одновременным формированием новой ткани. Этот процесс обеспечивается функционированием двух типов клеток: остеокластов, резорбирующих кость, и осте-
областов, восстанавливающих ее. Полный цикл обновления участка кости занимает 4 - 8 мес. На I этапе (фаза активации) происходят пролиферация и активация предшественников остеокластов, миграция остеокластов в зону резорбируемого участка. На II этапе (фаза резорбции) осуществляется разрушение сначала неорганического, а затем и органического компонента кости с участием кислот и лизосомальных ферментов остеокластов. На III этапе в образованной полости появляются остеобласты за счет их пролиферации и миграции. Остеобласты формируют органический матрикс, минерализующийся через 5 - 10 дней. Зрелая форма остеокластов (многоядерные клетки) образуется за счет слияния менее дифференцированных моноядерных клеток-предшественников. Прямыми стимуляторами формирования остеокластов служат гемопоэтические цитокины (интерлейкины, факторы, стимулирующие рост колоний, - CSFs, фактор стволовых клеток). Остеопороз - процесс снижения степени минерализации кости, происходящий за счет отставания костеобразующей активности остеобластов от резорбирующей активности остеокластов.
Паратгормон и 1,25-диоксивитамин D3. Секреция ПТГ стимулируется снижением кальция крови, сенсором которого служит мембранный рецептор кальция, CaR. ПТГ увеличивает переход кальция и фосфата из кости в кровь, повышает реабсорбцию кальция и экскрецию фосфата и бикарбоната в почках (последний эффект - за счет ингибирования Na/Pi-котранспорта и Na/H-обмена в проксимальных канальцах), индуцирует 1а-гидроксилазу витамина D3 в почках, что приводит к повышению образования гормонально активной формы этого витамина. 1,25-(OH)2-D3 - стимулятор всасывания кальция в кишечнике, реабсорбции в почках, пермиссивный фактор в действии ПТГ на кость. ПТГ и 1,25-(OH)2-D3 оказывают на остеокласты двойное действие: на ранней стадии они прямо увеличивают пролиферацию и дифференцировку предшественников остеокластов, а на более поздней стадии дифференцировки оказывают непрямое действие через остеобласты или стромальные клетки. Именно остеобласты, но не зрелые остеокласты экспрессируют ПТГ-Рц. Под действием ПТГ в остеобластах снижается синтез коллагена, остеокальцина и щелочной фосфатазы, повышается синтез коллагеназы. Внутриклеточными посредниками ПТГ служат цАМФ и Ca2+. Паракринными посредниками действия ПТГ на остеокласты, очевидно, служат цитокины (например ИЛ-6) и хемокины (например, белок 1 хемотаксиса моноцитов, MCP-1), хотя полный спектр этих факторов не установлен.
Кальцитонин. Секреция кальцитонина С-клетками щитовидной железы стимулируется повышением концентрации кальция в крови, глюкагоном и пентагастрином (которые упреждают подъем кальция в крови за счет его поступления с пищей). Кальцитонин тормозит резорбцию матрикса кости и высвобождение кальция и фосфата и повышает вхождение кальция и фосфата в кость. Мишенью для кальцитонина служат остеокласты, экспрессирующие соответствующий рецептор, а также предшественники остеокластов, терминальная дифференцировка которых тормозится кальцитонином. Внутриклеточным посредником действия кальцитонина служит цАМФ. Паракринным посредником действия кальцитонина на остеобласты служит пептид, связанный с геном кальцитонина, стимулирующий аккумуляцию цАМФ в остеобластах.
Глюкокортикоиды. До половины пациентов с болезнью Иценко - Кушинга (избыточная продукция глюкокортикоидов) и больных, хронически принимающих глюкокортикоиды, страдают остеопорозом. Глюкокортикоиды тормозят захват кальция кишечником и реабсорбцию кальция в почках (ингибируя действие ПТГ), ингибируют функцию остеобластов и, в частности, продукцию этими клетками коллагена. Глюкокортикоиды тормозят дифференцировку клеток-предшественников в остеобласты, сокращают период активности остеобластов.
Тиреоидные гормоны. При гипертиреозе процессы обновления кости значительно ускоряются за счет увеличения количества остеокластов и стимуляции активности остеобластов. Суммарный баланс кальция при этом оказывается отрицательным, что сопровождается остеопорозом.
Инсулин и инсулиноподобный фактор роста I. При диабете 1-го типа нередко наблюдается остеопороз. Рецептор инсулина обнаружен в остеобластах. Остеобласты чувствительны также к стимулирующему действию ИФР-I, который вызывает их пролиферацию и синтез белка.
Половые гормоны. В период постменопаузы у женщин часто наблюдаются отрицательный баланс кальция и остеопороз. Отчасти это связано со снижением уровня кальцитонина из-за падения концентрации эстрогенов. Эстрогены оказывают прямое стимулирующее влияние на продукцию кальцитонина С-клетками щитовидной железы. Остеопороз развивается и при других состояниях, сопровождающихся снижением функции яичников (позднее менархе, овариэктомия, гиперпролактинемия). У мужчин концентрация кальцитонина
выше, чем у женщин. Снижение продукции андрогенов у мужчин (первичный и гипофизарный гипогонадизм, гиперпролактинемия) также сопровождается остеопорозом. Второй механизм влияния эстрогенов на костную ткань заключается в прямой стимуляции остеобластов. Остеобласты экспрессируют Э-Рц. Пара/аутокринными посредниками действия эстрогенов на костную ткань служат, видимо, ИЛ-1 и 6, ФНО-а, ИФР-II, ТФР-β. Андрогены действуют на костную ткань преимущественно опосредованно, за счет предварительного превращения в эстрогены ароматазой остеобластов. Вместе с тем опыт клинического применения антиандрогенов (например, при лечении рака предстательной железы) показывает, что андрогены могут стимулировать костную ткань и самостоятельно.
Регуляция обмена кальция в почках и кишечнике
Реабсорбция кальция в почках. Реабсорбция кальция в почках происходит парацеллюлярным и трансцеллюлярным путем (рис. 12-20).
Парацеллюлярный обратный захват Ca2+ происходит в восходящем колене петли Генле нефрона и энергетически поддерживается разностью потенциалов на апикальной (+) и базолатеральной (-) мембранах клеток канальца (рис. 12-21). Эта разность создается благодаря электрогенности системы из транспортеров Na+,K+ и Cl-. Таким образом, управление реабсорбцией Ca2+ может быть достигнуто посредством регуляции захвата Na+ в данном отделе нефрона. Основными стимуляторами реабсорбции Na+ (а значит, и Ca2+) являются гормональные факторы (глюкагон, β-адренергические соединения, ПТГ, вазопрессин и т.д.), повышающие активность аденилатциклазы. Обратное действие оказывают факторы, подавляющие активность аденилатциклазы и/ или увеличивающие уровень внутриклеточного кальция и активность фосфолипаз. Одним из таких факторов служит кальций крови, действующий через сенсор кальция, локализованный на базолатеральной мембране. Его активация, с одной стороны, подавляет активность аденилатциклазы клеток канальцев, а с другой - ингибирует активность транспортеров ионов. Прямой эффект Ca2+ на почки усиливается торможением кальцием через CaR секреции паратгормона (рис. 12-22).
Трансцеллюлярная реабсорбция Ca2+ происходит в дистальных отделах нефрона (дистальных извитых канальцах, соединительных и собирательных трубочках). Энергетически транспорт поддерживается работой Na+/К+-АТФазы и Ca2+-АТФазы, локализованных на базолатеральной мембране эпителиальных клеток. Экспорт Ca2+ из клеток в
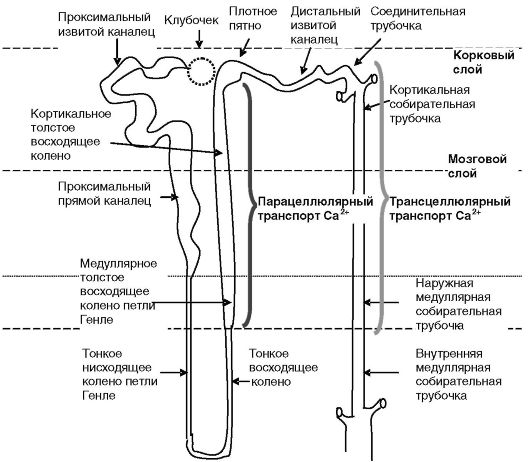 Рис. 12-20. Области транспорта кальция в нефроне
Рис. 12-20. Области транспорта кальция в нефроне
кровь осуществляется Na+/Ca2+-обменником (NCX) и Ca2+-АТФазой (PMCA). Вхождение Ca2+ в клетки через апикальную мембрану происходит через специализированные каналы TRPV5 и 6 (рис. 12-23). Перемещение Ca2+ внутри клеток происходит с участием растворимых кальцийсвязывающих белков кальбиндинов D (9K и 28K), причем, как полагают, кальбиндин D (9K) постоянно находится в примембранном пространстве, а кальбиндин D (28K) осуществляет челночные перемещения внутри клетки. Эффективность работы TRPV ингибируется кальцием при участии кальмодулина или еще одного кальцийсвязывающего белка, 80K-H. Одной из функций кальбиндинов, по-видимому, является обеспечение оттока кальция от каналов, снимающее ингибирование (рис. 12-23, 12-24). Кальбиндины, кроме того, снижают уровень свободного кальция в клетке. В противном случае кальций мог бы оказывать цитотоксичное действие.
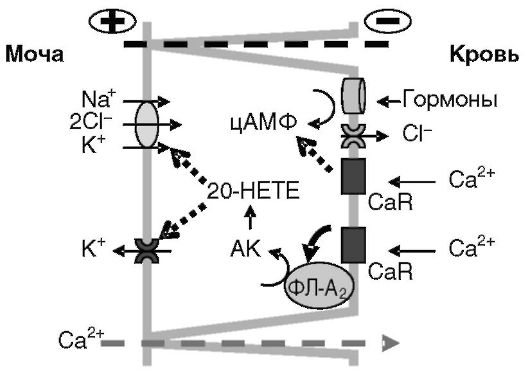 Рис. 12-21. Предполагаемый механизм регуляции кальцием крови парацеллюлярной реабсорбции Ca2+ из мочи
Рис. 12-21. Предполагаемый механизм регуляции кальцием крови парацеллюлярной реабсорбции Ca2+ из мочи
Через свой сенсор (CaR) Ca2+ подавляет стимулируемую гормонами (через цАМФ) реабсорбцию Na+; активируя фосфолипазу A2, способствует аккумуляции арахидоновой кислоты (AK), метаболит которой (предположительно 20-HETE) ингибирует активность Na+/K+/2Cl- котранспортера и K+ канала апикальной мембраны. Положительный потенциал на люминальной поверхности клеток снижается, что снижает парацеллюлярный перенос Ca2+
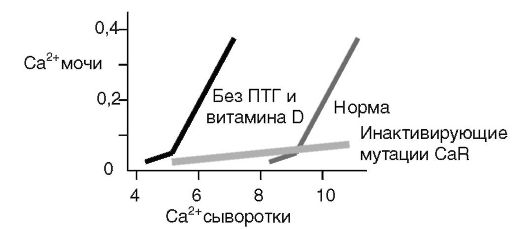 Рис 12-22. Роль гормонов и сенсора Ca2+ в регуляции реабсорбции кальция в почках
Рис 12-22. Роль гормонов и сенсора Ca2+ в регуляции реабсорбции кальция в почках
Элементы системы трансцеллюлярного транспорта стимулируются на транскрипционном уровне кальцием крови и гормональной формой витамина D3. Активность TRPV может также регулироваться путем изменения распределения между и внутриклеточным, и мембранным пулами. Известное кальцийсохраняющее действие эстрогенов отчасти связано со стимуляцией этими гормонами экспрессии TRPV5 в почках.
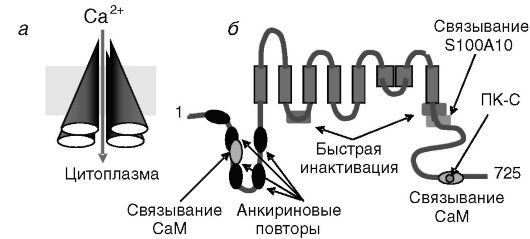 Рис. 12-23. Архитектура кальциевого канала TRPV6 (=CAT1) (а). Функциональные элементы субъединицы канала (б).
Рис. 12-23. Архитектура кальциевого канала TRPV6 (=CAT1) (а). Функциональные элементы субъединицы канала (б).
Ингибирование канала кальцием происходит прямо и через кальмодулин (CaM). Фосфорилирование ПК-C задерживает инактивацию. Связывание белка S100A10 обеспечивает встраивание в плазматическую мембрану.
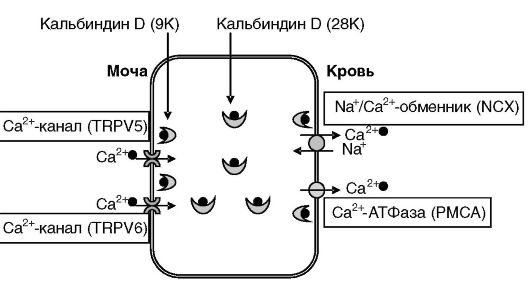 Рис. 12-24. Трансцеллюлярный транспорт кальция в дистальном отделе нефрона.
Рис. 12-24. Трансцеллюлярный транспорт кальция в дистальном отделе нефрона.
Кальций поступает в клетки из мочи через каналы TRPV5 и 6. В примембранной области кальций связывается с кальбиндином D (9K) и затем переносится к базолатеральной мембране кальбиндином D (28K). Посредством кальбиндина D (9K) кальций доставляется к транспортерам Na+/Ca2+- обменнику (NCX) и Ca2+-АТФазе (PMCA), экскретирующим кальций в кровь. Экспрессия элементов системы стимулируется кальцием и 1,25- (OH)2-D3.
Тетрамерные, содержащие 6 трансмембранных доменов, кальциевые каналы TRPV5 и 6 относятся к семейству белков, 4 остальные известные члены которого являются неселективными каналами и служат сенсорами: VR1, VRL-1 и TRPV3 активируются повышенной температурой в разных диапазонах, а OTRPC4 активируется при гипоосмотических условиях. Сходную с TRPV5 и 6 архитектуру имеют также активируемые гиперполяризацией и управляемые циклическими нуклеотидами каналы K+ (HCN и CNG), потенциалзависимые и активируемые Ca2+ каналы K+ (KCN). TRPV5 и/или 6 экспрессируются в клетках, осуществляющих трансцеллюлярный транспорт кальция (клетки кишечника, почек, плаценты), а также в клетках органов с экзокринными функциями (клетки поджелудочной, слюнной, предстательной, молочной железы, желудка). Предполагается, что TRPV5 и 6 могут обеспечивать обратный захват клетками кальция, выделившегося из клеток в составе секреторных везикул. Допускается также, что данные каналы могут служить одним из элементов так называемого управляемого хранилищем входа Ca2+ - явления мультипликации действия сигналов, высвобождающих Ca2+ из внутриклеточных депо, за счет увеличения вхождения в клетку внеклеточного Ca2+.
Значительное увеличение концентрации кальция в моче могло бы вызывать образование почечных камней. Компенсаторный механизм включает ингибирующее действие кальция крови через CaR на антидиуретическое действие вазопрессина в собирательных трубочках нефрона. В результате моча оказывается более разбавленной, и соли кальция не выпадают в осадок (рис. 12-25).
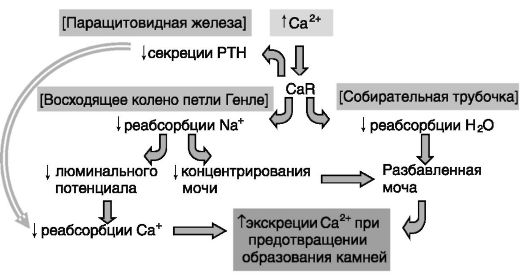 Рис. 12-25. Координированная регуляция обмена кальция и воды
Рис. 12-25. Координированная регуляция обмена кальция и воды
Транспорт кальция в кишечнике в целом сходен с описанным выше для почек и включает пара- и трансцеллюлярный пути. Преобладающим каналом кальция в трансцеллюлярном пути служит TRPV6 (лимитирующее звено пути). Внутриклеточный транспорт осуществляется с участием кальбиндинов D (9K и 28K). Экспорт в кровь происходит благодаря работе Ca2+-АТФазы (PMCA). Вклад Na+/Ca2+ - обменника (NCX), по-видимому, невелик. Экспрессия указанных элементов транспорта стимулируется 1,25-диоксивитамином D3 и кальцием, а также эстрогенами, оказывающими остеопротекторное действие.
ОБМЕН ФОСФАТА
Приблизительно 85% фосфата в организме локализовано в костной ткани, 14% - в клетках мягких тканей, 1% - во внеклеточных жидкостях. 30% фосфата крови находится в неорганической форме (Pi) и 70% - в органической, преимущественно в эритроцитах. Pi плазмы крови на 20% представлен моновалентной (H2PO4- )и на 80% двухвалентной (HPO42-) формами. Регуляция обмена фосфата осуществляется параллельно с регуляцией обмена кальция, но не идентична ему. Регуляция происходит на уровне всасывания в кишечнике, минера- лизации/деминерализации костной ткани и реабсорбции в почках.
Реабсорбция Pi в почках происходит преимущественно в проксимальных канальцах (60-70% Pi фильтрата). 10-20% Pi реабсорбируется в дистальных отделах нефрона. Лимитирующей стадией реабсорбции Pi является зависимый от Na+ транспорт через апикальную мембрану. Клонировано несколько Na/Pi котранспортеров, которые делят на три группы: I (NaPi-1), II (NaPi-IIa, -IIb и -IIc) и III (PiT-1 и 2). PiT-1/2 дополнительно играют роль рецепторов ретровирусов. В проксимальном отделе нефрона экспрессируются NaPi-1, NaPi-IIa, NaPiIIc (апикальная мембрана) и PiT-1 и 2 (базолатеральная мембрана; рис. 12-26). Функциональное значение NaPi-1 остается неясным. Ведущую роль в регулируемом транспорте Pi играет NaPi-IIa (~70%). В период отъема от груди временно возрастает вклад NaPi-IIc. NaPi-IIa переносит Na и Pi в стехиометрическом отношении 3:1 (электрогенный перенос), а NaPi-IIc - в отношении 2:1 (электронейтральный перенос).
Главными регуляторами транспортеров Pi служат уровень самого Pi и ПТГ. Регуляция происходит на транскрипционном и посттранскрипционном уровнях. ПТГ вызывает быстрый эндоцитоз NaPi-IIa и
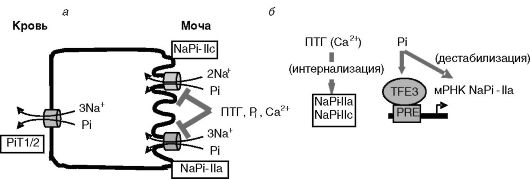 Рис. 12-26. Основные транспортеры фосфата в проксимальном отделе нефрона (а) и их регуляция (б)
Рис. 12-26. Основные транспортеры фосфата в проксимальном отделе нефрона (а) и их регуляция (б)
более медленный эндоцитоз NaPi-IIc, их перемещение в окаймленные клатрином везикулы и разрушение в лизосомах. В проведении сигнала участвуют рецепторы ПТГ, локализованные и на апикальной, и на базолатеральной мембранах клеток. Сигнал проводится с участием ПК-A и C. В интернализации принимает участие небольшой фарнезилированный белок пероксисом (PEX19), непосредственно взаимодействующий с транспортером. Действие ПТГ потенцируется сенсором кальция CaR.
Высокий уровень Pi в пище подавляет экспрессию транспортера NaPi-IIa. В промоторе гена NaPi-IIa выявлен фосфатчувствительный элемент (PRE), с которым взаимодействует транскрипционный фактор TFE3. Уровень TFE3 ингибируется фосфатом. Эксперименты с мышами, у которых гены 1а-гидроксилазы и рецептора витамина D3 были нокаутированы, показали, что ингибирующий эффект пищевого фосфата на транспортеры фосфата в почках (NaPi-IIa) и кишечнике (NaPi-IIb) не опосредуется 1,25-(OH)2-D3, хотя повышение фосфата пищи подавляет 1а-гидроксилазу и уровень 1,25-(OH)2-D3. Сенсор фосфата остается неизвестным. Допускается, что таким сенсором может служить транспортер фосфата PiT2.
В 5'-нетранслируемой области мРНК NaPi-IIa выявлена последовательность, обеспечивающая нестабильность. Увеличение поступления фосфата с пищей ведет к снижению связывания с этой областью белков и дестабилизации мРНК.
Важным регулятором транспорта фосфата служит ФРФ23, который подавляет захват фосфата клетками почек и кишечника и действует независимо от ПТГ. Уровень самого ФРФ23 позитивно регулируется фосфатом пищи.
Сведения о влиянии 1,25-(OH)2-D3 на обмен фосфата противоречивы. По-видимому, хронический избыток гормональной формы витамина D3 аддитивно с ПТГ подавляет уровень транспортера NaPiII и тем самым стимулирует экскрецию фосфата.
В костной ткани распределение транспортеров фосфата зависит от функций клеточных элементов. В остеобластах, осуществляющих восстановление костной ткани, экспрессируются транспортеры PiT1 и PiT2. В остеокластах выявлена новая транспортная система, независимая от натрия, но связанная с транспортом протонов. Ее активность возрастает в кислой среде, создаваемой остеокластами для резорбции кости, что обеспечивает согласованность усиленного образования ионов фосфата и их удаления остеокластами.
Рекомендуемая литература
Feraille E., Doucet A. Sodium-potassium-adenosinetriphosphatase-dependent sodium transport in the kidney: hormonal control. Physiol Rev. 2001;81(1): 345 - 418.
Gamba G. Molecular physiology and pathophysiology of electroneutral cation-
chloride cotransporters. Physiol Rev. 2005;85(2):423 - 493.
Hebert S.C., Brown E.M., Harris H.W. Role of the Ca(2+)-sensing receptor in divalent mineral ion homeostasis. J Exp Biol. 1997;200(Pt 2):295 - 302.
Heymann J.B., Engel A. Aquaporins: Phylogeny, Structure, and Physiology of Water Channels. News Physiol Sci. 1999;14:187 - 193.
Miyamoto K., Segawa H., Ito M., Kuwahata M. Physiological regulation of renal sodium-dependent phosphate cotransporters. Jpn J Physiol. 2004; 54(2):93 -102.
Peng J.B., Brown E.M., Hediger M.A. Epithelial Ca2+ entry channels: transcellular Ca2+ transport and beyond. J Physiol. 2003;551(Pt 3):729 - 740.
Yang B., Bankir L. Urea and urine concentrating ability: new insights from studies in mice. Am J Physiol Renal Physiol. 2005;288(5):F881 - 896.