Эндокринная регуляция. Биохимические и физиологические аспекты : учеб. пособие / А.Н. Смирнов ; под ред. В.А. Ткачука - 2009. - 368 с.
|
|
|
|
ГЛАВА 2. ПОЛОВАЯ ДИФФЕРЕНЦИРОВКА
ГЕНЕТИЧЕСКАЯ ДЕТЕРМИНАЦИЯ ПЕРВИЧНОГО ПОЛА
Канализация развития гонад
Канализация развития осуществляется с участием управляющих генов (master genes). У мух тип половых клеток и соматический пол определяются соотношением X- и аутосом. Ведущим механизмом является альтернативный сплайсинг продуктов транскрипции регуляторных генов.
Сигнал канализации не обязательно имеет генетическую природу: у ряда рептилий таким сигналом является температурный режим развития яйца. У крокодила, некоторых ящериц повышение температуры приводит к развитию самцов, у черепах - самок. Даже у живородящей ящерицы температура среды, в которой обитает мать, оказывает влияние на соотношение самок и самцов в потомстве. Температурная зависимость направленности развития гонад выявлена также у некоторых рыб и амфибий. При данном способе канализации половой дифференцировки гонад имеется «критический период», соответствующий наличию сформированной потенциально бисексуальной прегонады в виде полового гребешка. Поступление дифференцирующего сигнала в этот период обеспечивает либо проникновение будущих половых клеток в медуллярный слой прегонады с формированием тестикулярных тяжей с участием эпителиальных клеток, дифференцирующихся затем в клетки Сертоли (развитие семенников), либо развитие коры прегонады с образованием структур, превращающихся затем в примордиальные фолликулы (развитие яичников). Изменения температуры инкубации яиц за границами критического периода не оказывают существенного влияния на половую дифференцировку гонад. Первичный «приемник» температурного режима не идентифицирован, но одним из посредников, по-видимому, служат эстрогены. Температура, способствующая формированию яичников, повышает экспрессию в прегонаде ароматазы - фермен-
та, превращающего андрогены в эстрогены (рис. 2-1). Введение в яйцо эстрогенов способствует формированию яичников, а введение антиэстрогенов или ингибиторов ароматазы ведет к формированию семенников. У садовой ящерицы половая дифференцировка гонад не зависит от температуры, но направленность действия вводимых извне половых гормонов - зависит. Виды, у которых половая дифференцировка гонад управляется температурным режимом, имеют кариотип, неразличимый у самцов и самок. Вместе с тем в гонадах будущих самцов экспрессия ортологов некоторых генов, характерных для дифференцирующихся семенников млекопитающих (например, SOX9 - см. ниже), преобладает над их экспрессией в гонадах будущих самок. Известны также переходные формы канализации полового развития. Так, у атлантического палтуса температурный режим влияет (через регуляцию экспрессии специфичного для яичников изозима ароматазы) на развитие яичников только у личинок с кариотипом XX, т.е. у этого вида доля мужского потомства может варьировать от 50 до 100%, а женского - от 0 до 50%.
У ряда ящериц, змей, а также у птиц канализация половой дифференцировки гонад определяется на генетическом уровне. Направление развития гонад зависит от генов половых хромосом: кариотип ZZ обеспечивает формирование семенников, а кариотип ZW - яичников. Предполагается, что для направленности дифференцировки важны как гены хромосомы W, так и доза генов хромосомы Z. Как и в случае видов с температурным управлением половой дифференцировки, важную роль в направлении развития гонад у птиц играют эстрогены: их раннее появление в прегонаде за счет экспрессии ароматазы индуцирует формирование яичников. Филогенетический след участия эстрогенов в «канализации» развития гонад обнаруживается и у мле-
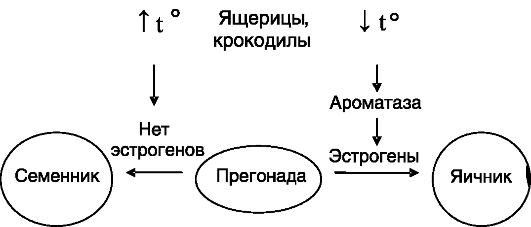 Рис. 2-1. Канализация половой дифференцировки температурным режимом
Рис. 2-1. Канализация половой дифференцировки температурным режимом
копитающих. Так, обработка эстрогеном новорожденных сумчатых (у которых еще не произошла дифференцировка прегонад) ведет к обращению пола генетических самцов с образованием овотестесов (гонад, включающих структуры, характерные для яичников и семенников). У более высокоорганизованных млекопитающих эстрогены в яичниках начинают продуцироваться уже после половой дифференцировки прегонад, и их функция, по-видимому, заключается в поддержании уже сформированной структуры яичников. В отсутствие эстрогенов или возможности их действия (у генетических самок мышей с кариотипом XX с нокаутом генов рецепторов эстрогенов α и β или ароматазы) в яичниках происходит трансдифференцировка интерстициальных и гранулезных клеток в клетки Лейдига и Сертоли.
У млекопитающих первичным сигналом канализации полового развития является наличие (у самцов) или отсутствие (у самок) Y-хро- мосомы. Y-хромосома определяет развитие из прегонады семенника (первичный мужской пол), андрогены которого вызывают половую дифференцировку соматических клеток (вторичный мужской пол или вторичные мужские половые признаки). Тип половых клеток определяется клеточным окружением (клетками семенника или яичника; рис. 2-2).
Следует отметить, что данный способ канализации половой дифференцировки гонад возник у млекопитающих не одномоментно. Предполагается, что половые хромосомы возникли из древних аутосом. У представителя однопроходных утконоса выявлено 5 пар половых хромосом, расходящихся при мейозе в виде связок. Эти X- и Y-хромосомы включают ортологи генов, характерных как для X- и Y-хромосом более высокоорганизованных млекопитающих, так и для половых хромосом Z и W птиц. Возникновение множества X- и Y- хромосом у утконоса связывают с разделением исходных половых
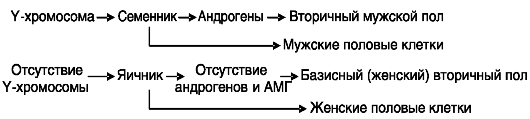 Рис. 2-2. У
млекопитающих первичный пол (тип гонад) определяется наличием (у
самцов) или отсутствием (у самок) Y-хромосомы. Вторичный (соматический)
мужской пол зависит от гормональных продуктов семенников, а женский - от
их отсутствия
Рис. 2-2. У
млекопитающих первичный пол (тип гонад) определяется наличием (у
самцов) или отсутствием (у самок) Y-хромосомы. Вторичный (соматический)
мужской пол зависит от гормональных продуктов семенников, а женский - от
их отсутствия
хромосом на части и перемещением на полученные фрагменты генетического материала с аутосом. И наоборот, часть генов, имеющихся в X-хромосоме млекопитающих, у утконоса локализована в аутосомах. Возможно, аналогичная система множественных половых хромосом имеется и у других представителей однопроходных (ехидны). Аберрантное образование связок половых хромосом при мейозе отмечалось и у приматов.
Факторы, участвующие в детерминации развития семенников, локализованы на конце короткого плеча Y-хромосомы, в зоне «обращения пола» (sex reversal, Sxr). Эта зона путем кроссинговера с гомологичной областью X-хромосомы при мейозе может приводить к появлению самцов с кариотипом XX. У человека мужчины с кариотипом XX встречаются с частотой 1:20 000. В зоне Sxr обнаружен ряд генов или их кластеров: локус Y-хромосомы детерминации семенников (testis-determining Y, Tdy), антигенов с мужской половой специфичностью: антигенов гистосовместимости Y-хромосомы (histocompatibility Y antigens, Hya) и серологически выявляемого антигена самцов (serologically detected male antigen, Sdma), сперматогенный ген Y-хро- мосомы (spermatogenic gene from Y chromosome, Spy), необходимый для нормального сперматогенеза, а также гены Y-хромосомы белков 1 и 2, содержащих цинковые пальцы (zinc-finger-containing Zfy-1, Zfy-2). Ген гистосовместимости HY, которому ранее приписывали ведущую роль в дифференцировке семенников, локализован в проксимальной части длинного плеча Y-хромосомы. В области Tdy обнаружен ген, названный детерминирующей пол областью Y-хромосомы (sexdetermining region of the Y chromosome, Sry), который, по-видимому, служит исходным пунктом канализации полового развития.
Эта последовательность имеет область гомологии с генами транскрипционного фактора Mc и белков групп высокой мобильности HMG1 и HMG2 и кодирует транскрипционный регулятор. Область HMG соответствует ДНК-связывающему домену Sry, узнающему консенсусную последовательность AATAAC. Предполагается, что Sry может действовать путем рекрутирования белков, модулирующих транскрипцию. Вне Y-хромосомы у мыши обнаружено несколько гомологов Sry.
Экспрессия генов локуса Sdma Y-хромосомы начинается уже на 8-клеточной стадии развития зародыша. Эффект Y-хромосомы на дифференцировку семенников осуществляется в течение 1 - 2 дней после появления половой складки - полоски мезенхимы, прилегаю-
щей к мезонефросу. Первым типом клеток, дифференцирующихся из стромальных клеток по мужскому типу, являются клетки Сертоли, которые, агрегируя, формируют семенные канальцы.
Половая дифференцировка половых клеток, как отмечалось, определяется клеточным окружением. У самцов первичные половые клетки накапливаются в семенных канальцах, где превращаются в сперматогонии в G1-фазе мейоза. По-видимому, блокада мейоза предотвращает развитие первичных половых клеток в ооциты. Мейоз начинается лишь после рождения. У самок первичные половые клетки вступают в профазу мейоза еще на ранней стадии развития, после чего окружаются фолликулярными клетками. Мейоз возобновляется при половом созревании. Жизнеспособность половых клеток зависит от обеих половых хромосом: наличие лишь одной X-хромосомы у женщин (кариотипы XY и XO) приводит к деградации ооцитов и стерильности, отсутствие Y-хромосомы у мужчин (кариотипы XX и XOSxr) также ведет к стерильности. Детерминация семенников может происходить в отсутствие половых клеток, а детерминация яичников - лишь в присутствии половых клеток. В отсутствие половых клеток фолликулярные клетки могут трансдифференцироваться в клетки Сертоли. При контакте с растущими ооцитами возможна и обратная дифференцировка клеток Сертоли в фолликулярные клетки. Предшественники клеток Лейдига мигрируют в половую складку из мезонефроса при обязательном условии предварительной дифференцировки клеток Сертоли. Появление гермафродитов (крайне редкое событие) может происходить при смещении времени экспрессии генов в области Tdy относительно реализации программы развития яичников и одновременном присутствии в прегонаде двух типов стромальных клеток, например, у химер XX(..)XY или у мозаиков XY/X0. (У рептилий с управляемой температурой половой дифференцировкой особи с овотестесами - достаточно частое явление.)
Детерминирующие гонады факторы
Молекулярные механизмы формирования дифференцированных по полу гонад остаются неясными, хотя изучена динамика экспрессии ряда ключевых генов, локализованных на Y-, X-хромосомах и аутосомах. Допускается, что развитие гонад может быть результатом перекрестных взаимодействий регуляторных элементов, а не линейного каскада. Ниже приведены сведения в отношении некоторых из потенциальных факторов дифференцировки гонад.
Sry: экспрессия гена ассоциирована с пролиферацией клеток целомического эпителия прегонады, превращающихся затем в клетки Сертоли и интерстициальные клетки, и необходима для миграции этих клеток из мезонефроса в формирующийся семенник. Вторая волна экспрессии Sry в будущих клетках Сертоли определяет индукцию экспрессии гена Sox9, опосредующего дальнейшую дифференцировку клеток Сертоли. Полагают, что действие Sry может включать два механизма: функционирование в качестве транскрипционного фактора и в качестве фактора, изгибающего спираль ДНК, что обеспечивает взаимодействие между собой белков, локализованных на отдаленных участках ДНК.
Конкретные гены-мишени для Sry неизвестны. Неизвестно даже, действует ли данный белок в качестве активатора или репрессора транскрипции. Индукция экспрессии Sry в прегонаде осуществляется набором транскрипционных факторов, включающим, в частности, стероидогенный фактор 1 (SF1) и продукт гена 1 опухоли Уилма (Wilms tumor gene 1, WT1, см. ниже.). У человека 15-20% случаев 46.XY полной дисгенезии гонад связано с мутациями SRY. Приблизительно 2/3 мужчин с кариотипом 46.XX имеют транслокацию SRY с отцовской Y-хромосомы на отцовскую X-хромосому, что связано с обязательной рекомбинацией части X- и Y-хромосом при мейозе. При истинном гермафродитизме субъекты 46.XX, как правило, не содержат SRY.
Sox9 (сходный с блоком HMG SRY, SRY-like HMG Box): при нормальном развитии семенников служит посредником действия Sry. Экспрессия аутосомного гена транскрипционного фактора Sox9 у эмбрионов повторяет паттерн экспрессии Sry. Одна из гипотез, объясняющих стимулирующее действие Sry на экспрессию Sox9, предполагает, что Sry снимает ингибирующий эффект некоего репрессора, которым мог бы быть атипичный ядерный рецептор DAX1. Дупликация SOX9 может служить причиной чувствительного к дозе обращения пола (Ж→М) у особей с кариотипом 46.XX. Приблизительно 70% случаев 46.XY дисгенезиса гонад связано с мутациями SOX9. Интересно, что у человека обращение пола (M→Ж) происходит при инактивирующей мутации уже одного аллеля SOX9, а у мыши - только при выключении обоих аллелей. По-видимому, Sox9 служит посредником действия Sry: формирование семенников может быть достигнуто и в отсутствие экспрессии Sry, но при условии индукции Sox9.
АМГ (антимюллеров гормон): служит одним из поздних посредников действия Sox9. AMГ способен стимулировать миграцию клеток целомического эпителия в формируемый семенник, однако неизвест-
но, реализуется ли эта способность in vivo. Экспрессия AMГ в эмбриогенезе клетками Сертоли кооперативно стимулируется Sox9, SF-1, GATA4 и WT-1. DAX-1 блокирует синергизм SF-1 и GATA4 в действии на AMr. В период полового созревания негативными регуляторами экспрессии AMГ становятся андрогены, которые таким образом снимают ингибирующее влияние AMГ на мейоз. В женском организме измеримый уровень AMГ появляется только при половом созревании.
Рецепторы AMГ локализованы в мезенхимальных клетках, окружающих мюллеровы каналы - монопотенциальные зачатки части женского репродуктивного тракта, т.е. индукция AMГ апоптоза эпителия мюллеровых каналов осуществляется с помощью паракринного посредника. Нокаут или мутации генов AMr или его рецептора ведут к особой форме мужского ложного гермафродитизма - появлению внешне нормальных мужских особей с сохраненными производными мюллеровых каналов.
Помимо действия на мюллеровы каналы (внутриутробный период) в допубертатный период AMr выполняет функцию ограничителя дифференцировки клеток Лейдига и продукции ими андрогенов, блокируя тем самым возможность преждевременного полового созревания. Во взрослом женском организме AMГ ограничивает вовлечение фолликулов в развитие, продлевая тем самым репродуктивный период.
SF-1 (стероидогенный фактор 1): транскрипционный фактор класса ядерных рецепторов. Экспрессируется в гонадах, надпочечниках, гипоталамусе и гипофизе. Нокаут или мутации гена SF-1 сопровождаются агенезом гонад (женский фенотип 46.XY), гипоплазией надпочечников и нарушениями развития вентромедиального ядра гипоталамуса. Помимо участия в морфогенезе гонад SF-1 является необходимым фактором стимуляции тропными гормонами экспрессии ферментов стероидогенеза.
Экспрессия SF-1 появляется в недифференцированной прегонаде еще до начала экспрессии Sry, и SF-1 может быть одним из факторов, стимулирующих экспрессию Sry. После завершения детерминации пола гонад в семенниках экспрессия SF-1 сохраняется (снижаясь в клетках Сертоли и увеличиваясь в клетках Лейдига), тогда как в яичниках быстро снижается. Стимуляторами экспрессии SF-1 могут быть Sox9 и GATA4 (см. ниже), а ингибитором - DAX-1.
DAX-1 (ген 1 критической области чувствительного к дозе обращения пола и наследуемой гипоплазии надпочечников хромосомы X,
dosage-sensitive sex reversal-congenital adrenal hypoplasia critical region on the X chromosome, gene 1): транскрипционный фактор класса ядерных рецепторов, действующий как репрессор за счет взаимодействия со шпильковыми структурами ДНК и белковыми активаторами транскрипции. Спектр органов, в которых экспрессируется DAX-1, в целом совпадает с таковым для SF-1, причем SF-1 служит важным стимулятором экспрессии DAX-1. В развивающихся семенниках DAX-1 сначала экспрессируется в клетках Сертоли, а с началом стероидогенеза - в клетках Лейдига. Роль DAX-1 в детерминации пола не вполне ясна: как избыток, так и недостаток DAX-1 ведет к нарушениям половой дифференцировки.
Так, дупликация гена DAX-1 у генетических самцов мыши ведет к обращению пола (М- Ж), а делеция гена приводит к нарушениям структуры семенников, гиперплазии клеток Лейдига с увеличением экспрессии в них ароматазы и дегенерации зародышевого эпителия. В норме DAX-1 ингибирует стимулирующее действие SF-1 на экспрессию ароматазы и ряда других ферментов стероидогенеза и подавляет эффекты некоторых других факторов, необходимых для развития семенников (WT1, Sox9 и GATA4). У самок делеция гена DAX-1 не сказывалась на развитии яичников, и поэтому DAX-1 рассматривают как антитестикулярный фактор.
Wt1 (ген 1 опухоли Уилма, Wilm's tumor 1 gene) - транскрипционный фактор, кодируемый аутосомой. Необходим для развития гонад и почек. Экспрессируется в недифференцированных прегонадах генетических самцов и самок и служит индуктором экспрессии Sry.
Альтернативный сплайсинг может влиять на наличие/отсутствие трех аминокислот, Lys, Thr, Ser (KTS), между цинковыми пальцами 3 и 4. Вариант с отсутствием этих аминокислот (WT1(+KTS)) действует как транскрипционный фактор, а вариант с их наличием (WT1(+KTS)), как полагают, участвует в процессинге РНК. Оба варианта необходимы для полного развития семенников, но для дифференцировки прегонады в семенник необходим лишь вариант (WT1(+KTS)), в отсутствие которого наблюдается полное обращение пола (М- Ж). Предполагается, что WT1(-KTS) стимулирует экспрессию Sry, а WT1(+KTS) обеспечивает процессинг или стабильность мРНК Sry.
GATA4 (белок 4, связывающий мотив GATA в ДНК): транскрипционный фактор, содержащий 2 цинковых пальца. Экспрессия начинается в еще недифференцированных прегонадах самцов и самок. В семенниках экспрессируется в клетках Сертоли и клетках Лейдига,
причем максимум экспрессии GATA4 в клетках Сертоли наблюдается в период их интенсивной пролиферации, а в клетках Лейдига - в периоды интенсивного стероидогенеза (т.е. сходно с SF-1). Одним из активаторов экспрессии GATA4 служат андрогены: при нечувствительности к андрогенам GATA4 практически не экспрессируется в семенниках. Объектами регуляции GATA4 служат AMr и ферменты стероидогенеза. Мутация GATA4, нарушающая его взаимодействие со специфичным коактиватором FOG-2 (другом 2 GATA, friend 2 of GATA), или нокаут Fog-2 у мыши блокирует формирование семенников у генетических самцов. У таких животных не экспрессируются или слабо экспрессируются Sry, Sox9, SF-1, WT1, AMr, ферменты стероидогенеза. В яичниках GATA4, по-видимому, выполняет функцию одного из посредников действия гонадотропинов и оказывает антиапоптотическое действие.
Для развития семенников требуется множество других генов. Например, ген X-хромосомы (XH2) кодирует геликазу, разворачивающую ДНК, что обеспечивает доступность ДНК для действия транскрипционных факторов. Дифференцировка прегонады в семенник или яичник определяется не только наличием/отсутствием Y-хромосомы и ее продукта Sry, но и действием ряда репрессоров. Помимо упомянутого выше DAX1 функцию репрессоров могут выполнять паракринные регуляторы WNT4 и R-спондин (см. ниже), нарушение функции которых может приводить к развитию из прегонады семенника и в отсутствие Sry. Предполагаемые связи между белковыми продуктами важных для формирования семенников генов показаны на рис. 2-3.
Развитие яичников, по-видимому, осуществляется конститутивно. Для этого необходимы гены обеих X-хромосом, но конкретные гены, определяющие развитие яичников, неизвестны. У индивидуумов с кариотипом 45X (синдром Тернера) развивается дисгенезия гонад. При трисомии (47XXX, частота 1:1000 новорожденных девочек) около 20% женщин страдают аменореей. Для развития яичников требуется также активность ряда генов аутосом, например гена Wnt4 (гена 4 бескрылого типа семейства интеграции MMTV, Wingless type MMTV integration family, member 4), кодирующего паракринный белковый регулятор. Wnt4 экспрессируется в прегонадах эмбрионов обоего пола, но в развивающихся семенниках эта экспрессия подавляется GATA4. Одним из механизмов участия Wnt4 в половой дифференцировке гонад служит его ингибирующее действие на формирование так называемого целомического сосуда - специфичной для семенников артерии, в значительной мере влияющей на ход дифференцировки
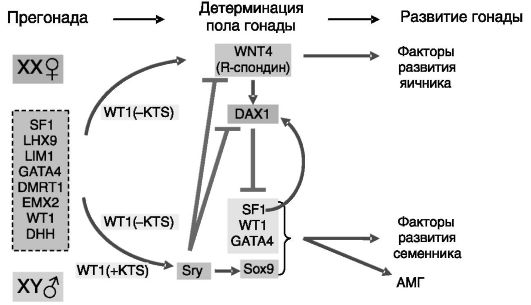 Рис. 2-3. Связи между продуктами основных генов половой дифференцировки семенников:
Рис. 2-3. Связи между продуктами основных генов половой дифференцировки семенников:
LHX9 - LIM homeobox containing transcription factor 9 (транскрипционный фактор 9, содержащий гомеоблок LIM); LIM1 - назван по имени автора, описавшего обогащенный остатками цистеина мотив цинковых пальцев; DMRT1 - doublesex and mab-3 related transcription factor 1 (транскрипционный фактор 1, родственный факторам двойного пола и mab-3 дрозофилы); EMX2 - empty spiracles homolog 2 (гомолог 2 фактора свободных дыхалец); DHH - desert hedgehog protein (белок пустынного ежа)
гонад, а в последующий период обеспечивающей отток андрогенов от семенника. В яичниках данный сосуд не развивается из-за блокады экспрессии активина B под действием Wnt4 (рис. 2-4). Нокаут гена Wnt4 у мыши, с одной стороны, ведет к деградации ооцитов,
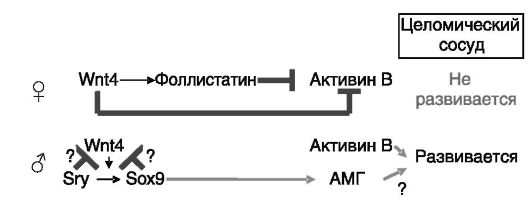 Рис. 2-4. Wnt4 яичнников блокирует развитие специфичного для семенников целомического сосуда
Рис. 2-4. Wnt4 яичнников блокирует развитие специфичного для семенников целомического сосуда
а с другой - к экспрессии маркеров клеток Сертоли и Лейдига, что сопровождается маскулинизацией экстрагонадных органов за счет продукции в яичниках андрогенов и AMr. В связи с этим Wnt4 рассматривают как антитестикулярный фактор (наряду с DAX-1).
Недавно выявлен еще один регулятор половой дифференцировки гонад - секретируемый паракринный фактор R-спондин 1.
В одной итальянской семье часть братьев (индивидуумов с мужским фенотипом внутренних и наружных гениталий, отсутствием производных мюллерова канала) имела кариотип XX при отсутствии гена SRY. Проведенный анализ выявил гомозиготную вставку одного нуклеотида в экзоне 5 гена R-спондина 1 (хромосома 1), приводящую к сдвигу рамки считывания с возникновением стоп-кодона, прерывающего синтез белка после 10-го аминокислотного остатка. Близкий фенотип наблюдается при другой мутации гена R-спондина 1 (делеции), сопровождающейся образованием укороченного с N-конца белка. (Эти мутации ассоциированы также с ладонно-подошвенным гиперкератозом и предрасположенностью к плоскоклеточной карциноме.) У мыши экспрессия R-спондина 1 выявляется в прегонаде (в соматических клетках) с 10,5 дня развития, и в период половой дифференцировки (12-14 дни) преобладает у самок. Можно полагать, что R-спондин 1, как и Wnt-4, является антитестикулярным фактором. Возможно, оба паракринных регулятора действуют посредством сходных механизмов, включающих рецепторы группы Fz (Frizzled - «кудрявый») класса рецепторов, сопряженных с G-белками, и вспомогательные рецепторы группы белков, родственных рецепторам липопротеинов низкой плотности (ЛНП), стабилизацию β-катенина и последующую активацию транскрипционного фактора TCF (T cell factor - фактор T-клеток).
Среди млекопитающих имеются значительные различия в механизмах половой дифференцировки гонад. В эволюционном плане возникающие различия могут служить барьером для рождения плодовитого потомства при скрещивании близких видов и тем самым могут ускорять процессы дивергенции видов.
ФОРМИРОВАНИЕ ВТОРИЧНОГО ПОЛА
Мужской или женский фенотип (вторичный, или соматический пол) формируется преимущественно под действием гормонов гонад, среди которых ведущую роль играют андрогены и AMГ у мужских особей и эстрогены - у женских.
Становление эндокринной функции гонад в онтогенезе
Продукция андрогенов в семенниках начинается сразу после дифференцировки клеток Лейдига. У человека она достигает первого максимума на 12 - 14-й неделе внутриутробного развития, после чего снижается и вновь возрастает с максимумом на 28 - 32-й неделе развития. К моменту рождения секреция андрогенов снижается, но возрастает в первые месяцы после рождения и остается высокой приблизительно до 2-летнего возраста. После этого наступает так называемый препубертатный провал с очень низким уровнем андрогенов. Последний, пубертатный подъем секреции андрогенов достигает максимума к 14 - 15 годам жизни и сохраняется приблизительно до 25 лет, после чего секреция андрогенов начинает постепенно снижаться (рис. 2-5). Интересно, что в начале пубертации усиление секреции андрогенов происходит в ночное время, но постепенно дневная и ночная концентрации андрогенов выравниваются.
Секреция AMr клетками Сертоли начинается еще до инициации стероидогенеза в семенниках и продолжается на высоком уровне до пубертации. В женском организме, напротив, продукция AMr гранулезными клетками при пубертации возрастает, и у взрослых мужчин и женщин концентрация AMr в крови оказывается одинаковой (см. рис. 2-5).
В женском организме продукция эстрогенов возникает при формировании яичников во внутриутробный период, но эта волна секреции слабая и быстро снижается до очень низкого уровня. Значение
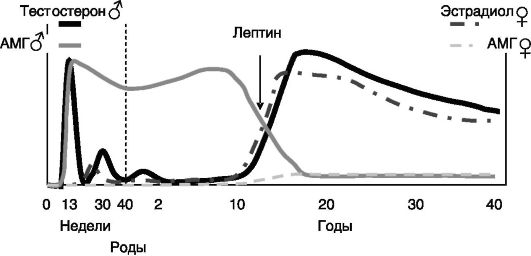 Рис. 2-5. Динамика продукции гормонов гонад в развитии человека
Рис. 2-5. Динамика продукции гормонов гонад в развитии человека
первой волны эстрогенов, возможно, заключается в дополнительной феминизации развития яичников (в частности, эстрогены блокируют продукцию альфа-ингибина в клетках гранулезы яичников, тормозящего развитие примордиальных фолликулов). Кроме того, первая волна эстрогенов обеспечивает формирование отрицательной обратной связи в секреции гонадотропинов гипофизом. В отсутствие эстрогенов (например, при недостаточности ароматазы) избыточная секреция гонадотропинов индуцирует развитие поликистоза яичников с избыточной продукцией андрогенов, вызывающих вирилизацию половых органов у новорожденных девочек. Вторая волна секреции развивается уже в период пубертации и продолжается до наступления менопаузы (45 - 55 лет), после чего секреция значительно снижается. Пермиссивным фактором для пубертатного подъема секреции половых гормонов гонадами служит лептин (см. рис. 2-5).
Формирование вторичных половых признаков (вторичного пола)
Формирование соматического, или вторичного, пола или вторичных половых признаков полностью зависит от гормонов гонад. При этом половой дифференцировке подвергаются не только репродуктивные органы, но и обслуживающие репродуктивную функцию системы, такие, как гипоталамические центры регуляции гонадотропной функции гипофиза, центры регуляции и реализации полового поведения головного и спинного мозга, ферменты метаболизма половых гормонов печени и почек, белки транспорта половых стероидов, а также системы, непосредственно не связанные с репродукцией, например система нейроэндокринной регуляции секреции СТГ или тонуса сосудов. Потребность в половой дифференцировке подобных «парасексуальных» признаков, по-видимому, определяется различиями в биологическом предназначении и соответственно образе жизни и характере обменных процессов у самцов и самок.
В дифференцирующем по полу действии половых гормонов различают две формы влияния, соответствующие внутриутробной/неона- тальной и пубертатной волнам секреции гормонов. Первая волна секреции андрогенов у самцов обеспечивает формирование мужского полового тракта и наружных гениталий из би- и моносексуальных зачатков. В отсутствие андрогенов развитие этих зачатков идет по женскому (базисному) типу. Эстрогены яичников первой волны для формирования репродуктивного тракта женского типа не требуются. Описана форма мужского ложного гермафродитизма (тестикулярная
феминизация), обусловленная инактивирующими мутациями А-Рц, когда, несмотря на наличие семенников и секрецию ими андрогенов, репродуктивный тракт развивается по женскому типу. Часть зачатков развивается по мужскому типу под действием тестостерона. Но для развития некоторых зачатков требуется превращение тестостерона в 5а-дигидротестостерон. Недостаточность 5а-редуктазы, катализирующей данное превращение, приводит к особой форме мужского ложного гермафродитизма, для которой характерны наружные гениталии женского типа при наличии ряда элементов мужского репродуктивного тракта. Гормональная индукция половой дифференцировки разных отделов репродуктивного тракта показана в табл. 2-1.
Заложенная во внутриутробный период гормональная программа развития репродуктивного тракта подкрепляется в период пуберта-
Таблица 2-1. Этапы половой дифференцировки репродуктивных органов млекопитающих
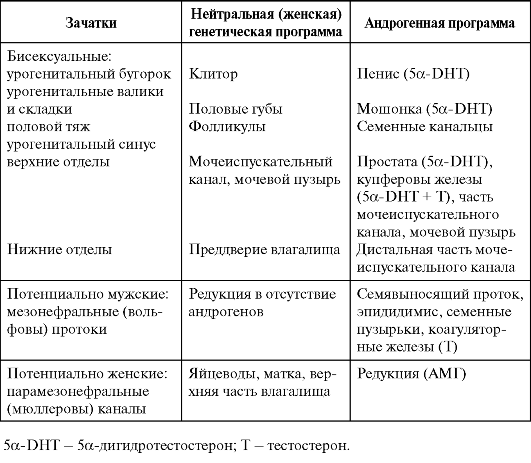 ции второй волной секреции половых гормонов, окончательно обеспечивающей репродуктивную функцию.
ции второй волной секреции половых гормонов, окончательно обеспечивающей репродуктивную функцию.
Несколько иная ситуация наблюдается при гормональной индукции половой дифференцировки функций мозга и некоторых других органов. В этих случаях результат действия андрогенов во внутри- утробный/неонатальный период начинает проявляться лишь при половом созревании, т.е. здесь эффект гормона реализуется в форме импринтинга, запечатления. Особенностями данной формы гормонального действия являются наличие так называемого критического периода, за границами которого гормон не оказывает программирующего, детерминирующего эффекта, а также передача информации о состоявшейся встрече клетки с гормоном дочерним клеткам при пролиферации. Импринтинг может проявляться в виде как морфофункциональных, так и чисто функциональных изменений. По данным, полученным на грызунах, импринтинг происходит уже в период спада первой волны секреции андрогенов, охватывая конец внутриутробной жизни и первые 10-15 дней постнатальной жизни. У этих животных программа половой дифференцировки функций мозга, связанных с репродукцией (тип секреции гонадотропинов, половое поведение, агрессивность), формируется раньше, чем программа дифференцировки парасексуальных функций, таких, как паттерн секреции СТГ Импринтинг андрогенами экспрессии эстрогенсульфотрансферазы в печени и относительной резистентности к инсулину у крысы вообще не имеет верхней границы критического периода и может быть реализован у взрослых животных. Остается неизвестным, имеет ли место импринтинг андрогенами у человека. Если да, то он, скорее всего, должен происходить еще во внутриутробный период развития.
Половая дифференцировка функций и систем, подвергаемых гормональному импринтингу, усиливается и модулируется второй волной секреции половых гормонов.
Многие вторичные половые признаки развиваются в результате действия лишь второй волны секреции половых гормонов. К таким признакам относятся, например, сосудистый тонус или экспрессия ферментов метаболизма стероидов в почках. В отличие от детерминирующих эффектов андрогенов первой волны эффекты второй волны секреции половых гормонов являются обратимыми, и для поддержания половой дифференцировки требуется постоянное присутствие соответствующих гормонов.
Импринтинг андрогенами ряда функций мозга включает стадию локального превращения андрогенов в эстрогены под действием ароматазы, уровень экспрессии которой также подвергается импринтингу с преобладанием в мозгу мужских особей. Женские особи избегают импринтинга собственными эстрогенами из-за низкой гормонпродуцирующей активности яичников в критические периоды половой дифференцировки.
У грызунов имеется также дополнительный механизм недопущения импринтинга собственными и материнскими эстрогенами: у этих видов a-фетопротеин крови (эмбриональный гомолог сывороточного альбумина взрослых) очень интенсивно связывает эстрогены, препятствуя их переходу из кровяного русла в клетки тканей. Андрогены же не связываются этим белком и легко проникают в подвергаемые импринтингу структуры.
Примеры гормональных механизмов половой дифференцировки
Секреция гонадотропинов. Для самок млекопитающих характерен циклический тип функционирования репродуктивной системы. Нарастающая секреция эстрогенов созревающими фолликулами яичников вызывает мощный выброс гипоталамусом гонадолиберинов (ЛГРГ), которые, с одной стороны, стимулируют половое поведение, а с другой - индуцируют выброс гипофизом ЛГ, который вызывает разрыв зрелых фолликулов (овуляцию) с выходом готовой к оплодотворению яйцеклетки. Репродуктивная система самцов функционирует в тоническом режиме, и введение им эстрогенов не вызывает выброса ЛГРГ. Данное половое различие связано с блокадой андрогенами первой волны у самцов (у грызунов перинатально, у овец - внутриутробно) функционирования так называемого циклического центра, расположенного в преоптической области.
Механизм данной блокады остается неясным. Нейроанатомическим субстратом для блокады, возможно, служит синаптогенез в циклическом центре. Показано, что введение андрогенов самкам в критический период индуцирует приблизительно 2-кратное снижение количества синапсов на ЛГРГ-нейронах преоптической области до уровня, характерного для самцов, и такие нейроны уже не отвечают на эстрогены повышением синтеза ЛГРГ и экспрессией транскрипционного фактора c-fos.
Для блокирования циклического центра андрогены должны локально превратиться в эстрогены, и введение высокой дозы эст-
рогенов воспроизводит описанное действие тестостерона, а перинатальное введение ингибитора ароматазы приводит к феминизации системы контроля секреции ЛГРГ.
Половое поведение. У грызунов и ряда других видов животных формирование мужского типа полового поведения, как и ряда других дифференцированных по полу функций мозга, складывается из двух компонентов: импринтинга андрогенами первой волны (внут- риутробный/неонатальный период) и регуляторного (обратимого) действия андрогенов в период половой зрелости. Критический период запечатления эффекта андрогенов является весьма узким. Если в этот период уровень андрогенов недостаточен (как это имеет место в норме у самок или в результате кастрации новорожденных самцов), то ведение андрогенов после его окончания уже не способно обеспечить нормальное мужское поведение (рис. 2-6).
Оказалось далее, что перинатальное программирующее действие тестостерона на последующее мужское половое поведение необходимо включает локальное превращение тестостерона в эстрогены: андрогенный импринтинг у неонатально кастрированных самцов или у самок может быть воспроизведен введением в критический период эстрадиола; однократное неонатальное введение антиэстрогена самцам подавляет их последующее стремление к спариванию, несмотря на нормальный уровень продукции тестостерона; сходные последс-
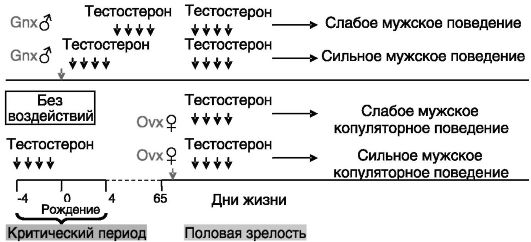 Рис. 2-6. Организующее
в перинатальный период и активирующее в постпубертатный период действие
тестостерона на мужское половое поведение у грызунов:
Рис. 2-6. Организующее
в перинатальный период и активирующее в постпубертатный период действие
тестостерона на мужское половое поведение у грызунов:
Gnx - гонадэктомия; Ovx - овариэктомия
твия наблюдаются при неонатальном введении ингибитора ароматазы; аналогично действует инъекция антисмысловой РНК рецептора эстрогенов альфа (Э-Рца). Экспрессия ароматазы в мозгу грызунов достигает пика сразу после рождения (т.е. в критический период), и ее уровень у самцов значительно выше, чем у самок, за счет индукции андрогенами первой волны.
Для реализации мужского полового поведения у взрослых животных и человека также необходимы андрогены. Кастрация взрослых самцов, угасание стероидогенной функции семенников при старении ведут к подавлению полового поведения, причем это подавление связано с утратой как андрогенов, так и образующихся из них эстрогенов.
Показано, что введение кастрированным самцам эстрадиола частично восстанавливает их половую активность. Однако полное восстановление мужского полового поведения может быть достигнуто лишь введением тестостерона или сочетания эстрадиола и неароматизируемого андрогена 5α-дигидротестостерона. (Рецепторы и андрогенов, и эстрогенов выявлены в ряде областей мозга, связанных с половым поведением - гипоталамусе, преоптической области, лимбической системе, причем нередко оба типа рецепторов локализуются в одном и том же нейроне.) Необходимость рецепторов и андрогенов, и эстрогенов для стимуляции мужского полового поведения доказывается утратой способности тестостерона поддерживать копуляторную активность у кастрированных самцов крыс при одновременном введении антиандрогена или ингибитора ароматазы; самцы с недостаточностью рецептора андрогенов (синдром тестикулярной феминизации) и нокаутные по гену Э-Рца самцы мыши в значительной мере утрачивают интерес к самкам. Нокаут гена Э-Рцβ у мыши практически не сказывается на стимулирующем половое поведение действии эстрогенов (в отличие от индукции эстрогенами агрессивной реакции, которая значительно возрастает у нокаутированных по Э-Рцβ мышей).
Одним из важнейших эффекторов стимулирующего влияния половых гормонов на мужское половое поведение является дофаминергическая система мозга, связанная с мотивацией, силой желания и физической реализацией полового поведения (нигростриатный тракт, мезолимбический тракт, преоптическая область).
Введение агониста дофамина самкам мыши с нокаутированным геном Э-Рца индуцирует мужское копуляторное поведение, т.е. воспроизводит эффект тестостерона или эстрогенов, характерный для
животных с интактным Э-Рца. Установлено, что у самцов во время копуляции возрастает продукция дофамина в преоптической области, и для этого необходим тестостерон. Высвобождение дофамина особенно важно для молодых животных, не имеющих сексуального опыта. Эффект тестостерона (через превращение в эстрогены) на продукцию дофамина, по-видимому, реализуется путем индукции NO-синтазы (NOS).
Женское половое поведение также зависит и от эстрогенов, и от андрогенов. Одно из доказательств прямого стимулирующего действия эстрогенов получено в экспериментах с нокдауном Э-Рца в вентромедиальном гипоталамусе мыши путем инъекции антисмысловой РНК. На самостоятельное стимулирующее действие андрогенов указывают данные о повышении либидо у женщин, получавших небольшую дозу тестостерона, независимо от одновременного введения ингибитора ароматазы.
Секреция ГР. Хорошо известны половые различия в скорости ростовых процессов. Эти различия в значительной мере связаны с особенностями действия половых гормонов на паттерн секреции СТГ. Половые гормоны оказывают влияние на продукцию СТГ несколькими путями. Андрогены семенников новорожденных крысят индуцируют увеличение количества соматотрофов в гипофизе и ГРРГ-ергических нейронов в аркуатном ядре гипоталамуса, что способствует более высокому уровню секреции СТГ у взрослых самцов по сравнению с самками. Неонатальное действие тестостерона также программирует способность гипоталамуса взрослых самцов к повышенному биосинтезу ГРРГ и соматостатина, что определяет, соответственно, высокоамплитудный паттерн секреции СТГ при низком межпиковом уровне гормона. У взрослых животных андрогены усиливают действие этой программы. Кроме того, андрогены у взрослых повышают чувствительность соматотрофов к действию ГРРГ и грелина, стимулируя экспрессию соответствующих рецепторов и подавляют ингибирующее действие соматостатина. Многие (но не все) из указанных эффектов реализуются путем локального превращения андрогенов в эстрогены, что служит причиной однонаправленного действия эстрогенов яичников и андрогенов семенников на секрецию СТГ при половом созревании (рис. 2-7). Половые гормоны, кроме того, способны прямо влиять на уровень ИФР-I, ингибирующего секрецию СТГ.
Цитохромы P-450 печени. Цитохромы P-450 выполняют множество функций, связанных преимущественно с гидроксилированием
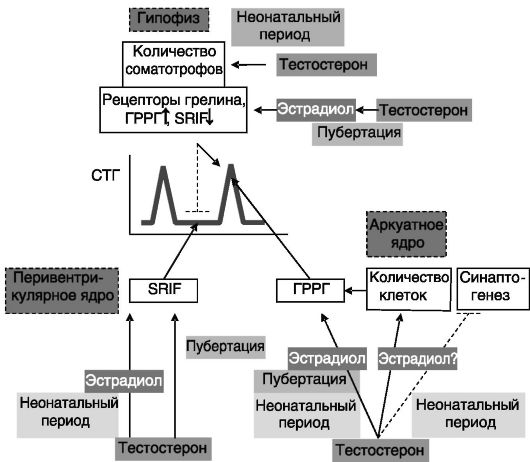 Рис. 2-7. Половая дифференцировка паттерна секреции СТГ; SRIF-соматостатин
Рис. 2-7. Половая дифференцировка паттерна секреции СТГ; SRIF-соматостатин
субстратов, включая метаболизм стероидных гормонов и катаболизм ксенобиотиков, например лекарственных препаратов. В целом общая масса цитохромов P-450 в печени самцов крысы приблизительно в 1,5 раза превышает количество цитохромов в печени самок. Но представленность индивидуальных цитохромов (а значит - и метаболизм отдельных субстратов) может различаться между самками и самцами в десятки раз, причем одни цитохромы преобладают у самцов, а другие - у самок. Дифференцирующее по полу действие андрогенов и эстрогенов на экспрессию цитохромов в печени опосредовано дифференцированным по полу паттерном секреции СТГ (см. выше). Установлено, что характерные для самцов редкие высокоамплитудные выбросы СТГ с низким межпиковым уровнем гормона вызывают в печени активацию транскрипционного фактора STAT5b, а более частые низкоамплитудные колебания уровня СТГ с высоким меж-
пиковым уровнем гормона, которые характерны для самок, стимулируют активацию родственного транскрипционного фактора STAT5a. STAT5b и STAT5a стимулируют экспрессию специфичных для самцов и самок изоформ цитохромов (рис. 2-8). Для транскрипции генов некоторых специфичных для самцов цитохромов требуется лишь отсутствие женского паттерна секреции СТГ, поскольку эта транскрипция имеет место и у гипофизэктомированных самцов. Таким образом, существуют разные варианты дифференцирующего по полу действия паттерна секреции ГР. Эффект паттерна СТГ через STAT5
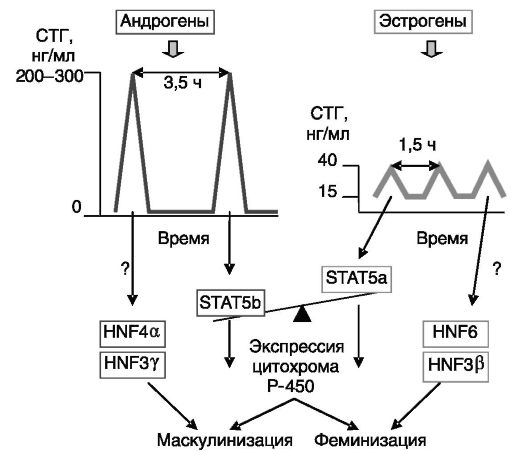 Рис. 2-8. Гормональный механизм половой дифференцировки экспрессии цитохромов P-450 в печени крысы
Рис. 2-8. Гормональный механизм половой дифференцировки экспрессии цитохромов P-450 в печени крысы
дополняется дифференцированными по полу транскрипционными факторами группы ядерных факторов гепатоцитов (HNF). Сходные гормональные механизмы обеспечивают половую дифференцировку экспрессии и ряда других белков печени. Следует, однако, отметить, что эти механизмы не являются универсальными. Так, значительное преобладание в печени самцов крысы эстрогенсульфотрансферазы
является результатом прямого стимулирующего действия на печень андрогенов и прямого ингибирующего действия эстрогенов, а СТГ выполняет функцию пермиссивного фактора. Кроме того, в отношении экспрессии данного фермента андрогены выступают также в качестве фактора гормонального импринтинга.
Рекомендуемая литература
Chowen J.A., Frago L.M., Argente J. The regulation of GH secretion by sex steroids. Eur J Endocrinol. 2004;151 (Suppl 3):U95-100.
Dinapoli L., Capel B. SRY and the standoff in sex determination. Mol Endocrinol. 2008; 22 (1): 1- 9.
Harley V.R., Clarkson M.J., Argentaro A. The molecular action and regulation of the testis-determining factors, SRY (sex-determining region on the Y chromosome) and SOX9 [SRY-related high-mobility group (HMG) box 9]. Endocr Rev. 2003;24(4):466 - 487.
Parma P., Radi O., Vidal V. et al. R-spondin1 is essential in sex determination, skin differentiation and malignancy. Nat Genet. 2006;38(11):1304 -1309.
Pieau C., DorizziM Oestrogens and temperature-dependent sex determination in reptiles: all is in the gonads. J Endocrinol. 2004; 181(3):367-377.
Rens W., Grutzner F., O'Brien P.C. et al. Resolution and evolution of the duckbilled platypus karyotype with an X1Y1X2Y2X3Y3X4Y4X5Y5 male sex chromosome constitution. Proc Natl Acad Sci U S A. 2004;101(46):16257-16261.
Scordalakes E.M., Imwalle D.B., Rissman EF. Oestrogen's masculine side: mediation of mating in male mice. Reproduction. 2002;124(3):331-338.
Teixeira J., Maheswaran S., Donahoe P.K. Mullerian inhibiting substance: an instructive developmental hormone with diagnostic and possible therapeutic
applications. Endocr Rev. 2001;22(5):657- 674.
Waxman D.J., O'Connor C. Growth hormone regulation of sex-dependent liver gene expression. Mol Endocrinol. 2006;20(11):2613-2629.