Эндокринная регуляция. Биохимические и физиологические аспекты : учеб. пособие / А.Н. Смирнов ; под ред. В.А. Ткачука - 2009. - 368 с.
|
|
|
|
ГЛАВА 8. АЗОТИСТЫЙ ОБМЕН
К азотистым соединениям относятся белки, пептиды, аминокислоты и их производные, нуклеиновые кислоты, нуклеотиды и их производные, а также азотистые производные сахаров. Основная часть связанного азота приходится на белки, поэтому азотистый обмен часто отождествляют с белковым. Хотя аминокислоты, образующиеся при распаде белков, могут быть повторно использованы для биосинтеза белка (в среднем 5 раз), для нормальной жизнедеятельности необходимо постоянное поступление аминокислот в составе пищи. Последствия недостаточного потребления белковых продуктов иллюстрируются квашиоркором - заболеванием детей вследствие алиментарной недостаточности белка при нормальном покрытии потребностей в углеводах и липидах (рис. 8-1).
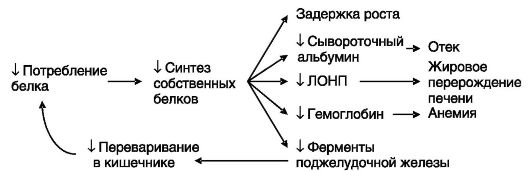 Рис. 8-1. Порочный круг при квашиоркоре
Рис. 8-1. Порочный круг при квашиоркоре
Принято считать, что минимальная суточная потребность взрослого человека в белке составляет около 100 г. Эта потребность возрастает при интенсивном росте, восстановлении после перенесенной болезни, беременности, лактации. Азотистый баланс (т.е. отношение потребленного азота к экскретируемому) служит важным показателем состояния организма и, в частности, ростовых процессов.
Срок жизни белков в организме варьирует в диапазоне от десятков минут до нескольких месяцев, в среднем составляя 3 нед. Этот срок может снижаться факторами, стимулирующими катаболизм, например глюкокортикоидами или провоспалительными цитокинами.
ПЕРЕВАРИВАНИЕ БЕЛКОВ
Пепсин желудка. Основная протеиназа желудка пепсин (семейство аспартатных протеиназ, по наличию в активном центре двух остатков аспарагиновой кислоты) образуется под действием кислой среды полости желудка из двух предшественников - пепсиногенов I и II (или A и C), секретируемых главными клетками желудка. Поступление пищи стимулирует высвобождение пепсиногенов из секреторных гранул с параллельным усилением синтеза de novo. Стимулирующее действие на секрецию пепсиногенов разнообразных нервных и гуморальных факторов реализуется преимущественно посредством повышения уровня цАМФ (секретин, вазоактивный интестинальный пептид (ВИП), катехоламины) или внутриклеточного Ca2+ (холецистокинин - ХЦК, гастрин, гастрин-рилизинг пептид - ГРП, бомбезин, ацетилхолин). Соматостатин подавляет секрецию. Известное ульцерогенное действие фармакологических доз глюкокортикоидов может быть отчасти связано с их стимулирующим действием на экспрессию гена пепсиногена C, в регуляторной области которого обнаружен функциональный ГКЧЭ. Базальный уровень глюкокортикоидов необходим для нормального уровня экспрессии пепсиногенов.
Панкреатические протеиназы. Поступающие из желудка в кишечник пептидные продукты переваривания пепсином подвергаются дальнейшему гидролизу несколькими протеиназами, образующимися в просвете двенадцатиперстной кишки из неактивных предшественников (зимогенов), поступающих из поджелудочной железы. Каскад активации инициируется энтеропептидазой (или энтерокиназой), экспрессируемой в энтероцитах и бокаловидных клетках двенадцатиперстной кишки. Этот фермент удаляет из полипептидов трипсиногена (3 изоформы) ингибирующие фрагменты. Образующийся трипсин (семейство сериновых протеиназ) катализирует далее аутоактивацию и активацию химотрипсиногена (семейство сериновых протеиназ) и прокарбоксипептидазы (2 изоформы). Синтез и секреция зимогенов в поджелудочной железе адаптивно стимулируются белковой пищей, предположи-
тельно с участием холецистокинина. Показано также стимулирующее действие ацетилхолина, инсулина, секретина, бомбезина на секрецию зимогенов. Полагают, что одной из причин развития панкреатита может служить внутриклеточная (т.е. преждевременная) активация зимогенов.
ТРАНСПОРТ ОЛИГОПЕПТИДОВ И АМИНОКИСЛОТ
Олигопептиды. Основная часть продуктов переваривания белков в желудке и кишечнике представлена ди- и трипептидами. Данные олигопептиды всасываются клетками слизистой оболочки тонкой кишки, где под действием пептидаз гидролизуются до аминокислот. Транспорт олигопептидов через апикальную мембрану клеток кишечника является энергозависимым и определяется Н+-пептид- ным котранспортером, PepT1.
Этот транспортер представляет собой гликозилированный белок, содержащий 12 трансмембранных доменов. Отличается низкой субстратной специфичностью (способен транспортировать 400 различных дипептидов, 8000 трипептидов, ряд лекарственных препаратов, имитирующих структуру ди- и трипептидов, например, β-лактамовые антибиотики) и низким сродством к субстратам. Энергия для транспорта обеспечивается работой Na+,K+-АТФазы, локализованной на базолатеральной поверхности клеток. Снижение концентрации Na+ в клетках служит движущей силой для функционирования локализованного на апикальной поверхности клеток Na+/Н+-обменника, выводящего протоны из клеток в просвет кишечника. Эти протоны затем возвращаются в клетки вместе с олигопептидами через Н+-пептидный котранспортер PepT1 (рис. 8-2).
Активность Н+-пептидного котранспортера PepT1 регулируется субстратами на транскрипционном уровне, однако данные о направленности этой регуляции противоречивы. Хотя стимулирующий эффект дипептидов на уровень PepT1 может быть воспроизведен in vitro на культуре клеток кишечника, не исключено, что in vivo действие субстрата может быть опосредовано его стимулирующим действием на гормоны желудочно-кишечного тракта, такие, как глюкагоноподобный пептид. Инсулин стимулирует активность PepT1, но это происходит на посттрансляционном уровне, за счет повышения встраивания PepT1 в плазматическую мембрану. Лептин, который может поступать к клеткам кишечника как через системный кровоток, так и через просвет
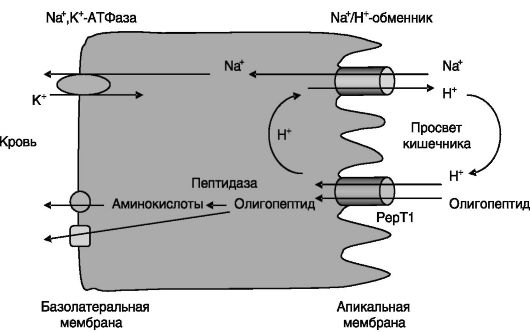 Рис. 8-2. Транспорт олигопептидов в клетки слизистой кишечника
Рис. 8-2. Транспорт олигопептидов в клетки слизистой кишечника
кишечника после его секреции желудком, повышает экспрессию PepT1 на транскрипционном уровне, а тиреоидные гормоны снижают.
В почках, легких, мозгу и ряде других органов и тканей экспрессируется родственный PepT1 транспортер олигопептидов, PepT2. Принцип работы данного транспортера сходен с таковым PepT1.
В качестве субстратов PepT2 может использовать ди-, три- и тетрапептиды, предпочтительно дипептиды. Его сродство к субстратам существенно выше сродства PepT1. В почках PepT2 локализован на апикальной поверхности клеток почечных канальцев, где он обеспечивает реабсорбцию олигопептидов из мочи. Исключая ингибирующее действие тиреоидных гормонов и эпидермального фактора роста на экспрессию PepT2, гормональная регуляция этого транспортера практически не исследована.
Аминокислоты. Липидный бислой плазматической мембраны клеток непроницаем для аминокислот. Для всасывания аминокислот в кишечнике, реабсорбции из мочи, обратного захвата в синапсе, выхода в кровоток, поступления в клетки-потребители используется широкий спектр транспортеров аминокислот, которые делят на две основные группы: независимые и зависимые от Na+. Транспортеры аминокислот проявляют весьма высокую специфичность в отношении определенных групп субстратов.
Субстратами транспортеров аминокислот могут служить также биогенные амины, тиреоидные гормоны, ряд лекарственных препаратов. Значительная часть зависимых от Na+ транспортеров осуществляет энергозависимый перенос аминокислот через плазматическую мембрану, тогда как независимые от Na+ транспортеры обеспечивают облегченную диффузию субстратов. Примером транспортеров первой группы может служить сопряженный с протонами транспортер аминокислот, PAT1, экспрессируемый преимущественно на апикальной поверхности клеток слизистой кишечника. Принцип работы данного транспортера сходен с таковым для транспортера олигопептидов PepT1, описанного выше. Регуляция активности PAT1 может осуществляться, в частности, путем фосфорилирования Na+/H+-обменника или регулирующих его белков. Транспортер SN1 переносит аминокислоту также за счет обмена Na+/ H+, но этот обмен осуществляется самим транспортером и происходит в направлении, обратном описанному для транспортера PAT1, сопряженного с Na+/H+-обменником (рис. 8-3). Транспортер SN1, в частности, обеспечивает поступление глутамина в перипортальные гепатоциты для синтеза мочевины и, напротив, экспорт глутамина перицентральными гепатоцитами в кровоток и далее в почки. В проксимальных канальцах почек экспрессия данного транспортера адаптивно возрастает при хроническом ацидозе (функция - аммонийгенез для выведения протонов, см. ниже), и этому росту способствуют глюкокортикоиды. Еще один вариант зависимого от Na+ транспорта аминокислот можно наблюдать в случае транспортера ATA1, осуществляющего совместный транспорт аминокислоты и Na+. В данном случае протоны выступают в качестве аллостерических регуляторов транспортера (см. рис. 8-3).
Примером системы транспорта аминокислот путем облегченной диффузии служит система L. Транспортеры данной группы построены из двух субъединиц: легкой и тяжелой, связанных дисульфидной связью. Легкая субъединица, например LAT1, 12 раз пронизывает плазматическую мембрану. Тяжелая гликозилированная субъединица, например 4F2hc, содержит лишь один трансмембранный домен (рис. 8-4). Данная группа транспортеров обеспечивает преимущественно взаимообмен между аминокислотами, локализованными в клетке и во внеклеточной среде. Значение данной системы транспорта, повидимому, заключается в обеспечении трансмембранного перемещения аминокислот, являющихся плохими субстратами для зависимых от Na+ транспортеров. Так, локализованный на апикальной поверхности клеток проксимальных канальцев почек димерный транспортер rbAT/
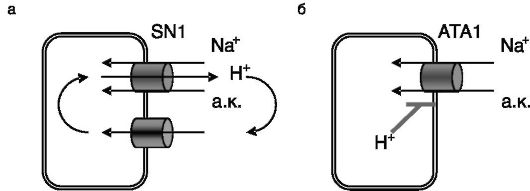 Рис. 8-3. Варианты зависимых от Na+ транспортеров аминокислот (а.к.): a - транспортер
SN1 осуществляет совместный транспорт Na+ и аминокислоты в обмен на
протон (протон необходим для переориентации SN1 в мембране). SN1
обеспечивает импорт глутамина в перипортальные гепатоциты из кровотока и
экспорт синтезированного глутамина из перицентральных гепатоцитов;
Рис. 8-3. Варианты зависимых от Na+ транспортеров аминокислот (а.к.): a - транспортер
SN1 осуществляет совместный транспорт Na+ и аминокислоты в обмен на
протон (протон необходим для переориентации SN1 в мембране). SN1
обеспечивает импорт глутамина в перипортальные гепатоциты из кровотока и
экспорт синтезированного глутамина из перицентральных гепатоцитов;
б - электрогенный транспортер ATA1 действует сходно с SN1, но не переносит протон
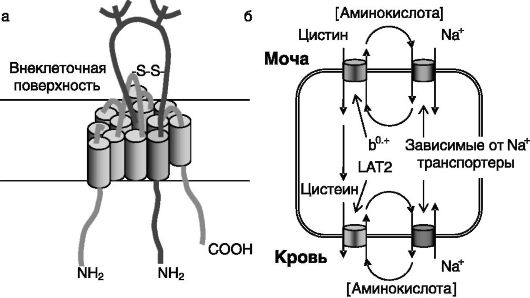 Рис. 8-4. Транспортеры аминокислот:
Рис. 8-4. Транспортеры аминокислот:
а - димерный транспортер аминокислот b0,+ построен из тяжелой цепи rbAT (светлый тон) и легкой цепи b0,++AT (темный тон), связанных дисульфидной связью. Локализован на апикальной поверхности клеток почек, тонкого кишечника, мозга;
б - транспортер b0,+ осуществляет независимый от Na+ обмен нейтральных и двухосновных аминокислот и совместно с родственным транспортером LAT2-4F2hc в кооперации с зависимыми от Na+ транспортерами обеспечивает реабсорбцию цистина, аргинина, лизина, орнитина. Недостаточность транспортера сопровождается цистинурией
b0,.+AT обеспечивает реабсорбцию из первичной мочи цистина, который далее в клетках превращается в цистеин, секретируемый затем в кровь через базолатеральную мембрану клетки посредством второго димерного транспортера - 4F2/LAT2. Энергетически работа данной системы реабсорбции обеспечивается зависимым от Na+ транспортом аминокислот, обмениваемых на цистин и цистеин соответственно. Показано стимулирующее действие глюкокортикоидов на экспрессию транспортеров этого типа в почках.
ОБМЕН АМИНОКИСЛОТ
Аминокислоты представляют собой, с одной стороны, строительный материал для биосинтеза белков и других содержащих азот соединений, а с другой - источник энергии. В зависимости от того, способна ли та или иная аминокислота синтезироваться в организме, различают заменимые и незаменимые аминокислоты.
Для биосинтеза белка необходимым условием является поддержание в клетке баланса между аминокислотами, соответствующего их содержанию в белках. Этот баланс в значительной мере поддерживается за счет взаимопревращений аминокислот. Взаимопревращения включают реакции двух типов: переаминирования и окислительного дезаминирования/восстановительного аминирования. Эти же реакции используются для деградации аминокислот при глюконеогенезе.
Обратимые реакции переаминирования, т.е. переноса аминогруппы с одного субстрата на другой, катализируются аминотрансферазами. Одним субстратом служит аминокислота X, по наименованию которой называют соответствующую аминотрансферазу, или соответствующая α-кетокислота X'. Второй субстрат представлен парой α-кетоглутарат/глутамат. В зависимости от соотношения концентраций субстратов реакция будет направлена на образование либо аминокислоты X, либо глутамата. При накоплении глутамата последний может стать донором аминогруппы для α-кетокислоты Y' с образованием аминокислоты Y в реакции, катализируемой соответствующей аминотрансферазой. Аналогичным образом может быть достигнут паритет между другими аминокислотами.
Избыток аминокислот может быть ликвидирован путем окислительного дезаминирования глутамата под действием глутаматдегидрогеназы. Обратная реакция восстановительного аминирования, напротив, способна увеличить пул аминокислот в клетке
(рис. 8-5). Указанная на рисунке цепь реакций используется также в процессе глюконеогенеза: например, стимулируемая глюкокортикоидами при стрессе деградация мышечного белка сопровождается поступлением в кровь аланина, который в печени через пируват
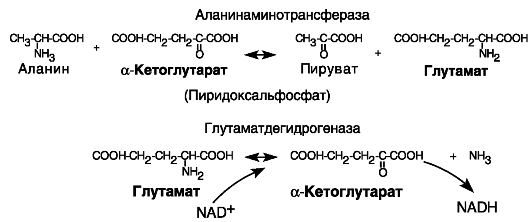 Рис. 8-5. Взаимопревращения аминокислот.
Рис. 8-5. Взаимопревращения аминокислот.
Аминотрансферазы переносят аминогруппу на α-кетоглутарат. Образовавшийся глутамат подвергается окислительному дезаминированию. Обратные реакции обеспечивают синтез аминокислот.
направляется на синтез глюкозы. Индуцируемому глюкокортикоидами глюконеогенезу способствует также известная способность этих гормонов стимулировать транскрипцию генов ряда аминотрансфераз.
ОБМЕН АММИАКА
Глутамин - важный источник энергии, особенно для клеток кишечника и иммунной системы, предшественник для глюконеогенеза, переносчик аммиака. Является преобладающей аминокислотой в крови. Обмен глутамина осуществляется с участием цитозольного фермента глутаминсинтазы и двух изозимов митохондриальной глутаминазы (рис. 8-6).
Активность печеночной глутаминазы возрастает при голодании, диабете и при высоком содержании белка в пище. Все эти состояния характеризуются повышенным катаболизмом поступающих в печень аминокислот, направленным отчасти на усиление глюконеогенеза и на удаление избытка азота через цикл мочевины. Повышение активности фермента происходит, в частности, под действием глюкагона за
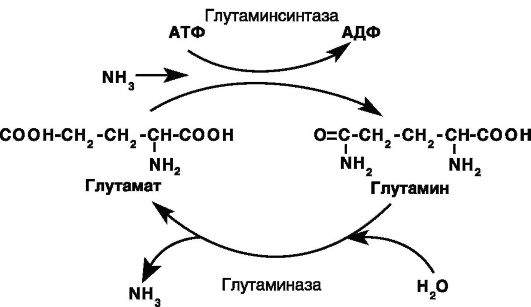 Рис. 8-6. Взаимопревращения глутамата и глутамина
Рис. 8-6. Взаимопревращения глутамата и глутамина
счет индукции транскрипции гена через цАМФ-чувствтвительный элемент (CRE) и глюкокортикоидов через ГКЧЭ (рис. 8-7).
При хроническом метаболическом ацидозе возрастает активность почечной глутаминазы. Основная задача этого фермента - генерация аммиака для связывания протонов и выведения их с мочой. Эффект реализуется на посттранскрипционном уровне за счет стабилизации мРНК фермента. Механизм включает взаимодействие pH-чувстви- тельного элемента (pHRE) З'-нетранслируемой области мРНК (представляющего собой прямой повтор из 8 оснований, обогащенный аденозином и уридином) с зета-кристаллином (см. рис. 8-7).
При стрессе возрастает активность глутаминсинтазы в мышцах, легких. Эффект реализуется на уровне транскрипции. Например, в легких мРНК фермента возрастает в 10 раз. Глюкокортикоиды действуют на экспрессию фермента через канонический ГКЧЭ в 1-м интроне и З полусайта ГКЧЭ в отдаленной регуляторной области гена.
При хроническом стрессе в почках возрастает активность глутаматдегидрогеназы, превращающей глутамат в α-кетоглутарат с высвобождением аммиака. Регуляция осуществляется на посттранскрипционном уровне путем стабилизации мРНК фермента за счет связывания расположенных в З'-нетранслируемой области четырех pHREs с зетакристаллином, т.е. аналогично регуляции почечной глутаминазы.
Утилизация образующегося при ацидозе в почках α-кетоглутарата происходит посредством индукции ферментов глюконеогенеза. Индукция одного из них - фосфоенолпируваткарбоксикиназы (PEPCK) происходит на транскрипционном уровне: снижение внут-
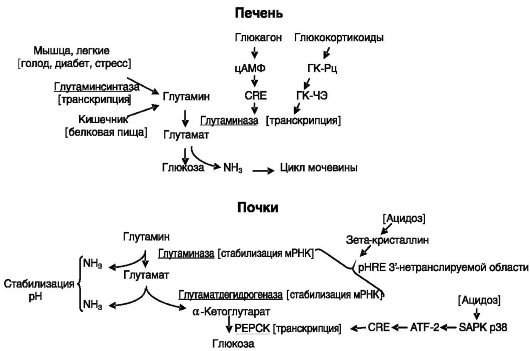 Рис. 8-7. Регуляция обмена аммиака в печени и почках
Рис. 8-7. Регуляция обмена аммиака в печени и почках
риклеточного pH сопровождается активацией активируемой стрессом протеинкиназы p38 (SAPK p38), которая фосфорилирует транскрипционный фактор ATF-2, взаимодействующий с цАМФ-чувствительным элементом (CRE) гена PEPCK, что стимулирует транскрипцию.
ЦИКЛ МОЧЕВИНЫ
Энергозависимое образование мочевины в печени у млекопитающих является основным путем утилизации аммиака, образующегося из аминокислот и других азотсодержащих соединений. Синтез мочевины включает образование из углекислого газа и аммиака карбамоилфосфата, который, взаимодействуя с орнитином, дает цитруллин. С участием аминогруппы аспартата через образование промежуточного соединения, аргининоянтарной кислоты, синтезируется аргинин, гидролиз которого дает мочевину и исходный орнитин (рис. 8-8).
Синтез карбамоилфосфата может катализироваться двумя ферментами: митохондриальной карбамоилфосфатсинтазой I, характерной для печени и отчасти кишечника, и широко экспрессируемым белком CAD (карбамоилфосфатсинтазой II), обладающим активностью кар-
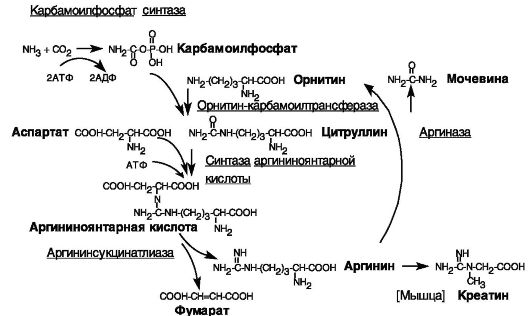 Рис. 8-8. Цикл мочевины
Рис. 8-8. Цикл мочевины
бамоилфосфатсинтазы, аспартаттранскарбамилазы и дигидрооротазы, который катализирует 3 из 6 реакций биосинтеза пиримидинов.
Перенос карбамоильной группы на орнитин катализируется орнитин-карбамоилтрансферазой. Митохондриальный фермент экспрессируется преимущественно в печени и слизистой кишечника. Недостаточность фермента является одной из причин гипераммониемии, сопровождающейся рвотой, летаргией, припадками и иногда смертью.
Недостаточность аргининосукцинатсинтазы, фермента, катализирующего взаимодействие цитруллина и аспартата, ведет к цитруллинемии, сопровождающейся приступами рвоты и задержкой умственного развития. Образование аргинина из аргининоянтарной кислоты катализируется аргининосукцинатлиазой. Недостаточность фермента служит причиной аргининсукциникэсидурии, сопровождающейся отставанием в умственном и физическом развитии, увеличением печени, повреждениями покровов, периодической потерей сознания.
Образование мочевины из аргинина катализируется аргиназой. Фермент представлен двумя изозимами (I и II). Цитозольная аргиназа I (гомотример) экспрессируется преимущественно в печени, где обеспечивает образование мочевины. Недостаточность печеночной аргиназы вызывает аргининемию, сопровождающуюся задержкой развития психомоторной функции, спастическим параличом четырех конечнос-
тей. Экспрессия аргиназы I, а также митохондриальной аргиназы II (гомогексамер) в других органах и тканях может обеспечивать другие стороны обмена азотистых соединений (обеспечение орнитина для биосинтеза глутамата, глутамина, ГАМК, агматина, полиаминов, креатина, пролина, NO). В частности, аргиназа может конкурировать с NO- синтазой за аргинин как субстрат и тем самым участвовать в регуляции процессов, управляемых NO и цГМФ (например, эрекции).
Ферменты цикла мочевины стимулируются катаболическими гормонами (глюкокортикоидами, глюкагоном) на транскрипционном уровне. Индукция может быть прямой или опосредованной через стимуляцию биосинтеза транскрипционного фактора C/EBP (рис. 8-9).
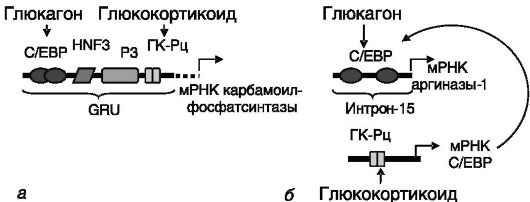 Рис. 8-9. Отдаленный
энхансер обеспечивает стимуляцию транскрипции гена
карбамоилфосфатсинтазы глюкокортикоидами и глюкагоном (а). Энхансер гена
аргиназы-1 обеспечивает стимуляцию глюкагоном и (опосредованно, через
индукцию C/EBP) глюкокортикоидами (б):
Рис. 8-9. Отдаленный
энхансер обеспечивает стимуляцию транскрипции гена
карбамоилфосфатсинтазы глюкокортикоидами и глюкагоном (а). Энхансер гена
аргиназы-1 обеспечивает стимуляцию глюкагоном и (опосредованно, через
индукцию C/EBP) глюкокортикоидами (б):
С/ЕВР - белок, связывающий ССААТ/энхансер; HNF3 - ядерный фактор гепатоцитов 3; GRU - глюкокортикоидчувствительная единица
Рекомендуемая литература
Adibi S.A. Regulation of expression of the intestinal oligopeptide transporter (Pept-1) in health and disease. Am J Physiol Gastrointest Liver Physiol. 2003;285(5):G779-788.
Curthoys N.P., Gstraunthaler G. Mechanism of increased renal gene expression during metabolic acidosis. Am J Physiol Renal Physiol. 2001;281(3):F381-390.
Desvergne B., Michalik L., Wahli W. Transcriptional regulation of metabolism. Physiol Rev. 2006;86(2):465-514.
Wagner C.A., Lang F., Broer S. Function and structure of heterodimeric amino acid transporters. Am J Physiol Cell Physiol. 2001;281(4):C1077-1093.
Wu G., Jaeger L.A., Bazer F.W., Rhoads J.M. Arginine deficiency in preterm infants: biochemical mechanisms and nutritional implications. J Nutr Biochem. 2004;15(8):442-451.