Эндокринная регуляция. Биохимические и физиологические аспекты : учеб. пособие / А.Н. Смирнов ; под ред. В.А. Ткачука - 2009. - 368 с.
|
|
|
|
ГЛАВА 4. БЕРЕМЕННОСТЬ
Гормоны гонад ответственны за весь цикл размножения, включая созревание гамет, подготовку половых органов и организма в целом к спариванию, а женского организма - и к вынашиванию плода, выкармливанию и выхаживанию потомства.
ПОДГОТОВКА К БЕРЕМЕННОСТИ
Овулировавшая яйцеклетка вместе с окружающими ее гранулезными клетками кумулуса в течение нескольких минут захватывается прилегающим к яичнику бахромчатым концом фаллопиевой трубы (яйцевода) и доставляется к ампулярно-перешеечному соединению, где остается в течение 1-2 дней (у человека) до оплодотворения. Следующая остановка уже оплодотворенной яйцеклетки происходит в перешеечноматочном соединении (3 дня после овуляции), после чего яйцеклетка поступает в полость матки. Продвижение яйцеклетки вдоль яйцевода в значительной мере определяется активностью ресничек клеток слизистой. Как количество, так и двигательная активность ресничек возрастают в периовуляторный период, по-видимому, под влиянием предовуляторного выброса эстрогенов. Двигательная активность ресничек стимулируется также простагландинами, высвобождающимися из овулировавшего фолликула. Прогестерон, напротив, подавляет активность ресничек, а к середине лютеиновой (секреторной) фазы цикла - и их количество. Предполагается, что и встречное движение сперматозоидов в определенной мере зависит от реснитчатого аппарата выстилающего яйцеводы эпителия. Возрастающая в периовуляторный период сократительная активность гладкомышечного слоя яйцеводов (вероятно, под влиянием эстрогенов) обеспечивает, как предполагается, перемешивание секрета железистых клеток яйцеводов, количество которого также возрастает под действием эстрогенов.
Сперматозоиды, поступающие при коитусе в женские половые пути, по мере продвижения к яйцеклетке подвергаются ряду модифи-
каций, определяющих их способность к оплодотворению. Эти модификации, совокупно называемые капаситацией, включают удаление ингибиторов, присутствующих в семенной плазме, структурные и функциональные изменения, индуцируемые различающимся окружением в разных отделах женского репродуктивного тракта, и завершаются акросомной реакцией (слиянием мембраны акросомы - головной лизосомы с плазматической мембраной сперматозоида с выбросом содержимого для проникновения в ооцит). Капаситация зависит от гормонального фона в женском организме, а ее завершающая стадия - от гормонпродуцирующей активности окружающих ооцит клеток кумулуса (скопления); (рис. 4-1). Стимуляция акросомной реакции секретируемым кумулусом прогестероном опосредуется, видимо, негеномным путем особыми мембранными рецепторами прогестерона при сенсибилизирующей поддержке эстрогенов, действующих также негеномным путем. Блокада гормональной индукции акросомной
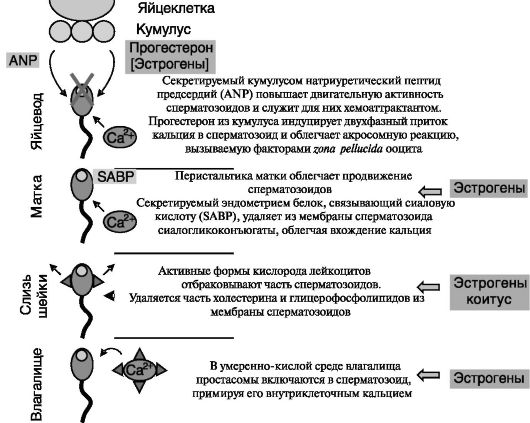 Рис. 4-1. Стадии капаситации и их гормональная регуляция
Рис. 4-1. Стадии капаситации и их гормональная регуляция
реакции под действием антител против лигандсвязывающих доменов рецепторов прогестерона и эстрогенов позволяет предполагать, что мембранные формы рецепторов на поверхности сперматозоида могут представлять собой фрагменты или сплайсинговые варианты классических ядерных рецепторов прогестерона и эстрогенов.
МАТЕРИНСКОЕ УЗНАВАНИЕ БЕРЕМЕННОСТИ
На всем протяжении беременности матка обеспечивает снабжение плода кислородом, питательными веществами, ростовыми факторами. Эти функции матки полностью зависят от гормонов, продуцируемых желтыми телами яичников, а позднее - и плаценты, а также гипофизарных гормонов матери. На ранних стадиях беременности питание и стимуляция роста трофобласта обеспечиваются секрецией железами эндометрия комплекса веществ, включающего разнообразные ферменты, факторы роста, цитокины, гормоны, транспортные белки и т.д., собирательно называемого гистотрофом. Морфогенез и функционирование желез эндометрия зависят от гормонов желтого тела.
Сохранение гормонпродуцирующей функции желтого тела является абсолютно необходимым на начальных этапах беременности. Сигналы, спасающие желтое тело от деградации в самом конце лютеальной фазы цикла, поступают от зародыша.
У жвачных животных таким сигналом является интерферон тау (ИФН-τ). Его экспрессия трофобластом начинается на 8-9-й (овца) или 10-й (корова) день после овуляции и заканчивается, соответственно, на 22-й и 25-й день. При отсутствии беременности регрессия желтого тела происходит из-за пульсовой секреции люминальным эпителием эндометрия матки простагландина PGF2a, которая стимулируется окситоцином, продуцируемым желтым телом и гипофизом. Начало процесса определяется появлением рецепторов окситоцина в эндометрии (у овцы - 10-й день). ИФН-τ тормозит экспрессию рецепторов окситоцина в эндометрии. После 20-го дня желтое тело уже не может продуцировать окситоцин, следовательно, эпизодическая секреция лютеолитического PGF2a не индуцируется, и потребность в продукции ИФН-τ отпадает. Экспрессия самого ИФН-τ индуцируется, как предполагается, ретровирусами, продуцируемыми эпителиальными клетками матки в ответ на действие прогестерона (рис. 4-2).
Пусковым фактором секреции окситоцина клетками желтого тела являются эстрогены, а факторами индукции рецепторов окситоцина
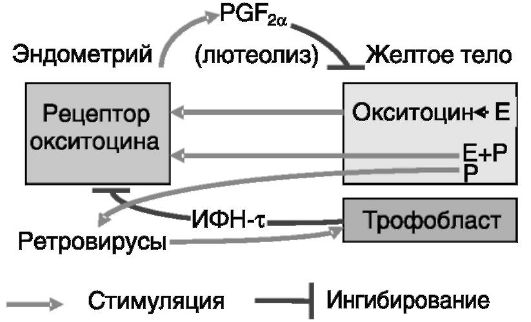 Рис. 4-2. Секреция трофобластом жвачных ИФН-τ ингибирует продукцию эндометрием лютеолитического простагландина F2a (PGF2a), спасая тем самым желтое тело от деградации. E - эстрогены; P - прогестерон
Рис. 4-2. Секреция трофобластом жвачных ИФН-τ ингибирует продукцию эндометрием лютеолитического простагландина F2a (PGF2a), спасая тем самым желтое тело от деградации. E - эстрогены; P - прогестерон
матки - эстрогены + прогестерон. Действие прогестерона на экспрессию рецепторов окситоцина в определенной мере парадоксально. Полагают, что высокий уровень прогестерона в период максимальной активности желтого тела ингибирует экспрессию Э-Рца и за счет этого (т.е. опосредованно) - рецептора окситоцина (промотор гена рецептора окситоцина содержит эстрогенчувствительный элемент - ЭЧЭ). Однако длительное действие прогестерона (к концу лютеиновой фазы цикла) приводит к подавлению экспрессии его собственных рецепторов в клетках люминального и железистого эпителия. В результате снимается прогестероновый блок экспрессии Э-Рца и соответственно рецептора окситоцина. ИФН-τ трофобласта замещает утрату ингибирующего действия прогестерона на экспрессию Э-Рц в эндометрии матки (предположительно посредством индукции транскрипционного репрессора, регуляторного фактора 2 ИФН (IRF-2) и тем самым тормозит экспрессию рецепторов окситоцина (рис. 4-3).
Лютеолитическое действие PGF2a, как предполагается, включает иммунный компонент: индуцируется продукция клетками желтого тела хемоаттрактанта для эозинофильных лейкоцитов, которые, в свою очередь, секретируют цитокины с лютеолитической активностью - фактор некроза опухолей (ФНО-a), интерлейкин 1 (ИЛ-1). Кроме того, PGF2a тормозит стимулирующее действие ЛГ на активность аденилатциклазы клеток желтого тела. В клетках желтого тела имеется система синтеза эндогенных простагландинов из арахидоновой кислоты, высвобождаемой из мембранных липидов фосфолипазами (ФЛ-А2, ФЛ-С, ФЛ-D). Дополнительным источником арахидоновой кислоты служат липид-
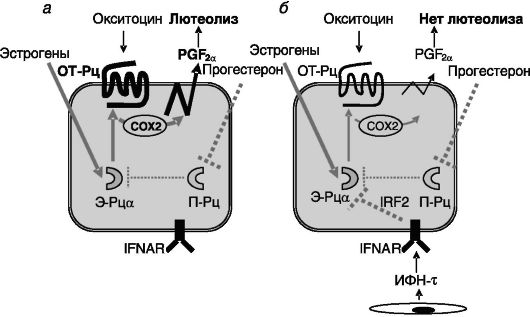 Рис. 4-3. Секретируемый
трофобластом жвачных ИФН-τ (б) компенсирует утрату опосредованного
ингибирующего действия прогестерона на экспрессию рецептора окситоцина
(ОТ-Рц) в конце лютеиновой фазы (а) и тем самым предотвращает секрецию
клетками эндометрия лютеолитического простагландина F2a (PGF2a) в ответ на действие окситоцина:
Рис. 4-3. Секретируемый
трофобластом жвачных ИФН-τ (б) компенсирует утрату опосредованного
ингибирующего действия прогестерона на экспрессию рецептора окситоцина
(ОТ-Рц) в конце лютеиновой фазы (а) и тем самым предотвращает секрецию
клетками эндометрия лютеолитического простагландина F2a (PGF2a) в ответ на действие окситоцина:
П-Рц - рецепторы прогестерона; COX2 - циклоксигеназа 2; IFNAR - рецептор A ИФН; IRF2 - регуляторный фактор 2 ИФН (транскрипционный репрессор)
ные капли в клетках желтого тела, образующиеся в период лютеолиза. Активность ФЛ-А2 в этот период возрастает. Активность ферментов синтеза простагландинов (PG-эндопероксидсинтаз, PG-изомераз, PG- редуктаз) в позднюю лютеальную фазу и при беременности возрастает. Таким образом, в регуляции процесса лютеолиза могут принимать участие простагландины как матки, так и желтого тела. К локальным регуляторам желтого тела относится лютеинизирующего гормона рилизинг-гормон (ЛГРГ), продуцируемый клетками гранулезы. При длительном действии он снижает образование прогестерона.
У видов с гемохориальной плацентой (грызуны, кролик, человек) матка не играет существенной роли в регуляции активности желтого тела.
У свиньи лютеолитическим фактором также служит PGF2a матки, но механизм блокирования лютеолиза трофобластом отличен от описанного выше. Полагают, что трофобласт смещает направление
секреции PGF2a маткой с эндокринного на экзокринный в просвет матки, в результате чего этот простагландин не достигает желтого тела. Это смещение происходит под действием эстрогенов, секретируемых трофобластом, и включает, по-видимому, циркуляцию кальция через эпителий эндометрия. Эстрогены трофобласта, кроме того, поддерживают чувствительность желтого тела к антиапоптотическому действию ЛГ за счет стимуляции экспрессии его рецептора (рис. 4-4). Трофобласт свиньи, как и овцы, секретирует интерфероны (ИФН-γ и ИФН-δ), но их роль в поддержании беременности иная: они стимулируют поляризацию эпителиальных клеток эндометрия, обеспечивающую направленную секрецию гистотрофа в просвет матки.
У грызунов желтое тело спасается лютеотропными факторами (децидуальным лютеотропином - ЛГ и плацентарным лактогеном - ПЛ), которые секретируются децидуальной тканью, формируемой из эндометрия матки под действием плода.
У человека спасение желтого тела осуществляет хорионический гонадотропин (ХГ), секреция которого эмбрионом начинается еще до имплантации (рис. 4-5). В последующий период секреция ХГ поддерживается эстрогенами, прогестероном, глюкокортикоидами, активином. Существенную роль в поддержании желтого тела играет также ПРЛ. ПРЛ ингибирует образование в желтом теле простагландинов, увеличивает чувствительность клеток к ЛГ. Для инициации беременности существенную роль играет рефлекторный выброс ПРЛ при коитусе. При блокировке секреции ПРЛ бромкриптином продукция прогестерона падает, и эмбрионы рассасываются.
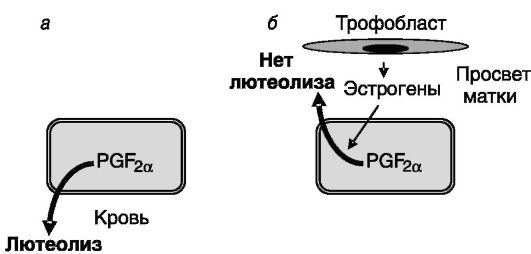 Рис. 4-4. Продуцируемые трофобластом свиньи эстрогены (б) смещают направление секреции эндометрием лютеолитического простагландина F2a (PGF2a) с эндокринного (а) на экзокринное (б), что предотвращает деградацию желтого тела в конце лютеиновой фазы цикла
Рис. 4-4. Продуцируемые трофобластом свиньи эстрогены (б) смещают направление секреции эндометрием лютеолитического простагландина F2a (PGF2a) с эндокринного (а) на экзокринное (б), что предотвращает деградацию желтого тела в конце лютеиновой фазы цикла
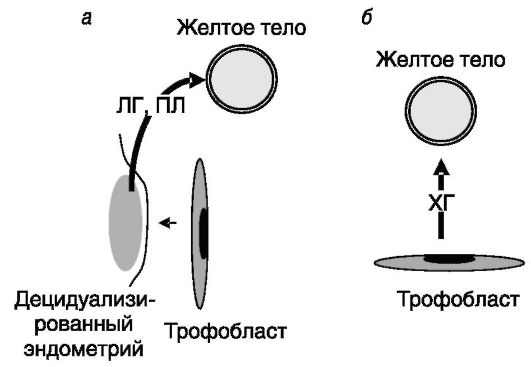 Рис. 4-5. У
грызунов (а) желтое тело спасается в конце лютеиновой фазы ЛГ и ПЛ,
секретируемыми децидуализированным под действием трофобласта
эндометрием, а у человека (б) - ХГ трофобласта
Рис. 4-5. У
грызунов (а) желтое тело спасается в конце лютеиновой фазы ЛГ и ПЛ,
секретируемыми децидуализированным под действием трофобласта
эндометрием, а у человека (б) - ХГ трофобласта
У видов с эндотелиохориальным типом плаценты (хищники - собака, кошка), у которых длительность функционирования желтого тела вне беременности равна продолжительности беременности, нет необходимости спасать желтое тело. Соответственно у них ни матка, ни плод не влияют на секрецию прогестерона желтым телом.
Иммуносупрессия
Плод можно рассматривать как аллотрансплантат. Предотвращение его отторжения происходит с участием гормональных механизмов. У овцы важную роль в этом процессе играет прогестерон. До 50-го дня беременности, т.е. до полного завершения имплантации и развития независимости матки от прогестерона желтого тела, сравнительно невысокие концентрации прогестерона индуцируют секрецию эндометрием двух так называемых маточных белков молока (UTMP), ингибирующих функции лимфоцитов. После 50-го дня высокий уровень прогестерона, продуцируемого плацентой, дополнительно оказывает прямое ингибиторное действие на пролиферацию лимфоцитов. Данные механизмы подавляют иммунный ответ в области контакта матки и плаценты без иммуносупрессии на системном уровне.
UTMPs, компоненты гистотрофа, относятся к семейству ингибиторов сериновых протеиназ (серпинов). У овцы продуцируются исключительно клетками железистого эпителия эндометрия. Парадоксально, но для стимулирующего действия прогестерона на экспрессию UTMPs
необходимо подавление прогестероном экспрессии собственных рецепторов в этих клетках. Предполагаемый механизм индукции UTMP включает опосредованное ретровирусом стимулирующее действие прогестерона на секрецию трофобластом ИФН-τ, который, в свою очередь, индуцирует экспрессию транскрипционного фактора IRF-1, стимулирующего активность промотора UTMP. Пермиссивным фактором для действия IRF-1 служит снятие прямого тормозного действия прогестерона на активность промотора UTMP благодаря ингибированию прогестероном экспрессии собственных рецепторов. Через несколько дней к стимулирующему эффекту ИФН-τ добавляется действие ПЛ, также продуцируемого трофобластом. Этому действию ПЛ способствует ИФН-τ, который стимулирует образование белка OAS, регулирующего активность рецептора ПЛ (рис. 4-6).
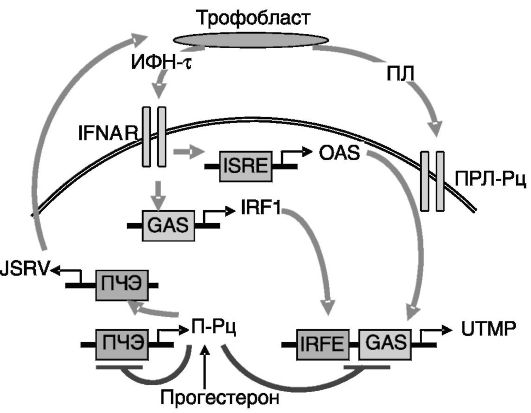 Рис. 4-6. Предполагаемые
механизмы индукции экспрессии UTMP в железистых клетках эндометрия.
Транскрипционные факторы, опосредующие активность рецептора А
интерферона (IFNAR) и рецептора пролактина (ПРЛ-Рц) (STAT1, ISGF3 и
STAT5), не показаны:
Рис. 4-6. Предполагаемые
механизмы индукции экспрессии UTMP в железистых клетках эндометрия.
Транскрипционные факторы, опосредующие активность рецептора А
интерферона (IFNAR) и рецептора пролактина (ПРЛ-Рц) (STAT1, ISGF3 и
STAT5), не показаны:
П-Рц - рецепторы прогестерона; ПЧЭ - прогестерончувствительный элемент; GAS - активируемая ИФН-α последовательность; IRF1 - регуляторный фактор 1 ИФН; ISRE - чувствительный к стимулируемому интерфероном генному фактору 3 элемент; OAS - 2',5'-олигоаденилатсинтаза; IRFE - чувствительный к IRF элемент; JSRV - ретровирус
Другим фактором гистотрофа, ингибирующим отторжение трофобласта, является утероглобин, небольшой белок семейства секретоглобинов. За счет двух межцепочечных дисульфидных связей формирует гомодимеры с расположенной между цепями гидрофобной полостью, способной связывать прогестерон и другие низкомолекулярные гидрофобные соединения. Утероглобин обладает противовоспалительной и антихемотаксической активностями. Одним из механизмов этого действия может служить связывание утероглобином стимулирующего воспаление, лютеолиз и сокращения матки PG F2a. (Провоспалительное действие PGF2a включает цепочку: рецептор PGF2a FP → ... →транскрипционный фактор NF-kB → COX2 → фосфолипидные посредники воспаления.) В отличие от UTMP стимулирующее действие прогестерона на экспрессию утероглобина является прямым. Действие прогестерона усиливается эстрогенами и ПРЛ, причем прогестерон дополнительно выполняет пермиссивную функцию по отношению к проведению сигнала пролактина, индуцируя экспрессию транскрипционного фактора RUSH (RING-finger motif protein cloned in rabbit, binds the uteroglobin promoter, SWI/SNF-related, and Helicase-like, белка, содержащего пальцевый мотив RING, связывающего промотор утероглобина, родственного SWI/SNF и подобного геликазе), активируемого ПРЛ (рис. 4-7).
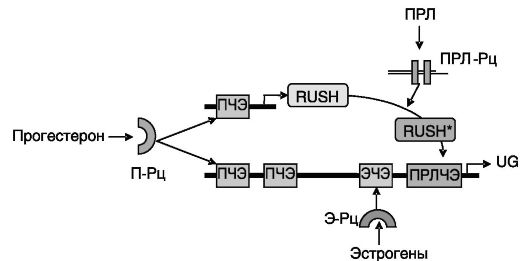 Рис. 4-7. Гормональная
регуляция экспрессии утероглобина: П-Рц, Э-Рц и ПРЛ-Рц-рецепторы
прогестерона, эстрогенов и ПРЛ; ПЧЭ, ЭЧЭ и ПРЛЧЭ - прогестерон-,
эстроген- и пролактинчувствительные элементы; RUSH - транскрипционный
фактор
Рис. 4-7. Гормональная
регуляция экспрессии утероглобина: П-Рц, Э-Рц и ПРЛ-Рц-рецепторы
прогестерона, эстрогенов и ПРЛ; ПЧЭ, ЭЧЭ и ПРЛЧЭ - прогестерон-,
эстроген- и пролактинчувствительные элементы; RUSH - транскрипционный
фактор
Децидуализация эндометрия
Децидуальная реакция, готовящая матку к имплантации зародыша, включает процессы морфологической и биохимической дифференцировки стромальных клеток эндометрия (приобретение округлой формы и свойств миофибробластов, секреция ряда маркерных биологически активных соединений, включая ПРЛ, ИФРСБ1, тканевый фактор). У приматов в отсутствие имплантации трофобласта и при низком уровне прогестерона в конце секреторной фазы децидуализированный верхний слой эндометрия отторгается, и происходит менструация. При наступлении беременности децидуальная реакция распространяется на базальный слой эндометрия, обеспечивая возможность инвазии трофобласта и образования плаценты. В развитии децидуальной реакции принимают участие многие сигнальные соединения, включая простагландины, фактор, ингибирующий лейкоз, ИЛ-11 и прогестерон. Нарушение их продукции или рецепции приводит к прекращению беременности. Децидуальная реакция включает также перестройку сосудистого русла матки и приток естественных киллеров и макрофагов, служащих защитой от воспаления и окислительного стресса.
Центральную роль в индукции децидуальной реакции играет прогестерон, действующий синергично с другими сигнальными соединениями, в частности стимулирующими продукцию в клетках цАМФ. К таким соединениям относятся ЛГ, ХГ, кортиколиберин, релаксин, PGE2, действующие через рецепторы, сопряженные с G-белками. Преобладающим или единственным сенсором цАМФ в стромальных клетках эндометрия служит ПК-A. Синергизм прогестерона и факторов, повышающих уровень цАМФ, определяется несколькими механизмами: прямым взаимодействием рецептора прогестерона A с транскрипционными факторами, активируемыми цАМФ, в частности с активирующей формой (LAP) белка β, связывающего CCAAT/энхан- сер (C/EBPβ); стимуляцией прогестероном экспрессии Gas белка, участвующего в активации аденилатциклазы, и др. Предполагается, что одной из функций секретируемого трофобластом ХГ как раз и является поддержание процесса децидуализации на фоне сравнительно низкого уровня прогестерона в конце лютеиновой фазы цикла.
Важную роль в децидуализации матки и имплантации играет локально образующийся ингибиторный фактор лейкоза (LIF). Самки мышей с нокаутированным геном LIF нефертильны из-за дефектов в децидуализации эндометрия матки и имплантации эмбриона. Заместительная терапия LIF таких животных обеспечивает нормаль-
ную имплантацию и беременность. Пассивная иммунизация овец и коров против LIF снижает частоту наступления беременности.
Для децидуализации матки требуется также ИЛ-11. Нокаут гена ИЛ- 11Рц α у мыши блокировал имплантацию, но не влиял на другие стороны репродуктивной функции у самок, а самцы были фертильными. В децидуоме LIF экспрессируется между 2,5 и 3,5 днями после коитуса и затем быстро снижается, а ИЛ-11 достигает максимума между 5,5 и 7,5 днями (имплантация происходит на 4,5 день). Очевидно, LIF действует в более раннем звене каскада децидуализации.
У мыши имплантация зависит от эстрогенов, и экспрессия LIF в эндометрии овариэктомированных животных стимулируется эстрогеном, но не прогестероном. У кролика эстрогены для имплантации не требуются, и экспрессия LIF стимулируется прогестероном, но не эстрогенами. У человека ситуация с регуляцией экспрессии LIF не ясна.
У мыши экспрессия формирующих гетероолигомерный рецептор LIF LIF-R и gp130 в децидуоме во времени совпадает с экспрессией самого LIF. Максимальная экспрессия субъединиц рецептора наблюдается в слое клеток, примыкающих к эмбриону. К 8,5 дню экспрессия LIF-R снижается, а gp130 сохраняется и даже растет. У человека LIF-R экспрессируется на протяжении цикла очень слабо, а gp130 - на измеримом уровне с максимумом в секреторную фазу. В I триместре небольшая экспрессия LIF-R наблюдается в децидуоме и высокая - в ворсинках.
LIF, LIF-R и gp130 экспрессируются клетками детской части плаценты и плода, и LIF оказывает выраженное действие на развитие
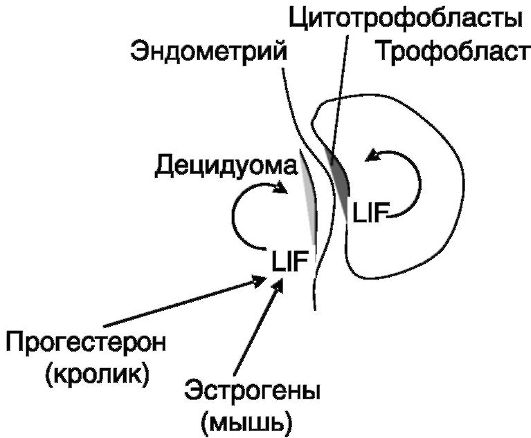 Рис. 4-8. Участие LIF в имплантации
Рис. 4-8. Участие LIF в имплантации
зародыша, в частности, тормозя дифференцировку плюрипотентных стволовых клеток и стимулируя дифференцировку цитотрофобластов в направлении ворсинчатого фенотипа, обеспечивающего заякоривание зародыша на матке. Таким образом, LIF выполняет функцию паракринного стимулятора имплантации, действующего и с материнской, и с детской стороны (рис. 4-8).
ПОДДЕРЖАНИЕ БЕРЕМЕННОСТИ
Прогестерон. Центральную роль в поддержании беременности играет прогестерон. Блокирование продукции (например, с помощью овариэктомии) или действия (например, введением антигестагена) прогестерона у всех видов млекопитающих приводит к прекращению беременности. При этом не существенно, растет ли уровень прогестерона при беременности (у человека, морской свинки) или нет (у свиньи, хорька) по сравнению с лютеиновой фазой цикла (рис. 4-9).
У ряда видов (кролик, коза) основным источником прогестерона на протяжении всей беременности являются желтые тела яичников, и овариэктомия на любой стадии беременности ведет к аборту. У других видов (человек, овца) в последние 2/3 беременности прогестерон продуцируется преимущественно плацентой, и овариэктомия в этот период не вызывает аборта. Факторы, поддерживающие продукцию прогестерона в ходе беременности, также различны у разных видов. У кролика, свиньи, козы ведущую роль играют гипофизарные гормоны (ПРЛ, ФСГ, ЛГ), и гипофизэктомия на любой стадии беременности ведет к аборту. У крысы, овцы, человека главную роль играют лютеотропные факторы плаценты, которые также способны стимулировать биосинтез прогестерона в плаценте (ХГ, плацентарные лактогены, ПРЛ, ЛГ), и гипофизэктомия во 2-ю половину беременности не приводит к аборту.
Эстрогены. Эффективность действия прогестерона на матку в значительной мере зависит от эстрогенов, которые стимулируют экспрессию П-Рц. У крысы эстрогены играют также важную роль в поддержании биосинтеза прогестерона. Эстрогены выполняют и самостоятельную функцию, стимулируя рост матки. Источники эстрогенов различаются у разных видов: у крысы это фолликулы яичников, у человека - плацента, причем основным субстратом биосинтеза эстрогенов в плаценте служит сульфат дегидроэпиандростерона
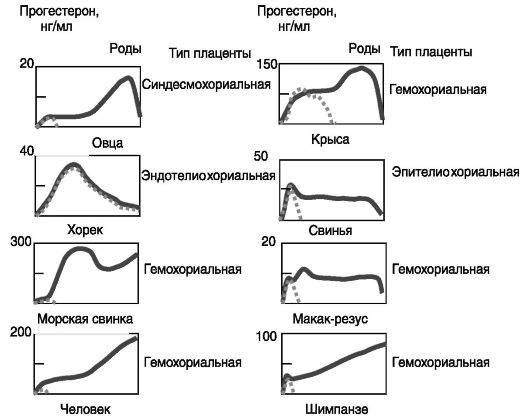 Рис. 4-9. Динамика
концентрации прогестерона в крови при беременности (сплошная линия) и в
лютеальную фазу цикла (пунктир) у разных видов, животных и человека
Рис. 4-9. Динамика
концентрации прогестерона в крови при беременности (сплошная линия) и в
лютеальную фазу цикла (пунктир) у разных видов, животных и человека
(ДГЭА-С), поступающий из надпочечников плода, и его 16а-гидрок- сипроизводное, образующееся в печени плода (рис. 4-10).
Динамика основных гормонов в ходе беременности у человека показана на рис. 4-11. Снижение продукции ХГ после I триместра связано со смещением продукции прогестерона и эстрогенов из яичников в плаценту, где основным стимулятором стероидогенеза становится ПЛ.
Обеспечение роста плода. В развитии системы снабжения плода кислородом и питательными веществами и удаления шлаков важную роль играют образующиеся в плаценте паракринные факторы семейства СТГ, пролиферин (PLF) и белок, родственный пролиферину (PRP). PLF стимулирует прорастание сосудов матки в сторону трофобласта. На более поздней стадии беременности PRP, напротив,
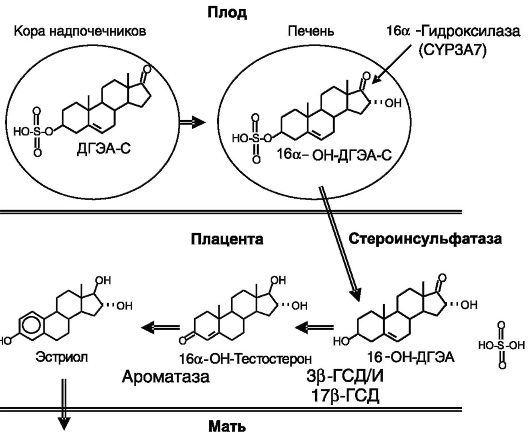 Рис. 4-10. Фетоплацентарная система биосинтеза эстрогенов у человека: ГСД - гидроксистероиддегидрогеназа; И - изомераза
Рис. 4-10. Фетоплацентарная система биосинтеза эстрогенов у человека: ГСД - гидроксистероиддегидрогеназа; И - изомераза
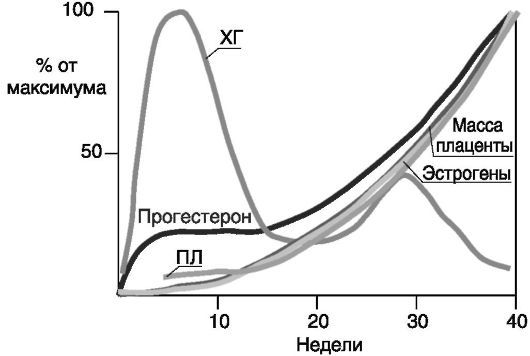 Рис. 4-11. Динамика гормонов при беременности у человека
Рис. 4-11. Динамика гормонов при беременности у человека
ограничивает направленное друг к другу прорастание сосудов матери и плода, обеспечивая автономность сосудистой системы плода (рис. 4-12).
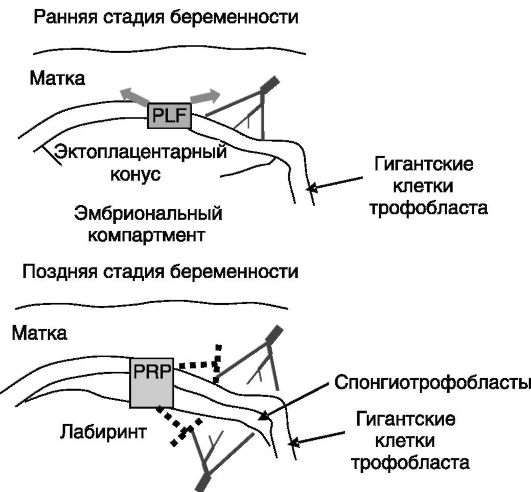 Рис. 4-12. Секретируемый
гигантскими клетками трофобласта PLF стимулирует пролиферацию клеток
матки и ангиогенез в матке с появлением непосредственных контактов
клеток трофобласта с кровью матери. На более поздней стадии беременности
PRP, секретируемый гигантскими клетками и спонгиотрофобластами,
ингибирует прорастание сосудов матери в плодную часть, сосудов плода в
матку и миграцию клеток эндотелия матери в область контактов ее сосудов с
трофобластом
Рис. 4-12. Секретируемый
гигантскими клетками трофобласта PLF стимулирует пролиферацию клеток
матки и ангиогенез в матке с появлением непосредственных контактов
клеток трофобласта с кровью матери. На более поздней стадии беременности
PRP, секретируемый гигантскими клетками и спонгиотрофобластами,
ингибирует прорастание сосудов матери в плодную часть, сосудов плода в
матку и миграцию клеток эндотелия матери в область контактов ее сосудов с
трофобластом
Другие представители семейства СТГ, ПЛ и СТГ-2, также образующиеся в плаценте, как принято считать, стимулируют мобилизацию материнских запасов питательных веществ (вызывая гипергликемию, мобилизацию аминокислот у матери) и их усвоение плодом (за счет снабжения субстратами и через стимуляцию секреции инсулина и
ИФР (рис. 4-13).
Вместе с тем ряд экспериментальных данных не укладывается в данную концепцию. Так, введение плодам овец ПЛ практически не оказывало влияния ни на их рост, ни на уровни ИФР-I, ИФР-II и
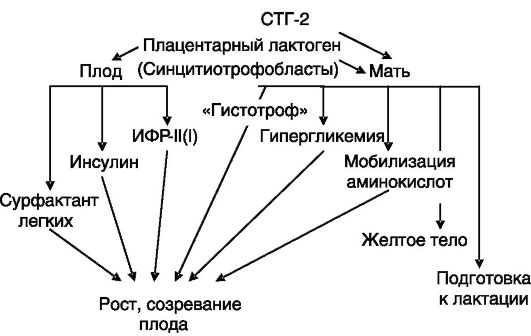 Рис. 4-13. ПЛ
стимулирует поступление к плоду питательных веществ от матери и
утилизацию этих веществ плодом для роста и развития. Часть эффектов ПЛ у
матери дублируется СТГ-2, секретируемым плацентой
Рис. 4-13. ПЛ
стимулирует поступление к плоду питательных веществ от матери и
утилизацию этих веществ плодом для роста и развития. Часть эффектов ПЛ у
матери дублируется СТГ-2, секретируемым плацентой
инсулина или оказывало очень небольшое стимулирующее действие. У плодов коровы уровень ПЛ обратно коррелировал с массой тела и скоростью роста и в ходе беременности снижался при росте уровней ИФР-I и ИФР-II.
РОДЫ
Для родов необходимы координированное повышение сократимости матки, раскрытие шейки матки, созревание плода для выживания вне матки и подготовка материнского организма к лактации.
Переход матки из состояния относительного покоя на протяжении беременности к родовой деятельности связан с повышением экспрессии рецепторов окситоцина в миометрии, увеличением плотности щелевых контактов в миометрии и раскрытием шейки матки.
У большинства млекопитающих эти процессы инициируются падением секреции прогестерона. В результате снятия прогестеронового блока при сохранении высокого уровня эстрогенов усиливается сократительная активность миометрия, инициирующая роды. У приматов и морской свинки родовая деятельность связана не с падением уровня прогестерона, а с функциональной блокировкой действия прогестерона. Эта блокировка отчасти связана со снижением экспрессии
в матке П-Рц и/или изменением соотношения изоформ рецепторов и подавлением экспрессии коактиваторов П-Рц (CBP, SRC-2,3), сопровождающимся снижением уровня ацетилирования гистонов. Стимул к родовой деятельности исходит от плода и связан с отставанием роста матки от роста плода. Продолжительность беременности определяется генотипом плода: у суррогатных матерей-овец время вынашивания зависело от породы плодов.
Активация миометрия. В конце беременности миометрий матки «активируется», т.е. приобретает под действием механических стимулов и эстрогенов способность к спонтанным и индуцированным различными факторами сокращениям. Стимуляция активированного миометрия простагландинами, окситоцином ведет к родовой деятельности. Ключевым ферментом, запускающим сокращение миометрия, является киназа легких цепей миозина (myosin light chain kinase, MLCK). Релаксация происходит за счет дефосфорилирования легких цепей миозина под действием фосфатазы типа 2A. MLCK активируется взаимодействием с комплексом Ca2+-кальмодулин (Ca-CAM). Сродство MLCK к Ca-CAM снижается при фосфорилировании MLCK ПК-A, что ведет к инактивации MLCK. Существенно, что ПК-A инактивирует MLCK даже в присутствии Ca-CAM (рис. 4-14). Таким образом, сократимость матки стимулируется факторами, усиливающими поступление Ca2+ извне через кальциевые каналы плазматической мембраны (простагландины) или выхода Ca2+ из внутриклеточных депо (простагландины, окситоцин), и тормозится факторами, повышающими в клетке уровень цАМФ (агонисты β-адренорецепторов,
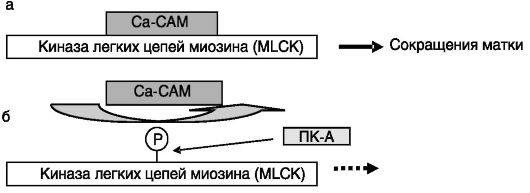 Рис. 4-14. Родовая
деятельность инициируется взаимодействием Ca-CAM с MLCK (а). Состояние
покоя поддерживается фосфорилированием MLCK ПК-A и низким уровнем
внутриклеточного Ca2+ (б)
Рис. 4-14. Родовая
деятельность инициируется взаимодействием Ca-CAM с MLCK (а). Состояние
покоя поддерживается фосфорилированием MLCK ПК-A и низким уровнем
внутриклеточного Ca2+ (б)
релаксин, PGI2), а также цГМФ, ингибирующих активность MLCK или тормозящих выход Ca2+ из депо (рис. 4-15).
Координация сокращений клеток миометрия достигается за счет установления щелевых контактов, состоящих из сотен пор, формируемых коннексинами в присутствии молекул адгезии. Резкое увеличение экспрессии коннексинов начинается за 48 ч до родов с максимумом в момент родов. Функциональная активность щелевых контактов регулируется фосфорилированием коннексинов.
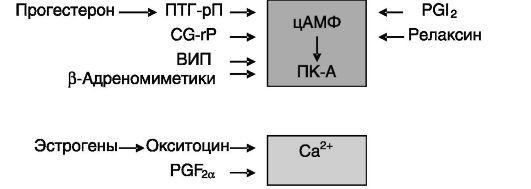 Рис. 4-15. Эндокринные факторы, влияющие на активность миометрия посредством изменения соотношения цАМФ и Ca2+:
Рис. 4-15. Эндокринные факторы, влияющие на активность миометрия посредством изменения соотношения цАМФ и Ca2+:
CG-RP - пептид, относящийся к гену кальцитонина; ПТГ-рП - пептид, родственный паратгормону; ВИП - вазоактивный интестинальный пептид
Состояние покоя миометрия на протяжении большей части беременности поддерживается рядом ингибиторов. Экспрессия одного из них - пептида, родственного паратгормону (PTH-related peptide, ПТГ-рП), - стимулируется в миометрии прогестероном и ТФР-β. Рецептор ПТГ-рП локализован также в миометрии и через Gs-белок способен повышать уровень цАМФ в клетках. Другим ингибитором служит релаксин. Этот эндокринный/паракринный фактор продуцируется плодом, децидуальной тканью матки и плацентой, а также желтым телом матери. Рецептор релаксина обнаружен в децидуальной ткани, хориотрофобластах, шейке матки, где релаксин стимулирует экспрессию металлопротеиназ матрикса. В миометрии релаксин блокирует действие стимуляторов сокращений за счет опосредуемого ПК-A фосфорилирования G-белков, связанных с фосфолипазой C, что ведет к блокированию аккумуляции инозитолтрифосфата (IP3) и повышению [Ca2+]i. Еще одним ингибитором сокращений миомет-
рия служит простациклин PGI2, который также повышает уровень цАМФ. В качестве ингибитора может выступать NO. Экспрессия индуцибельной NO-синтазы (iNOS) в миометрии максимальна в конце беременности и снижается перед родами. Ингибиторами могут также служить CG-rP, ВИП и агонисты β-адренорецепторов, стимулирующие аккумуляцию цАМФ.
Релаксин. Основным источником релаксина кровотока матери служат желтые тела. У крысы, мыши и свиньи релаксин запасается в секреторных гранулах, которые высвобождают содержимое при лютеолизе незадолго до родов, что создает предродовой всплеск релаксина у этих видов. У человека релаксин, во-первых, не запасается в секреторных гранулах и, соответственно, не дает предродового всплеска и, во-вторых, его уровень в крови очень низок по сравнению с максимальными значениями у крысы или свиньи (рис. 4-16).
Эксперименты с блокированием образования или действия релаксина у мыши, крысы и свиньи показали, что этот гормон играет важную роль в процессе родов. В отсутствие действия релаксина продолжительность родов и гибель новорожденных существенно увеличиваются. Участие релаксина в родовом акте у человека не доказано. Основными объектами действия релаксина служат шейка матки, влагалище и лонное сочленение малого таза. Релаксин стимулирует рост шейки матки (зависимо от эстрогенов у крысы, независимо - у свиньи) и увеличивает ее эластичность. Последний эффект связан с дезорганизацией волокон внеклеточного матрикса, вызываемой стимуляцией секреции металлопротеиназ (коллагеназы, эластазы и т.д.), разрушающих внеклеточный матрикс, и протеогликанов, препятствующих фибриллогенезу. Прогестерон препятствует указанным эффектам релаксина на протяжении большей части беременности, но предродовое снижение уровня прогестерона приводит к снятию этого блока. Сходное действие (ростовое и стимулирующее эластичность) релаксин оказывает на влагалище. Трансформация фиброзно-хрящевого лонного сочленения в удлиненную гибкую эластичную связку была первым выявленным эффектом релаксина у морской свинки, позволивший идентифицировать данный гормон.
Помимо действия на репродуктивный тракт, релаксин участвует в адаптациях сердечно-сосудистой системы и системы осморегуляции к беременности и служит одним из факторов подготовки к лактации (см. ниже).
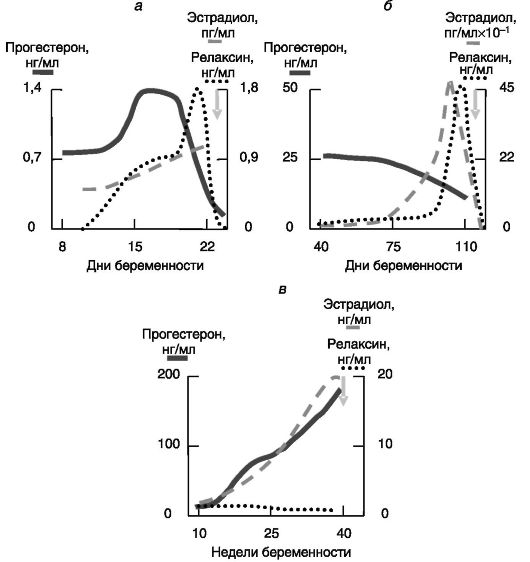 Рис. 4-16. Динамика изменений концентрации прогестерона, эстрадиола и релаксина при беременности у крысы (а), свиньи (б) и человека (в)
Рис. 4-16. Динамика изменений концентрации прогестерона, эстрадиола и релаксина при беременности у крысы (а), свиньи (б) и человека (в)
Гипоталамо-гипофизарно-адреналовая система в инициации родов.
Переход миометрия от фазы покоя к фазе активации включает координированную экспрессию ряда белков, обеспечивающих возможность синхронных, высокоамплитудных и высокочастотных сокращений матки. К этим белкам относятся ионные каналы, рецепторы стимуляторов сокращений, белки щелевых контактов. Сигналами служат механические стимулы от плода и эндокринные факторы.
Так, введение силастиковой трубки в пустой рог матки унилатерально беременных крыс индуцировало экспрессию коннексина-43 в миометрии (до уровня экспрессии в роге с плодами), но эта индукция происходила лишь при проведении операции на поздней стадии беременности, когда уровень прогестерона начинал снижаться. В гене коннексина-43 обнаружен элемент, чувствительный к растяжению клетки, что, вероятно, и определяет влияние механических стимулов на экспрессию данного гена.
Полагают, что рост матки в ходе беременности проходит в 3 стадии. В I триместре рост связан с гиперплазией и контролируется эндокринными факторами. На второй стадии, охватывающей II и III триместры, рост матки в точности следует росту плода. На третьей стадии рост матки начинает отставать от роста плода, что ведет к растяжению и напряжению стенки матки. Это отставание роста матки, возможно, связано с предродовым снижением уровня прогестерона (у овец и других животных). В свою очередь, снижение прогестерона связывают с активацией гипоталамо-гипофизарно-адреналовой оси плодов.
Установлено, что повреждение этой оси на любом уровне приводит к задержке родов, а введение адренокортикотропного гормона (АКТГ) или глюкокортикоидов сопровождается родами через 3- 5 дней. Уровень кортизола у плодов растет экспоненциально на протяжении последних 10 дней беременности с максимумом в момент родов. В этот период система отрицательной обратной связи между глюкокортикоидами и АКТГ не функционирует или ослаблена. Помимо кортиколиберина одним из факторов, стимулирующих секрецию АКТГ в этот период, может служить аргинин-вазопрессин, секретируемый аксонами вазопрессинергических нейронов непосредственно в переднюю долю гипофиза или транспортируемый кровью из гипоталамуса. Кортиколиберин и аргинин-вазопрессин действуют на секрецию АКТГ синергично, используя разные системы проведения сигнала (соответственно аденилатциклаза→цАМФ→ПК-A и ФЛ-С→ обмен фосфатидилинозитола→ПК-C). Определенную роль в усилении секреции глюкокортикоидов перед родами может играть изменение спектра секретируемых продуктов проопиомеланокортина: в этот период снижается уровень крупномолекулярных предшественников АКТГ (которые могут служить антагонистами АКТГ) и увеличивается доля самого АКТГ. Еще одной из причин усиления продукции глюкокортикоидов в конце беременности является значительное повышение экспрессии рецептора АКТГ в коре надпочечников в этот период и
повышение степени сопряжения активации рецептора с продукцией цАМФ и последующим усилением экспрессии стероидогенных ферментов P-450C17, P-450C11, P-450C21, 3β-ГСД.
Предполагается несколько механизмов ослабления отрицательной обратной связи между глюкокортикоидами и АКТГ. Во-первых, у плодов, в отличие от взрослых, глюкокортикоиды не подавляют, а стимулируют секрецию печенью транскортина. В результате, несмотря на рост секреции кортизола, уровень свободного гормона в плазме крови плодов остается относительно неизменным на протяжении беременности, за исключением последних нескольких часов перед родами, когда емкости транскортина не хватает и происходит резкий подъем свободного кортизола. Во-вторых, в гипофизе плодов активна 11β- ГСД типа 1, превращающая активный гормон кортизол в неактивный метаболит кортизон (в других тканях плодов, например в печени, тот же фермент катализирует обратную реакцию). В-третьих, перед родами значительно снижается экспрессия рецептора глюкокортикоидов в гипофизе, кортиколиберинергических и аргинин-вазопрессинергических нейронах гипоталамуса и в гиппокампе, что может служить причиной снижения эффективности действия глюкокортикоидов в системе отрицательной обратной связи на разных уровнях. Кроме того, глюкокортикоиды снижают экспрессию в кортиколиберинергических нейронах проэнкефалина, тормозящего действие кортиколиберина на секрецию АКТГ кортикотрофами гипофиза.
Досрочная активация оси гипоталамус-гипофиз-надпочечники плодов, возможно, служит причиной преждевременных родов при фетальном стрессе, вызванном, например, гипоксией. Следует отметить, что гипоксия плода развивается и в периоды спонтанных сокращений матки в предродовой период.
Повышение уровня кортизола у плодов в предродовой период ведет к изменениям продукции прогестерона (снижение) и эстрогенов (повышение) плацентой (рис. 4-17).
Наиболее значительным отличием приматов, включая человека, от других видов животных в плане механизмов инициации родов является отсутствие выраженного снижния уровня прогестерона в предродовой период. Как отмечалось, прогестерон блокирует экспрессию белков, связанных с сокращением миометрия, и блокирует роды. (Основным источником прогестерона у человека после 5-6 нед беременности становятся синцитиотрофобласт и хорионические трофобласты плаценты.) Предполагается, что высокий уровень прогесте-
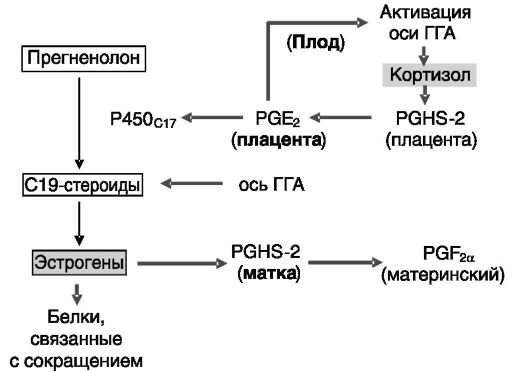 Рис. 4-17. Кортизол
плода стимулирует образование эстрогенов в плаценте, которые, в свою
очередь, индуцируют факторы сократимости матки: ГГА -
гипоталамус-гипофиз-надпочечники; PGHS-2 - простагландинсин- таза-2
Рис. 4-17. Кортизол
плода стимулирует образование эстрогенов в плаценте, которые, в свою
очередь, индуцируют факторы сократимости матки: ГГА -
гипоталамус-гипофиз-надпочечники; PGHS-2 - простагландинсин- таза-2
рона в предродовой период обеспечивает сохранение заторможенного состояния миометрия нижней части матки, что способствует продвижению плода по родовым путям. Для объяснения причины наступления родов в присутствии высокого уровня прогестерона выдвигается предположение о существовании локально действующих факторов, регулирующих эффективность прогестерона.
В качестве одного из таких факторов мог бы служить кортиколиберин. Действуя через рецептор CRH-R1, кортиколиберин может стимулировать аккумуляцию цАМФ и тем самым тормозить сократимость миометрия. Экспрессия CRH-R1 в нижней части миометрия значительно выше, чем в верхней. Молекулярным механизмом снижения чувствительности миометрия к прогестерону может служить выявленное предродовое падение экспрессии коактиваторов рецепторов прогестерона с одновременным снижением уровня ацетилирования гистонов (т.е. снижением пермиссивности среды для транскрипции).
Родовая деятельность стимулируется рядом факторов. Одним из них служит окситоцин, который продуцируется не только гипоталамусом, но и плодом, амнионом, хорионом и децидуальной тканью матки, причем к концу беременности продукция окситоцина этими тканями увеличивается. Кроме того, к моменту родов резко возрас-
тает чувствительность миометрия к окситоцину, что, по-видимому, связано с многократным ростом экспрессии рецептора окситоцина. В момент родов между секрецией окситоцина гипофизом и индуцированными им (через простагландины) сокращениями матки возникает система положительной обратной связи.
Простагландины. Важным индуктором родовой деятельности служат также простагландины, которые синтезируются из арахидоновой кислоты, образующейся при гидролизе мембранных фосфолипидов под действием ФЛ-А2 или ФЛ-C.
Превращение арахидоновой кислоты в простагландины катализируется простагландинсинтазами, обладающими циклооксигеназной и пероксидазной активностями. Простагландинсинтаза-1 (PGHS-1) - конститутивный фермент, а PGHS-2 - индуцибельный. Его индукторами служат ростовые факторы и цитокины, а также глюкокортикоиды и кортиколиберин. Именно PGHS-2 обеспечивает рост образования простагландинов в конце беременности. Образующийся промежуточный продукт PGH2 превращается далее в различные простагландины под действием специфических изомераз и синтаз. Инактивация простагландинов происходит под действием простагландиндегидрогеназ (PGDH). Наблюдаемое снижение их активности в конце беременности может быть одной из причин начала родовой деятельности. Экспрессия PGDH тормозится глюкокортикоидами и кортиколиберином и стимулируется прогестероном. Эффекты PGE2 реализуются через рецепторы EP1, EP2, EP3 и EP4, а действие PGF2a - через рецептор FP. EP1 и EP3 вызывают сокращение гладких мышц за счет повышения [Ca2+]j и снижения цАМФ, а EP2 и EP4 активируют аденилатциклазу и вызывают расслабление гладких мышц. У крысы перед родами в миометрии подавляется экспрессия рецепторов EP и повышается экспрессия FP, опосредующего стимуляцию сокращения.
Ферменты биосинтеза и деградации простагландинов имеют разную локализацию: PGHSs преобладают в амнионе, а PGDHs - в хорионе. PGDHs хориона служат метаболическим барьером, защищающим прилегающую децидуальную ткань и миометрий от действия простагландинов на протяжении большей части беременности. В конце беременности в плаценте появляется система положительной обратной связи в образовании простагландинов: они повышают экспрессию 11β-ГСД, превращающей биологически неактивный кортизон в активный глюкокортикоид кортизол, который, в свою очередь, стимулирует аккумуляцию простагландинов (рис. 4-18).
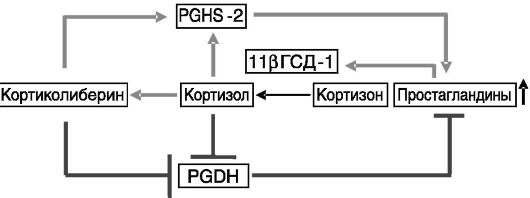 Рис. 4-18. Система положительной обратной связи в продукции простагландинов в матке в конце беременности
Рис. 4-18. Система положительной обратной связи в продукции простагландинов в матке в конце беременности
У приматов важную роль в инициации родов наряду с простагландинами и окситоцином может играть кортиколиберин. Продукция кортиколиберина плацентой (синцитиотрофобластом и промежуточными трофобластами) и децидуальной тканью матки возрастает в ходе беременности. Основная часть этого пептида попадает в кровоток матери. Но его активность в отношении стимуляции секреции АКТГ гипофизом матери и продукции простагландинов в матке блокируется секретируемым плацентой и печенью белком, связывающим кортиколиберин (КРГСБ). За 5-6 нед до родов концентрация этого белка начинает снижаться, тогда как секреция кортиколиберина увеличивается. Ингибиторами продукции кортиколиберина являются прогестерон и NO, стимуляторами - катехоламины, окситоцин, цитокины, глюкокортикоиды. Кортиколиберин действует через рецепторы, сопряженные с G-белками, CRH-R1 и CRH-R2, каждый из которых представлен по меньшей мере тремя сплайсинговыми вариантами. Полагают, что кортиколиберин может выполнять двоякую функцию: коррекцию гипоксии плода (за счет вазодилатации сосудистого русла плаценты) и стимуляцию родовой деятельности (путем активации продукции простагландинов в плаценте, глюкокортикоидов и андрогенов в надпочечниках плода, а из последних - эстрогенов в плаценте; рис. 4-19).
Предполагается, что за счет дифференциальной экспрессии разных форм рецепторов кортиколиберина этот пептид может оказывать противоположное по направленности действие на миометрий разных отделов матки.
Существенную роль в инициации родов играют рецепторы ГАМК. Приблизительно 45% синапсов на окситоцинергических нейронах супраоптической области содержат ГАМК, которая ингибирует пуль-
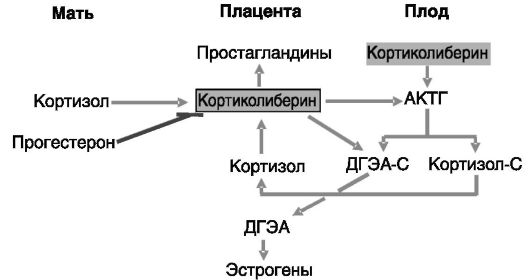 Рис. 4-19. Кортиколиберин плаценты в подготовке к родам
Рис. 4-19. Кортиколиберин плаценты в подготовке к родам
саторную активность нейронов и соответственно секрецию окситоцина. Во время беременности это действие ГАМК усиливается метаболитами прогестерона, в частности аллопрегнанолоном (тетрагидропрогестероном), являющимися аллостерическими агонистами рецепторов ГАМК, GABAA. Резкое падение уровня прогестерона перед родами, наблюдаемое у многих видов, приводит к снятию действия аллопрегнанолона и растормаживанию окситоцинергических нейронов. К этому же результату ведет и значительное увеличение в условиях фетального стресса перед родами продукции корой надпочечников плода ДГЭА, служащего ингибитором GABAA.
Рекомендуемая литература
Challis J.R.G., Matthews S.G., Gibb W., Lye S.J. Endocrine and paracrine regulation of birth at term and preterm. Endocr Rev. 2000;21(5):514-550.
Hunt J.S. Stranger in a strange land. Immunol Rev. 2006;213:36 - 47.
Linzer D.I., Fisher S.J. The placenta and the prolactin family of hormones: regulation of the physiology of pregnancy. Mol Endocrinol. 1999 Jun;13(6):837-840
Murphy V.E., Smith R., Giles W.B., Clifton V.L. Endocrine regulation of human fetal growth: the role of the mother, placenta, and fetus. Endocr Rev. 2006;27(2):141- 169.
Spencer T.E., BazerF.W. Conceptus signals for establishment and maintenance of pregnancy. Reprod Biol Endocrinol. 2004;2:49.
Sherwood O.D. Relaxin's physiological roles and other diverse actions. Endocr Rev. 2004;25(2):205-234.