Иммунология: структура и функции иммунной системы: учебное пособие / Р.М. Хаитов. - 2013. - 280 с.
|
|
|
|
Глава 3. МЕХАНИЗМЫ ВРОЖДЁННОГО ИММУНИТЕТА
Врождённый иммунитет - наиболее ранний защитный механизм как в эволюционном плане (он существует практически у всех многоклеточных), так и по времени ответа, развивающегося в первые часы и дни после проникновения чужеродного материала во внутреннюю среду, т.е. задолго до развития адаптивной иммунной реакции. Значительную часть патогенов инактивируют именно врождённые механизмы иммунитета, не доводя процесс до развития иммунного ответа с участием лимфоцитов. И только если механизмы врождённого иммунитета не справляются с проникающими в организм патогенами, в «игру» включаются лимфоциты. При этом адаптивный иммунный ответ невозможен без вовлечения механизмов врождённого иммунитета. Кроме того, врождённый иммунитет играет главную роль в удалении апоптотических и некротических клеток и реконструировании повреждённых органов. В механизмах врождённой защиты организма важнейшую роль играют первичные рецепторы для патогенов, система комплемента, фагоцитоз, эндогенные пептиды-антибиотики и факторы защиты от вирусов - интерфероны. Функции врождённого иммунитета схематично представлены на рис. 3-1.
РЕЦЕПТОРЫ РАСПОЗНАВАНИЯ «ЧУЖОГО»
На поверхности микроорганизмов присутствуют повторяющиеся молекулярные углеводные и липидные структуры, которые в подавляющем большинстве случаев отсутствуют на клетках организма хозяина. Особые рецепторы, распознающие этот «узор» на поверхности патогена, - PRR (Pattern Recognition Receptors - паттернраспознающие рецепторы) - позволяют клеткам врождённого иммунитета обнаруживать микробные клетки. В зависимости от локализации выделяют растворимые и мембранные формы PRR.
• Циркулирующие (растворимые) рецепторы для патогенов - белки сыворотки крови, синтезируемые печенью: липополисахаридсвя-
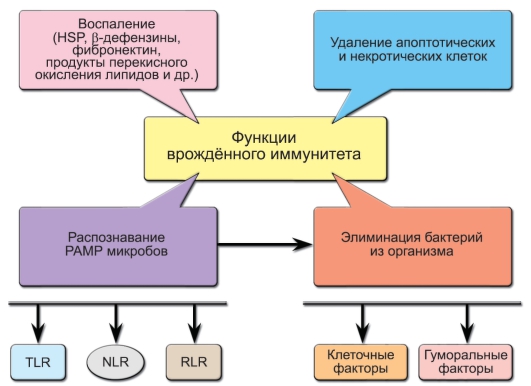
Рис. 3-1. Функции врождённого иммунитета. Обозначения: PAMP (PathogenAssociated Molecular Patterns) - молекулярные структуры микроорганизмов, HSP (Heat Shock Proteins) - белки теплового шока, TLR (Toll-Like Receptors), NLR (NOD-Like Receptors), RLR (RIG-Like Receptors) - клеточные рецепторы
зывающий белок (LBP - Lipopolysaccharide Binding Protein), компонент системы комплемента C1q и белки острой фазы MBL и С-реактивный белок (СРБ). Они непосредственно связывают микробные продукты в жидких средах организма и обеспечивают возможность их поглощения фагоцитами, т.е. являются опсонинами (от греч. opsonein - делающий вкусным). Кроме того, некоторые из них активируют систему комплемента.
- СРБ, связывая фосфорилхолин клеточных стенок ряда бактерий и одноклеточных грибов, опсонизирует их и активирует систему комплемента по классическому пути.
- MBL принадлежит к семейству коллектинов. Имея сродство к остаткам маннозы, экспонированным на поверхности многих микробных клеток, MBL запускает лектиновый путь активации комплемента.
- Белки сурфактанта лёгких - SP-A и SP-D принадлежат к тому же молекулярному семейству коллектинов, что и MBL. Они, вероятно, имеют значение в опсонизации (связывании антител с клеточной стенкой микроорганизма) лёгочного патогена - одноклеточного грибка Pneumocystis carinii.
• Мембранные рецепторы. Эти рецепторы расположены как на наружных, так и на внутренних мембранных структурах клеток.
- TLR (Toll-Like Receptor - Toll-подобный рецептор; т.е. сходный с Toll-рецептором дрозофилы). Одни из них непосредственно связывают продукты патогенов (рецепторы для маннозы макрофагов, TLR дендритных и других клеток), другие работают совместно с иными рецепторами: например, CD14 молекула на макрофагах связывает комплексы бактериального липополисахарида (ЛПС) с LBP, а TLR-4 вступает во взаимодействие с CD14 и передаёт соответствующий сигнал внутрь клетки. Всего у млекопитающих описано 13 различных вариантов TLR (у человека пока только 10).
• Цитоплазматические рецепторы:
- NOD-рецепторы (NOD1 и NOD2) находятся в цитозоле и состоят из трёх доменов: N-концевого CARD-домена, центрального NOD-домена (NOD - Nucleotide Oligomerization Domain - домен олигомеризации нуклеотидов) и C-концевого LRR-домена. Различие между этими рецепторами заключается в количестве CARD-доменов. Рецепторы NOD1 и NOD2 распознают мурамилпептиды - вещества, образующиеся после ферментативного гидролиза пептидогликана, входящего в состав клеточной стенки всех бактерий. NOD1 распознаёт мурамилпептиды с концевой мезодиаминопимелиновой кислотой (meso-DAP), которые образуются только из пептидогликана грамотрицательных бактерий. NOD2 распознаёт мурамилдипептиды (мурамилдипептид и гликозилированный мурамилдипептид) с концевым D-изоглутамином или D-глутаминовой кислотой, являющиеся результатом гидролиза пептидогликана как грамположительных, так и грамотрицательных бактерий. Кроме того, NOD2 имеет сродство к мурамилпептидам с концевым L-лизином, которые есть только у грамположительных бактерий.
- RIG-подобные рецепторы (RLR, RIG-Like Receptors): RIG-I (Retinoic acid-Inducible Gene I), MDA5 (Melanoma Differentiation-associated Antigen 5) и LGP2 (Laboratory of Genetics and Physiology 2).
Все три рецептора, кодируемые этими генами, имеют сходную химическую структуру и локализуются в цитозоле. Рецепторы RIG-I и MDA5 распознают вирусную РНК. Роль белка LGP2 пока неясна; возможно, он выполняет роль хеликазы, связываясь с двуцепочечной вирусной РНК, модифицирует её, что облегчает последующее распознавание с помощью RIG-I. RIG-I распознаёт односпиральную РНК с 5-трифосфатом, а также относительно короткие (<2000 пар оснований) двуспиральные РНК. MDA5 различает длинные (>2000 пар оснований) двуспиральные РНК. Таких структур в цитоплазме эукариотической клетки нет. Вклад RIG-I и MDA5 в распознавание конкретных вирусов зависит от того, образуют ли данные микроорганизмы соответствующие формы РНК.
ПРОВЕДЕНИЕ СИГНАЛОВ С TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ
Все TLR используют одинаковую принципиальную схему передачи активационного сигнала в ядро (рис. 3-2). После связывания с лигандом рецептор привлекает один или несколько адапторов (MyD88, TIRAP, TRAM, TRIF), которые обеспечивают передачу сигнала с рецептора на каскад серин-треониновых киназ. Последние вызывают активацию факторов транскрипции NF-kB (Nuclear Factor of к-chain B-lymphocytes), AP-1 (Activator Protein 1), IRF3, IRF5 и IRF7 (Interferon Regulatory Factor), которые транслоцируются в ядро и индуцируют экспрессию геновмишеней.
Все адапторы содержат TIR-домен и связываются с TIR-доменами TOLL-подобных рецепторов (Toll/Interleukin-1 Receptor, так же как рецептора для ИЛ-1) путём гомофильного взаимодействия. Все известные TOLL-подобные рецепторы, за исключением TLR3, передают сигнал через адаптор MyD88 (MyD88-зависимый путь). Связывание MyD88 с TLR1/2/6 и TLR4 происходит при помощи дополнительного адаптора TIRAP, который не требуется в случае TLR5, TLR7 и TLR9. В передаче сигнала с TLR3 адаптор MyD88 не участвует; вместо него используется TRIF (MyD88-независимый путь). TLR4 использует как MyD88зависимый, так и MyD88-независимый пути передачи сигнала. Однако связывание TLR4 с TRIF происходит при помощи дополнительного адаптора TRAM.
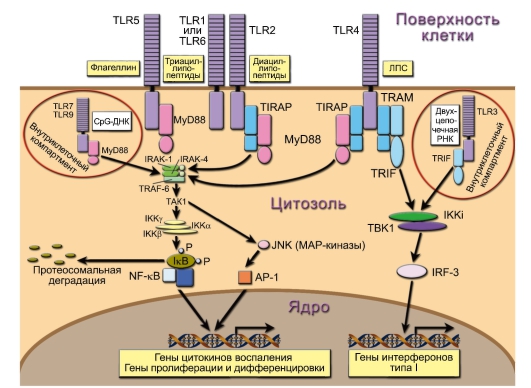
Рис. 3-2. Пути передачи сигналов с Toll-подобных рецепторов (TLR). Указанные на рисунке TLR3, TLR7, TLR9 - внутриклеточные эндосомальные рецепторы; TLR4 и TLR5 - мономерные рецепторы, встроенные в цитоплазматическую мембрану. Трансмембранные димеры: TLR2 с TLR1 или TLR2 с TLR6. Тип распознаваемого димерами лиганда зависит от их состава
MyD88-зависимый путь. Адаптор MyD88 состоит из N-концевого DD-домена (Death Domain - домен смерти) и С-концевого TIRдомена, связанного с рецептором с помощью гомофильного TIR- TIR взаимодействия. MyD88 привлекает киназы IRAK-4 (Interleukin-1 Receptor-Associated Kinase-4) и IRAK-1 через взаимодействие с их аналогичными DD-доменами. Это сопровождается их последовательным фосфорилированием и активацией. После этого IRAK-4 и IRAK-1 отделяются от рецептора и связываются с адаптером TRAF6, который, в свою очередь, привлекает киназу TAK1 и убиквитин-лигазный комплекс (на рис. 3-2 не показан), что приводит к активации TAK1. TAK1 активирует две группы мишеней:
• IκB-киназу (IKK), состоящую из субъединиц IKKα, IKKβ и IKKγ. В результате фактор транскрипции NF-kB освобождается от ингибирующего его белка IκB и транслоцируется в клеточное ядро;
• каскад митоген-активируемых протеинкиназ (MAP-киназ), способствующий активации факторов транскрипции группы AP-1. Состав AP-1 варьирует и зависит от типа активирующего сигнала. Основные его формы - гомодимеры c-Jun или гетеродимеры c-Jun и c-Fos.
Результатом активации обоих каскадов является индукция экспрессии антимикробных факторов и медиаторов воспаления, в том числе фактора некроза опухолей альфа ФНОа (TNFa), который, воздействуя на клетки аутокринно, вызывает экспрессию дополнительных генов. Кроме того, AP-1 инициирует транскрипцию генов, ответственных за пролиферацию, дифференцировку и регуляцию апоптоза.
MyD88-независимый путь. Передача сигнала происходит через адаптер TRIF или TRIF:TRAM и приводит к активации киназы TBK1, которая, в свою очередь, активирует фактор транскрипции IRF3. Последний индуцирует экспрессию интерферонов I типа, которые, как и ФНОа в MyDSS-зависимом пути, воздействуют на клетки аутокринно и активируют экспрессию дополнительных генов (interferon response genes). Активация различных сигнальных путей при стимуляции TLR, вероятно, обеспечивает направленность врождённой иммунной системы на борьбу с тем или иным типом инфекции.
Сравнительная характеристика врождённых и адаптивных механизмов резистентности приведена в табл. 3-1.
Существуют субпопуляции лимфоцитов со свойствами, «промежуточными» между таковыми неклонотипных механизмов врождённого иммунитета и клонотипных лимфоцитов с большим разнообразием рецепторов для антигенов. Они не пролиферируют после связывания антигена (т.е. экспансии клонов не происходит), но в них сразу индуцируется продукция эффекторных молекул. Ответ не слишком специфичен и наступает быстрее, чем «истинно лимфоцитарный», иммунная память не формируется. К таким лимфоцитам можно отнести:
• внутриэпителиальные γδT-лимфоциты с перестроенными генами, кодирующими TCR ограниченного разнообразия, связывают лиганды типа белков теплового шока, нетипичные нуклеотиды, фосфолипиды, MHC-IB;
• B1-лимфоциты брюшной и плевральной полостей имеют перестроенные гены, кодирующие BCR ограниченного разнообразия, которые обладают широкой перекрёстной реактивностью с бактериальными антигенами.

К категории лимфоцитов с «промежуточными» свойствами относят также NK-лимфоциты, или естественные киллеры.
ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ
Особая субпопуляция лимфоцитов - естественные киллеры (NKклетки, натуральные киллеры). Они дифференцируются из общей лимфоидной клетки-предшественника и in vitro способны спонтанно, т.е. без предварительной иммунизации, убивать некоторые опухолевые, а также инфицированные вирусами клетки. NK-клетки являются большими гранулярными лимфоцитами, не экспрессирующими линейных маркёров Т- и В-клеток (CD3, CD19). В циркулирующей крови нормальные киллеры составляют около 15% всех мононуклеарных клеток, а в тканях локализованы в печени (большинство), красной пульпе селезёнки, слизистых оболочках (особенно репродуктивных органов).
Большинство NK-клеток содержит в цитоплазме азурофильные гранулы, где депонированы цитотоксические белки перфорин, гранзимы и гранулизин.
Главными функциями NK-клеток являются распознавание и элиминация клеток, инфицированных микроорганизмами, изменённых в результате злокачественного роста, либо опсонизированных IgGантителами, а также синтез цитокинов ИФНу, ФНОа, GM-CSF, ИЛ-8, ИЛ-5. In vitro при культивировании с ИЛ-2 NK-клетки приобретают высокий уровень цитолитической активности по отношению к широкому спектру мишеней, превращаясь в так называемые LAK-клетки.
Общая характеристика NK-клеток представлена на рис. 3-3. Главные маркёры NK-клеток - молекулы CD56 и CD16 (FcγRIII). CD16 является рецептором для Fc-фрагмента IgG. На NK-клетках имеются рецепторы для ИЛ-15 - ростового фактора NK-клеток, а также для ИЛ-21 - цитокина, усиливающего их активацию и цитолитическую активность. Важную роль играют молекулы адгезии, обеспечивающие контакт с другими клетками и межклеточным матриксом: VLA-5 способствует прилипанию к фибронектину; CD11a/CD18 и CD11b/CD18 обеспечивают присоединение к молекулам эндотелия ICAM-1 и ICAM-2 соответственно; VLA-4 - к молекуле эндотелия VCAM-I; CD31, молекула гомофильного взаимодействия, ответственна за диапедез (выхождение через сосудистую стенку в окружающую ткань) NK-клеток через эпителий; CD2, рецептор для эритроцитов барана, является молекулой адгезии, которая
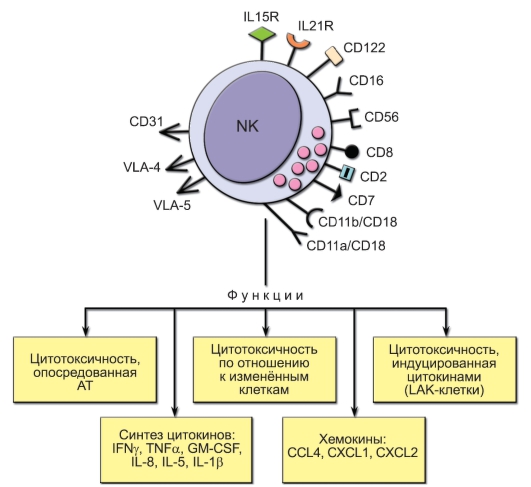
Рис. 3-3. Общая характеристика NK-клеток. IL15R и IL21R - рецепторы для ИЛ-15 и ИЛ-21 соответственно
взаимодействует с LFA-3 (CD58) и инициирует взаимодействие NKклеток с другими лимфоцитами. Помимо CD2, на NK-клетках человека выявляются и некоторые другие маркёры Т-лимфоцитов, в частности CD7 и гомодимер CD8a, но не CD3 и TCR, что отличает их от NKTлимфоцитов.
• По эффекторным функциям NK-клетки близки к T-лимфоцитам: они проявляют цитотоксическую активность в отношении клетокмишеней по тому же перфорин-гранзимовому механизму, что и ЦТЛ (см. рис. 1-4 и рис. 6-4), и продуцируют цитокины - ИФНγ, ФНО, GM-CSF, ИЛ-5, ИЛ-8.
• Отличие естественных киллеров от T-лимфоцитов состоит в том, что у них отсутствует TCR и они распознают комплекс антиген-
MHC иным (не вполне ясным) способом. NK не формируют клетки иммунной памяти.
• На NK-клетках человека есть рецепторы, относящиеся к семейству KIR (Killer-cell Immunoglobulin-like Receptors), способные связывать молекулы MHC-I собственных клеток. Однако эти рецепторы не активируют, а ингибируют киллерную функцию нормальных киллеров. Кроме того, на NK-клетках есть такие иммунорецепторы, как FcyR, и экспрессирована молекула CD8, имеющая сродство к
MHC-I.
• На уровне ДНК гены KIR не перестраиваются, но на уровне первичного транскрипта происходит альтернативный сплайсинг, что обеспечивает определённое разнообразие вариантов этих рецепторов у каждой отдельной NK-клетки. На каждом нормальном киллере экспрессировано более одного варианта KIR.
• H.G. Ljunggren и K. Karre в 1990 г. сформулировали гипотезу «missing self» («отсутствие своего»), согласно которой NK-клетки распознают и убивают клетки своего организма с пониженной или нарушенной экспрессией молекул MHC-I. Поскольку субнормальная экспрессия MHC-I возникает в клетках при патологических процессах, например при вирусной инфекции, опухолевом перерождении, NK-клетки способны убивать инфицированные вирусами или перерождённые клетки собственного организма. Гипотеза «missing self» схематично представлена на рис. 3-4.
СИСТЕМА КОМПЛЕМЕНТА
Комплемент - система сывороточных белков и нескольких белков клеточных мембран, выполняющих 3 важные функции: опсонизацию микроорганизмов для дальнейшего их фагоцитоза, инициацию сосудистых реакций воспаления и перфорацию мембран бактериальных и других клеток. Компоненты комплемента (табл. 3-2, 3-3) обозначают буквами латинского алфавита C, B и D с добавлением арабской цифры (номер компонента) и дополнительных строчных букв. Компоненты классического пути обозначают латинской буквой «С» и арабскими цифрами (C1, C2 ... C9), для субкомпонентов комплемента и продуктов расщепления к соответствующему обозначению добавляют строчные латинские буквы (C1q, C3b и т.д.). Активированные компоненты выделяют чертой над литерой, инактивированные компоненты - буквой «i» (например, iC3b).
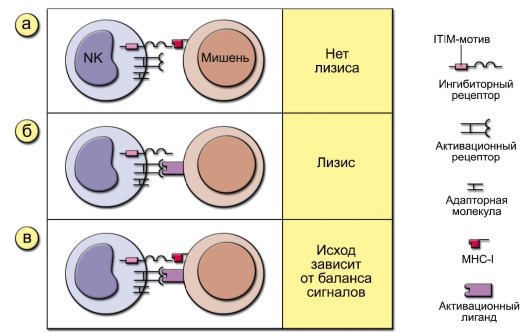
Рис. 3-4. Гипотеза «missing self» (отсутствие своего). На рисунке представлены три типа взаимодействия NK-клеток с мишенями. На NK-клетках имеется два типа распознающих рецепторов: активационные и ингибиторные. Ингибиторные рецепторы различают молекулы MHC-I и угнетают сигнал от активационных рецепторов, которые, в свою очередь, определяют либо молекулы MHC-I (но с меньшей аффинностью, чем ингибиторные рецепторы), либо MHC-подобные молекулы: а - клетка-мишень не экспрессирует активационных лигандов, и лизиса не происходит; б - клетка-мишень экспрессирует активационные лиганды, но не экспрессирует MHC-I. Такая клетка подвергается лизису; в - клеткамишень содержит как молекулы MHC-I, так и активационные лиганды. Исход взаимодействия зависит от баланса сигналов, идущих от активационных и ингибиторных рецепторов NK-клеток
• Активация комплемента (рис. 3-5). В норме, когда внутренняя среда организма «стерильна» и патологического распада собственных тканей не происходит, уровень активности системы комплемента невысок. При появлении во внутренней среде микробных продуктов происходит активация системы комплемента. Она может происходить по трём путям: альтернативному, классическому и лектиновому.
- Альтернативный путь активации. Его инициируют непосредственно поверхностные молекулы клеток микроорганизмов [факторы альтернативного пути имеют буквенное обозначение: P (пропердин), B и D].
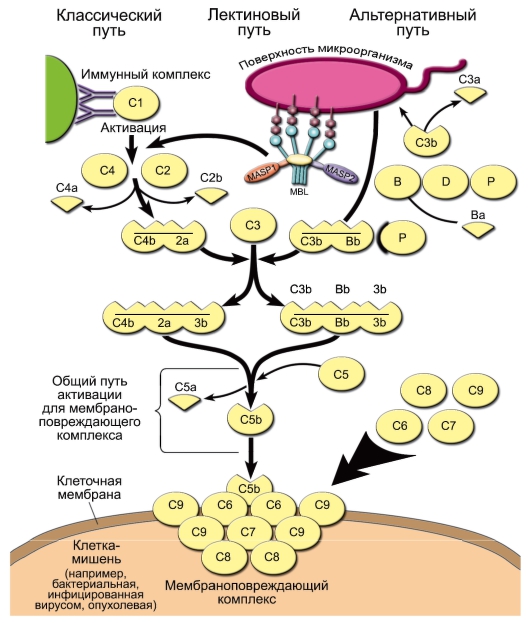
Рис. 3-5. Активация системы комплемента и образование мембраноатакующего комплекса. Пояснения см. в тексте, а также в табл. 3-2, 3-3. Активированные компоненты, согласно международному соглашению, надчёркнуты

◊ Из всех белков системы комплемента в сыворотке крови больше всего C3 - его концентрация в норме составляет 1,2 мг/мл. При этом всегда имеется небольшой, но значимый уровень спонтанного расщепления C3 с образованием C3a и C3b. Компонент C3b - опсонин, т.е. он способен ковалентно связываться как с поверхностными молекулами микроорганизмов, так и с рецепторами на фагоцитах. Кроме того, «осев» на поверхности клеток, C3b связывает фактор В. Тот, в свою очередь, становится субстратом для сывороточной сериновой протеазы - фактора D, который расщепляет его на фрагменты Ва и Bb. C3b и Bb образуют на поверхности микроорганизма активный комплекс, стабилизируемый пропердином (фактор Р).
◊ Комплекс C3b/Bb служит С3-конвертазой и значительно повышает уровень расщепления С3 по сравнению со спонтанным. Кроме того, после связывания с C3 он расщепляет C5 до фрагментов C5a и C5b. Малые фрагменты C5a (наиболее сильный) и C3a - анафилатоксины комплемента, т.е. медиаторы воспалительной реакции. Они создают условия для миграции фагоцитов в очаг воспаления, вызывают дегрануляцию тучных клеток, сокращение гладких мышц. C5a также вызывает повышение экспрессии на фагоцитах CR1 и CR3.
◊ С C5b начинается формирование «мембраноатакующего комплекса», вызывающего перфорацию мембраны клеток микроорганизмов и их лизис. Сначала образуется комплекс C5b/C6/ C7, встраивающийся в мембрану клетки. Одна из субъединиц компонента C8 - C8b - присоединяется к комплексу и катализирует полимеризацию 10-16 молекул C9. Этот полимер и формирует неспадающуюся пору в мембране, имеющую диаметр около 10 нм. В результате клетки становятся неспособными поддерживать осмотический баланс и лизируются.
- Классический и лектиновый пути сходны друг с другом и отличаются от альтернативного способом активации C3. Главной C3конвертазой классического и лектинового пути служит комплекс C4b/C2a, в котором протеазной активностью обладает C2a, а C4b ковалентно связывается с поверхностью клеток микроорганизмов. Примечательно, что белок C2 гомологичен фактору В, даже их гены расположены рядом в локусе MHC-III.
◊ При активации по лектиновому пути один из белков острой фазы - MBL - взаимодействует с маннозой на поверхности клеток микроорганизмов, а MBL-ассоциированная сериновая протеаза (MASP - Mannose-bindingprotein-Associated Serine Protease) катализирует активационное расщепление C4 и C2.
◊ Сериновой протеазой классического пути служит C1s, одна из субъединиц комплекса C1qr2s2. Она активируется, когда по крайней мере 2 субъединицы C1q связываются с комплексом антиген-антитело. Таким образом, классический путь активации комплемента связывает врождённый и адаптивный иммунитет.
• Рецепторы компонентов комплемента. Известно 5 типов рецепторов для компонентов комплемента (CR - Complement Receptor) на различных клетках организма.
- CR1 экспрессирован на макрофагах, нейтрофилах и эритроцитах. Он связывает C3b и C4b и при наличии других стимулов к фагоцитозу (связывания комплексов антиген-антитело через FcyR или при воздействии ИФНу - продукта активированных T-лимфоцитов) оказывает пермиссивное действие на фагоциты. CR1 эритроцитов через C4b и C3b связывает растворимые иммунные комплексы и доставляет их к макрофагам селезёнки и печени, обеспечивая тем самым клиренс крови от иммунных комплексов. При нарушении этого механизма иммунные комплексы выпадают в осадок - прежде всего в базальных мембранах сосудов клубочков почек (CR1 есть и на подоцитах клубочков почек), приводя к развитию гломерулонефрита.
- CR2 B-лимфоцитов связывает продукты деградации C3 - C3d и iC3b. Это в 10 000-100 000 раз увеличивает восприимчивость B-лимфоцита к своему антигену. Эту же мембранную молекулу - CR2 - использует в качестве своего рецептора вирус Эпштейна-Барр - возбудитель инфекционного мононуклеоза.
- CR3 и CR4 также связывают iC3b, который, как и активная форма C3b, служит опсонином. В случае если CR3 уже связался с растворимыми полисахаридами типа бета-глюканов, связывания iC3b с CR3 самого по себе достаточно для стимуляции фагоцитоза.
- C5aR состоит из семи доменов, пенетрирующих мембрану клетки. Такая структура характерна для рецепторов, связанных с G-белками (белки, способные связывать гуаниновые нуклеотиды, в том числе ГТФ).
• Защита собственных клеток. Собственные клетки организма защищены от деструктивных воздействий активного комплемента благодаря так называемым регуляторным белкам системы комплемента.
- C1-ингибитор (C1inh) разрушает связь C1q с C1r2s2, тем самым ограничивая время, в течение которого C1s катализирует активационное расщепление C4 и C2. Кроме того, C1inh ограничивает спонтанную активацию C1 в плазме крови. При генетическом дефекте dinh развивается наследственный ангионевротический отёк. Его патогенез состоит в хронически повышенной спонтанной активации системы комплемента и избыточном накоплении анафилактинов (C3a и С5а), вызывающих отёки. Заболевание лечат заместительной терапией препаратом dinh.
- C4-связывающий белок - C4BP (C4-Binding Protein) связывает C4b, предотвращая взаимодействие C4b и С2а.
- DAF (Decay-Accelerating Factor - фактор, ускоряющий деградацию, CD55) ингибирует конвертазы классического и альтернативного путей активации комплемента, блокируя формирование мембраноатакующего комплекса.
- Фактор H (растворимый) вытесняет фактор В из комплекса с C3b.
- Фактор I (сывороточная протеаза) расщепляет C3b на C3dg и iC3b, а C4b - на C4c и C4d.
- Мембранный кофакторный белок MCP (Membrane Cofactor Protein, CD46) связывает C3b и C4b, делая их доступными для фактора I.
- Протектин (CD59). Связывается с C5b678 и предотвращает последующее связывание и полимеризацию С9, блокируя тем самым образование мембраноатакующего комплекса. При наследственном дефекте протектина или DAF развивается пароксизмальная ночная гемоглобинурия. У таких больных эпизодически возникают приступы внутрисосудистого лизиса собственных эритроцитов активированным комплементом и происходит экскреция гемоглобина почками.
ФАГОЦИТОЗ
Фагоцитоз - особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. «Профессиональные» фагоциты у млекопитающих - два типа дифференцированных клеток - нейтрофилы и макрофаги, которые созревают в костном мозге из СКК и имеют общую промежуточную клетку-предшественник. Сам термин «фагоцитоз» принадлежит И.И. Мечникову, который описал клетки, участвующие в фагоцитозе (нейтрофилы и макрофаги), и основные стадии фагоцитарного процесса: хемотаксис, поглощение, переваривание.
Нейтрофилы составляют значительную часть лейкоцитов периферической крови - 60-70%, или 2,5-7,5х109 клеток в 1 л крови. Нейтрофилы формируются в костном мозге, являясь основным продуктом миелоидного кроветворения. Они покидают костный мозг на предпоследней стадии развития - палочкоядерной форме, или на последней - сегментоядерной. Зрелый нейтрофил циркулирует 8-10 ч и поступает в ткани. Общая продолжительность жизни нейтрофила -
2-3 сут. В норме нейтрофилы не выходят из сосудов в периферические ткани, но они первыми мигрируют (т.е. подвергаются экстравазации) в очаг воспаления за счёт быстрой экспрессии молекул адгезии - VLA-4 (лиганд на эндотелии - VCAM-1) и интегрина CD11b/CD18 (лиганд на эндотелии - ICAM-1). На их наружной мембране выявлены эксклюзивные маркёры - CD66а и CD66d (раково-эмбриональные антигены). На рисунке 3-6 представлено участие нейтрофилов в фагоцитозе (миграция, поглощение, дегрануляция, внутриклеточный киллинг, деградация, экзоцитоз и апоптоз) и основные процессы, происходящие в этих клетках при активации (хемокинами, цитокинами и микробными веществами, в частности РАМР) - дегрануляция, образование активных форм кислорода и синтез цитокинов и хемокинов. Апоптоз нейрофилов и их фагоцитоз макрофагами можно рассматривать как важную составную часть воспалительного процесса, так как своевременное их удаление препятствует деструктивному действию их ферментов и различных молекул на окружающие клетки и ткани.
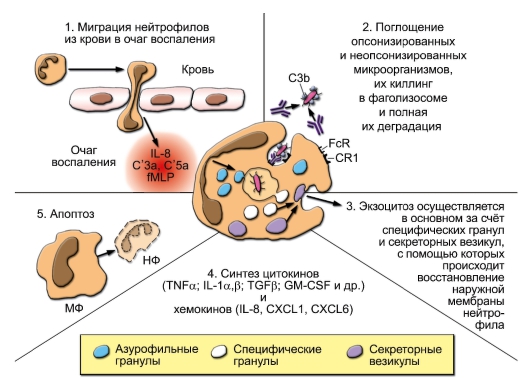
Рис. 3-6. Основные процессы, происходящие в нейтрофилах (НФ) при их активации и фагоцитозе
Моноциты и макрофаги. Моноциты являются «промежуточной формой», в крови их 5-10% от общего числа лейкоцитов. Их назначение - стать оседлыми макрофагами в тканях (рис. 3-7). Макрофаги локализуются в определённых участках лимфоидной ткани: медуллярных тяжах лимфатических узлов, красной и белой пульпы селезёнки. Клетки, производные моноцитов, присутствуют практически во всех нелимфоидных органах: клетки Купфера в печени, микроглия нервной системы, альвеолярные макрофаги, клетки Лангерганса кожи, остеокласты, макрофаги слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальные клетки почек (на рисунке не показаны). Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы. Макрофаги
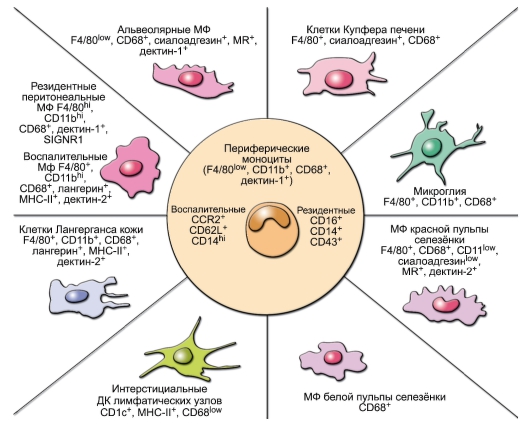
Рис. 3-7. Гетерогенность клеток, происходящих от моноцитов. Тканевые макрофаги (МФ) и дендритные клетки (ДК) происходят от моноцитов (МН) периферической крови
слизистых оболочек играют ведущую роль в защите организма. Для реализации этой функции они имеют набор распознающих рецепторов, кислородозависимые и кислородонезависимые механизмы киллинга микроорганизмов. Существенную роль в защите организма от инфекции играют макрофаги альвеолярные и слизистой оболочки кишечника. Первые «работают» в относительно бедной опсонинами среде, поэтому они экспрессируют большое количество паттернраспознающих рецепторов, включая скавенджер-рецепторы, маннозные рецепторы, β-глюканспецифические рецепторы, дектин-1 и др. При микробной инфекции в очаг проникновения микробов дополнительно мигрирует большое число воспалительных моноцитов, способных дифференцироваться в различные клеточные линии в зависимости от цитокинового окружения.
Рецепторы мембраны макрофагов
• CD115 (CSF-1R) - рецептор для моноцитарного колониестимулирующего фактора (M-CSF). Присутствует также на мембране полипотентной клетки-предшественника гранулоцитов и моноцитов и унипотентного предшественника моноцитов.
• Рецепторы клеточной мембраны макрофагов, участвующие в процессе фагоцитоза.
- CD14 - рецептор для комплексов бактериальных ЛПС с белками сыворотки крови, связывающими ЛПС (LBP), а также липоарабиноманнана клеточной стенки микобактерий и липотейхоевой кислоты грамположительных бактерий.
- Рецепторы для фрагментов фосфолипидных мембран и других компонентов собственных повреждённых и умирающих клеток (рецепторы-«мусорщики», scavenger receptors). Таков, например, CD163 - рецептор для «старых» эритроцитов.
- Рецептор, связывающий маннозу (Macrophage Mannose Receptor). Присутствует на мембране тканевых макрофагов и через маннозосодержащие поверхностные структуры связывает бактерии, вирусы и грибки.
- Рецепторы для комплемента - CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma.
- CD64 - рецептор для Fc-фрагментов IgG - FcγRI (Fcy-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. Сила связывания FcyRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 >
IgG2.
• Рецепторы, осуществляющие взаимодействие с лимфоцитами. Наряду с уже упомянутым CD64 к ним относят:
- рецепторы для цитокинов, вырабатываемых активированными лимфоцитами. Связывание с ИФНу и фактором некроза опухоли (ФНО) активирует макрофаг. Через рецептор для ИЛ-10 макрофаг, напротив, инактивируется;
- CD40, B7, MHC-II - мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. У нейтрофилов такие рецепторы отсутствуют.
Последствия фагоцитоза. После того как фагоцит охватывает своей мембраной поглощаемый объект и заключает его в мембранную везикулу, называемую фагосомой, происходят следующие события.
• Расщепление фагоцитированного материала. Этот процесс идёт по одинаковым биохимическим механизмам во всех фагоцитах.
- Лизосомы - специальные внутриклеточные органеллы, содержащие набор гидролитических ферментов (кислых протеаз и гидролаз) с оптимумом pH порядка 4,0. В клетке лизосомы сливаются с фагосомами в фаголизосому, где и происходят реакции расщепления поглощённого материала.
- Ферментные системы. НАДФ-Н-оксидазы, супероксиддисмутаза, NO-синтазы, генерируют активные формы неорганических окислителей, участвующих в деструкции фагоцитированного объекта: пероксид водорода (Н2О2), супероксид анион (О2-), синглетный кислород (1O2), радикал гидроксила (OH-), гипохлорид (OCl-), оксид азота (NO). Активация НАДФ-Н-оксидазы приводит к формированию так называемого «кислодородного взрыва» (рис. 3-8). Первичным продуктом «кислородного взрыва» является супероксидный анион О2-, который образуется при переносе НАДФ-H-оксидазой электрона на кислород. Супероксидный анион обладает слабым бактерицидным эффектом и является недолговечным. В результате реакции, катализируемой ферментом супероксидисмутазой (СОД), из двух молекул супероксидного аниона формируется перекись водорода, обла-
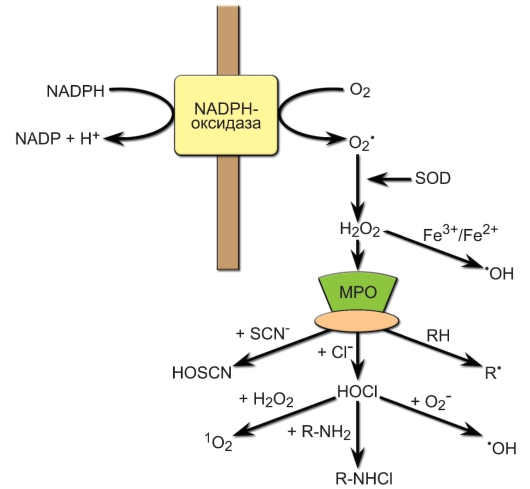
Рис. 3-8. Образование активных форм кислорода фагоцитами («кислородный взрыв»). Обозначения: NADPH-оксидаза - НАДФ-Н-оксидаза, NADP - НАДФ
дающая сильным микробицидным эффектом. При окислении хлоридов перекисью водорода в присутствии миелопероксидазы (МПО) образуется мощный цитотоксический агент - гипохлорная кислота HOCl, при её окислении супероксидным радикалом - гидроксильный радикал ОН, при окислении гипохлорит-иона перекисью водорода формируется синглетный кислород 1О2, который является источником образования другого бактерицидного вещества - озона О3 (на рис. не показан). При взаимодействии гипохлорной кислоты с аминогруппой
формируется микробицидное производное монохлорамина - R-NHCl.
• Секреция литических ферментов и окислительных радикалов в межклеточное пространство, где они также оказывают бактерицидное действие, но при этом поражают и собственные ткани. Нейтрофилы, помимо уже названных веществ, продуцируют и секретируют коллагеназу, катепсин G, желатиназу, эластазу и фосфолипазу A2.
• Образование и секреция цитокинов. Макрофаги и нейтрофилы, активированные продуктами микроорганизмов, начинают продуцировать цитокины и другие биологически активные медиаторы, инициирующие воспалительные реакции в очаге проникновения чужеродных агентов, подготавливая возможность развития адаптивного иммунного ответа.
- Макрофаги продуцируют интерлейкины (ИЛ-1, ИЛ-6, ИЛ-12); хемокин ИЛ-8; фактор некроза опухоли а (ФНОа); простагландины; лейкотриен В4 (LTB4); фактор, активирующий тромбоциты (ФАТ).
- Нейтрофилы продуцируют ФНОа, ИЛ-12, хемокин ИЛ-8, LTB4
и ФАТ.
• Процессинг и презентация антигена - образование внутри клеток комплексов из продуктов расщепления фагоцитированного материала с собственными молекулами MHC-II и экспрессия этих комплексов на поверхности клетки для презентации антигенов T-лимфоцитам. Этот процесс осуществляется АПК: ДК, макрофагами и др.
ЭНДОГЕННЫЕ ПРОТИВОМИКРОБНЫЕ ПЕПТИДЫ - ПРИРОДНЫЕ АНТИБИОТИКИ
Пептиды, обладающие активностью антибиотиков, обнаружены в клетках многих эукариот - от растений до человека. Они образуются путём процессинга более крупных белков-предшественников и содержат 13-80 аминокислотных остатков. Изучение противомикробных пептидов в настоящее время - это одно из самых новых направлений исследований. В базе данных о пептидах-антибиотиках содержится свыше 1200 наименований.
Выделяют несколько групп пептидов-антибиотиков, из которых для человека важны так называемые дефензины - пептиды, содер-
жащие несколько цистеинов, между которыми сформированы 3 дисульфидные связи. α-Дефензины содержатся в гранулах нейтрофилов. Синтез β-дефензинов происходит в клетках покровных тканей - эпителия дыхательных путей и пищеварительного тракта (рис. 3-9). Главными источниками α-дефензинов I-IV типов являются нейтрофилы и макрофаги, α-дефензинов V-VI типов - клетки Пеннета кишечника; β-дефензинов - эндотелиоциты и кератиноциты. Дефензины являются многофункциональными агентами, играющими важную роль в процессе фагоцитоза и воспаления. Первый эффект - способность убивать бактерии, грибы, оболочечные вирусы. Он может реализовываться внутриклеточно (в фаголизосоме) и внеклеточно. В результате экзоцитоза довольно большие концентрации дефензинов могут накапливаться в воспалительном очаге. Дефензины индуцируют синтез ИЛ-8 и сами являются хемоаттрактантами. Они оказывают ряд не-
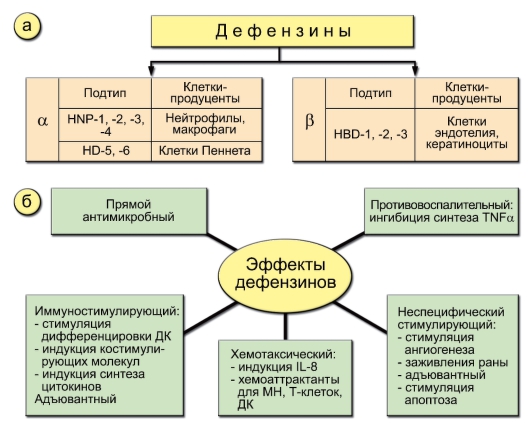
Рис. 3-9. Дефензины и их роль в процессе воспаления и фагоцитоза: а - источники дефензинов; б - эффекты дефензинов. Обозначения: МН - моноциты
специфических эффектов: стимулируют ангиогенез, заживление ран, индуцируют апоптоз и ингибируют синтез ФНОа, что важно на заключительных этапах воспаления. Вместе с тем дефензины стимулируют дифференцировку ДК.
Генетические дефекты пептидов-антибиотиков или необходимых для их функционирования кофакторов (например, ионных каналов, так как активность пептидов-антибиотиков «высокочувствительна» к ионной силе), вероятно, коррелируют с развитием прогредиентно текущей хронической патологии с инфекционными факторами в этиологии. Например, на сегодняшний день доказана связь развития муковисцидоза с мутацией гена регулятора мембранной проводимости CFTR, которая, возможно, определяет снижение активности β-дефензина в эпителии дыхательных путей.
ИНТЕРФЕРОНЫ ТИПА I
Как факторы противовирусной защиты интерфероны были открыты в 1957 г. А. Isaacs и J. Lindenmann. Выделяют интерфероны I, II и III типов. У человека тип I включает ИФНα, ИФНβ, ИФНκ, ИФНω, ИФНε. Главная роль во врождённой защите от вирусов принадлежит ИФНα (включает 13 членов) и ИФНβ (представлен одним членом). ИФНα и ИФНβ состоят из одной α-спиральной цепи из 165 и 166 аминокислотных остатков соответственно. Гомология между цепями составляет около 70%. К интерферонам типа II относится ИФНγ, а к интерферонам III типа - интерфероноподобные цитокины ИФН-λ1 (ИЛ-29), ИФН-λ2 (ИЛ-28A) и ИФН-λ3 (ИЛ-28B).
Считают, что основной источник интерферонов типа I в организме - плазмоцитоидные ДК. Интерфероны - небольшие белки, синтезируемые в инфицированных вирусом клетках. Индуктором синтеза интерферонов служат молекулы двуспиральной РНК. Двуспиральная РНК может быть геномной РНК вирусов или промежуточным продуктом транскрипции у ДНК-содержащих вирусов. В клетках млекопитающих собственных двуспиральных РНК нет.
Интерфероны типа I связываются со специфическими рецепторами на поверхности многих типов клеток иммунной системы и стимулируют противовирусный и в некоторых случаях противоопухолевый иммунный ответ. Подробнее эти действия описаны ниже и представлены на рис. 3-10.
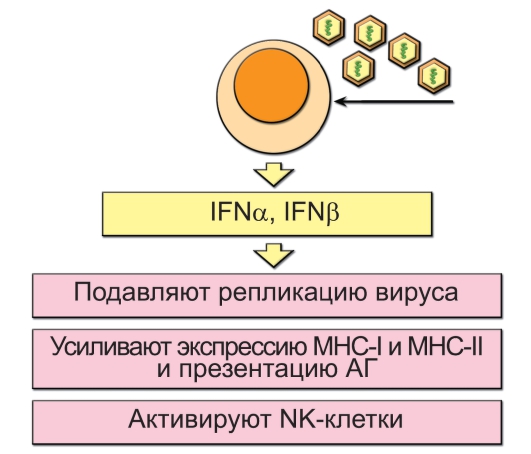
Рис. 3-10. Функции ИФНα/β
Влияние ИФНα/β на дендритные клетки и В-лимфоциты (рис. 3-11)
ИФНα/β стимулируют превращение незрелых ДК (1) в зрелые (2). Это приводит к усилению ими синтеза цитокинов, хемокинов, экспрессии молекул МНС, особенно I класса, костимуляторных молекул, экспрессии и секреции главных факторов выживания и активации В2клеток - BAFF и APRIL. Эти лиганды, взаимодействуя с рецепторами В-клеток BAFFR и TACI соответственно, при участии цитокинов ИЛ10, ТФРβ и ИЛ-15, синтезируемых активированными ДК, вызывают в наивных В-клетках (3) переключение иммуноглобулиновых генов CμСγ и Cμ-Сα и их созревание в IgG(4)- и IgA(5)-плазмабласты. ИФНα/β вызывают активацию макрофагов с теми же последствиями, что и для ДК (на рис. 3-11 не показано). ИФНα/β являются необходимыми цитокинами для созревания и пролиферации В1-клеток - главных продуцентов естественных аутоантител в организме.
Влияние ИФНα/в на Т-клетки (рис. 3-11)
ИФНα/β способствуют выживанию и пролиферации CD4+ и CD8+ T-клеток. ИФНα/β усиливают цитотоксические свойства CD8+Т-клеток, а также макрофагов и NK-клеток (на рис. 3-11 не показано). Вместе с тем ИФНα/β оказывают мощное антипролиферативное и проапоптозное действие, усиливая экспрессию проапоптотических молекул. Наличие одновременно пролиферативных и антипролиферативных свойств
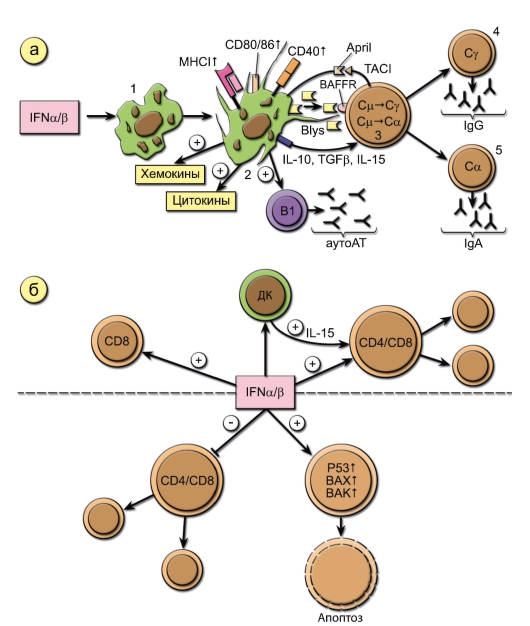
Рис. 3-11. Влияние ИФНα/β на клетки иммунной системы. Обозначения: Blys и April - факторы выживания и активации В2-клеток BAFF и APRIL; BAFFR и TACI - рецепторы В-клеток. Этапы 1-5 описаны в тексте
связано, вероятно, с включением на различных этапах инфекционного процесса или адаптивного иммунного ответа различных регуляторных механизмов, определяющих чувствительность клетки к действию ИФНа/р.
Интерфероны типа I индуцируют ферменты, нарушающие репликативный цикл вирусов:
• олигоаденилатсинтетазу, полимеризующую АТФ в 2',5'-олигомеры (в норме нуклеотиды в нуклеиновых кислотах связаны по 3',5'). Аномальные 2',5'-олигомеры активируют эндорибонуклеазу, которая расщепляет их и заодно вирусные нуклеиновые кислоты;
• серинтреониновую киназу Р1 , фосфорилирующую фактор инициации синтеза белка эукариот eIF-2, что приводит к подавлению трансляции, в том числе и вирусных белков;
• белок MX - клеточный белок, необходимый для проявления резистентности клетки к размножению в ней вируса гриппа (по данным генетического нокаута гена mx).
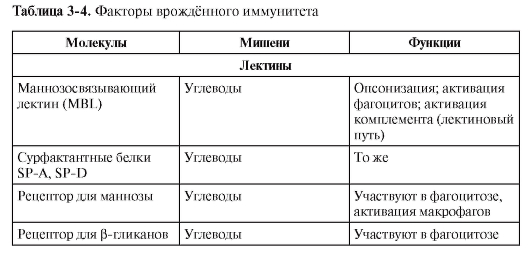
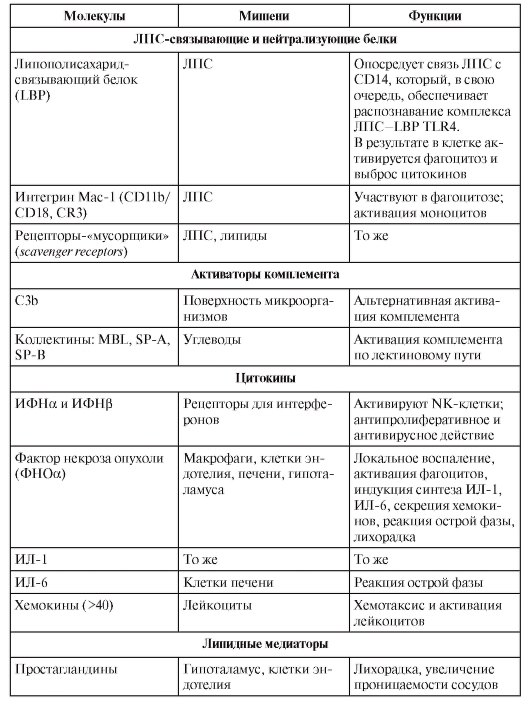
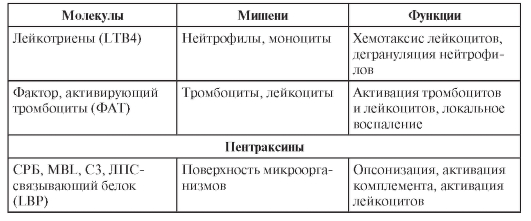
ФАКТОРЫ ВРОЖДЁННОГО ИММУНИТЕТА
В табл. 3-4 перечислены различные факторы (молекулы) врождённой резистентности, относящиеся к разным функциональным классам (лектины, ЛПС-реактивные белки, активаторы комплемента, цитокины, липидные медиаторы, реактанты острой фазы, пентраксины).