Иммунология: структура и функции иммунной системы: учебное пособие / Р.М. Хаитов. - 2013. - 280 с.
|
|
|
|
Глава 8. ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ИММУНИТЕТА
Эффекторные механизмы иммунитета направлены на связывание и элиминацию патогенов.
Существует 2 типа антигенсвязывающих рецепторов. В связи с этим выделяют 2 типа эффекторных механизмов.
• Антителозависимый, или гуморальный иммунитет. Осуществляется за счёт гуморальных (растворимых) факторов - антител, связывающих антиген и удаляющих его с использованием ряда механизмов: преципитации, агглютинации, нейтрализации, лизиса, блокады и опсонизации.
• Опосредованный клетками (антителонезависимый), или клеточный иммунитет. Клеточный иммунитет реализуется за счёт клеток иммунной системы, в первую очередь Т-лимфоцитов, а также активированных макрофагов и NK-клеток, непосредственно разрушающих генетически чужеродные клетки или инфицированные вирусами и другими внутриклеточными патогенами, и опухолевые клетки.
АНТИТЕЛОЗАВИСИМЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
Опсонизация и запуск системы комплемента
Само по себе связывание антител с антигеном является защитным, по крайней мере, в двух случаях:
• если антиген - сильный яд, антитело при связывании нейтрализует его токсичность;
• если антиген представлен на поверхности патогена (вирус, прион, бактерия), антитело, связав его, препятствует распространению патогена в организме.
Однако в этих случаях защитная реакция не заканчивается на образовании макромолекулярных комплексов антиген-антитело. Эти комплексы необходимо расщепить до мелких метаболитов. Это происходит
при связывании образовавшихся иммунных комплексов с компонентами комплемента. Способность связывать комплемент у иммуноглобулинов разных классов различается (IgM > IgG3 > IgG1). Комплексы антиген-антитело-компоненты комплемента транспортируются эритроцитами, имеющими рецепторы для компонентов комплемента, в синусоиды селезёнки и печени, где их фагоцитируют и расщепят макрофаги.
Fc-рецепторы
Fc-рецепторы (FcR) - семейство мембранных рецепторов клеток иммунной системы, главной функцией которой является распознавание и связывание Fc-фрагмента иммуноглобулинов, находящихся в свободном состоянии и в составе иммунного комплекса. FcR, наряду с TCR и BCR, можно отнести к иммунорецепторам, поскольку клетка-носитель FcR способна связать антиген (пусть и посредством антител) и отвечать на него. FcR выявлены не только на лимфоцитах, но и на всех известных лейкоцитах.
Типы и разновидности FcR. По изотипу связываемых тяжёлых цепей иммуноглобулинов выделяют 4 разновидности FcR: γ, ε, α, μ; а по аффинности связывания с лигандом - 3 типа FcR: I, II и III. FcR типа I способны связывать свободные молекулы антител (это особенно характерно для IgE), FcR типов II и III - только комплексы антиген- антитело.
Fcγ-рецепторы (FcγR) различаются по строению и сродству к Fcчасти IgG, а также специфичности к различным подклассам IgG (рис. 8-1). FcγRI содержит в своём составе 2 полипептидные цепи, из которых α-цепь отвечает за связывание IgG, а γ-цепь - за передачу сигнала (эту функцию осуществляет внутриклеточный γ-домен). Рецепторы типа FcyRII образованы единственной цепью. В зависимости от структуры их внутриклеточной части различают две разновидности этих рецепторов - FcγRIIA и FcγRIIB. В первом случае во внутриклеточной части содержится γ-домен, во второй - последовательность ITIM (Immunoreceptor-Tyrosin-based Inhibitory Motif - тирозинсодержащие ингибирующие последовательности аминокислот в иммунорецепторах). Эти особенности определяют функцию рецепторов: FcγRIIA передаёт стимулирующий, а FcγRIIB - ингибирующий сигнал. FcγRIII тоже существует в двух вариантах. Вариант FcγRIIIA, подобно FcγRI, содержит IgG-связывающую α- и сигнальную γ- (или ζ-) цепи. FcγRIIIB не
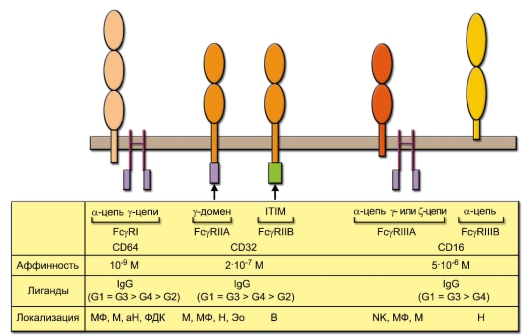
Рис. 8-1. Строение и свойства основных разновидностей Fcγ-рецепторов. Овальными символами обозначены домены, принадлежащие к суперсемейству иммуноглобулинов; ITIM - ингибирующая последовательность иммунорецепторов, содержащая тирозин. В нижней части рисунка в строке «Лиганды» в скобках представлены подклассы IgG, расположенные по убыванию их сродства к данному типу FcγR. Клетки, на которых локализуются Fcγ-рецепторы: Н - нейтрофил, аН - активированный нейтрофил, М - моноцит, МФ - макрофаг, Эо - эозинофил, NK - NK-клетка, В - В-лимфоцит, ФДК - фолликулярная дендритная клетка
обладает сигнальной функцией: его единственная a-цепь заякорена в фосфолипидный слой мембраны и лишена цитоплазматической части. Внеклеточные домены a-цепей рецепторов и единственных цепей FcγRII относятся к суперсемейству иммуноглобулинов.
Известны две разновидности Fcε-рецепторов, отличающиеся по структуре, сродству к Fc-части IgE и по биологической роли (рис. 8-2). FcεI-рецептор построен аналогично FcγRIIIA, но имеет дополнительную β-цепь, четырёхкратно пронизывающую мембрану. Этому рецептору принадлежит основная роль в запуске дегрануляции тучных клеток (ТК) - ключевого события в развитии реакций гиперчувствительности немедленного типа. FcεII-рецептор структурно не имеет сродства к FcεI-рецептору. Он играет роль в регуляции синтеза IgE, а также в регу-
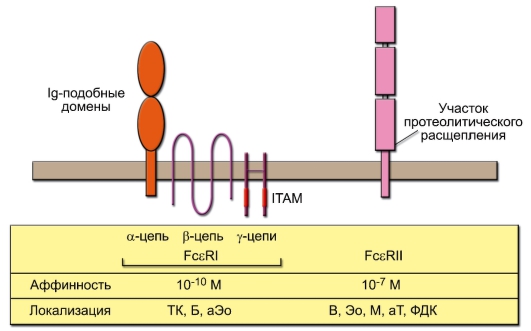
Рис. 8-2. Строение и свойства Fcε-рецепторов. Овальными символами обозначены домены, принадлежащие к суперсемейству иммуноглобулинов; ITAM - активационная последовательность иммунорецепторов, содержащая тирозин. Клетки, на которых локализуются Fcε-рецепторы: ТК - тучная клетка; Б - базофил, М - моноцит, Эо - эозинофил, В и Т - В- и Т-лимфоциты соответственно, ФДК - фолликулярная дендритная клетка. Буква «а» обозначает активированные клетки
ляции роста и дифференцировки В-лимфоцитов. FcεII-рецептор также существует в виде секретируемой формы, играя роль цитокина с широким спектром действия.
Fcα-рецептор структурно сходен с рецепторами FcγRIIIA и FcεIR, его α-цепь принадлежит к суперсемейству иммуноглобулинов (рис. 8-3). Функция этого рецептора практически не изучена.
Рецептор Poly-IgR предназначен для транспорта полимерных иммуноглобулинов (IgA, IgM) через стенку слизистых оболочек. Его фрагмент, связанный с этими молекулами, обозначают как секреторный компонент (SC).
Неонатальный рецептор FcγRn (n - neonatal) отвечает за транспорт IgG, поступающего в кишечник ребёнка с молозивом или молоком, а затем - через кишечную стенку в кровоток ребёнка. Он также отвечает за трансплацентарный транспорт IgG. По структуре он аналогичен молекулам МНС-I (см. рис. 5-1) и содержит в своем составе β2-микроглобулин,
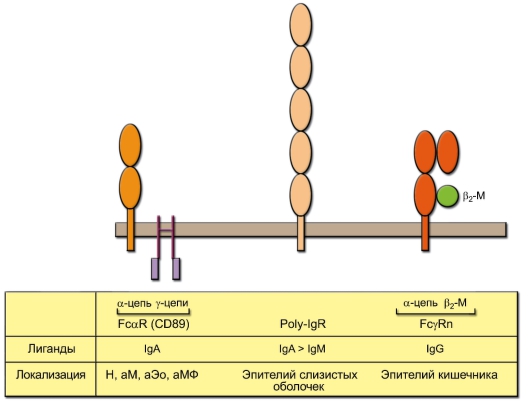
Рис. 8-3. Fcα-рецептор и Fс-рецепторы, ответственные за транспорт иммуноглобулинов. Клетки, на которых локализуются Fcγ-рецепторы: Н - нейтрофил, М - моноцит, МФ - макрофаг, Эо - эозинофил. Буква «а» обозначает активированные клетки
нековалентно связанный с α-цепью. Кроме того, FcγRn повышает срок жизни IgG в организме, защищая его от деградации в эндосомах.
На рис. 8-4 схематично представлены основные пути передачи сигналов с FcR. При перекрестном связывании FcR с лигандом (например, опсонизированным микроорганизмом) ITAM-мотив γ-цепи или α-цепи FcγRIIA фосфорилируется Src-киназами. Это приводит к взаимодействию SH2-доменов Syk-киназы с ITAM-мотивом FcR, его активации и фосфорилированию Scr-киназами. Активированная Syk-киназа фосфорилирует адапторный белок SLP-76, вовлекая в сигнальный процесс белок Vav из семейства GEF (Guanine nucleotide Exchange Factor). Он активирует ГТФазу Rac и адапторный белок ADAP, что вызывает реорганизацию актина, необходимую для образования фагоцитарной чаши и поглощения микроорганизма. С помощью адаптора SLP-76 фосфо-
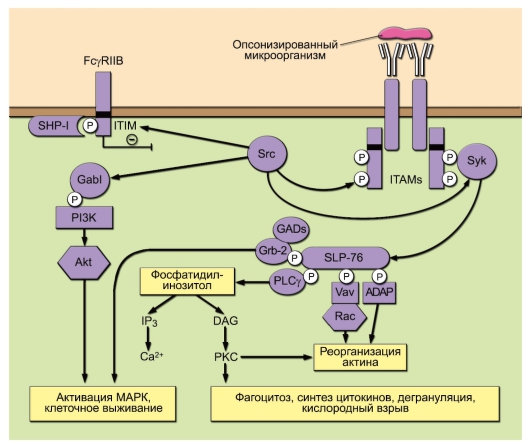
Рис. 8-4. Сигнальные пути, идущие от Fc-рецептора. Пояснения см. в тексте
рилируется фосфолипаза С (PLCγ), расщепляющая фосфатидилинозитол на инозитолтрифосфат (IP3; активатор Са2+) и диацилглицерол (DAG) - активатор протеинкиназы С (PKC). Эти события определяют развитие процессов поглощения антигена, дегрануляции и кислородного взрыва. Src-киназы через адапторный белок Gab1 фосфорилируют фосфоинозитид-3-киназу (PI3K), активируя белок Akt, киназу МАР и поддерживают выживание клеток - ингибирование апоптоза. Srcкиназы также могут инициировать ингибиторный путь. В покоящейся клетке фосфатазы SHP-1 или SHIP-1 ассоциированы с ITIM-мотивом. Фосфорилирование ITIM-мотива приводит к активации фосфатаз. Последние дефосфорилируют активированные ферменты и адапторные белки и прерывают развитие сигнального пути.
Антителозависимая клеточная цитотоксичность
Феномен АнтителоЗависимой Клеточной ЦитоТоксичности (АЗКЦТ) проявляется, когда антитело связывает антиген на поверхности какой-либо клетки-мишени и через Fc-фрагмент привлекает для ее разрушения эффекторные клетки (NK-клетки, макрофаги, эозинофилы и др.).
• Естественные киллеры. NK-клетки имеют рецептор (FcγRIII) для
Fc-фрагментов IgG. Механизм собственно киллерного действия NK-лимфоцитов на клетку-мишень такой же, как и киллерный механизм ЦТЛ - перфорин-гранзимовый (см. рис. 1-4 и рис. 6-4).
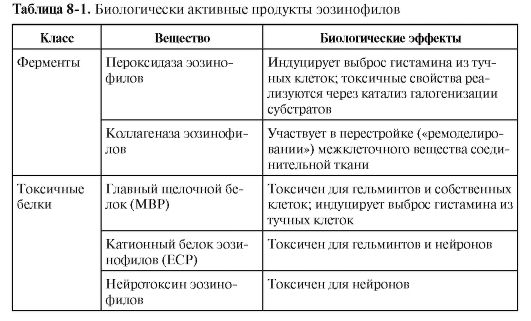
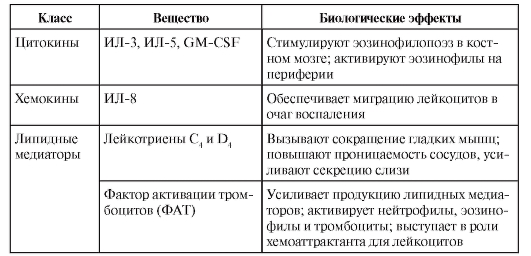
• Эозинофилы. Механизм санации от гельминтов - вариант антителозависимой клеточной цитотоксичности, где в качестве эффекторных клеток выступают эозинофилы, имеющие низкоаффинные рецепторы для IgE - FcεRII и для IgA - FcαRII. Связывание этих рецепторов с лигандами в сочетании с сигналом от цитокина ИЛ-5 стимулирует синтез и секрецию эозинофилом высокотоксичных белков, направленных на уничтожение гельминтов. Другими словами, активированный эозинофил секретирует ряд биологически активных веществ, действие которых объясняют симптоматику так называемых эозинофильных воспалительных процессов (табл. 8-1).
Гиперчувствительность немедленного типа
Сосудистые и миоконстрикторные реакции, опосредованные медиаторами тучных клеток и базофилов, приводят к развитию гиперчувствительности немедленного типа (ГНТ). Цитокины тучных клеток и базофилов поддерживают иммунный сдвиг в дифференцировке субпопуляций CD4+ T-лимфоцитов в сторону Th2 (ИЛ-4, ИЛ-13), а также поддерживают дифференцировку и активацию эозинофилов (ИЛ-5, ИЛ-3, GM-CSF). В случае патологии именно эти клетки (Th2, тучные клетки, базофилы, эозинофилы) и IgE составляют самоподдерживающийся ансамбль, ответственный за реакции ГНТ. Мишени для цитокинов - клетки гладкой мускулатуры и эндотелия (следовательно, сосуды, бронхи, органы пищеварения). Системная реакция ГНТ - анафилактический шок.
Базофильные лейкоциты и тучные клетки. В этих реакциях антитела вовлекают в ответ базофилы и тучные клетки. Существенные функциональные признаки этих клеток схожи: наличие на мембране высокоаффинного рецептора для IgE (FcεRI) и одинаковый набор биологически активных медиаторов.
• Тучные клетки локализованы в соединительной ткани собственного слоя слизистых оболочек (laminapropria mucosae), в подкожной соединительной ткани и соединительной ткани, расположенной по ходу всех кровеносных сосудов. Выделяют, по крайней мере, 2 тканевые разновидности тучных клеток.
- Тучные клетки слизистых оболочек из сериновых протеаз экспрессируют триптазу и химазу, секретируют минимум гистамина; из протеогликанов в них преобладает хондроитинсульфат; из метаболитов арахидоновой кислоты - лейкотриен C4 (LTC4). По-видимому, дифференцировка этих клеток зависит от T-лимфоцитов, а именно от местной стимуляции клеток-предшественников цитокином ИЛ-3.
- Тучные клетки соединительной ткани локализованы в серозных оболочках полостей тела и в лёгких. Из сериновых протеаз экспрессируют преимущественно триптазу, из протеогликанов - гепарин, секретируют много гистамина, из метаболитов арахидоновой кислоты в них преобладает простагландин D2. Дифференцировку этих тучных клеток стимулируют фибробласты.
• Базофилы циркулируют в крови и мигрируют в ткани только в очаг воспаления (как нейтрофилы). На базофилах экспрессированы молекулы адгезии, важные для хоминга в очаг: LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18), CD44.
Активация. Сигналы, активирующие как тучные клетки, так и базофилы.
• Гомотипная агрегация FceRI. Клетки активируются комплексом IgE с антигеном или антителами к рецептору. FceRI способен связывать свободные IgE-антитела - до того, как они свяжут свой антиген. Клетки с комплексом IgE-FceRI на мембране тучных клеток находятся в состоянии готовности в считанные секунды и минуты осуществить дегрануляцию в ответ на распознавание поступившего антигена (рис. 8-5). Ход событий: антиген взаимодействует с Fabфрагментами IgE и активированная этим сигналом тучная клетка подвергается дегрануляции.
• Анафилатоксины - фрагменты компонентов системы комплемента, образующиеся при развитии каскада.
• Медиаторы из активированных нейтрофилов.
• Нейромедиаторы (норадреналин, вещество Р).
Медиаторы тучных клеток и базофилов различны по биохимическим свойствам, по предназначению и по срокам выброса из активированной клетки. Медиаторы, депонируемые в гранулах, первыми выбрасываются из клетки в ответ на активирующий сигнал. Другие медиаторы синтезируются de novo и вступают в процесс позже.
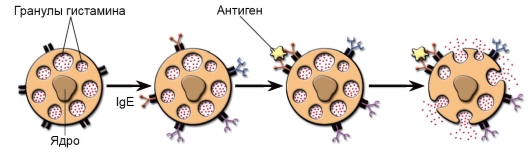
Рис. 8-5. Дегрануляция тучных клеток
• Гистамин. На разных клетках есть разные рецепторы для гистамина - Н1, Н2 и Н3. Гистамин проявляет вазоактивные эффекты: вызывает констрикцию эндотелиальных клеток, контакты между эндотелиоцитами становятся менее плотными, и сыворотка выходит из сосуда в ткани; стимулирует синтез в клетках эндотелия простациклина и радикала оксида азота (NO'), вызывающих расслабление гладких мышц сосудистой стенки и, следовательно, вазодилатацию.
- Если процесс происходит в коже, клинически он проявляется в виде волдырей и покраснения (крапивница). В случае аллергической патологии снять симптомы помогают лекарственные средства - блокаторы Н1-рецепторов гистамина.
- При выделении достаточно большого количества гистамина он вызывает клинически значимые сокращения гладких мышц кишечника (перистальтику) и бронхов (бронхоспазм), однако этот эффект непродолжителен, поскольку гистамин быстро распадается во внеклеточной среде.
• Липидные медиаторы. При стимуляции тучных клеток в них активируются ферменты метаболизма липидов, а именно фосфолипаза А2. Этот фермент участвует в образовании биологически активных медиаторов, используя в качестве субстратов фосфолипиды клеточных мембран и липиды (в первую очередь арахидоновую кислоту).
- Простагландин D2 - действует как вазодилататор и бронхоконстриктор. В биосинтезе простагландина D2 из арахидоновой кислоты участвует циклооксигеназа. Фармакологическим ингибитором этого фермента является ацетилсалициловая кислота.
- Лейкотриены (LTC4, LTD4, LTE4) - альтернативные продукты метаболизма арахидоновой кислоты, образуемые под воздей-
ствием 5-липооксигеназы. Комплекс лейкотриенов - медленно реагирующий компонент анафилаксии. Именно он в наибольшей мере ответственен за бронхоконстрикцию при бронхиальной астме. Это объясняет усугубление астматических приступов ацетилсалициловой кислотой: блокируя синтез простагландина D2, ацетилсалициловая кислота высвобождает метаболический шунт арахидоновой кислоты в пользу лейкотриенов.
- Фактор активации тромбоцитов (ФАТ) вызывает бронхоконстрикцию, а также релаксацию гладких мышц сосудов и ретракцию эндотелия. ФАТ продуцируют не только (а может быть, и не столько) тучные клетки, но и клетки эндотелия, стимулированные гистамином и лейкотриенами.
- Ферменты тучных клеток и базофилов [сериновые протеазы (триптаза и химаза), катепсин G, карбоксипептидаза] способствуют перестройке матрикса соединительной ткани.
- Цитокины тучных клеток и базофилов. К ним относят интерлейкины, GM-CSF и др.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ, ОПОСРЕДОВАННЫЕ КЛЕТКАМИ
Антителонезависимые эффекторные механизмы иммунитета в первую очередь реализуют ЦТЛ. К ним относят CD8+ Tαβ-лимфоциты и NKT-клетки - лимфоциты, одновременно экспрессирующие рецепторы NK- и Т-клеток. Есть T-киллеры и среди Tγδ-лимфоцитов.
Главное назначение ЦТЛ - санация организма от внутриклеточных патогенов, опухолевых и других изменённых клеток, реализуемая киллерной функцией ЦТЛ и цитокинами.
• Киллерная функция. ЦТЛ осуществляют киллерную функцию (см. рис. 1-5 и рис. 6-7) с помощью особых белков - цитотоксинов, к которым относят перфорин, гранзимы и недостаточно изученный цитолизин.
- Синтез цитотоксинов происходит de novo после вовлечения ЦТЛ в иммунный ответ и распознавания ими специфичного антигена.
- Накопление цитотоксинов. В виде функционально неактивных молекул-предшественников цитотоксины накапливаются в гранулах, сконцентрированных в клетке вблизи TCR.
- Дегрануляция ЦТЛ происходит в области межклеточного контакта, образующегося при связывании TCR с антигеном на по-
верхности клетки-мишени. Этот процесс облигатно зависит от
Ca2+.
- Перфорин накапливается в гранулах в виде растворимого предшественника. При высвобождении из гранул и в присутствии Ca2+ перфорин быстро полимеризуется в мембране клетки-мишени, образуя цилиндрическую структуру. При этом липофильные участки молекул перфорина ориентируются в сторону клеточной мембраны, а гидрофильные - в сторону канала внутрь клетки. В результате образуется пора диаметром около 16 нм.
- Гранзимы и апоптоз. Через пору, образованную перфорином, внутрь клетки-мишени попадают выделенные ЦТЛ-гранзимы. Охарактеризовано 3 гранзима ЦТЛ - А, В и С. Это специализированные сериновые протеазы, субстратами которых служат ферменты, инициирующие в клетке-мишени программу апоптоза. При этом происходит разрушение ДНК и белков клетки, а в случае, если она поражена вирусом, то и инфицировавшего её патогена.
- Лизис мишени. Если механизмы апоптоза клетки-мишени по какой-либо причине нарушаются, ЦТЛ всё равно разрушает клетку путём осмотического лизиса через сформированные перфорином поры. Однако в этом случае неповреждённые вирусные частицы и нуклеиновые кислоты могут инфицировать другие клетки, что и происходит в случае некоторых инфекционных заболеваний.
• Цитокины. CD8+ ЦТЛ продуцируют цитокины - ИФНγ, ФНОα и ФНОβ (лимфотоксин). Эффекты ИФНγ перечислены ниже:
- непосредственно подавляет репликацию вирусов;
- индуцирует в клетках-мишенях повышенную экспрессию молекул MHC-I и MHC-II, способствуя более эффективной презентации вирусных антигенов T-лимфоцитам: и для распознавания, и для киллинга;
- активирует макрофаги и NK-клетки;
- служит кофактором при индукции дифференцировки наивных CD4+ T-лимфоцитов в Th1-клетки. Это означает, что CD8+ ЦТЛ вносят вклад в развитие других эффекторных механизмов иммунного ответа - с участием Th1-лимфоцитов.
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ ЗАМЕДЛЕННОГО ТИПА
Гиперчувствительность замедленного типа (ГЗТ) - воспаление тканей, «организуемое» CD4+ T-лимфоцитами субпопуляции Th1 - продуцентами ИФНу. Клетками-исполнителями служат активированные макрофаги. Если в очаге инфекции происходит активация макрофага CD4+ Th1-лимфоцитом, микробицидные возможности макрофага существенно увеличиваются, и он более эффективно разрушает поглощённые патогены. К сожалению, в макрофаге погибают не все патогены, особенно жизнеспособны вирусы, например ВИЧ, а также микобактерии.
Активация макрофага. Для активации макрофага необходимы 2 типа воздействия со стороны лимфоцитов:
• контактное - молекула CD40L на Thl-лимфоците связывается с молекулой CD40 на макрофаге;
• цитокиновое - ИФНγ, продуцируемый Th1-клеткой, CD8+ ЦТЛ или NK-клеткой, связывается с рецептором на макрофаге;
• инфицированный макрофаг имеет больше шансов вступить во взаимодействие с Th1-клеткой, что обусловлено распознаванием Т-клеткой антигена на поверхности макрофага. В результате именно этот макрофаг получит активирующие сигналы от Т-клетки через интерферон и CD40L.
Ингибитор активации макрофагов - ИЛ-10.
Характеристики активированного макрофага. Макрофаг, активированный взаимодействием с Th1-клеткой, приобретает следующие признаки и функциональные способности.
• Увеличивается число рецепторов FcγR, при помощи которых макрофаг связывает комплексы антиген-антитело и фагоцитирует их.
• ИФНу в макрофагах индуцирует биосинтез ферментов, образующих радикалы активных форм кислорода, которые окисляют фагоцитированный антиген.
• В макрофагах под действием ИФНγ, ФНОα и, возможно, ИЛ-1 индуцируется экспрессия NO-синтазы, продуцирующей радикал NO*, который тоже окисляет фагоцитированный материал.
• В макрофагах индуцируется синтез липидных медиаторов воспаления - ФАТ, простагландинов и лейкотриенов (LTE4).
• Макрофаг синтезирует тканевой фактор коагуляции. В начавшемся процессе коагуляции активируется сывороточный тромбин - протеаза, стимулирующая клетки эндотелия сосудов, а также
нейтрофилы к синтезу ФАТ, что ещё больше способствует прогрессированию воспалительного процесса.
• ИФНγ служит самым сильным из известных индукторов синтеза и экспрессии молекул MHC-II. Кроме того, на активированных макрофагах, в отличие от неактивированных, индуцируется экспрессия костимуляторной молекулы B7, что делает активированные макрофаги более эффективными АПК. А также на активированных макрофагах возрастает экспрессия молекул адгезии ICAM-1 и LFA-3.
• Активированные макрофаги продуцируют ИЛ-12, способствующий дифференцировке Th1-лимфоцитов.
Очаг воспаления. Цитокины активированных макрофагов - ФНОа, ИЛ-1 и хемокины - создают очаг воспаления в виде плотных на ощупь узелков разного размера (симптом индурации). Плотность очага обусловлена выпотом из сосудов фибриногена и полимеризацией его в фибрин. Среди клеток, присутствующих в очаге, в первые 6-8 ч преобладают нейтрофилы, затем макрофаги и Th1-лимфоциты. Плотность клеток в свежем очаге ГЗТ невелика.
Сроки развития реакции. ГЗТ получила такое название, поскольку между моментом проникновения антигена в ткань и развитием характерного очага плотного воспаления проходит не менее 24-48 ч. После связывания антигена Th1-клетке требуется примерно 1 ч для индукции биосинтеза цитокинов, а также для синтеза и экспрессии на мембране молекулы CD40L.
Эффекты факторов роста. Среди цитокинов, продуцируемых активированными макрофагами, присутствуют факторы роста, что может значительно изменить состояние прилегающих к очагу тканей. Стандартная защитная реакция - развитие очага воспаления по типу ГЗТ, однако в патологических случаях цитокины, выделяемые активированными макрофагами, вызывают фиброзное перерождение тканей: тромбоцитарный фактор роста PDGF (Platelet-Derived Growth Factor) стимулирует пролиферацию фибробластов, а вырабатываемый CD4+ T-лимфоцитами и макрофагами ТФР-β стимулирует синтез коллагена. Кроме того, факторы роста, вырабатываемые макрофагами, вызывают образование дополнительных кровеносных сосудов - ангиогенез.