Биология: учебник: в 2 т. / под ред. В. Н. Ярыгина. - 2011. - Т. 1. - 736 с. : ил.
|
|
|
|
Глава 3. СУЩЕСТВОВАНИЕ КЛЕТКИ ВО ВРЕМЕНИ
3.1. жизненный цикл клетки
Закономерные изменения структурно-функциональных характеристик клетки во времени составляют содержание ее жизненного цикла. Жизненный (клеточный) цикл (рис. 3.1) - это период существования клетки от момента ее образования вследствие деления материнской клетки до собственного деления или смерти. Обязательный компонент клеточного цикла - митотический (пролиферативный) цикл (см. рис. 3.1, I) - комплекс однонаправленных, регулируемых, взаимосвязанных и упорядоченных во времени событий, происходящих в процессе подготовки клетки к делению, на протяжении деления и непосредственно после завершения деления. Кроме митотического цикла, в жизненный цикл клеток многоклеточного организма входит период
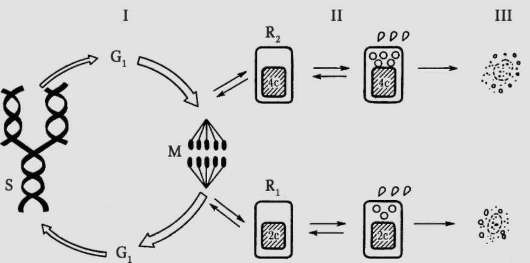
Рис. 3.1. Жизненный цикл клетки многоклеточного организма: I - митотический цикл; II - переход клетки в дифференцированное состояние; III - гибель клетки; G1 - пресинтетический (постмитотический) период интерфазы; G2 - постсинтетический (предмитотический) период интерфазы; S - синтетический период интерфазы; Ri и R2 - периоды покоя; М - митоз; 2с - диплоидное количество ДНК, 4с - тетраплоидное (удвоенное) количество ДНК
выполнения специфических функций (дифференцированные клетки) и периоды покоя (образовавшиеся вследствие митоза дочерние клетки «ожидают сигнала», дифференцироваться им или вступить в митотический цикл).
На рисунке 3.1, II показаны два выделявшихся цитологией второй половины ХХ в. периода покоя, обозначенные как R1 и R2 (англ., resting). Первый из них (Rj) приходится на постмитотический (предсинтетиче-ский) период интерфазы митотического цикла и иногда обозначается как период G0, второй (R2) - на постсинтетический (предмитотический) период интерфазы и иногда называется периодом G2. Наличие постсинтетического периода покоя (R2 или G2) не без оснований оспаривается.
Известны типы клеток, жизненный цикл которых представлен исключительно митотическим циклом, например бластомеры на стадии дробления в эмбриогенезе.
Завершение клеткой жизненного пути может быть связано с запуском механизма генетически контролируемой гибели (самоуничтожение) или апоптоза, а также гибели вследствие действия неблагоприятных факторов - клеточный некроз (см. п. 3.1.2 и рис. 3.1, III).
Еще одно направление изменения состояния клетки в жизненном цикле состоит в ее бласттрансформации, т.е. превращении в опухолевую (на рис. 3.1 не показано). Она приобретает способность к бесконечному размножению и становится формально бессмертной (в условиях in vitro, вне организма). In vivo длительность жизни такой клетки ограничивается смертью организма-носителя опухоли.
3.1.1. МИТОТИЧЕСКИЙ (ПРОЛИФЕРАТИВНЫЙ) ЦИКЛ
Митотический или пролиферативный цикл (см. рис. 3.1, I) - основа жизненного цикла всех клеток. Его биологическое значение состоит в том, что он обеспечивает преемственность хромосом (и следовательно, геномов, генов) в ряду клеточных поколений, т.е. образование клеток, равноценных по количеству ДНК и содержанию наследственной информации. Таким образом, цикл является универсальным механизмом воспроизведения клеточной организации эукариотического типа в индивидуальном развитии живых форм.
До последней трети ХХ в. вопрос о том, гарантирует ли митотиче-ский процесс наследование клетками полноценной во всех отношениях генетической информации, был предметом научных споров. Удачное клонирование животных: лягушки (рис. 3.2), мыши, свиньи, козы, овцы,
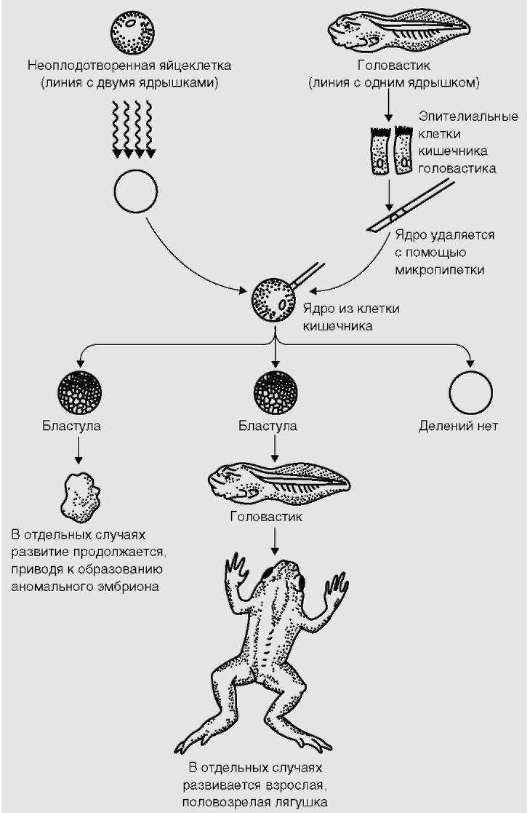
Рис. 3.2. Биоинформационная полноценность (количественная и качественная) ДНК ядер соматических клеток. Успешное репродуктивное клонирование амфибий. Схема опытов
крупного рогатого скота, - из клеток с цитоплазмой от яйцеклетки и ядром от соматической клетки (в случае известной овцы Долли - ядро клетки молочной железы) является основанием для утвердительного ответа. Известно, однако, что репродуктивное клонирование, имеющее целью получить новый организм, дает высокий процент потомства с отклонениями в развитии (уродства).
В ходе эволюции многоклеточных организмов митоз послужил основой мейоза, представляющего собой центральный и специфический механизм образования половых клеток - гаметогенеза. Мейоз встречается у всех видов организмов, размножающихся половым путем. Принципиальный с общебиологических позиций результат митоза состоит в сохранении в ряду клеточных поколений постоянного диплоидного количества хромосом. Мейоз, напротив, приводит к образованию из диплоидных клеток гаплоидных гамет. При оплодотворении свойственный виду диплоидный набор хромосом (кариотип) восстанавливается.
Главные события митотического цикла заключаются в репликации (самоудвоении, самокопировании) наследственного материала - ДНК материнской клетки, а также в равномерном и равноценном распределении этого материала между дочерними клетками. Указанным событиям сопутствуют закономерные изменения морфологической и химической организации хромосом (см. пп. 2.4.3.4, 2.4.3.4-а, 2.4.3.4-б, 2.4.5.3). По двум названным событиям в митотическом цикле выделяют репродуктивную и разделительную фазы, соответствующие интерфазе и собственно митозу классической цитологии.
3.1.1.1. Клетка в митотическом цикле. Интерфаза
В начальный отрезок интерфазы (постмитотический, предсин-тетический или период G2) восстанавливаются черты организации интерфазной клетки, завершается формирование ядрышка, начавшееся в телофазе митоза. В цитоплазме, параллельно реорганизации ультраструктуры, интенсифицируется биосинтез белка, значительные количества которого предназначаются для вновь создаваемого ядра. Энергичное образование белка способствует восстановлению важного клеточного параметра - ее массы. Если клетке предстоит вступить в очередной митотический цикл, синтезы приобретают направленный характер. Формируется пул химических предшественников ДНК, образуются ферменты и другие белки репликации. Вступление клетки в следующий, синтетический период интерфазы требует прохождения ею точки рестрикции, приходящейся на конец периода G1.
Предположительно переход клетки из G1 -периода в период S связан с наличием инсулиноподобного фактора роста, который, воздействуя на специфический белок-рецептор клеточной оболочки, запускает процесс сигнальной трансдукции: последовательно активируются белки-переносчики сигнала (G-белки, ферменты цитоплазматические тирозинкиназы, активируемые ими белки-циклины и др.), белки, связывающиеся с ядром (обеспечивают, по всей видимости, перенос сигнальных молекул или сигнальных комплексов через ядерную оболочку), белки-транскрипционные факторы (способны к специфическому взаимодействию с белками промоторов определенных генов, обусловливая их активацию или репрессию, см. также п. 2.4.3.1 - белки теплового шока). В зависимости от того, какие гены активируются, а какие репрессируются, клетка либо вступает в синтетический период митотического цикла (выбор направления «пролиферация»), либо в дифференцировку (см. рис. 3.1).
Если клетка не проходит точку рестрикции, то она выходит из митотического цикла и либо, как уже говорилось, встает на путь специализации (дифференцировки) в определенном структурно-функциональном направлении (см. рис. 3.1, II), либо приостанавливает свое движение по клеточному циклу (ни подготовки к митозу, ни дифференцировки), переходит в период покоя и, если это период R1, сохраняется в G0 клеточной популяции (см. здесь же, ниже). Некоторые типы специализированных клеток (эритроциты) навсегда утрачивают перспективу вернуться в митотический цикл и, в конце концов, гибнут (терминальная дифференцировка - см. рис. 3.1, III), тогда как другие (лимфоциты, фибробласты, печеночные клетки) сохраняют указанную перспективу и в соответствующих условиях вновь переходят к делению (см. рис. 3.1, II). Клетки, приостановившие движение по клеточному циклу и находящиеся в периоде R1 интерфазы, составляют G0-клеточную популяцию. Они возвращаются в митотический цикл при действии стимулирующих митоз (митогенетических) сигналов.
В синтетическом или периоде S интерфазы происходит удвоение количества (репликация) наследственного материала клетки. За некоторыми исключениями (достраивание цепей недореплициро-ванной ДНК теломер хромосом, см. п. 2.4.3.4-г) ДНК реплицируется полуконсервативным способом (см. п. 2.4.5.3, а также рис. 2.25). За митотический цикл ДНК реплицируется один раз. Механизм, блокирующий повторную репликацию, не выяснен. Предположительно он связан с функцией белков репликативного комплекса (см. п. 2.4.5.3).
Вхождение клетки в митотический цикл запускается митогенным (митогенетическим) сигналом, роль которого обычно выполняет соответствующий фактор роста. Фактор роста активирует внутриклеточный сигнальный путь (явление сигнальной трансдукции, см. здесь же, выше), результатом чего является включение в процесс Cdk. Их переход в функционально активное состояние происходит путем соединения двух субъединиц - каталитической и белка из семейства циклинов. В клетках млекопитающих имеется девять разных циклинов и семь разных Cdk. Их различные комбинации обусловливают регуляцию прохождения клеткой отдельных периодов митотического цикла. Так, прохождение клеткой синтетического (S) периода требует последовательной смены комплексов «циклин А - Cdk 2» и «циклин В - Cdk 2». Циклин В принимает участие также в завершающей фазе митотическо-го цикла: его деградация необходима для вступления клетки в анафазу митоза. Начальный отрезок периода G1 интерфазы осуществляется при участии комплекса «циклин D - Cdk 4» и/или «циклин D - Cdk 6». Эти же комплексы необходимы для возвращения в митотический цикл клеток из G0-популяции. Завершающая часть предсинтетического периода требует участия комплекса «циклин Е - Cdk 2». Смена периодов интерфазы, временные отношения между интерфазой и митозом определяются тем, что во время предшествующего периода образуются транскрипционные факторы, активирующие гены, контролирующие последующий период: G1 -S - G2 - митоз.
В клетках, прошедших синтетический период, хромосомы содержат удвоенное, в сравнении с обычным для соматических клеток диплоидным (2с, где с - гаплоидное количество ДНК), тетраплоидное (4с) количество генетического материала (ДНК).
Наряду с ДНК, в периоде S интерфазы интенсивно образуются РНК и белки, причем количество гистоновых белков, так же как и ДНК, строго удваивается. Последнее не удивительно, имея в виду нахождение ДНК в хромосомах в составе нуклеогистонового комплекса. При этом массовые отношения ДНК и гистонов составляют 1:1.
В синтетическом периоде удваивает свое количество незначительная часть митохондриальной ДНК, тогда как основная ее часть реплицируется в пост(после)синтетическом (G2) периоде интерфазы.
Из других цитоплазматических событий периода S следует назвать удвоение центриолей клеточного центра.
Отрезок времени от окончания синтетического периода до начала митоза обозначают как пост(после)синтетический, предмитотиче-
ский или период G2. Он отличается активным образованием РНК и белков. Некоторые из этих белков прямо связаны с предстоящим митозом. К ним относятся, в частности, тубулины, идущие на построение микротрубочек веретена деления. В периоде G2 завершается удвоение суммарной клеточной массы. Реализация программы периода G2 требует своего циклинкиназного комплекса: «циклин В - Cdk 1». Названный комплекс вводит клетку в митоз и регулирует ход последнего.
3.1.1.2. Клетка в митотическом цикле. Митоз
Собственно митоз делят на четыре фазы (рис. 3.3 и табл. 3.1). Таблица 3.1. События последовательных фаз митоза

Окончание табл. 3.1

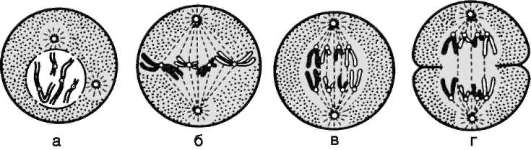
Рис. 3.3. Митоз в животной клетке: а - профаза; б - метафаза; в - анафаза; г - телофаза
Продолжительность митотического цикла варьирует и для большинства животных клеток укладывается в диапазон от 10 до 50 ч. У млекопитающих время непосредственно митоза составляет 0,5-1,5 ч, пост(после)митотического периода интерфазы - 9 ч, синтетического периода - 6-10 ч, предмитотического периода - 2-5 ч. При этом не учитывается время возможного пребывания клеток в периоде(ах) покоя. Время отдельных периодов интерфазы митотического цикла может выходить за указанные пределы. Так, в мужском гаметогенезе в пред-мейотических сперматогониях млекопитающих синтетический период занимает 15 ч, а в мейотических сперматоцитах - порядка 100 ч.
Известны типичные отклонения в ходе той или иной фазы митоза. В некоторой своей части эти отклонения приводят к патологическим последствиям. Отклонения в процессе спирализации (конденсации) хромосом в профазе нередко дают их набухание и слипание, что блокирует переход к следующим фазам. Может произойти отрыв участка хромосомы, который, если он лишен центромеры, выпадает из анафаз-ного движения к полюсам клетки и теряется. В генетике это оценивается как хромосомная мутация - делеция. Если оплодотворение прошло с участием половой клетки, несущей делетированную хромосому, это скажется на развитии организма потомка, причем в неблагоприятном отношении вплоть до его гибели. Отставать в движении могут отдельные хроматиды (дочерние хромосомы), из-за чего образуются клетки с несбалансированными хромосомными наборами. Генетиками это квалифицируется как геномная мутация - анэуплоидия. Повреждения со стороны веретена деления результируются в задержке митоза в ме-тафазе, нарушениях структуры метафазной пластинки и «рассеивании» хромосом. При изменении количества центриолей возникают патологические по своим последствиям многополюсные и асимметричные митозы.
3.1.2. КОНТРОЛЬ КОЛИЧЕСТВА КЛЕТОК В МНОГОКЛЕТОЧНОМ ОРГАНИЗМЕ. АПОПТОЗ. КЛЕТОЧНЫЙ НЕКРОЗ
Возникновение в эволюции многоклеточных живых форм породило ряд специфических задач. Учитывая требование дискретности (см. п. 1.3), одна из таких задач - ограничение количества клеток, строящих организм. Действительно, размеры ныне существующих животных, например млекопитающих, укладываются в определенный диапазон (сравни: мышь и слон). В эволюции одного и того же вида нередко наблюдается дивергенция по такому признаку, как размеры тела. Так, когда-то существовали карликовые слоны. Известны популяции людей, представители которых отличаются в среднем большим (отдельные группы аборигенов-негров к северу от границы тропических лесов - племя Масаи, полинезийцы Маркизских островов, шотландцы) или меньшим (пигмеи Центральной Африки и Юго-Восточной Азии, бушмены Южной Африки) ростом. Важным представляется то, что тело многоклеточного живого существа образовано определенным числом необходимых для обеспечения жизнедеятельности типов специализированных (дифференцированных) клеток. У человека, в организме которого насчитывается 1013-1014 клеток, этих типов 220-250. Количество клеточных элементов каждого типа, хоть и варьирует, ограничено определенным пределом. Есть данные о том, что клеточные типы, связанные функционально, находятся в закономерных количественных отношениях. Контроль количества соматических (телесных) клеток в организме в целом и числа клеток определенных типов специализации осуществляется, с одной стороны, на уровне пролиферации, а с другой, - благодаря механизму генетически контролируемой клеточной гибели (апоптоз).
В тканях и органах, в которых клеточный состав обновляется на протяжении всей жизни особи, обычно сохраняются так называемые камбиальные (матричные) зоны с пролиферирующими клетками-предшественницами клеток конкретных типов специализации. В отношении эпителиальных клеток выстилки тонкой кишки - это «дно» крипт, эпидермиса кожи - базальный слой клеток эпителиального пласта, клеток периферической крови (эритроциты, лейкоциты) - красный костный мозг. Согласно современной номенклатуре, клетки камбиальных зон причисляют к региональным или резидентным (в отличие от эмбриональных, отличающихся тоти(омни)потентностью; по мнению ряда исследователей, оставляющих свойство тоти(омни)потентности исключительно за зиготой, ЭСК внутренней клеточной массы характеризуются мульти(плюри)потентностью ) стволовым клеткам, характеризующимся
полипотентностью (кроветворные стволовые клетки дают достаточно широкий набор специализированных клеточных типов периферической крови), олигопотентностью (клетки придонных зон крипт дают ограниченное число специализированных клеток эпителия кишки - предположительно «каемчатый» всасывающий эпителий и некоторые, но не все типы одноклеточных желез) и даже унипотентностью (клетки базального слоя эпидермиса дают через ряд переходных форм только роговые чешуйки).
Клеточная пролиферация как фактор регуляции количества клеток находится под генетическим контролем. Так, у плодовой мухи (дрозофила) имеется мутация, для которой характерно увеличение числа клеточных делений в развитии на одно. Фенотипически мутация проявляется в увеличении в два раза размеров тела в связи с удвоенным количеством соматических клеток.
Наряду с клеточной пролиферацией, количество клеток в структурах тела животного определяется интенсивностью и временными (например, относительно периода онтогенеза или функционального состояния) характеристиками их гибели.
Долгое время науке был известен один вид гибели клеток в многоклеточном организме - клеточный некроз (см. здесь же, ниже), случающийся в ответ на действие неблагоприятных факторов. Последняя четверть ХХ в. ознаменована открытием и активным изучением еще одного вида гибели клеток - апоптоза, происходящего вне прямой связи с действием на клетки повреждающих агентов.
В отличие от некроза, апоптоз - это генетически контролируемый вид клеточной гибели и в качестве такового он является эволюционно «проработанным» клеточным механизмом развития и жизнедеятельности многоклеточных живых существ (как клеточная пролиферация или дифференцировка) (см. также раздел 8.2.4). Описано немало процессов и состояний в эмбриогенезе и во взрослом организме, в которых принимает участие апоптоз. Так, будучи закономерными событиями, резорбция хвоста у головастика и жабр у тритона при метаморфозе амфибий, отмирание клеток вольфовых или мюллеровых протоков при формировании мочеполовой системы соответственно у самок и самцов, определение финальной численности нервных клеток ядер головного мозга или приобретение требуемой формы, например бедренной костью путем удаления клеток в соответствующих зонах «заготовки-болванки» (скульптурная функция) во внутриутробном развитии млекопитающих и многое другое, обеспечиваются апоптозом. Во взрослом состоянии у женщин путем апоптоза после овуляции в яичниках погибают фолликулярные клетки, а по окончании лактации - клетки молочных желез.
В эксперименте удаление семенников (кастрация) приводит к апопто-тической гибели клеток предстательной железы, а удаление гипофиза вызывает гибель клеток надпочечников.
Многообразие ситуаций с участием апоптоза, их неслучайность, принадлежность апоптоза к естественным клеточным механизмам развития и жизнедеятельности ставят вопрос о природе сигналов, запускающих этот вид гибели клеток. Некоторые из приведенных выше примеров (молочные железы после лактации, кастрация, резорбция хвоста головастика) говорят о том, что в ситуациях, связанных с индивидуальным развитием и жизнедеятельностью, эти сигналы нередко имеют гормональную природу, а апоптоз является реакцией на изменение гормонального статуса организма. В случае молочных желез или простаты - это падение уровня соответственно прогестерона или андрогенов. При резорбции хвоста головастика в метаморфозе речь идет о тироксине.
Апоптоз происходит при недостатке регуляторных молекул, необходимых для жизнедеятельности клеток определенного типа. Так, при отсутствии фактора роста нервов (англ. NGF - Nerve Growth Factor) нервные клетки в условиях in vitro (в культуре клеток, вне организма) гибнут апоп-тозом. Другие регуляторные молекулы, например фактор некроза опухолей, ФНО (англ. TNF - Tumor Necrosis Factor), вызывают апоптотическую гибель разных типов клеток. Сигналом к апоптозу может стать нарушение клеточного метаболизма вследствие действия экзогенных токсинов.
Цитогенетическая система, обусловливающая развитие апоптоза, сходна у представителей разных таксонов, в том числе далеко отстоящих друг от друга в эволюционном плане, например, у круглого червя C. elegans и позвоночных животных. Ее начальный отрезок представлен регулятором, адаптером и эффектором. У позвоночных функцию регулятора выполняет белок bcl-2, который ингибирует адаптерный белок Apaf-1, стимулирующий ферменты каспазы. Каспазы, выполняющие роль эффекторов, - это протеиназы, расщепляющие молекулы разных белков (у позвоночных таких белков-мишеней более 60).
Представление о процессе апоптоза дает схема на рис. 3.4. При наличии соответствующего трофического фактора в цитоплазме присутствует фосфорилированный и в таком состоянии неактивный белок Bad-P. При отсутствии трофического фактора названный белок дефосфори-лируется и превращается в активную форму - Bad. Последний, связываясь с регуляторным белком наружной митохондриальной мембраны bcl-2, лишает его антиапоптозных свойств, что переводит в активное состояние проапоптотический белок Bax. В таких условиях в митохон-
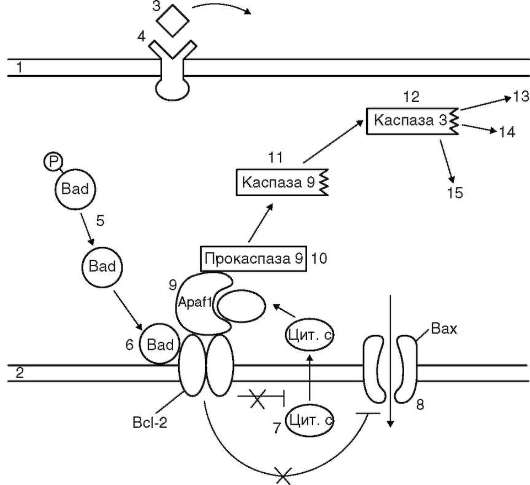
Рис. 3.4. Вариант развития апоптоза: запускающий фактор - отсутствие жизненно важного трофического фактора (схема): 1 - плазматическая мембрана; 2 - наружная мембрана митохондрии; 3 - трофический фактор; 4 - рецептор трофического фактора; 5 - дефосфорилирование проапоптотического белка Bad; 6 - инактивация антиапоптозного белка Bcl-2; 7 - выход цитохрома С из митохондрии в цитозоль; 8 - активация проапоптозного белка Bax, открытие ионных каналов; 9 - цитохром С активирует адапторный белок Apaf-1; 10 - активация прокаспазы 9; 11 - активная каспаза 9; 12 - активация каспазы 3; 13-15 - разрушение ядерной ламины (плотная пластинка, см. п. 2.4.3.1), цито-скелетных структур, конденсация и фрагментация хроматина
дрию через открывшиеся ионные каналы устремляется поток ионов, а из органеллы в цитозоль выходит фермент цитохром С. Комплекс названного фермента и адапторного белка Apaf-1 переводит прокаспазу 9 в активную форму. Каспаза 9, в свою очередь, активирует каспазу 3, которая, проявляя свойства протеазы, вызывает деградацию белков, в
частности адгезивных, что способствует обособлению апоптозирующей клетки от соседних, а также приводит к конденсации и распаду хроматина, цитоскелетных структур и ядерной ламины. Перечисленные изменения означают, что судьба клетки предопределена, и она вступила на путь апоптоза. В результате внутриклеточных изменений деструктивного характера клетка распадается на фрагменты - апоптотические тельца, которые «опознаются», захватываются и перевариваются макрофагами. При этом макрофаги не реагируют на находящиеся в непосредственной близости, но не неапоптозирующие клетки.
К апоптотической гибели приводят не только внешние относительно клеток (изменение гормонального статуса, недостаток в организме жизненно важного ростового фактора), но и внутриклеточные события, в частности нерепарируемые нарушения химической структуры ДНК (см. п. 2.4.5.3-a), дающие генетически (биоинформационно) дефектные и, следовательно, балластные или угрожающие здоровью и даже жизни клетки(приводящшие благодаря генетическим или биоинформационным нарушениям к функционально дефектным состояниям, угрожающим здоровью и даже жизни клетки). В таких случаях начальная фаза процесса заключается в накоплении в цитоплазме транскрипционного фактора р53, что активирует белок р21. Последний, с одной стороны, блокирует вступление клетки в период S (G1-блок митотического цикла) интерфазы или в митоз (G2-блок митотического цикла), тогда как с другой, - активирует проапоптотический белок Bax (см. здесь же, выше и рис. 3.4). Далее события развиваются в соответствии с представленным на рис. 3.4 сценарием. Внутриклеточным по своему происхождению событием, запускающим апоптоз, является деструктивное действие активных форм кислорода (АФК, свободные радикалы - см. п. 2.4.8) на митохондрии. Следствием нарушения структуры названных орга-нелл является выход в цитозоль цитохрома С, его комплексирование с Apaf-1, перевод прокаспазы 9 в каспазу 9 и т.д. (см. рис. 3.4). Можно заключить, что существуют варианты апоптоза, различающиеся природой инициирующего сигнала и событиями в дебюте процесса.
На рисунке 3.5 в схематическом изображении представлены гибель клетки, с одной стороны, путем апоптоза, а с другой, путем некроза. Очевидно, что это два отдельных процесса. Во-первых, они различаются по морфологии, во-вторых, по запускающим их факторам. К клеточному некрозу приводят повреждения мембраны плазмолеммы и подавление активности мембранных ионных насосов токсинами, недостаток кислорода, например, вследствие ишемизации тканей при спазме
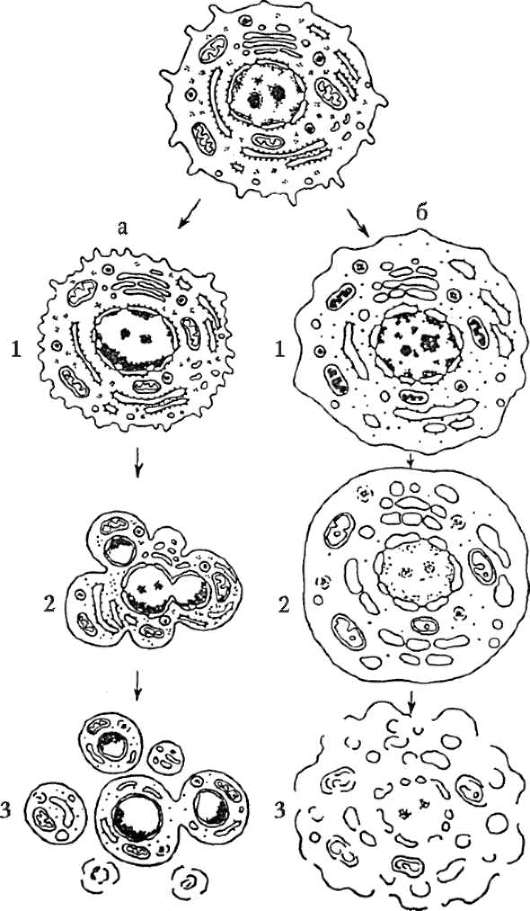
Рис. 3.5. Апоптоз и клеточный некроз - сравнительная характеристика морфологии процессов (схема): а - апоптоз: 1 - специфическое сжатие клетки и конденсация хроматина; 2 - фрагментация ядра; 3 - фрагментация тела клетки с образованием апоптических телец; б - некроз: 1 - набухание вакуолярных структур и клетки в целом, компактизация хроматина, кариопикноз и карио-рексис; 2 - дальнейшее набухание мембранных органелл, кариолизис; 3 - разрушение мембранных структур, клеточный лизис
или закупорке кровеносных сосудов (инфаркт миокарда, ишемический инсульт мозга), выключение из функции митохондриальных ферментов в результате действия некоторых ядов (цианиды). Обычно клеточный некроз развивается по следующему сценарию. Повышается проницаемость цитоплазматической мембраны, происходит обводнение цитоплазмы, что приводит к набуханию клетки. Одновременно набухают вакуолярные цитоплазматические структуры с деструкцией мембран. Необратимо изменяются митохондрии, прекращается продукция энергии, что тут же сказывается на состоянии клеточных функций, которые блокируются. Благодаря повышению концентрации ионов Na+ и Ca++ цитоплазма закисляется, жизненно важные синтезы, в частности белковые, прекращаются, из лизосом высвобождаются ферменты кислые гидролазы (см. п. 2.4.4.4-в), происходит лизис клетки. Одновременно хроматин ядер компактизируется (кариопикноз) с последующим распадом (кариорексис), происходят разрывы ядерной оболочки с последующим исчезновением ядра (кариолизис).
В отличие от апоптоза, при котором клеточная гибель носит автономный характер и не распространяется на клетки, соседствующие с апоптозирующей, при клеточном некрозе в процесс вовлекаются объемные участки тканей и органов, т.е. сразу некоторое количество клеток. В зоне некроза развивается воспаление, и некротизированный участок буквально «наводняется» (инфильтрируется) лейкоцитами. Этого не происходит в случае апоптоза. Можно заключить, что генетически контролируемая клеточная гибель путем апоптоза, в отличие от клеточного некроза, не носит характера патологического процесса и по своим параметрам удовлетворяет статусу одного из базисных клеточных механизмов развития и жизнедеятельности многоклеточного организма.
3.1.3. КЛЕТОЧНАЯ ДИФФЕРЕНЦИРОВКА
Дифференцировка - это процесс, в результате которого клетки становятся специализированными, т.е. приобретают морфологические, цитохимические, а главное - функциональные особенности, соответствующие запросам многоклеточного организма (см. также разделы 8.2.5, 8.2.5.1, 8.2.5.2 и 8.2.6). В широком смысле под дифференциров-кой понимают постепенное, наблюдаемое, в частности, в процессе эмбриогенеза через ряд последовательных делений и смену положения в теле развивающегося организма, появление все больших различий между клетками, происходящими из относительно однородных кле-
ток конкретного эмбрионального зачатка (например, зародышевого листка - энто-, эктоили мезодермы). Специализированные в заданном структурно-функциональном направлении клетки возникают и во взрослом организме, замещая, к примеру, постоянно гибнущие клетки - физиологическая регенерация.
Процесс клеточной дифференцировки как в эмбриогенезе, так и во взрослом состоянии «растянут» во времени, распространяется на группы клеток и определяется понятием гистогенез. Гистогенез начинается со стволовых (у взрослого, региональные стволовые, см. п. 3.1.2) клеток, включает несколько митотических делений, дающих ряд закономерных промежуточных клеточных форм, и завершается возникновением дифференцированных клеток. Появление отдельных морфологических, цитохимических, метаболических и иных характеристик дифференцированного состояния в ходе гистогенеза может происходить независимо и приурочено, как правило, к конкретным промежуточным клеточным формам. Вся совокупность соответствующих характеристик выявляется в дифференцированной зрелой клетке, составляя ее цитофенотип. Предположительно такое появление говорит о смене одних генов, активно транскрибируемых на предшествующей стадии гистогенеза, на другие.
Клеточные формы, с которых начинается гистогенез, обычно лишены признаков специализации. Тем не менее в нормальных условиях развития и жизнедеятельности организма направление дифференцировки определено. Известно, например, что клетки дерматома, склеротома и миотома, на которые подразделяются мезодермальные сомиты, в дальнейшем развитии дифференцируются соответственно в фибробласты соединительной ткани собственно кожи (дермы), хондробласты хряща и миобласты скелетной мускулатуры. В этих случаях говорят о состоянии детерминации. Конкретные факторы и механизмы клеточной детерминации однозначно не определены. Предположительно речь идет об активном состоянии определенных генов и экспрессии клетками соответствующих белков. Свою роль, видимо, играют характер дистантных (действующих на расстоянии) и местных (локальных) межклеточных взаимодействий и положение клеток в организме, органе или клеточной тканевой системе (см. п. 3.2) - морфогенетические поля: клеточные контакты с другими структурами, например клеток базального слоя эпидермиса с базальной мембраной, особенности микроокружения по маршруту перемещения клеток-предшественниц в процессе их превращения в «каемчатые» или железистые дифференцированные эпителиальные клетки выстилки тонкой кишки из придонных участков крипт на ворсинку - все то, что объединяется понятием эпигенетический ландшафт.
Представления о механизмах цитодифференцировки имеют свою историю (рис. 3.6). Гипотезы, связывающие клеточную дифференцировку с неравнозначностью наследственного материала в разных типах клеток (А. Вейсман), имеют историческое значение. К настоящему времени собрано много доказательств того, что соматические клетки подавляющего большинства животных, в том числе высокоорганизованных, характеризуются неизменным диплоидным набором хромосом. Цитофотометриче-ские исследования показали, что количество ДНК в ядрах клеток разных тканей и органов не различается. Оно одинаково и, как правило, соответствует диплоидному (2с). Результаты, полученные методом молекулярной гибридизации (см. п. 5.2.2.3-б), свидетельствуют об отсутствии различий в нуклеотидных последовательностях ДНК клеток разных направлений
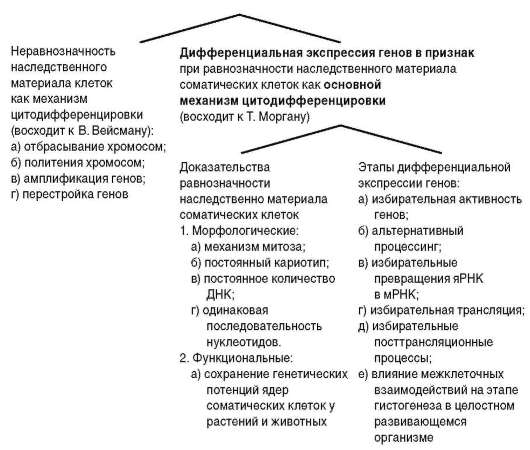
Рис. 3.6. Развитие представлений о механизмах цитодифференцировки
специализации. О сохранении соматическими клетками функционально-генетического потенциала говорят успешные опыты по репродуктивному клонированию организмов (см. п. 3.1.1).
Современная биология связывает генетический механизм клеточной дифференцировки с явлением дифференциальной (избирательной) активности генов . Различия между характеристиками соматических клеток разных направлений структурно-функциональной специализации (дифференцировки) видят в том, что в различных типах клеток активны (транскрибируются) разные гены и, соответственно, экспрес-сируются (транслируются) разные белки. Естественно, что выше речь шла о белках, относящихся к семейству «белков роскоши», а не о белках «домашнего хозяйства» (см. п. 2.4.4.4-е). К дифференцированным клеткам относятся, в частности, эритроциты. Хотя в зрелых эритроцитах белковые синтезы сведены к нулю, в клетках-предшественницах эритроцитов (полихроматофильные и базофильные, в терминологии классической гистологии - эритробласты, ретикулоциты) активны гены, обусловливающие экспрессию полипептидов гемоглобина - α- и β-глобинов. Пример с глобинами показателен тем, что эти гены имеют кластерную организацию, т.е. представлены совокупностью генов, каждый из которых активен в строго определенный период онтогенеза. Так, β-глобиновый кластер (β-мультигенное семейство) человека представлен 7 генами. У эмбрионов активен ген ε, у плода - Gγ и Αγ (Джи-гамма и Эй-гамма), после рождения - δ и β. Кроме того, имеется два так называемых псевдогена. Активация очередного гена кластера сопряжена с инактивацией гена, который транскрибировался в предшествующий период онтогенеза. Предположительно смена активных β-глобиновых генов оптимизирует функцию транспорта кислорода в различных условиях существования организма человека (эмбрион - доплацентарный период внутриутробного развития, плод - плацентарный период, после рождения - дыхание атмосферным воздухом).
Важное место в процессе клеточной дифференцировки принадлежит экспрессии белков цитоскелетных структур и плазмолеммы. Наличие цитоскелета - непременное условие приобретения и поддержания дифференцированной клеткой требуемой формы, а в случае необходимости - полярности (всасывающий «каемчатый» эпителий кишки), построения таких структур, как микроворсинки (всасывающий эпителий тонкой кишки) или реснички (реснитчатый эпителий трахеи и крупных бронхов). В случае плазмолеммы речь идет, в частности, о рецепторных и других белках (см. п. 2.4.2).
Самостоятельное значение в плане выполнения дифференцированной клеткой специфических функций имеет закономерное распределение белков и структур в клеточном объеме. Так, микроворсинки и реснички, о которых шла речь выше, располагаются на обращенных в просвет соответствующих органов полюсах клеток. Показателен пример эпителиально-мышечной клетки актинии, выполняющей одновременно опорную, сократительную и чувствующую (рецепторную) функции. Названная клетка имеет бокаловидную форму, в ее основании находится пучок миофибрилл, а у апикальной поверхности - чувствующий волосок (рис. 3.7).
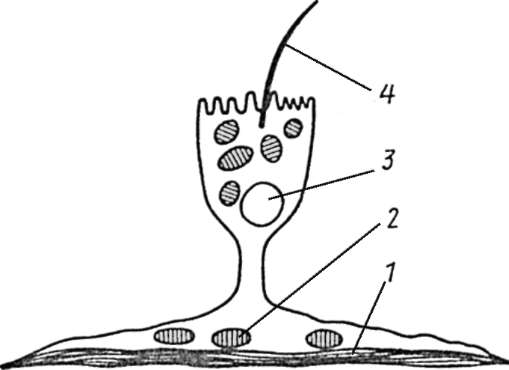
Рис. 3.7. Эпителиально-мышечная клетка актинии. Схема: 1 - мышечные волокна; 2 - митохондрии; 3 - ядро; 4 - чувствующий волосок
В связи с проблемой клеточной дифференцировки важным представляется вопрос о механизме избирательной активности конкретного гена (и следовательно, экспрессии соответствующего белка) клетками разных органов. Имеющиеся данные указывают на несомненную роль энхансеров (рис. 3.8), промоторов, транскрипционных факторов, гор-
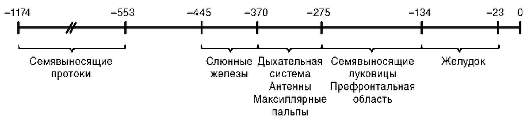
Рис. 3.8. Регуляторная зона тканеспецифичного гена estS (фермент эстераза) плодовой мухи. Показано расстояние (в п.н.) энхансеров, ответственных за транскрипцию гена клетками разных органов мухи, от стартовой точки трансляции
монов, факторов роста и других сигнальных молекул, изменение плотности упаковки хроматина - гетерохроматизация эухроматиновых участков и эухроматизация гетерохроматиновых.
3.1.4. ОНКОТРАНСФОРМАЦИЯ КАК ОДНА ИЗ ВОЗМОЖНЫХ СОСТАВЛЯЮЩИХ ЖИЗНЕННОГО ЦИКЛА КЛЕТКИ
Идея о том, что опухолевый рост представляет собой биологическую проблему, возникла давно. В разное время эта идея наполнялась различным конкретным содержанием. В частности, высказывались предположения, что рак - это следствие дерепрессии клеточного генома в связи с потерей хромосомами гистонов, а онкогенез, как явление, можно рассматривать в качестве побочного эффекта «противостояния» клеток процессу старения. В настоящее время распространение получила точка зрения, также связывающая онкотрансформацию с изменениями клеточного генома. Предположительно путь к опухолевому перерождению клетки представляет собой перестройку генома, а не единичную мутацию определенного гена. Действительно, описаны опухоли, удовлетворяющие понятию «моногенная наследственная болезнь», например ретинобластома (retina: средневеков. от лат.: rete - сеть, самая внутренняя оболочка глаза; греч. blastos - почка, росток, побег, завязь; греч. oma - опухоль). Это злокачественное новообразование сетчатки с аутосомно-доминантным типом наследования. К развитию ретино-бластомы приводят точковые мутации в гене RB1 (13q14.1). С другой стороны, названная опухоль развивается при транслокациях между хромосомами Х и 13, причем место разрыва приходится на участок хромосомы 13, не имеющий отношения к месту расположения названного гена, а находящийся от него за несколько миллионов пар нуклеотидов - 13q12-q13. При этом допускается, что в случае транслокаций речь тоже идет об инактивации гена RB1, но не вследствие его мутации, а в результате разобщения областей промотора и энхансера, т.е. фактически эффекта положения.
Рассмотренный пример возвращает нас к идее, что онкотрансформа-ция как самостоятельная траектория жизненного цикла соматической клетки связана с изменениями в геноме, причем затрагивающими конкретные системы генетической регуляции состояния клеток, в частности, связанные с их пролиферацией. Подсчитано, что к онкогенезу у человека из общего числа примерно в 30 тыс. имеют отношение 120-150 генов. Далеко не все они являются структурными (кодирующими аминокис-
лотные последовательности полипептидов) в понимании классической генетики. Многие из них выполняют регуляторные, сервисные и/или конценсусные функции. Факторами, провоцирующими превращение клеток в опухолевые, являются мутагены окружающей среды, такие, как промышленные и сельскохозяйственные яды, табачный дым.
Согласно современным взглядам, онкогенез - многоступенчатый процесс. Единичной мутации в протоонкогене или гене-супрессоре онкотрансформации достаточно для инициации клеточного роста, который через ряд стадий, связанных с закономерными изменениями в геномах клеток растущей популяции, может приобрести черты злокачественного (рис. 3.9).
Таким образом, в случае клеточной онкотрансформации речь идет о геномных изменениях, затрагивающих генетические системы регуляции существенных составляющих клеточного цикла, прежде всего процессов пролиферации и апоптоза. Это дает основание рассматривать онкогенез, воспринимаемый как биологический в своей основе феномен, в связи с организацией жизненного цикла эукариотической клетки многоклеточного организма. Дополнительный аргумент заключается в том, что, согласно новейшим данным, опухолевые клетки постоянно циркулируют в кровотоке, причем если их количество не превышает 0,5 млн, то ситуация оценивается как онкологически спокойная. При количестве клеток в диапазоне от 0,5 млн до 1 трлн ситуация оценивается как настораживающая - предрак. На обеих названных стадиях какие-либо признаки наличия злокачественной опухоли в организме существующими диагностическими методами не выявляются. Опухоль диагностируется и становится предметом профессионального внимания врачей, если количество клеток превышает 1 трлн.
3.2. клеточные тканевые системы (клеточные популяции). регенеративная медицина
Тело взрослого человека образовано 220-250 типами дифференцированных клеток, каждый из которых соответствует конкретному направлению функциональной специализации (цитотип, цитофенотип). Отдельные клеточные типы закономерно (по набору и количеству) представлены в различных органах и структурах организма. В гистологии сложилось представление о клеточной популяции, к которой относят совокупность клеток одного цитотипа (гепатоциты или печеночные клетки, кардиомиоциты, нервные клетки с подразделением по
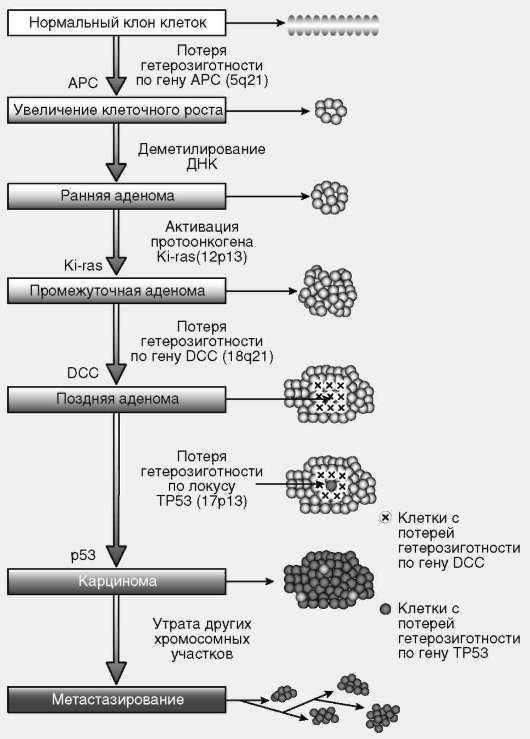
Рис. 3.9. Многоступенчатый характер процесса онкогенеза (на примере рака прямой кишки)
вариантам или субпопуляциям - нейроны Пуркинье коры мозжечка, пирамидные нейроны коры головного мозга). Введение указанного понятия, с одной стороны, создает перспективу оценить суммарный функциональный потенциал организма по отдельным направлениям клеточной специализации. С другой стороны, осознаются подходы к решению вопроса о путях поддержания требуемого уровня этого потенциала во времени - путем клеточной пролиферации или другими способами (клеточная гипертрофия, внутриклеточная регенерация). Классифицируя клеточные популяции, классическая гистология в качестве ведущего, практически исключительного критерия использует сохранение клетками пролиферативного потенциала - в прямом виде (гепатоциты) или благодаря наличию матричных (камбиальных) про-лиферативных зон (клетки периферической крови, эпидермис кожи). Соответственно классификация вариантов клеточных популяций в многоклеточном организме строится на оценке баланса между темпами потери и восполнения клеточного материала за счет митотического деления. Так, выделяются популяции обновляющиеся (клетки эпителиальной выстилки тонкой кишки, соединительной ткани), растущие (гепатоциты), стабильные (нейроны, кардиомиоциты). Возможные варианты клеточных популяций, если исходить из названного выше критерия, приведены на рис. 3.10.
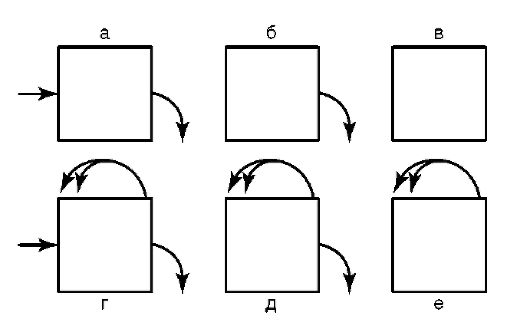
Рис. 3.10. Возможные типы клеточных популяций (схема): а - простая транзитная; б - распадающаяся; в - статичная закрытая; г - делящаяся транзитная; д - стволовых клеток; з - делящаяся закрытая. Стрелки - поступление клеток в популяцию, выход из нее и деление клеток внутри популяции (двойные стрелки)
Согласно современным представлениям источником, из которого образуются все дифференцированные клетки, являются стволовые (прогениторные) клетки, а процесс, благодаря которому в индивидуальном развитии и/или при регенерации органов и тканей в организме появляются клетки требуемых цитотипов, носит название гистогенеза (см. п. 3.1.3).
Стволовые клетки отличаюся рядом особенностей. Во-первых, они составляют в организме самоподдерживающуюся популяцию в том смысле, что определенное их количество восстанавливается путем деления, если часть клеток покидают популяцию, встав на путь клеточной дифференцировки. Предполагается, однако, что по мере увеличения возраста особи численность указанных популяций (имеются в виду, прежде всего, популяции региональных резидентных стволовых клеток) сокращается. Во-вторых, стволовые клетки способны к так называемому асимметричному митотическому делению, когда одна из образующихся дочерних клеток вступает в следующий митотический цикл, способствуя поддержанию количества стволовых клеток, тогда как другая встает на путь дифференцировки. Если обе дочерние клетки, возникшие вследствие деления стволовой клетки, возвращаются в митотический цикл, говорят о симметричном митозе. Природа сигналов и клеточный механизм разграничения симметричного и асимметричного митозов не выяснены.
Прогениторными называются стволовые клетки, вступившие в гистогенез, то есть для которых направление специализации определено (начальное событие клеточной дифференцировки в виде детерминации состоялось): предположительно прогениторными являются региональные или резидентные стволовые клетки. Принято считать, что вероятность онкотрансформации прогениторных клеток сопоставима с вероятностью онкотрансформации обычных симатических клеток на завершающей стадии гистогенеза.
С учетом отмеченного, представления о клеточных популяциях трансформируются в представления о тканевых клеточных системах (рис. 3.11). Все процессы, ведущие к оформлению (индивидуальное развитие) или к поддержанию и восстановлению (физиологическая и репаративная регенерация) в организме групп клеток определенного цитофенотипа, имеют в своей основе соответствующие гистогенезы. Принципиальная структура гистогенеза показана на рис. 3.12. Место и роль различных клеточных механизмов в гистогенезе отражены в рис. 3.13. Из рисунка 3.12 следует, что гистогенез начинается со стволо-
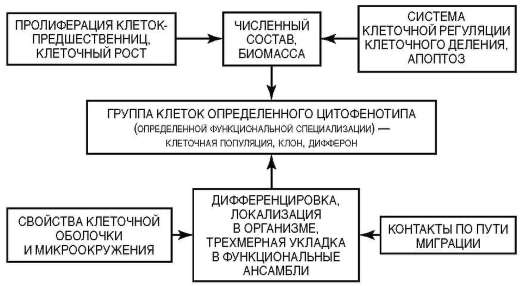
Рис. 3.11. Тканевая клеточная система (принцип организации)
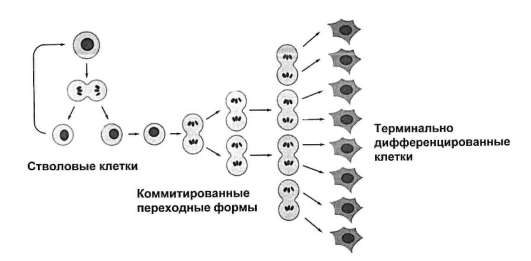
Рис. 3.12. Динамика клеточных форм в гистогенезе
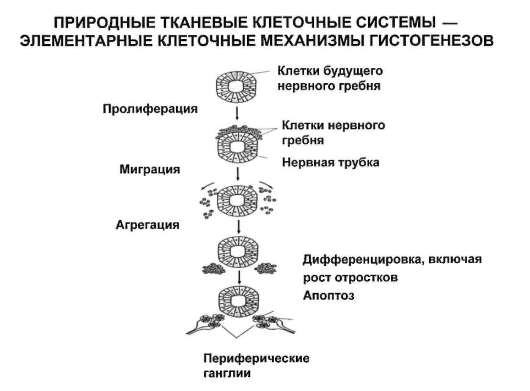
Рис. 3.13. Динамика клеточных форм в тканевых системах
вой (эмбриогенез) или прогениторной (родившийся человек, возможно плод на стадии органогенезов) клетки.
Данные по биологии стволовых и прогениторных клеток-предшественниц дифференцированных клеток различных цитотипов (цитофено-типов) служат основой для разработки терапевтических биомедицинских клеточных технологий нового поколения, относящихся к формирующемуся разделу практического здравоохранения - регенеративной медицине.
Вопросы для самоконтроля
1. Что такое жизненный и митотический циклы клетки?
2. Какие процессы реализуются в различных фазах митотического цикла, и как осуществляется его регуляция?
3. Что представляет собой апоптоз и в чем его значение для организма?
4. В чем суть клеточной дифференцировки?