Биология: учебник: в 2 т. / под ред. В. Н. Ярыгина. - 2011. - Т. 1. - 736 с. : ил.
|
|
|
|
Раздел II. КЛЕТОЧНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ЖИЗНИ. Глава 2. КЛЕТОЧНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ЖИЗНИ - ОСНОВА ЖИЗНЕДЕЯТЕЛЬНОСТИ И РАЗВИТИЯ ЖИВЫХ ФОРМ ВСЕХ ТИПОВ СТРУКТУРНО-ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ. БИОЛОГИЯ КЛЕТКИ
Среди всеобщих обусловленных «инфраструктурой» эволюционного процесса уровней организации жизни клеточному уровню принадлежит особое место. Клетка, представляющая элементарную структуру этого уровня, необходима и, в то же время, достаточна, чтобы жизнь как особое явление существовала в пространстве и времени. Клеточная организация наделена всем необходимым для наращивания количества и разнообразия, сохранения и применения в жизненных обстоятельствах биологически полезной информации, активной мобилизации веществ и энергии из окружающей среды и их использования в целях построения живых структур, обеспечения требуемых функций. Элементарное явление клеточного уровня представлено совокупностью упорядоченных в объеме клетки и закономерно распределенных по фазам клеточного цикла реакций метаболизма, обусловливающих реализацию потоков информации, энергии и веществ в живых системах. События на клеточном уровне обеспечивают биоинформационное и вещественно-энергетическое сопровождение феномена жизни на всех уровнях ее организации.
Хотя первым в перечне всеобщих уровней организации жизни значится молекулярно-генетический (см. п. 1.6), изучение существенных ее проявлений целесообразно начать с клеточного уровня.
2.1. клетка - элементарная единица живого
Клетка - это наименьшая по размерам биологическая структура, которая наделена всей полнотой свойств жизни и способна в приемлемых условиях среды поддерживать эти свойства в себе самой и передавать их в ряду поколений. Современная жизнь вне связи с клеткой невозможна. Это делает клетку элементарной структурной, функциональной и генетической единицей живых форм1. Другими словами, клетка составляет основу строения, функций и развития всех живых существ - прокариотических и эукариотических, одноклеточных и многоклеточных, даже неклеточных (вирусы), животных, растений, грибов, лишайников. Клеточная организация, как таковая, характеризуется наличием: мембраны, отграничивающей клетку от окружения; ДНК; цитоплазмы. Занимая положение элементарной единицы жизни, клетка отличается сложным строением. Указанная сложность по-разному реализуется в про- и эукариотических клетках (см. п. 2.3).
Место клетки в жизненных процессах описывается клеточной теорией.
2.2. клеточная теория
Клеточная теория сформулирована немецким зоологом Т. Шван-ном (1839). Так как он активно использовал данные своего современника ботаника М. Шлейдена, последнего по праву считают соавтором клеточной теории. Исходя из предположения о гомологичности (общности происхождения) растительных и животных клеток, что доказывается одинаковым механизмом их возникновения, Т. Шванн обобщил сведения о клеточном строении различных организмов в виде теории, по которой клетки являются структурной и функциональной основой живых существ. Во 2-й половине XIX в. немецкий патолог Р. Вир-хов сделал важный вывод о том, что клетка может возникнуть лишь из уже существующей клетки. Р. Вирхов рассматривал клетку также как элементарную единицу патологии организма, считая, что в основе болезней лежат изменения на клеточном уровне.
Клеточная теория включает три положения.
Первое из них утверждает, что жизнь, какие бы сложные или простые формы она не принимала, в ее структурном, функциональном
1 Характеристика клетки как генетической единицы означает, что в основе главных форм развития живых существ - индивидуального (онтогенез) и исторического (филогенез) - лежит принцип клеточной организации.
и генетическом плане обеспечивается только клеткой. Эта роль клетки обусловлена тем, что она является биологической структурой, при помощи которой происходит извлечение из окружающей среды, превращение и использование организмами энергии и веществ. В клетке сохраняется и воплощается в процессы жизнедеятельности биологическая (генетическая, наследственная) информация - ДНК, матричный механизм репликации ДНК и синтеза белков.
Второе положение говорит о том, что в настоящих условиях единственным способом возникновения новых клеток является деление существующих клеток. В обосновании клеточной природы земной жизни тезису о единообразном способе образования клеток принадлежит особая роль. Этот тезис использовали М. Шлейден и Т. Шванн как свидетельство гомологичности клеток различных типов1. Современная биология расширила круг доказательств. Независимо от структурно-функциональных, химических и иных особенностей все клетки одинаковым образом:
• сохраняют биологическую информацию (ДНК);
• удваивают свой генетический материал с целью передачи количественно и качественно полноценной биоинформации в ряду поколений (репликация ДНК);
• используют биоинформацию для обеспечения функциональных отправлений (матричный синтез белковых молекул);
• вырабатывают и переносят энергию (АТФ);
• превращают энергию в работу.
Третье положение соотносит клетку с многоклеточными формами. Многоклеточное существо - это совокупность высоко интегрированных в систему организма клеточных ансамблей, качественно и количественно закономерно представленных в тканевых и органных структурах, объединяемых дистантными гуморальными, нервными и иммунными, а также местными (цито- и хемокины, ростовые факторы) формами регуляции и интеграции. Системе (здесь организм) свойственно наличие специфических качеств, не сводимых к свойствам элементов (здесь клетки), образующих систему. Указанные качества - результат закономерного пространственно-
1 Авторы клеточной теории, выдвигая верное положение о единообразном пути возникновения всех клеток, механизм их образования представляли неверно. М. Шлейден считал, что клетки возникают путем конденсации слизистого вещества в ядро с последующим наслоением и отграничением от окружения цитоплазмы. Т. Шванн разделял эту точку зрения.
временного взаимодействия элементов системы. В XIX в. Р. Вирхов предложил концепцию «клеточного государства», суть которой состояла в утверждении, что хотя клетка и является самостоятельным структурно-функциональным образованием, но в составе многоклеточного организма ее жизнедеятельность подчинена задачам и согласуется с активностью других клеток этого организма.
Системный характер организации, функционирования и развития свойственен не только организму, но и другим принципиальным биологическим категориям - геному и генотипу, отдельно взятой клетке, клеточной популяции (тканевая клеточная система), популяции организмов, биоценозу или экосистеме, биосфере.
Системный подход как научно-методологическое направление используется в биологических исследованиях с начала минувшего столетия и реализуется в формате научной дисциплины системной биологии. В современной науке о жизни, наряду с системной биологией, зародилось направление биология систем - systems biology (см. п. 1.1).
2.3. типы клеточной организации
Имеется большое разнообразие клеток, которые различаются по размерам и форме, структурным и ультраструктурным, химическим и другим признакам. Главных типов клеточной организации два - прокарио-тический и эукариотический. Различие между ними видят в том, что в первом случае - это относительно просто устроенные клетки со сложной физиологией, а во втором - это клетки со сложной внутренней организацией. Указывая на сравнительно сложную или простую структуру (морфологию), имеют в виду прежде всего компартментацию клеточного объема при помощи мембран (см. п. 2.4.1) или ее отсутствие. Эукариотический тип представлен подтипом клеток одноклеточных организмов (простейшие), и подтипом клеток многоклеточных существ, а также животными, растительными клетками, клетками грибов, лишайниками.
Клеткам прокариотического типа (рис. 2.1), к которым относят бактерии и цианобактерии (в более ранних систематиках сине-зеленые водоросли), свойственны малые размеры (0,5-5,0 мкм диаметром или длиной) и отсутствие обособленного ядра (доядер-ные формы), так как наследственный материал - ДНК - не отграничен от цитоплазмы оболочкой и, следовательно, не заключен в отдельную внутриклеточную структуру. Молекулы прокариотиче-ской ДНК имеют форму замкнутого кольца. Генетический аппарат
клетки представлен, как правило, одной хромосомой, хотя есть исключения. В хромосоме прокариот (нуклеоид) нет белков основного характера - гистонов, что указывает на различия в организации и регуляции генетических функций в клетках прокариотического и эукариотического типов. К особенностям структуры и функционирования аппарата биосинтеза белка относят меньшие размеры рибосом и их субъединиц, полицистронный формат транскрипции и трансляции. В цитоплазме прокариотических клеток за некоторым исключением (пурпурные бактерии, цианобактерии) не развита система мембран. Для прокариот не типичны внутриклеточные перемещения цитоплазмы (ци-клоз) или амебоидное движение. Двигательная активность некоторых форм обеспечивается жгутиками. Для прокариот характерна быстрая смена поколений. Время, необхо-
димое для образования дочерних клеток из материнской (время генерации), - десятки минут.
Современные прокариоты - сборная группа организмов. Различия относятся к типу обмена веществ (аэробы и анаэробы, хе-моавтотрофы и фотоавтотрофы, хемогетеротрофы), средам обитания, среди которых есть экстремальные по температурным, химическим и иным жизненно важным условиям, характеру связей в биоценозах (свободно существующие формы, паразиты, комменсалы). Оправдано заключение об исключительной эколо-
Рис. 2.1. Прокариотическая клетка (схема): 1 - клеточная стенка; 2 - плазматическая мембрана; 3 - ДНК нуклеоида, 4 - полирибосомы цитоплазмы; 5 - мезосома; 6 - ламеллярные структуры; 7 - впячи-вания плазмалеммы; 8 - скопления хроматофоров; 9 - вакуоли с включениями; 10 - бактериальные жгутики; 11 - пластинчатые тилакоиды
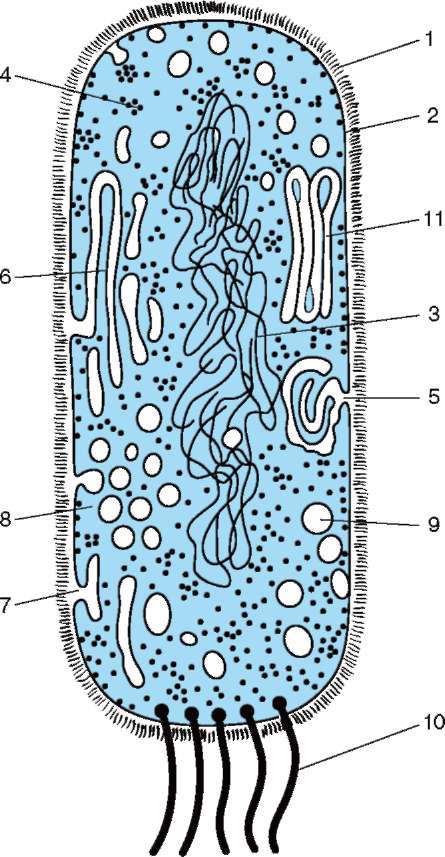
гической пластичности прокариот, которую связывают с особенностями организации и пластичностью прокариотического генома.
Отличительные признаки клеток эукариотического типа (рис. 2.2) - обособленное от цитоплазмы ядро (ядерные формы) и значительно большее количество ДНК на клетку. Молекулы ДНК имеют линейную форму и находятся в связи с гистонами (нуклеогисто-новый комплекс). ДНК эукариотических клеток распределена между
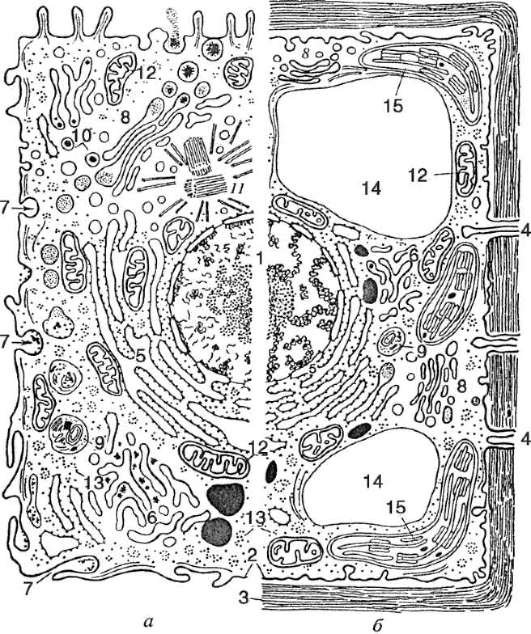
Рис. 2.2. Эукариотическая клетка: а - животного происхождения; б - растительного происхождения (схема). 1 - ядро с хроматином и ядрышком; 2 - плазматическая мембрана; 3 - клеточная стенка; 4 - плазмодесма; 5 - гранулярный эндоплазматический ретикулум; 6 - гладкий ретикулум; 7 - пи-ноцитозная вакуоль; 8 - аппарат Гольджи; 9 - лизосома; 10 - жировые включения в гладком ретикулуме; 11 - центриоль и микротрубочки центросферы; 12 - митохондрии; 13 - полирибосомы гиалоплазмы; 14 - центральная вакуоль; 15 - хлоропласт
большим или меньшим числом ядерных структур - хромосом. Эука-риотические клетки крупнее прокариотических, их диаметр или длина достигает десятков и сотен микрон. В цитоплазме таких клеток присутствуют постоянные структуры (органеллы) частью мембранного, а частью безмембранного строения. Время генерации эукариотических клеток исчисляется часами и десятками часов.
Особенности растительных клеток (см. рис. 2.2) - наличие среди органелл пластид, отсутствие центриолей, присутствие в клеточной стенке полисахарида целлюлозы. Для клеток растений характерно интенсивное внутриклеточное движе-
ние цитоплазмы (циклоз).
В состав клеточных стенок грибов («низшие растения» в более ранних систематиках; в настоящее время выделены в отдельное Царство - см. п. 1.9) входит полисахарид хитин.
Особенность одноклеточных эу-кариотических организмов - простейших - то, что они (исключая колониальные формы) в структурном отношении соответствуют уровню клетки, а в физиологическом - особи. Специфическая черта организации некоторых (но далеко не всех) видов простейших - присутствие в цитоплазме миниатюрных образований, выполняющих в объеме клетки функции органов многоклеточного организма. Так, у инфузорий (рис. 2.3) - это цитостом,
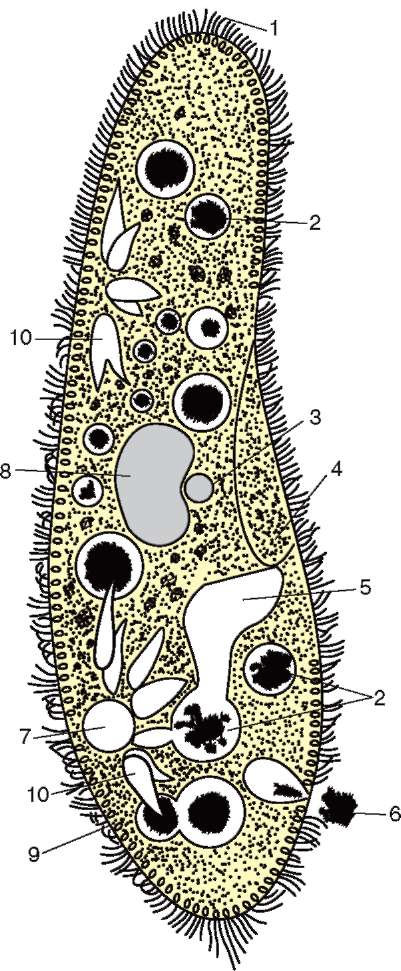
Рис. 2.3. Одноклеточный организм - инфузория: 1 - реснички; 2 - пищеварительные вакуоли; 3 - микронуклеус; 4 - клеточный рот (цитостом); 5 - клеточная глотка (цитофаринкс); 6 - анальная пора; 7 - выделительная (сократительная вакуоль); 8 - макронуклеус; 9 - трихоцисты; 10 - проводящие каналы пульсирующей вакуоли
цитофарингс, пищеварительные вакуоли и порошица, образующие в совокупности аналог пищеварительного тракта. Генетический аппарат инфузорий представлен двумя ядрами - вегетативным и генеративным. Функция первого - генетический контроль обмена веществ и жизнедеятельности организма, функция второго - обеспечение полового процесса.
2.4. принципы структурно-функциональной организации клетки многоклеточного животного организма
2.4.1. СТРУКТУРНО-ФУНКЦИОНАЛЬНО-МЕТАБОЛИЧЕСКАЯ ВНУТРИКЛЕТОЧНАЯ КОМПАРТМЕНТАЦИЯ. БИОЛОГИЧЕСКАЯ МЕМБРАНА. НЕМЕМБРАННЫЕ СПОСОБЫ КОМПАРТМЕНТАЦИИ
Упорядоченность содержимого эукариотической клетки и происходящих в ней процессов достигается путем компартментации, то есть разделения ее объема на компартменты или «ячейки», различающиеся по химическому, прежде всего, ферментному составу.
Компартментация обеспечивает пространственное разделение и/или обособление веществ и процессов в клетке. Понятие компартмента распространяется на целую органеллу (митохондрия) или ее часть (внутренняя мембрана митохондрии или ограничиваемое ею пространство). Иногда в качестве самостоятельного компартмента выделяют клеточное ядро.
Роль биологических мембран в компартментации объема эукариотической клетки очевидна (рис. 2.4). Мембраны разных компартментов различаются по химической организации (липидный и белковый состав, набор ассоциированных молекул). Этим достигается их функциональная специализация.
Мембраны выполняют функции: отграничивающую (барьерную), поддержания формы и сохранения содержимого структуры (клетки или органеллы), организации поверхностей раздела между гидрофильной водной и гидрофобной неводной фазами и, таким образом, избирательного размещения в объеме клетки соответствующих ферментных систем. Сами мембраны благодаря наличию в них жировых веществ (липидов) образуют в клетке гидрофобную фазу для химических превращений в неводной среде.
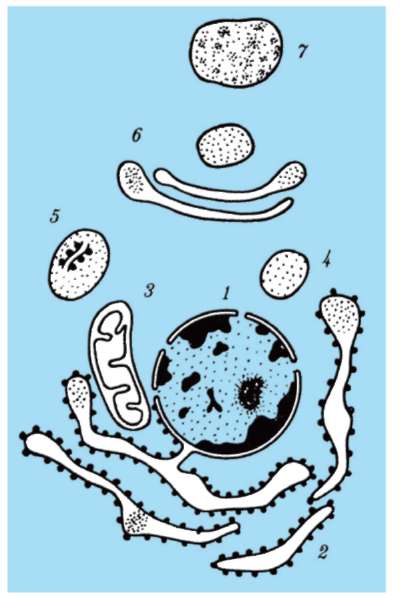
Рис. 2-4. Компартментация объема клетки с помощью мембран: 1 - ядро; 2 - шероховатая цитоплазматическая сеть; 3 - митохондрия; 4 - транспортный цитоплазматический пузырек; 5 - лизосома; 6 - пластинчатый комплекс; 7 - гранула секрета
Общепринята жидкомозаичная
модель молекулярной организации биологической мембраны (рис. 2.5). Конструкционную основу мембраны составляет двойной или бимолекулярный слой (бислой) липидов. Мембранные липиды полярны. Их молекулы имеют гидрофобные, обращенные в бислое друг к другу и внутрь мембраны, и гидрофильные «наружные» участки. Липидный бислой имеет свойство, ликвидируя свободные края, самозамыкаться, что обусловливает способность мембран восстанавливать непрерывность при повреждениях. Это же свойство лежит в основе образования с восстановлением непрерывности мембраны клеточной оболочки
пузырьков при поглощении клеткой (эндоцитоз) твердых частиц (фагоцитоз) и порций жидкости (пиноцитоз), а также при выделении железистой клеткой секрета (экзоцитоз). По агрегатному состоянию липидный бислой напоминает жидкость: липидные молекулы свободно перемещаются в пределах «своего» монослоя.
Разнообразие функций биологических мембран связано с многообразием мембранных белков. Выделяют интегральные и периферические мембранные белки. Первые пронизывают мембрану насквозь или же погружены в липидный бислой частично, вторые располагаются на поверхности мембраны. Такая структура позволяет рассматривать мембрану как жидкомозаичное образование: в двухмерном «море» липидов «плавают» белковые «айсберги» и «льдины».
Мембранный механизм компартментации объема клетки - не единственный. Известно семейство самокомпартментирующихся ферментов - протеаз (пептидаз), участвующих во внелизосом-
ном расщеплении белков. В клетках они «укрыты» в протеасомах (рис. 2.6). Это мультимерные гетеробелковые агрегаты «цилиндрической» формы, образующиеся путем самосборки. Протеазы в них занимают внутреннюю зону, а снаружи располагаются белки-«проводники»
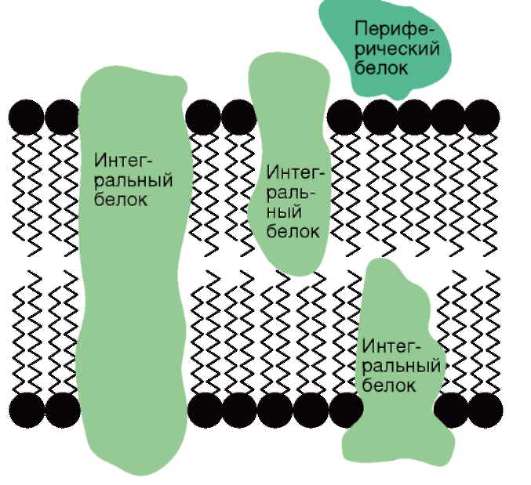
Рис. 2.5. Жидкомозаичная модель молекулярной организации биологической мембраны
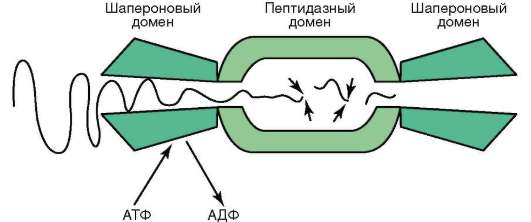
Рис. 2.6. Протеасомный комплекс (самокомпартментализующиеся протеазы)
или шапероны (см. п. 2.4.4.4-д и 2.4.9). В функцию последних входит опознание (детекция) белков, подлежащих протеолитическому расщеплению, и их «допуск» внутрь протеасомы к протеазам. Известно, что протеасомы обеспечивают деградацию циклина B в анафазе митоза. В комплексе с соответствующей циклинзависимой киназой (Cdk - англ. cyclin dependent kinase) названный белок принимает участие в регуляции прохождения клеткой митотического цикла (см.
п. 3.1.1.1).
2.4.2. КЛЕТОЧНАЯ ОБОЛОЧКА
Клетки как дискретные структуры отделены от окружения оболочкой. Основу клеточной оболочки (плазмалемма) составляет мембрана. Изнутри к мембране примыкает кортикальный (корковый) слой цитоплазмы (0,1-0,5 мкм), лишенный рибосом и пузырьков, но богатый цитоскелетными структурами - микротрубочками и микрофила-ментами, имеющими в своем составе сократимые белки. Наличие таких белков обусловливает участие этих структур в двигательной функции. Белки цитоскелетных образований связаны с интегральными мембранными белками (см. п. 2.4.1).
Снаружи мембрана клеточной оболочки покрыта гликокаликсом (10-20 нм). В его основе - комплексы белков с углеводами (глико-протеиды), жирами (липопротеиды) и жиров с углеводами (глико-липиды). Белковые и липидные участки комплексов находятся внутри мембраны или в связи с ней, тогда как углеводные «выдвинуты» во внеклеточный матрикс (внеклеточная или околоклеточная среда - часть внутренней среды организма). Такая структура плазмалеммы обеспечивает избирательное взаимодействие клеток друг с другом, а также с факторами внутренней среды организма.
Среди этих факторов важная роль принадлежит сигнальным молекулам (лиганды). Белки клеточных оболочек, являющиеся мишенями для сигнальных молекул, составляют семейство рецепторных белков или рецепторов. В результате их взаимодействия с сигнальными молекулами образуется лиганд-рецепторный комплекс, который активирует внутриклеточный сигнальный путь (сигналлинг). В итоге достигается необходимая реакция клеток-мишеней: активируются гены и, следовательно, образуются требуемые белки, изменяется интенсивность энергетического обмена, запускаются клеточная пролиферация, дифференцировка, апоптоз. К этому семейству относятся
адренорецепторы, взаимодействующие с таким лигандом, как гормон мозгового вещества надпочечников адреналин (рис. 2.7). Адреналин как сигнальная молекула выполняет функцию первичного внеклеточного мессенджера (англ. messenger - посланник, гонец, посредник; здесь и ниже - агент, доставляющий к клетке или передающий внутри нее сигнал, побуждающий к определенному действию или изменению состояния). Образующийся гормон-рецепторный комплекс запускает внутриклеточный сигнальный путь, начинающийся с белка-преобразователя (семейство G-белков). Активированный G-белок (на рис. 2.7 не показан) передает сигнал на фермент аденилатциклазу с образованием из АТФ циклического аденозинмонофосфата (цАМФ). Последний в качестве вторичного внутриклеточного мессенджера активирует фермент протеинкиназу, катализирующую фосфорили-рование других ферментов. Перейдя благодаря фосфорилированию в функционально активное состояние, эти ферменты обеспечивают метаболический или иной ответ. Описанная последовательность событий соответствует, например, ситуации, когда животное попадает в экстремальные условия и вынуждено вступить в борьбу или обратиться в бегство («кошка - собака»). Адекватный ответ здесь состоит в выбросе из клеток печени в кровь глюкозы с активацией распада гликогена в мыш-
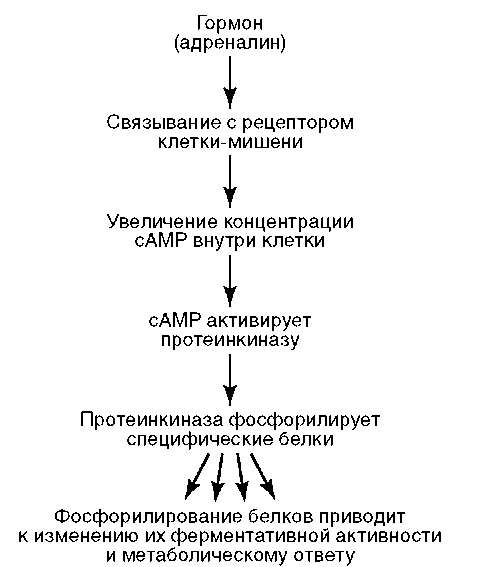
Рис. 2.7. Гормональная регуляция клеточной деятельности с участием рецепторов плазмалеммы
цах, что решает проблему покрытия возросших энергозатрат. В других случаях образование комплекса «адреналин-адренорецептор» и, далее, цАМФ приводит к активации промоторов, запускающих транскрипцию цАМФ-индуцибильных (-зависимых) генов с образованием соответствующих белков.
Реакция клетки на сигнальные молекулы (лиганды) зависит от наличия в плазмалемме рецепторного белка, а содержание клеточного ответа - от разновидности рецептора, активируемого сигнального пути и/или типа клетки. G-белки активируют образование не только цАМФ, но и других вторичных мессенджеров, которыми служат циклический гуано-зинмонофосфат (цГМФ), оксид азота (NO), ионы Са2+, липид диацилгли-церин (ДАГ). Некоторые внутриклеточные сигнальные пути запускаются с рецепторов плазмалеммы без участия вторичных мессенджеров.
Лиганд-рецепторные взаимодействия представляют собой ключевой элемент межклеточного общения, без которого невозможна жизнедеятельность многоклеточного живого существа.
Белки клеточных оболочек многочисленны и разнообразны: в плаз-малемме эритроцитов, например, их не менее 100. Классификация этих белков имеет функциональную основу - рецепторные, о которых речь шла выше, структурные, транспортные, обеспечивающие взаимодействия как межклеточные, так и клеток и околоклеточного окружения (внеклеточного матрикса) и др.
Структурные белки плазмалеммы во взаимодействии с цитоске-летными образованиями участвуют в поддержании формы клеток, допуская ее обратимые изменения. В обеспечении специфической формы эритроцита (двояковогнутый диск) важная роль принадлежит белку спектрину, волоконца которого образуют субплазмалеммальный при-мембранный каркас. Мутации по гену спектрина фенотипически проявляются в изменении формы эритроцитов, а клинически - в развитии наследственных болезней красной крови сфероцитоза и эллиптоцитоза.
Необходимым условием жизнедеятельности клеток является чрез-мембранный транспорт веществ, который должен быть избирательным и иметь скорость, соответствующую метаболическим потребностям. Эти задачи решаются благодаря специализированным транспортным системам с участием в них представителей семейства транспортных белков. К семейству относится, в частности, белок анионного канала в мембране эритроцита, посредством которого в соответствии с концентрационными градиентами происходит обмен ионами Cl- и HCO3- между плазмой крови и красными кровяными тельцами в тканях и в легких.
Многие белки клеточных оболочек являются антигенами. Наличие помеченных распознаваемым под микроскопом «зондом» (флюоресцентный краситель) моноклональных антител, образующих комплекс исключительно со «своим» антигеном, позволяет использовать антигенные белки клеточных оболочек в качестве маркеров клеток определенного типа (белок CD19 - маркер В-лимфоцитов человека), их положения в гистогенетическом ряду (антигенными маркерами родона-чальных клеток всех клеточных элементов периферической крови являются белки CD34 и CD133, клеток лейкоцитарного ряда - CD33, клеток эритроцитарного ряда - CD36) или функционального состояния (белок CD95 участвует в передаче клетке сигнала к апоптозу).
Некоторые белки, в том числе с антигенными свойствами, использованы природой в процессе коэволюции видов при формировании биоценозов. Они, в частности, обеспечивают проникновение в клетки животных и человека внутриклеточных патогенов: одноклеточных паразитов (CD234 - возбудитель трехдневной малярии Plasmodium vivax; β1-интегрин из группы адгезивных белков - возбудитель городского трипаносомоза или болезни Чагаса Trypanosoma cruzi), бактерий (CD46 - Streptococcus pyogenes группы А), вирусов (CD4 и CD45 - ВИЧ; CD46 - корь).
Маркеры CD («кластеры дифференцировки» - от англ. cluster of differentiation) используют в диагностических и/или прогностических целях. Клетки злокачественных опухолей различной локализации образуют конкретные белки-антигены: CD24 типичен для клеток мелкоклеточного рака легких, CD87 - рака молочной железы, кишечника, простаты. Уровень синтеза CD82 коррелирует со скоростью метастази-рования раковых клеток ряда опухолей, а наличие CD9 типично для пониженного уровня метастазирования клеток при раке молочной железы и меланоме. Избирательное образование представителей семейства CD наблюдается при болезнях неонкологической природы: например, при одной из форм цирроза печени - первичном биллиарном - снижен синтез CD26.
При перспективности научно-практического направления, как такового, индикаторный потенциал большинства маркеров CD, прежде всего в онкологии, где требуется высочайший уровень ответственности перед пациентом, на настоящее время ниже желаемого и не дает оснований для бесспорных диагностических заключений.
2.4.2.1. Макромолекулярный полиморфизм: механизмы и функциональные следствия
Для многих белков клеточной оболочки характерно свойство макро-молекулярной полифункциональности. В многоклеточном организме они являются участниками разных событий. Механизмы и следствия этого феномена иллюстрирует белковое семейство CD44.
CD44 - широко экспрессируемое (их образуют кроветворные клетки, Т- и В-лимфоциты, моноциты, кератиноциты, фибробласты, эндотелиальные клетки сосудов, цилиндрический эпителий желудочно-кишечного тракта, переходный эпителий мочевого пузыря) семейство изоформ (вариантов) «базовой» молекулы.
Члены семейства CD44 - трансмембранные белки. Особенность гена CD44 состоит в наличии двух групп экзонов (об экзон-интронной организации генов см. п. 2.4.5.5). Одна из них (экзоны 1-5 и 16-20 или s1-10) кодирует так называемые стабильные (CD44s), тогда как другая (экзоны 6-15 или v1-10) так называемые вариабельные (CD44v) изоформы белка. На посттранскрипционном уровне из пре-и(м)РНК транскрипта в результате альтернативного сплайсинга образуется более 1000 вариантов и(м)РНК. Полиморфизм изоформ и, следовательно, свойств образуемых белков усиливается благодаря посттрансляционным изменениям молекул1: их гликозилированию, а также комплекси-рованию субъединиц (полипептидов) путем полимеризации2.
Молекулярный полиморфизм CD44 и разнообразие лигандов (гиалу-роновая кислота, коллагены I и VI типов, ряд внутриклеточных белков) объясняют вовлеченность белка во многие события. Это перемещение (миграция) и метастазирование опухолевых клеток, агрегация, адгезия и активация лимфоидных клеток, представление (презентация) росто-
1 При использования генетической информации ДНК в жизнедеятельности клетки важная роль принадлежит пост(после)транскрипционным и пост(после)транс-ляционным процессам, благодаря чему путь от гена к функционирующему белку, как правило, долгий. Это объясняет, почему исследования в области геномики и протеомики (см. п. 1.1) должны проводиться согласованно.
2 Гомоили гетерологичная полимеризация (ди-, три-, тетрамеризация), заключается в образовании надмакромолекулярных комплексов из, соответственно, одинаковых или разных белковых субъединиц (двух, трех, четырех полипептидов или простых белков) является эффективным механизмом регуляции функций на макромолекуляр-ном уровне. Применительно к членам семейства CD44 она способствует усилению сродства к определенным лигандам. Полимеризацию белковых субъединиц допустимо рассматривать как один из способов безмембранной функциональной компар-тментации внутри- и внеклеточных процессов на макромолекулярном уровне.
вых факторов и цитокинов клеткам, хоуминг (англ. home - дом; здесь, избирательное проникновение клеток в подходящую «тканевую нишу») Т-лимфоцитов, выход из сосудистого русла лейкоцитов.
2.4.3. КЛЕТОЧНОЕ ЯДРО
Появление 1,9-2 млрд лет назад на Земле эукариотических организмов (ядерные формы, см. п. 2.3), клетки которых отличаются наличием отграниченного от цитоплазмы ядра, оценивается как событие более фундаментальное, чем разделение мира жизни на растения и животных. Эволюционно-функциональные приобретения, связанные с обособлением наследственного субстрата (ДНК) в отдельной структуре, описаны в разделе 1.10.
Клеточное ядро (рис. 2.8) отделено от содержимого клетки оболочкой. Функции ядра состоят в хранении наследственного материа-
Рис. 2.8. Структура клеточного ядра (схема): 1 - ядерная оболочка (две мембраны - внешняя и внутренняя, и перинуклеарное пространство); 2 - ядерная пора; 3 - конденсированный хроматин; 4 - диффузный хроматин; 5 - ядрышко (гранулярный и фибриллярный компоненты, в центральных светрых зонах находится р-ДНК); 6 - интерхроматиновые гранулы (РНП); 7 - перихрома-тиновые гранулы (РНП); 8 - перихроматиновые фибриллы (РНП); 9 - кариоплазма, ядерный сок
ла (ДНК), его воспроизводстве (репликация ДНК) с целью передачи в ряду клеточных поколений (митоз), а также в реализации наследственной информации в ходе биосинтеза белка в жизнедеятельности клетки (транскрипция, процессинг пре-РНК транскриптов). В нем образуются структурные элементы - большая и малая субъединицы - цитоплазма-тических органелл рибосом, на которых в цитоплазме происходит образование полипептидов (простых белков).
В ядре выделяют ядерную оболочку, ядерный матрикс, ядрышко, хромосомы (хроматин), ядерный сок.
2.4.3.1. Ядерная оболочка
Функции ядерной оболочки (кариолемма) состоят в отграничении ядерного содержимого от цитоплазмы, поддержании условий, необходимых для выполнения ядром функций, в частности генетических, в обеспечении доступа к генетическому материалу и структурам (ДНК, хромосомы) сигналов (транскрипционные факторы), меняющих функциональное состояние генов, в упорядочении пространственной организации генетических структур и процессов, в реализации двусторонних ядерно-цитоплазматических обменов и взаимодействий.
Механизмы ядерно-цитоплазматических транспортных потоков разнообразны. Ионы, низкомолекулярные соединения (сахара, аминокислоты, нуклеотиды), некоторые белки (гистоны) проникают в ядро относительно легко и вне связи с порами ядерной оболочки. Известен механизм проникновения в ядро стероидных, в частности половых гормонов (эстрадиол, прогестерон, тестостерон). Будучи жирорастворимыми, они легко проходят через плазмалемму из околоклеточной среды в цитоплазму клетки, где комплексируются с цитозольными рецепторами (семейство «белков теплового шока»). Такой комплекс проходит через ядерную оболочку и связывается с гормонидуцируемыми генами. В итоге - активация последних, обусловливающая цепь событий, необходимых для полового развития организма и осуществления им репродуктивной функции. В рассмотренном примере белки теплового шока - это транскрипционные факторы в неактивном состоянии, активируемые путем взаимодействия с гормоном (рис. 2.9).
Крупные белковые молекулы, рибонуклеопротеидные комплексы (субъединицы рибосом) попадают в ядро или покидают его через особые структуры - ядерные поры. Это проверено введением в цитоплазму клетки частиц коллоидного золота (диаметр порядка 14 нм), которые
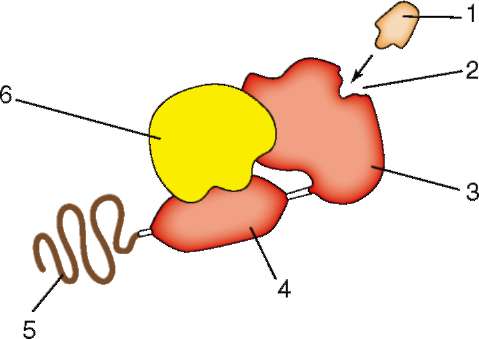
Рис. 2.9. Комплексирование сигнальной молекулы (стероидный гормон) с ци-тозольным рецептором (для полового гормона - белки «теплового шока»), приводящее к транспорту в ядро и активации специфического транскрипционного фактора (схема). 1 - сигнальная молекула; 2 - цитозольный рецептор: участок (центр) связывания сигнальной молекулы; 3 - цитозольный рецептор: участок (домен) связывания сигнальной молекулы; 4 - цитозольный рецептор: участок (домен) связывания ДНК; 5 - цитозольный рецептор: участок (домен) активации транскрипции; 6 - ингибирующий белок
проникают из цитоплазмы в ядро, предварительно скапливаясь вблизи ядерных пор.
Ядерная оболочка выполняет в отношении главных ядерных структур хромосом организующую функцию. Преобразования ядерной оболочки и хромосом в митозе взаимосвязаны. В конце анафазы перед началом их декомпактизации хромосомы устанавливают контакты с мембранными пузырьками, которые затем, параллельно процессу де-компактизации, слагаются в ядерную оболочку. Если в эксперименте вызвать декомпактизацию хромосом уже в метафазе митоза, то каждая из них вступит в контакт с мембранным пузырьком и приобретет самостоятельную отдельную оболочку, имеющую строение ядерной. Ядерная оболочка состоит из двух мембран, разделенных околоядерным (перинуклеарным) пространством. Несмотря на сходство электронно-микроскопической картины, скорость обмена фосфолипи-дов во внешней мембране в 4 раза превосходит скорость их обмена во внутренней. Перинуклеарное пространство (20-50 нм) сообщается с канальцами цито(эндо)плазматической сети. К наружной мембране ядерной оболочки прикрепляются рибосомы и полисомы. В околоядерной зоне цитоплазмы повышено содержание микрофиламентов и микротрубочек. К внутренней мембране, за исключением участков, занятых
порами, прилежит высоко компактизированный хроматин. Между мембраной и хроматином располагается ядерная ламина (плотная пластинка). Она образована промежуточными микрофиламентами (10 нм) в комплексе с белками внутренней ядерной мембраны. Учитывая прочность связи между пластинкой и хроматином, можно думать, что этим контактом обеспечивается пространственная упорядоченность расположения хромосом в объеме интерфазного ядра, что, возможно, имеет функциональный смысл. Так, образование молекул гемоглобина требует скоординированной транскрипции генов α- и β-глобинов, которые у человека расположены, соответственно, на хромосомах 16 и 11. Такая согласованность может достигаться благодаря пространственному сближению названных хромосом. Плотная пластинка выполняет структурную функцию: при ее наличии ядро сохраняет форму в отсутствии обеих мембран ядерной оболочки.
Ядерная пора (поровый комплекс) - структура диаметром порядка 100 нм, в образовании которой принимают участие обе мембраны ядерной оболочки и более 1000 белков (рис. 2.10). Число ядерных пор на 1 мкм2 ядерной оболочки зависит от интенсивности синтетических процессов в клетке. У низших позвоночных, зрелые эритроциты которых сохраняют ядра, хотя синтезы в них сведены к нулю, на 1 мкм2 ядерной поверхности приходится до 5 пор, тогда как в активно образующих гемоглобин эритробластах - 30. Оболочка ядра зрелого сперматозоида лишена пор. Относительное количество ядерных пор различается у жи-
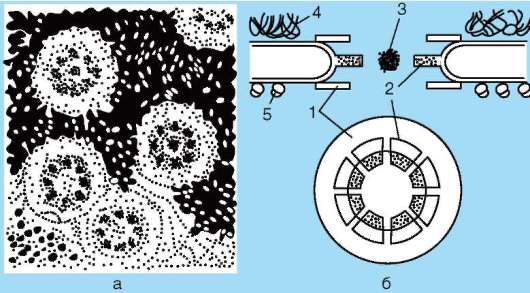
Рис. 2-10. Поровый комплекс (схема): а - внешний вид ядерных пор в ядре ооцитов; б - схема строения ядерной поры: 1 - кольцо; 2 - спицы; 3 - центральная гранула; 4 - хроматин; 5 - рибосомы
вотных разных видов: для лимфоцитов мышей эта цифра составляет 3,3 на 1 мкм2, а для лимфоцитов человека - порядка 5.
Структуры, аналогичные по строению поровым комплексам, в качестве редких находок обнаружены в мембранах гранулярной эндоплаз-матической сети. Их функция неизвестна. Транслоконы, через которые образующиеся на рибосомах полипептиды проникают в просвет канальцев эндоплазматической сети, имеют другое строение (см. п. 2.4.4.4-а).
2.4.3.2. Ядерный матрикс
Ядерный матрикс представлен нерастворимыми белками числом порядка 50. Предполагается наличие единой для внутреннего содержимого ядра сетчатой конструкции (скэффолд). Ее образуют плотно упакованные фибриллы (5-7 нм) с обозначениями согласно зонам их расположения в ядре - перихроматиновые, связанные с ядрышком (см. рис. 2.8). Конструкция связана с поровыми комплексами, плотной пластинкой, хроматином, ядрышком. Ее рассматривают как динамичную каркасную и объединяющую внутриядерные процессы структуру. Во взаимодействии с ядерным матриксом транскрипционные факторы обеспечивают требуемое взаиморасположение промоторных, энхансер-ных или сайленсерных участков транскрибируемых генов (рис. 2.11), происходят транскрипция и процессинг пре-и(м)РНК транскрипта. В генетически активных участках хроматина нуклеосомы связаны с белками матрикса (см. п. 2.4.3.4-б). Такой же контакт демонстрируют активно транскрибируемые и потенциально активные гены рДНК в области ядрышковых организаторов (см. п. 2.4.3.4-в).
Наряду с ядерным матриксом для обозначения внутренней среды ядра используют термин «ядерный сок». Его роль видится в обеспечении условий для функционирования генетического аппарата клетки - наличие предшественников для образования ДНК или РНК и ферментов их синтеза, ферментов молекулярной репарации ДНК или процессинга пре-и(м)РНК транскриптов. В нем находятся «транзитные» компоненты, следующие после проникновения внутрь ядра к ДНК хромосом или же в обратном направлении к ядерной оболочке и далее в цитоплазму.
2.4.3.3. Ядрышко
В интерфазных клеточных ядрах эукариот обнаруживается хорошо различимое при микроскопировании образование - ядрышко (нукле-ола). В ядрышках образуются молекулы рибосомных РНК (рРНК),
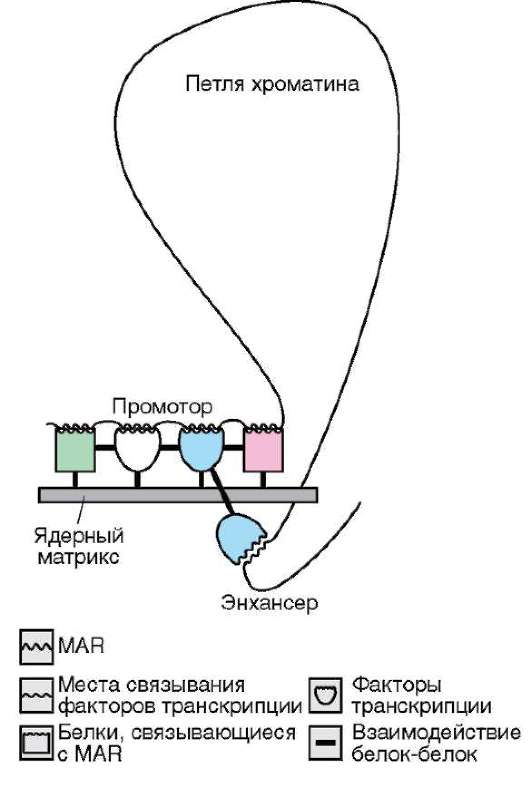
Рис. 2-11. Ядерный матрикс как субстрат для образования транскрипционного инициаторного комплекса: взаимодействие белков ма-трикса, петли ДНК и общих трансрипционных факторов (схема)
входящих в структуру рибосом - безмембранных цитоплазматических органелл, на которых происходит образование полипептидов (простых белков). Необходимость белковых синтезов для жизнедеятельности любой клетки объясняет наличие ядрышек в клетках всех эукариот. Это правило подтверждается исключениями. Ядрышек нет в ядрах дробящихся клеток (бластомеров) в эмбриогенезе амфибий, поскольку в них используются рибосомы, заготовленные «впрок» в яйцеклетках в периоде роста овогенеза. Ядрышки утрачиваются сохраняющими ядра зрелыми эритроцитами птиц, поскольку в этих клетках белковый синтез завершен.
Образование трех из четырех видов рРНК эукариот (у прокариот три вида рРНК) происходит на генах (рДНК), занимающих определенные
участки или локусы хромосом - ядрышковые организаторы . У человека - это хромосомы 13, 14, 15, 20 и 21. В области организаторов формируются ядрышки. Нередко, но не всегда, указанные области соответствуют участкам первичных (околоцентромерный гетерохроматин, см. п. 2.4.3.4-в) или вторичных перетяжек хромосом (см. п. 4.3.4). Количество ядрышек на ядро - величина переменная. Максимальное их количество не превышает числа организаторов. Снижение в сравнении с числом ядрышковых организаторов количества нуклеол объясняется их слиянием. В диплоидных соматических клетках человека при количестве ядрышковых организаторов, равном 10, ядрышко может быть одно.
Совокупное количество ядрышкового материала различается в клетках разного типа или в клетках одного типа при изменении функционального состояния. Оно отражает необходимость обеспечить образование требуемой массы рРНК.
Особенность генов рРНК в том, что они представлены в геноме многими копиями (мультигенные семейства или генные кластеры). У человека на гаплоидный набор хромосом их порядка 200. Для сравнения, количество копий генов рРНК: у мыши - 100, у кошки - 1000, у тритона - 4100, у аскариды - 300, у эвглены - 800, у кукурузы - 8500. Ну-клеотидные последовательности рДНК относятся к фракции умеренно повторяющихся. У прокариот отсутствуют структуры, соответствующие ядрышковым организаторам эукариот. Тем не менее сайты рДНК могут быть повторены в геноме бактерии 6-7 раз. Функциональное значение «тиражирования» генов рРНК заключается в повышении надежности генетической системы, обеспечивающей построение в клетках жизненно необходимого аппарата биосинтеза белка.
В области ядрышковых организаторов сначала создается 45S пре-рРНК транскрипт, путем процессинга которого образуются три из четырех видов эукариотической рРНК - 18S, 5,8S и 28S. Размеры даны в единицах Сведберга (S), отражающих скорость оседания (седиментации) макромолекул при ультрацентрифугировании: чем крупнее молекулы, тем быстрее они оседают. В процессинге пре-рРНК транскрипта участвуют малые ядрышковые РНК (от англ. snoRNA - small nucleolar RNA) или «указывающие РНК» (англ. - «guide RNA»). Функции этих РНК окончательно не установлены. Предположительно, они необходимы для химической модификации в специфических точках и конформа-ционных (объемных, трехмерных) изменений пре-рРНК транскрипта в целях обеспечения приготовления из него зрелых рРНК. Особенность многих snoRNA в том, что их нуклеотидная последовательность закоди-
рована в ДНК интронов структурных генов, особенно тех, которые контролируют образование рибосомальных белков. Гены четвертого вида рРНК эукариот - 5S - размещаются вне ядрышковых организаторов и повторены в геноме человека порядка 2000 раз.
С помощью электронного микроскопа в ядрышке описаны зоны с преимущественно фибриллярной (нитчатой) и гранулярной (зернистой) структурой. Первые представлены комплексами молекул белка и гигантских молекул пре-рРНК, из которых затем образуются более мелкие молекулы зрелых рРНК. В процессе созревания ядрышковые фибриллы преобразуются в гранулы, которыми представлены зоны с гранулярной структурой. Непосредственно в фибриллярной зоне ядрышка располагаются гетерохроматизированные неактивные сайты рДНК (см. п. 2.4.3.4-в).
2.4.3.4. Хроматин (хромосомы)
В ядре сосредоточена большая часть ДНК эукариотической клетки - 90%. Она распределена между ядерными структурами - хромосомами (греч. chroma - цвет, soma - тело). Морфология хромосом меняется по стадиям клеточного цикла. При вхождении клетки в митоз материал хромосом приобретает плотную упаковку (митотическая форма), а вне митоза - рыхлую (интерфазная форма). При просмотре в микроскоп гистологических препаратов митотические хромосомы видны как хорошо окрашиваемые основными красителями (гематоксилин, краситель Гимза) тельца. Материал хромосом на гистологических срезах в интерфазных ядрах виден как совокупность интенсивно окрашенных основными красителями глыбок, зерен и волоконец - хроматин в терминологии классической морфологии. Генетики наполняют этот термин (исторически морфологический) иным содержанием. Под хроматином они понимают вещество хромосомы, как таковое. Исходя из представления о сохранении структурной целостности хромосом в клеточном цикле, подчеркивается, что химический состав хроматина и плотность его упаковки различаются по длине хромосомы в зависимости от стадии этого цикла.
Хромосомы во взаимодействии с внехромосомными механизмами обеспечивают:
• хранение генетической информации;
• использование этой информации для воспроизводства и поддержания клеточной организации и функций;
• регуляцию считывания (транскрипция) наследственной информации;
• удвоение (репликация, самокопирование) генетического материала материнских клеток перед клеточным делением;
• передачу этого материала дочерним клеткам в процессе митоза. Первую из этих функций хромосома выполняет в обеих структурных
формах - митотической и интерфазной, следующие три функции - в интерфазной форме, последнюю - в митотической форме.
Хромосомная организация наследственного материала эукариот создает условия для тонкой регуляции генетических функций, репара-тивных процессов, минимизирующих объем нарушений молекулярной структуры ДНК, а также для рекомбинации ДНК в ходе мейоза при образовании половых клеток (см. кроссинговер, комбинативная геноти-пическая изменчивость).
2.4.3.4-а. Химический состав хроматина (хромосом) эукариотической клетки
Большая часть объема хромосом представлена ДНК и белками. Заметные химические компоненты хромосом - РНК и липиды. Среди белков (65% массы хромосом) выделяют гистоновые (60-80% всех белков) и не-гистоновые. Массовые соотношения ДНК : гистоны : негистоновые белки :
РНК : липиды составляют - 1:1:(0,2-0,5):(0,1-0,15):(0,01-0,03). Также
в малых количествах присутствуют полисахариды, ионы металлов (Ca, Mg) и некоторые другие компоненты. Обеспечение биоинформационно-генетических процессов в клетках связано, в основном, с ядерной ДНК. На долю ДНК митохондрий приходится порядка 10%. Как правило, эу-кариотическая хромосома содержит одну двойную спираль ДНК, образованную двумя линейными комплементарными друг другу молекулами.
Вместе с тем известны примеры закономерно увеличенного количества ДНК на клетку. К ним относятся гигантские политенные хромосомы в клетках слюнных желез насекомых, которые образуются в результате многократной репликации ДНК без расхождения биспира-лей (эндоредупликация). У плодовой мухи количество таких копий 512-1024. В диплотене профазы первого мейотического деления в ооци-тах рыб, земноводных, рептилий и птиц образуются хромосомы типа «ламповых щеток» (рис. 2.12), для них характерно образование петель. Петля содержит фрагмент ДНК длиной 5-100 тыс. п.н. Хромосомы типа «ламповых щеток» отличаются высоким уровнем транскрипции. Кратное гаплоидному увеличение количества ДНК в клетках печени закономерно происходит в постнатальном онтогенезе крыс и ряда других
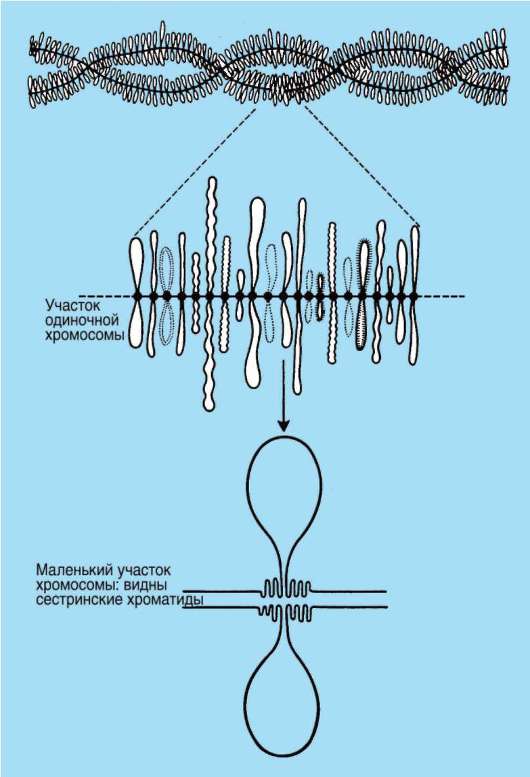
Рис. 2.12. Хромосомы типа «ламповых щеток»
животных - феномен соматической полиплоидии. Полиплоидные (тетраплоидные - 4с, октаплоидные - 8с, 16с и далее, где с - количество ДНК гаплоидного набора хромосом) клетки имеют большие в сравнении с диплоидными (2с) клетками размеры и, следовательно, более высокий функциональный потенциал. Если полиплоидное ядро делится и деление не сопровождается цитотомией, то образуется двуядерная полиплоидная клетка с оптимизированным в сравнении с одноядерной полиплоидной клеткой соотношением объема и площади поверхности ядер. Полиплоидные клетки - печеночные, нервные, кардиомио-циты - обнаружены и у человека. В овогенезе амфибий наблюдается амплификация или временное увеличение количества генов рРНК. В диплоидных клетках африканской шпорцевой лягушки число копий этих генов 900, тогда как в диплотене профазы первого мейотическо-го деления в образовании рибосомных РНК принимает участие более миллиона копий генов рРНК. Подсчитано, что без амплификации образование необходимого количества рибосомных РНК и, следовательно, числа рибосом заняло бы порядка 500 лет в сравнении с отпущенным природой периодом в 3-6 мес.
В дополнение к названным выше способам, увеличение количества ДНК может также происходить путем дупликации определенного фрагмента нуклеиновой кислоты. Последовательная неоднократная дупликация с дивергентным развитием копий ведет к образованию генных кластеров или мультигенных семейств, связанных с генетическим контролем в принципе одной функции, но в разных условиях. В качестве примера назовем кластер β-глобиновых генов гемоглобина человека (см. п. 2.4.3.4-д). В некоторых случаях механизм дупликации использовался в эволюции для увеличения в геноме количества практически идентичных копий нуклеотидной последовательности, кодирующей макромолекулы, необходимые для выполнения жизненно важных общеклеточных функций: рРНК (см. п. 2.4.3.3), тРНК, гистонов. Дополнительная новая ДНК приобретается также вследствие включения в геномы генов от других организмов путем горизонтального (латерального) их переноса, а также мобильных генетических элементов (МГЭ).
Белки хромосом выполняют функции: защитную, структурную, ре-гуляторную1, каталитическую, сервисную, опознавательно-сигнальную и ряд других.
1 Регуляторная роль компонентов хромосом заключается в «запрещении» или «разрешении» считывания информации (транскрипция) с ДНК, в изменении скорости транскрипции и репликации ДНК.
Особое место среди хромосомных белков принадлежит гистонам. Проявляя в химическом отношении основные свойства и характеризуясь в целом положительным зарядом (благодаря высокому содержанию аминокислот аргинина и лизина), они образуют ионные связи с отрицательно заряженными фосфатными группами внешней стороны двойной спирали ДНК. В составе нуклеогистонового комплекса ДНК менее доступна ферментам нуклеазам, вызывающим ее гидролиз (функция защиты). Гистоны выполняют структурную функцию, участвуя в процессе компактизации хроматина (см. п. 2.4.3.4-б, нуклеосомный уровень ком-пактизации). Нуклеогистоновый комплекс ограничивает доступ к ДНК с целью использовать заключенную в ней генетическую информацию. Формирование инициаторного (стартового) комплекса перед началом транскрипции включает ацетилирование гистонов в промоторной области транскриптона, что, предположительно, облегчает доступ соответствующих ферментов к ДНК (регуляторная функция). Гистоновые белки представлены пятью видами (фракциями): Н1, Н2А, Н2В, Н3 и Н4.
Число ядерных негистоновых белков превышает несколько сотен. Среди них ферменты транскрипции РНК, репликации, репарации и химической модификации ДНК (каталитическая функция). Структурно-регуляторную функцию приписывают негистоновым белкам хромосомного матрикса (скэффолд - см. п. 2.4.3.2). Фиксируя участки двойной спирали (англ. SAR - Scaffold Attachment Regions), такие белки удерживают «открытую» конфигурацию хроматина, «разрешающую» доступ к биоинформации ДНК, то есть ее транскрипцию.
Многие негистоновые белки обнаруживаются в составе хромосом лишь некоторое время в связи с той или иной функциональной задачей. Так, начало процесса репликации ДНК состоит в присоединении к хромосоме инициирующих или «узнающих» белков (см. п. 2.4.5.3), помечающих стартовую точку репликонов (опознавательно-сигнальная функция). Затем появляются расплетающие биспираль ферменты - х(г)еликаза и топоизомеразы, далее белки SSB (англ. Single Strand Binding Proteins), стабилизирующие одноцепочечные участки ДНК, белок-активатор праймазы - фермента, катализирующего образование РНК-затравки (РНК-праймера), - и, наконец, ДНК-полимераза. Сборка белковых комплексов - необходимое условие многих процессов с участием ДНК хромосом, включая репликацию и транскрипцию. Так, транскрипция фрагмента ДНК (структурный ген) у эукариот начинается с образования в области промотора гетеробелкового инициаторно-го комплекса, участниками которого являются так называемые общие
транскрипционные факторы. Без этого невозможны ни «посадка» РНК-полимеразы на ДНК в требуемом месте, ни определение стартовой точки транскрипции (см. п. 2.4.5.5) - сервисная функция.
К категории «временных» относятся цитозольные белки-рецепторы (функционально-транскрипционные факторы), захватывающие сигнальные молекулы, например, стероидные гормоны, в комплексе с которыми они проникают в ядро и которые их активируют (см. п. 2.4.3.1).
РНК хромосом представлена продуктами транскрипции, еще не покинувшими место синтеза, - непосредственный продукт транскрипции генов или пре-и(м)РНК, пре-рРНК, пре-тРНК транскрипты. 5S РНК, которые «метят» начало и конец фрагментов пре-и(м)РНК транскрипта, соответствующие интронам, чем обеспечивают точность их удаления (сервисная или «конценсусная» функция на уровне пре-и(м)РНК транскрипта). Некоторые виды РНК «временного внутриядерного пребывания» создают условия для основного процесса, выполняя сигнальную функцию. Так, репликация ДНК требует для своего начала образуемой «на месте» РНК-затравки (РНК-праймер), которая по завершении процесса разрушается здесь же в ядре.
2.4.3.4-6. Структурная организация эукариотической хромосомы
На протяжении клеточного цикла хромосома сохраняет структурную целостность. В разные фазы цикла наблюдаемые под микроскопом картины меняются. Изменения хромосом при переходах из одной формы структурной организации в другую в клеточном цикле связаны со сменой функциональных приоритетов (см. п. 2.4.3.4). В основе таких переходов лежит процесс компактизации-декомпактизации (конденсация-деконденсация) хромосомного материала - хроматина. Суммарная длина вытянутых в нити биспиралей ДНК 46 хромосом человека равна примерно 190 см, тогда как суммарная длина 46 метафазных хромосом, содержащих те же молекулы ДНК в состоянии максимальной компактизации, составляет порядка 180 мкм. Вследствие компактизации при переходе хромосом из интерфазной формы в ми-тотическую суммарный линейный показатель сокращается примерно в 7-10 тыс. раз. Тело человека состоит из 5х1013-1014 клеток и, следовательно, суммарная длина всех биспиралей ДНК в организме людей составляет 1011 км. Хотя это почти в 1000 раз больше расстояния от Земли до Солнца, в клетке на долю ДНК приходится менее 1% массы.
Выделяют следующие уровни компактизации хроматина (табл. 2.1 и рис. 2.13).
Таблица 2.1. Последовательные уровни компактизации хроматина
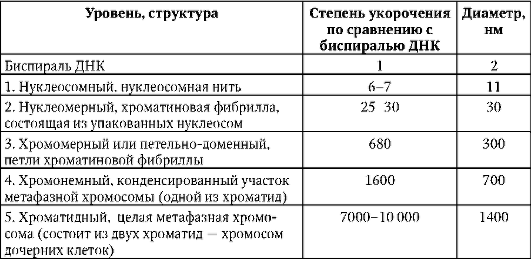
В образовании нуклеосомной нити диаметром 11 нм (первый уровень компактизации) ведущая роль принадлежит гистонам Н2А, Н2В, Н3 и Н4. Они образуют белковые тела или коры, состоящие из восьми молекул (по две молекулы каждого вида). Молекула ДНК комплексуется с белковыми корами, спирально накручиваясь на них. В контакте с ко-ром оказывается фрагмент биспирали в 146 п.н. Свободную от контакта с корами ДНК (протяженность от 15 до 100 п.н. в клетках разных типов) называют линкерной (связующая). Отрезок ДНК порядка 200 п.н. вместе с белковым кором образует нуклеосому (рис. 2.14, а). Благодаря описанной организации в основе структуры хроматина находится фибрилла, напоминающая нитку бус и представляющая собой цепочку повторяющихся единиц - нуклеосом (рис. 2.14, б). ДНК генома человека, насчитывающая суммарно 3,2х109 п.н., упаковывается максимально в 1,5х107 нуклеосом. В нуклеогистоновом комплексе имеются области без нуклеосом. Они располагаются с интервалами в несколько тысяч пар нуклеотидов. Им принадлежит важная роль в дальнейшей упаковке хроматина, поскольку они содержат нуклеотидные последовательности, специфически узнаваемые негистоновыми белками. Нуклеосомы важны для осуществления ДНК биоинформационно-генетической функции. Благодаря нуклеосомам в промоторных участках ДНК заблокированы области инициации (начала) транскрипции. Для того чтобы инициатор-ный комплекс возник, нуклеосомы должны быть «вытеснены» из соответствующих фрагментов ДНК.
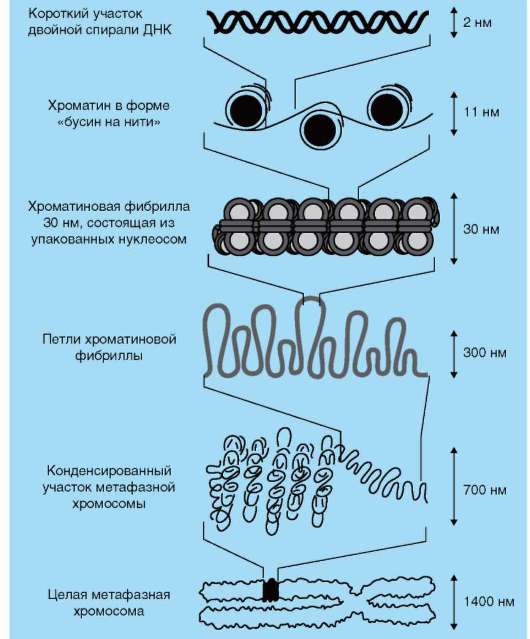
Рис. 2.13. Уровни компактизации хроматина. Старт - биспираль ДНК
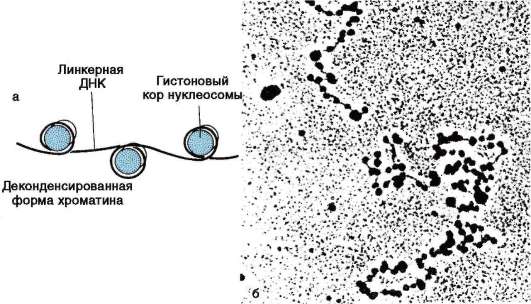
Рис. 2.14. Нуклеосомная организация хроматина: а - молекула ДНК накручена на белковые коры; б - электронная микрофотография эукариотического хроматина: видны нуклеосомы и участки линкерной ДНК
Образование хроматиновой фибриллы диаметром 30 нм (второй уровень компактизации) происходит с участием гистона Н1, который, связываясь с линкерной ДНК, скручивает нуклеосомную нить в спираль по типу соленоида с шагом в 6-8 нуклеосом (рис. 2.15).
Если главная роль в обеспечении компактизации на первых двух уровнях отводится спирализации, то на следующем петельно-доменном уровне, дающем фибриллы диаметром 300 нм, главное событие заключается в укладке фибриллы диаметром 30 нм в петли (рис. 2.16). В этом процессе активная роль отводится негистоновым белкам. Основания петель «заякорены» в ядерном матриксе. Петля содержит от одного до нескольких генов (петельный домен). Длина участка ДНК, равного петле, от 20 тыс. п.н. до 80 тыс. п.н. Инактивация генов сопровождается компактизацией петельного домена в суперсоленоид, а активация - декомпактизацией или «выпетливанием». Хроматиновые фибриллы диаметром 300 нм являются, по-видимому, наиболее типичными структурами интерфазного хроматина.
На следующем уровне компактизации фибриллы диаметром 300 нм, складываясь по длине, превращаются в метафазные хроматиды (хромосомы будущих дочерних клеток) диаметром 700 нм. Эти изменения происходят с хромосомным материалом клеток, вступающих в митоз.
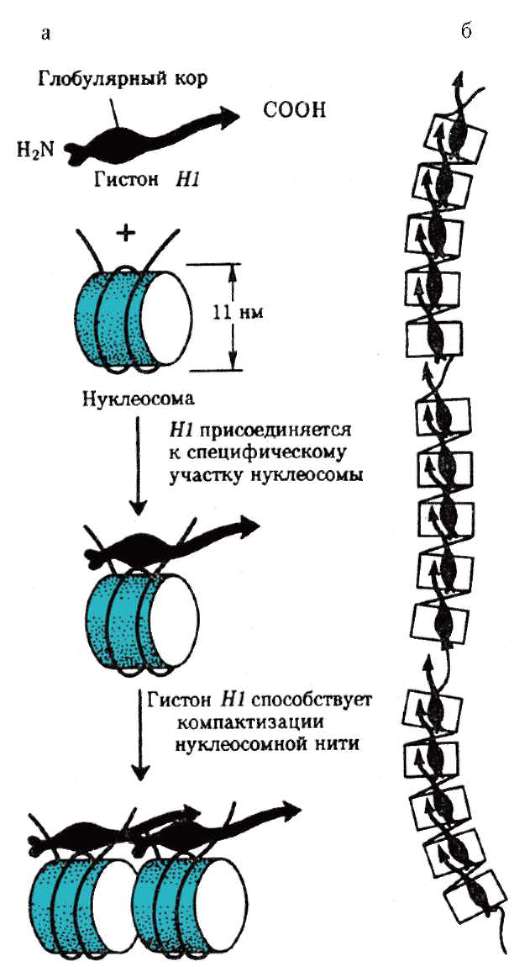
Рис. 2.15. Хроматиновая фибрилла диаметром 30 нм: а - соединение нуклеосом с помощью гистона Н1; б - упаковка ДНК в хроматиновой фибрилле в виде соленоида
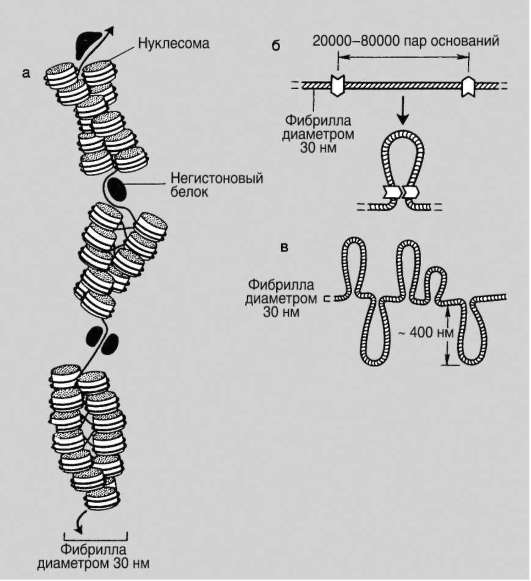
Рис. 2.16. Петельно-доменная структура хроматина: а - хроматиновая фибрилла с присоединенными негистоновыми белками; б - образование петли на участке хроматиновой фибриллы; в - участок метафазной хромосомы
Максимальная степень компактизации достигается на пятом уровне в структурах, известных как метафазные хромосомы с диаметром 1400 нм. В этом состоянии ДНК выключена из биоинформационно-генетических процессов (транскрипция, репликация). Такая структура обеспечивает оптимальное решение задачи транспортировки генетического материала в дочерние клетки в анафазе митоза.
2.4.3.4-в. Гетерохроматин и эухроматин интерфазных хромосом
В зависимости от степени компактизации материал интерфазных хромосом представлен эухроматином и гетерохроматином . Эухроматин отличается низкой степенью компактизации и, следовательно, неплотной «упаковкой» хромосомного материала. В геноме человека на его долю приходится 2,9 млрд п.н. из 3,2 млрд п.н. Эухроматин представлен, в основном, ДНК с уникальными последовательностями нукле-отидов. Хотя существует ряд механизмов регуляции генной активности с различными точками приложения в биспирали ДНК и хромосоме, общей предпосылкой возможности транскрипции сайтов ДНК считают их расположение в эухроматиновой зоне. Гены из эухроматизированного участка хромосомы, оказавшись в гетерохроматизированном участке или рядом с ним, обычно инактивируются.
Гетерохроматин отличается высокой степенью компактизации, то есть плотной «упаковкой» материала хромосомы. Большая его часть представлена умеренно или многократно повторяющимися нуклеотид-ными последовательностями ДНК. К первым относятся мультикопий-ные гены гистонов, рибосомных и транспортных РНК.
Выделяют факультативный и конститутивный (структурный) гетерохроматин. Факультативная гетерохроматизация - инструмент выключения из функционирования групп сцепления (хромосом), геномов или генов на известных стадиях онтогенеза или в соответствующих физиологических условиях. Примером факультативного гетерохро-матина на хромосомном уровне служит тельце полового хроматина (тельце Барра), образуемое в клетках организмов гомогаметного пола (у людей - женский) вследствие инактивации одной из двух однотипных половых хромосом (у человека - Х). Гены гетерохроматизи-рованной хромосомы Х клеток женского организма, кроме восьми, не транскрибируются (феномен дозовой компенсации в сравнении с особями гетерогаметного пола: у человека - мужчины, имеющие в клетках при паре половых хромосом XY единичную хромосому Х). Один из названных восьми генов активен только на гетерохроматизированной хромосоме Х, семь других - на обеих. Некоторые из этих генов участвуют в контроле развития половых желез и фертильности (способность к репродукции) организма женщины. Гетерохроматизация хромосомы Х происходит на 16-е сутки эмбрионального периода развития человека. Центр гетерохроматизации и, таким образом, генетической инактивации находится непосредственно в хромосоме Х.
Примером факультативной гетерохроматизации на геномном уровне служит хроматин ядер зрелых эритроцитов птиц. Полная гете-рохроматизация хроматина в данном случае совпадает с прекращением транскрипции всех генов, включая глобиновые. В зрелых эритроцитах птиц гетерохроматизированы оба генома - материнский и отцовский. У диплоидных самцов мучнистого червеца Planococcus cirti гетерохро-матизируются хромосомы отцовского генома, что превращает их в гаплоидных особей. У самок животных этого вида на протяжении жизни активны геномы и матери, и отца.
Факультативная гетерохроматизация затрагивает участки хромосом (блоки генов или отдельные гены). Выбор таких участков может быть связан с направлением клеточной дифференцировки: рисунок хроматина интерфазных ядер клеток разных тканей и органов на гистологических препаратах различается.
Конститутивная гетерохроматизация отличается постоянством локализации гетерохроматизированных участков по длине хромосом и сохранением названного состояния хроматина во времени, например в ряду клеточных поколений. В качестве примера назовем около(при) центромерные участки хромосом, в которых располагаются ядрышковые организаторы (см. п. 2.4.3.3), содержащие копии генов рРНК (рДНК). У человека известны четыре вида сайтов рДНК: активно транскрибируемые, потенциально активные (не транскрибируются в клетках определенной специализации), неактивные и «молчащие». Неактивные сайты располагаются в центральной области фибриллярных зон (фибриллярные центры) ядрышка в участках плотной «упаковки» (гете-рохроматин) петель хроматина. Генетически активные сайты рДНК занимают периферию фибриллярных зон. «Молчащие» сайты располагаются вне ядрышек. Предположительно, конститутивная гетерохро-матизация около(при)центромерных участков является инструментом количественной регуляции генетической активности в мультикопийном семействе генов рРНК.
В составе около(при)центромерного гетерохроматина с постоянством обнаруживается сателлитная ДНК (см. п. 2.4.3.4-д). Это короткие тан-демно (друг за другом) расположенные нуклеотидные последовательности, не выполняющие кодирующей функции и повторенные от десятков тысяч до миллионов раз. Генетические функции сателлитной ДНК, видимо, разнообразны, и выясняются.
Роль конститутивной гетерохроматизации в функционировании генома определяется в большей мере не состоянием ДНК, а белками. Об
этом говорят мутации, ослабляющие или, наоборот, усиливающие степень инактивации генов эухроматиновых участков при попадании их в зону конститутивного гетерохроматина (см. эффект положения).
2.4.3.4-г. Теломерные участки молекул ДНК: организация и репликация. Функциональный аспект
Конститутивная гетерохроматизация характеризует теломерные (концевые) участки хромосом. Длина этих участков различается у разных видов животных: 10-15 тыс. п.н. в клетках эмбрионов человека и порядка 100 тыс. п.н. - в клетках мыши. Теломерные участки ДНК человека от З'-конца образованы короткими тандемными повторами ТТАГГГ. За ними следуют более протяженные повторяющиеся последовательности и далее идет участок также повторяющихся последовательностей, уникальных для каждой хромосомы. Комплекс ДНК со специфическими белками на концах хромосом называется «теломера» .
Теломеры участвуют в прикреплении хромосом к структурам ядерного матрикса и, возможно, к ядерной ламине (плотной пластинке), чем обеспечивается пространственная ориентация хромосом в объеме ядра. В зи-готене профазы первого деления мейоза направленное перемещение по внутренней поверхности ядерной оболочки концов гомологичных хромосом способствует их конъюгации и далее (пахитена профазы первого деления мейоза) кроссинговеру. В метафазе митоза сестринские хрома-тиды удерживаются в парах, в том числе, благодаря взаимодействию их теломер. В анафазе митоза это взаимодействие ослабевает и хроматиды, теперь уже как самостоятельные хромосомы, расходятся в дочерние клетки. Известна мутация в области теломерной ДНК, проявляющаяся фено-типически в нерасхождении хромосом в анафазе. Теломеры «защищают» молекулы ДНК от разрушающего действия ферментов.
Специфическая черта теломер, отражающая «технические» особенности репликации ДНК (необходимость для начала процесса РНК-затравки), состоит в том, что в каждом репликационном цикле (период S интерфазы) концы и материнской, и дочерней молекул ДНК укорачиваются, в среднем, на 50 нуклеотидов. Недорепликация ДНК на концах хромосом не является фатальной благодаря наличию в клетках макро-молекулярного комплекса с ферментативной активностью - теломера-зы. Последняя функционирует как обратная транскриптаза, достраивая недореплицируемые участки ДНК.
Концевая недорепликация ДНК как неизбежное («техническое») событие благодаря тому, что теломеры лишены структурных (смысло-
вых, кодирующих) генов, не наносит вреда в виде биоинформационных потерь (функция буфера). Известны примеры, когда при участии теломеразы путем образования теломерной ДНК «закрываются» концы на месте случайных разрывов хромосом. Это сохраняет оторвавшиеся участки хромосом функционирующими, хотя бы частично. Такое наблюдается у больных α-талассемией - наследственным заболеванием, связанным с мутацией в кластере α-глобиновых генов в виде разрыва в длинном плече хромосомы 16. Транскрипционная активность генов вблизи теломер снижена (см. эффект положения). При укорочении те-ломер из-за недорепликации ДНК названный эффект снимается и гены активируются.
Теломеразный механизм, активный в клетках эмбриона, не функционирует во многих типах клеток взрослого организма, и потери концевой ДНК в репликационных циклах не восполняются. Укорочение хромосом до известного предела приводит к выходу клетки из пролиферативного цикла с единственной перспективой погибнуть (терминальная диффе-ренцировка). Исключение составляют клетки зародышевого пути - половые клетки.
В концевой недорепликации ДНК (маргинотомия) видят причину лимита Л. Хейфлика . высказавшего на основании результатов исследований динамики клеток в культуре (вне организма, in vitro) мысль о конечности числа делений клеток многоклеточного организма, с чем фундаментальная геронтология пыталась связать закономерные возрастные изменения - теломерная теория старения. Современные исследования внесли свои уточнения. Теломеразная активность сохраняется или восстанавливается у взрослых особей в интенсивно делящихся клеточных популяциях, а также в стволовых клетках. Кроме того, активная теломераза - отличительная черта клеток большинства злокачественных новообразований.
2.4.3.4-д. Функционально-генетическая организация ДНК. Проект «Геном человека». От структурной геномики к геномике функциональной и сравнительно-эволюционной
ДНК генома человека насчитывает 3,2х109 п.н. (по другим данным, 3,165х109 п.н. или 3х109 п.н.). На долю смысловых (кодирующих, структурных) нуклеотидных последовательностей для полипептидов в нем приходится 1,2% ДНК. Если присовокупить смысловые последовательности для нетранслируемых в полипептиды РНК - рибосом-ных, транспортных и др., то суммарное количество ДНК, выполняющее
биоинформационно-генетическую функцию непосредственно, в геноме человека составляет порядка 3%.
Впервые в конце 70-х гг. ХХ в. была полностью определена последовательность нуклеотидов ДНК генома фага φ (греч. фи - phi) Х174 - 5375 п.н., 9 генов. Рубеж ХХ-ХХI вв. ознаменован реализацией проекта «Геном человека», состоящего в определении последовательности нукле-отидов (секвенирование) в молекулах ДНК всех хромосом человека.
На начало 2001 г. информации оказалось достаточно, чтобы представить организацию человеческого генома в целом (область интереса структурной геномики). Транскрибируемая часть составляет 28-30% генома, но транслируется до белков не более 5% (экзон-ная порция). 45-50% ДНК генома представлено повторяющимися последовательностями. Из них 45% приходится на «избыточную» (она же «паразитическая», «эгоистическая») ДНК. Приведенные эпитеты возникли потому, что соответствующие участки нуклеиновой кислоты, не выполняя видимой генетической функции, реплицируясь в обязательном порядке, сохраняются в клеточных геномах в ряду поколений. Науке еще предстоит раскрыть функции многих участков генома (область интереса функциональной геномики).
В области структурной геномики не все доведено до необходимого уровня ясности: доля ДНК, участвующей в синтезе белков непосредственно, оценивается разными исследователями и в 1,2%, и в 3%, и в 5%.
В геноме человека структурные (смысловые, кодирующие) гены расположены по длине хромосом блоками, между которыми находятся протяженные участки некодирующей межгенной ДНК. От участков «избыточной» ДНК гены отделены « монотонными» последовательностями из Г-Ц пар до 30 тыс. п.н. длиной. Допускается, но не доказано бесспорно, что такие участки имеют отношение к регуляции активности смысловых генов.
В ДНК обнаруживаются уникальные нуклеотидные последовательности, представленные в геноме в единственном экземпляре, а также повторяющиеся последовательности: 3% ДНК - это короткие повторы, 5% - длинные. Среди повторяющихся нуклеотидных последовательностей есть, во-первых, тандемные повторы, когда соответствующие участки ДНК следуют друг за другом по типу «голова-хвост», и диспергированные повторы, когда участки-повторы разбросаны по геному. Во-вторых, в зависимости от числа копий имеются высоко-повторяющиеся (от десятков или сотен тысяч до миллионов копий), среднеповторяющиеся (тысячи и десятки тысяч копий) и слабопов-
торяющиеся (единицы, десятки или сотни копий) последовательности. В-третьих, длина повторяющихся последовательностей варьирует от сотен и реже тысяч до 2-10 нуклеотидов. В-четвертых, относительно небольшая доля повторов представлена идентичными последовательностями, тогда как большая их часть характеризуется наличием в копиях повторяющейся последовательности нуклеотидных замен, выпадений (делеций) и вставок (инсерций).
В современном генетическом словаре есть термин сателлитная ДНК. Она представлена большим числом копий коротких нуклео-тидных фрагментов. Выделяют микросателлитные (длина повторяющегося фрагмента 1-4 п.н.) и минисателлитные (длина 4-6 п.н.) повторы. К последним относятся теломерные повторы (см. п. 2.4.3.4-г). У представителей ряда видов повторяющиеся единицы теломерной ДНК имеют идентичный нуклеотидный состав (у человека - ТТАГГГ), у других нуклеотидный состав различается. Теломерные повторы относятся к категории тандемных.
В геноме животных и человека имеются кластеры генов, возникновение которых в эволюции связывают с неоднократной дупликацией предковой нуклеотидной последовательности. Молекулярная дивергенция членов такого кластера, например, вследствие нуклеотидных замен, с последующим отбором вела к возникновению совокупностей структурных (смысловых) генов со «скромными» различиями по нуклеотид-ному составу, кодирующих в принципе один и тот же полипептид, но с определенными функциональными особенностями. В качестве примера приведем β-глобиновый кластер, расположенный у человека на коротком плече хромосомы 11, члены которого обусловливают экспрессию β-полипептида гемоглобина: эмбриона - ген ε, плода - гены Ay и Gy, взрослого - гены δ и β. Кластерная организация характеризует гены, контролирующие синтез рибосомных и транспортных РНК, гистоновых белков. Здесь, однако, имеет место многократный повтор стереотипной нуклеотидной последовательности. Кластеры смысловых (кодирующих, структурных) генов обозначают как мультигенные семейства.
Диспергированные повторы образуют несколько семейств. Это короткие или SINE (англ. Short Interspersed Nucleotide Elements) повторы. Представителем этого семейства является Alu-повтор (300 п.н., высоко-повторяющаяся последовательность с числом копий у человека 105-106 на геном. Alu-повтор встречается в интронах, межгенной и сателлитной ДНК). У млекопитающих есть семейство длинных или LINE (англ. Long Interspersed Nucleotide Elements) повторов (не более 6-7 тыс. п.н.). От-
дельные члены семейства различаются последовательностью нуклеоти-дов. Это среднеповторяющиеся последовательности с числом копий у человека 103-105 на геном. К LINE-повторам относятся ретротранспо-зоны (МГЭ, или «прыгающие» генетические элементы), в структуре которых имеется ген обратной транскриптазы (см. теломеразный ферментный комплекс, п. 2.4.3.4-г).
Нуклеотидные повторы обнаруживаются в кодирующей ДНК. Так, особенность а2-пептида коллагена I типа (кожа, сухожилия, кости, строма внутренних органов) - это повтор из аминокислот пролина, ок-сипролина и глицина, которым соответствуют повторы соответствующих кодонов в экзонах коллагенового гена Colla I. Благодаря названным аминокислотным повторам достигается плотная «упаковка» пептидов в коллагеновых волокнах.
Повторы не типичны для ДНК прокариот, которая представлена почти исключительно уникальными последовательностями.
Сведения о различных категориях нуклеотидных последовательностей эукариотического генома, которыми располагает современная наука, фрагментарны, нередко противоречивы и недостаточны для того, чтобы однозначно оценить их участие в процессах жизнедеятельности клеток, индивидуальном и историческом развитии живых форм.
Наряду со структурной и функциональной геномикой, интенсивно развивается сравнительная геномика, имеющая целью, если говорить о человечестве, конкретизировать генетический полиморфизм и особенности гено(аллело)фондов различных популяций, народностей, расовых и этнических групп, а также сопоставить геномы представителей различных таксонов живых существ (включая инфекционные и паразитарные агенты).
Внимания заслуживают однонуклеотидные замены, с которыми связывают особую разновидность генетического полиморфизма (многообразия) - однонуклеотидный генетический полиморфизм (ОНП, англ. SNP - Single Nucleotide Polymorphism). Будучи распространенными (встречаются через каждые 1-2 тыс. п.н., в геноме человека их 3,2х106), они играют важную роль в наследственном полиморфизме людей. Так как примерно половина (1,5х106) однонуклеотидных замен в геноме человека приходится на экспрессируемую (смысловая, кодирующая, транслируемая) часть генома, их идентификация используется в целях картирования генов на хромосомах, молекулярной диагностики наследственных болезней, изучения генетической предрасположенности к мультифакториальным болезням.
2.4.3.4-е. Эволюция генома
Как у прокариот, так и у эукариот носителями генетической информации являются нуклеиновые кислоты и белки, а способы ее кодирования в биоинформационных макромолекулах совпадают. В связи с этим предполагают, что геномы этих типов организмов являются результатом дивергентной эволюции от общего предка. На уровне предково-го генома уже, видимо, были решены задачи самовоспроизведения на основе репликации ДНК, записи информации в виде последовательности триплетов нуклеотидов (нуклеиновые кислоты) и аминокислот (белки), а также универсальности генетического кода. Способность к репликации (самосохранение через самовоспроизведение) оформилась в эволюции раньше, чем функция кодирования. С появлением функции кодирования стало возможным на биоинформационной основе генотипов создание фенотипов. Фенотипы становятся объектом действия естественного отбора, и процесс исторического развития (эволюция) приобретает приспособительную и прогрессивную направленность. Появляются предпосылки для коэволюции.
Еще одна предполагаемая характеристика предкового генома - наличие избыточной ДНК. На заре эволюции живых форм в условиях, когда главные составляющие потока биоинформации (механизмы репликации, транскрипции, трансляции) были несовершенны, присутствие избыточной ДНК создавало возможность «эволюционного маневра» в виде наращивания доли кодирующих (смысловых, структурных) нуклеотидных последовательностей и, таким образом, увеличения разнообразия фенотипов, тестируемых отбором на выживаемость.
Предположительно, расхождение про- и эукариотического геномов от общего предка началось с момента, когда в связи с возросшей надежностью потока биоинформации дальнейшее приращение объема смысловых (кодирующих, структурных) последовательностей перестало быть критическим для обеспечения выживаемости в разнообразных средах.
Эволюционный путь к геному современных прокариот состоял, видимо, в уменьшении размеров и «упрощении» за счет освобождения от избыточной ДНК. Этот путь в сочетании с коротким временем генерации прокариотических организмов (десятки минут) и их гаплоидностью обеспечивает выживание за счет появления в популяциях «перспективных» мутантов, среди которых есть отвечающие новым требованиям среды обитания, и быстрой смены поколений.
Для прокариотических геномов характерен полицистронный формат организации единиц транскрипции, представленных оперонами.
При этом цистроны (по существу, гены), собранные в одном опероне, например, лактозном, контролируют экспрессию белков, необходимых для обеспечения отдельных этапов конкретного биохимического пути
(см. п. 2.4.5.6).
Эволюционный путь к геному современных эукариот состоял в увеличении размеров (количества ДНК), в т.ч. за счет «мобилизации» уже имевшихся некодирующих нуклеотидных последовательностей. Ставка была сделана на усложнение структуры генетического аппарата клеток на надмолекулярном уровне. Все это служило оптимизации и расширению способов использования генетической информации, повышению надежности биоинформационных процессов, совершенствованию механизмов их регуляции. Вспомним характерные черты эукариотиче-ского генома - линейная форма молекул ДНК, существование ДНК в виде нуклеогистонового комплекса, две структурные формы хромосом (митотическая и интерфазная), наличие эу- и гетерохроматина, распределение ДНК по хромосомам - структурам, открывшим возможности тонкой регуляции генетических функций и использования биоинформации частями, а также точное качественное и количественное воспроизведение ДНК в дочерних клетках при клеточном делении (митоз) в условиях увеличенного количества наследственного материала. Дипло-идность эукариотических клеток послужила предпосылкой образования резерва наследственной изменчивости. Эукариотические клетки с их сложной организацией приобрели способность к формированию многоклеточных живых конструкций.
Учитывая гипотезу о происхождении эукариот от прокариот, интересны материалы сравнительно-эволюционной геномики и протеомики. Оказалось, что структурные (смысловые, кодирующие, транслируемые) гены белков транскрипции и трансляции эукариот гомологичны генам наиболее древних микроорганизмов из группы Archaea, а гены метаболических белков - генам микроорганизмов из группы Bacteria, что рассматривается как аргумент в пользу симбиотической гипотезы происхождения эукариотической клетки, а также предположения о горизонтальном переносе генов из органелл в ядро.
Сравнение секвенированных геномов одноклеточного эукариота Sacchoromyces cerevisiae (дрожжи) и многоклеточного эукариота Caeno-rhabditis elegans (круглый червь) указывает на наличие как общих генов, характеризующих эукариотность обоих организмов, так и генов, связанных с многоклеточностью, присутствующих только у червя. Это, в частности, гены, кодирующие белки межклеточного общения и клеточ-
ной адгезии, а также контролирующие программированную клеточную гибель - апоптоз. В геноме червя порядка 15% генов собраны в оперо-ны. Транскрипция всех генов оперона «запускается» с одного промотора, образуется общий пре-РНК транскрипт. Вместе с тем, в отличие от прокариот, для которых оперонная организация генома есть правило, у C. elegans гены одного оперона не обязательно связаны функционально и могут транслироваться независимо друг от друга.
Согласно морфофизиологической теории эволюции и теории фил-эмбриогенезов А.Н. Северцова, эволюционно значимые изменения затрагивают эмбриогенез и происходят в форме ароморфозов (начальные фазы процесса индивидуального развития), если речь идет о появлении на арене жизни принципиально нового типа структурно-функциональной организации. Известно беспозвоночное низшее хордовое Ciona intestinalis (подтип Личиночно-хордовые, или Urochordata) с полностью секвенированным геномом. Сравнительная геномика говорит о том, что в геномах высших хордовых (подтип Позвоночные, или Vertebrata) изменения касаются гомеозисных генов Hox, определяющих эмбриогенез. Если у С. intestinalis имеется один кластер из 9 генов Hox, то у позвоночных животных таких кластеров несколько, причем в каждом по 13 генов.
2.4.4. ЦИТОПЛАЗМА КЛЕТКИ
В цитоплазме размещены рабочие механизмы клетки. Рабочими эти механизмы могут быть названы потому, что они обеспечивают превращение «потенциальной» биологической информации нуклеиновых кислот (ДНК, и(м)РНК) в действующую (актуализированную) - белков - в процессе их синтеза, извлечение из веществ, поступающих в клетку, энергии и фиксацию ее в молекулах АТФ, образование пула («запаса») низкомолекулярных предшественников, необходимых для внутриклеточных синтезов, пространственно-временную организацию биохимических реакций синтеза (анаболизм) и распада (катаболизм) веществ в клетке.
В цитоплазме выделяют основное вещество, цитоскелет, включения и органеллы.
2.4.4.1. Основное вещество
Основное вещество цитоплазмы (матрикс, гиалоплазма), заполняя пространство между плазмалеммой, ядром и другими внутрикле-
точными структурами, представляет собой внутреннюю среду клетки. Белковый состав основного вещества разнообразен: ферменты гликолиза, обмена сахаров, липидов, азотистых оснований, аминокислот. В гиало-плазме находятся белки-субъединицы, из которых путем полимеризации собирается ряд цитоплазматических структур, например, тубулины, из которых строятся микротрубочки. На долю белков основного вещества приходится 20-25% от общего количества белка эукариотической клетки. В прокариотических клетках, в основном, лишенных мембран, эта цифра приближается к 50%. В гиалоплазме откладываются запасные питательные вещества - полисахариды (например, гликоген), жировые капли. Химическим составом и организацией гиалоплазмы определяются осмотические и буферные свойства клетки. По физико-химическим свойствам основное вещество цитоплазмы является сложной коллоидной системой, способной к обратимым гель-золь переходам, функциональное значение которых освещено ниже (см. п. 2.4.10).
2.4.4.2. Цитоскелет
Цитоскелет (внутриклеточный скэффолд) образован сетью из микротрубочек (25 нм), актиновых (6 нм) и промежуточных (10 нм) микрофибрилл (рис. 2.17). Он выполняет каркасную (опорную) функцию, участвует во внутриклеточных транспортах и связан с некоторыми видами двигательной активности клеток (амебоидное движение). От состояния цитоскелета зависит прикрепление клеток к внеклеточным
Рис. 2.17. Цитоскелет эукариотической клетки: 1 - микрофиламенты; 2 - микротрубочки; 3 - промежуточные филаменты; 4 - плазматическая мембрана; 5 - ядро; 6 - митохондрии; 7 - рибосомы
структурам. Ослабление контакта с такими структурами - одно из условий подвижности и метастази-рования некоторых видов опухолевых клеток.
2.4.4.3. Цитоплазматические включения
Включения (рис. 2.18) - относительно непостоянные компоненты цитоплазмы, которые являются либо запасными питательными веществами (жир, гликоген, желток яйцеклетки), либо продуктами для нужд организма, приготовляемыми клеткой и подлежащими выводу из нее (секреты желез), либо балластными веществами (пигмент изнашивания или липофусцин).
2.4.4.4. Органеллы эукариотической клетки
Органеллы (органоиды в
терминологии классической цитологии) - постоянные структуры цитоплазмы, выполняющие в клетках жизненно важные функции. Они имеют мембранное или безмембранное строение. К ор-ганеллам безмембранного типа относятся микротрубочки и структуры, основу которых они составляют (базальные тельца ресничек и жгутиков, центриоли), микро-филаменты и микрофибриллы, рибосомы. Мембранные органеллы представляют собой «ячейки» или компартменты, отличающиеся по химическому составу, биохимическим процессам и, следовательно, функциям. Для некоторых из мембранных
Рис. 2.18. Цитоплазматические включения эукариотической клетки: а - липофусцин; б - липидная капля; в - гранулы секрета
цитоплазматических структур характерно наличие двух отграничивающих мембран (митохондрии, хлоропласты растительных клеток), тогда как для других - одной (лизосомы, пероксисомы). Предположительно, двумембранные органеллы имеют симбиотическое происхождение (см. п. 1.10), тогда как одномембранные возникали путем отделения («от-шнуровки») от плазмалеммы или эндоплазматической сети в виде вакуолей.
Наряду с органеллами общего значения, которые присутствуют в клетках всех типов, выделяют специальные органеллы. Последние в значительном количестве встречаются в клетках, специализированных к выполнению конкретной функции, тогда как в других типах клеток их количество невелико или они отсутствуют вовсе. К специальным орга-неллам относят микроворсинки всасывающей поверхности эпителиальных клеток кишечника, реснички мерцательного эпителия трахеи и бронхов, миофибриллы скелетной или сердечной мышц, синапти-ческие пузырьки, транспортирующие вещества-переносчики (медиаторы) нервного возбуждения с одной нервной клетки на другую или на исполнительную клетку рабочего органа.
К органеллам общего значения относят вакуолярно-канальцевую систему цитоплазмы, включающую шероховатую и гладкую цито(эндо) плазматическую сеть (ретикулум) и связанные с ней происхождением и функционально везикулы (относительно мелкие пузырьки), вакуоли (относительно крупные пузырьки) и цистерны (уплощенные вну-трицитоплазматические полости), пластинчатый комплекс Гольджи, лизосомы, пероксисомы, микротельца. В эту же группу включают рибосомы и полисомы, митохондрии, микротрубочки и микрофиламенты, центриоли клеточного центра (для животных клеток). В растительных клетках выделяют хлоропласты (содержат пигмент фотосинтеза хлорофилл). В клетках растений обнаруживаются структуры с общим названием пластиды. Среди них выделяют лейкопласты (лишены пигмента), хромопласты (содержат красящие пигменты), амилопласты (содержат крахмал). Между различными формами пластид возможны переходы.
Новейшая клеточная биология вносит свой вклад в расширение ассортимента общеклеточных органелл. О протеасомах, в которых разрушаются «дефектные» полипептиды, сказано выше (см. п. 2.4.1), в процессинге пре-и(м)РНК транскрипта принимает участие мультигете-робелковый комплекс - сплайсосома (см. п. 2.4.5.5).
2.4.4.4-а. Вакуолярно-канальцевая система цитоплазмы
Вакуолярно-канальцевая система образована сообщающимися или располагающимися по отдельности трубчатыми (канальцы, ту-булы), а также уплощенными (цистерны) полостями, ограниченными мембранами. Нередко цистерны имеют пузыревидные расширения. В системе выделяют шероховатую и гладкую цито(эндо)плазматиче-скую сети.
Особенность шероховатой (гранулярной) сети состоит в прикреплении к ее мембранам рибосом (полисом). В качестве главной она выполняет функцию образования белков, преимущественно функционирующих вне клетки, например секретируемых клетками экзокринных желез. В области шероховатой сети происходит синтез и сборка белков и липидов клеточных мембран. Плотно упакованные в слоистую структуру цистерны гранулярной сети являются участками наиболее активного белкового синтеза - эргастоплазма.
Мембраны гладкой эндоплазматической сети лишены рибосом (полисом). Функционально эта сеть связана с обменом углеводов, жиров и других веществ небелковой природы, например, стероидных гормонов в клетках половых желез и коркового вещества надпочечников. В участках цитоплазмы печеночных клеток, богатых структурами гладкой сети, разрушаясь, обезвреживаются токсические вещества и ряд лекарств (снотворные из группы барбитуратов). В канальцах и пузырьках гладкой цитоплазматической сети поперечно-полосатой мускулатуры сохраняются (депонируются) ионы кальция, играющие важную роль в процессе мышечного сокращения.
Вакуолярно-канальцевая система выполняет транспортную функцию, в частности, в отношении белков лизосом, пероксисом, мембран и тех, которые предназначены для вывода из клетки. Все белки вне зависимости от места их конечной локализации в клетке образуются на рибосомах (полисомах). Белки, которые подлежат транспорту с участием эндоплазматической сети, имеют лидерную последовательность длиной 25±11 аминокислот, распознаваемую «узнающими сигнал» частицами цитоплазмы. Соединение двух названных элементов означает прекращение наращивания на рибосоме полипептида и прикрепление комплекса к соответствующему рецептору мембраны эндо-плазматической сети. В зоне прикрепления формируется полипептид транслоцирующая пора (транслокон), через которую пептид проникает в просвет канальца. Здесь полипептид гликозилируется путем присоединения олигосахаридов и далее поступает в транспортные
пузырьки, отшнуровывающиеся от безрибосомных участков эндо-плазматической сети. Пузырьки переносят полипептиды в пластинчатый комплекс Гольджи.
2.4.4.4-6. Пластинчатый комплекс Гольджи
Пластинчатый комплекс Гольджи (аппарат Гольджи в терминологии классической цитологии) образован совокупностью разбросанных по цитоплазме или локализующихся в приядерной зоне диктиосом числом от нескольких десятков до нескольких сотен или тысяч на клетку. Диктиосома (рис. 2.19, а) представлена «стопкой» из 3-12 уплощенных дискообразных цистерн, от краев которых отшнуровываются мелкие пузырьки (везикулы). Локальные расширения цистерн дают более крупные пузырьки (вакуоли). Функция пластинчатого комплекса состоит в «сортировке» белков, поступающих из эндоплазматическо-го ретикулума (см. п. 2.4.4.4-а), в зависимости от их дальнейшего места назначения. Здесь же происходит химическая модификация белков. Секретируемые белки разделяются (сегрегируются) на «порции» c их «упаковкой» в мембранную оболочку. Такие белковые «кванты» адресно направляются к плазмалемме с целью их выведения из клетки или же в лизосомы, пероксисомы и другие внутриклеточные структуры.
Для адресной доставки разные категории белков должны быть помечены. Это происходит тоже в пластинчатом комплексе Гольджи. Ли-зосомальные белки, например, узнаются ферментами этого комплекса, фосфорилирующими маннозу с образованием маннозофосфата в олиго-сахаридной части названных белков. Помеченные таким образом молекулы при помощи специальных рецепторов фиксируются на мембране комплекса Гольджи с последующим формированием пузырьков, содержащих исключительно ферменты лизосом. Далее эти пузырьки сливаются с другими, специфически характеризующимися низкими значениями pH. Следующий этап состоит в диссоциации рецепторов маннозофосфа-та, возвращающихся в комплекс Гольджи, от гликопротеиновой части лизосомных ферментов, которые оказываются в лизосоме.
Внутрицитоплазматический транспорт с участием эндоплазмати-ческого ретикулума распространяется на полипептиды, образуемые на полисомах гранулярной сети. Его называют котрансляционным, поскольку он начинается при продолжающемся синтезе полипептида на рибосоме. В перемещении от места образования к месту назначения белков митохондрий, синтезируемых на свободных (не связанных с мембранами эндоплазматической сети) полисомах, задействован другой механизм (см. п. 2.4.4.4-д).
Рис. 2.19. Общеклеточные органеллы: а - диктиосома; б - митохондрии; в - лизосомы; г - вторичные лизосомы; д - микротрубочки; е - микрофила-менты
2.4.4.4-в. Лизосомы
Лизосомы (рис. 2.19, в) - пузырьки (диаметр 0,2-0,4 мкм), которые содержат ферменты с общим названием кислые гидролазы -
протеиназы, фосфатазы, эстеразы, ДНКазы, РНКазы. Своим названием эти ферменты обязаны тому, что в их функцию входит катализ гидролитического (в водной среде) расщепления нуклеиновых кислот, белков, жиров, полисахаридов и мукополисахаридов, других химических соединений при низких значениях рН (4,5). В цитобиологических по-
нятиях эту функцию следует рассматривать как внутриклеточное переваривание веществ и структур. Лизосомы есть во всех эукариотических клетках. В печеночной клетке млекопитающих, например, их несколько сотен.
Оболочка лизосом образована одной мембраной, иногда покрытой снаружи волокнистым белковым слоем (англ. coated vesicles - окаймленные пузырьки). Окаймленные пузырьки иногда идентифицируются с первичными лизосомами. Наличие мембраны - один из факторов защиты внутриклеточных образований от разрушающего действия лизосомальных ферментов. Еще один фактор защиты клетки от атаки собственными гидролитическими ферментами обусловлен тем, что лизосомальные ферменты активны исключительно в кислой среде, которая внутри органеллы создается специальным насосом, удаляющим протоны (H+). Нарушение же целостности мембран единичных лизосом не может на
нести ущерба клетке. С одной стороны, соответствующие
ферменты в гиалоплазме с pH около 7,3 практически неактивны, а с другой - буферная емкость основного вещества цитоплазмы несравнимо больше, чем содержимого отдельной лизосомы.
Лизосомы в клетке - это сборная (гетерогенная) группа частиц, что обусловлено их функцией. Первичными лизосомами называют неактивные органеллы, вторичными - органеллы, в которых идет процесс переваривания. Вторичные лизосомы образуются из первичных. Они подразделяются на гетеролизосомы (фагосомы или фа-голизосомы) и аутолизосомы (цитолисомы или цитолизосомы). В первых (рис. 2.19, г) переваривается материал, поступающий в клетку извне путем фагоцитоза (твердые частицы) и пиноцитоза (порции жидкости), во вторых разрушаются собственные структуры клетки, завершающие жизненный путь. К ним относятся митохондрии, длительность жизни которых, например, в клетках печени составляет порядка 10 сут, фрагменты мембран. Вторичные лизосомы, в которых процесс переваривания завершен, составляют подгруппу остаточных телец (телолизосомы). В них отсутствуют гидролазы и содержится материал, который не мог быть разрушен. Известны наследственные заболевания, в основе которых лежит отсутствие в лизосомах одного или нескольких ферментов. Такие состояния ведут к серьезными негативным для здоровья последствиями, так как клетки оказываются перегруженными определенными химическими соединениями. В случае болезни Тея-Сакса это сфинголипиды, соединения из группы полярных липидов, используемых при построении мембран. Для болезни
Помпе, приводящей к смерти в младенческом возрасте, характерно в связи с недостаточностью соответствующего лизосомального фермента накопление в клетках гликогена.
2.4.4.4-г. Микротельца
Микротельца - сборная группа структур (пузырьков), ограниченных одной мембраной (диаметр 0,1-1,5 мкм). Согласно электронно-микроскопическим исследованиям, для них характерны мелкозернистое внутреннее содержимое (матрикс) и, нередко, кристаллоидные или аморфные включения белковой природы. К этой группе относят перок-сисомы (см. п. 2.4.8).
2.4.4.4-д. Митохондрии
Митохондрии (рис. 2.19, б) - структуры округлой или палочковидной, иногда ветвящейся формы толщиной 0,5 мкм и длиной обычно 5-10 мкм. В животных клетках количество митохондрий варьирует от 150 до 1500, хотя в яйцеклетках амфибий их число достигает нескольких сотен тысяч. В сперматозоидах предположительно есть одна гигантская митохондрия, закрученная вокруг основания жгутика. Единичная ветвящаяся митохондрия обнаружена у одноклеточного кровяного паразита человека трипаносомы.
Оболочка митохондрии представлена двумя мембранами, различающимися по химическому составу и функциям. Внешняя мембрана легко проницаема для широкого круга веществ, тогда как внутренняя для большинства веществ практически непроницаема. Для тех же соединений, для которых она проходима, имеются чрезмембранные транспортные каналы. Внутренняя мембрана органеллы образует выпячивания или кристы, количество которых коррелируют с интенсивностью процесса энергообразования. Объясняется это тем, что во внутренней мембране размещается цепь переносчиков электронов от химических субстратов (веществ) на кислород. Высвобождаемая отдельными порциями в ходе такого ступенчатого окисления (в отличие от горения) энергия утилизируется с помощью встроенного в ту же внутреннюю мембрану механизма синтеза АТФ из АДФ и неорганического фосфата (фосфорилирование). Благодаря наличию двух отмеченных составляющих, описанный процесс в целом назван окислительным фосфори-лированием.
Пространство, ограниченное внутренней мембраной, составляет внутреннюю среду или матрикс. По данным электронной микроскопии, он имеет мелкозернистый вид с наличием более крупных зерен диаметром
20-40 нм. Последние содержат ионы кальция и магния, а также полисахариды, например гликоген.
Матрикс органеллы представляет собой концентрированный раствор ферментов, катализирующих все, кроме одной, реакции цикла лимонной кислоты. В нем размещен собственный аппарат биосинтеза белка митохондрии. Он представлен 2-6 копиями кольцевой молекулы ДНК (хромосома М), рибосомами, набором тРНК, ферментами репликации ДНК, транскрипции и трансляции генетической информации. По таким свойствам, как организация наследственного материала (отсутствие гистонов, ДНК в форме кольца, отсутствие интронов), размеры рибосом, использование формилметионин-тРНК на старте трансляции, этот аппарат близок к таковому прокариот и отличается от аппарата биосинтеза белка цитоплазмы эукариотической клетки. Все это рассматривают в качестве аргумента в пользу симбиотической гипотезы происхождения митохондрий (см. п. 1.10). В митохондриях находится около 10% ДНК животных клеток.
Гены собственной ДНК кодируют нуклеотидные последовательности митохондриальных рибосомных и транспортных РНК, а также последовательность аминокислот в некоторых белках органеллы, главным образом, ее внутренней мембраны. Аминокислотные последовательности большинства белков митохондрии закодированы в ДНК ядерных хромосом, а сами белки образуются вне органеллы, в цитоплазме. Перемещение митохондриальных белков, образуемых под контролем ядерных генов, обеспечивается благодаря участию белков шаперонов (англ., chaperon - пожилая дама, сопровождающая на балах молодую девушку; см. также п. 2.4.1). Белки митохондрий, о которых идет речь, синтезируются на свободных (не прикрепляющихся к мембранам) полисомах. По завершении синтеза они отделяются от рибосом и комплексируются с шаперонами. В составе такого комплекса белки достигают органеллы и проникают в нее. Оказавшись в матриксе митохондрии, комплекс распадается. Здесь же в матриксе при участии других шаперонов белки приобретают третичную (трехмерную, объемную) структуру. Прохождению через мембраны помогает присутствие в митохондриальных белках ци-топлазматического происхождения лидерных аминокислотных последовательностей (сервисные участки). Такие последовательности имеют фрагмент, который обеспечивает присоединение белков к рецептору внешней мембраны органеллы с дальнейшим прохождением через пору во внешней и внутренней мембранах. Оказавшись в матриксе, белки теряют лидерную последовательность. В случае, когда митохон-
дриальный белок цитоплазматического происхождения предназначен для межмембранного пространства органеллы, он имеет две лидерные последовательности. Первая, аналогичная упомянутой выше, транспортирует его в матрикс, тогда как вторая способствует выходу белка через внутреннюю мембрану в межмембранное пространство.
Дополнительной характеристики заслуживает семейство внутриклеточных белков-шаперонов, которые участвуют в обеспечении фолдинга (англ. fold - складывать, сгибать, загибать) полипептидов (первичная, линейная конфигурация) в трехмерные структуры (третичная, объемная конфигурация). При этом шапероны лишь организуют процесс фолдинга, тогда как функционально активная трехмерная форма белка определяется аминокислотной последовательностью полипептида.
Главная функция митохондрий состоит в извлечении из химических соединений энергии путем их окисления и фиксации энергии в биологически используемой форме путем синтеза АТФ. Еще одна функция митохондрий, редко выделяемая в качестве самостоятельной, состоит в том, что в них в процессах энергообразования утилизируется 95-99% О2. Последнее служит снижению внутриклеточного парциального давления кислорода до значений, минимизирующих его разрушительное действие на биологические макромолекулы и структуры. Митохондрии - участницы процесса генетически контролируемой клеточной гибели апоптоза (см. п. 3.1.2 и рис. 3.3). Среди дополнительных функций митохондрий называют образование стероидных гормонов и некоторых аминокислот (глутаминовая). В клетках бурой жировой ткани новорожденных детей митохондрии решают задачу теплопродукции
(см. п. 2.4.6.1).
2.4.4.4-е. Рибосома
К органеллам общего значения относятся некоторые постоянные структуры цитоплазмы, лишенные мембран. Среди них рибосомы, в связи с которыми происходит биосинтез белков. Названная органелла представляет собой сборную рибонуклеопротеиновую частицу диаметром 20-30 нм. Она состоит из малой и большой субъединиц (рис. 2.20). Объединение субъединиц в рибосому происходит в цитоплазме в присутствии инфомационной (матричной) РНК - и(м)РНК. Одна молекула и(м)РНК обычно объединяет несколько рибосом наподобие нитки бус - полисома (полирибосома). Полисомы свободно располагаются в основном веществе цитоплазмы или прикреплены к мембранам шероховатой цитоплазматической сети. В обоих случаях они служат ме-
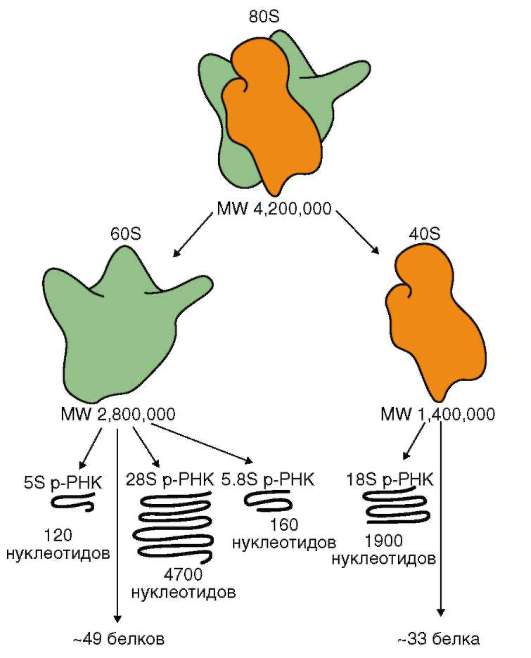
Рис. 2.20. Структура эукариотической рибосомы (схема). Указаны молекулярный вес (MW) и седиментационные характеристики (S) рибосомы и ее субъединиц, молекулы рибосомных РНК и количество белков большой и малой субъединиц
стом синтеза белков. На «свободных» полисомах образуются, главным образом, белки для собственных нужд («домашнего» использования, англ. housekeeping proteins) клетки, тогда как на полисомах гранулярной сети синтезируются белки, покидающие клетку и используемые на нужды организма (белки «роскоши», англ. luxury proteins; например, пищеварительные ферменты, белки грудного молока). Рибосомы (полисомы) отсутствуют в эритроцитах млекопитающих, в том числе чело-
века, полностью утративших способность образовывать белки. Детали строения рибосомы и ее функциональный цикл охарактеризованы ниже (см. п. 2.4.5-ж).
2.4.4.4-ж. Микротрубочки
К органеллам немембранного строения относят микротрубочки (см. рис. 2.19, д) - трубчатой формы образования различной длины с внешним диаметром 24 нм, толщиной стенки около 5 нм и шириной «просвета» 15 нм. Они встречаются в свободном состоянии в цитоплазме клеток или как структурные элементы жгутиков (сперматозоиды), ресничек (мерцательный эпителий трахеи), митотического веретена и центриолей (делящиеся клетки).
Микротрубочки строятся путем сборки (полимеризации) белка ту-булина. Микротрубочки полярны: в них выделяют концы (+) и (-). Их рост происходит от специальной структуры неделящихся клеток - центра организации микротрубочек, с которым органелла связана концом (-) и который представлен двумя элементами, идентичными по строению центриолям клеточного центра. Удлинение микротрубочек происходит путем присоединения новых субъединиц на конце (+). В начальной фазе направление роста не определено, но из образующихся микротрубочек сохраняются те, которые вступают в контакт своим (+) концом с подходящей мишенью. В растительных клетках, в которых микротрубочки имеются, структур типа центриолей не найдено. Микротрубочки принимают участие в поддержании формы клеток, в организации их двигательной активности (жгутики, реснички) и внутриклеточных транспортов (хромосомы в анафазе митоза). Функции внутриклеточных молекулярных двигателей выполняют белки кинезин и динеин, имеющие активность фермента АТФ-азы. При жгутиковом или реснитчатом движении молекулы динеина, прикрепляясь к микротрубочкам и используя энергию АТФ, перемещаются по их поверхности по направлению к базальному тельцу, то есть к концу (-). Смещение микротрубочек друг относительно друга вызывает волнообразные движения жгутика или ресничек, побуждающие клетку к перемещению в пространстве. В случае неподвижных клеток, например, реснитчатого эпителия трахеи, описанный механизм используется для выведения из дыхательных путей слизи с оседающими в ней частицами (дренажная функция).
Участие микротрубочек в организации внутриклеточных транспортов иллюстрирует перемещение в цитоплазме пузырьков (везикул). Молекулы кинезина и динеина содержат две глобулярных «головки»
и «хвосты» в виде белковых цепей (рис. 2.21, а). При помощи головок белки контактируют с микротрубочками, перемещаясь по их поверхности: кинезин от конца (-) к концу (+), а динеин в противоположном направлении. При этом они тянут за собой пузырьки, прикрепленные к «хвостам» (рис. 2.21, б). Предположительно, макромолекулярная организация «хвостов» вариабельна, чем обеспечивается узнавание различных транспортируемых структур.
С микротрубочками как обязательным компонентом митотическо-го аппарата связывают расхождение центриолей к полюсам делящейся клетки и перемещение хромосом в анафазе митоза. Для животных клеток, клеток части растений, грибов и водорослей характерен клеточный центр (диплосома), образованный двумя центриолями. Под электронным микроскопом центриоль имеет вид «полого» цилиндра диаметром 150 нм и длиной 300-500 нм. Стенка цилиндра образована 27 микротрубочками, сгруппированными в 9 триплетов. В функцию центриолей, сходных по структуре с элементами центра организации микротрубочек (см. здесь же, выше), входит образование нитей митотического веретена (веретена деления, ахроматинового веретена классической цитологии), представляющих собой микротрубочки. Центриоли поляризуют про-
Рис. 2.21. Структура кинезина (а) и транспорт везикулы по микротрубочке (б)
цесс деления клетки, обеспечивая закономерное расхождение к ее полюсам сестринских хроматид (дочерних хромосом) в анафазе митоза.
2.4.4.4-3. Микрофиламенты
Микрофиламенты (см. рис. 2.19, е) - тонкие нитеобразные структуры, обнаруживаемые по всей цитоплазме и иногда формирующие пучки. Известно несколько типов микрофиламентов.
Актиновые микрофиламенты диаметром 6 нм построены из белка актина. Их наличие связывают с амебоидным клеточным движением. Им также приписывают каркасную роль и участие в организации внутриклеточных перемещений органелл и участков основного вещества цитоплазмы. Двигательную функцию актиновые микрофиламенты осуществляют во взаимодействии с белком миозином. Молекулы миозина своей глобулярной частью контактируют с актиновыми микро-филаментами, а вытянутой хвостовой - формируют вместе с другими аналогичными молекулами так называемые толстые филаменты. Последние обеспечивают тянущее действие в отношении смежных ак-тиновых микрофиламентов. Так как тянущие усилия действуют относительно микрофиламентов в противоположном направлении, они создают скользящий момент, благодаря которому расстояние между концами микрофиламентов сокращается. Если указанные концы прикреплены к клеточной мембране, то ее форма в зоне прикрепления меняется, что лежит в основе образования псевдоподий и, следовательно, амебоидного движения. Выполнение актиновыми микрофиламентами каркасной (структурной) функции иллюстрирует строение микроворсинок эпителиальных клеток выстилки просвета кишечника. Сердцевина микроворсинок представлена пучками актиновых микроволоконец. Форма клеток поддерживается благодаря размещению под плазмалем-мой плотных пучков актиновых микрофиламентов.
В клетках присутствуют промежуточные микрофиламенты , Их название определено тем, что по диаметру (10 нм) они занимают среднее положение между микротрубочками и актиновыми микрофиламентами. Хотя разные типы промежуточных микрофиламентов образованы различными белками, эти белки отличаются большой степенью гомологии (достаточно близки друг к другу по аминокислотному составу). Промежуточные микрофиламенты - один из элементов цитоскелета. Наличием промежуточных филаментов обусловлена высокая прочность клеток эпидермиса кожи, а особых кератиновых микрофиламентов - волос. Вместе с тем недостаток рассматриваемых структур при некото-
рых мутациях не мешает клеткам с мутантным фенотипом в условиях культуры (in vitro) делиться и расти. Напомним, что промежуточные микрофиламенты принимают участие в образовании ядерной ламины (см. п. 2.4.3.1), которая подстилает внутреннюю мембрану ядерной оболочки, выполняя каркасную роль. Промежуточные микрофиламен-ты необходимы для нормального функционирования нервных клеток. Развитие таких нейродегенеративных заболеваний, как болезни Альц-геймера и Паркинсона, боковой амиотрофический склероз, связано с изменениями микрофиламентозных структур.
2.4.5. ПОТОК ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ: КЛЕТОЧНЫЙ УРОВЕНЬ
Жизнедеятельность клетки как единицы биологической активности обеспечивается совокупностью взаимосвязанных, приуроченных к определенным внутриклеточным структурам, упорядоченных в пространстве и во времени метаболических (обменных), созидательных (конструктивных, продуктивных, синтетических) и регуляторных процессов. Эти процессы образуют три потока: информации, энергии и веществ.
Благодаря потоку информации клетка, используя эволюционный опыт предков, приобретает структуру, отвечающую критериям элементарной структурной, функциональной и генетической единицы жизни (см. п. 2.1), поддерживает ее во времени и передает в ряду поколений. Этот же поток составляет основу выполнения специализированными клетками многоклеточного организма их функций.
Непосредственными участниками потока информации являются клеточное ядро (ДНК хромосом, репликация и транскрипция), макромолекулы, переносящие генетическую информацию из ядра в цитоплазму (информационная, или матричная, и другие виды РНК, посттранскрипционные изменения пре-РНК транскриптов), цитоплаз-матический аппарат образования простых белков или полипептидов (рибосомный цикл синтеза белка). С полипептидами происходят посттрансляционные изменения (фолдинг - приобретение вторичной и третичной структуры или конфигурации, объединение в комплексы - четвертичная структура, химическая модификация). Функционально зрелые белки и их комплексы используются в качестве ферментов, строительных блоков, антител и т.д. (рис. 2.22).
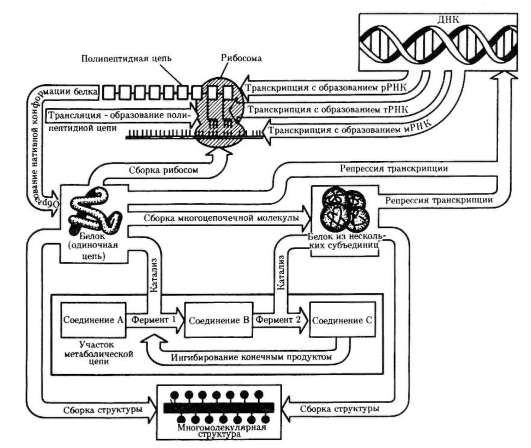
Рис. 2.22. Поток биологической информации в клетке
2.4.5.1. Макромолекулярная и надмолекулярная организация ДНК
Молекулой, с которой связано сохранение в клетках биологической (наследственной, генетической) информации, является ДНК. Ею обеспечиваются передача качественно и количественно полноценной информации в ряду клеточных поколений и использование этой информации для организации клеточных функций. Первая из названных задач решается путем воспроизведения идентичных двойных спиралей ДНК, вторая - путем биосинтеза белков. На заре биогенеза роль носителя генетической информации принадлежала, видимо, РНК (см. п. 1.4.6). Выбор эволюции в пользу ДНК обусловлен ее большей химической инертностью и, следовательно, стабильностью. Стабильности вещества наследственности в мире жизни принадлежит особое место. Минимизация искажения информации за счет хи-
мической стабильности молекул-носителей была в эволюции усилена путем возникновения механизмов «макромолекулярной редакции» ДНК-текстов, коррекции в них ошибок и молекулярной репарации повреждений молекул ДНК.
Генетическая (биологическая) информация записана по длине молекул ДНК в виде последовательности нуклеотидов, тогда как способность передавать эту информацию от клетки к клетке, а также использовать для обеспечения клеточной жизнедеятельности определяется надмолекулярной организацией ДНК в виде двойной спирали, в которой осуществлен принцип комплементарности , Осуществление этого принципа, делая возможным матричный синтез, составляет молекулярно-биологический базис обеих главных функций ДНК - использование информации в целях организации клеточных функций (через механизмы транскрипции и трансляции) и передача информации в ряду клеточных поколений (через механизмы репликации ДНК и митоза). На макромолекулярном уровне в связи с первой функцией речь идет об образовании молекул информационных (матричных) РНК и рибосомном цикле биосинтеза белка, со второй - о копировании и распределении между дочерними клетками биспиралей ДНК.
Биоинформационное обеспечение жизнедеятельности эукариотиче-ских организмов требует сложного генетического аппарата. Основу названного аппарата составляет клеточный геном. Формально геном (термин предложен немецким генетиком Г. Винклером в 1920 г.) определяется как совокупность генов одинарного (гаплоидного) набора хромосом. В связи с открытием некодирующих сайтов (см. п. 4.3.1) ДНК в настоящее время предлагается включать в геном всю совокупность ну-клеотидных последовательностей ДНК гаплоидного набора хромосом организмов определенного вида. При таком определении понятие генома распространяется, во-первых, на гены в понимании классической генетики, то есть на сайты ДНК, кодирующие молекулы РНК, участвующие в белковом синтезе (рибосомные, транспортные), а также белки. Во-вторых, в геном включаются все остальные нуклеотидные последовательности (сайты) ДНК с регуляторными, сервисными, конценсусны-ми и рядом других, нередко еще мало понятых наукой функций.
Макромолекула ДНК - полимер, построенный из мономеров-нуклеотидов (их 4). Нуклеотиды различаются по азотистым основаниям, которые представлены либо пурином (аденин или гуанин), либо пиримидином (цитозин или тимин). Два других компонента молекулы ДНК - пятиуглеродный сахар дезоксирибоза и остаток
фосфорной кислоты. Нуклеотиды в ДНК соединены связями между дезоксирибозой и фосфатом (рис. 2.23, А). Последовательность ну-клеотидов в рассматриваемой цепочке (первичная структура) может быть любой. ДНК присутствует в клетках в виде комплекса из двух комплементарных (взаимодополняющих) антипараллельных молекул - вторичная структура (рис. 2.23, Б). Так как существование такой конструкции («лестничная» конфигурация) невозможно по стереохимическим соображениям, комплекс «закручен» в трехмерную двойную спираль (биспираль, англ. helix, г(х)еликс) - третичная структура (рис. 2.24). Образующиеся при этом малая и большая бороздки - необходимое условие присоединения к ДНК регуляторных белков (транскрипционных факторов). Обычно это правозакрученная (витки следуют по часовой стрелке) спираль или В-форма. Обнаружена также левозакрученная Z-форма.
Полимеры в биспирали удерживаются связями между пурином и пиримидином: «аденин-тимин» и «гуанин-цитозин». Отмеченные особенности организации обеспечивают выполнение ДНК функций информационной макромолекулы. Независимая комбинация нуклеотидов по длине молекулы служит записи биологической информации (см. п. 2.4.5.2), а двойная спираль из комплементарных полимеров решает задачу копирования этой информации (см. п. 2.4.5.3).
Диаметр спирали ДНК составляет 2 нм, расстояние между смежными парами оснований - 0,34 нм, а один виток спирали - 10 пар азотистых оснований или нуклеотидов. Число молекул ДНК равно числу хромосом в ядре клетки. Длина таких молекул различна, поскольку хромосомы имеют разные размеры. У человека наибольшие размеры имеет хромосома 1 (263 млн п.н., минимальное оценочное число генов 2237, из которых ассоциированных с болезнями 157), наименьшие - хромосома 21 (50 млн п.н., минимальное оценочное число генов 204, из которых ассоциированных с болезнями 23). Классическая цитогенетика наименьшие размеры приписывала хромосоме 22. Длина кольцевой митохондриаль-ной ДНК (хромосома М) человека 16 569 п.н.
Наиболее крупный из обнаруженных в природе или синтезированных в лаборатории полимеров - это биспираль ДНК хромосомы 1 длиной 8 см. Размеры геномов оцениваются в пикограммах, дальтонах или в парах нуклеотидов: 1 пг = 10-9 мг = 0,6х1012 дальтон = 0,9х109 п.н. ДНК генома людей состоит из 3,2 млрд п.н., что по весу составляет 3,5 пг. Следовательно, диплоидная соматическая клетка человека содержит примерно 7 пг ДНК.
Рис. 2.23. Первичная (а) и вторичная (б) структура ДНК. Стрелками обозначена антипараллельность цепей
Рис. 2.24. Двойная спираль ДНК (трехмерная третичная структура). I - левоза-крученная Z-форма; II - правозакрученная В-форма
Об информационной емкости генома человека говорит следующий пример. Если ДНК-тексты одной клетки воспроизвести шрифтом телефонных справочников (наиболее мелкий из используемых в полиграфии), то для их издания понадобилось бы 1000 книг по 1000 страниц в каждой.
2.4.5.2. Способы записи биологической информации. Генетический (биологический) код
Переход от преджизни к жизни на Земле связывают с оформлением потока информации (см. п. 1.4.6, рис. 2.22). Любая информация,
включая биологическую, для ее сохранения или манипуляций с нею требует системы записи или кодирования. В мире жизни это решается благодаря информационным макромолекулам (ДНК, РНК, белки), представляющим собой биомолекулярные тексты (взаимосоответствующие по содержанию ДНКовые, РНКовые и белковые), составленные с использованием биологического (генетического) кода. Использование в биоинформатике названных выше полимеров дает право называть земную жизнь белково-нуклеиновой.
Вопрос о химической природе носителя биологической информации в клетке долгое время был предметом дискуссий. Решающим аргументом в пользу нуклеиновых кислот (ДНК) послужили результаты опытов Ф. Гриффита (1928), воспроизведенных на новом методическом уровне О. Эйвери (1944). Эти результаты говорили о том, что приобретение пневмококками непатогенного штамма патогенных свойств обусловлено проникновением в эти пневмококки ДНК пневмококков патогенного штамма. Другие доказательства биоинформационно-генетической функции ДНК:
• постоянство содержания ДНК в соматических клетках организма;
• соответствие содержания ДНК плоидности клеток (в соматических клетках ее вдвое больше, чем в половых);
• явление генетической рекомбинации у прокариот при их конъюгации, в ходе которой осуществляется проникновение фрагментов ДНК из одной бактериальной клетки в другую с соответствующим изменением фенотипических свойств;
• феномен трансдукции - изменение наследственных свойств бактериальных клеток путем переноса ДНК от одного штамма к другому при помощи бактериофага;
• инфицирующая способность вирусов определяется их нуклеиновой кислотой.
Метаболическая стабильность (сохранность информации), большие размеры молекул (информационная емкость), надмолекулярная организация ДНК в виде биспирали, образованной комплементарными макромолекулами (матричный механизм копирования или «снятия» информации) отвечают требованиям к материалу, выполняющему функции хранения и тиражирования генетической информации. По-иному обстоят дела с использованием информации в процессах развития и жизнедеятельности. Из природных полинуклеотидов РНК (но не ДНК) может проявлять ферментативную активность (рибозимы), но в очень ограниченном объеме. Белки же характеризуются такой активностью в полной мере. Оформившийся в эволюции механизм «опо-
средованного автокатализа пептидов» (см. п. 1.4.4) или, другими словами, процесс биосинтеза белка в клетке, объединил в себе потенциал обоих типов биополимеров и предопределил структуру информационной системы (потока информации) живых форм. Главные участники этой системы - ДНК, РНК и белки.
В мире жизни присутствует два вида текстов: связанные с нуклеиновыми кислотами, записанные при помощи нуклеотидов, и связанные с белками, записанные при помощи аминокислот.
Расчеты говорят о том, что для кодирования одной аминокислоты в белке достаточно тройки нуклеотидов в ДНК и/или РНК. Число возможных сочетаний из 4 нуклеотидов по 4, располагающихся по-разному в молекуле ДНК, измеряется астрономическими цифрами. Так, во фрагменте ДНК всего из 100 п.н. теоретически может быть закодированы аминокислотные последовательности 4100 белков среднего размера. Число сочетаний из 4 по 2 (16) при количестве аминокислот в «стандартном» наборе для синтеза белков 20 недостаточно, тогда как число сочетаний из 4 по 3 (64) удовлетворяет критерию достаточности.
В пробирке синтезировали короткие фрагменты РНК, содержащие один из четырех нуклеотидов. Эти фрагменты затем использовали в искусственных системах синтеза белка. Применяя фрагмент поли-У (по-лиуридиловый полимер), получали пептид, состоящий исключительно из аминокислоты фенилаланина. Был сделан вывод, что три уридило-вых нуклеотида в РНК (три адениловых нуклеотида в ДНК) кодируют в белках фенилаланин. Благодаря описанному приему, в 60-х гг. ХХ столетия генетический код был расшифрован полностью (табл. 2.2). Тройки нуклеотидов, соответствующие отдельным аминокислотам, получили название триплетов или кодонов.
Таблица 2.2. Генетический (биологический) код: аминокислоты и кодирующие их триплеты ДНК
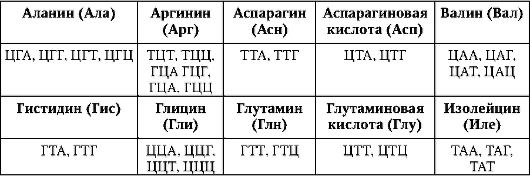
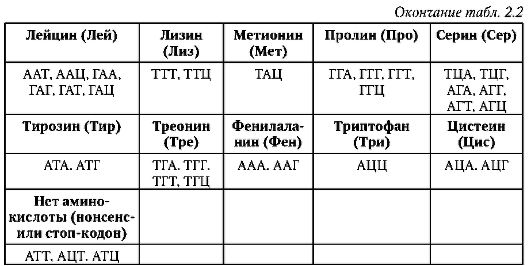
Приведенные в табл. 2.2 триплеты располагаются в кодогенной молекуле двойной спирали ДНК. и(м)РНК, обеспечивающая синтез белка с определенной аминокислотной последовательностью, образуется на парной ей матричной молекуле биспирали. В триплетах и(м)РНК, в сравнении с триплетами ДНК, тимидиловый нуклеотид (Т) заменен на уридиловый (У). Генетический код в виде триплетов и(м)РНК приведен в табл. 2.3.
Таблица 2.3. Генетический (биологический) код: аминокислоты и кодирующие их триплеты и(м)РНК
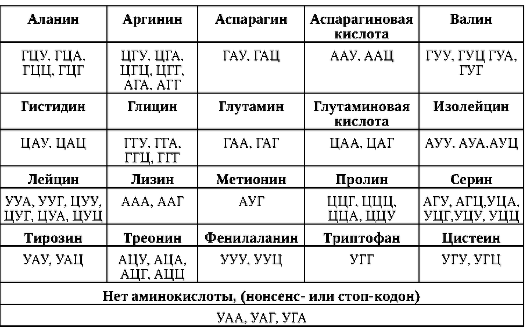
Нуклеотидные последовательности генов одной хромосомы обычно размещены в одной и той же молекуле биспирали ДНК, но есть исключения. Так, из пяти гистоновых генов плодовой мухи для двух генов информация записана в одной полинуклеотидной цепи, а для трех других генов - в парной ей цепи биспирали ДНК. Таким образом, роль кодогенной (а также матричной) молекулы может выполнять любая из цепей двойной спирали.
Единицей информации в молекулах ДНК служит тройка нуклеоти-дов или триплет, то есть генетический код является триплетным. При этом 4 нуклеотида, строящие ДНК, образуют 64 триплета, из которых 61 кодирует 20 аминокислот (смысловые триплеты), а 3 не имеют кодируемых аминокислот и служат для обозначения пункта терминации (завершения) транскрипции (бессмысленные или нонсенс-кодоны, стоп-кодоны). Генетический код является неперекрывающимся (отдельной аминокислоте соответствует самостоятельный триплет), непрерывным (триплеты для последовательности аминокислот в конкретном белке следуют друг за другом без «пробелов», но см. интроны, п. 2.4.5.5), универсальным (одни и те же триплеты используются для кодирования одних и тех же аминокислот у представителей всех групп живых существ - от вирусов и прокариот до млекопитающих, в том числе человека; известны исключения - см. здесь же, ниже), вырожденным (для кодирования одной аминокислоты, кроме метионина и триптофана, используется от двух до шести триплетов), специфичным (конкретному триплету соответствует одна аминокислота).
Если для аминокислоты существует от двух до четырех триплетов (аланин, валин, глицин, пролин, треонин), то различия между триплетами касаются исключительно последнего, третьего нуклеотида (нонсенс-кодоны не подпадают под это правило). В таком случае мутационное изменение третьего нуклеотида в триплете примерно в 64% дает триплет-синоним, что служит повышению уровня сохранности информации в ДНК. Сходные по строению и/или химическим свойствам аминокислоты имеют триплеты с одним и тем же центральным (вторым) нуклеотидом. К примеру, триплеты гидрофобных аминокислот (фенилаланин, лейцин, изолейцин, метионин, валин) имеют в ДНК второй нуклеотид А, а в и(м)РНК - У. Эта особенность генетического кода создает «биоинформационный буфер», который сводит к минимуму влияние многих генных мутаций на функциональные характеристики соответствующих белков (гидрофобная аминокислота меняется на гидрофобную).
Есть примеры, не отвечающие принципу универсальности генетического кода. Так, в клетках распространенного возбудителя микозов человека Candida albicans кодон ЦУГ соответствует аминокислоте серину, а не лейцину, как в клетках почти всех других живых форм. В автономной белокобразующей системе митохондрий клеток млекопитающих триплет и(м)РНК АУА соответствует аминокислоте метионину, тогда как в цитоплазме этих же клеток - изолейцину. Триплеты ТЦГ и ТЦЦ митохондриальной ДНК некоторых видов организмов не кодируют аминокислот, являясь нонсенс-кодонами. В приведенных примерах функционально-генетические особенности поименованных кодонов воспроизводятся на постоянной основе, что дает основания рассматривать эти особенности как следствие своеобразия эволюционного процесса.
Во всех кодовых системах записи выделяют буквы (алфавит) и слова (словарь) текста. В кодовой системе нуклеиновых кислот (ДНК, РНК) буквы - это нуклеотиды (4-буквенный алфавит), а слова - тройки нуклеотидов или триплеты, которым соответствуют отдельные аминокислоты (61-словный словарь, включая синонимы).
Изменения в нуклеотидных последовательностях (генетических текстах) ДНК приводят к искажению информации и носят название генных или истинных мутаций. Такие изменения состоят в замене одного смыслового триплета на другой или нонсенс-кодон, выпадении или вставках нуклеотидов, что приводит к сдвигу рамки считывания биоинформации. У людей известно несколько сотен (из 5 тыс. генных болезней, выявленных на 2004 г.) наследственных болезней, для которых обнаружен мутировавший ген и описан фенотипический эквивалент мутации. В эту группу входят ахондроплазия (характерный признак - непропорциональная карликовость), вызываемая заменой гуанилового нуклеотида на цитидиловый в гене рецептора гормона роста, серповидноклеточная анемия (характерный признак - эритроциты серповидной формы в связи с понижением растворимости и повышением степени полимеризации гемоглобина), вызываемая заменой в гене β-глобина в 6-м положении триплета глутаминовой кислоты на триплет валина, α-талассемия (характерный признак - гемолитическая анемия в связи с аномальной структурой гемоглобина по α-глобину), вызываемая выпадением некоторого количества нуклеотидов в гене α-глобинового кластера, невосприимчивость людей к вирусу иммунодефицита человека (ВИЧ), обусловливаемая выпадением части нуклеотидов (ДНК-текста) в гене ccr5 (кодирует белок-рецептор для локальных регуляторов клеточной
активности β-цитокинов; мутантный белок лишен аминокислотной последовательности, необходимой для проникновения вируса в клетки).
2.4.5.3. Передача генетической информации в ряду клеточных поколений. Самокопирование или репликация ДНК
В земной жизни способом образования новых клеток является ми-тотическое деление уже существующих. Этот процесс организован в форме митотического (пролиферативного) цикла, решающего важнейшую биоинформационно-генетическую задачу - обеспечение клеток дочерних поколений генетической информацией, полноценной в количественном и качественном (смысловом) отношении. Структура цикла и принципы его регуляции рассмотрены в главе 3. Здесь же речь идет о процессе самокопирования (самовоспроизведения) или реплика-ции1 ДНК в синтетическом (S) периоде интерфазы митотического цикла или же в гаметогенезе - перед первым делением мейоза.
Генетический материал эукариот имеет хромосомную организацию. В каждой хромосоме находится комплекс из двух взаимокомплементарных молекул (цепей) ДНК, закрученных в спираль. В ходе репликации вдоль каждой такой молекулы (цепи) «строится» комплементарная полинуклеотидная цепь. Репликация ДНК, таким образом, представляет собой симметричный процесс в том смысле, что обе молекулы биспирали выполняют роль матриц. Дезоксирибонуклеотиды выстраиваются в дочернюю молекулу в соответствии с правилом компле-ментарности: адениловый нуклеотид (А) встает в пару с тимидиловым (Т), а гуаниловый (Г) с цитидиловым (Ц) и наоборот. В итоге на основе одной биспирали ДНК возникают две, идентичные по информационному наполнению. Способ удвоения, при котором каждая возникающая вследствие репликации двойная спираль образована одной предсуще-ствующей материнской молекулой ДНК и одной заново образованной дочерней, называют полуконсервативным (рис. 2.25).
ДНК эукариот удваивается не одним блоком от начала и до конца биспирали, а участками или репликонами со средним размером порядка 30 мкм (1600 тыс. нуклеотидов в так называемой лидирующей цепи биспирали ДНК, см. здесь же, ниже). В ДНК хромосом соматической клетки человека насчитывается до 50 тыс. репликонов. В некоторых ре-пликонах удвоение ДНК происходит одновременно, в других - в раз-
1 Термин «репликация» обычно используют для обозначения самокопирования ДНК; термин «редупликация» чаще используют для обозначения удвоения хромосом.
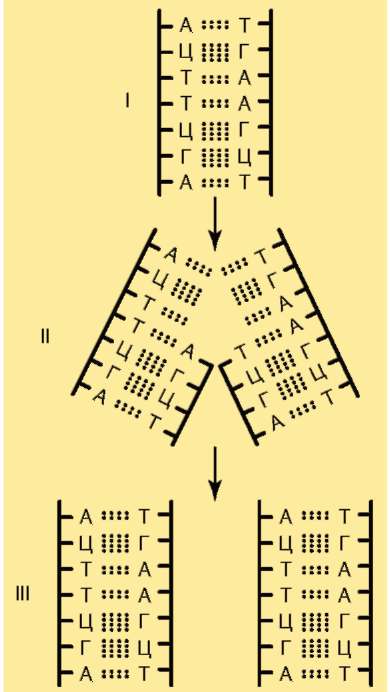
Рис. 2.25. Полуконсервативный способ редупликации ДНК: I - материнская би-спираль ДНК; II - достраивание комплементарных полинуклеотидных цепей; III - две дочерние биспирали ДНК
ное время. Так, репликация ДНК гетерохроматиновых участков, будучи наиболее поздней, осуществляется в конце периода S. ДНК центромер-ных отделов хромосом удваивается даже не в периоде S интерфазы, а в начале анафазы предыдущего митоза непосредственно перед расхождением дочерних хромосом.
Самоудвоение происходит группами по 10-100 репликонов. Репли-конный формат самокопирования ДНК дает выигрыш по времени. Если бы молекула ДНК реплицировалась одним репликоном, то при скорости синтеза у человека порядка 0,5 мкм/мин (в среднем 100 п.н./с у эука-риот и 1500 п.н./с у прокариот) на удвоение хромосомы 1 (длина 8 см) потребовалось бы около 3 мес. Благодаря полирепликонной организации процесс самоудвоения всей ДНК в S периоде интерфазы занимает у млекопитающих, в среднем, 7-12 ч in vivo и 6-8 ч in vitro. Количество точек начала репликации (активируемых репликонов) и ее скорость меняется в зависимости от стадии индивидуального развития организма, типа клеток и стадии гистогенеза, на которой они находятся, условий их существования. Так, в сперматогониях на одну хромосому приходится в
среднем порядка 40 точек начала репликации (продолжительность периода S 15 ч), а на более поздних стадиях сперматогенеза в сперматоци-тах хромосомы имеют по 5-6 этих точек (продолжительность периода S 100 ч).
Для того чтобы пошла репликация, необходим пул субстратов (предшественников) в высоко энергизированном состоянии - дезок-сирибонуклеозидтрифосфаты тимина, аденина, цитозина и гуанина.
В процессе репликации ДНК выделяют фазы инициации (начало, старт), элонгации (удлинение, приращение) и терминации (завершение, окончание).
Хотя сама репликация происходит в периоде S (синтетический) интерфазы митотического цикла, пререпликативный комплекс образуется в периоде G1 (пресинтетический, постмитотический) интерфазы. Это сложный ферментный комплекс, включающий 15-20 белков, в частности, инициирующие («узнающие») белки, такие как ORS, Cdc6 и Mcm. Названный комплекс, благодаря белкам ORS, связывается с ДНК в точках инициации (начала) репликации. Отличительная черта этих точек - богатство парами А-Т. В таких парах 2 (а не 3, как в парах Г-Ц) водородные связи, что облегчает местную (в точке инициации) денатурацию ДНК с расхождением молекул двойной спирали. Образующиеся при этом одноцепочечные участки ДНК связываются дестабилизирующими белками комплекса (RPA - Replication Protein A эукариот или SSB - Single Strand Binding рroteins прокариот), молекулы которых выстраиваются вдоль полинуклеотидных цепей-матриц и «растягивают» их, делая азотистые основания доступными для присоединения нуклеотидов. Благодаря описанным событиям между соседними точками начала репликации образуется структура, получившая название « репликативный глаз» и соответствующая участку ДНК с разошедшимися («открывшимися» для репликации) полинуклеотидными цепями материнской биспирали. В точках начала репликации (точки ori) образуются репликативные вилки, начинающие процесс в двух взаимопротивоположных направлениях. С этого момента следует говорить не о пре-, а о репликативном комплексе (рис. 2.26). Такие комплексы являются мультимакромолекулярными образованиями, участники которых - специальные белки, в том числе ферменты - обеспечивают три функции: связь необходимых белков, включая ферменты, с точками начала репликации, раскручивание молекул ДНК и ее местную (в зоне репликации) денатурацию, непосредственно репликацию.
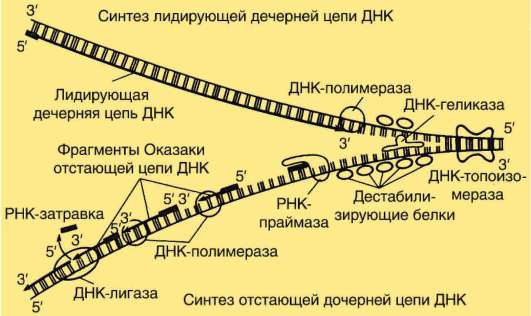
Рис. 2.26. Репликационный комплекс (репликационная вилка): главные участники процесса самокопирования ДНК (схема)
Разделение закрученных в биспираль полинуклеотидных цепей ДНК осуществляется ферментом геликазой при участии дестабилизирующего белка RPA. Местное разделение полинуклеотидных цепей при сохранении двуцепочечной структуры на остальном протяжении биспирали должно было бы приводить к образованию супервитков перед репликационной вилкой. Для снятия напряжения, с необходимостью возникавшего бы в такой ситуации, и создания условий для поступательного продвижения репликационной вилки вся материнская биспираль должна была бы быстро вращаться вокруг своей оси. Это высоко энергозатратный процесс. Эволюция нашла выход: ферменты ДНК топоизомеразы I и II , разрывая, соответственно, одну или обе цепи биспирали ДНК, создают возможность для локального вращения, что ослабляет напряжение и препятствует образованию супервитков.
Ферментом, катализирующим образование дочерних полинуклео-тидных цепей, является ДНК-полимераза, представляющая собой сложный мультимакромолекулярный комплекс. В репликативном образовании ДНК эукариот на отдельных этапах участвуют разные ферменты с функцией ДНК-полимеразы. На старте процесса функционирует комплекс из ферментов α ДНК-полимеразы и праймазы (ферменту
праймазе принадлежит роль РНК-полимеразы, что необходимо для синтеза РНК-праймера, см. здесь же, ниже). Указанный комплекс, будучи вытесненным с 3'-конца начавшей рост полинуклеотидной цепи, уступает место δ ДНК-полимеразе. В клетках эукариот присутствуют также β, ε ДНК-полимеразы, участвующие в процессах репарации молекулярных повреждений ДНК, и γ ДНК-полимераза, катализирующая репликацию ДНК митохондрий.
ДНК-полимеразы не способны начать синтез полинуклеотида самостоятельно путем соединения двух дезоксирибонуклеозидтрифос-фатов. Они лишь присоединяют при помощи фосфодиэфирной связи трифосфонуклеотид-предшественник к уже имеющейся нуклеотидной цепи на 3'-конце. В связи с этим инициация репликации ДНК требует предварительного образования затравки или праймера - короткого фрагмента РНК, образующегося при участии репликационного белка RPA и ферментного комплекса «α ДНК-полимераза-праймаза» (рис. 2.27). Из схемы следует, что матрицей для репликации может служить только молекула ДНК, несущая спаренный с ней РНК-праймер, который имеет свободный 3'-ОН-конец.
Построение одной из дочерних полипептидных цепей (лидирующая) на материнской матрице опережает построение второй (запаздывающая). Элонгацию обеих полинуклеотидных цепей ДНК катализирует фермент δ ДНК-полимераза. Кроме собственно фермента, в репликативный комплекс входят белки RFC - Replication Factor C и PCNA - Proliferating Cell Nuclear Antigen. Первый блокирует наращивание РНК-праймера на 3'-конце сверх требуемой длины. Второй играет роль «прищепки» или зажима, крепящего δ ДНК-полимеразу к реплици-руемой полинуклеотидной цепи. Участки ДНК лидирующей цепи синтезируются в пределах репликонов как непрерывные достаточно длинные фрагменты, тогда как ДНК запаздывающей цепи образуется короткими (у эукариот 1000-2000 нуклеотидов) участками - фрагменты Ока-заки. Смысл образования запаздывающей цепи фрагментами Оказаки заключается в том, что в пределах такого фрагмента наращивание молекулы происходит, как обычно, в направлении от 5' к 3'-концу (по типу шитья «назад иголкой»), так как по-иному ДНК-полимераза не работает.
Завершение репликации (терминация) состоит в удалении РНК-праймеров, заполнении нуклеотидами образующихся при этом «брешей», «сшивании» фрагментов ДНК для восстановления целостности молекулы. В этой фазе процесса участвует группа ферментов: РНК-аза Н или просто нуклеаза Н (удаляет праймер, разрушая РНК в гибридных
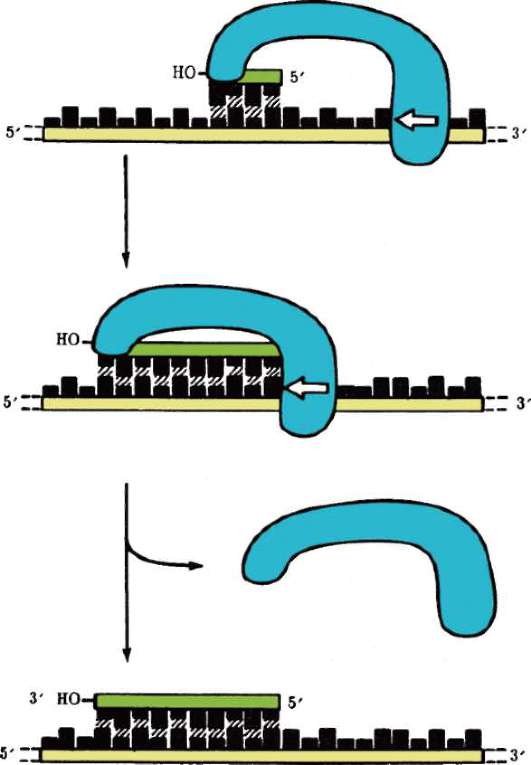
Рис. 2.27. Образование РНК-затравки, катализируемое РНК-праймазой, в дебюте репликации ДНК (схема)
РНК/ДНК-комплексах; предположительно, у эукариот эту функцию выполняет δ ДНК-полимераза), β ДНК-полимераза (заполняет «бреши»), ДНК-лигаза («пришивает» фрагмент ДНК, заменивший РНК-праймер, к дочерней цепи). У эукариот репликационный синтез ДНК прекращается при встрече репликационных вилок соседних репликонов.
Полирепликонный формат построения лидирующей цепи и образование запаздывающей цепи фрагментами Оказаки приводит к тому, что по завершении процесса дочерние полинуклеотиды ДНК представлены отдельными участками. Целостность (непрерывность) молекул
восстанавливается благодаря активности фермента ДНК-лигазы, катализирующего, как и ДНК-полимераза, образование межнуклеотидной фосфодиэфирной связи. Особенность действия названного фермента в том, что он «сшивает конец в конец» только такие одноцепочечные участки, которые находятся в составе двухцепочечной ДНК.
Самокопирование вирусных и бактериальных ДНК имеет особенности. У прокариот ДНК реплицируется не прерываясь (как один репликон) с одной точки начала репликации и с образованием двух ре-пликационных вилок. Так как реплицирующаяся хромосома (ДНК) исходно кольцевой формы по конфигурации напоминает греческую букву θ (тета), то весь процесс получил название θ-репликации. У ряда вирусов - бактериофаг λ - наблюдается репликация по типу «катящегося кольца» или σ-репликация. Ключевой фермент репликации ДНК прокариот - ДНК-полимераза III. Функционируя в комплексе примерно с 20 белками, названный фермент строит единым блоком лидирующую и запаздывающую (фрагменты Оказаки) полинуклеотидные цепи. Завершение процесса в запаздывающей цепи требует подключения ДНК-полимеразы I, которая заполняет дезоксирибонуклеотидами участки, образующиеся на месте удаляемых праймеров. ДНК-полимераза I в рассматриваемом процессе выполняет три функции. Наряду с катализом образования ДНК на месте РНК-праймеров (ДНК-полимеразная активность), она обеспечивает удаление этих праймеров в запаздывающей цепи («передняя» или «от 5' к 3'» экзонуклеазная активность), а также редактирование ДНК-текста путем удаления ошибочно встроившихся неспаренных нуклеотидов на растущем конце цепи («задняя» или «от 3' к 5'» экзонуклеазная активность). ДНК-полимераза I прокариот является, по-видимому, функциональным аналогом одновременно нуклеазы Н, β ДНК-полимеразы и δ ДНК-полимеразы эукариот. ДНК-полимераза III (функциональный аналог α и δ ДНК-полимераз эукариот) лишена «передней» экзонуклеазной активности. ДНК-полимераза II участвует в процессе молекулярной репарации повреждений бактериальной ДНК.
Завершение (терминация) репликации у прокариот характеризуется своими особенностями. В ДНК прокариот присутствует участок из нескольких коротких (23 п.н.) последовательностей - сайты ter. Репликация завершается по достижении репликационной вилкой указанного участка в том случае, если с вышеназванными сайтами связывается продукт гена tus.
Известны примеры, когда механизм репликации, не будучи связанным с клеточным размножением, решает другие задачи. Это происходит,
в частности, при амплификации (увеличение числа ДНК-копий путем многократного самокопирования) генов рРНК в профазе первого деления мейоза при образовании яйцеклеток у амфибий (см. п. 2.4.3.4-а). В описанном случае используется вариант σ-репликации.
Самокопирование митохондриальной ДНК осуществляется с участием фермента γ ДНК-полимеразы. Репликация ДНК - сложный процесс. У человека, например, за процесс репликации и контроль клеточного (митотического) цикла ответственно более 400 генов. Некоторые из них активны на стадии инициации, другие - на стадии элонгации. Далеко не все детали организации и функционирования «репликационной машины» в достаточной мере ясны.
2.4.5.3-а. Защита и/или минимизация искажения генетической информации на уровне ДНК
Важным фактором сохранения биоинформации во времени (в ряду поколений клеток и организмов) является химическая инертность ДНК (см. п. 2.4.5.1). Одного этого, однако, недостаточно. Изменения в ну-клеотидных последовательностях ДНК, искажающие смысл генетической информации, происходят в силу неизбежных ошибок, например, репликации, рекомбинации, репарации ДНК, а также под воздействием агрессивных внутренних (активные формы кислорода или свободные радикалы, температурные колебания) или внешних (кванты космической энергии, УФ и инфракрасное, ионизирующие излучения, определенные химические соединения) агентов.
Механизм репликации ДНК характеризуется исключительной (1 ошибка на 109-1010 спариваний комплементарных нуклеотидов), но не абсолютной точностью. В обеспечении высокой надежности репликации важную роль играет фермент ДНК-полимераза, к функциям которого относится выбор «правильного» нуклеотида из пула нуклео-зидтрифосфатов (АТФ, ТТФ, ГТФ и ЦТФ) и точное присоединение его по длине матричной материнской цепи ДНК, т.е. его включение в строящиеся дочерние цепи (лидирующую и запаздывающую) в надлежащем месте.
Ошибки спаривания (включение ошибочных нуклеотидов), тем не менее, имеют место. Нередко они зависят от образования в клетке химически измененных (таутомерных, возникают с частотой 1 на 104105 «правильных») форм азотистых оснований. Таутомерная форма, например, цитозина образует пару не с гуанином, а с аденином. Тауто-мерные основания существуют, как правило, недолго. При их переходе
в обычную форму в растущей дочерней цепи ДНК в соответствующих парах нуклеотидов нарушается правило комплементарности, что ведет к появлению неспаренных нуклеотидов. Включающийся механизм самокоррекции или редактирования (англ. proofreading) ДНК-текста отщепляет «неправильный» нуклеотид. Функцию молекулярного редактирования выполняет фермент ДНК-полимераза, проявляя в данном случае каталитическую активность нуклеазы. «Редакторская» функция ДНК-полимеразы состоит также в том, что после того, как очередной дезоксирибонуклеотидтрифосфат-предшественник занял место по длине молекулы-матрицы, но до присоединения его к растущей дочерней цепи фермент изменяет свою трехмерную структуру (конформацию) и, если нуклеотид ошибочен, присоединения, скорее всего, не происходит.
По завершении акта редактирования ДНК-полимераза продолжает нуклеотид за нуклеотидом наращивать дочернюю цепь ДНК (рис. 2.28). Следствием саморедактирования (самокоррекции) является снижение частоты ошибок репликации на порядок или в 10 раз - с 10-5 до 10-6.
Наряду с ошибками спаривания, причинами нарушения первичной структуры (последовательности нуклеотидов) ДНК и, следовательно, искажения биоинформации могут быть самопроизвольная (спонтанная) потеря полимером пуриновых азотистых оснований аденина и гуанина (апуринизация; в среднем за сутки диплоидная клетка теряет 5х104 пуринов, что, к примеру, за 70 лет - средняя продолжительность жизни человека в экономически развитых странах - в отсутствие процессов репарации привело бы к утрате ДНК порядка 25% соответствующих нуклеотидов), химическая модификация азотистых оснований путем присоединения метильных или этильных групп, дезаминирова-ние цитозина, превращающегося при этом в урацил, сшивки соседних тиминовых оснований под действием УФ-облучения, одноцепочечные разрывы молекул ДНК под воздействием рентгеновых лучей или двух-цепочечные под воздействием жесткого α-излучения. Большая часть изменений такого рода устраняется благодаря механизмам молекулярной репарации (восстановления).
Различают дорепликативную (сопровождающую репликацию ДНК) и пострепликативную (затрагивающую уже образованные дочерние биспирали ДНК) репарацию.
В первом случае процесс начинается с идентификации заново образованной дочерней цепи, которая несет ошибку. При этом вторая, исходно материнская цепь биспирали сохраняет «правильную» после-
Рис. 2.28. Самокоррекция или молекулярное редактирование ДНК-текста в процессе репликации
довательность нуклеотидов. Разграничение в биспиралях материнской и дочерней цепей возможно в части случаев потому, что дочерние молекулы ДНК отличаются от материнских сравнительно низким уровнем метилирования. В других случаях основанием для разграничения являются разрывы по ходу дочерней цепи, в том числе (у высших организмов) по границам смежных репликонов. Следующий этап состоит в обнаружении места ошибки и его «обозначении». Нередко такое «обозначение» состоит в разрыве в точке повреждения фосфодиэфирной связи (например, при утрате пуриновых оснований, для чего необходим фермент эндонуклеаза). Затем включается фермент экзонуклеаза. На этой стадии измененный (и «помеченный») участок полимера вместе с примыкающими к нему нуклеотидами «вырезается» и удаляется. На его месте ДНК-полимераза, используя в качестве матрицы «нормальную» материнскую цепь, достраивает отсутствующий фрагмент с соблюдением правила комплементарности нуклеотидов (рис. 2.29). Далее происходит восстановление непрерывности молекулы ДНК (фермент ДНК-лигаза). При химической модификации азотистых оснований путем дезаминирования, алкилирования и др. в репарации ДНК задействованы ферменты ДНК-гликозилазы числом около 20, распознающие соответствующие повреждения, которые удаляются с восстановлением требуемой нуклеотидной последовательности.
Если структурное нарушение молекулы ДНК состоит в образовании тиминовых димеров «-Т-Т-», удалению подлежит достаточно протяженный участок цепи ДНК, содержащей ошибку. Восстановление участка на месте «вырезанного» фрагмента происходит с использованием ферментов дорепликативной репарации, как это описано выше. «Брешь» заполняется «правильными» нуклеотидами с соблюдением правила комплементарности и целостность дезоксирибополинуклеотида восстанавливается.
Механизмы молекулярной репарации ДНК разнообразны. Они отражают характер и условия возникновения молекулярных «дефектов». Механизмы, включающие момент «вырезания» измененных участков, объединены под общим названием эксцизионной репарации. Этими механизмами обеспечивается макромолекулярная репарация ДНК в буквальном смысле, так как «вырезанию» (эксцизия) подвержены измененные фрагменты биоинформационной молекулы, что в функционально-генетическом плане равнозначно удалению ошибки.
Иногда ошибки в виде тиминовых димеров, а также некоторые другие не исправляются описанным образом. В таких случаях включается
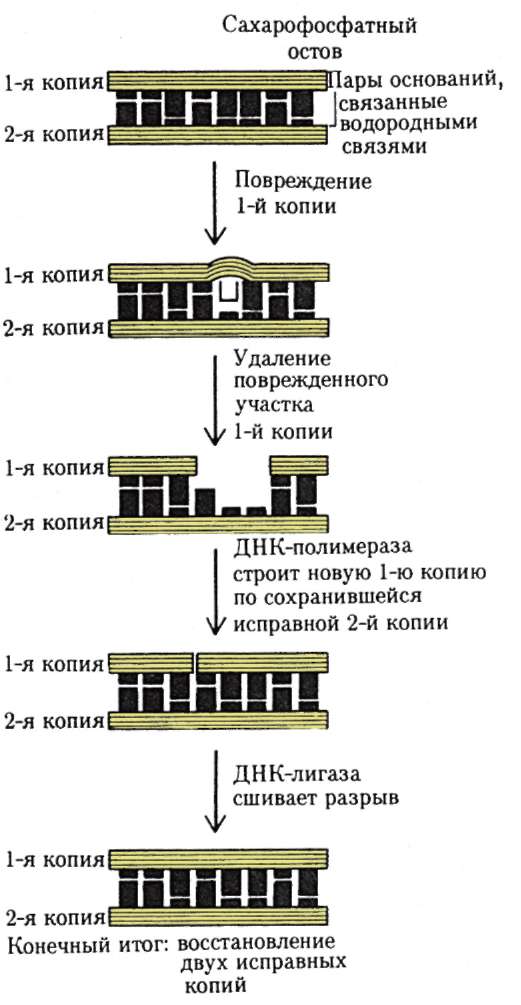
Рис. 2.29. Дорепликативная или эксцизионная репарация ДНК (схема)
механизм пострепликативной репарации, в основе которого лежит рекомбинация фрагментов молекул ДНК (рис. 2.30). Механизм постре-пликативной репарации лишен специфичности в том смысле, что в нем отсутствует момент узнавания повреждения. По существу, речь идет о возможности репликации на матрице поврежденной молекулы ДНК без удаления повреждения. Ошибка в нуклеотидной последовательности
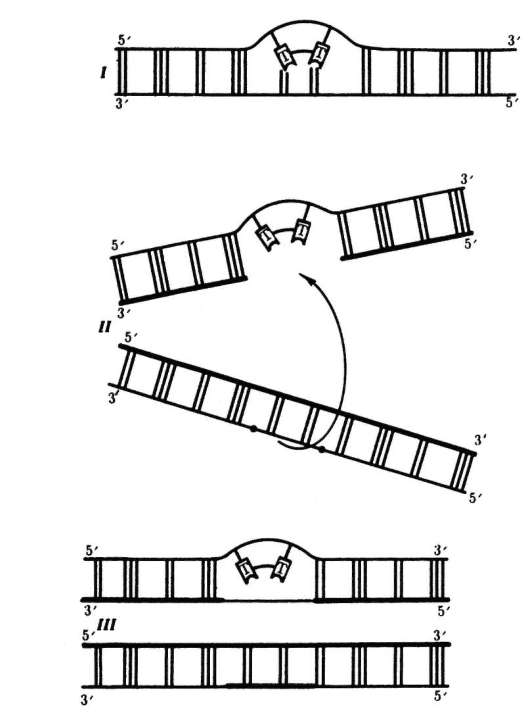
Рис. 2.30. Пострепликативная репарация ДНК (схема)
вновь образованной биспирали ДНК, таким образом, сохраняется, но может быть удалена в последующем с использованием эксцизионного (см. здесь же, выше) механизма.
Процессы молекулярной репарации ДНК важны для обеспечения нормальной жизнедеятельности, о чем свидетельствуют серьезные с точки зрения нарушения здоровья людей фенотипические изменения в случае мутаций по соответствующим сайтам (генам). Классический пример - заболевание пигментная ксеродерма или XP (xeroderma pigmentosum: греч. xeros - сухой, derma - кожа; лат. pigmentum - краска). У пациентов наблюдается повышенная чувствительность к солнечному (более точно, УФ) свету, что клинически проявляется в увеличении частоты развития рака слизистой оболочки полости рта в 20 тыс. раз, сокращении длительности жизни и др. Для названного наследственного заболевания характерен аутосомно-рецессивный тип наследования. Установлено несколько генетических форм заболевания (феномен генокопирования, см. п. 4.3.1.1). Все они связаны с мутациями и, следовательно, функциональной «дефектностью» генов, участвующих в контроле процессов репарации повреждений молекул ДНК ультрафиолетовым светом. Предположительно, при отдельных формах нарушено распознавание поврежденного участка, его эксцизия, механизм постре-пликативной репарации и др.
Если клетка попадает в крайне неблагоприятные условия, количество повреждений ДНК может достичь таких величин, что обычные механизмы репарации не справляются с их коррекцией. В подобных ситуациях активируется «аварийная» группа ДНК-репарирующих индуцибиль-ных (в данном случае, побуждаемых к активации обстоятельствами) ферментов SOS-системы (англ. «Save Our Souls» или «Спасите наши души» - международный сигнал бедствия на море и в воздухе). Особенность функционирования SOS-системы заключается в том, что восстановление целостности поврежденных молекул ДНК происходит в срочном порядке без соблюдения правила комплементарности, вследствие чего по завершении процесса в таких молекулах обнаруживается значительное число «свежих» мутаций. При очень высоком количестве повреждений блокируется репликация ДНК и, как следствие, прохождение клеткой митотического цикла. Функционально-биологический смысл блока состоит в том, что клетка не делится и, следовательно, передачи в ряду поколений искаженной в связи с повреждениями ДНК информации не происходит.
Описанные выше способы коррекции и восстановления ДНК-текстов в случае искажения, назовем их активными, дополняются генетическими механизмами, блокирующими или снижающими неблагоприятные фенотипические последствия искажений, если они произошли и не были исправлены. Так, благодаря диплоидности эукариотических клеток измененные (мутировавшие) гены, если они проявляют свойство рецессивности, в гетерозиготах в формировании фенотипа не участвуют и, следовательно, не подпадая под действие естественного отбора, сохраняются в гено(аллело)фондах популяций. Свой вклад в минимизацию неблагоприятных фенотипических последствий нарушений в нуклеотидных последовательностях ДНК, состоящих в замене отдельных нуклеотидов, вносит вырожденность генетического кода (см. п. 2.4.5.2). Уместно вспомнить также явление экстракопирования генов, которые обусловливают контроль жизненно важных клеточных функций, в частности, кодирующих рРНК, тРНК, гистоны (см. п. 2.4.3.3). Механизмы такого рода можно назвать естественными антимутационными.
2.4.5.4. Внутриклеточное движение биологической (генетической) информации. Необходимые условия
Генетическая информация ДНК хромосом в обеспечении процессов жизнедеятельности клеток непосредственно не участвует. Механизмом актуализации этой информации является внутриклеточное образование белковых молекул с присущими им биокаталитической (ферментной), структурной, транспортной, рецепторной, сигнальной и другими функциями. Роль посредника, в задачу которого входит «перевод» наследственной информации с языка нуклеотидных последовательностей ДНК на язык аминокислотных последовательностей белков (полипептидов), играют рибонуклеиновые кислоты (РНК).
В клетке присутствует значительное число разновидностей РНК, принимающих участие во многих жизненно важных процессах. Ранее мы познакомились с РНК-праймерами (см. п. 2.4.5.3), запускающими репликацию ДНК, и snoRNA ядрышек (см. п. 2.4.3.3).
В отличие от ДНК, молекулы рибонуклеиновых кислот представлены единичной полинуклеотидной цепью, по ходу которой, однако, нередко и закономерно образуются двухцепочечные участки. Так, в молекулах транспортных РНК, наряду с пятью одноцепочечными участками, имеется 4 двухцепочечных.
Полинуклеотидная цепь РНК построена из четырех видов нуклео-тидов. Каждый из них представлен пятиуглеродным сахаром рибозой, одним из четырех азотистых оснований (аденин, гуанин, цитозин, урацил) и остатком фосфорной кислоты. Таким образом, отличия между ДНК и РНК касаются сахара (дезоксирибоза/рибоза) и одного из четырех азотистых оснований (тимин/урацил). Все РНК образуются на молекулах ДНК при участии ферментов РНК-полимераз с соблюдением правила комплементарности: адениловому нуклеотиду ДНК соответствует уридиловый нуклеотид РНК, цитидиловому - гуаниловый и гуа-ниловому - цитидиловый. В молекулах РНК встречаются химически модифицированные (неканонические) нуклеотиды (см. здесь же, ниже: например, инозин антикодонов транспортных РНК). Их количество, как правило, невелико (минорные нуклеотиды), но в аланино-вой тРНК на их долю приходится 13%.
В отличие от репликации, когда обе полинуклеотидных цепи двойной спирали ДНК функционируют в качестве матриц, матрицей для образования РНК служит одна (матричная) полинуклеотидная цепь, комплементарная второй (кодогенной) цепи, на которой, собственно, и расположены гены (рис. 2.31). Таким образом, процесс транскрипции является асимметричным. Особенность матричной цепи ДНК состоит в том, что на ней формируется открытый для РНК-полимеразы 3'-конец.
На рис. 2.31 видно, что с учетом замены тимидиловых (Т) нуклео-тидов на уридиловые (У) последовательность кодонов и(м)РНК идентична последовательности триплетов кодогенной молекулы биспирали
ДНК.
В биосинтезе белков в эукариотических клетках задействованы три типа РНК: информационная (матричная), или и(м)РНК, рибосом-ные, или рРНК, и тРНК. Соответственно, в этих клетках имеется три РНК-полимеразы - I, II и III. РНК-полимераза I участвует в синтезе молекулы-предшественницы пре-рРНК, РНК-полимераза II - ключевой фермент в транскрипции структурных (смысловых) генов, кодирующих аминокислотные последовательности белков, а также

Рис. 2.31. Образование и(м)РНК на матричной цепи биспирали ДНК
нуклеотидные последовательности snoPHK и некоторых snRNA (англ. small nuclear RNA или малых ядерных РНК, см. здесь же, ниже). РНК-полимераза III участвует в транскрипции генов тРНК, некоторых snRNA и других преимущественно низкомолекулярных видов РНК. Отдельные РНК-полимеразы эукариот различают «свои» промоторы, чем объясняется транскрибирование ими разных видов РНК.
В прокариотических клетках функционирует одна РНК-полимераза. В стартовый мультибелковый ферментный комплекс входит диссоциируемая субъединица - фактор σ. Этот фактор находит нуклеотидную последовательность ДНК (промотор), создающую условия для начала синтеза РНК, обеспечивает, присоединяясь к ДНК, расхождение цепей биспирали на коротком протяжении и на одной из цепей строит РНК-олигонуклеотид длиной порядка 10 нуклеотидов. В этот момент фактор σ «покидает» стартовый комплекс, а процесс транскрипции при участии РНК-полимеразы переходит в фазу элонгации (наращивания) строящейся молекулы РНК путем последовательного присоединения на ее 3'-конце рибонуклеозидтрифосфатов-предшественников. Процесс продолжается до момента, когда фермент, следующий вдоль матричной цепи ДНК, достигает кодона-терминатора.
Ориентированный на обеспечение общеклеточных и специальных функций внутриклеточный трафик биоинформации - многоступенчатый процесс. В нем выделяют перенос (транскрипция) информации, записанной в нуклеотидных последовательностях (сайтах, генах) ДНК, на пре-и(м)РНК транскрипт, посттранскрипционные изменения последнего, включающие процессинг пре-и(м)РНК транскрипта с образованием зрелой и(м)РНК, «выбраковку» и(м)РНК с ошибками (см. п. 2.4.5.7), транспорт и(м)РНК в цитоплазму, перенос (трансляция) с нее информации в процессе сборки на рибосомах (полисомах) полипептидов, посттрансляционные изменения, предусматривающие «выбраковку» дефектных полипептидов, транспорт белков в соответствующие внутриклеточные структуры или выведение их из клетки, образование вторичной, третичной (фолдинг) структуры белковых молекул и надмолекулярных мультимерных белковых комплексов (четвертичная структура). Одновременно на рДНК (см. здесь же, ниже) синтезируются молекулы пре-рРНК транскрипта, происходит их процессинг, транспортировка в цитоплазму с образованием там рибосом. Для того чтобы процесс трансляции пошел, необходимы также сервисные и регуляторные факторы (главным образом, белковые), ферменты, низкомолекулярные предшественники-аминокислоты, на-
бор необходимых тРНК. Процесс транскрипции, процессинга и ядерно-цитоплазматического транспорта и(м)РНК рассмотрен в деталях ниже (см. п. 2.4.5.5).
У эукариот образование рРНК (см. п. 2.4.3.3) происходит в зоне расположения кластеров соответствующих генов (рДНК, ядрышковые организаторы) одним блоком (45S пре-РНК транскрипт) и катализируется ферментом РНК-полимеразой I. В результате процессинга пре-рРНК транскрипта образуются молекулы 28S, 18S и 5,8S рРНК (см. рис. 2.20). Гены 5S рРНК транскрибируются отдельно ферментом РНК-полимеразой III. Особенностью рибосомных РНК является их относительное богатство гуаниловыми и цитидиловыми нуклеотидами. Во вторичной структуре рРНК много двухцепочечных участков и петель.
Транспортные РНК, или тРНК - это небольших размеров (не более 100 нуклеотидов, наиболее часто - 76) молекулы, напоминающие по форме в схематическом изображении клеверный лист (рис. 2.32). «Стебли» с петлями образуются благодаря внутреннему спариванию азотистых оснований. В функциональном отношении наиболее важны участки: З'-ЦЦА («гибкая рука») или акцепторный, к которому присоединяется аминокислота, и антикодоновый или триплет неспа-ренных нуклеотидов, спаривающийся с кодоном и(м)РНК.
Специфическое соединение («зарядка») тРНК со «своей» аминокислотой происходит в два этапа (рис. 2.33). На первом аминокислота взаимодействует с АТФ. Итогом является ее активация, то есть переход в высоко энергизированное состояние. На втором этапе такая аминокислота при участии фермента аминоацил-тРНК-синтетазы присоединяется к 3'-концу (акцепторному) тРНК с образованием ами-ноацил-тРНК или аа-тРНК. В этой форме аминокислота готова к участию в процессе трансляции.
Так как количество смысловых кодонов для отдельных аминокислот равно 61, логично предположить, что число разных тРНК такое же. На самом деле количество тРНК, хотя и выражается десятками (порядка 40 тРНК задействовано в биосинтезе белка в цитоплазме эукариотиче-ских клеток; в митохондриях используется 22 разных тРНК), но меньше названной цифры за счет того, что антикодон одной тРНК может узнавать несколько кодонов, правда, если они «шифруют» одну и ту же аминокислоту. Это обеспечивается механизмом неоднозначного спаривания или «качания» тРНК. Суть его состоит в том, что благодаря гибкости близлежащего к антикодону участка молекулы транспортной РНК третий нуклеотид антикодона, например У, взаимодействует в ко-
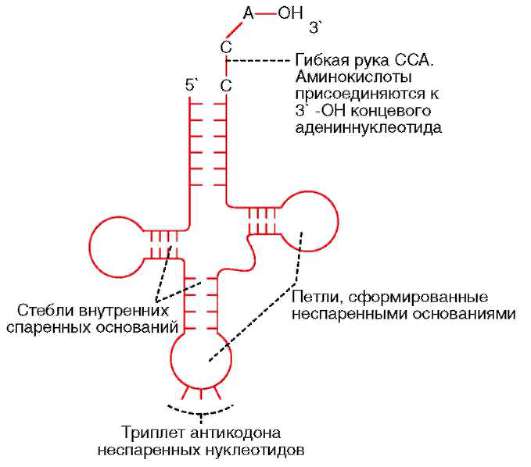
Рис. 2.32. Структура тРНК (клеверный лист) в схематичном изображении
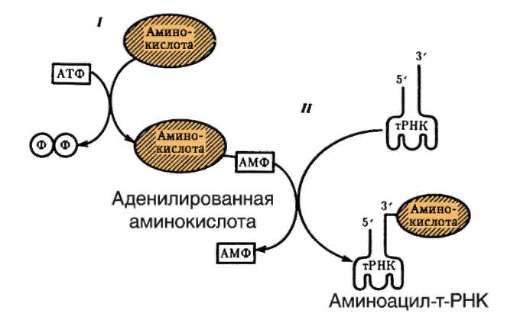
Рис. 2.33. Образование аминоацил-тРНК
доне не только с А (канонический вариант), но и с Г, а Г не только с Ц (канонический вариант), но и с У. Таким образом, один и тот же анти-кодон «3'ЦГГ5'» взаимодействует с кодонами «5'ГЦУ3'» и «5'ГЦЦ3'». Оба названных кодона соответствуют аминокислоте аланин. Для более
гибкого взаимодействия «антикодон тРНК - кодон и(м)РНК» анти-кодон нередко содержит нестандартное азотистое основание, в частности, гипоксантин (или инозин), узнающий Ц, У и А нуклеотиды кодонов (читается в направлении от 5' к 3'). Молекула тРНК связывается с кодоном одной аминокислоты, если третий нуклеотид анти-кодона (читается в направлении от 3' к 5') Ц или А, с кодонами двух аминокислот, если третий нуклеотид У или Г, и с кодонами трех аминокислот, если третий нуклеотид инозин. Молекулы тРНК образуются на матрице ДНК при участии фермента РНК-полимеразы III (также как
5S рРНК).
2.4.5.5. Внутриклеточное движение генетической (биологической) информации. Транскрипция и посттранскрипционные процессы. Транспорт и(м)РНК из ядра в цитоплазму
Транскрипция - процесс образования молекул РНК на матричной полинуклеотидной цепи двойной спирали ДНК (см. рис. 2.31). Среди РНК выделяют информационные, рибосомные и транспортные, принимающие непосредственное участие в биосинтезе белка, а также ряд других видов, главным образом, низкомолекулярных, выполняющих регуляторные, коценсусные и иные функции (РНК-праймеры при репликации ДНК - см. п. 2.4.5.3, snoRNA, участвующие в процессинге пре-рРНК транскрипта - см. п. 2.4.3.3). Если иметь в виду внутриклеточный трафик генетической (биологической) информации, то речь должна идти, прежде всего, об информационных (мессенджер; англ. messenger, см. п. 2.4.2) РНК - и(м)РНК.
Для осуществления транскрипции необходимо наличие, кроме ДНК-матрицы, пула предшественников (аденин-, гуанин-, цитозин- и урацилтрифосфатнуклеотиды) и соответствующего фермента (РНК-полимераза). Большая роль принадлежит условиям, определяющим доступ РНК-полимеразы к ДНК и модификацию структуры двойной спирали, «разрешающую» считывание информации, а также синтез молекулы РНК, начинающийся и завершающийся в определенных точках матрицы. Речь, по существу, идет о протяженности гена или, в более общем виде, транскрибируемого сайта ДНК, длина которой заведомо меньше длины молекулы ДНК в хромосоме. Избирательная транскрипция генов, в частности, связанная с выполнением дифференцированной клеткой синтезов для нужд многоклеточного существа («luxury proteins» см. п. 2.4.4.4-е), требует включения функционально-генетических элементов эукариотического генома в регуляторный контур организма.
Это обеспечивается отчасти специальными (сервисные, конценсусные, регуляторные) нуклеотидными последовательностями ДНК, а отчасти подключением белков - общих и специфических транскрипционных факторов, энхансеров, сайленсеров (см. здесь же, ниже). Транскрипция - матричный процесс, в котором выделяют стадии инициации, элонгации и терминации.
Представление о процессе считывания информации с ДНК дает знакомство со структурой транскриптона1 - единицы транскрипции у эукариот, включающей как собственно биоинформативную часть, так и элементы, необходимые для инициации, осуществления, терминации и регулирования образования требуемых и(м)РНК (рис. 2.34). Некоторые элементы транскриптона определяют свойства зрелых и(м)РНК, например, продолжительность их жизни в цитоплазме и, следовательно, длительность периода синтеза, то есть количество соответствующих полипептидов (см. п. 2.4.5.6).
Особенностью клеток многоклеточных эукариот является избирательность транскрипции генов (генетической активности сайтов ДНК): по месту - разные типы клеток, по времени - разные периоды и фазы клеточного цикла или онтогенеза особи, по интенсивности - изменения функционального состояния клеток.
Биоинформативная область транскриптона полностью транскрибируется. Вместе с тем, несмотря на то что названная область целиком транскрибируется, в ней присутствуют участки ДНК, которые далее (по ходу внутриклеточного потока биоинформации) транслируются или не транслируются. В большинстве, но не во всех эукариотиче-
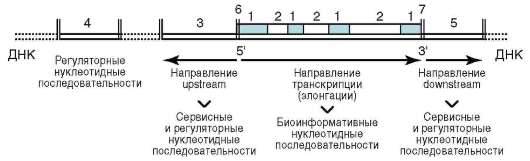
Рис. 2.34. Транскриптон эукариот (схема): 1 - экзоны (транскибируются, транслируются); 2 - интроны (транскрибируются, не транслируются); 3 - 5" нетранслируемая последовательность; 4 - энхансер (сайленсер); усиливающий (ослабляющий) сайт; 5 - 3" нетранслируемая последовательность; 6 - инициирующий кодон; 7 - кодон-терминатор (стоп-кодон)
1 В настоящее время термин «транскриптон» не употребляется широко и повсеместно. Тем не менее, он удобен, особенно в учебной литературе, своей конкретностью.
ских генах участки транскрибируемой части, транслируемые (экспрес-сируемые) в аминокислотные последовательности белка - экзоны, перемежаются с участками, нетранслируемыми (неэкспрессируемыми) в аминокислотные последовательности белка - интроны (см. также п. 2.4.5.5). Количество экзонов и интронов в генах варьирует. Так, в геноме людей относительно небольших размеров ген β-глобина гемоглобина протяженностью 2000 п.н. имеет 3 экзона, а более крупный ген фактора VIII свертываемости крови (его мутации приводят к развитию одной из форм гемофилии) протяженностью 200 тыс. п.н. - 26 экзонов. В геноме человека на долю экзонов приходится до 1,5% ДНК, на долю интронов - 24%. Гены основных (щелочных) белков хроматина гисто-нов лишены интронов.
Интрон/экзонный формат структуры генов порождает самостоятельную проблему процессинга пре-и(м)РНК транскрипта путем вырезания участков, соответствующих интронам, и точного воссоединения «конец в конец» (сплайсинг) участков, соответствующих экзонам. Для того чтобы исключить ошибки, границы интронов и экзонов представлены так называемыми конценсусными нуклеотидными последовательностями. В пре-и(м)РНК транскрипте подавляющее большинство участков, соответствующих интронам, начинается с последовательности ГУ и заканчивается последовательностью АГ. Предположительно, с такими «пограничными» конценсусными последовательностями соединяются специальные snRNA, являющиеся составным элементом рибонуклеопротеиновых частиц - сплайсосом. О важной роли кон-ценсусных последовательностей для точного сплайсинга говорит следующий пример. В пре-и(м)РНК транскрипте β-полипептида гемоглобина на 5'-конце интрона «Г» может быть заменен на «А», что ведет к искажению биоинформации сначала в зрелой β-глобиновой и(м)РНК, а затем через «дефектный» или отсутствующий β-глобиновый полипептид и в гемоглобине. Результат состоит в развитии одной из форм наследственной болезни человека β-талассемии, в клинический фенотип которой в качестве ведущего признака входит анемия.
Согласно распространенной точке зрения, интрон/экзонный формат организации генов эукариот возник в связи с необходимостью решать определенные задачи в рамках эволюционного процесса. В частности, благодаря такой организации и феномену альтернативного сплайсинга (см. здесь же, ниже) удается повысить информационную емкость генома без увеличения количества ДНК. Предположительно, 35-59% пре-и(м) РНК транскриптов в клетках млекопитающих и человека подвержены
альтернативному сплайсингу с образованием, в среднем, более двух разных зрелых и(м)РНК. В качестве примера приведем и(м)РНК, возникающие вследствие альтернативного сплайсинга пре-и(м)РНК транскрипта гена α-тропомиозина, специфичные для разных типов клеток (рис. 2.35).
Наряду с названными выше, в состав транскриптона как функциональной единицы транскрипции включены так называемые не-транслируемые (хотя частично транскрибируемые) фрагменты ДНК, расположенные относительно биоинформативной части как с 5' (направление «вверх по течению», англ. upstream), так и с 3' (направление «вниз по течению», англ. downstream) ее конца, а также сайты, находящиеся на расстоянии сотен и тысяч пар нуклеотидов от биоинформативной части по обоим направлениям - upstream и downstream.
Важные в функциональном отношении нетранслируемые нуклео-тидные последовательности транскриптона расположены на 5'-конце матричной цепи биспирали ДНК перед точкой начала транскрипции (направление upstream). Они составляют область промотора. Функция промотора состоит в создании условий для инициации транскрипции, а также в регуляции некоторых параметров транскрипции, например, тканеспецифичности и скорости. Ключевой участник транскрипции и(м)РНК эукариот - РНК-полимераза II - не может самостоятельно взаимодействовать с биспиралью ДНК и, в частности, определить точку начала транскрипции. Предварительно с ДНК должны прореагировать белки - общие транскрипционные факторы . Это взаимодействие
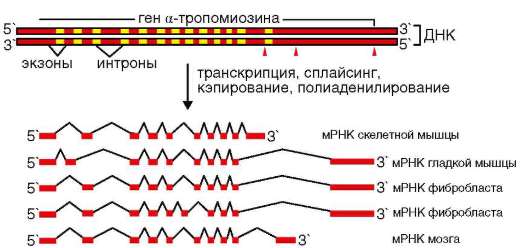
Рис. 2.35. Цитотипические и(м)РНК, образующиеся вследствие альтернативного сплайсинга пре-и(м)РНК-транскрипта гена α-тропомиозина
происходит в области промотора, имеющего в своем составе определенную нуклеотидную последовательность. В промоторах примерно 60% генов, транскрибируемых РНК-полимеразой II, - это «ТАТА»-последовательность, или ТАТА-бокс, располагающийся на расстоянии примерно 25 нуклеотидов от стартовой точки (инициирующего кодона). В остальных генах, но и в генах с последовательностью «ТАТА» присутствует последовательность «ЦААТ», либо выполняющая, либо способствующая выполнению функции последовательности «ТАТА». В рассматриваемой области транскриптона есть и другие знаковые ну-клеотидные последовательности. Важнейшая функция промотора, как уже говорилось, состоит в правильном позиционировании фермента РНК-полимеразы относительно точки инициации (начала) транскрипции. Вместе с тем 5'-нетранслируемая область и, в частности, зона промотора служит структурой, на базе которой собирается сложный мультимакромолекулярный регуляторный комплекс, обусловливающий такие параметры транскрипции, как ее скорость (в частности, благодаря взаимодействию с энхансерами и сайленсерами), а также избирательность процесса считывания биоинформации, включая тканеспецифич-ность (рис. 2.36). Среди образуемых эукариотическими клетками белков, выполняющих, прежде всего, биокаталитическую функцию, различают конститутивные и индуцибильные. Первые синтезируются клетками на постоянной основе, вторые - периодически по мере возникновения необходимости в конкретной биохимической реакции (или совокупности реакций). Наиболее часто индуцибильные ферменты образуются при появлении в клетке соответствующего субстрата, в метаболизме которого участвует данный фермент. Очевидно, что в отсутствии субстрата синтез такого фермента функционально бессмысленен. Понятно также, почему роль индуктора выполняет обычно молекула субстрата. Инду-цибильные синтезы являются правилом для прокариот и относительно редки у эукариот. С другой стороны, конститутивные белковые синтезы есть и у прокариот. Существует мнение, что для запуска транскрипции индуцибильных генов в эукариотических клетках существует самостоятельный механизм. Известно, что 5'-конец эукариотических и(м)РНК «кэпирован» (англ. CAP - шапка, колпачок), т.е. «прикрыт» нетранс-лируемым участком в виде метилированного гуанилового нуклеотида. В случае взаимодействия с участком ДНК, ответственным за кэпи-рование, соответствующего регуляторного белка (специфический транскрипционный фактор, см. комплекс цитозольных белков «теплового шока» с молекулой стероидного, например, полового гормона -
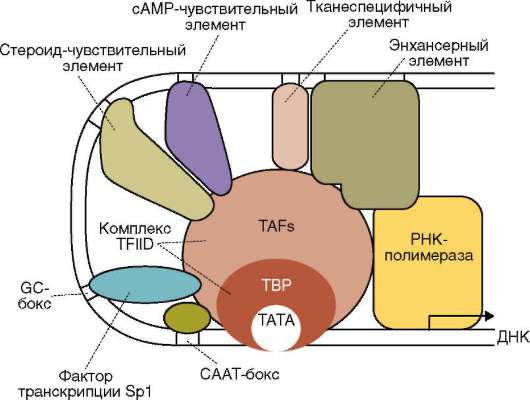
Рис. 2.36. Принципиальная структура инициаторно-регуляторного комплекса транскриптона эукариотической клетки (схема). TATA, ЦААТ, ГЦ - см. п. 2.4.5.5; TBP, TAFs, TFIID - мультибелковые комплексы
п. 2.4.3.1) запускается транскрипция генов индуцибильных белков. Согласно еще одной точке зрения, в запуске транскрипции индуци-бильных генов определенным своим фрагментом участвует область промотора. У высших многоклеточных животных функция индуктора выполняется нередко гормонами (стероидные половые - см. п. 2.4.3.1; адреналин - см. п. 2.4.2). В организме млекопитающих и человека индуцированные синтезы достаточно типичны для клеток печени, выполняющих, наряду с прочими, детоксицирующую функцию в отношении так называемых ксенобиотиков, например, инсектицидов, удобрений, некоторых лекарств. Соответствующие химические соединения, являясь индукторами, вызывают транскрипцию генов, контролирующих образование ферментов детоксикации, в частности, из семейства Р450.
Уточнение функционально-биоинформационной роли 5' (направление upstream, см. рис. 2.34) и 3' (направление downstream, см. рис. 2.34) нетранслируемых нуклеотидных последовательностей ДНК про-
должается. Некоторые сведения по указанному вопросу относительно 5'-участка изложены здесь же, выше, а относительно 3'-участка транскриптона приведены в п. 2.4.5.6-а и 2.4.5.7.
Таким образом, в структуре транскриптона как функционально-генетической единицы (единицы транскрипции) эукариотической клетки можно выделить располагающиеся компактно биоинформативную часть, характеризующуюся для большинства структурных генов интрон-экзонной организацией, а также 5' (направление upstream) и 3' (направление downstream) части. Нуклеотидные последовательности первой из названных частей участвуют в биоинформационном обеспечении фенотипа непосредственно, тогда как нуклеотидные последовательности двух других частей выполняют сервисные, конценсусные, регуляторные функции. Энхансерные и сайленсерные (см. п. 2.4.5.5-а) нуклеотидные последовательности выполняют регуляторную функцию. Они располагаются вне пределов транскриптона.
По завершении процессинга пре-и(м)РНК транскрипта молекулы и(м)РНК некоторое время остаются в ядре в составе особых рибону-клеопротеиновых частиц размером порядка 30S - ядерные информо-сомы. Кроме стабилизации структуры, соединение и(м)РНК с белками решает задачу ее перемещения из ядра в цитоплазму на ядерном отрезке «маршрута». Переход молекул и(м)РНК в цитоплазму происходит со сменой белков. Белковый компонент ядерных информосом остается в ядре, а присоединение к и(м)РНК цитоплазматических белков дает ци-топлазматические информосомы. В составе последних и(м)РНК сохраняются в цитоплазме клетки в течение часов и суток.
2.4.5.5-а. Регуляция генетической активности (транскрипции, экспрессии генов)
Для прокариот типичен полицистронный, а для эукариот моноци-стронный формат транскрипции или экспрессии генов (см. п. 2.4.5.6-б), что заставляет предполагать разные механизмы регуляции генетической активности у представителей подимперий доядерных и ядерных организмов (см. п. 1.9). Известно также, что в геномах прокариот преобладают гены, контролирующие индуцибильные белковые синтезы, тогда как в геномах эукариот большинство генов связаны с конститутивными белковыми синтезами (см. п. 2.4.5.5). Механизмы регуляции транскрипции названных категорий генов различаются.
Есть негативный (отрицательный) и позитивный (положительный) варианты регуляции активности индуцибильных генов (в общем виде,
регуляция транскрипции у прокариот). В случае негативного варианта связывание регуляторного белка с оператором блокирует работу оперо-на, а в случае позитивного варианта указанное связывание эту работу активирует. В качестве примера рассмотрим регуляцию активности генов (цистронов) лактозного оперона бактерии кишечной палочки (см. п. 2.4.5.6-б). Названный оперон (рис. 2.37) включает 3 цистрона или структурных гена Z, Y и A (экспрессируемые белки: β-галактозидаза, β-галактозидпермеаза и трансацетилаза), транскрибируемые на одну поли(3-х)цистронную и(м)РНК по сигналу с одного промотора. В зоне промотора находится регуляторная нуклеотидная последовательность, обозначаемая как ген-оператор. Пространственно вне связи с лак-тозным опероном находится еще одна регуляторная нуклеотидная последовательность, обозначаемая как ген-регулятор. Этот ген имеет собственный промотор и точку терминации транскрипции. Благодаря гену-регулятору в микробной клетке образуется белок-репрессор, который в отсутствие в среде лактозы, взаимодействуя с геном-оператором и блокируя, тем самым, продвижение к структурным генам РНК-полимеразы, выключает из функции лактозный оперон (негативный вариант регуляции). Выживание микроорганизмов в этом случае обеспечивается метаболизмом глюкозы. При появлении в среде молочного сахара, он, играя роль индуктора и взаимодействуя с белком-репрессором, препятствует соединению последнего с геном-оператором, снимая блокирующее действие. Оперон переходит в функционально активное состояние и структурные гены обмена лактозы транскрибируются. При существенном обеднении среды глюкозой, но при наличии таких сахаров, как лактоза, галактоза и арабиноза срабатывает позитивный вариант регуляции. Включается особый белок-активатор или БАК (англ. CAP - catabolite activator protein). Этот белок при наличии цАМФ взаимодействует с промоторами оперонов, ответственных за утилизацию в качестве альтернативных глюкозе источников энергии и углерода перечисленных выше сахаров, и, увеличивая сродство к РНК-полимеразе, активирует транскрипцию.
В геномах эукариот к категории генов, контролирующих индуци-бельные белковые синтезы, относятся, в частности, запускаемые стероидными половыми гормонами. Регуляторно-активирующее действие в данном случае состоит в изменении функциональных характеристик внутриклеточных транскрипционных факторов, находящихся в отсутствие гормона в репрессированном состоянии и лишенных, таким образом, возможности соединиться со специфическими сайтами ДНК и
а
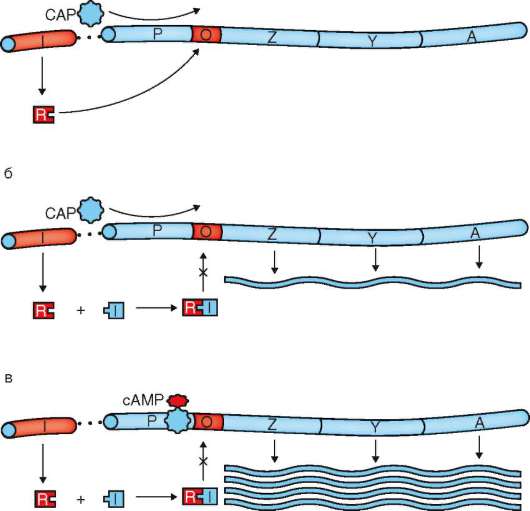
Рис. 2.37. Негативный и позитивный варианты регуляции транскрипции лак-тозного оперона кишечной палочки: а - в среде есть глюкоза, нет лактозы, лак-тозный оперон не транскрибируется; б - в среде снижен уровень глюкозы, есть лактоза, уровень цАМФ низкий; в - в среде нет глюкозы, в среде есть лактоза, галактоза и/или арабиноза, уровень цАМФ высокий; CAP - белок-активатор, Р - промотор, R - репрессор, I - индуктор (лактоза)
открыть их для транскрипции (см. п. 2.4.3.1 и рис. 2.9). В приведенном примере речь идет о позитивном варианте регуляции генетической активности. У эукариот описан также негативный вариант контроля транскрипции индуцибельных генов (см. здесь же, выше).
Регуляция транскрипции большинства генов эукариот, у которых преобладают конститутивные белковые синтезы, отличается разно-
образием механизмов и конкретных участников. Свою специфику в проблему регуляции генетической активности вносит многоуровневая структура аппарата наследственности эукариот (см. п. 4.3). В первом приближении механизмы регуляции генетических функций эукариоти-ческого генома делят на неспецифические и специфические.
К неспецифическим механизмам относят, прежде всего, те, в которых ведущая роль принадлежит изменениям плотности упаковки материала хромосом, феномену «компактизации-декомпактизации» этого материала, в частности, его гетерохроматизации. В качестве примера приводят хорошо известный еще классической (домолекулярной) генетике факт подавления генетических функций сайтов, находящихся рядом с гетерохроматизированными участками хромосом - «эффект положения» (см. п. 2.4.3.4-г - ингибирующий эффект теломерной ДНК, ослабевающий или снимаемый по мере укорочения теломер). Существование в эукариотическом геноме ДНК обязательно в виде нуклеогистонового комплекса, а также нуклеосомный принцип структурной организации этого комплекса может также рассматриваться, правда, с некоторыми оговорками (см. здесь же, ниже), как один из неспецифических механизмов регуляции генетической функции
ДНК.
Механизмы специфической регуляции генетической активности на уровне ДНК связывают с наличием в транскриптоне (см. п. 2.4.5.5) 5'-нетранслируемой области, особенностями структуры промоторов, наличием таких регуляторных сайтов, как энхансеры (усилители транскрипции, англ. enhance - увеличивать, усиливать) и сайленсеры (ослабители транскрипции, англ. silense - заглушать).
Значительное место в регуляции транскрипции у эукариот молекулярная биология отводит регуляторным белкам с общим названием транскрипционные факторы. Принципиальная черта последних заключается в их способности узнавать и связываться с определенными сайтами ДНК. Выделяют группу общих транскрипционных факторов и группу специфических транскрипционных факторов. Первые, как это вытекает из исследований регуляции транскрипции гена альбумина (ALB) в клетках печени млекопитающих, являются обязательными участниками мультигетеробелкового комплекса, образуемого в связи с «ТАТА»-последовательностью промотора, необходимого для функционирования РНК-полимеразы II и, следовательно, запуска транскрипции. Другие транскрипционные факторы из этой же группы, образуя комплекс с последовательностью «ЦААТ» промотора, влияют
на эффективность транскрипции. В области промотора названного гена есть знаковые сервисные и конценсусные нуклеотидные последовательности (PE, DEI, DEII и DEIII), связывающие специфические транскрипционные факторы. Так, последовательность РЕ, у мыши длиной 13 п.н., взаимодействует с тканеспецифическим белком печени HNF1. Функции специфических транскрипционных факторов состоят в активации промоторов различных генов.
Молекулы разных транскрипционных факторов различаются структурными особенностями (мотивами). На основании этих особенностей их группируют в семейства: белки «спираль-поворот-спираль», гомео-доменные белки, белки типа «лейциновой застежки-молнии» и «цинковые пальцы».
Важная роль в осуществлении транскрипционными факторами их функций принадлежит ядерному матриксу (см. п. 2.4.3.2). Есть данные о том, что транскрипционные факторы во взаимодействии с ядерным ма-триксом обеспечивают должное пространственное расположение промоторов генов и энхансерных участков.
В связи с проблемой регуляции транскрипции нельзя не назвать такой механизм, как химическая модификация ДНК, в частности, ее метилирование (обычно по 5-му углероду цитозинов). Присоединение метильных групп, с одной стороны, препятствует взаимодействию транскрипционных факторов с ДНК, а с другой - метилированные участки ДНК приобретают способность взаимодействовать с белками транскрипционными репрессорами. Метилирование цитозинов ДНК всегда ведет к подавлению генетической активности. К примеру, почти все гены инактивированной хромосомы Х (см. п. 2.4.3.4-в - тельце полового хроматина) в клетках женщин метилированы.
Многие стороны процесса регуляции генетической активности у эу-кариот далеки от понимания, что объективно создает трудности в описании конкретных механизмов.
Регуляция экспрессии генов осуществляется также на трансляционном и пост(после)трансляционном уровнях, в частности, путем изменения «времени жизни» зрелых и(м)РНК (см. п. 2.4.5.6-а).
2.4.5.6. Внутриклеточное движение биологической {генетической) информации. Трансляция и посттрансляционные процессы. Рибосомный цикл биосинтеза белка
Биосинтез белков в клетках эукариот осуществляется в цитоплазме на рибосомах (или, что более точно, на ассоциациях рибосом с и(м) РНК - полисомах, полирибосомах). Важнейшие задачи, решаемые рибосомой, состоят в создании условий, во-первых, для требуемого пространственного взаиморасположения участников образования белковых молекул и, во-вторых, для осуществления каталитических и регуляторных актов, необходимых для образования аминокислотных последовательностей, соответствующих последовательностям кодо-нов и(м)РНК. Процесс построения полипептида (трансляция), раз начавшись, идет, не прерываясь, вплоть до своего завершения. При этом субъединицы рибосом, тРНК, некоторые белки (например, выполняющие сервисные функции) вовлекаются в процесс неоднократно. Это дает основания говорить о «рибосомном цикле биосинтеза белка».
Главными участниками, объединяемыми пространственно на рибосоме, являются и(м)РНК, тРНК с энергетически активированной аминокислотой в виде аминоацил-тРНК или аа-тРНК («заряженная» тРНК), тРНК, несущая строящийся пептид (пептидил-тРНК). Нелишне подчеркнуть, что необходимая пространственная ориентация участников является непременным условием функциональной состоятельности трансляции. Действительно, если генетический код является неперекрывающимся, то начало считывания информации с и(м)РНК должно приходиться на строго определенный кодон. К примеру, кодирующая (транслируемая) область и(м)РНК начинается с последовательности -АУГ-УУУ-ААА-ЦЦЦ-ЦУГ- и соответствует пептиду: -Мет-Фен-Лиз-Про-Лей-. Допустим, что произошло выпадение первого А. Тогда нукле-отидная последовательность, выраженная в кодонах, примет вид -(А) УГУ-УУА-ААЦ-ЦЦЦ-УГ что соответствует пептиду: -Цис-Лей-Асп-Про- .... Таким образом, отклонение хотя бы на один нуклеотид вызывает сдвиг «рамки считывания», что, неизбежно приводя к изменению последовательности аминокислот, дает функционально «дефектные» полипептиды.
Приращение образуемого пептида происходит путем присоединения очередной аминокислоты, для чего необходимо взаимодействие аа-тРНК и пептидил-тРНК. Два названных участника должны занимать
друг относительно друга строго определенные пространственно близкие позиции, что и имеет место на самом деле.
Решение рибосомой необходимых задач обеспечивается наличием у нее функциональных центров:
• связывания и(м)РНК или М-центр;
• связывания пептидил-тРНК или П-центр;
• связывания аа-тРНК или А-центр;
• пептидилтрансферазный или ПТФ-центр, катализирующий перенос аминокислоты с аа-тРНК на пептидил-тРНК с образованием пептидной связи, а также участвующий в транслокации пептидил-тРНК из А-центра в П-центр.
М-центр расположен на малой субъединице, ПТФ-центр - на большой, аП-и А-центры имеют свои участки на обеих субъединицах (рис. 2.38). Из приводимой схемы видно, что центры находятся на контактирующих поверхностях субъединиц. В действующей рибосоме между названными поверхностями существует ряд полостей и углублений, в которых размещаются аа-тРНК, пептидил-тРНК, а также выделяются две бороздки. Одна из них удерживает растущую пептидную цепь, вторая - и(м)РНК.
Будучи матричным процессом, трансляция включает все необходимые фазы: инициации, элонгации и терминации. О важности фазы инициации уже говорилось. Первым шагом является присоединение и(м)РНК ее нетранслируемой 5' нуклеотидной последовательностью (см. рис. 2.34) к малой субъедице рРНК еще до сборки органеллы (рис. 2.39). При этом размещение инициирующего кодона после сборки рибосомы будет точно отвечать уровню участка П-центра на большой субъединице. У эукариот роль инициирующего принадлежит
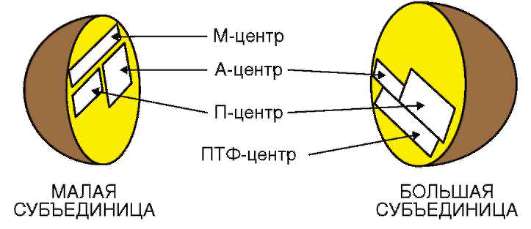
Рис. 2.38. Расположение функциональных центров рибосомы на субъединицах (схема)
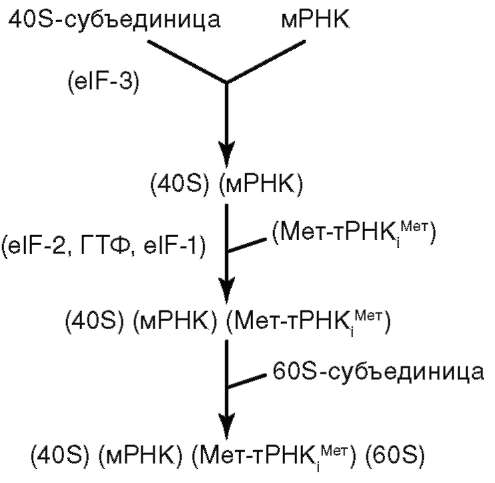
Рис. 2.39. Инициация трансляции: последовательность соединения главных участников
кодону аминокислоты метионина - АУГ. Это, однако, не означает, что все образуемые клеткой белки начинаются с этой аминокислоты. Реально полипептид «открывается» аминокислотой, кодируемой следующим триплетом. Метионин, конечно, встречается и во внутренних участках пептидов. Быть кодону метионина инициирующим или шифрующим положение соответствующей аминокислоты в полипептиде решается на уровне метиониновой тРНК. Таких тРНК в клетках две. Одна из них, маркируемая для удобства индексом «i», выбирает инициирующий кодон и(м)РНК. Имеет принципиальное значение, что в эукариотической клетке метионин образует два функционально разных комплексааа-тРНК: один используетсядляинициации - Мет-тРНКiМет, другой - для элонгации - Мет-тРНКiМет. Инициация трансляции требует участия белковых факторов eIF-1, eIF-2 и eIF-3 (eucariotic Initiation Factors): eIF-3 способствует образованию связи и(м)РНК с малой субъединицей и препятствует преждевременному присоединению большой субъединицы, eIF-2 участвует в связывании инициирующей аа-тРНК. В состав инициирующего комплекса входит также гуанозинтрифосфат (ГТФ), который, гидролизуясь до ГДФ и Pi (пирофосфат, неорганический фосфат), обеспечивает энергией, в частности, установку Мет-тРНКМет в П-центре и присоединение большой субъединицы. Таким образом, в дебюте трансляции инициирующая метиониновая аа-тРНК играет роль пептидил-тРНК. Из названных участников акта инициации окончательно не выяснена функция eIF-1. Возможно, этот фактор способствует объединению Мет-тРНКМет, eIF-2 и ГТФ. Представление о
расположении основных участников инициации белкового синтеза дает рис. 2.40.
У прокариот (а также в митохондриях) к метионину, связывающемуся с инициаторной тРНК, присоединяется формильная группа с образованием формилметионина, благодаря чему соответствующий комплекс обозначается как fМет-тРНКifМеt.
Фаза элонгации представляет собой циклический процесс, в ходе которого с каждым очередным «шагом» строящийся пептид удлиняется на один аминокислотный остаток. Суть происходящего сводится к тому, что соответствующая аа-тРНК узнает находящийся в данный момент в А-центре кодон и(м)РНК, комплементарный ее антикодону, и занимает требуемое место на рибосоме (рис. 2.41). Благодаря закономерным пространственным отношениям акцепторные зоны пептидил-тРНК (в П-центре) и аа-тРНК (в А-центре) вместе с находящимися в связи с ними аминокислотами оказываются в каталитическом ПТФ-центре, где между аминокислотами образуется пептидная связь. Присоединение к пептиду новой аминокислоты происходит без энергозатрат. Строящийся пептид, увеличивший свою длину на один аминокислотный остаток, переносится из П-центра в А-центр - пептидилтрансферазная реакция. Таким образом, этот пептид оказывается присоединенным к аа-тРНК А-центра, которая теперь с полным основанием может рассматриваться как новая пептидил-тРНК. В элонгации пептида участвует свой набор белковых факторов - EF-1u и EF-1s (англ., Elongation Factors). Первый из них при участии EF-1s организует сборку комплекса аминокислота-тРНК (аа-тРНК) и ГТФ и вместе с комплексом достигает рибосомы. Обратите внимание, что упомянутые факторы элонгации выполняют функции, сходные с теми, которые характеризуют факторы eIF-2 и eIF-1 фазы инициации. Если антикодон тРНК комплементарен
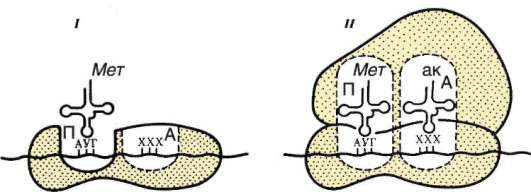
Рис. 2.40. Инициация трансляции: взаиморасположение главных участников
кодону и(м)РНК в А-центре, то аа-тРНК занимает место в названном центре, ГТФ гидролизуется до Рi и ГДФ с выделением энергии и вместе с EF-1u покидает рибосому.
Хотя местом прикрепления к рибосоме пептидил-тРНК на этом этапе является А-центр, собственно пептидильный фрагмент, предположительно, располагается в зоне П-центра,
что создает стерическое напряжение. Следующим событием является происходящее также с участием каталитического ПТФ-центра и, возможно, с учетом отмеченного напряжения перемещение (трансфер) новой пептидил-тРНК из А-в П-центр. Не исключено, что перемещающийся в область П-центра комплекс пептидил-тРНК, благодаря своей связи через тРНК с «реализованным» кодоном тянет последний также в зону П-центра. Реально это воспринимается как перемещение рибосомы относительно и(м) РНК в направлении ее 3'-конца на один «шаг» (эквивалентен одному кодону или триплету) с экспозицией в зоне А-центра очередного кодона, который будет опознан антикодоном следующей аа-тРНК. тРНК, ранее связанная с П-центром, освобождается и через E-участок (англ., exite) этого центра возвращается в цитоплазму. Здесь она может быть ис-
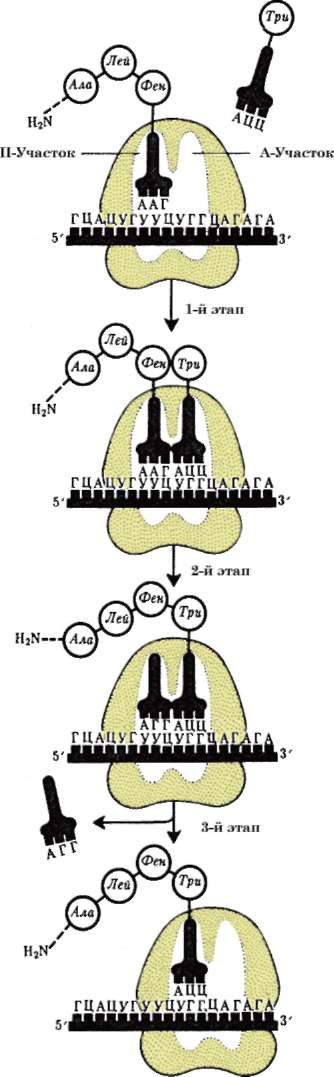
Рис. 2.41. Фаза элонгации трансляции: основные этапы. 1-й этап - аминоацил-тРНК присоединяется к кодону в А-центре; 2-й этап - между аминокислотами вА-и П-центрах (пептидил-тРНК) образуется пептидная связь; тРНК П-центра освобождается от аминокислоты (пептида) и покидает рибосому; 3-й этап - рибосома перемещается по и(м)-РНК на один кодон так, что тРНК, нагруженная пептидной цепочкой, переходит из А-центра в П-центр; свободный А-центр может быть занят соответствующей аа-тРНК
пользована в новых аа-тРНК. В возвращении пептидил-тРНК в область П-центра участвуют с каталитической функцией белковый фактор элонгации EF-2 - транслоказа и ГТФ как донор энергии.
Описанный процесс продолжается до момента, когда в А-центре рибосомы окажется терминирующий кодон, для которого не существует тРНК - УАА, УАГ или УГА, что соответствует наступлению фазы тер-минации (завершения) трансляции (рис. 2.42). Указанные кодоны узнаются белковыми факторами освобождения или терминации eRF (eucariotic Releasing Factors). Их два: один служит для соединения с триплетами УАА и УАГ, второй - с триплетами УАА и УГА. Вследствие соединения фактора терминации со «своим» кодоном в зоне ПТФ-центра возникает гидролазная активность, разрушающая связь между тРНК и пептидом. Полипептид, тРНК и и(м)-РНК покидают рибосому, субъединицы которой, диссоциируя, поступают в цитоплазму и могут быть использованы в синтезе белка повторно.
Процесс трансляции у эукариот носит характер «конвейера»: на одной и(м)РНК одновременно строится несколько идентичных пептидов. Это означает, что на нетранслируемом 5'-участке одной и той же информационной РНК последовательно оформляются инициаторные комплексы, собираются функционирующие рибосомы и синтезируются полипептиды. Рибосомы, связанные с одной и(м)РНК, образуют полисому (полирибосому). Смысл полисомного формата белкового синтеза понятен и заключается в повышении производительности процесса.
Представление о некоторых параметрах полисомного «конвейера» дают данные по трансляции глобиновых и(м)РНК в ретикулоцитах (клетки - непосредственные предшественницы зрелых эритроцитов млекопитающих, в том числе человека). Для названного объекта среднее расстояние между рибосомами в полисоме равно примерно 80 нуклео-тидам. Так как длина кодирующей (транслируемой) части указанных РНК составляет порядка 430 нуклеотидов, нетрудно подсчитать, что соответствующая полисома содержит 5-6 рибосом. У эукариот рибосомы перемещаются относительно и(м)РНК со средней скоростью до 15 ну-клеотидов в секунду. В таком случае скорость включения аминокислот в строящийся пептид составляет примерно до 5 аминокислотных остатков в секунду. При скорости элонгации в 1-2 аминокислотных остатка в секунду продолжительность трансляции глобиновой и(м)РНК оценивается в 2 мин.
Для осуществления специфической функции образовавшийся полипептид, если он относится к белкам «домашнего использования», дол-
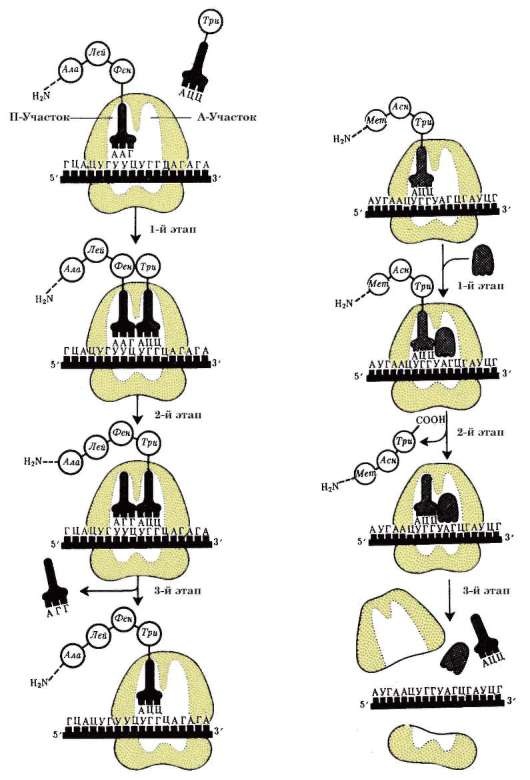
Рис. 2.42. Завершение (терминация) образования полипептида на рибосоме. 1-й этап - присоединение фактора терминации к нонсенс(стоп)-кодону; 2-й этап - высвобождение завершенного синтезом пептида; 3-й этап - диссоциация рибосомы на субъединицы
жен быть адресно доставлен в соответствующую клеточную структуру (лизосома, митохондрия, пероксисома, ядро) или, если этого требует выполняемая им функция (например, трипсиноген, образуемый эк-зокринными клетками поджелудочной железы), выведен из клетки. Примеры механизмов, с помощью которых решаются обозначенные выше задачи, приведены в пунктах 2.4.4.4-а, 2.4.4.4-б, 2.4.4.4-д.
Процесс трансляции в митохондриях во многом сходен с таковым прокариотической клетки.
2.4.5.6-а. Механизмы регуляции продолжительности существования в цитоплазме зрелых и(м)РНК: цитофункциональный аспект
В клеточной биологии проблема регуляции количества элементарного конечного продукта внутриклеточного потока биологической (генетической) информации - полипептида (простого белка) - воспринимается как важная. Тем более она важна для медицины, поскольку количественная дисрегуляция белковых синтезов может стать причиной развития патологических состояний. Известны примеры генетических патологий, фенотипически проявляющихся в чрезмерном накоплении в клетках веществ из-за того, что при нормальных параметрах их образования вследствие «дефектности», например, лизосомальных ферментов они не разрушаются (сфинголипиды при болезни Тея-Сакса, гликоген при болезни Помпе - см. п. 2.4.4.4-в). Нет оснований исключать возможность развития клеточной патологии подобного рода в результате функционально неадекватной интенсификации или неоправданно пролонгированного во времени синтеза белков.
Хотя известны генетические механизмы количественной регуляции РНК-овых и белковых синтезов, реализуемые на уровне генетического аппарата клеток (кластерная организация генов рРНК и тРНК, гисто-новых белков - см. п. 2.4.3.4-д; феномен эу- и гетерохроматизации - см. п. 2.4.3.4-в; политенные хромосомы клеток слюнных желез некоторых насекомых, хромосомы типа «ламповых щеток» в овогенезе некоторых позвоночных и амплификация генов рРНК в овогенезе амфибий, полиплоидизация соматических клеток млекопитающих, см. п. 2.4.3.4-а), главные события количественной регуляции белковых синтезов молекулярная и клеточная биология относят к процессу трансляции и связывают прежде всего со стабильностью и, таким образом, «временем жизни» и(м)РНК.
Описаны разные механизмы регуляции стабильности и, следовательно, длительности существования в цитоплазме и участия в белковых
синтезах и(м)РНК. Структура тубулиновой и(м)РНК дестабилизируется, например, при наличии в цитоплазме свободных мономеров тубули-на (конкретный механизм неизвестен). В нетранслируемой З'-области и(м)РНК, ответственной за образование рецепторного белка транс-феррина, участвующего в транспорте в клетки железа, есть группа из 5 «шпилечных» петель - железочувствительный элемент IRE (англ. iron-responsive element). При отсутствии железа к IRE присоединяется белок, что стабилизирует трансферриновую и(м)РНК: время образования рецептора и, следовательно, его количество в клетке возрастают, обеспечивая поступление железа в требуемом объеме. Правилом для многих короткоживущих и(м)РНК является наличие в З'-нетранслируе-мых участках «нуклеотидных последовательностей нестабильности» - богатых аденином и урацилом элементов - AURE (англ. adenine/uracil-rich elements), с которыми, возможно, соединяются определенные регу-ляторные белки. Почти все (исключение составляют матричные РНК гистонов) зрелые и(м)РНК имеют на З'-конце фрагменты из меньшего или большего количества адениловых нуклеотидов - так называемый полиадениловый (поли-А) «хвост». Соединение с указанным «хвостом» определенного белка стабилизирует и(м)РНК, а деаденилирование нередко происходит перед ее распадом. Нуклеотидные последовательности ДНК, ответственные за наличие в пре-и(м)РНК транскриптах, а затем в зрелых и(м)РНК полиадениловых «хвостов», IRE, AURE и т.п. находятся в З'-нетранслируемом районе транскриптона (направление downstream, см. п. 2.4.5.5).
2.4.5.6-6. Биосинтез белков в прокариотической клетке
Белковый синтез в клетках прокариот организован в принципе так же, как у эукариот. Однако есть ряд отличий. Так, речь идет о меньших размерах рибосомы (70S) и строящих ее субъединиц (50S и 30S). Основу большой субъединицы прокариотической рибосомы составляют молекулы рРНК двух (отсутствует 5S рРНК), а не трех разных типов. Количество рибосомальных белков меньше - З4 в большой и 21 в малой субъединице. Некоторые различия существуют в наборе белковых факторов инициации, элонгации и терминации трансляции.
Определенные особенности биосинтеза белков у прокариот заслуживают специального внимания. Для прокариот характерен полици-стронный формат, в соответствии с которым образование конкретных пептидов жестко сопряжено во времени, т.е. происходит одним блоком (оперон) с группы генов (цистронов), контролирующих образова-
ние белков, ответственных за необходимые стадии (стороны) одного функционально-метаболического пути или цикла. Так, лактозный опе-рон (lac-оперон) микроорганизма кишечной палочки (E. coli), дающий бактерии возможность при отсутствии глюкозы утилизировать лактозу (молочный сахар), имеет три цистрона (гена). Их одновременные активация и экспрессия (транскрипция и трансляция) необходимы в силу того, что один из цистронов контролирует образование ключевого фермента β-галактозидазы, катализирующего гидролиз β-галактозида лактозы до глюкозы и галактозы, второй - образование транспортного белка β-галактозидпермеазы, обеспечивающего проникновение лактозы в микробную клетку, третий - синтез белка галактозидтрансацетила-зы, защищающего бактерию от неметаболизирующихся, потенциально токсичных β-галактозидов. Каждая из образующихся вследствие транскрипции блока взаимосвязанных цистронов (генов) и(м)РНК имеет собственный инициирующий трансляцию участок и кодон-терминатор. В качестве инициирующего участка выступает находящаяся на 5'-конце нуклеотидная последовательность Шайна-Дальгарно, связывающаяся с 16S-рРНК малой субъединицы. Эта последовательность отсутствует у эукариот, у которых соответствующую роль выполняет, по-видимому, «кэпированный» метилированным гуаниновым нуклеотидом участок нетранслируемой 5'-последовательности и(м)РНК. После присоединения этим участком известных белков осуществляется связь и(м)РНК и малой (40S) субъединицы бактериальной рибосомы. Одновременно транскрибируемые и далее транслируемые в белки цистроны составляют единый функционально-генетический блок - оперон с единым механизмом регуляции, поскольку выпадение синтеза хотя бы одного белка делает всю ситуацию функционально бессмысленной. Полици-стронный формат генетического обеспечения клеточных функций характеризует синтез так называемых индуцируемых (индуцибильных) белков, прежде всего ферментов, непременным условием образования которых клеткой должно быть наличие соответствующего субстрата (в рассмотренном примере молочный сахар).
Для эукариот типичен моноцистронный формат организации белкового синтеза с соответствующими регуляторными механизмами, хотя индуцибильные гены у них также имеются.
В инициации трансляции у прокариот участвует химически модифицированный метионин - формилметионин. Функциональный резон этого события неясен. У прокариот имеет место сопряжение транскрипции и трансляции. В частности, трансляция у них осуществляет-
ся на фрагментах и(м)РНК без утраты их связи с ДНК, т.е. при идущей транскрипции. Белокобразующий комплекс прокариот, таким образом, представлен кольцевой молекулой ДНК, перемещающейся по ней РНК-полимеразой, фрагментом синтезируемой и(м)РНК, продвигающимися по этому фрагменту рибосомами, строящимся пептидом.
2.4.5.7. Надежность внутриклеточного потока биологической (генетической) информации. «Контроль качества» и(м)РНК и белков
В пункте 2.4.5.3-а обсуждалась проблема сохранности и минимизации искажений содержания биологической (генетической) информации на уровне ДНК, а также в связи с передачей этой информации в ряду клеточных поколений (репликация ДНК). Обращает внимание наличие целого комплекса соответствующих факторов и механизмов. Вследствие их совокупного действия по завершении процесса самоудвоения (самокопирования) ДНК в геноме остается 1 ошибка на 109-1010 спариваний нуклеотидов. Можно предположить, что существуют механизмы, снижающие возможность появления и/или сохранения функционально «дефектных» биоинформационных полимеров на таких этапах внутриклеточного потока генетической информации, как транскрипция, процессинг пре-РНК транскриптов, трансляция, пост(после)трансляци-онные события.
Общий итог известен: один «дефектный» полипептид приходится на 104 образуемых клеткой.
Ведущее место в стратегии гарантии требуемого качества на названных этапах внутриклеточного потока биоинформации занимают, видимо, не «профилактика» искажений или, если уж они возникают, их устранение с восстановлением «правильного» текста (восстановление содержания, смысла), а детекция и селективное (избирательное) разрушение функционально неполноценных продуктов. Тем не менее в эволюции эукариотической клетки возникли механизмы защиты нукле-отидных последовательностей и(м)РНК от разного рода агрессивных воздействий, в частности ферментных (нуклеазы). Соответствующие функции выполняют «кэп» на 5'-конце и предположительно поли-А участок на З'-конце молекулы. Свой вклад вносят, по-видимому, белки, комплексирующиеся с и(м)РНК в ядре (ядерные информосомы) и цитоплазме (цитоплазматические информосомы).
С другой стороны, известны механизмы ликвидации и(м)РНК путем их деградации. Понятен «биоинформационный резон» раз-
рушения и(м)РНК в случае «неправильного» размещения в них кодонов-терминаторов (англ. nonsense-mediated RNA decay или NMD; синоним - mRNA surveillance). Ориентиром для ферментов, осуществляющих контроль функционального соответствия информационных (матричных) РНК, является присутствие по ходу транскрипта ниже места расположения кодона-терминатора (направление downstream) нетранслируемой нуклеотидной последовательности. В «контроле качества» и(м)РНК принимают участие ядерные структуры - экзосомы (англ. exosomes; аналог деградом (degradosomes) бактериальных клеток). Они, по-видимому, осуществляют мониторинг степени аденилирования транскрипта непосредственно перед тем, как и(м)РНК покинет ядро. И(м)РНК, «несостоятельные» по поли-А-«хвосту», разрушаются.
Выше указывалось на роль тРНК в правильном подборе аминокислот и важность для получения функционально полноценного результата адекватного пространственного взаиморасположения участников рибосомного цикла синтеза полипептидов (трансляция). Тем не менее в эволюции возникли способы молекулярной детекции и «мечения» полипептидов, подлежащих деградации. В одном из них участвует небольших размеров белок убиквитин, образуемый только клетками эукариот, узнающий соответствующий полипептид по N-концевой аминокислоте. В детекции могут принимать участие белки-шапероны (см. п. 2.4.4.4-д). «Выбраковке» и деградации подлежат белки с ошибочно включенными аминокислотами, что обычно сказывается на их фолдинге, химически поврежденные, а также «старые» молекулы. Основная роль в деградации белков принадлежит лизосомам (см. п. 2.4.4.4-в). Существуют также внелизосомные механизмы, например протеасомный (см. п. 2.4.1). Сбои в механизмах деструкции функционально «несостоятельных» полипептидов приводят у людей к тяжелой патологии (см. п. 2.4.8).
Важно помнить о функциональном аспекте деградации белков, образуемых эукариотической клеткой, среди которых есть как долгоживущие (гемоглобин), так и короткоживущие (многие регуля-торные белки). Время полужизни (период полураспада) нормально работающих белков колеблется от минут до суток и более. Особого внимания заслуживает распад белков мышечной ткани при голодании, направленный на высвобождение аминокислот с их использованием для поддержания энергетики организма (через механизм глюконеогенеза). Без такого распада человек не мог бы пережить голодание свыше 24 ч.
Напомним, что биоинформационный сегмент в мире жизни представлен первичными ДНК-текстами, а также вторичными РНК- и белковыми текстами. Складывается впечатление, что эволюционная стратегия в отношении базовых генетических текстов (ДНК) отдавала предпочтение выработке механизмов защиты, сохранения исходной «биологически правильной» и исправления возникающих искажений, тогда как в отношении РНК- и белковых текстов, в случае появления искажений, вполне допускались их уничтожение и замена биоинформационно полноценными путем нового синтеза.
2.4.6. ВНУТРИКЛЕТОЧНЫЙ ПОТОК ЭНЕРГИИ
Поток энергии у представителей разных групп ныне существующих организмов обеспечивается различными механизмами энергообеспечения - фотоили хемосинтезом, брожением, дыханием.
2.4.6.1. Дыхательный обмен
Центральная роль в биоэнергетике клеток высших организмов принадлежит дыхательному обмену. В наиболее общем виде он включает реакции расщепления низкокалорийного органического «топлива» в виде глюкозы (гликогена), жирных кислот (жиров), аминокислот (белков) и использование выделяемой при этом энергии для образования универсального высококалорийного клеточного «топлива» - АТФ. Энергия АТФ, непосредственно или будучи «зарезервированной» в других макроэргических химических соединениях (креатинфосфат мышечной ткани), преобразуется в тот или иной вид работы - химическую (синтезы), осмотическую (поддержание градиентов или перепадов концентрации веществ), электрическую (поддержание градиентов и движения зарядов), конструктивную (сборка микротрубочек из субъединиц тубулина), механическую (мышечное сокращение, внутриклеточное перемещение структур), регуляторную (рис. 2.4З).
Макроэргическим называют соединение, в химических связях которого содержится энергия в форме, доступной для использования в биологических процессах. Универсальным соединением такого рода служит АТФ. Высвобождение значительных количеств свободной энергии (около З0,5 кДж/моль на связь) происходит при гидролизе как третьей, так и второй концевых фосфатных групп молекулы АТФ. Это дает формальное основание обе фосфатные группы рассматривать как высокоэнергетические (макроэргические). В реальной биоэнергетике,
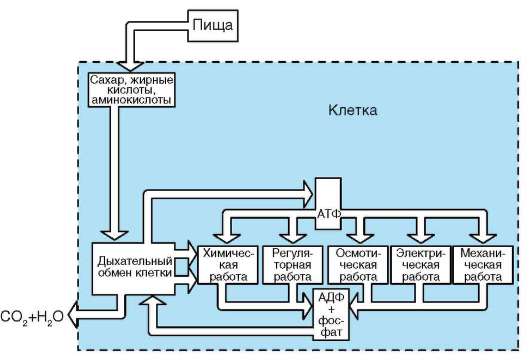
Рис. 2.43. Поток энергии в клетке
благодаря невозможности диффузии в клетку извне и, как следствие, необходимости постоянного внутриклеточного образования АТФ, самостоятельное значение имеет кругооборот, включающий гидролиз АТФ до АДФ (энергообеспечение проявлений жизнедеятельности) с оперативным ресинтезом АТФ из АДФ (аденозиндифосфорная кислота) и Pi (неорганический фосфат, пирофосфат). Таким образом, исключительная роль в энергообеспечении процессов жизнедеятельности отдана третьей фосфатной связи АТФ.
Особое место в дыхательном обмене принадлежит основному веществу (матриксу) цитоплазмы и митохондриям, что может быть проиллюстрировано на примере окисления глюкозы, которое в полном объеме состоит из трех этапов. Первый из них - анаэробный гликолиз - заключается в частичном расщеплении сахара и происходит в основном веществе цитоплазмы. Вследствие неполного окисления на этом этапе извлекается не более 10% энергии, содержащейся в исходном «топливе». При достаточном притоке к клеткам кислорода конечные продукты первого этапа окисления глюкозы в виде аниона пировиноградной кислоты (пируват) и восстановленной формы нико-тинамидадениндинуклеотида (NADH) поступают в митохондрии, где
окисляются - первое до СО2 и H2О, а второе до NAD+ (аэробный гликолиз) с извлечением оставшейся энергии. В случае недостаточного притока кислорода, в частности, на фоне повышенных функциональных запросов (мышцы в начальной стадии реакции тревоги - частота сердечных сокращений еще не возросла в требуемой степени, а энергопотребности увеличены) NADH тут же в основном веществе цитоплазмы окисляется пируватом до NAD+, который необходим для поддержания первого (анаэробного) этапа гликолиза. Одновременно образуется анион молочной кислоты (лактат), который током крови переносится в печень, где используется для ресинтеза глюкозы (глю-конеогенез). Анаэробный гликолиз в связи с низким выходом АТФ на молекулу глюкозы является энергетически невыгодным. Однако у ряда организмов (дрожжи) ему принадлежит исключительное место. То же можно сказать и о некоторых типах клеток многоклеточных организмов, в частности эритроцитах, лишенных митохондрий. Возвращаясь к дрожжам, отметим, что в них в связи с неполным ее окислением накапливаются значительные запасы глюкозы. Последняя расщепляется с образованием спирта и углекислоты.
В клетках с полным окислением глюкозы образовавшийся на первом этапе пируват поступает в матрикс митохондрий. Здесь он подвергается окислительному (два электрона отдаются NAD+) декар-боксилированию (потеря карбоксильной группы) с переносом образовавшейся ацетильной группы на кофермент(коэнзим)А и в виде ацетил-кофермента(коэнзима)А (ацетил-СоА) включается в цикл лимонной кислоты (цикл трикарбоновых кислот, цикл Креб-са), составляющий содержание второго (аэробного) этапа гликолиза. Ацетил-СоА занимает ключевое положение во многих метаболических превращениях. Главная его функция связана с переносом ациль-ных остатков (двууглеродная конструкция) от различных по природе химических соединений в форме тиоэфиров, представляющих собой макроэргические соединения, в частности в цикл лимонной кислоты. Не вдаваясь в детали, заметим, что в процессе превращений пирувата в цикле лимонной кислоты также извлекается и запасается в виде АТФ определенное количество энергии. Дальнейшее извлечение энергии происходит на третьем этапе аэробного гликолиза, структурно связанного с внутренней мембраной митохондрий. Он заключается в переносе электронов (окисление) с восстановленных форм никотинамидаде-ниндинуклеотида (NADH) и флавинадениндинуклеотида (FADH2), образующихся на первых двух этапах, на кислород с образованием воды.
Указанный перенос осуществляется благодаря наличию электронно-транспортной цепи. Выделяемая при этом порциями энергия фиксируется в третьей фосфатной связи молекул АТФ, синтез которых из АДФ и неорганического фосфата с участием фермента АТФ-синтазы (фосфо-рилирование) также приурочен к внутренней мембране митохондрий. Сопряженные вместе окисление и фосфорилирование в митохондриях обозначают термином окислительное фосфорилирование. Третий этап аэробного гликолиза дает клетке основное количество молекул АТФ на исходную молекулу глюкозы. Суммарная производительность аэробного гликолиза с учетом того, что некоторое количество АТФ используется на месте в ходе описанных превращений, выражается цифрой 30-32 молекулы АТФ на молекулу глюкозы. Эффективность рассмотренного механизма энергообеспечения можно оценить по коэффициенту полезного действия. Для митохондрий он составляет 45-60%. Для сравнения: коэффициент полезного действия в современных двигателях внутреннего сгорания - 17%, в паровой машине - 8%.
Выход АТФ в митохондриях меняется с изменением проницаемости их внутренней мембраны для протонов. Максимальный выход АТФ соответствует ничтожной проницаемости, когда протоны буквально «вынуждены» проходить через фермент АТФ-синтазу. Описаны, однако, примеры, когда для решения специфических задач в названной мембране активно формируются протонные каналы. В такой ситуации процессы окисления, с одной стороны, и фосфорилирования АДФ до АТФ, с другой, разобщаются и АТФ не образуется. Вся выделяемая в этом случае энергия превращается в тепло. Описанный механизм работает, в частности, в клетках бурой жировой ткани (см. также 2.4.4.4.-д), чрезвычайно богатых митохондриями, в которых присутствует специальный белок терминоген. Функция последнего состоит в создании во внутренней мембране митохондрий протонных каналов, разобщении окислительного фосфорилирования и, как следствие, интенсификации теплопродукции. Образуемое таким образом тепло позволяет сохранять на требуемом уровне температуру тела новорожденных, отличающихся незрелостью механизмов теплопродукции и терморегуляции.
Обеспечение энергозатрат организма происходит за счет окисления не только глюкозы (гликогена), но также жирных кислот (жиров) и избыточного (относительно потребности в них белковых синтезов) количества аминокислот. Содержание второго и третьего этапов окисления жирных кислот и аминокислот совпадают с таковым для глюкозы: это превращения в цикле лимонной кислоты и окислительное
фосфорилирование. На первом этапе от молекул жирных кислот последовательно отщепляются по два углеродных атома, которые превращаются в ацетильную группу ацетил-СоА, поступающего в цикл лимонной кислоты. Аминокислоты на начальном этапе дезаминиру-ются (теряют аминогруппу), после чего их углеродные части используются для образования пирувата и/или ацетил-СоА, входящих далее в цикл лимонной кислоты.
Фосфорилирование той или иной макромолекулы, прежде всего белковой, заключающееся в переносе на нее фосфатных групп АТФ, обычно связывают с активацией функции, например каталитической. Известны примеры, когда фосфорилирование приводит к подавлению ферментативной активности. Так, фосфорилирование протеинкиназы Cdk2, участвующей в регуляции прохождения клеткой периодов G1 и S клеточного цикла, по остаткам аминокислоты треонина активирует фермент, а по остаткам аминокислоты тирозина угнетает.
2.4.6.2. Фотосинтез
В основе энергетики жизни лежат окислительно-восстановительные процессы. Многие из нынешних обитателей планеты относятся к гете-ротрофам. Источником энергии (реально, высоко энергезированных электронов) для них служат поступающие в организм в виде пищи органические вещества, отличающиеся повышенным энергетическим потенциалом. Использование указанного потенциала связано с процессом дыхания, в ходе которого соответствующие вещества, окисляясь и, следовательно, разрушаясь, отдают свои электроны, транспортируемые по дыхательной цепи митохондрий на кислород. Существенным результатом происходящих превращений является синтез ключевого элемента биоэнергетики - АТФ. В приведенной схеме обращают внимание два обстоятельства: во-первых, конечность запасов источника электронов - предсуществующей органики, во-вторых, необходимость в достаточном количестве свободного кислорода (эффективный акцептор электронов). Среди современного населения Земли известны формы, энергетика которых не связана с наличием в природе готовых органических веществ. Это хемоавтотрофы, использующие в качестве донора электронов при синтезе АТФ мощные восстановители, такие, в частности, как сероводород, выделяемый в мировом океане на больших глубинах в районах разломов земной коры (см. п. 1.4.4 - черные и белые «курильщики»). Однако и в этом случае есть проблема конечности запасов источника электронов
(H2S) для нужд биоэнергетики. Для «гарантированного» и устойчивого поддержания жизни во времени, оптимизации и создания высокоэффективных систем энергообеспечения жизнедеятельности организмов в эволюции возникает механизм фотосинтеза, обусловливающий стабильный кругооборот электронов и при этом отличающийся рядом принципиальных преимуществ. Во-первых, в нем задействован практически неисчерпаемый источник энергии - солнце, во-вторых, практически неисчерпаемый донор электронов - вода. И в-третьих, выделяющийся в ходе фотосинтеза кислород является практически неисчерпаемым акцептором электронов. Сказанное объясняет, почему фотосинтез рассматривается как одно из важнейших достижений эволюции жизни.
Фотосинтез определяют как процесс образования веществ, прежде всего органических (хотя и не только, см. О2), из неорганических за счет использования энергии солнечного света. Он осуществляется в специальных органеллах клеток зеленых растений - хлоропластах. Особенность последних - наличие пигмента хлорофилла.
Хлоропласты представляют собой структуры протяженностью 5-10 мкм и диаметром 2-4 мкм, ограниченные двойной мембраной, что соответствует симбиотической гипотезе их происхождения. Внешняя и внутренняя мембраны отличаются по своей проницаемости. Пространство, ограниченное внутренней мембраной, составляет строму органеллы. В клетках зеленых водорослей может быть всего по одному хлоропласту, тогда как в клетках высших растений их число обычно составляет 10-30, а в гигантских клетках палисадной ткани махорки - около 1000. Хлоропласты, так же как и митохондрии, имеют собственный аппарат биосинтеза белка, представленный ДНК, рибосомами, набором транспортных РНК. Этот аппарат по ряду существенных характеристик схож с соответствующим аппаратом прокариот, что также говорит в пользу симбиотической гипотезы происхождения. Специфично для хлоропластов присутствие в них особых образований, погруженных в строму, - гран. Они образованы уложенными наподобие столбика монет замкнутыми мембранными мешками - тилакоидами. В тилакоидах размещен хлорофилл, молекулы которого упакованы в тилакоидных мембранах в виде двух функциональных комплексов или фотосистем I и II. Фотосистемы представлены, с одной стороны, молекулами так называемого «обычного» (антенного) хлорофилла, улавливающего кванты солнечного света (фотоны), что переводит его в активированное (возбужденное) состояние в связи с перемещением электронов на энергетически более высокую атомную орбиту. С другой стороны, в них
обнаруживаются участки, представленные особыми комплексами хлорофилла с белками (реакционные центры), выполняющими функцию своеобразных «ловушек» высоко энергезированных электронов (в общем виде энергии). В реакционном центре электрон, находящийся на верхнем энергетическом уровне, передается акцептору, составляющему первое звено цепи переноса электронов. Эта цепь (комплекс цитохро-мов bf) - третья составляющая фотосистем.
Происходящий в хлоропластах фотосинтез представляет собой совокупность взаимосвязанных процессов, приводящих в конечном итоге к связыванию углекислоты, образованию сахаров и выделению кислорода. Обобщенная реакция фотосинтеза имеет следующий вид:
свет
nCO2 + nH2O - (CH2O)n + nO2 хлорофилл
Для осуществления необходимых синтезов на определенном этапе фотосинтеза образуются значительные количества АТФ.
В фотосинтезе различают световую и темновую фазы. Непременное условие первой - освещение растения (в природных условиях солнечным светом). Важным событием световой фазы, на которую приходится поглощение хлорофиллом световых квантов, является фотолиз воды, в ходе которого для дальнейших процессов мобилизуются электроны и протоны (атомы водорода Н+), образуется выделяемый в атмосферу кислород. В этой же фазе часть поглощенной световой энергии используется для синтеза АТФ, которая затем расходуется при образовании органических веществ. Хлоропласты - исключительно продуктивные производители АТФ. Выход макроэр-гического соединения в хлоропластах примерно в 30 раз превосходит его количество, образуемое митохондриями клеток того же растения. Еще один существенный результат световой фазы - восстановление NADP+ до NADPH, который далее играет роль восстановителя в реакциях синтеза углеводов. Фотосистемы I и II, а также цепь переносчиков электронов располагаются в тилакоидной мембране, тогда как образование углеводов происходит в строме хлоропласта. Последнее событие приурочено к темновой фазе. Обозначение указанной фазы как тем-новой не означает, что соответствующие процессы требуют отсутствия освещения. Эти процессы в полном объеме осуществляются и в листьях освещаемых растений. Принятое название подчеркивает, что для них нет необходимости в свете.
Организуя кругооборот электронов на основе использования энергии солнца, обеспечивая образование органических веществ из неорганических, обогащая атмосферу планеты кислородом, фотосинтез представляет собой один из безусловных факторов существования и развития (включая прогрессивную эволюцию живых форм) современной жизни. То, что фотоавтотрофы входили в биоту планеты с древнейших времен, доказывает обнаружение остатков хлорофилла (неразложившийся пигмент цианобактерий фикобилин) в породах, образование которых отстоит от наших дней на 3,1 млрд лет. Углерод заведомо органического происхождения (т.е. принимавший участие в фотосинтезе) со смещенным в сторону более легкого изотопа соотношением 12С и 13С обнаружен в породах из формации Исуа в Гренландии, возраст которых 3,8 млрд лет.
2.4.7. ВНУТРИКЛЕТОЧНЫЙ ПОТОК ВЕЩЕСТВ
Существование живых форм любого плана структурно-функциональной организации базируется на определенном наборе реакций образования, распада и модификаций структуры химических соединений различной природы, объединяемых понятием обмен веществ (метаболизм). Высокая степень упорядоченности обменных процессов дает основания говорить о внутриклеточном потоке веществ. Важнейшая характеристика этого потока, осуществляемого согласно своеобразному метаболическому «сценарию», - взаимосвязь (вплоть до взаимозаменяемости) и скоординированность превращений главных его участников - белков, жиров, углеводов. Указанные превращения идут в одних случаях достаточно простыми, в других - более сложными путями. Эти пути в их конкретном выражении у представителей разных групп живых существ могут не совпадать, однако главный принцип организации метаболизма - взаимосвязь и скоординированность отдельных блоков потока веществ - реализуется неукоснительно. Так, жирные кислоты, необходимые для синтеза липидов, через промежуточные продукты в виде пирувата и ацетил-СоА относительно просто образуются из глюкозы. Вместе с тем синтез последней непосредственно из жирных кислот в животной клетке исключен, вследствие невозможности превращения ацетил-СоА в пируват и затем в глюкозу. Если иметь в виду жиры в качестве источника пополнения в организме запасов глюкозы, то у животных для ее образования используется такой продукт гидролитического расщепления жиров, как глицерин. Сам же глицерин легко синтезиру-
ется из промежуточных метаболитов гликолиза. С другой стороны, растительные и бактериальные клетки, благодаря наличию в них наряду с циклом лимонной кислоты так называемого глиоксилатного цикла, способны направлять часть ацетил-СоА условно в «обратном» направлении по пути, дающему в итоге глюкозу.
Центральное место в интеграции различных блоков внутриклеточного обмена веществ принадлежит циклу лимонной кислоты. Через указанный цикл, образно называемый иногда «метаболическая мельница», проходит путь углеродных атомов (углеродных «скелетов») большинства соединений, служащих промежуточными продуктами синтеза и распада химических компонентов клетки. В нем происходит выбор пути превращения того или иного соединения, а также переключение обмена клетки с одного пути на другой, например, с углеводного на жировой. Таким образом, дыхательный обмен, составляющий основу внутриклеточного потока энергии у большинства живых форм, одновременно образует ведущее звено внутриклеточного потока веществ, объединяющего в единое целое жизненно необходимые метаболические пути превращения белков, углеводов, жиров, нуклеиновых кислот и др. (рис. 2.44).
2.4.8. ДРУГИЕ ВНУТРИКЛЕТОЧНЫЕ МЕХАНИЗМЫ ОБЩЕГО ЗНАЧЕНИЯ
Увязанные в единое целое потоки информации, энергии и веществ осуществляются непрерывно, составляя абсолютное условие существования клетки в качестве живой системы. Наряду с процессами, включенными в эти потоки непосредственно, клетки характеризуются рядом функциональных отправлений, которые также следует причислить к обязательным и жизненно важным. Нередко такие механизмы лишены специального структурного оформления в виде соответствующего типа органелл. Функциональное предназначение некоторых из них, что представляет непосредственный интерес для медицины, состоит в препятствии накопления балластных продуктов или в снижении вредоносных последствий от образования в ходе естественных внутриклеточных процессов побочных продуктов, характеризующихся в силу их химической природы разрушительным действием на клеточные структуры. Остановимся на некоторых из них.
Выше говорилось об уничтожении полипептидов с ошибочно включенными аминокислотами и «неправильным» фолдингом (см. п. 2.4.5.7).
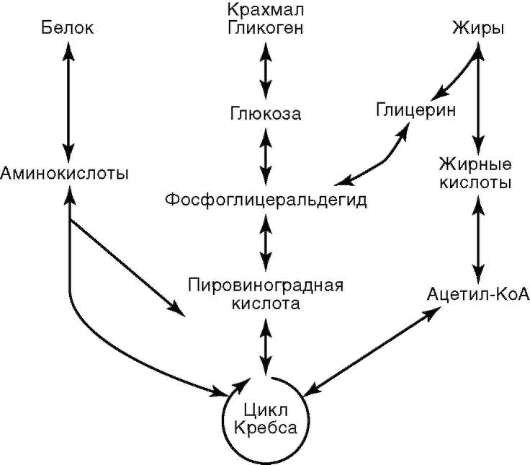
Рис. 2.44. Поток веществ в клетке
Лишь часть белков с аномальной конформацией разрушаются легко. Категория неразрушаемых аберрантных (аномальных, «неправильных») конформеров последовательно создает все более сложные белковые агрегаты. Последние по микротрубочкам перемещаются в область центра их организации (см. п. 2.4.4.4-ж), где, связываясь с белками распадающихся промежуточных микрофиламентов, образуют так называемые агреасомы. Указанным структурам приписывают защитную функцию связывания и, таким образом, блокирования вмешательства белков с «неправильной» третичной структурой в ход внутриклеточных процессов. Вместе с тем их избыточное накопление служит причиной гибели клеток, в частности нервных, при таких нейродегенеративных заболеваниях, как болезнь Паркинсона, боковой амиотрофический склероз. При болезни Паркинсона конкретно речь идет о нарушении метаболизма белка α-синуклеина. Хотя его функция однозначно не установлена, на него приходится примерно 1% всех белков нервной ткани. Сборка α-синуклеина в форме фибриллярных структур предшествует образованию специфических для рассматриваемого заболевания включений,
накапливающихся в цитоплазме нервных клеток - телец Леви, в образовании которых принимают участие промежуточные микрофиламенты и агреасомы. Мутантный α-синуклеин на 33-42% снижает протеолити-ческую активность ферментов протеасом. Предположительно это обстоятельство не дает агреасомам выполнить свою защитную функцию. Напротив, они становятся источником накапливающегося балластного материала, приводящего в конечном итоге к клеточной гибели.
Возможны и другие механизмы, связанные с нарушением детекции и адресной доставки дефектного (балластного) материала к месту его уничтожения. В некоторых случаях с помощью генноинженерного подхода реальна активная коррекция путем исключения образования нежелательного внутриклеточного балласта. Так, в первом десятилетии текущего XXI столетия американские ученые получили линию трансгенных мышей с «омоложенной» печенью, которые даже в очень продвинутом возрасте (22-26 месяцев) при добавлении в пищу нежелательных (вредных) примесей осуществляли высокоэффективную детоксикацию последних благодаря возможности адекватного синтеза лизосомальных рецепторов к белкам-шаперонам, адресно доставляющим дефектные (вредные) молекулы к лизосомам печеночных клеток с целью их уничтожения.
Переход от анаэробного (бескислородного) обеспечения жизнедеятельности организмов энергией к аэробному, в котором в качестве акцептора электронов задействован кислород, стал одним из решающих достижений эволюционного процесса. Однако, как в любом механизме, в работе митохондриальной цепи переноса электронов иногда происходят сбои, нередко провоцируемые мутациями митохондриальной ДНК. Они приводят к утечке электронов с промежуточных переносчиков. «Правильный» ход событий в дыхательной цепи предусматривает полное восстановление молекулярного кислорода с непременным участием фермента цитохромоксидазы. Приобретение кислородом неспаренного электрона (неполное восстановление) превращает его в исключительно реакционноспособный анион-радикал-супероксид (О2), который атакует ковалентные связи других молекул, вызывая их повреждения и функциональные потери. Опасность супероксида многократно усиливается тем, что его взаимодействие с другими молекулами порождает следующие радикалы, также высоко реакционноспособные. Возникает цепная реакция.
В настоящее время со свободнорадикальными процессами в клетках ученые связывают многие деструктивные явления - от возрастных
и поражения ионизирующими излучениями до развития катаракты хрусталика глаза и инфаркта миокарда. Дисбаланс в функциях про- и антиоксидантов проявляется в таких принципиальных изменениях клеточной судьбы, как онкогенез и апоптоз.
Накопление продуктов частичного восстановления кислорода (свободные радикалы, активные формы кислорода - АФК), перекисей липидов и белков обозначают как окислительный стресс. Хотя существует химическая возможность самопроизвольного «угасания» свободнорадикального цепного процесса, она, по-видимому, не обеспечивает требуемый уровень защиты клеток от активных форм кислорода. В связи с этим эволюция «нашла» специальные механизмы защиты внутриклеточных структур и механизмов от супероксидов. Один из них заключается в блокировании опасных цепных реакций особой категорией молекул (антиоксиданты), которые, реагируя со свободными радикалами, превращаются в радикалы с малой реакционноспособностью. Главные естественные антиоксиданты - два витамина: аскорбиновая кислота (витамин С) и α-токоферол (витамин Е). Примечательно, что первый витамин - водорастворимый, а второй - жирорастворимый. Таким образом, они способны защитить компоненты как основного вещества цитоплазмы, так и мембранные липиды. Наряду с названными, антиоксидантные свойства демонстрирует ряд других соединений, в частности β-каротин (витамин А), мочевая кислота, желчный пигмент билирубин. Еще один способ борьбы со свободными радикалами связан с наличием фермента супероксиддисмутазы, катализирующего превращение супероксида в перекись водорода (Н2О2), которая затем разрушается ферментом каталазой. Последнее необходимо, так как в присутствии ионов металлов, например железа, перекись водорода дает высокореакционноспособные гидроксильные радикалы (ОН и ОН). Супероксиддисмутаза отличается практически повсеместным распространением в организме. Она обнаруживается в клетках подавляющего большинства тканей, где в наибольших концентрациях присутствует в митохондриях, лизосомах и пероксисомах, а также в лимфе, плазме крови, синовиальной жидкости суставов. Перекись водорода, а также обладающие вредоносным действием органические гидроперекиси (R-O-OH) восстанавливаются до воды под действием еще одного фермента - глутатионпероксидазы.
Представления об активных формах кислорода, свободнорадикаль-ных процессах и окислительном стрессе как об исключительно негативных факторах и явлениях не отвечают всем фактам, известным науке.
При низком внутриклеточном парциальном давлении О2, отвечающем физиологическим условиям, перекисное окисление субстратов вполне встраивается в нормальные метаболические процессы и решает позитивные задачи. Так, активные формы кислорода, пероксиды липидов и белков выполняют функции сигнальных молекул, активируя транскрипционные факторы и модифицируя экспрессию генов, инициируют или, напротив, подавляют активность ряда ферментов - обязательных участников фундаментальных биологических процессов, включая клеточную пролиферацию, апоптоз и др. В связи с отмеченным, акценты в свободнорадикальной тематике смещаются в область баланса/дисбаланса прооксидантных и антиоксидантных явлений.
2.4.9. КЛЕТКА КАК ЦЕЛОСТНАЯ СТРУКТУРА. ПОНЯТИЕ О БИОКОЛЛОИДЕ
Выше мы познакомились с различными по строению и функциям клеточными структурами. Однако, взаимодействуя с окружающей средой, клетка ведет себя как целостная структура. Об этом свидетельствует стереотипный характер реакции разных типов клеток на действие раздражителей, вызывающих переход клетки в возбужденное состояние. Указанное состояние характеризуется обратимыми изменениями протоплазмы (живого вещества, как такового), запускающими ту или иную клеточную деятельность и одновременно являющимися основой последней.
Понятию протоплазмы, которым обозначается все содержимое живой клетки, включающее одновременно ядро, цитоплазму и находящиеся в них структуры, принадлежит в науке о жизни заметное место. Свойствам протоплазмы приписывается важная роль функционального объединения структурных компонентов и компартментов клетки. В целом, ее принято рассматривать как особую многофазную коллоидную систему или биоколлоид. От обычных коллоидных систем, относящихся к области научных интересов химиков, биоколлоид отличается сложностью дисперсной фазы. Ее основа представлена макромолекулами, которые находятся либо в составе плотных микроскопически определяемых структур (органеллы), либо в диспергированном состоянии, близком к растворам или рыхлым сетеобразным структурам типа гелей (основное вещество цитоплазмы, ядерный сок).
Будучи коллоидным раствором в физико-химическом смысле, биоколлоид благодаря наличию липидов и крупных частиц проявляет
одновременно свойства соответственно эмульсии и суспензии. На обширных поверхностях макромолекул фиксируются различные «примеси», что вызывает изменение конформации этих макромолекул и, как следствие, агрегатного состояния протоплазмы.
Между крайними полюсами организации протоплазмы в виде, с одной стороны, вязких гелей, а с другой, - растворов имеются переходные состояния. При указанных переходах совершается работа, в результате которой осуществляются различные функциональные преобразования - образование мембран, сборка микротрубочек или ми-крофиламентов из субъединиц, внутриклеточный транспорт веществ и структур, выброс железистой клеткой секрета, изменение геометрии (конформации) белковых молекул, приводящее к торможению или, напротив, усилению активности ферментов. Специфическая особенность биоколлоида состоит в том, что в физиологических условиях в силу наличия особого ферментативного механизма переходы протоплазмы из одного агрегатного состояния в другое обратимы. Названное свойство биоколлоида обеспечивает клеткам способность при наличии энергии многократно совершать работу в ответ на действие стимулов.
Вопросы для самоконтроля
1. Перечислите основные положения клеточной теории.
2. В чем основные отличия прокариотического и эукариотического типов клеточной организации?
3. Охарактеризуйте особенности строения и функций структурных элементов эукариотической клетки.
4. В чем заключаются особенности структуры, локализации и функций хроматина интерфазных хромосом?
5. Какие последовательности ДНК выявлены в геноме человека?
6. Какие нуклеиновые кислоты участвуют в реализации потока информации в клетке? Охарактеризуйте их строение и функции.
7. Перечислите этапы реализации генетической информации в клетке и объясните их.
8. Как осуществляется репликация ДНК?
9. Изложите основные закономерности внутриклеточных потоков веществ и энергии.