Детские болезни в 2-х томах: том 2 : учебник / Под ред. И.Ю. Мельниковой, - 2009.
|
|
|
|
РАЗДЕЛ III РЕВМАТИЧЕСКИЕ БОЛЕЗНИ
В данном разделе объединены заболевания, основным признаком которых является поражение соединительной ткани.
Острая ревматическая лихорадка (I00-I02)
В последние годы частота острой ревматической лихорадки (ОРЛ) существенно снизилась, хотя, по данным Н.Н. Кузьминой (2003), составляет 0,45 на 1000 детского населения России.
Этиология и патогенез. Возникновение ОРЛ (как первой атаки, так и рецидивов) связано с инфицированием гемолитическим стрептококком группы А.
По мнению экспертов ВОЗ (1989), патогенез ОРЛ может рассматриваться с позиций токсико-иммунологической гипотезы как системный васкулит в ответ на стрептококковый антиген (антигены) с повышенной тропностью к тканям сердца.
Патогенез поражения сердца, вероятно, определяется двумя основными факторами: токсическим воздействием ряда ферментов стрептококка, обладающих кардиотоксическими свойствами (стрептолизины O и S, протеиназа и др.) и наличием у некоторых штаммов стрептококка антигенных субстанций, общих с сердечной тканью. Наличие кардиотропности стрептококкового антигена (антигенов) создает принципиальную возможность для воздействия антител к этим антигенам не только на стрептококк, но и на ткани сердца.
Классификация. В настоящее время в России пользуются рабочей классификацией и номенклатурой ОРЛ, принятой в 1964 г. по докладу А.И. Нестерова (Приложение ? 1). По международной классификации заболеваний 10-го пересмотра, предлагается следующий подход в отношении ОРЛ и других заболеваний, обсуждаемых в данной главе (Приложение ? 2).
По возможности следует уточнить ведущую локализацию поражения (миокардит, эндокардит, перикардит, коронарит) и указать
количество атак.
Клиника. Ревматизмом заболевают дети преимущественно школьного возраста.
Первая атака ревматизма у детей, как правило, начинается остро - с повышения температуры тела до фебрильной, явлений интоксикации. Практически у всех детей можно отметить перенесенное за 2-3 недели до этого заболевание верхних дыхательных путей. Одновременно с повышением температуры тела развиваются явления полиартрита или артралгий.
Характерными признаками ревматического полиартрита можно считать следующие: выраженный болевой синдром с нарушением функций, летучий характер болей, поражение преимущественно средних и крупных суставов. Поражение суставов при ревматизме обычно нестойкое и быстро исчезает при проведении противовоспалительной терапии.
Уже в острый период заболевания у 80-85% больных обнаруживают признаки поражения сердца - основного критерия для постановки диагноза ревматизма. Миокардит - самое частое проявление сердечной патологии при этом заболевании. При миокардите наблюдается значительное ухудшение состояния ребенка, бледность кожных покровов, расширение границ сердца, тахикардия или брадикардия, глухость тонов, иногда их раздвоение, могут отмечаться признаки недостаточности кровообращения.
Однако в большинстве случаев симптомы миокардита не столь ярки. Для современного течения ревматизма более характерны умеренные изменения со стороны миокарда. Общее состояние изменяется мало, при объективном исследовании удается обнаружить умеренную тахикардию, реже - брадикардию. Перкуторно находят расширение границ сердца влево, аускультативно - снижение звучности первого тона, реже приглушение обоих тонов. На ЭКГ можно наблюдать удлинение атриовентрикулярной проводимости и изменение конечной части желудочкового комплекса.
Более чем у половины детей при первой атаке уже в острый период удается обнаружить поражение клапанного аппарата сердца - эндокардит. Наиболее часто поражается митральный клапан, реже - аортальный. Характерным признаком поражения митрального клапана является появление систолического шума «дующего» тембра. В начале атаки эндокардиальный шум характеризуется умеренной громкостью, лабильностью, относительно небольшой иррадиацией, слышен
на верхушке сердца, может сопровождаться снижением звучности I тона. Реже эндокардиальный шум уже с самого начала может звучать как сформированная недостаточность митрального клапана.
Большую помощь в диагностике эндокардита митрального клапана может оказать ФКГ. Эндокардиальный шум записывается как высокочастотный, чаще связан с I тоном, убывающий или лентовидный, по продолжительности занимает половину или большую часть систолы.
В 10-15% случаев наблюдается поражение клапанов аорты. В начале заболевания определяется аортальный диастолический шум, который лучше всего слышен в точке Боткина на глубоком выдохе, очень короткий, может не иметь типичного в последующем льющегося характера, не всегда постоянный. Трудности диагностики возрастают вследствие того, что в начальных стадиях этот шум может не регистрироваться на ФКГ.
Относительно редко при первой атаке могут одновременно поражаться два клапана - митральный и аортальный.
Вовлечение в патологический процесс перикарда при первой атаке наблюдают редко. Признаки перикардита обычно встречаются при остром, гиперергическом течении заболевания и сочетаются с выраженными изменениями со стороны других оболочек сердца. При перикардитах всегда нарушается общее состояние больного и имеются признаки интоксикации.
В последние годы особое внимание для констатации поражения сердца при ОРЛ придают ультразвуковому исследованию, более того, есть много сторонников включения данных УЗИ в критерии постановки диагноза.
Поражение нервной системы при ревматизме у детей чаще всего проявляется в виде малой хореи. Заболевание может возникнуть остро, но чаще отмечают постепенное развитие патологического процесса. Дети становятся несобранными, раздражительными, изменяется их поведение, появляются непроизвольные движения (гиперкинезы) разной степени выраженности.
Гиперкинетический синдром часто больше выражен с одной стороны, нередко только в одной правой или левой половине тела (гемихорея). Одновременно у большинства больных появляется гипотония мышц. У 20-30% больных хореей имеется поражение сердца.
Клиническая картина рецидива ревматизма у детей обусловливается как симптомами активности патологического процесса, так и изменениями, которые имеются у ребенка в результате перенесенных
до этого атак ревматизма, прежде всего со стороны сердца. У большинства больных атака начинается остро и по клиническим проявлениям мало отличается от первой атаки. Имеется определенная закономерность в том, что каждая последующая атака как по своим клиническим проявлениям, так и по своей активности, нередко повторяет предыдущую. При рецидивировании ведущей является патология со стороны сердца. При второй атаке поражение сердца наблюдается не менее чем у 95% детей, при последующих атаках отсутствие патологии со стороны сердца вызывает сомнение в правильности диагноза. При перенесении ребенком нескольких атак у него могут наблюдаться практически все из встречающихся приобретенных пороков сердца.
Диагноз и дифференциальный диагноз. В практической деятельности при постановке диагноза и проведении дифференциальной диагностики можно пользоваться диагностическими критериями, сформулированными Киселем-Джонсоном. Их разделяют на основные «большие» и дополнительные, или «малые»:
Основные:
• кардит;
• полиартрит;
• хорея;
• кольцевидная эритема;
• ревматические подкожные узелки; Дополнительные:
• клинические:
- предшествующая ревматическая атака или ревматическое поражение сердца;
- артралгия, лихорадка;
• лабораторные:
- острые фазовые реакции: повышение СОЭ, С-реактивный белок, лейкоцитоз, повышение уровня сиаловых кислот и др.;
- повышение проницаемости капилляров;
- удлинение интервала P-Q на ЭКГ.
Диагноз ревматизма считают достоверным при наличии двух основных критериев или одного основного и двух дополнительных. В последние годы по рекомендации ВОЗ для постановки диагноза ревматизма считают обязательным подтверждение предшествующей стрептококковой инфекции (увеличение уровня антистрептолизина-О (АСЛ-О) или других противострептококковых антител, недавно перенесенная скарлатина).
При различных формах ревматизма круг заболеваний, с которыми приходится проводить дифференциальную диагностику, неодинаков.
При ревматической атаке, протекающей с полиартритом без клинических признаков поражения сердца, дифференциальный диагноз приходится проводить прежде всего с реактивным и ювенильным хроническим артритом (ЮХА).
При ревматической атаке, протекающей с поражением миокарда, основные трудности возникают при дифференциальной диагностике с инфекционно-аллергическими миокардитами и состояниями, которые могут быть обозначены как тонзиллогенные миокардиодистрофии. Здесь часто приходится ориентироваться на выраженность симптоматики и количественные характеристики. При ревматизме полиартритический синдром проявляется более ярко (случаи изолированного ревматического миокардита без полиартрита встречаются исключительно редко), артралгии как при инфекционно-аллергическом миокардите, так и при тонзиллогенных миокардиодистрофиях обычно непостоянны, не сопровождаются выраженным болевым синдромом, практически никогда не дают нарушения функции суставов, не всегда удается обнаружить и четкую временную связь между полиартралгиями и симптомами поражения сердца.
Сам характер поражения миокарда имеет некоторые отличия: объективные данные обычно скудные - небольшое приглушение тонов, снижение амплитуды I тона, умеренная тахиаритмия, лабильность артериального давления, нередко экстрасистолия. В то же время такие больные, особенно с тонзиллогенными миокардиодистрофиями, предъявляют большое количество жалоб: ухудшение самочувствия, утомляемость, неприятные ощущения в области сердца и др. Расширение же границ сердца, удлинение атриовентрикулярной проводимости - симптомы, довольно характерные для ревматического поражения миокарда - при тонзиллогенной миокардиодистрофии вообще не наблюдают, а при инфекционно-аллергическом миокардите (по крайней мере в тех случаях, которые приходится дифференцировать от ревматизма) встречаются редко.
При поражении эндокарда, особенно при вовлечении в патологический процесс митрального клапана, диагноз не труден, так как практически все приобретенные клапанные пороки сердца у детей ревматического происхождения. Клапанные поражения при септическом эндокардите редко вызывают дифференциально-диагностические трудности с ревматизмом (см. выше).
Несколько иного характера затруднения возникают при определении активности ревматического процесса. Здесь приходится проводить дифференциальный диагноз между вялым течением и латентными формами ревматизма и решать вопрос о наличии или отсутствии повторного обострения у ребенка, уже перенесшего до этого атаку или несколько атак ревматизма.
При вялом течении лабораторные тесты показывают обычно лишь минимальную активность, в этих случаях достоверный диагноз может быть поставлен только на основании динамики изменений со стороны сердца.
В типичных случаях диагноз рецидива ревматизма не труден, тем более, что в отношении этих больных существует определенная настороженность. Важно выяснить исход предыдущей атаки, чтобы правильно оценить степень и характер поражения сердца при данном обострении. Во время рецидивов значительно чаще чем при первой атаке патологический процесс протекает с небольшими изменениями лабораторных показателей, что, безусловно, затрудняет диагностику. В этих случаях решающим для диагноза являются нарастание и появление новых изменений со стороны сердца.
Основой для дифференциальной диагностики являются упорство суставного синдрома (при ЮХА) и отсутствие этиологической связи с стрептококком.
При ОРЛ, протекающей с поражением миокарда, основные трудности возникают при разграничении с другими миокардитами. Подтверждение стрептококковой этиологии миокардита и наличие других критериев (артрита, хореи и др.) позволяют поставить правильный диагноз.
При вовлечении в патологический процесс других оболочек сердца (эндокарда, перикарда) только в самом начале заболевания могут возникнуть затруднения в разграничении с бактериальным эндокардитом и перикардитами другой этиологии.
Лечение больного ревматизмом или даже при подозрении на ревматизм следует осуществлять в стационарных условиях.
Медикоментозная терапия больного направлена на два основных звена патогенеза - инфекционный агент и аллергическую (иммунопатологическую) реакцию.
При поступлении назначают 7-10-дневный курс парентерального введения пенициллина в дозах 20 000-50 000 ЕД на 1 кг массы тела в сутки. После окончания курса вводят бициллин-5 или бицил-
лин-1 каждые три недели в дозах для школьников в два раза больше. В случае непереносимости пенициллина (аллергические реакции) назначают эритромицин.
При высокой активности и значимом поражении сердца (кардиомегалия, клапанные поражения) для воздействия на аллергическую (иммунопатологическую) реакцию при ревматизме наиболее часто используют совместное применение глюкокортикоидов и нестероидных противовоспалительных препаратов. При данном заболевании наилучшим сочетанием является использование преднизолона и ацетилсалициловой кислоты. Доза преднизолона зависит от активности процесса: при умеренной активности достаточны дозы 0,5 мг на 1 кг массы тела, в случаях высокой активности дозы увеличивают до 1 или даже 2 мг на 1 кг массы тела в сутки. Снижение дозы при хорошем эффекте (уменьшении клинической и лабораторной активности) проводят в среднем через каждые 10 дней по 5 мг.
Негормональные противовоспалительные препараты назначают обычно параллельно гормональным - ацетилсалициловая кислота в дозе 50-70 мг на 1 кг массы тела в сутки, но не более 2 г. Использование при ревматизме таких противовоспалительных препаратов, как бутадион, реопирин, бруфен и других, особых преимуществ не имеет.
В случаях незначительного поражения сердца и умеренной активности процесса гормональную терапию можно не назначать и лечение ограничивать противовоспалительными препаратами, доза которых может быть несколько повышена.
В стационаре больной находится приблизительно 1,5-2 месяца, после стационара его направляют на 2-3 месяца для этапного лечения в местный санаторий.
Прогноз. Несмотря на то что ревматизм в настоящее время протекает более доброкачественно, чем в предыдущие годы, прогноз при этом заболевании серьезен и определяется прежде всего исходом поражения сердца.
Профилактика. Несомненно, что основная роль в постановке диагноза ревматизма и его профилактике принадлежит участковым врачам, поскольку именно они, как правило, первыми сталкиваются с этими больными. Принципиально важным является положение, что правильное ведение стрептококковой инфекции, начатое не позднее третьего дня от ее начала, практически гарантирует ребенка от заболевания ревматизмом. Различают первичную и вторичную профилак-
тику ревматизма. Под первичной профилактикой понимают комплекс мероприятий, уменьшающих возможность стрептококкового инфицирования, а в случаях возникновения стрептококковой инфекции - своевременное ее лечение. Лечение острых стрептококковых заболеваний проводят антибиотиками в течение 10 дней. Наиболее целесообразным является введение пенициллина внутримышечно в дозе 30 000-50 000 ЕД на 1 кг массы тела в сутки с последующим введением бициллина-5 в дозе 750 000-1 500 000 ЕД. При невозможности внутримышечного введения пенициллина для лечения острых стрептококковых заболеваний может быть использован феноксиметилпенициллин (в той же дозе, как для внутримышечного введения) или другие препараты пенициллинового ряда. При непереносимости пенициллина могут быть назначены другие антибиотики, причем предпочтение отдают группе макролидов - эритромицин (30 000-50 000 ЕД на 1 кг массы в сутки) продолжительностью 10 дней.
Параллельно с антибактериальной терапией рекомендуют назначать противовоспалительные препараты - ацетилсалициловую кислоту или другие препараты этой группы (метиндол, бруфен и др.) в половине терапевтической дозы сроком 7-10 дней.
Особо важное значение в профилактике повторных атак ревматизма придают правильно проводимой вторичной профилактике ревматизма. Бициллиномедикаментозной профилактике подлежат все больные независимо от возраста и наличия или отсутствия порока сердца, перенесшие достоверный ревматический процесс.
В настоящее время единственно правильным методом вторичной профилактики ревматизма можно считать круглогодичную бициллиномедикаментозную профилактику (сезонная профилактика, используемая ранее, применяться не должна). Круглогодичную профилактику осуществляют с помощью бициллина-1 или бицилли- на-5 (оба препарата обладают примерно равной эффективностью). Бициллин-1 вводят внутримышечно детям дошкольного возраста в дозе 600 000 ЕД, школьного возраста - в дозе 1 200 000 ЕД один раз в месяц. Бициллин-5 применяют у дошкольников в дозе 750 000 ЕД, у школьников - 1 500 000 ЕД, кратность введения та же, что и бициллина-1.
В связи с тем, что при введении бициллина-5 только у 20% детей к 21-му дню сохраняется достаточная терапевтическая концентрация антибиотика, в настоящее время предпочтительнее использовать другие дюрантные препараты пенициллина, например бензатин-
пенициллин (экстенциллин) в дозе для дошкольников 1,2 млн ЕД, школьников 2,4 млн ЕД ежемесячно.
В период возникновения ангин, обострений хронического тонзиллита, фарингита, синусита, повторных острых респираторных заболеваний всем больным ревматизмом, несмотря на получаемую профилактику, назначают 10-дневное лечение антибиотиками в сочетании с противовоспалительными средствами - так называемая текущая профилактика ревматизма по методике, описанной в разделе «Первичная профилактика».
Индивидуальная непереносимость препаратов пенициллина является абсолютным противопоказанием к назначению инъекций бициллина и по сути дела единственным противопоказанием для проведения вторичной профилактики ревматизма. Таким больным профилактику ограничивают текущей профилактикой с использованием вместо пенициллина другой антибактериальной терапии.
Ювенильный хронический артрит и диффузные заболевания соединительной ткани
Этиология и патогенез. Этиология в настоящее время неизвестна. Нельзя исключить, что единого этиологического фактора не существует, а возникновение патологического процесса связано с самыми разнообразными воздействиями (бактериальная и вирусная инфекции, лекарственные препараты, особенно введение белковых препаратов, физические факторы и т.д.), которые выявляют генетически детерминированную неполноценность иммунного ответа, в частности снижение «цензорной» функции Т-клеточной популяции лимфоцитов с развитием аутоиммунных реакций. При системной красной волчанке аутоантитела направлены против ДНК, в случае ревматоидного артрита - против иммуноглобулинов. Нозологическая принадлежность заболевания определяется не столько особенностями патогенеза, сколько органами-«мишенями», на которые направлен аутоиммунный процесс. Учитывая неуправляемый процесс размножения иммунокомпетентных клеток, эти заболевания склонны к рецидивированию и прогрессированию.
ЮВЕНИЛЬНЫЙ ХРОНИЧЕСКИЙ АРТРИТ (ЮХА). М06
Термин «ЮХА» в 1977 г. был принят Европейской лигой по борьбе с ревматизмом, а в 1983 г. - Американской ассоциацией ревматологов для обозначения артритов в детском возрасте длительностью более трех месяцев. В 1985 г. и в Советском Союзе предложено разделить на два самостоятельных заболевания - ювенильный ревматоидный артрит (ЮРА) и ЮХА.
В начале заболевания термин «ЮХА» является объединяющим для всех форм хронических артритов, в дальнейшем при прогрессировании заболевания (генерализация суставного синдрома, вовлечение в патологический процесс внутренних органов); признаках разрушения пораженных суставов (разрушение хрящевой ткани, мелкокистозная перестойка структуры эпифизов, узурация суставных поверхностей, анкилозирование); стойком нарушении и особенно прогрессировании нарушений функции суставов ставится диагноз «ЮРА».
В детском возрасте наибольший пик заболеваемости относится к возрасту 2-5 лет, затем вплоть до препубертатного возраста заболеваемость остается на приблизительно одинаковом, относительно низком уровне, далее наблюдается вновь повышение частоты заболеваний. Во все возрастные периоды чаще болеют девочки, но соотношение девочек и мальчиков при разных формах может отличаться.
Классификация. При постановке диагноза можно пользоваться классификацией, предложенной группой московских педиатров (Долгополова А.В., Яковлева А.А., Исаева Л.А.) в 1980 г. для ЮРА (Приложение ? 3).
Клиника. Суставные поражения при ЮХА имеют ряд клинических особенностей и первой из них, несомненно, является стойкость артрита. Именно этот признак положен в основу самого отнесения суставных поражений к данному заболеванию. Боль проявляется только при движении. Пальпация суставов безболезненна, за исключением редких случаев с резко выраженными экссудативными явлениями в периартикулярных тканях. Весьма характерным может считаться наличие утренней скованности разной степени выраженности и продолжительности (от десятков минут до нескольких часов). Нередко можно отметить и суточный ритм артралгий, которые в наибольшей степени выражены в утренние часы.
Наиболее часто встречаются моно-, олигоартритический вариант начала ЮХА, который наблюдается у половины больных. Почти
2/3 из них заболевают в возрасте 2-4 лет. Достаточно типичным может считаться подострое начало без отчетливых общих проявлений. Общей закономерностью является то положение, что чем больше суставов одновременно вовлекаются в патологический процесс и чем крупнее суставы, тем более ярким и активным является начальный период.
Первыми симптомами, на которые обращают внимание родители, являются нарушения функции пораженных суставов, реже - изменение их конфигурации. Практически у всех детей при подробном расспросе удается выявить наличие утренней скованности, а у детей младшего возраста родители нередко сами отмечают, что ребенок утром хуже владеет пораженным суставом, а к середине дня и вечером движения восстанавливаются почти полностью. При этих формах поражения наиболее часто страдают крупные суставы нижних конечностей, из них на первом месте стоит коленный сустав, причем правый коленный сустав поражается почти в 3 раза чаще, чем левый. Второе место по частоте занимают голеностопные суставы. Остальные суставы (тазобедренные, лучезапястные, мелкие суставы кистей и стоп) вовлекаются реже.
При объективном обследовании обнаруживаются изменение конфигурации и увеличение объема суставов за счет периартикулярных тканей, у половины больных - повышение местной температуры. Практически во всех случаях наблюдаются болевые контрактуры, как правило, умеренной степени выраженности.
Лабораторная активность четко коррелирует с остротой заболевания (проявление общей интоксикации, температурная реакция), в меньшей степени - с местными изменениями со стороны суставов. При остром начале наблюдается повышение СОЭ, появление в крови С-реактивного протеина, диспротеинемия с увеличением α и γ-глобулинов. При подостром и латентном течении заболевания лабораторные показатели активности или не изменяются, или обнаруживаются их умеренные изменения, главным образом в результате динамического наблюдения.
С позиций повреждений опорно-двигательного аппарата моно- и олигоартикулярные формы ЮХА могут считаться благоприятными. Приблизительно у 1/4 части детей заболевание не прогрессирует, периодическое, иногда довольно редкое, обострение пораженных суставов протекает с умеренной активностью, небольшой болевой реакцией и хорошо поддается терапии. В этих случаях редко обна-
руживаются и признаки костной деструкции на рентгенограммах. У остальных детей наблюдается вовлечение в патологический процесс других суставов (генерализация), однако, как правило, небольшого их количества и с умеренными признаками активности. Редко отмечается поражение внутренних органов, за исключением глаз. На этих формах ЮХА необходимо остановиться особо, тем более, что они являются наиболее инвалидизирующими формами и присущи почти исключительно детскому возрасту.
Хронический иридоциклит возникает чаще всего у детей младшего возраста (2-4 года) и почти исключительно при моноили олигоартритических вариантах. При специальном наблюдении окулиста почти 1/3 детей с моноартритом имеет ту или иную степень поражения глаз, при олигоартрите - это 1/6 часть больных. Сложность диагностики заключается в том, что начальные проявления хронического иридоциклита не могут быть выявлены при обычном клиническом наблюдении, тем более, что приблизительно у пятой части больных поражения глаз предшествуют суставным поражениям. Необходимо отметить также, что, как правило, наиболее активное течение иридоциклита наблюдается у больных с небольшой активностью суставного поражения.
Первыми клиническими признаками, которые появляются при уже грубом поражении глаз, являются жалобы ребенка на снижение зрения, ощущение «песка в глазах». Объективно можно обнаружить усиленный сосудистый рисунок глазного яблока, изменение формы зрачка за счет синехий и отсюда плохая зрачковая реакция на свет пораженного глаза.
Приблизительно треть всех случаев ЮХА начинается с п о л и - артритического варианта. У больных этой группы в патологический процесс вовлекаются самые разнообразные суставы, но чаще всего крупные суставы нижних конечностей. По клинической картине, активности и остроте начального периода эту группу больных можно разделить на две группы: с поражением нескольких крупных суставов (2/3 от всех больных с полиартритическим вариантом начала) и с поражением мелких суставов кистей или стоп.
При поражении нескольких крупных суставов заболевание начинается чаще всего остро. В клинической картине наряду с достаточно ярким полиартритическим синдромом (выраженная болевая реакция, изменение конфигурации суставов, нарушение функции) отмечаются явные признаки интоксикации, повышение температу-
ры. Лабораторные показатели во всех случаях значительно изменены. У этих больных в дальнейшем отмечается стойкость суставного синдрома, плохая его курабильность, вовлечение в патологический процесс других суставов и внутренних органов.
При вовлечении в патологический процесс кистей или стоп начальный период протекает чаще незаметно и первыми жалобами являются: утренняя скованность, неловкость и изменение конфигурации суставов. Объективно преобладают пролиферативные изменения суставов. Чаще всего такая форма поражения наблюдается у детей школьного и подросткового возраста.
Приблизительно у 7-10% детей ЮХА начинается как системное заболевание. Такой вариант течения нередко называют болезнью (синдромом) Стилла. Первыми и наиболее яркими клиническими симптомами являются: высокая гектическая температура, генерализованное увеличение лимфатических узлов, печени, нередко - селезенки. Уже в начальный период у части больных можно обнаружить поражение внутренних органов: почек в виде гломерулонефрита, легких - по типу интерстициальной пневмонии, сердца - чаще всего миокарда и других органов. У большинства детей наблюдаются сыпи, разнообразные по своему характеру, не только у отдельных больных, но и у одного ребенка. У половины больных в начале заболевания обнаруживается вовлечение суставного аппарата всегда очень яркое с выраженным экссудативным компонентом. Из-за выраженности суставного поражения такие дети нередко попадают в хирургические стационары с подозрением на остеомиелит. У второй половины больных суставной синдром проявляется позднее (на 2-3 недели) от начала клинических проявлений. В этих случаях он не столь выражен. Заболевание всегда протекает с гиперлейкоцитозом, нейтрофилезом со сдвигом влево, нередко наблюдается анемия, СОЭ резко увеличена, значительно изменены другие показатели активности патологического процесса. По своему дальнейшему течению вариант Стилла является одним из наиболее неблагоприятных.
Особой формой ЮХА является с у б с е п с и с В и с с л е р а - Ф а н к о н и . Отнесение этой формы к ЮХА и до настоящего времени является дискутабельным, поскольку, по крайней мере у половины детей, при дальнейшем наблюдении не выявляется хронического артрита. Однако сходство его симптоматики с начальными проявлениями других форм ЮХА, завершение у части больных развитием типич-
ного хронического артрита позволяют рассматривать аллергический субсепсис как форму или, точнее, как фазу в развитии ЮХА.
В большинстве случаев заболевание начинается остро. Наиболее типичными клиническими признаками являются: температурная реакция, сыпь, боли в суставах, нередко - висцеральные проявления. Температура, как правило, высокая, неправильного типа, нередки подъемы в утренние и ночные часы. Обращает на себя внимание, что дети обычно хорошо переносят температуру без нарушения самочувствия. Сыпь - один из основных симптомов заболевания и наблюдается у всех детей. Сыпь у большинства больных отличается полиморфизмом. У большинства детей имеются жалобы на боли в суставах по типу полиартралгий. Объективные изменения в суставах в начальный период заболевания наблюдаются редко.
Из висцеральных проявлений наиболее часто отмечается поражение сердца в виде миокардитов или миоперикардитов. Приблизительно у половины больных наблюдаются изменения в моче в виде преходящей гематурии и протеинурии. Поражение других внутренних органов встречается редко.
Со стороны периферической крови в период острых явлений характерны лейкоцитоз, нередко - гиперлейкоцитоз, нейтрофилез со сдвигом влево, значительно увеличенная СОЭ. Другие показатели активности (протеинограмма, сиаловые кислоты и др.) также существенно изменены.
Как уже отмечалось, приблизительно у половины больных (в последние годы - у 70%) субсепсис протекает остро и заканчивается выздоровлением после одного-двух острых периодов. У остальных детей патологический процесс локализуется в суставах и заболевание приобретает типичные черты ЮХА, преимущественно в виде полиартрической формы.
Как уже указывалось, при ЮХА в начале заболевания, а особенно значимо в ходе эволюции патологического процесса, наблюдается поражение внутренних органов. Наиболее существенно для прогноза заболевания поражение глаз и почек. О первом уже упоминалось выше. Частота поражения почек широко колеблется а зависимости от объема методов исследования. На биопсийном и секционном материале изменения обнаруживаются у трети детей в виде гломерулонефрита и межуточного нефрита, нередко с морфологическими признаками амилоидоза. В начальных стадиях патология почек проявляется в виде умеренной гематурии и протеинурии без нарушений
функции. Стабильная и выраженная протеинурия у больного с ЮХА всегда подозрительна на развитие амилоидоза.
Диагноз и дифференциальный диагноз. При диагностике ЮХА, кроме описанной выше клинической картины, могут быть использованы и специально разработанные критерии. Наиболее удачными являются диагностические критерии, разработанные большой группой педиатров социалистических стран применительно к диагностике ювенильного ревматоидного артрита (1976), которые могут использоваться и в диагностике ЮХА.
Клинические признаки:
Артрит продолжительностью 3 месяца и более. Артрит второго сустава, возникший через 3 месяца и более после поражения первого.
Симметричное поражение мелких суставов.
Выпот в полость сустава.
Контрактура сустава.
Тендосиновит или бурсит.
Мышечная атрофия (чаще регионарная).
Утренняя скованность.
Рентгенологические признаки.
Остеопороз.
Сужение суставных щелей. Нарушение роста костей.
Наличие у больного 3 из 11 перечисленных признаков и более при обязательном наличии первого позволяет поставить диагноз ЮХА.
Дифференциальный диагноз. Круг заболеваний, с которыми приходится дифференцировать ЮХА, неодинаков при различных формах течения заболевания.
Наиболее частые суставные варианты начала редко вызывают серьезные трудности для разграничения или эти трудности могут быть только в самом начале заболевания. В реальных условиях дифференциальный диагноз приходится проводить с группой реактивных артритов, реже - с травматическими и обменными поражениями суставов.
Среди группы реактивных артритов наиболее близкими к ЮХА являются артриты, связанные с кишечной инфекцией (иерсениоз, сальмонеллез, дизентерия), поскольку они нередко достаточно стойкие, а кишечный синдром выражен весьма умеренно. В этих случаях приходится ориентироваться на результаты посевов кала, серологи-
ческие реакции с соответствующими антигенами, диагностикой ex juvantibus с использованием антибиотиков, действующих на кишечную группу (левомицетин, цефалоспорин и др.). В детском возрасте именно с этими этиологическими факторами связана диагностика синдрома Рейтера с типичной триадой симптомов (артрит, уретрит, конъюнктивит). Первые два из них - артрит, уретрит, как правило, наиболее яркие.
Травматические артриты наблюдаются у детей нечасто и тем более редко задерживаются в своем обратном развитии на длительный период. Исключение в этом отношении составляют травматические артриты при гемофилии, но обычно диагноз гемофилии известен до того, как возникает необходимость в дифференциальной диагностике.
Обменные артриты у детей также встречаются достаточно редко и в реальных условиях наблюдаются почти исключительно у тучных детей. Связь болевого синдрома с нагрузкой на пораженные суставы, отсутствие больших изменений со стороны суставов позволяют довольно надежно проводить разграничение этой патологии.
При системном начале ЮХА дифференциальный диагноз приходится проводить с некоторыми генерализованными инфекционными процессами, в частности наибольшее значение имеют стрептококковая и иерсениозная инфекции и началом некоторых диффузных заболеваний соединительной ткани, из которых на первом месте стоят системная красная волчанка и узелковый периартериит, реже дерматомиозит. До тех пор пока суставный синдром не примет типичный для ЮХА характер - стабильность, утренняя скованность, наличие выпота в полости сустава, - надежный дифференциальный диагноз очень затруднителен. Однако в большинстве случаев к трем месяцам с момента начала заболевания, срок, который считается обязательным для постановки диагноза ЮХА, диагноз становится ясным.
Лечение. Моно- и олигоартритические варианты с острым и подострым течением. В терапии этих форм используют тактику минимальной терапии. Лечение следует начинать с использования ацетилсалициловой кислоты (50-70 мг/кг массы в сутки). При хорошей переносимости препарата и отсутствии выраженного противовоспалительного эффекта в течение 7-10 дней дозы повышают до 100-120 мг на кг. Параллельно применяют обволакивающие средства (смесь Рысса, альмагель), учитывая возможное ульцерогенное действие аспирина.
В случае отсутствия эффекта от салицилатов в течение 2-3 недель или появлении побочного действия, следует переходить на другие нестероидные противоспалительные препараты (НПВП) - метиндол (индометацин в дозе 1-3 мг/кг сутки), вольтарен, диклофенак в такой же дозе, бруфен, ибупрофен - 10-30 мг/кг/день. Необходимо еще раз отметить, что дети с ЮХА обладают индивидуальной чувствительностью к перечисленным выше препаратам.
Первоначально все противовоспалительные препараты назначаются равномерно в течение суток - 4 раза. В отдельных случаях, ориентируясь главным образом на выраженность болевого синдрома, суточный ритм приема лекарств можно изменять. Например, при наличии наибольшей болезненности или скованности в утренние часы может быть рекомендовано назначение большей части суточной дозы в вечерние и ранние утренние часы.
При наличии высокой активности (плохо поддающейся указанной терапии), экссудативных изменений в суставах и особенно при выраженных общих проявлениях патологического процесса (лихорадка, нарушение общего состояния) к терапии НПВП могут быть подключены средства, улучшающие микроциркуляцию: никошпан в дозе 2-3 мг/кг; курантил - 4-5 мг/кг/день; гепарин в дозе 100-150 ед/кг на введение (доза считается адекватной при удлинении длительности свертывания по Ли-Уайту до 10-12 мин) с частотой 2 раза в сутки при подкожном введении и 3-4 раза - при внутримышечном, а также и другие средства.
Суставные формы с поражением глаз и изолированные ревматоидные поражения глаз. Местно могут быть использованы противовоспалительные препараты, при упорных увеитах по назначению офтальмолога назначаются глюкортикоиды в инъекциях под конъюнктиву. При наличии суставного синдрома - общая терапия НПВП в сочетании со средствами, улучшающими микроциркуляцию. Средством выбора при всех формах ревматоидного поражения глаз является метиндол. Контроль за эффективностью терапии проводится только по глазному синдрому с обязательной оценкой состояния передних камер глаза при помощи щелевой лампы.
Отсутствие эффекта от проводимой терапии в течение месяца или прогрессирование глазного синдрома являются показанием для назначения цитостатической терапии (дополнительным показанием можно считать высокие титры антинуклеарных антител). Из цитостатиков наилучшим является циклофосфан (3-5 мг/кг в сутки)
орально, в/м или в/в; хлорбутин - 0,1-0,3 мг/кг/день. Недельная доза может быть введена за 2 раза (понедельник и четверг).
Полиартритические формы ЮХА, острое и подострое течение. Первоначально проводится противовоспалительная терапия по принципам, изложенным в отношении моно- и олигоартрита (индивидуальный подбор).
В исключительных случаях, при невозможности снять болевой синдром и общую активность патологического процесса вышеперечисленными способами, используют короткий курс гормональной терапии. При назначении глюкокортикоидов необходимо учитывать следующие положения: лечение должно начинаться с достаточно высоких доз (1-3 мг/кг в сутки), но, по возможности коротким курсом (до 1,5-2 месяцев). Предпочтение отдается интермиттирующим схемам терапии (однократная дача всей суточной дозы через день). У детей, которые до этого находились в течение длительного времени на поддерживающей гормональной терапии, нет необходимости в условиях стационара стремиться к полной отмене кортикостероидов.
При неэффективности предыдущего лечения в течение 2-3 месяцев, высокой гормонозависимости показано назначение иммуномодулирующей терапии (цитостатические препараты) по результатам иммунологического обследования. При повторных обострениях вопрос об иммуномодулирующей терапии необходимо решить в течение первого месяца безуспешной терапии другими средствами.
Полиартритические формы с первично-хроническим течением. По характеру своего течения эти формы аналогичны взрослому РА. При наличии болевого синдрома и утренней скованности могут быть назначены НПВП, несмотря на отсутствие лабораторной активности. Гормональная терапия не показана.
Наиболее адекватной может считаться терапия иммуномодулирующими препаратами: при умеренном болевом синдроме рекомендуется лечение хинолиновыми препаратами, в более активных случаях - D-пеницилламин, ауранофин. Подтверждение высокой иммунологической активности и отчетливое прогрессирование заболевания (преимущественно по рентгенологическим данным) являются основанием для назначения иммуносупрессивной терапии.
Суставно-висцеральные формы, в том числе и синдром Стилла. Поскольку эти формы ЮХА у детей протекают, как правило, неблагоприятно, терапия их с самого начала должна быть достаточно
активной. Эти формы в первые дни ведутся как полиартритические варианты с острым и острейшим течением, начиная с НПВП и сосудистых препаратов. При невозможности снять активность в течение 1-2 недель назначается гормональная терапия (пульс-терапия).
Параллельно проводится иммунологическое обследование, по результатам которого подбирается иммунодепрессивная терапия, включая наиболее активные методы иммунодепрессии - циклофосфан 4-5 мг/кг в день. У большинства детей именно такая терапия является единственно эффективной.
Субсепсис Висслера-Фанкони. Так как известны случаи полного излечения детей после одного или нескольких периодов острого течения, то ведение больных несколько отличается от терапии суставно-висцеральных форм ЮХА. В этих случаях необходимо пытаться снять активность с использованием НПВП и гормональных препаратов, не прибегая к методам иммунодепрессии. Может быть оправданным применение повышенных доз гормональных препаратов (до 4-6 мг/кг) короткими курсами по интермиттирирующей схеме, и при достижении 0,8-1,1 мг/кг снижение дозы препарата до полной отмены проводить медленно, в течение 8-12 месяцев.
В последние годы широко обсуждается использование длительно с противоспалительной активностью таких преператов, как метотрексат и сульфосалазин. Опыт использования метотрексата показал, что он наиболее эффективен при олигоартритических формах ЮХА при относительно малом воздействии на лабораторную активность. Сульфасалазин может быть рекомендован в основном при спондилоартритах, ассоциированных с антигеном гистосовместимости В27. Однако малочисленность исследований и отсутствие четко апробированных схем, а также достаточно высокая частота побочных реакций сдерживают их широкое применение у детей. В приложении ? 4 приведены суточные дозы, сроки ожидаемого эффекта и наиболее типичные побочные реакции препаратов, наиболее часто используемых при лечении ЮХА.
Из методов медикаментозной терапии необходимо также остановиться на возможности местного использования препаратов путем непосредственного их введения в полость сустава. Наибольшее распространение получило внутрисуставное введение глюкокортикоидов, чаще гидрокортизона (препарат вводят: в крупные суставы по 100-125 мг, в средние - по 50-75 мг, в мелкие - по 25 мг; интервал зависит от эффекта, но не рекомендуется менее 5 дней). В последнее
время считается более эффективным введение дюрантных препаратов глюкокортикоидов, лучшим из которых является кеналог, из расчета 10-20 мг на один крупный сустав. Преимущества препарата связаны с длительным действием, что позволяет интервал между пункциями увеличить до 2-8 недель. Возможной модификацией местного введения является одновременное использование глюкортикоидов и циклофосфана или препаратов золота. Местное применение описанных выше препаратов, как правило, используется при моно-, олигоартритических поражениях.
Исключительно важное место в терапии ЮХА и РА принадлежит методам физической реабилитации. Хорошо известно, что отсутствие активных движений в суставах, и особенно иммобилизация, очень быстро приводят к их функциональным нарушениям, которые в последующем чрезвычайно сложно устранить.
Неотъемлемой частью комплексного лечения и реабилитации больных является применение физиотерапевтических процедур. Объем этих методов лечения в значительной степени зависит от возможностей лечебного учреждения и приверженности врачей-специалистов к тем или иным методам воздействия. Вероятно, наиболее правильным можно считать два направления при лечении ЮХА и ЮРА. Первое из них связано с уменьшением воспалительной реакции и относится преимущественно к острой экссудативной фазе поражения опорнодвигательного аппарата и второе, связанное с антипролиферативным рассасывающим эффектом физиотерапевтических методов.
Исключительно ответственной является тактика ведения больного в амбулаторных условиях. Одним из основных принципов правильного ведения ЮХА является постоянное, длительное (месяцы и годы) использование подобранных схем лечения. Оптимальным может считаться подбор терапии (препараты и дозы) в условиях специализированного стационара, центров, которые определяют также и последующее изменение тактики лечения.
В поликлинических условиях особую сложность представляет ведение больных, получающих «базисную» терапию, при присоединении интеркуррентных заболеваний. Во всех таких случаях назначается антибактериальная терапия, причем лучше использовать антибиотики широкого спектра действия - полусинтетические пенициллины и др. Вне интеркуррентных заболеваний в постоянной антибактериальной терапии, в том числе и профилактика бициллином, даже при получении гормональных и/или цитостатических
препаратов, больные не нуждаются. При использовании в качестве «базисной» терапии НПВП, их доза увеличивается в 1,5 раза, а возвращение к исходной осуществляется через 3-5 дней после нормализации температуры. Если в качестве «базисной» терапии используются иммунорегулирующие препараты, их отменяют с первого дня возникновения интеркуррентного заболевания. Сразу после нормализации температуры терапия НПВП в полной дозе. Через 7-10 дней после нормализации температуры возвращаются к иммунорегулирующим препаратам, параллельно уменьшая дозу НПВП вдвое. При отсутствии признаков обострения основного заболевания НПВП отменяют через 7-10 дней (общая длительность лечения НПВП, таким образом, составляет 2-3 недели). Гормональная терапия, если ребенок получает ее, проводится в той же дозе, однако при наличии гормонозависимости необходимо увеличение дозы в 1,5-2 раза, возвращение к исходным уровням проводится после нормализации температуры на фоне НПВП через 3-5 дней. При тяжело протекающих интеркуррентных заболеваниях больного госпитализируют даже без признаков обострения основного процесса.
СКЛЕРОДЕРМИЯ
В детском возрасте по частоте склеродермия занимает второе место среди заболеваний с аутоагрессивным течением после ЮХА. Данных о частоте этой патологии в детском возрасте нет, поскольку очаговые формы, как правило, наблюдаются дерматологами, а системные формы, которые у детей встречаются крайне редко, лечатся у кардиоревматологов. По сводной статистике, очаговые формы чаще наблюдаются у девочек (60%), при системной склеродермии соотношение девочек к мальчикам составляет 1,5:1. Из предлагаемых классификаций наиболее удачной в детском возрасте представляется приведенная в приложении ? 5.
Этиология и патогенез. Этиология неизвестна. В патогенезе рассматриваются две основные гипотезы развития заболевания: иммунная и сосудистая.
К сожалению, ни одна из них не может считаться доказанной, нельзя исключить, что клеточные и гуморальные иммунологические механизмы могут играть роль в индукции и поддержании патологического процесса при склеродермии.
Клиника. Очаговая склеродермия (L94.0). При классическом варианте, который наблюдается приблизительно у половины детей, изменения кожи проходят последовательно три фазы - отека, индурации и атрофии. При таком варианте при бляшечной форме в начальной фазе наблюдается появление желтовато-розовых эритематозных отечных бляшек, которые постепенно превращаются в твердые, восковидные, цвета слоновой кости или желто-белые поражения, иногда с фиолетовым ободком, которые называют морфеа. Эти элементы могут быть ограниченными или множественными, разного размера.
При поражении в виде линейных форм также может иметь место морфеа, но достаточно быстро появляется линейная конфигурация, которая выглядит как широкая полоса, нередко вдоль сосудистонервного пучка любой конечности (чаще одной). В начальной фазе при этих формах отек может быть более выраженным, чем при бляшечных поражениях. Особая локальная форма линейной склеродермии, названная «удар саблей», появляется на волосистой части головы, лбу и захватывает часть лица (гемиатрофия).
Линейные формы склеродермии нередко не ограничиваются поражением только кожи, но сопровождаются вовлечением в патологический процесс подкожной клетчатки, мышц, фасций и даже костей. В этих случаях заболевание может сопровождаться значительными деформациями. Поражение лица и скальпа могут сопровождаться увеитом и эпилептическими припадками.
Кроме поражения кожи могут наблюдаться артриты с утренней скованностью, ограничением движений, но без выраженных воспалительных изменений и болевого синдрома, наиболее часто поражаются лучезапястные и локтевые суставы, но могут вовлекаться и другие крупные суставы - коленные и голеностопные. Иногда поражение суставов может предшествовать кожным изменениям. У некоторых больных с очаговыми формами склеродермии диагностируют синдром Рейно.
При генерализованных формах очаговой склеродермии приблизительно у 20% при специальном (рентгенологическом) исследовании можно обнаружить признаки нарушения моторики пищевода при отсутствии жалоб и других клинических признаков.
Системная склеродермия (М34). Еще раз хочется подчеркнуть, что системная склеродермия у детей встречается крайне редко. Начальным и практически постоянным признаком является синдром
Рейно, характеризующийся трехфазной вазоспастической реакцией после охлаждения, волнений, переутомления (побеление, цианоз и геперемия). Первые признаки синдрома Рейно носят эпизодический характер с вовлечением дистальных отделов нескольких пальцев кисти, затем всей кисти, стоп, реже лица (нос, губы, уши).
Характерное склеродермическое поражение кожи проходит стадию плотного отека (ранний признак), индурации и атрофии (поздняя стадия) с преимущественной локализацией на кистях и лице.
Диагноз устанавливается, когда появляется диффузное утолщение кожи пальцев кистей и стоп, и эти изменения становятся проксимальными к метокарпо-, метотарзофалангеальным суставам. Этот признак практически патогмоничен для отличия системной и локальной формы склеродермии. Постепенно развивается диффузное поражение всех кожных покровов, которое может сопровождаться появлением телеангиоэктазий и подкожных кальцификатов, особенно в пальцах и локтевых суставах. В типичных случаях раньше всего поражается кожа лица и рук, затем шеи, груди, живота, ног).
При всех формах пигментные изменения часто чередуются с областями гипо- и гиперпигментации («соль с перцем»).
Для системной склеродермии характерным является поражение внутренних органов. На первом месте, несомненно, стоит поражение желудочно-кишечного тракта в виде нарушения его моторной функции. Наиболее часто диагностируется поражение пищевода - нарушение прохождения пищи по пищеводу и болью, необходимость запивать водой сухую пищу. Клинические симптомы достаточно выражены не более чем у половины больных. Однако при рентгенологическом исследовании отмечают нарушения пищевода в дистальном отделе и недостаточность кардии в виде рефлюкс-эзофагита.
Среди других висцеральных поражений является поражение сердца, при этом в патологический процесс вовлекаются все оболочки сердца и сосуды всех калибров, поэтому часто отмечается сочетанное поражение (перикардит и миокардит).
Среди вариантов системной склеродермии выделяют относительно благоприятно текущий CREST-синдром (аббревиатура от латинских слов: кальциноз, Рейно, пищевод, склеродактилия, телеангиэктация) с медленным развитием висцеральных поражений (включая тяжелую легочную гипертензию и биллиарный цирроз). Ранее он был известен как синдром Тибьериса-Вейссенбаха.
Практически все формы склеродермии протекают с малой лабораторной активностью.
Диагноз и дифференциальный диагноз. При наличии типичных изменений кожи диагноз не труден. В плане дифференциальной диагностики напоминают склеродермию следующие заболевания (состояния) - склеродерма (синдром China-Doll, синдром Бушке). Одномоментное развитие индуративного отека шеи, плечевого пояса, лица, реже туловища, реже проксимальных и никогда дистальных отделов конечностей, обратное развитие без атрофии кожи помогает поставить правильный диагноз.
При системной склеродермии надежный диагноз может быть поставлен только при появлении типичных изменений. Так считается, что наличие проксимальной склеродермии (склеротические изменения кожи проксимальнее лучезапястных суставов) является уже достаточным для постановки диагноза (большой критерий). К малым критериям относятся:
- склеродактилия;
- изъязвление подушечек пальцев;
- двусторонний базальный пневмосклероз.
При наличии двух из трех перечисленных симптомов также считается достаточным для постановки диагноза системной склеродермии.
Лечение. В связи с тем что очаговые формы склеродермии очень редко трасформируются в системную и более чем в половине случаев не дают распространения, основная терапия ограничивается местным использованием средств, улучшающих микроциркуляцию. Может быть показано использование гепариновой мази, димексида или димексида с добавлением гепарина. При наличии синдрома Рейно и при больших площадях поражения можно рекомендовать антиагреганты - аспирин в дозах 10-15 мг на кг массы в сутки, курантил, препараты, содержащие никотиновую кислоту.
Хороший эффект был получен при использовании нифедипина (блокатор кальциевых каналов) из расчета 0,3-0,5 мг в сутки, особенно в начальных стадиях (индурации). При прогрессировании кожного процесса могут быть использованы глюкокортикоиды (преднизолон в умеренной дозе 0,5 мг на кг массы тела в сутки), возможно применение D-пеницилламина (дозы см. выше в разделе ЮХА).
При системной склеродермии, кроме препаратов улучшающих микроциркуляцию, остальные терапевтические средства могут рассматриваться как симптоматические.
В последнее время появились обнадеживающие наблюдения об успешном использовании циклоспарина и метотрексата у взрослых больных.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА (СКВ). M32
По современным представлениям СКВ можно рассматривать как исходно полисистемное, хроническое, прогрессирующее заболевание. У детей встречается относительно редко, составляя 1-1,5 ребенка на 100 тыс. и преимущественно у девочек в период полового созревания.
Этиология и патогенез. Несмотря на отсутствие подтвержденного этиологического фактора, описан ряд воздействий, которые могут играть роль запускающего механизма и особенно обострение заболевания. К ним относятся прежде всего ультрафиолетовое воздействие и лекарственные препараты.
Большую роль играют аллергические реакции, особенно медикаментозные. К лекарственным препаратам, индуцирующим развитие СКВ, относятся противосудорожные средства, сульфониламиды, контрацептивы, Д-пеницилламин, тиреоидин.
Среди конкретных механизмов развития болезни доказано влияние иммунных нарушений в Т-клеточном аппарате и в продукции цитокинов, которые принимают участие в активации и дифференциации В-лимфоцитов в антителпродуцирующие клетки.
Значение генетических факторов подтверждаются нередкими указаниями на ревматические болезни в семье, высокой поражаемостью монозиготных близнецов, дефицитом С4-комплемента.
Есть мнение о влиянии вирусной инфекции на развитие СКВ, причем эта вирусная инфекция сходна с ВИЧ-инфекцией, так как вызывает сходные иммунные нарушения.
Клиника. Распространенное поражение тканей при системной красной волчанке отличает это заболевание пестротой клинической картины и возможностью многочисленных клинических вариантов течения патологического процесса.
Болезнь чаще развивается с рецидивирующего артрита, напоминающего ревматический артрит, недомогания и слабости (астеновегетативный синдром), повышение температуры, различных кожных высыпаний, трофических расстройств, быстрого похудания. Реже
болезнь начинается внезапно - с высокой температуры, резкой боли в суставах и их припухлости, выраженного кожного синдрома. При последующем рецидивирующем течении постепенно в процесс вовлекаются различные органы и системы. В типичных случаях наличие лихорадки, кожных высыпаний и артрита позволяют заподозрить
СКВ.
Частота встречаемости отдельных симптомов у разных авторов несколько отличается. В приложении ? 6 приведены данные в порядке убывания частоты.
В связи с тем что каждый из них имеет некоторые особенности, имеющие значение для диагностики, ниже приводятся характеристики каждого из них.
Артрит (синовит), наиболее частый симптом, проявляется в виде мигрирующих артралгий или артритов, реже в виде стойкого болевого синдрома с болевыми контрактурами. Поражаются преимущественно мелкие суставы кистей, лучезапястные, голеностопные суставы, реже коленные и тазобедренные. Типичным может считаться симметричность поражения. Суставной синдром сопровождается упорной миалгией, оссалгией. Зачастую болевой синдром не соответствует выраженности синовита.
Истинный синовит - характерный симптом заболевания. Обычно он бывает нестойким и редко вызывает деструктивные изменения хряща. Отсутствие эрозивных изменений является отличительным признаком синовита при СКВ от ревматоидного артрита. Характерным является то, что артриты при СКВ не упорны, нет экссудации, только периартикулярные изменения. Важным рентгенологическим признаком является формирование на дистальных фалангах участков просветления - остеолиза, так как асептические некрозы свойственны, прежде всего, волчанке.
Кожные покровы поражаются почти так же часто, как и суставы. Наиболее типичны эритематозные высыпания на лице в области скуловых дуг и спинки носа («бабочка»), но они наблюдаются не всегда. Среди других кожных проявлений необходимо отметить неспецифическую экссудативную эритему на коже конечностей, грудной клетки (по типу декольте), признаки фотодерматоза на открытых участках тела, очаги дискоидной эритемы на лице, груди, конечностях, может быть и крапивница.
Большое диагностическое значение имеют капилляриты на ладонях, которые в настоящее время рассматриваются как бы эквива-
лентом «бабочки». Диагностическое значение имеют и поражения слизистых оболочек: энантема на твердом нёбе, стоматит, в частности ангулярный, поражение красной каймы губ.
Определенное диагностическое значение имеет совокупность общетрофических расстройств в сочетании с резким похуданием. Среди них довольно рано появляются повышенное выпадение волос, повышенная их ломкость, трофические изменения ногтей, кожи, афтозно-язвенный стоматит. Алопеция может быть одним из первых изолированных симптомов заболевания.
Поражение ретикулогистиоцитарной системы характеризуется развитием полиадении - весьма частым и, по-видимому, ранним признаком генерализации процесса, а также увеличением печени и селезенки. Наличие пролиферативного синдрома требует исключения онкологической патологии (лимогрануломатоз и др.).
Симптомы поражения желудочно-кишечного тракта очень разнообразны. К ним относятся анорексия, тошнота, рвота, диарея, боли в животе. Боли в животе могут быть столь интенсивными, что возникает клиническая картина острого живота. Эти симптомы обусловлены различными изменениями, включая артериит, перитонит, перигепатит, панкреатит.
Поражение почек - волчаночный гломерулонефрит, люпуснефрит - классический иммунокомплексный нефрит, наблюдаемый в половине случаев, обычно в период генерализации процесса. В целом клиническая картина патологии почек соответствует общеизвестной. При патологии почек у больных с рецидивирующим суставным синдромом, лихорадкой и стойко увеличенной СОЭ необходимо исключить волчаночную природу нефрита.
Поражение серозных оболочек - признак классической триады (дерматит, артрит, полисерозит) - наблюдается почти у 90% больных. Особенно часто поражается плевра (45 %), перикард (30 %), реже - брюшина в виде сухого или выпотного серозита.
Поражения легких могут быть связаны с основным заболеванием или присоединением вторичной инфекции. Волчаночный воспалительный процесс в легких (пневмонит) либо развивается быстро, либо тянется месяцами.
Поражение сердечно-сосудистой системы весьма характерно для СКВ. Обычно поражаются последовательно 2 или 3 оболочки сердца. Наиболее часто отмечается поражение перикарда, имеющее тенденцию к рецидивам и облитерации перикарда.
Поражение периферического сосудистого русла проявляется в виде тромбофлебитов, в 25% случаев - нижних конечностей с развитием трофических язв, возможны некрозы фаланг и другие поражения. Возможно развитие синдрома Рейно (задолго до обнаружения болезни).
Поражение нервно-психической сферы выражено в различной степени у многих больных во всех фазах заболевания. Уже в самом начале заболевания выявляется астеновегетативный синдром: слабость, быстрая утомляемость, адинамия, раздражительность, подавленное настроение, головная боль, нарушение сна, повышенная потливость и т.д. Часто доминируют церебральные васкулиты (в 10-15% случаев в дебюте заболевания). Возможны и необычные проявления в виде хореи, эпилептоидных приступов.
Среди лабораторных показателей наиболее типичны следующие:
Гематологические нарушения - в клиническом анализе крови отмечается значительное повышение СОЭ до 60-70 мм/ч, практически у всех больных. Более чем у 50% больных выявляется лейкопения со сдвигом до молодых форм, в сочетании с лимфопенией. Весьма часто обнаруживаются умеренная гипохромная анемия, в редких случаях гемолитическая анемия, тромбоцитопения.
Иммунные нарушения - диагностическое значение имеет определение патогномоничного для СКВ большого числа LE клеток и антинуклеарных антител в высоком титре.
Большое значение придается антинуклеарным антителам, особенно в высоких «диагностических» титрах. Среди них - антитела к нативной ДНК, дезоксирибонуклеопротеиду, определяемые методом иммунофлюоресценции. Абсолютное диагностическое значение имеют антитела к Sm-ядерному антигену, однако они обнаруживаются не более чем у 1/3 больных.
Информативно также исследование комплемента крови: снижение его обычно коррелирует с активностью волчаночного нефрита.
Диагноз и дифференциальный диагноз. Диагноз системной красной волчанки основывается на многосистемности поражения (особенно характерным может считаться сочетание поражения суставов и почек), высокой, плохо поддающейся терапии лабораторной активности, обнаружения в крови LE клеток и антинуклеарного фактора, хотя они, правда редко, могут обнаруживаться и при диффузных заболеваниях соединительной ткани. При развернутой картине заболевания приходится проводить дифференциальный диагноз с ревматизмом, субсепсисом Висслера-Фанкони и узелковым периартериитом.
При СКВ-подобном синдроме, вызванном приемом лекарственных препаратов, патологические изменения быстро исчезают при их отмене.
Для постановки диагноза системной красной волчанки у детей могут быть использованы критерии, разработанные американской ревматологической ассоциацией для взрослых (пересмотр 1997 г.).
? п/п | Критерии | Определение |
1 | Высыпания в скуловой области | Фиксированная эритема, плоская или приподнимающаяся на скуловых дугах с тенденцией к распространению на назолабиальные складки |
2 | Дискоидные высыпания | Эритематозные приподнимающиеся бляшки с кератотическим нарушением и фолликулярными пробками; на старых очагах могут встречаться атрофические рубчики |
3 | Фотосенсибилизация | Кожные высыпания как результат необычной реакции на инсоляцию, по данным анамнеза или наблюдениям врача |
4 | Язвы полости рта | Язвы во рту или носоглоточной области, обычно безболезненные, наблюдаемые врачом |
5 | Артрит | Неэрозивный артрит двух периферических суставов или более, характеризующийся болезненностью, припухлостью или выпотом |
6 | Серозит | а) плеврит (плевральная боль в анамнезе, шум трения плевры при аускультации, плевральный выпот) и/или б) перикардит (шум трения перикарда, выпот в перикарде, ЭКГ-признаки) |
7 | Поражение почек | а) стойкая протеинурия более 0,5 г/сут или б) цилиндрурия (эритроцитарные, канальцевые, зернистые, смешанные цилиндры) |
8 | Неврологические нарушения | Судороги или психоз, не связанные с приемом лекарств или метаболическими нарушениями вследствие уремии, кетоацидоза, электролитного дисбаланса |
9 | Гематологические нарушения | а) гемолитическая анемия с ретикулоцитозом; б) лейкопения (менее 4х109/л) при двух определениях или более; в) лимфопения (менее 1,5х109/л) при двух исследованиях или более; г) тромбоцитопения (менее 100х109/л), не связанная с приемом лекарств |
? п/п | Критерии | Определение |
10 | Иммунные нарушения | а) антитела к нативной ДНК в повышенных титрах; б) наличие антител к Sm-антигену; в) наличие антифосфолипидных антител: повышенный титр антител к кардиолипину (lgМили IgG); выявление волчаночного антикоагулянта стандартным методом; ложноположительная реакция на сифилис в течение 6 мес по реакции иммобилизации или в тесте абсорбции флюоресцирующих антитрепонемных антител |
11 | Антинукле - арные антитела | Повышение титра АНА в тесте иммунофлюоресценции (или в другом), не связанное с приемом лекарств, способных вызывать лекарственную волчанку |
Примечание. Критерии АРА 1997 г. несколько отличаются от предыдущих, например пересмотра 1982 г.: перечень признаков не включает наличие LE-клеток, хотя в клинической практике этот тест по-прежнему широко используется, в качестве критерия рассматривается наличие антифосфолипидных антител.
При наличии у больного 4 признаков или более в любом сочетании диагноз СКВ считается достоверным. Чувствительность приведенных критериев, по данным разных авторов, составляет 78-96%, а специфичность - 89-96%.
Лечение. Учитывая тяжесть заболевания и часто неблагоприятный прогноз, лечение должно быть весьма активным. Только в самом начале заболевания при достоверном отсутствии поражения внутренних органов в терапии могут быть использованы негормональные противовоспалительные препараты (см. ЮХА). При развернутой клинической картине препаратами выбора являются глюкокортикоиды. Их назначают из расчета не менее 1-3 мг на кг массы в сутки равномерно в течение суток. При снижении активности, уровня антинуклеарных антител и положительной динамики со стороны пораженных внутренних органов дозу уменьшают, подбирая ее индивидуально (у больных СКВ не надо бояться проявлений синдрома Кушинга).
При достижении ремиссии можно перейти на интермитирующую схему терапии, которая продолжается длительно (месяцы, годы). Отсутствие эффекта от использования глюкокортикоидов в течение 1,5- 2 мес является показанием для применения гормонально-цитостатичес-
кой терапии. По нашим наблюдениям, наилучшим из цитостатических препаратов является циклофосфан (3-5 мг на кг массы в сутки).
При острейшем течении и волчаночных кризах с самого начала показана гормонально-цитостатическая терапия. Может быть использована и пульс-терапия (введение одномоментно до 1,0 метипреда, иногда совместно с циклофосфаном 10-15 мг на кг массы). В этих случаях может быть использован и плазмаферез.
В последние годы появились попытки лечения системной красной волчанки без использования в терапии глюкокортикоидов, дающим у большинства больных много побочных эффектов, особенно при длительном использовании. Например, обсуждается возможность применения циклофосфана совместно с метатрексатом, а также использования циклоспоринов. Данные схемы находятся в состоянии клинической апробации и не могут быть рекомендованы для широкого использования.
ДЕРМАТОМИОЗИТ (М33)
Дерматомиозит у детей - системное заболевание мышц, кожных покровов и сосудов микроциркуляторного русла с неярким поражением внутренних органов, нередко осложняющееся кальцинозом и гнойной инфекцией.
Считается, что дерматомиозит занимает третье место среди диффузных заболеваний соединительной ткани у детей после склеродермии и системной красной волчанки. Достоверных данных о распространенности данной патологии нет. Чаще заболевают девочки, соотношение девочек и мальчиков составляет 1,5:1. Регистрируются два возрастных пика заболеваемости у детей в 3-5 и 7-9 лет.
Этиология и патогенез. Возбудитель дерматомиозита не установлен. Однако в последние годы высказывается мнение, что пусковым фактором может являться вирусная инфекция, в частности Коксаки А2 и В. При дерматомиозите у детей достаточно часто обнаруживают антитела к этим возбудителям.
В патогенезе предполагается, что после разрушения мышечной ткани (возможно, вирусной природы) образуются антитела к цитоплазматическим белкам, мышечной ткани и сосудистой стенке, которые в последующем приобретают аутоагрессивные свойства, поддерживая прогрессирование патологического процесса.
Клиника. Наиболее характерным для дерматомиозита является поражение кожи и мышц. В типичных случаях, которые встречаются, к сожалению, не так часто, поражение кожи является достаточно характерным для данной патологии. Это проявляется в лиловой окраске верхних век (гелиотронные веки, «очки»), периорбитальная эритема и отечность век и отечность век и супраорбитальной области, ушных раковин. Особенностью эритемы на лице в отличие, например, от СКВ является ее цианотичный оттенок, недаром дерматомиозит нередко называют «лиловой болезнью».
Кроме эритемы на лице достаточно типичными являются высыпания над межфланговыми и пястно-фаланговыми суставами кистей рук (синдром Готтрона), которые трансформируются в своеобразные депигментированные атрофические рубчики настолько характерными, что считаются «визитной карточкой» болезни. Кроме кистей сыпь нередко располагается вокруг крупных суставов, чаще локтевых и коленных, иногда она является полиморфной, когда на коже имеются разнообразные высыпания и очаги гипо- и гиперпигментации - пойкилодермия.
Поражение сосудов проявляется в виде вертикальных ногтевых телеангиоэктазий, капилляритами ладоней, сетчатым ливедо на груди, спине, в подмышечных областях и на конечностях. Сосудистые поражения могут осложняться некрозами, изъязвлениями, отложениями кальция.
Поражение мышц или миопатический синдром - не только обязательное, но иногда и единственное проявление данного заболевания (полимиозит). Наблюдаются отек, тестоватость или плотность мышц, нередко болезненность при пальпации, быстро нарастающая слабость. Достаточно характерным для дерматомиозита (нередко используемым для дифференциальной диагностики с миозитами другого происхождения) является симметричное поражение проксимальных мышц конечностей. В этих случаях у ребенка появляются типичные жалобы - он с трудом поднимается по лестнице, не может подняться из положения приседа, самостоятельно встать с горшка (симптом «горшка»). Ребенок лежит в вынужденной позе на спине или боку и не может самостоятельно подняться или делает это с так называемыми миопатическими приемами, сначала поворачиваясь на бок и приподнимаясь с участием рук.
В тяжелых случаях снижаются рефлексы, развивается миогенный парез или паралич, в том числе и прогностически наиболее небла-
гоприятный миогенный бульбарный (псевдобульбарный) синдром с явлениями дисфагии, дисфонии, дизартрии. Дети плохо глотают, поперхиваются, жидкая пища может выливаться через рот с возможной аспирацией, речь гнусавая, тихая, неразборчивая. Возможны расстройства дыхания за счет ограничения экскурсии грудной клетки.
Одним из возможных тяжелых осложнений дерматомиозита является кальциноз (оссификация) мышц. Оно развивается обычно на 2-3-м году заболевания. Локализуются кальцинаты в толще пораженных мышц, реже в подкожной клетчатке вокруг локтевых, кожных суставов обычно на месте некрозов, изъязвлений.
Поражения внутренних органов при дерматомиозите у детей обычно не имеют ярких клинических черт.
По течению, приблизительно у четвертой части больных, заболевание начинается остро - с высокой лихорадкой, яркими проявлениями дерматита и быстро нарастающими мышечными поражениями, с болевым синдромом, прогрессирующей мышечной слабостью, вплоть до полной обездвиженности и псевдобульбарного синдрома. Параллельно наблюдается ускорение СОЭ, умеренный лейкоцитоз со сдвигом влево.
Наиболее часто заболевание протекает подостро, нарастание клинических признаков поражения кожи и мышц постепенное, температура, изменения со стороны клинических анализов крови могут отсутствовать.
Из лабораторных показателей в диагностике поражения мышц являются повышение активности трансфераз (АсАТ и АлАТ), альдолазы, лактатдегирогеназы (ЛДГ), креатинфосфаткиназы (КФК), креатинурия. Их изменение в значительной степени зависит от активности процесса.
Диагноз и дифференциальный диагноз. В случаях острого течения возникают проблемы диагностики с началом СКВ, смешанной болезнью соединительной ткани и острыми миозитами, преимущественно вирусной этиологии.
При подостром течении дерматомиозита трудности возникают при разграничении с полирадикулоневритом и различными заболеваниями мышц (миастения, прогрессирующая мышечная дистрофия и др.).
В настоящее время наиболее удачными можно считать диагностические критерии дерматомиозита (ДМ) и полимиозита (ПМ), предложенные Bohan и соавторами в 1975 г:
1. Прогрессирующая мышечная слабость с последующим присоединением дисфагии и нарушением акта дыхания.
2. Изменения в мышцах при биопсии (некроз мышечных волокон, периваскулярная инфильтрация; фагоцитоз, процессы регенерации с базофилией и образованием крупных ядер в сарколемме, перифасциальная атрофия, воспалительный экссулат).
3. Повышение ферментативной активности сыворотки крови (КФК, аминотрансферазы и ЛДГ).
4. Короткие, мелкие, полифазные моторные единицы, фибрилляции и т.п. при электромиографическом исследовании.
5. Характерные изменения кожных покровов, включающие гелиотропную окраску век с периорбитальным отеком, чешуйчатый эритематозный дерматит тыльной поверхности кистей, чаще над пястно-фаланговыми (симптом Готтрона), коленными и локтевыми суставами, а также на лице, шее, верхней половине грудной клетки.
Диагноз считается достоверным при наличии 3-4 критериев, в том числе кожных изменений для ДМ и 4 критериев для ПМ.
Диагноз рассматривается как вероятный при 2 критериях с кожными изменениями для ДМ и при 3 - для ПМ и как возможный - при 1 критерии в сочетании с кожными проявлениями для ДМ и 2 критериях для ПМ.
Лечение. Препаратом выбора при дерматомиозите является преднизолон, его назначают из расчета 1-2 мг/кг в сутки. Контролем его эффективности являются уровень мышечных ферментов и уменьшение клинических проявлений. При остром течении, особенно при псевдобульбарном синдроме и поражении дыхательной мускулатуры, его доза может быть увеличена до 3-5 мг/кг в сутки и даже использована пульс-терапия - трехкратно ежедневно или через день.
При получении эффекта дозу снижают до поддерживающей, которую подбирают индивидуально. Отсутствие эффекта в течение 2-4 недель или поддерживающая доза выше 0,5 мг/кг в сутки служат показанием для назначения цитостатических препаратов. Среди этих препаратов средством выбора при дерматомиозите считается метотрексат (орально по 5-7 мг два дня подряд в неделю или парентерально от 10 до 50 мг 1 раз в неделю). Не худший эффект можно получить при использовании циклофосфана (3-5 мг/кг в сутки, недельную дозу вводят 2 раза в неделю в/м).
При кальцинатах можно применять двунатриевую соль этилендиаминтетрауксусной кислоты (Na2 ЭДТА) капельно внутривенно от 5
до 10 мл в 5% растворе глюкозы (150-200 мл) со скоростью около 15 капель в 1 минуту. К сожалению, при уже сформированных кальцификатах эффект от такой терапии незначительный.
СМЕШАННАЯ БОЛЕЗНЬ СОЕДИНИТЕЛЬНОЙ ТКАНИ
(СБСТ) M35.1
Смешанная болезнь соединительной ткани, или болезнь Шарпа, сравнительно недавно (1972) выделена в самостоятельную нозологическую форму. Она протекает с признаками системной красной волчанки, дерматомиозита и системной склеродермии в разных сочетаниях. Нередко в ходе своего развития она приобретает окончательные черты одного из перечисленных выше заболеваний.
У детей СБСТ встречается достаточно редко с преимущественным поражением девочек.
Как и все диффузные заболевания соединительной ткани, она имеет иммунопатологический, прогрессирующий характер. Отличительной особенностью патогенеза является высокий титр антител к рибонуклеопротеиду (nRNP).
Клиника. Клиническая картина смешанной болезни соединительной ткани практически не отличается от проявлений заболевания у взрослых. По суммарным данным, приводимым в литературе, частота встречаемости клинико-лабораторных признаков, суммированы в таблице, приведенной в приложении ? 7.
Диагноз и дифференциальный диагноз. В постановке диагноза можно пользоваться диагностическими критериями, предложенными в 1987 г. Kasukawa и др.
I. Общие симптомы:
1. Феномен Рейно.
2. Опухание пальцев или кистей.
II. Антитела к nRNP.
III. Смешанные проявления: 1. СКВ-подобные:
- полиартрит;
- лимфаденопатия;
- эритема на лице;
- перикардит или плеврит;
- лейкопения или тромбоцитопения;
2. ССД-подобные:
- склеродактилия;
- легочный фиброз, ристриктивные изменения легких или снижение диффузионной способности;
- гипомобильность или дилатация пищевода;
3. ДМ-подобные:
- мышечная слабость;
- повышенный уровень мышечных энзимов в сыворотке (КФК);
- миогенная ЭМГ.
Для диагноза необходимо: наличие одного из двух общих симптомов, наличие антител к nRNP (нуклеарный рибонуклеопротеин), положительный один признак или более из числа клинических проявлений.
Лечение. Препаратом выбора при СБСТ являются глюкокортикоиды, при умеренной активности в дозе 0,5-1,0 мг/кг в сутки, при высокой 1,0-2,0-3,0 мг/кг в сутки. В случаях недостаточного эффекта и прогрессировании, особенно со стороны внутренних органов, лечебная тактика не отличается от ведения больных с системной красной волчанкой.
СИСТЕМНЫЕ ВАСКУЛИТЫ (M30-M31)
К системным васкулитам может быть отнесена группа заболеваний, в основе которых лежит преимущественное поражение сосудов любого калибра по типу очагового или сегментарного поражения и некроза.
Общего этиологического фактора при системных васкулитах не существует. В патогенезе основное значение придают иммунопатологическим процессам, в первую очередь иммунокомплексным. Особое значение могут иметь реологические и микроциркуляторные нарушения, приводящие к гиперкоагуляции с возможным развитием ДВС-синдрома.
Наиболее приемлемой может считаться классификация, основанная на морфологической основе, в зависимости от доминирующего типа пораженных сосудов (приложение ? 8).
Клиника. В связи с системным поражением сосудистой системы клинические проявления всей группы заболеваний весьма многообразны и достаточно близки (приложение ? 9).
Однако каждая нозологическая форма имеет преимущественные отличительные особенности, что позволяет поставить правильный диагноз. У детей из первичных системных васкулитов наиболее часто встречается геморрагический васкулит (болезнь Шенлейна-Геноха), реже узелковый периартериит, гранулематоз Вегенера, болезнь Бехчета и неспецифический аортоаортит (болезнь Такаясу).
Узелковый периартериит. Начало заболевания в основном острое. Лихорадка носит обычно неправильный характер. Имеются общие проявления интоксикации - головная боль, нарушения сна, недомогание. У детей различают две формы - кожную и системную. Типичным для первой формы является поражение кожи в виде самых разнообразных высыпаний, чаще геморрагического характера. В последующем на месте поражений, в периферических областях (пальцы кистей и стоп, кончик носа, ушные раковины) могут возникнуть некрозы, атрофии. В местах поражения присутствует болевой синдром, нередко отмечаются жалобы на суставные и мышечные боли.
При системной форме, наряду с кожными высыпаниями, на первый план выходят органные поражения. Наиболее частыми из них являются поражения желудочно-кишечного тракта (боли в животе, нарушения стула, кишечные кровотечения). Характерным и прогностически наиболее неблагоприятным является поражение почек в виде гематурической формы гломерулонефрита со стойкой гипертензией. Нередки церебральные сосудистые кризы, коронарные изменения. Любые формы узелкового периартрита сопровождаются высокой лабораторной активностью.
Гранулематоз Вегенера - некротический гранулематоз верхних дыхательных путей, глазной орбиты или легких, нередко сочетающийся с системным васкулитом. В детском возрасте наблюдается значительно реже, чем у взрослых. Заболевание, как правило, начинается остро; с неспецифических проявлений васкулита - лихорадка, артралгии, носовые кровотечения, конъюнктивит, отек век или щеки. Клинические признаки локального гранулематоза присоединяются на 2-4-й неделе от начала заболевания в виде синусита, язвенно-некротического поражения ЛОР-органов, гранулематоза области орбит, очаговых изменений в ткани легких. Из внутренних органов в патологический процесс наиболее часто вовлекаются почки, вплоть до развития гломерулонефрита.
Болезнь Бехчета - своеобразная форма системного васкулита, которая характеризуется рецидивирующим эрозивно-язвенным
поражением слизистых оболочек полости рта и (или) гениталий в сочетании с несколькими неспецифическими синдромами - кожным с некрозами, узловатой эритемой, суставным, чаще всего в виде моноили олигоартрита крупных суставов, желудочно-кишечного тракта (эрозивно-язвенные поражения пищевода, желудка, двенадцатиперстной кишки), глаз (иридоциклиты, панувеиты) и нервной системы в виде менингоэнцефалита. Заболевание чаще развивается у жителей Средиземноморья и Японии.
Неспецифический аортоаортит (болезнь Такаясу, болезнь отсутствия пульса) - может рассматриваться как деструктивно-продуктивный сегментарный аортит и субаортальный панартериит с возможным поражением коронарных и легочных сосудов. Достаточно типичным является формирование аневризм и/или стенозов аорты, вплоть до сегментарной артериальной окклюзии. В начальной стадии заболевания преобладают общевоспалительные проявления (лихорадка разной степени выраженности), боли в мышцах и суставах, кожный синдром (геморрагическая или полиморфная сыпь, узловатая эритема). Обычно в этот период определяется и лабораторная активность (увеличение СОЭ, лейкоцитоз, положительный СРБ и др.).
Основные клинические (ишемические) синдромы активного периода коррелируют с локализацией поражения крупных сосудов. Наиболее типичными могут считаться признаки недостаточности периферического кровотока, кардиоваскулярный синдром, артериальная гипертензия.
Полиартериит с поражением легких (синдром Чарга-Стросса) - системный некротизирующий васкулит мелких и средних артерий с развитием гранилематозного воспаления и вовлечением в патологический процесс дыхательных путей. Данное заболевание преимущественно встречается у взрослых, у детей диагностируется редко и не имеет отличных черт от взрослых.
Заболевание обычно развивается подостро - с проявлений бронхообструктивного синдрома с тенденцией к прогрессированию, характерным является нарастающая эозинофилия. При рентгенологическом обследовании могут выявляться нестойкие легочные инфильтраты (синдром Леффлера). По мере развития заболевания у больных появляется лихорадка, снижается масса тела и появляются клинические симптомы, характерные для узелкового периартериита. Отличительной особенностью является высокая эозинофилия, менее выраженное поражение почек и желудочно-кишечного тракта.
До появления признаков системного васкулита заболевание обычно трактуется как бронхиальная астма.
Слизисто-кожный лимфонодулярный синдром (болезнь Кавасаки) описан в 1987 г. в качестве новой нозологической формы. Заболевание в основном регистрируется в странах Юго-Восточной Азии (Япония, Китай, Корея). Наиболее распространенным является мнение об инфекционной природе заболевания, хотя конкретный возбудитель не выявлен, активно обсуждаются проблемы расовой принадлежности.
Обычно болезнь Кавасаки протекает в три стадии:
- острая лихорадочная;
- подострая;
- выздоровление.
Первая стадия заболевания сопровождается высокой лихорадкой, конъюнктивитом, гиперемией слизистой оболочки губ, рта и глотки. Параллельно появляются гиперемия и плотный отек кистей и стоп с последующей десквамацией, полиморфная сыпь на туловище.
Характерным является значительное увеличение лимфатических желез. Возможен реактивный артрит. Типичным для болезни Кавасаки считается поражение сердца: расширение границ, нарушение ритма, систолический шум. При ЭКГ-обследовании регистрируются признаки ишемии и/или инфаркта миокарда. Именно поражение сердца определяет прогноз заболевания, поскольку у 10-20% больных развиваются аневризмы коронарных сосудов. Поражение почек, печени, желудочно-кишечного тракта встречаются относительно редко. Острый период всегда сопровождается лабораторной активностью (ускорение СОЭ, лейкоцитоз).
Через 7-14 дней все клинические симптомы претерпевают обратное развитие. Спустя 6-10 нед наступает выздоровление у большинства детей.
В терапии основным методом является сочетание ацетилсалициловой кислоты с в/в введением иммуноглобулина. Ацетилсалициловую кислоту назначают из расчета 30-40 мг на кг массы в сутки, после снижения лихорадки используют общепринятые дозы на протяжении 6 недель. Доза иммуноглобулина колеблется от 200 до 2000 ЕД мг/кг 3-5 дней.
Дифференциальный диагноз. Для всех системных васкулитов наиболее значимо разделение первичных и вторичных системных васкулитов (перечень возможных причин вторичных васкулитов приведен в таблице классификации системных васкулитов).
Лечение. При системных васкулитах терапия ориентирована на преимущественное поражение сосудов. С этих позиций наиболее удачными представляются рекомендации DGL (Scott, RA Watts, 1994).
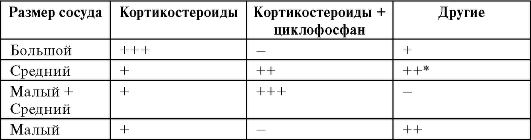 * Включая плазмафарез, антивирусную терапию при васкулитах, ассоциированных с гепатитом В, и внутривенное введение иммуноглобулина при болезни Кавасаки.
* Включая плазмафарез, антивирусную терапию при васкулитах, ассоциированных с гепатитом В, и внутривенное введение иммуноглобулина при болезни Кавасаки.
При остром начале и высокой активности показана пульс-терапия метипредом с последующим переходом на базисную терапию.