Руководство к практическим занятиям по гигиене труда : учебное пособие для вузов / Под ред. В.Ф. Кириллова. - 2008. - 416 с. : ил.
|
|
|
|
ГЛАВА 11 ГИГИЕНИЧЕСКИЙ КОНТРОЛЬ БИОТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Биологический фактор определяется как совокупность биологических объектов, воздействие которых на человека и окружающую среду связано с их способностью размножаться в естественных или искусственных условиях либо продуцировать биологически активные вещества.
Биотехнология - технология получения необходимых человеку продуктов из живых клеток различного происхождения. На предприятиях, использующих биотехнологии, основой производства является применение в процессах микробного синтеза различных видов промышленных микроорганизмов. Штаммы микроорганиз- мов-продуцентов должны быть либо невирулентными и нетоксичными, либо обладать чрезвычайно слабыми вирулентными и токсигенными свойствами.
Критериями потенциальной опасности промышленных штаммов микроорганизмов являются уровни их сенсибилизирующего, иммуномоделирующего и антимикробного действия на организм.
При воздействии на организм производственных факторов биологической природы у рабочих могут возникать изменения иммуно- логического гомеостаза, что проявляется поражениями кожи (эпидермиты, экземы, крапивница), дыхательных путей (вазомоторный ринит, бронхиты, бронхиальная астма), изменениями в составе микрофлоры кишечника (дисбактериоз) и др.
Основными компонентами биологического фактора, оказывающего прямое или опосредованное влияние на человека, является микро- и макроорганизмы, продукты метаболической деятельности микроорганизмов и микробиологического синтеза.
Микроорганизмы, используемые в качестве промышленных штаммов, относятся (ГОСТ 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности») к 3-му и 4-му классам опасности (по классификации ВОЗ это соответствует 2-й группе риска - умеренный индивидуальный риск и ограниченный риск для населения в целом):
- к 3-му классу опасности - микроорганизмы-продуценты и микроорганизмы, входящие в состав бактериальных препаратов, предельно допустимая концентрация (ПДК) которых не превышает или равна 5000 клеток/м3;
- к 4-му классу - микроорганизмы-продуценты, микроорганизмы, входящие в состав бактериальных препаратов, ПДК которых более 5000 клеток/м3 (ГН 2178-07 «Предельно допустимые концентрации (ПДК) микроорганизмов-продуцентов, бактериальных препаратов и их компонентов в воздухе рабочей зоны»).
Все формы технологии по товарной продукции можно разделить на три основные группы:
- первая группа - имеющие в продукте в качестве основного активного компонента жизнеспособные микроорганизмы (средства защиты растений, бактериальные удобрения, закваски для силосования кормов, биодеграданты и другие средства биотрансформации);
- вторая группа - включающие активированную биомассу клеток и продукты ее переработки (кормовые дрожжи, грибной мицелий и др.);
- третья группа - полученные на основе очищенных продуктов метаболизма (витамины, аминокислоты, ферменты, антибиотики, биолипиды, полисахариды, продукты комплексной переработки микробных биомасс и метаболитов).
Технология производства медицинских препаратов на основе микробиологического синтеза характеризуется периодичностью процессов и состоит из ряда последовательных стадий:
• приготовление посевного материала и питательной среды;
• выращивание и культивирование штаммов-продуцентов (ферментация);
• фильтрация или сепарирование культуральной жидкости;
• выделение необходимого продукта из нативного раствора и его очистка;
• сушка;
• фасовка и упаковка готового продукта.
Современное промышленное производство продуктов микробиологического синтеза представляет собой единую биотехнологическую систему, которая складывается из последовательных стадий и операций, количество и особенности которых зависят от вида производимой продукции и ее товарной формы.
В этой системе можно выделить два основных этапа:
- культивацию клеток-продуцентов;
- обработку биомассы для получения необходимой товарной формы.
Первый этап. Культивация клеток-продуцентов. На данном этапе происходит приготовление посевного материала и питательной среды, выращивание и культивирование микроорганизмов-продуцентов (ферменция), фильтрация или сепарирование культуральной жидкости (сепарация).
При осуществлении этого этапа наиболее неблагоприятным фактором является загрязненность воздуха рабочих помещений микроорганизмами: продуцентами, биопрепаратами и их компонентами. Эти продукты присутствуют в воздухе рабочей зоны в виде аэрозолей. Величины ПДК для них являются максимальны- ми - ПДКм; они выражены в микробных клетках на
Содержание микробов-продуцентов, бакпрепаратов и их компонентов в воздухе рабочей зоны подлежит контролю в соответствии с требованиями методических указаний «Обоснование ПДК мик- роорганизмов-продуцентов и содержащих их готовых препаратов в объектах производственной и окружающий среды» ? 5789/1-91, утвержденных Минздравом СССР.
Классы условий труда устанавливают согласно «Руководству по гигиенической оценке факторов рабочей среды и трудового процесса. Критерии и классификация условий труда» 2.2.2006-05 для микро- организмов (табл. 11.2).
Второй этап. Обработка биомассы с целью получения необходимой товарной формы. Это конечные стадии технологического процесса: упаковка и погрузка готовой продукции. При выполнении этих операций в воздушной среде помещений обнаруживается большая концентрация высокодисперсной пыли биопрепаратов. Величина предельно допустимых концентраций для такой пыли являтся мак- симальной (ПДКм). Она выражается в единицах объема - мг/м3.
Гигиенические критерии при воздействии факторов биологической природы - продуктов микробиологического синтеза представлены в табл. 11.3.
Для веществ с возможным остронаправленным, раздражающим действием противоопухолевых лекарственных препаратов,
Таблица 11.1. Предельно допустимые концентрации в воздухе рабочей зоны (экспликация из ГН 2.2.6.2178-07)
а) микроорганизмов-продуцентов и компонентов бактериальных препаратов
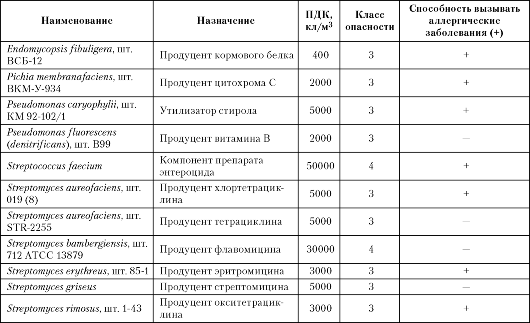
б) бактериальные препараты

Таблица 11.2. Классы условий труда в зависимости от содержания в воздухе рабочей зоны биологического фактора (превышение ПДК, раз)
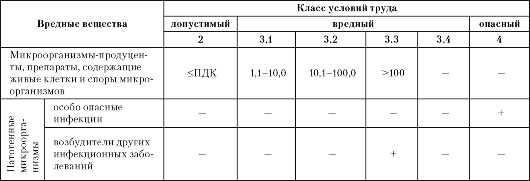
Таблица 11.3. Классы условий труда в зависимости от содержания в воздухе рабочей зоны вредных веществ (превышение ПДК, раз) (в соответствии с «Руководством по гигиенической оценке факторов рабочей среды и трудового процесса. Критерии и классификация условий труда» Ρ 2.2.2006-05)
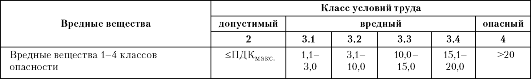
канцерогенов и опасных для репродуктивной функции кратность превышения ПДК, определяющая класс условий труда, как правило, иная (см. табл. 1 «Руководства... 2.2.2006-05»)
Контроль содержания микроорганизмов в воздухе рабочей зоны
(«Руководство... 2.2.2006-2006-05, приложение 10). Методика определяет требования к измерению в воздухе рабочей зоны концентраций микроорганизмов, живых клеток и спор, находящихся в составе товарных форм бактериальных препаратов, на биотехнологических предприятиях, а также в воздухе общественных и промышленных зданий.
К использованию в технологических процессах допускаются штаммы микроорганизмов, разрешенных к применению Федеральной службой по надзору в сфере защиты прав потребителей и благополучия населения (Роспотребнадзор).
Метод основан на аспирации микроорганизмов из воздуха на поверхность плотных питательных средств: элективных (избирательных для данного организма) или элективно-дифференциальных (путем добавления в среду ингибиторов - антибиотиков, красителей и др.). После инкубации в термостате по типичным морфологическим признакам проводится подсчет колоний, выросших на 2-4 сутки (и более) после посева пробы воздуха.
Микроорганизмы, выросшие на чашке Петри, подлежат макро- и микроскопической идентификации. К макроскопическим призна- кам относятся форма и размер колоний, их цвет, консистенция, к микроскопическим - форма (кокки, бациллы и т.п.), подвижность (количество жгутиков), отношение к окраске по Граму, наличие спор и капсул.
Для дальнейшей идентификации и дифференциации микроорганизмов могут быть использованы биохимические методы, различные автоматизированные системы, а также любые современные методы идентификации микроорганизмов.
При отборе проб дается краткая характеристика микроорганизмов: указываются семейство, род, вид, штамм, морфологическая характеристика колоний и оптимальные условия их роста на твердой питательной среде (рН, Т?).
Контроль проводится при следующих производственных процессах:
• засеве инокуляторов в зоне дыхания и между инокуляторами;
• отборе проб из инокуляторов;
• засеве посевных аппаратов (при условии прямого засеивания);
• отборе проб из посевных аппаратов у пробника и между посевными аппаратами;
• отборе проб из ферментеров;
• спуске культуральной жидкости из ферментеров в коагуляторы или прямо на фильтрацию.
Если в технологическом процессе имеет место сушка биомассы, то отбор проб проводится при:
• перемешивании;
• выгрузке из сушильных аппаратов;
• фасовке биомассы.
При текущем контроле в одном помещении число точек должно быть не менее трех.
Для
сравнительного анализа концентраций микроорганизмов в воздухе рабочей
зоны отбор проб должен проводиться не реже раза в неделю в аналогичной
ситуации (высота установки прибора
В качестве прибора для бактериологического анализа воздуха используется импактор воздуха микробиологический «Флора-100», позволяющий отбирать заданный объем воздуха и осаждать биологический аэрозоль на чашку Петри с плотной питательной средой.
Применяемый метод позволяет учитывать на чашке Петри до 150-200 колоний. Результаты рассчитывают в кл/м3 по следующей формуле:

Результаты замеров заносят в протокол.

Контроль воздуха на содержание вредных веществ биологической природы - продуктов микробного синтеза (ферменты, витамины, антибиотики и др.) проводится так, как это принято для химических веществ.
К
примеру, для определения в воздухе рабочей зоны готового продукта
производства белково-витаминного концентрата (БВК) - пыли этого
концентрата - рекомендуется использовать фотометрический метод
определения БВК по белку (Методические рекомендации
Для определения БВК исследуемый воздух аспирируют в течение 30 мин через фильтр АФА, который затем помещают в широкогорлую колбу, добавляют соответствующие реактивы, фотометрируют и рассчитывают содержание белка по предварительно построенному калибровочному графику.
Методы общего микробиологического контроля в чистых помещениях. Чистые помещения - это помещения, в воздушной среде которых концентрация живых и механических частиц поддержива- ется в соответствии с классом чистоты.
В
фармацевтической промышленности используется следующая классификация
по классам чистоты воздуха помещения (исходя из количества частиц,
содержащихся в
- классы чистоты А, В (100) - зоны производства, в которых осуществляются основные асептические операции;
- классы чистоты С (10 000) и D (100 000) - зоны вспомогательные. Подробнее см. Методические указания МУ33.2.056-96 «Определение класса чистоты производственных помещений и рабочих мест».
В качестве руководства по методам общего микробиологического контроля при производстве медицинских иммунобиологических препаратов (МИБП) следует использовать Методические указания «Микробиологический мониторинг производственной среды» (МУК 4.2.734-99). Этот документ включает в себя контроль воздуха рабочих зон, поверхностей помещений и оборудования, рук и одежды персонала.
Основной целью программы оценки микробиологического состояния производственной среды является постоянная гарантия стабильности асептических условий производства МИБП, выявление начальных отклонений и выработка корректирующих действий до возникновения ситуаций, приводящих к появлению нестерильной продукции.
Процедуры микробиологического мониторинга обычно включают следующие элементы:
- выделение микроорганизмов из производственной среды (на агаровую поверхность, в питательный бульон или жидкость, на мембрану фильтра);
- посев, если требуется, на питательную среду и культивирование;
- учет и анализ результатов.
Выбор точек отбора проб. В первую очередь микробиологическому мониторингу должны подвергаться следующие элементы производственной среды:
• технологическое оборудование;
• инструментарий;
• рабочие поверхности;
• руки оператора в перчатках;
• одежда персонала;
• контейнеры, в которых хранится продукт;
• вода;
• сжатый воздух, инертные газы.
Реже, но периодически контролируемыми являются также:
• стены, пол и потолок помещения;
• двери;
• мебель и транспортные тележки;
• контейнеры для сбора отходов;
• инструменты и приборы для тестирования.
Число контрольных точек на одно помещение при текущем контроле должно быть следующим:
- воздух - не менее трех;
- поверхности - не менее трех;
- руки - у каждого оператора.
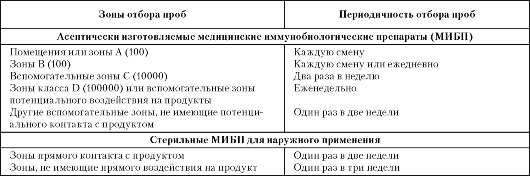
Частота и время отбора проб. Частота отбора проб зависит от установленного класса чистоты для данного помещения и от вида обработки, которой подвергается продукт далее в процессе его производства. Зоны класса А (100) должны проверяться каждую рабочую смену, зоны класса В (100) - также каждую смену или ежеднев- но; вспомогательные зоны - с меньшей периодичностью, например зоны класса С (10 000) два раза в неделю, зоны класса D (100 000) - еженедельно.
Для сравнительного анализа состояний производственной среды отбор проб должен проводиться в одно и то же фиксированное в плане время, т.е. приходиться на равнозначную по интенсивности технологического процесса временную точку.
Обязательными для отбора проб точками являются: воздух (во время работы), поверхности (перед работой), руки оператора (перед выполнением асептических манипуляций).
Дополнительно могут проводиться исследования по окончании работы для оценки бактериальной нагрузки за рабочую смену.
Технологический процесс, включающий ручные операции, имеет повышенный риск загрязнения продукта. В этих случаях частоту проведения текущего контроля следует, согласно табл. 11.4, увеличить.
Объем пробы воздуха должен быть достаточным как для обнаружения микроорганизмов в заданном объеме воздуха, так и для роста дискретных и пригодных к подсчету колоний на фильтрующей мембране или агаровой пластине.
Выбор питательной среды для проведения микробиологического мониторинга является одним из важных факторов. Питательная среда должна поддерживать рост широкого спектра микроорганизмов, включая дрожжи и грибы.
Все выявленные в процессе мониторинга окружающей среды микроорганизмы подлежат обязательной макроскопической (форма, цвет, консистенция колоний) и микроскопической идентификации окра- шенных по Граму мазков. Результаты исследований должны регистрироваться в документах, где указывают основные морфологические признаки: отношение к окраске по Граму, наличие или отсутствие спорообразования, форма микроорганизмов (кокки, палочки и т.д.).
Кроме указанных методов морфологической идентификации, существуют также биохимические тест-системы и идентификацион- ные автоматизированные системы.
Методы тестирования воздушной среды. Микроорганизмы потенциально всегда присутствуют в воздухе контролируемой зоны, так как фильтры, используемые для очистки воздуха, не имеют абсолютной эффективности, даже тогда, когда работают в специфицированных условиях (классы чистоты А (100) и В (100).
Основной целью микробиологического контроля воздуха асептической зоны является определение уровня и спектра микробной загрязненности (контаминации), чтобы оценить вероятность ее проникновения в производственный продукт. Используются два метода тестирования - пассивный (качественный) и активный (количественный).
Активные методы и приборы для микробной контаминации воздуха: наиболее часто в фармацевтической промышленности используются щелевые импакторы и центрифужные пробоотборники типа RCS с плотной агаровой питательной средой.
Учитывая приемлемость по основным характеристикам и удобство использования, рекомендуется применять аэрозольные пробоотборники типа «Флора-100» или Biotest RCS.
Таблица 11.4. Рекомендуемая периодичность проверки контролируемой среды
Пассивный метод контроля микробной контаминации воздуха заключается в экспозиции плотной питательной среды в открытых чашках Петри.
Частицы, присутствующие в воздухе, со временем осаждаются на поверхности агара. Время экспозиции составляет от 15 мин до нескольких часов. Однако длительная экспозиция приводит к высыханию поверхности питательной среды и ухудшению условий сохранения и культивирования бактерий. Этот метод широко распространен, и его применение целесообразно в сочетании с активным методом контроля микробной контаминации воздуха. Открытые чашки Петри располагают в нескольких точках. Например, при розливе препаратов - как можно ближе к наполняющим иглам и в точки «наихудших условий». В асептических зонах класса А (100) и В (100) при экспозиции чашек Петри с питательной средой в течение 30 мин во время работы допускается рост одной, редко двух колоний.
Методы отбора проб с поверхностей. Для контроля микробной загрязненности рабочих поверхностей используются следующие методы: смыв, контактная пластина.
Смывы с поверхностей проводят стерильным ватным тампоном, укрепленным на стеклянном или металлическом держателе, кото- рый вмонтирован в ватно-марлевую пробку пробирки. В пробирке должно содержаться приблизительно 2 мл стерильной воды.
В чашки Петри разливают по 20-25 мл питательной среды ? 1 для бактерий и среды ? 2 для грибов и дрожжей (перед исследованием чашки с разлитой средой выдерживаются в термостате в течение суток при температуре 30-35 ?С).
Смывы проводят увлажненным тампоном с поверхности площадью от 24 до 30 см2. После взятия пробы необходимо провести несколько раз по поверхности питательной среды в двух параллельных чашках Петри со средами ? 1 и ? 2. После отбора проб чашки Петри помещают в термостат (для среды ? 1 - температура 30-35 ?С в течение 48 ч; для среды ? 2 -температура 20-25 ?С в течение 72 ч).
Далее проводят подсчет колоний в двух параллельных чашках, делают мазки, фиксируют их, окрашивают по Граму и микроскопируют.
Контактные пластины готовят с соответствующей плотной питательной средой, разливая ее на специальные пластины. Если исполь- зуют чашки Петри, то поверхность агара должна выступать над краем чашки.
При исследовании стерильная поверхность питательной среды накладывается на гладкую ровную поверхность. После снятия отпе- чатка эту поверхность необходимо обработать спиртом или любым другим дезинфектантом для удаления остатков питательной среды. После инкубации в соответствии со сроками и температурой для используемых сред (например, среды ? 1 и 2) проводят подсчет колоний и микроскопируют окрашенные по Граму мазки.
Метод контактных пластин подходит для тестирования гладких и ровных поверхностей, таких, как рабочий стол, стены, пол или одежда персонала.
Методы определения микробной загрязненности одежды и перчаток персонала. Для определения микробной загрязненности перчаток персонала используют следующий метод.
Отпечатки пяти пальцев каждой руки оставляют на поверхности плотной питательной среды, например среды ? 1 и среды ? 2 (параллельно). Чтобы касание было полным, рекомендуется сделать скользящее движение пальцами по всей поверхности агара. Руки после контакта с агаром тщательно обрабатываются спиртом.
Рекомендуется следующая частота тестирования: в зависимости от степени автоматизации технологического процесса от одного раза в рабочую смену до одного раза в месяц.
Микробная загрязненность одежды и бахил персонала обычно определяется на предплечьях с помощью контактных пластин.
Можно применять метод смыва тампоном. Для этого делают смывы увлажненным тампоном с 4 участков площадью по 25 см2 каждый на нижней части двух рукавов, верхней передней поверхности комбинезона (халата) и шлеме.
Рекомендуемые уровни чистоты в контролируемых зонах (число колоний КОЕ).
Приведенные в таблице уровни микробной загрязненности устанавливаются на конец рабочей смены при обычных рабочих условиях.
Таблица 11.5. Уровни чистоты поверхностей (число частиц в
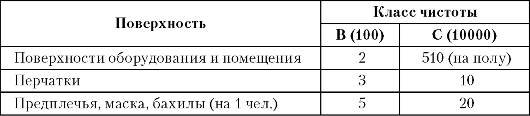
В начале рабочей смены одежда и перчатки должны быть стерильными. Контроль стерильной одежды проводят раз в две недели - непосредственно после стерилизации одежды. Контролируют не менее трех комплектов из каждой загрузки автоклава.
Анализ результатов текущего контроля должен давать постоянную оценку соответствия асептического процесса установленному уровню.
Оздоровительные мероприятия. Эффективность мероприятий, направленных на сохранение здоровья рабочих, в значительной мере зависит от обеспечения микробиологической надежности производств, основанных на использовании жизнедеятельности микроорганизмов.
Наиболее эффективно обеспечить благоприятные условия труда можно путем совершенствования технологического процесса, пре- дупреждая попадание в рабочую зону продуцентов и продуктов микробиологического синтеза (непрерывный технологический процесс, максимальная автоматизация, герметизация трудовых операций и др.).
Рабочие, подвергающиеся воздействию биофакторов, подлежат предварительным и периодическим медицинским осмотрам (приказ Минздрава РФ ? 90 от 14.03.1996 г. «О порядке проведения предва- рительных и периодических медицинских осмотров работников и медицинских регламентах допуска к профессии».
При поступлении на работу противопоказаниями к приему будут аллергические заболевания, хронические заболевания бронхолегочного аппарата, кандидоз, микозы, дисбактериоз, хронические заболевания мочевыводящих путей, ревматизм, системные васкулиты.
Периодические осмотры проводят раз в год с участием терапевта, дерматолога, отоларинголога, по показаниям - невропатолога; проводится лабораторное исследование лейкоцитарной формулы.
Лица, у которых при периодических осмотрах выявлены заболевания кожи, слизистых оболочек, органов дыхания и женских половых органов, а также стойкое кандидоносительство, подлежат динамическому диспансерному наблюдению и лечению.
При наличии рецидивов аллергических проявлений, стойких патологических изменений кожных покровов, бронхолегочного аппарата, гениталий необходимо проводить комплексное клиниколабораторное обследование в условиях стационара.
В качестве специфических аллергических тестов рекомендуются реакции специфического лизиса лейкоцитов, непрямого специфи- ческого повреждения базофилов, специфической преципитации. При обследовании должны быть использованы не менее одной гуморальной и двух клеточных реакций.
Раннее диагностирование профессиональных аллергических болезней при проведении периодических медицинских осмотров имеет первостепенное и существенное значение для исхода этих заболеваний, так как наблюдения показывают, что несвоевременное прекращение контакта с аллергенами приводит к возникновению хронического процесса. Трудоустройство вне контакта с аллергенами на более позднем этапе не дает полного исчезновения клинической симптоматики.
Специалист в области гигиены труда должен контролировать, обеспечены ли работники биотехнологических предприятий (по нормам и в установленные сроки) средствами индивидуальной защиты. Контролю также подлежит правильность обеспыливания и обеззараживания спецодежды, а также соблюдение сроков этих мероприятий. Спецодежду, загрязненную веществами 1-го и 2-го классов опасности, предварительно обезвреживают, а обсемененную клетка- ми-продуцентами - обеззараживают.