Наглядная детская гастроэнтерология и гепатология : учеб. пособ. - Кильдиярова Р. Р., Лобанов Ю. Ф. 2013. - 124 с. : ил.
|
|
|
|
Глава 6. Болезни печени
СИНДРОМ ЖИЛЬБЕРА
Код по МКБ-10
Е80.4. Синдром Жильбера.
Синдром Жильбера - пигментный гепатоз (простая семейная холемия, конституциональная гипербилирубинемия, идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха) с аутосомно-доминантным типом наследования, характеризуемый умеренным интермиттирующим повышением содержания несвязанного (непрямого) билирубина в крови. Впервые синдром описали французские врачи A.N. Gilbert и P. Lereboullet в 1901 г.
Это самая частая форма наследственного пигментного гепатоза, которая выявляется у 2-5% населения. Среди европеоидов распространенность синдрома составляет 2-5%, среди монголоидов - 3%, среди негроидов - 36%. Болезнь проявляется в подростковом возрасте и протекает практически в течение всей жизни. Встречается чаще у лиц мужского пола.
Этиология и патогенез
Синдром обусловлен мутацией в гене UGT1A1, который кодирует фермент уридиндифосфатглюкуронилтрансферазу (УДФГТ). В патогенезе синдрома лежат следующие звенья:
• нарушение захвата билирубина микросомами васкулярного полюса гепатоцитов;
• нарушение транспорта билирубина с помощью глутатион-8-трансферазы, доставляющей неконъюгированный билирубин к микросомам гепатоцитов;
• неполноценность фермента микросом УДФГТ, с помощью которого осуществляется конъюгация билирубина с глюкуроновой и другими кислотами.
При синдроме Жильбера активность УДФГТ снижается лишь на 10-30% по сравнению с нормой, основное значение придается нарушению захвата билирубина гепатоцитами, которое связывают с аномалией проницаемости мембран и дефектом белка внутриклеточного транспорта.
Обмен билирубина складывается из транспорта его в плазме крови, захвата печенью, конъюгации, билиарной экскреции (рис. 6-1).
Ежедневно в организме человека продуцируется примерно 250-300 мг неконъюгированного билирубина: 70-80% этого количества - результат ежедневного распада гемоглобина эритроцитов; 20-30% образуется из белков гема в костном мозге или в печени. За сутки у здорового человека распадается около 1% циркулирующих эритроцитов.
Билирубин, который образовался в клетках ретикулоэндотелия, является токсическим соединением. Он называется неконъюгированным, непрямым, или свободным, несвязанным билирубином (из-за специфики реакции при его определении), является водонерастворимым. Именно поэтому в плазме крови он присутствует в форме соединения с альбумином. Альбумин-билирубиновый комплекс препятствует поступлению билирубина через гломерулярную мембрану в мочу.
С током крови непрямой билирубин поступает в печень, где эта форма билирубина превращается в менее токсичную форму - прямой (связанный, конъюгированный) билирубин. Обе фракции составляют общий билирубин.
В печени происходят отделение неконъюгированного билирубина от альбумина на уровне микроворсинок гепато-

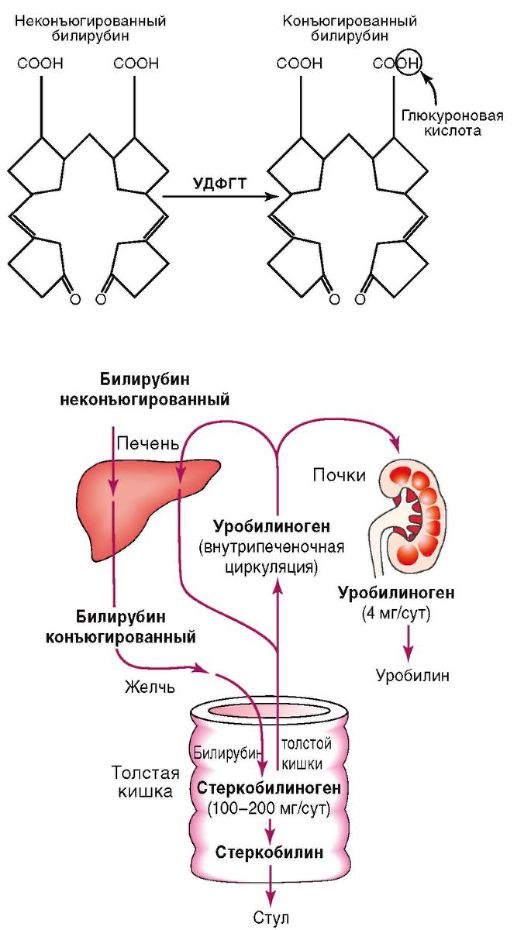
Рис. 6-1. Обмен и конъюгирование билирубина
цитов, захват его внутрипеченочным протеином. Конъюгацию билирубина с образованием моно- и диглюкуронидов (конъюгированного билирубина) обеспечивает УДФГТ.
Выделение билирубина в желчь является конечным этапом обмена пигмента и происходит через цитоплазматические мембраны гепатоцитов.
В желчи конъюгированный билирубин образует макромолекулярный комплекс с холестерином, фосфолипидами и солями желчных кислот. Далее с желчью он поступает в ДПК и тонкую кишку, где трансформируется в уробилиноген, часть которого всасывается через кишечную стенку, попадает в портальную вену и с током крови переносится в печень (кишечно-печеночная циркуляция), где полностью разрушается.
Основное количество уробилиногена из тонкой кишки поступает в толстую кишку, где под действием бактерий превращается в стеркобилиноген и выделяется с калом. Количество фекального стеркобилиногена и стеркобилина варьирует от 47 до 276 мг/сут в зависимости от массы тела и пола.
Менее 2% билирубина выводится с мочой в виде уробилина.
Клиническая картина
Легкая желтушность, включая иктеричность склер, - главный симптом заболевания. В отдельных случаях происходит окрашивание кожного покрова (рис. 6-2, а), особенно стоп, ладоней, носогубного треугольника, подмышечных впадин.
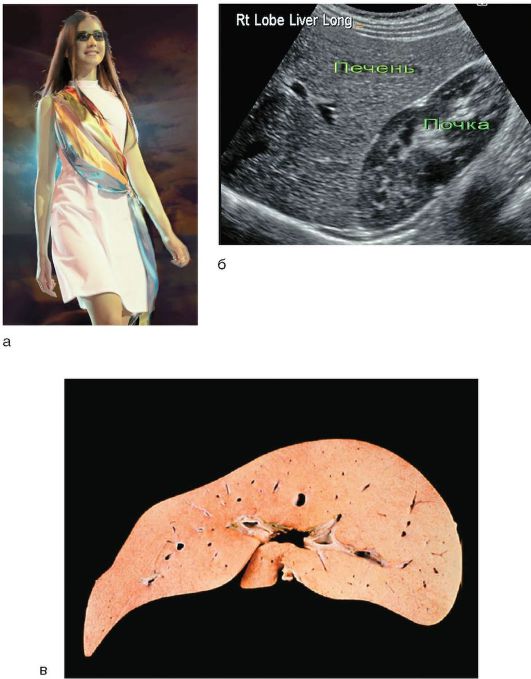
Рис. 6-2. Синдром Жильбера: а - пациентка - участница конкурса красоты; б - УЗИ: изменения отсутствуют; в - макропрепарат печени с накоплением липофусцина
Осматривать пациентов следует при дневном свете. При электрическом освещении цвет кожи искажается и может быть неправильно истолкован.
Желтушность кожного покрова и видимых слизистых оболочек становится хорошо заметной, когда уровень билирубина в сыворотке крови достигает 43-50 мкмоль/л и выше.
Желтушность и гипербилирубинемия носят перемежающийся характер, поэтому эти симптомы редко бывают постоянными. Стресс (например, в период экзаменов или при большом физическом напряжении, возникшем при поднятии тяжестей) способствует появлению желтухи и усилению иктеричности склер. Усилению симптомов способствуют различные операции, простудные заболевания, неправильная диета, голодание, употребление алкогольных напитков и некоторые виды лекарственных препаратов. Общий билирубин при синдроме Жильбера колеблется на уровне от 21 до 51 мкмоль/л и периодически повышается до 85-140 мкмоль/л.
В половине случаев наблюдаются диспепсические жалобы: метеоризм, нарушение стула, тошнота, отрыжка, отсутствие аппетита. Возникновение желтухи может сопровождаться неприятными ощущениями в области печени и слабостью.
Синдром ассоциируется с дисплазией соединительной ткани (особенно часто по типу синдромов Марфана и Элерса-Данлоса).
Диагностика
Диагностика заболевания подразумевает проведение тестов.
Тест на содержание билирубина в сыворотке крови, которое повышается на фоне голодания. Больной на протяжении 2 сут получает питание, энергетическая ценность которого не превышает 400 ккал/сут. Проводят определение уровня билирубина в сыворотке крови натощак и через 48 ч. Проба является положительной, если его подъем составляет
50-100%.
Проба с фенобарбиталом - уровень билирубина снижается на фоне приема фенобарбитала за счет индуцирования конъюгируемых ферментов печени.
Проба с никотиновой кислотой - внутривенное введение препарата вызывает повышение уровня билирубина за счет уменьшения осмотической резистентности эритроцитов.
Результат анализа кала на стеркобилин обычно отрицательный.
Печеночные пробы, в частности уровни ферментов АСТ, АЛТ, ЩФ и др., как правило, в пределах нормы или незначительно повышены. Могут наблюдаться увеличение общего белка и диспротеинемия; протромбиновое время - в пределах нормы. Маркеры вирусов гепатитов В, С, D отсутствуют.
Молекулярная диагностика включает анализ ДНК гена УДФГТ.
С помощью УЗИ органов брюшной полости определяют размеры и состояние паренхимы печени (рис. 6-2, б); размеры, форму, толщину стенок, возможные конкременты в желчном пузыре и желчных протоках.
При наличии показаний для исключения хронического гепатита (ХГ), цирроза печени проводят чрескожную пункционную биопсию печени с морфологической оценкой биоптата.
Патоморфология
Морфологические изменения в печени характеризуются жировой дистрофией гепатоцитов и накоплением в них желтовато-коричневого пигмента липофусцина, чаще в центре долек по ходу желчных капилляров (рис. 6-2, в).
Дифференциальная диагностика
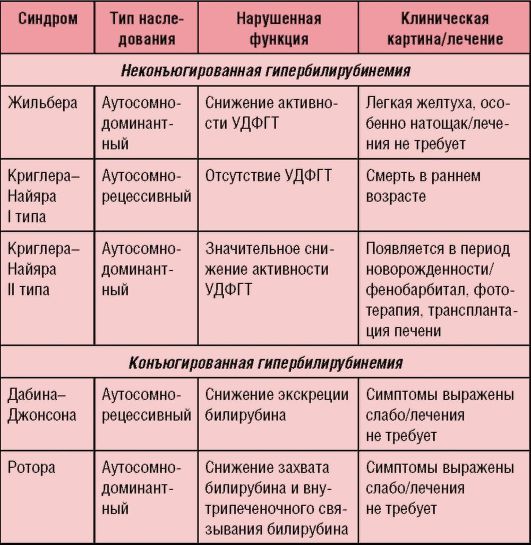
Дифференциальную диагностику проводит со всеми типами гипербилирубинемий (табл. 6-1), гемолитическими анемиями, врожденными циррозами печени и гепатитами, атрезией желчных ходов или тонкой кишки и т.д.
Таблица 6-1. Дифференциальная диагностика наследственных гепатозов
Лечение
Пациенты в специальном лечении, как правило, не нуждаются, поскольку синдром Жильбера - это не заболевание, а индивидуальная, генетически обусловленная особенность организма. Основное значение имеет соблюдение режима учебы, труда, отдыха, питания.
Крайне нежелательны алкогольные напитки и жирная пища, не рекомендуются физические перегрузки (профессиональные занятия спортом), инсоляция, большие перерывы между приемами пищи, ограничение жидкости.
Компоненты терапии и профилактики обострений синдрома Жильбера:
• диетотерапия;
• исключение провоцирующих факторов (инфекций, физических и психических нагрузок, употребления гепатотоксичных препаратов и алкоголя);

• противопоказание инсоляции.
Эпизод желтухи может разрешиться самостоятельно, без применения лекарственных средств.
Если уровень билирубина достигает 50 мкмоль/л и сопровождается плохим самочувствием, возможен прием фенобарбитала коротким курсом (1,5-2,0 мг/кг, или 30-200 мг/ сут в 2 приема в течение 2-4 нед). Фенобарбитал (люминал*) входит в состав таких препаратов, как корвалол*, барбовал*, валокордин*, поэтому иногда предпочитают применять эти препараты (20-30-40 капель 3 раза в день в течение 1 нед),
хотя эффект от такого лечения отмечается лишь у малой части пациентов. К индукторам ферментов монооксидазной системы гепатоцитов, кроме фенобарбитала, относят зиксорин (флумецинол*), назначаемый подросткам в дозе 0,4- 0,6 г (4-6 капсул) 1 раз в неделю или по 0,1 г 3 раза в день в течение 2-4 нед. Под влиянием этих препаратов снижается уровень билирубина в крови, исчезают диспепсические явления, но в процессе лечения возникают вялость, сонливость, атаксия. В таких случаях эти препараты назначают в минимальных дозах перед сном, что позволяет принимать их длительное время.
В связи с тем что у значительной части больных наблюдается развитие холецистита и ЖКБ, рекомендуют прием настоев желчегонных трав, периодическое проведение тюбажей из сорбита (ксилита), карловарской соли и др. Показаны гепатопротекторы: препараты урсодезоксихолевой кислоты (урсосан*, урсофальк*), фосфолипиды (эссенциале*), силибинин (карсил*), экстракт плодов расторопши пятнистой (легалон 70*), экстракт листьев артишока полевого (хофитол*), лив 52*; холеретики: холагол*, холензим*, аллохол*, берберин*, холосас*; витаминотерапия, особенно витамины группы В.

Выведение конъюгированного билирубина возможно с помощью усиленного диуреза, применения активированного угля, адсорбирующего билирубин в кишечнике.
Тепловые физиопроцедуры на область печени противопоказаны.
Посредством фототерапии достигается разрушение билирубина, фиксированного в тканях, тем самым высвобождаются периферические рецепторы, которые могут связать новые порции билирубина, предотвращая его проникновение через гематоэнцефалический барьер.
Профилактика
Профилактика включает соблюдение режима труда, питания, отдыха. Следует избегать значительных физических нагрузок, ограничения жидкости, голодания и гиперинсоляций. Недопустимо употребление спиртных напитков, гепатотоксичных препаратов.
Синдром Жильбера не является поводом для отказа от прививок.
Обязательны санация хронических очагов инфекции и лечение имеющейся патологии желчевыводящих путей.
Прогноз
Прогноз благоприятный. Гипербилирубинемия сохраняется пожизненно, однако не сопровождается прогрессирующими изменениями в печени и повышением смертности. При страховании жизни таких людей относят к группе обычного риска. При лечении фенобарбиталом уровень билирубина снижается до нормальных значений. Возможно развитие воспаления в желчевыводящих путях, ЖКБ, психосоматических расстройств.
Родители детей, страдающих этим синдромом, должны проконсультироваться у генетика перед планированием очередной беременности.
Аналогичным образом следует поступать, если у родственников семейной пары, планирующей рождение детей, диагностирован этот синдром.
ЖИРОВАЯ ДЕГЕНЕРАЦИЯ ПЕЧЕНИ
Код по МКБ-10
К76.0. Жировая дегенерация печени.
Гепатозы (стеатоз печени, неалкогольный стеатогепатит) - группа заболеваний печени, в основе которых лежат нарушение обмена веществ в гепатоцитах и развитие в клетках печени дистрофических изменений, при этом воспалительные явления отсутствуют или слабовыражены.
В последние годы наблюдают значительное увеличение заболеваемости жировой дегенерацией печени, в основном связанное с ростом распространенности ожирения. Среди больных, которым проводилась биопсия печени, выявляют примерно 7-9% случаев гепатоза в западных странах и 1-2% - в Японии.
Этиология и патогенез
Причинами возникновения заболевания считают ожирение, сахарный диабет, дислипидемию, быстрое похудение, недостаток белка в рационе, врожденные дефекты β-окисления жирных кислот, дефицит α-1-антитрипсина, воздействие токсических для печени веществ, в том числе алкоголя и др. Гепатоз может быть как самостоятельным заболеванием, так и проявлением других заболеваний.
Избыточное накопление жира в ткани печени (в гепатоцитах и клетках Ито) может быть в результате первого воздействия (рис. 6-3, а, г) - насыщенной липидами, простыми углеводами и повышенной калорийностью пищи:
• повышения поступления свободных жирных кислот в печень;
• снижения скорости β-окисления свободных жирных кислот в митохондриях печени;
• повышения синтеза жирных кислот в митохондриях пе чени;
• снижения синтеза или секреции липопротеинов очень низкой плотности и экспорта триглицеридов в их составе.
Итогом нарушения диеты являются инсулинорезистентность и жировая инфильтрация печени.
Второе воздействие (см. рис. 6-3, г) подразумевает нарушение выведения липидов из печени, которое происходит при снижении количества веществ, участвующих в их переработке (белка, липотропных факторов). Нарушается образование из жиров фосфолипидов, β-липопротеинов, лецитина. В патогенезе имеют значение фактор некроза опухоли-α, эндотоксин, иммунные факторы. Предполагают, что, независимо от причин развития стеатоза, в основе воспалительно-некротических изменений в печени лежат универсальные механизмы. Будучи высокореактогенными соединениями, свободные жирные кислоты служат субстратом перекисного окисления липидов. Образуемые свободные радикалы вызывают разрушение липидных, белковых компонентов мембран, рецепторов печени и т.д., вызывая дальнейшие изменения в печени.
Классификация
Различают пигментные и жировые гепатозы. Чаще всего под термином «гепатоз» подразумевают жировой гепатоз (стеатоз), так как пигментные гепатозы встречаются значительно реже и рассматриваются отдельно (см. «Редкие синдромы»), за исключением синдрома Жильбера.
Клиническая картина и диагностика
На начальных этапах симптомы минимальны. Как правило, течение заболевания скрытое, отмечаются лишь повышение активности печеночных трансаминаз и гепатомегалия. У многих пациентов нарушения функций печени выявляют случайно, во время обследования по поводу других заболеваний. Наблюдается минимальная или умеренно выраженная активность воспаления в печени, выявляемая при биохимических исследованиях сыворотки крови. Однако без лечения может наблюдаться переход в цирроз печени, постепенно нарастают явления печеночной недостаточности.
Жировой гепатоз часто выносят в заключение врачи ультразвуковой диагностики на основании характерных признаков: равномерного увеличения печени, диффузного повышения ее эхогенности (иногда выраженного) с сохранением ее однородности, хотя при прогрессировании процесса появляется характерная зернистость паренхимы, свидетельствующая о начале развития стеатогепатита и гепатита (рис. 6-3, б).
Патоморфология
По данным морфологических исследований, стеатогепатит - чрезмерное накопление триглицеридов в печени, что сопровождается повреждением клеточных мембран и других органелл гепатоцитов, воспалительным процессом, фиброзообразованием вплоть до цирроза печени (рис. 6-3, в).
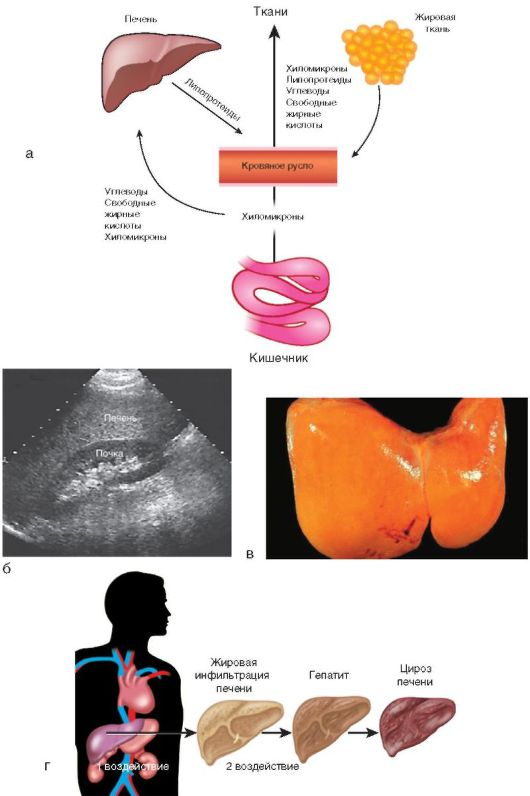
Рис. 6-3. Функции и заболевания печени: а - участие печени в липидном обмене; б - УЗИ: гепатомегалия и повышенная эхогенность печени; в - макропрепарат: стеатоз печени; г - стадийность формирования патологии печени
Лечение
Диетотерапия является постоянно действующим и безопасным методом лечения жировой дистрофии печени.

В целях нормализации окисления жирных кислот в митохондриях, улучшения транспорта триглицеридов из печени, уменьшения процессов перекисного окисления липидов назначают препараты, улучшающие липидный обмен, - гепатопротекторы, витамин В12, фолиевую кислоту, тиоктовую кислоту (липоевую кислоту*) и т.д.
Профилактика
Основой первичной профилактики являются здоровый образ жизни и здоровое питание (рис. 6-4). Рекомендуется достаточная физическая активность.
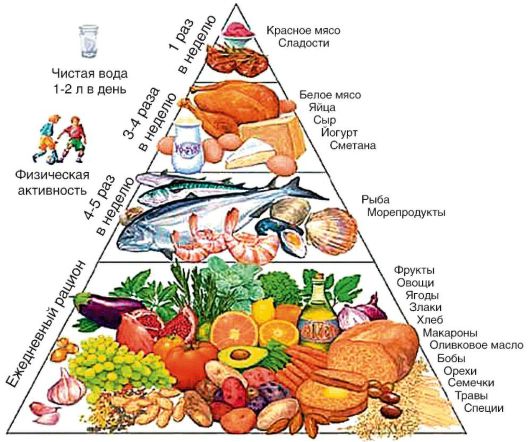
Рис. 6-4. Пирамида питания при жировой дегенерации печени
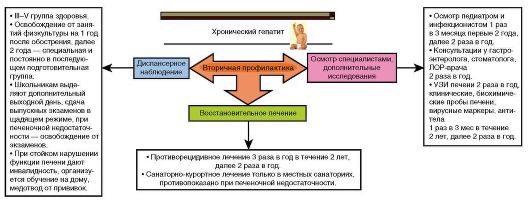
Диспансерное наблюдение описано ниже (см. «Профилактика хронических гепатитов»).
Прогноз
При исключении причинных факторов и своевременном лечении возможно выздоровление, однако гепатоз может трансформироваться в ХГ и цирроз (см. рис. 6-3, г).
ХРОНИЧЕСКИЙ ГЕПАТИТ
Код по МКБ-10
К73. Хронический гепатит.
Хронические гепатиты - группа заболеваний, сопровождаемых развитием диффузного воспалительного процесса в печени, протекающего более 6 мес, подтвержденных биохимическими показателями, результатами морфологического исследования печени, а также специфическими маркерами в сыворотке крови.
Распространенность ХГ точно не установлена из-за большого количества стертых и бессимптомных форм, отсутствия популяционных исследований. Чаще всего выявляют хронические вирусные гепатиты (ХВГ), обусловленные персистенцией вирусов гепатитов В (29,2%), С (33,3%), хронический гепатит В+С (16,7%), реже В+D (4,1%), D+G (не более 2%). В 16,7% случаев выявляют гепатит невыясненной этиологии.
Классификация
Современная классификация гепатитов представлена в табл. 6-2. С учетом этиологии различают следующие виды гепатита.
• Специфические вирусные гепатиты. Основными формами таких гепатитов являются гепатиты А, В и С. Гепатит D менее распространен в мире. Гепатит Е остается главной проблемой в развивающихся странах. Описаны и другие вирусы гепатита (G, TTV и др.), но их клиническое значение невелико.
• Неспецифические вирусные гепатиты вызываются группой вирусов, которые могут поражать и печень, и другие органы. Например, вирус инфекционного мононуклеоза (вирус Эпштейна-Барр) избирательно поражает клетки ретикулоэндотелиальной системы (клинически проявляется в виде ангины, гиперспленизма, гепатита и др.). Аденовирус вызывает фарингоконъюнктивальную лихорадку, острую пневмонию, гепатит. Вирус простого герпеса - СПИД-индикаторная инфекция.
• Гепатиты - проявление этиологически самостоятельного заболевания (при лептоспирозе, псевдотуберкулезе).
• Гепатиты, связанные с употреблением лекарственных препаратов, - токсико-аллергические и лекарственные гепатиты. Алкогольный гепатит - сочетанное поражение ацетальдегидом и каким-либо другим фактором.
• Неспецифические реактивные гепатиты - реакция клеток печени на патологию соседних органов: поджелудочной железы, желчного пузыря, ДПК. Реактивный гепатит развивается у больных хроническим панкреатитом, ЯБ ДПК.
• Среди аутоиммунных форм хронического гепатита выделены 3 типа заболеваний (см. табл. 6-2).
• Ряд редких заболеваний печени могут иметь клинические и гистологические черты хронического персистирующего гепатита:
- первичный билиарный цирроз;
- болезнь Вильсона-Коновалова;
- первичный склерозирующий холангит;
- недостаточность α-1-антитрипсина.
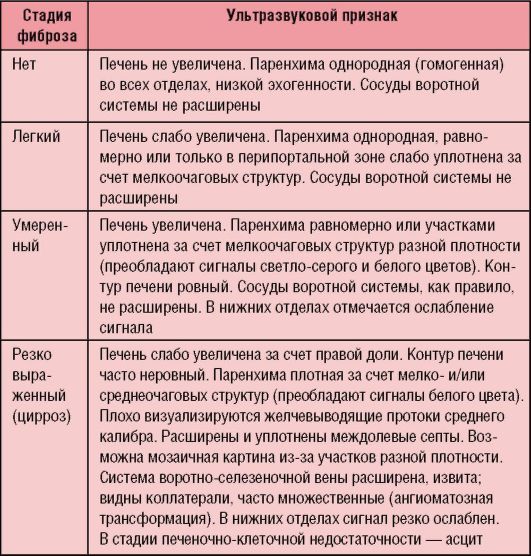
Стадию фиброзирования устанавливают на основании патоморфологического исследования биоптатов печени (табл. 6-3), ориентировочно - по данным УЗИ (табл. 6-4).
Таблица 6-2. Классификация хронического гепатита (международная группа экспертов, Лос-Анджелес, 1994)
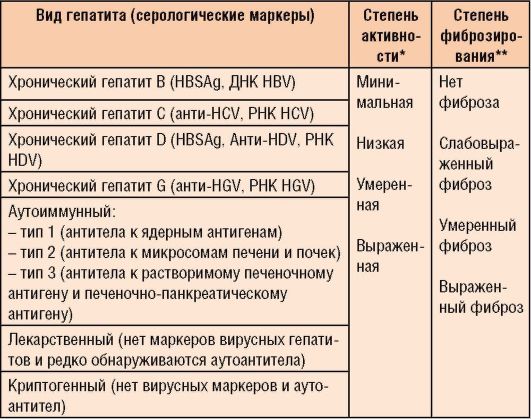
* Устанавливается по результатам гистологического исследования ткани печени и ориентировочно - по степени активности АЛТ и АСТ (1,5-2 нормы - минимальная, 2-5 норм - низкая, 5- 10 норм - умеренная, выше 10 норм - выраженная). ** Устанавливается на основании морфологического исследования печени и ориентировочно - по данным УЗИ.
Таблица 6-3. Индекс гистологической активности гепатита в баллах (Knodell R..J. et al., 1994)
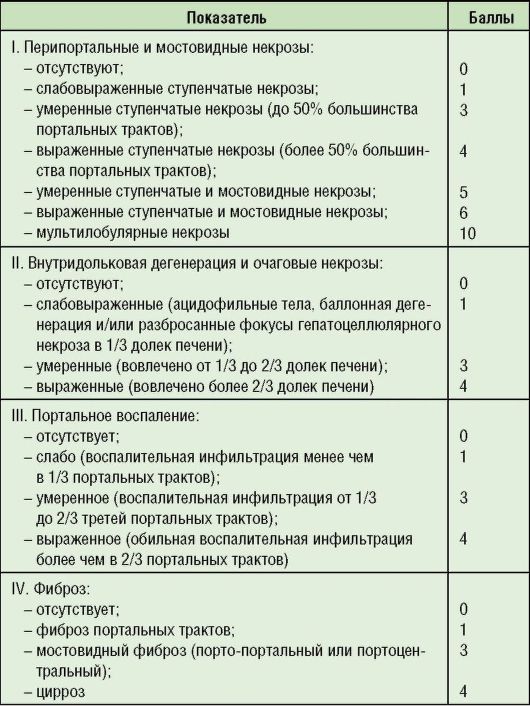
Примечание: 1-3 балла - минимальная степень активности хронического гепатита; 4-8 - хронический гепатит средней выраженности; 9-12 баллов - умеренный хронический гепатит; 13-18 баллов - тяжелый хронический гепатит.
Таблица 6-4. Ультразвуковые критерии стадий фиброза печени при хроническом гепатите у детей
Микст-гепатит устанавливается как основной диагноз при наличии одновременной репликации 2 типов вируса и более. При репликации одного и интеграции другого устанавливают основной гепатит и сопутствующий.
Хронические вирусные гепатиты
Коды по МКБ-10
В18. Хронический вирусный гепатит.
818.0. Вирусный гепатит В хронический с D-агентом.
818.1. Вирусный гепатит В хронический без D-агента.
818.2. Вирусный гепатит С хронический.
818.8. Вирусные гепатиты хронические другие.
818.9. Вирусные гепатиты хронические неуточненные. Более чем в 70% случаев причиной развития ХГ являются гепатотропные вирусы В, С и D. В мире насчитывается 350- 400 млн человек, инфицированных вирусом гепатита B, и ежегодно около 1 млн человек умирает от связанных с инфекцией вирусного гепатита В (ВГВ) заболеваний. Распространенность ВГВ-инфекции в разных странах колеблется от 0,1 до 20%. Риск перехода острой ВГВ-инфекции в хроническую с возрастом снижается: при перинатальном заражении он достигает 90%, при заражении в возрасте 1-5 лет - 25-35%, а при заражении взрослых - менее 10%.
Этиология и патогенез
Механизм формирования, диагностика гепатитов В и С представлены на рис. 6-5. Вирусный гепатит В (8 основных генотипов - A-H) обнаруживают в крови и других биологических жидкостях (сперме, слюне, носоглоточной слизи), передается четырьмя основными путями:
• половым;
• перинатальным (от матери ребенку во внутриутробном периоде и в родах);
• парентеральным (через кровь);
• горизонтальным (при тесном бытовом контакте или через инфицированные предметы общего пользования; в основном наблюдается в раннем детстве).
У детей основной путь передачи вирусного гепатита В - перинатальный. Если беременная является носительницей вирусного гепатита В (и, кроме того, HBeAg-позитивна), вероятность заражения новорожденного с развитием у него носительства вируса составляет 90%. Будучи взрослыми 25% таких детей умирают от хронической печеночной недостаточности или рака печени. Хотя HBsAg, HBeAg и ДНК вирусного гепатита В обнаруживают в грудном молоке, тип вскармливания на риск передачи вирусного гепатита В не влияет. К другим факторам риска заражения гепатитом B относятся:
- переливание крови и/или ее компонентов;
- введение инъекционных наркотиков, татуировки, пирсинг и другие инвазивные процедуры на коже;
- незащищенные проникающие половые контакты, особенно анальный и вагинальный половой акт;
- трансплантация органов;
- работа в медицинских учреждениях;
- гемодиализ.
В регионах с низкой эндемичностью ВГВ-инфекции наибольшая заболеваемость приходится на подростков и молодежь. Самые частые пути передачи вирусного гепатита В в этих группах - половой и парентеральный (при небезопасных инъекциях наркотиков, в частности, повторном использовании одноразовых шприцев).
Считается, что хронический гепатит В (ХГВ) - первично хроническое или возникающее после стертой или субклинической формы острой инфекции заболевание.
Фазы ХГВ:
- начальная, или иммунной толерантности;
- иммунного ответа (репликативная), протекающего с выраженной клинической и лабораторной активностью;
- интегративная;
- носительство HBsAg.
Сам ДНК-вирус гепатита В (ДНК HBV) не вызывает цитолиза. Повреждение гепатоцитов связано с иммунными реакциями, возникающими в ответ на циркулирующие вирусные и печеночные антигены. Во 2-й фазе репликации вируса экспрессируются антигены вируса: HBsAg (поверхностный), HBcAg, (ядерный), HBeAg (рис. 6-5, а), иммунная реакция более выражена, что вызывает массивный некроз паренхимы печени и далее мутацию вируса.
Репликация вируса гепатита В возможна и вне печени - в клетках костного мозга, мононуклеарах, щитовидной и слюнной железе, чем обусловлены внепеченочные проявления болезни.
Пути передачи хронического гепатита С (ХГС) аналогичны таковым при ХГВ. В отличие от вирусного гепатита В, РНК-вирус гепатита С оказывает прямое гепатотоксическое действие. Вследствие этого репликация вируса и его персистенция в организме ассоциируются с активностью и прогрессированием гепатита. Интересно, что вирусный гепатит С способен блокировать апоптоз (программированную гибель) пораженных им клеток, чтобы длительное время находиться в организме человека. Апоптоз - нормальный процесс, избавляющий организм от «изношенных» или пораженных заболеваниями клеток. Закодированный в геноме вирусного гепатита С белок, известный как NS5A, блокирует открытие калиевых каналов в клетках печени, предохраняя свои «убежища» от естественной гибели и задерживаясь таким образом в организме человека надолго. Жизненный цикл вирусного гепатита С представлен на рис. 6-5, б.
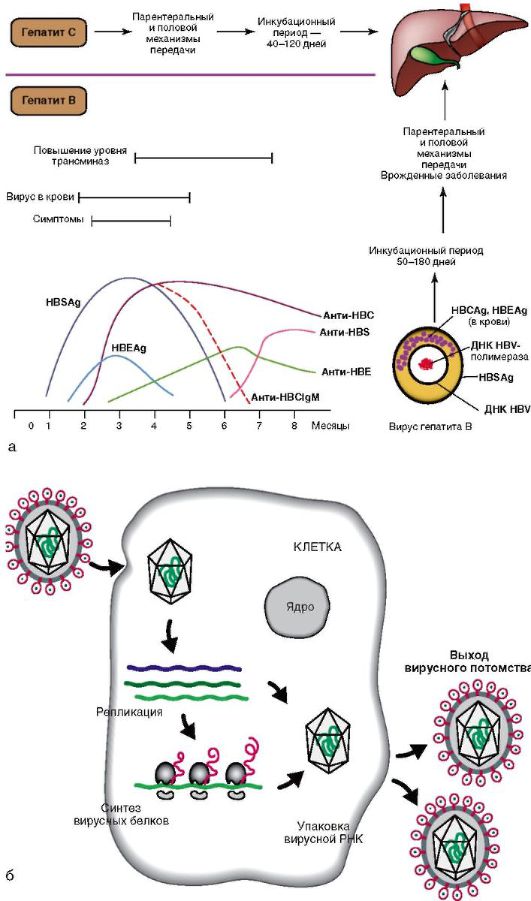
Рис. 6-5. Хронические гепатиты С и В: а - диагностика гепатитов С и В и динамика серологических маркеров гепатита В; б - жизненный цикл вируса гепатита С
Возбудитель хронического гепатита D (ХГО) - РНК-содержащая частица, внешняя оболочка которой представлена HBsAg. В центре частицы находится антиген вируса гепатита D. Дельта-вирус способен размножаться в клетках печени только в присутствии вирусного гепатита В, так как для выхода из клетки частицы дельта-вируса используются его белки. Заболевание протекает одновременно с вирусным гепатитом В по типу коили суперинфекции.
Клиническая картина
Клиническая картина ХГ выражена слабо и неспецифична. Бессимптомное течение отмечается у 25% больных. Формирование ХГ чаще происходит в исходе острого гепатита, протекающего в виде атипичных (стертых, безжелтушных, субклинических) форм и крайне редко - при манифестных (желтушных) формах острого гепатита. Острую фазу гепатита и появление клинических симптомов хронической формы заболевания разделяют 5 лет и более.
Клинические проявления ХГ зависят от возраста ребенка на момент инфицирования, выраженности морфологических
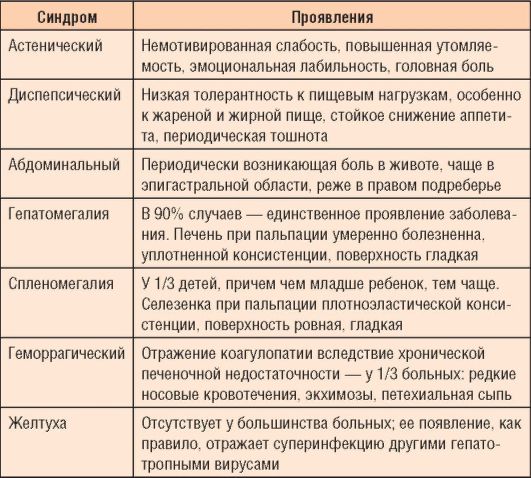
изменений в печени, фазы инфекционного процесса (репликации, интеграции), преморбидного фона. У детей, в отличие от взрослых, холестатический вариант ХГ встречается редко; при наличии холестаза необходимо исключить врожденную патологию внутриили внепеченочных ходов, дефицит α-1-антитрипсина, муковисцидоз. Основные синдромы заболевания приведены в табл. 6-5.
Таблица 6-5. Основные синдромы хронического вирусного гепатита
Внепеченочные проявления, связанные с внепеченочной репликацией вируса, более характерны для ХГС, могут проявляться рецидивирующими дерматитами, геморрагическим васкулитом, гломерулонефритом, артропатиями, тиреоидитом, синдромом Шегрена, панкреатопатиями. Внепеченочные проявления чаще развиваются в пубертатном возрасте, у девочек характерно развитие эндокринных нарушений, у мальчиков формируются гломерулонефриты и другие заболевания.
К внепеченочным проявлениям относят сосудистые изменения (табл. 6-6; рис. 6-6). У детей они встречаются гораздо реже, их наличие обязывает провести расширенное исследование функций печени.
Таблица 6-6. Сосудистые внепеченочные проявления при хроническом гепатите
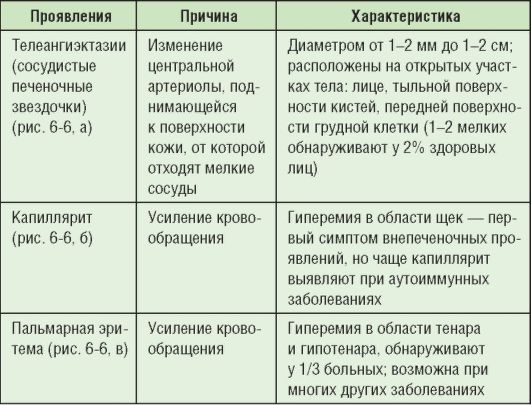
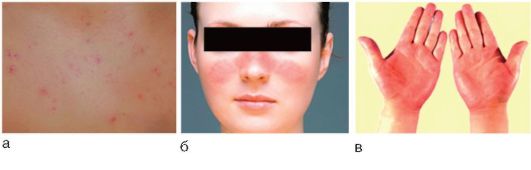
Рис. 6-6. Сосудистые внепеченочные проявления при хроническом гепатите: а - телеангиэктазии; б - капиллярит; в - пальмарная эритема
Диагностика
Специфические методы. С помощью иммуноферментного анализа (ИФА) обнаруживают основные маркеры ХГ, с помощью полимеразной цепной реакции (ПЦР) - ДНКили РНК-вируса (табл. 6-7; рис. 6-5, а).
Таблица 6-7. Маркерная диагностика хронических гепатитов В и С
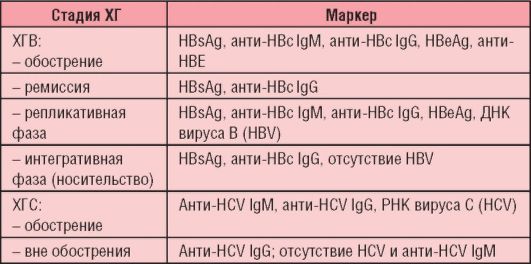
Серологические маркеры вирусного гепатита В используют для установления диагноза и стадии заболевания.
Антигены были представлены выше (см. рис. 6-5, а). Антитела к поверхностному антигену вируса (анти-HBsAg) появляются в крови через 3-6 мес и сохраняются в течение многих лет или, возможно, всю жизнь. Их обнаружение свидетельствует либо о перенесенной ранее инфекции, либо о предшествующей вакцинации.
Ядерный антиген (HBcAg) в крови обычно не циркулирует, однако антитела к нему появляются на ранних стадиях заболевания, их титр быстро достигает максимума, а затем постепенно снижается (но полностью не исчезает). Вначале появляются антитела класса IgM (анти-HBcAg IgM), затем появляются IgG. Антиген Е (HBeAg) появляется в крови на короткий срок в начале болезни, что сопровождается выработкой к нему антител (анти-HBe).

Хроническая ХГВ-инфекция характеризуется наличием в крови HBsAg и анти-HBcAg IgG.
При ХГС, помимо вирусемии (РНК HCV), обнаруживают антитела классов IgM и IgG. Вне обострения РНК ХГС и анти-HCV IgM не выявляются, но сохраняются антитела класса IgG (см. табл. 6-7).
К неспецифическим методам можно отнести биохимические, иммунологические тесты и инструментальные исследования.
Биохимические тесты не несут информации об этиологии заболевания, но отражают характер поражения печени и состояние ее функции. К ним относятся:
• повышение уровня печеночных ферментов: при ХГ увеличение АЛТ более выражено, чем АСТ, что связано с различной локализацией ферментов (АЛТ - в цитоплазме, АСТ - в митохондриях), при циррозах, напротив, преобладает активность АСТ над таковой АЛТ; также характерно увеличение таких ферментов, как лактатдегидрогеназа, γ-глютамилтранспептидаза,
ЩФ;
• нарушение жирового и пигментного обмена: повышение прямой фракции билирубина, содержания общего холестерина, β-липопротеинов, активности ЩФ, 5-нуклео тидазы;
• нарушение белково-синтетической функции печени: снижение общего белка, повышение тимоловой пробы, снижение сулемовой пробы, снижение уровня протромбина, стойкая диспротеинемия за счет повышения глобулиновых фракций, особенно γ-глобулинов, и снижения альбуминов.
Биохимические синдромы, отражающие нарушение функций печени, представлены в главе 1 (см. табл. 1-8, изменения белковых фракций - рис. 1-16, б).
Иммунологические тесты. Характерно снижение уровней Т-супрессоров, повышение уровней сывороточных иммуноглобулинов.
Инструментальные методы. УЗИ печени является обязательным методом исследования при ХГ, поскольку позволяет визуализировать печень, определить ее размеры, выявить цирроз печени и портальную гипертензию. Даже при бессимптомном течении заболевания с помощью данного метода можно выявить увеличение печени, изменение эхогенности паренхимы. Могут быть использованы реогепатография, пункционная биопсия печени.
На сегодняшний день биопсия печени является золотым стандартом диагностики заболеваний печени (рис. 6-7, а). В процессе биопсии с помощью специальной иглы получают кусочек печени диаметром около 1 мм. Процедуру проводят под местным или общим обезболиванием и под контролем УЗИ, так как необходим контроль за ходом иглы, что позволяет сделать манипуляцию безопасной.
Степень активности ХГ чаще всего оценивают с помощью полуколичественного гистологического индекса активности, известного так же, как система Кноделля, определяемого в баллах (см. табл. 6-3). Гистология биоптата (образца тканей) печени позволяет принять решение о необходимости и тактике противовирусной терапии.
Патоморфология
При морфологическом исследовании биоптатов печени уже в первые месяцы жизни ребенка с первичным ХГ выявляются признаки воспаления, которые сохраняются многие годы, а также характерно прогрессирующее фиброзирование с формированием цирроза печени.
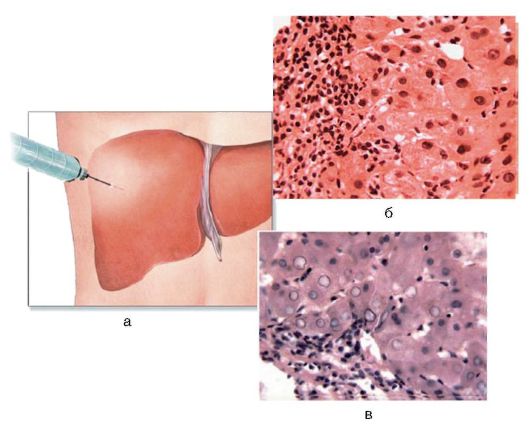
Рис. 6-7. Диагностика хронического гепатита: а - методика биопсии; гистологическая картина: б - ХГВ (окраска гематоксилинэозином; χ 400); в - ХГС (х 400).
Для ХГВ характерен некроз (рис. 6-7, б); патогномоничный признак при ХГС - вакуолизация ядер гепатоцитов, так называемые матово-стекловидные гепатоциты, а также ступенчатый их некроз (рис. 6-7, в).
Дифференциальная диагностика
Дифференциальную диагностику проводят с наследственными заболеваниями (гликогенозами, липидозами, недостаточностью α-1-антитрипсина, синдромом Жильбера и другими пигментными гепатозами); паразитарными (описторхозом, эхинококкозом), обменными (болезнью Вильсона-Коновалова) и т.д. В верификации заболевания используют данные УЗИ печени, эзофагогастродуоденоскопии, КТ и других специальных методов исследования.
Лечение
В фазу репликации (обострения) показаны госпитализация в специализированное отделение, постельный режим, строгая диетотерапия.

Базисная терапия включает назначение противовирусных препаратов. Показания к ее назначению:
• наличие маркеров активной репликации гепатита;
• уровень АЛТ более чем в 2-3 раза выше нормы;
• отсутствие холестаза и признаков цирроза печени с декомпенсацией;
• отсутствие тяжелых сопутствующих заболеваний в стадии декомпенсации;
• отсутствие аутоиммунных заболеваний, иммунодефицитного состояния, микст-гепатитов.
Индукторы интерферона характеризуются низкой токсичностью и отсутствием побочных эффектов в отличие от препаратов интерферона, благодаря их применению удается значительно увеличить продолжительность жизни у детей и взрослых (рис. 6-8).
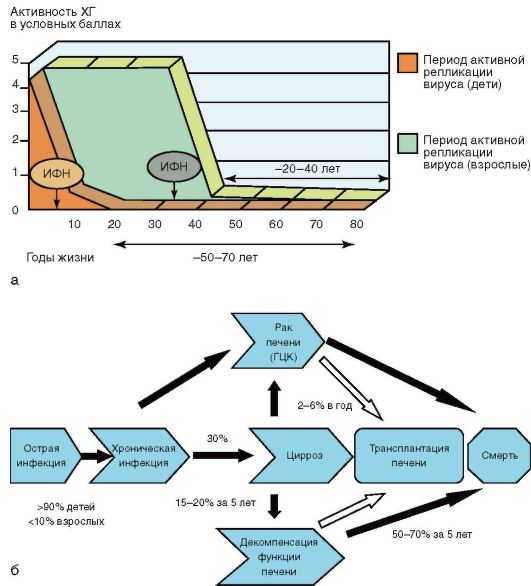
Рис. 6-8. Хронический гепатит (течение и лечение): а - противовирусное лечение детей и взрослых с хроническими вирусными гепатитами В и С и выигранные годы жизни; б - естественное течение гепатита В
Препараты интерферона противопоказаны при психозах, эпидемическом синдроме, выраженной нейтро- и тромбоцитопении, аутоиммунных заболеваниях (АИГ, тиреоидите и др.), декомпенсированном циррозе печени и заболеваниях почек, патологии сердца в стадии декомпенсации.
Интерферон-а-2Ь (реаферон*, роферон*, нейроферон*) - лиофилизат для приготовления суспензии для приема внутрь - назначают за 30 мин до еды, перед применением к содержимому флакона добавляют 1-2 мл охлажденной кипяченой воды. Препарат в инъекциях вводят при ХГВ в дозе 5 млн МЕ/м2, при ХГС - 3 млн МЕ/м2 площади поверхности тела трижды в неделю (1 раз с интервалом 72 ч) п/к или в/м. Рассчитанную дозу интерферона первоначально вводят в течение 3 мес. По истечении этого срока проводят контрольное исследование (РНК или ДНК вируса, активность). Если не обнаруживается отчетливая положительная динамика этих показателей (исчезновение РНК, ДНК вируса из крови, снижение АЛТ), лечение по этой схеме лучше прекратить или перейти на комбинированную терапию. Но если наблюдается снижение активности АЛТ, падение концентрации РНК, ДНК вируса в крови, лечение по выбранной схеме продолжают еще 3 мес, вслед за этим проводят контрольное
лабораторное исследование. При положительной динамике при ХГС лечение еще продолжают 3 мес для закрепления результатов лечения. Таким образом, курс лечения при ХГВ - 6 мес, при ХГС - 9-12 мес.
В педиатрической практике используют виферон (сочетание α-интерферона с мембраностабилизаторами), который выпускается в ректальных суппозиториях. Дозы для детей: до 3 лет - по 1 млн МЕ, старше 3 лет - по 2 млн МЕ 2 раза в сутки с интервалом 12 ч 3 раза в неделю. У больных, леченных по программе протокола с использованием виферона, эффективность лечения оценивается по вышеизложенным принципам. Если у данной категории больных при контрольном исследовании через 3 мес после начала терапии отсутствует положительный эффект, то виферон можно заменить реафероном*, рофероном*.
Индуктор α-интерферона меглюмина акридонацетат (циклоферон*) вводят при ХГ по 6-10 мг/кг в сутки, 10 инъекций ежедневно, затем 3 раза в неделю в течение 3 мес в качестве комплексной терапии.
Противовирусный препарат тилорон (амиксин ) назначают детям старше 7 лет в таблетках по 0,125 внутрь после еды, первые 2 дня ежедневно, затем по 125 мг через день - 20 таблеток, затем по 125 мг 1 раз в неделю в течение 10-20 нед. Курс лечения при ХГА - 2-3 нед, при ХГВ - 3-4 нед.
При ХГВ на фоне репликации вируса рекомендуют противовирусный химиопрепарат ламивудин (зеффикс , эпивир*) в растворе для приема внутрь и таблетках. Дозируется по 3 мг/кг в сутки детям с 3 мес, но не более 100 мг внутрь 1 раз в сутки курсом 9-12 мес. Таблетки по 100 мг 1 раз в сутки назначают подросткам (16 лет и старше) внутрь независимо от приема пищи.
В целом терапия интерферонами оказывается эффективной у 40% больных ХГВ и у 35% больных ХГС, но у 10-30% больных после окончания лечения возможны рецидивы болезни.


При тяжелой форме ХГ назначают глюкокортикоиды: преднизолон или метилпреднизолон в таблетках по 0,001; 0,0025 и 0,005 мг по 1-2 мг/кг в сутки в 2 приема без учета суточного ритма. После достижения ремиссии дозу снижают на 5-10 мг до поддерживающей дозы 0,3-0,6 мг/кг в сутки: 10-15 мг/сут преднизолона или 8-12 мг/сут метилпреднизолона.
Критерии эффективности лечения:
• биохимические - наиболее информативно определение уровня АЛТ, причем в ходе лечения активность АЛТ следует определять на протяжении всего курса и еще 6 мес после отмены, а затем каждые 3-6 мес на протяжении 3 лет;
• вирусологические - определение РНК, ДНК вируса с помощью ПЦР;
• гистологические - наиболее информативны для оценки эффективности лечения, однако на практике не всегда реализуемы, особенно в педиатрии.
Биохимическая ремиссия в конце лечения предполагает нормализацию уровней ферментов сразу после окончания курса терапии; полная ремиссия - нормализация уровней АСТ и АЛТ и исчезновение РНК, ДНК вируса сразу после лечения; стабильная биохимическая ремиссия - сохранение нормального значения трансаминаз через 6 мес и более после прекращения терапии; стабильная полная ремиссия - сохранение нормальных уровней АСТ и АЛТ и отсутствие РНК, ДНК вируса через 6 мес после лечения.
В случае достижения стабильной полной ремиссии рекомендуют продолжать наблюдение за больным в течение не менее 2 лет с периодичностью 1 раз в полгода. В фазу ремиссии (фазу интеграции ХВГ) противовирусную терапию обычно не проводят, лечение складывается из организации диеты, режима, подключения пробиотиков, ферментов, фитопрепаратов, слабительных средств по показаниям для предупреждения дисфункции ЖКТ и кишечной аутоинтоксикации.
Сопроводительная терапия - это симптоматическое и патогенетическое лечение.
В целях купирования холестаза применяют препараты урсодезоксихолевой кислоты (урсосан*, урдокса*, урсофальк*) в виде монотерапии в нерепликативной фазе гепатита, в репликативной фазе - в сочетании с интерферонами до 6-12 мес по 10 мг/кг однократно в сутки перед сном.
Гепатопротекторы, обладающие способностью защищать гепатоциты, назначают курсами до 1,5-2 мес. Повторный курс - через 3-6 мес по показаниям.
Листьев артишока экстракт (хофитол*) - средство растительного происхождения, который обладает гепатопротективным и желчегонным действиями. Хофитол* назначают детям старше 6 лет по 1-2 таблетке или 1/4 ч. л. раствора для приема внутрь 3 раза в сутки перед приемом пищи, подросткам - по 2-3 таблетки или 0,5-1 ч. л. раствора 3 раза в сутки, курс - 10-20 дней. Раствор для внутримышечного или внутривенного медленного введения - по 100 мг (1 ампула) в течение 8-15 дней; средние дозы могут быть значительно увеличены, особенно при стационарном лечении.
Гепатопротектор «Лив 52*» представляет собой комплекс биологически активных веществ растительного происхождения; его назначают детям старше 6 лет по 1-2 таблетки 2-3 раза в сутки, подросткам - по 2-3 таблетки 2-3 раза в сутки.
Адеметионин (гептрал*) - гепатопротектор, который оказывает холеретическое и холекинетическое, а также некоторое антидепрессивное действие. Детям назначают с осторожностью внутрь, в/м, в/в. При интенсивной терапии в
первые 2-3 нед лечения - по 400-800 мг/сут в/в медленно или в/м; порошок растворяют только в специальном прилагаемом растворителе (растворе L-лизина). Для поддерживающей терапии - по 800-1600 мг/сут внутрь между приемами пищи, не разжевывая, желательно в первой половине дня.

Профилактика
Основные профилактические мероприятия должны быть направлены на предотвращение инфицирования вирусами гепатитов, следовательно, требуются раннее выявление больных со стертыми формами заболевания и их адекватное лечение. У носителей HBsAg необходим регулярный (не реже 1 раза в 6 мес) контроль биохимических и вирусологических показателей в целях предотвращения активации и репликации вируса.
Для вакцинации против гепатита В применяют рекомбинантные вакцины: «Биовак В*», «Энджерикс В*», «Эувакс В*», «Шанвак-В*» и др. РД для новорожденных и детей до 10 лет - 10 мкг (0,5 мл суспензии), для детей старше 10 лет - 20 мкг (1 мл суспензии).
Новорожденным, рожденным от матерей - носителей гепатита В, одновременно с вакциной рекомендуют введение иммуноглобулина против гепатита В, при этом препараты следует вводить в разные места. В соответствии с правилами, существующими в РФ, вакцинацию этой категории детей проводят четырехкратно по схеме: 0 (в день рождения)-1- 2-12 мес жизни. Против гепатита В обязательно прививают подростков в возрасте 11-13 лет по той же схеме.
Широко вакцинируют медицинских работников и лиц из групп риска по заражению гепатитом В. Вакцинация приводит к постепенному снижению уровня инфицированности населения РФ вирусом гепатита В.
Вакцина против гепатита С до настоящего времени не разработана, в связи с чем профилактику гепатита С строят на пресечении всех возможностей парентерального (в том числе трансфузионного) инфицирования.
Диспансерное наблюдение описано ниже.
Прогноз
Вероятность полного выздоровления незначительна. При ХГВ происходит многолетняя персистенция вируса-возбудителя, возможно сочетание с активным патологическим процессом. В среднем через 30 лет у 30% больных хроническим активным гепатитом В развивается цирроз печени. В течение 5 лет примерно у каждого четвертого пациента с циррозом, обусловленным гепатитом В, наступает декомпенсация функции печени, еще у 5-10% пациентов развивается рак печени (см. рис. 6-8). Без лечения примерно 15% пациентов с циррозом умирают в течение 5 лет. В 1-1,5% случаев формируется цирроз, а в остальных 89% возникает длительная ремиссия с носительством НВsАg. При ΧΓD прогноз неблагоприятный: в 20-25% случаев процесс перетекает в цирроз печени; высвобождения от возбудителя не наступает. ХГС течет медленно, мягко, без прекращения вирусемии в течение многих лет, с периодическим повышением активности трансаминаз и с выраженной склонностью к фиброзированию. По мере прогрессирования процесса развиваются цирроз печени и гепатоцеллюлярная карцинома.
АУТОИММУННЫЙ ГЕПАТИТ
Код по МКБ-10
К75.4. Аутоиммунный гепатит.
АИГ - прогрессирующее гепатоцеллюлярное воспаление печени неизвестной этиологии, характеризуемое наличием перипортального гепатита, частой ассоциацией с другими аутоиммунными заболеваниями, повышением концентрации иммуноглобулинов (гипергаммаглобулинемией) и наличием аутоантител в крови.
Как и другие аутоиммунные заболевания, АИГ чаще встречается у лиц женского пола, общая заболеваемость составляет примерно 15-20 случаев на 100 000 населения. В детском возрасте доля АИГ среди хронических гепатитов составляет от 1,2 до 8,6%, наблюдается в возрасте 6-10 лет. Соотношение девочек и мальчиков составляет 3-7:1.
Этиология и патогенез
В основе патогенетического механизма развития АИГ лежит врожденный дефект мембранных рецепторов HLA. У пациентов имеется дефект функции Т-супрессоров, сцепленных гаплотипом HLA, в результате возникает неуправляемый синтез В-лимфоцитами антител класса IgG, разрушающих мембраны нормальных гепатоцитов, причем развиваются патологические иммунные реакции против собственных гепатоцитов. Часто в процесс вовлекается не только печень, но и крупные железы внешней и внутренней секреции, в том числе поджелудочная, щитовидная, слюнные железы. В качестве основного фактора патогенеза АИГ рассматривается генетическая предрасположенность (иммунореактивность к аутоантигенам), которая, однако, сама по себе не является достаточной. Полагают, что для реализации процесса необходимы запускающие агенты (триггеры), среди которых рассматриваются вирусы (Эпштейна-Барр, кори, гепатитов А и С) и некоторые лекарственные препараты (например, препараты интерферона) и неблагоприятные факторы окружающей среды.
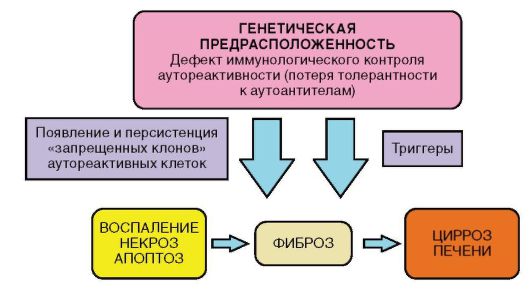
Рис. 6-9. Патогенез АИГ
Патогенез АИГ представлен на рис. 6-9. Эффекторный механизм повреждения гепатоцитов, вероятно, в большей степени связан с реакцией аутоантител на печеночноспецифические антигены гепатоцитов, нежели с прямой Т-клеточной цитотоксичностью.
Классификация
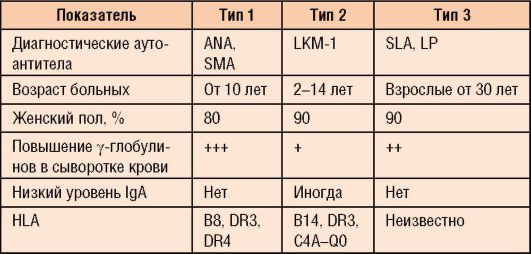
В настоящее время выделяют 3 типа АИГ:
- тип 1 - классический вариант, на его долю приходится 90% всех случаев болезни. Выявляют антитела к к гладкомышечным клеткам (Smooth Muscle Antibody - SMA) и ядерным антигенам (печеночно-специфическому
белку - Antinuclear Antibodies - ANA) в титре более 1:80 у подростков и более 1:20 у детей;
- тип 2 - составляет около 3-4% всех случаев АИГ, большая часть больных - дети от 2 до 14 лет. Выявляют антитела к микросомам печени и почек (Liver Kidney Microsomes - LKM-1);
- тип 3 - характеризуется наличием антител к растворимому печеночному антигену (Soluble Liver Antigen - SLA) и печеночно-панкреатическому антигену (LP).
Некоторые особенности АИГ с учетом типов представлены в табл. 6-8.
Таблица 6-8. Классификация и особенности типов АИГ
Клиническая картина
Заболевание в 50-65% случаев характеризуется внезапным появлением симптомов, сходных с таковыми при вирусном гепатите. В ряде случаев оно начинается постепенно и проявляется повышенной утомляемостью, анорексией и желтухой. Другие симптомы включают лихорадку, артралгию, витилиго (нарушение пигментации, выражающееся в исчезновении пигмента меланина на отдельных участках кожи) и носовые кровотечения. Печень выступает из-под края реберной дуги на 3-5 см и уплотняется, имеется спленомегалия, живот увеличен в размере (рис. 6-10, а). Как правило, выявляют внепеченочные признаки хронической патологии печени: сосудистые звездочки, телеангиэктазии, пальмарную эритему. У части пациентов имеется кушингоидная внешность: угри, гирсутизм и розовые стрии на бедрах и животе; у 67% диагностируют другие аутоиммунные заболевания: тиреоидит Хашимото, ревматоидный артрит и др.
Диагностика
Диагностика основывается на обнаружении синдромов цитолиза, холестаза, гипергаммаглобулинемии, увеличении концентрации IgG, гипопротеинемии, резком увеличении СОЭ, подтверждается выявлением аутоантител против гепатоцитов.
Характерен синдром гиперспленизма, его признаки:
• спленомегалия;
• панцитопения (уменьшение количества всех форменных элементов крови): анемия, лейкопения, нейтропения, лимфопения, тромбоцитопения (при резкой степени выраженности появляется синдром кровоточивости);
• компенсаторная гиперплазия костного мозга.
В диагностике безусловное значение имеют инструментальные методы исследования (сканирование, биопсия печени и др.).
Патоморфология
Морфологические изменения печени при АИГ являются характерными, но неспецифичными. ХГ, как правило, переходит в мультилобулярный цирроз печени (рис. 6-10, б); характерна высокая степень активности: перипортальные
некрозы, порто-портальные или центропортальные мостовидные некрозы, реже - портальный или лобулярный гепатит, преимущественно лимфоцитарная инфильтрация с большим количеством плазматических клеток, образование розеток (рис. 6-10, в).
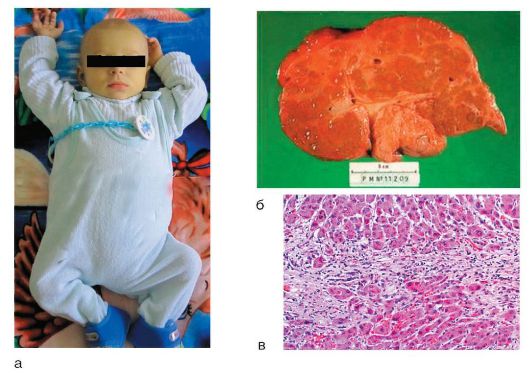
Рис. 6-10. АИГ: а - ребенок с исходом в цирроз печени; б - макропрепарат: макронодулярный цирроз; в - микропрепарат: гистологическая картина (окраска гематоксилин-эозином; χ 400)
Дифференциальная диагностика
Дифференциальную диагностику проводят с ХГВ, холециститом, болезнью Вильсона-Коновалова, лекарственным гепатитом, недостаточностью α-1-антитрипсина и т.д.
Выделяют определенный и вероятный АИГ. Первый вариант характеризуется наличием вышеуказанных показателей, включая увеличение титров аутоантител. Кроме того, отсутствуют вирусные маркеры в сыворотке крови, поражение желчных протоков, отложение меди в ткани печени, нет указаний на гемотрансфузии и применение гепатотоксических лекарственных препаратов.
Вероятный вариант АИГ оправдан, когда имеющиеся симптомы позволяют думать об АИГ, но недостаточны для постановки диагноза.
Лечение
Основой является иммуносупрессивная терапия. Назначают преднизолон, азатиоприн или их сочетания, которые позволяют достичь клинической, биохимической и гистологической ремиссии у 65% больных в течение 3 лет. Лечение продолжают по меньшей мере 2 года до достижения ремиссии по всем критериям.
Преднизолон назначают в дозе 2 мг/кг (максимальная доза - 60 мг/сут) с постепенным ее снижением на 5-10 мг каждые 2 нед под еженедельным контролем биохимических показателей. При отсутствии нормализации уровня трансаминаз дополнительно назначают азитиоприн в начальной дозе 0,5 мг/кг (максимальная доза - 2 мг/кг).
Через год от начала ремиссии желательно отменить иммуносупрессивную терапию, но только после контрольной пункционной биопсии печени. Морфологическое исследование должно свидетельствовать об отсутствии или минимальной активности воспалительных изменений.
При неэффективности глюкокортикоидной терапии применяют циклоспорин (сандиммум неорал*) для приема внутрь с первого года жизни, который выпускают в растворе 100 мг в 50 мл во флаконе, капсулах по 10, 25, 50 и 100 мг,
назначают препарат в дозе 2-6 мг/кг в сутки (не более 15 мг/ м2 в неделю). Циклофосфамид (циклофосфан*) назначают в/в капельно в дозе 10-12 мг/кг 1 раз в 2 нед, далее в таблетках по 0,05 г по 15 мг/кг 1 раз в 3-4 нед, курсовая доза - не более 200 мг/кг.

У 5-14% пациентов наблюдают первичную резистентность к лечению. Они в первую очередь подлежат консультации в центрах трансплантации печени.

Профилактика
Первичная профилактика не разработана, вторичная заключается в ранней диагностике, диспансерном наблюдении больных (описано ниже) и длительной иммуносупрессивной терапии.
Прогноз
Заболевание без лечения непрерывно прогрессирует и не имеет самопроизвольной ремиссии - формируется цирроз печени. При АИГ типа 1 чаще эффективны глюкокортикоиды и прогноз относительно благоприятный: во многих случаях удается достичь продолжительной клинической ремиссии. При АИГ типа 2 заболевание обычно быстро прогрессирует в цирроз печени. Тип 3 клинически недостаточно очерчен, и его течение не изучено.
При неэффективности иммуносупрессивной терапии больным показана трансплантация печени, после которой 5-летняя выживаемость составляет более 90%.
Лекарственный гепатит
Код по МКБ-10
K71. Лекарственный гепатит.
Лекарственный гепатит - токсическое поражение печени, включающее идиосинкразическую (непредсказуемую) и токсическую (предсказуемую) лекарственную болезнь печени, связанное с приемом гепатотоксических лекарственных препаратов и токсичных веществ.
Этиология и патогенез
Печень выполняет важную роль в метаболизме ксенобиотиков (чужеродных веществ). Группа ферментов, расположенных в эндоплазматической сети печени, известных под названием «цитохром Р450», является самым важным семейством ферментов метаболизма в печени. Цитохром Р450 усваивает около 90% токсических и лекарственных средств.
Нередко печень становится мишенью для их повреждающего действия. Выделяют прямой и непрямой типы повреждения печени.
Прямой тип повреждения печени зависит от дозы препарата и обусловлен действием самого препарата на клетки печени и ее органеллы. К препаратам с облигатным дозозависимым гепатотоксическим действием относят парацетамол и антиметаболиты, приводящие к некрозу гепатоцитов. Прямое повреждение печени также могут вызывать тетрациклин, меркаптопурин, азатиоприн, андрогены, эстрогены и др.
Непрямой тип повреждения печени, не зависящий от дозы лекарственных средств, наблюдают при приеме нитрофуранов, рифампицина, диазепама, мепробамата и др. Этот тип отражает индивидуальную реакцию организма ребенка как проявление гиперчувствительности к лекарственным средствам.
Печень участвует в метаболизме различных ксенобиотиков благодаря процессам биотрансформации, подразделяемым на две фазы.
• Первая фаза - окислительные реакции, проходящие при участии цитохромов Р450. Во время этой фазы могут образовываться активные метаболиты, некоторые из них обладают гепатотоксическими свойствами.
• Вторая фаза, во время которой происходит конъюгация образовавшихся ранее метаболитов с глутатионом, сульфатом или глюкуронидом, вследствие чего формируются нетоксичные гидрофильные соединения, выводимые из печени в кровь или желчь.
Особое место среди токсических поражений печени занимают лекарственные, или медикаментозные, гепатиты. Их формирование происходит чаще в результате бесконтрольного применения лекарственных препаратов (рис. 6-11, а). Практически любой препарат способен вызвать поражение печени и развитие гепатита разной степени тяжести.
Токсины можно условно разделить на бытовые и производственные. Выделяют производственные яды органической природы (углерода тетрахлорид, хлорированный нафталин, тринитротолуол, трихлорэтилен и др.), металлы и металлоиды (медь, бериллий, мышьяк, фосфор), инсектициды (дихлордифенилтрихлорэтан - ДДТ, карбофос и др.).
Рис. 6-11. Лекарственный гепатит: а - формирование лекарственного гепатита с некрозом гепатоцитов; б - гистологическая картина лекарственного гепатита после лечения острого лейкоза (окраска гематоксилин-эозином; χ 400)
Особенно тяжелые формы поражения гепатоцитов развиваются при отравлении такими веществами, как парацетамол, яд бледной поганки, белый фосфор, четыреххлористый углерод, все производственные яды.
Клиническая картина
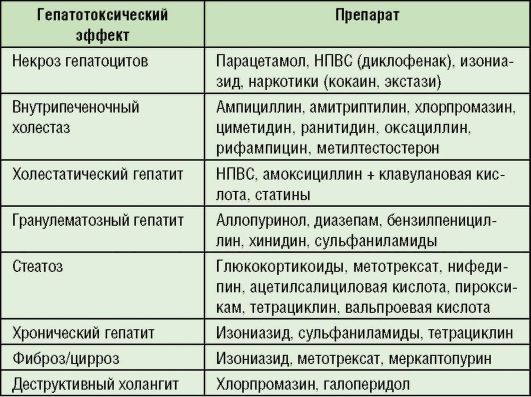
Типичные формы поражения печени с гепатотоксическими эффектами лекарственных препаратов представлены в табл.
6-9.
Таблица 6-9. Наиболее распространенные гепатотоксические эффекты лекарственных препаратов
Лекарственные реакции могут быть транзиторными, ХГ наблюдаются нечасто. Функциональные пробы печени могут нормализоваться через несколько недель (до 2 мес) после отмены лекарственных препаратов, но при холестатическом гепатите этот период может увеличиваться до 6 мес. Желтуха всегда указывает на более тяжелое поражение печени, возможно развитие острой печеночной недостаточности.
Диагностика
Основу диагностики лекарственных поражений печени составляет тщательно собранный анамнез о применявшихся лекарственных препаратах, предписанных или применяемых в качестве самолечения. Обычно временной интервал между приемом препарата и началом заболевания составляет от 4 дней до 8 нед.
Биопсия может быть показана при подозрении на предшествующую патологию печени или при отсутствии нормализации биохимических показателей крови (функциональных проб печени) после отмены лекарственного препарата.
Патоморфология
Наблюдаются дискомплексация печеночных балок, тяжелая белковая (зернистая и баллонная) дистрофия гепатоцитов, полиморфизм ядер гепатоцитов, дистрофические и некробиотические изменения в ядрах гепатоцитов (рис. 6-11, б).
Дифференциальная диагностика
Возможность токсических эффектов лекарственных препаратов следует учитывать при дифференциальной диагностике печеночной недостаточности, желтухи. Необходимо исключение других причин: вирусных гепатитов, заболеваний желчных протоков и т.д. В редких случаях приходится проводить дифференциальную диагностику с врожденными обменными заболеваниями, способными стать причиной поражения печени, гликогенозами I типа (болезнью Гирке),
III типа (болезнь Кори), IV типа (болезнь Андерсена), VI типа (болезнью Герса). Эти заболевания возникают вследствие избыточного накопления в клетках печени гликогена. Хронические поражения печени лекарственного генеза следует также дифференцировать от липидозов: болезни Гоше (в основе лежит накопление в ретикулогистиоцитарных клетках азотсодержащих цереброзидов) и болезни Нимана- Пика (возникающей вследствие накопления в клетках ретикулоэндотелиальной системы фосфолипидов, главным образом сфингомиелина). Также необходимо исключить галакто- и фруктоземию.
Лечение
Обязательным и главным условием лечения является полный отказ от применения гепатотоксического лекарственного препарата.
Высококалорийная (90-100 ккал/кг в сутки) диета, богатая белками (2 г/кг в сутки) и углеводами, способствует восстановлению функционального состояния печени. С лечебными целями рекомендуют эссенциальные фосфолипиды, обладающие мембраностабилизирующим и гепатопротективным действием, а также ингибиторы процессов перекисного окисления липидов. Также назначают тиоктовую кис-
лоту (липоевую кислоту*, липамид*), которая снижает токсическое воздействие лекарственных препаратов благодаря антиоксидантному действию; детям старше 12 лет - флавоноид силибинин (карсил*) по 5 мг/кг в 3 приема (драже не разжевывать, принимать после еды, запивая большим количеством воды).
Прогноз
Прогноз зависит от того, насколько быстро отменен препарат, обусловивший поражение печени. Обычно клинические проявления и изменения биохимических показателей нормализуются в течение нескольких дней, редко недель.
Прогноз всегда серьезный, когда формируется картина хронического поражения печени с печеночно-клеточной недостаточностью.
Профилактика хронических гепатитов
Первичная профилактика не разработана, вторичная заключается в раннем распознавании и адекватном лечении детей с острым вирусным гепатитом.
Широкое внедрение вакцинации против гепатитов А и В позволит решить проблему не только острого, но и хронического гепатита.
ЦИРРОЗ ПЕЧЕНИ
Коды по МКБ-10
К71.7. Токсическое поражение печени с фиброзом и циррозом печени.
К74. Фиброз и цирроз печени криптогенный. К74.3. Первичный билиарный цирроз. К74.4. Вторичный цирроз печени. К74.5. Билиарный цирроз неуточненный. К74.6. Другой и неуточненный цирроз печени. P78.3. Цирроз врожденный.
Цирроз печени - хроническое прогрессирующее заболевание, характеризуемое дистрофией и некрозом печеночной паренхимы, сопровождаемое ее узловой регенерацией, диффузным разрастанием соединительной ткани. Является поздней стадией различных заболеваний печени и других органов, при которой нарушается структура печени, а функции печени выполняются не в полном объеме, в результате чего развивается печеночная недостаточность.
Следует отличать цирроз печени от ее фиброза. Фиброз - очаговое разрастание соединительной ткани при различных поражениях печени: абсцессах, инфильтратах, гранулемах и т.д.
В экономически развитых странах цирроз печени встречается у 1% населения, входит в число 6 основных причин смерти пациентов в возрасте от 35 до 60 лет. Ежегодно в мире умирают 40 млн человек от вирусного цирроза печени и гепатоцеллюлярной карциномы, развивающейся на фоне носительства вируса гепатита В. Чаще наблюдается у лиц мужского пола, соотношение с женским полом составляет 3:1.
Атрезия желчных путей - одна из частых причин билиарного цирроза у детей грудного возраста, заболеваемость составляет 1 на 10 000-30 000 новорожденных.
Этиология и патогенез
К циррозу печени приводят многие болезни печени и других органов, длительный прием лекарственных препаратов (см. рис. 6-11, а, 6-12, а) и т.д. Кроме того, в формировании цирроза имеют значение другие заболевания:
• первичный билиарный цирроз;
• паразитарные заболевания печени: эхинококкоз, шистосомоз и др.;
• наследственные нарушения обмена веществ (гемохроматоз, гепатолентикулярная дегенерация, галактоземия, недостаточность α-1-антитрипсина и др.);
• нарушение венозного оттока из печени (синдром Бадда-Киари, веноокклюзионная болезнь, тяжелая правожелудочковая сердечная недостаточность) и т.д.
Атрезию желчевыводящих путей относят к аномалиям развития, которую в большинстве случаев связывают с перенесенным внутриутробно гепатитом, чаще вызванным одним из реовирусов. У некоторых детей возникновение этого порока развития обусловлено неблагоприятными факторами, действовавшими на 4-8-й неделе внутриутробной жизни. Обычно у таких детей имеются пороки развития других органов (чаще почек, сердца, позвоночника). У некоторых детей имеется ассоциация с трисомиями по 13-й и 18-й парам хромосом. Атрезия характеризуется полным закрытием внутри-, внепеченочных желчных ходов в различных вариантах. Чаще (в 70-80% случаев) встречается внутрипеченочная форма атрезии.
Одним из главных признаков и осложнений цирроза печени является синдром портальной гипертензии, который возникает из-за повышения давления в воротной вене (вене, приносящей кровь от органов брюшной полости к печени) более 5 мм рт.ст. В результате повышенного давления в воротной вене кровь не может оттекать от органов брюшной полости и возникает застой крови в этих органах (рис. 6-12, б).
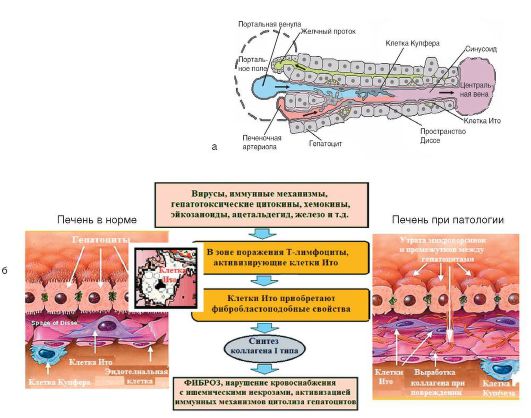
Примерный клеточный состав печени: 70-80% - гепатоциты, 15% - эндотелиальные клетки, 20-30% - клетки Купфера (макрофаги), 5-8% - клетки Ито (рис. 6-13, а). Клетки Ито (синонимы: звездчатые клетки печени, жирозапасающие клетки, липоциты), расположенные в перисинусоидальном пространстве Диссе, играют ключевую роль в патогенезе цирроза печени. Являясь основными клетками соединительной ткани в печени, они формируют внеклеточный матрикс, в норме накапливая липиды. При повреждении печени клетки Ито начинают продуцировать коллаген типа I и цитокины, приобретая фибробластоподобные свойства (рис. 6-13, б). Этот процесс происходит при участии гепатоцитов и клеток Купфера.
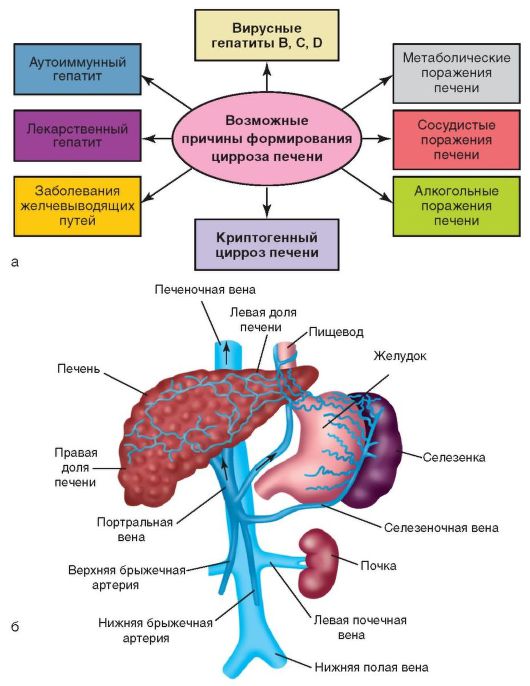
Рис. 6-12. Цирроз печени: а - этиологические факторы; б - портальная система печени и механизм формирования портальной гипертензии
Патогенез цирроза печени представлен на рис. 6-13, б, но приблизительно у 10-35% больных этиология и патогенез цирроза печени остаются неизвестными.
1 Рис. 6-13. а - часть печеночной дольки и ее клеточный состав; б - патогенез цирроза печени
Изменения печени при циррозе обычно диффузные, лишь при билиарном циррозе они могут быть очаговыми. Гибель гепатоцитов, ассоциированная с воспалением и фиброзом, приводит к нарушению нормальной архитектоники печени: утрате нормальной печеночной сосудистой сети с развитием портокавальных шунтов и формированием узлов регенерации сохранившихся гепатоцитов (рис. 6-14, а), а не нормальных печеночных долек, выявляемых в аутопсийном материале или прижизненно с помощью МРТ (рис. 6-14, б).
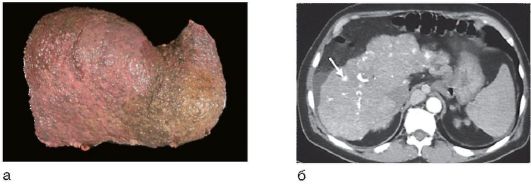
Рис. 6-14. Изменения печени при циррозе: а - макропрепарат микронодулярного цирроза печени; б - МРТ печени: стрелкой указан узел регенерации
Классификация
Выделяют атрезию внепеченочных желчных путей (без или в сочетании с атрезией желчного пузыря), атрезию внутрипеченочных желчных протоков (без или в сочетании с атрезией внепеченочных желчных путей), тотальную атрезию. Классификация цирроза печени представлена в табл. 6-10.
Таблица 6-10. Классификация цирроза печени
Клиническая картина
При первичном билиарном циррозе печени, который проявляется воспалением желчных протоков печени с нарушением оттока желчи, наблюдаются желтуха, кожный зуд, повышение температуры тела и другие симптомы. Билиарный цирроз, связанный с врожденной атрезией желчевыводящих путей, формируется быстро, приводя к летальному исходу при отсутствии оперативного вмешательства по жизненным показаниям.
Алкогольный цирроз печени развивается у лиц, длительное время употребляющих алкогольные напитки в неумеренно больших дозах, в гепатологии детского возраста он не рассмат ривается.
Цирроз печени у детей старшего возраста развивается медленно и в первое время может протекать без симптомов. Признаки, указанные в табл. 6-11, как правило, развиваются постепенно и незаметны для ребенка, длительное время болеющего хроническим заболеванием печени или других органов, и для его родителей.

Гепатомегалию наблюдают в начале заболевания. Постепенная деструкция гепатоцитов, фиброз по мере прогрессирования основного заболевания приводят к уменьшению размеров печени. Особенно характерно уменьшение размеров печени при циррозе, обусловленном вирусным и аутоиммунным гепатитом.
Таблица 6-11. Признаки цирроза печени


Осложнениями цирроза печени являются синдром портальной гипертензии (табл. 6-12), варикозное расширение вен нижних конечностей, кровотечение из расширенных вен пищевода, печеночная кома.
Таблица 6-12. Диагностика синдрома портальной гипертензии
Варикозное расширение вен нижних конечностей - осложнение цирроза печени, проявляющееся болями в конечностях, видимым и значительным увеличением вен. Кровотечение из расширенных вен пищевода проявляется выделением крови изо рта и/или почернением кала. Печеночная кома - поражение головного мозга, развивающееся в результате скопления в крови большого количества токсичных веществ, как правило, развивается при декомпенсированном циррозе; основные признаки синдрома печеночно-клеточной недостаточности представлены в табл. 6-13.
Таблица 6-13. Признаки синдрома печеночно-клеточной недостаточности
Диагностика
В биохимическом анализе выявляют первоначально синдромы цитолиза, холестаза, воспаления, позже - гепатодепрессивный синдром (см. табл. 1-8).
При УЗИ описывают микронодулярный (рис. 6-15, а) или макронодулярный (рис. 6-15, б) виды цирроза печени. Гистологические синонимы для этих названий:
• мелкоузловой цирроз - характерно образование мелких узелков (диаметром около 1 мм);
• крупноузловой цирроз - в областях предшествующего разрушения печеночной архитектоники выявляют крупные фиброзные рубцы.
Патоморфология
Классический макропрепарат печени, ярко представляющий билиарный цирроз печени, представлен на рис. 6-15, в.
При жизни ребенка с точностью указать на цирроз печени может только биопсия, при которой выявляют тяжелые дистрофические изменения в гепатоцитах, холестазы, очаги разрастания соединительной ткани (фиброзные узлы), между которыми островками расположены нормальные клетки печени (рис. 6-15, г).
Дифференциальная диагностика
Дифференциальную диагностику проводят с заболеваниями печени, обусловленными нарушениями питания и обмена веществ: жировым гепатозом, гликогенозами, амилоидозом, муковисцидозом и др. Исключают опухоли, абсцесс, паразитарные заболевания печени.
Лечение
Основными принципами лечения цирроза печени являются следующие.
• Устранение причин, приведших к циррозу (этиотропное лечение): противовирусная терапия (вирусные гепатиты), абстиненция (алкогольный цирроз), отмена лекарственных препаратов (лекарственный гепатит).
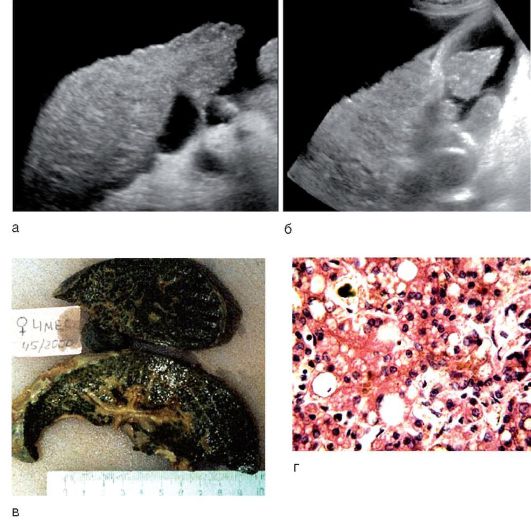
Рис. 6-15. Цирроз печени по данным УЗИ: а - микронодулярный; б - макронодулярный: врожденная атрезия желчных ходов с формированием цирроза: в - макропрепарат; г - микропрепарат (окраска гематоксилин-эозином; χ 400)
• Диетотерапия.
• Терапия развившихся осложнений цирроза печени: симптоматическое лечение печеночной энцефалопатии, синдрома портальной гипертензии и др.
• Патогенетическое: удаление избытка железа и меди (гемохроматоз, болезнь Вильсона-Коновалова), иммуносупрессивная терапия (АИГ), лечение холестаза (первичный билиарный цирроз).

При установленном диагнозе атрезии желчных путей лечение оперативное: холедохоеюностомия либо протоэнтеростомия (операция Касаи - создание прямого анастомоза между декапсулированной вскрытой поверхностью печени в
области ворот и кишечником), пересадка части печени. До операции лечение поддерживающее. Глюкокортикоиды неэффективны, так же как и другие лекарственные средства. В то же время 1 раз в неделю следует вводить витамин К парентерально, периодически проводить курсы гепатопротекторов, витаминов Е, D.
Лечение осложнений цирроза печени
Асцит (основные рекомендации):
• строгий постельный режим;
• гипонатриевая диета: при минимальном и умеренном асците - ограничение приема поваренной соли до 1,0- 1,5 г/сут; при напряженном асците - до 0,5-1,0 г/сут;
• ограничение приема жидкости до 0,8-1,0 л в день;
• диуретическая терапия: антагонисты альдостерона и натрийуретики;
• терапевтический парацентез (3-6 л) с внутривенным введением раствора альбумина (из расчета 6-8 г на 1 л удаленной асцитической жидкости);
• ультрафильтрация с помощью перитонеально-венозного шунта, трансъюгулярного внутрипеченочного портосистемного шунта;
• трансплантация печени.
Диуретики. Гидрохлоротиазид (гипотиазид*) в таблетках и капсулах назначают внутрь детям с 3 до 12 лет по 1-2 мг/кг в сутки в 1 прием. Гипокалиемии можно избежать применением препаратов, содержащих калий, или приемом пищи, богатой калием (фруктов, овощей).
Спиронолактон (верошпирон*, альдактон*, веропилактон*) в таблетках, капсулах, начальная суточная доза - 1,33 мг/кг, максимально - 3 мг/кг в 2 приема, или 30- 90 мг/м2, курс - 2 нед. Противопоказан в грудном возрасте.
Фуросемид (лазикс*) в таблетках по 40 мг и гранулах для приготовления суспензии, ампулах 1% - 2 мл. Новорожденным назначают 1-4 мг/кг в сутки 1-2 раза, 1-2 мг/кг в/в или в/м 1-2 раза в сутки, детям - 1-3 мг/кг в сутки, подросткам - по 20-40 мг/сут.
Мочегонные препараты назначают утром. Необходимы контроль уровня калия в сыворотке крови, ЭКГ.

Критерием эффективности проводимой терапии служит положительный водный баланс, составляющий 200-400 мл/ сут при малом объеме асцита и 500-800 мл/сут - при отечноасцитическом синдроме у детей старшего возраста. Парацентез выполняют по строгим показаниям (при большом количестве жидкости) с одновременным введением альбумина в количестве 4-5 г в/в. При неэффективности лекарственной терапии возможно оперативное лечение (шунтирование).
Основные рекомендации при кровотечении из расширенных вен пищевода
• Гемостатическая терапия (ε-аминокапроновая кислота, викасол*, глюконат кальция, дицинон*, эритроцитная масса).
• Восстановление объема циркулирующей крови (раствор альбумина, плазма).
• Фармакологическое снижение портального давления (вазопрессин, соматостатин, октреотид).
• Механическая тампонада пищевода (зонд Сенгстакена- Блэкмора).
• Эндоскопические методы остановки кровотечения (склеротерапия с помощью этаноламина, полидоканола, лигирование стволов вен).
• Трансъюгулярный внутрипеченочный портосистемный шунт.
• Профилактика стрессовых язв ЖКТ (блокаторы Н2-гистаминовых рецепторов, ИПН).
• Профилактика печеночной энцефалопатии (лактулоза, сифонные клизмы).
• Профилактика спонтанного бактериального перитонита (антибиотики).
Основные фармакологические средства при геморрагическом синдроме
ε-Аминокапроновая кислота для внутривенного введения и в гранулах для приготовления суспензии для приема внутрь, суточная доза для детей до 1 года - 3 г; 2-6 лет - 3-6 г, 7-10 лет - 6-9 г.
Менадиона натрия бисульфат (викасол*) 1% раствор назначают детям до 1 года - по 2-5 мг/сут, 1-2 года - 6 мг/сут, 3-4 года - 8 мг/сут, 5-9 лет - 10 мг/сут, 10-14 лет - 15 мг/сут. Продолжительность лечения - 3-4 дня, после 4-дневного перерыва курс повторяют.
Этамзилат (дицинон*) выпускают в таблетках по 250 мг и в виде 12,5% раствора в ампулах по 2 мг (250 мг в ампуле) для внутримышечного и внутривенного введения. При кровотечении детям до 3 лет вводят по 0,5 мл, 4-7 лет - 0,75 мл, 8-12 лет - 1-1,5 мл и 13-15 лет - 2 мл. Указанную дозу повторяют каждые 4-6 ч в течение 3-5 дней. В дальнейшем лечение дициноном* можно продолжить в таблетках (суточная доза - 10-15 мг/кг): детям до 3 лет - по 1/4 таблетки, 4-7 лет - 1/2 таблетки, 8-12 лет - по 1 таблетке и 13-15 лет - по 1,5-2 таблетки 3-4 раза в сутки.
Средство для укрепления сосудистой стенки - флавоноид троксерутин, аскорбиновая кислота + рутозид (аскорутин*).
Для снижения портального давления используют десмопрессин (минирин*) - аналог естественного гормона аргинин-вазопрессина по 100-200 мг на ночь.

Лечение злокачественного новообразования печени проводят специалисты онкологического центра. Показания к спленэктомии
• Сегментарная внепеченочная портальная гипертензия.
• Выраженный гиперспленизм с геморрагическим синдромом.
• Отставание в физическом и половом развитии детей с циррозом печени.
• Гигантская спленомегалия с выраженным болевым синдромом (инфаркты, периспленит).
Лечение спонтанного бактериального перитонита осуществляют цефалоспоринами III-IV поколения.
Радикальным методом лечения цирроза печени является трансплантация печени.
Профилактика
Основой вторичной профилактики является своевременное этиотропное и патогенетическое лечение острого и хронического гепатита.
Профилактика цирроза по существу третичная и четвертичная, поскольку проводят лечение, направленное на стабилизацию патологического процесса в печени, предупреждение обострений, снижение риска развития и прогрессирования осложнений. Дети должны находиться под динамическим наблюдением в специализированных клиниках и центрах, а в амбулаторных условиях - под наблюдением педиатра и гастроэнтеролога. Иммунопрофилактику проводят строго индивидуально.
Профилактика осложнений, к примеру первого кровотечения из варикозно расширенных вен пищевода, возможна благодаря эндоскопическому исследованию не реже 1 раза в 2-3 года в целях динамического наблюдения вероятного их развития. Состояние больных с начальной стадией варикозного расширения вен пищевода контролируют эндоскопически 1 раз в 1-2 года. Профилактическое лечение проводят при средней и тяжелой степени.
Прогноз
Прогноз цирроза печени неблагоприятный и, как правило, неопределенный и непредсказуемый, так как зависит от причины цирроза, возраста больного, стадии болезни, возможности непредвиденных фатальных осложнений. Сам по себе цирроз печени неизлечим (за исключением тех случаев, когда была сделана пересадка печени), однако правильное лечение цирроза позволяет в течение длительного времени (20 лет и более) компенсировать болезнь. Соблюдение диеты, традиционных и альтернативных методов лечения (рис. 6-16), отказ от вредных привычек значительно повышают шансы больного на компенсацию болезни.
Рис. 6-16. Варианты лечения пациентов с циррозом печени
Без хирургического лечения дети с атрезией желчных путей погибают на 2-3-м году жизни. Чем раньше проведена операция, тем лучше прогноз. Около 25-50% рано оперированных детей переживают 5 лет и более, когда им делают пересадку печени. Исход зависит от наличия или отсутствия воспалительного и склеротического процесса в печени.
ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ
Коды по МКБ-10
К72. Печеночная недостаточность. K72.0. Острая и подострая печеночная недостаточность. K72.1. Хроническая печеночная недостаточность. K72.9. Печеночная недостаточность неуточненная.
Печеночная недостаточность - комплекс симптомов, характеризуемый нарушением одной или нескольких функций печени, появляющийся вследствие повреждения ее паренхимы (синдром гепатоцеллюлярной или печеночно-клеточной недостаточности). Портосистемная или печеночная энцефалопатия - это симптомокомплекс нарушений ЦНС, возникающий при печеночной недостаточности с глубоким нарушением многочисленных жизненно важных функций печени.
Смертность от печеночной недостаточности составляет 50-80%. При острой печеночной недостаточности возможно развитие печеночной энцефалопатии, которая при острых болезнях печени встречается редко, но летальность может достигать 80-90%.
Этиология и патогенез
Острая печеночная недостаточность возникает при тяжелых формах вирусных гепатитов А, В, С, D, Е, G, отравлениях гепатотропными ядами (алкоголем, некоторыми лекарственными препаратами, промышленными токсинами, микотоксинами и афлатоксинами, углекислым газом и др.). Ее причинами могут быть вирусы герпеса, цитомегаловирус, вирус инфекционного мононуклеоза, простого и опоясывающего лишая, Коксаки-вирус, возбудитель кори; септицемия при абсцессах печени. Описана острая печеночная недостаточность при токсических гепатозах (синдроме Рея, состоянии после отключения тонкой кишки), болезни Вильсона- Коновалова, синдроме Бадда-Киари.
Синдром Бадда-Киари (код по МКБ-10 - I82.0) развивается вследствие прогрессирующего сужения или закрытия печеночных вен. На почве тромбофлебита пупочной вены и аранциева протока, впадающего в устье левой печеночной вены, синдром Бадда-Киари может начаться в раннем детстве. В результате в печени развивается застой со сдавлением печеночных клеток.
Синдром Рея (код по МКБ-10 - G93.7) - острая энцефалопатия с отеком мозга и жировой инфильтрацией печени, возникающая у ранее здоровых новорожденных, детей и подростков (чаще в возрасте 4 - 12 лет), связанная с предшествующей вирусной инфекцией (например, ветряной оспой или гриппом типа А) и приемом препаратов, содержащих ацетилсалициловую кислоту.
Хроническая печеночная недостаточность является следствием прогрессирования хронических заболеваний печени (гепатитов, цирроза печени, злокачественных опухолей печени и др.). Основные этиологические факторы указаны на рис. 6-17, а.
В основе патогенеза печеночной недостаточности лежат два процесса. Во-первых, выраженная дистрофия и распространенный некробиоз гепатоцитов ведут к значительному снижению функций печени. Во-вторых, из-за многочисленных коллатералей между воротной и полой веной значительная часть всосавшихся токсических продуктов поступает в большой круг кровообращения в обход печени. Отравление вызывают необезвреженные продукты распада белка, конечные продукты обмена веществ (аммиак, фенолы).
Возникновение печеночной энцефалопатии при печеночной недостаточности связано с нарушениями гомеостаза, кислотно-основного состояния и электролитного состава крови (дыхательным и метаболическим алкалозом, гипокалиемией, метаболическим ацидозом, гипонатриемией, гипохлоремией, азотемией). В системный кровоток из ЖКТ и печени поступают церебротоксические вещества: аминокислоты и продукты их распада (аммиак, фенолы, меркаптаны); продукты гидролиза и окисления углеводов (молочная, пировиноградная кислоты, ацетон); продукты нарушенного метаболизма жиров; ложные нейротрансмиттеры (аспарагин, глутамин), которые оказывают токсические эффекты на ЦНС. Механизм поражения ткани головного мозга связан с нарушением функции астроцитов, которые составляют примерно 30% клеток головного мозга. Астроциты играют ключевую роль в регуляции проницаемости гематоэнцефалического барьера, в обеспечении транспорта нейротрансмиттеров к нейронам головного мозга, а также в разрушении токсических веществ (в частности, аммиака) (рис. 6-17, б).
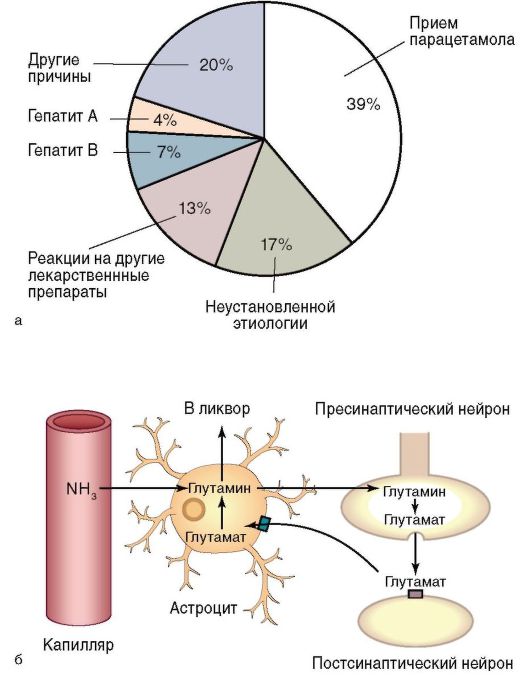
Рис. 6-17. Хроническая печеночная недостаточность и печеночная энцефалопатия: а - этиология печеночной недостаточности; б - механизм формирования печеночной энцефалопатии
Обмен аммиака. У здоровых людей в печени аммиак трансформируется в мочевую кислоту в цикле Кребса. Он необходим в реакции превращения глутамата в глутамин, которая опосредована ферментом глутаматсинтетазой. При хроническом поражении печени количество функционирующих гепатоцитов уменьшается, создавая предпосылки для гипераммониемии. При возникновении портосистемного шунтирования аммиак, минуя печень, попадает в системный кровоток - возникает гипераммониемия. Аммиак, поступая
в головной мозг, приводит к нарушению функционирования астроцитов, вызывая в них морфологические изменения. В результате при печеночной недостаточности возникает отек головного мозга, повышается внутричерепное давление.
В условиях цирроза печени и портосистемного шунтирования возрастает активность глутаматсинтетазы скелетной мускулатуры, где начинает происходить процесс разрушения аммиака. Этим объясняется уменьшение мышечной массы у пациентов с циррозом печени, что, в свою очередь, также способствует гипераммониемии. Процессы метаболизма и экскреции аммиака происходят и в почках.
Клиническая картина
Клиническая картина проявляется расстройствами сознания и когнитивных функций, сонливостью, монотонной речью, тремором, дискоординацией движений. Особенно важными признаками являются быстрое уменьшение размеров печени, ее размягчение и болезненность при пальпации. В табл. 6-14 кратко сведены клинические проявления по стадиям печеночной недостаточности и энцефалопатии, различия острой и хронической печеночной недостаточности - в табл. 6-15.
Таблица 6-14. Классификация стадий печеночной недостаточности и энцефалопатии
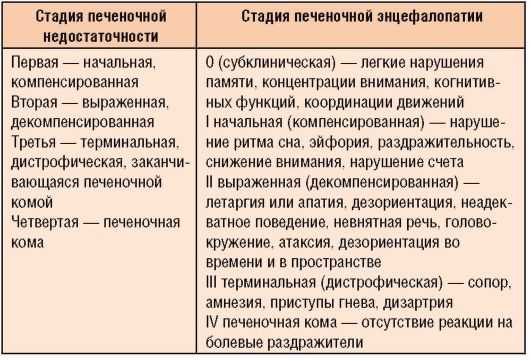
Таблица 6-15. Дифференциальная диагностика острой и хронической печеночной недостаточности
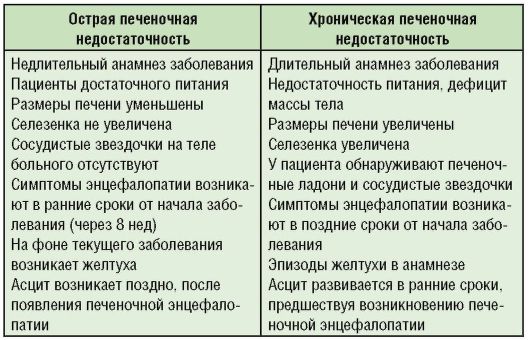
Печеночной коме предшествует общее возбуждение, которое переходит в угнетение сознания: ступор и сопор, затем происходит полная его потеря. Появляются менингеальные явления, патологические рефлексы (хватательный, сосательный), двигательное беспокойство, судороги. Дыхание становится аритмичным, по типу Куссмауля или Чейна-Стокса. Пульс малый, неритмичный. Изо рта и от
кожи исходит печеночный запах (foetor hepatica), обусловленный выделением метилмеркаптана; усиливаются желтуха и геморрагический синдром, нарастают асцит, гипопротеинемические отеки (рис. 6-18, а). Клинические проявления декомпенсированной и терминальной стадий ярко представлены на рис. 6-18, б-г. Термином «злокачественная форма» (наиболее тяжелая форма) обозначается качественно новое клиническое состояние, возникающее у больных вирусным гепатитом В в случае развития у них массивного или субмассивного некроза печени.
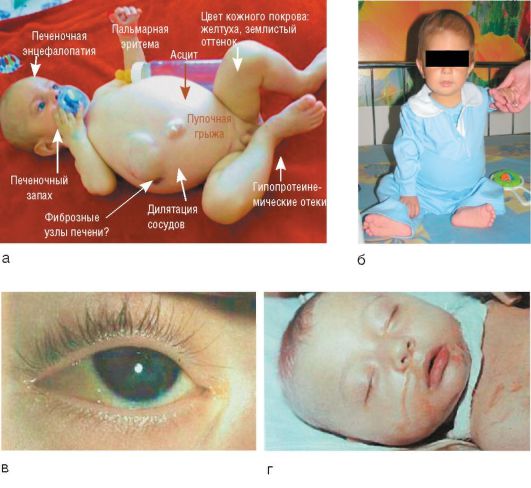
Рис. 6-18. Печеночная недостаточность: а - клинические проявления; а и б - декомпенсированная стадия; в - терминальная стадия («плавающее глазное яблоко»); г - печеночная кома

В течение последующих 2-3 дней развивается глубокая печеночная кома. Иногда кома наступает, минуя стадию возбуждения.
Диагностика
Проводят лабораторно-инструментальные исследования.
• В общем анализе крови выявляются анемия, лейкоцитоз, тромбоцитопения, повышение СОЭ.
• При биохимическом исследовании диагностируются билирубинемия, азотемия, гипоальбуминемия, гипохолестеринемия, возрастают уровни АЛТ, АСТ, ЩФ, снижаются уровни фибриногена, калия, натрия, протромбиновый индекс, отмечается метаболический ацидоз.
• При УЗИ, КТ печени выявляется изменение размеров и структуры паренхимы печени.
Патоморфология
Морфологические изменения в печени касаются всех ее тканевых компонентов: паренхимы, ретикулоэндотелия, соединительнотканной стромы, в меньшей степени - желчевыводящих путей.
Различают три варианта острой формы болезни:
- острую циклическую форму;
- холестатический (перихолангиолитический) гепатит;
- массивный некроз печени.
Выраженность морфологических изменений зависит от тяжести и этиологии болезни (рис. 6-19, а, б). В разгар заболевания преобладают альтернативные, экссудативные процессы, в период выздоровления - процессы пролиферации и регенерации.
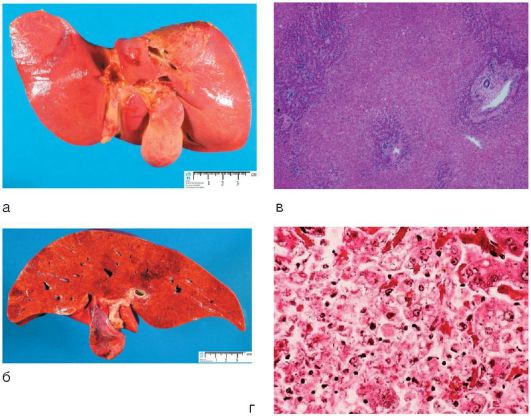
Рис. 6-19. Некроз печени, макро- и микропрепараты: а - этиология неизвестна; б - аденовирусная этиология; в - χ 250; г - χ 400 (окраска гематоксилин-эозином)
При холестатическом (перихолангиолитическом) гепатите морфологические изменения касаются в основном внутрипеченочных желчных ходов (холангиолит и перихолангиолит).
Некроз печени представляет собой крайнюю степень изменений в печени, который может быть массивным, когда гибнет почти весь печеночный эпителий или сохраняется незначительная кайма клеток по периферии долек, или субмассивным, при котором некробиозу подвергаются большинство гепатоцитов, преимущественно в центре долек (рис. 6-19, в, г).
Дифференциальная диагностика
В целях дифференциальной диагностики необходимо исключить внепеченочные причины появления симптомов со стороны ЦНС. Определяют уровень аммиака в крови при поступлении в стационар пациента с циррозом печени и признаками поражения ЦНС. Необходимо установить наличие в анамнезе больного таких патологических состояний, как метаболические расстройства, желудочно-кишечное кровотечение, инфекции, запор.
При возникновении симптомов печеночной энцефалопатии проводят дифференциальную диагностику с заболеваниями, к которым относятся следующие.
• Внутричерепные патологические состояния: субдуральная гематома, внутричерепное кровотечение,
инсульт, опухоль головного мозга, абсцесс головного мозга.
• Инфекции: менингит, энцефалит.
• Метаболическая энцефалопатия, развившаяся на фоне гипогликемии, электролитных нарушений, уремии.
• Гипераммониемия, вызванная врожденными аномалиями мочевыводящих путей.
• Токсическая энцефалопатия, вызванная приемом алкоголя, острой интоксикацией, энцефалопатией Вернике.
• Токсическая энцефалопатия, возникшая на фоне приема лекарственных препаратов: седативных и антипсихотических средств, антидепрессантов, салицилатов.
• Послесудорожная энцефалопатия.
Лечение
Лечение заключается в ограничении количества белка в пищевом рационе, назначении лактулозы. Пациенты с печеночной энцефалопатией являются кандидатами на трансплантацию печени.

В комплексе лечебных мероприятий печеночной недостаточности существуют этапы (рис. 6-20), а также выделяют базисную (стандартную) терапию и ряд более радикальных средств, имеющих целью очищение организма от токсических продуктов нарушения обмена веществ, а также замену (временную или постоянную) функций пораженной печени.
Базисная терапия острой печеночной недостаточности направлена на коррекцию электролитного, энергетического баланса, кислотно-основного состояния, витаминов и кофакторов, нарушений свертывающей системы крови, гемоциркуляции, ликвидацию гипоксии, профилактику осложнений, предупреждение всасывания из кишечника продуктов гнилостного распада. К базисной терапии относится и применение глюкокортикоидов.
Общие принципы ведения больного с острой печеночной недостаточностью
• Индивидуальный пост медицинской сестры.
• Мониторирование мочевыделения, глюкозы в крови и жизненных функций каждый час.
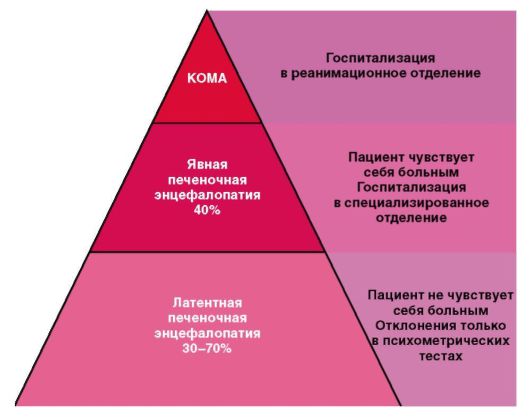
Рис. 6-20. Этапы лечения печеночной энцефалопатии
• Контроль калия в сыворотке крови 2 раза в день.
• Анализ крови, определение содержания креатинина, альбумина, оценка коагулограммы ежедневно.
• Профилактика пролежней.
Общие принципы ведения больного с хронической печеночной недостаточностью
• Активное наблюдение за состоянием пациента с учетом выраженности симптомов энцефалопатии.
• Ежедневное взвешивание больного.
• Ежедневная оценка баланса жидкости, выпитой и выделенной за сутки.
• Ежедневное определение анализа крови, содержания электролитов, креатинина.
• Определение 2 раза в неделю содержания билирубина, альбумина, активности АСТ, АЛТ, ЩФ.
• Коагулограмма, содержание протромбина.
• Оценка необходимости и возможности трансплантации печени в конечной стадии цирроза печени.
Лечение печеночной энцефалопатии
• Устранение провоцирующих факторов.
• Остановка желудочно-кишечного кровотечения.
• Подавление роста протеолитической микрофлоры в толстой кишке и лечение инфекционных заболеваний.
• Нормализация электролитных расстройств.
• Уменьшение степени гипераммониемии:
а) уменьшение аммиакогенного субстрата:
- очищение ЖКТ (сифонные клизмы, слабительные);
- уменьшение потребления белка;
б) связывание аммиака в крови:
- орнитин (гепа-мерц*);
в) подавление образования аммиака:
- антибиотики широкого спектра действия;
- ацидификация кишечного содержимого лактулозой. Для снижения содержания аммиака рекомендуют клизмы
или применение слабительных средств для опорожнения кишечника не менее 2 раз в день. С этой целью назначают лактулозу (нормазе*, дюфалак*) в сиропе по 20-50 мл внутрь каждый час до появления диареи, затем по 15-30 мл 3-4 раза в день. Для использования в клизме препарата до 300 мл разводят в 500-700 мл воды.
Перед выпиской пациента из стационара дозу лактулозы следует уменьшить до 20-30 мл на ночь с возможной последующей отменой на амбулаторном этапе.

К радикальным методам лечения относятся следующие меры по массивному удалению токсичных продуктов из крови больного.
• Управляемая гемодилюция.
• Плазмаферез.

• Заменное переливание крови.
• Временная (или постоянная) замена печени больного путем экстракорпорального подключения ксенопечени (свиной), перекрестного кровообращения.
• Гетеро- и ортотопическая трансплантация печени.
Профилактика
Лучший способ предотвратить печеночную недостаточность - предупредить риск развития цирроза или гепатита. Для этого требуется специфическая иммунизация, важны соблюдение здорового образа жизни, правил личной гигиены, диетотерапия.
Введение специфического иммуноглобулина при случайном переливании инфицированной крови и при рождении ребенка у матери - носительницы HBsAg или больной гепатитом В позволит осуществить пассивную иммунизацию. Активная иммунизация - вакцинация ребенка в первые сутки после рождения, непривитых детей любого возраста, а также лиц из групп риска: профессиональных (медиков, работников экстренных служб, военных и др.), лиц, находящихся на программном гемодиализе и др. (ревакцинация каждые 7 лет). Вакцинация против вирусного гепатита В защищает от заражения гепатитом D.
Прогноз
При устранении причины, вызвавшей печеночную недостаточность, можно уменьшить проявления печеночной энцефалопатии. Хроническая печеночная кома имеет летальный исход, однако при острой гепатоцеллюлярной недостаточности иногда возможно выздоровление. При развитии печеночной энцефалопатии летальность может достигать 80-90%.