Эндокринная регуляция. Биохимические и физиологические аспекты : учеб. пособие / А.Н. Смирнов ; под ред. В.А. Ткачука - 2009. - 368 с.
|
|
|
|
ГЛАВА 5. ЛАКТАЦИЯ
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
Стадии развития молочной железы. В ходе онтогенеза молочная железа проходит ряд стадий развития, обеспечивающих соответствие ее морфологического и функционального состояния потребности в вскармливании потомства:
1) органогенез молочной железы из первичной протоковой системы, вырастающей из конечных концевых почек. После достижения протоками границы стромы формирующейся молочной железы конечные концевые почки исчезают, развивается разветвленная структура с лобулярными (дольковыми) почками. Стадия начинается в эмбриогенезе и завершается при половом созревании;
2) разрастание и физиологическая дифференцировка лобулоальвеолярной системы из лобулярных почек. Стадия начинается приблизительно в середине беременности и завершается при родах;
3) стимуляция лактации. Стадия начинается после родов и завершается при прекращении кормления;
4) инволюция лобулоальвеолярной системы с возвращением к состоянию конца стадии 1.
Все этапы развития молочной железы являются гормонзависимыми. Ведущую роль в указанных процессах играет ПРЛ, действующий совместно с рядом других гормонов, набор которых специфичен для каждой стадии и зависит от вида животного.
Важнейшую роль в развитии молочной железы играют межклеточные взаимодействия между эпителиальными клетками, формирующими протоки и альвеолы, и окружающими клетками стромы (фибробласты и адипоциты). Эти взаимодействия реализуются с участием ряда паракринных сигнальных соединений.
Андрогены. У грызунов андрогены семенников мужских эмбрионов служат фактором, блокирующим развитие зачатков молочной желе-
зы. Эпителиальные клетки у плода индуцируют экспрессию А-Рц в мезенхиме. Благодаря этому в ответ на андроген мезенхимальные клетки собираются вокруг эпителиальной почки и разрушают ее. Индукция А-Рц в мезенхиме осуществляется с паракринным участием ПТГ-рП. В отсутствие экспрессии ПТГ-рП в эпителиальных клетках или его рецептора (ПТГ/ПТГ-рП-Рц) в мезенхимальных клетках А-Рц в последних не экспрессируется, и развитие молочной железы идет по женскому типу (рис. 5-1). В постнатальный период андрогены снижают пролиферативное действие эстрогенов на протоковую систему молочной железы.
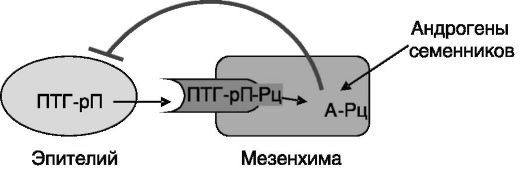 Рис. 5-1. Механизм блокады развития молочной железы андрогенами
Рис. 5-1. Механизм блокады развития молочной железы андрогенами
Эстрогены. Эстрогены являются ведущим фактором развития протоковой системы молочной железы при половом созревании (1-я стадия развития; рис. 5-2). Нокаут генов ароматазы (блокировка продукции эстрогенов) или Э-Рца (блокировка проведения сигнала эстрогенов) у мыши ведет к тому, что протоковая система у взрослых животных остается такой же неразвитой, как у новорожденных. Эксперименты с рекомбинацией тканей эмбрионов позволяют предполагать, что первичным объектом действия эстрогенов служат стромальные клетки, которые паракринным путем стимулируют пролиферацию клеток про-
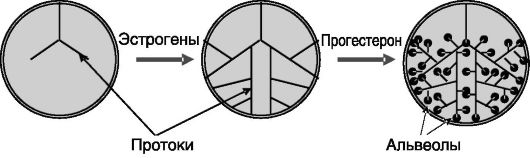 Рис. 5-2. Эстрогены индуцируют рост протоков, а прогестерон - их ветвление и альвеологенез
Рис. 5-2. Эстрогены индуцируют рост протоков, а прогестерон - их ветвление и альвеологенез
токов. У взрослых животных эстрогенный сигнал принимают и эпителиальные, и стромальные клетки. Э-Рцβ, хотя и способен проводить пролиферативный сигнал эстрогенов, но, по-видимому, не является необходимым для этого. Нокаут гена Э-Рцβ у мыши ведет к снижению экспрессии молекул адгезии, в результате чего возникают дефекты морфогенеза молочной железы. Интересно отметить, что основная часть пролиферирующих под действием эстрогенов эпителиальных клеток лишена рецепторов эстрогенов (Э-Рц), что указывает на паракринный путь распространения пролиферативного сигнала (рис. 5-3). Паракринными посредниками действия эстрогенов через стромальные клетки могут быть фактор роста гепатоцитов (ФРГ), а также ИФРI и ФРФ10. В распространении сигнала эстрогенов, воспринимаемого эпителиальными клетками, участвует амфирегулин. Однако форма этого участия остается неясной, поскольку известный рецептор амфирегулина (ЭФР-Рц) локализуется не в эпителиальных, а в стромальных клетках. Поэтому допускается, что амфирегулин действует на лишенные Э-Рц эпителиальные клетки опосредованно, индуцируя секрецию
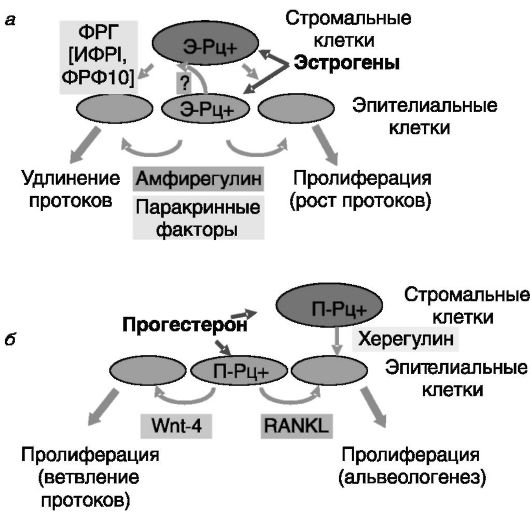 Рис. 5-3. Паракринные механизмы в действии эстрогенов (а) и прогестерона (б) на развитие молочной железы
Рис. 5-3. Паракринные механизмы в действии эстрогенов (а) и прогестерона (б) на развитие молочной железы
стромальными клетками других паракринных факторов. Эстрогены принимают участие и в следующих стадиях развития молочной железы. В частности, эстрогены являются индукторами экспрессии рецепторов прогестерона в эпителиальных клетках, и это является необходимым элементом для 2-й стадии развития молочной железы.
Прогестерон. Повышенный уровень прогестерона при беременности посредством стимуляции пролиферации эпителиальных клеток обеспечивает боковое ветвление протоков и альвеологенез в молочной железе, а также подавляет апоптоз альвеолярных клеток (см. рис. 5-2). Указанные эффекты опосредуются паракринным путем небольшой группой эпителиальных клеток, содержащих П-Рц, и которые сами не пролиферируют в ответ на прогестерон. Паракринным посредником действия прогестерона на альвеолы служит лиганд рецептора, активирующего ядерный фактор κΒ (RANKL). RANKL индуцирует экспрессию циклина D1 и тем самым стимулирует пролиферацию клеток. Паракринным посредником стимуляции прогестероном ветвления протоков, по-видимому, является Wnt-4 - секретируемый белок, взаимодействующий с рецептором, сопряженным с G-бел- ками (группа «кудрявых» рецепторов; см. рис. 5-3). Интересно, что для стимулирующего действия прогестерона на экспрессию RANKL необходима изоформа П-Рц Β, а индукция экспрессии Wnt-4 может опосредоваться обеими изоформами рецептора (П-Рц A и П-Рц Β).
Релаксин. Релаксин, продуцируемый желтыми телами яичников при беременности, стимулирует развитие альвеолярного аппарата и вызывает дезорганизацию фибрилл внеклеточного матрикса молочной железы, подавляет рефлекторное отделение молока. У крысы и мыши играет решающую роль в развитии сосков молочных желез. Так, нокаут генов релаксина или его рецептора (LGR7) у мыши ведет к тому, что соски оказываются слишком малыми для захвата новорожденными, и мышата гибнут от голода. В отличие от большинства других эффектов действие релаксина на соски не зависит от эстрогенов.
Пролактин. Мыши с нокаутированным геном рецептора ПРЛ (ПРЛ-Рц-/-) стерильны из-за неспособности бластоцисты к имплантации. Введение прогестерона обеспечивает беременность, но молочная железа оказывается неразвитой. В действии ПРЛ на развитие молочной железы принимают участие многие эндокринные, паракринные и аутокринные факторы, а также внутриклеточные белковые посредники. ПРЛ-Рц экспрессируются в эпителиальных клетках - основных объектах действия пролактина. ПРЛ-Рц образуется в двух
формах - короткой и длинной. Считается, что только длинная форма способна к полноценному проведению гормонального сигнала. Действие ряда лактогенных гормонов направлено, в частности, на регуляцию уровня экспрессии и соотношения форм ПРЛ-Рц. Так, у девственных овец при гормональной индукции лактации введение эстрогена и прогестерона повышало экспрессию обеих форм ПРЛ-Рц. Дополнительное введение глюкокортикоида и гормона роста повышало долю длинной формы рецептора.
Стимулирующее действие пролактина на пролиферацию эпителиальных клеток и альвеологенез включает индукцию ИФР-II. Клетки, лишенные ПРЛ-Рц, не отвечают пролиферацией на ПРЛ, но отвечают на эктопическую экспрессию ИФР-II. Объектом ИФР-II служит циклин D1, участвующий в пролиферации клеток.
ПРЛ также обеспечивает чувствительность ткани молочной железы к прогестерону, участвующему в лобулоальвеолярной дифференцировке железы при беременности. Прекращение вскармливания сопровождается инволюцией молочной железы, инициация которой, в частности, связана со снижением уровня ПРЛ в кровяном русле.
При инволюции молочной железы у крысы наблюдается 50-кратное повышение содержания в молоке ИФРСБ 5. ИФРСБ 5 секретируется эпителиальными клетками, подвергающимися апоптозу. Повышение тормозилось введением пролактина. Введение ИФРСБ 5 интактным животным вызывало инволюцию молочной железы. У трансгенных мышей с экспрессией ИФРСБ 5, специфичной для молочной железы (под промотором β-лактоглобулина), отмечалось недоразвитие молочной железы, сниженное количество альвеолярных концевых почек, сниженное ветвление протоков. Полагают, что ИФРСБ 5 блокирует антиапоптотическое действие ИФР-I и ИФР-II путем их связывания с мицеллами казеина.
Глюкокортикоиды. Пересадка зачатка молочной железы мышей с нокаутированным геном рецептора глюкокортикоидов (ГК-Рц-/-) в жировые тельца нормальных мышей сопровождается недоразвитием протоков, нарушениями люминального эпителия, увеличением стромы. У мышей с мутантным ГК-Рц с дефектом связывания с ДНК наблюдаются нарушения развития протоков, вероятно, за счет снижения пролиферации эпителиальных клеток. Инволюция молочной железы по окончании лактации включает апоптоз альвеолярного эпителия. Этому препятствуют прогестерон и глюкокортикоиды (взаимозаменяемо). Инволюция коррелирует с активностью STAT3.
Гормон роста. У овец индукция лактации может быть вызвана комбинированным введением эстрадиола, прогестерона и глюкокортикоида. Дополнительное введение соматолиберина вызывало дальнейший рост молочной железы и выход молока. У мышей с нокаутированным геном рецептора ГР (ГР-Рц-/-) наблюдается недостаточность развития протоков. В то же время при пересадке эпителия молочной железы мышей ГР-Рц -/- в жировые тельца нормальных мышей наблюдается нормальное развитие ткани. По-видимому, сигнал ГР поступает через стромальные клетки. Действительно, гормон роста (а также ЭФР) активирует STAT5 преимущественно в строме. Полагают, что ГР стимулирует секрецию стромальными клетками ИФР-I, оказывающего антиапоптотическое, ростовое действие на клетки эпителия.
Тиреоидные гормоны. У крысы при лактации снижен уровень ТТГ, T3, T4, свободного T4. Гипертиреоз у лактирующих крыс ведет к инволюции молочной железы, связанной, по-видимому, с недостаточным выбросом окситоцина, а также ГР и ПРЛ при сосании.
Пептид, родственный паратгормону. ПТГ-рП у крысы экспрессируется эпителиальными клетками с 14-го дня беременности и во время лактации. Секретируется в кровь и молоко. Экспрессируется в миоэпителиальных и эпителиальных клетках. Оказывает несколько типов эффектов на молочную железу.
В линии миоэпителиальных клеток человека ПТГ-рП через повышение цАМФ ингибировал стимулирующий эффект окситоцина на Саi. Стимулирует секрецию кальция с молоком у овец. Повышает кровоток в молочной железе (вазодилатация), повышает концентрацию кальция и снижает концентрацию фосфата в крови. Гиперэкспрессия ПТГ-рП в молочной железе у трансгенных мышей ведет к дефектам удлинения протоков и их ветвления при пубертации, а также лобулоальвеолярном развитии при беременности. Но ПТГ-рП необходим для образования первичного протокового дерева в эмбриогенезе. На трансгенных животных с репрессируемой тетрациклином экспрессией ПТГ-рП показано, что временная гиперэкспрессия трансгена перед рождением ведет к дефектам ветвления протоков при пубертации, а гиперэкспрессия при пубертации вызывает снижение скорости удлинения протоков. Гиперэкспрессия после завершения морфогенеза протоков не влияет на лобулоальвеолярное развитие. Нарушение элонгации протоков связано с повышением скорости апоптоза терминальных концевых почек и отсутствием повышения пролиферации
концевых почек. В результате эстрогены и прогестерон не формируют терминальные протоки.
Инактивирующие мутации рецептора ПТГ-рП (ПТГ-Рц1), вызывающие летальную форму карликовости, сопровождаются отсутствием у плодов сосков и молочных желез. У мыши ПТГ-рП продуцируется в эпителиальных клетках эмбриональной молочной железы. ПТГ-рП взаимодействует с окружающей мезенхимой (стромой), экспрессирующей рецептор ПТГ/ПТГ-Рп, для образования плотной мезенхимы, которая поддерживает и включает эпителиальный морфогенез и индуцирует вышележащий эпидермис к образованию соска. В лактирующей молочной железе крысы ПТГ-рП экспрессируется в альвеолярных эпителиальных клетках и стромальных фибробластах, а рецептор ПТГ/ПТГ-рП - в альвеолярных эпителиальных клетках, стромальных фибробластах и миоэпителиальных клетках.
Экспрессия ПТГ-рП в эпителиальных клетках стимулируется ЭФР, инсулином, ИФР-I. Эффекты ингибировались гидрокортизоном и 1,25(OH)2D3. У человека во время лактации ПТГ-рП коррелирует с ПРЛ.
RANKL и RANK. RANKL и RANK - лиганд и его рецептор семейства фактора некроза опухолей альфа (ФНО-α). Могут служить пара/аутокринными посредниками действия прогестерона, пролактина и ПТГ-рП. Оба белка экспрессируются в эпителии молочной железы. ПРЛ и ПТГ-рП повышают экспрессию RANKL. Нокаут мышей по RANKL или RANK ведет к недоразвитию лобулоальвеолярной системы при беременности, хотя более ранние стадии развития были нормальными.
Лептин. Лептин обнаружен в коровьем молоке. Экспрессируется адипоцитами, эпителиальными и миоэпителиальными клетками. Индуцируется инсулином и ИФР-I в культуре. Рецептор лептина обнаруживается в эпителиальных клетках. Данные о влиянии лептина на развитие молочной железы противоречивы. С одной стороны, у мышей с недостаточностью лептина (линия ob/ob) или его рецептора (линия db/db) развитие молочной железы было минимальным, что свидетельствует о стимуляции лептином пролиферации эпителия. С другой стороны, экспрессия лептина в молочной железе подавляется лактогенными гормонами.
Инсулиноподобные факторы роста. ИФР служат ауто/паракрин- ными посредниками стимулирующего действия ПРЛ, ГР и отчасти эстрогенов на рост и ветвление протоков молочной железы.
У гипофизэктомированных (недостаточность ПРЛ и ГР) крыс наблюдается недоразвитие протоков. Имплантация в молочную железу ИФР-I нормализует развитие. В культуре органа ГР стимулирует экспрессию ИФР-I. И напротив, введение мышам антагониста ГР-Рц подавляет развитие молочной железы за счет снижения продукции ИФР-I. Стимулирующее действие ГР реализуется через стромальные клетки, содержащие ГР-Рц, и синтезированный фибробластами и адипоцитами ИФР-I направляется к эпителиальным клеткам, содержащим рецептор ИФР. Пролактин действует непосредственно на эпителиальные клетки, стимулируя ими секрецию ИФР-II. Эстрогены используют оба пути стимуляции продукции ИФР в молочной железе. У мышей с нокаутированным геном ИФР-I снижены количество терминальных концевых почек, пролиферация и ветвление протоков. Нарушения снимаются введением ИФР-I, а также беременностью. В культуре эпителия ИФР тормозят апоптоз. Инволюция молочной железы после окончания лактации тормозится у мышей с гиперэкспрессией ИФР-I или ИФР-II. Действие ИФР-I на образование терминальных концевых почек синергично с эстрогенами, т.е. ИФР-I - не только посредник, но и партнер эстрогенов в действии на молочную железу. В стимуляции пролиферации наблюдается также синергизм между ИФР-I и ЭФР. Эффект осуществляется через нижележащие эффекторы и трансактивацию ЭФР-Рц.
Белки, связывающие инсулиноподобные факторы роста. ИФРСБ сдерживают антиапоптотическое действие ИФР, что проявляется при инволюции молочной железы, когда соотношение ИФР ИФРСБ значительно снижается.
мРНК всех шести известных ИФРСБ обнаружены в терминальных концевых почках пубертатных молочных желез с преобладанием ИФРСБ 3 и ИФРСБ 5. При беременности оба белка интенсивно экспрессируются в протоковом и альвеолярном эпителии и в строме. При беременности только в строме обнаруживаются ИФРСБ 2, ИФРСБ 4 и ИФРСБ 6. После прекращения кормления наступает инволюция, сопровождающаяся резким увеличением продукции ИФРСБ 5. Рост ИФРСБ 5 при окончании лактации связывают со снижением уровня ПРЛ. Введение ПРЛ блокирует подъем ИФРСБ 5 (рис. 5-4) и тормозит инволюцию молочной железы. Посредником действия ПРЛ, возможно, является регуляторный фактор интерферона (IRF-1), поскольку отсутствие IRF-1 в молочной железе ведет к повышенной экспрессии ИФРСБ 5. При прекращении лактации резко возрастает также активность STAT3. В отсутствие STAT3 инволюция задерживается и
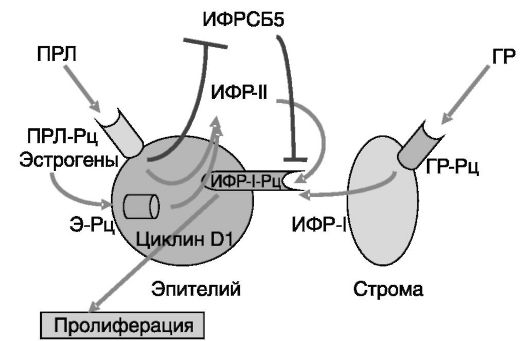 Рис. 5-4. ИФР в регуляции пролиферации эпителия молочной железы
Рис. 5-4. ИФР в регуляции пролиферации эпителия молочной железы
блокируется рост ИФРСБ 5. На модели с генетически измененными мышами показано участие в инволюции проапоптотического ТФР-β и антиапоптотического ингибитора металлопротеиназы-3.
Фактор роста гепатоцитов. ФРГ продуцируется стромальными клетками молочной железы и служит посредником стимулирующего действия эстрогенов на рост и ветвление протоков.
Блокада продукции ФРГ ингибирует 1-ю стадию развития молочной железы. ФРГ экспрессируется преимущественно в период полового созревания, экспрессия снижается во время беременности и лактации и вновь возрастает при инволюции молочной железы. ФРГ оказывает также ингибирующее действие на продукцию молока. Действует через рецепторную тирозинкиназу c-met, экспрессируемую эпителиальными клетками протоков.
Херегулин. Херегулин, или неурегулин, секретируется стромальными клетками и может служить посредником стимулирующего действия прогестерона на лобулоальвеолярную дифференцировку молочной железы. Блокада продукции херегулина ингибирует 2-ю стадию развития железы. Херегулин экспрессируется при беременности, его уровень снижается при лактации и падает до неизмеримых величин при инволюции молочной железы. Херегулин способен также стимулировать продукцию некоторых белков молока. Действует через рецепторные тирозинкиназы группы с-erbB, локализованные на эпителиальных клетках. Вероятным пара/аутокринным посредником херегулина является ИФР-I.
Амфирегулин. Амфирегулин продуцируется эпителиальными клетками в ответ на действие эстрогенов и служит одним из паракринных посредников иррадиации стимулирующего действия эстрогенов на удлинение протоков.
Единственный известный рецептор амфирегулина - ЭФР-Рц - экспрессируется стромальными клетками, поэтому предполагается непрямое действие амфирегулина на пролиферацию эпителиальных клеток, включающее стимуляцию секреции стромальными клетками других паракринных регуляторов (предположительно ФРГ, ИФР-I или ФРФ-10).
ИНВОЛЮЦИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
Различают 2 стадии инволюции после прекращения вскармливания: обратимую (~2 дня) и необратимую (последующие ~ 2 недели). На 1-й стадии активируются (через повышение экспрессии) пути апоптоза, связанные с рецепторами семейства ФНО-α и их лигандами. На 2-й стадии усиливается экспрессия эффекторов митохондриального пути апоптоза (белков группы Bax, каспаз, Apaf). Гибнущие клетки эпителия и остатки молока удаляются из молочной железы активированными клетками иммунной системы, инфильтрация которых в молочную железу стимулируется секрецией хемоаттрактантов типа ИЛ-8. Инволюция молочной железы на данной стадии сходна с заживлением ран. Одним из инициаторов инволюции служит цитокин LIF, действующий через транскрипционный фактор STAT3, экспрессия которого, как отмечалось, резко увеличивается при прекращении вскармливания. Необходимо отметить, что процессы воспаления в инволюирующей молочной железе строго сбалансированы экспрессией противовоспалительных факторов, включая сам LIF и его рецептор. В результате инволюция не связана с повреждением всей молочной железы при обеспечении защиты от инфекции.
РЕГУЛЯЦИЯ СЕКРЕЦИИ МОЛОКА
Основными белками молока являются казеин (преобладающий белок) и белки сыворотки: сывороточный кислый белок (WAP), α-лактоглобулин (или α-лактальбумин) и β-лактоглобулин. В состав молока входят также минорные белковые компоненты, выполняющие
разные функции (рис. 5-5). В регуляции секреции молока принимают участие ПРЛ (через транскрипционные факторы группы STAT), глюкокортикоиды, инсулин. У крупного рогатого скота определенную роль играет ГР (видимо, через ИФР).
Казеин. Локус казеина у мыши состоит из пяти генов. Регуляторные области этих генов имеют сходную организацию. мРНК казеинов в эпителиальных клетках молочной железы начинают увеличиваться со второй половины беременности под действием ПРЛ и ПЛ, но полноценная экспрессия сдерживается высоким уровнем прогестерона и относительно низким уровнем глюкокортикоидов. Наиболее изученной является регуляция экспрессии β-казеина (рис. 5-6). Композитный чувствительный элемент β-казеина включает сайты связывания транскрипционных факторов STAT, NF-1, YY1, ГК-Рц и C/EBP. Данный элемент обеспечивает ингибирование экспрессии гена вне лактации и стимуляцию экспрессии в период лактации. При развитии молочной железы экспрессия доминантно-негативной изоформы C/ΕΒΡβ (LIP) возрастает и коррелирует с клеточной
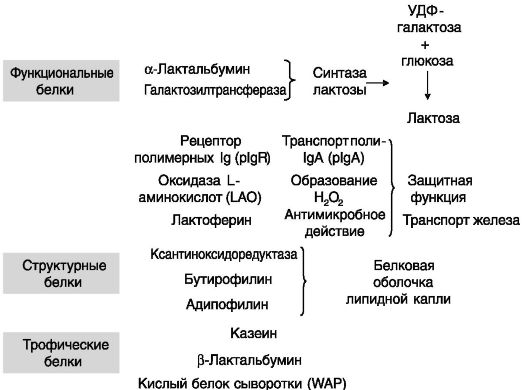 Рис. 5-5. Белки молока
Рис. 5-5. Белки молока
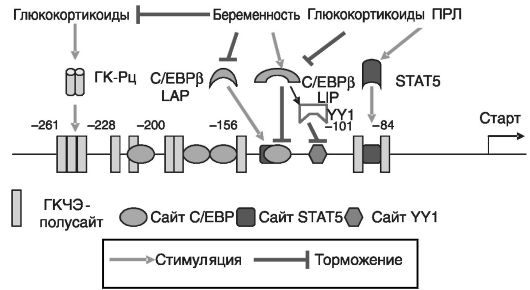 Рис. 5-6. Регуляция экспрессии β-казеина
Рис. 5-6. Регуляция экспрессии β-казеина
пролиферацией при беременности. После родов экспрессия падает. Взаимодействие LIP с промотором гена облегчает связывание еще одного негативного регулятора - фактора YY1. Экспрессия активирующих изоформ C/EBPβ (LAP) после родов несколько снижается, но из-за резкого снижения LIP соотношение LAP/LIP возрастает более чем в 100 раз. Одним из факторов, определяющих падение LIP при родах, служит резкий подъем уровня глюкокортикоидов в этот период. Гены казеина синергично индуцируются ПРЛ и глюкокортикоидами. Эффект глюкокортикоидов зависит от активации ПРЛ STAT5. STAT5 активируется при беременности ПРЛ и играет важную роль в росте и альвеолярной дифференцировке эпителиальных клеток. Во время лактации он управляет экспрессией генов белков молока. ГКРц повышает трансактивационный потенциал STAT5 за счет образования комплекса и доставки к сайту связывания STAT5 на ДНК. Кроме того, ГК-Рц активирует короткую форму STAT5, лишенную трансактивационного домена. В конце беременности и при лактации два остатка серина в трансактивационном домене STAT5a фосфорилируются, и это снижает активность STAT5a в отношении β-казеина в отсутствие одновременной стимуляции ГК-Рц. STAT5a может действовать на ген β-казеина не только самостоятельно, но и в качестве средства доставки к промотору внутриклеточного домена тирозинкиназы erbB4, служащей рецептором паракринного регулятора херегу-
лина. Указанный домен обладает собственной трансактивационной активностью, но не способен прямо взаимодействовать с ДНК. В свою очередь, этот домен erbB4 благодаря наличию в нем сигнала ядерной локализации может обеспечивать транспорт фосфорилированного STAT5a в клеточное ядро под действием херегулина. В гене β-казеина мыши имеется область block C, с которой связываются октамерсвязывающие факторы. Активность этих факторов повышается in vitro инсулином, гидрокортизоном и пролактином, а in vivo - прогестероном ± эстрадиолом.
Белок сыворотки молока (WAP). Экспрессия гена WAP значительно индуцируется глюкокортикоидами в сочетании с инсулином. ПРЛ дополнительно повышает экспрессию. Одна из функций глюкокортикоидов в этом случае заключается в деконденсации хроматина и открытии доступа к сайту для транскрипционных факторов семейства NF-1 (продуктов четырех генов). Интересно, что у жвачных животных ген WAP не экспрессируется, т.е. является псевдогеном.
β-Лактоглобулин. β-Лактоглобулин секретируется у жвачных животных, но не у грызунов и человека. Этот белок относится к семейству липокалинов - небольших белков, связывающих гидрофобные низкомолекулярные соединения. Показано, что он способен связывать жирные кислоты, ретинол, холестерин, витамин D2. Неизвестно, однако, используется ли эта способность для транспорта подобных соединений с молоком. Экспрессия β-лактоглобулина возрастает под действием комбинаций эстроген + прогестин, ПРЛ + инсулин + глюкокортикоид, а также ГР.
α-Лактальбумин. Этот небольшой белок выполняет важную функцию в биосинтезе специфичного для молока дисахарида лактозы. Каталитическую функцию в реакции УДФ-галактоза + глюкоза → лактоза выполняет галактозилтрансфераза. Но в других тканях этот фермент используется для присоединения галактозы к углеводным цепям гликопротеинов. В присутствии α-лактальбумина, являющегося регуляторной субъединицей синтазы лактозы, субстратом для присоединения галактозы становится глюкоза. Экспрессия α-лактальбумина стимулируется сочетанием ПРЛ, инсулина и глюкокортикоида.
Минорные белки молока
Иммуноглобулины. Поступающие с молоком иммуноглобулины матери играют важную роль в защите новорожденных от патогенной флоры. Секреторная форма IgA состоит из полимерного IgA (pIgA),
связанного с внеклеточной частью полимерного рецептора иммуноглобулинов (pIgR). Рецептор опосредует трансцитоз pIgA через эпителиальные клетки. У овец в эпителии молочной железы экспрессия pIgR начинается в последней трети беременности с максимумом в период лактации. Основными индукторами pIgR служат ПРЛ и глюкокортикоиды.
Оксидаза L-аминокислот (LAO). Под действием LAO из аминокислот образуется перекись водорода, выполняющая, по-видимому, бактерицидную функцию. LAO состоит из двух субъединиц. Экспрессия LAO-60 характерна только для эпителия молочной железы. Для экспрессии необходимы глюкокортикоиды. Экспрессия возрастает за 1 день до родов, максимальна в середине лактации и снижается к концу периода лактации.
Ксантиноксидоредуктаза. Ксантиноксидоредуктаза (XOR) - лимитирующий фермент катаболизма пуринов. Ее концентрация в альвеолярных эпителиальных клетках мыши значительно возрастает при переходе от беременности к лактации, причем параллельно происходит перемещение XOR из цитоплазмы в апикальную мембрану. XOR входит в состав липидной глобулы молока, образуя дисульфидные связи с двумя другими белками оболочки липидной капли - бутирофилином и адипофилином. У кормящих мышей с нокаутированным аллелем гена XOR (XOR+/-) детеныши гибнут от истощения, связанного с преждевременной инволюцией молочной железы. Таким образом, XOR играет структурную роль в формировании белковой оболочки липидной капли при ее секреции апикальной поверхностью альвеолярной клетки. В культуре клеток экспрессия белка синергично увеличивалась под действием ПРЛ и кортизола.
Влияние других гормонов на лактацию
Инсулин и ИФР. Инсулин стимулирует экспрессию β-казеина и α-лактальбумина. ИФР-I и ИФР-II были значительно менее эффективны. Механизмы действия инсулина на продукцию молока неизвестны.
Эстрогены и прогестерон. Помимо влияния на рост и дифференцировку молочной железы эти гормоны осуществляют функциональную подготовку к лактации. В частности, эти гормоны обеспечивают чувствительность ткани к ПРЛ, индуцируя экспрессию его рецептора. Глюкокортикоиды обеспечивают возможность рефлекторного выброса ПРЛ при сосании, а эстрогены определяют общий уровень экспрессии ПРЛ.
Окситоцин. Рефлекторный выброс окситоцина при сосании вызывает сокращение миоэпителиальных клеток, окружающих альвеолы, и выдавливание молока в систему протоков. Опорожнение альвеол стимулирует секрецию молока. В молочной железе крысы уровень рецепторов окситоцина постепенно растет в течение беременности (мРНК увеличивается в 150 раз) и остается высоким при лактации. Механизм индукции неясен, поскольку введение эстрогена не влияло на экспрессию рецептора.
Рекомендуемая литература
Akers R.M. Major advances associated with hormone and growth factor regulation of mammary growth and lactation in dairy cows. J Dairy Sci. 2006;89:1222-1234.
Aoki N. Regulation and functional relevance of milk fat globules and their components in the mammary gland. Biosci Biotechnol Biochem. 2006;70:2019-2027.
Cunha G.R., Cooke P.S., Kurita T. Role of stromal-epithelial interactions in hormonal responses. Arch Histol Cytol. 2004;67:417-434.
Hens J.R., Wysolmerski J.J. Key stages of mammary gland development: molecular mechanisms involved in the formation of the embryonic mammary gland. Breast Cancer Res. 2005;7:220-224.
Rosen J.M., Wyszomierski S.L., Hadsell D. Regulation of milk protein gene expression. Annu Rev Nutr. 1999;19:407-436.