Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 8. ПОЛИФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
8.1. Общая характеристика
Полифункциональными называют соединения, в молекулах которых имеется несколько одинаковых функциональных групп.
Среди полифункциональных соединений, участвующих в процессах жизнедеятельности, наиболее широко представлены соединения с гидроксильными и карбоксильными функциональными группами. Специальный интерес представляют β-дикарбонильные соединения. Соединения с несколькими аминогруппами встречаются реже.
8.1.1. Многоатомные спирты и фенолы
Двухатомные спирты, т. е. спирты, содержащие две гидроксильные группы, имеют общее название диолы, или гликоли; трехатомные спирты называют триолами. Представителями таких спиртов являются этиленгликоль и глицерин соответственно. Общее название многоатомных спиртов - полиолы.
В состав многих природных соединений входят в виде фрагментов двухатомные фенолы - пирокатехин, резорцин, гидрохинон.
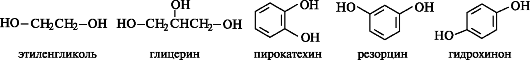
Этиленгликоль (этандиол-1,2) - высокотоксичная жидкость (т. пл. -16 ?С, т. кип. 197 ?С), используется в технике для приготовления антифризов - жидкостей с низкой температурой замерзания.
Глицерин (пропантриол-1,2,3) - нетоксичная вязкая жидкость сладкого вкуса (т. пл. 17 ?С, т. кип. 290 ?С), входит в состав большинства липидов (см. 10.3.2). Применяется как компонент мазей для смягчения кожи.
Пирокатехин (о-дигидроксибензол), называемый также катехолом, является структурным фрагментом многих биологически активных
веществ, в частности катехоламинов (см. 9.2.1). Монометиловый эфир пирокатехина - гваякол - применяется как компонент в составе лекарственных средств при катаре верхних дыхательных путей.
Резорцин (м-дигидроксибензол) используется как антисептик и дезинфицирующее средство при кожных заболеваниях.
Гидрохинон (п-дигидроксибензол), обладающий восстановительной способностью, является структурным фрагментом ряда соединений. В организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспорта электронов от окисляемого субстрата к кислороду.
К спиртам высшей атомности относятся пентиты и гекситы, т. е. соответственно пяти- и шестиатомные спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса. Представители пентитов и гекситов - ксилит и сорбит (см. 11.1.5) - заменители сахара для больных диабетом.
Многоатомный циклический спирт миоинозит (см. 7.2.2) относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных липидов - фосфатидилинозитов (см. 10.4.1). В растениях широко распространена фитиновая кислота, представляющая собой гексафосфат миоинозита. Кальциевая или смешанная кальций-магниевая соль фитиновой кислоты, называемая фитином, улучшает состояние нервной системы при заболеваниях, связанных с недостатком фосфора в организме.
8.1.2. Дикарбоновые кислоты
Карбоновые кислоты, содержащие в своем составе одну карбоксильную группу, называют одноосновными, две - двухосновными и т. д. В настоящем разделе будут рассмотрены некоторые представители дикарбоновых кислот алифатического и ароматического рядов (табл. 8.1). Все они представляют собой кристаллические вещества.
Таблица 8.1. Названия некоторых дикарбоновых кислот и их производных
Название кислоты | Формула | Название аниона или основы сложного эфира |
Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) | НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН | Оксалат Малонат Сукцинат Глутарат |
Систематические названия дикарбоновых кислот строятся по общим правилам заместительной номенклатуры. Однако для боль- шинства из них предпочтительны тривиальные названия. Их латинские названия служат основой названия анионов и производных кислот, которые часто не совпадают с русскими тривиальными названиями (см. табл. 8.1).
Щавелевая кислота - простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium - янтарь).
Малеиновая и фумаровая кислоты - представители ненасыщенных дикарбоновых кислот с одной двойной связью (см. 7.1.3). Фумаровая кислота участвует в обменных процессах, протекающих в организме.
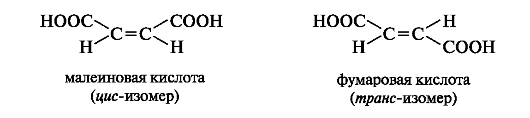
8.1.3. Диамины
Наиболее известны тетраметилендиамин, или путрес- цин H2N(CH2)4NH2, и пентаметилендиамин, или кадаверин H2N(CH2)5NH2. Их долгое время считали трупными ядами, т. е. веществами, образующимися при декарбоксилировании диаминокислот и обусловливающими ядовитость гниющих белков. В настоящее время выяснено, что ядовитые свойства белкам при гниении придают другие вещества.
8.2. Реакционная способность и специфические реакции многоатомных спиртов и фенолов
Полифункциональные соединения могут проявлять свойства, присущие монофункциональным соединениям, т. е. способность вступать в реакции по каждой функциональной группе, поэтому наблюдается определенное сходство в поведении монофункциональ-
ных и полифункциональных соединений. Однако одновременное наличие нескольких функциональных групп обусловливает специфическую реакционную способность, как показано на примере приведенных ниже реакций.
Кислотные свойства. Многоатомные спирты обладают большей кислотностью по сравнению с одноатомными, что является следствием -/-эффекта одной гидроксильной группы по отношению к другой и более полной делокализации отрицательного заряда в сопряженном основании. Так, этиленгликоль проявляет более сильные кислотные свойства, чем этанол.

Хелатообразование. Многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, при взаимодействии с гидроксидами тяжелых металлов, например гидроксидом меди(11) в щелочной среде, образуют внутрикомплексные, так называемые хелатные, соединения. Такие соединения обычно хорошо растворимы в воде и интенсивно окрашены, поэтому реакция используется как качественная. При взаимодействии этиленгликоля или глицерина с гидроксидом меди(11) возникает интенсивно синее окрашивание в результате образования гликолята меди(11) или глицерата меди(11).
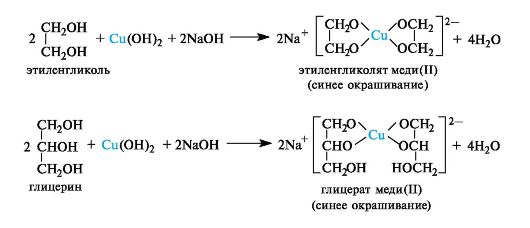
Эта качественная реакция характерна для многоатомных спиртов с открытой цепью и некоторых циклических спиртов, в которых гидроксильные группы достаточно сближены.
Дегидратация. Нагревание этиленгликоля с серной кислотой приводит к межмолекулярному отщеплению двух молекул воды и образованию диоксана.
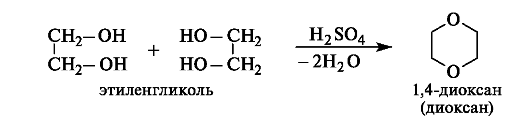
Диоксан (т. кип. 101 ?С) известен как хороший растворитель, смешивается с водой и углеводородами, весьма токсичен.
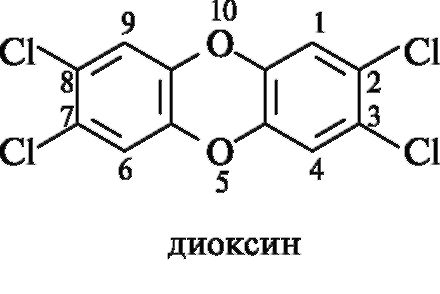
Хлорсодержащие дибензопроизводные диоксана обладают еще более высокой токсичностью. Печальную известность получил 2,3,7,8-тетрахлородибензо-n-диоксин (или просто диоксин), вызывающий в чрезвычайно низких концентрациях тяжелые заболевания иммунной и кроветворной систем. Попадание диоксина в почву, происходящее при использовании некоторых гербицидов (где он содержится в виде незначительной примеси), представляет серьезную экологическую проблему.
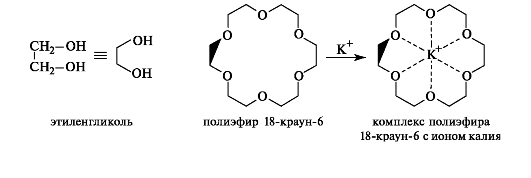
На основе этиленгликоля получают макроциклические полиэфиры, называемые краун-эфирами (от англ. crown - корона). Краунэфиры - перспективные комплексообразователи и служат своеобразными ловушками катионов. Они моделируют действие некоторых веществ (например, антибиотика пептидной природы - валиномицина, см. Приложение 15-6), облегчающих транспорт ионов через клеточные мембраны. Примером может служить полиэфир 18-краун-6, образующий прочный комплекс с ионом калия.
Образование сложных эфиров. Важное значение имеют некоторые сложные эфиры глицерина с неорганическими кислотами, в частности азотной и фосфорной. Тринитрат глицерина, или нитроглицерин, образуется при действии на глицерин азотной кислоты в присутствии серной кислоты.
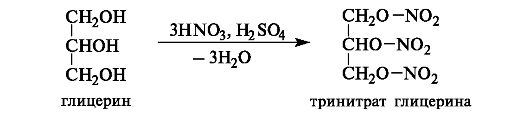
Тринитрат глицерина - взрывчатое вещество. В малых концентрациях (в виде 1% раствора в этаноле) применяется как сосудорас- ширяющее средство.
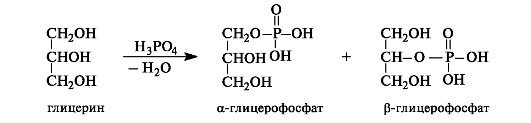
В результате действия фосфорной кислоты на глицерин образуется смесь α-глицерофосфата и β-глицерофосфата. Глицерофосфаты применяются как общеукрепляющие средства. Они являются струк- турными элементами фосфолипидов (см. 10.4.1).
Сложные эфиры глицерина и высших карбоновых кислот (жиры, масла) рассмотрены в главе 10.
Окислительно-восстановительные реакции. Реакции этого типа свойственны двухатомным фенолам с орто- и пара-положением гидроксильных групп в бензольном кольце. Среди продуктов окисления таких двухатомных фенолов особый интерес представляют хиноны.
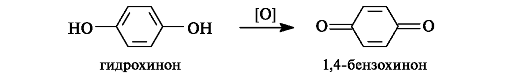
Хиноны содержат своеобразную систему сопряженных связей, называемую хиноидной группировкой, включающую две двойные связи в цикле и двойные связи двух карбонильных групп.
1,2-Бензохинон (о-бензохинон) и 1,4-бензохинон (п-бензохинон) - простейшие представители хинонов, образующиеся при окислении пирокатехина и гидрохинона соответственно. Наиболее важны 1,4-хиноны, обычно называемые просто хинонами.
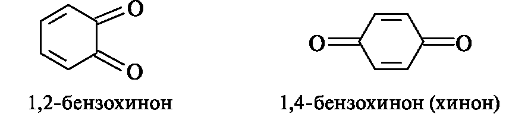
Окисление гидрохинона в хинон in vivo происходит с участием пероксида водорода под действием фермента.
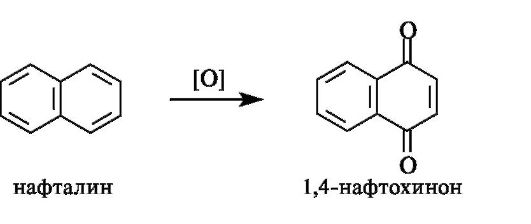
При окислении нафталина образуется 1,4-нафтохинон, являющийся структурным фрагментом витаминов группы K (см. 15.4).
Хиноны - сильные окислители. Принимая два электрона и два протона, они восстанавливаются в соответствующие гидрохиноны.
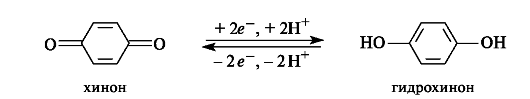
Окислительно-восстановительная система хинон-гидрохинон играет важную роль в организме. По отношению к большинству органических субстратов эта система выступает в роли окислителя.
С химической точки зрения производными 1,4-бензохинона являются убихиноны, называемые еще коферментом Q. Функционирование убихинонов в организме основано на их способности легко и обратимо превращаться в восстановленные формы (см. 15.4).
Структурный фрагмент о-хинона содержится в составе окисленной формы флавоноидов. Пирокатехиновая группировка в структуре
таких важных биологически активных веществ, как флавоноиды, обусловливает их способность к участию в окислительно-восстано- вительных реакциях в организме (см. 15.5).
8.3. Реакционная способность и специфические реакции дикарбоновых кислот
Дикарбоновые кислоты образуют два ряда функциональных производных - по одной и по двум карбоксильным группам.
Кислотные свойства. С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -/- эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
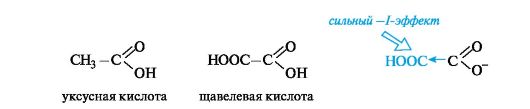
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
Декарбоксилирование. При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.
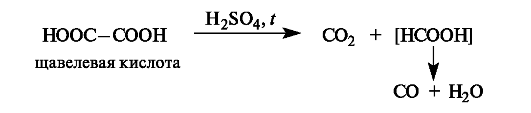
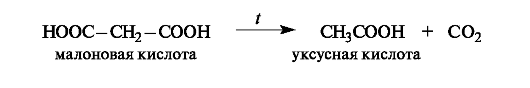
Малоновая кислота легко декарбоксилируется при нагревании выше 100 ?С.
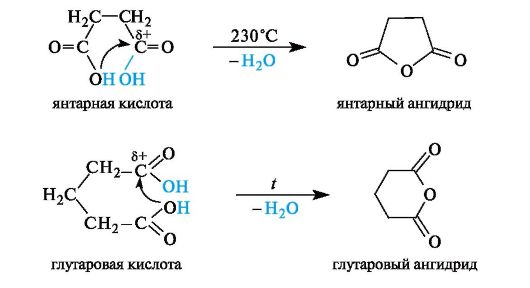
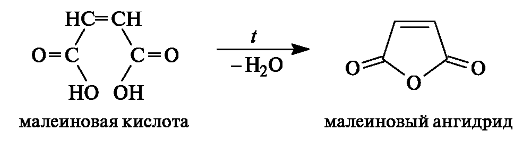
Образование циклических ангидридов. В дикарбоновых кислотах, содержащих четыре или пять атомов углерода в цепи и способных вследствие этого находиться в клешневидной конформации, происходит сближение в пространстве функциональных групп. В результате внутримолекулярной атаки одной карбоксильной группой (нук- леофилом) электрофильного центра другой карбоксильной группы происходит образование (при нагревании) устойчивого пятиили соответственно шестичленного циклического ангидрида, как показано на примерах янтарной и глутаровой кислот. Другими словами, ангидриды дикарбоновых кислот являются продуктами внутримоле- кулярной циклизации.
Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных - кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Окисление янтарной кислоты in vivo. Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД (см. Приложение 14-3). Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме - фумарат).
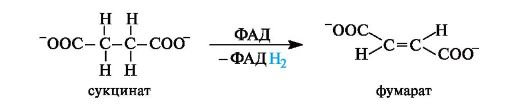
8.4. Таутомерия β-дикарбонильных соединений
Определенная протонная подвижность атома водорода у α-атома углерода в карбонильных соединениях (слабого СН-кислотного центра) проявляется в их способности к реакциям конденсации (см. 5.4). Если подвижность такого атома водорода возрастет настолько, что он сможет отщепиться в виде протона, то это приведет к образованию мезомерного иона (I), отрицательный заряд которого рассредоточен между атомами углерода и кислорода. Обратное присоединение протона к этому иону в соответствии с его граничными структурами может приводить либо к исходному карбонильному соединению, либо к енолу.
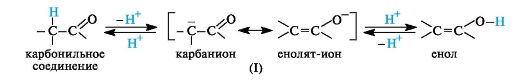
В соответствии с этим карбонильное соединение может существовать в равновесии с изомером - енольной формой. Такой вид изомерии называют таутомерией, а изомеры, находящиеся в состоянии подвижного равновесия, - таутомерами.
Таутомерия - равновесная динамическая изомерия. Ее сущность заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы и соответствующим перераспределением электронной плотности.
В рассматриваемом случае между кетонной и енольной формами осуществляется перенос протона, поэтому такое равновесие называют прототропной таутомерией, в частности, кето-енольной таутомерией.
В монокарбонильных соединениях (альдегидах, кетонах, сложных эфирах) равновесие практически полностью смещено в сторону кетонной формы. Например, содержание енольной формы в ацетоне составляет всего 0,0002%. При наличии второй электроноакцепторной группы у α-атома углерода (например, второй карбонильной группы) содержание енольной формы возрастает. Так, в 1,3-дикар- бонильном соединении ацетилацетоне (пентандионе-2,4) енольная форма преобладает.
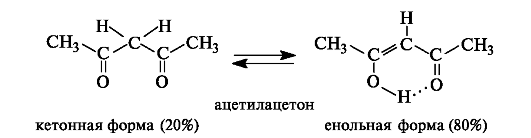
Енольная форма ацетилацетона дополнительно стабилизирована сопряженным со второй π-связью и внутримолекулярной водородной связью.
Многие реакции, включающие образование и превращения карбонильных соединений in vivo, как будет показано в дальнейшем, протекают через промежуточные енольные формы или производные этих форм.
8.5. Функциональные производные угольной кислоты
Угольная кислота занимает особое место среди соединений углерода, ее можно рассматривать как двухосновную кислоту.
Угольная кислота как индивидуальное соединение существует только в водном растворе. Попытка выделить кислоту из раствора приводит к ее разложению на диоксид углерода и воду.

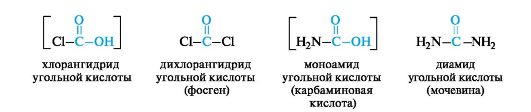
Угольная кислота и ее производные выполняют важные функции в организме, некоторые из них применяются в качестве лекарствен- ных средств. На схеме 8.1 приведены основные производные угольной кислоты.
Схема 8.1. Основные производные угольной кислоты (в скобках формулы нестабильных соединений)
Диоксид углерода (углекислый газ) - участник многих реакций карбоксилирования и декарбоксилирования in vivo и in vitro.
Карбоксилирование возможно тогда, когда в реакцию с диоксидом углерода вступают соединения с частичным отрицательным зарядом на атоме углерода. В организме взаимодействие диоксида углерода с ацетилкоферментом А приводит к образованию малонилкофермента А.

Подобно самой угольной кислоте, в свободном виде неизвестны и некоторые ее производные: монохлорангидрид С1СООН и моноамид - карбаминовая кислота H2NCOOH. Однако их сложные эфиры - вполне стабильные соединения.
Для синтеза производных угольной кислоты можно использовать фосген (дихлорангидрид) СОСl2, легко образующийся при взаимодействии монооксида углерода с хлором на свету. Фосген - чрезвычайно ядовитый газ (т. кип. 8 ?С), в Первую мировую войну его применяли в качестве боевого отравляющего вещества.
Этиловый эфир хлоромуравьиной кислоты при реакции с аммиаком образует этиловый эфир карбаминовой кислоты H2NCOOC2H5. Эфиры карбаминовой кислоты (карбаматы) имеют общее название - уретаны.
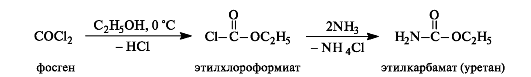
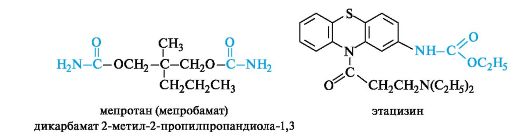
Уретаны нашли применение в медицине как лекарственные средства, в частности мепротан и этацизин.
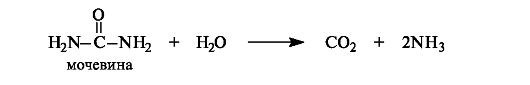
Мочевина (карбамид) (NH2)2C=0 - важнейший азотсодержащий конечный продукт обмена веществ у человека (с мочой выделяется мочевины около 20-30 г/сут).
Кислоты и щелочи при нагревании вызывают гидролиз мочевины; в организме она гидролизуется под действием ферментов.
При медленном нагревании до температуры 150-160 ?С мочевина разлагается с выделением аммиака и образованием биурета.
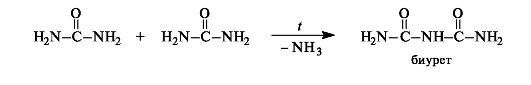
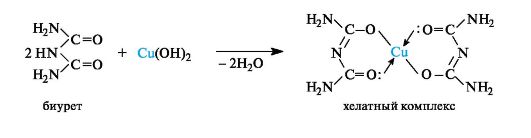
При взаимодействии биурета в щелочных растворах с ионами меди(11) наблюдается характерное фиолетовое окрашивание, обусловленное образованием хелатного комплекса (биуретовая реакция). Остаток биурета в хелатном комплексе имеет имидную структуру.
Производными карбоновых кислот, содержащими остаток мочевины в качестве заместителя, являются уреиды. Они применяются в медицине, в частности уреид α-бромоизовалериановой кислоты - бромизовал (бромурал) - используется как мягкое снотворное средство. Его эффект обусловлен сочетанием известных своим угнетающим действием на ЦНС брома и остатка изовалериановой кислоты.
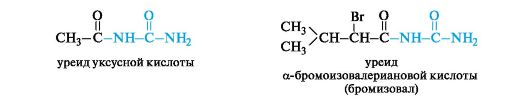
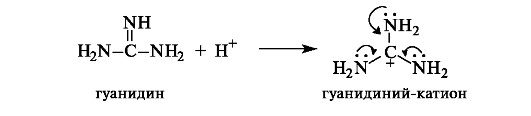
Гуанидин (иминомочевина) - азотистое производное мочевины - является сильным основанием, поскольку сопряженная кислота - ион гуанидиния - мезомерно стабилизирован.
Остаток гуанидина входит в состав α-аминокислоты - аргинина (см. схему 12.1) и нуклеинового основания - гуанина (см. 14.1).