Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 9. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
9.1. Общая характеристика
Большинство веществ, участвующих в метаболизме, являются гетерофункциональными соединениями.
Гетерофункциональными называют соединения, в молекулах которых имеются различные функциональные группы.
Характерные для биологически важных соединений сочетания функциональных групп представлены в табл. 9.1.
Таблица 9.1. Наиболее распространенные сочетания функциональных групп в биологически важных алифатических соединениях
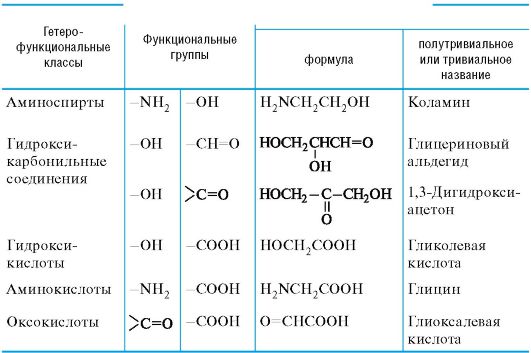
Среди гетерофункциональных соединений в природных объектах наиболее распространены аминоспирты, аминокислоты, гидроксикарбонильные соединения, а также гидрокси- и оксокислоты (табл. 9.2).
Таблица 9.2. Некоторые гидрокси- и оксокислоты и их производные
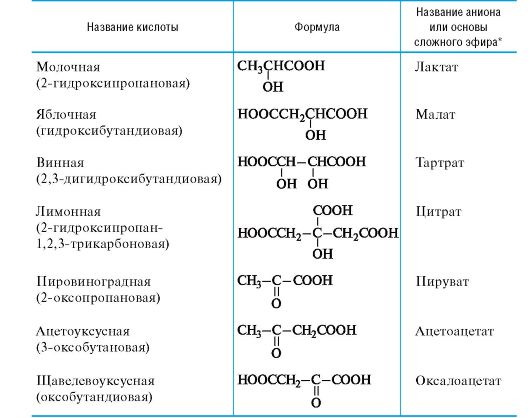
* Для ди- и трикарбоновых кислот - при участии всех карбоксильных групп. Для неполных солей и функциональных производных добавляется префикс гидр(о)-, например «гидроксалат» для аниона НООС-СОО-.
Имеющие особую биологическую важность α-аминокислоты описаны в главе 12. Полигидроксиальдегиды и полигидроксикетоны (углеводы) рассматриваются в главе 13.
В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств (см. 9.3) составляют и-аминофенол, и-аминобензойная, салициловая и сульфаниловая кислоты.
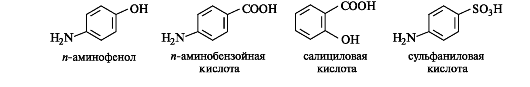
Систематические названия гетерофункциональных соединений строятся по общим правилам заместительной номенклатуры (см. 1.2.1). Однако для ряда широко распространенных кислот предпочтительны тривиальные названия (см. табл. 9.2). Их латинские названия служат основой названия анионов и производных кислот, которые часто не совпадают с русскими тривиальными названиями.
9.2. Реакционная способность
и специфические свойства биологически важных
гетерофункциональных соединений
9.2.1. Аминоспирты
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
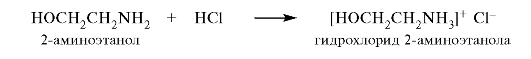
Эти две функциональные группы непрочно удерживаются у одного атома углерода, в результате чего происходит отщепление аммиака или воды. Простейшим представителем аминоспиртов является 2-аминоэтанол - соединение, в котором обе группы расположены у соседних атомов углерода. 2-Аминоэтанол (тривиальное название коламин) является структурным компонентом сложных липидов - фосфатидилэтаноламинов (см. 10.4.1).
С сильными кислотами 2-аминоэтанол образует устойчивые соли.
α-Аминоспирты способны образовывать окрашенные внутрикомплексные соединения с гидроксидом меди(11).
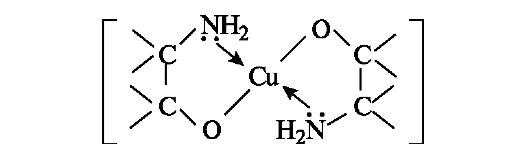
внутрикомплексное соединение меди(Н) с а-аминоспиртом
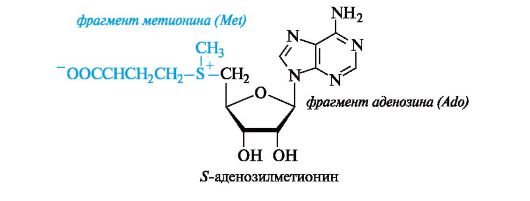
Четвертичное аммониевое основание - гидроксид (2-гидрокси- этил)триметиламмония [HOCH2CH2N+(CH3)3]OH- - имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. Его катион называют холином.
В организме холин образуется с участием кофермента S-аде- нозилметионина (SAM), являющегося переносчиком метильных групп (структурные фрагменты SAM рассмотрены ниже, см. 12.1.1 и 14.1.1). В молекуле этого кофермента метильная группа «активирована» вследствие того, что находится в составе сульфониевой группировки.
При метилировании коламина в реакции участвует атом азота, более нуклеофильный, чем атом кислорода (см. 4.3).
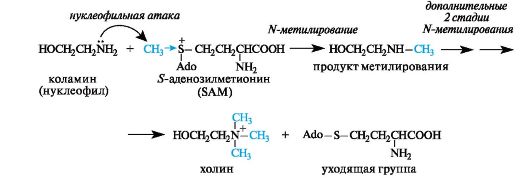
В результате окисления холина in vivo образуется диполярный ион бетаин, который также может служить источником метильных групп, входящих в состав аммониевой группировки.
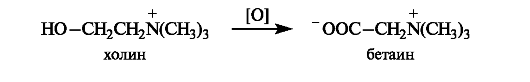
Сложноэфирные производные холина выполняют в организме различные биологические функции. Замещенные фосфаты холина являются структурной основой фосфолипидов - фосфатидилхолинов - важнейшего строительного материала клеточных мембран (см. 10.4.1). Сложный эфир холина и уксусной кислоты - ацетилхолин - наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А
(см. 6.2.4).
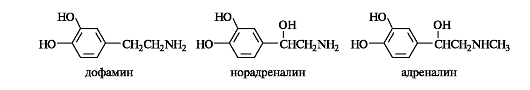
Важная роль в организме принадлежит аминоспиртам, содержащим в качестве структурного фрагмента остаток пирокатехина. Они носят общее название катехоламинов. К этой группе относятся представители образующихся в организме биогенных аминов. К катехоламинам принадлежат дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин участвует в регуляции сердечной деятельности, при физиологических стрессах он выделяется в кровь («гормон страха»).
9.2.2. Гидроксикарбонильные соединения
Гидроксикарбонильными называют соединения, содержащие в молекуле одновременно гидроксильную и альдегидную (или кетон- ную) группы.
В соответствии с этим различают гидроксиальдегиды и гидроксикетоны.
Наиболее известными представителями этих классов соединений являются глицериновый альдегид и дигидроксиацетон, играющие в виде фосфатов большую роль в биохимических процессах.
Глицериновый альдегид (глицеральдегид). Использование глицеринового альдегида в качестве конфигурационного стандарта рассмотрено выше (см. 7.1.2). d-Глицериновый альдегид образуется наряду с дигидроксиацетонфосфатом при ферментативном расщеплении d-фруктозы (в виде 1-фосфата, см. 11.1.5) и далее фосфорилируется до d-глицеральдегид-З-фосфата с помощью АТФ.
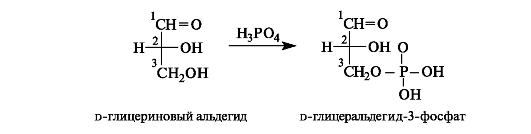
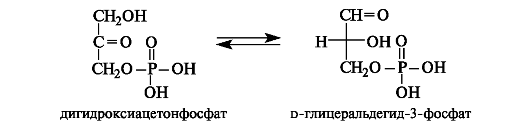
Оба фосфата, дигидроксиацетонфосфат и d-глицеральдегид-З- фосфат, образуются, кроме того, при ферментативном расщеплении 1,6-дифосфата d-фруктозы (см. 11.1.5). Важной стадией метаболизма является взаимопревращение этих монофосфатов.
Внутримолекулярная циклизация. Для гидроксикарбонильных соединений с достаточно удаленными друг от друга функциональными группами возможна внутримолекулярная циклизация. Вследствие сближения в пространстве этих групп между ними происходит взаимодействие с образованием циклических продуктов. Особенно легко внутримолекулярная циклизация протекает тогда, когда она приводит к термодинамически устойчивым пяти- и шестичленным циклам. Например, в γ- и δ-гидроксиальдегидах и гидроксикетонах возможно внутримолекулярное взаимодействие гидроксильной и карбонильной групп. В результате этого доля циклического полуацеталя в его равновесной смеси с 5-гидрокси- пентаналем составляет 94%.
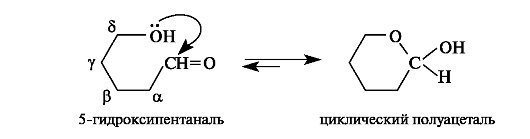
Образованием циклических полуацеталей объясняется таутомерия углеводов (см. 11.1.2).
9.2.3. Гидрокси- и аминокислоты
Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу.
В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
Кислотно-основные свойства. В гетерофункциональных соединениях в зависимости от природы функциональных групп и их местоположения в молекуле возможно усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Например, кислотность гидроксикислот выше, чем незамещенных кислот. Аминокислоты, содержащие одновременно кислотные и основные фунциональные группы, проявляют амфотерные свойства, т. е. способность взаимодействовать как с кислотами, так и с основаниями. В нейтральных водных растворах или кристаллическом состоянии аминокислоты существуют преимущественно в форме внутренних солей (диполярных ионов), как показано на примере γ-аминомасляной кислоты.

α-Гидрокси- и α-аминокислоты. У α-гидроксикислот и α-аминокислот функциональные группы близки, но внутримолекулярного взаимодействия между ними не происходит из-за неустойчивости трехчленных циклов, которые могли бы при этом образоваться. При нагревании α-гидрокси- и α-аминокислоты претерпевают межмоле- кулярную циклизацию с образованием продуктов, называемых соответственно лактидами и дикетопиперазинами (последнее - от названия шестичленного гетероцикла с двумя атомами азота - пиразина).
Лактиды содержат две сложноэфирные группы, дикетопиперазины - две амидные группы.
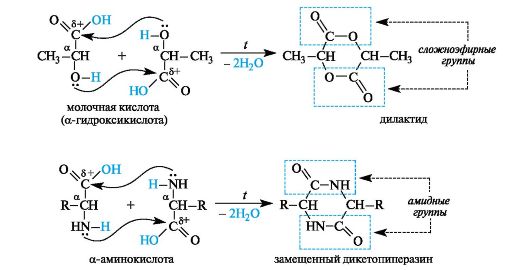
Лактиды и дикетопиперазины, являясь сложными эфирами или амидами соответственно, в условиях кислотного или основного ката- лиза способны гидролизоваться с образованием исходных α-гидрокси- или α-аминокислот.
Особое свойство α-гидроксикислот заключается в их способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.
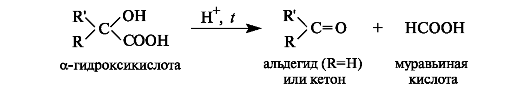
Молочная кислота известна как продукт молочнокислого брожения лактозы, содержащейся в молоке, и других углеводов, входящих в состав овощей и плодов.
В организме L-(+)-молочная кислота является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мыш- цах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты - недостаток
кислорода, что вызывает восстановление пировиноградной кислоты с участием НАДН в молочную.
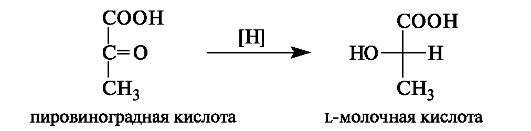
Во время отдыха запасы кислорода возобновляются, и молочная кислота окисляется снова в пировиноградную кислоту.
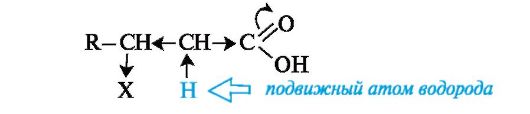
β-Гидрокси- и β-аминокислоты. Характерное общее свойство этих гетерофункциональных кислот заключается в способности к элиминированию молекулы воды или соответственно аммиака с образованием α,β-ненасыщенных кислот.
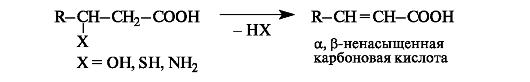
Реакции элиминирования протекают в мягких условиях. Это объясняется высокой протонной подвижностью α-атома водорода, обусловленной электронным влиянием двух электроноакцепторных
групп (Х и СООН).
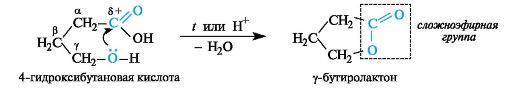
γ-Гидрокси- и γ-аминокислоты. Эти кислоты, как и кислоты с δ-расположением функциональных групп, при нагревании претерпевают внутримолекулярную циклизацию. Из гидроксикислот при этом образуются циклические сложные эфиры - лактоны, из аминокислот - циклические амиды - лактамы. Лактоны легко образуются уже при незначительном нагревании, а также в кислой среде.
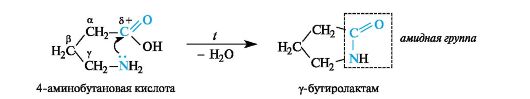
Принципиально так же происходит внутримолекулярное взаимодействие амино- и карбоксильной групп в γ- и δ-аминокислотах.
Лактоны и лактамы, будучи соответственно сложными эфирами и амидами, гидролизуются в кислой или щелочной среде.
4-Гидроксимасляная кислота (традиционно называемая γ-гидроксимасляной кислотой, ГОМК) применяется в виде натриевой соли как снотворное средство, а также в анестезиологии.
4-Aминомасляная кислота (ГАМК - сокращение от γ-аминомасляной кислоты) принимает участие в обменных процессах, происходящих в головном мозге, является нейромедиатором. В медицинской практике под названием гаммалон, или аминалон, применяется в качестве ноотропного средства.
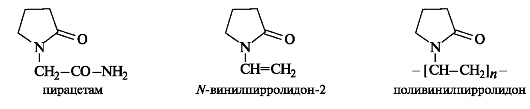
Важное значение для медицины имеют производные «циклической формы ГАМК» - ее лактама (γ-бутиролактам, или пирроли- дон-2). Производное пирролидона-2 под названием пирацетам (или ноотропил) рассматривается как первый представитель ноотропных средств.
Полимер N-винилпирролидона-2 - поливинилпирролидон в виде водного раствора применяется в качестве заменителя синовиальной жидкости.
Многоосновные гидроксикислоты. Рассматриваемые в этом разделе яблочная, лимонная, изолимонная кислоты, а также щавелевоуксусная (см. 9.2.4) и рассмотренные ранее янтарная и фумаровая (см. 8.1.2) кислоты являются участниками цикла трикарбоновых кислот, называемого также циклом лимонной кислоты, или циклом Кребса. Это универсальный этап окислительного катаболизма углеводов и других соединений в присутствии кислорода.
Происходящие в организме превращения этих кислот являются по своей химической сути реакциями окисления или восстановления. Для каждой из этих кислот реакции катализируются специфическими
ферментами с использованием коферментов. Для окислительно-восстановительных процессов наиболее характерно участие коферментов никотинамидной природы, строение и свойства которых детально рассмотрены далее (см. 14.3.2). В нижеприводимом изложении используются только их сокращенные наименования НАД+ и НАДН. Следует учитывать, что с участием НАД+ осуществляются окислительные процессы, а с участием НАДН - восстановительные.
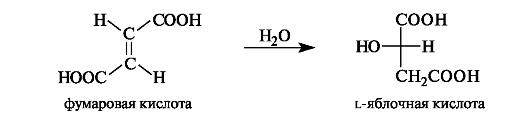
Яблочная кислота в значительных количествах содержится в незрелых яблоках, рябине, фруктовых соках. В организме l-яблочная кислота образуется путем гидратации фумаровой кислоты.
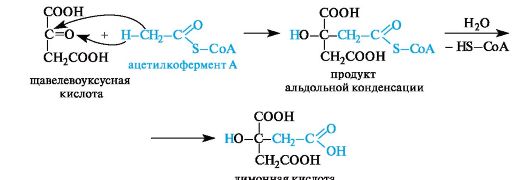
Лимонная кислота содержится в плодах цитрусовых (лимоны, апельсины), винограде, крыжовнике, а также в листьях табака.
Биосинтез лимонной кислоты происходит по типу альдольной конденсации из щавелевоуксусной кислоты и ацетилкофермента А
(см. 8.3.2).
При последующей дегидратации лимонной кислоты как β-гидроксикарбоновой кислоты получается цис-аконитовая кислота, которая далее гидратируется с образованием изолимонной кислоты.
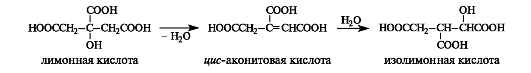
Винные кислоты - представители дигидроксидикарбоновых кислот, содержат два асимметрических атома углерода и поэтому должны были бы существовать в виде четырех стереоизомеров, но в действительности известны три стереоизомера (см. 7.1.3).
D-(+)-Bинная кислота, или обыкновенная винная кислота, известна под названием виннокаменной кислоты. Она содержится в ви- нограде, рябине. Кислая калиевая соль трудно растворима в воде. Она осаждается в винных бочках в виде так называемого винного камня. При нейтрализации этой соли гидроксидом натрия образуется смешанная калиево-натриевая соль. Действием на нее гидроксида меди(II) в щелочной среде получают жидкость Фелинга - реактив для обнаружения альдегидной группы (см. 11.1.5).
L-(-)-Винная кислота в очень небольшом количестве содержится в виноградных винах.
Мезовинная кислота (см. 7.1.3) в природе не встречается; она частично образуется при длительном нагревании в щелочном растворе любого из ее стереоизомеров.
Виноградная кислота (т. пл. 205 ?С) представляет собой рацемат d- и l-винных кислот, оптической активностью не обладает и отличается по физическим свойствам от индивидуальных энантиомеров.
9.2.4. Оксокислоты
Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы.
В соответствии с этим различают альдегидокислоты и кетонокислоты.
Простейшей альдегидокислотой является глиоксалевая (глиоксиловая) кислота, которая обычно существует в виде гидрата (НО)2СНСООН. Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается.
Важную роль в биохимических процессах играют кетонокислоты - пировиноградная, ацетоуксусная и щавелевоуксусная (см. табл. 9.2).
Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов. Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты.
Пировиноградная кислота декарбоксилируется при нагревании с разбавленной и декарбонилируется (отщепляет СО) - с концент- рированной серной кислотой.

При ферментативном декарбоксилировании пировиноградной кислоты получается ацетальдегид, связанный с коферментом («активный ацетальдегид»). Он может окисляться в присутствии кофермента А в ацетилкофермент А.
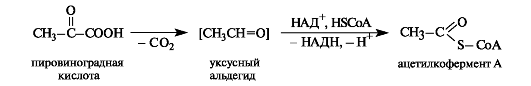
Производным пировиноградной кислоты является фосфоенолпировиноградная кислота (фосфат енольной формы кислоты). В организме анион этой кислоты - фосфоенолпируват - образуется в процессе гликолиза и служит предшественником пирувата.

Щавелевоуксусная кислота одновременно является α- и β-оксокислотой. Она образуется при окислении яблочной кислоты.
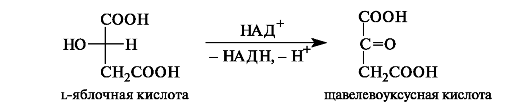
Далее щавелевоуксусная кислота при конденсации с ацетилкоферментом А превращается в лимонную кислоту (см. 9.2.3).
Ацетоуксусная кислота - представитель β-оксокислот. В свободном состоянии представляет сиропообразную жидкость, медленно выделяющую диоксид углерода.
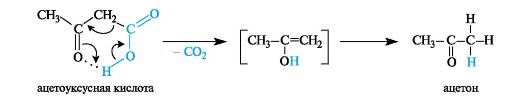
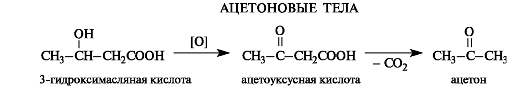
Как продукт окисления 3-гидроксимасляной кислоты наряду с продуктами ее превращений накапливается в организме больных сахарным диабетом (так называемые ацетоновые, или кетоновые тела, см. Приложение 10-2).
Большое теоретическое значение в связи с вопросами таутомерии и двойственной реакционной способности имеет этиловый эфир ацетоуксусной кислоты, называемый просто ацетоуксусным эфиром.
Ацетоуксусный эфир - жидкость с приятным фруктовым запахом. Впервые синтезирован более 100 лет назад, его строение долгое время было предметом острых дискуссий. Основная трудность заключалась в том, что в результате его химических превращений получались два ряда производных - ацетоуксусной и 3-гидроксикротоновой кислот, т. е. ацетоуксусный эфир проявлял двойственную реакционную способность.
Исследования показали, что ацетоуксусный эфир представляет собой смесь двух изомеров - кетона (92,5%) и енола (7,5 %), находящихся в таутомерном равновесии. Это еще один пример кето-енольной таутомерии, описанной ранее на примере ацетилацетона (см. 8.4).
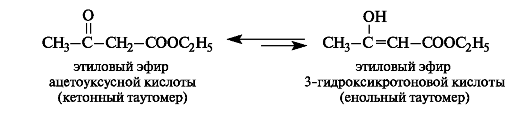
При действии на ацетоуксусный эфир какого-либо реагента в реакцию вступает один из таутомеров. Поскольку второй таутомер в результате равновесия восполняет убыль реагирующего таутомера, таутомерная смесь реагирует в данном направлении как одно целое.
9.3. Гетерофункциональные производные бензола как лекарственные средства
Неразрывная связь химии и медицины отчетливо проявляется в области создания и использования лекарственных средств. Еще в XVI в. основатель ятрохимии Парацельс утверждал, что «настоящая цель химии заключается не в изготовлении золота, а в приготовлении лекарств». С давних времен эмпирическим путем происходил отбор биологически активных органических соединений, и появление ряда лекарственных средств часто было обязано случаю. В настоящее время все синтезируемые соединения должны проходить испытания на биологическую активность (биологический скрининг). Это важно для выявления общих закономерностей взаимосвязи структуры соединений с их биологической активностью. Проблема «струк- тура-свойство» служит фундаментом целенаправленного создания эффективных лекарственных средств.
В последние десятилетия появилось множество новых лекарственных средств. Однако большое значение сохраняют некоторые группы известных ранее лекарственных средств, в частности с бензольным ядром в качестве структурной основы.
Сам бензол может быть причиной острых и хронических отравлений. Он оказывает раздражающее действие на кожу, его пары в большой концентрации вызывают возбуждение, расстройство дыхания.
Монофункциональные производные бензола в большинстве случаев также обладают выраженными токсическими свойствами. Фенол, анилин, галогенопроизводные ароматического ряда служат исходными или промежуточными продуктами крупнотоннажной химической промышленности. В связи с этим необходимо учитывать их токсическое действие.
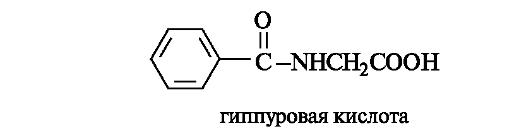
Бензойная кислота. Применяется в виде натриевой соли как отхаркивающее средство. В свободном виде бензойная кислота встречается в некоторых смолах и бальзамах, а также в клюкве, бруснике, но чаще
содержится в связанном виде, например в виде N-бензоильного производного аминоуксусной кислоты, называемого гиппуровой кислотой. Эта кислота образуется в печени из бензойной и аминоуксусной (глицин) кислот и выводится с мочой. В клинической практике по количеству гиппуровой кислоты в моче больных (после приема бензоата натрия) судят об эффективности обезвреживающей функции печени.
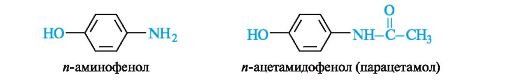
и-Аминофенол и его производные. Как гетерофункциональное соединение п-аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное - парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.
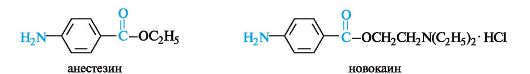
и-Аминобензойная кислота (ПАБК) и ее производные. Эфиры ароматических аминокислот способны в той или иной степени вызывать местную анестезию. Особенно заметно это свойство у пара-производных. В медицине используют анестезин (этиловый эфир ПАБК) и новокаин (2-диэтиламиноэтиловый эфир ПАБК). Новокаин при- меняют в виде соли (гидрохлорида), что связано с необходимостью повышения его растворимости в воде.
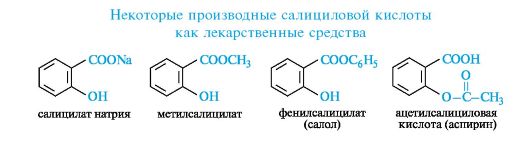
Салициловая кислота и ее производные. Салициловая кислота (см. 8.1) относится к группе фенолокислот. Как соединение с орто- расположением функциональных групп она декарбоксилируется при нагревании с образованием фенола.
Салициловая кислота умеренно растворима в воде, дает интенсивное окрашивание с хлоридом железа(Ш), на чем основано качественное обнаружение фенольной гидроксильной группы. Салициловая кислота проявляет антиревматическое, жаропонижающее и антигрибковое действие, но как сильная кислота (рKа 3,0) вызывает раздражение желудочно-кишечного тракта и поэтому применяется только наружно. Внутрь применяют ее производные - соли или эфиры.
Салициловая кислота способна образовывать производные по каждой функциональной группе. Практическое значение имеют салицилат натрия, сложные эфиры по карбоксильной группе - метилсалицилат, фенилсалицилат (салол), а также по гидроксильной группе - ацетилсалициловая кислота (аспирин).
Перечисленные производные (кроме салола) оказывают анальгетическое, жаропонижающее и противовоспалительное действие. Метилсалицилат из-за раздражающего действия используется наружно в составе мазей. Салол применяется как дезинфицирующее средство при кишечных заболеваниях и примечателен тем, что в кислой среде желудка не гидролизуется, а распадается только в кишечнике. В связи с этим салол используют также в качестве материала для защитных оболочек некоторых лекарственных средств, нестабильных в кислой среде желудка.
Салициловая кислота впервые была получена путем окисления салицилового альдегида, содержащегося в растении таволге (род Spireae). Отсюда и ее первоначальное название - спировая кислота, с которым связано название аспирин (начальная буква «а» обозначает ацетил). Ацетилсалициловая кислота в природе не найдена.
Из других производных салициловой кислоты большое значение имеет и-аминосалициловая кислота (ПАСК) как противотуберкулезное средство. ПАСК является антагонистом п-аминобензойной
кислоты, необходимой для нормальной жизнедеятельности микроорганизмов.

Сульфаниловая кислота и ее производные. Сульфаниловая (п-аминобензолсульфоновая) кислота существует в виде диполярного иона.
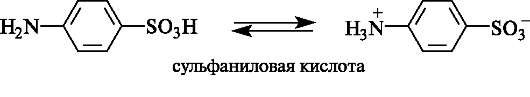
Амид сульфаниловой кислоты (сульфаниламид), известный как стрептоцид, является родоначальником группы лекарственных средств, обладающих антибактериальной активностью и называемых сульфаниламидами.
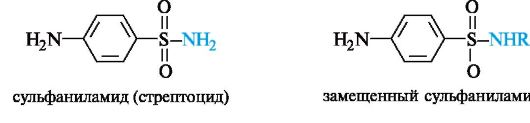
Все сульфаниламиды содержат сульфонамидную группу -SO2NH2. Замена ее другими группами приводит к потере антибактериальной активности. Установлено, что аминогруппа в пара-положении должна оставаться незамещенной, а в бензольное кольцо нельзя вводить дополнительные заместители, так как они снижают антибактериальную активность соединения.
В поиске эффективных антибактериальных средств было синтезировано более 10 тыс. производных сульфаниламида. Однако лишь несколько десятков из них нашли практическое применение. Наибольшую активность проявляют те производные, у которых радикал R имеет гетероциклическую природу.