Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 13. БИОЛОГИЧЕСКИ ВАЖНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
13.1. Общая характеристика 13.1.1. Классификация
Гетероциклическими называют циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов).
Гетероциклические соединения очень разнообразны. Их классифицируют согласно следующим структурным признакам:
• природа гетероатома;
• число гетероатомов;
• размер цикла;
• степень насыщенности.
В зависимости от природы гетероатома различают, в частности, азот-, кислород-, серосодержащие гетероциклические соединения. Гетероциклы с этими гетероатомами наиболее важны в связи с их биологической ролью.
По числу гетероатомов гетероциклические соединения подразделяют на гетероциклы с одним, двумя и т. д. гетероатомами. При этом гетероатомы могут быть как одинаковыми, так и разными.
Размер цикла может быть различным, начиная с трехчленного. Наибольшее распространение в природе имеют пяти- и шестичленные циклы, содержащие в качестве гетероатомов азот, кислород, серу. В таких соединениях валентные углы между атомами в цикле существенно не отличаются от обычных валентных углов sp3- или sр2-гибридизованного атома углерода. Причина этого заключается в одинаковой гибридизации атомов С, N, О, S и сравнительно небольших размерах указанных атомов, близких по размеру к группе СН2, поэтому замена группировки -СН2- или -СН= в цикле на такой гетероатом практически не изменяет геометрию молекулы.
Гетероциклы могут быть ароматическими, насыщенными и ненасыщенными.
Ароматические гетероциклы - самые распространенные в природе, поэтому им уделено основное внимание в данной главе. Наиболее важные гетероциклы, составляющие основу многих природных биологически активных веществ и лекарственных средств, приведены на схеме 13.1.
Насыщенные гетероциклы, например приведенные ниже, представляют собой циклические простые эфиры (см. 8.2) или вторичные амины с циклическим скелетом.
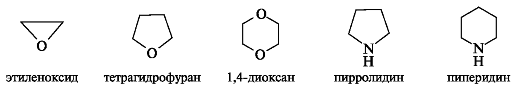
Ненасыщенные гетероциклы (кроме ароматических) часто неустойчивы и встречаются, как правило, в виде производных. Кислородсодержащий гетероцикл α-пиран вообще не известен, так как термодинамически неустойчив.
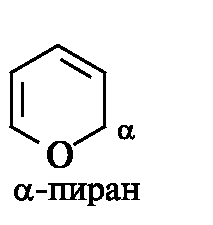
Схема 13.1. Ароматические гетероциклические соединения

13.1.2. Номенклатура
Названия ароматических гетероциклов, как правило, тривиальные, и они приняты номенклатурой ИЮПАК (см. схему 13.1).
В моноциклических соединениях нумерация атомов всегда начинается от гетероатома (примеры нумерации приведены выше). В гетероциклах с несколькими одинаковыми гетероатомами эти атомы получают наименьшие номера. Если имеются два атома азота с различным электронным строением (-N= и -NH-), то нумерацию ведут от фрагмента -NH-, как показано на примерах пиразола и имидазола. В гетероциклах с разными гетероатомами старшим считается кислород, далее сера и затем азот.
В конденсированных гетероциклах нумерацию ведут от одной из вершин бициклической структуры так, чтобы гетероатом полу- чил наименьший номер (см. примеры хинолина и изохинолина). Однако имеются исключения из этого правила, как, например, пурин (см. схему 13.1), для которого сохранена исторически сложившаяся нумерация.
Производные гетероциклов называют по общим правилам заместительной номенклатуры (см. 1.2.1), где в качестве названий родоначальных структур приняты тривиальные названия гетероциклов. В приведенных примерах в скобках указаны также тривиальные названия некоторых производных.
13.2. Реакционная способность ароматических гетероциклов
13.2.1. Ароматические свойства
Пиридин по электронному строению напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации, и все σ-связи (C-C, C-N и C-H) лежат в одной плоскости (рис. 13.1, а). Из трех гибридных орбиталей атома азота две участвуют в образовании
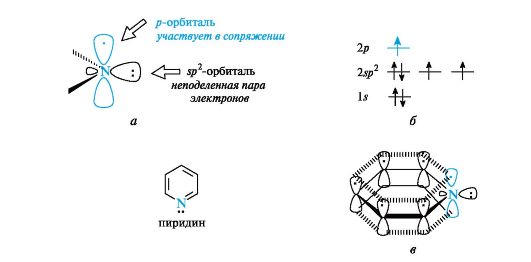
Рис. 13.1. Пиридиновый атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиридина (в) (связи С-Н для упрощения рисунка опущены)
σ-связей с атомами углерода (показаны только оси этих орбиталей), а третья орбиталь содержит неподеленную пару электронов и в образовании связи не участвует. Атом азота с такой электронной конфигурацией называют пиридиновым.
За счет электрона, находящегося на негибридизованной р-орбитали (см. рис. 13.1, б), атом азота участвует в образовании единого электронного облака ср-электронами пяти атомов углерода (см. рис. 13.1, в). Таким образом, пиридин является π,π-сопряженной системой и удовлетворяет критериям ароматичности (см. 2.3.2).
В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца, поэтому системы с пиридино-
вым атомом азота называют π-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота.
Пиррол также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sp2-гибридизации. Однако в отличие от пиридина атом азота в пирроле имеет иную электронную конфигурацию (рис. 13.2, а, б).
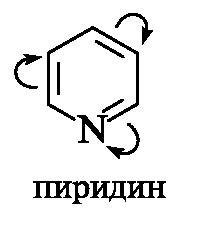
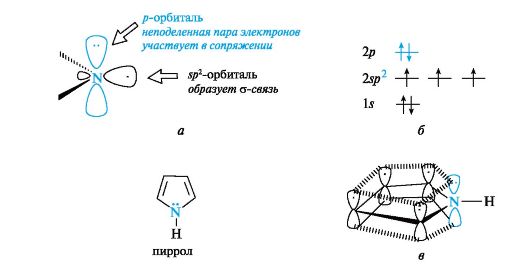
Рис. 13.2. Пиррольный атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиррола (в) (связи С-Н для упрощения рисунка опущены)
На негибридизованной р-орбитали атома азота находится неподеленная пара электронов. Она участвует в сопряжении с р-электрона- ми четырех атомов углерода с образованием единого шестиэлектронного облака (см. рис. 13.2, в). Три sp2-гибридные орбитали образуют три σ-связи - две с атомами углерода, одну с атомом водорода. Атом азота в таком электронном состоянии получил название пиррольного.
Шестиэлектронное облако в пирроле благодаря р,п-сопряжению делокализовано на пяти атомах цикла, поэтому пиррол представляет собой π-избыточную систему.
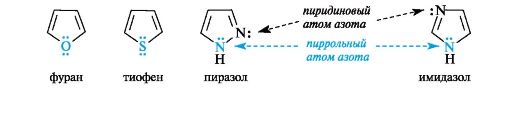
В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной p-АО кислорода или серы соответственно. В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару и-электронов, а пиридиновый - один p-электрон.
Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.
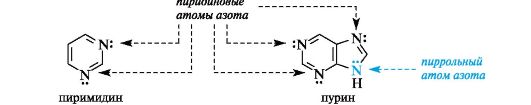
Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N-9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2).
Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
13.2.2. Кислотно-основные и нуклеофильные свойства
Основные свойства гетероциклических соединений обусловлены неподеленной парой электронов гетероатома, способной присоединять протон. Такими свойствами обладает пиридиновый атом азота, у которого n-электроны находятся на sp2-гибридной орбитали и не вступают в сопряжение. Пиридин является основанием и с сильными кислотами образует пиридиниевые соли, подобные аммониевым солям.

Аналогично основные свойства проявляют и другие гетероциклы, содержащие пиридиновый атом азота. Так, имидазол и пиразол образуют соли с минеральными кислотами за счет пиридинового атома азота.
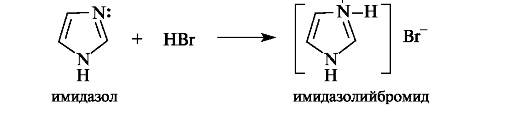
Пиррольный атом азота в молекулах имидазола, пиразола и, естественно, самого пиррола не склонен связывать протон, так как его неподеленная пара электронов является частью ароматического секстета. В результате пиррол практически лишен основных свойств.
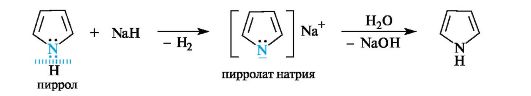
В то же время пиррольный атом азота может служить центром кислотности. Пиррол ведет себя, как слабая NH-кислота, поэтому протон будет отщепляться только при действии очень сильных оснований, например амида натрия NaNH2 или гидрида натрия NaH. За счет пиррольного атома азота в реакциях со щелочными металлами также образуются соли, которые легко гидролизуются.
Таким образом, имидазол и пиразол могут проявлять как основные, так и кислотные свойства, т. е. являются амфотерными соединениями.

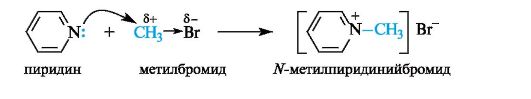
Гетероциклы, содержащие пиридиновый атом азота, проявляют и нуклеофильные свойства, т. е. способность атаковать атом углерода, несущий частичный положительный заряд (электрофильный центр). Так, взаимодействие пиридина с галогеноалканами приводит к образованию алкилпиридиниевых солей.
13.2.3. Особенности реакций электрофильного замещения
Пиррол и фуран относятся к π-избыточным системам. У них легче протекают реакции электрофильного замещения по сравнению с бензолом. Следует, однако, учитывать, что сильные кислоты, часто при- меняемые при электрофильном замещении, атакуют атомы углерода
π-избыточных гетероциклов, что приводит к образованию смесей полимерных продуктов, не имеющих практического применения. Способность гетероциклических соединений подвергаться глубоким превращениям под действием кислот называют ацидофобностью (боязнью кислот), а сами гетероциклы - ацидофобными.
Пиридин и другие гетероциклы с пиридиновым атомом азота являются электронодефицитными. Они гораздо труднее, чем бензол, вступают в реакции электрофильного замещения, а некоторые реакции (например, алкилирование по атомам углерода кольца) не идут вовсе. Низкая реакционная способность пиридина обусловлена еще и тем, что в сильнокислых средах, в которых осуществляется электрофильное замещение, пиридин находится в протонированной форме в виде катиона пиридиния C5H5NH+, что существенно затрудняет электрофильную атаку.
13.3. Пятичленные гетероциклы
13.3.1. Гетероциклы с одним гетероатомом
Важнейшим
представителем пятичленных гетероциклов с одним гетероатомом является
пиррол. Видимо, неслучайно сам пиррол был первым гетероциклическим
соединением, выделенным из природных источников еще в
Индол. По химическим свойствам эта ароматическая система очень напоминает пиррол. Индол также ацидофобен и практически лишен основных свойств. При взаимодействии с сильными основаниями ведет себя, как слабая NH-кислота.
Индол является структурным фрагментом белковой аминокислоты триптофана и продуктов его метаболических превращений - триптамина и серотонина, относящихся к биогенным аминам, а также (индол-3-ил)уксусной кислоты (гетероауксина).
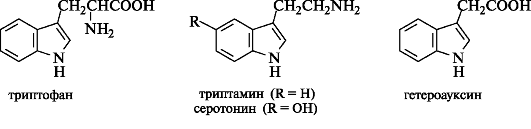
Гетероауксин в растительном мире является гормоном роста и применяется в сельском хозяйстве для стимуляции роста растений.
Немало синтетических производных индола применяется в медицине. Примером таких соединений может служить антидепрессант индопан.
Фуран. Соединения фуранового ряда не обнаружены в продуктах метаболизма животных организмов, но они встречаются в растительном мире. Известны многие лекарственные средства, содержащие фурановое ядро, часто в комбинации с другими гетероциклами. Примерами служат противомикробные препараты фурацилин и фуразолидон.
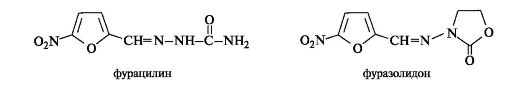
13.3.2. Гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами, один из которых азот, имеют общее название азолы. Важнейшими из них являются имидазол, пиразол и тиазол (см. схему 13.1). Эти соединения, в отличие от пятичленных гетероциклов с одним гетероатомом, не разрушаются при действии кислот (т. е. неацидофобны), а образуют с ними соли (см. 13.2.1).
Имидазол. Этот гетероцикл является структурным фрагментом белковой аминокислоты гистидина и продукта ее декарбоксилирования - биогенного амина гистамина.
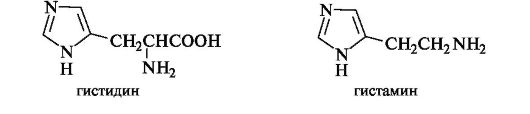
Имидазол, конденсированный с бензольным кольцом - бензимидазол - входит в состав ряда природных веществ, в частности витамина В12, а также вазодилатирующего средства дибазола (2-бен- зилбензимидазола).
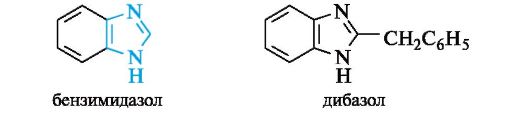
Пиразол. Производные пиразола в природе не обнаружены. Наиболее известным производным пиразола является пиразолон, одна из изомерных форм которого приведена ниже. На основе пиразолона созданы анальгетические средства - анальгин, бутадион и др.
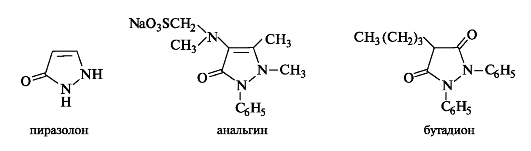
Тиазол. В цикле тиазола содержатся два разных гетероатома. Структура тиазола встречается в составе важных биологически активных веществ - тиамина (витамина В1) и ряде сульфаниламидных препаратов, например, противомикробного средства фталазола.
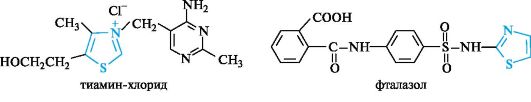
Цикл полностью гидрированного тиазола - тиазолидин - является структурным фрагментом пенициллиновых антибиотиков (см. 15.6).
13.4. Шестичленные гетероциклы
13.4.1. Гетероциклы с одним гетероатомом
Пиридин. Этот наиболее типичный представитель ароматических гетероциклов проявляет большинство химических свойств ароматических соединений: легче вступает в реакции замещения, чем присоединения; его атомы углерода устойчивы к действию окислителей. Он термодинамически устойчив.
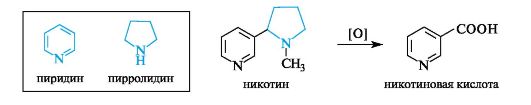
В то же время гомологи пиридина (аналогично гомологам бензола) легко окисляются в соответствующие пиридинкарбоновые кислоты. Важное значение имеет окисление изомерных метилпиридинов. Так, 3-метилпиридин превращается в никотиновую кислоту, а его 4-изо- мер - в изоникотиновую (пиридин-4-карбоновую) кислоту.
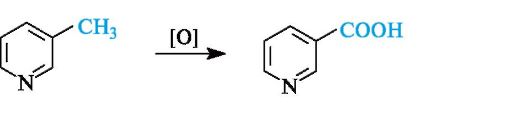
Кстати, никотиновая кислота получила свое название оттого, что была получена при окислении никотина (см. 13.6.1).
Как уже говорилось (см. 13.2.2), пиридин проявляет основные свойства; его основность несколько выше, чем ароматических аминов (например, анилина), но значительно ниже, чем алифатических аминов. Это
связано с тем, что неподеленная пара электронов атома азота занимает sp2-гибридную орбиталь. Атом азота в пиридине более электроотрицателен, чем sp3-гибридизованный атом азота в алифатических аминах, и, следовательно, прочнее удерживает свою электронную пару.
Благодаря пониженной электронной плотности на атомах углерода кольца пиридин может вступать в не характерные для бензола реакции с нуклеофильными реагентами. Наиболее восприимчиво к нуклеофильной атаке кольцо алкилпиридиниевого иона, где электронная плотность на атомах углерода особенно понижена. Так, алкилпиридиниевые соли способны восстанавливаться комплексными гидридами металлов в частично насыщенное производное пиридина, как упрощенно показано ниже.
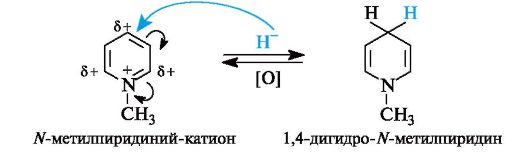
В 1,4-дигидро-N-метилпиридине ароматичность нарушена, поэтому его молекула обладает большим запасом энергии и стремится путем обратной реакции окисления вновь перейти в ароматическое состояние. Эти реакции окисления-восстановления моделируют действие важного кофермента НАД+, в состав которого входит замещенный катион пиридиния (см. 14.3.2).
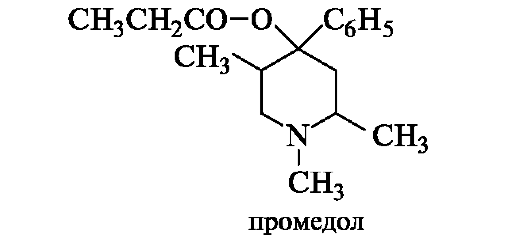
Структура полностью насыщенного пиридина - пиперидина - лежит в основе анальгетика промедола.
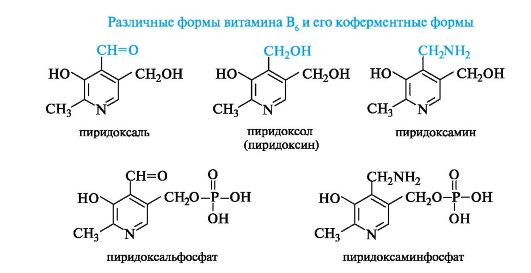
Важными производными пиридина являются некоторые витамины группы В, выступающие в роли структурных элементов кофер- ментов. Ниже приведены различные формы витамина В6, участвующие в виде фосфатов в реакции биосинтеза α-аминокислот (см. Приложение 12-4).
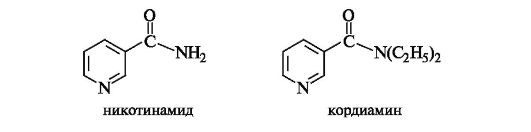
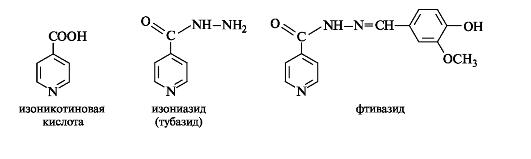
Никотиновая и изоникотиновая кислоты и их производные. Никотиновая кислота и ее амид - никотинамид - известны как две формы витамина РР. Никотинамид является составной частью ферментных систем, ответственных за окислительно-восстановительные процессы в организме, а диэтиламид никотиновой кислоты - кордиамин - служит эффективным стимулятором ЦНС.
На основе изоникотиновой кислоты синтезированы противотуберкулезные средства изониазид (тубазид) - гидразид этой кислоты и его производное фтивазид.
Хинолин и изохинолин. Эти конденсированные системы (см. схему 13.1) по свойствам подобны пиридину: проявляют основные свойства, способны образовывать четвертичные соли.
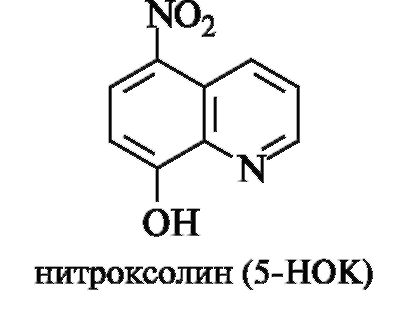
Ядро хинолина входит в состав противомикробного средства нитроксолина (5-НОК).
13.4.2. Гетероциклы с двумя гетероатомами
В этой группе наиболее важными являются гетероциклы, содержащие два атома азота. Они имеют общее название диазины и различаются взаимным расположением атомов азота.
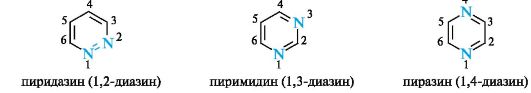
Эти гетероциклы содержат атомы азота пиридинового типа, поэтому каждый из диазинов представляет собой шестиэлектронную ароматическую систему. Введение второго атома азота в шестичленное кольцо еще больше понижает активность гетероциклического ядра (по сравнению с пиридином) в реакциях электрофильного замещения.
Основность диазинов значительно (на 3-4 порядка) ниже, чем пиридина, поскольку один атом азота выступает в роли электроноакцептора по отношению к другому. Диазины образуют соли только с одним эквивалентом сильной кислоты.
Среди производных диазинов, имеющих биологическое значение и применяемых в медицине, наиболее важны гидрокси- и аминопроизводные пиримидина.
Для 2-гидроксипроизводных гетероциклов, содержащих фрагмент -N=C-OH, типична лактим-лактамная таутомерия как частный случай прототропной таутомерии (см. 9.2.3). Взаимопревращение тауто- мерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную группу ОН, к основному центру - пиридиновому атому азота и обратно. В полярных растворителях и в кристаллическом состоянии лактамные формы явно преобладают, что связано с большим сродством к протону атома азота, нежели атома кислорода.
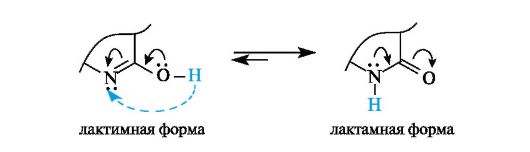
Три пиримидиновых основания - урацил (2,4-дигидроксипи- римидин), тимин (2,4-дигидрокси-5-метилпиримидин) и цитозин (4-амино-2-гидроксипиримидин) - являются компонентами нуклеотидов и нуклеиновых кислот. Пиримидиновые основания существуют практически только в лактамной форме (лактамный фрагмент выделен цветной рамкой, лактимный - черной).
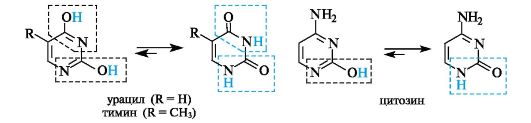
Очевидно, что в лактимной форме, т. е. гидроксиформе, пиримидиновое ядро ароматично. Однако и в лактамной форме ароматичность не нарушена, так как ароматическая система образована в результате участия в сопряжении неподеленной пары электронов «амидного» атома азота. Разрыв сопряжения в кольце отсутствует.
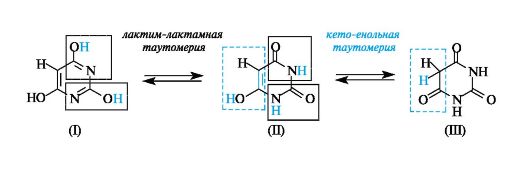
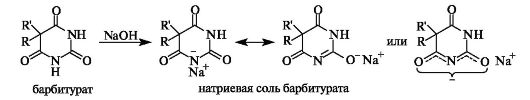
К производным пиримидина относится барбитуровая кислота (2,4,6-тригидроксипиримидин), которая может существовать в несколь- ких таутомерных формах, три из которых приведены ниже. Структуры (I) и (II) представляют соответственно лактимный и лактамный таутомеры, а структуры (II) и (III) - енольный и кетонный таутомеры. В кристаллическом состоянии барбитуровая кислота имеет строение триоксопроизводного (III), которое преобладает и в растворе.
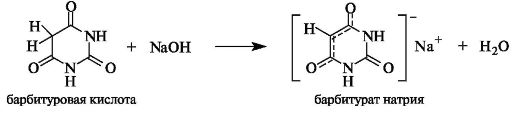
Барбитуровая кислота легко образует соли при действии щелочей. Ее весьма высокая кислотность (pKa 3,9) обусловлена эффективной делокализацией отрицательного заряда в барбитурат-ионе с участием двух атомов кислорода.
Широкое применение в медицине нашли барбитураты - производные барбитуровой кислоты, у которых в положении 5 находятся два (реже - один) углеводородных заместителя. С начала ХХ в. в качестве снотворных средств использовались барбитал (веронал), фенобарбитал (люминал). Последний применяют в настоящее время как противоэпилептическое средство.
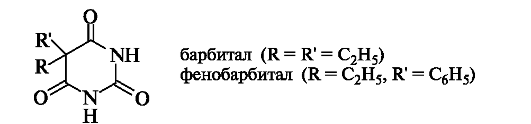
Барбитураты также обладают определенной кислотностью (например, pKa барбитала равен 7,9). Некоторые из них применяются в виде натриевых солей, например барбитал-натрий, что обусловлено хорошей растворимостью таких солей в воде.
Представителем шестичленных гетероциклических соединений с двумя различными гетероатомами (азота и серы) служит фенотиазин.
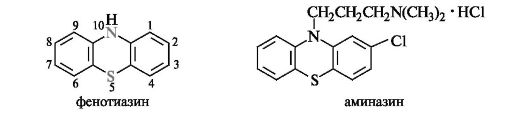
Важное значение имеют 2,10-дизамещенные производные фенотиазина, составляющие большую группу лекарственных средств психотропного действия. Один из них - аминазин - широко применяется как антипсихотическое средство.
13.5. Конденсированные гетероциклы
Из систем с двумя конденсированными гетероциклами важное значение имеют соединения пуринового ряда, в частности гидроксипурины и аминопурины, принимающие активное участие в процессах жизнедеятельности.
13.5.1. Гидроксипурины
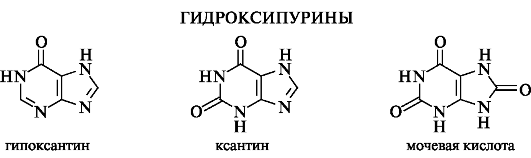
Гипоксантин (6-гидроксипурин), ксантин (2,6-дигидроксипурин) и мочевая кислота (2,6,8-тригидроксипурин) образуются в организме при метаболизме нуклеиновых кислот. Ниже они изображены в лактамной форме, в которой находятся в кристаллическом состоянии.
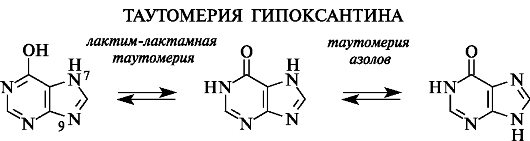
У гидроксипуринов возможна как лактим-лактамная таутомерия, так и таутомерия азолов, связанная с миграцией атома водорода от атома N-7 к N-9, как показано на примере гипоксантина.
Мочевая кислота - конечный продукт метаболизма пуриновых соединений в организме. Она выделяется с мочой в количестве 0,5-1 г/сут. Мочевая кислота двухосновна, плохо растворима в воде, но легко растворяется в щелочах, образуя соли с одним или двумя эквивалентами щелочи (приведено вероятное строение солей).
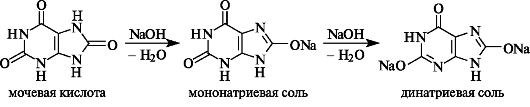
Соли мочевой кислоты называют уратами. При некоторых нарушениях в организме они откладываются в суставах, например при подагре, а также в виде почечных камней.
Ксантин и гипоксантин по химическому поведению во многом аналогичны мочевой кислоте. Они амфотерны и образуют соли с кислотами и щелочами.
Метилированные в различной степени по атомам азота производные ксантина обычно относят к алкалоидам (см. 13.6). Это кофе- ин (1,3,7-триметилксантин), теофиллин (1,3-диметилксантин) и тео- бромин (3,7-диметилксантин). Их природными источниками служат листья чая, зерна кофе, бобы какао.
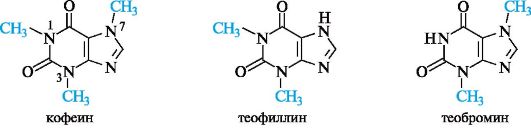
Кофеин - эффективный возбудитель ЦНС, он стимулирует работу сердца. Общестимулирующее действие теофиллина и теобромина выражено меньше, но они обладают довольно сильными мочегонными свойствами.
13.5.2. Аминопурины
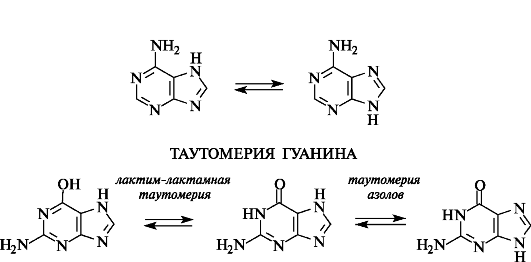
Из аминопуринов наиболее важны аденин (6-аминопурин) и гуанин (2-амино-6-гидроксипурин), являющиеся структурными фрагмента- ми нуклеиновых кислот. Аденин также входит в состав некоторых
коферментов (см. 14.3). Преобладающей таутомерной формой гуанина является лактамная. Для обоих соединений возможна и таутомерия азолов в результате миграции атома водорода между атомами
N-7 и N-9.
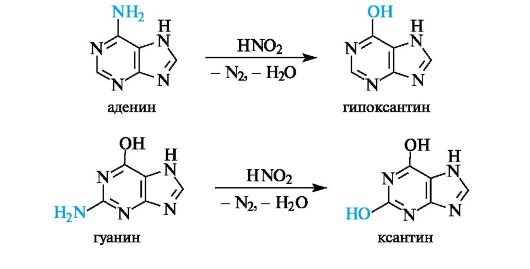
При действии на аденин азотистой кислоты HNO2 происходит его дезаминирование (см. 4.3) с образованием гипоксантина. Аналогичная реакция в случае гуанина приводит к ксантину.
13.6. Алкалоиды
Алкалоидами называют основные азотсодержащие вещества природного (главным образом растительного) происхождения.
Благодаря высокой фармакологической активности алкалоиды известны с давних времен и используются в медицине. Хрестоматийным примером служит применение с середины XVII в. хинина, выделяемо- го из коры хинного дерева, для лечения малярии.
Почти все алкалоиды имеют в структуре атом азота. Это обусловливает основные свойства алкалоидов, что нашло отражение в их групповом названии (от араб. al-qali - щелочь). В растениях алкалоиды содержатся в виде солей органических кислот - лимонной, яблочной, щавелевой и др.
Важнейшим структурным фрагментом большинства алкалоидов служит какой-либо азотсодержащий гетероцикл. Этот признак положен в основу химической классификации алкалоидов, по которой они подразделяются на группы в соответствии с типом гетероцикла в их структуре, например пиридина, хинолина и т. д. Такие алкалоиды имеют единство в биогенетическом происхождении от аминокислот, их называют истинными алкалоидами.
Наряду с этим существуют алкалоиды, у которых атом азота не включен в гетероциклическую структуру. Эти алкалоиды представляют собой растительные амины, их относят к протоалкалоидам.
При большом разнообразии структур алкалоидов в качестве общего химического свойства можно выделить реакции солеобразования. Эти реакции используют в двух направлениях:
• для получения хорошо растворимых в воде солей, например, с минеральными кислотами (хлориды, ацетаты);
• для получения окрашенных солей с ограниченной растворимостью (с органическими и неорганическими кислотами).
Первое направление используется главным образом для извлечения алкалоидов из природных источников, второе - в аналитических целях для качественного обнаружения алкалоидов.
13.6.1. Алкалоиды группы пирролидина, пиридина и пиперидина
Никотин - весьма токсичный алкалоид, содержание которого в листьях табака доходит до 8%. Включает связанные простой связью
ядра пиридина и пирролидина. Воздействует на вегетативную нервную систему, сужает кровеносные сосуды.
Никотиновая кислота (одна из форм витамина РР) является одним из продуктов окисления никотина и используется для синтеза других препаратов.
Лобелин и родственные ему алкалоиды обнаружены в североамериканском растении лобелия. Они близки по структуре и используются в медицине в качестве эффективных рефлекторных стимуляторов дыхания.
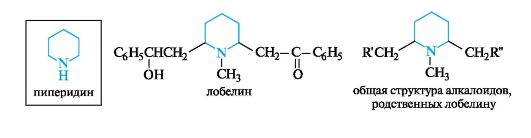
13.6.2. Алкалоиды группы тропана
Базовая структура алкалоидов этой группы - тропан - является бициклическим соединением, в состав которого входят пирролидино- вое и пиперидиновое кольца.

К тропановым алкалоидам относятся атропин и кокаин, применяемые в медицине как холиноблокаторы.
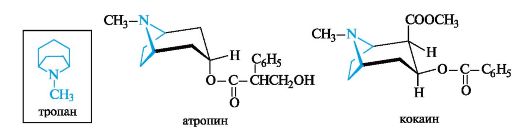
Атропин содержится в растениях семейства пасленовых: красавке, белене, дурмане. Несмотря на высокую токсичность, он широко применяется в глазной практике, благодаря способности расширять зрачок.
Кокаин - основной алкалоид южноамериканского кустарника Erythroxylon coca Lam. Это одно из первых используемых в медицине анестезирующих и наркотических средств. Синтетические аналоги кокаина, лишенные наркотических свойств, являются производными п-аминобензойной кислоты (см. 9.3).
13.6.3. Алкалоиды группы хинолина и изохинолина
Наибольшую известность из хинолиновых алкалоидов получил хинин, выделенный из коры хинного дерева. В состав хинина входят две гетероциклические системы - хинолиновая и хинуклидиновая.
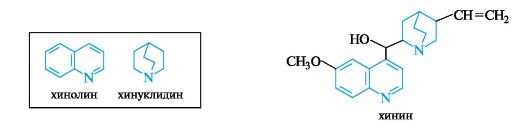
Хинин используется в медицине более 300 лет в качестве противомалярийного средства. В настоящее время из-за ряда негативных побочных эффектов его использование сократилось и на смену ему пришли новые синтетические противомалярийные препараты.
Ядро изохинолина содержится в алкалоидах опия, представляющего собой высохший млечный сок незрелых коробочек мака опийного. Основной из них - морфин - обладает сильным обезболивающим свойством, но при длительном употреблении вызывает привыкание. Морфин был первым алкалоидом, выделенным в чистом виде (1806) и был назван по имени бога сна и сновидений Морфея.
Монометиловый эфир морфина - кодеин - оказывает противокашлевое действие, а диацетильное производное - героин - наркотик.
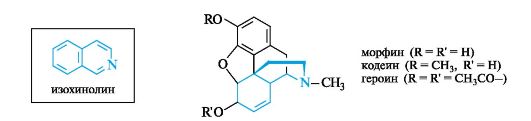
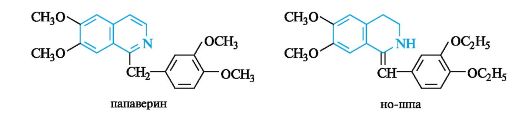
Другим алкалоидом группы изохинолина, также выделенным изопия, служит папаверин, применяемый в качестве эффективного спазмолитического средства. Синтетический аналог папаверина ношпа имеет с ним явное структурное сходство.
13.6.4. Протоалкалоиды
В эту группу алкалоидов входят растительные основания, не имеющие в своей структуре какого-либо гетероцикла. Важнейшим их представителем является эфедрин, выделяемый из различных видов эфедры.
В молекуле эфедрина содержатся два хиральных центра, в соответствии с этим эфедрин существует в виде четырех стереоизомеров и двух рацематов. Наибольшей фармакологической активностью обладает природный эфедрин, являющийся одним из стереизомеров.
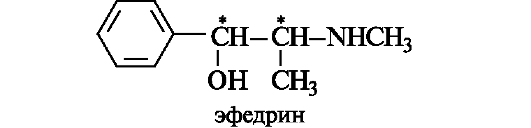
По химической структуре эфедрин подобен катехоламинам (см. 9.2.1).