Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 15. НИЗКОМОЛЕКУЛЯРНЫЕ БИОРЕГУЛЯТОРЫ
К низкомолекулярным биорегуляторам относится большая группа природных веществ с относительно небольшой молекулярной массой и высокой биологической активностью, выполняющих разнообразные функции в живых организмах: терпеноиды, стероиды, витамины, флавоноиды, простагландины, антибиотики, алкалоиды (см. 13.6) и ряд других соединений. Значительная часть низкомолекулярных биорегуляторов является изопреноидами.
Изопреноидами называют соединения, построенные из фрагментов изопрена.
К ним относятся прежде всего терпеноиды и стероиды. Первые, как правило, имеют растительное происхождение, вторые преобладают в животном мире. Между ними много общего, например, в их структурах присутствуют одинаковые пятиуглеродные изопреновые фрагменты, а их биосинтез включает одни и те же промежуточные соединения.
Один из наиболее известных представителей изопреноидов - натуральный каучук - представляет собой полимер изопрена.
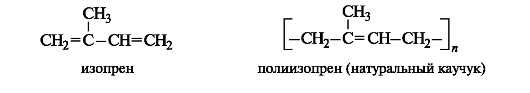
15.1. Терпеноиды
Под названием «терпеноиды» объединяют ряд углеводородов и их производных, содержащих главным образом гидроксильную и карбонильную группы, углеродный скелет которых построен из двух звеньев изопрена и более.
Сами углеводороды называют терпеновыми углеводородами, или терпенами.
К терпенам относятся и такие растительные пигменты, как каротиноиды; группировка терпенового типа (изопреноидная цепь) входит
в состав ряда других низкомолекулярных биорегуляторов, в частности жирорастворимых витаминов.
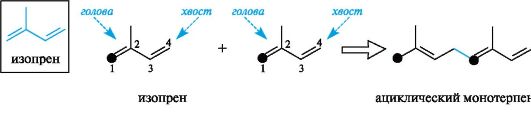
В большинстве терпеноидов изопреновые фрагменты соединены друг с другом по принципу «голова к хвосту».
С учетом числа изопреновых звеньев в молекуле различают:
• монотерпены - два изопреновых звена (10 атомов С);
• дитерпены - четыре изопреновых звена (20 атомов С);
• тритерпены - шесть изопреновых звеньев (30 атомов С);
• тетратерпены - восемь изопреновых звеньев (40 атомов С).
Терпеноиды могут иметь ациклическое и циклическое строение. Примером ациклических терпеновых углеводородов служит монотерпен мирцен, содержащийся в эфирных маслах хмеля и благородного лавра. Родственными ему терпеноидами являются спирт гераниол, входящий в состав эфирных масел герани и розы, и альдегид цитраль а - продукт окисления гераниола.
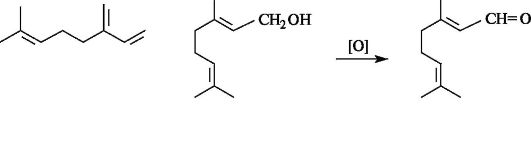
Цитраль и гераниол выделяются в небольших количествах рабочими пчелами при поиске пищи и привлекают других пчел. Соединения подобного действия называют феромонами. По существу феромоны являются биорегуляторами и используются насекомыми как средство внутривидовой передачи информации.
Тритерпен сквален является промежуточным продуктом в биосинтезе холестерина.
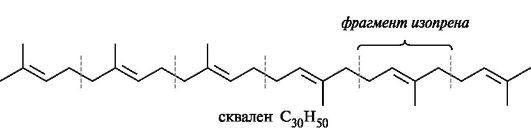
Среди терпенов наиболее распространены моно- и бициклические соединения. Соответствующие моно- и бициклическим терпенам насыщенные углеводороды носят названия ментан, пинан и борнан.
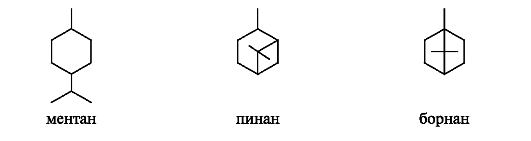
(-)-Лимонен - представитель моноциклических терпенов. Он содержится в лимонном масле и скипидаре. (+)-Лимонен входит в состав масла тмина. Рацемическая форма лимонена (дипентен) может быть получена из изопрена.
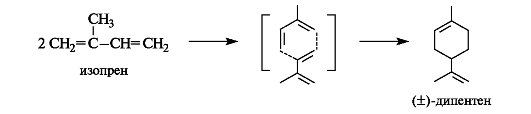
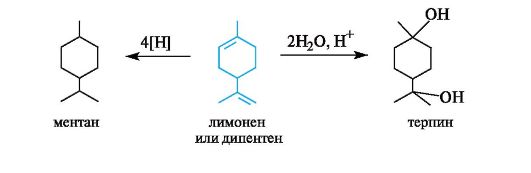
При восстановлении оптически активного лимонена или дипентена получается ментан, а при полной их гидратации в кислой среде, протекающей в соответствии с правилом Марковникова, образуется двухатомный спирт терпин. Терпин в виде гидрата применяется в медицине в качестве отхаркивающего средства.
(-)-Ментол имеет скелет ментана и содержится в эфирном масле мяты перечной. Из приведенной конформации ментола видно, что все три заместителя в циклогексановом кольце занимают наиболее выгодные экваториальные положения.
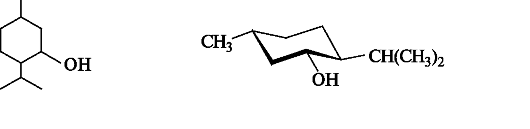
Ментол оказывает антисептическое, успокаивающее и болеутоляющее действие, входит в состав валидола, а также мазей, применяемых при насморке.
α-Пинен - бициклический монотерпен ряда пинана. Один из его энантиомеров - важная составная часть скипидара, получаемого из хвойных деревьев.
Камфора - бициклический кетон. Применяется в медицине как стимулятор сердечной деятельности. Один из ее стереоизомеров выделяют из эфирного масла камфорного дерева.
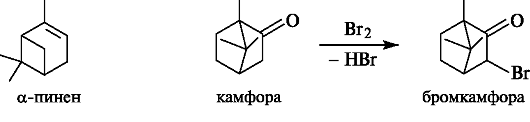
При действии брома на камфору замещается α-положение по отношению к карбонильной группе с образованием бромкамфоры.
Бромкамфора улучшает деятельность сердца, оказывает успокаивающее действие на ЦНС.
15.2. Каротиноиды
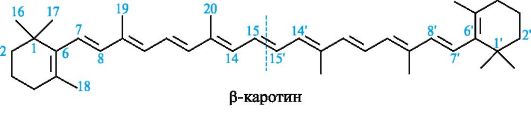
Особую группу терпенов составляют каротиноиды. Большинство каротиноидов относится к тетратерпенам. Они содержат значительное число сопряженных двойных связей и имеют желто-красный цвет. Для природных каротиноидов характерна транс-конфигурация двойных связей.
Каротины - растительные пигменты желто-красного цвета, содер- жащиеся в моркови, а также в томатах и сливочном масле. Наиболее известны три изомера - α-, β- и γ-каротины, различающиеся числом циклов и положением двойных связей. Все они являются предшественниками витаминов группы А (см. 15.4). Молекула β-каротина симметрична и состоит из двух одинаковых частей.
15.3. Стероиды
Стероиды широко распространены в природе и выполняют в организме человека разнообразные функции. Наряду с использованием природных стероидов синтетически получено множество физиологически активных веществ стероидной природы.
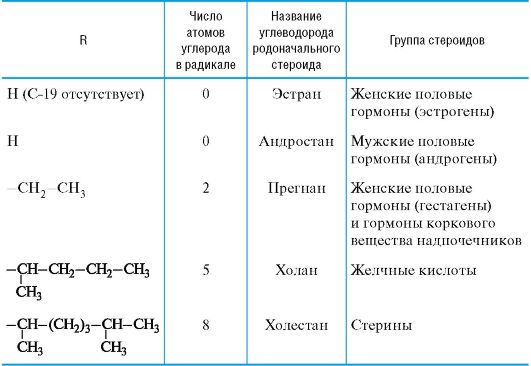
В основе структуры стероидов лежит скелет гонана, состоящий из конденсированных, нелинейно сочлененных циклогексановых колец А, В и С и циклопентанового кольца D. Общая структура стероидов и принятый порядок нумерации атомов приведены ниже.
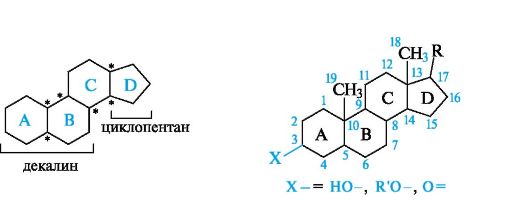
Большинство природных стероидов имеет в стероидном скелете следующие заместители:
• «ангулярные» («угловые») метильные группы у атомов С-10 (СН3-19) и С-13 (СН3-18);
• алифатический заместитель R у атома С-17;
• кислородсодержащий заместитель у атома С-3 (OH, OR', оксогруппа).
По числу атомов углерода в радикале R стероиды делятся на группы, приведенные в табл. 15.1 (кроме сердечных гликозидов и экдистероидов).
Таблица 15.1. Классификация стероидов по величине углеводородного
радикала R у С-17
Стереохимия стероидов. Гонан содержит 6 узловых асимметрических атомов углерода. С введением заместителей к любым неузловым атомам число возможных стереоизомеров еще более возрастает. Тем не менее из-за высокой стереоселективности реакций, лежащих в основе биогенеза стероидов, в живой природе встречаются только некоторые из возможных стереоизомерных форм.
Сочленение между собой попарно колец А и В, В и С, С и D может осуществляться по транс-типу. Типы сочленения колец А и В можно продемонстрировать на примере бициклического углеводорода декалина, являющегося фрагментом структуры гонана.
В зависимости от конфигурации атомов С-9 и С-10 декалин может существовать в виде двух стереоизомеров: транс-декалина, у которого атомы водорода у атомов С-9 и С-10 находятся по разные стороны от условной плоскости колец (рис. 15.1, а), и цис-декалина
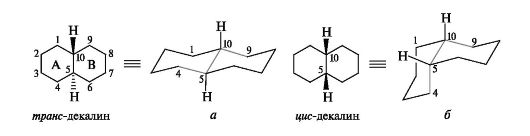
Рис. 15.1. цис- и транс-Сочленение циклогексановых колец в декалине
с расположением атомов водорода у этих атомов углерода по одну сторону плоскости (см. рис. 15.1, б).
Стереоизомерные декалины различаются по термодинамической стабильности: цис-декалин обладает более высокой энергией, чем транс-декалин, поэтому в стероидах более распространен транс-со- члененный декалиновый фрагмент.
В целом для природных стероидов характерно транс-сочленение колец ВиСи преимущественно транс-сочленение колец Си D, а кольца АиВ могут иметь как транс-, так и цис-сочленение. Все циклогексановые кольца находятся в конформации кресла.
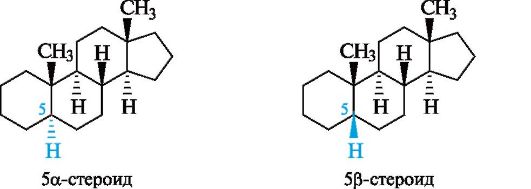
В структурных формулах стероидов положение атомов водорода и заместителей снизу или сверху от условной плоскости кольца обозначают буквами α и β соответственно (что напоминает обозначения в углеводах). Стереохимию сочленения колец А и В указывают по ориентации атома водорода в положении 5. Так, 5а-стероид имеет транс-, а 5β-стероид - цис-сочленение колец А и В.
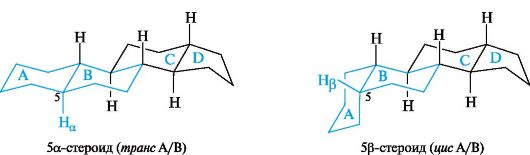
При обычном написании формул стероидов циклический скелет принято изображать плоским. Заместители и атомы водорода в таком случае будут располагаться либо под плоскостью чертежа (α-ориен- тация), либо над нею (β-ориентация).
15.3.1. Стерины
Клетки живых организмов, как правило, очень богаты стеринами.
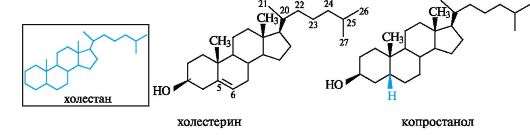
В основе структуры стеринов лежит скелет углеводорода холестана, алифатический радикал R у атома С-17 которого включает 8 атомов углерода (см. табл. 15.1). В качестве обязательного заместителя стерины содержат гидроксильную группу у атома С-3, т. е. являются спиртами (поэтому в их названии часто присутствует суффикс -ол).
Примерами служат холестерин, а также образующийся из холестерина в кишечнике и поэтому присутствующий в фекалиях копроста- нол. Гидроксильная группа у этих стеринов имеет β-ориентацию.
В организме стерины являются предшественниками желчных кислот и стероидных гормонов.
Холестерин - наиболее распространенный представитель стеринов (рис. 15.2), присутствующий практически во всех тканях животных организмов. В биохимической литературе холестерин часто называют холестеролом. Особенность структуры холестерина - двойная связь в кольце В между атомами С-5 и С-6.
Рис. 15.2. Молекулярная модель холестерина
Холестерин - кристаллическое оптически активное вещество (т. пл. 150 ?С, [α]D20 -39?). В организме встречается как в свободном состоянии, так и в виде сложного эфира.
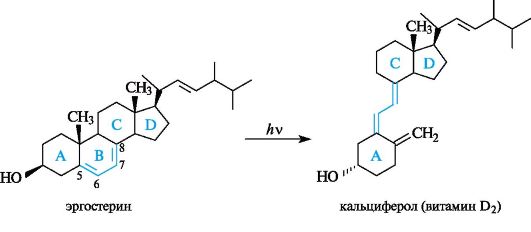
При облучении ультрафиолетовыми лучами некоторых стеринов, например выделенного из дрожжей эргостерина (эргостерола), происходит размыкание кольца В и образуются продукты, относящиеся к витаминам группы D (антирахитические). Они содержатся в яичном желтке, сливочном масле и рыбьем жире.
15.3.2. Желчные кислоты
Алифатическая боковая цепь у атома С-17 в желчных кислотах, производных углеводорода холана, состоит из 5 атомов углерода (см. табл. 15.1) и включает концевую карбоксильную группу. Из желчи человека выделены четыре кислоты, которые получили название холевых кислот. Наиболее распространенная среди них - сама холевая кислота. Все гидроксильные группы в ней имеют α-расположение, а кольца А и В - цис-сочленение. Другие кислоты этой группы отличаются отсутствием одной или двух гидроксильных групп у атомов С-12 и С-17.
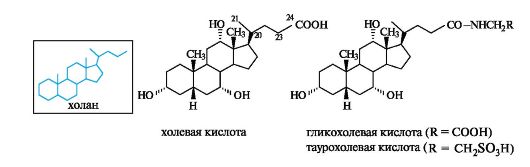
Желчные кислоты играют важную роль в процессе обмена жиров. Они находятся в организме также в виде амидов. Посредством амидной связи к ним могут быть присоединены остатки глицина H2NCH2COOH, как в гликохолевой кислоте, или таурина H2NCH2CH2SO3H, как в таурохолевой кислоте. Натриевые и калиевые соли желчных кислот обладают поверхностно-активными свойствами. Эмульгируя жиры пищи, они улучшают их усвоение.
15.3.3. Кортикостероиды
Кортикостероиды - группа стероидных гормонов, образующихся в корковом веществе надпочечников. Основу их структуры составля- ет углеводород прегнан. Боковая цепь в кортикостероидах у атома С-17 включает два атома углерода в виде группировки -CO-CH2OH.
• Кортикостероиды можно разделить на две группы: минералокортикостероиды, регулирующие водный и солевой
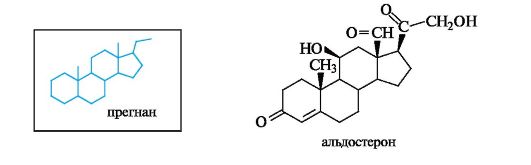
Глюкокортикостероиды оказывают противовоспалительное, противошоковое, антиаллергическое действие. Их получают либо из коркового слоя надпочечников крупного рогатого скота, либо синтетически и используют при лечении бронхиальной астмы, экзем, инфекционного гепатита, артритов. Примерами служат кортикостерон и преднизолон, структурной характеристикой которых является система α, β-ненасыщенного кетона в кольце А.
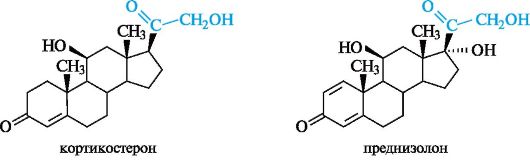
Кортикостерон действует как антагонист инсулина, повышая содержание глюкозы в крови. Преднизолон представляет собой син- тетический кортикостероид, по действию превосходящий природные аналоги.
15.3.4. Половые гормоны
Эти вещества вырабатываются половыми органами и регулируют половые функции. К их числу относятся женские (гестагены и эст- рогены) и мужские половые гормоны (андрогены).
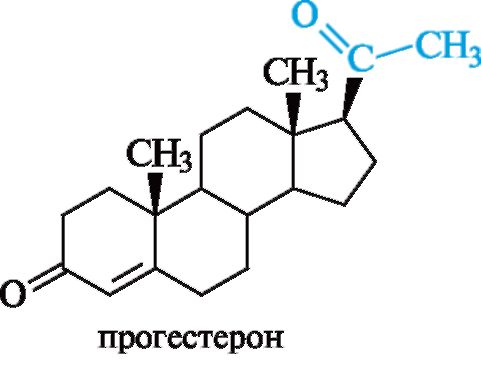
Гестагены образуются в желтом теле яичников (гормоны беременности). Гестагены, как и кортикостероиды, являются производными прегнана. Наибольшей активностью среди них обладает прогестерон, боковая цепь которого содержит два атома углерода (см. табл. 15.1).
Эстрогены контролируют менструальный цикл у женщин, используются при лечении климактерических расстройств, гипертонии и других заболеваний. Наиболее важны эстрон и эстрадиол - производ- ные углеводорода эстрана. В отличие от всех других групп стероидов эстрогены содержат ароматическое кольцо А.
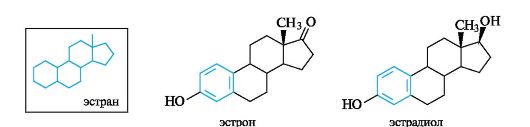
Эстрогены содержатся и в растениях - кокосовых орехах, цветках ивы и др. В настоящее время для медицинских целей эстроген получают путем промышленного химического синтеза.
Широкий поиск синтетических аналогов эстрогенов привел к получению соединений, обладающих мощной эстрогенной актив- ностью. К ним относятся диэтилстильбэстрол и продукт его гидрирования синэстрол.
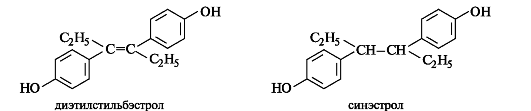
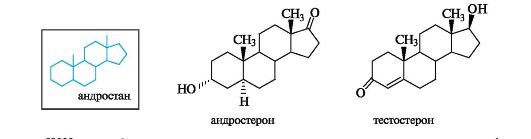
Андрогены стимулируют развитие вторичных мужских половых признаков и выработку спермы, влияют на эндокринную систему человека, дают сильный анаболический эффект. Основные мужские половые гормоны - андростерон и более активный тестостерон. В основе их структуры лежит скелет углеводорода андростана. Боковая цепь у атома С-17 у этих кетостероидов, как и у эстрогенов, отсутствует (см. табл. 15.1), но сохраняются обе «ангулярные» метильные группы.
15.3.5. Сердечные гликозиды
Сердечные гликозиды - стероидные гликозиды растительного происхождения. В этих соединениях стероидная часть молекулы играет роль агликона (в этом случае его называют генином) в некоторых моноили олигосахаридах. В небольших количествах они возбуждают сердечную деятельность и используются в кардиологии, в больших дозах являются сердечными ядами. Эти соединения выделяют из различных видов наперстянки пурпуровой, ландыша, горицвета и других растений.
К генинам сердечных гликозидов растительного происхождения относятся дигитоксигенин и строфантидин.
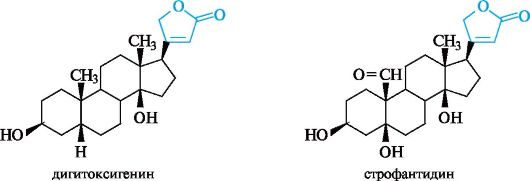
Дигитоксигенин является генином в молекуле гликозида дигитоксина, выделенного из наперстянки пурпуровой, а строфантидин является генином в молекуле гликозида, выделяемого из различных видов строфантов и ландыша майского.
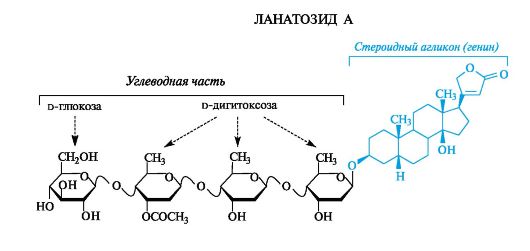
Особенность их структуры - наличие ненасыщенного γ-лактонного кольца у атома С-17 и цис-сочленение колец C и D. Остатки углеводов (ими могут быть 2,6-дидезоксисахара, см. 11.1.4) присоединяются по гидроксильной группе у атома С-3. Связь между молекулой углевода и генином является β-гликозидной. Примером сердечного гликозида служит ланатозид А, выделяемый из наперстянки.
15.4. Жирорастворимые витамины
Витамины делят на водорастворимые и жирорастворимые. К водорастворимым витаминам относятся рассмотренные выше тиамин, или витамин В1 (см. 13.3.2); никотиновая кислота, или витамин РР (см. 13.4.1); аскорбиновая кислота, или витамин С (см. 11.1.4). К жирорастворимым относятся витамины групп А, Е, K и убихиноны.
Витамины группы А. Витамины группы А считаются факторами роста. Их недостаток в пище вызывает исхудание, высыхание роговицы глаза (куриную слепоту), понижает сопротивляемость организма инфекции. По химическому строению витамины этой группы относятся к терпеноидам.
Одним из представителей является витамин А1 - ретинол, обра- зующийся в организме из β-каротина (см. 15.2).
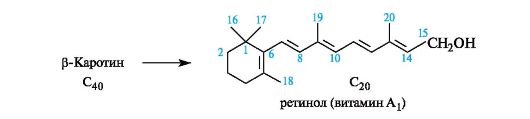
Роль ретинола в процессе зрительного восприятия изучена достаточно хорошо (рис. 15.3). В организме ретинол окисляется в альдегид - 11-транс-ретиналь, который под воздействием фермента превращается в 11-цис-ретиналь, а затем связывается с белком палочек
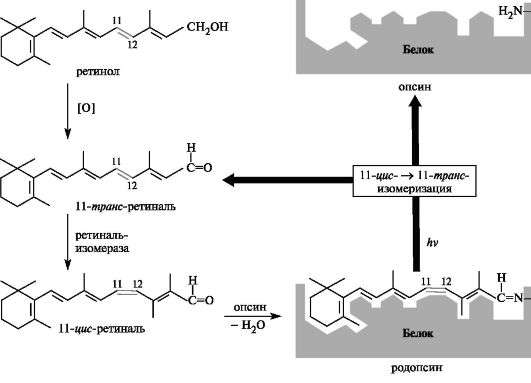
Рис. 15.3. Химические основы процесса зрительного восприятия
сетчатки опсином с образованием светочувствительного пигмента родопсина. При поглощении света в результате фотоизомеризации ретинальный компонент родопсина переходит в 11-транс-ретиналь, его конформация существенно изменяется, и он отделяется от опсина. Эта реакция служит пусковым механизмом, обеспечивающим возбуждение палочек сетчатки глаза.
Витамины группы Е. Среди витаминов этой группы наиболее важен сам витамин Е - α-токоферол. Он представляет собой производное гидрохинона, содержащего изопреноидную боковую цепь. В бензольном кольце содержатся три метильные группы.
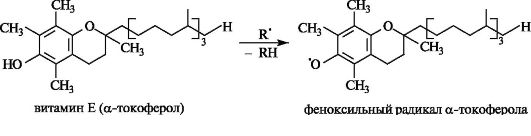
α-Токоферол является одним из самых активных эндогенных антиоксидантов, ингибирующих в клетке процесс пероксидного окисления липидов. Антиоксидантная функция обеспечивается способностью восстанавливать появляющиеся в клетках активные свободные радикалы путем превращения α-токоферола в относительно устойчивый и потому не способный к продолжению цепи феноксильный радикал.
Кофермент Q (убихиноны). Эти витамины близки по структуре витаминам группы Е (в переводе «убихинон» означает «вездесущий хинон»). Они присутствуют в клеточных мембранах и принимают участие в окислительно-восстановительных процессах, сопровождающихся переносом электронов. В приведенной ниже формуле уби- хинонов число n варьирует от 6 до 10. С химической точки зрения эти соединения являются производными 1,4-бензохинона (см. 8.2), содержащими изопреноидную боковую цепь. Кроме того, в хиноновом кольце присутствуют метоксигруппы, а по соседству с изопреноидной группировкой - метильная группа.
В организме убихиноны могут легко и обратимо восстанавливаться в гидрохиноны.
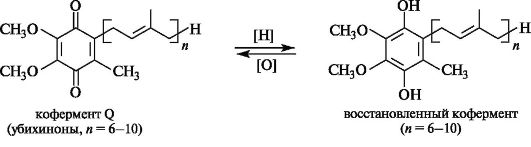
Химическая основа функционирования убихинонов в организме базируется на их способности легко и обратимо превращаться в вос- становленные формы, что обусловливает их способность к переносу электронов.
Витамины группы K. Витамины этой группы необходимы для обеспечения нормальной свертываемости крови. Они являются производными 1,4-нафтохинона (см. 8.2) и подобно витаминам группы Е и убихинонам содержат изопреноидную боковую цепь. Представителем этой группы витаминов в организмах животных и бактерий являются менахиноны (группа витаминов K2).
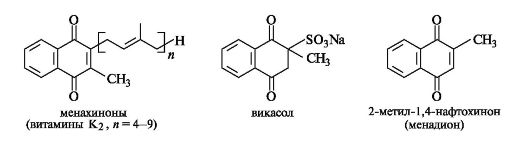
В лечебной практике применяется синтетический водорастворимый аналог витаминов группы K, викасол, повышающий способ- ность крови к свертыванию.
Для проявления биологической активности витаминов этой группы важно присутствие метильного заместителя в положении 2 хинонового кольца. Об этом свидетельствует высокая К-витаминная активность 2-метил-1,4-нафтохинона - менадиона. Возможно, в организме менадион превращается в соединения с изопреноидной боковой цепью.
15.5. Флавоноиды
Флавоноиды являются продуктами жизнедеятельности растений. Они участвуют в клеточном обмене, выполняют функции регуляторов роста, развития и репродукции растений. Интерес к флавоноидам очень велик ввиду широкого спектра их биологической активности. Они входят в состав многих препаратов растительного происхождения, называемых фитопрепаратами, которые в настоящее время привлекают пристальное внимание как наиболее безопасные лекарственные средства.
Углеродный скелет флавоноидов можно обозначить как С6-С3-С6. Эта структурная матрица включает два бензольных кольца (А и В), соединенных трехуглеродной цепью. Семейство флавоноидов включает группы соединений, различающиеся по строению трехуглеродного фрагмента. Самую многочисленную группу составляют флавоны и флаваноны, структура которых представляет собой конденсированную систему бензольного кольца А и кислородсодержащего гетероцикла γ-пирона С с боковым фенильным заместителем В.
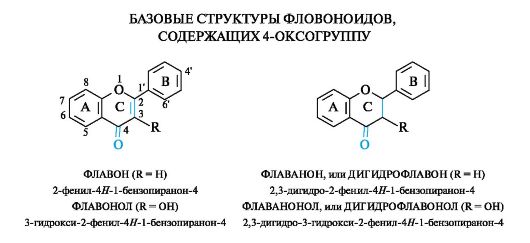
Базовая химическая структура флавоноидов может содержать гидроксильные, алкоксильные, гликозилоксильные заместители, различающиеся числом и положением в молекуле, что обеспечивает большое разнообразие соединений этого типа.
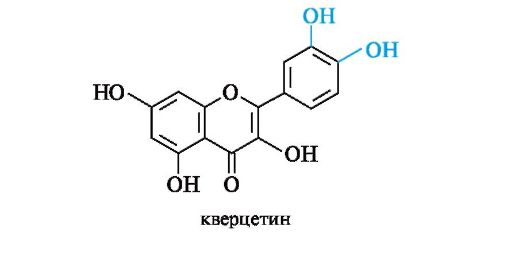
Флавоноиды составляют важную группу природных антиоксидантов. Наряду с эндогенными антиоксидантами (α-токоферол, убихиноны, аскорбиновая кислота и др.) флавоноидные соединения, поступающие с пищей или лекарствами, принимают участие в защите организма от оксидативного стресса и занимают ведущее место среди экзогенных природных антиоксидантов. Известный представитель кверцетин (3,5,7,3',4'-пентагидроксифлавон) впервые выделен из коры дуба, он стал родоначальником множества фитопрепаратов.
Пирокатехиновая группировка в структуре кверцетина обусловливает способность к участию в окислительно-восстановительных реакциях. В таких реакциях молекула кверцетина выступает в роли восстановителя (донора электронов) по отношению к радикальному субстрату R', переходя при этом в окисленную (радикальную) форму. Образующийся радикал имеет относительно высокую устойчивость в результате рассредоточения электронной плотности по всей сопряженной системе молекулы и стабилизации путем образования изомерных хиноидных структур.
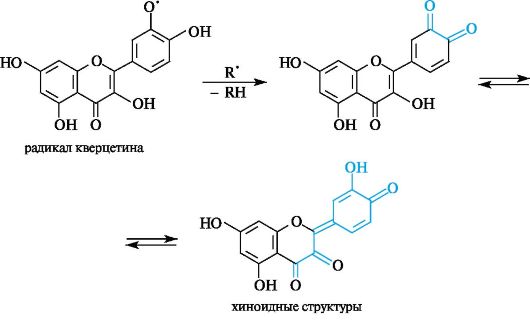
Отметим, что в составе окисленной формы флавоноидов содержится структурный фрагмент о-хинона (см. 8.2).
15.6. Антибиотики
Антибиотиками называют вещества, синтезируемые микроорганизмами и способные препятствовать развитию других микроорганизмов.
По химической структуре антибиотики относятся к различным классам органических соединений. Большая часть их имеет сложную гетероциклическую структуру. В промышленных масштабах их получают микробиологическим путем. Широко развито также производство полусинтетических антибиотиков. Оно основано на химической модификации соединения, выделяемого из культуральной жидкости, вырабатываемой определенным штаммом микроорганизмов. Так, из плесневого гриба Penicillium chrysogenum выделяют 6-аминопеницил- лановую кислоту, которую используют для получения полусинтети- ческих пенициллинов путем ее ацилирования обычными химическими методами.
Пенициллины. В основе структуры пенициллинов лежит пени- циллановая кислота, содержащая два конденсированных гетероциклических кольца - четырехчленное β-лактамное (А) и пятичленное тиазолидиновое (В).
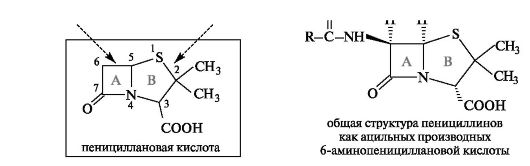
Природные и полусинтетические пенициллины представляют собой N-ацилированные различными ацильными радикалами производные 6-аминопенициллановой кислоты. Природа радикала в ацильной группе учитывается в названии пенициллина. Например, соединение с R = СбН5СН2 называют бензилпенициллином, а с R = СбН5ОСН2 - феноксиметилпенициллином.
Основная особенность строения пенициллинов заключается в наличии четырехчленного β-лактамного кольца, не встречавшегося ранее в природных соединениях. β-Лактамное кольцо чрезвычайно лабильно. В мягких условиях оно подвергается гидролизу с разрывом амидной связи С-7-N-4, что приводит к потере биологической активности.
Природные пенициллины обладают довольно избирательным, а полусинтетические - гораздо более широким спектром антимикробного действия.
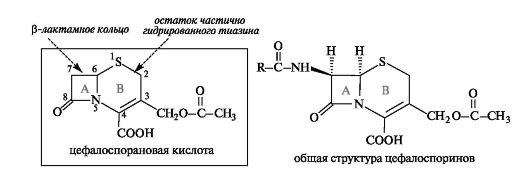
Цефалоспорины. Цефалоспориновые антибиотики близки по строению к пенициллинам и также содержат β-лактамное кольцо. В основе их структуры лежит цефалоспорановая кислота, содержащая два конденсированных гетероциклических кольца - четырехчленное β-лактамное (А) и частично гидрированное шестичленное 1,3-тиазиновое (В).
Антибиотики цефалоспориновой группы являются производными 7-аминоцефалоспорановой кислоты. Они обладают широким спектром действия и тормозят рост некоторых штаммов бактерий, устойчивых к пенициллину.