Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 14. НУКЛЕИНОВЫЕ КИСЛОТЫ. НУКЛЕОТИДНЫЕ КОФЕРМЕНТЫ
Нуклеиновые кислоты представляют собой высокомолекулярные соединения, молекулярная масса которых колеблется от 25 тыс. до 1 млн и более.
Полимерные цепи нуклеиновых кислот построены из мономерных единиц - нуклеотидов, в связи с чем нуклеиновые кислоты назы- вают полинуклеотидами.
Обычно «неделимое» мономерное звено (например, аминокислотный остаток в белках) у нуклеотидов представляет собой трехкомпонентное образование, включающее гетероциклическое основание, углеводный остаток и фосфатную группу.
Углеводными компонентами служат пентозы - D-рибоза и 2-дезокси-э-рибоза. В зависимости от этого нуклеиновые кислоты делятся на рибонуклеиновые (РНК), содержащие рибозу, и дезоксирибо- нуклеиновые (ДНК), содержащие дезоксирибозу.
ДНК содержатся в основном в ядрах клеток, РНК находятся преимущественно в рибосомах, а также протоплазме клеток. РНК непосредственно участвуют в биосинтезе белка.
14.1. Нуклеотиды
14.1.1. Нуклеозиды
В химии нуклеиновых кислот входящие в их состав гетероциклические соединения пиримидинового и пуринового рядов обычно называют нуклеиновыми основаниями.
Нуклеиновые основания в качестве заместителей в гетероцикле могут содержать:
• либо оксогруппу, как в урациле и тимине;
• либо аминогруппу, как в аденине;
• либо одновременно обе эти группы, как в цитозине и гуанине.
Кислородсодержащие основания представлены лактамными таутомерными формами, в которых ароматичность не нарушена (см. 13.4). Для всех оснований приняты сокращенные трехбуквенные обозначения, составленные из первых букв их латинских названий.
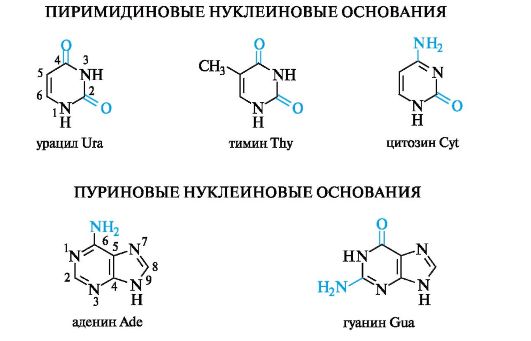
Нуклеиновые кислоты различаются входящими в них гетероциклическими основаниями: урацил входит только в РНК, а тимин -
в ДНК:
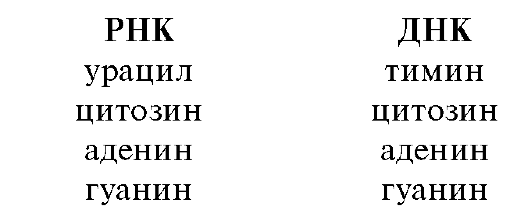
Нуклеиновые основания образуют связь за счет одного из атомов азота с аномерным центром пентозы (D-рибозы или 2-дезокси-D- рибозы). Этот тип связи аналогичен обычной гликозидной связи и известен как N-гликозидная связь, а сами гликозиды - как N-гликози- ды. В химии нуклеиновых кислот их называют нуклеозидами.
В состав природных нуклеозидов пентозы входят в фуранозной форме (атомы углерода в них нумеруют цифрой со штрихом). Гликозидная связь осуществляется с атомом азота N-1 пиримидинового и N-9 пуринового оснований.
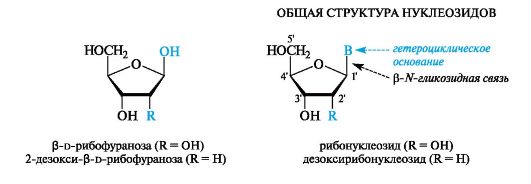
Природные нуклеозиды всегда являются β-аномерами.
В зависимости от природы углеводного остатка различают рибонуклеозиды и дезоксирибонуклеозиды. Для нуклеозидов употребительны названия, производимые от тривиального названия соответствующего нуклеинового основания с суффиксами -идин у пиримидиновых и -озин у пуриновых нуклеозидов.
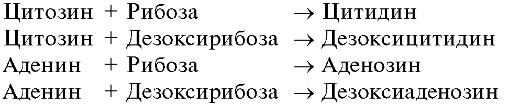
Исключение составляет название «тимидин» (а не дезокситимидин), используемое для дезоксирибозида тимина, входящего в состав ДНК. В тех редких случаях, когда тимин встречается в РНК, соответствующий нуклеозид называется риботимидином.
Трехбуквенные символы нуклеозидов отличаются от символов оснований последней буквой. Однобуквенные символы применяются только для остатков (радикалов) нуклеозидов в более сложных структурах.
Нуклеозиды устойчивы к гидролизу в слабощелочной среде, но гидролизуются в кислой. Пуриновые нуклеозиды гидролизуются легко, пиримидиновые труднее.
В качестве лекарственных средств в онкологии используют синтетические производные пиримидинового и пуринового рядов, по строению похожие на естественные метаболиты (в данном случае - на нуклеиновые основания), но не полностью им идентичные, т. е. являющиеся антиметаболитами. Например, 5-фторурацил выступает
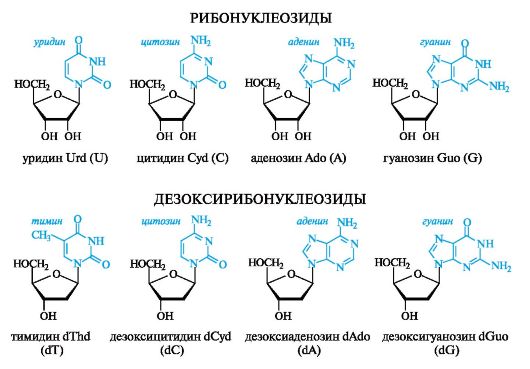
в роли антагониста урацила и тимина, 6-меркаптопурин - аденина. Конкурируя с метаболитами, они нарушают синтез нуклеиновых кислот в организме на разных этапах.
14.1.2. Нуклеотиды
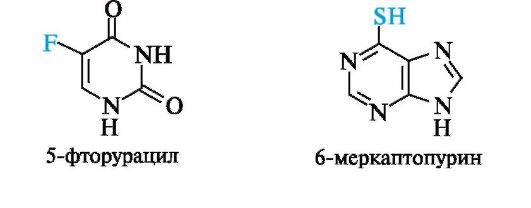
Нуклеотидами называют фосфаты нуклеозидов. Фосфорная кислота обычно этерифицирует спиртовый гидроксил при С-5' или С-3' в остатке рибозы (рибонуклеотиды) или дезоксирибозы (дезоксирибонуклеотиды).
Общий принцип строения нуклеотидов показан на примере фосфатов аденозина. Для связывания трех компонентов в молекуле нуклеотида используются сложноэфирная и N-гликозидная связи.
Нуклеотиды можно рассматривать, с одной стороны, как эфиры нуклеозидов (фосфаты), а с другой - как кислоты (в связи с наличием остатка фосфорной кислоты).
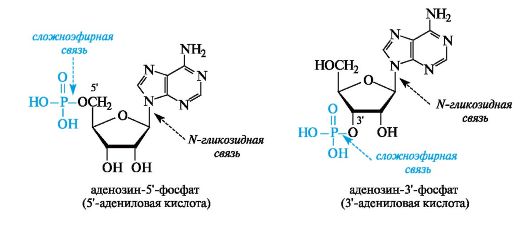
За счет фосфатного остатка нуклеотиды проявляют свойства двухосновной кислоты и в физиологических условиях при рН ~7 находятся в полностью ионизированном состоянии.
Для нуклеотидов используют два вида названий (табл. 14.1). Одно включает наименование нуклеозида с указанием положения в нем фосфатного остатка, например, аденозин-3'-фосфат, уридин-5'-фос- фат; другое строится с добавлением сочетания -иловая кислота к названию остатка пиримидинового основания, например, 5'-уридило- вая кислота, или пуринового основания, например 3'-адениловая кислота.
Используя принятый для нуклеозидов однобуквенный код, 5'-фосфаты записывают с добавлением латинской буквы «р» перед символом нуклеозида, 3'-фосфаты - после символа нуклеозида. Аденозин-5'-фосфат обозначается рА, аденозин-3'-фосфат - Ар и т. п. Эти сокращенные обозначения используют для записи последовательности нуклеотидных остатков в нуклеиновых кислотах. По отношению к свободным нуклеотидам в биохимической литера-
туре широко используют их названия как монофосфатов с отражением этого признака в сокращенном коде, например АМР (или АМФ) для аденозин-5'-фосфата и т. д. (см. табл. 14.1).
Таблица 14.1. Важнейшие нуклеотиды, входящие в состав нуклеиновых кислот

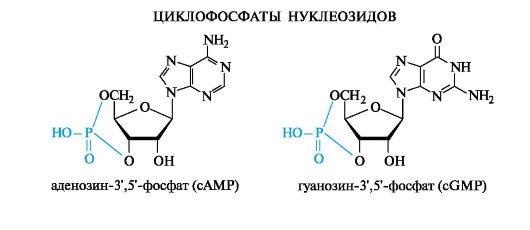
Циклофосфаты. К ним относятся нуклеотиды, у которых одна молекула фосфорной кислоты этерифицирует одновременно две гидроксильные группы углеводного остатка. Практически во всех клетках присутствуют два нуклеозидциклофосфата - аденозин-3',5'- циклофосфат (cAMP) и гуанозин-3',5'-циклофосфат (cGMP).
14.2. Структура нуклеиновых кислот
14.2.1. Первичная структура
В полинуклеотидных цепях нуклеотидные звенья связаны через фосфатную группу. Фосфатная группа образует две сложноэфирные связи: с С-3' предыдущего и с С-5' последующего нуклеотидных звеньев (рис. 14.1). Каркас цепи состоит из чередующихся пентозных и фосфатных остатков, а гетероциклические основания являются «боковыми» группами, присоединенными к пентозным остаткам. Нуклеотид со свободной 5'-ОН группой называют 5'-концевым, а нуклеотид со свободной З'-ОН группой - З'-концевым.
На рисунке 14.2 приведено строение произвольного участка цепи ДНК, включающего четыре нуклеиновых основания. Легко представить, какое множество сочетаний можно получить путем варьирования последовательности четырех нуклеотидных остатков. Принцип построения цепи РНК такой же, как и у ДНК, с двумя исключениями: пентозным остатком в РНК служит D-рибоза, а в наборе гетероциклических оснований используется не тимин, а урацил.
Первичная структура нуклеиновых кислот определяется последовательностью нуклеотидных звеньев, связанных ковалентными связями в непрерывную цепь полинуклеотида.
Для удобства записи первичной структуры существует несколько способов сокращений. Один из них заключается в использовании ранее приведенных сокращенных названий нуклеозидов. Например, показанный на рис. 14.2 фрагмент цепи ДНК может быть записан
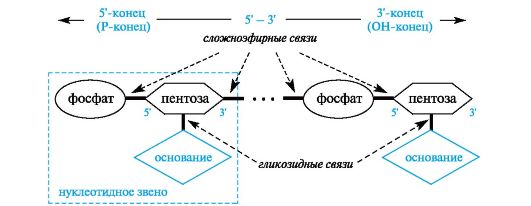
Рис. 14.1. Общий принцип строения полинуклеотидной цепи
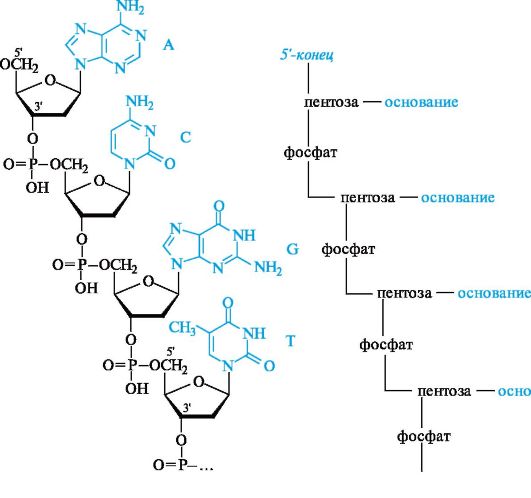
Рис. 14.2. Первичная структура участка цепи ДНК
как d(ApCpGpTp...) или d(A-C-G-T...). Часто букву d опускают, если очевидно, что речь идет о ДНК.
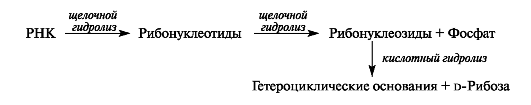
Важной характеристикой нуклеиновых кислот служит нуклеотидный состав, т. е. набор и количественное отношение нуклеотидных компонентов. Нуклеотидный состав устанавливают, как правило, путем исследования продуктов гидролитического расщепления нуклеиновых кислот.
ДНК и РНК различаются поведением в условиях щелочного и кислотного гидролиза. ДНК устойчивы к гидролизу в щелочной среде. РНК легко гидролизуются в мягких условиях в щелочной среде до нуклеотидов, которые, в свою очередь, способны в щелочной среде отщеплять остаток фосфорной кислоты с образованием нуклеозидов. Нуклеозиды в кислой среде гидролизуются до гетероциклических оснований и углеводов.
14.2.2. Вторичная структура ДНК
Под вторичной структурой понимают пространственную организацию полинуклеотидной цепи. Согласно модели Уотсона-Крика молекула ДНК состоит из двух полинуклеотидных цепей, правозакрученных вокруг общей оси с образованием двойной спирали. Пуриновые и пиримидиновые основания направлены внутрь спирали. Между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи возникают водородные связи. Эти основа- ния составляют комплементарные пары.
Водородные связи образуются между аминогруппой одного основания и карбонильной группой другого -NH...O=C-, а также между амидным и иминным атомами азота -NH...N-Например, как показано ниже, между аденином и тимином образуются две водородные связи, и эти основания составляют комплементарную пару, т. е. аденину в одной цепи будет соответствовать тимин в другой цепи. Другую пару комплементарных оснований составляют гуанин и цитозин, между которыми возникают три водородные связи.
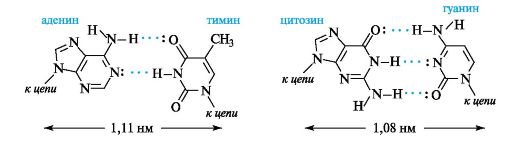
Водородные связи между комплементарными основаниями - один из видов взаимодействий, стабилизирующих двойную спираль. Две цепи ДНК, образующие двойную спираль, не идентичны, но комплементарны между собой. Это означает, что первичная структура, т. е. нуклеотидная последовательность, одной цепи предопределяет первичную структуру второй цепи (рис. 14.3).
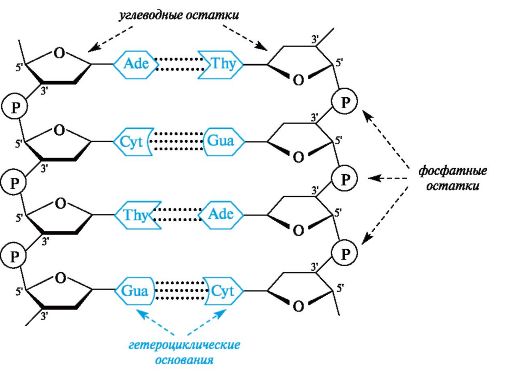
Рис. 14.3. Комплементарность полинуклеотидных цепей в двойной спирали
ДНК
14.3. Нуклеотидные коферменты
Нуклеотиды имеют большое значение не только как строительный материал для нуклеиновых кислот. Они участвуют в биохими- ческих процессах и особенно важны в роли коферментов, т. е. веществ, тесно связанных с ферментами и необходимых для проявления ими ферментативной активности.
14.3.1. Нуклеозидполифосфаты
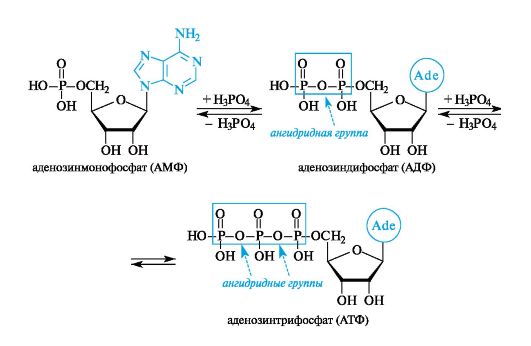
Во всех тканях организма содержатся моно-, ди- и трифосфаты нуклеозидов. Особенно широко известны аденинсодержащие нук- леотиды - аденозин-5'-фосфат (АМР), аденозин-5'-дифосфат (ADP)
и аденозин-5'-трифосфат (ATP) (для этих соединений наряду с приведенными сокращенными обозначениями латинскими буквами в оте- чественной литературе используют сокращения соответствующих русских названий - АМФ, АДФ, АТФ).
Нуклеотиды, фосфорилированные в разной степени, способны к взаимопревращениям путем наращивания или отщепления фос- фатных групп. Дифосфатная группа содержит одну, а трифосфатная - две ангидридные связи, называемые макроэргическими, поскольку они обладают большим запасом энергии. Необходимые для образования такой связи энергетические затраты восполняются за счет энергии, выделяемой в процессе метаболизма углеводов. При расщеплении макроэргической связи Р~О (обозначаемой волнистой линией) выделяется ~32 кДж/моль. С этим связана важнейшая роль АТФ как «поставщика» энергии во всех живых клетках.
В показанных ниже взаимопревращениях АМФ, АДФ и АТФ формулы этих соединений соответствуют их неионизированному состоянию. В физиологических условиях при рН ~7 фосфатные группы почти полностью ионизированы, поэтому в биохимической литературе эти и любые другие нуклеотиды записывают соответственно в виде анионов.
Нуклеозидполифосфаты в биохимических процессах. С участием АТФ и АДФ в организме осуществляется важнейший биохимический процесс - перенос фосфатных групп. Например, образование сложных эфиров (фосфатов) - типичная реакция в метаболизме углеводов. Все стадии гликолиза (превращения глюкозы в пируват) осуществляются только в фосфатной форме. Получение фосфатов гидроксилсодержа- щих соединений можно представить в виде общей схемы.
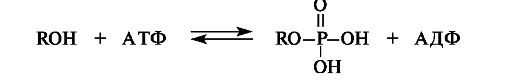
Так, галактоза, образующаяся при расщеплении лактозы, на начальной стадии метаболического превращения в глюкозу взаимо- действует с АТФ с образованием монофосфата.
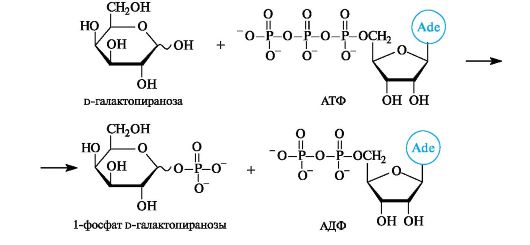
14.3.2. Никотинамиднуклеотиды
Наиболее важными представителями этой группы соединений являются никотинамидадениндинуклеотид (NAD, или в русской литературе НАД) и его фосфат (NADP, или НАДФ). Эти соединения выполняют важную роль коферментов в осуществлении многих
окислительно-восстановительных реакций. В соответствии с этим они могут существовать как в окисленной (НАД+, НАДФ+), так и восстановленной (НАДН, НАДФН) форме.

Структурным фрагментом НАД+ и НАДФ+ является никотинамидный остаток в виде пиридиниевого катиона. В составе НАДН и НАДФН этот фрагмент превращается в остаток 1,4-дигидропиридина.
В ходе биологического дегидрирования субстрат теряет два атома водорода, т. е. два протона и два электрона (2Н+, 2е) или протон и гидрид-ион (Н+ и Н-). Кофермент НАД+ обычно рассматривается как акцептор гидрид-иона Н- (хотя окончательно не установлено, происходит ли перенос атома водорода к этому коферменту одновременно с переносом электрона или эти процессы протекают раздельно).
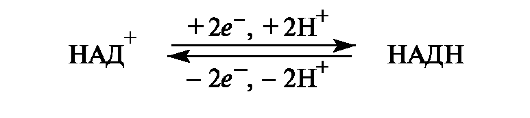
В результате восстановления путем присоединения гидрид-иона к НАД+ пиридиниевое кольцо переходит в 1,4-дигидропиридиновый фрагмент. Этот процесс обратим.
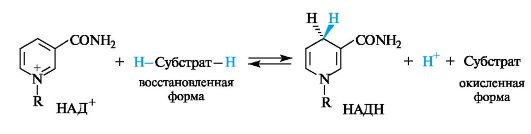
В реакции окисления ароматический пиридиниевый цикл переходит в неароматический 1,4-дигидропиридиновый цикл. В связи с потерей ароматичности возрастает энергия НАДН по сравнению с НАД+. Таким способом НАДН запасает энергию, которая затем расходуется в других биохимических процессах, требующих энергетических затрат.
Типичными примерами биохимических реакций с участием НАД+ служат окисление спиртовых групп в альдегидные (например, пре- вращение ретинола в ретиналь, см. 15.4), а с участием НАДН - восстановление карбонильных групп в спиртовые (превращение пировиноградной кислоты в молочную, см. 9.2.3).