Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 7. СТЕРЕОХИМИЧЕСКИЕ ОСНОВЫ СТРОЕНИЯ МОЛЕКУЛ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Стереохимия (от греч. stereos - пространственный) - это «химия в трех измерениях». Большинство молекул трехмерны (threedimentional, сокращенно 3D). Структурные формулы отражают двумерное (2D) строение молекулы, включающее в себя число, тип и последовательность связывания атомов. Напомним, что соединения, имеющие одинаковый состав, но различное химическое строение, называются структурными изомерами (см. 1.1). Более широкое понятие структуры молекулы (иногда образно называемой молекулярной архитектурой) наряду с понятием химического строения включает стереохимические компоненты - конфигурацию и конформацию, отражающие пространственное строение, т. е. трехмерность молекулы. Молекулы, обладающие одинаковым химическим строением, могут различаться пространственным строением, т. е. существовать в виде пространственных изомеров - стереоизо- меров.
Пространственное строение молекул - это взаимное расположение атомов и атомных групп в трехмерном пространстве.
Стереоизомеры - соединения, в молекулах которых имеется одинаковая последовательность химических связей атомов, но раз- личное расположение этих атомов относительно друг друга в пространстве.
В свою очередь стереоизомеры могут быть конфигурационными и конформационными изомерами, т. е. различаться соответственно конфи- гурацией и конформацией.
7.1. Конфигурация
Конфигурация - это порядок расположения атомов в пространстве без учета различий, возникающих вследствие вращения вокруг одинарных связей.
Конфигурационные изомеры могут переходить друг в друга путем разрыва одних и образования других химических связей и могут существовать раздельно в виде индивидуальных соединений. Они подразделяются на два основных типа - энантиомеры и диастереомеры.
7.1.1. Энантиомерия
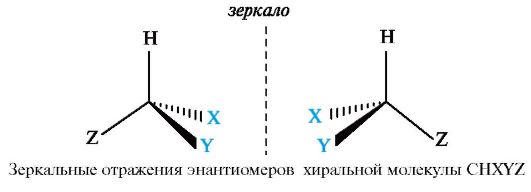
Энантиомеры - стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение.
В виде энантиомеров могут существовать только хиральные молекулы.
Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением. Хиральными (от греч. cheir - рука), или асимметричными, объектами являются левая и правая рука, а также перчатки, ботинки и др. Эти парные предметы представляют собой объект и его зеркальное отражение (рис. 7.1, а). Такие предметы не могут быть полностью совмещены друг с другом.
В то же время существует множество окружающих нас предметов, которые совместимы со своим зеркальным отражением, т. е. они являются ахиральными (симметричными), например тарелки, ложки, стаканы и т. д. Ахиральные предметы обладают по крайней мере одной плоскостью симметрии, которая делит объект на две зеркальноидентичные части (см. рис. 7.1, б).
Подобные взаимоотношения наблюдаются также в мире молекул, т. е. молекулы делятся на хиральные и ахиральные. У ахиральных молекул есть плоскости симметрии, у хиральных их нет.
В хиральных молекулах имеется один или несколько центров хиральности. В органических соединениях в качестве центра хиральности чаще всего выступает асимметрический атом углерода.

Рис. 7.1. Отражение в зеркале хирального объекта (а) и плоскость симметрии, разрезающая ахиральный объект (б)
Асимметрическим является атом углерода, связанный с четырьмя различными атомами или группами.
При изображении стереохимической формулы молекулы символ «С» асимметрического атома углерода обычно опускается.
Чтобы определить, является молекула хиральной или ахиральной, нет необходимости изображать ее стереохимической формулой, достаточно внимательно рассмотреть все атомы углерода в ней. Если находится хотя бы один атом углерода с четырьмя разными заместителями, то этот атом углерода асимметричен и молекула за редкими исключениями (см. 7.1.3) хиральна. Так, из двух спиртов - пропано- ла-2 и бутанола-2 - первый ахирален (две группы СН3 у атома С-2), а второй - хирален, так как в его молекуле у атома С-2 все четыре заместителя разные (Н, ОН, СН3 и С2Н5). Асимметрический атом углерода иногда помечают звездочкой (С*).
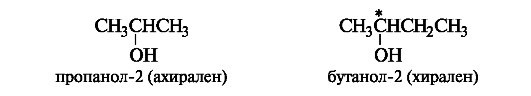
Следовательно, молекула бутанола-2 способна существовать в виде пары энантиомеров, которые не совмещаются в пространстве (рис. 7.2).
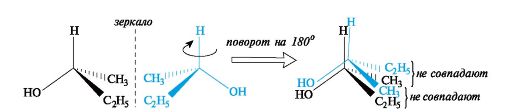
Рис. 7.2. Энантиомеры хиральных молекул бутанола-2 не совмещаются
Свойства энантиомеров. Энантиомеры обладают одинаковыми химическими и физическими свойствами (температуры плавления и кипения, плотность, растворимость и т. д.), но проявляют различную оптическую активность, т. е. способность отклонять плоскость поляризованного света*.
При прохождении такого света через раствор одного из энантиомеров происходит отклонение плоскости поляризации влево, другого - вправо на один тот же по величине угол α. Значение угла α, приведенное к стандартным условиям, является константой оптически активного вещества и называется удельным вращением [α]. Левое вращение обозначается знаком «минус» (-), правое - знаком «плюс» (+), а энантиомеры называют соответственно лево- и правовращающими.
С проявлением оптической активности связаны другие названия энантиомеров - оптические изомеры или оптические антиподы.
Каждое хиральное соединение может иметь и третью, оптически неактивную форму - рацемат. Для кристаллических веществ это обычно не просто механическая смесь кристаллов двух энантиомеров, а новая молекулярная структура, образованная энантиомерами. Рацематы оптически неактивны, так как левое вращение одного энантиомера компенсируется правым вращением равного количества другого. В этом случае перед названием соединения иногда ставят знак «плюс-минус» (?).
7.1.2. Относительная и абсолютная конфигурации
Проекционные формулы Фишера. Для изображения конфигурационных изомеров на плоскости можно пользоваться стереохимическими формулами. Однако удобнее применять более простые в написании проекционные формулы Фишера (проще - проекции Фишера). Рассмотрим их построение на примере молочной (2-гидроксипропа- новой) кислоты.
Тетраэдрическую модель одного из энантиомеров (рис. 7.3) располагают в пространстве так, чтобы цепь атомов углерода оказалась в вертикальном положении, а карбоксильная группа - сверху. Связи с неуглеродными заместителями (Н и ОН) у хирального центра долж-
* Подробнее см. учебник Ремизов А.Н., Максина А.Г., Потапенко А.Я. Медицинская и биологическая физика. 4-е изд., перераб. и дополн. - М.: Дрофа, 2003.- С. 365-375.
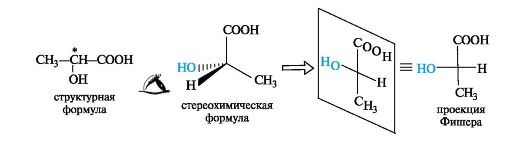
Рис. 7.3. Построение проекционной формулы Фишера (+)-молочной кислоты
ны быть направлены к наблюдателю. После этого модель проецируют на плоскость. Символ асимметрического атома при этом опускается, под ним понимают точку пересечения вертикальной и горизонтальной линий.
Тетраэдрическую модель хиральной молекулы перед проецированием можно располагать в пространстве по-разному, не только так, как показано на рис. 7.3. Необходимо только, чтобы связи, образующие на проекции горизонтальную линию, были направлены к наблюдателю, а вертикальные связи - за плоскость рисунка.
Полученные таким образом проекции можно с помощью несложных преобразований привести к стандартному виду, в котором углеродная цепь расположена вертикально, а старшая группа (в молочной кислоте это СООН) - сверху. Преобразования разрешают две операции:
• в проекционной формуле разрешается менять местами два любых заместителя у одного и того же хирального центра четное число раз (двух перестановок бывает достаточно);
• проекционную формулу разрешается поворачивать в плоскости рисунка на 180? (что эквивалентно двум перестановкам), но не на 90?.
D.L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с позиций стереоизомерии) молекул, таких, как α-аминокислоты, α-гидроксикислоты и им подобные. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой l (от лат. laevus - левый). Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой d (от лат. dexter - правый).
Заметим, что в стандартной проекционной формуле l-глицеринового альдегида группа ОН находится слева, а у d-глицеринового альдегида - справа.

Отнесение к d- или l-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией d- или l-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у l-глицеринового альдегида, поэтому энантиомер (I) относят к l-ряду. Из тех же соображений энантиомер (II) относят к d-ряду. Так из срав- нения проекций Фишера определяют относительную конфигурацию.
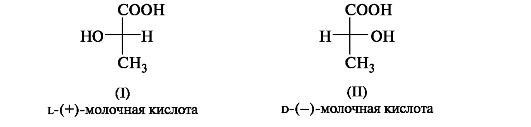
Следует отметить, что l-глицериновый альдегид имеет левое вращение, а l-молочная кислота - правое (и это не единичный случай). Более того, одно и то же вещество может быть как лево-, так и правовращающим в зависимости от условий определения (разные растворители, температура).
Знак вращения плоскости поляризованного света не связан с принадлежностью к d- или l-стереохимическому ряду.
Практическое определение относительной конфигурации оптически активных соединений проводят с помощью химических реакций: либо исследуемое вещество превращают в глицериновый альдегид (или другое вещество с известной относительной конфигурацией), либо, наоборот, из d- или l-глицеринового альдегида получают исследуемое вещество. Разумеется, что в ходе всех этих реакций не должна изменяться конфигурация асимметрического атома углерода.
Произвольное приписание лево- и
правовращающему глицериновому альдегиду условных конфигураций было
вынужденным шагом. В то время абсолютная конфигурация не была известна
ни для одного хирального соединения. Установление абсолютной
конфигурации стало возможным только благодаря развитию
физико-химических методов, особенно рентгеноструктурного анализа, с
помощью которого в
d,l-Система в настоящее время применяется для α-аминокислот, гидроксикислот и (с некоторыми дополнениями) для углеводов
(см. 11.1.1).
R,S-Система обозначения конфигурации. d,L-Система имеет весьма ограниченное применение, так как часто невозможно соотнести конфигурацию какого-либо соединения с глицериновым альдегидом. Универсальной системой обозначения конфигурации центров хиральности является R,S-система (от лат. rectus - прямой, sinister - левый). В ее основе лежит правило последовательности, основанное на старшинстве заместителей, связанных с центром хиральности.
Старшинство заместителей определяется атомным номером элемента, непосредственно связанного с центром хиральности, - чем он больше, тем старше заместитель.
Так, группа ОН старше NH2, которая, в свою очередь, старше любой алкильной группы и даже СООН, поскольку в последней с асимметрическим центром связан атом углерода. Если атомные номера оказываются одинаковыми, старшей считается группа, у которой следующий за углеродом атом имеет больший порядковый номер, причем, если этот атом (обычно кислород) связан двойной связью, он учитывается дважды. В результате следующие группы так располагаются в порядке падения старшинства: -СООН > -СН=О > -СН2ОН.
Для определения конфигурации тетраэдрическую модель соединения располагают в пространстве так, чтобы самый младший замес- титель (в большинстве случаев это атом водорода) был наиболее удален от наблюдателя. Если старшинство трех остальных заместителей убывает по часовой стрелке, то центру хиральности приписывают R-конфигурацию (рис. 7.4, а), если против часовой стрелки - S-конфигурацию (см. рис. 7.4, б), как это видно водителю, находящемуся за рулем (см. рис. 7.4, в).
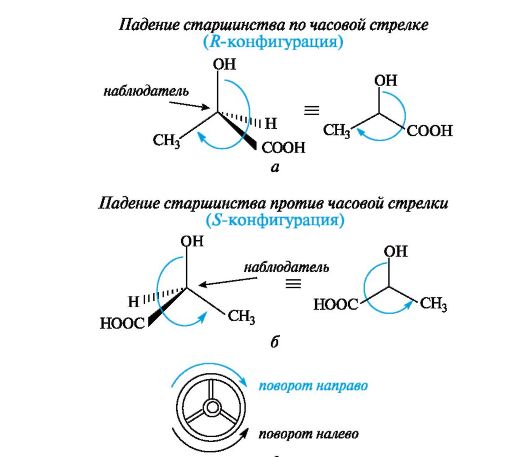
Рис. 7.4. Определение конфигурации энантиомеров молочной кислоты по R,S- системе (объяснение в тексте)
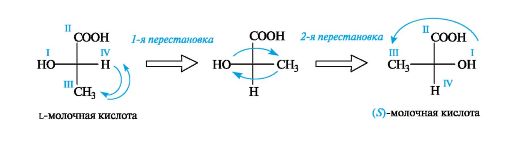
Для обозначения конфигурации по RS-системе можно применить проекции Фишера. Для этого проекцию преобразуют так, чтобы младший заместитель разместился на одной из вертикальных связей, что соответствует его положению за плоскостью чертежа. Если после преобразования проекции старшинство остальных трех заместителей убывает по часовой стрелке, то асимметрический атом имеет R-конфигурацию, и наоборот. Применение такого способа показано на примере l-молочной кислоты (цифрами обозначено старшинство групп).
Существует более простой способ определения R- или S-конфигу- рации по проекции Фишера, в которой младший заместитель (обычно атом Н) расположен на одной из горизонтальных связей. В этом случае не проводят указанных выше перестановок, а сразу определяют старшинство заместителей. Однако, поскольку атом Н находится «не на месте» (что равносильно противоположной конфигурации), падение старшинства будет означать теперь не R-, а S-конфигурацию. Этот способ показан на примере l-яблочной кислоты.
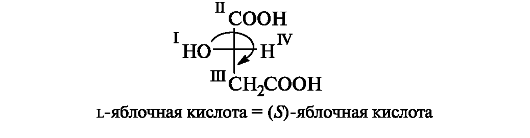
Указанный способ особенно удобен для молекул, содержащих несколько хиральных центров, когда для определения конфигурации каждого из них потребовались бы перестановки.
Между d,l- и RS-системами отсутствует корреляция: это два разных подхода к обозначению конфигурации хиральных центров. Если в d,L-системе сходные по конфигурации соединения образуют стерео- химические ряды, то в RS-системе хиральные центры в соединениях, например, l-ряда, могут иметь как R-, так и S-конфигурацию.
7.1.3. Диастереомерия
Диастереомерами называют стереоизомеры, не относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отражение, т. е. не являющиеся энантиомерами.
Наиболее важными группами диастереомеров являются σ-диастереомеры и π-диастереомеры.
σ-Диастереомеры. Многие биологически важные вещества содержат в молекуле более одного центра хиральности. При этом возрастает число конфигурационных изомеров, которое определяется как 2n, где n - число центров хиральности. Например, при наличии двух асимметрических атомов соединение может существовать в виде четырех стереоизомеров (22 = 4), составляющих две пары энантиомеров.
2-Амино-3-гидроксибутановая кислота имеет два центра хиральности (атомы С-2 и С-3) и, следовательно, должна существовать в виде четырех конфигурационных изомеров, один из которых является природной аминокислотой.
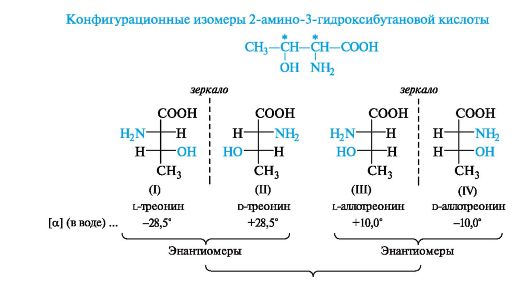
Структуры (I) и (II), соответствующие l- и d-треонину, а также (III) и (IV), соответствующие l- и d-аллотреонину (от греч. alios - другой), относятся друг к другу, как предмет и несовместимое с ним зеркальное отражение, т. е. они представляют собой пары энантиомеров. При сопоставлении структур (I) и (III), (I) и (IV), (II) и (III), (II) и (IV) видно, что в этих парах соединений у одного асимметрического центра конфигурация одинаковая, а у другого - противоположная. Такие пары стереоизомеров представляют собой диастереомеры. Подобные изомеры называют σ-диастереомерами, так как заместители в них связаны с центром хиральности σ-связями.
Аминокислоты и гидроксикислоты с двумя центрами хиральности относят к d- или l-ряду по конфигурации асимметрического атома с наименьшим номером.
Диастереомеры, в отличие от энантиомеров, различаются физическими и химическими свойствами. Например l-треонин, входящий в состав белков, и l-аллотреонин имеют разные значения удельного вращения (как показано выше).
Мезосоединения. Иногда в молекуле содержатся два асимметрических центра и более, но молекула в целом остается симметричной. Примером таких соединений может служить один из стереоизомеров винной (2,3-дигидроксибутандиовой) кислоты.
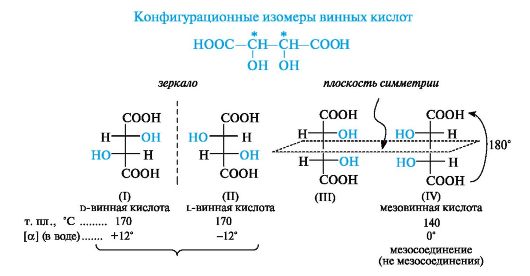
Теоретически эта кислота, в которой имеется два центра хиральности, могла бы существовать в виде четырех стереоизомеров (I)-(IV).
Структуры (I) и (II) соответствуют энантиомерам d- и l-ряда (отнесение проведено по «верхнему» центру хиральности). Может показаться, что структуры (III) и (IV) также соответствуют паре энантиомеров. В действительности это формулы одного и того же соединения - оптически неактивной мезовинной кислоты. В идентичности формул (III) и (IV) легко убедиться, повернув формулу (IV) на 180?, не выводя ее из плоскости. Несмотря на два центра хиральности, молекула мезовинной кислоты в целом является ахиральной, так как имеет плоскость симметрии, проходящую по середине связи С-2-С-3. По отношению к d- и l-винным кислотам мезовинная кислота является диастереомером.
Таким образом, существует три (а не четыре) стереоизомера винных кислот, не считая рацемической формы.
При использовании R,S-системы не возникает трудностей с описанием стереохимии соединений с несколькими хиральными центрами. Для этого определяют конфигурацию каждого центра по R,S-системе и указывают ее (в скобках с соответствующими локантами) перед полным названием. Так, d-винная кислота получит систематическое название (2R,3R)-2,3-дигидроксибутандиовая кислота, а мезовинная кислота будет иметь стереохимические символы (2R,3S)-.
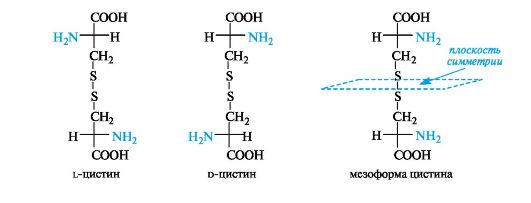
Подобно мезовинной кислоте существует мезоформа α-аминокислоты цистин. При двух центрах хиральности число стереоизомеров цистина равно трем вследствие того, что молекула внутренне сим- метрична.
π-Диастереомеры. К ним относятся конфигурационные изомеры, содержащие π-связь. Этот вид изомерии характерен, в частности, для алкенов. Относительно плоскости π-связи одинаковые заместители у двух атомов углерода могут располагаться по одну (цис) или по разные (транс) стороны. В связи с этим существуют стереоизомеры, известные под названием цис- и транс-изомеров, как показано на примере цис- и транс-бутенов (см. 3.2.2). π-Диастереомерами являются простейшие ненасыщенные дикарбоновые кислоты - малеиновая и фумаровая.

Малеиновая кислота является термодинамически менее стабильным цис-изомером по сравнению с транс-изомером - фумаровой кислотой. Под действием некоторых веществ или ультрафиолетовых лучей между обеими кислотами устанавливается равновесие; при нагревании (~150 ?C) оно смещено в сторону более стабильного транс-изомера.
7.2. Конформации
Вокруг простой связи С-С возможно свободное вращение, в результате которого молекула может принимать различные формы в пространстве. Это видно на стереохимических формулах этана (I) и (II), где отмеченные цветом группы СН3 расположены по-разному относительно другой группы СН3.
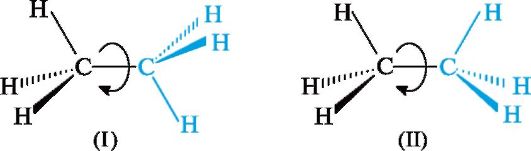
Поворот одной группы СН3 относительно другой происходит без нарушения конфигурации - изменяется лишь взаимное расположение в пространстве атомов водорода.
Геометрические формы молекулы, переходящие друг в друга путем вращения вокруг σ-связей, называют конформациями.
В соответствии с этим конформационными изомерами являются стереоизомеры, различие между которыми вызвано поворотом отдельных участков молекулы вокруг σ-связей.
Конформационные изомеры обычно нельзя выделить в индивидуальном состоянии. Переход различных конформаций молекулы друг в друга происходит без разрыва связей.
7.2.1. Конформации ациклических соединений
Простейшим соединением со связью С-С является этан; рассмотрим две из множества его конформаций. В одной из них (рис. 7.5, а) расстояние между атомами водорода двух групп СН3 наименьшее, поэтому находящиеся друг против друга связи С-Н отталкиваются. Это приводит к увеличению энергии молекулы, а следовательно, к меньшей устойчивости этой конформации. При взгляде вдоль связи С-С видно, что три связи С-Н у каждого атома углерода попарно «заслоняют» друг друга. Такую конформацию называют заслоненной.
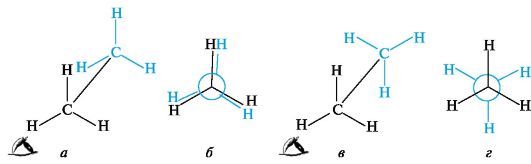
Рис. 7.5. Заслоненная (а, б) и заторможенная (в, г) конформации этана
В другой конформации этана, возникающей при повороте одной из групп СН3 на 60? (см. рис. 7.5, в), атомы водорода двух метильных групп максимально удалены друг от друга. При этом отталкивание электронов связей С-Н будет минимальным, энергия такой конформации также будет минимальной. Эту более устойчивую конформацию называют заторможенной. Разница в энергии обеих конформаций невелика и составляет ~12 кДж/моль; она определяет так называемый энергетический барьер вращения.
Проекционные формулы Ньюмена. Эти формулы (проще - проекции Ньюмена) используют для изображения конформаций на плоскости. Для построения проекции молекулу рассматривают со стороны одного из атомов углерода вдоль его связи с соседним атомом углерода, вокруг которой происходит вращение. При проецировании три связи от ближнего к наблюдателю атома углерода к атомам водорода (или в общем случае - к другим заместителям) располагают в виде трехлучевой звезды с углами 120?. Удаленный от наблюдателя (невидимый) атом углерода изображают в виде круга, от которого также под углом 120? отходят три связи. Проекции Ньюмена также дают наглядное представление о заслоненной (см. рис. 7.5, б) и заторможенной (см. рис. 7.5, г) конформациях.
При обычных условиях конформации этана легко переходят друг в друга, и можно говорить о статистическом наборе различных конформаций, незначительно различающихся по энергии. Выделить в инди- видуальном виде даже более устойчивую конформацию невозможно.
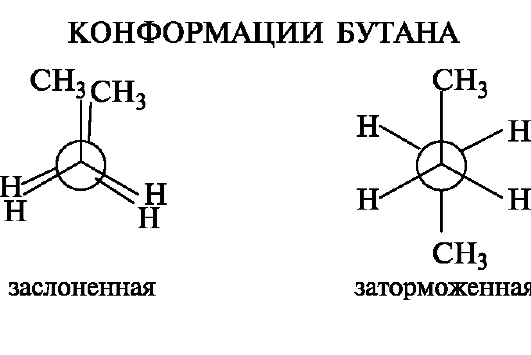
В более сложных молекулах замена атомов водорода при соседних атомах углерода на иные атомы или группы приводит к их взаимному отталкиванию, что сказывается на увеличении потенциальной энергии. Так, в молекуле бутана наименее выгодной будет заслоненная конформация, а самой выгодной - заторможенная конформация с максимально удаленными группами СН3. Разница между энергиями этих конформаций составляет ~25 кДж/моль.
По мере удлинения углеродной цепи в алканах быстро возрастает число конформаций в результате расширения возможностей враще- ния вокруг каждой связи С-С, поэтому длинные углеродные цепи алканов могут принимать множество разнообразных форм, например зигзагообразную (I), нерегулярную (II) и клешневидную (III).
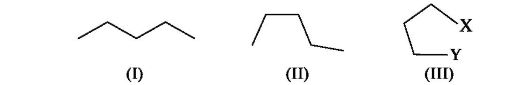
Предпочтительна зигзагообразная конформация, в которой все связи С-С в проекции Ньюмена образуют угол 180?, как в затормо- женной конформации бутана. Например, фрагменты длинноцепочечных пальмитиновой C15H31COOH и стеариновой C17H35COOH кислот в зигзагообразной конформации (рис. 7.6) входят в состав липидов клеточных мембран.

Рис. 7.6. Скелетная формула (а) и молекулярная модель (б) стеариновой кислоты
В клешневидной конформации (III) сближаются атомы углерода, удаленные друг от друга в иных конформациях. Если на достаточно близком расстоянии оказываются функциональные группы, например Х и Y, способные реагировать друг с другом, то в результате внутримолекулярной реакции это приведет к образованию циклического продукта. Такие реакции распространены довольно широко, что связано с выгодностью образования термодинамически устойчивых пяти- и шестичленных циклов.
7.2.2. Конформации шестичленных циклов
Молекула циклогексана не является плоским шестиугольником, так как при плоском строении валентные углы между атомами углерода составляли бы 120?, т. е. существенно отклонялись от величины нормального валентного угла 109,5?, и все атомы водорода находились в невыгодном заслоненном положении. Это привело бы к неустойчивости цикла. В действительности шестичленный цикл наиболее устойчив из всех циклов.
Различные конформации циклогексана возникают в результате частичного вращения вокруг σ-связей между атомами углерода. Из нескольких неплоских конформаций наиболее энергетически выгодна конформация кресла (рис. 7.7), так как в ней все валентные углы между связями С-С равны ~110?, а атомы водорода при соседних атомах углерода не заслоняют друг друга.
В неплоской молекуле можно только условно говорить о расположении атомов водорода «над и под плоскостью». Вместо этого используют другие термины: связи, направленные вдоль вертикальной оси симметрии цикла (на рис. 7.7, а показаны цветом), называют аксиаль- ными (а), а связи, ориентированные от цикла (как бы по экватору, по аналогии с земным шаром), называют экваториальными (е).
При наличии в кольце заместителя более выгодна конформация с экваториальным положением заместителя, как, например, конформация (I) метилциклогексана (рис. 7.8).
Причина меньшей устойчивости конформации (II) с аксиальным расположением метильной группы заключается в 1,3-диаксиальном отталкивании группы СН3 и атомов Н в положениях 3 и 5. В таком
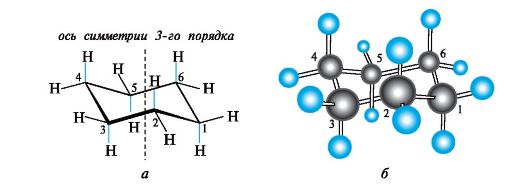
Рис. 7.7. Циклогексан в конформации кресла:
а - скелетная формула; б - шаростержневая модель
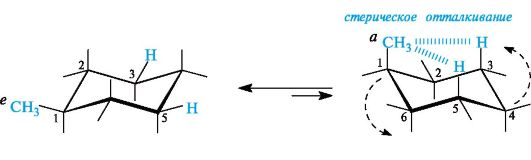
Рис. 7.8. Инверсия цикла молекулы метилциклогексана (показаны не все атомы водорода)
случае цикл подвергается так называемой инверсии, принимая более устойчивую конформацию. Особенно велико отталкивание в про- изводных циклогексана, имеющих положениях 1 и 3 объемные группы.
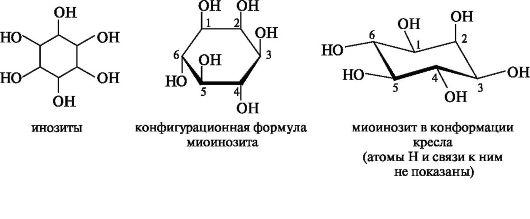
В природе встречается множество производных циклогексанового ряда, среди которых важную роль играют шестиатомные спирты - инозиты. В связи с наличием в их молекулах асимметрических центров инозиты существуют в виде нескольких стереоизомеров, из которых наиболее распространен миоинозит. Молекула миоинозита имеет стабильную конформацию кресла, в которой пять из шести групп ОН находятся в экваториальных положениях.