Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с.
|
|
|
|
ГЛАВА 11. УГЛЕВОДЫ
Углеводы входят в состав клеток и тканей всех растительных и животных организмов. Они имеют большое значение как источники энергии в метаболических процессах.
Углеводы служат основным ингредиентом пищи млекопитающих. Общеизвестный их представитель - глюкоза - содержится в расти- тельных соках, плодах, фруктах и особенно в винограде (отсюда ее название - виноградный сахар). Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций.
Углеводы образуются в растениях в процессе фотосинтеза из диоксида углерода и воды. Для человека основным источником угле- водов является растительная пища.
Углеводы делятся на моносахариды и полисахариды. Моносахариды не гидролизуются с образованием более простых углеводов. Способные к гидролизу полисахариды можно рассматривать как продукты поли- конденсации моносахаридов. Полисахариды являются высокомолекулярными соединениями, макромолекулы которых содержат сотни и тысячи моносахаридных остатков. Промежуточную группу между моно- и полисахаридами составляют олигосахариды (от греч. oligos - немного), имеющие относительно небольшую молекулярную массу.
Составная часть приведенных выше названий - сахариды - связана с употребляющимся до сих пор общим названием углеводов - сахара.
11.1. Моносахариды
11.1.1. Строение и стереоизомерия
Моносахариды, как правило, представляют собой твердые вещества, хорошо растворимые в воде, плохо - в спирте и нерастворимые в большинстве органических растворителей. Почти все моносахариды обладают сладким вкусом.
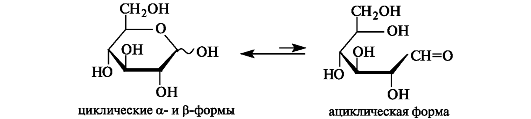
Моносахариды могут существовать как в открытой (оксоформе), так и в циклических формах. В растворе эти изомерные формы находятся в динамическом равновесии.
Открытые формы. Моносахариды (монозы) являются гетерофункциональными соединениями. В их молекулах одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп, т. е. моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды и полигидроксикетоны. Они имеют неразветвленную углеродную цепь.
Моносахариды классифицируют с учетом природы карбонильной группы и длины углеродной цепи. Моносахариды, содержащие аль- дегидную группу, называют альдозами, а кетонную группу (обычно в положении 2) - кетозами (суффикс -оза применяют для названий моносахаридов: глюкоза, галактоза, фруктоза и т. д.). В общем виде строение альдоз и кетоз можно представить следующим образом.
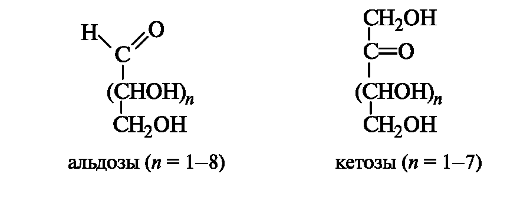
В зависимости от длины углеродной цепи (3-10 атомов) моносахариды делят на триозы, тетрозы, пентозы, гексозы, гептозы и т. д. Наиболее распространены пентозы и гексозы.
Стереоизомерия. Молекулы моносахаридов содержат несколько центров хиральности, что служит причиной существования многих стереоизомеров, отвечающих одной и той же структурной формуле. Например, в альдогексозе имеются четыре асимметрических атома углерода и ей соответствуют 16 стереоизомеров (24), т. е. 8 пар энантиомеров. По сравнению с соответствующими альдозами кетогексозы содержат на один хиральный атом углерода меньше, поэтому число стереоизомеров (23) уменьшается до 8 (4 пары энантиомеров).
Открытые (нециклические) формы моносахаридов изображают в виде проекционных формул Фишера (см. 7.1.2). Углеродную цепь в них записывают вертикально. У альдоз наверху помещают альдегидную группу, у кетоз - соседнюю с карбонильной первичную спиртовую группу. С этих групп начинают нумерацию цепи.
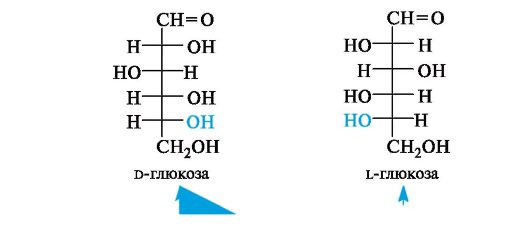
Для обозначения стереохимии используется D,L-система. Отнесение моносахарида к D- или L-ряду проводят по конфигурации хирального центра, наиболее удаленного от оксогруппы, независимо от конфигурации остальных центров! Для пентоз таким «определяющим» центром является атом С-4, а для гексоз - С-5. Положение группы ОН у последнего центра хиральности справа свидетельствует о принадлежности моносахарида к D-ряду, слева - к L-ряду, т. е. по аналогии со стереохимическим стандартом - глицериновым альдегидом (см. 7.1.2).
Известно, что для обозначения стереохимического строения соединений с несколькими центрами хиральности универсальной является R,S-система (см. 7.1.2). Однако громоздкость получаемых при этом названий моносахаридов ограничивает ее практическое применение.
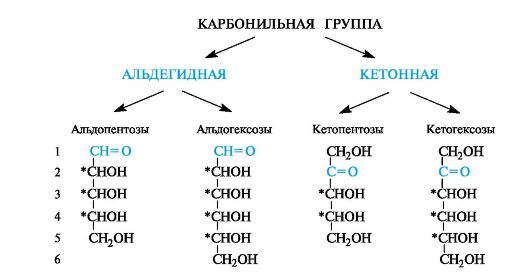
Большинство природных моносахаридов принадлежит к D-ряду. Из альдопентоз часто встречаются D-рибоза и D-ксилоза, а из кетопентоз - D-рибулоза и D-ксилулоза.
Общие названия кетоз образуются введением суффикса -ул в названия соответствующих альдоз: рибозе соответствует рибулоза, ксилозе - ксилулоза (из этого правила выпадает название «фруктоза», которое не имеет связи с названием соответствующей альдозы).
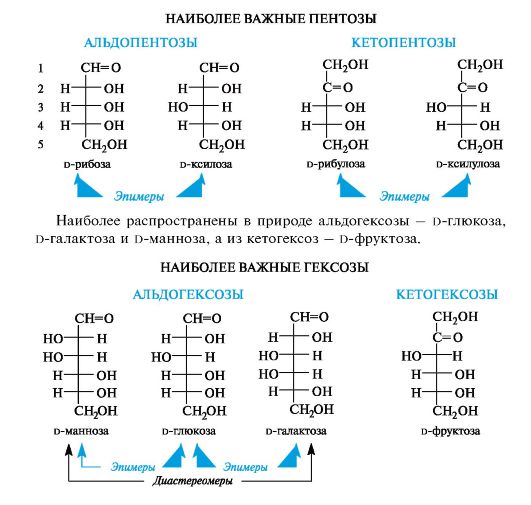
Как видно из приведенных выше формул, стереоизомерные d-альдогексозы, равно как d-альдопентозы и d-кетопентозы, явля- ются диастереомерами. Среди них есть такие, которые отличаются конфигурацией только одного центра хиральности. Диастереомеры, различающиеся конфигурацией только одного асимметрического атома углерода, называются эпимерами. Эпимеры - частный случай диастереомеров. Например, d-глюкоза и d-галактоза отличаются друг
от друга только конфигурацией атома С-4, т. е. являются эпимерами по С-4. Аналогично d-глюкоза и d-манноза - эпимеры по С-2, а d-рибоза и d-ксилоза - по С-3.
Каждой альдозе d-ряда соответствует энантиомер l-ряда с противоположной конфигурацией всех центров хиральности.
Циклические формы. Открытые формы моносахаридов удобны для рассмотрения пространственных отношений между стереоизомерными моносахаридами. В действительности моносахариды по строению являются циклическими полуацеталями. Образование циклических форм моносахаридов можно представить как результат внутримолекулярного взаимодействия карбонильной и гидроксильной групп (см. 9.2.2), содержащихся в молекуле моносахарида.
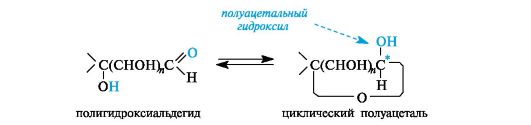
Полуацетальную гидроксильную группу в химии углеводов называют гликозидной. По свойствам она значительно отличается от остальных (спиртовых) гидроксильных групп.
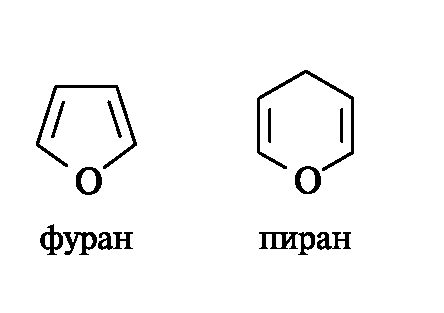
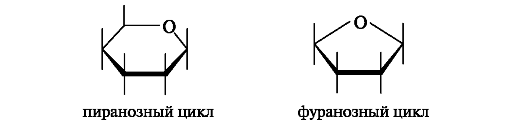
В результате циклизации образуются тер- модинамически более устойчивые фуранозные (пятичленные) и пиранозные (шестичленные) циклы. Названия циклов происходят от названий родственных гетероциклических соединений - фурана и пирана.
Образование этих циклов связано со способностью углеродных цепей моносахаридов принимать достаточно выгодную клешневидную конформацию (см. 7.2.1). Вследствие этого в пространстве оказы- ваются сближенными альдегидная (или кетонная) и гидроксильная при С-4 (или при С-5) группы, т. е. те функциональные группы, в результате взаимодействия которых осуществляется внутримолекулярная циклизация. Если у альдогексоз в реакцию вступит гидроксильная группа при С-5, то возникает полуацеталь с шестичленным пиранозным циклом. Аналогичный цикл у кетогексоз получается при участии в реакции гидроксильной группы при С-6.
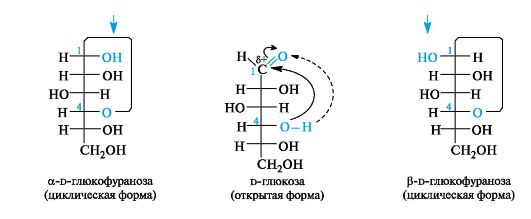
В названиях циклических форм наряду с названием моносахарида указывают размер цикла словами пираноза или фураноза. Если в циклизации у альдогексоз участвует гидроксильная группа при С-4, а у кетогексоз - при С-5, то получаются полуацетали с пятичленным фуранозным циклом.
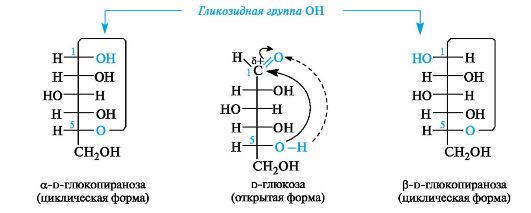
В циклической форме создается дополнительный центр хиральности - атом углерода, ранее входивший в состав карбонильной группы (у альдоз это С-1). Этот атом называют аномерным, а два соот- ветствующих стереоизомера - α- и β-аномерами (рис. 11.1). Аномеры представляют собой частный случай эпимеров.
Различные конфигурации аномерного атома углерода возникают вследствие того, что альдегидная группа из-за поворота вокруг σ-связи С-1-С-2 атакуется нуклеофильным атомом кислорода фак- тически с разных сторон (см. рис. 11.1). В результате образуются полуацетали с противоположными конфигурациями аномерного центра.
У α-аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к d- или l-ряду, а у β-аномера - противоположна. В проекционных формулах Фишера у моносахаридов d-ряда в α-аномере гликозидная группа ОН находится справа, а в β-аномере - слева от углеродной цепи.
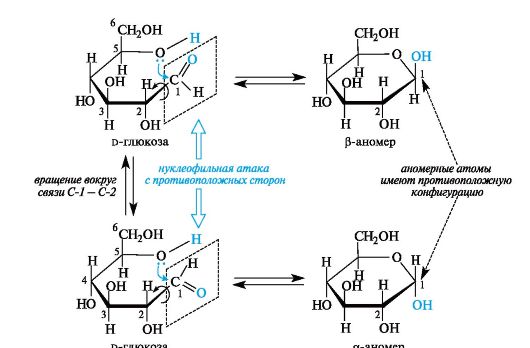
Рис. 11.1. Образование α- и β-аномеров на примере d-глюкозы
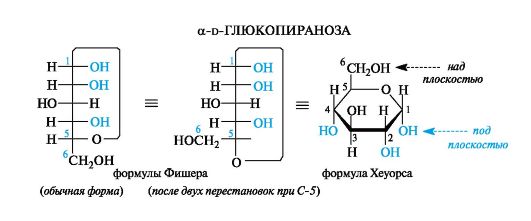
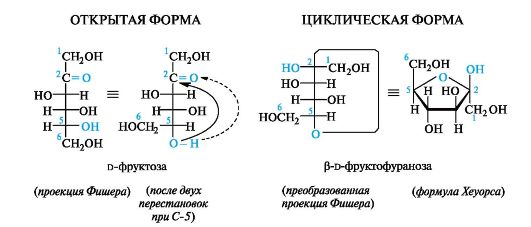
Формулы Хеуорса. Циклические формы моносахаридов изображают в виде перспективных формул Хеуорса, в которых циклы показывают в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагают в пиранозном цикле в дальнем правом углу, в фуранозном - за плоскостью цикла. Символы атомов углерода в циклах не указывают.
Для перехода к формулам Хеуорса циклическую формулу Фишера преобразуют так, чтобы атом кислорода цикла располагался на одной прямой с атомами углерода, входящими в цикл. Это показано ниже на примере a-d-глюкопиранозы путем двух перестановок у атома С-5, что не изменяет конфигурацию этого асимметрического центра (см. 7.1.2). Если преобразованную формулу Фишера расположить горизонтально, как требуют правила написания формул Хеуорса, то заместители, находившиеся справа от вертикальной линии углеродной цепи, окажутся под плоскостью цикла, а те, что были слева, - над этой плоскостью.
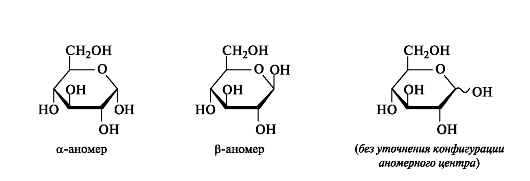
У d-альдогексоз в пиранозной форме (и у d-альдопентоз в фуранозной форме) группа СН2ОН всегда располагается над плоскостью цикла, что служит формальным признаком d-ряда. Гликозидная гид- роксильная группа у a-аномеров d-альдоз оказывается под плоскостью цикла, у β-аномеров - над плоскостью.
С целью упрощения в формулах Хеуорса часто не изображают символы атомов водорода и их связи с атомами углерода цикла. Если речь идет о смеси аномеров или стереоизомере с неизвестной конфигурацией аномерного центра, то положение гликозидной группы ОН обозначают волнистой линией.
d-ГЛЮКОПИРАНОЗА
По аналогичным правилам осуществляется переход и у кетоз, что показано ниже на примере одного из аномеров фуранозной формы d-фруктозы.
11.1.2. Цикло-оксо-таутомерия
В твердом состоянии моносахариды находятся в циклической форме. В зависимости от того, из какого растворителя была перекристаллизована d-глюкоза, она получается либо в виде a-d-глюкопиранозы (из спирта или воды), либо в виде β-d-глюкопиранозы (из пиридина). Они различаются величиной угла удельного вращения [a]D20, а именно +112? у a-аномера и +19? у β-аномера. У свежеприготовленного раствора
каждого аномера при стоянии наблюдается изменение удельного вращения до достижения постоянного, одинакового для того и другого раствора угла вращения +52,5?.
Изменение во времени угла вращения плоскости поляризации света растворами углеводов называют мутаротацией.
Химическая сущность мутаротации состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров - открытой и циклических форм. Такой вид таутомерии называется цикло-оксо-таутомерией.
В растворах равновесие между четырьмя циклическими таутомерами моносахаридов устанавливается через открытую форму - оксоформу. Взаимопревращение a- и β-аномеров друг в друга через про- межуточную оксоформу называется аномеризацией.
Таким образом, в растворе d-глюкоза существует в виде таутомеров: оксоформы и a- и β-аномеров пиранозных и фуранозных циклических форм.
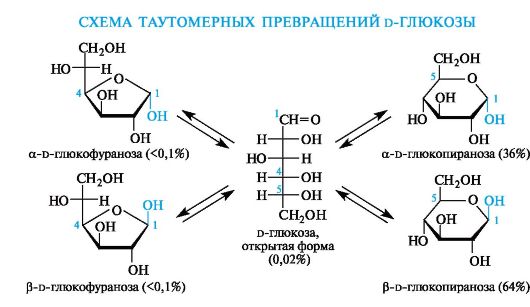
В смеси таутомеров преобладают пиранозные формы. Оксоформа, а также таутомеры с фуранозными циклами содержатся в малых количествах. Важно, однако, не абсолютное содержание того или иного таутомера, а возможность их перехода друг в друга, что приводит к пополнению количества «нужной» формы по мере ее расходова-
ния в каком-либо процессе. Например, несмотря на незначительное содержание оксоформы, глюкоза вступает в реакции, характерные для альдегидной группы.
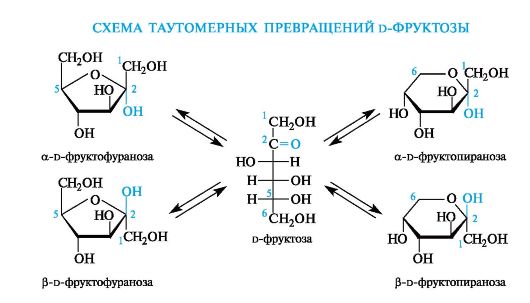
Аналогичные таутомерные превращения происходят в растворах со всеми моносахаридами и большинством известных олигосахаридов. Ниже приведена схема таутомерных превращений важнейшего представителя кетогексоз - d-фруктозы, содержащейся во фруктах, меде, а также входящей в состав сахарозы (см. 11.2.2).
11.1.3. Конформации
Наглядные формулы Хеуорса тем не менее не отражают реальной геометрии молекул моносахаридов, поскольку пяти- и шестичлен- ные циклы не являются плоскими. Так, шестичленный пиранозный цикл, подобно циклогексану, принимает наиболее выгодную конформацию кресла (см. 7.2.2). В распространенных моносахаридах объемная первичноспиртовая группа СН2ОН и большинство гидроксильных групп находятся в более выгодных экваториальных положениях.
Из двух аномеров d-глюкопиранозы в растворе преобладает β-аномер, у которого все заместители, включая полуацетальный гидроксил, расположены экваториально.
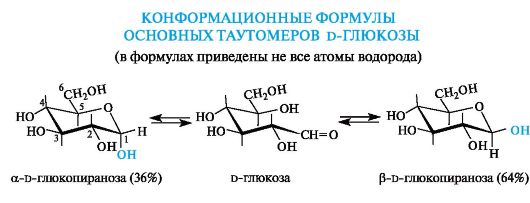
Высокой термодинамической устойчивостью d-глюкопирано- зы, обусловленной ее конформационным строением, объясняется наибольшее распространение d-глюкозы в природе среди моносахаридов.
Конформационное строение моносахаридов предопределяет пространственное расположение полисахаридных цепей, формируя их вторичную структуру.
11.1.4. Неклассические моносахариды
Неклассическими моносахаридами называют ряд соединений, имеющих общую структурную «архитектуру» с обычными, «класси- ческими» моносахаридами (альдозами и кетозами), но отличающихся либо видоизменением одной или нескольких функциональных групп, либо отсутствием некоторых из них. В таких соединениях часто отсутствует группа ОН. Их называют путем добавления к названию исходного моносахарида приставки дезокси- (означает отсутствие группы ОН) и названия «нового» заместителя.
Дезоксисахара. Самый распространенный из дезоксисахаров - 2-дезокси-D-рибоза - является структурным компонентом ДНК. В природных сердечных гликозидах (см. 15.3.5), применяемых в кардиологии, содержатся остатки дидезоксисахаров, например дигитоксозы (сердечные гликозиды наперстянки).
Аминосахара. Эти производные, содержащие вместо гидроксильной группы аминогруппу (обычно при С-2), обладают основными свойствами и образуют с кислотами кристаллические соли. Важнейшими представителями аминосахаров служат аналоги d-глю- козы и d-галактозы, для которых часто используют полутривиаль-
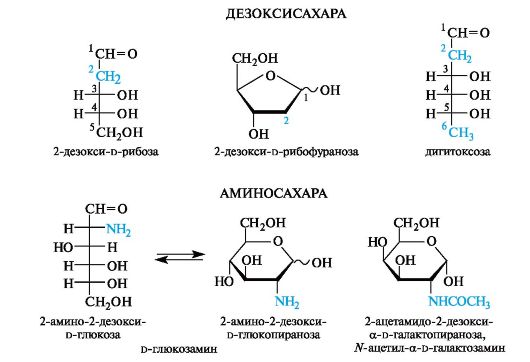
ные названия - d-глюкозамин и d-галактозамин соответственно. Аминогруппа в них может быть ацилирована остатками уксусной, иногда серной кислоты.
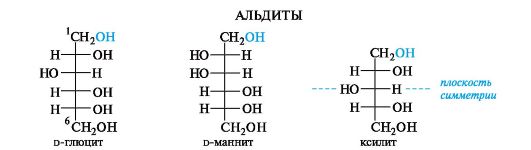
Альдиты. К альдитам, называемым также сахарными спиртами, относят многоатомные спирты, содержащие гидроксильную группу вместо оксогруппы =О. Каждой альдозе соответствует один альдит, в названии которого используют суффикс -ит вместо -озя, например d-маннит (от d-маннозы). Альдиты обладают более симметричной структурой, чем альдозы, поэтому среди них встречаются мезосоединения (внутренне симметричные), например ксилит.
Кислые сахара. Моносахариды, в которых вместо звена СН2ОН содержится группа СООН, имеют общее название уроновые кислоты. В их названиях используют сочетание -уроновяя кислотя вместо суффикса -озя соответствующей альдозы. Заметим, что нумерация цепи ведется от альдегидного атома углерода, а не от карбоксильного, чтобы сохранить структурное родство с исходным моносахаридом.
Уроновые кислоты являются компонентами растительных и бактериальных полисахаридов (см. 13.3.2).
КИСЛЫЕ САХАРА
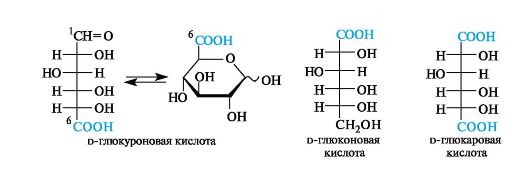
Моносахариды, содержащие карбоксильную группу вместо альдегидной, относят к альдоновым кислотам. Если карбоксильные группы присутствуют на обоих концах углеродной цепи, то такие соединения имеют общее название альдаровые кислоты. В номенклатуре этих типов кислот применяют соответственно сочетания -оновяя кислотя и - яровяя кислотя.
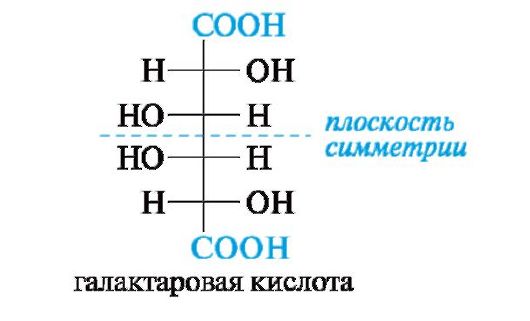
Альдоновые и альдаровые кислоты не могут образовывать таутомерных циклических форм, так как лишены альдегидной группы. Альдаровые кислоты, как и альдиты, могут существовать в виде мезо-соединений (пример - галактаровая кислота).
Аскорбиновая кислота (витамин С). Этот, пожалуй, старейший и самый популярный витамин по структуре близок к моносахаридам и представляет собой γ-лактон кислоты (I). Аскорбиновая кислота
содержится во фруктах, особенно в цитрусовых, ягодах (шиповник, черная смородина), овощах, молоке. В больших масштабах произ- водится в промышленности из d-глюкозы.
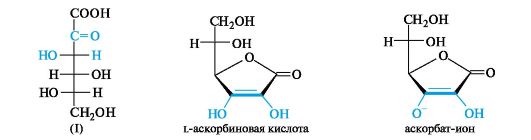
Аскорбиновая кислота проявляет довольно сильные кислотные свойства (рКа 4,2) за счет одной из гидроксильных групп ендиольного фрагмента. При образовании солей γ-лактонное кольцо не размыкается.
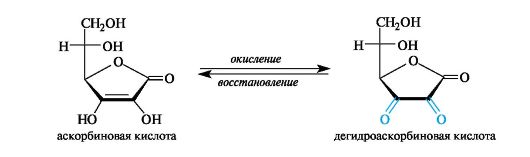
Аскорбиновая кислота обладает сильными восстановительными свойствами. Образующаяся при ее окислении дегидроаскорбиновая кислота легко восстанавливается в аскорбиновую. Этот процесс обеспечивает ряд окислительно-восстановительных реакции в организме.
11.1.5. Химические свойства
Моносахариды - вещества с богатой реакционной способностью. В их молекулах имеются следующие наиболее важные реакционные центры:
• полуацетальный гидроксил (выделен цветом);
• спиртовые гидроксильные группы (все остальные, кроме полуацетальной);
• карбонильная группа ациклической формы.
Гликозиды. К гликозидам относят производные циклических форм углеводов, в которых полуацетальная гидроксильная группа заменена группой OR. Неуглеводный компонент гликозида называют агликоном. Связь между аномерным центром (в альдозах это С-1, в кетозах - С-2) и группой OR называют гликозидной. Гликозиды являются ацеталями циклических форм альдоз или кетоз.
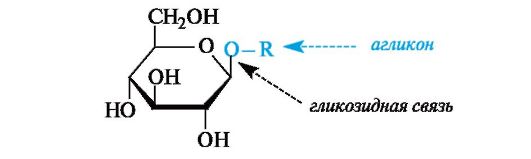
В зависимости от размера оксидного цикла гликозиды подразделяют на пиранозиды и фуранозиды. Гликозиды глюкозы называют глюкозидами, рибозы - рибозидами и т. п. В полном названии гликозидов последовательно указывают наименование радикала R, конфигурацию аномерного центра (α- или β-) и название углеводного остатка с заме- ной суффикса -оза на -озид (см. примеры в схеме реакции ниже).
Гликозиды образуются при взаимодействии моносахаридов со спиртами в условиях кислотного катализа; при этом в реакцию вступает только полуацетальная группа ОН.
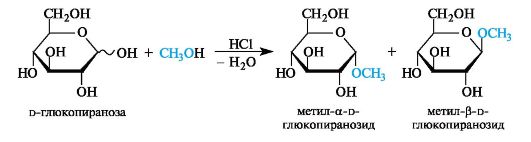
Растворы гликозидов не мутаротируют.
Превращение моносахарида в гликозид - сложный процесс, протекающий через ряд последовательных реакций. В общих чертах он ана-
логичен получению ациклических ацеталей (см. 5.3). Однако вследствие обратимости реакции в растворе в равновесии могут находиться таутомерные формы исходного моносахарида и четыре изомерных гликозида (α- и β-аномеры фуранозидов и пиранозидов).
Как и все ацетали, гликозиды гидролизуются разбавленными кислотами, но проявляют устойчивость к гидролизу в слабощелочной среде. Гидролиз гликозидов приводит к соответствующим спиртам и моносахаридам и представляет собой реакцию, обратную их образованию. Ферментативный гидролиз гликозидов лежит в основе расщепления полисахаридов, осуществляемого в животных организмах.
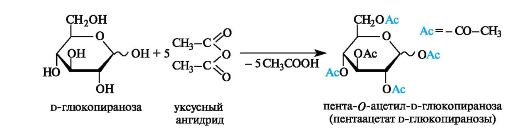
Сложные эфиры. Моносахариды легко ацилируются ангидридами органических кислот, образуя сложные эфиры с участием всех гидроксильных групп. Например, при взаимодействии с уксусным ангидридом получаются ацетильные производные моносахаридов. Сложные эфиры моносахаридов гидролизуются как в кислой, так и в щелочной средах.
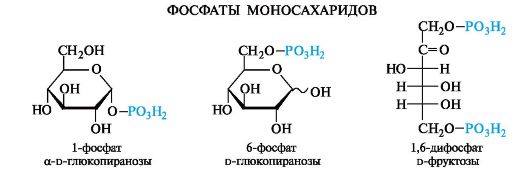
Большое значение имеют эфиры неорганических кислот, в частности эфиры фосфорной кислоты - фосфаты. Они содержатся во всех растительных и животных организмах и представляют собой метаболически активные формы моносахаридов. Наиболее важную роль играют фосфаты d-глюкозы и d-фруктозы.
Эфиры серной кислоты - сульфаты - входят в состав полисахаридов соединительной ткани (см. 11.3.2).
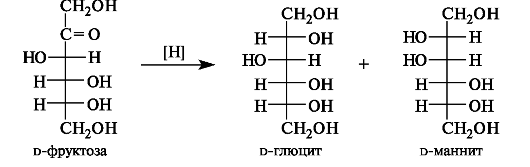
Восстановление. При восстановлении моносахаридов (их альдегидной или кетонной группы) образуются альдиты.
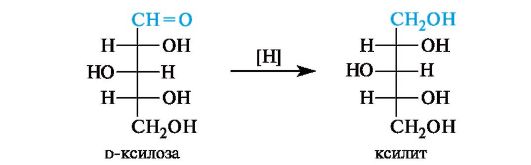
Шестиатомные спирты - D-глюцит (сорбит) и D-маннит - получаются при восстановлении соответственно глюкозы и маннозы. Альдиты легко растворимы в воде, обладают сладким вкусом, некоторые из них (ксилит и сорбит) используются как заменители сахара для больных сахарным диабетом.
При восстановлении альдоз получается лишь один полиол, при восстановлении кетоз - смесь двух полиолов; например, из d-фруктозы образуются d-глюцит и d-маннит.
Окисление. Реакции окисления используют для обнаружения моносахаридов, в частности глюкозы, в биологических жидкостях (моча, кровь).
В молекуле моносахарида окислению может подвергаться любой атом углерода, но легче всего окисляется альдегидная группа альдоз в открытой форме.
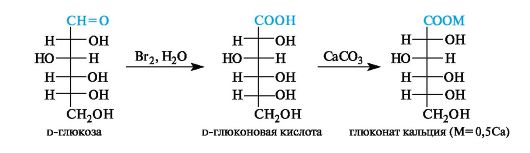
Мягкими окислителями (бромная вода) можно окислить альдегидную группу в карбоксильную, не затрагивая других групп. При
этом образуются альдоновые кислоты. Так, при окислении d-глюкозы бромной водой получается d-глюконовая кислота. В медицине используется ее кальциевая соль - глюконат кальция.
Действие более сильных окислителей, таких, как азотная кислота, перманганат калия, и даже ионов Cu2+ или Ag+ приводит к глубокому распаду моносахаридов с разрывом углерод-углеродных связей. Углеродная цепь сохраняется только в отдельных случаях, например при окислении d-глюкозы в d-глюкаровую кислоту или d-галактозы в галактаровую (слизевую) кислоту.
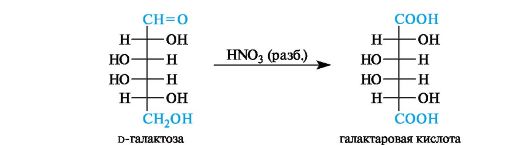
Получающаяся галактаровая кислота трудно растворима в воде и выпадает в осадок, что используется для обнаружения галактозы указанным методом.
Альдозы легко окисляются комплексными соединениями меди(11) и серебра - соответственно реактивами Фелинга и Толленса (см. также 5.5). Такие реакции возможны в связи с присутствием альдегидной (открытой) формы в таутомерной смеси.
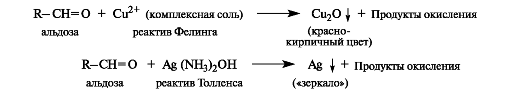
Благодаря способности восстанавливать ионы Cu2+ или Ag+ моносахариды и их производные, содержащие потенциальную альдегидную группу, называют восстанавливающими.
Гликозиды не проявляют восстановительной способности и не дают положительной пробы с этими реактивами. Однако кетозы способны восстанавливать катионы металлов, так как в щелочной среде они изомеризуются в альдозы.
Прямое окисление звена СН2ОН моносахаридов в карбоксильную группу невозможно из-за присутствия более склонной к окислению альдегидной группы, поэтому для превращения моносахарида в уроновую кислоту окислению подвергают моносахарид с защищенной альдегидной группой, например, в виде гликозида.
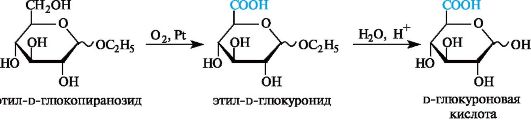
Образование гликозидов глюкуроновой кислоты - глюкуронидов - является примером биосинтетического процесса конъюгации, т. е. процесса связывания лекарственных средств или их метаболитов с биогенными веществами, а также с токсичными веществами с последующим выведением из организма с мочой.
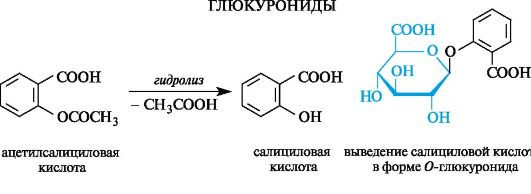
11.2. Олигосахариды
Олигосахариды - углеводы, построенные из нескольких остатков моносахаридов (от 2 до 10), связанных между собой гликозидной связью.
Простейшими олигосахаридами являются дисахариды (биозы), которые состоят из остатков двух моносахаридов и представляют собой гликозиды (полные ацетали), в которых один из остатков выполняет роль агликона. С ацетальной природой связана способность дисахаридов гидролизоваться в кислой среде с образованием моносахаридов.
Существуют два типа связывания моносахаридных остатков:
• за счет полуацетальной группы ОН одного моносахарида и любой спиртовой группы другого (в примере ниже - гидроксил при С-4); это группа восстанавливающих дисахаридов;
• с участием полуацетальных групп ОН обоих моносахаридов; это группа невосстанавливающих дисахаридов.
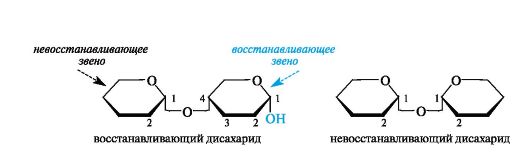
11.2.1. Восстанавливающие дисахариды
В этих дисахаридах один из моносахаридных остатков участвует в образовании гликозидной связи за счет гидроксильной группы (чаще всего при С-4). В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла.
Восстановительные свойства таких дисахаридов и мутаротация их растворов обусловлены цикло-оксо-таутомерией.
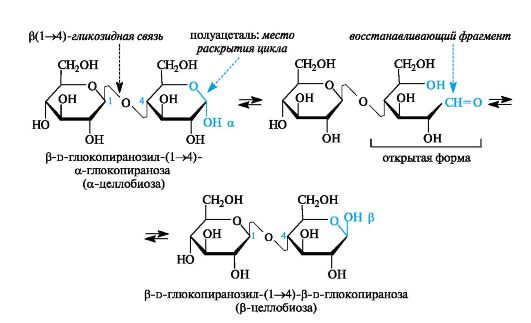
Представителями восстанавливающих дисахаридов являются мальтоза, целлобиоза, лактоза.
Мальтоза. Этот дисахарид называют еще солодовым сахаром (от лат. maltum - солод). Он является основным продуктом расщепления крахмала под действием фермента β-амилазы, выделяемого слюнной железой, а также содержащегося в солоде (проросших, а затем высушенных и измельченных зернах хлебных злаков). Мальтоза имеет менее сладкий вкус, чем сахароза.
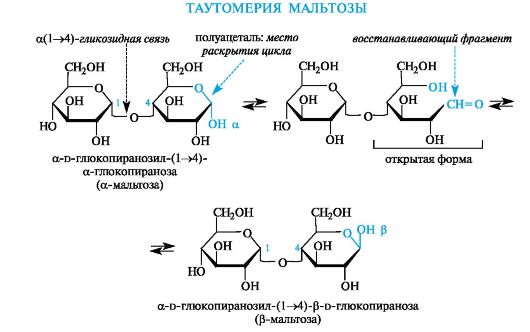
Мальтоза - дисахарид, в котором остатки двух молекул d-глюко- пиранозы связаны а(1^4)-гликозидной связью.
Аномерный атом углерода, участвующий в образовании этой связи, имеет а-конфигурацию, а аномерный атом с полуацетальной гидроксильной группой может иметь как α-, так и β-конфигурацию (соответственно а- и β-мальтоза).
В систематическом названии дисахарида «первая» молекула приобретает суффикс -озил, а у «второй» сохраняется суффикс -оза. Кроме того, в полном названии указывают конфигурации обоих аномерных атомов углерода.
Целлобиоза. Этот дисахарид образуется при неполном гидролизе полисахарида целлюлозы.
Целлобиоза - дисахарид, в котором остатки двух молекул d-глю- копиранозы связаны β(1-4)-гликозидной связью.
Отличие целлобиозы от мальтозы состоит в том, что аномерный атом углерода, участвующий в образовании гликозидной связи, имеет β-конфигурацию.
Мальтоза расщепляется ферментом α-глюкозидазой, который не активен по отношению к целлобиозе. Целлобиоза способна расщепляться ферментом β-глюкозидазой, но этот фермент в человеческом организме отсутствует, поэтому целлобиоза и соответствующий полисахарид целлюлоза не могут перерабатываться в организме человека. Жвачные животные могут питаться целлюлозой (клетчаткой) трав, поскольку находящиеся в их желудочно-кишечном тракте бактерии обладают β-глюкозидазой.
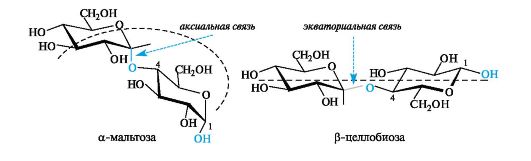
Конфигурационное различие между мальтозой и целлобиозой влечет за собой и конформационное различие: α-гликозидная связь в мальтозе расположена аксиально, а β-гликозидная связь в целло- биозе - экваториально. Конформационное состояние дисахаридов служит первопричиной линейного строения целлюлозы, в состав которой входит целлобиоза, и клубкообразного строения амилозы (крахмал), построенной из мальтозных единиц.
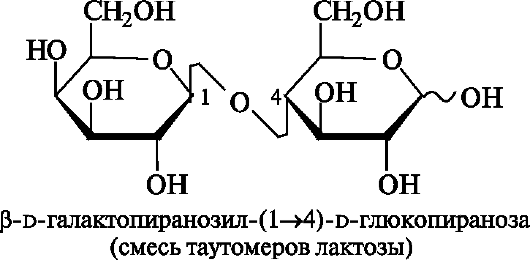
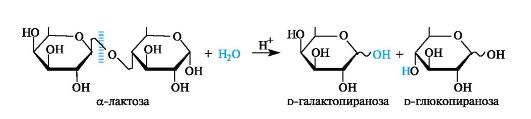
Лактоза содержится в молоке (4-5%) и получается из молочной сыворотки после отделения творога (отсюда и ее название «молочный сахар»).
Лактоза - дисахарид, в котором остатки d-галактопиранозы и d-глюкопиранозы связаны Р(1-4)-гликозидной связью.
Участвующий в образовании этой связи аномерный атом углерода d-галактопиранозы имеет β-конфигурацию. Аномерный атом глюкопиранозного фрагмента может иметь как α-, так и β-конфигурацию (соответственно α- и β-лактоза).
11.2.2. Невосстанавливающие дисахариды
Важнейшим из невосстанавливающих дисахаридов является сахароза. Ее источником служат сахарный тростник, сахарная свекла (до 28% от сухого вещества), соки растений и плодов.
Сахароза - дисахарид, в котором остатки a-d-глюкопиранозы и β-d-фруктофуранозы связаны гликозидными связями за счет полуацетальных гидроксильных групп каждого моносахарида.
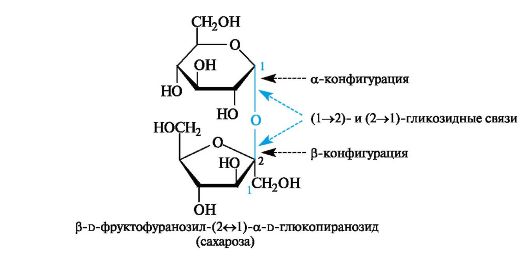
Поскольку в молекуле сахарозы отсутствуют полуацетальные гидроксильные группы, она неспособна к цикло-оксо-таутомерии. Растворы сахарозы не мутаротируют.
11.2.3. Химические свойства
По химической сути олигосахариды являются гликозидами, а восстанавливающие олигосахариды обладают еще и признаками моносахаридов, так как содержат потенциальную альдегидную группу (в открытой форме) и полуацетальный гидроксил. Этим и определяется их химическое поведение. Они вступают во многие реакции, свойственные моносахаридам: образуют сложные эфиры, способны окисляться и восстанавливаться под действием тех же реагентов.
Наиболее характерной реакцией дисахаридов является кислотный гидролиз, приводящий к расщеплению гликозидной связи с образованием моносахаридов (во всех таутомерных формах). В общих чертах эта реакция аналогична гидролизу алкилгликозидов (см. 11.1.5).
11.3. Полисахариды
Полисахариды составляют основную массу органической материи в биосфере Земли. Они выполняют три важные биологические функции, выступая в роли структурных компонентов клеток и тканей, энергетического резерва и защитных веществ.
Полисахариды (гликаны) - высокомолекулярные углеводы. По химической природе они являются полигликозидами (полиацеталями).
По принципу строения полисахариды не отличаются от восстанавливающих олигосахаридов (см. 11.2). Каждое звено моносахарида связано гликозидными связями с предыдущим и последующим зве- ньями. При этом для связи с последующим звеном предоставляется полуацетальная гидроксильная группа, а с предыдущим - спиртовая группа. Различие заключается лишь в количестве моносахаридных остатков: полисахариды могут содержать их сотни и даже тысячи.
В полисахаридах растительного происхождения наиболее часто встречаются (1-4)-гликозидные связи, а в полисахаридах животно- го и бактериального происхождения имеются связи и других типов. На одном конце полимерной цепи находится остаток восстанавливающего моносахарида. Поскольку его доля во всей макромолекуле очень мала, полисахариды практически не проявляют восстановительных свойств.
Гликозидная природа полисахаридов обусловливает их гидролиз в кислой и устойчивость в щелочной средах. Полный гидролиз приводит к образованию моносахаридов или их производных, неполный - к ряду промежуточных олигосахаридов, в том числе и дисахаридов.
Полисахариды имеют большую молекулярную массу. Им присущ типичный для высокомолекулярных веществ более высокий уровень структурной организации макромолекул. Наряду с первичной структурой, т. е. с определенной последовательностью мономерных остатков, важную роль играет вторичная структура, определяемая пространственным расположением макромолекулярной цепи.
Полисахаридные цепи могут быть разветвленными или неразветвленными (линейными).
Полисахариды делят на группы:
• гомополисахаридов, состоящих из остатков одного моносахарида;
• гетерополисахаридов, состоящих из остатков разных моносахаридов.
К гомополисахаридам относятся многие полисахариды растительного (крахмал, целлюлоза, пектиновые вещества), животного (гликоген, хитин) и бактериального (декстраны) происхождения.
Гетерополисахариды, к числу которых относятся многие животные и бактериальные полисахариды, изучены меньше, но играют важную биологическую роль. Гетерополисахариды в организме связаны с белками и образуют сложные надмолекулярные комплексы.
11.3.1. Гомополисахариды
Крахмал. Этот полисахарид состоит из полимеров двух типов, построенных из d-глюкопиранозы: амилозы (10-20%) и амилопектина (80-90%). Крахмал образуется в растениях в процессе фотосинтеза и «запасается» в клубнях, корнях, семенах.
Крахмал - белое аморфное вещество. В холодной воде нерастворим, в горячей набухает и некоторая часть его постепенно растворяется. При быстром нагревании крахмала из-за содержащейся в нем влаги (10-20%) происходит гидролитическое расщепление макромолекулярной цепи на более мелкие осколки и образуется смесь полисахаридов, называемых декстринами. Декстрины лучше растворяются в воде, чем крахмал.
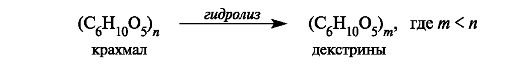
Такой процесс расщепления крахмала, или декстринизация, осуществляется при хлебопечении. Крахмал муки, превращенный в де- кстрины, легче усваивается вследствие большей растворимости.
Амилоза - полисахарид, в котором остатки d-глюкопиранозы связаны а(1-4)-гликозидными связями, т. е. дисахаридным фрагмен- том амилозы является мальтоза.
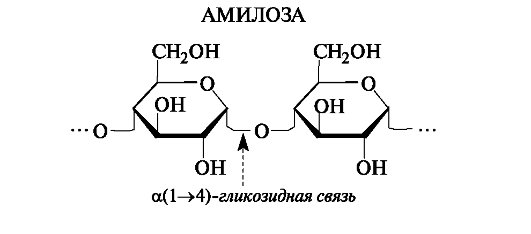
Цепь амилозы неразветвленная, включает до тысячи глюкозных остатков, молекулярная масса до 160 тыс.
По данным рентгеноструктурного анализа, макромолекула амилозы свернута в спираль (рис. 11.2). На каждый виток спирали приходится шесть моносахаридных звеньев. Во внутренний канал спирали могут входить соответствующие по размеру молекулы, например молекулы иода, образуя комплексы, называемые соединениями включения. Комплекс амилозы с иодом имеет синий цвет. Это используется в аналитических целях для открытия как крахмала, так и иода (иодкрахмальная проба).
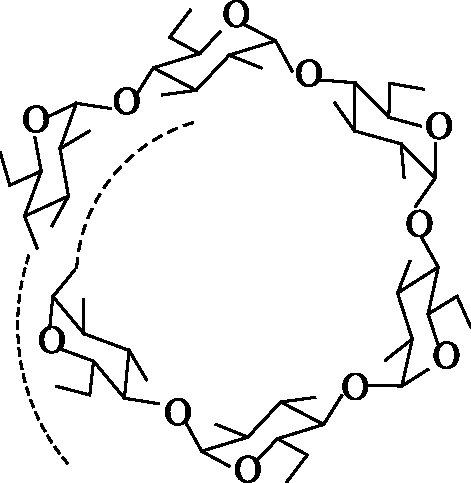
Рис. 11.2. Спиралевидная структура амилозы (вид вдоль оси спирали)
Амилопектин в отличие от амилозы имеет разветвленное строение (рис. 11.3). Его молекулярная масса достигает 1-6 млн.
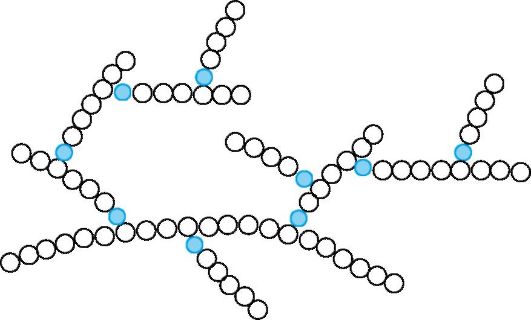
Рис. 11.3. Разветвленная макромолекула амилопектина (цветные кружки - места ответвления боковых цепей)
Амилопектин - разветвленный полисахарид, в цепях которого остатки D-глюкопиранозы связаны а(1^4)-гликозидными связями, а в точках разветвления - а(1^6)-связями. Между точками разветвления располагаются 20-25 глюкозных остатков.
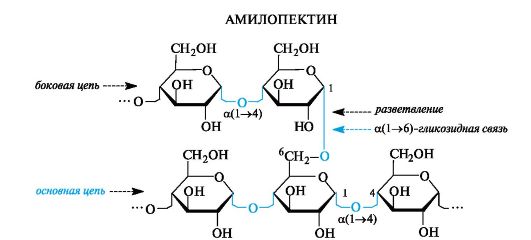
Гидролиз крахмала в желудочно-кишечном тракте происходит под действием ферментов, расщепляющих а(1-4)- и а(1-6)-гликозидные связи. Конечными продуктами гидролиза являются глюкоза и мальтоза.
Гликоген. В животных организмах этот полисахарид является структурным и функциональным аналогом растительного крахмала. По строению он подобен амилопектину, но имеет еще большее разветвление цепей. Обычно между точками разветвления содержатся 10-12, иногда даже 6 глюкозных звеньев. Условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции, так как только при множестве концевых остатков можно обеспечить быстрое отщепление нужного количества молекул глюкозы.
Молекулярная масса гликогена необычайно велика и достигает 100 млн. Такой размер макромолекул содействует выполнению функции резервного углевода. Так, макромолекула гликогена из-за большого размера не проходит через мембрану и остается внутри клетки, пока не возникнет потребность в энергии.
Гидролиз гликогена в кислой среде протекает очень легко с количественным выходом глюкозы. Это используют в анализе тканей на содержание гликогена по количеству образовавшейся глюкозы.
Аналогично гликогену в животных организмах такую же роль резервного полисахарида в растениях выполняет амилопектин, име- ющий менее разветвленное строение. Это связано с тем, что в растениях значительно медленнее протекают метаболические процессы и не требуется быстрого притока энергии, как иногда необходимо животному организму (стрессовые ситуации, физическое или умственное напряжение).
Целлюлоза. Этот полисахарид, называемый также клетчаткой, является наиболее распространенным растительным полисахаридом. Целлюлоза обладает большой механической прочностью и выполняет функцию опорного материала растений. Древесина содержит 50-70% целлюлозы; хлопок представляет собой почти чистую целлюлозу. Целлюлоза является важным сырьем для ряда отраслей промышленности (целлюлозно-бумажной, текстильной и т. п.).
Целлюлоза - линейный полисахарид, в котором остатки d-глюко- пиранозы связаны Р(1-4)-гликозидными связями. Дисахаридный фрагмент целлюлозы представляет собой целлобиозу.
Макромолекулярная цепь не имеет разветвлений, в ней содержится 2,5-12 тыс. глюкозных остатков, что соответствует молеку- лярной массе от 400 тыс. до 1-2 млн.
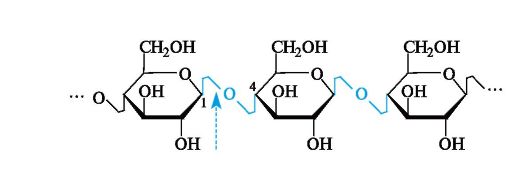
β-Конфигурация аномерного атома углерода приводит к тому, что макромолекула целлюллозы имеет строго линейное строение. Этому способствует образование водородных связей внутри цепи, а также между соседними цепями.
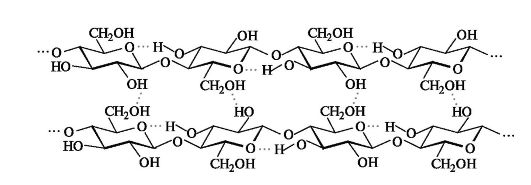
Такая упаковка цепей обеспечивает высокую механическую прочность, волокнистость, нерастворимость в воде и химическую инертность, что делает целлюлозу прекрасным материалом для построения клеточных стенок растений. Целлюлоза не расщепляется обычными ферментами желудочно-кишечного тракта, но необходима для нормального питания как балластное вещество.
Большое практическое значение имеют эфирные производные целлюлозы: ацетаты (искусственный шелк), нитраты (взрывчатые вещества, коллоксилин) и другие (вискозное волокно, целлофан).
11.3.2. Гетерополисахариды
Полисахариды соединительной ткани. Среди полисахаридов соединительной ткани наиболее полно изучены хондроитинсульфаты (кожа, хрящи, сухожилия), гиалуроновая кислота (стекловидное тело глаза, пуповина, хрящи, суставная жидкость), гепарин (печень). По структуре эти полисахариды имеют некоторые общие черты: их неразветвленные цепи состоят из дисахаридных остатков, в состав которых входят уроновая кислота (d-глюкуроновая, d-галактуроно- вая, l-идуроновая - эпимер d-глюкуроновой кислоты по С-5) и аминосахар (N-ацетилглюкозамин, N-ацетилгалактозамин). Некоторые из них содержат остатки серной кислоты.
Полисахариды соединительной ткани иногда называют кислыми мукополисахаридами (от лат. mucus - слизь), поскольку они содержат карбоксильные группы и сульфогруппы.
Хондроитинсульфаты. Они состоят из дисахаридных остатков N-ацетилированного хондрозина, соединенных β(1-4)-гликозидными связями.
N-Ацетилхондрозин построен из остатков D-глюкуроновой кислоты и N-ацетил-D-галактозамина, связанных β(1-3)-гликозидной связью.
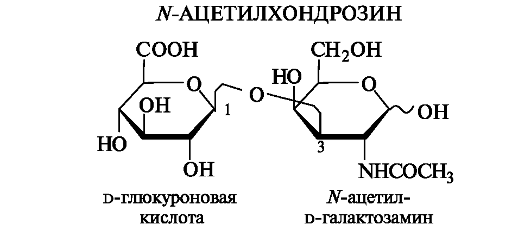
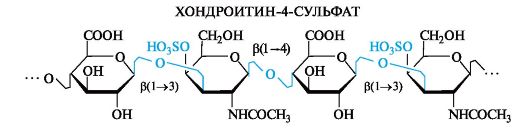
Как свидетельствует название, эти полисахариды являются эфирами серной кислоты (сульфатами). Сульфатная группа образует эфирную связь с гидроксильной группой N-ацетил-D-галактозамина, находящейся в положении 4 или 6. Соответственно различают хон- дроитин-4-сульфат и хондроитин-6-сульфат. Молекулярная масса хондроитинсульфатов составляет 10-60 тыс.
Гиалуроновая кислота. Этот полисахарид построен из дисахаридных остатков, соединенных β(1-4)-гликозидными связями.
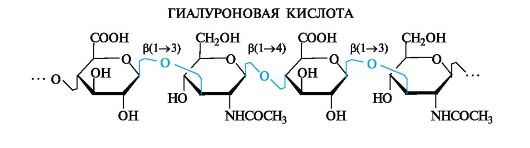
Дисахаридный фрагмент состоит из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, связанных β(1-3)-гликозидной связью.
Гепарин. В гепарине в состав повторяющихся дисахаридных еди- ниц входят остатки d-глюкозамина и одной из уроновых кислот - d-глюкуроновой или l-идуроновой. В количественном отношении преобладает l-идуроновая кислота. Внутри дисахаридного фрагмента осуществляется α(1-4)-гликозидная связь, а между дисахаридными фрагментами - α(1-4)-связь, если фрагмент оканчивается l-идуро- новой кислотой, и β(1-4)-связь, если d-глюкуроновой кислотой.
Аминогруппа у большинства остатков глюкозамина сульфатирована, а у некоторых из них ацетилирована. Кроме того, сульфатные группы содержатся у ряда остатков l-идуроновой кислоты (в положе- нии 2), а также глюкозамина (в положении 6). Остатки d-глюкуроно- вой кислоты не сульфатированы. В среднем на один дисахаридный фрагмент приходятся 2,5-3 сульфатные группы. Молекулярная масса гепарина равна 16-20 тыс.
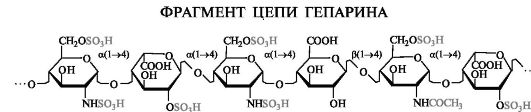
Гепарин препятствует свертыванию крови, т. е. проявляет антикоагулянтные свойства.
Многие гетерополисахариды, включая рассмотренные выше, содержатся не в свободном, а в связанном виде с полипептидными цепями. Такие высокомолекулярные соединения относят к смешан- ным биополимерам, для которых в настоящее время используется термин гликоконъюгаты.