Биология: учебник: в 2 т. / под ред. В. Н. Ярыгина. - 2011. - Т. 1. - 736 с. : ил.
|
|
|
|
Глава 8. ЗАКОНОМЕРНОСТИ ИНДИВИДУАЛЬНОГО РАЗВИТИЯ ОРГАНИЗМОВ
8.1. основные концепции в биологии индивидуального развития
В предыдущих главах были рассмотрены генетические закономерности, определяющие формирование определенного фенотипа, изложено основное содержание стадий онтогенеза, последовательно и закономерно сменяющих друг друга. Все эти сведения не дают, однако, ответа на вопрос, почему и каким образом генотип реализуется в фенотип в виде тех или иных клеточных и системных процессов, в виде сложных пространственных и упорядоченных во времени онтогенетических преобразований.
При сравнении зиготы и половозрелой особи, которые, по сути, являются двумя разными онтогенетическими стадиями существования одного и того же организма, обнаруживаются очевидные различия, касающиеся по крайней мере размеров и формы. Начиная с XVII в. ученые пытались познать и объяснить процессы, приводящие к этим количественным и качественным изменениям особи.
Первоначально возникла гипотеза, согласно которой онтогенез рассматривали лишь как рост расположенных в определенном пространственном порядке предсуществующих структур и частей будущего организма. В рамках этой гипотезы, получившей название преформизма, каких-либо новообразований или преобразований структур в индивидуальном развитии не происходит. Логическое завершение идеи преформизма заключается в допущении абсурдной мысли о «заготов-ленности» в зиготе и даже в половых клетках прародителей структур организмов всех последующих поколений, как бы вложенных последовательно наподобие деревянных матрешек.
Альтернативная концепция эпигенеза была сформулирована в середине XVIII в. Ф.К. Вольфом, впервые обнаружившим новообразование нервной трубки и кишечника в ходе эмбрионального развития. Индивидуальное развитие стали связывать целиком с качественными
изменениями, полагая, что структуры и части организма возникают как новообразования из бесструктурной яйцеклетки.
В XIX в. К. Бэр впервые описал яйцо млекопитающих, в том числе и человека, а также зародышевые листки и обнаружил сходство плана строения зародышей различных классов позвоночных - рыб, амфибий, рептилий, птиц, млекопитающих. Он же обратил внимание на преемственность в этапах развития - от более простого к более сложному. Бэр рассматривал онтогенез не как предобразование, не как новообразование структур, а как их преобразование, что вполне согласуется с современными представлениями.
Выяснение конкретных клеточных и системных механизмов таких преобразований составляет основную проблему современной биологии развития. Увеличение массы тела особи, т.е. ее рост, и появление новых структур в ходе ее развития, называемое морфогенезом, нуждаются в объяснении. Рост и морфогенез подчиняются законам, которые обусловливают приуроченность конкретных процессов онтогенеза к определенному месту зародыша и периоду эмбриогенеза. Отдельные стадии индивидуального развития отличаются также определенной скоростью протекания с характерным качественным и количественным результатом.
Биология развития изучает пути генетического контроля индивидуального развития и особенности реализации генетической программы в фенотип в зависимости от условий. Под условиями понимают различные внутриуровневые и межуровневые процессы и взаимодействия: внутригеномные (внутригенетические), клеточные, межклеточные, тканевые, внутриорганные, организменные, популяционные, экологические. Можно сказать, что усилия исследователей в области биологии развития концентрируются вокруг стержневой проблемы генетической предопределенности и лабильности онтогенетических процессов, что в известном смысле на ином уровне познания возвращает нас к идеям преформизма и эпигенеза (неопреформизма и эпигенеза).
Не менее важны исследования конкретных онтогенетических механизмов роста и морфогенеза. К ним относятся следующие клеточные механизмы: пролиферация, или размножение клеток, миграция, или перемещение клеток, сортировка клеток, их запрограммированная гибель, дифференцировка клеток, контактные взаимодействия клеток (индукция и компетенция), дистантные взаимодействия клеток, тканей и органов (паракринные, гуморальные и нервные механизмы интеграции). Все эти процессы носят избирательный характер, т.е. протекают в определенных пространственно-временных рамках с определенной интенсивностью, подчиняясь принципу целостности развивающегося ор-
ганизма. Биология развития стремится выяснить степень и конкретные пути контроля со стороны генома и одновременно уровень автономности различных процессов в ходе онтогенеза.
8.2. элементарные клеточные механизмы онтогенеза
В онтогенезе особи происходят сложнейшие преобразования: осуществляется дифференциация частей развивающегося организма (морфогенез), формирование его внешней и внутренней структуры (морфогенез), рост. В основе этих преобразований лежат клеточные и системные механизмы развития. К клеточным механизмам относят размножение, перемещения, избирательную сортировку, дифферен-цировку, программированную гибель клеток. Важной особенностью действия этих механизмов является их избирательность, которая означает, что тот или иной механизм реализуется в определенное время развития в определенном месте развивающегося организма с определенной интенсивностью и скоростью и приводит к конкретному качественному и количественному результату. Строгая закономерность действия клеточных механизмов в онтогенезе особи регулируется системными механизмами развития, к которым относят межклеточные взаимодействия, взаимодействия клеточных комплексов, частей и структур зародыша (эмбриональная индукция), нервную и гуморальную регуляцию, образование морфогенетических полей.
8.2.1. ДЕЛЕНИЕ КЛЕТОК
Деление клеток (размножение, пролиферация) играет важную роль в процессах онтогенеза. Во-первых, благодаря делению из зиготы, которая соответствует одноклеточной стадии развития, возникает многоклеточный организм. Во-вторых, пролиферация клеток, происходящая после стадии дробления, обеспечивает рост организма. В-третьих, избирательному размножению клеток принадлежит заметная роль в обеспечении морфогенетических процессов. В-четвертых, в постнатальном периоде индивидуального развития благодаря клеточному делению осуществляется обновление многих тканей в процессе жизнедеятельности организма (физиологическая или гомеостатическая регенерация), а также заживление ран, восстановление утраченных органов (репаративная регенерация).
Зигота, бластомеры и соматические клетки организма, за исключением половых клеток в периоде созревания гаметогенеза, делятся мито-
зом. Клеточное деление как таковое является одной из фаз клеточного цикла. От продолжительности интерфазы (G1-, S-, G2-периодов) зависит частота последовательных делений в ряду клеточных поколений. В свою очередь, интерфаза имеет разную продолжительность в зависимости от стадии развития зародыша, локализации и функции клеток.
Так, в периоде дробления эмбриогенеза митотические циклы сильно укорочены. Причины подобной модификации: отсутствие периода G1, а у ряда организмов и периода G2, ускорение репликации - подробно обсуждались в п. 7.4.1. В результате указанных изменений митотического цикла происходит выравнивание ядерно-цитоплазматического соотношения в клетках зародыша, при этом деления бластомеров осуществляются с очень высокой скоростью (рис. 8.1.) Последнее является важным фактором нормального развития зародыша. В результате такой «ускоренной» пролиферации осуществляется быстрое накопление значительного количества клеток. Было доказано, что зародыш или его структуры должны иметь необходимый минимум клеток для успешного протекания дальнейшего развития. Так, формирование полноценной бластулы мыши - ее кавитация, т.е. образование бластоцеля - требует наличия не менее 22-25 бластомеров в моруле. Для последующей успешной имплантации зародыша необходимо пороговое количество бластомеров внутренней клеточной массы бластоцисты. В экспериментах на амфибиях установлено, что при наличии менее 100 клеток в зачатке нервной
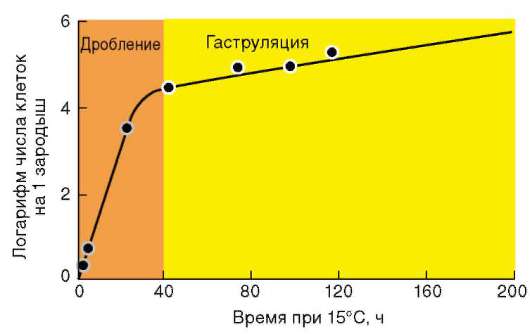
Рис. 8.1. Скорость образования новых клеток в ходе дробления и гаструляции у лягушки Rana pipiens (по: Sze, 1953)
трубки, образования этой структуры не происходит. Если при закладке верхней конечности в ее зачатке (почке) число клеток недостаточно, то развивается конечность с неполным числом пальцев.
К концу стадии дробления восстанавливается соответствие структуры и продолжительности интерфазы ее обычным характеристикам, и все последующие деления клеток зародыша сопровождаются их ростом, вследствие чего происходит и рост организма в целом.
В ходе гаструляции и всех последующих стадий развития становится очевидной избирательность пролиферации, т.е. клетки активно делятся преимущественно в определенных областях развивающегося организма. Избирательность размножения клеток зародыша дрозофилы представлена на рис. 8.2. Особое значение неравномерность размножения клеток приобретает в ходе органогенеза и гистогенеза. Там, где скорость клеточного деления высокая, происходят и качественные изменения в структуре эмбриональной закладки, т.е. формообразовательные процессы сопровождаются активным размножением клеток. Так, особенности пролиферации клеток передней части нервной трубки приводят к формированию головного мозга (рис. 8.3).
Еще одним примером избирательности размножения клеток может служить аллометрия роста - явление, при котором наблюдается неравномерный рост отдельных частей тела, благодаря которому достигается формирование нормального взрослого организма конкретного вида. Очень отчетливо это явление наблюдается, например, в развитии человека (рис. 8.4). При сравнении пропорций тела плода, новорожденного и взрослого становится очевидной более высокая скорость роста нижних конечностей по сравнению со скоростью роста головы.
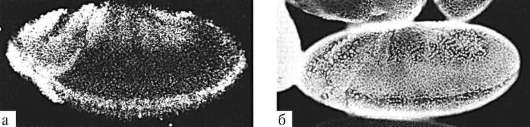
Рис. 8.2. Дифференциальная скорость размножения клеток в разных частях зародыша дрозофилы: а - авторадиографическое выявление мРНК гена string, экспрессия которого наблюдается в активно делящихся клетках, б - регионы зародыша с различной митотической активностью клеток под световым микроскопом (по: S.F. Gilbert, 2005)
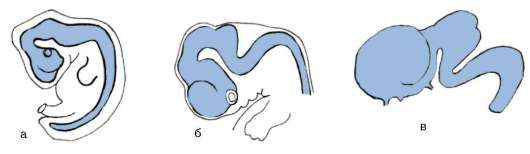
Рис. 8.3. Избирательное размножение клеток переднего конца нервной трубки при формировании головного мозга у зародыша человека: а - 4-недельный зародыш, б - 6-недельный зародыш, в - 8-недельный зародыш
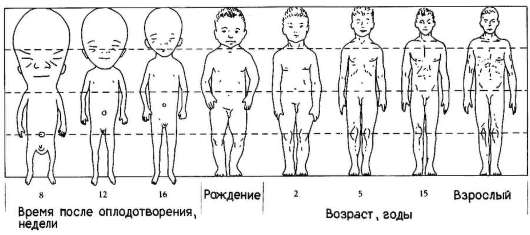
Рис. 8.4. Неравномерность роста в онтогенезе человека
Установлено формирование в процессе развития многих структур зародыша клетками, происходящими от небольшого числа или даже одной клетки. Совокупность клеток, являющихся потомками одной ро-доначальной, называют клоном. Примером подобного явления служит формирование всей мезодермы у моллюска Dentalium из единственного бластомера 4d. Его удаление в эксперименте приводило к отсутствию мезодермальных органов или частей органов у взрослой особи. Не менее интересные данные получены благодаря работам, выполненным на зародышах мыши. Установлено, что организм развивается всего из трех клеток внутренней клеточной массы на стадии, когда бластоциста состоит из 64 клеток, а сама внутренняя клеточная масса содержит примерно 15 клеток. Показано также, что большие по объему участки центральной нервной системы образуются из определенных клеток формирующегося
организма. Важное следствие такой ситуации - то, что многие клетки раннего зародыша не участвуют в дальнейшем развитии. В большинстве случаев неясно, в какой именно срок происходит отбор родоначальных клеток и каков механизм этого отбора.
Очевидно, что соматические мутации в клетке-родоначальнице клона могут быть причиной мозаицизма, явления, при котором большие группы клеток многоклеточного организма отличаются по набору хромосом или аллельному составу. У человека результатом таких мутаций могут быть мозаичные формы хромосомных болезней, например синдрома Дауна. Известна также соматическая мутация - «белая прядь волос».
В сформировавшемся организме способность клеток к делению также значительно разнится. Некоторые клетки, например нейроны, вообще не делятся, в то время как в кроветворной и эпителиальной тканях продолжается активное размножение клеток. Практически не делящиеся в обычных условиях клетки таких органов, как печень и почки, при наличии стимула в виде воздействия гормональных или внутритканевых факторов, могут вступить в митотический цикл.
Среди стимулов, побуждающих клетки к делению, значительную часть составляют факторы роста, относящиеся к группе гистогормонов. Они продуцируются неспециализированными клетками, находящимися во всех тканях, и обладают эндокринным (действуют на отдаленные клетки-мишени через кровоток), паракринным (на соседние клетки путем диффузии), аутокринным (на сами клетки-продуценты) и даже интракринным (внутри клетки, не секретируясь, т.е. не выделяясь из клетки-продуцента) действием. Факторы роста - это по большей части пептиды с молекулярной массой 5000-50 000 кДа (дальтон, или Да - единица атомного веса, 1 кДа = 103 Да), индуцирующие синтез ДНК и вхождение клетки в митоз, однако они могут выполнять и другие функции.
Так, например, тромбоцитарный фактор роста (PDGF) стимулирует дифференцировку, гепатоцитарный фактор роста (HGF) служит хемоат-трактантом и изменяет подвижность клеток эпителия почки. Действие факторов роста необходимо рассматривать в связи с другими стимуляторами, прежде всего гормонами, и с учетом типа клеток-мишеней и их тканевого микроокружения. Фактор роста, активирующий митоз клеток одного типа, может действовать как ингибитор пролиферации клеток другого типа. Так, например, фактор роста эпидермиса (EFG) может подавлять пролиферацию клеток кишечного эпителия крыс, а полипептиды, стимулирующие рост недифференцированных эмбриональных клеток, останавливают пролиферацию лейкозных клеток и индуцируют их дифференцировку.
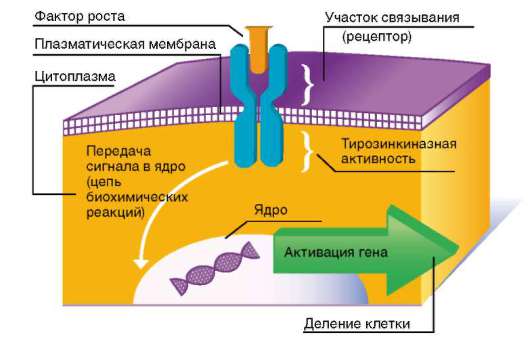
Рис. 8.5. Схема действия факторов роста
Большинство факторов роста оказывает митогенное (стимулирующее митоз) действие, связываясь с рецепторами мембраны клетки, т.е. действуя как лиганды, что приводит к активации фермента, ассоциированной с этими рецепторами (рис. 8.5). Это ведет через те или иные посредники (сигналлинги) к запуску каскадов митогенактивирующих протеинкиназ. Конечные ферменты этого каскада, фосфорилируя ряд транскрипционных факторов, активируют их, а они, в свою очередь, запускают экспрессию определенных генов. Среди последних гены, кодирующие Cdk, которые играют ключевую роль в поочередной смене фаз клеточного цикла, и их активаторные субъединицы - циклины (см. главу 3). На рис. 8.6 показано, в каких именно точках митотического цикла осуществляют свое действие различные Cdk и циклины.

Рис. 8.6. Комплексы циклин-циклинзависимая киназа (Cdk), контролирующие разные фазы клеточного цикла
Факторы роста, их рецепторы, участники передачи сигнала внутри клетки, транскрипционные факторы нередко являются продуктами экспрессии протоонкогенов. Это гены, осуществляющие контроль деления, роста, дифференцировки клеток и находящиеся в свою очередь под контролем ряда других генов. К настоящему времени идентифицировано более 100 протоонкогенов. Известно, что часть таких генов (в геноме человека их около 40), экспрессируется только в эмбриональных клетках и малоактивна в зрелых. Некоторые протоонкогены экспрессируют-ся (транскрибируются и транслируются) не только в эмбриогенезе, но и в постнатальном развитии в ходе регенерационных процессов, например после хирургических операций.
Изменения структуры и усиление сверх нормы экспрессии протоон-когенов во взрослом организме вызывает развитие опухолей (что определило их название: от греч. protos - первый и onkos - опухоль).
В эмбриональном развитии мутации таких генов являются генетической основой формирования пороков. Так, мутации одного из протоон-когенов - FRFR3, кодирующего рецептор к фактору роста фибробластов, приводит к нарушению пролиферации хрящевых клеток, участвующих в формировании трубчатых костей конечности, и в результате к ахон-дроплазии. Другие мутации того же гена лежат в основе летальной тана-тоформной дисплазии и менее тяжелого синдрома гипохондроплазии, которые также являются следствием нарушения (хондро)остеогенеза.
Наряду с факторами роста описан целый ряд полипептидных ингибиторов пролиферации клеток, которые ранее чаще именовали кейло-нами. Эти вещества существенно различаются по молекулярной массе, содержанию углеводных, липидных и других компонентов, а также по чувствительности к температуре и иным свойствам. Кейлоны считаются тканеспецифичными регуляторами пролиферации, т.е. проявляют свое ингибирующее действие в той же ткани, где и образуются. Кейлоны не имеют выраженной видовой специфичности. Так, эпидермальный кей-лон трески действует и на эпидермис млекопитающего. Предполагается, что каждый тип клеток образует свой специфичный ингибитор пролиферации. Хотя для некоторых клеток известно несколько таких веществ.
Регуляция пролиферации может осуществляться и другими способами, например контактными межклеточными взаимодействиями. Многие клетки способны делиться только будучи прикрепленными к внеклеточным структурам. Например, для эпителиоцитов такой структурой является базальная мембрана, а для фибробластов - коллагеновые волокна межклеточного вещества. Если клетка устанавливает контакт не с внеклеточным
матриксом, а с другими клетками, то при определенной плотности клеток наблюдается прекращение делений. Этот эффект назван «контактное торможение». Для каждой ткани «тормозящая» плотность специфична. При регенерации клетки активно делятся лишь до достижения оптимального их количества, после чего пролиферация ингибируется.
Считают, что делящимся клеткам соответствует некий генетически запрограммированный лимит делений, при приближении к которому в клетках наступают глубокие изменения, вызывающие в конечном счете прекращение делений и клеточную гибель.
Роль пролиферации как одного из основополагающих механизмов развития доказывается мутациями генов, контролирующих деление клеток. У Drosophila melanogaster описана мутация gt (giant). Она наследуется по рецессивному сцепленному с полом типу. У мутантов gt развитие протекает нормально на протяжении всего эмбрионального периода. Однако в тот момент, когда нормальные особи окукливаются и начинают метаморфоз, мутантные особи продолжают оставаться в личиночном состоянии еще дополнительно 2-5 сут. За это время у них происходит одно, а может быть, и два дополнительных деления в имагинальных дисках, от количества клеток которых зависит размер будущей взрослой особи. Затем мутанты образуют куколку вдвое крупнее обычной. После метаморфоза несколько удлиненной по времени стадии куколки на свет появляется морфологически нормальная взрослая особь (имаго) удвоенного размера.
У мышей известен ряд мутаций, обусловливающих снижение проли-феративной активности и следующие за этим фенотипические эффекты. К ним относят, например, мутацию or (ocular retardation), затрагивающую сетчатку глаза начиная с 10-х суток эмбрионального развития и приводящую к микрофтальмии (уменьшению размеров глазных яблок), и мутацию tgla, затрагивающую центральную нервную систему с 5-6-х суток после рождения и приводящую к отставанию роста и атрофии некоторых внутренних органов.
Таким образом, деление клеток - чрезвычайно важный процесс в онтогенетическом развитии. Оно протекает с разной интенсивностью в разное время и в разных структурах организма, носит, видимо всегда, клональный характер и подвержено генетическому контролю. Все это характеризует клеточное деление как сложнейшую функцию целостного организма, подчиняющегося регулирующим влияниям на различных уровнях: генетическом, тканевом, онтогенетическом.
8.2.2. КЛЕТОЧНЫЕ ПЕРЕМЕЩЕНИЯ
В процессе развития особи происходят неоднократные перемещения (миграции) отдельных клеток, их групп, клеточных пластов. Особое значение миграция клеток приобретает на стадии гаструляции, приводя к формированию зародышевых листков. В ходе органогенеза этот механизм важен, например, при формировании крупных пищеварительных желез, производных нервного гребня. Не менее значима его роль и в постэмбриональном развитии. Амебоидное движение макрофагов обеспечивает реализацию реакций иммунитета, перемещения сперматозоидов (жгутиковое движение) необходимы для осуществления оплодотворения, миграции клеток эпидермиса приводят к закрытию раневой поверхности при повреждениях кожи и т.д. В целом, миграция обеспечивает доставку клеточного материала в нужную область организма.
Следует отметить, что перемещаться могут как отдельные клетки, так и целые клеточные пласты. Последний вариант характерен для эпителиальных клеток, которые тесно прилегают друг к другу боковыми стенками и подстилаются базальной мембраной (рис. 8.7). Отростчатые или веретеновидные клетки, погруженные в межклеточное вещество, - ме-зенхимные клетки - более подвижны, не образуют между собой стойких контактов, вследствие этого они мигрируют одиночно или группами (рис. 8.8). Как мезенхима, так и эпителии могут быть образованы из любого из трех зародышевых листков. Особая форма движения отдельных
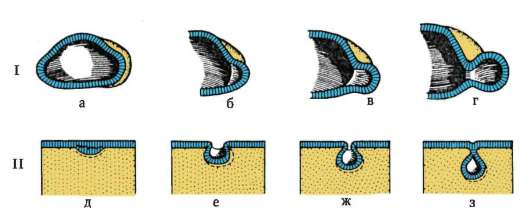
Рис. 8.7. Перемещение клеточных пластов: I - путем выпячивания на примере образования глазного пузырька; II - путем впячивания на примере образования слухового пузырька: а - стенка переднего мозга; б - местное ускорение роста; в - выпячивание; г - глазной пузырек; д-ж - углубление ямки; з - от-шнуровывание пузырька
Рис. 8.8. Миграция мезен-химных клеток в ходе га-струляции у амфибий
клеток наблюдается на ранних стадиях развития у некоторых зародышей. Например, у птиц первичные половые клетки мигрируют из стенки желточного мешка в кровяное русло и таким образом (с током крови) переносятся в гонады.
Миграции клеток осуществляются на основе дистантных и контактных взаимодействий. К дистантным может быть отнесено перемещение по градиенту концентрации тех или иных веществ - движение по типу хемотаксиса. Такой механизм встречается довольно редко, его достоверных случаев для эмбриональных клеток многоклеточных животных не обнаружено.
Основой миграции клеток многоклеточных животных как в эмбриогенезе, так и в постнатальном развитии являются контактные взаимодействия, прежде всего между внеклеточным веществом и мигрирующими клетками. В качестве примера подобного взаимодействия рассмотрим миграцию клеток нервного гребня (рис. 8.9), который вследствие многочисленности и значимости его производных иногда называют четвертым зародышевым листком (см. п. 7.4.3).
Начало миграции клеток нервного гребня связано с их выделением из пласта нейроэпителия замыкающейся нервной трубки и приобретением ими внешних признаков мезенхимных клеток.
Оказавшиеся вне нейроэпителиального пласта клетки нервного гребня начинают активно перемещаться. Миграция клеток определяется взаимодействием клеток с межклеточным веществом - внеклеточным матриксом. Матрикс служит для клеток механической опорой или, как принято говорить, твердым субстратом. Его компоненты в настоящее время довольно хорошо изучены и включают разные типы коллагена, фи-бронектин, ламинин, гликозаминогликаны и другие вещества (рис. 8.10).

Рис. 8.9. Миграция клеток нервного гребня: а - поперечный срез зародыша;
б - производные клеток нервного гребня у взрослого организма; 1 - нервный гребень; 2 - узел спинного корешка; 3 - пигментные клетки; 4 - симпатический узел; 5 - развивающийся надпочечник; 6 - нервное сплетение в стенке кишки;
7 - клетка шванновской оболочки; 8 - униполярный чувствительный нейрон; 9 - клетка-спутник; 10 - мультиполярный нейрон симпатического узла; 11 - хромаффинная клетка в мозговом веществе надпочечника; 12 - превертебраль-ное сплетение; 13 - парасимпатическое сплетение в кишке; стрелками показано направление миграции клеток нервного гребня
Гликопротеиды фибронектин и ламинин - основные вещества внеклеточного матрикса, принимающие участие в миграции клеток нервного гребня. Они оказывают стимулирующий эффект на их перемещение. Напротив, коллаген II типа, откладывающийся, по данным ряда авторов, преимущественно на выпуклых поверхностях нейральных пластов, задерживает на себе клетки нервного гребня, повышая их концентрацию и способствуя дифференцировке.
Взаимосвязь мигрирующих клеток с компонентами внеклеточного матрикса осуществляется особым видом клеточных рецепторов -
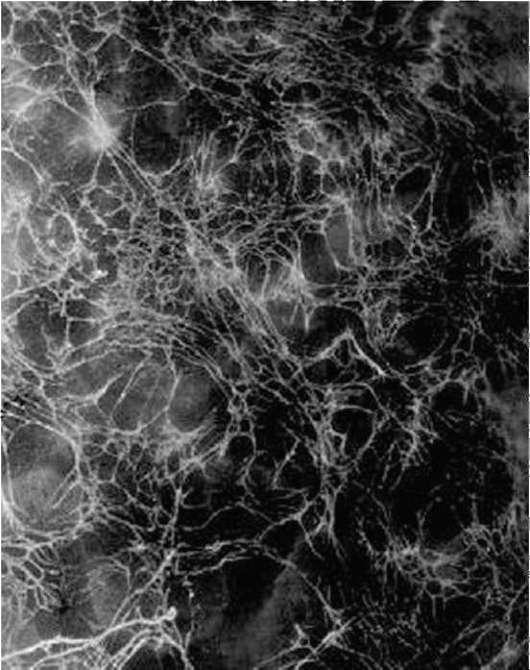
Рис. 8.10. Фибронектино-вые фибриллы во внеклеточном матриксе крыши бластоцеля гаструлы амфибии, выявленные методом иммунофлюоресценции
белками-интегринами (рис. 8.11, а). В эксперименте показано, что введение в головной отдел зародыша антител к интегрину, блокирующих связь клеток с фибронектином или ламинином, приводит к значительным нарушениям в распределении клеток нервного гребня.
Интегриновый рецептор - трансмембранный белок: его молекула пронизывает плазматическую мембрану клетки и обладает как внеклеточной, так и внутриклеточной частями (доменами). Внутриклеточный домен интегрина через цепь различных соединенных между собой белков взаимодействует с актиновыми микрофиламентами цитоскелета клетки, и тем самым осуществляется структурная связь между внеклеточным матриксом и цитоскелетом прикрепившейся клетки (рис. 8.11, б). Интегрин состоит из α- и β-субъединиц, которые могут комбинироваться в различных сочетаниях, формируя более 20 разных типов интег-ринов.
Мигрирующая мезенхимная клетка в некоторых участках своей поверхности образует псевдоподии (клеточные выросты в виде тонких нитей - филоподии или пластинчатой формы - ламеллоподии). Точ-
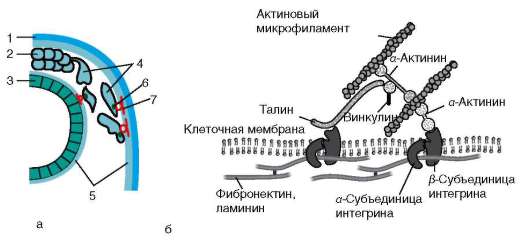
Рис. 8.11. Взаимодействие мигрирующей клетки с компонентами внеклеточного матрикса: а - общий вид; б - механизм действия интегринового рецептора. 1 - покровная эктодерма; 2 - нервный гребень; 3 - нервная трубка; 4 - мигрирующие клетки нервного гребня; 5 - внеклеточный матрикс; 6 - интегрин; 7 - ламинин
ки прикрепления псевдоподий к внеклеточному матриксу называют фокальными контактами (рис. 8.12). Именно в них оказываются сосредоточенными интегрины. Под фокальными контактами понимают макромолекулярные динамические комплексы, включающие до 100 различных белков, посредством которых передаются регуляторные сигналы от внеклеточного матрикса к клетке. Зафиксировавшись на субстрате, клетка за счет сокращения микрофиламентов и микротрубочек цитоскелета подтягивается в точке прикрепления. Затем она теряет фокальные контакты, формирует новые псевдоподии, на которых снова устанавливаются фокальные контакты, и т.д.
Различия в миграции эпителиальных пластов и мезенхимальных клеток, возможно, связаны именно с характером распределения фокальных контактов по клеточному краю: у мезенхимных клеток они сосредоточены преимущественно в концевых отделах, тогда как у эпителиальных клеток фокальные контакты распределены относительно равномерно по всей периферии и силы связывания с субстратом выражены слабее, чем у мезенхимы.
Наиболее интересный и принципиальный вопрос при перемещении клеток - целенаправленный характер процесса миграции, когда клетки движутся не хаотически, а по определенным путям именно в те участки зародыша, где впоследствии из них будут образовываться зре-
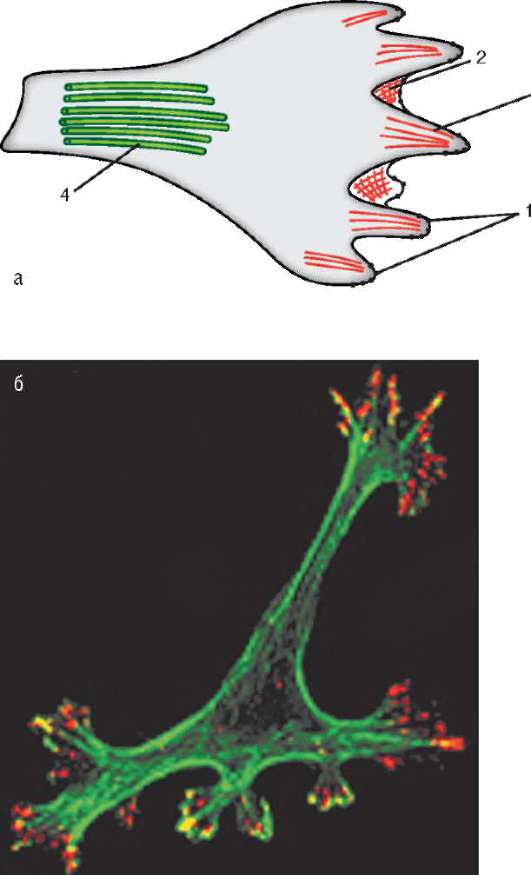
Рис. 8.12. Мигрирующая клетка: а - схематическое изображение; б - микрофотография с использованием антител к актину (зеленый) и интегрину (красный). 1 - фокальные контакты; 2 - ламеллоподия с сетью актиновых филамен-тов; 3 - филоподия с пучком актиновых филаментов; 4 - микротрубочки
лые производные. Каким образом клетки определяют, куда они должны мигрировать?
В последние годы установлено, что направление миграции может быть задано неоднородностью компонентов матрикса и, следовательно, его адгезивных свойств, кривизной его поверхности или микрорельефом, а также различными нарушениями непрерывности матрикса. Все это служит своеобразными опознавательными знаками для выбора направления клеточных миграций и сосредоточения определенных типов клеток в участках закладки будущих органов или регенерации.
С учетом описанных выше взаимодействий рецепторов клетки с соответствующими компонентами внеклеточного матрикса становится очевидно, что если необходимые элементы матрикса распределены не
равномерно, а, например, в виде островков или узких дорожек, то клетки смогут прикрепляться и перемещаться лишь в границах определенных участков. Такая картина реально наблюдается в организме в условиях эмбриогенеза или при заживлении ран, когда клетки направленно мигрируют вдоль линейных участков на поверхности внеклеточного ма-трикса в соответствии с наличием в этих участках белковых компонентов, необходимых для адгезии клеток данного типа (рис. 8.13).
Механизм реакции мигрирующих клеток на геометрическую конфигурацию субстрата в настоящее время активно обсуждается. Одно из предположений состоит в том, что в этих реакциях участвуют так называемые рецепторы растяжения. Эти рецепторы клеточной мембраны, возможно, реагируют на кривизну или микронеровности поверхности суб страта, вызывая реоргани-
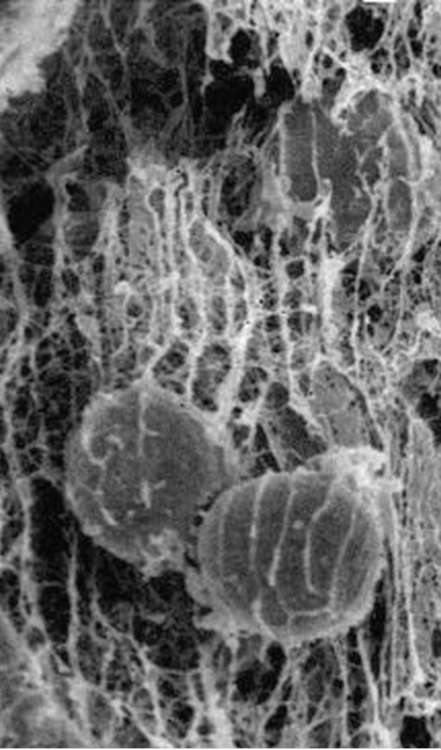
Рис. 8.13. Фибриллы внеклеточного матрикса зародыша морского ежа на стадии гаструляции и мигрирующие вдоль них клетки
зацию актинового цитоскелета и неравномерное перераспределение сил натяжения в клетке. В результате клетки начинают вытягиваться и ориентироваться в определенном направлении. Активация рецепторов растяжения включает внутриклеточную сигнализацию, которая вызывает фосфорилирование некоторых белков и изменение генной экспрессии. Одним из вероятных кандидатов на роль рецепторов растяжения являются ионные хлоридные каналы в клеточной мембране: в среде с дефицитом хлоридов вытягивание клеток вдоль микроканавок резко ослабевает. Однако для доказательства данного и ряда других предположений необходимы дальнейшие исследования.
Помимо доставки клеточного материала в нужную область зародыша миграция также обеспечивает определенный характер расположения клеток в зачатке формирующейся структуры, вследствие чего последний приобретает форму.
Так, например, в зачатке головного мозга клетки перемещаются из зоны размножения, прилежащей к полости невроцеля, к наружной стороне нервной трубки и образуют ряд выпячиваний, так называемых мозговых пузырей. Миграция клеток из зоны размножения обеспечивает также упорядоченное расположение слоев коры переднего мозга. Формирование начинается с самых глубоких слоев. Сначала мигрируют и занимают нужную позицию клетки самого нижнего (внутреннего) уровня. Клетки каждого последующего слоя, чтобы достичь своего места локализации, должны преодолеть уже сформированные клеточные уровни. Один из регуляторов процесса миграции и позиционирования нервных клеток коры переднего мозга - белок рилин, кодируемый геном RELN. Название «рилин» происходит от английского глагола to reel - кружиться, идти нетвердой походкой. Именно такая, «закрученная», неровная походка наблюдается у мышей с генетически обусловленным недостатком рилина. Нехватка белка ведет к таким нарушениям миграции нейронов, что у мышей наблюдается инверсия слоев коры головного мозга, т.е слои выстраиваются «наоборот»: более молодые нейроны не в состоянии преодолеть слои уже «осевших» на своем уровне клеток.
Генетический контроль миграции клеток, как и других процессов, осуществляемых в онтогенезе, сложен и в настоящее время активно изучается. Имея в виду перемещения клеток нервного гребня, можно привести следующие примеры. Продукт гена Slug участвует в трансформации клеток нервного гребня в мигрирующие мезенхимальные клетки. Продукт гена Foxd3 усиливает их перемещения. Миграция отдельных групп клеток нервного гребня также генетически детерминирована. Так,
при одной из форм синдрома Ваарденбурга наблюдается частичный альбинизм, врожденная нейросенсорная тугоухость, а в некоторых случаях и отсутствие вегетативных ганглиев в кишечнике. Эта патология обусловлена нарушением миграции трех производных нервного гребня, одно из которых - меланоциты, второе - клетки улиткового ганглия, третье - нейроны межмышечного сплетения кишки. У больных выявлены мутации генов, кодирующих регуляторные белки РАХЗ и MITF, и мутация гена, кодирующего рецептор к эндотелину-3.
В целом, нарушения клеточной миграции, происходящие в период эмбриогенеза, приводят к формированию таких врожденных пороков развития, как гетеротопии и эктопии, т.е. к аномальной локализации органов или структур. Так, гетеротопия поджелудочной железы млекопитающих определяется нарушением перемещения закладок этого органа, в результате чего формирование компактной железы происходит в ненадлежащем месте.
Таким образом, несомненно, что миграция клеток является одним из важнейших механизмов развития, определяя правильность формирования структуры, формы органов, их локализацию, обеспечивая процессы регенерации, иммунитета и другие. Приобретение клетками способности к миграции, взаимодействие мигрирующих клеток с субстратом, детерминирующее перемещение клеток, находятся под генетическим контролем.
8.2.3. СОРТИРОВКА И СЛИПАНИЕ КЛЕТОК
Механизм сортировки и слипания (адгезии) клеток лежит в основе выделения и объединения клеток одного типа среди всех прочих. В процессе развития клетки «узнают» друг друга и сортируются в зависимости от свойств, т.е. образуют скопления и пласты избирательно, только с определенными клетками. Этот механизм крайне важен при формировании зародышевых листков в ходе гаструляции, образовании структур в органогенезе, осуществлении регенеративных процессов и иммунных реакций в постнатальном развитии.
Начало изучению сортировки и адгезии клеток положили эксперименты Таунса и Гольтфретера. Диссоциированные (см. разделенные) с помощью ферментов клетки зародыша амфибии на стадии гаструлы тщательно перемешивали и помещали в культуральную среду. Сначала клетки представляли собой беспорядочную смесь, затем клетки эктодермы, мезодермы и энтодермы разделялись (сегрегировали), собирались в
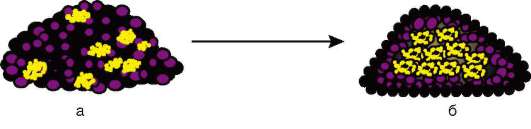
Рис. 8.14. Адгезия клеток зародышевых листков: а - смесь диссоциированных клеток гаструлы амфибий; б - клетки эктодермы, мезодермы и энтодермы, группирующиеся послойно путем адгезии
отдельные группы, каждая из которых занимала свою определенную область. Локализация заново образованных зародышевых листков иногда даже соответствовала их положению в зародыше - эктодерма по периферии агрегата, энтодерма внутри, а мезодерма между ними (рис. 8.14).
Было установлено, что клетки зародышевых листков имеют избирательное сродство друг к другу: внутренняя поверхность эктодермы имеет положительное сродство к мезодермальным клеткам и отрицательное к энтодермальным. Мезодерма в свою очередь обладает положительным сродством и к экто-, и к энтодерме.
Многочисленные исследования, выполненные в последние годы, показали, что избирательная сортировка и адгезия клеток обеспечивается наличием на их мембранах так называемых молекул межклеточной адгезии (САМ, от англ. cell-adhesion molecules).
САМ - белки, связанные с плазматической мембраной клетки и обеспечивающие механическое взаимодействие клеток друг с другом. Часто они пронизывают мембрану и присоединяются к цитоскелету. Во многих случаях отдельная молекула способна взаимодействовать не с одним, а с несколькими веществами, для чего служат разные участки связывания. Обычно белки межклеточной адгезии расположены кластерами (группами) и образуют участки многоточечного связывания.
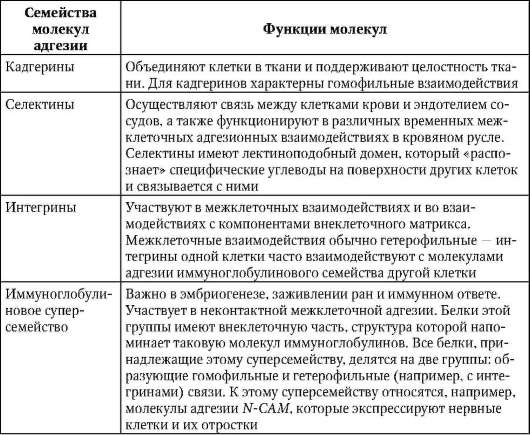
К молекулам адгезии относят 4 семейства белков: кадгерины, селек-тины, интегрины и семейство иммуноглобулинов. Опосредуемая ими адгезия может осуществляться на основе двух механизмов: гомофиль-ного - молекулы адгезии одной клетки связываются с молекулами того же типа соседней клетки, и гетерофильного, когда две клетки имеют на своей поверхности разные типы молекул адгезии, которые связываются между собой (рис. 8.15). Особенности функционирования различных семейств представлены в табл. 8.1.
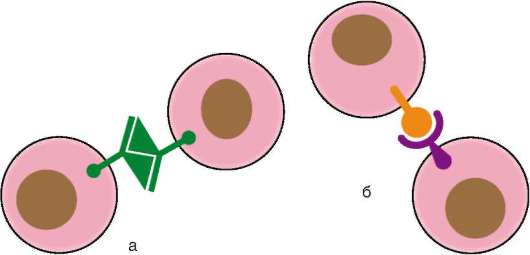
Рис. 8.15. Механизмы межклеточной адгезии: а - гомофильный механизм; б - гетерофильный механизм
Таблица 8.1. Функциональное значение молекул адгезии
На этапах раннего эмбрионального развития основная роль в обеспечении механизма избирательной сортировки и адгезии клеток принадлежит кадгеринам. Остановимся на них более подробно.
Большинство кадгеринов представляют собой единожды пересекающие плазматическую мембрану гликопротеины, состоящие из 700-750 аминокислот. Внутриклеточные домены кадгеринов связаны с цитоплазматическими белками катенинами, а те, в свою очередь, - с цитоскелетом клетки - актиновыми филаментами (рис. 8.16). Кадге-рины являются Са2+-зависимыми, т.е. опосредуют клеточную адгезию только в присутствии ионов кальция. В отсутствие кальция кадгерины претерпевают значительную конформационную перестройку и в результате быстро разрушаются ферментами.
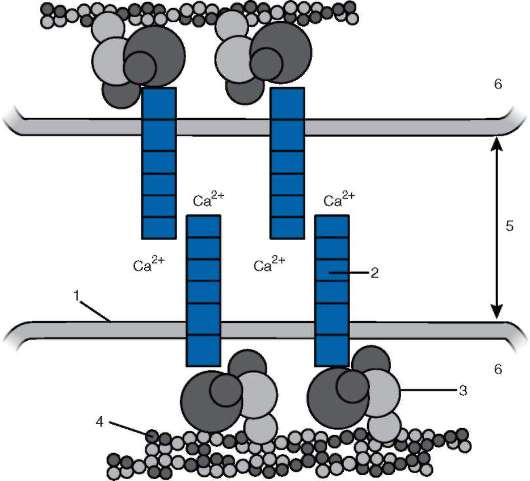
Рис. 8.16. Схема взаимодействия молекулы кадгерина с цитоскелетом: 1 - клеточная мембрана; 2 - молекула кадгерина; 3 - катенины; 4 - актиновые фила-менты; 5 - межклеточное пространство; 6 - цитоплазма клетки
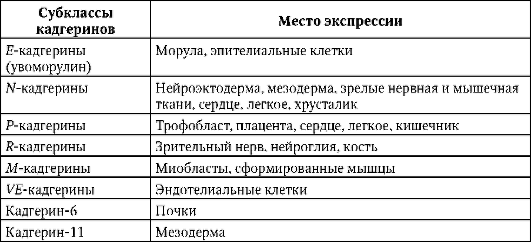
К настоящему моменту известно более десяти субклассов кадгеринов, каждый из которых кодируется отдельным геном. Клетки позвоночных экспрессируют один или более типов кадгеринов. Для конкретного типа клеток характерен определенный набор экспрессируемых кадгеринов. В табл. 8.2 представлены некоторые из них.
Таблица 8.2. Экспрессия кадгеринов различных субклассов в организме
Роль кадгеринов в развитии можно проиллюстрировать следующими примерами.
В начале дробления бластомеры располагаются рыхло. Затем происходит компактизация клеток - бластомеры прижимаются друг к другу, плотно упаковываются и связываются межклеточными соединениями (см. рис. 8.30). Ключевая роль кадгеринов в этом процессе доказана в экспериментах. Так, антитела к Е-кадгерину блокируют компактизацию бластомеров, тогда как антитела, реагирующие со многими другими поверхностными молекулами этих клеток, не оказывают такого действия. Этот же субкласс молекул адгезии наиболее важен и при формировании плотных контактов между клетками трофобласта в бластоцисте плацентарных млекопитающих. В зародыше трансгенных мышей, лишенных гена Е-кадгерина, не формируется трофобласт, и зародыш не имплантируется. Помимо Е-кадгерина важную роль в имплантации зародыша играет Р-кадгерин. Молекулы указанных субклассов экспрессируются на поверхности клеток трофобласта и матки, обеспечивая прилипание зародыша к эпителию матки на начальном этапе этого процесса.
Очевидно, что кадгерины не менее значимы и на более поздних стадиях развития позвоночных, так как их появление и исчезновение
коррелирует с важными морфогенетическими событиями, при которых ткани отграничиваются друг от друга. Так, клетки покровной эктодермы содержат Е-кадгерин. По мере формирования нервной трубки и отделения ее от покровной эктодермы в клетках развивающегося нервного эпителия исчезает Е-кадгерин и появляется iV-кадгерин (и N-CAM) (рис. 8.17). Присутствие различных субклассов кадгеринов на поверхности клеток покровной эктодермы и клеток формирующейся нервной трубки обеспечивает избирательную адгезию этих клеточных типов при смыкании нервных валиков. Интересно, что при миграции клеток нервного гребня из нервной трубки они теряют N-кадгерин (и N-CAM), но вновь начинают вырабатывать его позднее, когда, объединяясь, формируют нервный узел. Экспрессия CAM этих же двух семейств на поверхности мигрирующих мезенхимальных клеток, происходящих из склеротома, приводит к их объединению и последующему образованию кости. Механизм избирательной сортировки и адгезии лежит в основе и многих других процессов органогенеза, в частности, формирования мышечных волокон при слиянии клеток-миобластов, установление контактов между аксонами клеток сетчатки и нейронами других отделов зрительного анализатора и т.д.
Установлено, что число экспрессируемых на поверхности клеток кад-геринов также имеет значение при их избирательной сортировке и адгезии. В эксперименте были использовали две идентичные клеточные линии, отличающиеся по количеству синтезируемого Р-кадгерина. При смешивании клеток этих двух линий те из них, которые имели большее число молекул адгезии, демонстрировали более выраженное сцепление

Рис. 8.17. Экспрессия кадгеринов: А - при формировании нервной трубки; Б - при выселении мезенхимальных мигрирующих клеток нервного гребня; 1 - эктодерма (Е-кадгерин); 2 - нервный желобок (N-кадгерин и N-CAM); 3 - нервная трубка (N-кадгерин и N-CAM); 4 - нервный гребень; 5 - мигрирующие клетки нервного гребня; 6 - хорда; 7 - сомит
друг с другом и формировали плотную группу. Она окружалась клетками с меньшим числом молекул адгезии и, следовательно, образующими менее прочные контакты.
В процессе развития избирательное сродство клеток меняется. Этот факт подтверждается экспериментами по реагрегации диссоциированных клеток мезодермы куриных зародышей. Разделенные клетки головной части мезодермы, где уже были сформированы сомиты зародыша, после диссоциации легко реагрегировали в скопления, по размерам равные сомитам. Диссоциированные клетки из задних отделов, где еще не образовались сомиты, не реагрегировали с той же легкостью.
Нарушение действия механизма избирательной клеточной сортировки и адгезии в ходе органогенеза приводит к формированию таких пороков развития, как несращение нервной трубки (spina bifida), несмыкание верхнечелюстных костей и их небных отростков (расщелина твердого неба). Мутация гена SOX-9 у человека проявляется в нарушении конденсации и адгезии клеток-предшественников при формировании хрящевых закладок костей и приводит к развитию кампомелической дисплазии. Это заболевание выражается в дефектах образования большинства костей тела и заканчивается смертью детей в период новорожденности от дыхательной недостаточности, вызванной аномалиями хрящей ребер и трахеи.
В постнатальном онтогенезе при нарушении синтеза молекул адгезии может наблюдаться торможение контактного ингибирования пролиферации клеток (см. п. 8.2.1), приводящее к образованию опухолей. Утрата их клетками молекул адгезии сопровождается стойкой дестабилизацией межклеточных контактов и последующим метастазированием. В частности, нарушение синтеза Е-кадгерина, вызванное мутациями кодирующих его генов, приводит к развитию диффузного рака желудка с ранним метастазированием и плохим прогнозом.
Таким образом, сортировка клеток и их избирательная адгезия наряду с другими клеточными процессами играют важную роль на протяжении всего онтогенеза, начиная с самых ранних его этапов, обеспечивая нормальное развитие и функционирование организма. Как и все прочие механизмы развития, клеточная сортировка и адгезия подвержены генетическому контролю.
8.2.4. ГИБЕЛЬ КЛЕТОК
Наряду с описанными выше делением, сортировкой и миграцией клеток, важную роль в индивидуальном развитии организмов играет
процесс программированной гибели клеток, или апоптоза. В эмбриогенезе он является одним из основных механизмов органогенеза и метаморфоза, способствует достижению характерных для определенного биологического вида черт его морфофункциональной организации. В постнатальном развитии апоптоз обеспечивает гибель клеток на терминальных стадиях дифференцировки (например, эритроцитов), стареющих и поврежденных клеток, уничтожение аутореактивных, т.е. действующих против собственных клеток, клонов лимфоцитов и т.д. Помимо этого на протяжении всего развития механизм программированной клеточной гибели обеспечивает регуляцию численности клеток, а именно - установление нужного равновесия между процессами пролиферации и гибели клеток, что в одних ситуациях обеспечивает стабильное состояние организма, в других - рост, в-третьих - атрофию тканей и органов.
В настоящее время различают два принципиально различных типа клеточной гибели: апоптоз (в переводе с греческого «отпадающий») и некроз (см. п. 3.1.2).
Некроз представляет собой патологическую форму смерти клеток в результате их острого повреждения. Он характеризуется разрывом ци-топлазматической и внутриклеточных мембран, что приводит к разрушению органелл, высвобождению лизосомальных ферментов и выходу содержимого цитоплазмы в межклеточное пространство, при этом часто развивается воспалительный процесс, захватывающий территорию от части клетки до целого органа (см. рис. 3.5).
В отличие от некроза, апоптоз - генетически контролируемая клеточная гибель, которая приводит к «аккуратной» разборке и удалению клеток. Он широко распространен и типичен для физиологических условий. В процессе апоптоза наблюдаются следующие морфологические изменения (см. рис. 3.5). Клетка уменьшается в размерах, цитоплазма уплотняется, органеллы располагаются более компактно. Происходит конденсация хроматина под мембраной ядра, при этом образуются четко очерченные плотные массы различной формы и размеров. Ядро может разрываться на два или несколько фрагментов. Затем в апоптоти-ческой клетке формируются глубокие впячивания мембраны, что приводит к фрагментации клетки и формированию окруженных мембраной апоптотических телец, состоящих из цитоплазмы и плотно расположенных органелл, с фрагментами ядра или без них. После чего очень быстро происходит их фагоцитоз, который осуществляется как макрофагами, так и окружающими здоровыми клетками. Очень важно, что при апоп-
тозе не развивается воспалительный процесс и гибель отдельных клеток или их групп происходит избирательно, без повреждения окружающих здоровых клеток.
Выделяют два вида программированной клеточной гибели: апоптоз «изнутри» и апоптоз «по команде».
В первом случае задача процесса - убрать поврежденные клетки. Апоптоз запускается сигналами, возникающими внутри самой клетки при неудовлетворительном ее состоянии - повреждении хромосом, внутриклеточных мембран и т.д.
Второй вариант апоптоза наблюдается во вполне нормальных и жизнеспособных клетках, которые с позиции целого организма оказываются ненужными или вредными. В этом случае клетка получает из внеклеточной среды, например от окружающих клеток, сигнал «погибнуть», который передается через мембранные или, реже, цитоплазма-тические рецепторы. Иногда сигналом для начала апоптоза может быть и отсутствие необходимого сигнала. В результате контакта сигнальных молекул с наружной частью белка-рецептора последний претерпевает структурные изменения, что тем или иным способом приводит к запуску реакций клеточной гибели.
Механизмы апоптоза многообразны. Они представляют собой сложнейшие молекулярные каскады, изучением которых занимаются многие лаборатории по всему миру. Остановимся на роли некоторых основных участников этих каскадов.
Реализуемые в организме схемы осуществления апоптоза различаются в основном своими начальными стадиями (рис. 8.18). Большинство из них осуществляется с участием белка р53 и лишь небольшая часть, например запускаемая с рецепторов ФНО, реализуется без его участия (см. п. 3.1.2).
Какими бы сигналами ни запускалась программируемая клеточная гибель - разнообразными внешними или внутренними, - если в схеме принимает участие белок р53, то происходит его накопление и увеличение активности.
Белок p53 в норме присутствует во всех типах клеток. Он локализуется в ядре, где функционирует как транскрипционный фактор. В его молекуле у человека - 392 аминокислотных остатка, образующих шесть различных по размеру и функции доменов (блоков).
Центральный и самый большой домен (включающий около 200 остатков) отвечает за узнавание энхансеров генов-мишеней и связывание с ними. В результате изменяется активность нескольких групп
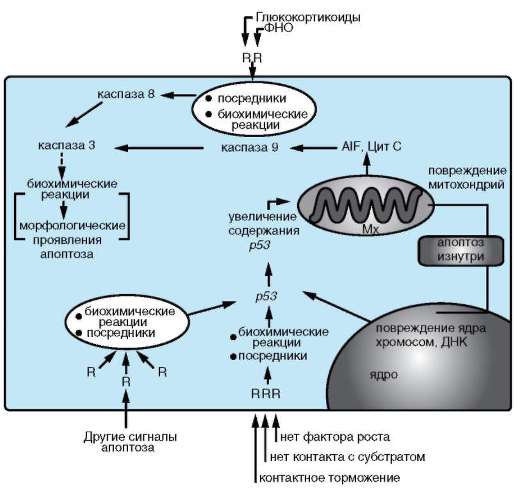
Рис. 8.18. Обобщающая схема некоторых механизмов апоптоза: R - рецептор; ФНО - фактор некроза опухолей
генов и среди них - генов, продукты которых принимают участие в реализации апоптоза. К последним относятся гены, кодирующие белки, стабилизирующие мембраны митохондрий (BCL2, BCLK и др.) и наоборот, повышающие их проницаемость (например, ВАХ, ВАD, BAK). Изменение соотношения этих белков в цитоплазме клетки вызывает повышение проницаемости мембран митохондрий, вследствие чего ее покидают белки, активирующие каспазный каскад через каспазу 9 (Aif, Цит C). Включение апоптозного пути через рецепторы без вовлечения белка р53 активирует этот же каскад, но через каспазу 8.
Каспазы - семейство белков, являющихся непосредственными участниками внутриклеточных реакций, обеспечивающих апоптоз. Кас-пазы представляют собой ферменты - сериновые или цистеиновые ци-топлазматические протеазы, в зависимости от наличия в их активном центре соответствующей аминокислоты. В своих белках-мишенях кас-
пазы разрывают те пептидные связи, которые образованы с участием остатка аспарагиновой кислоты. Считают, что эти ферменты находятся в цитоплазме практически всех клеток, и до инициации реакций клеточной гибели они присутствуют в виде неактивных предшественников - прокаспаз. Последние активируются путем ряда модификаций. Известно 14 каспаз, которые подразделяются на инициаторы, эффекторы и стимуляторы. Каспазы способны в определенной последовательности активировать друг друга, образуя своего рода каскад, причем разветвленный. Инициаторы (каспаза 8 и 9) расщепляют и активируют каспазы-эффекторы. Одна из них - узловое звено каспазного каскада - каспаза 3. Ее мишени - как другие участники этого каскада, так и, возможно, некаспазные белки. Функция завершающих членов каскада - ограниченный протеолиз (разрушение) некоторых цитоплазматических и ядерных белков, что и приводит к развитию морфологических проявлений апоптоза.
В эмбриональном периоде развития основным видом программированной клеточной гибели является апоптоз «по команде».
Особое значение этот клеточный механизм имеет для многих формообразовательных процессов. Так, разделение пальцев на руках или ногах зародыша, разделение локтевой и лучевой костей предплечья, формирование суставов основано на гибели клеток, которая осуществляется избирательно, в определенных участках зачатков конечностей (рис. 8.19). Образование полостей сосудов (кавитация), которые первоначально представляют собой тяжи клеток, разделение верхнего и нижнего век и многие другие процессы развития имеют в своей основе механизм избирательной клеточной гибели.
Апоптоз обеспечивает также и исчезновения органов. Таким образом происходит резорбция личиночных органов животных при метаморфозе, например жаберных лепестков, хвоста и кишечника у головастиков.
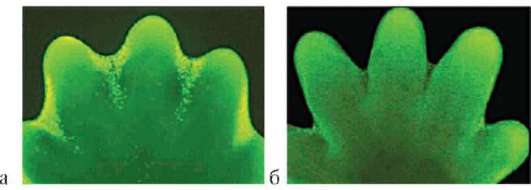
Рис. 8.19. Апоптоз во время нормального развития конечности мыши: а - клетки, подвергающиеся апоптозу, мечены желтым; б - та же конечность через 1 сут
Подобные примеры имеют место и в эмбриональном развитии человека. Как и у других млекопитающих, у человека закладываются 9-10 хвостовых позвонков, волосяной покров, шесть или семь зачатков пальцев. Наблюдаемая в последующем развитии гибель клеток в этих закладках приводит к тому, что в копчике остается 4-5 позвонков, редуцируется большинство волосяных зачатков, а конечности становятся пятипалыми. В ходе развития мочеполовой системы погибают клетки предпочки и туловищной почки, в центральной нервной системе происходит гибель части нейронов, что в большинстве случаев обусловлено отсутствием контакта с клетками-мишенями.
Нарушение механизма программированной клеточной гибели приводит к формированию аномалий развития, таких как синдактилия (сращение пальцев), гипертрихоз (повышенное оволосение), полидактилия (многопалость) (рис. 8.20).
Как уже было сказано, процесс апоптоза требует скоординированной регуляции экспрессии многих генов. Нарушения синтеза белковых продуктов любого из них влекут за собой сбои в развитии и функционировании различных клеточных популяций. Так, к настоящему времени установлено, что активность гена белка bcl-2 требуется для поддержания жизнеспособности лимфоцитов, меланоцитов, эпителия кишечника и клеток почек во время развития эмбриона. Продукт гена bcl-x необходим для ингибирования смерти клеток в эмбриогенезе, особенно в нервной системе. Экспрессия гена Bax требуется для апоптоза тимоци-тов и поддержания жизнеспособности мужских половых клеток в ходе гаметогенеза. Как в раннем, так и в постнатальном развитии механизм клеточной гибели используется организмом для предотвращения не-
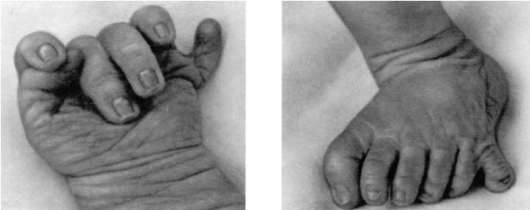
Рис. 8.20. Полидактилия кисти и стопы
санкционированной пролиферации поврежденных или патологически измененных клеток. Мутации гена p53 обнаруживаются примерно в половине опухолей, независимо от их происхождения или типа. Мыши, у которых отсутствовали оба этих гена, проявляли чрезвычайно высокую склонность к развитию злокачественных образований в результате полного или частичного нарушения апоптоза предопухолевых клеток.
Таким образом, программированная клеточная гибель является естественным, эволюционно обусловленным и генетически контролируемым механизмом развития, активно реализуемым организмом на различных стадиях онтогенеза для решения широкого спектра задач.
8.2.5. ДИФФЕРЕНЦИРОВКА КЛЕТОК
Еще один клеточный механизм развития - дифференцировка клеток (см. раздел 3.1.3). Именно благодаря ей однородный клеточный материал зародыша становится разнородным, образует ткани, входит в состав различных органов и систем, т.е. дифференцировка клеток является основой процесса дифференциации частей и структур зародыша.
Так, в эмбриогенезе человека из одной соматической клетки - зиготы - формируется особь, имеющая нервную, мышечную, соединительную и эпителиальную ткани, в состав которых входит более (не менее) 220 клеточных типов (например, клетки соединительной ткани - остеоциты, хондроциты, фибробласты, лейкоциты, эритроциты и т.д.). Клетки и ткани образуют опорно-двигательную, сердечно-сосудистую, мочеполовую, иммунную и другие системы органов. Напомним, что истинная многоклеточность - это многотканевый организм.
Клеточной дифференцировкой (цитодифференцировкой) называется процесс приобретения клетками биохимических, морфологических и функциональных различий. Другими словами, это процесс, в результате которого клетка становится специализированной, имеющей характерное строение, определенный тип метаболизма, и способной к выполнению определенных функций.
Как правило, дифференцируются не отдельные клетки, а группы сходных клеток, которые претерпевают постепенные изменения на протяжении нескольких клеточных циклов. Дифференцировка клеток, гистогенез и морфогенез совершаются в совокупности, причем в определенных участках зародыша и в определенное время. Это очень важно, потому что указывает на координированность и интегрированность эмбрионального развития. Первые биохимические и морфогенетические
различия между клетками у большинства позвоночных обнаруживаются в период гаструляции.
Для недифференцированного состояния клетки характерны относительно крупное ядро и высокое ядерно-цитоплазматическое отношение, диспергированный хроматин (преобладает эухроматин) и хорошо выраженное ядрышко, многочисленные рибосомы и интенсивный синтез РНК, высокая митотическая активность и неспецифический метаболизм (активны гены «домашнего хозяйства»). Все эти признаки изменяются в процессе дифференцировки, характеризуя приобретение клеткой специализации.
8.2.5.1. Роль генетического материала в дифференцировке клеток
На чем же основана клеточная дифференцировка? Развитие представлений о механизмах цитодифференцировки представлено на рис. 3.6.
В конце XIX в. А. Вейсман предложил механическую модель цито-дифференцировки. Он предполагал, что при делении клеток зародыша распределение генетического материала не происходит равномерно. Только линия половых клеток получает при делении и передает потомкам полный набор хромосом. Линии же соматических клеток наследуют лишь часть генетического материала, причем все они отличаются друг от друга по количеству и содержанию полученного материала. Предположение Вейсмана нашло ряд подтверждений. Так, в ходе делений дробления у аскариды наблюдается элиминация, т.е. утрата, части хромосом. Это явление получило название диминуция хроматина. Полный набор неповрежденных (интактных) хромосом сохраняется только в том бластомере, который в дальнейшем дает начало первичным половым клеткам. Элиминация целых хромосом была обнаружена у некоторых насекомых, низших ракообразных и даже одного из представителей сумчатых млекопитающих. У последних все соматические клетки содержали лишь одну половую хромосому Х, а предшественники половых клеток - две хромосомы: ХХ или ХY в зависимости от пола животного.
В дальнейшем выяснилось, что в ходе цитодифференцировки количество генетического материала может не только уменьшаться, но и увеличиваться. У некоторых насекомых, моллюсков, круглых червей в клетках слюнных желез, эпителии желудка и задней кишки, мальпигиевых сосудах и ряде других тканей обнаружены политенные хромосомы. Такие хромосомы, содержащие до тысячи и даже более копий одной и той же молекулы ДНК, образуются в результате многократной ее репликации, не сопровождающейся последующим разделением этих молекул. Явле-
ние амплификации - многократного избирательного копирования отдельных генов, наблюдаемое, в частности, в овогенезе амфибий, также приводит к увеличению количества генетического материала в определенных клетках особи (см. п. 2.4.3.4). Однако все приведенные примеры являются скорее исключением, нежели правилом.
Как установлено к настоящему времени, сбалансированность генотипа по дозам генов - одно из основополагающих условий нормального развития особи. Действительно, формирование новых организмов в подавляющем большинстве случаев происходит из одной или нескольких диплоидных соматических клеток, которые делятся митозом. Этот механизм деления обеспечивает равномерное распределение генетического материала в дочерних клетках и генетическую идентичность материнской и дочерних клеток. Следовательно, все соматические клетки, образующиеся в ходе развития, среди которых и первичные половые клетки, имеют полный набор генетического материала. (Редкие случаи соматических мутаций учитывать не будем.) Наиболее прямые доказательства эквивалентности геномов соматических клеток получены методами молекулярной гибридизации нуклеиновых кислот (см. п. 5.2.2.3). Уже более 20 лет тому назад их применение показало, что ДНК всех типов клеток большинства позвоночных животных имеют одинаковое количество и одинаковые типы последовательностей нуклеотидов.
Функциональная полноценность генетического материала соматических клеток была доказана в экспериментах Дж. Гердона. Суть опытов заключалась в следующем (см. рис. 3.2). Ядро яйцеклетки шпорцевой лягушки, которое содержало два ядрышка, подвергали ультрафиолетовому облучению, чем вызывали его инактивацию. Вместо него в цитоплазму яйцеклетки помещали ядро с одним ядрышком, взятое из дифференцированных клеток кожи взрослой особи или кишечника головастика. В определенном проценте случаев из такой яйцеклетки развивался нормальный организм, все клетки которого имели ядро с одним ядрышком. Полученный результат доказывает, что ядро дифференцированной клетки содержит всю информацию, необходимую для полноценного развития особи.
О функциональной полноценности генетического материала зрелой соматической клетки свидетельствуют и выполненные к настоящему времени многочисленные эксперименты по клонированию растений, животных, в том числе и млекопитающих. Клонирование, в основе которого лежит трансплантация ядер дифференцированных соматических клеток в энуклеированные (лишенные ядра) ооциты, представило не-
опровержимые доказательства того, что геном эукариотических клеток не претерпевает необратимых изменений в ходе их дифференцировки и может быть репрограммирован, т.е. возвращен на уровень функциональной активности, наблюдаемый у зиготы. Более того, показано, что ядра высокодифференцированных клеток, таких как В- или Т-лимфоциты, способны обеспечить полноценное развитие особи в сходных экспериментах, несмотря на то что некоторые их гены (иммуноглобулинов и Т-рецепторов) претерпевают перестройку в ходе дифференцировки. И хотя остается неясным, способны ли сохранять возможность реализации информации гены любых типов дифференцированных клеток, список обладающих такой способностью клеток достаточно велик и включает у млекопитающих в том числе фибробласты эмбрионов и взрослых животных, эпителиальные клетки молочной железы и яйцевода, В- и Т-лимфоциты, незрелые клетки Сертоли и пролиферирующие нейральные клетки коры головного мозга эмбрионов. Следовательно, причина дифференцировки - не изменение количества или функциональной полноценности генетического материала в клетках, а какие-то иные механизмы.
В настоящее время считают, что возникающая в процессе развития специализация клеток - результат дифференциальной (или избирательной) экспрессии генов . Эта точка зрения ведет начало от Т. Моргана, который, опираясь на хромосомную теорию наследственности, предположил, что дифференцировка клеток в процессе онтогенеза является результатом последовательных реципрокных (взаимных) влияний цитоплазмы и меняющихся продуктов активности генов. Различные типы клеток используют разные гены из одинакового набора, присутствующего в каждой клетке. Это означает, что в конкретных клетках активны не все гены, а только часть из них, причем экспрессия тех или иных генов происходит избирательно в зависимости от типа клеток, этапа онтогенеза и других факторов. Результатом такой избирательной экспрессии становится образование в разных типах клеток различных наборов белков, которые обеспечивают протекание в клетках определенных биохимических реакций, специфичность их строения и функции. Так, нервные клетки способны возбуждаться и передавать это возбуждение на другие клетки, эритроциты - транспортировать кислород к тканям, мышечные клетки - сокращаться и тем самым обеспечивать различные проявления движения, фоторецепторы - воспринимать световой поток. Выполнение этими клетками специфических функций определяется их строением, а именно: наличием отростков у нейронов,
по которым передается возбуждение; двояковогнутой формой эритроцитов, позволяющей им проникать в узкие капилляры и осуществлять газообмен; значительной протяженностью мышечных волокон, образованных при слиянии нескольких клеток-предшественников, что делает их способными эффективно изменять свою длину; формированием складок мембраны, где располагается фотопигмент, у палочек и колбочек. Указанные морфофункциональные различия обеспечиваются разнообразием белков: нейроны продуцируют нейропептиды, эритроциты - гемоглобин, мышечные клетки - актин и миозин, клетки сетчатки - опсины. В некоторых случаях дифференцировка оказывается связанной с синтезом не белков, а других веществ, например сахаров и их производных. Так, межклеточное вещество хрящевой ткани состоит из мукополисахаридов - производных углеводов. Однако их синтез в клетках-хондробластах невозможен без некоторых специфических ферментов, а последние - это белки. Поэтому утверждение, что в основе подавляющего большинства клеточных дифференцировок лежит синтез специфических белков, абсолютно справедливо. Следует подчеркнуть, что этот принцип диффе-ренцировки является общим в онтогенезе как животных, так и растений, несмотря на то что между ними существуют огромная эволюционная дистанция и существенные различия в характере развития.
Гипотезу избирательной активности генов подтверждают данные, полученные в генетических и эмбриологических исследованиях. Один из объектов, позволяющих визуально, с помощью светового или электронного микроскопа изучать активность отдельных генов, - политенные хромосомы. В них хорошо видны темноокрашенные области плотной упаковки ДНК, которые получили название дисков. Между ними расположены светлые участки генетического материала менее плотной упаковки. Многие отдельные диски соответствуют отдельным генам. Активная транскрипция определенных генов в таких хромосомах сопровождается образованием вздутий или пуфов на месте дисков (рис. 8.21). Сравнение различных типов дифференцированных клеток по набору только что транскрибированных молекул пре-мРНК, выполненное методом молекулярной гибридизации молекул РНК с комплементарными им ДНК, также выявило различия в зависимости от типа клеток. Было показано, что клетки разных типов, синтезирующие отличающиеся мРНК и белки, демонстрируют в одних и тех же хромосомах различную локализацию пуфов. Кроме того, расположение пуфов меняется в ходе онтогенетического развития, что коррелирует с синтезом определенных белков в конкретный промежуток времени (рис. 8.21).

Рис. 8.21. Последовательное изменение активности трех пуфов с особой морфологией - колец Бальбиани (КБ1-КБЗ) у Chironomus tentans: 1 - диск; 2 - междисковый промежуток; 3 - пуф
По мере развития число функционирующих генов в клетке, по-видимому, прогрессивно снижается. Так, из 40 тыс. генов одного из видов морского ежа на стадии бластулы активны примерно 30 тыс., гаструлы и личинки - 12-15, у взрослых животных - 5-7 тыс. генов. У человека, по некоторым оценкам, в раннем эмбриогенезе активны до 60% генов, а в дифференцированных клетках взрослого организма - от 1 до 7-10% (по отдельным данным, до 44% в нервных клетках). Установлено, что часть генов при усилении специализации блокируется в клетках необратимо. Подтверждением тому могут служить уже упоминавшиеся опыты Гердона по пересадке ядра дифференцированной клетки в яйцеклетку с инактивированным собственным ядром. Количество успешных развитий особей прямо зависело от возраста донора (рис. 8.22). С этой точки зрения дифференцировка может быть определена как экспрессия той части генома, которая остается в распоряжении клетки. Вместе с тем эти опыты обнаружили и другие важнейшие закономерности. Так, они еще раз подтвердили предположение Т. Моргана о решающем значении взаимодействия цитоплазмы и ядра в жизнедеятельности клеток и развитии организма.
Как было сказано ранее (см. п. 2.4.4.4-е), структурные гены генотипа подразделяются на две группы: гены «домашнего хозяйства», кодирующие белки, обеспечивающие реализацию фундаментальных процессов жизнедеятельности в клетке, и гены дифференцировки, называемые также гены «роскоши». Последние отвечают за синтез специфических белков. На самых ранних этапах эмбрионального развития, а именно в ходе дробления, когда начинает работать собственный геном зародыша, первоначально экспрессируются только гены «домашнего хозяйства». Синтез белков, кодируемых генами «роскоши», в клетках большинства
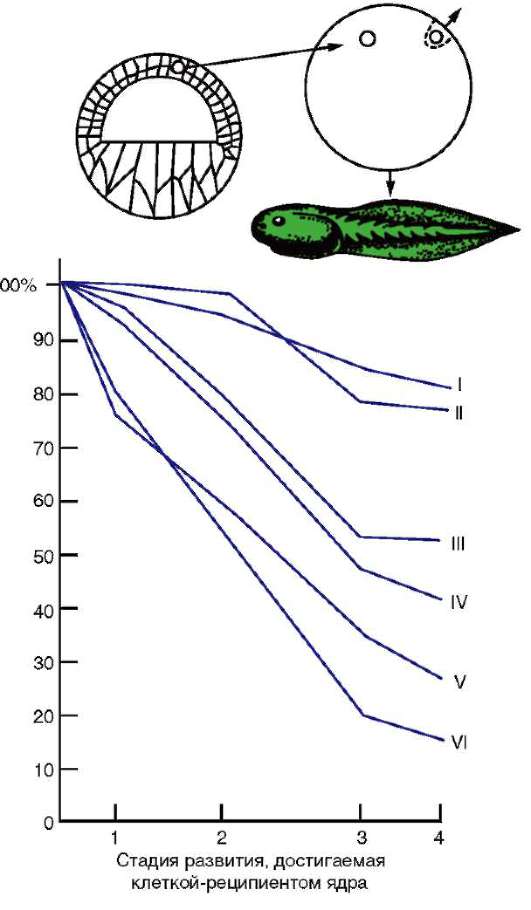
Рис. 8.22. Зависимость успеха пересадки ядер из дифференцированной клетки в яйцеклетку от возраста донора (i-VI) ядра: I - бластула; II - гаструла; III - нейрула; IV - появление мышечной реакции; V - начало сердечной деятельности и вылупления; VI - активное плавание; 1 - ранняя гаструла; 2 - нейрула; 3 - плавающий головастик; 4 - питающийся головастик; вверху изображена схема опыта
хордовых осуществляется, начиная со стадии бластулы. В этой группе представлены гены, кодирующие тканеспецифические белки, характерные для всех типов клеток данной ткани (например, нервной), и гены, кодирующие типоспецифические белки, определяемые только в конкретных специализированных клетках (например, в колбочках). Первоначально на этапах дифференцировки включаются гены, отвечающие за синтез тканеспецифических белков, а затем - типоспецифических. Проследить это возможно на примере синтеза белков мембраны. Клетки разных типов характеризуются различными белковыми компонентами клеточной поверхности, которые к тому же изменяются по мере развития клеток. Эти специфические мембранные белки часто выявляют с помощью антисывороток, поэтому их называют антигенами диф-ференцировки. На рис. 8.23 показаны временные изменения клеточной мембраны одной эпителиальной клетки дрозофилы по мере того, как она превращается в фоторецептор сетчатки. Как только эпителиальная клетка приобретает свойства нейрона, она экспрессирует антиген 22С10, который обнаруживается и на других нервных клетках. Вскоре клетка начинает синтезировать другую молекулу клеточной мембраны - антиген 24В10, что характерно только для нейронов, дающих начало фоторецепторам. На более поздних стадиях в некоторых областях созревающего фоторецептора появляется антиген 21А6, а затем другой,
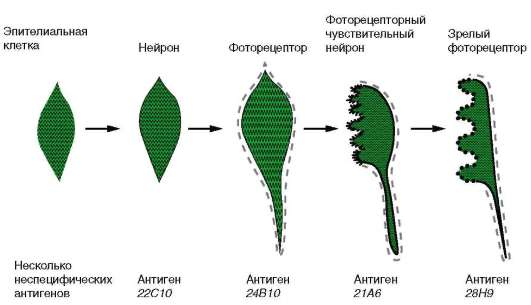
Рис. 8.23. Избирательность синтеза специфических белков клеточной мембраны в ходе дифференцировки нейрона в фоторецептор сетчатки
28Н9, специфические для окончательно дифференцированных фоторецепторов сетчатки.
Число активных генов терминальной дифференцировки в специализированных клетках очень невелико. При изучении разнообразия мРНК в почках, печени и головном мозге мышей было обнаружено, что большая их часть была одинакова и представляла собой результат транскрипции генов «домашнего хозяйства». Лишь примерно 1/10 из общего количества активных генов, число которых, как было сказано выше, составляет 1-10%, оказались специфичны для какой-либо одной ткани (т.е. всего около 0,1-1% от общего числа генов генома). Именно они транскрибировались с уникальных нуклеотидных последовательностей генов «роскоши».
Часть клеток развивающегося организма не вступает на путь дифференцировки, сохраняя способность к самообновлению и потенциал к развитию, - стволовые клетки (см. п. 3.1.2). Во взрослом организме присутствуют региональные стволовые клетки, которые могут дать начало одному, нескольким или многим типам специализированных клеток. Они найдены не только в хорошо регенерирующих в норме тканях, таких как эпителий и красный костный мозг, но также и в статических, образующих, например, нервную систему и печень. Стволовые клетки играют центральную роль в гистогенезе и, кроме того, составляют существенный восстановительный резерв в организме, способствуя замещению дефектов, возникающих в силу тех или иных обстоятельств в разных органах.
Избирательная экспрессия генов, наблюдаемая в ходе клеточной дифференцировки, основана на действии целого ряда механизмов, которые условно можно разделить на две группы: локальные - внутриклеточные, обеспечивающие избирательную экспрессию генов в отдельной клетке, и системные (межклеточные взаимодействия, эмбриональная индукция, нервная и гуморальная регуляция). Последние, определяя целостность развивающегося организма и достижение определенного конечного результата, регулируют дифференцировку клеток в строго определенном направлении и закономерное расположение различных дифференцированных клеточных типов в целом организме. Еще одним важным механизмом, обеспечивающим процесс дифференцировки и целостное развитие организма, является гетерогенность яйцеклетки (овоплазматическая сегрегация).
Рассмотрим различные механизмы регуляции экспрессии генов более подробно.
8.2.5.2. Локальные механизмы дифференцировки и детерминации
Под экспрессией гена понимают синтез в клетке функционально активной формы белка, кодируемого данным геном. Процесс реализации генетической информации у эукариот к настоящему времени достаточно хорошо изучен, однако регуляция этого многоступенчатого процесса очень сложна и неоднозначна (см. главу 2). Данные, накопленные в результате многолетней и кропотливой работы многих исследователей, позволяют выделить следующие возможные уровни регуляции биосинтеза белков, а, следовательно, и дифференцировки клеток, основанной, прежде всего, на приобретении клетками биохимических различий: регуляция путем соматических мутаций, регуляция транскрипции, регуляция процессинга мРНК и транспорта мРНК в цитоплазму, регуляция трансляции, регуляция на посттрансляционном уровне.
К регуляции путем соматических мутаций могут быть отнесены случаи качественного и количественного изменения генетического материала, происходящие в ходе развития в отдельных соматических клетках. Помимо элиминации хромосом, амплификации генов, образования политенных хромосом (см. п. 8.2.5.1), примером может служить перестройка генов иммуноглобулинов, в результате которой в организме человека иммунокомпетентные клетки могут синтезировать широкий спектр различных белков-антител. В организмах высших животных, в том числе человека, существует более миллиона клонов В-лимфоцитов, различающихся по продуцируемым антителам (иммуноглобулинам). Иммуноглобулины состоят из так называемых легких и тяжелых аминокислотных цепей. Гены для легких цепей содержат 2 вариабельных сегмента ДНК (V и J) и константный сегмент С. Сегмент V включает около 250 различных нуклеотидных последовательностей, а сегмент J - 4 таких последовательности. На нитях ДНК еще недифференцированных клеток участки V, J и С пространственно разделены. В эмбриональном развитии в ходе дифференцировки Б-лимфоцитов промежуточная ДНК элиминируется, и любая из V-последовательностей может сблизиться с любой из J-последовательностей, а их комбинация - с константным С-сегментом, т.е. происходят перемещения (транслокации) нуклеотидных последовательностей ДНК. Таким образом, может быть образовано около 1500 различных комбинаций генов. Гены для тяжелых цепей содержат вариабельные сегменты V, D и J, состоящие, соответственно, из 500, 15 и 4 последовательностей, а также константный участок С (рис. 8.24). Их комбинирование дает около 30 000 вариантов. При синтезе конкретного иммуноглобулина объединяются белки, коди-
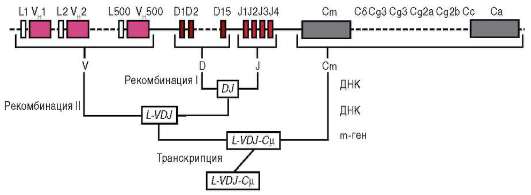
Рис. 8.24. Рекомбинация генов, кодирующих тяжелые цепи иммуноглобулинов (V, D, J и С)
руемые одним из генов легких цепей и одним из генов тяжелых цепей, что определяет возможность продуцировать около 100 млн различных типов антител.
Подобные механизмы, в отличие от обсуждаемых далее, являются скорее исключением и обнаруживаются либо у отдельных видов животных, либо на определенных стадиях развития, либо обеспечивают реализацию конкретной внутриорганизменной задачи.
Как было установлено, в подавляющем большинстве случаев все соматические клетки организма имеют идентичный по количеству и содержанию набор ДНК. Наблюдаемая при их дифференцировке избирательная активность генов регулируется на разных стадиях процесса реализации генетической информации - от транскрипции до посттрансляционных изменений образованных полипептидных цепей - и базируется на действии многообразных механизмов. Экспрессия одного и того же гена может подвергаться действию различных регулирующих механизмов.
Регуляция транскрипции обеспечивает синтез первичных транс-криптов (пре-мРНК) только на определенных структурных генах. Некоторые примеры избирательной транскрипции обсуждались ранее - это синтез мРНК на выпетлившихся участках хромосом ооцита типа «ламповых щеток», а также на вздутых участках - пуфах - политен-ных хромосом в ядрах клеток слюнных желез некоторых насекомых
(см. п. 2.4.3.4).
Наборы транскрибируемых генов отличаются в разных клетках на разных этапах развития, что и определяет направление их дифференцировки. В многомодульной регуляции транскрипции в
эукариотических клетках принимает участие ряд нуклеотидных последовательностей ДНК, которые выполняют сервисные и регуляторные функции (см. п. 2.4.5.5). Прежде всего, это расположенные в непосредственной близости от кодирующих последовательностей гена участки ДНК: промоторы и операторы. Промоторы связывают РНК-полимеразу, комплекс общих транскрипционных факторов и специфические факторы транскрипции, операторы взаимодействуют с белками-регуляторами и веществами небелковой природы - эффекторами. Наличие нескольких промоторов в одном гене обусловливает альтернативную транскрипцию, т.е. образование различных форм мРНК при инициации считывания с разных промоторов. Так, в гене, кодирующем белок дис-трофин, имеется 8 промоторов, с которых происходит альтернативная транскрипция в разных тканях (сердечных и скелетных мышцах, эмбриональных нейронах, коре головного мозга, сетчатке глаз), что приводит к образованию в этих тканях различных изоформ белка. Обсуждается возможность формирования разных мРНК, транскрибируемых с одного гена, за счет использования альтернативных терминаторов (рис. 8.25).
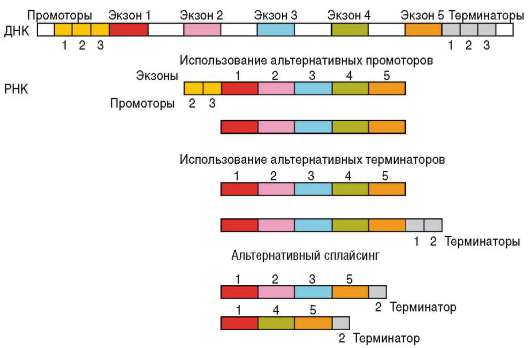
Рис. 8.25. Схема возможных механизмов синтеза различных мРНК с одного гена
Помимо этого имеются области ДНК, называемые энхансерами. Они могут располагаться на значительном расстоянии от регулируемых генов (за тысячи нуклеотидов) и контролировать работу не одного конкретного, а целой группы доступных для них генов. Энхансеры связываются с комплексами белков, которые в зависимости от своего состава могут либо усиливать, либо подавлять транскрипцию данного структурного гена. Воздействие энхансера на конкретный ген осуществляется благодаря изгибу расположенного между ними участка ДНК, в результате чего комплекс энхансер-белки устанавливает непосредственный контакт со структурным геном (см. рис. 2.36). Изгиб становится возможен вследствие деконденсации участка ДНК, расположенного между энхансером и контролируемым им геном.
К процессам, регулирующим активность генов на уровне транскрипции, следует отнести также метилирование-деметилирование различных участков ДНК. Метилирование - присоединение метильной группы к цитозину, наблюдаемое в том случае, если рядом с ним находится гуанин, т.е. в составе динуклеотидов ЦГ (CpG). У млекопитающих в соматических клетках взрослого организма метилирование ДНК обычно происходит в последовательностях длиной 1000-2000 пар - CpG-островках, в которых содержание динуклеотидов ГЦ в 10-20 раз выше, чем в среднем по геному. CpG-островки присутствуют в 5' регуля-торных областях многих генов. Их метилирование препятствует взаимодействию регуляторных белков (факторов транскрипции) с промотором и блокирует активность генов. Обратный процесс - деметилирование приводит, соответственно, к деблокированию активности генов.
Одно из наиболее значимых в последние годы открытий в области регуляции генной экспрессии в раннем периоде онтогенеза млекопитающих - установление феномена перепрограммирования генома. На стадии дробления от зиготы до бластоцисты отмечается практически тотальное деметилирование генома, (за исключением импринтированных локусов (см. п. 4.1.1)), в результате чего происходит активация генов. Предполагается, что подобные преобразования генома существенны для обеспечения тотипотентности зиготы.
В период имплантации, когда наблюдается обособление зародышевых и внезародышевых листков (групп клеток), запускается процесс установления тканеспецифичного метилирования. При этом уровень метилирования ДНК в клетках трофобласта возрастает незначительно, в то время как ДНК клеток-производных внутренней клеточной массы, дающих начало эмбриональным структурам, подвергается су-
щественному метилированию. Возрастающая плотность метилирования коррелирует с последующим сужением спектра возможных путей дифференцировки клеток. Показано, что рисунок метилирования оказывается специфическим для данного типа клеток и способствует поддержанию устойчивости его дифференцировки. У человека за процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами (DNMT1, DNMT3a, DNMT3b). Предполагается, что DNMT3a и DNMT3b - это метилтрансферазы, которые осуществляют формирование рисунка метилирования ДНК на ранних стадиях развития. DNMT1 является, предположительно, ферментом, поддерживающим метилирование ДНК на более поздних стадиях развития организма и отвечающим за присоединение метильной группы на комплементарной цепи при репликации ДНК дочерней клетки.
Установлено, что изменение доступности промоторов для белков, участвующих в транскрипции, и, следовательно, обеспечение избирательной экспрессии генов достигается также благодаря ацетилирова-нию гистонов. Гистоны целенаправленно модифицируются с помощью ферментов ацетилтрансфераз на тех промоторах, которые требуется активировать. Деацетилирование гистонов, в частности Н4, ремоделирует структуру хроматина, повышая степень его компактизации, что приводит к репрессии транскрипции.
Еще один механизм избирательной транскрипции структурных генов в дифференцирующихся клетках связан с пространственной организацией хромосом в интерфазных ядрах. Так, согласно некоторым данным, при дифференцировке В-лимфоцитов гены CD2, CD4, CD8-alpha, CD19, CD45-lambda5 включаются в состав гетерохроматина, в результате чего их экспрессия подавляется. Связь неактивных генов с гетерохромати-ном осуществляется с помощью белка Ikaros, который специфически связывается с промоторами генов и тем самым «рекрутирует» их в состав гетерохроматина.
Другой недавно обнаруженный фактор, влияющий на активность и, возможно, на специфичность транскрипции - размер петлеобразных участков ДНК - доменов, возникающих при прикреплении молекулы к ядерному матриксу (см. п. 2.4.3.2). У шпорцевой лягушки до 12-го деления дробления зародыша транскрипции на его генах не происходит, и петли хроматина не имеют постоянных точек фиксации на ядерном матриксе. С началом экспрессии собственного генома места их прикрепления точно фиксируются. По ходу развития размер хроматиновых петель, как правило, увеличивается. Кроме того, во всех клетках выявлены
одинаковые петли ДНК, что позволяет сделать вывод о сохранении в ряду клеточных делений специфической организации доменов, разделенных зонами прикрепления. Предполагается, что при образовании петель могут фиксироваться позиции различных регуляторных элементов и их мишеней - структурных генов, способствуя их взаимодействию либо, наоборот, исключая его.
Регуляция процессинга РНК ранее обозначалась как посттранскрипционная. Считалось, что она осуществляется лишь после окончания транскрипции. По современным данным, однако, процессы «созревания» пре-мРНК протекают еще во время самой транскрипции - котранскрипционно.
Один из широко используемых механизмов в процессинге РНК - альтернативный сплайсинг. Как известно, только что транскрибированная молекула пре-мРНК состоит не только из участков, несущих генетическую информацию (экзонов), но и из некодирующих «вставок» (интронов). Еще в ходе транскрипции интроны удаляются из новосинтезированной мРНК. Оставшиеся экзоны могут соединяться в различных комбинациях, в результате чего из одной молекулы пре-мРНК может образоваться несколько типов более коротких молекул мРНК, кодирующих различные белки (изоформы белка) (см. п. 2.4.5.5, см. рис. 8.25). Было показано, например, что в результате альтернативного сплайсинга первичного транскрипта гена каль-цитонина могут быть образованы различные мРНК. В результате в клетках щитовидной железы он экспрессируется в виде гормона каль-цитонина, а в клетках гипофиза - в виде нейропептида CGRP, и эти пептиды будут участвовать в дифференцировке совершенно различных типов клеток.
Анализ сотен миллионов фрагментов РНК из разных тканей и органов человека показал, что до 60%, а по некоторым данным, до 94% генов подвергаются альтернативному сплайсингу, причем в разных тканях производятся разные наборы изоформ белков. Благодаря альтернативному сплайсингу разнообразие белков в организме млекопитающих значительно выше, чем у низших животных, хотя количество генов у тех и других примерно одинаково.
Интересно, что среди генов, сплайсинг которых отличается наиболее строгой тканеспецифичностью (в одних тканях всегда или почти всегда синтезируется только одна изоформа, в других - другая) повышена доля генов-регуляторов индивидуального развития, обмена веществ, межклеточных взаимодействий и передачи сигналов. Это именно те
функции, от которых зависят структурные и функциональные различия между клетками и тканями.
В ходе формирования функционально активной мРНК может осуществляется также редактирование (эдитинг) РНК. Суть его состоит во внесении изменений в молекулу РНК - замена оснований, вырезание и вставка нуклеотидов, которые позволяют синтезировать иные полипептиды на отредактированных матрицах. Хорошо изучен процесс редактирования мРНК аполипопротеина В (АроВ) млекопитающих, участвующего в транспорте холестерина и триглицеридов. Обнаружены две формы AроB, кодируемые одним и тем же геном и образующиеся в результате редактирования AроB-мРНК. Ген AроB человека содержит 29 экзонов, и его общая длина составляет 43 тыс. п.о. Длина мРНК этого гена, кодирующей ApoB100, составляет 14 тыс. оснований. В середине самого большого экзона 26 имеется глутаминовый кодон CAA, который в результате редактирования мРНК превращается в нонсенс-кодон UAA, что приводит к образованию более короткой мРНК длиной в 7 тыс. оснований. В результате трансляции редактированной мРНК образуется укороченный AроB48. Полноразмерный белок Аро100 синтезируется в клетках печени и вовлечен в транспорт эндогенно синтезированных триглицеридов и холестерола, АроВ48 образуется в клетках кишечника и задействован в транспорте жиров, поступающих с пищей и всасывающихся в кишечнике.
Помимо указанных механизмов регуляции избирательной экспрессии генов на уровне процессинга РНК есть еще один - регуляция транспорта мРНК из ядра. Например, у млекопитающих лишь около 5% синтезированной РНК покидает ядро и транспортируется в цитоплазму. Достоверно неизвестно, каким образом происходит отбор конкретных РНК, подлежащих участию в трансляции. Однако изучение геномов различных млекопитающих позволяет указать один из механизмов такого отбора. Суть его заключается в том, что в молекулу РНК, служащую матрицей для синтеза белка, вносятся изменения, делающие молекулу «бессмысленной», и тогда она уничтожается. Обнаружено, что подобные изменения вносятся в ультраконсервативные участки ДНК, которые абсолютно идентичны у разных групп млекопитающих, в частности, у человека и мыши. Установлено, что таким образом происходит регуляция экспрессии генов, белки которых принимают участие в осуществлении альтернативного сплайсинга.
Следующий уровень регуляции избирательной экспрессии генов - уровень трансляции. Даже при одинаковом наборе готовых к транс-
ляции мРНК клетки могут различаться между собой по времени начала и по скорости трансляции. Регуляция трансляции включает в себя репрессию-дерепрессию собственно трансляции, а также стабилизацию-дестабилизацию мРНК (см. п. 2.4.5.6). Наиболее общий пример регуляции такого рода - блокирование трансляции заготовленных в оогенезе материнских мРНК вплоть до активации яйцеклетки. Инактивацию и стабилизацию материнских мРНК в ооцитах обеспечивают определенные белки, например FRGY2 у шпорцевой лягушки или p50 у кроликов, участвующие в запасании мРНК в составе рибонуклеопротеиновых частиц - информосом.
В дальнейшем по ходу дробления материнская мРНК вступает в трансляцию также не сразу повсеместно, а по определенной пространственно-временной программе. Устранение блока трансляции на временно инактивированных мРНК после активации яйцеклетки достигается в том числе добавлением большого количества адениловых групп на 3'-конце молекул. Полиаденилирование происходит у многих эукариотических организмов и является крайне консервативным механизмом регуляции функционирования мРНК на ранних стадиях развития. Полиаденилирование осуществляется поли(А)-полимеразами (PAP), одна из которых находится в ядре, а другая локализована в цито плазме.
Существенные задержки в начале трансляции уже заготовленных мРНК отмечены также при дифференцировке эритроидных, спермато-генных и других специализированных типов клеток.
Изменение скорости трансляции наблюдается, например, в ходе дифференцировки клеток хрусталика куриного зародыша: на 6-е сутки эмбрионального развития на 1 молекулу мРНК синтезируется в 5 раз больше соответствующего белка (α-кристаллина), чем на 19-е сутки.
Недавно был открыт новый способ регуляции на уровне трансляции, основанный на так называемой РНК-интерференции. Это явление впервые было обнаружено у круглого червя Caenorhabditis elegans, а к настоящему времени выявлено у многих эукариотических организмов, в том числе у человека. В клетке на требуемых стадиях развития благодаря активности определенных генов и последующему процессингу возникают короткие молекулы РНК (размером 21-28 нуклеотидов). Они связываются с комплементарными участками транслируемых мРНК, что приводит к подавлению синтеза белка молекулы, а иногда и к деградации активных мРНК. Возможность РНК-интерференции установлена в цитоплазме яйцеклетки насекомых.
После завершения трансляции осуществляется посттрансляционная регуляция экспрессии гена. Вновь синтезированный полипептид, прежде чем стать функционально активным, проходит многочисленные превращения, например отщепление фрагментов, различные химические модификации, например добавление фосфатных или углеводных групп (ацетилирование, фосфорилирование и гликозилирование), изменение третичной структуры, образование в ряде случаев четвертичной структуры из нескольких субъединиц, наконец, так называемую «адресацию» - перемещение к месту окончательного функционирования.
Время и место посттрансляционных превращений, как правило, строго определены. Временная задержка посттрансляционных модификаций может быть достаточно большой. Например, фермент тирози-наза появляется у зародышей амфибий еще в раннем эмбриогенезе, но переходит в активную форму лишь после вылупления зародыша. Роль посттрансляционных модификаций в регуляции клеточной дифферен-цировки изучена еще далеко не достаточно, но предполагают, что она весьма значительна.
Таким образом, представленные в данном разделе механизмы регуляции избирательной экспрессии генов объясняют, каким образом в ходе индивидуального развития может осуществляться процесс диффе-ренцировки различных типов клеток. Следует иметь в виду, что избирательной экспрессии подвергаются, как правило, не отдельные гены, а целые группы (блоки) генов, обеспечивающие специфическую диффе-ренцировку клеток конкретного типа. После активации блока генов их экспрессия поддерживается на определенном уровне. Этим может быть объяснена высокая устойчивость дифференцированного состояния многих типов клеток.
Однако формирование целостного организма в ходе индивидуального развития не сводится только к приобретению специфичности конкретными группами клеток, поэтому применительно к многоклеточному организму клеточная дифференцировка неотрывна от пространственно-временных аспектов и, следовательно, от еще более высоких уровней ее регуляции, нежели уровни регуляции биосинтеза белка на клеточном уровне. На организменном уровне регуляция дифференцировки осуществляется благодаря системным механизмам развития или механизмам интеграции, реализация которых обеспечивает целостность и интегрированность организма на всех стадиях его онтогенеза, начиная с момента образования зиготы. Подробно эти механизмы рассматриваются в следующих разделах.
8.2.6. ГЕТЕРОГЕННОСТЬ ЯЙЦЕКЛЕТКИ
КАК ОСНОВА ДИФФЕРЕНЦИРОВКИ
Зрелая яйцеклетка, которую Т.Х. Морган справедливо считал самой дифференцированной клеткой в организме, представляет собой мозаичную, высокогетерогенную систему. Один из процессов, приводящий к гетерогенности яйцеклетки - овоплазматическая сегрегация.
Неравномерное распределение компонентов цитоплазмы в яйцеклетке можно обнаружить уже на стадии созревания. Как было показано в п. 7.2, овоплазматическую сегрегацию сопровождает поляризация яйцеклетки. Остановимся более подробно на процессах, приводящих к овоплазматической сегрегации и роли последней в дифференцировке клеток развивающегося зародыша.
Формирование сегрегации цитоплазмы подробно изучено в созревающем яйце дрозофилы. Неоднородность цитоплазмы яйцеклетки возникает в том числе вследствие неравного положения ее полюсов среди клеток материнского организма. К переднему полюсу яйцеклетки примыкают фолликулярные и питающие клетки, которые продуцируют мРНК для белка bicoid. Эта мРНК транспортируется в яйцеклетку, и еще до оплодотворения устанавливается градиент ее концентрации с максимумом на переднем конце яйцеклетки, что обусловливает в дальнейшем развитии формирование головных структур зародыша из этой части яйца. Будущий задний полюс соседствует с фолликулярными клетками, которые доставляют в эту область яйца мРНК, считанную с гена nanos, детерминирующую образование заднего конца зародыша (рис. 8.26). Таким образом, еще в неоплодотворенной яйцеклетке дрозофилы формируется передне-задняя ось будущего организма. Аналогично задается и дорсо-вентральная ось. Вещества, имеющие четкий градиент распре-

Рис. 8.26. Распределение морфогенов по продольной оси яйца дрозофилы
деления, принято называть морфогенами. Следует обратить внимание, что градиенты морфогенов в яйцеклетке дрозофилы создаются благодаря активности в окружающих яйцо фолликулярных и питающих клетках генов материнского организма. Они получили название - «гены с материнским эффектом».
Следует обратить внимание, что большинство запасенных в яйцеклетке мРНК первоначально находится в неактивном состоянии в комплексе с белком в виде информосом. Такие неактивные мРНК могут быть распределены в цитоплазме достаточно равномерно. Создание их градиентов осуществляется благодаря их неравномерной активации. Механизмы активации могут быть различными. Так, например, установлено, что фиксация мРНК на цитоплазматическом матриксе яйцеклетки (локализация мРНК в определенных зонах яйца) приводит к их активации. Показано, что в дальнейшем транслируются только локализованные мРНК, а нелокализованные разрушаются.
Другие механизмы избирательной трансляции запасенных мРНК наблюдаются на следующих этапах формирования овоплазматической сегрегации и связаны с перемещениями цитоплазмы вследствие оплодотворения.
Проникновение сперматозоида в яйцеклетку в момент оплодотворения и последующее движение его пронуклеуса приводит к усилению овоплазматической сегрегации. В яйце наблюдаются сложные перемещения цитоплазмы и ее функциональная перестройка. В результате она становится еще более неоднородной. Этот процесс хорошо заметен в тех случаях, когда разные участки цитоплазмы содержат гранулы веществ разной окраски (желток, темный пигмент и др.).
Хорошим примером может служить яйцо асцидии. Серая цитоплазма центральной части яйцеклетки окружена кортикальным слоем, содержащим желтые липидные включения. На анимальном полюсе располагается светлая цитоплазма с ядерным материалом. Сразу после оплодотворения цитоплазма яйца перемещается, и кортикальный ее слой формирует желтый серп, расположенный между экватором и вегетативным полюсом (рис. 8.27).
Перемещения цитоплазмы вследствие оплодотворения хорошо заметны и в яйцеклетке амфибий. В ней слой темного пигмента меланина первоначально покрывает все анимальное полушарие. После проникновения сперматозоида поверхностный - кортикальный - слой цитоплазмы толщиной в несколько микрометров поворачивается примерно на 30о относительно внутренней массы желтка в направлении, которое
Рис. 8.27. Сегрегация цитоплазмы в яйце асцидии Styelapartita: а - до оплодотворения; б - после оплодотворения; 1 - кортикальная цитоплазма с желтыми липидными включениями; 2 - цитоплазма, содержащая желток; 3 - светлая цитоплазма с ядром ооцита; 4 - желтый серп; 5 - цитоплазма с желтком; 6 - серый серп; 7 - анимальная светлая цитоплазма; 8 - хорион
зависит от места проникновения сперматозоида. В результате этого у некоторых амфибий против места проникновения спермия появляется серповидная слабопигментированная область, названная серым серпом. В ней позже, в ходе гаструляции, возникает дорзальная губа бластопора. Вследствие всех указанных перемещений цитоплазмы формируются оси зародыша. Сторона, где формируется серый серп, становится дорзаль-ной, а противоположная, где наблюдается внедрение сперматозоида - вентральной. Анимально-вегетативная ось соответствует головно-хво-стовой оси будущего зародыша (см. рис. 7.3).
Перемещения цитоплазмы вследствие проникновения спермия в яйцеклетку - еще один механизм, приводящий к избирательной трансляции запасенных в яйцеклетке мРНК. В частности, благодаря в том числе и этому механизму осуществляется детерминирование дорсо-вентральной оси зародыша. В оогенезе у амфибий на вегетативном полюсе яйца запасаются мРНК для белка Xwnt11. После оплодотворения и поворота цитоплазмы часть этой мРНК перемещается по стороне, противоположной внедрению сперматозоида, в направлении анималь-ного полюса. В области серого серпа происходит полиаденилирование молекул мРНК Xwnt11, что приводит к их активации и последующей трансляции. В результате только в этой области яйца образуется соответствующий белок - один из основных дорсализующих факторов. Остальная мРНК для Xwnt11 в вегетативном полушарии, по-видимому,
остается репрессированной. Выполненные исследования установили, что именно поворот цитоплазмы является механизмом, запускающим трансляцию мРНК Xwnt11 через полиаденилирование.
Анализ результатов многих проведенных экспериментов позволил сделать вывод, что в создании сегрегации цитоплазмы яйцеклетки ведущая роль принадлежит цитоскелету. Так, транспорт мРНК, поступающих из окружающих клеток и синтезированных в самой яйцеклетке, к месту их локализации в цитоплазме осуществляется на большие расстояния по микротрубочкам, а на малые - по микрофиламентам. Считают, что местом локализации в клетке морфогенетических детерминант может быть кортикальный слой или цитоскелет клетки. Предполагают также, что и перемещения цитоплазмы яйца, наблюдаемые после оплодотворения, определяются цитоскелетом. В частности, в этом процессе возможно значительное участие центриоли сперматозоида и отходящих от нее микротрубочек. С помощью нарушающего сборку микротрубочек колхицина удается подавить транспорт и активацию мРНК, перемещения цитоплазмы и ооплазматическую сегрегацию в целом.
В ходе дробления разные участки цитоплазмы зиготы, содержащие специфический набор веществ, попадают в разные бластомеры. Экспериментами с микроинъекциями коллоидных частиц золота показано, что при дроблении цитоплазма яйцеклетки распределяется между бла-стомерами, не перемешиваясь. Различия в характере цитоплазмы могут служить регулятором считывания информации с разных генов в разных бластомерах и тем самым влиять на ход их дифференцировки. Показано, что цитоплазматические факторы белковой природы проникают в ядро бластомера и путем избирательной активации или инактивации конкретных генов определяют характер считываемой информации. Полагают, что таким способом морфогенетические детерминанты, содержащиеся в отдельных участках цитоплазмы, жестко, порой необратимо контролируют предопределенность (детерминированность) данного бластомера к образованию клеток определенного типа.
Такое жесткое предопределение судьбы бластомеров наблюдается у оболочечников, к которым относятся и асцидии. Неоднократно экспериментально доказано, что у этих животных каждый бластомер ответственен за образование специфического набора тканей личинки, при этом каждая клетка дифференцируется автономно, независимо от окружающих ее клеток. Тунг и другие исследователи пересаживали в цитоплазму бластомера, лишенного генетического материала, ядро из другого бла-стомера. Показано, что дальнейшее развитие клетки-реципиента идет
по пути того бластомера, чья цитоплазма ему досталась. Обнаружено также, что удаление у оболочечников каких-либо бластомеров приводит к отсутствию у личинки как раз тех структур, которые в норме из них формируются, а изоляция определенных групп клеток зародыша приводит к формированию из них характерных структур вне связи с другими клетками. Так, в серии экспериментов на 8-клеточном зародыше оболо-чечников показана способность только одной пары бластомеров, содержащих фермент ацетилхолинэстеразу, давать начало мышечной ткани.
У асцидий после оплодотворения по-разному окрашенные области цитоплазмы яйца распределяются по разным бластомерам, детерминируя их дальнейшую судьбу. Клетки бластулы, унаследовавшие цитоплазму желтого серпа, дают начало мышечным клеткам, цитоплазму серого экваториального серпа - образуют хорду и нервную трубку, анимальную цитоплазму - становятся эпидермисом личинки, содержащие желток вегетативной области - формируют в ходе развития кишку (см. рис. 8.27).
Жесткая детерминация судьбы бластомеров, определяемая составом веществ попавшего туда участка цитоплазмы яйца, обнаружена и у ряда других животных, например гребневиков, круглых и кольчатых червей, моллюсков. Тип развития этих животных, дифференцировка клеток которых определяется очень рано в развитии благодаря прежде всего ово-плазматической сегрегации, назван мозаичным.
Помимо овоплазматической сегрегации в определении судьбы бла-стомеров на самых ранних этапах развития может принимать участие и другой системный механизм - межклеточные взаимодействия. В этом случае развитие бластомеров в большей степени зависит от их взаимодействий с соседними клетками, межклеточным матриксом, которые определяются положением этих бластомеров в зародыше. Подобный тип развития, наблюдаемый у иглокожих и позвоночных, назван регуляционным.
Следует, однако, иметь в виду, что в развитии и мозаичных, и регуляционных зародышей участвуют оба механизма, однако степень их влияния значительно разнится, и основную роль играет один из них. Так, локализация специфических белков или м-РНК в определенных областях зиготы не ограничена мозаичными зародышами. Обнаружено, что анимальные и вегетативные области яиц амфибий, имеющих регуляционный тип развития, содержат уникальные мРНК. Кроме того, в цитоплазме вентральной области зиготы лягушки была выявлена так называемая половая детерминанта. Клетки, получающие при дробле-
нии цитоплазму с данным веществом, становятся предшественниками половых клеток, и их потомки дают начало гаметам. Показано, что у зародышей ряда других животных, раннее развитие которых является в основном регуляционным и определяется межклеточными взаимодействиями, обнаруживаются подобные половые детерминанты. Содержащие их бластомеры в ходе дальнейшего развития дают начало предшественникам гамет и мигрируют в закладку гонад.
Помимо овоплазматической сегрегации, гетерогенность яйцеклетки определяется также неоднородностью организации ее плазмалем-мы. Так, для овулировавших яйцеклеток млекопитающих характерна своеобразная организация цитоскелета, что в свою очередь приводит к мозаичной организации плазматической мембраны. Основная часть мембраны яйцеклетки образует микроворсинки, и лишь примерно от одной десятой до одной пятой общей поверхности яйцеклетки мыши представлено районом, в котором нет микроворсинок. Под плазма-леммой в этой области яйцеклетки располагается густая сеть микро-филаментов, а глубже находится мейотическое веретено метафазы II. У других млекопитающих район, не имеющий микроворсинок, также соответствует той области цитоплазмы, где располагается мейотическое веретено.
При оплодотворении спермий контактирует с мембраной яйцеклетки в любом месте, богатом микроворсинками. После этого микроворсинки исчезают, генетический материал спермия попадает в цитоплазму яйцеклетки, а часть мембраны спермия встраивается в месте его проникновения в мембрану яйцеклетки. В результате возникает разнородность плазматической мембраны, которая отражается на нескольких делениях дробления. Первые два бластомера имеют одинаковый размер, но не вполне одинаковые характеристики. Во время интерфазы синтез рибосомальной РНК в ядрышках этих бластомеров происходит в разное время, продолжительность фазы репликации ДНК у них также неодинакова. Один из бластомеров содержит в плазмалемме антигены, а в цитоплазме - структурные компоненты хвоста спермия. Предполагается, что именно этот бластомер вступает во второе деление дробления на 20-60 мин раньше другого. Мембранные антигены спермия сохраняются в плазмалеммах у потомков этого бластомера еще на протяжении нескольких делений. Установлено, что потомки именно этого бластомера, который на 2-клеточной стадии делится первым, с большей вероятностью дадут начало развитию внутренней клеточной массы бла-стоцисты, тогда как потомки запаздывающего при делении бластомера с
большей вероятностью станут источником для формирования внезаро-дышевых частей эмбриона.
Таким образом, гетерогенность яйцеклетки не только определяет последующую дифференцировку клеток зародыша, но и обеспечивает развитие зародыша как единой системы.
8.2.7. МЕЖКЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ
Межклеточные взаимодействия чрезвычайно важны в развитии и являются одним из механизмов, обеспечивающих интегрированность развития особи. Этот механизм действует на протяжении всего онтогенеза, но особую значимость имеет на ранних этапах эмбриогенеза, а именно, в период дробления.
Так, уже на 2-клеточной стадии зародыш представляет собой не совокупность отдельных клеток, а единый организм. Это может быть показано с привлечением результатов ряда экспериментов. Немецкий эмбриолог Вильгельм Ру разрушал одну из клеток зародыша лягушки на стадии 2 бластомеров раскаленной иглой. В ходе дальнейшего развития из оставшегося неповрежденными бластомера формировалась только половина зародыша - полунейрула с полным набором структур правой или левой стороны (рис. 8.28). Однако, как известно, на стадии дробления клетки большинства хордовых тотипотентны. И действительно, если повторить описанный эксперимент и сразу отделить убитый бла-стомер от неповрежденного, то из последнего сформируется абсолютно полноценный организм. Аномальное развитие зародыша в опыте В. Ру наблюдалось вследствие контакта бластомеров. Неповрежденный бла-стомер, благодаря наличию межклеточных влияний, «определял» себя только как часть целого организма и развивался в соответствии с по-
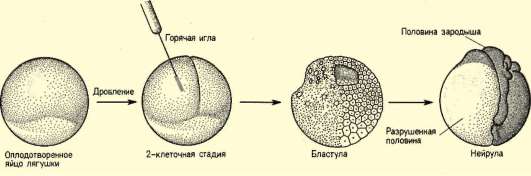
Рис. 8.28. Схема эксперимента В. Ру
лученной информацией. При отделении этого бластомера сигналов к нему от погибшей клетки не поступало, и он давал начало полноценной особи. Таким образом, уже начиная со стадии 2 бластомеров, каждый из них развивается как часть единого организма в соответствии с сигналами, полученными от своего окружения.
Межклеточные взаимодействия - основной механизм дифференци-ровки клеток зародышей, характеризующихся регуляционным типом развития. Однако у организмов с ярко выраженным мозаичным типом развития также осуществляются подобные взаимодействия между бла-стомерами. Так, у оболочников только две пары передних бластомеров 8-клеточного зародыша способны образовывать нервную систему, однако развитие нейральных структур возможно лишь при контакте этих двух пар клеток между собой. Если же эти пары бластомеров разобщить, то формирования нервных клеток не происходит.
Внешние сигналы, поступающие прямо или опосредованно от других клеток организма, а также от структур внеклеточного матрикса, играют решающую роль в выборе клеткой направления дифференцировки. Именно такой путь обеспечивает гибкую и тонкую пространственно-временную координацию дифференцировок, без чего невозможно нормальное развитие.
Воздействовать друг на друга клетки могут следующими способами. Во-первых, формируя межклеточные контакты, во-вторых, за счет диффузии веществ от одной клетки к другой, в-третьих, в результате контакта между клеткой и матриксом, сформированным другими клетками (рис. 8.29). При этом могут наблюдаться обмен молекулами, изменение
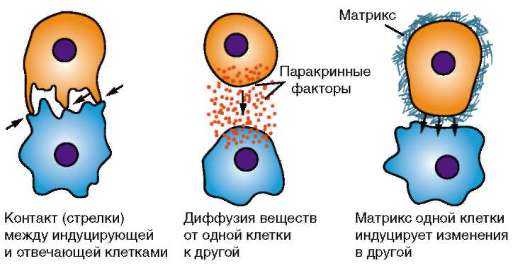
Рис. 8.29. Возможные варианты межклеточных взаимодействий
в межклеточной среде концентрации ионов, выделение продуктов жизнедеятельности, электрические и механические взаимодействия. Было продемонстрировано, например, что на поздних стадиях дробления между клетками зародыша шпорцевой лягушки передаются электрические импульсы. После электрического разобщения клеток дальнейшее развитие нарушается.
Остановимся на значении межклеточных контактов для дифферен-цировки.
Давно обнаружено, что одиночные эмбриональные клетки дифференцируются плохо, тогда как контакты с соседними клетками существенно активируют этот процесс. Явление получило название «эффект коммунальности». В некоторых случаях увеличение числа клеток в развивающемся фрагменте может привести к расширению спектра его возможных дифференцировок. Так, если срастить вместе несколько дорсальных губ бластопора ранней гаструлы тритона, то возникнет более обширный набор осевых зачатков, нежели из одной губы.
Напротив, даже кратковременное нарушение межклеточных контактов существенно ограничивает возможности дальнейшего развития этого фрагмента. Например, у амфибий в период гаструляции даже кратковременное (на несколько десятков секунд) разобщение клеток хордоме-зодермы приводит к изменению их возможностей к дифференцировке. Нарушение контактов между дифференцированными клетками взрослого организма может привести к утрате их дифференцированного состояния, а в некоторых случаях - к злокачественному перерождению.
Яркие примеры влияния межклеточных взаимодействий на процесс клеточной специализации можно наблюдать в ходе дробления.
В эксперименте было показано, что у прудовика, развитие которого мозаично, бластомер 3D во время паузы в дроблении на стадии 24 бластомеров увеличивает число своих соседей с 6 до 24. Одно из ближайших последствий «катастрофы связности» состоит в том, что меняются характеристики клеточного цикла этого бластомера, и он делится неодновременно со всеми остальными, имеющими по 5-6 соседей. Вероятно, именно благодаря этому потомки только данной клетки дают начало всей мезодерме и развивающимся из нее структурам.
В ходе дробления мыши на стадии 8-клеточного зародыша происходит его компактизация. Рыхло расположенные клетки внезапно сближаются, площадь контактов между ними увеличивается, и они образуют компактный клеточный шар. В результате более тесного прилегания друг к другу бластомеры изменяют свою форму от сферической
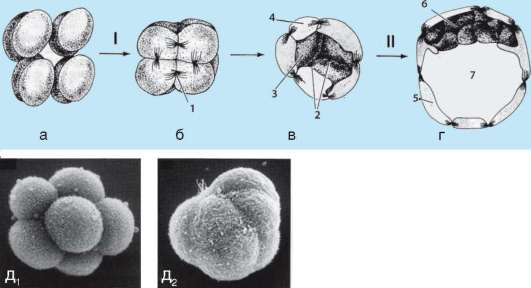
Рис. 8.30. Компактизация и образование бластоцисты: а - ранний 8-клеточ-ный зародыш; б - 8-клеточный зародыш после компактизации; в - морула (32 клетки); г - бластоциста; д - микрофотографии 8-клеточного зародыша мыши (сканирующая электронная микроскопия): д1 - до компактизации; д2 - после компактизации. I - компактизация; II - кавитация. 1 - плотные контакты; 2 - щелевые контакты; 3 - внутренняя клетка; 4 - наружная клетка; 5 - клетка трофобласта; 6 - клетка эмбриобласта; 7 - бластоцель
до уплощенной, при этом контур зародыша сглаживается (рис. 8.30). Между уплощающимися клетками, расположенными на поверхности, возникают плотные контакты, и этот слой изолирует внутренние клетки округлой формы, связанные между собой щелевыми контактами.
Большая часть потомков наружных клеток, соединенных плотными контактами, становится клетками трофобласта и участвует в образовании плодной части плаценты. Потомки внутренних клеток, объединенных щелевыми контактами, образуют эмбриобласт, который даст начало зародышу и ряду внезародышевых структур, таких как амнион, аллантоис, желточный мешок. Клетки эмбриобласта отличаются от клеток трофобласта не только по своему виду, но и по спектру белков, которые они синтезируют. Таким образом, возникновение различий между этими двумя группами клеток является ранним процессом дифференцировки в развитии млекопитающих, и базирующимся на межклеточных взаимодействиях.
Щелевым контактам принадлежит особая роль в межклеточных взаимодействиях. Это специфические области, где плазматическая мембра-
на одной клетки вступает в тесный контакт с плазматической мембраной другой клетки. У большинства зародышей по крайней мере ранние бла-стомеры связаны именно такими контактами, в результате чего небольшие растворимые молекулы и ионы свободно проходят между ними. Показано, что щелевые контакты формируются в точно определенное время, когда возникает необходимость передачи информации от одного бластомера другому.
О значении этих контактов в развитии можно судить по результатам опытов, выполненных на зародышах амфибий и млекопитающих. Когда в один из бластомеров 8-клеточного зародыша амфибии путем микроинъекции вводили антитела к белкам щелевых контактов, то потомки этой клетки не могли обмениваться молекулами веществ с соседними бластомерами. Головастики, развившиеся из обработанных таким способом зародышей, оказались дефектными, и эти дефекты развития были прямо связаны с судьбой инъецированной клетки. Потомки такой клетки не погибали, но оказывались неспособными следовать по нормальному пути развития.
Контактные взаимодействия между клетками важны для дифферен-цировки на всех стадиях развития - от самых ранних и до взрослого состояния.
Обнаружено, что при формировании сложных фасеточных глаз у дрозофилы межклеточные взаимодействия распространяются по эмбриональной ткани в виде волны. Области образующихся межклеточных контактов имеют разную форму. Установлено, что дифференцировка клеток зависит от геометрии их контактных зон с соседними клетками. Клетки с одинаковой формой контактов дифференцируются в одном и том же направлении. Среди всех остальных выявляется одна фоторе-цепторная клетка, которая отличается от других по этому показателю. Именно она может воспринимать ультрафиолетовую область спектра.
Таким образом, межклеточные взаимодействия важны для развития организма и его целостности, особенно в период дробления. Начиная со стадии бластулы, ведущим интегрирующим механизмом онтогенеза становится эмбриональная индукция.
8.2.8. ЭМБРИОНАЛЬНАЯ ИНДУКЦИЯ
По мере развития организма взаимодействия отдельных клеток сменяются взаимодействиями более крупных элементов зародыша - клеточных комплексов, формирующих структуры, ткани, зачатки ор-
ганов зародыша. Примером таких влияний служит эмбриональная индукция - взаимодействие элементов развивающегося зародыша, при котором воздействие одного из них направляет (индуцирует) развитие другого. В результате такого взаимодействия запускается цепь морфогенетических (формообразовательных) процессов. Элемент, оказывающий воздействие, назван индуктором. Способность воспринимать индукционное воздействие и отвечать на него определяется как компетенция, а элемент организма, способный реагировать на индукционное воздействие изменением своего развития, назван компетентной тканью. В результате компетентная ткань становится детерминированной (предопределенной) к специфическому типу развития. Далее детерминированное состояние реализуется в процессе дифференцировки (дифференциации).
Следует понимать, что индукционные взаимодействия осуществляются на основе межклеточных, без которых не обходится ни один этап развития.
Феномен эмбриональной индукции был открыт немецким эмбриологом Г. Шпеманом и его ученицей Г. Мангольд в 1921 г. в серии экспериментов по изучению свойств материала хордомезодермы. Для того чтобы иметь возможность проследить за судьбой клеток при трансплантации, были использованы два вида тритонов, отличающихся по окраске эмбриональных тканей: гребенчатый тритон, клетки которого не содержат пигмента, и обычный тритон с пигментированными клетками. Участок дорзальной губы бластопора, содержащий материал хордоме-зодермы, зародыша гребенчатого тритона на стадии ранней гаструлы пересаживали в (под) боковую или брюшную эктодерму обыкновенного приблизительно той же стадии развития. У зародыша-реципиента в месте пересадки наблюдалось образование второго комплекса осевых органов (хорды, нервной трубки и сомитов). В некоторой доле случаев развитие завершалось формированием дополнительного зародыша (рис. 8.31). По распределению неокрашенных и пигментированных клеток было установлено, что почти вся нервная трубка и значительная часть мезодермы возникли из тканей реципиента, а пересаженная хор-домезодерма образовала, как и следовало ожидать, хорду, часть мезодермы, а также небольшой участок нервной трубки.
Описанное явление получило название первичной эмбриональной индукции. Зачаток хордомезодермы, локализованный в дорзальной губе бластопора, был назван первичным эмбриональным индуктором. Эктодерма, воспринимающая воздействие и отвечающая формировани-
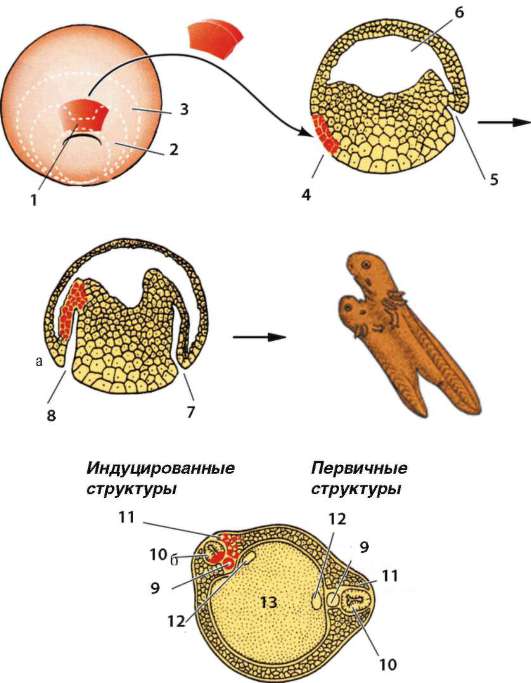
Рис. 8.31. Эксперимент Г. Шпемана по пересадке спинной губы бластопора от зародыша-донора зародышу-реципиенту: а - схема опыта; б - поперечный срез на стадии закладки двух комплексов осевых органов. 1 - спинная губа бластопора; 2 - презумптивная мезодерма; 3 - презумптивная хорда; 4 - материал донора; 5 - инвагинация; 6 - бластоцель; 7 - первичная инвагинация; 8 - вторичная инвагинация; 9 - хорда; 10 - нервная трубка; 11 - мезодерма; 12 - полость кишки; 13 - энтодерма
ем нервной трубки в этом эксперименте представляет собой компетентную ткань.
В ходе дальнейших исследований было показано, что ткань индуктора не сразу приобретает способность направлять формирование всего спектра структур, который образуется под ее влиянием. Наблюдается созревание способности к индукции - постепенное приобретение каждой частью индуцирующей ткани возможности оказывать воздействие на формирование определенных элементов зародыша. Если пересадить дорзальную губу ранней гаструлы, то индуцируется развитие структур переднего мозга, если же пересадить дорзальную губу поздней гаструлы, то развиваются спинной мозг и мезодермаль-ные ткани (рис. 8.32).
Осуществление индукции возможно лишь при условии, что клетки реагирующей ткани способны воспринять воздействие, т.е. являются компетентными. Только в этом случае они отвечают образованием соответствующих структур. Компетенция ткани также возникает на определенной стадии развития. Клетки реагирующей ткани должны пройти определенные фазы развития, прежде чем они приобретут способность к дифференцировке под влиянием сигналов индуктора. Состояние компетенции к воздействию определенного индуктора сохраняется ограниченное время. Затем может появиться компетенция к другому индуктору. Для каждого индуктора также характерно наличие определенного периода функциональной активности.
В эксперименте на амфибиях показано, что компетенция к образованию нервной ткани у амфибий возникает с начала гаструляции и затрагивает всю эмбриональную эктодерму. К концу этой стадии компетенция прекращается. Время контакта между хордой и нейроэктодер-мой при первичной индукции должно быть не менее 4 ч. При меньшем

Рис. 8.32. Результаты пересадки дорзальной губы бластопора на стадиях ранней (а) и поздней (б) гаструлы (объяснение в тексте)
по времени индуцирующем воздействием формирования нейральных структур не происходит.
Пересадка материала дорзальной губы бластопора на стадии нейру-ляции не приводит к формированию дополнительной нервной трубки. Это объясняется тем, что эктодерма на указанной фазе развития уже не способна отвечать на сигналы данного индуктора. Однако она становится компетентна в отношении иных индукторов. Например, на индуцирующее действие глазного пузыря отвечает образованием хрусталика. Задний мозг сходным образом может индуцировать образование из прилегающей к нему эктодермы слухового пузырька.
Кроме вышеперечисленного для эффективного ответа на индуцирующее влияние необходимо наличие в компетентной ткани определенного, минимального числа клеток, т.е. требуется некоторый «порог массы». Одиночные клетки не воспринимают действие индуктора. Если же их число превышает «порог массы» и клетки обладают минимальной организацией, то количество образуемых структур из возможного спектра для данной конкретной индукции зависит от объема реагирующей ткани. Чем больше в ней клеток, тем активнее ее реакция. При этом для оказания индуцирующего воздействия достаточно лишь одной клетки индуктора.
Во всех классах хордовых индукционные взаимодействия между хор-домезодермальным и нейральным зачатками подобны таковым у амфибий. У зародышей амниот (птиц, рептилий и млекопитающих) зачаток хордомезодермы локализован в области гензеновского узелка. Поэтому второй зародыш сходным образом «организуется» благодаря воздействию спинной губы бластопора, а у птиц и млекопитающих подобное действие оказывает гензеновский узелок. Интересно, что у ланцетника и круглоротых активен только туловищный индуктор, стимулирующий формирование нервной трубки (спинного мозга), а головной индуктор не действует. Это, безусловно, связано с отсутствием головного мозга у бесчерепных и слабым его развитием у круглоротых. У костистых рыб уже присутствуют оба индуктора.
В целом формирование гомологичных структур в группах эволю-ционно родственных организмов происходит под контролем сходных индукций. Так, для формирования придатков кожи необходимо стимулирующее влияние мезодермы на эпидермис кожи. Показано, что начальные этапы формирования кожных придатков у амниот можно индуцировать дермой зародышей других классов, например дерма ящерицы стимулирует развитие волос в эпидермисе мыши. Это свиде-
тельствует о том, что эмбриональная индукция как один из важнейших механизмов развития имеет большое эволюционное значение, а сами индукторы зачастую эволюционно консервативны.
После открытия явления первичной эмбриональной индукции были предприняты неоднократные попытки идентифицировать индуцирующие молекулы, выделяемые первичным организатором, определить их свойства и механизм действия. В 1932 г. группа исследователей, возглавляемая Г. Шпеманом, экспериментально продемонстрировала химическую природу индуцирующего сигнала, вызывающего формирование нейральных структур. Вскоре выяснилось, что индукцию могут вызывать разнообразные убитые ткани, вытяжки из различных живых тканей беспозвоночных и позвоночных животных, а также растений, несколько классов химических соединений (белки, нуклеопротеины, стероиды и даже неорганические вещества).
Новый этап исследований молекулярных механизмов эмбриональной индукции начался примерно 20 лет назад, когда благодаря прогрессу молекулярной биологии оказалось возможным связать индукционные процессы, как и вообще клеточную дифференцировку, с активацией или репрессией работы определенных генов, ответственных за синтез специфических белков.
Было установлено, что на ранних стадиях эмбриогенеза в зародыше синтезируются белки семейства ВМР (от англ. bone morphogenetics proteins - морфогенетические белки, получаемые из костного мозга), входящие в надсемейство TGF-β - трансформирующих факторов роста β. Их концентрация наивысшая на вентральной стороне зародыша. Белки секретируются в межклеточное пространство, связываются с мембранными рецепторами эмбриональных клеток и препятствуют их диффе-ренцировке в нервную ткань и другие производные осевых зачатков, позволяя развитие только в сторону покровной эктодермы. Для осуществления формирования нервной трубки (нейральной дифференци-ровки) взаимодействие ВМР с рецепторами мембран клеток-мишеней должно быть предотвращено.
Клетки шпемановского организатора - хордомезодермы - секре-тируют в межклеточное пространство белки chordin и noggin. Их функция состоит в том, чтобы связывать молекулы ВМР в межклеточном пространстве, препятствуя их взаимодействию с мембранными рецепторами клеток. В отсутствие ВМР клетки дорзальной эктодермы дифференцируются в нервную ткань (рис. 8.33). Таким образом, реализуется «индукция по умолчанию», поскольку данная дифференцировка не
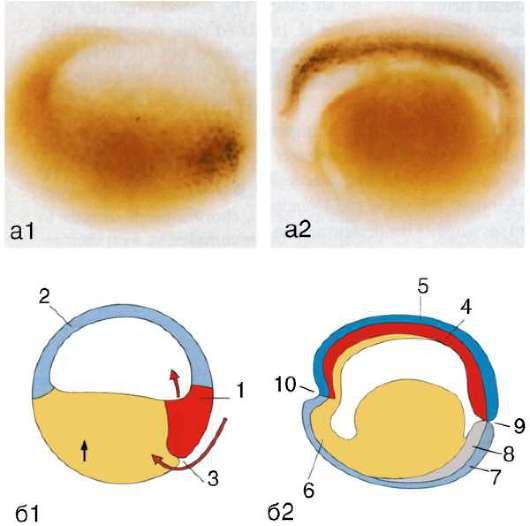
Рис. 8.33. Локализация мРНК белка noggin в ткани зародыша амфибии, выявленная методом гибридизации in situ (черные точки): а - фотографии; б - соответствующие схемы. а1, б1 - бластула; а2, б2 - гаструла. 1 - шпемановский организатор; 2 - презумптивная эктодерма; 3 - место начала инвагинации (дорзальная губа бластопора); 4 - зачаток хорды (хордомезодерма); 5 - ней-роэктодерма; 6 - энтодерма; 7 - эктодерма; 8 - мезодерма; 9 - бластопор; 10 - место образования будущего рта
требует дополнительных стимулирующих воздействий, а нуждается лишь в блокировании ВМР, и именно его осуществляет шпемановский индуктор.
Это открытие привело к существенному пересмотру традиционных представлений о первичной индукции. Ранее считалось, что базисный путь дифференцировки эмбриональных клеток, не требующий индукционных влияний, - их развитие в покровную эктодерму.
Подразделение нервной системы на отделы также осуществляется путем «индукции по умолчанию». Выяснено, что в межклеточном пространстве на стадии гаструлы присутствуют белки семейства Wnt. Оказалось, что если не препятствовать их связыванию с рецепторами клеток презумптивной (предполагаемой) нейральной эктодермы, то вся нервная пластинка развивается в спинной мозг. Вещества семейства Wnt
связываются в межклеточном пространстве белками ucrberus и Dickkopf, которые секретируются передней частью хордомезодермы - прехор-дальной пластинкой. Следствием такого взаимодействия становится активация в клетках, соответственно, передней части нервной пластинки определенных генов, среди которых ОТХ-2, anf и другие, что и приводит в результате к формированию головного мозга и его отделов.
Однако механизмы индукции не определяются только лишь включением и выключением определенных генов. Как и любой процесс в организме, регуляция индуктивных взаимодействий осуществляется на нескольких уровнях, она многогранна и к настоящему времени еще далеко не полностью изучена. Так, несмотря на многочисленные эксперименты, не удалось с достоверностью обнаружить химический фактор, выделяемый глазным бокалом и необходимый для индукции хрусталика, хотя его существование утверждается рядом исследователей.
Как было показано в предыдущем разделе, межклеточные взаимодействия, лежащие в основе индукции, могут осуществляться не только вследствие выделения клеткой каких-либо факторов, но и при непосредственном межклеточном контакте, а также через матрикс. Все это справедливо и для индуктивных взаимодействий. Например, установлено, что для развития метанефрогенной мезенхимы формирующейся почки под действием чужеродного индуктора (нервной ткани) необходим непосредственный контакт между клеточными отростками индуктора и реагирующей ткани. Роль компонентов внеклеточного матрикса в индуктивных процессах показана в том числе и в экспериментах со стволовыми клетками. Одна и та же стволовая клетка при добавлении в среду коллагена IV типа может дать начало эпителиальным клеткам, при добавлении фибронектина и коллагена I - соединительной ткани, а коллагена II - хрящу.
В 50-60-е гг. ХХ в. голландский эмбриолог П. Ньюкоп продемонстрировал, что первым индуцирующим событием в развитии зародыша является не воздействие хордомезодермы на дорзальную эктодерму на стадии ранней гаструлы, а осуществляемая на стадии бластулы индукция энтодермой (клетками, расположенными на вегетативном полюсе зародыша) преобразования смежных клеток в хордомезодермальную закладку (рис. 8.34). По сути дела, данное событие и есть истинно первичная эмбриональная индукция, что было подтверждено экспериментально. После удаления у зародыша-бластулы вегетативных клеток образования хорды и ряда мезодермальных структур не происходило. Опыты по рекомбинации клеток зародышей показали, что наиболее
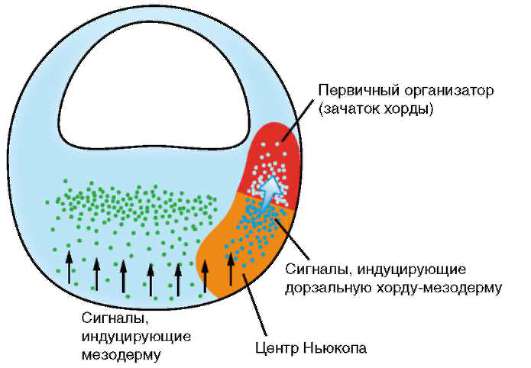
Рис. 8.34. Схематическое изображение влияний, реализуемых при индукции Ньюкопа на стадии бластулы
дорзальные бластомеры вегетативного полюса индуцируют развитие хорды и сомитов, а прочие клетки этого полюса определяют образование вентральных мезодермальных структур, прежде всего боковой пластинки. Таким образом, шпемановская индукция базируется на прошедшей перед этим индукции мезодермы. Но так как открытие Г. Шпеманом было сделано раньше, за ним закрепилось наименование первичная эмбриональная индукция. Все индукции, осуществляемые после нее, называют вторичными, третичными и т.д.
Описанные эксперименты могут быть расценены не как проявление индукционных влияний, а как один из примеров межклеточных взаимодействий. Однако они, несомненно, доказывают преемственность этих механизмов развития.
Действительно, начиная со стадии бластулы, уже на самых ранних этапах гаструляции выявляется выраженная кооперативность клеточного поведения, когда действуют не отдельные клетки, а клеточные группы, составляющие зачатки структур, тканей и органов особи. Гетерогенность клеточных популяций, взаимодействие между собой отличающихся друг от друга комплексов клеток - основа, на которой возникает дифференциальная активность генов на тканевом уровне, что приводит к дифференциации структур и формированию органов. Под дифференциацией понимают возникновение в процессе развития в
отдельном участке (структуре, части) организма морфологических и функциональных различий. Дифференциация структур базируется на дифференцировке клеток развивающегося организма.
В настоящее время установлено, что процессы эмбриональной индукции представляют собой каскад взаимодействий, которые определяют последовательное формирование структур и органов зародыша, его полноценное развитие. По современным данным, материальная основа этого каскада закладывается еще в оогенезе. Так, у амфибий непременной составной частью инициации данного процесса является описанный в п. 8.2.6 поворот оплодотворения.
В ходе роста ооцита амфибий поблизости от его вегетативного полюса синтезируется большое число белков, впоследствии участвующих в индукционных процессах, в том числе факторы семейства Wnt-1 и надсемейства TGF-β. мРНК для всех этих белков были синтезированы в оогенезе на хромосомах типа ламповых щеток. Ньюкоповская индукция опосредуется, в частности, белком Vg1, принадлежащим к над-семейству TGF-β. Другие участники этого процесса - белок dishevelled, синтезируемый в вентральной области яйцеклетки в период оогенеза, и β-катенин, который исходно распределен в цитоплазме зиготы более или менее равномерно. Вскоре после оплодотворения β-катенин подвергается ферментативному расщеплению, однако на дорсальной стороне зародыша активность расщепляющего фермента подавляется белком dishevelled (Dsh), который перемещается в эту область зародыша именно в результате поворота оплодотворения. Вследствие этого на дорсальной стороне β-катенин сохраняется и по мере делений дробления перемещается в клеточные ядра бластомеров (рис. 8.35). Роль β-катенина состоит в том, что он связывается с промоторами определенных генов, активи-

Рис. 8.35. Схема взаимодействия генов, инициированного поворотом оплодотворения у амфибий: а - последовательные стадии изменения распределения белка dishevelled (Dsh) в результате оплодотворения, б - распределение в цитоплазме зиготы; 1 - сперматозоид, 2 - кортикальный слой цитоплазмы, 3 - поворот оплодотворения, 4 - брюшная сторона зародыша, 5 - спинная сторона
руя их. Кодируемые ими белки, в свою очередь, оказывают аналогичное влияние на другие гены, и в результате запускается целая цепь генов, активирующих друг друга и участвующих в реализации индукционного каскада. Продукт одного из активированных таким образом генов - goosecoid - воздействует в клетках шпемановского организатора на гены, кодирующие уже знакомые нам белки chordin и noggin, т.е. факторы первичной эмбриональной индукции.
Как было сказано выше, дифференциация большинства структур и органов в процессе развития зависит от предшествующих индукционных событий. При этом в ходе их реализации наблюдается последовательная смена индукторов и состояний компетентности. Именно таким образом взаимодействие между зачатком хордомезодермы и дорзаль-ной эктодермой инициирует цепь формообразующих процессов. Сформированные в результате первичной эмбриональной индукции хорда и нервная трубка необходимы при дифференцировке клеток мезодермы для образования сомитов и для дифференцировки хрящевых клеток из дерматомов. Наличие сомитов в свою очередь обязательно для нормального формирования отделов кишечной трубки. Присутствие дорзальной энтодермы кишки оказывает индуцирующее влияние на развитие кроветворных участков мезодермы и т.д.
Индукция носит не только каскадный, но и переплетающийся, взаимный (реципрокный) характер, что может быть проиллюстрировано на примере формирования глаза (рис. 8.36.). Вырост переднего мозга - глазной пузырь - инициирует образование хрусталиковой плакоды из лежащей над ним эктодермы. Далее направление индукции меняется и, сформировавшись, хрусталиковая плакода, в свою очередь, вызывает изменения в глазном пузыре, передняя стенка которого инвагинирует,
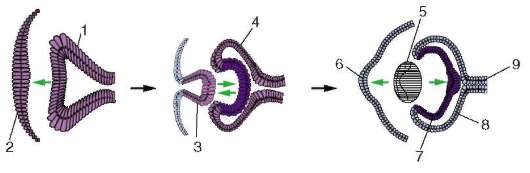
Рис. 8.36. Схема, иллюстрирующая реципрокный характер индукции: 1 - глазной пузырь, 2 - покровная эктодерма, 3 - формирующийся хрусталик, 4 - глазной бокал, 5 - сформированный хрусталик, 6 - роговица, 7 - нейральный слой сетчатки, 8 - пигментный слой сетчатки, 9 - зрительный нерв
и пузырь превращается в двустенную чашу - глазной бокал. Одновременно с этим два слоя глазного бокала начинают дифференцироваться в разных направлениях: внутренний становится сетчаткой, а наружный - пигментным эпителием. Под действием сетчатки, которая на этом этапе становится индуктором, из хрусталиковой плакоды образуется хрусталик. Последний вызывает формирование роговицы из прилежащей к нему эктодермы и оказывает направленное действие на окончательную дифференцировку клеток глазного бокала. Роговица в свою очередь также приобретает свойства индуктора и участвует в формировании век. Интересно отметить, что образующийся хрусталик выделяет вещества, препятствующие развитию еще одного хрусталика.
Интересен факт, что в индукции может наблюдаться «кумулятивный» эффект, т.е. в индукции той или иной структуры может участвовать не одна, а несколько тканей. Например, глазной бокал служит главным, но не единственным индуктором хрусталика. В ходе развития презум-птивный хрусталик, т.е. эпидермис, из которого затем должен развиться хрусталик, во время гаструляции лежит над энтодермой будущей глотки, первого индуктора хрусталика. Затем под этим эпидермисом оказывается сердечная мезодерма, которая также действует как индуктор. И только позднее, во время нейруляции на переднем конце нервной трубки выпячиваются глазные пузыри, образующие глазной бокал и сетчатку, являющуюся главным индуктором хрусталика (рис. 8.37). Путем удаления той или иной из индуцирующих тканей определили степень участия каждой из них в индукции хрусталика. Оказалось, что при удалении сетчатки глазного бокала у 42% зародышей амфибий все же формировались хрусталики и, следовательно, энтодерма и мезодерма в сумме обладают почти таким же индуцирующим действием, как и сетчатка глазного бокала. Полагают, что многочисленность индуцирующих тканей может иметь решающее значение для точного установления места формирования органа. Кроме того, последовательные индукции могут играть важную стабилизирующую роль в развитии, обеспечивая нормальное течение органогенеза, даже если один из компонентов индуцирующей системы не сумеет произвести сигнал нужной силы.
Различают гетерономную и гомономную индукцию. К гетерономной относят случаи, при которых одна структура зародыша индуцирует формирование иной структуры (хордомезодерма индуцирует появление нервной трубки и всего зародыша в целом). Гомономная индукция заключается в том, что индуктор побуждает окружающий материал к развитию в том же направлении, что и он сам. Например,
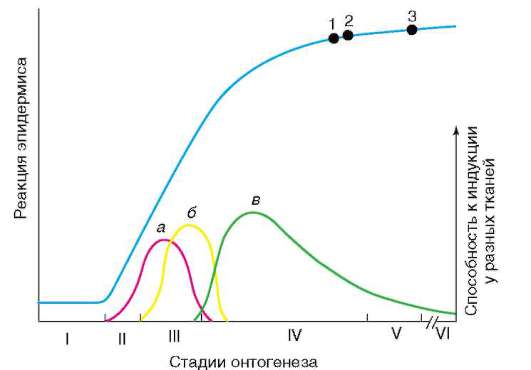
Рис. 8.37. Последовательные индукционные взаимодействия, необходимые для образования хрусталика у зародыша амфибии: I - ранний зародыш; II - гастру-ла; III - нейрула; IV - стадия хвостовой почки; V - личинка; VI - взрослая особь. 1 - хрусталиковая плакода; 2 - хрусталиковый пузырек; 3 - хрусталико-вые волокна. а - энтодерма; б - сердечная мезодерма; в - сетчатка
область нефротома, пересаженная другому зародышу, способствует развитию окружающего материала в сторону формирования головной почки, а прибавление в культуру фибробластов сердца маленького кусочка хряща влечет за собой процесс образования хряща.
Установлено, что индуктивные взаимодействия наиболее характерны для онтогенеза животных, характеризующихся регуляционным типом развития. Что же касается организмов с явно выраженным мозаичным онтогенезом, то у них явления типа эмбриональной индукции имеют меньшее значение, однако также оказывают определенное воздействие на клеточную дифференцировку. Например, ряд аналогичных процессов наблюдается в формировании нервной системы.
Так, у асцидий, на стадии 8 бластомеров, когда уже все основные зачатки предопределены, проводили некоторые перемещения клеток. Материал хордомезодермы и основная часть нейрального материала у них локализованы в заднем вегетативном бластомере. Небольшая часть нейрального материала, формирующего головной ганглий, находится в
Рис. 8.38. Карта презумптивных зачатков у зародыша асцидий на стадии восьми бластомеров: 1 - эпидермис; 2 - нервная пластинка; 3 - хорда; 4 - энтодерма; 5 - сомиты, 6 - мезодерма

заднем анимальном бластомере, расположенном над задним вегетативным (рис. 8.38). Для проверки индукционных взаимодействий между ними анимальный ярус бластомеров поворачивали на 180° так, чтобы задний анимальный бластомер терял контакт с задним вегетативным. Головной ганглий не развился нигде. Это означает, что для развития головного ганглия необходимо индукционное влияние на задний ани-мальный бластомер со стороны заднего вегетативного. Кроме того, очевидно, что задний анимальный бластомер не обладает автономностью развития, но только он компетентен к восприятию воздействия со стороны заднего вегетативного бластомера, содержащего хордомезодер-мальный зачаток.
Полноценная эмбриональная индукция зависит от того, насколько точно соответствует в развитии время созревания индуктора и компетентной ткани. В нормальных условиях компетентная ткань способна отвечать формообразованием в момент стимулирующего импульса от индуктора. Рассогласования во времени созревания индуктора и компетентной ткани нарушают ход соответствующих морфогенетических процессов. Мутации, вызывающие такие рассогласования, вероятно, распространены довольно широко.
Так, становление пигментации у амфибий определяется взаимодействием эпидермиса (индуктора) и ткани нервного гребня, который служит источником меланобластов, мигрирующих субэпидермально под
влиянием индуктора. Одна из мутаций в гомозиготном состоянии резко ослабляет окраску аксолотля, так что лишь спина животного слегка окрашена (так называемая белая раса аксолотлей). Экспериментально показано, что отсутствие окраски определяется рассогласованием во времени созревания двух взаимодействующих закладок, составляющих единую индукционную систему. При трансплантации кусочков презум-птивного эпидермиса между зародышами аксолотлей белой расы разного возраста обнаружено, что при некоторых сочетаниях возраста донора и реципиента в трансплантате развивается пигментация.
Исследования, выполненные к настоящему времени, позволили сделать вывод, что большинство индукционных процессов, особенно на более поздних стадиях органогенеза, являются пермиссивными. Это означает, что индуктор лишь запускает процесс дифференцировки, а его результат определяется свойствами компетентной ткани. В этом случае индуцирующий стимул как бы высвобождает ответ, уже предопределенный в клетках реагирующей ткани. Так, например, формирование конечности может быть индуцировано пересадкой слухового пузырька, носовой плакоды или гипофиза.
Изучение эмбриональной индукции, ее молекулярных и клеточных механизмов активно продолжается. Кроме того, это явление представляет большой теоретический интерес, т.к. позволяет оценить взаимоотношение таких процессов, как детерминация, дифференцировка и морфогенез.
8.2.9. НЕРВНАЯ И ГУМОРАЛЬНАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ
Гуморальную регуляцию развития, осуществляемую путем распространения различных веществ через жидкости, следует отнести к дистантным взаимодействиям, т.е. к тем, которые реализуются на расстоянии от источника.
Вещества (лиганды), участвующие в такой регуляции, можно разделить на два типа. Молекулы лигандов первого типа в силу своей гидро-фобности или же газовой природы свободно проникают через липидные компоненты клеточной мембраны. Сюда относятся стероидные гормоны: эстрогены, кортизол и другие; ретиноевая кислота, играющая важную роль в развитии ряда структур, например конечностей; окись азота (NU) и активные формы кислорода.
Ко второму типу лигандов относятся белковые молекулы, которые не проникают в цитоплазму, а связываются с рецептором клеточ-
ной мембраны или с внеклеточными белками. Наиболее важные из них - белковые гормоны (инсулин, гормон роста) и факторы роста (см. п. 8.2.1).
Рассмотрим в качестве примера регулирующую роль некоторых гормонов. Так, у дрозофилы в эксперименте через несколько минут после инъекции гормона линьки - экдизона в политенных хромосомах наблюдается появление 6 новых пуфов. Синтезируемые на этих нуклеотидных последовательностях белки через некоторое время индуцируют экспрессию десятков и даже более других последовательностей ДНК, в результате чего действие гормона многократно усиливается. Экдизон относится к группе стероидных гормонов, которые могут активировать синтез всех видов РНК - не только матричной, но и транспортной и рибосомальной, активируя тем самым все этапы биосинтеза белка.
Важно помнить следующее. Гормон взаимодействует только с клетками, имеющими рецептор к нему. Таким образом, он может оказывать действие лишь на определенные органы. Кроме того, в разных клетках-мишенях гормоны воздействуют на различные группы генов, и поэтому они могут оказывать разнонаправленное воздействие. Так, сложные морфогенезы в онтогенезе амфибий, обеспечивающие превращение головастика в лягушку, происходят под действием гормонов щитовидной железы, главным образом тироксина. Его влияние приводит к исчезновению хвоста и жаберных щелей, перестройке черепа, позвоночника и всего пищеварительного тракта, формированию конечностей, изменению строения кожи, в которой появляются многоклеточные слизистые железы. Другими словами, под действием гормона на данном этапе развития меняется вся организация особи.
У муравьев с помощью ювенильного гормона определяется не только морфофизиологические характеристики развивающегося организма, но и его место в иерархии популяции. В группе муравьев есть крупная фертильная матка, стерильные рабочие самки, крупные рабочие муравьи-солдаты с широкой головой и большой нижней челюстью и малые рабочие особи с хорошо развитыми ногами. Какая именно особь сформируется - определяется уровнем ювенильного гормона в развивающемся организме. В свою очередь, уровень гормона зависит от питания: чем лучше рацион, тем больше гормона, и тем дольше он выводится из организма. Пока гормон присутствует, личинка муравья растет и не может претерпеть линьку, после которой наступает окукливание. Более длительный рост особи до линьки приводит к развитию более крупного
взрослого муравья. Малые рабочие муравьи претерпевают окукливание при размере личинки 1,3 мм, а солдаты - 1,8 мм. Этот же гормон играет важную роль в определении, какая из самок станет маткой.
Нервная регуляция развития осуществляется на более поздних стадиях онтогенеза, когда нервная система будет сформирована и начнет функционировать. С этого момента нервные влияния наряду с гуморальными воздействиями станут основными интегрирующими механизмами в ходе всего дальнейшего онтогенеза особи.
8.2.10. КОНТРОЛЬ РАЗВИТИЯ
Онтогенез - это реализация генетической программы организма в определенных условиях среды. Следовательно, процесс развития находится под контролем генетических и средовых факторов.
8.2.10.1. Генетический контроль развития
Очевидно, что генетический контроль развития существует, так как набор генов, получаемый организмом при оплодотворении, обеспечивает развитие из зиготы особи совершенно конкретного вида. Каким образом гены определяют процесс развития? Это центральный и очень сложный вопрос, некоторые аспекты которого уже удалось прояснить, но для всеобъемлющего и убедительного ответа на него данных явно недостаточно. Главный прием изучения генетики индивидуального развития - использование мутаций. Выявив мутации, изменяющие онтогенез, проводят сравнение фенотипов мутантных особей с нормальными. Это помогает понять, как данный ген влияет на развитие. В настоящее время в биологии развития используется ряд новых методик, среди которых, например, техники knock out (делеции гена) или knock down (селективного подавления экспрессии гена с помощью мРНК-антагониста), метод FISH (применение меченых фрагментов ДНК для выявления определенных молекул мРНК и их распределения в клетке и зародыше). Использование этих и ряда других подходов позволяет выяснить помимо функции генов в развитии, время и место их действия, определить наличие взаимодействия между генами и его характер.
Дифференцировка клеток и опосредованная ею постепенная прогрессирующая последовательная и закономерная дифференциация частей развивающегося зародыша осуществляется, как было сказано ранее, благодаря дифференциальной активности генов (см. п. 8.2.5). Так как у эукариот регуляция экспрессии генов носит многоуровневый характер,
то «включение» того или иного гена и его транскрипция еще не означают выхода кодируемого им признака в клеточный фенотип. Процесс формирования большинства признаков очень сложен и зависит от активности продуктов не одного, а многих генов, градиента распределения генных продуктов в развивающемся зародыше, а также от особенностей их взаимодействия друг с другом.
Анализ генетического контроля затрудняется несколькими моментами. Прежде всего, тем, что роль генов неодинакова. Часть их экспрес-сируется практически во всех клетках, определяя жизненно важные функции и отвечая, например, за синтез тРНК или ДНК-полимеразы, без которых невозможно функционирование ни одной клетки - гены «домашнего хозяйства». Другая часть - гены «роскоши» - непосредственно участвует в детерминации, дифференцировке и морфогенезе, т.е. функция их более специфическая, и их активность проявляется в определенных клеточных популяциях (см. п. 3.1.3).
Для анализа генетического контроля необходимо, кроме того, знать место первичного действия конкретного гена, что позволяет различать случаи относительной, или зависимой, плейотропии от прямой, или истинной, плейотропии. В случае относительной плейотропии, как, например, при серповидноклеточной анемии, существует одно первичное место действия мутантного гена - гемоглобин в эритроцитах, а все остальные наблюдаемые при ней симптомы, такие как нарушение умственной и физической деятельности, сердечная недостаточность, местные нарушения кровообращения, увеличение и фиброз селезенки и многие другие, возникают как следствие аномального гемоглобина. При прямой плейотропии все разнообразные дефекты, возникающие в различных тканях или органах, вызывает непосредственное действие продукта одного и того же гена именно в этих разных местах.
Если рассматривать развитие с точки зрения реализации генетической информации, то оно представляется как многоступенчатый динамический процесс с постоянно меняющимися спектрами экспрессирующих-ся генов в зависимости от стадии онтогенетической дифференцировки. Важно понимать, что в каждый момент развития число вовлеченных в этот процесс генов очень велико - многие сотни и даже тысячи, которые располагаются на разных хромосомах или/и в пределах одной хромосомы. Это предполагает очень четкую координацию их экспрессии на протяжении всего онтогенетического развития и существования уже сформированного дифференцированного организма. Таким образом, становится понятным применение термина «программа развития», что
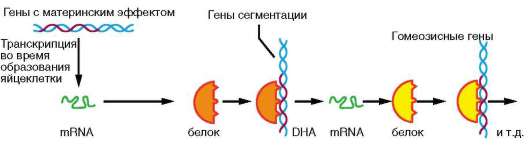
Рис. 8.39. Каскадное взаимодействие генов
подразумевает наличие строго упорядоченной и скоординированной во времени и пространстве экспрессии огромного числа генов. Все больше экспериментальных подтверждений получает концепция, согласно которой продукты генов предшествовавших стадий развития активируют новые генные наборы и/или репрессируют отдельные гены в последующие стадии. Такой тип взаимодействия генов определяют как каскадный, что подчеркивает преемственность в экспрессии генов ранних и более поздних стадий (рис. 8.39).
Преемственность генов в развитии может быть продемонстрирована на примере эмбриогенеза плодовой мушки дрозофилы. Ее эмбриональное развитие регулируется иерархической системой из трех классов генов: генов с материнским эффектом, генов сегментации и гомео-зисных генов.
Гены с материнским эффектом активны в организме самки. Их продукты запасаются в яйце и уже после оплодотворения определяют пространственные оси эмбриона: продольную (передне-заднюю) и дорсально-вентральную оси. К этому классу генов относятся bicoid и nanos, о которых речь шла в разделе 8.2.6. Продукты генов с материнским эффектом, как правило, являются ДНК-связывающими белками, которые в качестве факторов транскрипции активируют или блокируют экспрессию генов зародыша, в том числе генов сегментации.
Продукты генов сегментации - также транскрипционные факторы, они контролируют образование сегментов, из которых состоит насекомое. Их подразделяют на несколько групп: gap-гены, pair-rule гены и гены сегментарной полярности (табл. 8.3), образующих согласованную систему, благодаря активности которой эмбрион подразделяется на все более мелкие сегменты. Сегментационные гены последовательно активируются в процессе индивидуального развития (рис. 8.40).
Таблица 8.3. Гены сегментации

Рис. 8.40. Последовательное уточнение судьбы клеток в течение эмбриогенеза у дрозофилы: а - продукты генов с материнским эффектом; б - продукты gap-генов; в - продукты pair-rule генов; г - продукты генов сегментарной полярности
gaр-гены (от англ. gap - брешь). Они экспрессируются до 11-го деления зиготы и «делят» зародыш на широкие полосы. Их транскрипция стимулируется продуктами генов с материнским эффектом. Мутации генов группы gap приводят к потере нескольких прилежащих друг к другу сегментов тела, в результате чего в рисунке сегментации образуется пустота, или брешь. На фоне специфического распределения продуктов gaр-генов и под их влиянием активируются pair-rule гены (или гены «правила парности»), которые «дробят» зародыш на так называемые парасегменты - каждый из них по ширине равен двум возникающим позже сегментам тела личинки. Мутации в группе генов pair-rule, экспрессируе-мых в период 11-12-го деления, приводят к потере каждого второго сегмента. Продукты pair-rule генов, в свою очередь, запускают экспрессию генов сегментарной полярности. Их активность в зародыше дрозофилы выявляется в
период 13-го деления. Эти гены детерминируют границы конкретных сегментов зародыша и создают пространственную дифференцировку внутри каждого сегмента. У мутантов по генам сегментной полярности определенные части сегментов заменены структурами, представляющими зеркальные отражения прилежащих половин сегментов.
Все гены сегментации, последовательно активируемые в ходе эмбриогенеза, оказывают друг на друга взаимные влияния через кодируемые ими продукты (рис. 8.41). Следствием их экспрессии является активация гомеозисных генов. Это большой класс генов, которые считаются ключевыми в развитии и обеспечивают качественную спецификацию сегментов, т.е. определяют, какой конкретно сегмент - головы, груди или брюшка - и с какими структурами должен быть сформирован.
Название этой группы генов происходит от термина «го-меозис» который ввел в 1894 г. один из классиков генетики У. Бэтсон. Под «гомеозисом» он понимал превращение одной части тела в другую. Мутации по гомеозисным генам могут изменить структуру какого-либо сегмента или его придатков, например вызвать образование на голове мухи конечностей вместо антенны или аристы (рис. 8.42), но не изменяют количество или полярность сегментов.
Гомеозисные гены относятся к селекторным генам, т.е. таким, которые активируют или, напротив, подавляют другие гены, продукты которых уже прямо вовлечены в процесс формирования различных органов. Гомеозисные гены кодируют белки - факторы транскрипции, скоординированно регулирующие транскрипцию генов начальных звеньев генетических фор-
Рис. 8.41. Схема взаимодействия генов, контролирующих сегментацию в раннем развитии дрозофилы
Рис. 8.42. Гомеозисная мутация у дрозофилы: а - норма; б - муха с мутацией. 1 - глаз; 2 - ариста; 3 - антенна; 4 - ротовой аппарат
мообразовательных программ. Их белки-продукты, в свою очередь, влияют на экспрессию большого числа нижестоящих генов-мишеней, участвующих в реализации генетической программы образования конкретной структуры или органа. Таким образом, гомеозисные гены определяют выбор дифференцировки целого участка тела развивающегося организма.
Белковые продукты гомеозисных генов содержат специфическую последовательность из 60 остатков аминокислот - гомеодомен, обладающую высоким сродством к некоторым последовательностям нуклеотидов ДНК, с помощью которой они связываются с этими сайтами ДНК и таким образом влияют на экспрессию других генов. Так, у дрозофилы белковый продукт гомеозисного гена Antennapedia активирует гены, которые определяют структуру второго грудного сегмента, содержащего ноги и крылья, и репрессирует гены, вовлеченные в формирование глаз и антенн.
Гомеодомен кодируется последовательностью из 180 п.н., называемой
гомеобокс, которую содержит каждый из гомеозисных генов.
Гомеобокс впервые был обнаружен в составе генов, контролирующих развитие, в частности, в составе гомеозисных генов, у дрозофилы. Однако многие гены, содержащие гомеобокс, не являются гомеозисными. Таким образом, гомеобокс - это особая последовательность нуклеотидов, а гомеозисность - это потенциальная возможность образования гомеозисной мутации.
Гомеозисные гены дрозофилы образуют два комплекса, локализованные на третьей хромосоме. Гены каждого комплекса в хромосоме расположены очень близко друг к другу, формируя кластеры. Комплекс Antennapedia (ANT-C), содержит 5 генов (labial (lab), Deformed (Dfd), Sex comb reduced (Scr) и Antennapedia (Antp)) и определяет развитие головы и передних грудных сегментов мухи. Второй комплекс - Bithorax, включающий 3 гена (Ultrabithorax (Ubx), AbdominalA (abdA) и Abdominal's (abdB)), контролирует развитие задних грудных (торакальных) и брюшных сегментов (рис. 8.43). Мутации в гене Antennapedia приводят
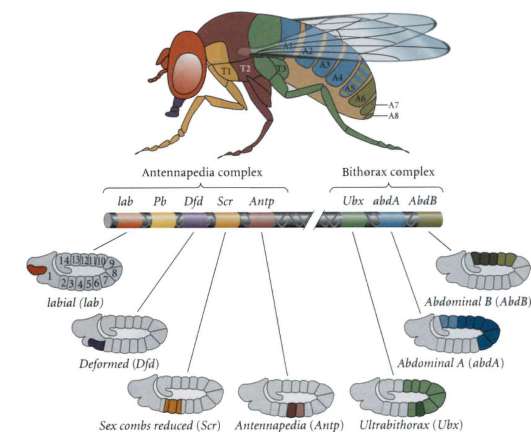
Рис. 8.43. Гомеозисные гены дрозофилы
к образованию конечностей на голове мухи вместо антенн. Мутация, подавляющая активность гена Ultrabithorax, приводит к образованию второй пары крыльев вместо жужжалец.
После того как были открыты и изучены гомеозисные гены дрозофилы, сходные гены были найдены у всех других животных от стрекающих, например медуз, до человека. Число кластеров гомеозисных генов в ходе эволюции менялось (рис. 8.44).
В различных таксонах гомеозисным генам были даны разные названия, что привело к путанице в номенклатуре. Так, в случае некоторых первичноротых гомеозисные гены, как было показано у дрозофилы, составляют два кластера Antennapedia и Bithorax, которые вместе называют HOM-C (гомеозисный комплекс, Homeotic Complex). В случае вторичноротых (в частности, у человека и большинства других позвоночных) гомеозисные гены называют Hох-генами и в геноме выявлено
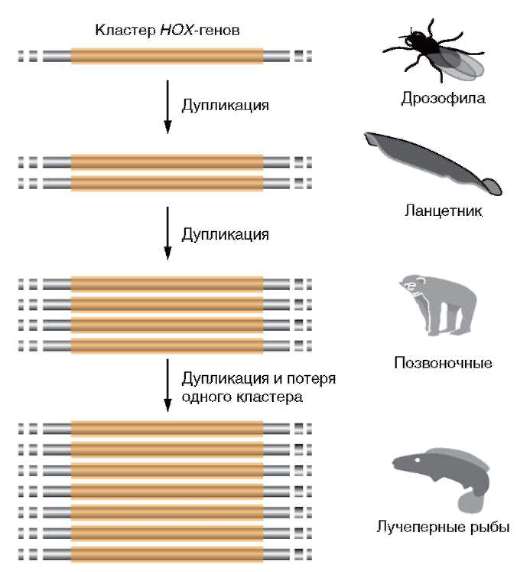
Рис. 8.44. Изменение числа кластеров гомеозисных генов в эволюции у некоторых групп животных
четыре их кластера: HoxA, HoxB, HoxC и HoxD. У первичноротых гомеозисные гены также часто называют Hox-генами, несмотря на то что это и не вполне верно.
Хотя гомеозисные гены позвоночных являются копиями генов пер-вичноротых, эти копии не идентичны. В результате накопления мутаций белки, кодируемые ими, выполняют различные функции. Кроме того, у разных групп позвоночных некоторые гены утрачены или дуплициро-ваны (рис. 8.45).
Несмотря на изменения, накопленные в ходе эволюции в гомео-зисных генах животных, принадлежащих к разным таксонам, последовательность нуклеотидов в их гомеобоксах высоко консервативна. Функциональная равнозначность кодируемых ими белков, содержащих гомеодомен, может быть доказана тем фактом, что развитие мухи с соответствующими гомеозисными генами курицы протекает нормально. Несмотря на то что общий предок курицы и мухи существовал около 670 млн лет назад, гомеозисные гены кур аналогичны таковым у мух до такой степени, что могут заменить друг друга.
У человека 39 гомеозисных генов, сгруппированных, как сказано выше, в 4 кластера (семейства) - А, В, С и D (рис. 8.46). Внутри каждого
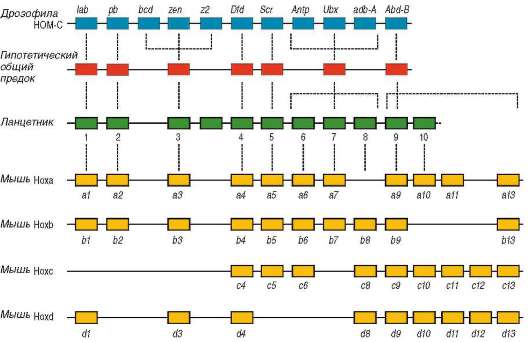
Рис. 8.45. Отличия кластеров гомеозисных генов у животных
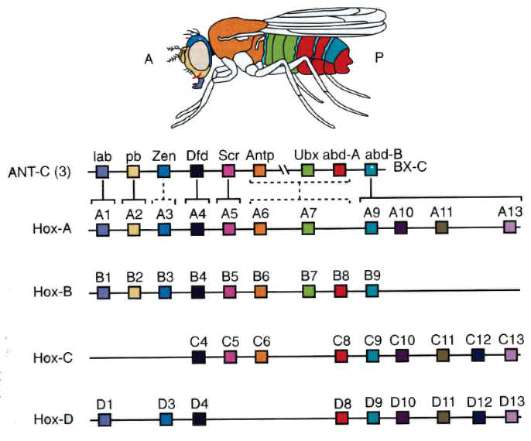
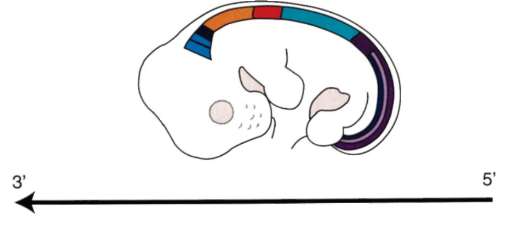
Рис. 8.46. Экспрессия гомеозисных генов в эмбриональном развитии дрозофилы и человека
кластера наблюдаются значительные вариации в кодируемых аминокислотных последовательностях, но последовательности, кодируемые паралогами (т.е. генами, занимающими одно и то же положение в каждом кластере), очень похожи. Так, например, А10 более похож на С10 и D10, чем на А9 или А11. Это означает, что паралоги несут очень похожие, но не обязательно идентичные функции.
Было бы ошибкой думать, что определенный Hох-ген, связываясь с регуляторными последовательностями 10-20 других генов, включает их или выключает. В реальности этот ген в разных частях эмбриона может транскрибироваться с различными скоростями, благодаря альтернативному сплайсингу он может кодировать целое семейство белков. Белки-продукты этого гена взаимодействуют с несколькими другими транскрипционными факторами и совместно регулируют экспрессию конкретного гена-мишени. Вследствие этого общий эффект продуктов данного Hох-гена может варьировать в широких пределах.
Гомеозисные гены интересны еще и тем, что наблюдается отчетливая (хотя и не абсолютная) корреляция между их положением вдоль хромосомы (от 3' к 5' концу цепи ДНК) и их экспрессией от переднего к заднему концу тела зародыша: гены, расположенные ближе к 3'-концу цепи ДНК, экспрессируются ближе к переднему концу тела (см. рис. 8.46). Эта закономерность, названная коллинеарностью, прослеживается у многих представителей животного мира от пресноводной гидры до млекопитающих. Она указывает на общность эволюционного происхождения передне-задней оси у всех представителей животного царства.
Исследования по расшифровке геномов разных животных, выполненные в течение последних лет, показали, что упорядоченность расположения Hox-генов в хромосомах отнюдь не является общим признаком. Выяснилось, что, например, у иглокожих первые три Hox-гена находятся прямо перед последним четырнадцатым, а начинается кластер с пятого гена. У нематод и оболочников Hox-гены вообще не образуют кластеров, и последовательность их расположения в хромосомах не соблюдается вовсе. Это свидетельствует о том, что в ряде случаев порядок экспрессии Hox-генов в различных частях эмбриона не соответствует порядку расположения этих генов в хромосоме. Таким образом, можно сделать вывод, что последовательность включения Hox-генов зависит, помимо их места на хромосоме, еще от каких-то дополнительных факторов.
Установлено также, что Hox-гены не экспрессируются строго один за другим в прилежащих участках тела. Часто отмечается транскрипция сразу с нескольких Hox-генов в одном и том же участке зародыша - перекрывание экспрессии, и при этом в задних районах Hox-гены более активны, чем в передних (рис. 8.47).
Стали известны некоторые детали регуляции самих Hox-генов. Между этими генами расположены участки ДНК, прежде считавшиеся бессмысленными. Как оказалось, они кодируют короткие молекулы ре-гуляторных РНК - микроРНК. Некоторые из них усиливают или ослабляют экспрессию Hox-генов, другие косвенно влияют на работу иных транскрипционных факторов. В экспериментах показано, что эти ми-кроРНК могут регулировать как соседний, так и отдаленные Hox-гены.
Выявлено также, что у многих животных, включая человека, большинство мРНК Hox-генов предсинтезированы уже в созревающей яйцеклетке и предимплантационных зародышах. Преформированный набор мРНК многих Hox-генов сохраняется в зародыше до начала гаструляции и нейруляции. Предобразованные мРНК у млекопитающих выявлены

Рис. 8.47. Активность Hox-генов при формировании отделов конечности: А-В - последовательные стадии развития конечности; 1 - плечевая кость, 2 -лучевая кость; 3 - локтевая кость; 4 - пястные кости и пальцы
на стадии регионализации нервной пластинки. Таким образом, показано, что в онтогенетическом развитии Нох-гены, как и ряд других генов, функционируют с опережением.
Кодируемые Нох-генами белки, подобно многим другим транскрипционным факторам, участвуют в регуляции не только раннего развития, но функционируют также и на более поздних его этапах в клетках ряда органов и тканей.
Так, было установлено, что появление определенных белков кластера НохС в нервных клетках спинного мозга направляет их дифференциров-ку в соответствии с функциями конкретного участка мозга. При анализе места и времени появления каждого белка из кластера НохС в отдельных двигательных нейронах было выполнено подробное картирование локализации этих нервных клеток в передних рогах спинного мозга. В результате оказалось, что внутри каждого фрагмента, обеспечивающе-
го иннервацию отдельной части организма, например конечности, имеется по крайней мере 50 различных типов нейронов. Для каждого типа выявлена четкая схема экспрессии Hox-генов, в соответствии с которой осуществляется дифференцировка двигательных нейронов и их соединение с иннервируемыми мышцами. Первоначально экспрессия генов кластера HoxC приводит к подразделению групп нейронов по участкам позвоночного столба, затем определяется, с какими мышцами - на внешней или на внутренней стороне конечности - будут связаны эти группы, и, наконец, выделяются популяции нервных клеток, связанные с конкретными мышцами. Эти результаты получили подтверждение в экспериментах с изменением схемы экспрессии Hox-генов в нейронах спинного мозга, что привело к образованию нервных клеток другого типа, которые стали связываться с другими мышцами.
Стабильность дифференцированного состояния - краеугольный камень развития. Установленное на ранних этапах, оно должно сохраняться на протяжении всего онтогенеза. В поддержании достигнутого благодаря экспрессии гомеозисных генов дифференцированного состояния клеток участвуют два генных комплекса: Polycomb и Trithorax. Впервые они были обнаружены у дрозофилы. Исследования показали, что эти генные комплексы сохраняют сформированный рисунок экспрессии гомеозисных генов, локально изменяя конформацию хроматина. Белки генов группы Polycomb подавляют экспрессию, а продукты генов Trithorax, напротив, сохраняют активность транскрипции гомео-зисных генов. К настоящему времени установлено, что эта система регуляции активности гомеозисных генов очень консервативна в процессе эволюции. Для всех генов комплексов Polycomb и Trithorax дрозофилы существуют гомологичные гены у млекопитающих. Более того, найдены и сходные регуляторные элементы, взаимодействуя с которыми белки, кодируемые этими комплексами, предотвращают изменения транскрипционной программы, характерной для конкретного типа клеток. Предполагается, что эта система регулирует активность и многих других генов, помимо гомеозисных, что свидетельствует о фундаментальности данного онтогенетического механизма.
Установление роли гомеозисных генов в развитии - крайне непростая задача. Очевидно, что любая их мутация, которая существенно влияет на функцию ключевых в раннем эмбриогенезе транскрипционных факторов, будет летальной, и, вероятнее всего, эмбрион погибнет вскоре после оплодотворения. Это делает практически невозможным обнаружение такой мутации. Поэтому вниманию генетиков доступны лишь
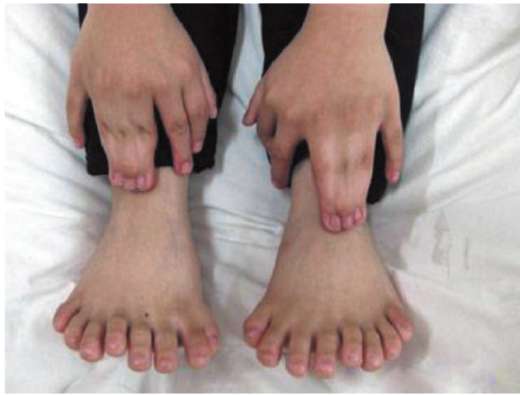
Рис. 8.48. Синполидактилия
те из них, которые затрагивают более поздние стадии эмбриогенеза и имеют относительно умеренное влияние на развитие. У человека идентифицированы лишь немногие изменения в этих генах. Показано, что мутации гена Нохd13 могут вызывать синполидактилию (наличие более пяти сросшихся пальцев, рис. 8.48), гена Нохa13 - приводят к формированию синдрома кисть-стопа-гениталии (аномальные большие пальцы, небольшие ступни, удвоение женских половых органов).
Мутации или делеции генов Hoxd3, НохЬ4, Hoxd9, проявляют-
ся тяжелыми аномалиям скелета. Парная делеция генов Ноха2 и Ноха3 вызывает дефекты развития костно-мышечной системы лица, шеи, аномалии развития тимуса, щитовидной железы.
Другая группа транскрипционных факторов, важных для раннего развития, - белки семейства Рах. Гены , их кодирующие, также принадлежат к семейству гомеобокссодержащих. Эти белки действуют как регуляторы органогенеза, а кроме того, необходимы для поддержания плюрипотентности (мультипотентности) популяций стволовых клеток, т.е. их способности дифференцироваться во множество специализированных типов клеток. Особенность белков Pax - наличие последовательности, состоящей из 128 аминокислотных остатков, которая образует два района для связывания с ДНК («раired box» - Рах). Считают, что эти белки связываются с энхансерными последовательностями ДНК и модифицируют таким образом транскрипционную активность ряда «подчиненных» генов. У человека, и вообще у млекопитающих, имеется девять генов Рах.
Гены Рах1 и Рах9 экспрессируются при развитии позвоночного столба, зачатков конечностей и тимуса, где они демонстрируют пере-
крывающиеся рисунки экспрессии. У мышей мутации в генах Pax1 и Pax9 вызывают дефекты скелета, а мутации в Pax9 могут также приводить к отсутствию тимуса и паращитовидной железы. У человека мутации гена Pax9 вызывают олигодонтию - неразвитие шести и более постоянных зубов.
Ген Pax3 экспрессируется у млекопитающих в дорзальной части нервной трубки - области, в которой формируются мигрирующие клетки нервного гребня. Мутации данного гена приводят к нарушению развития этих клеток и появлению у человека болезни Гиршспрунга (отсутствие нервных клеток в мышечном и подслизистом сплетениях толстой кишки и нарушение вследствие этого ее перистальтики) и синдрома Ва-арденбурга (глухота, частичный альбинизм и другие нарушения). Совместная экспрессия генов Pax3 и Pax7 отмечается в предшественниках мышечных клеток, что необходимо для их дифференцировки в клетки (волокна) скелетных мышц.
Функция гена Pax6 является ключевой в развитии глаз и носа. У людей, гетерозиготных по мутации этого гена, может наблюдаться ани-ридия (отсутствие радужной оболочки глаза) и катаракта (помутнение хрусталика).
Полагают, что транскрипционный фактор, кодируемый геном Pax2, участвует в процессе дифференцировки клеток почек. Белок гена Pax5 известен как специфический транскрипционный фактор В-лимфоцитов. Считают, что его синтез необходим в ходе нейрогенеза, сперматогенеза и дифференцировки В-лимфоцитов.
Как и гомеозисные гены, гены, сходные с Pax, также обнаруживаются в геномах животных разных таксонов. Так, ген дрозофилы eyeless близок к гену Pax6 млекопитающих и участвует в регуляции развития глаз. Замена гена eyeless у дрозофилы соответствующим мышиным геном приводит к формированию у мухи нормального глаза, что указывает на консервативность структуры этих генов. Важным результатом данного эксперимента является тот факт, что при инициации геном мыши развивается глаз, характерный для дрозофилы. Это свидетельствует о том, что гены Pax6 и eyeless лишь «запускают» программу формирования структуры, в реализации которой участвуют многие другие гены организма, которые и определяют, какой конкретно глаз будет сформирован. По расчетам, в процессе формирования глаз у животных принимает участие примерно 2500 генов, действующих каскадно. Более того, активируя ген eyeless в необычном месте в организме дрозофилы, получали развитие глаза на брюхе, на лапках, на крыле и в любом другом месте (рис. 8.49).

Рис. 8.49. Формирование глаза дрозофилы в атипичных местах под действием гена eyeless: 1 - на лапе; 2 - на антенне
Таким образом, выявляется некоторая общая закономерность генетической регуляции индивидуального развития. Оно во многом определяется иерархией генов, кодирующих транскрипционные факторы. Эти белки, инициируя одну стадию развития, влекут за собой активацию других генов и синтез новых транскрипционных факторов, которые регулируют следующую стадию, активируя очередную группу генов, но оказывая при этом регулирующее влияние и на предыдущие. В результате формирование конкретных структур управляется целыми генными сетями. Ключевые гены, инициирующие специфическую программу развития определенной структуры или органа, т.е. активирующие конкретную генную сеть (сетевой принцип генетической регуляции), образно названы «гены-господа» или «мастер-гены», а запускаемые ими структурные гены-мишени, образующие каскад, - «гены-рабы ».
Примерами скоординированной экспрессии генов, приводящей к формированию той или иной морфологически сложной структуры, могут служить программа развития поджелудочной железы, запускаемая геном pdf-1, развития селезенки благодаря активации гена Нох11, развития сердца, инициируемая геном Crypto. Известны «гены-господа» и для формирования отдельных зародышевых листков. Так, мутация гена casanova блокирует развитие энтодермы, а генов Brachiury и zeta-globin - мезодермы. Наконец, считают, что и специализированные ткани, и типы клеток формируются по «разрешающему сигналу» соответствующих ключевых генов. Таким геном, например, для созревания альвеолярного эпителия является Wn17.
Весьма интересный пример генетического контроля развития - функционирование сложного гена T-локуса у мышей (см. п. 4.3.3.2). Он представлен 117 аллелями, большинство из которых рецессивны и обозначаются буквой t с дополнительными индексами. Весь ряд рецессивных аллелей t разделяется на восемь групп, которые могут быть комплементарны друг другу, т.е. гетерозиготные зародыши, в генотипе которых находятся аллели t из разных групп, не погибают. В гомозиготном состоянии аллели каждой из восьми групп обусловливают разного рода дефекты (рис. 8.50). Первичное нарушение, лежащее в основе всех эффектов, всего лишь одного локуса пока не выяснено. Однако очевидно, что локус T играет первостепенную роль на самых ранних стадиях развития и в морфогенезе эктодермы мышиного зародыша, и организма в целом. Известны также пять доминантных мутаций T-локуса. Один из таких доминантных аллелей - Brachiury, о котором было сказано выше.
Таким образом, генетический контроль онтогенеза очевиден. Многочисленные исследования последних лет добавили многое для его понимания, но до формирования целостного представления еще очень далеко. Однако уже сейчас ученые пришли к выводу о существовании
Рис. 8.50. Аллели локуса T мыши, блокирующие развитие производных эктодермы на различных стадиях
ряда универсальных закономерностей генетической регуляции индивидуального развития. Они обсуждались в данном разделе. Одна из них - «опережающее» функционирование генов в ходе онтогенеза. Как отмечалось, многие продукты синтезируются в развивающемся зародыше заранее, задолго до того, как они будут востребованы. Это, в частности, вещества, которые участвуют в разметке плана строения организма (продукты генов сегментации, гомеозисных генов), в осуществлении эмбриональной индукции (индуцирующие вещества и их ингибиторы). Другая закономерность - существование генных сетей в развитии органов или структур - каскадов структурных генов, часто инициируемых активацией одного ключевого гена и организованных по иерархическому принципу. Другими словами, основу индивидуального развития составляет взаимодействие генов, их системное, а не автономное функционирование (см. независимое наследование признаков Г. Менделя - менделизм классической генетики, сальтаторный характер генных мутаций, феномен ге-нокопирования в практике медико-генетического консультирования).
8.2.10.2. Средовой контроль развития
Средовые факторы оказывают значительное влияние на процессы развития. В эмбриогенезе млекопитающих выделяют три группы таких факторов (см. п. 4.3.1.1). Во-первых, это среда самого развивающегося организма, во-вторых, - среда материнского организма и, наконец, внешняя среда в обычном ее понимании (внеорганизменная среда).
Приведем примеры влияния каждой группы. Воздействие среды самого развивающегося зародыша можно наблюдать при дифференциации глазного пузыря. В его стенке, прилегающей к покровному эпителию, затруднено снабжение тканей кислородом и происходит накопление продуктов метаболизма. Именно это и определяет его преобразование в сетчатку. В стенке пузыря, обращенной к мозгу, продукты жизнедеятельности активно удаляются, и кислород имеет свободный доступ к ткани, обеспечивая ее дифференциацию в пигментную оболочку.
Изменение гормонального статуса развивающегося организма также влияет на ход эмбриогенеза. При сравнении трех линий мышей, отличающихся по уровню гормона коры надпочечников - кортизола, было выявлено его воздействие на темпы роста небных отростков верхней челюсти и, таким образом, на формирование твердого неба. У одной из линий несращение твердого неба наблюдалось в 100% случаев, у второй - в 17% случаев. У гибридной линии, имеющей промежуточные показатели уровня кортизола, с расщелиной твердого неба рождалось 40% мышат.
Вторая группа средовых факторов, влияющих на организм на протяжении всего периода эмбрионального развития, отражает состояние материнского организма. Так, недостаток витаминов группы В у матери может быть причиной дефектов в строении печени и сердца плода, витамина С - дефектов нервной системы. Заболевание матери краснухой в начале беременности приводит к возникновению пороков сердца, органов зрения и слуха, нарушению срастания верхнечелюстных и небных костей. В случае недостаточности у матери функции щитовидной железы происходит гипертрофия (чрезмерное увеличение) ее у эмбриона, что ведет к нарушению деятельности этой железы у ребенка в постна-тальном онтогенезе.
Следующий пример характеризует влияние последней из указанных групп - факторов внеорганизменной среды. К подобным воздействиям может быть отнесен, например, недостаток кислорода во вдыхаемом воздухе в условиях высокогорья. В этом случае развивающийся организм не получает достаточно кислорода для осуществления метаболических процессов (гипоксия), следствием чего могут быть тяжелые поражения головного мозга, а в некоторых случаях и гибель.
Таким образом, совершенно очевидно существование генетического и средового контроля развития, однако результат онтогенеза особи зависит не только от влияния этих факторов, но и от действия системных интегрирующих механизмов развития и способности к эмбриональной регуляции, присущей самому зародышу.
8.3. целостность онтогенеза
Как только в результате дробления образуются два первых бласто-мера, каждый из них становится неразрывной частью новой биологической системы, и его поведение определяется этой системой. На любой стадии развития зародыш представляет собой интегрированное целое, а не сумму бластомеров (клеток). Интеграция развивающихся зародышей непрерывно меняется по мере развития. Основные механизмы интеграции - межклеточные и межзачатковые взаимодействия, а также гуморальная и нервная регуляция.
Различия в уровне интеграции, в характере взаимодействия клеток у разных видов животных могут быть очень существенными. Кроме того, иногда на более ранних стадиях развития зародыш более интегрирован, чем на более поздних. Так, личинки асцидий, вероятно, более интегрированы, чем взрослые формы. То же наблюдается, по-видимому, у мно-
гих моллюсков и червей. У позвоночных животных интегрированность нарастает по мере углубления процессов органогенеза и цитодифферен-цировки.
8.3.1. ДЕТЕРМИНАЦИЯ В ХОДЕ РАЗВИТИЯ
Дифференцировке клеток, приобретению ими морфологических и функциональных отличий предшествует детерминация (от лат. determinatio - ограничение, определение) - предопределение судьбы клеток, которое осуществляется благодаря возникновению качественных различий между ними. Под детерминацией подразумевается предназначение клеток к тому, чтобы в конечном счете дифференцироваться именно в этот, а не какой-нибудь иной клеточный тип. Никаких явных структурных или функциональных изменений в клетках на этой стадии не происходит. Клеточный материал считают детерминированным, начиная со стадии, когда он впервые обнаруживает способность при пересадке в чуждое место дифференцироваться в тот тип клеток, который из него образуется при нормальном развитии.
Детерминация отдельных клеток и клеточных комплексов неразрывно связана с детерминацией зачатков органов и структур организма, которая предшествует дифференциации частей (структур) развивающегося организма. При этом первоначально детерминируется общее - целый зачаток, а затем определяется судьба отдельных клеток. Под детерминацией частей организма также понимают возникновение качественных различий, которые предопределяют дальнейшую судьбу этих частей, прежде чем возникают морфологические различия между ними (дифференциация).
В последнее время получил распространение термин коммитация. По сути, он означает то же, что и детерминация. Термин «детерминация» относят преимущественно к ранним эмбриональным стадиям развития, а о коммитации говорят чаще всего применительно к отдельным клеткам, судьба которых определяется на относительно поздних стадиях развития. Так, например, говорят о коммитации различных типов клеток крови, возникших из первичной (родоначальной стволовой) кроветворной клетки.
Предшествующая процессам дифференцировки, дифференциации и морфогенеза, наблюдаемым на протяжении всего развития, детерминация также реализуется на протяжении всего онтогенеза особи. Объем детерминируемых областей с возрастом уменьшается. В раннем эмбриогенезе
детерминируются области, соответствующие зародышевым листкам, затем определяется общий план строения организма зародыша. На более продвинутых фазах эмбрионального развития и даже в постэмбриональном периоде под действие этих процессов подпадают более ограниченные области - зачатки органов или отдельных структур организма.
Детерминированность элементов развивающегося организма тесно связана с понятием потенций развития. Потенции (проспективные потенции) - это все возможные направления развития элементов организма, которые могли бы осуществиться при определенных условиях, в том числе и отличных от нормальных. То, во что данный элемент развивается при нормальных условиях, называют его проспективным (презум-птивным) значением. Очевидно, что проспективные потенции некоторой части зародыша не могут быть уже ее проспективного значения.
На каждом этапе развития элементы организма - отдельные клетки, клеточные комплексы, зачатки органов и структур характеризуются определенными потенциями. В ходе развития организма по мере усиления детерминации происходит изменение (сужение) потенций его элементов. Другими словами, наблюдается рестрикция - ограничение возможностей выбора путей развития, предоставляемых развивающемуся элементу. Пример, иллюстрирующий рестрикцию потенций клеток мезодермы зародыша, представлен на рис. 8.51.
Рассмотрим, как происходит изменение потенций элементов развивающегося организма на примере Хордовых. Как говорилось выше, на стадии дробления в клетках зародыша первоначально синтез белков осуществляется на матрицах, запасенных в ходе овогенеза. Когда происходит активация собственных генов зародыша, экспрессирует-ся максимальное за весь период онтогенеза количество генетического материала. Все клетки зародыша на этой стадии развития синтезируют только общеклеточные белки («house keeping» proteins) и проявляют активность одних и тех же генов. Вследствие этого (напомним, что на указанной стадии) зародыш является однослойным, поскольку все его клетки однородны с генетической и биохимической точек зрения. Бла-стомеры в фазе дробления эквипотенциальны (равнонаследственны), т.е. все они имеют одинаковые возможности развития. Эти возможности максимальны, что определяет способность отдельного бластомера дать начало целому зародышу и, следовательно, всем типам клеток сформированного организма. Это свойство клеток получило название тоти-(омни) потентность. Доказательством служат опыты Дриша, который разделял бластомеры 2-, 4- и даже 8-клеточных зародышей морского
Рис. 8.51. Схема дифференцировки мезодермы (по В.В. Яглову, с упрощениями)
ежа. Отдельные бластомеры впоследствии давали начало полноценному организму. Сходные эксперименты были предприняты и на других животных, в том числе относящихся к различным классам Хордовых. Было установлено, что у тритона тоти(омни)потентность сохраняется до стадии 16 бластомеров, у кролика - до стадии 4-8 бластомеров, у человека - 24 бластомеров. Доказательством последнего утверждения является рождение у человека однояйцевых близнецов (см. также полиэмбриония).
У большинства хордовых клетки утрачивают тоти(омни)потентность к концу дробления. На стадии бластулы и в фазе гаструляции начинают работать гены терминальной дифференцировки, кодирующие специфические белки. Вследствие этого происходит детерминация клеток и начинаются проявления дифференцировки клеток зародыша, образующих к концу гаструляции зародышевые листки. На этом этапе
наблюдается рестрикция потенций клеток зародыша, что подтверждают опыты по пересадке в развивающийся «неокрашенный» зародыш клеток, взятых из различных областей другого зародыша той же стадии развития и помеченных флуоресцентным красителем. Было установлено, что отдельные энтодермальные клетки до стадии средней бластулы практически тоти(омни)потентны: будучи пересаженными в соответствующую область, они могут дать все другие клеточные типы, происходящие в норме как из экто-, так и из мезодермы. Например, если одну меченую энтодермальную клетку пересадить на территорию глазного зачатка, то она даст одну из клеток сетчатки глаза. Однако если отдельные энтодермальные клетки пересаживали на стадии поздней бластулы, они сохраняли потенции к формированию мезодермальных клеток, но утрачивали потенции к образованию эктодермальных. Наконец, к стадии ранней гаструлы они сохраняли потенции только к образованию эн-тодермальных производных. В целом к концу гаструляции возможности дифференцировки клеток зародыша ограничиваются компетенциями конкретных зародышевых листков.
Однако круг возможных направлений развития клеток все еще довольно широк, клетки мульти(плюри)потентны. Благодаря этому клетки на стадии ранней гаструлы оказываются способны при определенных условиях к трансдетерминации - смене направления развития, переопределению своей судьбы. В этом случае говорят о состоянии лабильной детерминации. В ходе последующего развития лабильная детерминация сменяется стабильной, которая необратимо и прогрессивно сужает круг возможных направлений развития данного элемента организма. В ходе гисто- и органогенеза наблюдается дальнейшее ограничение возможных путей развития элементов зародыша, вплоть до момента, когда сохраняется лишь единственный путь специализации - подобное состояние определяется как унипотентность. Процесс прогрессивного ограничения потенций в ходе онтогенеза получил название канализация развития (рис. 8.52).
Из вышесказанного следует вывод, что детерминация элементов развивающегося организма - это процесс, пользуясь языком эмбриологов и биологов, развития, ограничения проспективных потенций до проспективных значений.
Как уже указывалось, детерминация идет от общего к частному: сначала детерминируется судьба целого зачатка развивающегося организма, а в дальнейшем определяется судьба клеток его конкретных (частей) элементов. Именно поэтому трансдетерминация на более ранних
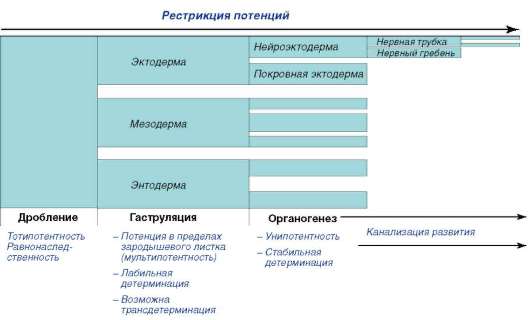
Рис. 8.52. Изменение потенций элементов зародыша в процессе развития
фазах развития возможна в более крупных масштабах, а в ходе дальнейших преобразований - во все более ограниченных. На стадии ранней гаструлы детерминируется судьба клеток целого зародышевого листка. Так, проспективные потенции любой клетки эктодермы обеспечивают возможность каждой из них войти в состав любого производного данного зародышевого листка: нейральных структур, эпителиальных структур кожи и начальных и конечных отделов кишечной трубки, элементов органов чувств и т.д. На стадии ранней гаструлы пересадка клеток пре-зумптивной нервной пластинки в область будущего эпидермиса живота приводила к тому, что они становились эпидермальными и наоборот, пересадка любого участка презумптивного эпидермиса в область будущей нервной пластинки вызывала его превращение в нервную ткань. На стадии поздней гаструлы клетки оказываются уже жестко детерминированными к образованию только конкретных структур, например клетки нейроэктодермы уже не способны к образованию эпителиальных структур кожи, передней и задней кишки. Они участвуют в формировании элементов центральной и периферической нервной системы, дают начало некоторым костям черепа, пигментным клеткам кожи, элементам органов чувств и др. В дальнейшем потенции определенных групп клеток нейроэктодермы еще более ограничиваются, причем каждая клеточная популяция характеризуется своим направлением развития. Однако и в
пределах ограниченных клеточных групп, если их потенции еще не уникальны, возможны явления трансдетерминации, конечно, в более узких масштабах, чем на более ранних фазах развития. В частности, в ходе органогенеза выпячивание переднего мозга формирует глазной пузырь, из которого образуется глазной бокал, представляющий собой двустенную чашу. При формировании последнего внутренняя стенка сжимается и образует сетчатку, а внешняя растягивается и формирует пигментный эпителий. Но эти участки эквипотенциальны - равнонаследственны. Если воздействия поменять, то и дифференцировка поменяется, т.е. довольно длительное время они могут превращаться друг в друга, что и было доказано в экспериментах на амфибиях.
Практически у всех животных в раннем развитии можно найти такую стадию, когда проспективные потенции частей шире их проспективных значений. Отличие состоит в том, в какой момент детерминация становится необратимой. У животных с регуляционным типом развития тоти(омни)- и мульти(плюри)потенциальность сохраняется довольно длительное время, что делает возможным трансдетерминацию. Потенции эмбриональных клеток при мозаичном типе развития существенно сужаются уже в период дробления, иногда в самом его начале. В этом случае клетки быстро теряют тоти(омни)потентность и зародыш представляет собой как бы мозаику самодифференцирующихся частей.
Считают, что одним из механизмов детерминации является избирательная трансляция мРНК в клетках. Как отмечалось в п. 8.2.5.2, предсинтезированные мРНК для многих белков запасаются в виде ин-формосом. Их трансляция начинается на более поздних стадиях развития, при этом часть из них подвергается деградации и в трансляции не участвует. Потенции клетки зависят от набора мРНК в ней, определяющих возможные пути дифференцировки. Эмбриональная детерминация наступает тогда, когда происходит синтез белка на одних матрицах из этого (существующего) набора и разрушение других. В целом, в зародышах транскрипция генов, отвечающих за последующие этапы диф-ференцировки, происходит в более широкой области (в большем числе клеток), чем последующая трансляция.
Другим механизмом может служить непосредственная активация или блокирование генов. Так, в опытах с использованием эмбриональных стволовых клеток было показано, что одним из генов, обусловливающим тоти(омни)потентность является OCT-4. Он экспрессируется в зрелых ооцитах и в делящихся эмбрионах до стадии морулы. Специализация клеток бластоцисты - формирование трофобласта - приво-
дит к исчезновению экспрессии OCT-4 в клетках последнего, тогда как в клетках внутренней клеточной массы экспрессия гена сохраняется. К 7-й неделе развития экспрессия OCT-4 определяется только в первичных половых клетках. В экспериментах на стволовых клетках установлено, что активация генов, обеспечивающих образование зародышевых листков, сопровождается прекращением экспрессии всех генов, контролирующих тоти(омни)потентность. Выяснено также, что существует антагонизм развития зародышевых листков. Например, главные индукторы гаструляции и мезодермы Nodal, Cripto, TGFβ являются сильнейшими блокаторами образования нейроэктодермы. Лишняя доза гена FoxA2 вызывает избыточное развитие эндодермы за счет мезодермы. Выключение гена-регулятора эктодермы EED приводит к перепродукции мезодермы за счет эктодермы зародыша.
В целом, детерминация тесно связана со свойствами развивающегося организма как интегрированной системы, которая включает взаимосвязанные и взаимозависимые части. Главное в понятии детерминации - проблема соотношения целостности организма и автономности, или способности его частей к самодифференцировке.
8.3.2. ЭМБРИОНАЛЬНАЯ РЕГУЛЯЦИЯ
В условиях нормального развития преобразования отдельных элементов и организма в целом строго согласованы по месту, объему и срокам. Однако даже при различных естественных или искусственных нарушениях процесса развития зародыша возможно восстановление нормального его хода. Это явление, получившее название эмбриональная регуляция, открыто в 1908 г. Г. Дришем.
Возможность эмбриональной регуляции определяется наличием в ходе развития периода, когда клетки зародыша тоти(омни)- или мульти(плюри)потентны и вследствие этого проспективные потенции элементов (частей) зародыша шире, чем их проспективная судьба. Важно заметить, что в этом периоде в зародыше имеются эквипотенциальные области, имеющие одинаковые возможности развития. На данном онтогенетическом отрезке развивающиеся элементы (части) зародыша обладают слабой компетенцией (способностью к выбору пути развития при определенных внешних воздействиях), а их детерминация лабильна, то есть не носит окончательного необратимого характера. Поэтому возможно изменить судьбу элемента (части) зародыша в результате изменения условий его (ее) развития, другими словами, возможна его трансдетерми-
нация. Путь дальнейшего развития элемента (части) зародыша во многом зависит от его положения в зародыше и оказываемых на него (нее) воздействий. Именно благодаря всему перечисленному и возможно восстановление нормальной, геометрически правильной (результат морфогенеза) и полной структуры организма, несмотря на удаление, добавление и перемешивание части материала зародыша, что было продемонстрировано многочисленными экспериментами по нарушению развития на стадиях зиготы, дробления, гаструляции, органогенеза. Например, исследователи объединяли диссоциированные клетки двух отличающихся по генам окраски шерсти мышиных зародышей, находящихся на стадии морулы. Образовавшуюся в результате объединения бластоцисту имплантировали в матку мыши (приемной матери). В итоге развивались нормальные мышата-химеры (аллофенные мыши), в окраске которых проявилось действие генов обоих «родителей» (рис. 8.53).
Восстановление нормального хода онтогенеза возможно даже при нарушении ово(оо)плазматической сегрегации яйцеклетки. Так, сильное центрифугирование яиц моллюсков, морского ежа, амфибий, приводящее к полному нарушению расположения в них (их цитоплазме) желтка
Рис. 8.53. Схема эксперимента по получению химерных мышей
и других компонентов, не изменяет характера развития. Аналогичные результаты получены и в ходе экспериментов по изъятию части цитоплазмы яйцеклетки или объединению цитоплазмы нескольких яйцеклеток. В этих случаях происходило формирование нормального зародыша, имевшего соответственно меньший или больший, чем обычно, размер.
Способность к эмбриональной регуляции гораздо ярче выражена у организмов с регуляционным типом онтогенеза (иглокожие, хордовые), у которых на ранних этапах развития ведущим является механизм межклеточных и межзачатковых взаимодействий. Полагают, что в ходе эволюции хордовых произошло расширение областей и удлинение сроков компетенции, что также является важным фактором, определяющим возможность эмбриональной регуляции. Иллюстрацией этого может служить формирование глаза не в ненадлежащем месте при перемещении индуктора (рис. 8.54). В отношении млекопитающих было высказа-
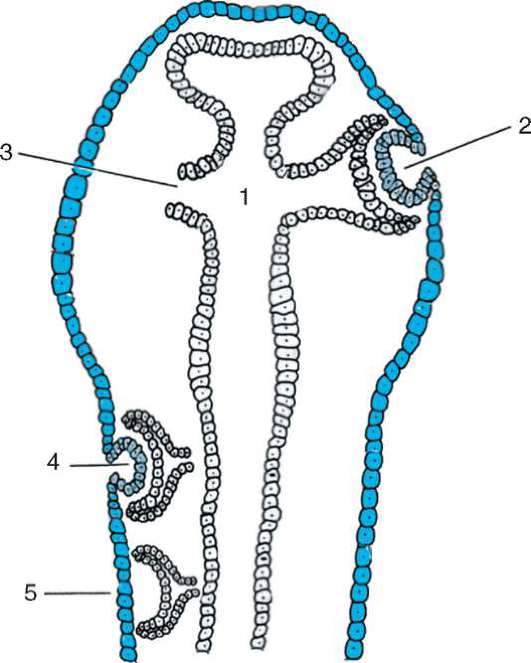
Рис. 8.54. Эмбриональная регуляция при формировании глаза: 1 - мозг; 2 - нормальное развитие; 3 - глаз не формируется при отсутствии индуктора; 4 - атипичное расположение глаза при перемещении индуктора; 5 - глаз не формируется, т.к. отсутствует компетентность ткани
но предположение, что их развитие целиком базируется на механизмах взаимодействия клеток и структур зародыша и предетерминированные участки цитоплазмы не играют никакой (существенной) роли.
Возможность эмбриональной регуляции существует и у зародышей с ярко выраженным мозаичным развитием, несмотря на раннюю и необратимую детерминацию клеток и структур развивающегося организма. Так, у одного из видов коловраток тело взрослой особи содержит точно определенное число клеток - 959, из них 301 - клетки кожи, 165 образуют глотку, 19 - половой аппарат, 122 - мускулатуру, 247 - нервную систему, 24 - выделительную систему. Формирование практически каждой клетки взрослого организма жестко и необратимо детерминируется цитоплазматической сегрегацией специфических факторов уже во время первого деления дробления. Однако изолированный единственный бластомер с половым зачатком может образовывать целый зародыш, т.е. он обладает тоти(омни)потентностью. Кроме того, у такого зародыша с жестко детерминированными клетками сохраняется ограниченная возможность переопределения клеточной судьбы (клеточных судеб) вследствие индуктивных межклеточных взаимодействий.
Важное следствие регуляционных процессов - эквифинальность развития, т.е. достижение нормального (требуемого) конечного результата разными путями. Например, после диссоциации и перемешивания бластомеров морского ежа формировались нормальные личинки, однако образование структур происходило иными путями: кишечник формировался не путем инвагинации, а вследствие расхождения клеток из плотной массы - шизоцельно, скелет возникал раньше, чем покровы.
Эмбриональная регуляция - признак эволюционного прогресса, так как она обеспечивает возможность получения нормального (требуемого) конечного результата развития даже при его нарушениях, а также определяет резерв изменчивости, который может стать источником эволюционных преобразований. В ходе онтогенеза способность (возможность) к эмбриональной регуляции падает (снижается), но не исчезает совсем, так как известно, что у взрослого организма существует, например, способность к регенерации.
8.3.3. МОРФОГЕНЕЗ
Морфогенез - процесс образования структур и органов и преобразования их формы в процессе индивидуального развития организмов. Это, несомненно, самый сложный и упорядоченный природный процесс.
В классической эмбриологии под морфогенезом обычно понимают возникновение многоклеточных структур. У хордовых животных первые видимые морфогенетические события - закладка осевых органов - отмечаются в ходе нейруляции. Однако следует помнить, что индукционные взаимодействия групп клеток (зачатков), определяющие начальные этапы морфогенеза, осуществляются еще на стадии бластулы и ранней гаструлы (см. п. 8.2.8). Таким образом, правомерно считать, что морфогенез на над-клеточном уровне начинается со стадии бластулы. В период гаструляции, как и во время нейруляции, перестройки охватывают весь зародыш. Следующие затем органогенезы представляют собой все более локальные процессы. Внутри зачатка каждого из формирующихся органов происходит дальнейшая последовательная дифференциация.
Параллельно с образованием многоклеточных структур формируются субклеточные и клеточные элементы. Происходят сложные цитодиффе-ренцировки, которые осуществляются путем координированной активности многих внутриклеточных образований - мембраны, микротрубочек и центров их организации, аппарата Гольджи и ряда других. Так, диффе-ренцировка всасывающих клеток эпителия почек и кишечника связана со сборкой мощных пучков актиновых микрофиламентов, образующих структурную основу микроворсинок, размеры и строение которых характеризуются высокой точностью (определенностью). Помимо этого происходит перестройка клеточных мембран, определяющая их будущие функциональные свойства. Эти процессы, в свою очередь, сопровождаются синтезом и пространственной организацией макромолекул, в частности, образованием и встраиванием в плазмалемму белковых комплексов, обеспечивающих различные виды транспорта веществ. Таким образом, морфогенез представляет собой многоуровневый динамический процесс, который в конечном итоге приводит к формированию интегрированной сбалансированной (целостной) особи конкретного биологического вида.
Морфогенез как рост и клеточная дифференцировка относится к ациклическим процессам, т.е. не возвращающимся в прежнее состояние и по большей части необратимым. Главное свойство ациклических процессов - их пространственно-временная организация. Проблема формирования пространственной структуры развивающегося организма относится к одной из наиболее сложных в биологии.
Каковы же движущие силы морфогенеза? Этот вопрос до сих пор остается открытым.
Безусловно, в осуществлении морфогенеза значительная роль принадлежит генетической информации, которую организм получает при фор-
мировании (образовании в момент оплодотворения). Геном обеспечивает возможность развития особи конкретного вида. Постепенные прогрессирующая и последовательная дифференциации клеточных комплексов и частей зародыша, образование определенных структур и органов в ходе его развития осуществляется на основе дифференциальной экспрессии генов (см. п. 8.2.5) в идентичных наборах (необходимо помнить о ди-плоидности зиготы и соматических клеток, что определяет возможность присутствия в генотипах разных зародышей различных аллельных форм конкретных генов). При этом в формировании даже отдельного признака, не говоря уже об образовании сложной пространственной структуры развивающегося организма, участвует значительное число генов, которое может достигать нескольких тысяч (рис. 8.55).
Система генов, регулирующих образование какого-либо органа или реализацию конкретного морфогенетического процесса, организована по иерархическому принципу. Так, в ходе онтогенеза происходит последовательная активация определенных групп генов, причем продукты ранее активированных генов влияют на экспрессию следующих групп. В генных каскадах существуют «гены-господа» («мастер-гены»), активация которых инициирует процесс и включает экспрессию целого

Рис. 8.55. Примерное число генов, участвующих в форсировании органов человека
комплекса подчиненных «генов-рабов», что в конечном итоге и приводит к формированию определенной структуры. Примером такого «мастер-гена» является ген ey, запускающий развитие глаза у дрозофилы. Убедительным свидетельством генетического контроля морфогенеза могут служить также открытые недавно различия в регуляции органогенеза трехкамерного и четырехкамерного сердца. Изучение развития сердца у амфибий, рептилий, млекопитающих и птиц показало, что ключевую роль в превращении в ходе эволюции трехкамерного сердца в четырехкамерное сыграли изменения в работе регуляторного гена Tbx5. В трехкамерном сердце этот ген экспрессируется равномерно в зачатке желудочка, а в четырехкамерном ген активен только в левой его части.
Таким образом, в геноме организмов содержится информация о развитии особи определенного вида и, кроме того, присутствуют гены, экспрессия которых может привести к формированию конкретных зародышевых листков, органов, тканей. В генотипе зиготы содержатся также аллели родителей, обладающие возможностью реализоваться в определенные признаки. Однако известно, что разноуровневая регуляция экспрессии генов (вспомним хотя бы альтернативный сплайсинг) приводит к тому, что результатом активности даже одних и тех же генов могут быть совершенно разные наборы конечных продуктов и, как следствие, множественность возможных путей развития.
Каким же образом активность отдельных генов, генных комплексов и генных каскадов может определить из каких именно клеток, в каком месте и в какой конкретной форме разовьется тот или иной орган? Этот вопрос становится еще более интригующим, если учесть такое наблюдаемое в онтогенезе явление, как перекрывание программ развития. Оно подразумевает, что в самую начальную фазу клеточной дифференци-ровки включается с разной степенью эффективности несколько разных программ развития, еще не дающих однозначного решения конечной клеточной судьбы. Например, в дифференцирующемся в катехолами-нэргическом направлении нейробласте происходит не только синтез и(м)РНК для образования компонентов катехоламинэргической системы, но и существенно более слабый синтез и(м)РНК для компонентов холинэргической системы. Если в определенный момент развития сменить иннервируемую данной клеткой катехоламинэргическую мишень на холинэргическую, то активируется синтез «холинэргических» РНК, а продукция «катехоламинэргических» начнет тормозиться. В результате произойдет изменение пути развития клетки - трансдетерминация. Несмотря на возможность изменений, в ходе эмбриогенеза реализуются
строго упорядоченные морфогенетические процессы, и с очень высокой пространственной точностью формируется организм конкретного вида, обладающий определенной структурой и значительно более богатой информацией, чем генетическая информация зиготы. Очевидно, что реализация морфогенеза не определяется только функционированием генетического материала.
Для объяснения механизмов морфогенеза был предложен ряд концепций. Суть некоторых из них заключается в определении судьбы клеток зародыша в соответствии с формируемыми в развивающемся организме градиентами.
В начале ХХ в. американским ученым Ч. Чайльдом разработана концепция физиологических градиентов. По мнению автора, пространственная локализация процессов клеточной дифференцировки и морфогенеза определяется обнаруживаемыми у многих животных градиентами интенсивности обмена веществ и совпадающими с ними градиентами повреждаемости тканей. Обычно они снижаются от переднего (головного, рострального, анимального) полюса зародыша к заднему (хвостовому, каудальному, вегетативному). Возникновение самих градиентов определяется гетерогенностью внешней среды, например распределением питательных веществ, концентрацией кислорода или силой тяжести. Любое из перечисленных условий или их совокупность могут вызвать первичный физиологический градиент в яйцеклетке. Затем возможно возникновение вторичного градиента под некоторым углом к первому. Система из двух или более градиентов и создает определенную координатную систему, функцией координаты является судьба клетки.
В 1969 г. английским биологом Л. Вольпертом сформулирована концепция позиционной информации (модель трехцветного французского флага) - одна из наиболее распространенных точек зрения на данный момент. Под позиционной информацией подразумевается зависимость судьбы той или иной клетки от ее положения (позиции) в системе развивающегося организма. Позиция определяется концентрацией химических веществ - морфогенов. По современным представлениям, морфоген выделяется из локального источника (группы клеток или определенной зоны зародыша), и во время последующей диффузии в ткани образуется градиент его концентрации. В развивающемся зародыше одновременно существуют градиенты различных морфогенов, диффундирующих из нескольких источников. Позиционная информация в виде различных концентраций разнообразных морфогенов воспринимается клетками, и их детерминация и дифференцировка определяются полученными
Рис. 8.56. Модель французского флага: а - изображение флага; б - каждая клетка потенциально может стать красной, синей или белой; в - позиция каждой клетки характеризуется определенным уровнем морфогена; г - направление дифференцировки клетки зависит от позиционной информации; 1 - концентрация морфогена; 2 - пороговые уровни морфогена
сигналами (рис. 8.56). Один и тот же набор сигналов может по-разному восприниматься и интерпретироваться клетками в зависимости от их чувствительности к различным концентрациям морфогена. Таким образом, создается своеобразная химическая мозаика, определяющая план строения организма, воплощаемый в жизнь в ходе онтогенеза. Важно то обстоятельство, что подобные градиенты морфогенов могут возникать как в целом зародыше на начальных этапах эмбриогенеза, так и в отдельных формирующихся зачатках в дальнейшем развитии. Получаемая клеткой позиционная информация определяет, какую часть образующейся структуры и в каком именно месте зародыша клетка будет формировать.
За последние годы осуществлено много исследований, посвященных роли морфогенов, особенно в развитии плодовых мушек (Drosophila) и амфибий (Xenopus). Так, у дрозофилы к группе морфогенов относят продукты активности генов с материнским эффектом, например, гена bicoid (bcd) (см. п. 8.2.6). Градиент концентрации данного морфогена в яйцеклетке определяет формирование передне-задней оси (передне-заднего направления) развивающегося организма. Морфогенами являются также факторы шпемановской индукции у амфибий. Под действием различных соотношений концентраций фактора noggin, секретируемого в области дорзальной губы бластопора, и вентрализующего фактора ВМР удалось получить различный набор осевых структур зародыша. Очень показательны в этом отношении опыты японского исследователя Асашимы. Помещение клеток дорзального полюса бластулы амфибий (презумптивной эктодермы) в растворы, содержащие различные концентрации активина (белка из группы TGF-β), приводило к их дифференцировке в клетки хорды, сердца, мышц и других структур (рис. 8.57).
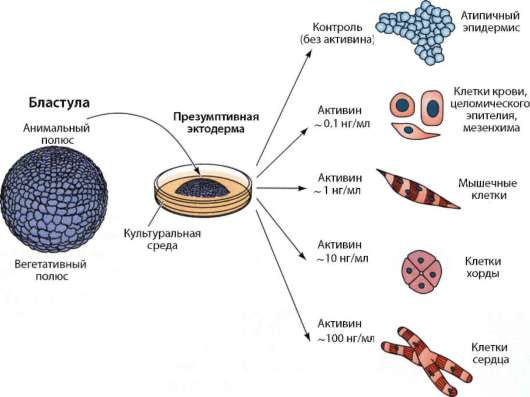
Рис. 8.57. Влияние различных концентраций активина на дифференцировку клеток презумптивной эктодермы амфибии в культуре
Однако представленные концепции не обладают целостностью. Очевидно, что одинаковые сигналы могут прочитываться клетками совершенно по-разному. Кроме того, градиенты в формирующемся зародыше могут изменяться. В опытах по перемешиванию клеток зародыша, объединению нескольких зародышей, удалению части клеток зародыша, при которых все сформированные градиенты нарушаются, наблюдается тем не менее возникновение нормальных (ожидаемых) закладок и формирование полноценных сложных структур. Все сказанное позволяет сделать вывод, что возникающие градиенты не являются той единственной движущей силой, которая однозначно определяет сложнейший процесс морфогенеза.
Изменение концентрации того или иного морфогена, вероятнее всего, не определяет однозначно направление клеточной дифференци-ровки, а носит дестабилизирующий характер, т.е. выводит клетки из исходного недифференцированного состояния. Достижение же клеткой окончательного состояния зависит в значительной мере от меж-
клеточных взаимодействий, геометрии клеточных групп, их движений, механических напряжений и т.д. Рассуждения подобного рода привели к разработке в 20-30-х гг. ХХ в. концепции морфогенетического поля. Наиболее разработанные концепции эмбрионального поля принадлежат австрийскому биологу П. Вейсу и двум российским-советским ученым А.Г. Гурвичу и Н.К. Кольцову. Они рассматривают весь зародыш (на ранних стадиях развития) либо отдельный его участок (на более поздних стадиях) как единое целое, развитием которого управляет поле этого целостного образования, созданное всей совокупностью элементов данного поля. Так, у амфибий и других животных на стадии поздней бластулы можно совершенно точно указать так называемые презум-птивные (предполагаемые) зачатки - области, из которых разовьются те или иные органы (см. п. 7.4.2.2). Эти области можно рассматривать как морфогенетические поля.
По мнению П. Вейса и А.Г. Гурвича, морфогенетическое поле не обладает обычными физико-химическими характеристиками. Так, А.Г. Гурвич полагал, что в формообразовательных процессах принимает участие биологическое поле, источником которого, вероятно, являются ядро клетки, его хромосомы. Клетки оказывают влияние друг на друга своими полями. Общее (целое) поле зародыша или зачатка какой-либо структуры - объединение полей всех составляющих его клеток. Н.К. Кольцов, напротив, считал, что силовое поле, с которым связано развитие зародыша, является физическим. Оно порождает потенциалы различной природы (электрической, химической, температурной, гравитационной и др.), под влиянием которых и осуществляются морфоге-нетические процессы.
Согласно всем этим концепциям, поле развивается так же, как и зародыш. Первоначальное воздействие поля приводит к осуществлению какого-либо морфогенетического процесса (например, образованию определенной закладки), следствием чего становится изменение поля, а это, в свою очередь, приводит к дальнейшему формообразованию. Таким образом, по мере развития образуются все новые и новые поля, управляющие развитием различных структур (органов).
По мнению П. Вейса, клетки формирующегося организма пассивны, и их преобразования полностью определяются морфогенетическим полем. По теории А.Г. Гурвича - поле порождают сами клетки зародыша.
В настоящее время полями органов называют эмбриональные территории, на которые распространяется состояние целостной детерминации, т.е. способности развиваться в зачаток того или иного органа.
Экспериментально установлено, что внутри поля образуется лишь один данный зачаток, тогда как развитие второго такого же, пересаженного в то же самое поле, подавляется, или он сливается с первым. Из любого малого участка поля формируется целый нормальный орган, хотя обычно меньшего размера. Каждое из полей (полей конкретных структур или органов) развивается независимо от других, т.е. какое-либо воздействие на одно из полей не влияет на соседнее.
Все элементы целого поля тем или иным способом «ощущают» друг друга, определяют свое положение и в соответствии с полученной информацией координируют свое поведение. Каким же образом осуществляется эта координация?
В настоящее время точно установлено, что в основе координированного развития лежат межклеточные и межзачатковые взаимодействия. Так, при формировании практически любой структуры развивающегося организма (глаз, зубов, легких и др.) наблюдаются реципрокные (дву-взаимонаправленные) индуктивные взаимодействия между элементами морфогенетического поля.
Яркий пример подобных взаимодействий наблюдается при формировании конечности. Источником ее развития служат скопление клеток, происходящих из боковой мезодермы, и покрывающие это скопление клетки эктодермы (рис. 8.58). Развитие конечности начинается с активации клеток боковой мезодермы в непосредственной близости
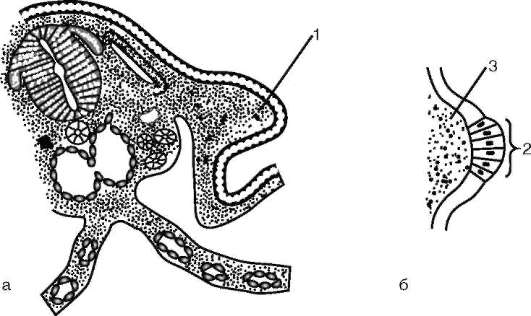
Рис. 8.58. Расположение элементов развивающегося крыла: а - схема расположения почки крыла; б - почка крыла; 1 - почка крыла; 2 - апикальный экто-дермальный гребень; 3 - мезодерма

от сомитов, которые, возможно, оказывают индуцирующее влияние на мезодерму в области будущей конечности. Активированные мезодер-мальные клетки зачатка конечности воздействуют на покрывающую их эктодерму, в результате чего она утолщается. Верхушку этого образовавшегося утолщения эпидермиса называют апикальным эктодер-мальным гребнем. Последний стимулирует рост почки конечности (при его удалении рост почки конечности прекращается), и под его влиянием происходит дифференцировка клеток мезодермы и образование дистальных отделов конечности. Мезодерма же поддерживает гребень в активном состоянии и определяет форму конечности. Например, мезодерма из почки крыла при соединении с эктодермой почки ноги образует крыло, покрытое перьями (рис. 8.59).
Взаимодействия между элементами поля могут иметь химическую, электрическую, механическую природу. Свое влияние может оказывать также тонкая структура твердого субстрата. Подобные взаимодействия могут быть не только ближними (между соседними элементами зародыша), но и дальними - между элементами, непосредственно между собой не контактирующими (поэтому и появился сам термин «поле»).
Рассмотрим некоторые примеры таких взаимодействий. Установлено, что в формирующейся конечности есть морфогенетически активная область - зона поляризующей активности (ЗПА). Она находится у основания закладки конечности на заднем крае. Ее присутствие необходимо для формирования передне-задней асимметрии конечности,
а именно образования определенного количества, формы и расположения пальцев. Это было доказано следующими опытами. Удаление ЗПА приводило к формированию симметричной конечности, а при подсаживании дополнительной ЗПА на передний край зачатка наблюдалось зеркальное удвоение конечности (рис. 8.60). Установлено, что в ЗПА выявляется повышенная концентрация ретиноевой кислоты. Предполагалось, что создается передне-задний градиент этого вещества, который и определяет асимметрию конечности. Однако эксперименты с репортерным геном, применение которого позволяет оценить экспрес-
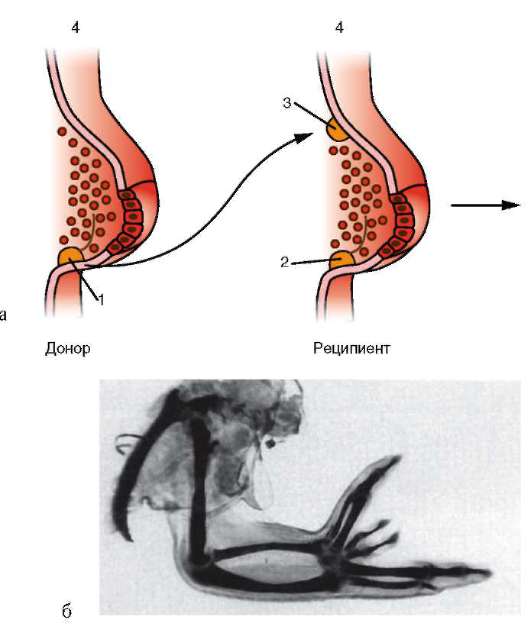
Рис. 8.60. Роль зоны поляризующей активности (ЗПА) в формировании конечности: а - схема эксперимента; б - фотография зародыша с зеркально удвоенной конечностью. 1 - локализация ЗПА в норме; 2 - собственная ЗПА реципиента; 3 - добавочная трансплантированная ЗПА; 4 - передний край развивающейся конечности
сию генетического материала в точке вставки этого гена, показали, что ретиноевая кислота действует не напрямую, а опосредованно, активируя синтез другого вещества, которое и является морфогеном. Это белок, кодируемый геном Sonic Hedgehog. Таким образом, в поле зачатка происходит получение позиционной информации на основе градиентов химических веществ, но это, как было сказано, лишь один из возможных вариантов.
Еще один определяющий морфогенез фактор - взаимодействия клеток с твердым субстратом. Примером могут служить эпителиаль-
но-мезенхимальные взаимодействия при образовании почки. Ее развитие происходит при участии эпителия формирующегося мочеточника и нефрогенной мезенхимы (рис. 8.61). Мезенхимные клетки продуцируют коллаген межклеточного матрикса, который повышает пролиферативную активность эпителия и стимулирует его развитие и ветвление. Под влиянием закладки мочеточника происходит конденсация клеток мезенхимы, и в ее межклеточном матриксе наблюдается замена ранее присутствующего коллагена I типа на вновь синтезируемый коллаген IV типа и лами-нин. В результате мезенхимные клетки превращаются в эпителиальные и начинают формировать капсулы и канальцы нефронов.
В реализации морфогенетических процессов определенная роль принадлежит механическим напряжениям. Так, при формировании глаза позвоночных животных образование сетчатки происходит из внутреннего сжатого слоя белочной оболочки, а клетки наружного растянутого слоя становятся пигментными (см. рис. 8.34). В эксперименте показано, что при культивировании глазного зачатка в условиях, исключающих растяжение, он весь превращается в сетчатку, а в условиях распластывания - в пигментный эпителий. Роль механических напряжений показана
Рис. 8.61. Развитие почки: а-г - последовательные стадии; 1 - мезенхима; 2 - эпителий формирующегося мочеточника; 3 - капсула нефрона; 4 - каналец нефрона
и для дифференцировки ряда других клеток - эритроцитов, фибробла-стов, клеток хряща и кости. Позднее было установлено, что механические напряжения влияют на скорость синтеза белков и нуклеиновых кислот и тем самым на процессы дифференцировки. В развитии зародыша дрозофилы под действием давления, оказываемого на глотку следующими за ней отделами кишки, происходит активация гена Armadillo. Этот ген может быть активирован и искусственным механическим давлением. Если давление устранить, то экспрессия гена не происходит.
Некоторое время назад считалось, что в межклеточных пространствах, так же как и в цитоплазме и клеточном ядре, находится что-то вроде разбавленных растворов, в которых осуществляется свободная диффузия сигнальных молекул. К настоящему времени, однако, накапливаются данные в пользу «твердотельной» модели, согласно которой большинство сигналов передается по «жестким конструкциям» из определенных белковых молекул. Эти конструкции собираются в ответ на специфические сигналы и разбираются в их отсутствие. В такой системе свободная диффузия молекул возможна лишь на весьма короткие расстояния (в несколько нанометров), а основная часть сигналов передается именно благодаря структурным перестройкам белковых конструкций. В связи с этим считают, что ядро, цитоплазма и внеклеточный матрикс обладают динамической, т.е. постоянно изменяющейся, архитектурой.
Таким образом, в ходе морфогенеза реализуются разнообразные межклеточные взаимодействия, осуществляемые на основе действия химических, физических и иных факторов. При рассмотрении процессов формообразования их действие разграничить весьма сложно. Каким бы ни было воздействие, в результате него клетка тем или иным путем получает определенный сигнал. В большинстве случаев это происходит посредством взаимодействия сигнальных молекул (лигандов) с рецеп-торными белками мембран клеток-мишеней. Сигнальная молекула может выделяться клеткой и передаваться по межклеточному пространству к клетке-мишени, может быть встроена в мембрану клетки и при контактных межклеточных взаимодействиях восприниматься клеткой-мишенью, или может быть выделена клеткой и при взаимодействии через внеклеточный матрикс фиксирована на его компонентах. Образующийся лиганд-рецепторный комплекс активирует внутриклеточный сигнальный путь (как правило, это цепь биохимических реакций, в которых принимают участие различные вторичные посредники - см. раздел 2.4.2). В итоге достигается изменение экспрессии (например, активация) определенных генов и необходимая реакция клеток-
мишеней: синтезируются требуемые белки, изменяется интенсивность энергетического обмена, запускаются клеточная пролиферация, апоп-тоз, дифференцировка и таким образом реализуется морфогенетический процесс. Оказалось, что сигнальные пути (каскады) очень консервативны. Набор сигнальных молекул и путей передачи сигналов сравнительно невелик. Они работают в морфогенезе беспозвоночных и позвоночных животных, что свидетельствует об их появлении в эволюции у общего предка двустороннесимметричных животных. Для некоторых видов межклеточных взаимодействий выявлены молекулярные механизмы, т.е. основные звенья сигнальных каскадов от лиганда через трансмембранные рецепторы и вторичные (внутриклеточные) посредники до активируемых генов.
Наряду с консерватизмом сигнальные пути обладают высокой степенью гибкости при ответах на межклеточные взаимодействия. Каждый сигнальный каскад (сигналлинг) неоднократно включается в разных тканях в процессе развития организмов, регулируя пространственную и временную специфичность экспрессии генов, определяющих пути дифференцировки различных клеток разнообразных формирующихся структур. Так, белки семейства Hh (Hendgehog) млекопитающих в качестве лигандов принимают участие в морфогенезе конечностей, образовании аорты и основных вен, регионализации нервной трубки и многих других процессах. Считают, что у позвоночных развитие лишь небольшого числа морфологических отделов тела не подвержено влиянию Hh-сигнала. У дрозофилы Hh-белки экспрессируются в клетках заднего отдела каждого имагинального диска. Им принадлежит центральная роль в эмбриональном развитии крыла, глаза, конечностей, гонад, брюшка, кишки и трахеи.
Неоднозначные эффекты одного и того же лиганда объясняются следующим. Возможно образование множества изоформ лигандов и рецепторов. Лиганд способен связываться с разными рецепторами. В свою очередь, один и тот же рецептор в разных тканях может активировать разные внутриклеточные посредники. Таким образом оказывается влияние на экспрессию разных групп генов и активируются альтернативные пути развития клеток. В регуляции экспрессии генов-мишеней могут одновременно участвовать несколько сигнальных путей, которые связываются между собой через боковые передающие цепочки, влияя друг на друга промежуточными продуктами. Результаты регуляции существенно зависят от параметров взаимодействия между каскадами. Подобные «разветвленные» взаимодействия обусловливают формирование сигнальных сетей.
Таким образом, действие одних и тех же лигандов, активация одних и тех же сигнальных путей, экспрессия одних и тех же (или очень близких по структуре) генов у разных видов животных и даже у одного и того же вида на разных стадиях развития приводит к осуществлению совершенно различных дифференцировок. Возможно также и обратное. Формирование гомологичных органов у эволюционно родственных групп организмов происходит под контролем совершенно различных молекулярно-генетических систем. Это позволило сделать заключение, что гены или сигнальные пути, взятые сами по себе, не могут управлять дифференцировкой клетки. Ответ клетки на конкретный сигнал и активация ею того или иного молекулярно-генетического механизма определяется всей предыдущей историей развития данной клетки. С этой точки зрения результаты межклеточных взаимодействий являются контекст-зависимыми. Под «контекстом» понимают состояние конкретной клетки в данный момент, которое определяется ее онтогенетической историей.
Существование предшествующей истории развития (контекст-зависимость) позволяет в некоторых случаях легко трансформировать дифференцированную клетку в другой клеточный тип. Например, фи-бробласт можно трансформировать в миобласт (мышечную клетку), если активировать лишь один ген МуоВ. Он, в свою очередь, запускает действие других генов, которые кодируют специфические мышечные белки. Такая возможность обусловлена близким сходством «контекстов» фибробластов и миобластов, т.е. сходством начальных стадий их дифференцировки.
Процесс формообразования может быть реализован при изменении положения, уменьшении или увеличении количества бластомеров, в атипичном месте или изолированно от организма. Так, если зачаток бедра куриного зародыша культивировать в искусственной среде, он продолжает развиваться в прежнем направлении. Глаз крысы, изолированный на стадии 14-17 сут, продолжает автоматически развиваться, хотя дефектно и медленнее. Через 21 сут глаз в культуре тканей приобретает ту степень сложности структуры, которую нормально он уже имеет на 8-е сутки после рождения крысы. Морфогенетический процесс может быть запущен активацией определенных генов или в результате взаимодействия элементов зародыша. Следовательно, можно предположить, что в процессе формирования структуры зародыша обладают способностью к саморазвитию, в достаточной степени автономны и регулируются самой целостной развивающейся системой.
Это позволяет рассматривать морфогенез как самоорганизующийся и самоконтролируемый процесс, причем целостными свойствами обладает не только каждая по отдельности стадия развития данного органа, но и весь путь развития.
Для объяснения всех этих явлений на вооружение взята физико-математическая теория самоорганизации неравновесных природных систем, как биологических, так и небиологических. Термин «самоорганизующаяся система» ввел в 1947 г. английский кибернетик У.Р. Эшби.
Однако сегодня еще рано говорить о появлении единой теории самоорганизации. Можно лишь констатировать существование различных концепций самоорганизации. В частности, можно указать на работы известного биолога К. Уоддингтона о морфогенезе как системе креодов. В процессе эмбриогенеза осуществление записанной в генах программы развития происходит в конкретных условиях среды. Взаимодействие генов и среды описывается на следующей модели (рис. 8.62). Эмбриональное развитие сравнивается с шариком, катящимся по наклонной поверхности с разными желобками, названной эпигенетическим ландшафтом (пространство возможностей). Структурно-устойчивые пути развития структур (желобки) обозначаются как креоды. Самый глубокий желобок, соответствующий наиболее вероятному пути, определяет нормальное развитие организма. У этого основного желобка есть много разветвлений, менее глубоких, соответствующих отклонениям в развитии, по ним шарик покатится с меньшей долей вероятности. Мутации меняют
Рис. 8.62. Эпигенетический ландшафт Уоддингтона
соотношение вероятностей разных путей (на рисунке - меняется глубина желобков), и увеличивают вероятность развития по «неправильному» пути. Однако в части случаев воздействие среды может скомпенсировать дефект и вернуть организм на нормальный путь развития. Используется широкое понимание термина «среда»: среда внутриклеточная (овоплаз-матическая сегрегация), внутриорганизменная (межклеточные и межзачатковые взаимодействия, гормональный фон и т.д.), внеорганизменная среда (в том числе воздействие лекарственных средств).
Близкие идеи лежат в основе концепции диссипативных структур. Диссипативными (от лат. dissipatio - рассеяние) называют энергетически открытые, термодинамически неравновесные биологические и небиологические системы, в которых часть энергии, поступающей в них извне, рассеивается. В настоящее время показано, что в сильно неравновесных условиях, т.е. при достаточно сильных потоках вещества и энергии, системы могут самопроизвольно и устойчиво развиваться, дифференцироваться. В таких условиях возможны и обязательны нарушения однозначных причинно-следственных связей и проявления эмбриональной регуляции и других явлений. Примерами диссипативных небиологических систем являются химическая реакция Белоусова-Жаботинского, а также математическая модель абстрактного физико-химического процесса, предложенная английским математиком А. Тьюрингом. В общих чертах применительно к морфогенезу идея такова (рис. 8.63). В некоторых самоорганизующихся системах существует первоначально
Рис. 8.63. Реакционно-диффузная модель морфогенеза: а - взаимодействие веществ в системе; б - последовательные стадии образования пиков в процессе морфогенеза; в - трехмерная модель области, где осуществляется формообразование; г - примеры окраски животных, морфогенез которых удалось смоделировать
однородное распределение молекул веществ. В простейшем случае их два: активатор и ингибитор, которые взаимодействуют друг с другом. В таких системах распределение веществ может спонтанно становиться волновым - появляются области с высокой (пик) и низкой концентрацией. Такая система названа реакционно-диффузной. При увеличении размеров системы число таких областей (пиков) возрастает. В случае нелинейных взаимодействий образуются сложные пространственно-временные режимы типа диссипативных структур - стационарных во времени и неоднородных по пространству распределений концентраций веществ, поддержание которых происходит за счет диссипации энергии системы.
С использованием этой модели была осуществлена динамическая компьютерная имитация формирования окраски у различных животных, например зебры, гепарда и др. Установлено, что запуск и остановка морфогенеза окраски происходит под управлением генетического аппарата, а формирование всего богатства окраски - результат образования различных диссипативных структур в ходе развития автоволновых процессов.
Несмотря на огромный интерес к процессу морфогенеза, многие проблемы формообразования остаются нерешенными. Теория морфогенеза до сих пор отсутствует, и его движущие силы остаются нераскрытыми. Все перечисленные концепции целостности развития носят пока фрагментарный характер, освещая то одну, то другую сторону процесса. Очевидно, что в ходе дальнейших научных исследований будут даны ответы на многие актуальные вопросы морфогенеза.
8.3.4. РОСТ
Рост - это увеличение общей массы и размеров организма в процессе развития. Он происходит на клеточном, тканевом, органном и ор-ганизменном уровнях. Увеличение массы в целом организме отражает рост составляющих его структур.
Различают два типа роста: ограниченный и неограниченный. Неограниченный рост продолжается на протяжении всего онтогенеза, вплоть до смерти. Таким ростом обладают, в частности, рыбы. Многие другие позвоночные характеризуются ограниченным ростом, т.е. достаточно быстро выходят на плато своей биомассы. Обобщенная кривая зависимости роста организма от времени при ограниченном росте имеет s-образную форму (рис. 8.64).
До начала развития организм имеет некоторые исходные размеры, которые в течение короткого времени практически не изменяются.
Рис. 8.64. Обобщенная кривая зависимости роста организма от времени
Затем начинается медленное, а потом и быстрое возрастание массы. Некоторое время скорость роста может оставаться относительно постоянной и наклон кривой не меняется. Но вскоре происходит замедление роста, а потом увеличение размеров организма прекращается. После достижения этой стадии устанавливается равновесие между расходованием материала и синтезом новых материалов, обеспечивающих увеличение массы.
Рост обеспечивается следующими механизмами:
• увеличением числа клеток;
• увеличением размера клеток;
• увеличением объема и массы неклеточного вещества (рис. 8.65).
В первом случае говорят о пролиферативном росте. Рост большинства тканей у животных происходит путем митотических делений клеток, например рост кожи. В органах, состоящих из функциональных единиц, таких как печень, почки, легкие, также наблюдается пролифе-ративный рост. Количество нефронов в почке и альвеол в легком закладывается в раннем детстве (рис. 8.66). Рост этих органов происходит за счет добавления клеток к уже существующим структурам. В ткани печени возможно не только размножение клеток, но и формирование новых структур, например долек печени. Скорость роста определяется соотношением между пролиферацией клеток и их гибелью.
Пролиферативный рост известен в двух формах: мультипликативный и аккреционный.
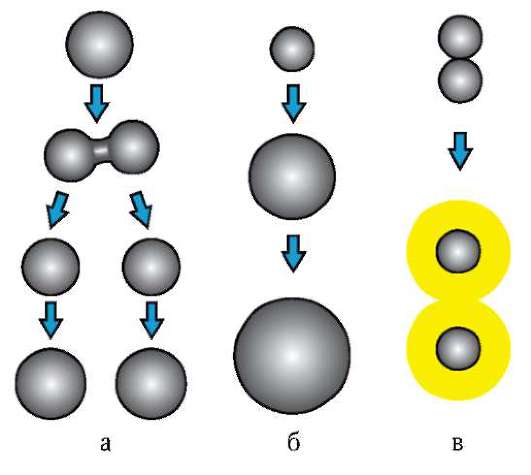
Рис. 8.65. Механизмы роста: а - пролиферативный; б - ауксентичный; в - за счет прироста межклеточного вещества

Рис. 8.66. Время, в течение которого к растущим структурам тела человека могут добавляться функциональные единицы
Мультипликативный пролиферативный рост характеризуется тем, что обе клетки, возникшие от деления родоначальной, снова вступают в деление (рис. 8.67, А). Число клеток (N) растет в геометрической прогрессии: если n - номер деления, то Nn = 2n. Мультипликативный рост очень эффективен и поэтому в чистом виде почти не встречается или очень быстро заканчивается. У большинства организмов он происходит в эмбриональном и раннем постэмбриональном периоде.
Аккреционный пролиферативный рост заключается в том, что после каждого последующего деления лишь одна из клеток снова делится, тогда как другая прекращает деление (заштрихована, рис. 8.67, Б). При этом число клеток растет линейно: если n - номер деления, то Nn = 2n. Этот тип роста связан с разделением органа на камбиальную и дифференцированную зоны. Клетки переходят из первой зоны во вторую, сохраняя постоянные соотношения между размерами зон. Такой рост характерен для тканей, где происходит обновление клеточного состава. Например, клетки эпителия кишечника, дыхательных путей - одна дочерняя клетка делится, а другая дифференцируется и после выполнения функций погибает.
Второй механизм роста характеризуется увеличением размеров клеток без изменения их количества - ауксентичный рост. К увеличению размера клетки может приводить возрастание объема цитоплазмы, ко-
Рис. 8.67. Формы пролиферативного роста: а - мультипликативный; б - аккреционный (пояснения в тексте)
личества органоидов, полиплоидизация. Такой рост характерен для коловраток, личинок насекомых, некоторых круглых червей, у которых число клеток тела фиксировано. В организме человека этот вариант роста встречается, например, у неделящихся дифференцированных нервных и мышечных клеток. Увеличение размеров мышечных волокон, количества содержащихся в них ядер происходит при слиянии волокон с сателлитными клетками. Рост нейронов происходит за счет увеличения размеров и ветвления отростков.
В некоторых органах наблюдается рост с участием обоих обсуждаемых механизмов. Так, в развитии хрусталика сначала осуществляется деление клеток пролиферативных зон, а затем, в ходе дифференциров-ки, увеличение размеров клеток.
В третьем случае рост базируется на увеличении количества межклеточного вещества. Так происходит в кости и хряще, где основная масса ткани приходится на экстрацеллюлярную часть. В межклеточном веществе при данном механизме роста могут происходить процессы минерализации, накапливаться метаболиты, увеличиваться содержание воды.
Пространственная организация роста сложна и закономерна. Она обеспечивает нормальное функционирование организма на протяжении всего онтогенеза. Клетки развивающейся особи должны получать питательные вещества, метаболизировать их и выделять конечные продукты обмена. Необходимость реализации этих процессов накладывает строгие ограничения на характер роста животного. Одно из основных ограничений - соотношение поверхности к объему. Если особь становится крупнее, но сохраняет свою старую форму, то площадь ее поверхности, имеющая большое значение для поглощения кислорода и питательных веществ, уменьшается по отношению к ее новому объему. Метаболические потребности растущего организма при этом возрастают.
Другое препятствие, связанное с увеличением размеров тела, - отношение между массой тела и размерами опорных и двигательных органов. Скорость роста последних в толщину должна быть очень высокой, т.к. в противном случае растущий организм будет раздавлен собственной тяжестью.
Пространственная организация роста может реализовываться в нескольких вариантах. Изометрический рост происходит путем включения нового материала в существующие ткани тела. Организм увеличивает свой объем, сохраняя пропорции неизменными. Такой вариант встречается, например, у членистоногих.
Логарифмическая спираль. Подобный тип роста характерен для животных, способных расти только с одного конца. Примером может служить развитие организма в раковине. В простейшем случае такой рост представляет собой расширение и удлинение этого животного в одном и том же отношении в течение всей жизни.
Третий вариант - аллометрический (дифференциальный) рост. Это означает, что скорость роста неодинакова, во-первых, в различных участках организма и, во-вторых, на разных стадиях развития. Очевидно, что дифференциальный рост оказывает огромное влияние на морфогенез. Благодаря нему достигается видоспецифичность размеров и строения организмов. Наглядный пример такого рода представлен на рис. 8.68. Самец манящего краба Uca pugnax первоначально на первой паре ног имеет клешни, каждая из которых составляет 8% от общей массы тела. По мере роста краба одна клешня увеличивается гораздо быстрее другой, и у взрослого самца достигает 38% его массы. Она служит ему для защиты и угрозы. У самок этого вида масса клешни по-прежнему составляет примерно 8% от массы тела.

Рис. 8.68. Аллометрический рост клешни манящего краба
Для человека также характерен аллометрический рост (см. рис. 8.4). Скорость общего роста человеческого организма меняется в зависимости от стадии развития (рис. 8.69). Максимальная скорость характерна для первых четырех месяцев внутриутробного развития. Это объясняется тем, что клетки в это время продолжают делиться. По мере роста плода число митозов во всех тканях уменьшается, и принято считать, что после шести месяцев внутриутробного развития почти не происходит образования новых мышечных и нервных клеток, если не считать клеток нейроглии. Скорость роста организма в постнатальном онтогенезе постепенно снижается к четырехлетнему возрасту, затем некоторое время остается постоянной, а в возрасте 10-13 лет опять делает скачок, называемый пубертатным скачком роста. Это связано с периодом полового созревания.
Рис. 8.69. Изменения скорости роста в зависимости от стадии развития человеческого организма: а - у плода и в первые два года после рождения; б - в начале постнатального периода
Различие в скорости роста органов и тканей показано на рис. 8.70. Кривые роста большинства скелетных и мышечных органов повторяют ход кривой общего роста. То же касается изменения размеров и отдельных органов: печени, селезенки, почек. Однако для целого ряда тканей и органов эти показатели существенно отличаются.
Интересна зависимость способности к росту от возрастной стадии организма. Ткани, взятые на разных стадиях развития и культивируе-
Рис. 8.70. Кривые роста отдельных органов и тканей: I - рост лимфатической ткани миндалин, червеобразного отростка, кишечника и селезенки; II - рост мозга, а также черепа, глаз и ушей; III - общая кривая роста тела и большей части других органов; IV - рост наружных и внутренних органов размножения
мые в питательной среде, характеризуются различной скоростью роста. Чем старше зародыш, тем медленнее растут его ткани в культуре. Ткани, взятые от взрослого организма, растут очень медленно.
Рост - одна из составляющих онтогенеза. Он тесно связан с процессами детерминации, дифференциации и морфогенеза. Важнейшая характеристика роста, как было сказано выше, - его дифференциальность. Другой не менее важной особенностью является такое свойство роста, как эквифинальность. Это означает, что, несмотря на воздействующие факторы, особь стремится достичь типичного видового размера. Как дифференциальность, так и эквифинальность роста указывают на проявление целостности развивающегося организма. В процессе роста реализуются клеточные и системные механизмы развития.
В процессе развития первоначально происходит детерминация и пространственная разметка структуры, а затем ее рост. Так, у куриного зародыша разметка зачатка конечности осуществляется, когда его размер составляет всего несколько миллиметров в длину. Сначала все элементы: плечо, локтевая кость и запястье одинаковы по размеру. Затем происходит их дифференциальный рост. Программы роста уже определены, когда реализуется пространственная разметка конечности, что подтверждается экспериментами по пересадке зачатка в нейтральное место зародыша. После пересадки каждый элемент скелета следует собственной программе развития.
На рост как процесс онтогенетического развития регулирующее действие оказывают гуморальные и генетические факторы. Так, в мышцах миобласты продуцируют белок миостатин, оказывающий тормозящее влияние на рост. Мутация гена, кодирующего данный белок, приводит к значительному увеличению мышечной массы. Генетически запрограммирован размер организма и его отдельных структур. Результат доказывающего это опыта представлен на рис. 8.71. Пересадка почки конечности от саламандры более крупного вида Ambystoma tigrinum к
Рис. 8.71. Генетическая детерминированность размера структуры. Опыт по пересадке (пояснения в тексте)
более мелкому Ambystoma punctatum приводит к формированию у последнего конечности увеличенного размера. Еще одним подтверждением генетического контроля роста служит факт, что почти у каждого вида организмов есть генетические линии, характеризующиеся предельными размерами особей, такими как карликовые или, наоборот, гигантские формы.
Реализация генетической информации в значительной мере обусловлена гуморальными воздействиями, а именно действием разнообразных ростовых факторов и гормонов. Из гормонов наиболее важен сомато-тропин, выделяемый гипофизом с момента рождения до подросткового периода. Гормон щитовидной железы тироксин играет очень большую роль на протяжении всего периода роста. С подросткового возраста рост контролируют стероидные гормоны надпочечников и гонад.
Пигмеи, живущие в Заире, имеют нормальный уровень гормона роста и инсулиноподобного фактора роста I до момента полового созревания, после чего уровень фактора роста у них резко снижается и становится ниже почти на треть по сравнению с нормальным уровнем, характерным для подростков.
Несомненное влияние на рост оказывают факторы среды. Наибольшее значение среди них имеют питание (рис. 8.72) , время года, физическая нагрузка и психологические воздействия.
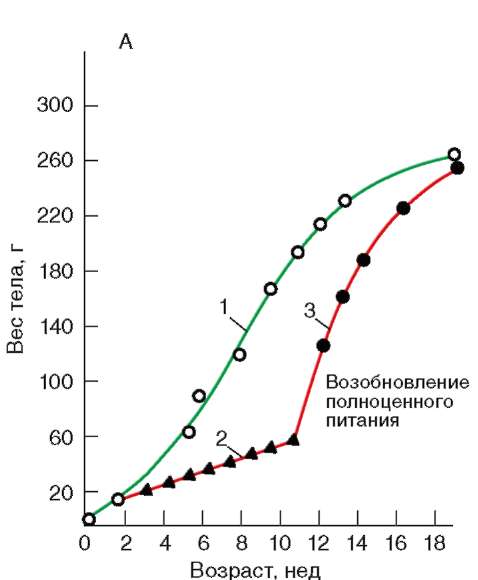
Рис. 8.72. Графики роста лабораторных крыс: 1 - S-образная кривая при нормальных условиях питания; 2 - в условиях голодания; 3 - компенсаторный рост после прекращения голодания
8.4. регенерация
Регенерация (от лат. regeneratio - возрождение) - процесс восстановления биологических структур в ходе жизнедеятельности организма. Регенерация поддерживает строение и функции организма, его целостность.
Регенерационные процессы реализуются на разных уровнях организации - молекулярно-генетическом, субклеточном, клеточном, тканевом, органном, организменном.
На молекулярно-генетическом уровне осуществляется репликация ДНК, ее репарация, синтез новых ферментов, молекул АТФ и т.д. Все эти процессы входят в обмен веществ клетки.
На субклеточном уровне происходит восстановление структур клетки за счет образования новых структурных единиц и сборки органелл или деления сохранившихся органелл. Например, подвижные образования клеточной мембраны - рецепторы, ионные каналы и насосы - могут перемещаться, концентрироваться или распределяться в составе мембраны. Помимо этого они выходят из мембраны, разрушаются и заменяются новыми. Так, в миобластах каждую минуту деградирует и заменяется новыми молекулами примерно 1 мкм2 поверхности. В фоторецептор-ных клетках - палочках (рис. 8.73) есть наружный сегмент, состоящий примерно из тысячи так называемых фоторецепторных дисков - плотно уложенных участков клеточной мембраны, в которые погружены светочувствительные белки, связанные со зрительным пигментом. Эти диски непрерывно обновляются - деградируют на наружном конце и вновь возникают на внутреннем со скоростью 3-4 диска в час. Аналогично осуществляются процессы восстановления после повреждений. Воздействие митохондриальных ядов вызывает утрату крист митохондрий. После прекращения действия яда в печеночной клетке митохондрии восстанавливают свою структуру за 2-3 сут.
Клеточный уровень регенерации подразумевает восстановление структуры и, в некоторых случаях, функций клетки. К примерам такого рода относится восстановление отростка нервной клетки нейрона. У млекопитающих этот процесс идет со скоростью 1 мм в сутки. Восстановление функций клетки может осуществляться за счет гиперплазии - увеличения количества внутриклеточных органелл (внутриклеточная регенерация).
На следующем уровне - тканевом или клеточно-популяционном - происходит восполнение теряемых клеток определенного направления дифференцировки. Происходят перестройки в пределах клеточных по-
пуляций, и их результатом становится восстановление функций ткани. Так, у человека время жизни клеток кишечного эпителия - 4-5 сут, тромбоцитов - 5-7 сут, эритроцитов - 120-125 сут. Ежесекундно разрушается порядка 1 млн эритроцитов и столько же образуется в красном костном мозге вновь. Возможность восстановления утраченных клеток обеспечивается благодаря тому, что в тканях существует два клеточных компартмента. Один - дифференцированные рабочие клетки, а другой - камбиальные клетки, способные к делению и последующей дифференцировке. Эти последние в настоящее время называют региональными стволовыми клетками (см. пп. 3.1.2, 3.2). Они коммити-рованы, т.е. судьба их предопределена (см. п. 8.3.1), поэтому они способны дать начало одному или нескольким определенным клеточным типам. Их дальнейшая дифференцировка определяется сигналами, поступающими извне: от окружения (межклеточными взаимодействиями) и дистантными (например, гормонами), в зависимости от которых в клетках избирательно активируются конкретные гены. Так, в эпителии тонкой кишки камбиальные клетки находятся в придонных зонах крипт (рис. 8.74). При определенных воздействиях они способны дать начало клеткам «каемчатого» всасывающего эпителия и некоторым одноклеточным железам.
Органный уровень регенерации предполагает восстановление функции или структуры органа. На этом уровне наблюдаются не только преобразования клеточных популяций, но также и морфогенетические процессы. При этом реализуются те же механизмы, что и при формировании органов в эмбриогенезе. Та-
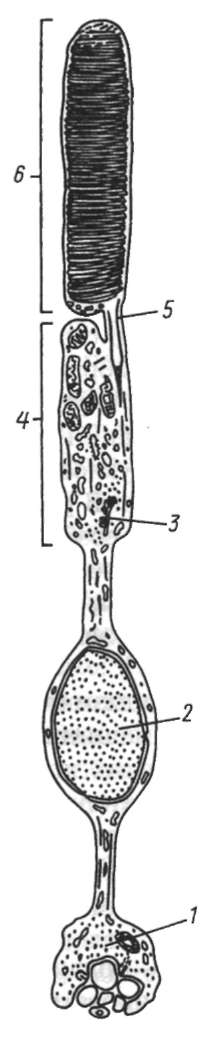
Рис. 8.73. Схематическое изображение фоторецептора сетчатки - палочки: 1 - синаптическое тельце, примыкающее к нейральному слою сетчатки, 2 - ядро, 3 - аппарат Гольджи, 4 - внутренний сегмент с митохондриями, 5 - соединительная ресничка, 6 - наружный сегмент с фото-рецепторными дисками
кая регенерация может осуществляться путем эпиморфоза, морфолаксиса, регенерационной гипертрофии. Эти
способы и механизмы регенерации обсуждаются далее.
На организменном уровне возможно в отдельных случаях воссоздание целостного организма из одной или группы клеток.
Различают два вида регенерации: физиологическую и репаративную.
Физиологическая (гомеостати-ческая) регенерация представляет собой процесс восстановления структур, которые снашиваются в процессе нормальной жизнедеятельности. Благодаря ей поддерживается структурный гомеостаз и обеспечивается возможность постоянного выполнения органами их функций.
С общебиологической точки зрения физиологическая регенерация, как и обмен веществ, является проявлением такого важнейшего свойства жизни, как самообновление.
Самообновление обеспечивает существование организма во времени и пространстве. В его основе лежит биогенная миграция атомов.
На внутриклеточном уровне значение физиологической регенерации особенно велико для так называемых «вечных» тканей, утративших способность к регенерации путем деления клеток. В первую очередь это относится к нервной ткани, сетчатке глаза.
На клеточном и тканевом уровнях осуществляется физиологическая регенерация в «лабильных» тканях, где
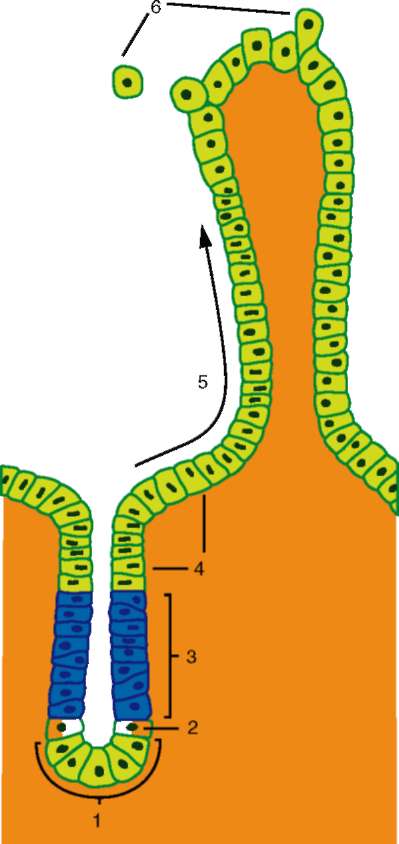
Рис. 8.74. Локализация региональных стволовых клеток в эпителии тонкой кишки: 1 - неде-лящиеся клетки; 2 - делящиеся стволовые клетки; 3 - быстро делящиеся клетки; 4 - неделящиеся дифференцированные клетки; 5 - направление перемещения клеток; 6 - клетки, слущенные с поверхности кишечной ворсины
интенсивность клеточного обновления очень велика, и в «растущих» тканях, клетки которых обновляются значительно медленнее. К первой группе относятся, например, роговица глаза, эпителий слизистой оболочки кишечника, клетки периферической крови, эпидермис кожи и его производные - волосы и ногти. Клетки таких органов, как печень, почка, надпочечник составляют вторую из указанных групп.
Об интенсивности пролиферации судят по числу митозов, приходящихся на 1000 подсчитанных клеток. Если учесть, что сам митоз в среднем длится около 1 ч, а весь митотический цикл в соматических клетках в среднем протекает 22-24 ч, становится ясно, что для определения интенсивности обновления клеточного состава тканей необходимо подсчитать число митозов в течение одних или нескольких суток. Оказалось, что число делящихся клеток не одинаково в разные часы суток. Так был открыт суточный ритм клеточных делений, пример которого изображен на рис. 8.75.
Суточный ритм числа митозов обнаружен не только в нормальных, но и в опухолевых тканях. Он отражает более общую закономерность,
Рис. 8.75. Суточные изменения митотиче-ского индекса (МИ) в эпителии пищевода (1) и роговицы (2) мышей. Митотический индекс выражен в промилле (0/00), отражающем число митозов в тысяче подсчитанных клеток
а именно, ритмичность всех функций организма. Одна из современных областей биологии - хронобиология - изучает, в частности, механизмы регуляции суточных ритмов митотической активности, что имеет весьма большое значение для медицины. Существование самой суточной периодичности числа митозов указывает на регулируемость физиологической регенерации организмом. Кроме суточных, существуют лунные и годичные циклы обновления тканей и органов.
Физиологическая регенерация присуща организмам всех видов, но особенно интенсивно она протекает у теплокровных позвоночных, так как у них вообще очень высока интенсивность функционирования всех органов по сравнению с другими животными.
Репаративная регенерация (от лат. reparatio - восстановление) - восстановление биологических структур после травм и действия других повреждающих факторов. К таким факторам могут быть отнесены ядовитые вещества, болезнетворные агенты, высокие и низкие температуры (ожоги и обморожения), лучевые воздействия, голодание и т.д.
Способность к регенерации не имеет однозначной зависимости от уровня организации, хотя давно уже было замечено, что более низко организованные животные обладают лучшей способностью к регенерации наружных органов. Это подтверждается удивительными примерами регенерации гидры, планарий, кольчатых червей, членистоногих, иглокожих, низших хордовых, например асцидий. Из позвоночных наилучшей регенерационной способностью обладают хвостатые земноводные. Известно, что разные виды одного и того же класса могут сильно отличаться по способности к регенерации. Кроме того, при изучении способности к регенерации внутренних органов оказалось, что она значительно выше у теплокровных животных, например у млекопитающих, по сравнению с земноводными.
Регенерация у млекопитающих отличается своеобразием. Для регенерации некоторых наружных органов нужны особые условия. Язык, ухо, например, не регенерируют при краевом повреждении (фактически речь идет об ампутации краевой части структуры). Если же нанести сквозной дефект через всю толщу органа, восстановление идет хорошо. Регенерация внутренних органов может идти очень активно. Из небольшого фрагмента яичника восстанавливается целый орган. Есть предположение, что невозможность регенерации конечностей и других наружных органов у млекопитающих носит приспособительный характер и обусловлена отбором, поскольку при активном образе жизни требующие сложной регуляции морфогенетические процессы затрудняли
бы существование. Ряд исследователей полагает, что организмы первоначально имели два способа исцеления от ран - действие иммунной системы и регенерацию. Но в ходе эволюции они стали несовместимы друг с другом. Хотя регенерация может показаться лучшим выбором, для нас более важны Т-клетки иммунной системы - основное оружие против опухолей. Регенерация конечности становится бессмысленной, если одновременно в организме бурно развиваются раковые клетки. Получается, что иммунная система, защищая нас от инфекций и рака, одновременно подавляет наши способности к восстановлению.
Объем репаративной регенерации может быть очень разным.
Крайний вариант - восстановление целого организма из отдельной малой его части, фактически из группы соматических клеток. Среди животных такое восстановление возможно у губок и кишечнополостных. Регенерацию гидры можно осуществить из группы клеток, полученных при продавливании ее через сито. Среди растений возможно развитие целого нового растения даже из одной соматической клетки, как это получено на примере моркови и табака. Такой вид восстановительных процессов сопровождается возникновением новой морфогенетической оси организма и назван Б.П. Токиным «соматическим эмбриогенезом», так как во многом напоминает эмбриональное развитие. В качестве подобного варианта регенерации может рассматриваться клонирование в эксперименте целого организма из одной соматической клетки у млекопитающих.
Следующий по объему вариант - восстановление больших участков организма, состоящих из комплекса органов. Примером служит регенерация у гидры, ресничного червя (планарии), морской звезды (рис. 8.76). При удалении части животного из оставшегося фрагмента, даже очень небольшого, возможно восстановление полноценного организма. Например, восстановление морской звезды из сохранившегося луча.
Далее в этом ряду следует регенерация отдельных органов, которая широко распространена в животном царстве, например, хвоста у ящерицы, глаз у членистоногих, глаза, конечности, хвоста у тритона.
Заживление кожных покровов, ран, повреждений костей и других внутренних органов - наименее объемный процесс, но не менее важный для восстановления структурно-функциональной целостности организма.
Существует несколько способов репаративной регенерации. К ним относят эпиморфоз, морфаллаксис, регенерационную гипертрофию, компенсаторную гипертрофию, заживление эпителиальных ран, тканевую регенерацию.
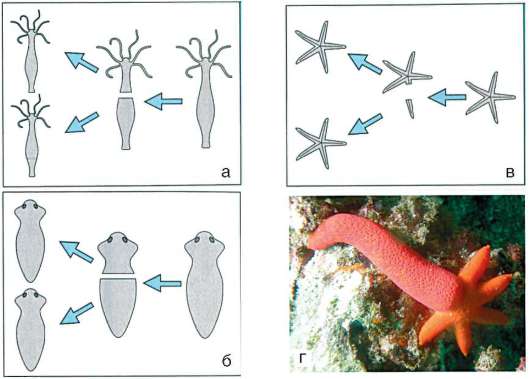
Рис. 8.76. Регенерация комплекса органов у некоторых видов беспозвоночных животных: а - гидра; б - плоский червь; в - морская звезда; г - восстановление морской звезды из луча
Эпиморфоз представляет собой наиболее очевидный способ регенерации, заключающийся в отрастании нового органа от ампутационной поверхности. Иллюстрацией может служить регенерация хрусталика или конечности у хвостатых амфибий (рис. 8.77). Рассмотрим более детально процесс регенерации на примере эпиморфоза конечности тритона. В процессе восстановления выделяют регрессивную и прогрессивную фазы регенерации. Регрессивная фаза начинается с заживления раны, во время которого происходят следующие основные события: остановка
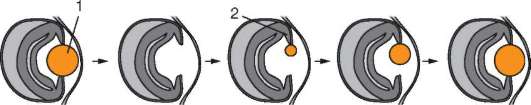
Рис. 8.77. Регенерация хрусталика (1) из дорзальной радужки (2) у тритона
кровотечения, сокращение мягких тканей культи конечности, образование над раневой поверхностью сгустка фибрина и миграция эпидермиса, покрывающего ампутационную поверхность.
Затем начинается разрушение тканей непосредственно проксималь-нее места ампутации. Одновременно в разрушенные мягкие ткани проникают клетки, участвующие в воспалительном процессе, наблюдается фагоцитоз и местный отек. Вслед за этим в области под раневым эпидермисом начинается дедифференцировка специализированных клеток: мышечных, костных, хрящевых и т.д. Клетки приобретают черты мезенхимных, образуют скопление и формируют регенерационную бластему (рис. 8.78). В это же время раневой эпидермис быстро утолщается и образует апикальную эктодермальную шапочку. На этом этапе в регенерационную бластему и эктодермальную шапочку врастают сосуды и нервные волокна.
Далее начинается прогрессивная фаза, для которой наиболее характерны процессы роста и морфогенеза. Длина и масса регенерационной бластемы быстро увеличиваются. Она приобретает коническую форму. Мезенхимные клетки бластемы дедифференцируются, давая начало всем специализированным клеточным типам, которые необходимы для формирования структур конечности. Осуществляется рост конечности и ее морфогенез (формообразование). Когда форма конечности в общих чертах уже сложилась, регенерат все еще меньше нормальной конечности. Чем крупнее животное, тем больше эта разница в размерах. Для завершения морфогенеза требуется время, по истечении которого регенерат достигает размеров нормальной конечности.
Некоторые стадии восстановления передней конечности у тритона после ампутации на уровне плеча показаны на рис. 8.79.
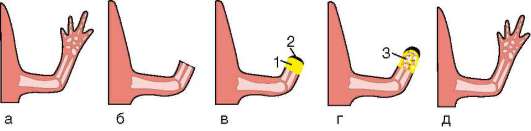
Рис. 8.78. Регенерация конечности у тритона: а - нормальная конечность, б - ампутация; в - формирование апикальной шапочки и бластемы; г - редиф-ференцировка клеток; д - вновь сформированная конечность. 1 - бластема; 2 - апикальная эктодермальная шапочка; 3 - редифференцировка клеток бластемы (пояснения в тексте)
У молодых личинок аксолотлей конечность может регенерировать за 3 нед, у взрослых тритонов и аксолотлей - за 1-2 мес, а у наземных амбистом для этого требуется около 1 года.
Морфаллаксис - регенерация путем перестройки регенерирующего участка. Примером служит регенерация гидры из кольца, вырезанного из середины ее тела, или восстановление планарии из одной десятой или двадцатой ее части. На раневой поверхности в этом случае не происходит значительных формообразовательных процессов. Отрезанный кусочек сжимается, клетки внутри него перестраиваются, и возникает целая особь уменьшенных размеров, которая затем растет. Этот способ регенерации впервые описал Т. Морган в 1900 г. В соответствии с его описанием, морфаллаксис осуществляется без митозов. Нередко имеет место сочетание эпиморфного роста на
месте ампутации с реорганизацией путем морфаллаксиса в прилежащих частях тела.
Регенерационная гипертрофия (эндоморфоз) относится к внутренним органам. Этот способ регенерации заключается в увеличении размеров остатка органа без восстановления исходной формы. Иллюстрацией служит регенерация печени позвоночных, в том числе млекопитающих. При краевом ранении печени удаленная часть органа никогда не восстанавливается. Раневая поверхность заживает. В то же время вну-
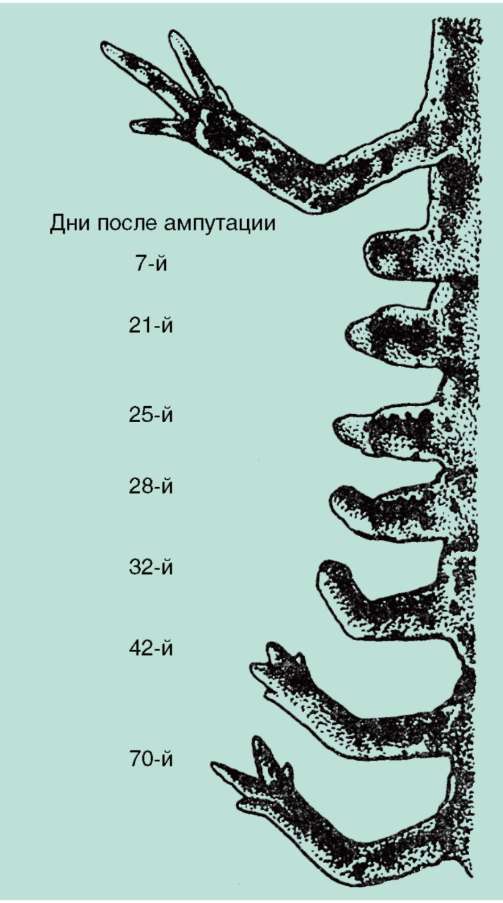
Рис. 8.79. Регенерация передней конечности у тритона в эксперименте
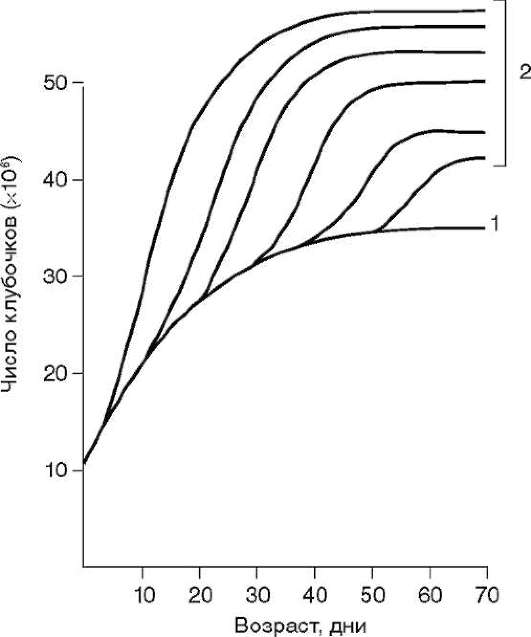
Рис. 8.80. Влияние возраста на увеличение числа клубочков нефронов после удаления одной почки у крыс вскоре после рождения: 1 - кривая прироста числа клубочков в нормальном постнатальном развитии в одной почке; 2 - кривые увеличения числа вновь образуемых клубочков после удаления почки на разных сроках онтогенеза
три оставшейся части усиливается размножение клеток (гиперплазия) и даже после удаления 2/3 печени восстанавливаются исходные масса и объем, но не форма. Внутренняя структура печени оказывается нормальной, дольки имеют типичную для них величину. Функция печени также возвращается к норме.
Компенсаторная (викарная) гипертрофия заключается в изменениях в одном из органов при нарушении в другом, относящемся к той же системе органов. Пример - гипертрофия в одной из почек при удалении другой или увеличение лимфатических узлов при удалении селезенки. Изменения способности к такого типа регенерации в зависимости от возраста показаны на рис. 8.80.
Последние два способа отличаются местом регенерации, но механизмы их одинаковы: гиперплазия и гипертрофия (рис. 8.81)1.
1 Гипертрофия (греч. hyper- + trophe - пища, питание) - увеличение объема и массы органа тела или отдельной его части. Гиперплазия (греч. hyper- + plasis - образование, формирование) - увеличение числа структурных элементов тканей путем их избыточного новообразования. Это не только размножение клеток, но и увеличение цитоплазма-тических ультраструктур (изменяются в первую очередь митохондрии, миофиламенты, эндоплазматический ретикулум, рибосомы).
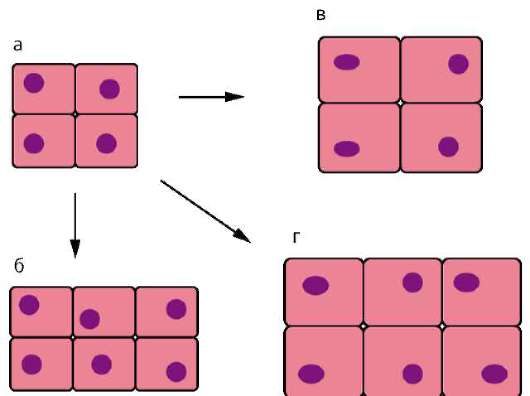
Рис. 8.81. Схема, иллюстрирующая механизмы гипертрофии и гиперплазии: а - норма; б - гиперплазия; в - гипертрофия; г - комбинированное изменение
Эпителизация при заживлении ран с нарушенным эпителиальным покровом идет примерно одинаково, независимо от того, будет далее происходить регенерация органа путем эпиморфоза или нет. Эпидер-мальное заживление раны у млекопитающих в том случае, когда раневая поверхность высыхает с образованием корки, проходит следующим образом (рис. 8.82). Эпителий на краю раны утолщается вследствие увеличения объема клеток и расширения межклеточных пространств. Сгусток фибрина играет роль субстрата для миграции эпидермиса в глубь раны. В мигрирующих эпителиальных клетках нет митозов, одна-
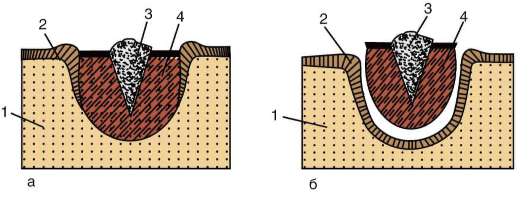
Рис. 8.82. Схема некоторых событий, происходящих при эпителизации кожной раны у млекопитающих: а - начало врастания эпидермиса под некротическую ткань, б - срастание эпидермиса и отделение струпа; 1 - соединительная ткань; 2 - эпидермис; 3 - струп; 4 - некротическая ткань
ко они обладают фагоцитарной активностью. Клетки с противоположных краев вступают в контакт. Затем наступает кератинизация раневого эпидермиса и отделение корки, покрывающей рану. К моменту встречи эпидермиса противоположных краев в клетках, расположенных непосредственно вокруг края раны, наблюдается вспышка митозов, которая затем постепенно угасает.
Восстановление отдельных мезодермальных тканей, таких как мышечная и скелетная, называют тканевой регенерацией. Для регенерации мышцы важно сохранение хотя бы небольших ее культей на обоих концах, а для регенерации кости необходима надкостница.
Таким образом, существует множество различных способов или типов морфогенетических явлений при восстановлении утраченных и поврежденных частей организма. Различия между ними не всегда очевидны, и требуется более глубокое понимание этих процессов.
При регенерации не всегда образуется точная копия удаленной структуры. В случае типичной регенерации восстанавливается утраченная часть правильной структуры (гомоморфоз), чего не происходит при атипичной регенерации. Примером последней является появление иной структуры на месте утраченной - гетероморфоз. Она может проявляться в виде гомеозисной регенерации, заключающейся в появлении антенны или конечности на месте глаза у членистоногих. Еще один вариант - гипоморфоз, регенерация с частичным замещением ампутированной структуры. Например, у ящерицы возникает шиловидная структура вместо конечности (рис. 8.83).
К атипичной регенерации могут быть отнесены случаи изменения полярности структуры. Так, из короткого фрагмента планарии можно стабильно получать биполярную планарию. Встречается образование дополнительных структур, или избыточная регенерация. После надреза культи при ампутации головного отдела планарии возникает регенерация двух голов или более (рис. 8.84).
Изучение регенерации касается не только внешних проявлений. Существует целый ряд аспектов, носящих проблемный и теоретический характер. К ним относятся вопросы регуляции и условий, в которых протекают восстановительные процессы, вопросы происхождения клеток, участвующих в регенерации, способности к регенерации у различных групп животных и особенностей восстановительных процессов у млекопитающих.
Установлено, что при регенерации происходят такие процессы, как детерминация, дифференцировка и дифференциация, рост, морфоге-

Рис. 8.83. Примеры атипичной регенерации: а - нормальная голова рака; б - формирование антенны вместо глаза; в - образование шиловидной структуры вместо конечности у саламандры. 1 - глаз; 2 - антенна; 3 - место ампутации; 4 - нервный ганглий
Рис. 8.84. Примеры атипичной регенерации: а - биполярная планария; б - многоголовая планария, полученная после ампутации головы и нанесения насечек на культю
нез, сходные с процессами, имеющими место в эмбриональном развитии. Данные, полученные к настоящему времени, указывают на то, что восстановление утраченных структур, по сути дела, осуществляется на основе той же самой программы развития, которая руководит формированием их у эмбриона, и на основе клеточных и системных механизмов развития. Однако при регенерации все процессы развития идут уже вторично, т.е. в сформированном организме, поэтому восстановление структур имеет ряд отличий и специфичных черт.
Несомненно, что в ходе регенерации большое значение принадлежит системным механизмам - межклеточным и межзачатковым взаимодействиям, нервной и гуморальной регуляции. Так, при эпиморфозе конечности тритона сформированный в ходе эпителизации эпидермис стимулирует лизис подлежащих мезодермальных тканей. В его отсутствие или при образовании шрама регенерации не происходит. Клетки под сформированным эпидермисом дедифференцируются и формируют бластему. На этом этапе наблюдаются реципрокные индуктивные влияния между эпидермисом, который формирует апикальную эктодермальную шапочку, и мезодер-мальной бластемой. В ходе эмбрионального развития при формировании конечности осуществлялись сходные взаимодействия между мезодермаль-ной почкой конечности и апикальным эктодермальным гребнем.
В ходе дедифференцировки в клетках подавляется активность типо-специфических генов, определяющих специализацию клетки, например генов MRF и Mif5 в мышечных волокнах. Затем активируются гены, необходимые для пролиферации клеток. Один из них msx1. На этой стадии врастающие в бластему нервные отростки и эпидермис продуцируют трофические и ростовые факторы, необходимые для пролиферации и выживания клеток бластемы. Среди них фактор роста фибробластов FGF-10. Этот же фактор необходим для пролиферации самого эпидермиса. Бластема, в свою очередь, синтезирует в ответ нейротрофические факторы, стимулирующие врастание нервов. Нервы нужны для формирования апикальной эктодермальной шапочки. Помимо этого бластема, так же как и апикальная эпидермальная шапочка, продуцирует FGF-8, который стимулирует врастание капилляров.
Следует отметить наблюдаемые на этой стадии различия между регенерацией и эмбриональным развитием. Для реализации регенерации необходима иннервация. Без нее может проходить дедифференцировка клеток, но последующее развитие отсутствует. В период эмбрионального морфогенеза конечности (в ходе клеточных дифференцировок) нервы еще не сформированы.
Помимо иннервации на ранней стадии регенерации требуется действие ферментов металлопротеиназ. Они разрушают компоненты ма-трикса, что позволяет клеткам разделиться (диссоциировать) и активно пролиферировать. Контактирующие между собой клетки не могут продолжать регенерацию и отвечать на действие ростовых факторов. Таким образом, в ходе регенерации наблюдаются все варианты межклеточных взаимодействий: путем выделения паракринных факторов, диффундирующих от одной клетки к другой, взаимодействия через матрикс и при непосредственном контакте клеточных поверхностей.
В стадии дедифференцировки в клетках культи экспрессируются гомеозисные гены HoxD8 и HoxDlO, а с началом дифференцировки - гены HoxD9 и HoxD13. Как было показано в п. 8.3.4, эти же гены активно транскрибируются и в эмбриональном морфогенезе конечности.
Важно отметить, что в ходе регенерации утрачивается дифферен-цировка клеток, а их детерминация сохраняется. Уже на стадии недифференцированной бластемы закладываются основные черты регенерирующей конечности. При этом не требуется активация генов, обеспечивающих спецификацию конечности (Tbx-5 для передней и Tbx-4 для задней). Конечность формируется в зависимости от локализации бластемы. Ее развитие происходит так же, как и в эмбриогенезе: сначала проксимальные отделы, а затем дистальные.
Проксимально-дистальный градиент, от которого зависит, какие части растущего зачатка станут плечом, какие - предплечьем, а какие - кистью, задается градиентом белка Prod 1. Он локализован на поверхности клеток бластемы и его концентрация выше у основания конечности. Этот белок играет роль рецептора, а сигнальной молекулой (лигандом) для него является белок nAG. Он синтезируется шванновскими клетками, окружающими регенерирующий нерв. При отсутствии этого белка, который через лиганд-рецепторное взаимодействие запускает активацию необходимого для развития каскада генов, регенерации не происходит. Это объясняет феномен отсутствия восстановления конечности при перерезке нерва, а также и при врастании в бластему недостаточного количества нервных волокон. Интересно, что если нерв конечности тритона отвести под кожу основания конечности, то образуется дополнительная конечность. Если его отвести к основанию хвоста - стимулируется образование дополнительного хвоста. Отведение нерва на боковую область никаких дополнительных структур не вызывает. Все это привело к созданию концепции регене-рационных полей.
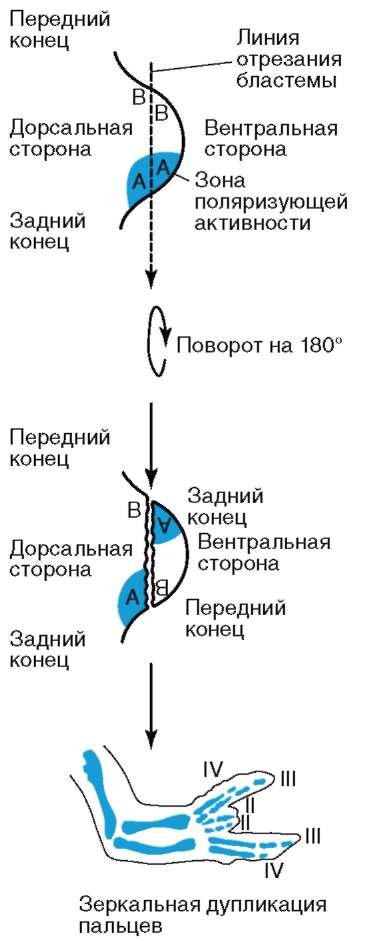
Рис. 8.85. Эксперимент с поворотом бластемы конечности (пояснения в тексте)
Аналогично процессу эмбриогенеза формируется и передне-задняя ось в поле развивающейся конечности. В формирующемся зачатке появляется зона поляризующей активности, определяющая асимметрию конечности. Повернув конец культи конечности на 180°, можно получить конечность с зеркальным удвоением пальцев (рис. 8.85).
Таким образом, справедливо утверждение, что формирование конечности происходит в поле органа, а бластема является саморегулирующейся системой. Наряду с вышесказанным, доказательством этому служат результаты, полученные в серии экспериментов по пересадке бластемы передней конечности на бластему середины бедра (рис. 8.86). При пересадке в регене-рационное поле другой конечности трансплантат располагается в соответствии с полученной позиционной информацией (градиенты веществ): бластема плеча смещается к середине бедра, предплечья - к голени, запястья - к лапке. Развитие трансплантированной бластемы в соответствующую часть передней конечности происходит в соответствии с ее детерминацией, которая определяется уровнем ампутации.
Помимо межклеточных и индукционных взаимодействий, которые оказываются менее разнообразными, чем в ходе эмбрионального морфогенеза, на регенерацию
значительное влияние оказывает нервная и гуморальная регуляция. Это вполне объяснимо тем, что регенерация осуществляется в уже сформированном организме, где основными регулирующими механизмами являются именно последние. Среди гуморальных влияний следует остановиться на действии гормонов. Альдостерон, гормоны щитовидной железы и гипофиза оказывают стимулирующее влияние на восстановление утраченных
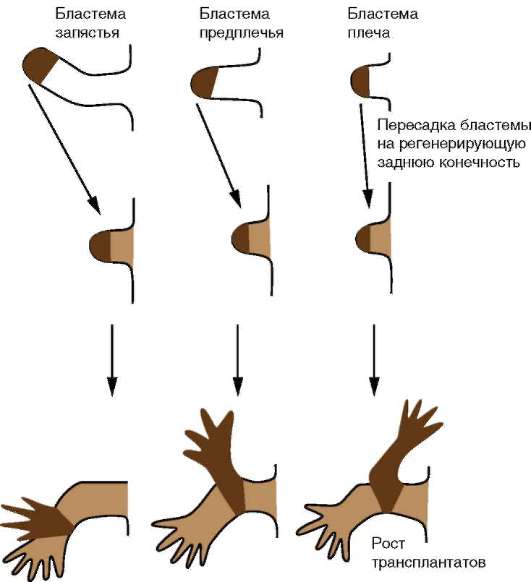
Рис. 8.86. Опыты по пересадке бластемы передней конечности в поле задней (пояснения в тексте)
структур. Сходное действие имеют и метаболиты, выделяемые поврежденной тканью и транспортируемые плазмой крови или передающиеся через межклеточную жидкость. Именно поэтому дополнительное повреждение в некоторых случаях ускоряет процесс регенерации.
Помимо перечисленного на регенерацию оказывают влияние и другие факторы, среди которых температура, при которой происходит восстановление, возраст животного, функционирование органа, стимулирующее регенерацию, и в определенных ситуациях изменение электрического заряда в регенерате.
Установлено, что в конечности амфибий после ампутации и в процессе регенерации происходят реальные изменения электрической ак-
тивности. При проведении электрического тока через ампутированную конечность у взрослых шпорцевых лягушек наблюдается усиление регенерации передних конечностей. В регенератах увеличивается количество нервной ткани, из чего делается вывод, что электрический ток стимулирует врастание нервов в края конечностей, в норме не регенерирующих.
Попытки стимулировать подобным образом восстановление конечностей у млекопитающих оказались безуспешными. Под действием электрического тока или при сочетании действия электрического тока с фактором роста нервов удавалось получить у крысы только разрастание скелетной ткани в виде хрящевых и костных мозолей, которые не походили на нормальные элементы скелета конечностей.
Один из наиболее интригующих в теории регенерации - вопрос об ее клеточных источниках. Откуда берутся или как возникают недифференцированные клетки бластемы, морфологически сходные с мезен-химными?
В настоящее время говорят о трех возможных источниках регенерации. Первый - это дедифференцированные клетки, второй - региональные стволовые клетки и третий - стволовые клетки из других структур, мигрировавшие к месту регенерации.
Большинство исследователей признают дедифференцировку и метаплазию при регенерации хрусталика у амфибий. Теоретическое значение этой проблемы заключается в допущении возможности или невозможности изменений клеткой ее программы до такой степени, что она возвращается в состояние, когда снова способна делиться и репро-граммировать свой синтетический аппарат.
Наличие региональных стволовых клеток установлено к настоящему времени во многих тканях: в мышцах, кости, эпидермисе кожи, печени, сетчатке и других. Такие клетки обнаружены даже в нервной ткани - в определенных зонах головного мозга. Во многих случаях считают, что источником, из которого образуются дифференцированные клетки в ходе регенерации, являются именно они (регенеративная медицина, регенеративная ветеринария). Предполагается, что по мере увеличения возраста особи численность популяций региональных стволовых клеток сокращается.
Если же в органе не хватает своих региональных стволовых клеток, то в него могут мигрировать клетки из других и дать начало нужной ткани. Недавно показано, что стволовые клетки, изолированные из одной взрослой ткани, могут дать начало зрелым клеткам других клеточных
линий, независимо от назначения классического зародышевого слоя. Так, эндотелий крупных магистральных артерий не имеет собственных запасов стволовых клеток. Его обновление происходит за счет стволовых клеток костного мозга, поступающих в кровоток. Однако сравнительная неэффективность подобных преобразований in vivo (в организме), даже при наличии повреждения ткани, ставит вопрос о том, имеет ли этот механизм физиологическое значение.
Интересно, что среди взрослых стволовых клеток способность к перемене линий наиболее велика у стволовых клеток, которые могут быть культивируемы в среде в течение длительного времени.
Если удастся решить вопрос трансформации клеточных линий, то вполне возможным станет использование этих технологий в репаратив-ной медицине для лечения широкого круга болезней. Однако, несмотря на достижения биологии последних лет, в проблеме регенерации еще остается очень много нерешенных вопросов.
8.5. старость и старение. смерть как биологическое явление
Старость представляет собой стадию индивидуального развития, по достижении которой в организме наблюдаются закономерные изменения в физическом состоянии, внешнем виде, эмоциональной сфере.
Старческие изменения становятся очевидными и нарастают в пострепродуктивном периоде онтогенеза. Однако начало угасания репродуктивной функции или даже ее полная утрата не могут служить нижней границей старости. Действительно, менопауза у женщин, заключающаяся в прекращении выхода зрелых яйцеклеток из яичника (овуляция) и, соответственно, прекращении месячных кровотечений, определяет окончание репродуктивного периода жизни. Вместе с тем к моменту достижения менопаузы большинство функций и внешних признаков далеко не достигают состояния, характерного для старых людей. С другой стороны, многие изменения, которые мы связываем со старостью, начинаются до снижения репродуктивной функции. Это относится как к физическим признакам (поседение волос, развитие дальнозоркости), так и к функциям различных органов. К примеру, у мужчин снижение выделения мужских половых гормонов половыми железами и повышение выделения гонадотропных гормонов гипофизом, что характерно для старого организма, начинается примерно с 25 лет.
Различают хронологический и биологический (физиологический) возраст. Согласно современной классификации, основанной на оценке многих средних показателей состояния организма, людей, хронологический (паспортный, календарный) возраст которых достиг 60-74 лет, называют пожилыми, 75-89 лет - старыми, свыше 90 лет - долгожителями. Точное определение биологического возраста затруднено тем, что отдельные признаки старости проявляются в разном хронологическом возрасте и характеризуются различной скоростью нарастания. Кроме того, возрастные изменения даже одного признака подвержены значительным половым и индивидуальным колебаниям.
Рассмотрим такой признак, как упругость (эластичность) кожи. Тот биологический возраст (первые признаки потери упругости), который в этом случае женщина достигает примерно в 30 лет, мужчина достигает значительно позже. Именно поэтому прежде всего женщинам необходим грамотный и постоянный уход за кожей. С целью определения биологического возраста, что необходимо для суждения о скорости старения, используют батареи тестов, проводя совокупную оценку одновременно многих признаков, закономерно изменяющихся в процессе жизни.
Основу таких батарей составляют сложные функциональные показатели, состояние которых зависит от согласованной деятельности нескольких систем организма. Простые тесты обычно бывают менее информативными. Например, скорость распространения нервного импульса, которая зависит от состояния нервного волокна, снижается в возрастном интервале 20-90 лет на 10%, тогда как жизненная емкость легких, определяемая координированной работой дыхательной, нервной и мышечной систем, - на 50%.
Состояние старости достигается благодаря изменениям, составляющим содержание процесса старения. Этот процесс захватывает все уровни структурной организации организма - молекулярный, субклеточный, клеточный, тканевой, органный. Суммарный результат многочисленных частных проявлений старения на уровне целостного организма заключается в нарастающем с возрастом снижении жизнеспособности особи, уменьшении эффективности приспособительных, гомеостатических механизмов. Показано, например, что молодые крысы после погружения в ледяную воду на 3 мин восстанавливают температуру тела примерно за 1 ч. Животным среднего возраста на это требуется 1,5 ч, а старым - около 2 ч.
В целом старение приводит к прогрессивному повышению вероятности смерти. Таким образом, биологический смысл старения заключается в том, что оно делает неизбежной смерть организма1. Последняя же представляет собой универсальный способ ограничить участие многоклеточного организма в размножении2. Без смерти не было бы смены поколений - одного из главных условий эволюционного процесса.
Возрастные изменения в процессе старения не во всех случаях заключаются в снижении приспособляемости организма. У человека и высших позвоночных в процессе жизни приобретается опыт, вырабатывается умение избегать потенциально опасных ситуаций. Интересна в этом плане и система иммунитета. Хотя ее эффективность после достижения организмом состояния зрелости в целом снижается, благодаря «иммунологической памяти» по отношению к некоторым инфекциям старые особи могут оказаться более защищенными, чем молодые.
8.5.1. ИЗМЕНЕНИЕ ОРГАНОВ И СИСТЕМ ОРГАНОВ В ПРОЦЕССЕ СТАРЕНИЯ
Рассмотрим кратко изменения органов и функциональных систем животных, и в том числе человека, которые становятся заметными и нарастают по завершении активного репродуктивного периода онтогенеза.
Как правило, после 40-50 лет у человека возникают стойкие внешние проявления старения, в частности кожных покровов. Появляются морщины, образующиеся из-за потери подкожной жировой ткани, пигментные пятна, бородавки. Кожа становится сухой и шершавой в связи с уменьшением количества потовых желез, теряется ее эластичность, она становится дряблой.
Общее направление этих изменений для сердечно-сосудистой и дыхательной систем, а также основного обмена, отражающего состояние энергетических процессов в организме, иллюстрирует рис. 8.87.
1 Наступлению биологической смерти нередко предшествует состояние клинической смерти, в котором клетки и ткани сохраняют достаточный уровень жизнеспособности, чтобы организм с помощью определенных воздействий мог быть возвращен к жизни (реанимация).
2 Вопрос о потенциальном бессмертии и отсутствии старения у простейших, поставленный учеными в конце XIX - начале XX столетия на заре экспериментальной геронтологии, требует дальнейшей разработки. Наблюдения над амебами, размножающимися бесполым путем, показали, что выживание клеточной культуры, образованной исходно одной клеткой (клеточный клон), зависит от условий культивирования. Клон инфузорий, для которых типична смена бесполого размножения и полового процесса, постепенно утрачивал способность к последнему.
Рис. 8.87. Возрастные изменения некоторых жизненно важных функций человека: 1 - основной обмен; 2 - сердечный индекс; 3 - скорость кровотока; 4 - емкость легких
Признаки старения сердечно-сосудистой системы становятся заметными обычно в возрасте после 40 лет. Закономерные изменения наблюдаются в стенках сосудов: в них откладываются липиды, прежде всего холестерин, что наряду с другими структурными превращениями снижает эластичность и искажает ответы на различные стимулы, регулирующие кровообращение. Типично разрастание в стенках сосудов и сердца соединительной ткани, замещающей рабочую мышечную ткань. В результате снижается эффективность работы сердца, нарушается кровоснабжение тканей и органов. Так, кровоток по сосудам головного мозга 75-летнего человека по сравнению с 30-летним уменьшен на 20%.
В основе функциональных расстройств дыхательной системы лежит разрушение межальвеолярных перегородок, что сокращает дыхательную поверхность, разрастание в легких соединительной ткани, что снижает эффективность аэрогематического обмена кислорода. В итоге с возрастом падает жизненная емкость легких, которая к 75 годам достигает всего 56% от уровня в возрасте 30 лет.
Легко заметным изменением в системе пищеварения является потеря зубов. Падает эффективность функционирования пищеварительных желез, нарушения двигательной (моторной) функции кишечника нередко приводят к привычным запорам.
В процессе старения страдает функция мочевыделительной системы, снижается интенсивность фильтрации в почечных клубочках (на 31% в 75-летнем возрасте по сравнению с 30-летним), так же как и обратное всасывание веществ из фильтрата в почечных канальцах. Ухудшение функции мочевыделения объясняется гибелью с возрастом значительного количества нефронов (до 44% от уровня 30-летнего возраста), представляющих собой структурно-функциональные единицы почек.
Специального внимания заслуживают изменения в процессе старения со стороны мышечной системы и скелета. Снижается сила сокращений поперечнополосатой мускулатуры, быстрее развивается утомление, наблюдается атрофия мышц. Характерная для стареющих людей перестройка костей заключается в разрежении их вещества (старческий остеопороз), что приводит к снижению прочности.
В процессе старения организма существенные изменения происходят в репродуктивной системе. При этом они затрагивают обе основные функции главных органов названной системы - половых желез: выработку гамет и образование половых гормонов. У женщин овогенез прекращается по достижении ими менопаузы. Образование функционально полноценных сперматозоидов в мужском организме возможно, по-видимому, даже в преклонном возрасте.
Изменение гормонального профиля людей в связи с угасанием репродуктивной функции носит сложный характер. Распространено мнение о прогрессивном снижении с возрастом концентрации у мужчин тестостерона, а у женщин эстрадиола и прогестерона - главных мужского и женских половых гормонов. Напомним, что оба типа гормонов образуются организмами обоих полов, только в разном количестве. Указанные сдвиги сопровождаются повышением секреции эстрадиола и прогестерона у мужчин и тестостерона у женщин. Вместе с тем содержание фолликулостимулирующего гормона у 80-90-летних женщин выше в 14 раз, а лютеинизирующего гормона - в 5 раз, чем у 20-30-летних. Резко нарушено у старых людей соотношение названных гормонов гипофиза, что является важной причиной нарушения репродуктивной функции в целом. Картина усложняется также тем, что в процессе старения изменяется ответ ткани на половые гормоны в связи с сокращением количества клеточных рецепторов к ним.
Изменения в процессе старения функций эндокринной системы
носят объективно сложный характер. В качестве примера рассмотрим изменения в стареющем организме функции щитовидной железы. Обнаружено, что к старости падает содержание в крови трийодтиронина и тироксина, в связи с изменением белков плазмы крови ухудшается перенос гормонов к тканям, в клетках уменьшается количество рецепторов, узнающих гормоны, а чувствительность рецепторов повышается. Вместе с тем в крови сохраняется достаточно высокая концентрация тиреотроп-ного гормона гипофиза; чувствительность к нему клеток щитовидной железы возрастает. Из приведенной картины видно, что в отдельных звеньях цепи регуляции жизненно важных функций гормонами щитовидной железы возрастные изменения не одинаковы по масштабу, а иногда и раз-нонаправлены. В таком случае важен общий результат, степень выраженности которого подвержена индивидуальным колебаниям.
Наряду с эндокринной системой нервной системе принадлежит важнейшая роль в регуляции, координации и интеграции разнообразных проявлений жизнедеятельности. Изменения нервной системы в процессе старения включают нарастающую гибель нейронов, масштабы которой колеблются от отдела к отделу и составляют от 15-20 до 70-75%. С другой стороны, сохранившиеся клетки увеличивают свои размеры, образуют дополнительные разветвления окончаний отростков в тканях-мишенях, что имеет приспособительное, заместительное значение. Общий итог, однако, заключается в том, что после 40-50 лет в тканях образуется недостаток нервных влияний, что приводит к нарушению регуляций функций. Это справедливо, к примеру, в отношении иннервации сердца и сосудов, а также поперечнополосатой скелетной мускулатуры симпатической нервной системой.
Функциональные нарушения в процессе старения в центральной нервной системе зависят как от уменьшения числа нервных клеток, так и от снижения синтеза медиаторов, ослабления связей между отдельными мозговыми структурами, уменьшения скорости проведения нервных импульсов по волокнам и через синапсы. В стареющем организме с большим трудом вырабатываются условные рефлексы, приобретаются новые навыки. Изменения ряда функций носят более сложный характер. Так, интеллектуальные способности людей в возрасте 55-70 лет сохраняются такими же, какими они были в 20-30-летнем возрасте, а в возрасте 55-60 лет наблюдается второй пик творческой деятельности.
Одна из черт процесса старения заключается в снижении надежности механизмов регуляции, направленных на поддержание постоянства
жизненно важных параметров внутренней среды организма - гомео-стаза. Причину этого видят в функциональных изменениях стареющего гипоталамуса, с которым связывают действия своеобразных биологических часов старения всего организма. К гипоталамической области головного мозга человека относятся 32 пары ядер, участвующих в регуляции важнейших вегетативных функций. В целом процесс старения гипоталамических структур характеризуется неравномерностью и разно-направленностью, что типично для других областей нервной системы.
В старости наблюдается снижение функций практически всех органов чувств. Уменьшается способность глаза к аккомодации, так как слабеют глазодвигательные мышцы и изменяется вещество хрусталика. Это ведет к старческой дальнозоркости. У старых людей хрусталик нередко теряет прозрачность - развивается катаракта. Падает острота зрения. Чувствительность органа слуха снижается, причем особенно к высокочастотным звуковым колебаниям. Старый человек хуже различает запах и вкус. К 75 годам люди сохраняют примерно 36% от количества вкусовых луковиц, которое имеется в возрасте 30 лет. У них нарушается чувство равновесия.
С возрастом заметно изменяются функции иммунной системы. За гуморальный иммунитет ответственны В-лимфоциты, вырабатывающие антитела к носителям чужеродной биологической информации - антигенам. Т-лимфоциты ответственны за клеточный иммунитет, например за отторжение трансплантата, хотя могут участвовать в реакциях гуморального иммунитета. К старости наблюдается ослабление реакций как гуморального, так и клеточного иммунитета. Становление функции иммунной системы во многом связано с активностью тимуса, которая прекращается в связи с инволюцией железы по достижении половозрелого возраста (рис. 8.88). Нарушение естественного развития иммунной системы в эксперименте путем удаления вилочковой железы (например, у мышей) сокращает продолжительность жизни животных. Напротив, пересадка тимуса и костного мозга от молодой мыши к старой приводит к омоложению иммунной системы 19-месячной мыши до уровня 4-месячной. Некоторые такие животные жили заметно дольше своего обычного срока.
В стареющем организме клетки иммунной системы ошибочно вырабатывают антитела против собственных клеток и белков. Таким образом, старение сопровождается нарастанием аутоиммунных реакций.
Изменения в процессе старения органов кроветворной системы заключаются в снижении продукции эритроцитов. С возрастом способ-
Рис. 8.88. Возрастные изменения вилочковой железы человека
ность костного мозга к восстановлению массы эритроцитов падает почти в 6 раз. Восполнение утраченных вследствие потери 30-40% общего объема крови эритроцитов происходит у 2-месячных крыс по 4,8%, а у 25-месячных - по 0,8% за 1 сут (рис. 8.89).
Из изложенного в данном разделе следует, что процесс старения распространяется практически на все структуры и функции организма. При этом некоторые показатели (упругость кожи, поседение волос) изменяются с возрастом довольно монотонно. Другие (артериальное давление,
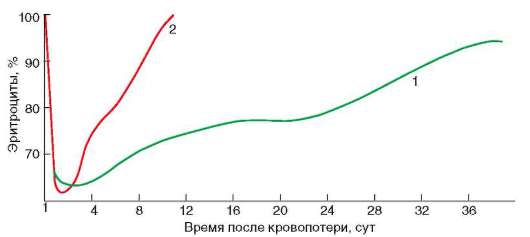
Рис. 8.89. Восстановление количества эритроцитов у 2-месячных (1) и 25-месячных (2) мышей после кровопотери
жизненная емкость легких) изменения носят пороговый характер, начиная регистрироваться примерно в возрасте 35-45 лет.
8.5.2. ПРОЯВЛЕНИЕ СТАРЕНИЯ НА МОЛЕКУЛЯРНОМ, СУБКЛЕТОЧНОМ И КЛЕТОЧНОМ УРОВНЯХ
Молекулярные и клеточные проявления старения многообразны. Они заключаются в изменении показателей потоков информации и энергии, состояния ультраструктур дифференцированных клеток, снижении интенсивности клеточной пролиферации.
Напомним, что функционирование ДНК, заключающей в себе биологическую (генетическую) информацию, связано с ее репродукцией, транскрипцией, репарацией. Учитывая возможную роль ошибок в молекулах ДНК в нарушении клеточных функций в процессе старения, изучали эффективность механизмов репарации повреждений молекулярной структуры ДНК (согласно расчетным данным, ежесекундно в геноме возникает минимум одно повреждение) в разном возрасте, а также корреляцию между интенсивностью этого процесса и продолжительностью жизни. В обоих случаях были получены противоречивые результаты. С одной стороны, уровень репарации повреждения УФ-облучением ДНК эмбриональных фибробластов трех линий мышей оказался пропорциональным средней продолжительности их жизни (900, 600 и 300 сут). С другой - репарация ДНК после УФ-облучения не различалась в культурах фибробластов кожи людей в диапазоне возрастов от 0 (новорожденные) до 88 лет. Общее заключение сводится к тому, что интенсивность молекулярной репарации ДНК меняется с возрастом в некоторых типах клеток, но главная причина клеточного старения не в этом.
В дифференцированных клетках млекопитающих старение сопровождается в целом снижением транскрипционной активности. Так, у мышей интенсивность синтеза РНК в ядрах печеночных и нервных клеток между 12-м и 30-м месяцами жизни падает на 50%. Изменение синтеза относится не только к рРНК, не кодирующим структуру белков, но и к и(м)РНК. В сравнении с активным репродуктивным периодом жизни в стареющем организме действительно наблюдается исчезновение в клетках определенных типов и(м)РНК, правда, в это же время регистрируется появление некоторых типов и(м)РНК, не образующихся ранее. Таким образом, речь идет о частичной смене биологической информации, используемой клеткой в разном возрасте (феномен дифференциальной активности генов).
Скорость снижения транскрипционной активности ДНК в постми-тотических высокодифференцированных клетках, к примеру нервных, зависит от условий их существования в течение жизни, в частности от напряженности их функционирования. Так, одна и та же функциональная нагрузка, распределенная между меньшим числом клеток, приводит к более раннему падению уровня транскрипции в их ядрах. Было также показано, что параллельно изменению скорости снижения транскрипции сокращается максимально достигаемая животными продолжительность жизни. ДНК эукариотических клеток находится в комплексе с белками - гистоновыми и негистоновыми, образуя вместе с ними хроматин ядер. Предполагают, что регуляция транскрипции информации с ДНК происходит путем изменения ДНК-белковых связей в хроматине. С возрастом такие связи становятся менее подвижными, отмечается снижение содержания в хроматине негистоновых белков.
Изменение трансляции в процессе старения изучают по содержанию рРНК (показатель общей белокобразующей способности клетки), и(м)РНК (набор образуемых белков), активности аминоацил-тРНК-синтетаз (ферменты активации аминокислот). Оказалось, что в возрасте от 12 до 70 лет у людей утрачивается до половины генов рРНК, относящихся, как известно, к умеренно повторяющимся нуклеотидным последовательностям, которые продублированы в геноме человека более 300 раз. Сохраняющееся число генов, по-видимому, способно обеспечить образование требуемого количества рРНК. Интенсивность белкового синтеза в целом снижается в зрелом возрасте.
О возрастных изменениях набора образуемых белков судят по содержанию в клетках различных ферментов. Полученные данные трудно оценить однозначно, так как обнаруженные отклонения даже в группах ферментов, сходных по функции, нередко разнонаправленны. Вместе с тем активность ферментов, ответственных за окисление, изменяется в стареющем организме однонаправленно: она снижается.
Немаловажное значение при старении имеют изменения энергетики организма, в частности, давно отмечена обратная связь между продолжительностью жизни животных различных видов и удельной скоростью обмена веществ. Существует особое понятие энергетического жизненного потенциала, отражающего общее количество расходуемой за жизнь энергии. Его величина для млекопитающих (кроме приматов) составляет примерно 924 кДж/г, большинства приматов - 1924 кДж/г, лемура, обезьяны-капуцина и человека - 3280 кДж/г массы тела. Изменения потока энергии в процессе старения состоят в снижении
количества митохондрий в клетках, а также падении эффективности их функционирования. Так, у взрослых крыс количество кислорода, потребляемое на 1 мг белка митохондрий, более чем в 1,5 раза выше, чем у старых животных. Важное свойство стареющего организма - смещение в процессах энергообеспечения функций соотношения между тканевым дыханием и гликолизом (бескислородный путь образования АТФ) в пользу последнего.
Изменения в процессе старения ультраструктуры клеток затрагивают практически все органеллы, как общего, так и специального значения. Одновременно может происходить накопление необычных веществ, иногда структурно оформленных (липофусцин). Наиболее заметна возрастная перестройка постмитотических высокоспециализированных клеток - нейронов, кардиомиоцитов. Для стареющих нервных клеток, например, типично обеднение цитоплазмы мембранами, сокращение объема шероховатой эндоплазматической сети, увеличение содержания в клеточных телах микрофибрилл, что, возможно, связано с нарушением транспорта веществ по отросткам.
В отростках мотонейронов старых крыс скорость транспорта составляет примерно 200 мм/сут, тогда как у зрелых животных - 320 мм/сут. Параллельно наблюдается снижение интенсивности синтеза белка и РНК. Отмечается замедление проведения нервного импульса, а в некоторых типах нервных клеток - уменьшение количества образуемого медиатора. Наиболее типичная черта старения нервных клеток млекопитающих, в том числе человека, - нарастающее накопление с возрастом в цитоплазме пигмента липофусцина. У 60-летних людей благодаря увеличению содержания пигмента доля цитоплазмы снижается в 1,3, a y 80-летних - в 2 раза в сравнении с 40-летними. Липофусцин часто называют пигментом изнашивания, т.е. балластом. Противоположная точка зрения приписывает липофусцину роль внутриклеточного депо кислорода.
Возрастное накопление липофусцина распространяется кроме нервной системы на сердечную и скелетную мускулатуру. Сдерживание роста содержания пигмента в клетках плодовых мух путем ограничения летательной активности сочеталось с двукратным увеличением средней продолжительности жизни.
Еще один пример изменения в ходе старения специальных органелл касается миофибрилл в клетках сердечной мышцы, в отношении которых начинают преобладать деструктивные процессы.
На определенном этапе прогрессивная эволюция жизни на земле оказалась связанной с переходом к более эффективному аэробному типу
энергообеспечения процессов жизнедеятельности. Не следует, однако, забывать, что использование клетками кислорода приводит к образованию свободных радикалов (О2-, ОН-, Н2О2), которые в силу чрезвычайной реакционной способности могут вызывать быстрые разрушения биологических структур (мембран, макромолекул). Неблагоприятным эффектам свободных радикалов в клетках противостоят закрепленные процессом эволюции природные антиоксидантные механизмы. К ним принадлежат ферменты, разрушающие пероксиды. В процессе старения действенность механизмов, нейтрализующих свободные радикалы и пероксиды, снижается. Свободные радикалы способны нарушить любое звено молекулярной организации клетки. Сказанное делает их универсальным фактором старения на молекулярном и субклеточном уровне вне зависимости от вида клетки.
С начала 60-х гг. появились новые взгляды на значение для старения и продолжительности жизни закономерностей клеточной пролиферации. На основании подсчета числа делений фибробластов, высеваемых в культуру ткани от эмбриона человека и от взрослых людей, было сделано заключение о пределе клеточных делений (лимит Хейфлика), которому соответствует видовая длительность жизни. Показано, что фибробласты мыши способны удваивать свою численность 14-28 раз, цыпленка - 15-35, человека - 40-60, черепахи - 72-114 раз. Проверка результатов, о которых идет речь, выявила, что представление об ограниченности числа клеточных делений в индивидуальном развитии неточно.
Вместе с тем сохраняют свое значение классические представления, уходящие корнями в XIX столетие, утверждающие, что старение и естественное его следствие - смерть - это своеобразная плата за явление клеточной дифференцировки. Выход клеток в дифференцировку для многих типов клеток означает старение и гибель в связи с утратой возможности возвращения в митотический цикл (нервные клетки, сердечная и скелетная мышцы, лейкоциты и эритроциты крови, эпителий ворсин кишечника).
8.6. зависимость проявления старения от генотипа, условий и образа жизни
Согласно данным многочисленных наблюдений, на скорость нарастания и выраженность изменений в процессе старения оказывают влияние генетическая конституция (генотип) организма, условия, в которых он развивается и живет, а для человека - его образ жизни.
Старение представляет собой всеобъемлющий процесс, охватывающий все уровни структурной организации особи - от макромолекулярного до организменного. Этим, а также тем, что главным биологическим результатом старения является прогрессивное повышение вероятности смерти, объясняется использование в исследованиях по генетике старения такого обобщающего показателя, как продолжительность жизни в пострепродуктивном периоде, наследуемость которого, собственно, и изучается.
Ряд наблюдений легли в основу достаточно распространенной точки зрения о наследуемости продолжительности жизни и, следовательно, наличии генетического контроля или даже особой генетической программы старения. Во-первых, максимальная продолжительность жизни ведет себя как видовой признак. При этом она положительно связана с такими важными эволюционно закрепленными показателями биологии вида, как длительность эмбрионального периода и возраст достижения половой зрелости (табл. 8.4).
Таблица 8.4. Максимальная продолжительность жизни, длительность эмбрионального периода и возраст достижения половой зрелости у различных видов млекопитающих животных
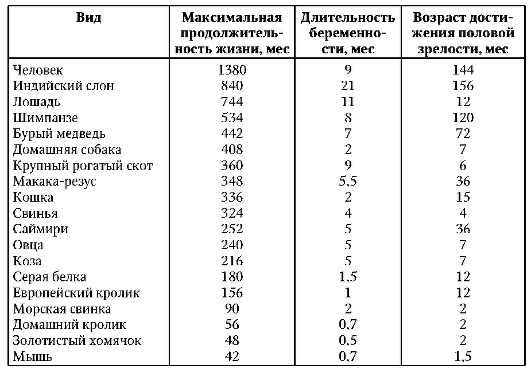
Во-вторых, величины продолжительности жизни у однояйцевых близнецов более близки (конкордантны), чем у разнояйцовых. Попарные различия по этому показателю составляют в среднем 14,5 года для первых и 18,7 года для вторых. Сходная картина наблюдается при сопоставлении колебаний длительности жизни среди лабораторных животных одной линии и различных линий. Так, у мышей получены линии с продолжительностью жизни от 120 до 700 сут.
В-третьих, описаны наследственные болезни с ранним проявлением признаков старости и одновременно резким сокращением продолжительности жизни. Например, при синдроме Хатчинсона-Гилфорда (инфантильная прогерия, или постарение в детском возрасте) уже на первом году жизни отмечаются задержка роста, раннее облысение, морщины, атеросклероз. Половой зрелости такие субъекты, как правило, не достигают, и смерть наступает в возрасте до 30 лет. Для названного синдрома установлено аутосомно-доминантное наследование.
В-четвертых, в лабораторных условиях путем близкородственных скрещиваний получены инбредные линии плодовой мухи и мыши, существенно различающиеся по средней и максимальной продолжительности жизни. Гибриды 1-го поколения от скрещивания родителей из разных короткоживущих линий (рис. 8.90) живут дольше родителей, что расценивают как явление гетерозиса.
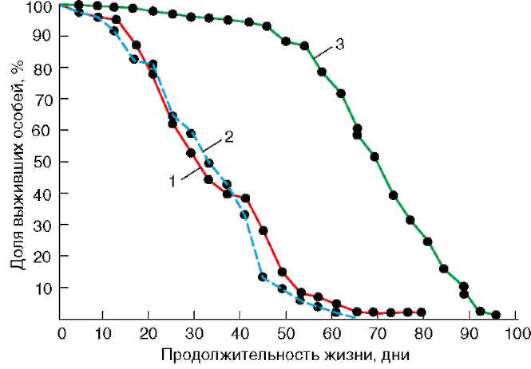
Рис. 8.90. Явление гетерозиса, заключающееся в увеличении длительности жизни гибридов первого поколения от скрещивания плодовых мух из двух ко-роткоживущих линий: 1 - инбредная линия К; 2 - инбредная линия В; 3 - гибриды F1 (В x К)
В-пятых, замечено, что среди плодовых мух особи, гомозиготные по аллелю зачаточных крыльев, имеют меньшую продолжительность жизни, чем мухи дикого типа (плейотропия). Потомки от скрещивания мутантов и мух дикого типа по рассматриваемому показателю проявляют единообразие и близки к последним. Среди гибридов 2-го поколения от скрещивания таких потомков между собой происходит расщепление по продолжительности жизни в отношении 3:1 (дикий тип: мутантный тип). Аналогично описанной мутации у мыши также обнаружено много примеров влияния отдельных генов на продолжительность жизни, причем в сторону ее снижения. Сходным примером у человека является мутация, приводящая к развитию синдрома Марфана и фенотипически проявляющаяся в дефектном развитии соединительной ткани: наряду с «паучьими» пальцами, подвывихом хрусталика, пороком сердца, повышенным выбросом в кровь адреналина такие субъекты отличаются сокращенной продолжительностью жизни.
В-шестых, для людей выявлена положительная связь между длительностью жизни родителей и потомков.
Приведенные материалы, свидетельствуя в пользу генетического контроля длительности жизни и старения, не дают ответа на важные вопросы о том, насколько велика сила этого контроля и через какие конкретные генетические механизмы он осуществляется. Представление о величине наследуемости продолжительности жизни получают, определяя коэффициент наследуемости. Он отражает меру сходства между родственниками по изучаемому признаку. По данным разных авторов, коэффициент корреляции между продолжительностью жизни детей и родителей составляет от 0,02 до 0,13, т.е. низок. Сходные цифры получены для мышей: 0,01-0,40. Родители и дети принадлежат к разным поколениям, а условия проживания меняются. С целью избежать занижения значений коэффициента корреляции за счет различий в условиях жизни сопоставляли продолжительность жизни братьев и сестер. В данном случае коэффициент корреляции оказался выше: 0,15-0,30. Однако и здесь значения существенно ниже тех, которые характеризуют признаки с высокой наследуемостью. К примеру, коэффициент наследуемости роста составляет около 0,70.
Данные по коэффициенту наследования долголетия полезно дополнить примерами, раскрывающими их биологический смысл. Так, если пронаблюдать 25-летних людей, предки которых жили либо достаточно мало, либо, наоборот, достаточно долго, то различие между этими группами по средней продолжительности жизни составит всего 2-4 года.
Тем не менее существуют данные о некоторой связи между средней длительностью жизни предков и потомков, прослеживаемой до 70-летнего возраста (табл. 8.5).
Таблица 8.5. Связь между продолжительностью жизни предков и потомков
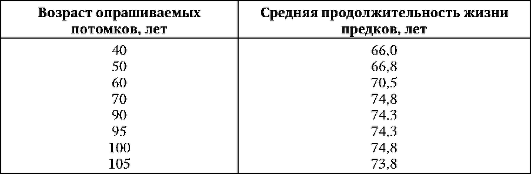
Изучение связи между продолжительностью жизни родителей и детей, достигших 20-летнего возраста, показало, что превышение родителями средней продолжительности жизни на 10 лет добавляет к жизни детей 1 год.
Отсутствие специальной генетической программы старения.
Между тем первостепенный интерес для медицины представляет вопрос о факторах, влияющих на скорость этого процесса, среди которых могут быть и генетические. Общий вывод заключается в том, что при отсутствии специальных генов или целой программы, прямо определяющих развитие старческих признаков, процесс старения находится тем не менее под генетическим контролем путем изменения его скорости.
Называют разные пути такого контроля. Во-первых, это плейо-тропное действие, свойственное многим генам. Допустим, что один из плейотропно действующих генов оказывает выраженное положительное влияние на ранних стадиях индивидуального развития, но ряд связанных с ним фенотипических проявлений носит отрицательный характер. Для сохранения полезных свойств гена и ослабления вредных в генотипе появляются и закрепляются отбором гены-модификаторы, ослабляющие неблагоприятное действие в раннем онтогенезе. В пострепродуктивном периоде онтогенеза действие модификаторов, уже не поддерживаемое отбором, снижается. Это дает возможность неблагоприятным свойствам гена проявить себя, ускоряя старение.
Во-вторых, со временем в генотипах соматических клеток, особенно в области регуляторных нуклеотидных последовательностей, накапливаются ошибки (мутации). Следствием этого становится на-
растающее с возрастом нарушение работы внутриклеточных механизмов, процессов репликации, репарации, транскрипции ДНК.
В-третьих, генетические влияния на скорость старения могут быть связаны с генами предрасположенности к хроническим заболеваниям, наследуемым по полигенному типу, таким как ишемическая болезнь сердца, атеросклероз сосудов головного мозга, гипертония. Правда, некоторые формы семейного повышения уровня холестерина в крови, фактора риска ишемической болезни сердца, наследуются моногенно. Частота этих форм составляет 6-8 на 1000 человек. Исследования на долгожителях показывают, что их отличает повышенная устойчивость к хроническим заболеваниям, а время наступления таких болезней отсрочено. Так, среди лиц, превысивших 80-летний возрастной рубеж и страдавших атеросклерозом сосудов головного мозга, свыше 86% имели лишь начальную стадию заболевания. В пользу наличия генотипических влияний говорит то, что у родственников долгожителей как бы замедлен темп старения нервной системы: некоторые показатели функционирования этой системы соответствуют на 15-20 лет меньшему календарному возрасту. Об этом свидетельствует повышенная вероятность заболеть ишемической болезнью у родственников (особенно 1-й степени родства) лиц, страдающих этим заболеванием.
Приведенные выше примеры зависимости скорости старения от особенностей генотипа можно истолковать как доказательство участия генотипа в контроле старения, т.е. процессов, ведущих к снижению жизнеспособности в пострепродуктивном периоде. Вместе с тем правомерна и иная точка зрения. От индивидуальных особенностей генотипа зависит надежность молекулярных, клеточных, системных механизмов жизнеспособности организма. Таким образом, речь идет о генетической основе противостояния процессу старения, снижения его скорости или степени риска заболеть достаточно рано хроническим заболеванием, большей устойчивости в стрессовых ситуациях.
В пользу такого взгляда на генетику старения говорят результаты исследований последних десятилетий: наблюдения за фенотипическим эффектом в виде увеличения средней и/или максимальной продолжительности жизни при некоторых мутациях, а также изменение длительности жизни животных (круглый червь C. elegans, плодовая муха, мышь), «нокаутированных» по определенным генам (генноинженерная технология «knock out», заключающаяся в удалении или функциональной инактивации конкретного гена). Дело в том, что в основном это гены, контроли-
рующие функционирование внутриклеточных антиоксидантных систем (плодовые мухи с увеличенным числом генов одновременно супероксид-дисмутазы и каталазы, но не гена одного из названных ферментов, жили на 20-37% дольше обычных мух), образование клеточных рецепторов к инсулину или инсулинподобному фактору роста 1, оказывающих влияние на гормональный фон (карликовые мыши Эймса, несущие точковые мутации в гене Prophet pit 1, живут на 50-64% дольше, характеризуясь пониженным уровнем пролактина, тиреоидстимулирующего гормона, гормона роста, инсулинподобного фактора роста 1 и инсулина в плазме крови; эти животные отличаются также сниженной температурой тела). Можно заключить, что генетический контроль существенных параметров старения (например, скорости) реализуется путем оптимизации генетического сопровождения процессов антибиостарения.
У людей долголетию способствует наличие в генотипах гена апо-липопротеина в виде аллеля Е2, тогда как аллель названного гена Е4 повышает предрасположенность к гиперхолистеринемии и болезни Альцгеймера (но не к диабету или раку).
8.6.2. ВЛИЯНИЕ НА ПРОЦЕСС СТАРЕНИЯ УСЛОВИЙ ЖИЗНИ
Условия жизни относятся к категории понятий, отличающихся широтой и некоторой размытостью границ. Если для животных оно включает природно-географические, прежде всего климатические, факторы, то в отношении человека необходимо учитывать также и социально-экономические факторы.
Исследование влияний условий жизни на процесс старения проводят несколькими путями. Во-первых, путем изучения скорости соответствующих изменений организмов, проживающих в разных условиях. Во-вторых, путем сопоставления значений смертности или продолжительности жизни в различающихся по условиям жизни популяциях в пределах одного или разных исторических периодов времени. Продолжительность жизни здесь выступает как обобщенный показатель жизнеспособности. В-третьих, свой вклад вносит изучение распределения по планете долгожителей.
Оценка влияния условий жизни на скорость старения требует предварительного отбора демонстративных показателей, значения которых закономерно изменяются соответственно возрасту. В исследованиях зависимости скорости старения от условий жизни, проводимых на лабораторных животных, используют следующие признаки:
• состояние белков соединительной ткани коллагена и эластина;
• показатели сердечной деятельности и кровообращения;
• содержание пигмента липофусцина в клетках нервной системы и
сердца;
• показатели произвольной двигательной активности;
• способность к обучению.
Изучали влияние на скорость старения многих условий жизни: пониженной температуры окружающей среды, измененного режима двигательной активности, воздействий ионизирующим облучением, повышенного парциального давления кислорода. В опытах на плодовых мухах, например, установлено, что увеличение в атмосфере в три раза концентрации О2 приводит к ускоренному старению, что выражается в более быстром отложении в тканях липофусцина. Параллельно отмечалось сокращение вдвое длительности жизни. В другом опыте кроликов с раннего возраста систематически и длительно подвергали повышенным двигательным нагрузкам. В описанных условиях у кроликов замедлялся ритм сердечных сокращений, снижалось артериальное давление. Направление изменений со стороны сердечно-сосудистой системы дает возможность судить о снижении скорости старения животных. Одновременно было установлено, что подопытные кролики жили в 1,5 раза дольше животных с обычной для вида двигательной активностью.
В процесс старения вовлекаются все структуры и функции организма. Важное свойство этого процесса - его гетерогенность. В соответствии с этим свойством изменения, характерные для старения, появляются в различных клетках, тканях и органах в разном календарном возрасте. С другой стороны, в любом органе стареющего организма типичные для этого процесса изменения сочетаются с изменениями приспособительными, направленными на восполнение структурных и функциональных потерь. В таких условиях невозможно точно определить скорость старения организма как целостной системы путем оценки скорости старения по изменениям отдельных показателей, будь то накопление липофусцина или повышение артериального давления. Необходим обобщенный критерий, каковым является продолжительность жизни или связанная с ней жизнеспособность.
Использование такого показателя, как продолжительность жизни, носящего статистический характер, позволяет проводить исследования непосредственно на людях, группируя условия жизни согласно их природе: социально-экономические, климатогеографические, местные, связанные, например, с минеральным составом почв и грунтовых вод или же с уровнем радиации.
Влияние социально-экономических условий на длительность жизни может быть оценено путем сравнения названного показателя для одной и той же популяции (например, население страны), но в разные исторические периоды или же путем сопоставления продолжительности жизни в двух популяциях, различающихся по жизненному уровню и сосуществующих в одно и то же историческое время. Социально-экономические условия жизни населения стран Европы, Северной Америки, некоторых стран Азии и Африки претерпели существенные изменения в текущем столетии. Главным итогом этих изменений стало повышение жизненного уровня, улучшение питания, жилищных усло-
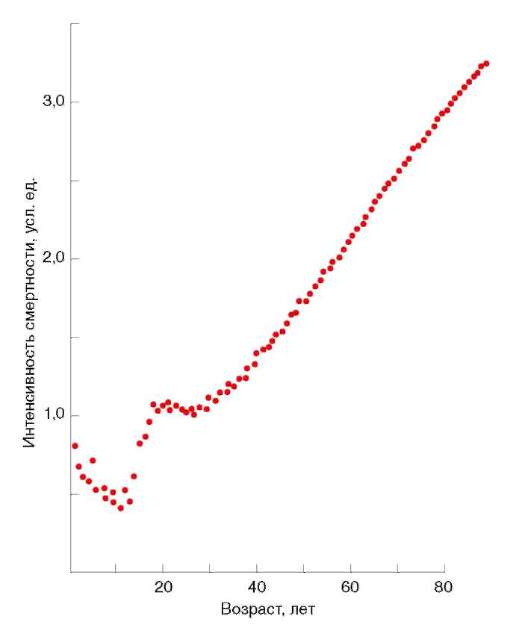
Рис. 8.91. Интенсивность смертности мужчин в зависимости от их возраста (Швеция, 1971-1975 гг.)
вий, качества охраны здоровья и медицинской помощи. Соответственно, значения средней продолжительности жизни в таких странах возросли к 90-м гг. XX в. более чем в два раза в сравнении со значениями показателя для начала века. К примеру, в начале века средняя продолжительность жизни жителей России составляла 32 года, тогда как в 1987 г. она достигла 64 лет для мужчин и 73 лет для женщин.
В экономически развитых странах средняя продолжительность жизни в целом превышает 70 лет, однако во многих развивающихся странах и в настоящий исторический период она не достигает 40 лет.
Приведенные сведения указывают на очевидную зависимость длительности жизни от социально-экономических условий. Означает ли это, что изменения социально-экономических условий в сторону их улучшения замедляют скорость старения? Зависимость смертности людей от возраста показана на рис. 8.91. По ходу приведенной кривой наблюдаются три отрезка, различающихся по интенсивности и направлению изменения смертности. Во-первых, это пик смертности, вершина
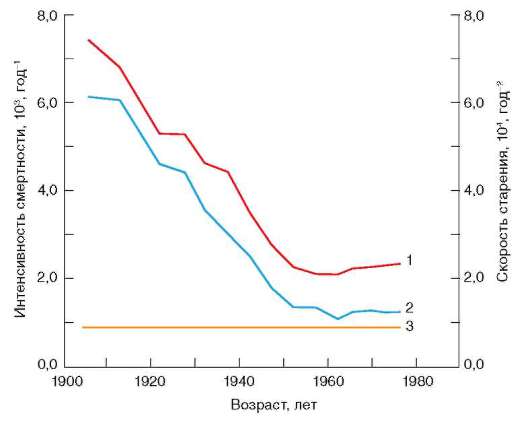
Рис. 8.92. Постоянство скорости старения людей определенной популяции в XX в. (Швеция): 1 - интенсивность смертности мужчин в возрасте 40 лет; 2 - то же, в возрасте 30 лет; 3 - скорость старения мужчин в возрастном интервале
30-40 лет
которого приходится на период новорожденности: примерно 2000 младенческих смертей на 100 000 рождаемых. Далее интенсивность смертности снижается, и в возрасте 9-12 лет она минимальна: 20-30 умерших на 100 000 детей. Начиная с возраста половой зрелости смертность монотонно возрастает, причем рост происходит по экспоненте таким образом, что после 30-35 лет удвоение значений происходит каждые 8 лет. В возрасте более 80 лет интенсивность смертности высока и по мере прибавления лет практически не меняется.
Для суждения о зависимости скорости старения людей от социально-экономических условий жизни достаточно сравнить ход кривых возрастной интенсивности смертности в популяции в начале и во второй половине XX в. Видно, что принципиальных изменений конфигурация кривой не претерпела. На всем своем протяжении она лишь сместилась в область более низких значений. Следовательно, улучшение социально-экономических условий уменьшает вероятность смерти в молодом возрасте, но не изменяет скорости старения. На неизменяемость скорости старения в конкретной популяции людей в течение XX в., несмотря на существенное повышение жизненного уровня, указывают, например, данные об абсолютном возрастном приросте интенсивности смертности мужчин Швеции с 1900 по 1980 г. (рис. 8.92). Таким образом, лучшие социально-экономические условия делают людей, притом любого возраста, лишь менее доступными действию факторов, которые в иных условиях привели бы к смертельному исходу.
Сделанное заключение хорошо согласуется с теми изменениями, которые произошли на протяжении текущего столетия в перечне главных причин смертности людей (табл. 8.6).
Относительно скромные значения средней продолжительности жизни (35-40 лет) в сравнении с максимально регистрируемой (115-120 лет) в первой трети XX в. в подавляющем большинстве стран Европы, отличавшихся в тот период относительно высоким жизненным уровнем, затрудняли прицельное изучение влияния физико-химических, климатических и иных природных факторов на скорость старения в популяциях, занимающих различные территории. В настоящее время с увеличением средней длительности жизни до 67,3-74,1 года у мужчин и до 74,2-79,9 года у женщин ситуация изменилась.
Рассмотрим следующий пример. Мужчин Финляндии отличает низкий показатель средней продолжительности жизни (69,2 года в 1980 г.) и один из самых высоких показателей смертности от сердечно-сосудистых заболеваний в Европе. При этом в самой Финляндии особенно высоких
Таблица 8.6. Изменение главных причин смертности людей в течение ХХ в. (на примере населения г. Нью-Йорка с 1900 по 1970 г.)
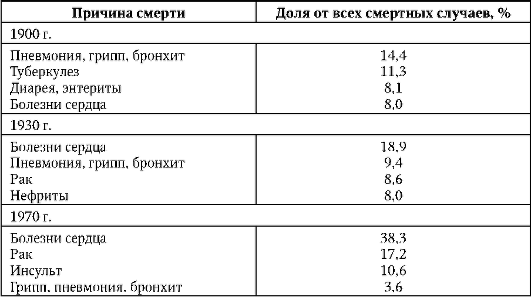
значений этот показатель достигает в Северной Карелии. При изучении минерального состава почв и грунтовых вод этого района оказалось, что в них исключительно низка концентрация микроэлемента селена (Se). Соответственно, низкой оказалась и концентрация Se в крови финнов: 0,056-0,081 мкг/мл, в сравнении с 0,206 мкг/мл, например, у жителей США. У мужчин с концентрацией Se в сыворотке крови менее 0,045 мкг/мл риск смерти от сердечно-сосудистых заболеваний выше в 2,7 раза, а от ишемической болезни сердца - в 3,6 раза. Зависимость скорости старения от поступления в организм достаточных количеств Se объясняется тем, что последний входит в состав фермента глутатионпероксидазы. Названный фермент катализирует реакции распада Н2О2 и органических ги-дропероксидов, разрушающих мембраны и другие клеточные структуры.
Следует отдавать отчет в том, что Se представляет собой лишь один из природных факторов, который, включаясь в процессы жизнедеятельности, изменяет риск смерти, влияя на скорость возрастной перестройки сердечно-сосудистой и других систем организма. Число таких факторов велико, причем большинство из них, видимо, еще не определены. С другой стороны, в Финляндии недостаток Se в диете мало сказывается на жизнеспособности женщин, которые по средней продолжительности жизни (77,6 года в 1980 г.) относятся в Европе к достаточно благополучным популяциям. Причина, по-видимому, кроется в генотипических различиях:
у мужчин во всех клетках активна единственная хромосома Х материнского происхождения со всеми ее дефектами, а у женщин в разных клетках активна хромосома Х то материнского, то отцовского происхождения.
Испытания атомного и водородного оружия, развитие ядерной энергетики и технологий повышают уровень радиационного фона. Расчеты на человечество в целом показывают, что хроническое облучение населения планеты с мощностью дозы 1 Гр на поколение сокращает продолжительность жизни на 50 000 лет на каждый 1 млн живых новорожденных в первом облученном поколении. В настоящее время за счет естественных и созданных человеком источников радиации за поколение человечество получает менее 0,05 Гр. Воздействие на живые ткани ионизирующего облучения приводит к образованию в них свободных радикалов, которые повышают риск развития сердечно-сосудистых заболеваний и рака (рис. 8.93). Так как нарастание риска этих заболеваний - показатель скорости старения, изменения условий жизни в сторону повышения радиационного воздействия ускоряют названный процесс.
К представлению о том, что риск развития раковых опухолей может рассматриваться как показатель скорости старения, следует относиться критически. Так, у мышей мутация гена фермента геликазы XPDTTD приводит к ускоренному старению (мутантные мыши не живут дольше 1,5 года), но без возрастания вероятности развития опухоли. Мыши с
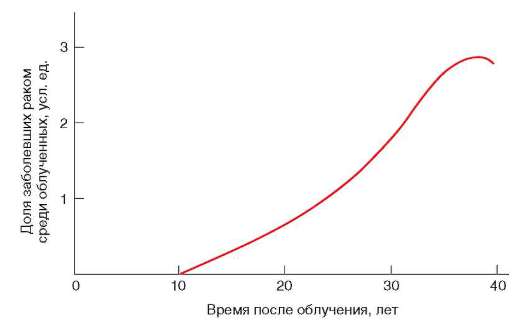
Рис. 8.93. Рост вероятности развития злокачественных опухолей (кроме лейкозов) после однократного облучения всего тела дозой 0,01 Гр
двойной мутацией названного гена XPDXP/CS, демонстрируя признаки ускоренного старения (остеопороз, ранняя потеря фертильности и остановка роста, нейродегенеративные изменения, глухота и др.), характеризуются также повышенным риском развития опухолей.
Определенные, хотя и ограниченные представления о влиянии условий жизни на процесс старения дает изучение субпопуляций долгожителей. Напомним, что к долгожителям причисляются лица в возрасте 90 лет и более. Их количество в популяции выражается индексом долгожительства, т.е. долей долгожителей среди населения старше 60 лет: Ν90/Ν60?1000, где N90 - число долгожителей; N60 - число членов популяции в возрасте 60 лет. На большей территории бывшего СССР (названия государства и административных единиц соответствуют 1970 г.; приводимые цифры основаны на данных переписи, проведенной в указанном году) индекс долгожительства не превышает 20%. В ряде территорий, однако, его значения выше в 2,5-3 раза. Для абхазов в Абхазии, азербайджанцев в Нахичевани, балкарцев в Кабардино-Балкарии, ингушей в Северной Осетии и Чечено-Ингушетии он превосходит 60%, для эвенков в Якутии - 50%.
Из приведенных сведений видно, что долгожительство характеризует определенные этнические группы, проживающие в основном в сельской местности, для которых можно предполагать достаточно высокий уровень брачной изоляции. Это наводит на мысль о генетической основе явления или же каких-то особенностях образа жизни. Два факта тем не менее свидетельствуют в пользу того, что и условия жизни могут иметь некоторое значение. Во-первых, индекс долгожительства, например азербайджанцев, проживающих в Грузии и Азербайджане, оказывается ниже примерно на 10%, чем для проживающих в Нахичевани. Во-вторых, русское население в зонах долгожительства (Кавказ, Якутия) отличается более низкими значениями индекса в сравнении с населением, исторически традиционным для территории.
8.6.3. ВЛИЯНИЕ НА ПРОЦЕСС СТАРЕНИЯ ОБРАЗА ЖИЗНИ
Понятие образа жизни в строгом смысле применимо лишь к человеку, так как включает в себя осознанное отношение к собственным действиям и, следовательно, оставляет за индивидуумом право выбора поступать так или иначе. В повседневной жизни образ жизни нередко как бы навязывается людям внешними обстоятельствами (ограниченная двигательная активность работников интеллектуального труда и
детей, увлеченных компьютерными играми, напряженный ритм жизни многомиллионного города, национальные традиции в питании). Значение образа жизни в изменении скорости старения усиливается тем, что те или иные привычки, среди которых есть вредные, устанавливаются в раннем зрелом возрасте и сопровождают человека обычно на протяжении всей жизни. Из многих важных сторон, характеризующих образ жизни, рассмотрим такие, как диета и семейная жизнь.
Осознание учеными зависимости скорости старения от особенностей питания изначально связано с результатами экспериментальной геронтологии. Приведем данные одного из многих опытов. При скармливании крысам начиная с момента прекращения питания материнским молоком сбалансированной по витаминам и минеральным веществам, но низкокалорийной пищи удалось увеличить среднюю продолжительность жизни с 680 до 971 сут, а животные-рекордсмены доживали до 4-летнего возраста. По внешнему виду крысы 2-3-летнего возраста из этой группы походили на трехмесячных контрольных животных. Среди них на 50-90% снижалась частота гломерулонефрита, соединительнотканного перерождения сердечной мышцы (миокардиальный фиброз), а также некоторых опухолей.
Систематическое изучение влияния диеты на старение людей - дело исключительно трудное. С одной стороны, это длительные наблюдения, практически сопоставимые по времени с продолжительностью жизни, что требует от участников поистине сверхдисциплинированности. С другой стороны, ранний переход к низкокалорийной диете, как показали исследования на животных, резко повышает вероятность смерти в детском возрасте. Вместе с тем общий вывод заключается в том, что контролируемая диета представляет собой важнейший фактор здорового долголетия. Пища должна иметь пониженную калорийность с ограничением жирного, сладкого и соленого, но высоким содержанием клетчатки и пектиновых веществ. Основной источник калорий - белки и углеводы растительного происхождения, однако полного исключения продуктов животного происхождения не требуется. При этом пища должна быть разнообразной, содержать достаточное количество витаминов и микроэлементов.
Различные составляющие описанной диеты влияют на процесс старения через разные механизмы жизнедеятельности. О том, чем объясняется положительное действие микроэлемента Se, говорилось выше. Известно, что при недостатке в пище клетчатки и пектиновых веществ растет вероятность сердечно-сосудистых заболеваний и рака. Показана сильная положительная связь между потреблением жиров и таким за-
болеванием, как рак молочной железы, толстого кишечника (рис. 8.94). Важно помнить, что для любой категории продуктов находятся заболевания, частота которых связана с их преимущественным потреблением. Так, преобладание в диете продуктов в основном животного происхождения (мясо, яйца, масло, молоко, но также сахар, пиво) свойственно популяциям с высокой смертностью от ишемической болезни сердца, рака толстого кишечника и молочной железы. Преобладание продуктов растительного происхождения (рис, бобовые, пшеница, овощи, фрукты, но рыба и вино) характеризует диету популяций с высокой смертностью от туберкулеза органов дыхания, язвенной болезни, цирроза печени, нефрита, рака полости рта, гортани, пищевода, желудка.
У грызунов, содержащихся на низкокалорийной диете, 80-90% из изученных в эксперименте параметров проявляло признаки замедленного старения. Специального внимания заслуживают также данные о том, что у таких животных выше уровень апоптоза, выбраковывающего пренео-пластические (предопухолевые) клетки, замедлено накопление мутаций и развитие «возрастной патологии». Вместе с тем демографическое исследование, проведенное в Австралии на 4677 мужчинах и 4563 женщинах, показало, что после 70 лет полные (имеющие избыточный вес) люди
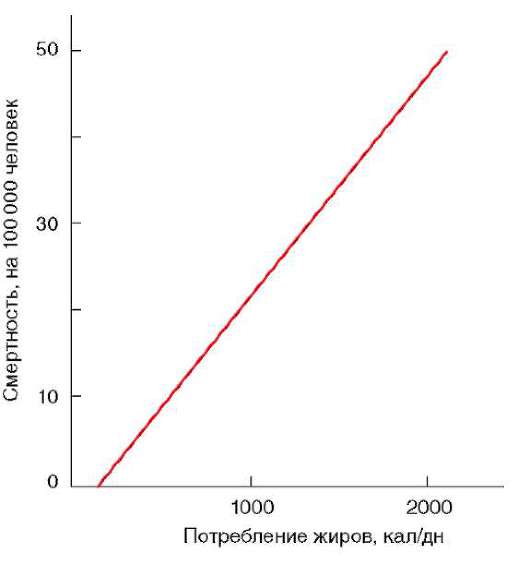
Рис. 8.94. Связь между потреблением жиров и смертностью от рака толстой кишки (лица в возрасте 55-64 лет)
живут дольше людей с нормальным телосложением. По мнению исследователей, в преклонном возрасте люди сталкиваются с иными факторами риска в сравнении с молодыми людьми и наличие избыточных жировых отложений (запасов) в организме может иметь положительное значение.
Приведенные данные говорят в пользу питания, сбалансированного по основным компонентам. Главным же правилом остается пониженная общая калорийность. Каковы возможные механизмы положительного действия низкокалорийного питания на старение? Ответ прост: речь может идти не о пользе низкокалорийной диеты, а о вреде переедания.
Статистика показывает, что защитное действие семейного образа жизни, во-первых, распространяется на все возрасты и, во-вторых, проявляется в отношении подавляющего большинства причин смерти, включая сердечно-сосудистые заболевания, рак, аппендицит, туберкулез, болезни органов пищеварения.
Механизм действия семейного образа жизни, видимо, достаточно сложен. Об этом свидетельствуют данные об исходе такого заболевания, как острый инфаркт миокарда у семейных и не имеющих семьи людей. В больницах при этом заболевании погибают 19,7% женатых и 26,7% неженатых мужчин, 23,3% замужних и 37,4% незамужних женщин. Среди перенесших инфаркт миокарда половина неженатых мужчин погибают в первые пять лет, тогда как женатых - в первые девять лет (рис. 8.95). Для замужних женщин этот период составляет 10, а незамужних - 6 лет.
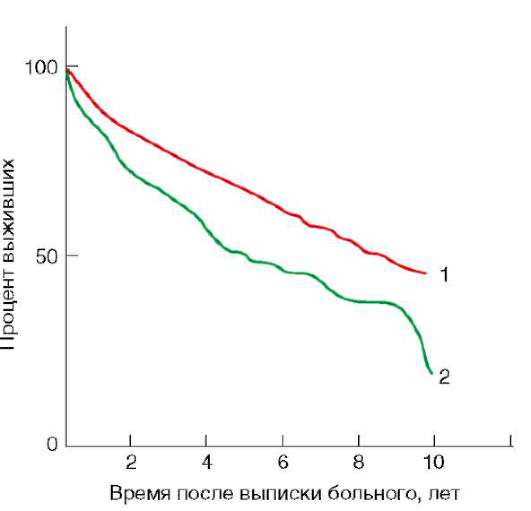
Рис. 8.95. Связь между выживанием мужчин после перенесенного инфаркта миокарда и семейным положением: 1 - женатые; 2 - неженатые
Конкретные пути благотворного влияния семейной жизни не установлены. Возможно, речь идет о благоприятной психоэмоциональной обстановке, сглаживании стрессовых ситуаций. Следует подумать также об особенностях функции желез внутренней секреции.
8.6.4. ВЛИЯНИЕ НА ПРОЦЕСС СТАРЕНИЯ ЭНДОЭКОЛОГИЧЕСКОЙ СИТУАЦИИ
С понятием экология мы связываем обычно совокупность абиоло-гических(тических) и биологических(тических) факторов, действующих на организм в среде его обитания, т.е. внешние условия жизни. Но сходные по своей природе факторы, например микробные, могут действовать на организм и изнутри. Действительно, определенные штаммы бактерий, обитающие в кишечнике, являются обязательными симбионтами животных и человека, причем им принадлежит важная роль в осуществлении ряда функций (обмен витаминов и др.). Все это дает основание судить об эндоэкологии организма.
В последние десятилетия технические возможности позволяют, с одной стороны, получать и содержать животных, полностью лишенных обычной для них внутренней микрофлоры (гнотобионты), а с другой - произвольно заселять тот же кишечный тракт специальными штаммами бактерий. Есть данные, указывающие на увеличение средней и максимально регистрируемой продолжительности жизни безмикробных животных и замедлении скорости старения. Возможное объяснение этому факту кроется в особенностях функционирования иммунной системы.
8.7. гипотезы, объясняющие механизмы старения
Геронтология знает не менее 500 гипотез, объясняющих и первопричину, и механизмы старения организма. Подавляющее большинство их не выдержало проверки временем и представляет чисто исторический интерес. К ним, в частности, относятся гипотезы, связывающие старение с расходованием особого вещества клеточных ядер, страхом смерти, утратой некоторых невосполняемых веществ, получаемых организмом в момент оплодотворения, самоотравлением продуктами жизнедеятельности, токсичностью продуктов, образуемых под действием микрофлоры толстого кишечника. Гипотезы, представляющие научную ценность в наши дни, соответствуют одному из двух главных направлений.
Некоторые авторы рассматривают старение как стохастический процесс возрастного накопления «ошибок», неизбежно случающихся в ходе обычных процессов жизнедеятельности, а также повреждений биологических механизмов под действием внутренних (спонтанные мутации) или внешних (ионизирующее облучение) факторов. Стохастичность обусловлена случайным характером изменений во времени и локализации в организме. В различных вариантах гипотез данного направления первостепенная роль отводится разным внутриклеточным структурам, от первичного повреждения которых зависят функциональные расстройства на клеточном, тканевом и органном уровнях. Прежде всего, это генетический аппарат клеток (гипотеза соматических мутаций).
Многие исследователи связывают начальные изменения старения организма с изменениями строения и, следовательно, физико-химических и биологических свойств макромолекул: ДНК, РНК, белков хроматина, цитоплазматических и ядерных белков, ферментов. Особо выделяют также липиды клеточных мембран, часто повреждаемые свободными радикалами. Сбои в работе рецепторов, в частности, клеточных оболочек, нарушают эффективность регуляторных механизмов, что приводит к рассогласованию процессов жизнедеятельности.
К рассматриваемому направлению относятся также гипотезы, усматривающие первооснову старения в нарастающем с возрастом износе структур в диапазоне от макромолекул до организма в целом, приводящем в конце концов к состоянию, не совместимому с жизнью. Такое представление, однако, слишком прямолинейно. Напомним, что возникновению и накоплению мутационных изменений в ДНК противостоят природные антимутационные механизмы, а вредные последствия образования свободных радикалов снижаются благодаря функционированию антиоксидантных механизмов. Таким образом, если «концепция износа» биологических структур правильно отражает сущность старения, то итог в виде большей или меньшей скорости старческих изменений возраста, в котором у разных людей эти изменения становятся очевидными, является следствием наложения разрушительных и защитных процессов. В этом случае гипотеза износа с неизбежностью включает в себя такие факторы, как генетическая предрасположенность, условия и даже образ жизни, от которых, как мы видели, зависит скорость старения.
Второе направление представлено генетическими или программными гипотезами, согласно которым процесс старения находится под прямым генетическим контролем. Контроль, согласно одним взглядам, осуществляется с помощью специальных генов (см. раздел 8.6.1).
По другим взглядам, он связан с наличием специальных генетических программ, как это имеет место в отношении других стадий онтогенеза, например, эмбриональной.
В пользу запрограммированности старения приводят доказательства, многие из которых уже рассмотрены в п. 8.6.1. Обычно также ссылаются на наличие в природе видов, у которых вслед за размножением бурно нарастают изменения, приводящие животных к гибели. Типичный пример - тихоокеанские лососи (кета, нерка, горбуша), погибающие после нереста. Пусковой механизм в этом случае связан с изменением режима секреции половых гормонов, что следует рассматривать как особенность генетической программы индивидуального развития лососевых, отражающей их экологию, а не как универсальный механизм старения. Примечательно, что кастрированная горбуша не нерестится и живет в 2-3 раза дольше. Именно в эти дополнительные годы жизни следует ожидать появления признаков старения в клетках и тканях.
Некоторые программные гипотезы основаны на допущении, что в организме функционируют биологические часы, в соответствии с которыми происходят возрастные изменения. Роль «часов» приписывают, в частности, вилочковой железе, прекращающей функционирование при переходе организма в зрелый возраст. Еще один кандидат - это нервная система, особенно некоторые ее отделы (гипоталамус, симпатическая нервная система), главным функциональным элементом которой являются первично стареющие нервные клетки. Допустим, что прекращение в определенном возрасте функций тимуса, что, несомненно, находится под генетическим контролем, становится сигналом начала старения организма. Это, однако, не означает генетического контроля процесса старения. В отсутствие тимуса ослабляется иммунологический контроль аутоиммунных процессов. Но для того чтобы эти процессы пошли, необходимы либо мутантные лимфоциты (повреждения ДНК), либо белки с измененной структурой и антигенными свойствами.
Генетические программы, в том числе и индивидуального развития, - всегда результат эволюции, закрепляемый в генофонде вида вследствие естественного отбора. На первый взгляд, естественный отбор должен благоприятствовать увеличению продолжительности жизни. В связи с этим приобретение видом в ходе эволюции генетической программы старения, обусловливающего неизбежность смерти, представляется маловероятным. Рассмотрим следующий пример. В природных условиях в первый год жизни сохраняется в живых лишь 1/4 синиц каждого поколения. По истечении 2-го года от поколения остаются еди-
ницы, если это вообще происходит. В лабораторных условиях птицы достигают 9-летнего возраста. В таком случае практически невозможно объяснить, в силу каких обстоятельств естественный отбор мог формировать генетическую программу саморазрушения организма в процессе старения, рассчитанную на 7-8 лет жизни, которые синицами не проживаются.
Изложенное выше не исключает зависимости скорости старения и времени наступления старческих изменений от генетических факторов, однако этими факторами не являются специальные гены или программа. Рассмотрим еще один пример. Типичный признак хореи Гентингтона - сильный тремор (дрожание) головы и конечностей (пляска святого Вит-та). Симптомы этого наследственного заболевания обычно появляются в возрасте 35-39 лет, причем у мужчин позднее, чем у женщин. Различие в сроках появления болезни объясняется особенностями эволюции мужского и женского генотипов. У мужчин, имеющих по сравнению с женщинами большую продолжительность репродуктивного периода, давление отбора против соответствующего признака угасает с возрастом более медленно. Неблагоприятное фенотипическое действие гена, лежащего в основе хореи Гентингтона, в юношеском и зрелом возрасте подавлялось благодаря присутствию в геноме генов-модификаторов
(см. п. 8.6.1).
Из представлений, складывающихся в последнее время и рассматривающих процесс старения как определяемый специальной программой, внимание привлекает гипотеза феноптоза (В.П. Скулачев). Автор гипотезы исходит из допущения, что, если в природе есть генетически определяемый физиологический механизм «самоубийства» на клеточном уровне (апоптоз), то вероятно, что аналогичный механизм существует и на уровне организма (феноптоз). Еще одно допущение, находящее подтверждение в результатах многочисленных научных исследований (см. 8.5.1), сводится к тому, что старение представляет собой запрограммированное ослабление с возрастом большой группы функций. В таком случае простейшим способом достижения указанного эффекта, безусловно характеризующего процесс старения, может быть уменьшение количества клеток, из которых состоят органы и структуры, функция которых при старении снижается. В целом представляется следующая последовательность событий: онтогенетические часы - повышение уровня АФК (активные формы кислорода, свободные радикалы) в митохондриях - преобладание апоптоза над пролиферацией клеток - уменьшение числа клеток в органах и структурах - ослабление
функций. Предположительно у млекопитающих супрахиазматическому ядру гипоталамуса отводится роль онтогенетических часов, эпифизу -роль органа, размножающего сигнал от супрахиазматического ядра, одному из гормонов эпифиза (мелатонину, уровень которого с возрастом закономерно снижается; мелатонин концентрируется в митохондриях и, возможно, существует внутримитохондриальный механизм, посредством которого мелатонин оказывает влияние на уровень АФК) -роль посредника между эпифизом и другими тканями.
Из двух принципиально различных направлений в объяснении старения как закономерной стадии онтогенеза в настоящее время большей популярностью пользуется представление, рассматривающее этот процесс как износ биологических структур, а не генетически предопределенное саморазрушение.
8.8. введение в биологию продолжительности жизни людей
Продолжительность жизни как житейская проблема связывается в нашем сознании обычно с геронтологией, т.е. с возможностью пережить период зрелости и дожить до преклонного возраста. На самом деле определенная вероятность умереть существует в любом возрасте. Это отражает, в частности, широкое использование наряду с видовой или максимальной зарегистрированной продолжительностью жизни такого показателя, как средняя продолжительность жизни. На рис. 8.91 приведена кривая дожития (интенсивности смертности) по возрастам для популяции людей.
Исключительный рост средней продолжительности жизни в экономически развитых странах в XX в. связан с повышением жизненного уровня, качества питания, жилья, медицинской помощи, улучшением санитарно-гигиенических и эпидемиологических условий. Можно сказать, что в основе демографической революции XX в. лежат социальные по своей природе факторы. Вместе с тем, несмотря на отмеченный рост средней продолжительности жизни людей, форма кривой дожития не меняется. Более того, такая же форма кривой воспроизводится в популяциях лабораторных животных, причем относящихся к разным типам животного царства (мышь, крыса, лошадь, головная вошь, плодовая муха).
Это означает, что продолжительность жизни, кроме условий существования, в немалой степени определяется биологическими факторами.
Они отражают особенности структурно-функциональной организации, индивидуального развития, объема приспособительных возможностей и в конечном счете выживаемость отдельных особей. Таким образом, продолжительность жизни отличается исключительной индивидуальной изменчивостью. Указанное свойство проявляется, в частности, в наличии иногда значительного разрыва в значениях средней и максимальной зарегистрированной продолжительности жизни. Так, один из рекордсменов среди долгожителей XX века японец Шигешио Изуми превысил 120-летний рубеж, тогда как средние показатели длительности жизни в Японии составляли 74,1 года для мужчин и 79,6 года для женщин.
8.8.1. СТАТИСТИЧЕСКИЙ МЕТОД ИЗУЧЕНИЯ ЗАКОНОМЕРНОСТЕЙ ПРОДОЛЖИТЕЛЬНОСТИ ЖИЗНИ
Закономерности изменений длительности жизни в историческом времени или от популяции к популяции по понятной причине невозможно изучать на одном отдельно взятом организме. Такие исследования проводят в популяциях с применением статистических методов. Еще в 1825 г. Б. Гомперц описал зависимость увеличения смертности от возраста людей или животных. Позже оказалось, что в отличие от популяций лабораторных животных, вымирающих в силу достаточно комфортных условий существования в точном соответствии с уравнением Гомперца, часть людей умирает вне зависимости от возраста по причине производственных, транспортных и бытовых травм, природных катастроф, неблагоприятных изменений экологии. Указанная особенность была учтена У. Мейкемом, дополнившим уравнение Гомперца слагаемым, не зависящим от возраста. Обобщенный закон Гомперца-Мейкема выглядит следующим образом:
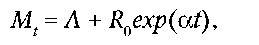
где Мt- интенсивность смертности (вероятность смерти) людей возраста t (доля ежегодно умирающих в заданном возрасте), А - фоновая компонента смертности, одинаковая для всех возрастных групп (слагаемое Мейкема), R0ехр(αt)-возрастная компонента смертности, отражающая экспоненциальный рост смертности с возрастом (слагаемое Гомперца).
Закон Гомперца-Мейкема описывает изменение вероятности смерти в интервале возрастов от 20 до 80 лет.
Одна из особенностей уравнения Гомперца-Мейкема заключается в том, что оно выделяет в общей смертности две части, которые различа-
ются по природе факторов, их определяющих. Вклад в конечное значение смертности первого слагаемого А определяется условиями жизни, тогда как вклад второго слагаемого R0ехр(αt) зависит от сопротивляемости (жизнеспособности) организма. Фоновая компонента смертности А является социально-контролируемой, а возрастная компонента R0ехр(αt) - социально-независимой. Соответственно, первую можно назвать социальной, вторую - биологической.
8.8.2. ВКЛАД СОЦИАЛЬНОЙ И БИОЛОГИЧЕСКОЙ КОМПОНЕНТ В ОБЩУЮ СМЕРТНОСТЬ В ИСТОРИЧЕСКОМ ВРЕМЕНИ И В РАЗНЫХ ПОПУЛЯЦИЯХ
Практическое применение закона Гомперца-Мейкема дает точное представление о природе факторов, обусловливающих различие в интенсивности смертности людей из разных популяций или же из одной популяции, но в разное историческое время. На рис. 8.96 показано, как изменялась общая смертность (1), а также социальная (2) и биологическая (3) ее компоненты в популяции 40-летних женщин Финляндии в интервале с 1890 по 1970 г., т.е. в период исключительного роста средней продолжительности жизни. Нетрудно видеть, что примерно 5-кратное
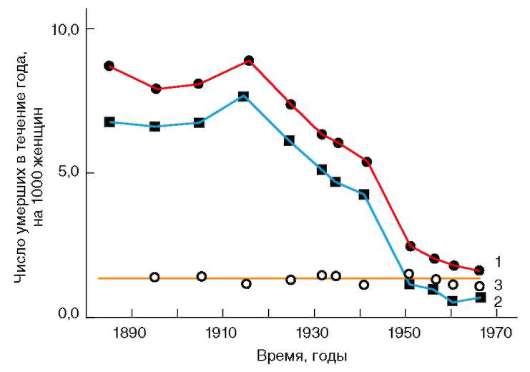
Рис. 8.96. Историческая динамика общей смертности и обеих ее компонент в популяции 40-летних женщин Финляндии (пояснения в тексте)
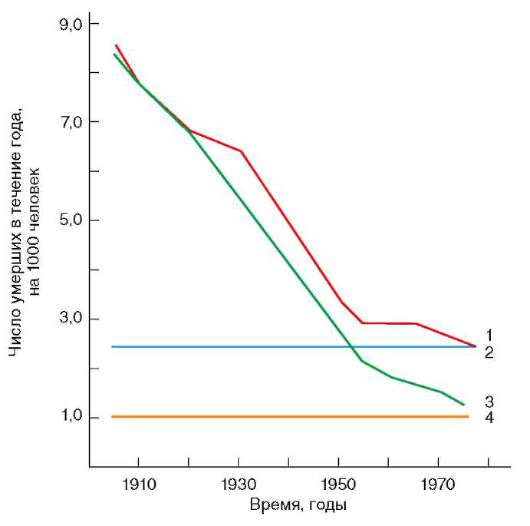
Рис. 8.97. Историческая динамика общей смертности и ее возрастной компоненты среди 40-летних мужчин и женщин (Италия, 1910-1970 гг.): 1 - общая смертность среди мужчин; 2 - возрастная компонента смертности среди мужчин; 3 - общая смертность среди женщин; 4 - возрастная компонента смертности среди женщин
снижение интенсивности смертности к 1970 г. полностью обусловлено уменьшением вклада социально-контролируемой компоненты. Ход кривых 1 и 2 практически совпадает. С другой стороны, доля возрастной компоненты, отражающая состояние биологических механизмов выживания, за описанный исторический период не менялась.
Из представленных материалов вытекают два важных практических следствия. Во-первых, увеличение продолжительности жизни финок целиком связано с повышением жизненного уровня, улучшением социально-гигиенических условий, ростом эффективности профилактической и лечебной медицины. Во-вторых, дальнейшее увеличение длительности жизни в описываемой популяции не может быть достигнуто путем изменения социально-контролируемых факторов. Справедливость второго следствия подтверждается незначительным приростом средней
продолжительности жизни среди населения Финляндии в последующее десятилетие. Так, если за 1969-1977 гг. названный показатель составлял для женщин Финляндии примерно 76,1 года, то в 1980 г. - 77,6 года.
Значение биологической компоненты в определении длительности жизни видно из сопоставления ее вклада в интенсивность смертности мужчин и женщин из итальянской популяции (рис. 8.97). Как и в предыдущем примере, за выбранный исторический период отмечается существенное снижение интенсивности общей смертности, причем и у мужчин, и у женщин. Достигнутый к середине 70-х гг. итог для женщин оказался выше, чем для мужчин, за счет биологических особенностей женского организма, что и нашло отражение в уровне возрастной компоненты смертности. Действительно, в 1978 г. средняя продолжительность жизни итальянок составляла 77,4 года, тогда как итальянцев - 70,7. Из материалов по итальянской популяции следует также, что дальнейшее приращение длительности жизни как мужчин, так и женщин требует воздействия на биологические механизмы выживания.
Различия в средней продолжительности жизни мужчин и женщин колеблются от популяции к популяции. Так, в США (1979), Финляндии и Франции (1980) они превышали 8 лет, тогда как в Греции (1981) составляли 4,5 года, а в Болгарии и Японии (1981) -5,5 года. О зависимости возрастной компоненты общей смертности от биологических механизмов свидетельствуют межпопуляционные колебания ее значений в различных европейских странах, в которых достигнут примерно одинаковый уровень жизни (рис. 8.98).
Вопросы для самоконтроля
1. Назовите основные концепции эмбрионального развития и в чем состоит их суть.
2. Перечислите клеточные механизмы онтогенетического развития. Охарактеризуйте их роль в нормальном развитии и при формировании аномалий и пороков.
3. Как осуществляется детерминация и дифференцировка в ходе онтогенеза? Проиллюстрируйте изменение потенций клеточных групп в процессе развития.
4. Каковы интегративные механизмы развития? Какова их роль и на каких этапах онтогенеза они действуют?
5. Как осуществляется контроль развития? Какие группы генов и на каких этапах развития участвуют в процессе контроля?
Рис. 8.98. Картограмма значений возрастной компоненты смертности 40-летних мужчин на территории Западной и Центральной Европы: 1 - низкий уровень (0,00160 год-1), 2 - пониженный уровень (0,00161-0,002220 год-1), 3 - средний уровень (0,00221-0,00280 год-1), 4 - повышенный уровень (0,00281-0,00340 год-1), 5 - высокий уровень (свыше 0,00341 год-1)
6. Что такое морфогенез и какие сформулированы концепции для объяснения его механизмов?
7. В чем биологическое значение репарации в онтогенетическом развитии? Какие известны виды и механизмы репарации?
8. Что представляет собой старение? Каковы характеристики и проявления этого процесса и методы его оценки?
9. Какие факторы влияют на процесс старения?
10. Какие гипотезы, объясняющие механизмы старения, существуют и в чем их суть?