Биохимия : руководство к практическим занятиям : учебное пособие / Под ред. проф. Н.Н. Чернова. - 2009. - 240 с. : ил.
|
|
|
|
РАЗДЕЛ 2. СЛОЖНЫЕ БЕЛКИ, НУКЛЕИНОВЫЕ КИСЛОТЫ И ФЕРМЕНТЫ
ВВЕДЕНИЕ
Как уже было сказано во введении к разделу 1, сложные (конъюгированные) белки состоят из белковой и небелковой частей. В качестве небелковой части (простетической группы) сложных белков могут выступать различные химические соединения, что находит отражение в классификации данной группы биологических соединений (хромопротеины, нуклеопротеины и т. д.).
Хромопротеины содержат окрашенную простетическую группу. Различают окрашенные в красный цвет гемопротеины (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза) и окрашенные в желтый цвет флавопротеины (ферменты класса оксидоредуктаз, содержащие производные рибофлавина).
Нуклеопротеины в качестве простетической группы содержат ДНК или РНК, что объясняет их участие в экспрессии генов и биосинтезе белка.
Липопротеины содержат такие липиды, как триацилглицеролы, свободные жирные кислоты, эфиры холестерина, фосфолипиды, и отличаются друг от друга процентным содержанием белка и плотностью. Липопротеины встречаются как в свободном виде (ЛП плазмы крови), так и в структурированном (в составе клеточных и внутриклеточных мембран).
Фосфопротеины участвуют в процессе эмбриогенеза. Это такие белки, как казеиноген молока, вителлин и фосвитин куриного желтка, ихтулин икры рыб. Известно, что фосфорилирование-дефосфорилирование белков и ферментов - способ изменения их функциональной активности.
Гликопротеины являются объектом интенсивного исследования, что объясняется многообразием их строения и выполняемых функций. Это гликоконъюгаты, к которым относят большинство
белковых гормонов, антитела (иммуноглобулины), белки плазмы крови и молока, интерфероны, факторы комплемента, рецепторные белки.
Металлопротеины представляют собой белки, в состав которых входят ионы металла (железа, меди, кобальта, марганца, молибдена, цинка, магния, кальция и др.). Типичные представители металлопротеинов, содержащих негемовое железо, - это ферритин и трансферрин.
Нуклеиновые кислоты относят к высокомолекулярным соединениям, состоящим из пуриновых и пиримидиновых оснований, остатков рибозы (или дезоксирибозы) и фосфорной кислоты. Данный класс соединений выполняет функцию хранения и передачи наследственной информации, а структурные компоненты нуклеиновых кислот (нуклеотиды) входят в состав коферментов (НАД+, ФАД, КоА), являются макроэргическими соединениями (АТФ, УТФ, ЦТФ, ГТФ, ТТФ) и вторичными посредниками (цАМФ, цГМФ) в передаче внутриклеточного сигнала.
Изучение ферментов (энзимов) выделено в отдельную науку - энзимологию. Все ферменты имеют белковую природу, чем объясняются их свойства (термолабильность, зависимость активности от рН среды, высокоспецифичное действие по отношению к реагирущим веществам - субстратам ферментативной реакции). Ферменты являются биокатализаторами, т.е. ускоряют химические реакции (такой способностью обладают еще только некоторые РНК, которые называют рибозимами). Активность ферментов выражают в каталах (количество фермента, которое превращает 1 моль субстрата за 1 с), а также в международных единицах (Е) (количество фермента, превращающего 1 мкмоль субстрата за 1 мин). Все изученные ферменты включены в особый каталог (классификация ферментов - КФ) и имеют свой классификационный номер, в котором первая цифра указывает на принадлежность к одному из шести классов ферментов:
1 - оксидоредуктазы;
2 - трансферазы;
3 - гидролазы;
4 - лиазы;
5 - изомеразы;
6 - лигазы (синтетазы).
Лабораторный практикум в рамках этой темы охватывает изучение влияния температуры на активность фермента и скорость хими-
ческой реакции (на примере амилазы), а также изучение специфических фермент-субстратных отношений (амилаза - крахмал; щелочная фосфатаза - п-нитрофенилфосфат).
2.1. ДЕЙСТВИЕ АМИЛАЗЫ НА КРАХМАЛ. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА АКТИВНОСТЬ АМИЛАЗЫ
А. Действие амилазы на крахмал
Фермент амилаза (α-1,4-глюкан-4-глюканогидролаза, КФ: 3.2.1.1) осуществляет гидролиз крахмала через промежуточные продукты распада (декстрины) до мальтозы. Последняя под влиянием фермента мальтазы расщепляется на две молекулы глюкозы. В слюне содержатся амилаза и мальтаза, так что слюна способна расщеплять крахмал до глюкозы.
Основным источником амилазы в организме человека является поджелудочная железа, секретирующая фермент в кишечник, где происходит расщепление поступающего с пищей крахмала.
Цель работы
Определить время полного расщепления крахмала амилазой слюны.
Принцип метода
Нерасщепленный крахмал с йодом дает синее окрашивание, а декстрины, в зависимости от размера молекул, дают с йодом последовательно фиолетовую, красно-бурую, оранжевую окраску, тогда как мальтоза и глюкоза окрашивания с йодом не дают. Таким образом, можно следить за скоростью расщепления крахмала по реакции с йодом. Активность амилазы в слюне не имеет большого физиологического значения и может значительно различаться у разных людей.
Выполнение работы
В девять пробирок наливают по 2 мл дистиллированной воды и добавляют по 1 капле 1%-ного раствора йода. Отдельно в стаканчик наливают 5 мл 0,5%-ного раствора крахмала. Из стаканчика берут пробу (1 каплю), вносят в первую пробирку и перемешивают, в результате чего раствор в пробирке окрашивается в синий цвет. В стаканчик быстро вносят 5 капель слюны, энергично перемешивают и замечают по секундомеру время. Через 20 с берут из стаканчика пробу
(1 каплю) и вносят во вторую пробирку. Если жидкость в пробирке станет фиолетовой или красной, то пробы из стаканчика нужно отбирать и вносить в пробирки через каждые 20 с. Если жидкость в пробирке ? 2 окрасится в синий цвет, то пробы следует отбирать через более длительные интервалы времени, например через 1 мин. Когда в одной из пробирок цвет раствора йода не изменится, гидролиз крахмала считают законченным. Фиксируют время, затраченное на полное расщепление крахмала. Результаты опыта записывают в виде таблицы.
Номер пробирки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
Окраска жидкости |
Самостоятельное формулирование выводов
Б. Влияние температуры на активность амилазы
При увеличении температуры скорость ферментативных реакций возрастает так же, как и скорость всех химических реакций: с повышением температуры на 10 оС скорость реакции увеличивается в 2-4 раза. В отличие от неферментативных процессов такое увеличение скорости ферментативных реакций наблюдается в узком интервале температур. Температура, при которой на графике зависимости скорости реакции от температуры наблюдается наибольшая скорость реакции, называется температурным оптимумом (обозначается tопт) и для ферментов теплокровных животных чаще всего лежит в пределах 37-40 оС. При более высоком значении температуры становится заметным влияние на фермент термической инактивации (тепловая денатурация белковой молекулы). Существенное падение скорости большинства ферментативных процессов наблюдается после достижения 42-50 оС.
Цель работы
Оценить скорость ферментативной реакции, катализируемой амилазой, при трех различных температурах и определить темпера- туру, при которой фермент наиболее активен.
Принцип метода
Образование окрашенного комплекса крахмала с йодом (см. предыдущую работу).
Выполнение работы
Для работы берут образец слюны, расщепляющей 5 мл крахмала примерно за 1 мин, по методике, описанной в предыдущей работе.
? | Реактивы и этапы | 0 оС | Комнатная температура | 100 оС | |
1 | В пробирки вносят 0,5%-ный раствор крах- мала. Доводят раствор крахмала до нужной температуры | 20 капель | 20 капель | 20 капель | |
2 | Добавляют раствор слюны, разведенной дистиллированной водой в 10 раз | 10 капель | 10 капель | 10 капель | |
3 | Перемешивают и инкубируют при нужной температуре | ||||
Окраска | |||||
4 | Через каждые 15 с отбирают из пробирок пробы по 3 капли и анализируют на предметном стекле, добавляя 1 каплю 1%-ного раствора йода и отмечая окраску | 15 с | |||
30 с | |||||
45 с | |||||
60 с | |||||
75 с | |||||
5 | Отмечают, в какой пробирке весь крахмал расщепляется быстрее | ||||
Самостоятельное формулирование выводов
Тестовые задания по теме
«Сложные белки и нуклеиновые кислоты»
1. Определите, верно ли утверждение.
1. Простетическая группа нуклеопротеинов представлена нуклеиновыми кислотами.
2. Углеводы не могут быть простетической группой сложных белков.
3. Фосфорная кислота в фосфопротеинах присоединяется к гидроксильным группам серина, треонина или тирозина.
4. Минорные основания чаще встречаются в составе тРНК.
5. Протамины и гистоны входят в состав нуклеопротеинов.
6. Миоглобин относят к хромопротеинам.
7. Белки отличаются от нуклеиновых кислот по своей химической структуре.
8. При денатурации белка может происходить разрыв водородных связей.
9. Нуклеиновые кислоты являются полинуклеотидами.
10. Молекулы дезоксирибозы и рибозы различаются количеством атомов углерода.
11. Нуклеопротеины входят в состав вирусов.
12. Флавопротеины относят к хромопротеинам.
13. В молекуле гемоглобина два типа субъединиц.
14. В нуклеотидах остаток рибозы присоединяется к азотистому основанию.
15. Ферритин является гемопротеином.
16. В оксигемоглобине железо двухвалентно.
17. В состав молекулы РНК входит тимин.
18. Псевдоуридин - это минорное азотистое основание.
19. Сложные белки могут выполнять каталитические функции в организме.
20. Гликозаминогликаны (мукополисахариды) являются сложными белками.
21. ЛПНП характеризуются высоким содержанием холестерина.
22. Серповидно-клеточная анемия связана с изменением первичной структуры гемоглобина.
23. В молекуле тимина есть свободная метильная группа.
24. Гистоны и протамины относят к сложным белкам.
2. Выберите правильный ответ.
Фетальный гемоглобин содержит Простетической группой гликопро-
полипептидные цепи теинов может быть
1) только альфа 1) галактоза
2) только бета 2) глюкозамин
3) альфа и бета 3) глюкуроновая кислота
4) альфа и гамма 4) нейраминовая кислота
5) только гамма 5) все вышеперечисленные
соединения
Первичную структуру Интерфероны - это молекулы
нуклеиновых кислот 1) простых белков и гликопро-
формируют связи теинов
1) ионные 2) одноцепочечной РНК
2) гидрофобные 3) двухцепочечной РНК
3) водородные 4) фосфопротеинов
4) пептидные 5) гемопротеинов
5) сложноэфирные
3. Установите соответствие между названием белка и строением белковой молекулы.
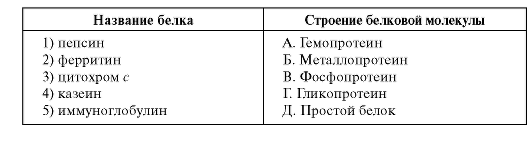
2.2. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ЩЕЛОЧНОЙ ФОСФАТАЗЫ В СЫВОРОТКЕ КРОВИ С П-НИТРОФЕНИЛФОСФАТОМ
Щелочная фосфатаза содержится в тканях и крови. Она катализирует гидролиз эфиров ортофосфорной кислоты и в норме поступает в кровь из печени, костной ткани, селезенки, почек, тонкого кишеч- ника и плаценты.
Клинико-диагностическое значение
В клинической практике обычно определяют активность щелочной фосфатазы в сыворотке крови. Активность возрастает при тяжелом рахите, заболеваниях печени (механическая желтуха, острые гепатиты, циррозы), различных заболеваниях костной системы и снижается при хроническом гломерулонефрите, квашиоркоре, гипотиреозе и цинге.
Цель работы
Определить активность щелочной фосфатазы в сыворотке крови и сравнить полученный результат с нормой.
Принцип метода
Щелочная фосфатаза катализирует гидролиз моноэфиров ортофосфорной кислоты. В качестве субстрата используют бесцветный
раствор и-нитрофенилфосфата. В результате реакции образуется n-нитрофенол, имеющий в щелочной среде желтую окраску. В ка- честве буфера используют
Реакция протекает по уравнению:
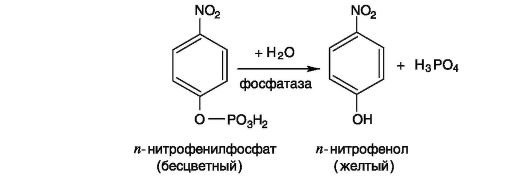
Выполнение работы (см. Приложение 9.2)
? | Реактивы и этапы | Опыт | Контроль |
1 | 1,0 | 1,0 | |
2 | Вода дистиллированная, мл | - | 0,05 |
3 | Выдерживают 5 мин при температуре 37 ?С в термостате | ||
4 | Сыворотка крови, мл | 0,05 | - |
5 | Тщательно перемешивают, замечают время и инкубируют ровно 5 мин при температуре 37 ?С в термостате | ||
6 | Раствор NaOH ( | 1,5 | 1,5 |
7 | Фотометрируют против Н2О (λ = 405 нм, толщина кюветы | ||
8 | Dш - Dk | ||
Расчеты
Активность щелочной фосфатазы в Е/л (международные единицы активности, мкмольмин-1.л-1) рассчитывают по формуле:

Норма (взрослые): при температуре анализа 25 ?С - 40-170 Е/л, при температуре анализа 37 ?С - 70-270 Е/л.
У детей определение активности щелочной фосфатазы не имеет диагностического значения.
Самостоятельное формулирование выводов
Тестовые задания по теме «Ферменты»
1. Определите, верно ли утверждение.
1. Специфичность действия сложных ферментов определяется коферментом.
2. Активный центр фермента состоит из субстратсвязывающего и каталитического участков.
3. Скорость ферментативной реакции не зависит от концентрации субстрата.
4. Ферменты ускоряют протекание как прямой, так и обратной реакции.
5. Скорость ферментативной реакции всегда увеличивается с увеличением рН среды.
6. Пепсин обладает абсолютной специфичностью действия.
7. В процессе ферментативной реакции всегда происходит образование фермент-субстратного комплекса.
8. Скорость ферментативного процесса зависит от количества присутствующего фермента.
9. На активность фермента влияют ионы тяжелых металлов.
10. Ферменты можно разделить методом высаливания сульфатом аммония.
11. Известны ферменты, обладающие стереоспецифичностью действия.
12. Действие некоторых лекарственных препаратов связано с ингибированием отдельных ферментов.
13. Все ферменты состоят из субъединиц.
14. Константа Михаэлиса выражается в единицах концентрации субстрата.
15. Изоферменты катализируют одну и ту же химическую реакцию.
16. Первая цифра в шифре фермента обозначает, к какому классу он относится.
17. В основе классификации ферментов лежит тип катализируемой реакции.
18. Изоферменты имеют различную электрофоретическую подвижность.
19. Лигазы осуществляют расщепление соединений по двойным связям.
20. Существуют мультиферментные комплексы.
21. Константа Михаэлиса изменяется в присутствии конкурентного ингибитора.
22. Скорость ферментативной реакции можно измерять по изменению свойств молекулы кофермента.
23. Ингибирование фермента всегда необратимо.
24. Препараты очищенных ферментов используют в терапевтических целях.
2. Выберите иравильный ответ.
Обратимость ферментативной К классу оксидоредуктаз
реакции зависит не относят фермент
1) от температуры 1) каталазу
2) от ионной силы раствора 2) пероксидазу
3) от термодинамического 3) амилазу состояния системы 4) аскорбатоксидазу
4) от концентрации фермента 5) лактатдегидрогеназу
5) от величины рН
Фермент, не относящийся Конкурентные ингибиторы
к гидролазам, - это 1) повышают КМ фермента
1) амилаза 2) понижают КМ фермента
2) трипсин
3) каталаза
4) холинэстераза 5)пепсин
3) повышают Vmax
4) понижают Vmax
5) не изменяют КМ и Vmax
3. Установите соответствие между тииом ингибирования ферментативной реакции и его графическим изображением.
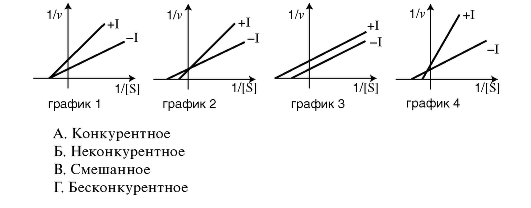
2.3. КОЛЛОКВИУМ ПО ТЕМЕ «СЛОЖНЫЕ БЕЛКИ, НУКЛЕИНОВЫЕ КИСЛОТЫ И ФЕРМЕНТЫ»
Вопросы для самостоятельной подготовки
1. Сложные белки и их классификация (примеры).
2. Нуклеопротеины: распространение в организме, биологическая роль. Химический состав нуклеопротеинов. Способы выделения ДНК из клеток.
3. Хромопротеины. Биологическая роль. Структура гемоглобина. Гемоглобинозы и гемоглобинопатии.
4. Структура молекулы гемоглобина. Кооперативность действия субъединиц во взаимодействии с кислородом. Аллостерическая регуляция.
5. Фосфопротеины, биологическая роль. Характер связи фосфорной кислоты в фосфопротеинах.
6. Химическое строение и структура нуклеиновых кислот. Первичная, вторичная и третичная структуры ДНК.
7. Рибосомные, информационные и транспортные РНК. Их строение, локализация в клетке и биологическая роль.
8. Биологические катализаторы. Рибозимы. Ферменты.
9. Понятие о коферментах. Связь коферментов с витаминами.
10. Понятие об активных центрах ферментов: каталитические и регуляторные центры. Аллостерические эффекторы. Активаторы и ингибиторы ферментов.
11. Общие свойства ферментов: термолабильность, рН-зависимость, специфичность действия. Единицы ферментативной активности.
12. Зависимость между концентрацией субстрата и скоростью ферментативных реакций. Понятие о константе Михаэлиса.
13. Типы ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное ингибирование.
14. Изоферменты и их значение для энзимодиагностики.
15. Классификация ферментов. Характеристика каждого класса ферментов (примеры).
16. Способы внутриклеточной регуляции действия ферментов.
17. Примеры использования ферментов в медицине.
Варианты письменной части коллоквиума
1. Сформулируйте краткое определение и приведите три примера белков класса
1) металлопротеинов
2) гемопротеинов
3) фосфопротеинов
4) флавопротеинов
2. Соедините в динуклеотид
1) ЦМФ и ГМФ
2) дЦМФ и ТМФ
3) дАМФ и ТМФ
4) АМФ и ГМФ
3. Укажите, как можно разделить
1) белки и нуклеиновые кислоты
2) лизин и АТФ
3) мРНК и тРНК
4) нуклеотиды и нуклеозиды
4. Сформулируйте определение
1) константы Михаэлиса
2) минорных оснований
3) талассемий
4) аллостерических эффекторов
5. Укажите, чем отличаются
1) ЛПОНП, ЛПНП и ЛПВП
2) НbА, HbF, HbS и HbM
3) синтазы и синтетазы
4) мРНК, рРНК и тРНК
6. Объясните изменение ферментативного действия на примере
1) изоферментов
2) фосфорилирования/дефосфорилирования
3) регуляции по типу обратной связи
4) конкурентного типа ингибирования
Варианты заданий компьютерного тестирования
Инструкция к тесту. Выберите все правильные ответы.
1. Фермент амилазу относят
1) к оксидоредуктазам
2) к гидролазам
3) лиазам
4) синтетазам
5) изомеразам
2. Смесь ферментов нельзя разделить методом
1) высаливания
2) диализа
3) гель-фильтрации
4) электрофореза
5) ионообменной хроматографии
3. Превращение альдоз в кетозы катализирует фермент из класса
1) оксидоредуктаз
2) трансфераз
3) гидролаз
4) изомераз
5) лиаз
4. Холинэстераза гидролизует связи
1) сложноэфирные
2) гликозидные
3) пептидные
4) дисульфидные
5) водородные
5. Молекула гема состоит из производных
1) пиррола
2) пурина
3) пиримидина
4) имидазола
5) пиридина
6. Активировать ферменты может
1) ингибитор
2) аллостерический активатор
3) продукт реакции
4) кофактор
5) изменение рН
7. Один катал - это
1) количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях
2) число молекул субстрата, превращающихся на 1 молекуле фермента за 1 с
3) число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента
4) количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях
5) активность фермента по отношению к наилучшему субстрату
8. Участку ДНК ГТАЦАГ будет комплементарна последовательность
РНК
1) ЦУГУАЦ
2) ЦАУГУЦ
3) ЦТГТАЦ
4) ЦАТГТЦ
5) ГАЦАТГ
9. Нуклеотидом является
1) аденин
2) аденозингидролаза
3) цитидин
4) прион
5) аденозинмонофосфат
10. Для молекулы ДНК неверно, что
1) А+Ц = Г+Т
2) А = Т
3) Г = Ц
4) А+Т = Г+Ц
5) Г+А = Ц+Т
11. Молекула гемоглобина - это
1) мономер
2) димер
3) тример
4) тетрамер
5) гексамер
12. Необратимая модификация фермента происходит
1) при аллостерической регуляции
2) при конкурентном ингибировании
3) при активации проферментов
4) при неконкурентном ингибировании
13. Фермент каталазу относят
1) к оксидоредуктазам
2) к трансферазам
3) к лиазам
4) к гидролазам
5) к изомеразам
14. С активным центром фермента не связывается
1) субстрат
2) продукт
3) кофермент
4) конкурентный ингибитор
5) аллостерический эффектор
15. Общее число субъединиц в лактатдегидрогеназе
1) две
2) три
3) четыре
4) шесть
5) восемь
16. Неокрашенный белок - это
1) пепсин
2) каталаза
3) миоглобин
4) гемоглобин
5) цитохром с
17. Простетические группы гликопротеинов - это
1) галактоза
2) глюкозамин
3) глутаминовая кислота
4) аспарагиновая кислота
5) нуклеиновая кислота
18. Активировать апофермент может
1) субстрат
2) аллостерический активатор
3) продукт реакции
4) кофермент
5) изменение рН
19. Нуклеиновые кислоты отличаются от белков тем, что
1) это высокомолекулярные соединения
2) имеют сложную пространственную структуру
3) поглощают свет в УФ области спектра
4) состоят из мономеров
5) не содержат аминокислотных остатков
20. Одна международная единица ферментативной активности - это
1) количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях
2) число молекул субстрата, превращающихся на 1 молекуле фермента за 1 с
3) число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента
4) количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях
5) активность фермента по отношению к наилучшему субстрату
21. Нуклеозидом является
1) цитозин
2) урацил
3) тимин
4) гуанозин
5) аденозинтрифосфат
22. Серповидно-клеточная анемия связана с заменой в молекуле гемоглобина
1) глу на вал
2) глу на асп
3) вал на лей
4) вал на цис
5) гли на асп
23. Аллостерический эффектор
1) конкурирует с субстратом за связывание в активном центре
2) связывается с участком молекулы фермента, отличным от активного центра
3) изменяет образующийся продукт реакции
4) активирует или ингибирует фермент
24. Конкурентные ингибиторы
1) повышают КМ фермента
2) понижают КМ фермента
3) повыщают Vmax
4) понижают
5) не изменяют КМ и Vmax
25. Специфичность сложных ферментов определяется
1) коферментом
2) апоферментом
3) аллостерическим эффектором
4) всеми вышеперечисленными факторами
26. К классу оксидоредуктаз не относят фермент
1) каталазу
2) пероксидазу
3) холинэстеразу
4) аскорбатоксидазу
5) лактатдегидрогеназу
27. Молекулярная активность (число оборотов) фермента - это
1) количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях
2) количество молекул субстрата, превращающихся на 1 молекуле фермента за 1 с
3) число единиц активности фермента, приходящееся на 1 мг белка
в препарате фермента
4) количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях
5) активность фермента по отношению к наилучшему субстрату
28. Изменение рН среды может сопровождаться
1) разрывом пептидных связей в молекуле фермента
2) изменением суммарного заряда молекулы фермента
3) изменением заряда субстрата
4) диссоциацией молекулы фермента
5) денатурацией фермента
29. Интерфероны - это молекулы
1) простых белков или гликопротеинов
2) одноцепочечной РНК
3) двухцепочечной РНК
4) гликолипидов
5) гемопротеинов
30. При тепловой денатурации (плавлении) ДНК пик поглощения в УФ-спектре при 260 нм
1) не изменяется
2) уменьшается
3) увеличивается
4) сдвигается в коротковолновую область
5) сдвигается в длинноволновую область
31. Первичную структуру нуклеиновых кислот формируют
1) ионные связи
2) гидрофобные взаимодействия
3) водородные связи
4) пептидные связи
5) гликозидные и сложноэфирные связи
32. Генетический код
1) одинаков у всех организмов
2) одинаков в пределах вида
3) разный у разных организмов
4) строго индивидуален
5) разный у растений и животных
33. Фетальные гемоглобины содержат полипептидные цепи
1) только альфа
2) только бета
3) альфа и бета
4) альфа и гамма
5) только гамма
34. Скорость ферментативной реакции повышается
1) при уменьшении температуры
2) при увеличении количества фермента
3) при денатурации фермента
4) при недостатке кофермента
5) при добавлении специфического активатора
35. Конкурентное ингибирование снимается
1) повышением температуры
2) добавлением продукта реакции
3) избытком субстрата
4) ионами тяжелых металлов
36. Ферменты увеличивают скорость реакции
1) повышая энергию активации реакции
2) уменьшая изменение свободной энергии (∆G) в ходе реакции
3) понижая энергию активации реакции
4) изменяя константу равновесия реакции
37. Оксидоредуктаза - это
1) амилаза
2) трипсин
3) каталаза
4) холинэстераза
5) пепсин
38. Каталитической активностью обладает
1) инсулин
2) миоглобин
3) казеин
4) пепсин
5) кератин
39. Гемопротеином не является
1) миоглобин
2) цитохром с
3) каталаза
4) гемоглобин
5) казеин
40. Обратимым может быть ингибирование
1) аллостерическое
2) конкурентное
3) неконкурентное
4) ретроингибирование
5) ингибирование продуктом реакции
41. Удельная активность фермента - это
1) количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях
2) число молекул субстрата, превращающихся на 1 молекуле фермента за 1 с
3) число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента
4) количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях
5) активность фермента по отношению к наилучшему субстрату
42. Минорным нуклеотидом природных нуклеиновых кислот не является
1) метилцитидинфосфат
2) оксиметилцитидинфосфат
3) дигидроуридинфосфат
4) псевдоуридинфосфат
5) уридинфосфат
43. Разные типы РНК различаются
1) первичной структурой
2) молекулярной массой
3) последовательностью нуклеотидов
4) функциями в клетке
44. Гетероциклическими являются кольца
1) пиримидиновое
2) пиридиновое
3) пуриновое
4) бензольное
5) имидазольное
45. Аллостерический регулятор гемоглобина - это
1) 1,3-бисфосфоглицериновая кислота
2) 2,3-бисфосфоглицериновая кислота
3) 1-фосфоглицериновая кислота
4) 2-фосфоглицериновая кислота
5) 3-фосфоглицериновая кислота
46. Если концентрация субстрата равна KM, то скорость реакции составляет
1) 0,25 Vmax
2) 0,33 VmaX
3) 0,50 VmaX
4) 0,67 VmaX
5) 0,75 Vmax
47. К гемопротеинам относят
1) пепсин
2) липазу
3) химотрипсин
4) цитохром Р450
5) казеин
48. К гемопротеинам относят
1) пепсин
2) коллаген
3) кератин
4) пероксидазу
5) эластин
49. К фосфопротеинам относят
1) пероксидазу
2) глутатион
3) казеин
4) альбумин
5) протамины
50. Низкомолекулярный пептид - это
1) пероксидаза
2) глутатион
3) казеин
4) альбумин
5) протамины
51. Низкомолекулярные пептиды - это
1) пероксидаза
2) брадикинин
3) казеин
4) альбумин
5) ангиотензин
52. Низкомолекулярные пептиды - это
1) эластин
2) каллидин
3) казеин
4) альбумин
5) аспартам
53. Низкомолекулярные пептиды - это
1) липаза
2) окситоцин
3) казеин
4) каталаза
5) вазопрессин
54. Регуляция активности ферментов в организме человека осуществляется
1) специфическим гидролизом пептидных связей (прицельным протеолизом)
2) с помощью белков-активаторов или белков-ингибиторов
3) путем отделения регуляторных субъединиц от каталитических
4) аденилированием молекулы фермента
5) фосфорилированием молекулы фермента
55. Ретроингибирование ферментов заключается
1) в связывании отдаленного продукта цепочки превращений с аллостерическим центром первого фермента
2) в денатурации фермента
3) в связывании с ферментом вторичного посредника
4) в связывании с ферментом продукта катализируемой этим ферментом реакции
5) в присоединении ингибитора к активному центру фермента
56. Аллостерический ингибитор может
1) быть продуктом реакции, катализируемой данным ферментом
2) вытеснять кофермент из активного центра
3) быть токсичным веществом
4) быть конечным продуктом цепочки последующих превращений
5) конкурентно ингибировать фермент
57. Окрашенной группой хромопротеинов может быть
1) галактозамин
2) пиридоксальфосфат
3) селен
4) гем
5) пальмитиновая кислота
58. N-ацетилнейраминовую кислоту содержат сложные белки
1) хромопротеины
2) гликопротеины
3) липопротеины
4) металлопротеины
5) нуклеопротеины
59. Окрашенной группой хромопротеинов может быть
1) галактоза
2) коэнзим А
3) магний
4) флавинмононуклеотид
5) фосфатидилхолин
Правильные ответы
1. 2
2. 2
3. 4
4. 1
5. 1
6. 2, 4, 5
7. 1
8. 2
9. 5
10. 4
11. 4
12. 3
13. 1
14. 5
15. 3
16. 1
17. 1, 2
18. 4
19. 5
20. 4
21. 4
22. 1
23. 2, 4
24. 1
25. 2
26. 3
27. 2
28. 2, 3, 4, 5
29. 1
30. 3
31. 5
32. 1
33. 4
34. 2, 5
35. 3
36. 3
37. 3
38. 4
39. 5
40. 1, 2, 3, 4, 5
41. 3
42. 5
43. 1, 2, 3, 4
44. 1, 2, 3, 5
45. 2
46. 3
47. 4
48. 4
49. 3
50. 2
51. 2, 5
52. 2, 5
53. 2, 5
54. 1, 2, 3, 4, 5
55. 1
56. 4
57. 4
58. 2
59. 4