Биохимия : руководство к практическим занятиям : учебное пособие / Под ред. проф. Н.Н. Чернова. - 2009. - 240 с. : ил.
|
|
|
|
РАЗДЕЛ 1. АМИНОКИСЛОТЫ И ПРОСТЫЕ БЕЛКИ
ВВЕДЕНИЕ
Белки - это высокомолекулярные соединения, молекулы которых построены из остатков аминокислот. Белки составляют основу структурных элементов клеток и тканей, а также выполняют многообразные жизненно важные функции (транспортную, защитную, регуляторную, каталитическую), обусловленные способностью молекул белков за счет своей уникальной пространственной конфигурации распознавать другие молекулы и взаимодействовать с ними.
Аминокислоты, кодируемые генетическим кодом и включающиеся в процессе трансляции в белки, называют протеиногенными. В основу современной классификации аминокислот положено химическое строение их радикалов. Каждая аминокислота имеет не только свое название (тривиальное и химическое), но и принятое трехбуквенное сокращение, а также латинский однобуквенный символ.
Следует отметить, что аминокислоты являются не только структурными элементами пептидов и белков, но и входят в состав других природных соединений (коферментов, конъюгированных желчных кислот, антибиотиков). Некоторые аминокислоты являются предшественниками биологически активных веществ (гормонов, биогенных аминов) или важнейшими метаболитами (глюконеогенез, биосинтез и деградация протеиногенных аминокислот, цикл моче- винообразования).
Белки условно делят на простые (при гидролизе образуют смесь аминокислот) и сложные, или конъюгированные (состоят из белкового и небелкового компонентов). В качестве небелковой части (просте- тической группы) конъюгированных белков могут выступать нуклеиновые кислоты, углеводы, липиды, металлы, пигменты, а также фосфорная кислота и коферменты.
Большинство методов анализа белков и аминокислот связаны с их физико-химическим свойствами, например с наличием определенных функциональных групп, размером и формой молекул, подвижностью в электрическом поле, различным распределением в системе подвижной и неподвижной фазы при разных видах хроматографии, способностью к поглощению в ультрафиолетовой области спектра.
В данном разделе предлагается провести цветные реакции, доказывающие разнообразную химическую природу аминокислот и белков, познакомиться с физико-химическими свойствами биополимеров на примере реакций осаждения и денатурации, провести количественное определение белков методом фотоэлектроколориметрии (биуретовый метод), а также осуществить разделение высокомолекулярных и низкомолекулярных соединений методом диализа.
Несомненно, что одной из наиболее универсальных и информативных методик, представленных в книге, является хроматография аминокислот на бумаге - метод, позволяющий разделять и анализировать состав смеси и количественные соотношения ее компонентов.
1.1. ПРОВЕРКА ЗНАНИЙ ПО ОРГАНИЧЕСКОЙ ХИМИИ
1. Определите, верно ли утверждение.
1. Кислород входит в состав углеводородов.
2. Фенол обладает кислыми свойствами.
3. Аминокислоты могут иметь гетероциклическую структуру.
4. Между молекулами органических кислот возможно образование сложноэфирной связи.
5. Глицерин относят к классу спиртов.
6. Кислые свойства дикарбоновых аминокислот обусловлены наличием карбоксильных групп.
7. Белки обладают свойствами амфотерных электролитов.
8. Структура белков и структура нуклеиновых кислот одинакова.
9. Сера может входить в состав белков.
10. Белки при растворении в воде образуют истинные растворы.
11. Синтез белка возможен в лабораторных условиях.
12. Все белки состоят из аминокислот.
2. Выберите правильный ответ.
Положительным зарядом К циклическим соединениям
может обладать не относят
1) карбоксильная группа 1) фенолы
2) аминогруппа 2) пиримидины
3) сульфгидрильная (тиольная) группа 3) стерины
4)гидроксильная группа 4)триацилглицеролы
5) амидная группа 5) пурины
3. Установите соответствие между химической формулой вещества и его принадлежностью к определенному классу соединений.
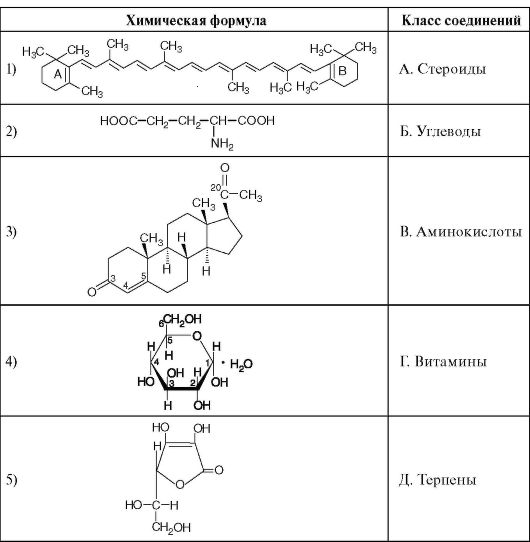
1.2. ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ. РЕАКЦИИ ОСАЖДЕНИЯ И ДЕНАТУРАЦИИ БЕЛКОВ
А. Цветные реакции на белки и аминокислоты
Белки - полимерные соединения, построенные из аминокислот, которые соединены между собой пептидными связями. Аминокислоты - это производные карбоновых кислот, у которых три валентности α-углеродного атома всегда заняты одним атомом водорода (-H), аминогруппой (-NH2) и карбоксильной группой (-COOH). Четвертая валентность может быть занята атомом водорода (глицин) или группировкой атомов, называемой радикалом (-R). В составе радикалов многие аминокислоты имеют реакционно-способные (функциональные) группы, например сульфгидрильную -SH (цистеин), тиометильную -S-CH3 (метионин), гидроксильную -ОН (серин, треонин, тирозин).
Цель работы
Провести цветные реакции с двумя растворами (I и II)*, один из которых содержит овальбумин (яичный белок), а другой - же- латину (овальбумин содержит все 20 аминокислот, а желатина только 17), и определить, в каком растворе - овальбумин, а в каком - желатина.
Принцип метода
Ряд химических реактивов специфически взаимодействуют с функциональными группами аминокислот (как свободных, так и в составе пептидов или белков), в результате чего развивается специфическое окрашивание. Такие реакции называют цветными реакциями. Интенсивность окраски в цветных реакциях пропорциональна количеству реагирующих функциональных групп. Поэтому цветные реакции могут быть использованы для качественного и количественного определения белков, для определения присутствующих в них аминокислот или для анализа состава белков. Например:
* Растворы I и II готовятся лаборантом по указанию преподавателя (белок одного куриного яйца разводят в 300 мл дистиллированной воды, фильтруют; используют 1%-ный раствор желатины).
1. с помощью биуретовой реакции определяют наличие пептидных групп в олигопептидах и в белках (универсальная реакция для любых белков);
2. с помощью нингидриновой реакции определяют наличие α-аминогрупп в свободных аминокислотах, а также в аминокислотах олигопептидов и белков (универсальная реакция для любых белков);
3. с помощью ксантопротеиновой реакции определяют наличие в белках ароматических аминокислот;
4. с помощью реакции Фоля определяют наличие в составе белков серосодержащей аминокислоты - цистеина.
Выполнение работы
Реакция | Номер пробирки | Ход работы | Окраска | Чем обусловлена реакция |
Биуретовая | 1 | Раствор I - 5 капель, 10%-ный раствор NaOH - 5 капель, 1%-ный раствор CuSO4 - 1 капля | ||
2 | Раствор II - 5 капель, 10%-ный раствор NaOH - 5 капель, 1%-ный раствор CuSO4 - 1 капля | |||
Нингидриновая | 1 | Раствор I - 5 капель, 1%-ный раствор нингидрина в ацетоне - 2 капли; нагревают | ||
2 | Раствор II - 5 капель, 1%-ный раствор нингидрина в ацетоне - 2 капли; нагревают | |||
Ксантопротеи- новая | 1 | Раствор I - 5 капель, HNO3 (конц.) - 3 капли; осторожно нагревают | ||
2 | Раствор II - 5 капель, HNO3 (конц.) - 3 капли; осторожно нагревают |
Окончание табл.
Реакция | Номер пробирки | Ход работы | Окраска | Чем обусловлена реакция |
Фоля | 1 | Раствор I - 5 капель, 30%-ный раствор NaOH - 5 капель, 5%-ный раствор (CH3COO)2Pb - 1 капля; нагревают до кипения | ||
2 | Раствор II - 5 капель, 30%-ный раствор NaOH - 5 капель, 5%-ный раствор (CH3COO)2Pb - 1 капля; нагревают до кипения |
Указанные цветные реакции можно проводить на четырех предметных стеклах*: на один край каждого стекла наносят 1 каплю раствора I, на другой - 1 каплю раствора II.
Биуретовая реакция. К белкам на первом стекле последовательно добавляют 1 каплю 10%-ного раствора NaOH и 1 каплю 1%-ного раствора CuSO4, аккуратно перемешивая стеклянной палочкой.
Нингидриновая реакция. К белкам на втором стекле добавляют 1 каплю раствора нингидрина, перемешивают и осторожно нагревают до кипения.
Ксантопротеиновая реакция. К белкам на третьем стекле добавляют 1 каплю концентрированной HNO3, перемешивают и осторожно нагревают.
Реакция Фоля. К белкам на четвертом стекле добавляют 1 каплю 30%-ного раствора NaOH и 1 каплю 5%-ного раствора (CH3OOO)2Pb. Нагревают до кипения.
Самостоятельное формулирование выводов
Б. Реакции осаждения и денатурации белков
Существуют белки растворимые и нерастворимые в воде. Коллоидные растворы белков относительно устойчивы. Эта устойчивость обусловлена тем, что белковые молекулы имеют одинаковый электрический заряд и упакованы так, что на их поверхности находится
* Параллельно преподаватель проводит демонстрационный опыт в пробирках, результаты которого студенты используют для оформления таблицы.
большое количество гидрофильных полярных групп. Вследствие этого вокруг белковой молекулы формируется плотная многослойная водная оболочка, называемая гидратной оболочкой. Гидрофобные радикалы аминокислот упрятаны внутрь глобулы.
Изменение зарядов белковых молекул и/или снятие гидратной оболочки приводит к агрегации белковых молекул и выпадению их в осадок. При нагревании молекулы белков денатурируют, т.е. теряют свою на- тивную структуру, разворачиваются, но остаются во взвешенном состоянии, что проявляется в помутнении разбавленного белкового раствора.
Реакции осаждения белков используют для экспресс-обнаружения белка в биологических жидкостях (например, в моче), для получения безбелковых растворов (например, при выделении ДНК из животных тканей), при разделении белковых фракций в процессе выделения и очистки белков.
Цель работы
Провести реакции осаждения белка (в работе используют раствор овальбумина), применяя различные воздействия.
Принцип метода
Для осаждения белка нужно лишить его стабилизирующих факторов: снять заряд, удалить гидратную оболочку или разрушить третичную структуру (вызвать денатурацию), используя различные хи- мические реагенты или нагревание.
Выполнение работы
? | Реакция осаждения белка | Ход работы* | Наблюдения | Чем обусловлена реакция |
1 | Нагреванием | В пробирку вносят 10 капель раствора яичного белка (см. предыдущую работу), нагревают | ||
2 | Концентрированными минеральными кислотами (азотная кислота) | В пробирку вносят 20 капель HNO3 (конц.), наклоняют пробирку под углом 45о и осторожно по стенке наслаивают на кислоту 20 капель раствора белка. Смотрят на просвет, перемешивают |
Окончание табл.
? | Реакция осаждения белка | Ход работы* | Наблюдения | Чем обусловлена реакция |
3 | Органическими кислотами [трихлоруксусная кислота (ТХУ)] | В пробирку вносят 10 капель раствора белка, добавляют 5 капель 10%-ного раствора ТХУ, перемешивают | ||
4 | Солями тяжелых металлов [сульфат меди(П)] | В пробирку вносят 5 капель раствора белка, прибавляют 1 каплю 7%-ного раствора CuSO4, перемешивают | ||
5 | Солями тяжелых металлов (нитрат серебра) | В пробирку вносят 5 капель раствора белка, прибавляют 2 капли 1%-ного раствора AgNO3, перемешивают | ||
6 | Органическими растворителями (ацетон) | В пробирку вносят 10 капель белка, прибавляют 20 капель ацетона, перемешивают |
*Если вместо пробирок используют предметные стекла, то на стекло наносят по 1 капле каждого требуемого реактива и перемешивают стеклянной палочкой.
Пояснение
1. Нагревание вызывает денатурацию белка, сопровождающуюся помутнением раствора.
2. Минеральные и органические кислоты вызывают дегидратацию и перезарядку части белковых молекул, сопровождающуюся их денатурацией.
3. Соли тяжелых металлов вызывают денатурацию белка, что обусловлено адсорбцией ионов металлов на поверхности белковой молекулы и образованием нерастворимого комплекса.
4. Органические растворители снимают гидратную оболочку и понижают устойчивость белка в растворе, но осадок выпадает только в нейтральных и слабокислых растворах. Длительное действие органического растворителя вызывает денатурацию белка.
Самостоятельное формулирование выводов
Тестовые задания по теме «Аминокислоты и простые белки»
1. Определите, верно ли утверждение.
1. Аспарагин содержит амидную группу.
2. Наличие электрических зарядов стабилизирует белковые молекулы в растворе.
3. Ксантопротеиновая реакция характерна для циклических аминокислот.
4. Смесь свободных аминокислот дает положительную нингидриновую реакцию.
5. Высаливание белков наиболее эффективно в изоэлектрической точке.
6. Аминокислота серин содержит свободную гидроксильную группу.
7. Валин, лейцин и изолейцин обладают гидрофобными свойствами.
8. Все белки растворимы в воде.
9. Пептидные связи разрываются при тепловой денатурации белка.
10. Смесь свободных аминокислот дает положительную биуретовую реакцию.
11. Орнитин входит в состав природных белков.
12. Метионин можно рассматривать как производное масляной кислоты.
2. Выберите правильный ответ.
К неполярным (гидрофобным) Биуретовая реакция
аминокислотам относят не дает окраски
1) серин 1) с простыми белками
2) треонин 2) с дипептидами
3) лизин 3) с трипептидами
4) валин 4) с альбуминами
5) цистеин 5) с желатиной
3. Установите соответствие между аминокислотой и входящим в ее состав радикалом.

1.3. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА БИУРЕТОВЫМ МЕТОДОМ. ПОСТРОЕНИЕ КАЛИБРОВОЧНОЙ КРИВОЙ
Определение концентрации белка проводят в научных учреждениях при изучении, выделении и очистке белков; в промышленности в процессе получения ферментов, пищевых белков, белковых лекарс- твенных препаратов; в медицинских биохимических лабораториях для оценки состояния печени и почек.
Существует много разных методов количественного определения белков. Среди них широкое распространение получили колориметрические методы, основанные на способности белков давать окра- шенные комплексы с рядом реактивов (цветные реакции). Среди этих методов наиболее распространены биуретовый метод и его модификация (метод Лоури*).
Цель работы
Освоить работу фотоэлектроколориметра (ФЭК). Научиться строить стандартные калибровочные кривые. Определить содержание белка в пробе с неизвестной концентрацией.
Принцип метода
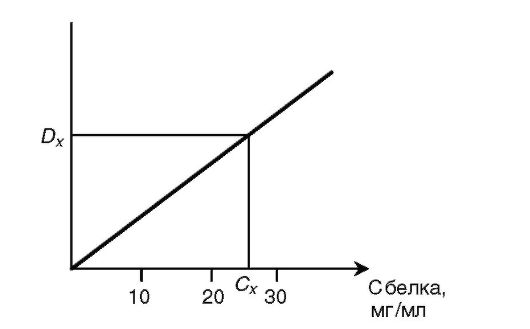
Биуретовый метод основан на образовании окрашенного в фиолетовый цвет комплексного соединения азота, входящего в состав пептидных связей белка, с ионами двухвалентной меди в щелочной среде (биуретовая реакция). Интенсивность развивающейся окраски раствора прямо пропорциональна концентрации белка и определяется фотометрически. Для количественного определения белка измеряют интенсивность окраски стандартных растворов белка с известной концентрацией (величину оптической плотности Dст). По полученным данным строят график зависимости оптической плотности ок- рашенных растворов от концентрации в них белка (стандартную калибровочную кривую). На оси ординат всегда откладывают величину D как функцию от задаваемых значений (см. рис. на с. 27).
Измеряют оптическую плотность Dх окрашенного раствора с неизвестной концентрацией белка и по стандартной кривой определяют
* Lowry O.H., Rosebrough N.J., Fair A.L., Rafndall R.Y. (1951) J.Biol.Chem., 193,
265-275.
в нем концентрацию белка. В качестве стандартного раствора белка обычно используют раствор сывороточного альбумина.
Выполнение работы
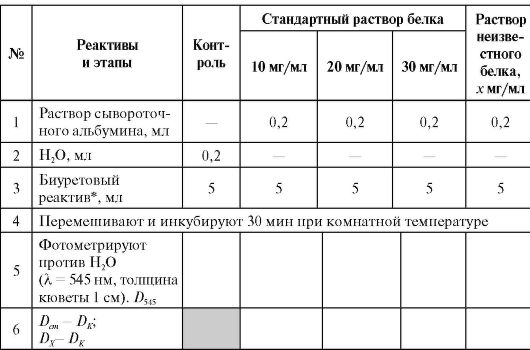
* Биуретовый реактив: исходный концентрат (медь сернокислая - 120 ммоль/л, калий иодистый - 300 ммоль/л, калий-натрий виннокислый - 320 ммоль/л, гидроксид натрия - 3 моль/л) разводят перед работой в соотношении 1:19.
Самостоятельное формулирование выводов
Тестовые задания по теме «Аминокислоты и простые белки»
1. Определите, верно ли утверждение.
1. Имидазольное кольцо гистидина содержит один атом азота.
2. N-концевая аминокислота в дипептиде гистидиллизин - это гистидин.
3. С-концевая аминокислота в трипептиде серилпролилглицин - это глицин.
4. Альбумины сыворотки крови выполняют транспортную функцию.
5. Пролин содержит иминогруппу.
6. Аспарагиновая кислота является производным янтарной кислоты.
7. Все пептиды дают положительную биуретовую реакцию.
8. Интенсивность окраски вещества в растворе зависит от его концентрации.
9. Белки можно разделить методом высаливания, используя сульфат меди(II) (сернокислую медь).
10. В организме человека встречаются аминокислоты, которые не входят в состав белков.
11. ε-NH2-группа лизина участвует в образовании пептидной связи в белках.
12. Радикалы серина и валина обладают гидрофильными свойствами.
2. Выберите правильный ответ.
Аминокислота с незаряженДля определения оптической плотности ным радикалом - это синего раствора используют светофильтр
1) треонин 1) голубой
2) лизин 2) желтый
3) аргинин 3) красный
4) гистидин 4) зеленый
5) глутаминовая кислота 5) синий
3. Установите соответствие между аминокислотой и функциональной группой, входящей в состав ее радикала.

1.4. ДИАЛИЗ СОЛЕВОГО РАСТВОРА БЕЛКА. БУМАЖНАЯ ХРОМАТОГРАФИЯ АМИНОКИСЛОТ
А. Диализ солевого раствора белка
Диализом называют процесс разделения высокомолекулярных веществ (например, белков) и низкомолекулярных (например, солей) с помощью полупроницаемых мембран.
Полупроницаемыми называют мембраны, диаметр пор которых позволяет проходить только низкомолекулярным соединениям. При- мером естественных полупроницаемых мембран могут быть капсулы Боумена-Шумлянского в почках. Широко используют искусственные полупроницаемые мембраны целлофан и коллодий, на основе которых созданы диализаторы, в том числе «искусственная почка».
Метод диализа используют в научных лабораториях, промышленности, клинической практике.
Цель работы
Доказать, что низкомолекулярное соединение NaCl проходит через полупроницаемую мембрану, а высокомолекулярный белок не проходит и остается в диализируемом растворе.
Принцип метода
Метод основан на том, что низкомолекулярные вещества легко диффундируют через полупроницаемые мембраны в чистый раство- ритель, образуя диализат. Диффузия будет продолжаться, пока не произойдет выравнивание концентраций диффундируемого вещества между диализируемым раствором и диализатом. Процесс возобновится, если диализат заменить чистым растворителем или если эта смена будет происходить постоянно (проточный диализ).
Выполнение работы
Подготовка диализатора. Полупроницаемой мембраной могут быть диализные трубки или целлофановые диализные мешочки. Целлофан (квадрат 10х10 см) смачивают дистиллированной водой, делают в нем углубление и получают диализный мешочек.
Приготовление диализируемого раствора. В диализный мешочек помещают 20 капель яичного белка, разведенного в 5%-ном растворе NaCl (белок одного яйца разводят в 300 мл 5%-ного раствора NaCl), и
перемешивают. Края целлофана зажимают между двумя стеклянными палочками, скрепленными между собой резиновыми кольцами.
Диализ. Мешочек с солевым раствором белка помещают в стакан с дистиллированной водой так, чтобы часть мешочка с раствором белка была полностью погружена в воду. Сразу же на просвет можно заметить струйки солевого раствора, опускающиеся из мешочка на дно стакана, что обусловлено изменением рефракции воды.
Анализ результатов диализа. Через 60 мин после начала диализа проводят качественные пробы на белок (биуретовую реакцию) и на NaCl (с AgNO3) в соответствии с таблицей.
Реактив | Проба на белок | Проба на ионы Cl- в диализате | |
в диализате | в диализируемом растворе | ||
Диализат | 10 капель | - | 10 капель |
Диализируемый раствор | - | 10 капель | - |
10%-ный раствор NaOH | 5 капель | 5 капель | - |
1%-ный раствор CuSO4 | 1 капля | 1 капля | - |
10%-ный раствор HNO3 | - | - | 1 капля |
1%-ный раствор AgNO3 | - | - | 1 капля |
Наблюдения | |||
Самостоятельное формулирование выводов
Б. Бумажная хроматография аминокислот
Хроматографический метод, разработанный русским ученым М.С. Цветом, является одним из относительно простых и быстрых методов разделения смеси веществ.
Существует несколько разновидностей метода в зависимости от принципа разделения смеси на составляющие компоненты (адсорб- ционная, ионообменная, аффинная хроматография).
Примером адсорбционной хроматографии является распределительная хроматография на бумаге, которая оказалась наиболее удоб- ной для разделения аминокислот, отличающихся гидрофобностью радикалов, а также для идентификации неизвестных аминокислот путем сравнения их подвижности с подвижностью известных аминокислот («свидетелей»).
Цель работы
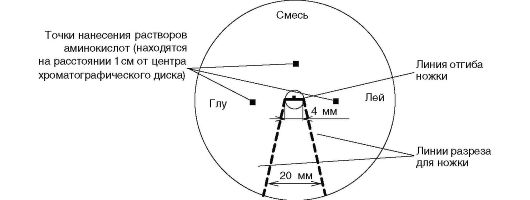
Провести разделение смеси двух неизвестных аминокислот*, рассчитать для каждой из них Rf (см. далее) и идентифицировать аминокислоты по сравнению с Rf стандартов (глутаминовая кислота и лейцин).
Принцип метода
Метод основан на различной растворимости отдельных аминокислот в двух частично смешивающихся жидкостях: в воде, которая удерживается фильтровальной бумагой и является неподвижной фазой растворителя, и в подвижной фазе органического растворителя (бутанол : уксусная кислота : вода, 5 : 1 : 4).
По мере продвижения растворителя по бумаге происходит многократное перераспределение аминокислот между подвижной и неподвижной фазами растворителя. Чем больше гидрофобность аминокислоты, тем быстрее она будет продвигаться по бумаге и наоборот. В соответствии с этим расстояния, которые аминокислоты пройдут с подвижной фазой растворителя по бумаге, будут различными.
Скорость передвижения каждой аминокислоты может быть выражена коэффициентом распределения (Rf). Коэффициентом распределения называют отношение расстояний (в мм) от места нанесения аминокислоты (старта) до середины ее пятна (величина а) к расстоянию от места старта до границы фронта растворителя (величина b). Чем выше гидрофобность аминокислотного радикала, тем ближе к единице будет величина Rf.
Коэффициент распределения для каждой аминокислоты постоянен при стандартных условиях проведения опыта (тип бумаги, температура, тип растворителя, влажность) и служит средством идентификации аминокислот по сравнению с аминокислотами-«свидетелями».
Выполнение работы
Диск хроматографической бумаги (d =
В места, отмеченные точками, наносят по 2 мкл образцов стандартных растворов аминокислот (0,6% раствор глутаминовой кислоты и 0,5% раствор лейцина) и смесь неизвестных аминокислот. Высушивают бумажный диск с образцами на воздухе.
* Смесь готовится заранее лаборантом по указанию преподавателя.
Разрезают хроматографический диск по линиям разреза, отгибают по линии сгиба получившуюся ножку и укорачивают ее до длины
Когда фронт растворителя пройдет 5-6 см, извлекают хроматограмму из камеры и тщательно обводят карандашом образовавшийся фронт растворителя.
Высушивают диск в сушильном шкафу при 60-80 ?С*.
Погружают диск в 0,5% раствор нингидрина в ацетоне и вновь высушивают до проявления пятен аминокислот*.
В рабочей тетради записывают ход работы, рассчитывают значение Rf для каждой аминокислоты, вклеивают полученную хроматограмму или зарисовывают ее.
Самостоятельное формулирование выводов
Тестовые задания по теме
«Структура и свойства пептидов и белков»
1. Определите, верно ли утверждение. 1. Целостность четвертичной структуры белка важна для проявления его биологической активности.
* Стадии, отмеченные звездочкой, выполняет под тягой лаборант в резиновых перчатках (см. раздел по технике безопасности работ в биохимической лаборатории).
2. Кератин нерастворим в воде.
3. Все белки содержат однотипные домены.
4. Фолдинг белковых молекул начинается с быстрого формирования элементов вторичной структуры.
5. Природные пептиды могут обладать гормональной активностью.
6. Метод диализа применяют для разделения белков с различной молекулярной массой.
7. Существуют белки, не содержащие β-складчатые слои.
8. Разделить белки можно методом бумажной хроматографии.
9. Вся полипептидная цепь белков полностью спирализована.
10. В моче здорового человека содержится белок.
11. Водородные связи участвуют в образовании вторичной структуры белка.
12. Гистоны относят к кислым белкам.
2. Выберите правильный ответ.
Смесь различных белков Шапероны участвуют
невозможно разделить методом в образовании
1) ионнообменной 1) первичной структуры белков хроматографии 2) первичной структуры нуклеино-
2) электрофореза вых кислот
3) высаливания 3) третичной структуры белков
4) диализа 4) третичной структуры нуклеино-
5) гель-фильтрации вых кислот
5) вторичной структуры нуклеиновых кислот
3. Установите соответствие между аминокислотой и характером радикала, входящего в ее состав.

1.5. КОЛЛОКВИУМ ПО ТЕМЕ «АМИНОКИСЛОТЫ И ПРОСТЫЕ БЕЛКИ»
Вопросы для самостоятельной подготовки
1. Классификация белков. Химия простых белков. Природные пептиды.
2. Аминокислотный состав белков. Цветные реакции на белки.
3. Физико-химические свойства белков. Изоэлектрическая точка растворов белков.
4. Уровни структурной организации белков: первичная, вторичная третичная и четвертичная структуры белков. Связь структуры белка с выполняемой функцией.
5. Аминокислоты: их строение и свойства. Классификация аминокислот. Характер связи аминокислотных остатков в молекуле белка.
6. Доменная структура белков. Фолдинг белковых молекул. Понятие о шаперонах. Деградация клеточных белков.
7. Биологически активные пептиды.
Варианты письменной части коллоквиума
1. Напишите формулу трипептида
1) глутамилпролиллизин
2) аспартиллизилпролин
3) пролиларгинилглутамат
4) гистидиллизилсерин
2. Укажите, какими методами можно разделить
1) альбумины и глобулины
2) казеин и продукты его гидролиза
3) гис и гли
4) асп и арг
3. Укажите, как можно определить наличие в растворе
1) трп
2) мет
3) глобулинов
4) цис
4. Приведите один пример белка из группы
1) протаминов
2) проламинов
3) альбуминов
4) глобулинов
5. Охарактеризуйте структуру белка
1) первичную
2) вторичную
3) третичную
4) четвертичную
6. Дайте краткое определение понятия
1) пострансляционная модификация белка
2) фолдинг белковых молекул
3) олигомерные белки
4) шапероны
Варианты заданий компьютерного тестирования
Инструкция к тесту. Выберите все правильные ответы.
1. Незаменимые для человека аминокислоты - это
1) фенилаланин
2) тирозин
3) триптофан
4) треонин
5) метионин
2. Положительным зарядом в радикальной части обладают аминокислоты
1) аспарагин
2) глутамин
3) лизин
4) глутамат
5) гистидин
3. Серосодержащие аминокислоты - это
1) метионин
2) лизин
3) валин
4) цистеин
5) аргинин
4. Гидрофобные аминокислоты - это
1) глутамин
2) валин 3)треонин
4) фенилаланин
5) изолейцин
5. При денатурации белка не нарушаются связи
1) дисульфидные
2) водородные
3) пептидные
4) ионные
5) гидрофобные
6. Донор метильных групп - это
1) валин
2) лейцин
3) метионин
4) аргинин
5) треонин
7. Наибольшая величина Rf при бумажной хроматографии будет у аминокислоты
1) глицина
2) треонина
3) серина
4) глутамата
5) валина
8. Изоэлектрическая точка белка зависит
1) от наличия гидратной оболочки
2) от суммарного заряда аминокислотных радикалов
3) от наличия водородных связей
4) от наличия спиральных участков в молекуле
5) от всех перечисленных параметров
9. Биуретовая реакция будет положительной
1) для простых белков
2) для дипептидов
3) для трипептидов
4) для раствора аминокислот
5) для желатины
10. Олигомерные белки
1) проходят через полупроницаемую мембрану
2) не содержат α-спиральных участков
3) состоят из нескольких полипептидных цепей
4) не обладают четвертичной структурой
5) соответствуют всем вышеуказанным утверждениям
11. Гидрофильные аминокислоты - это
1) глутамин
2) серин
3) аргинин
4) фенилаланин
5) аспарагин
12. Аминокислота, не имеющая стереоизомеров, - это
1) тирозин
2) глицин
3) аланин
4) цистеин
5) серин
13. Незаменимые для человека аминокислоты - это
1) лизин
2) треонин
3) орнитин
4) валин
5) цистеин
14. Аминокислоты с незаряженными радикалами - это
1) треонин
2) триптофан
3) аргинин
4) гистидин
5) серин
15. Аминокислоты, являющиеся производными пропионовой кислоты, - это
1) аланин
2) серин
3) цистеин
4) треонин
5) фенилаланин
16. Гидрофобная аминокислота - это
1) серин
2) лейцин
3) глутамин
4) цистеин
5) лизин
17. Денатурацию белка вызывает добавление
1) концентрированной азотной кислоты
2) сульфата меди(11)
3) нитрата серебра
4) концентрированной щелочи
5) сульфата аммония
18. Сульфгидрильную группу (тиогруппу) содержит аминокислота
1) аспарагин
2) гистидин
3) лизин
4) цистеин
5) метионин
19. Методом ионообменной хроматографии нельзя разделить
1) глутамат и лизин
2) глутамат и лейцин
3) лейцин и лизин
4) лейцин и валин
5) валин и глутамат
20. Денатурация белка всегда сопровождается
1) нарушением его третичной структуры
2) гидролизом пептидных связей
3) появлением окраски
4) образованием функциональных комплексов с другими белками
5) потерей нативных биологических свойств
21. Третичную структуру белков стабилизируют связи
1) сложноэфирные
2) гидрофобные
3) водородные
4) ионные
5) дисульфидные
22. Отрицательную нингидриновую реакцию дают
1) простые белки
2) дипептиды
3) трипептиды
4) свободные аминокислоты
5) карбоновые кислоты
23. Коллаген содержит много остатков
1) гистидина
2) глицина
3) аспарагина
4) лейцина
5) глутамата
24. Незаменимые для человека аминокислоты - это
1) лейцин
2) аланин
3) фенилаланин
4) пролин
5) аспарагин
25. Производным янтарной кислоты является
1) глутаминовая кислота
2) гистидин
3) пролин
4) триптофан
5) аспарагиновая кислота
26. Молекулярную массу белков можно определить методом
1) электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия
2) диализа
3) ионообменной хроматографии
4) колориметрическим
5) гель-фильтрации
27. Альбумины растворимы
1) в дистиллированной воде
2) в фосфатном буфере, pH = 6,8
3) в полунасыщенном растворе сульфата аммония
4) в полунасыщенном растворе сульфата меди(11)
5) в насыщенном растворе сульфата аммония
28. Смесь белков с различной молекулярной массой можно разделить методом
1) гель-фильтрации
2) ультрафильтрации через фильтры с молекулярным размером пор
3) диализа
4) ультрацентрифугирования
5) высаливания
29. Положительную ксантопротеиновую реакцию дают
1) фенилаланин
2) метионин
3) триптофан
4) аргинин
5) аспарагин
30. Шапероны участвуют в образовании и поддержании главным образом
1) первичной структуры белков
2) первичной структуры нуклеиновых кислот
3) третичной структуры белков
4) третичной структуры нуклеиновых кислот
5) вторичной структуры нуклеиновых кислот
31. Гидрофильными аминокислотами являются
1) фенилаланин
2) лейцин
3) треонин
4) серин
5) аланин
32. Фолдинг белка - это
1) формирование первичной структуры
2) модификация аминокислотных остатков
3) формирование третичной структуры
4) транспорт в митохондрии
33. Незаменимые для человека аминокислоты - это
1) изолейцин
2) аланин
3) глицин
4) валин
5) аспарагин
34. Аминокислоты с положительно заряженными радикалами - это
1) гистидин
2) валин
3) аргинин
4) лизин
5) изолейцин
35. Аминокислота, являющаяся производным глутаровой кислоты, - это
1) аспарагиновая кислота
2) глутаминовая кислота
3) аргинин
4) лизин
5) гистидин
36. Аминокислоты с отрицательно заряженными радикалами - это
1) аспарагин
2) глутамин
3) глутамат
4) аргинин
5) аспартат
37. Белки с различной молекулярной массой нельзя разделить, используя
1) трихлоруксусную кислоту
2) гидроксид натрия
3) сульфат меди(11)
4) сульфат аммония
38. Положительно заряженные белки - это
1) альбумины
2) глобулины
3) глутелины
4) гистоны
5) протамины
39. Сложные белки - это
1) протамины
2) миоглобин
3) гистоны
4) флавопротеины
5) гемоглобин
40. Для очистки белков от солей используют методы
1) гель-фильтрации
2) диализа
3) бумажной хроматографии
4) гидролиза
5) все вышеперечисленные
41. Положительную реакцию Фоля дает
1) триптофан
2) гистидин
3) тирозин
4) треонин
5) цистеин
42. В молекуле белка наиболее прочные связи
1) пептидные
2) дисульфидные
3) водородные
4) ионные
5) гидрофобные
43. Олигомерные белки отличаются от других белков наличием
1) неупорядоченной структуры
2) вторичной структуры
3) третичной структуры
4) четвертичной структуры
5) доменного строения
Правильные ответы
1. 1, 3, 4, 5
2. 3, 5
3. 1, 4
4. 2, 4, 5
5. 3
6. 3
7. 5
8. 2
9. 1, 3, 5
10. 3
11. 1, 2, 3, 5
12. 2
13. 1, 2, 4
14. 1, 2, 5
15. 1, 2, 3, 5
16. 2
17. 1, 2, 3, 4
18. 4
19. 4
20. 1, 5
21. 2, 3, 4, 5
22. 5
23. 2
24. 1, 3
25. 5
26. 1, 5
27. 1, 2, 3
28. 1, 2, 4, 5
29. 1, 3
30. 3
31. 3, 4
32. 3
33. 1, 4
34. 1, 3, 4
35. 2
36. 3, 5
37. 1, 2, 3
38. 4, 5
39. 2, 4, 5
40. 1, 2
41. 5
42. 1
43. 4