Биохимия : руководство к практическим занятиям : учебное пособие / Под ред. проф. Н.Н. Чернова. - 2009. - 240 с. : ил.
|
|
|
|
РАЗДЕЛ 6. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ОБМЕН АМИНОКИСЛОТ
ВВЕДЕНИЕ
Белковому обмену принадлежит особое место среди других видов обмена веществ. Это объясняется специфическими функциями белков (пластической, каталитической, иммунной), которые не могут выполнять ни углеводы, ни липиды.
В организме человека ежесуточно распадается до аминокислот (АМК) около
Поскольку белки всех организмов отличаются строгой видовой и тканевой специфичностью, организм человека использует белки пищи только после их полного гидролиза до АМК в желудочно-кишечном тракте под действием ряда протеолитических ферментов - пептидаз. Все пептидазы в зависимости от места расположения гидролизуемой пептидной связи подразделяют на (1) эндопептидазы, гидролизующие пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза) и (2) экзопептидазы, гидролизующие пептидые связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидаза, дипептидаза).
Желудочные и панкреатические пептидазы вырабатываются в неактивной форме, секретируются в месте действия, где активируются путем частичного протеолиза. Такой механизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
Переваривание белков в желудке происходит под действием пепсина. Профермент пепсиноген вырабатывается главными клетками желудочных желез и при поступлении пищи секретируется в полость желудка. Пепсиноген активируется двумя способами:
1) соляной кислотой (медленно);
2) аутокаталитически (быстро) уже имеющимся пепсином.
Желудочный сок содержит соляную кислоту, которая вырабатывается обкладочными клетками желудка и выполняет следующие функции:
1) оказывает бактерицидное действие;
2) денатурирует белки пищи;
3) создает оптимум рН для пепсина;
4) активирует пепсиноген путем частичного протеолиза. Переваривание белков в кишечнике происходит под действием:
1) ферментов поджелудочной железы (трипсина, химотрипсина, эластазы, карбоксипептидаз);
2) ферментов тонкой кишки (аминопептидаз, дипептидаз, трипептидаз).
Активная форма трипсина образуется в кишечнике при участии энтеропептидазы, которая отщепляет от N-конца трипсиногена гексапептид, что приводит к изменению конформации молекулы и формированию активного центра трипсина. Остальные протеазы панкреатического сока (химотрипсиноген, прокарбоксипептидаза, проэластаза) активируются трипсином.
Активация панкреатических пептидаз происходит по каскадному механизму. Кишечные пептидазы синтезируются в энтероцитах сразу в активной форме.
Конечным результатом переваривания белков является образование свободных АМК, поступающих в клетки слизистой оболочки кишечника путем активного транспорта. Большая часть образовавшихся свободных АМК используется для синтеза собственных белков организма; оставшиеся АМК используются для синтеза биологически активных молекул: гормонов, биогенных аминов, а также нуклеотидов, гема, креатинфосфата и многих других соединений, в том числе для синтеза глюкозы в процессе глюконеогенеза.
Важнейший путь превращений АМК в организме - это реакции трансаминирования с α-кетокислотами с образованием новых (за- менимых) АМК.
Еще один путь метаболизма АМК - декарбоксилирование с образованием биологически активных молекул - биогенных аминов. Основным коферментом обмена АМК является пиридоксальфосфат (ПФ).
Деградация АМК происходит путем их дезаминирования: безазотистые остатки могут использоваться для синтеза глюкозы (глюконеогенез) или, превращаясь в ацетил-КоА, окисляться до углекислого газа и воды с образованием энергии (различают гликогенные и кетогенные АМК).
В данном разделе приводится лабораторная работа по количественному анализу кислотности желудочного сока, позволяющая оценить содержание свободной, связанной, общей соляной кислоты, а также общей кислотности желудочного сока.
Процесс трансаминирования представлен двумя работами:
1) количественное определение аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) в сыворотке крови, имеющее диагностическое значение при поражениях сердца и для диф- ференциальной диагностики болезней печени;
2) хроматографическое доказательство активности АлАТ. Ранней диагностике наследственного заболевания - фенилпиро-
виноградной олигофрении (фенилкетонурии) - посвящена работа по количественному определению фенилаланина в сыворотке крови.
Количественное определение конечных продуктов обмена белков представлено двумя лабораторными работами:
1) количественное определение мочевины в моче ферментативным (уреазным) методом;
2) колориметрический метод количественного определения креатинина в моче.
6.1. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ЖЕЛУДОЧНОГО СОКА. ОПРЕДЕЛЕНИЕ СВОБОДНОЙ, СВЯЗАННОЙ, ОБЩЕЙ СОЛЯНОЙ КИСЛОТЫ И ОБЩЕЙ КИСЛОТНОСТИ ЖЕЛУДОЧНОГО СОКА
Желудочный сок представляет собой бесцветную жидкость с сильнокислой реакцией (рН 1,5-2,0). За сутки у человека выделяется около
Кислая реакция желудочного сока обусловлена присутствием соляной кислоты, гидрофосфатов, а при патологических процессах - молочной кислоты и жирных кислот. Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляют общую кислотность. Соляную кислоту, связанную с белками и продуктами их переваривания, называют связанной соляной кислотой, а находящуюся в несвязанном виде - свободной соляной кислотой. Содержание последней подвержено значительным колебаниям, тогда как количество связанной соляной кислоты достаточно постоянно.
В характере секреции желудочного сока различают следующие патологические изменения: 1) гиперхлоргидрию - увеличение содержания свободной соляной кислоты и общей кислотности. Такое состояние преимущественно наблюдается при язвенной болезни желудка; 2) гипохлоргидрию - уменьшение количества свободной соляной кислоты и общей кислотности; 3) ахлоргидрию - полное отсутствие соляной кислоты, общая кислотность при этом значительно снижена; 4) ахилию - отсутствие секреции желудочного сока.
Уменьшение или отсутствие соляной кислоты в желудке может наблюдаться при хроническом гастрите, раке желудка, злокачествен- ном малокровии.
В клинике используют рН-метрию желудочного сока, однако полезную информацию можно получить простым, изящным способом, предложенным ниже.
Цель работы
Последовательно оттитровать один из трех образцов желудочного сока раствором NaOH в присутствии двух индикаторов и на основании расчетов сделать вывод о кислотности желудочного сока: нормальная, повышенная или пониженная. Сравнить с другими образцами и отметить характер изменения общей кислотности, а также общей, свободной и связанной соляной кислоты.
Принцип метода
Пользуясь различными индикаторами (диметиламиноазобензол и фенолфталеин), в одной и той же пробе желудочного сока определяют как общую кислотность, так и содержание общей, свободной и связанной соляной кислоты.
Общую кислотность желудочного сока выражают количеством миллилитров
Свободную соляную кислоту выражают количеством миллилитров
Общая соляная кислота - это сумма свободной и связанной с белками соляной кислоты (последнюю находят по разности между общей и свободной соляной кислотой).
Выполнение работы
В колбу для титрования вносят из бюретки 5 мл исследуемого желудочного сока. Добавляют 1 каплю раствора диметиламиноа- зобензола и 2 капли раствора фенолфталеина. Появляется розовомалиновое окрашивание. Пробу титруют
Далее титрование продолжают до появления лимонно-желтой окраски и отмечают общее количество миллилитров NaOH, пошедших на титрование от начала общего титрования (II пункт титрования). Затем титрование продолжают до появления малинового окрашивания и отмечают количество миллилитров щелочи, пошедших на титрование вновь от начала общего титрования (III пункт титрования).
Расчеты
Допустим, что на титрование 5 мл желудочного сока до пункта I пошло от 0 до 1,5 мл
Данные титрования и расчета вносят в таблицу (см. ниже).
Пункт титрования | NaOH от 0 до соответствующего пункта титрования, мл | Окраска | Количество соляной кислоты (ед.) | Общая кислотность, ед. | ||
свободная | общая | связанная | ||||
I | ||||||
II | ||||||
III | ||||||
Самостоятельное формулирование выводов
Тестовые задания по теме «Превращение белков и дезаминирование аминокислот»
1. Определите, верно ли утверждение.
1. Протеиназы, амилазы и липазы относят к классу гидролаз.
2. Таурин является продуктом превращения цистеина.
3. Скатол и индол образуются в кишечнике из аминокислоты тирозина.
4. Соляная кислота в желудке способствует активации пепсиногена.
5. При дезаминировании аминокислот в организме образуются биогенные амины.
6. Пепсин относят к эндопептидазам.
7. В качестве кофермента глутаматдегидрогеназы НАД+ можно заменить на ФАД.
8. У человека происходит неокислительное дезаминирование цистеина.
9. Трипсин участвует в активации химотрипсиногена.
10. Возможно самопереваривание пепсина в желудке.
11. Карбокси- и аминопептидазы относят к эндопептидазам.
12. Уридиндифосфоглюкуроновая кислота участвует в обезвреживании индола.
2. Выберите правильный ответ.
Коферментом дезаминирования Заменимой аминокислотой
аминокислот не может быть для человека является
1) НАД+ 1) фенилаланин
2) ФАД 2) тирозин
3) ФМН 3) триптофан
4) ТПФ 4) треонин
5) ПФ 5) метионин
3. Установите соответствие между проферментом и соответствующим катализатором.

6.2. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АСПАРТАТАМИНОТРАНСФЕРАЗЫ И АЛАНИНАМИНОТРАНСФЕРАЗЫ
В СЫВОРОТКЕ КРОВИ
Аспартатаминотрансфераза (АсАТ, КФ: 2.6.1.1) и аланинаминотрансфераза (АлАТ, КФ: 2.6.1.2) - пиридоксальфосфатсодержащие ферменты.
АсАТ катализирует обратимый перенос аминогруппы от аспартата на α-кетоглутарат с образованием глутамата и оксалоацетата.
АлАТ катализирует обратимую реакцию переноса аминогруппы от аланина на α-кетоглутарат с образованием глутамата и пирувата (ПВК).
АлАТ содержится в цитозоле, тогда как для АсАТ известны две формы: цитоплазматическая и митохондриальная.
При поражении тканей аминотрансферазы «вымываются» из поврежденных клеток в кровоток, поэтому определение активности аминотрансфераз в сыворотке крови имеет важное значение, особенно для диагностики поражений сердца и дифференциальной диагностики болезней печени. Так, при неосложненном инфаркте миокарда уровень АсАТ в сыворотке крови начинает повышаться уже через 4-6 ч после наступления инфаркта, максимум активности приходится на вторые сутки и лишь на 5-8-й день активность фермента снижается до нормы. Изменение активности сывороточной АлАТ при этом незначительно.
При инфекционном гепатите (болезни Боткина) и обострении хронического гепатита активности обеих аминотрансфераз в сыворотке
крови повышаются (активность АлАТ повышается сильнее). Цирроз печени не сопровождается значительной гиперферментемией.
Цель работы
Определить активности обеих аминотрансфераз в сыворотке крови колориметрическим методом и сравнить полученные результаты с нормой.
Принцип метода
Определение активности обеих аминотрансфераз основано на колориметрическом обнаружении пирувата, образующегося за 1 ч инкубации, по цветной реакции с 2,4-динитрофенилгидразином в щелочной среде (см. работу 4.3Б). В случае АлАТ пируват образуется непосредственно из аланина, а в случае АсАТ пируват образуется из оксалоацетата после декарбоксилирования последнего в щелочной среде:

Активность обоих ферментов определяют по калибровочному графику.
Выполнение работы* (см. Приложение 9.2)
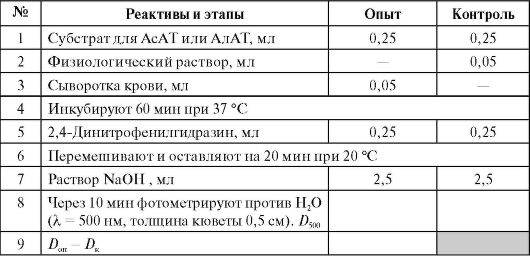
* Одна половина студенческой группы определяет активность АлАТ, другая - активность АсАТ, затем группы обмениваются результатами.
Расчеты
Расчет активности производят в мккат/л по калибровочному графику (данные для его построения приведены в таблице).

Норма: АлАТ = 0,05-0,12 мккат/л; АсАТ = 0,06-0,14 мккат/л. Верхний предел - 0,42 мккат/л.
Самостоятельное формулирование выводов
Тестовые задания по теме
«Переваривание белков и обмен аминокислот»
1. Определите, верно ли утверждение.
1. Тирозин является незаменимой аминокислотой для человека.
2. В окислительном дезаминировании аминокислот могут участвовать разные коферменты.
3. Реакции трансаминирования аминокислот необратимы.
4. В процессах трансдезаминирования и трансреаминирования аминокислот участвует α-кетоглутаровая кислота.
5. Коферентом аминотрансфераз служит ФАД.
6. В процессе трансаминирования выделяется аммиак.
7. В организме человека возможно превращение пировиноградной кислоты в аланин.
8. Фенилаланин является предшественником серотонина.
9. Для диагностики инфаркта миокарда используют определение активности аспартатаминотрансферазы в сыворотке крови человека.
10. Витамин В1 нужен для реакций трансаминирования.
11. Глюконеогенез усиливается при сахарном диабете.
12. Лизин и треонин участвуют в реакциях трансаминирования.
2. Выберите правильный ответ.
Метаболит ЦТК, участвующий в Гликогенной аминокислотой
реакциях трансаминирования, - это не является 1) цитрат 1) аргинин
2) изоцитрат 2) глутамин
3) сукцинат 3) гистидин
4) фумарат 4) лейцин
5) оксалоацетат 5) метионин
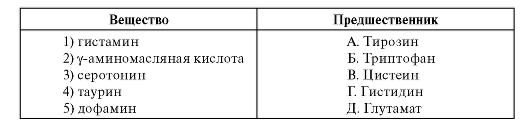
3. Установите соответствие между веществом и его предшественником.
6.3. ОБНАРУЖЕНИЕ АКТИВНОСТИ АЛАНИНАМИНОТРАНСФЕРАЗЫ МЕТОДОМ БУМАЖНОЙ ХРОМАТОГРАФИИ
Аланинаминотрансфераза (АлАТ), как и другие аминотрансферазы, участвует во взаимном превращении α-аминокислот и α-кетокислот в цитозоле клетки:
Аланин + α-Кетоглутарат ↔ Пируват + Глутамат.
Поэтому активность АлАТ можно определить качественно по появлению в реакционной смеси новой аминокислоты, образовавшейся в результате переноса аминогруппы от аланина или глутамата на α-кетоглутарат или пируват соответственно (в зависимости от того, в каком направлении проводится реакция).
Цель работы
Методом бумажной хроматографии показать наличие активности АлАТ и определить, какая аминокислота (аланин или глутамат) присутствовала в исходной субстратной смеси, т. е. в каком направлении проводилась ферментативная реакция.
Принцип метода
Поскольку в результате ферментативной реакции образуется новая аминокислота, осуществляют идентификацию исходной и обра- зующейся под действием АлАТ аминокислоты методом радиальной
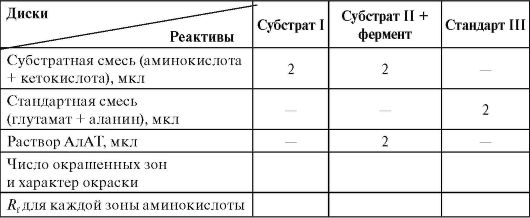
бумажной хроматографии (см. работу 1.4Б «Бумажная хроматография аминокислот»). Идентификацию проводят после окраски нингидрином по сравнению величин Rf исследуемых АМК со стандартными, которые разделяют одновременно в тех же условиях. Для решения задачи необходимо провести три независимых хроматографических разделения: 1) субстратной смеси (одна аминокислота); 2) субстратной смеси + АлАТ (образуется вторая аминокислота); 3) стандартного раствора «свидетелей» аланина и глутамата для идентификации.
Выполнение работы
Берут три диска хроматографической бумаги диаметром
Через 10 мин после нанесения последнего реагента (время инкубации) все три диска подсушивают на воздухе. На каждом диске от края к центру делают ножницами два параллельных разреза (ширина раз- реза равна диаметру кружочка в центре диска). Вырезанную полоску отгибают перпендикулярно диску так, чтобы линия сгиба проходила через середину зоны нанесения растворов. «Ножку» укорачивают до 2-3 см и помещают диск между нижней и верхней половинками чашки Петри, содержащей смесь бутанол + уксусная кислота + Н2О в соотношении 5:1:4. Проводят хроматографическое разделение под тягой приблизительно в течение 1 ч. Диски извлекают из хроматографической камеры и обводят фронт растворителя простым карандашом.
Высушивают* в сушильном шкафу при 100 ?С, смачивают раствором нингидрина* и снова высушивают*.
Рассчитывают величину Rf для каждой окрашенной зоны и проводят идентификацию аминокислот. Делают вывод о том, какая аминокислота находилась в субстратной смеси. Затем вырезают сегменты из каждого диска и складывают их вместе рядом, совмещая центральные зоны нанесения вещества.
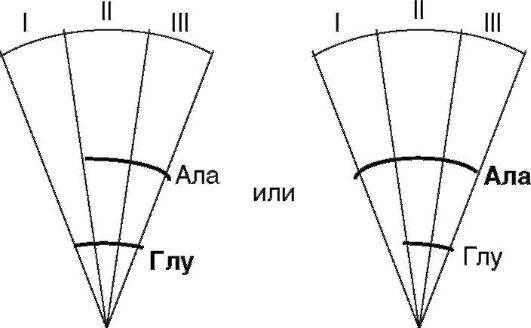
Самостоятельное формулирование выводов
6.4. ЭКСПРЕСС-МЕТОД ОПРЕДЕЛЕНИЯ ПОВЫШЕННОГО СОДЕРЖАНИЯ ФЕНИЛАЛАНИНА В ПЛАЗМЕ КРОВИ
Превращение незаменимой аминокислоты фенилаланина в заменимую - тирозин в организме человека осуществляется реакцией гидроксилирования, которую катализирует фермент фенилаланин- 4-монооксигеназа (косубстратом служит тетрагидробиоптерин).
Клинико-диагностическое значение
Врожденное отсутствие фенилаланин-4-монооксигеназы приводит к развитию тяжелого наследственного заболевания - фенилпировиноградной олигофрении (фенилкетонурии). При этом вследствие уменьшения потребления фенилаланина тканями его концентрация в плазме крови резко возрастает (в норме содержание 0,1 ммоль/л, что соответствует 0,015 г/л). Одновременно, в результате усиления
* Операции, отмеченные звездочкой, выполняются под тягой лаборантами.
реакции трансаминирования фенилаланина, в тканях повышается концентрация фенилпирувата - конкурентного ингибитора фермен- тов, участвующих в метаболизме пирувата. У ребенка наблюдается замедление умственного развития и развивается фенилпировиноградная олигофрения. В связи с этим чрезвычайно важно провести как можно более раннюю диагностику данной патологии (на 1-3-й день рождения ребенка) и ввести строгую диету, исключающую фенилаланин из питания. Для раннего выявления отсутствия фенилаланин- 4-монооксигеназы проводят определение повышенного содержания фенилаланина в плазме крови, которое довольно просто осуществить методом бумажной хроматографии.
Цель работы
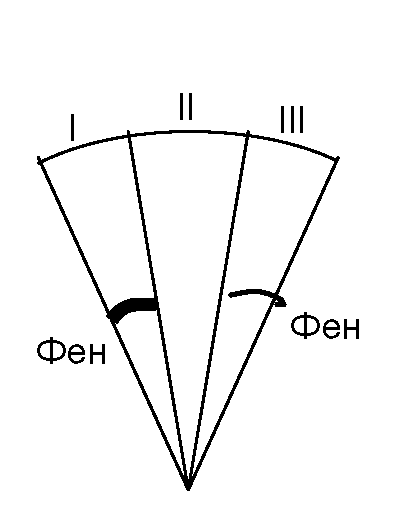
Оценить методом бумажной хроматографии содержание фенилаланина в плазме крови обследуемого ребенка по сравнению с его содержанием у заведомо здорового ребенка.
Принцип метода
Хроматографическое разделение образцов плазмы крови обследуемого ребенка и заведомо здорового в сравнении со стандартом, содержащим предельно допустимое количество фенилаланина (полуколичественное определение).
Выполнение работы
Берут три диска хроматографической бумаги диаметром
Нанесение растворов на хроматографические диски, проведение хроматографии и проявление хроматограмм осуществляют так же, как в предыдущей работе.
Сравнивают полученные хроматограммы по интенсивности окраски фенилаланина на всех трех дисках и делают вывод о содержании фенилаланина в плазме крови обследуемого ребенка.
Самостоятельное формулирование выводов
Тестовые задания по теме «Обмен аминокислот»
I. Определите, верно ли утверждение.
1. Гистидин в печени способен дезаминироваться по внутримолекулярному типу.
2. Восстановленные коферменты оксидаз аминокислот могут непосредственно окисляться молекулярным кислородом.
3. Дезаминирование глутаминовой кислоты сопровождается промежуточным образованием иминокислоты.
4. Коферментом моноаминоксидаз (МАО) служит ФАД.
5. Декарбоксилирование аминокислот является необратимым процессом.
6. Аммиак образуется при любом типе дезаминирования аминокислот.
7. Гистамин обладает сосудосуживающим действием.
8. Дофамин является предшественником норадреналина.
9. В организме человека возможно декарбоксилирование 5-окситрип- тофана.
10. Все природные аминокислоты могут «сгорать» в ЦТК.
II. В организме человека из аланина может образоваться глюкоза. 12. Лейцин относят к кетогенным аминокислотам.
2. Выберите правильный ответ.
Коферментом большинства Декарбоксилирование
декарбоксилаз аминокислот аминокислот приводит
является к образованию
1) ФАД 1) спирта
2) ФМН 2) альдегида
3) ПФ 3) амина
4) ТПФ 4) амида
5) НАДФ+ 5) кетона
3. Установите соответствие между ферментом, участвующего в обмене АМК, и его коферментом.

6.5. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ МОЧЕВИНЫ В МОЧЕ ФЕРМЕНТАТИВНЫМ УРЕАЗНЫМ/ФЕНОЛ-ГИПОХЛОРИТНЫМ МЕТОДОМ
Мочевина - основной конечный продукт обмена белков в организме человека. На долю мочевины приходится 80-90% выделяемого с мочой азота.
Биологическая роль синтеза мочевины в печени (орнитиновый цикл мочевинообразования) заключается в связывании образующегося при дезаминировании аминокислот аммиака в относительно малотоксичную молекулу мочевины, которая затем экскретируется с мочой.
Зная количество экскретируемой за сутки мочевины и количество азота, поступающего с пищей, можно вычислить азотистый баланс, который является важным показателем состояния белкового и аминокислотного обмена. Азотистый баланс может быть:
1) положительным - у детей, у выздоравливающих после тяжелой болезни;
2) отрицательным - при тяжелых заболеваниях, в том числе онкологических, при голодании и в старческом возрасте;
3) равным нулю (азотистое равновесие) - у здоровых взрослых людей (при нормальном питании).
Всякое повышение белкового обмена, процессы интенсивного распада белка (опухоли, гипертиреоз, диабет) сопровождаются усилением мочевинообразования и увеличением количества мочевины, выделяемой с мочой за стуки. Патологические изменения печени, приводящие к ее функциональной недостаточности, а следовательно, нарушению синтеза мочевины, сопровождаются снижением количества мочевины в крови и моче. Функциональная недостаточность почек ведет к понижению количества мочевины в моче и одновременному повышению ее содержания в крови (уремия). Некоторые формы диабета, характеризующиеся повышенным аппетитом и прогрессирующим исхуданием больного, сопровождаются повышением выделения мочевины с мочой за счет усиленного распада белков.
Цель работы
Определить содержание мочевины в суточной моче и сравнить полученный результат с нормой.
Принцип метода
Данный метод - ферментативный, он основан на реакции расщепления молекулы мочевины под действием высокоспецифического фермента (уреазы) до аммиака и углекислого газа, которые в водном растворе образуют карбонат аммония:
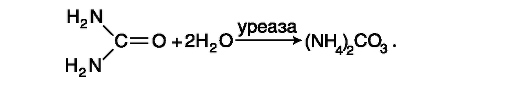
Ионы аммония в присутствии нитропруссида натрия реагируют с фенолом и гипохлоритом натрия. В результате реакции образуется индофенол (синего цвета), интенсивность окрашивания которого пропорциональна концентрации ионов аммония (и соответственно мочевины).
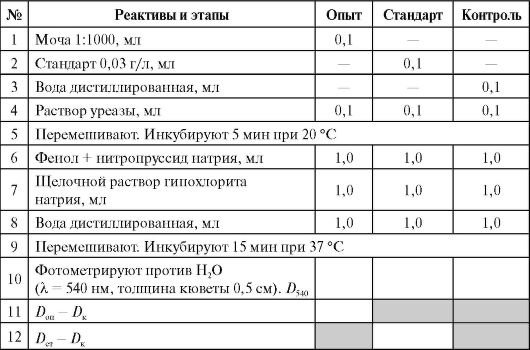
Выполнение работы (см. Приложение 9.2)
Для исследования берут следующие пробы (три маркированные пробирки): опыт (разведенная моча), стандарт (стандартный раствор мочевины 0,03 г/л) и контроль (вода). Все реактивы вносят согласно описанию в таблице.
На студенческую группу ставят два контроля и два стандарта. Остальные студенты делают опытные пробы.
Расчеты
Массу мочевины рассчитывают по стандарту мочевины*:

Самостоятельное формулирование выводов.
Тестовые задания по теме «Пути обезвреживания аммиака в организме человека и животных»
1. Определите, верно ли утверждение.
1. Глутаминсинтетазу относят к лигазам.
2. Выведение мочевины с мочой в количестве 20-35 мг/сут является нормой.
3. Образование карбамоилфосфата в синтезе мочевины требует затраты двух молекул АТФ.
4. Креатин в норме выводится с мочой.
5. Аргиназа катализирует образование оксида азота(11).
6. Аминогруппа аспартата служит одним из источников азота в молекуле мочевины.
7. Аминокислоты - единственный источник аммиака в организме.
8. Азот амидной группы глутамина может включаться в молекулу мочевины.
9. В глутаминсинтетазной реакции расходуется АТФ. * Считая суточное количество мочи равным
10. Для человека выделение
11. Метионин участвует в синтезе креатина.
12. Ион аммония выводится с мочой.
2. Выберите правильный ответ.
Аммиак в клетках мозга Цикл мочевинообразования
обезвреживается путем происходит
1) синтеза мочевины 1) в почках
2) образования солей аммония 2) в печени
3) превращения глутамата в глутамин 3) в надпочечниках
4) синтеза креатина 4) в мочевом пузыре
5) всеми перечисленными способами 5) в поджелудочной железе
3. Установите соответствие между Х и Y в реакции:

6.6. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
КРЕАТИНИНА В МОЧЕ
Креатинин является одним из конечных продуктов азотистого обмена (5% от общего азота мочи). Он образуется в мышечной ткани из креатинфосфата:
Креатинфосфат → Креатинин + Фн.
В свою очередь, креатинфосфат синтезируется из креатина в реакции, катализируемой креатинкиназой (креатинфосфокиназой, КФК) с участием АТФ:
Креатин + АТФ ↔ Креатин~Ф + АДФ.
Эта реакция обратима, и образование АТФ в обратной реакции является экстренным механизмом обеспечения энергией мышечного сокращения.
В норме с мочой выделяется только креатинин. Появление креатина в моче (креатинурия) свидетельствует о заболеваниях печени, почек, сахарном диабете, эндокринных расстройствах (гипертиреоз, аддисонова болезнь, акромегалия и др.), инфекционных заболеваниях. Исключением является появление креатина в моче у подростков и беременных женщин.
Гиперкреатининурия с одновременной креатинурией имеет место при патологии поперечно-полосатых мышц: миозит, миастения, дистрофия. Гипокреатининурия наблюдается при хроническом нефрите, мышечной атрофии после перенесенных инфекций, в старческом возрасте.
Цель работы
Определить содержание креатинина в суточной моче и сравнить полученный результат с нормой.
Принцип метода
Метод количественного определения креатинина в моче (по Фолину) основан на цветной реакции с пикриновой кислотой. Интенсивность оранжевой окраски пикрата креатинина, измеряемой на фотоэлектроколориметре с зеленым светофильтром (540 нм), прямо пропорциональна концентрации креатинина, которую определяют по калибровочному графику.
Выполнение работы
В 2 мерные колбы на 50 мл помещают реактивы, как указано в таблице

Для построения калибровочного графика используют стандартный раствор дихромата калия (K2Cr2O7).
Опытным путем найдено, что оптическая плотность
Из исходного раствора
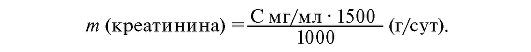
Норма: мужчины: 1-2 г/сут (8,8-17,6 ммоль/сут);
женщины: 0,6- 1,5 г/сут (5,3-13,2 ммоль/сут).
Самостоятельное формулирование выводов Тестовые задания по теме
«Особенности обмена отдельных аминокислот»
1. Определите, верно ли утверждение.
1. Глицин участвует в синтезе пуриновых оснований.
2. В состав КоА входит β-аланин.
3. Азот гуанидиновой группы аргинина служит источником образования оксида азота.
4. Монооксигеназы участвуют в образовании катехоламинов.
5. Триптофан может служить предшественником образования рибонуклеотида никотиновой кислоты (витамина РР).
6. Серотонин образуется из серина.
7. Глутаминовая кислота входит в состав глутатиона.
8. Гомогентизиновая кислота является промежуточным продуктом превращения фенилаланина.
9. Возможно превращение гистидина в глутаминовую кислоту.
10. Креатинфосфат является макроэргическим соединением.
11. Цистеин подвергается процессу декарбоксилирования.
12. Возможны превращения глицина в серин и треонин.
2. Выберите правильный ответ.
Молекула глицина не участвует Соединение, которое
в синтезе не образуется из тирозина, - это
1) гема 1) гомогентизиновая
2) пуриновых оснований кислота
3) пиримидиновых оснований 2) адреналин
4) парных желчных кислот 3) норадреналин
5) креатина 4) дофамин
5) фенилаланин
3. Установите соответствие между Х и Yв реакции

Тестовые задания по теме
«Регуляция и патология аминокислотного обмена»
1. Определите, верно ли утверждение.
1. Фенилкетонурия возникает в результате врожденного нарушения синтеза фенилаланин-4-монооксигеназы.
2. Моча с запахом кленового сиропа появляется при нарушении обмена разветвленных аминокислот.
3. Квашиоркор наблюдается у детей при недостатке в пище белков.
4. Алкаптонурия - врожденный дефект обмена триптофана.
5. Фенилкетонурию можно выявить по повышенному содержанию фенилаланина в сыворотке крови.
6. Квашиоркор сопровождается снижением сопротивляемости организма инфекциям.
7. Повышение концентрации аминокислот в крови сопровождается ацидемией.
8. При фенилкетонурии исключение из пищи тирозина приводит к положительному эффекту.
9. Ингибиторы моноаминоксидаз используют при лечении депрессивных состояний.
10. Болезнь Хартнупа связана с нарушением всасывания триптофана.
11. Недостаток витамина В6 вызывает нарушение обмена отдельных аминокислот.
12. Недостаток метионина может привести к жировому перерождению печени.
2. Выберите правильный ответ.
Фенилпировиноградная олигофрения Альбинизм связан
развивается в результате врожденного с нарушением обмена
отсутствия фермента класса 1) метионина
1) оксидоредуктаз 2) серина
2) трансфераз 3) цистеина
3) гидролаз 4) тирозина
4) лиаз 5) триптофана
5) изомераз
3. Установите соответствие между патологией и АМК, нарушение обмена или всасывания которой в кишечнике имеет место при данной патологии.

6.7. КОЛЛОКВИУМ ПО ТЕМЕ «ПЕРЕВАРИВАНИЕ БЕЛКОВ И ОБМЕН АМИНОКИСЛОТ»
Вопросы для самостоятельной подготовки
1. Понятие о биологической ценности белков. Роль белков в питании. Заменимые и незаменимые аминокислоты.
2. Общие пути превращения аминокислот в тканях.
3. Дезаминирование аминокислот. Механизмы окислительного дезаминирования.
4. Пути превращения безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты.
5. Трансаминирование аминокислот. Ферменты и коферменты трансаминирования. Трансдезаминирование и трансреаминирование. Диагностическое значение определения аминотрансфераз в сыворотке крови.
6. Реакции гидроксилирования и декарбоксилирования ароматических аминокислот.
7. Декарбоксилирование аминокислот. Образование биогенных аминов и их биологическая роль. Распад биогенных аминов. Моноаминоксидазы.
8. Пути образования аммиака в организме. Биосинтез мочевины.
9. Образование ядовитых продуктов гниения белков в кишечнике и механизм их обезвреживания в печени.
10. Особенности обмена глицина и серина.
11. Особенности обмена серосодержащих аминокислот.
12. Особенности обмена аргинина.
13. Особенности обмена дикарбоновых аминокислот.
14. Особенности обмена фенилаланина и тирозина. Фенилпировиноградная олигофрения. Алкаптонурия. Экспресс-метод определения повышенного содержания фенилаланина в сыворотке крови.
15. Синтез креатина. Креатинфосфат. Количественное определение креатинина в моче.
16. Связь обмена белков, жиров и углеводов.
Варианты письменной части коллоквиума
1. Укажите механизм активации
1) пепсиногена
2) трипсиногена
3) химотрипсиногена
4) проэластазы
2. Напишите реакции обезвреживания в печени
1) фенолов
2) индола
3) бензойной кислоты
4) аммиака
3. Рассмотрите механизм реакций и участие коферментов в процессах
1) гидроксилирования
2) трансдезаминирования
3) трансреаминирования
4) метилирования
4. Наиболее полно укажите фармакологические эффекты
1) дофамина
2) гистамина
3) серотонина
4) норадреналина
5. Разберите случаи нарушения обмена
1) триптофана
2) тирозина
3) серосодержащих аминокислот
4) аминокислот с разветвленной цепью
6. Укажите, в биосинтезе каких соединений участвует
1) метионин
2) аргинин
3) глутамин
4) глицин
Варианты заданий компьютерного тестирования
1. В обезвреживании аммиака участвуют аминокислоты
1) гистидин
2) аспарагиновая кислота
3) аланин
4) глутаминовая кислота
5) триптофан
2. Кофермент глутаматдегидрогеназы в реакции образования α- кетоглутаровой кислоты
1) НАД+
2) ПФ
3) ФАД
4) ФМН
5) КоQ(убихинон)
3. Больным со стойким увеличением содержания аммиака в крови может помочь прием аминокислоты
1) гистидина
2) аспарагина
3) глутамина
4) глутаминовой кислоты
5) лизина
4. Врожденный дефект синтеза фермента гомогентизинат-1,2-диок- сигеназы вызывает
1) фенилкетонурию
2) болезнь Паркинсона
3) алкаптонурию
4) альбинизм
5) гомоцистинурию
5. В синтезе креатина участвуют
1) аргинин
2) лейцин
3) метионин
4) серин
5) глицин
6. Суточное выделение креатинина с мочой составляет
1) 0,1-0,2 г/сут
2) 1,0-2,0 г/сут
3) 10-20 г/сут
4) 1,0-2,0 мг/сут
5) 10-20 мг/сут
7. Процесс трансаминирования аминокислот
1) обеспечивает синтез биогенных аминов
2) происходит при участии пиридоксальфосфата
3) обеспечивает образование заменимых аминокислот
4) сопровождается образованием аммиака
5) приводит к увеличению общего количества аминокислот
8. В орнитиновом цикле участвуют
1) цитруллин
2) лизин
3) аланин
4) аргинин
5) аспарагин
9. К смешанным (гликогенным и кетогенным) аминокислотам относят
1) триптофан
2) тирозин
3) фенилаланин
4) серин
5) лейцин
10. ТГФК участвует в синтезе
1) серина из глицина
2) цистеина из метионина
3) тирозина из фенилаланина
4) глутаминовой кислоты из гистидина
5) глутамина из глутамата
11. Процессу трансаминирования не подвергаются
1) глутамин и аспарагин
2) лизин и треонин
3) изолейцин и аспартат
4) фенилаланин и тирозин
5) аланин и валин
12. Аммиак в клетках мозга обезвреживается путем
1) синтеза мочевины
2) образования солей аммония
3) превращения глутамата в глутамин
4) образования аланина
5) синтеза креатина
13. Кофермент большинства декарбоксилаз аминокислот - это
1) ФАД
2) ФМН
3) ПФ
4) ТПФ
5) биотин
14. Гистидазу относят к классу
1) оксидоредуктаз
2) трансфераз
3) гидролаз
4) лиаз
5) изомераз
15. Скатол и индол обезвреживаются в печени с помощью
1) глицина
2) глутамата
3) α-кетоглутарата
4) уридиндифосфоглюкуроновой кислоты
5) пролина
16. Пиридоксальфосфат (ПФ) - кофермент
1) аланинаминотрансферазы
2) амилазы
3) аспартатаминотрансферазы
4) моноаминоксидазы
5) глутаматдегидрогеназы
17. Метаболит ЦТК, участвующий в реакциях трансаминирования, - это
1) цитрат
2) α-кетоглутарат
3) сукцинат
4) фумарат
5) малат
18. γ-аминомасляная кислота образуется
1) из гистидина
2) из аспарагиновой кислоты
3) из глутаминовой кислоты
4) из глутамина
5) из аспарагина
19. Суточное выведение мочевины с мочой в норме составляет
1) 25-35 мг
2) 0,25-0,35 г
3) 2,5-3,5 г
4) 25-35 г
5) 250-350 г
20. Глицин может образоваться
1) из метионина
2) из лизина
3) из валина
4) из тирозина
5) из серина
21. Альбинизм связан с нарушением обмена
1) метионина
2) серина
3) цистеина
4) тирозина
5) триптофана
22. Оксид азота(11) NO образуется из азота
1) аргинина
2) цистеина
3) валина
4) гистидина
5) серина
23. Коферментом оксидаз L-аминокислот может быть
1) ФМН
2) ПФ
3) НАД+
4) НАДФ+
5) КоА
24. Активность аспартатаминотрансферазы в сыворотке крови резко повышается
1) при заболеваниях почек
2) при панкреатитах
3) при простатитах
4) при нефритах
5) при инфаркте миокарда
25. Соляная кислота в желудке
1) денатурирует белки
2) оказывает бактерицидное действие
3) активирует пепсиноген
4) создает оптимум рН для пепсина
5) ингибирует пепсиноген
26. Кофермент моноаминоксидазы (МАО) - это
1) НАД+
2) ФАД
3) НАДН(Н+)
4) ТПФ
5) ПФ
27. Квашиоркор наблюдается у детей при недостатке в пище
1) углеводов
2) липидов
3) белков
4) витаминов
5) минеральных веществ
28. Источником образования таурина является
1) метионин
2) цистеин
3) глицин
4) серин
5) треонин
29. Строго кетогенная аминокислота - это
1) лейцин
2) аланин
3) серин
4) глутамин
5) лизин
30. При гнилостном распаде фенилаланина в кишечнике образуются
1) фенол
2) скатол
3) индол
4) крезол
5) лейцин
31. Алкаптонурия - врожденный дефект обмена
1) триптофана
2) гистидина
3) метионина
4) тирозина
5) глицина
32. Биосинтез мочевины происходит
1) в мозге
2) в мочевом пузыре
3) в поджелудочной железе
4) в надпочечниках
5) в печени
33. Суточная потребность в белках у человека составляет примерно
1) 100 г
2) 100 мг
3) 10 г
4) 1000 мг
5) 1000 г
34. Коферментами дезаминирования аминокислот могут быть
1) НАД+
2) ФАД
3) ФМН
4) ТПФ
5) КоА
35. В процессе восстановительного аминирования α-кетоглутаровой кислоты участвует
1) НАДФ+
2) НАДФН(Н+)
3) ФАДН2
4) ФМНН2
5) НАД+
36. Серотонин - продукт декарбоксилирования
1) гистидина
2) тирозина
3) пролина
4) фенилаланина
5) 5-окситриптофана
37. Строго кетогенная аминокислота - это
1) аланин
2) валин
3) триптофан
4) лейцин
5) метионин
38. Аргиназа участвует в синтезе
1) оксида азота(11)
2) креатина
3) мочевины
4) серина
5) белка
39. Монооксигеназы участвуют в образовании
1) тирозина
2) диоксифенилаланина
3) норадреналина
4) аспарагина
5) глутамина
40. Внутримолекулярному дезаминированию в организме человека подвергается
1) глицин
2) глутамин
3) гистидин
4) тирозин
5) триптофан
41. Соединения, образующиеся из тирозина, - это
1) γ-аминомасляная кислота
2) адреналин
3) норадреналин
4) дофамин
5) фенилаланин
42. Основной кофермент обмена аминокислот - это
1) КоА
2) ТПФ
3) НАД+
4) биоцитин
5) ПФ
43. Фенилпировиноградная олигофрения развивается в результате врожденного отсутствия фермента класса
1) лиаз
2) лигаз
3) гидролаз
4) изомераз
5) оксидоредуктаз
44. Из аминокислоты тирозина образуются
1) серотонин
2) диоксифенилаланин
3) дофамин
4) норадреналин
5) индол
45. Активация пепсиногена в пепсин осуществляется
1) трипсином
2) химотрипсином
3) пепсином
4) энтерокиназой
5) амилазой
46. Скатол и индол образуются при гнилостном распаде в кишечнике
1) тирозина
2) фенилаланина
3) триптофана
4) гистидина
5) пролина
47. Врожденный недостаток фермента фенилаланин-4-монооксиге- назы (фенилаланингидроксилазы) вызывает
1) фенилпировиноградную олигофрению
2) болезнь Паркинсона
3) алкаптонурию
4) альбинизм
5) гомоцистинурию
48. Фермент секрета поджелудочной железы, не проявляющий протеолитической активности, - это
1) трипсин
2) химотрипсин
3) амилаза
4) карбоксипептидаза
5) аминопептидаза
49. Диоксифенилэтиламин (дофамин) является
1) биогенным амином
2) предшественником синтеза норадреналина
3) сосудорасширяющим агентом
4) производным триптофана
5) предшественником γ-аминомасляной кислоты (ГАМК)
50. Биологическая ценность белка определяется
1) аминокислотным составом
2) наличием заряда
3) возможностью расщепления в желудочно-кишечном тракте
4) содержанием незаменимых аминокислот
5) молекулярной массой
51. Ферменты, участвующие в цикле мочевинообразования, - это
1) аргиназа
2) креатинкиназа
3) карбамоилфосфатсинтетаза
4) уреаза
5) фумараза
52. В моче пациента обнаружено значительное количество гомогентизиновой кислоты. Возможная патология - это
1) альбинизм
2) болезнь Паркинсона
3) цистинурия
4) алкаптонурия
5) фенилкетонурия
53. Наиболее интенсивному дезаминированию в печени подвергается
1) сер
2) гис
3) цис
4) асп
5) глу
54. Общий метаболит процессов синтеза мочевины и ЦТК - это
1) сукцинил-КоА
2) сукцинат
3) аспартат
4) фумарат
5) малат
55. Гистидаза (гистидинаммиаклиаза) катализирует реакцию
1) декарбоксилирования
2) окислительного дезаминирования
3) карбоксилирования
4) внутримолекулярного дезаминирования
5) метилирования
56. Метионин участвует в синтезе
1) адреналина
2) цистеина
3) мочевины
4) фосфатидилхолина
5) норадреналина
Правильные ответы
1. 2, 4
2. 1
3. 4
4. 3
5. 1, 3, 5
6. 2
7. 2, 3
8. 1, 4
9. 1, 2, 3
10. 1
11. 2
12. 3
13. 3
14. 4
15. 4
16. 1, 3
17. 2
18. 3
19. 4
20. 5
21. 4
22. 1
23. 1
24. 5
25. 1, 2, 3, 4
26. 2
27. 3
28. 2
29. 1
30. 1, 4
31. 4
32. 5
33. 1
34. 1, 2, 3
35. 2
36. 5
37. 4
38. 3
39. 1, 2, 3
40. 3
41. 2, 3, 4
42. 5
43. 5
44. 2, 3, 4
45. 3
46. 3
47. 1
48. 3
49. 1, 2
50. 1, 3, 4
51. 1, 3
52. 4
53. 5
54. 4
55. 4
56. 1, 2, 4