Лучевая терапия: учебник. - Т. 2. - Труфанов Г.Е., Асатурян М.А., 2010. - 192 с. : ил.
|
|
|
|
Глава 7. ЛУЧЕВАЯ ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
7.1. ЛУЧЕВАЯ ТЕРАПИЯ РАКА ЛЕГКОГО
Рак легкого занимает первое место в структуре онкологических заболеваний у мужчин. В России отмечается возрастание заболеваемости раком легкого за последние десятилетия более чем в 2 раза. Ежегодно в России заболевают раком легкого свыше 62 000 человек, в том числе свыше 52 000 мужчин. Почти у трети больных с впервые установленным диагнозом диагностируют IV стадию заболевания. Ежегодно среди умерших онкологических больных - более 20 % больные раком легкого. Эта болезнь в большинстве стран является главной причиной смертности у мужчин.
Твердо установлено, что риск заболевания раком легкого высок у тех, кто профессионально контактирует с радиоактивными веществами (шахтеры урановых рудников, лица, получившие более 0,9 Гр при взрывах атомных бомб и радиационных авариях), у работников металлургической, сталелитейной, деревообрабатывающей, никелевой и алюминиевой промышленности. Уровень заболеваемости раком легкого находится в прямой зависимости от количества и сорта потребляемого табака. Известно, что риск заболеть раком легкого у курящих более двух пачек в день длительное время, особенно дешевые сорта табака, выше, чем у некурящих, более чем в 25 раз.
Рак легкого метастазирует по лимфатическим и кровеносным путям. Лимфогенные метастазы могут быть в регионарных (бронхопульмональные, средостенные, трахеобронхиальные, паратрахеальные) и отдаленных (шейные, надключичные, забрюшинные и др.) лимфатических узлах. Гематогенные метастазы могут локализоваться в печени, головном мозге, костях, надпочечниках и других органах. Периферические опухоли, поражая метастазами плевру, могут вызывать опухолевый плеврит.
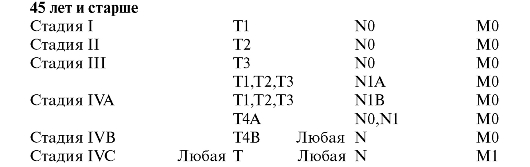
TNM Клиническая классификация Т - Первичная опухоль
ТX - Недостаточно данных для оценки первичной опухоли или опухоль доказана только наличием опухолевых клеток в мокроте, промывных водах бронхов, но не выявляется методами визуализации или при бронхоскопии
Т0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (carcinoma in situ)
Т1 - Опухоль не более 3 см в наибольшем измерении, окруженная легочной тканью или висцеральной плеврой, без видимой инвазии проксимальнее долевого бронха при бронхоскопии (без поражения главного бронха)
Т2 - Опухоль более 3 см в наибольшем измерении, или опухоль любого размера, прорастающая висцеральную плевру, или сопровождающаяся ателектазом, или обструктивной пневмонией, распространяющейся на корень легкого, но не захватывающей все легкое. Проксимальный край опухоли располагается на расстоянии не менее 2 см от карины
Т3 - Опухоль любого размера, непосредственно переходящая на грудную стенку (включая опухоли верхней борозды), диафрагму, медиастинальную плевру, перикард, или опухоль, не доходящая до карины менее чем на 2 см, но без вовлечения карины, или опухоль с сопутствующим ателектазом или обструктивной пневмонией всего легкого
Т4 - Опухоль любого размера, непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, карину (отдельные опухолевые узлы в той же доле или опухоль со злокачественным плевральным выпотом)
Примечание.
1. Необычные поверхностно распространяющиеся опухоли любого размера, если их инфильтративный рост ограничен стенкой бронха, при распространении на главный бронх классифицируются как Т1.
2. Большинство плевральных выпотов, сопутствующих раку легкого, вызваны опухолью, однако имеются случаи, когда многократные цитологические исследования плевральной жидкости не верифицируют опухолевую природу выпота.
Эти данные наряду с клиническими позволяют судить о неопухолевой природе выпота, и в этом случае наличие выпота не оказывает влияния на классификацию Т.
N - Регионарные лимфатические узлы.
NX - Недостаточно данных для оценки регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Имеется поражение перибронхиальных и/или лимфатических узлов корня легкого на стороне поражения, внутрилегочных лимфатических узлов, включая непосредственное распространение опухоли на лимфатические узлы
N2 - Имеется поражение лимфатических узлов средостения на стороне поражения или бифуркационных
N3 - Имеется поражение лимфатических узлов средостения или корня легкого на противоположной стороне, прескаленных или надключичных лимфатических узлов на стороне поражения или на противоположной стороне
М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов
Ml - Имеются отдаленные метастазы, включая отдельные опухолевые узлы в другой доле как на стороне заболевания, так и в противоположном легком
Группировка по стадиям

Основными методами лечения больных раком легкого являются хирургический, комбинированный, лучевой и комплексный.
Хирургическое лечение наиболее эффективно у больных с ограниченными дифференцированными опухолями плоскоклеточного или железистого строения. Основные радикальные операции при раке легкого - пневмонэктомия и лобэктомия, а также их варианты - расширенная или комбинированная пневмонэктомия, лобэктомия с циркулярной резекцией бронхов и др. У больных с периферической опухолью размерами менее 3-4 см иногда проводят сегментэктомию с расширением операции до лобэктомии в случае обнаружения метастазов в лимфатических узлах при срочном морфологическом исследовании.
Абсолютные противопоказания к проведению хирургического лечения: наличие отдаленных метастазов; обширное прорастание опухоли или ее метастазов в аорту, верхнюю полую вену, трахею, противоположный главный бронх, которое не позволяет произвести их резекцию; неспецифический плеврит.
Функциональная недостаточность дыхательной, сердечно-сосудистой, мочевыделительной и эндокринной системы также является распространенным противопоказанием для радикального оперативного вмешательства.
Среди больных с впервые установленным диагнозом рака легкого менее 20 % не имеют противопоказаний к радикальному хирургическому лечению. Поскольку большинство больных к моменту выявления рака легкого оказываются неоперабельными по онкологическим и функциональным показателям, а часть операбельных пациентов отказываются от операции, лучевая терапия становится ведущим методом лечения.
Лучевая терапия проводится по радикальной программе с паллиативной целью и в рамках комбинированного лечения. Радикальная лучевая терапия возможна лишь у больных I-II стадий, у которых есть противопоказания к операции или в случае отказа от нее. Паллиативную лучевую терапию проводят больным с метастазами во всех группах узлов средостения, при их наличии в подключичных лимфатических узлах, после выявления большой распространенности опухоли в процессе пробной торакотомии.
При выраженном положительном эффекте у части больных меняют план лечения на радикальный.
Лучевую терапию осуществляют на дистанционных гамма-установках, линейных ускорителях и бетатронах с применением радиомодификаторов - гипербарической оксигенации, гипертермии и др.
Дистанционное облучение не проводят у больных с обильным кровохарканьем или кровотечением, наличием специфического плеврита, множественных отдаленных метастазов, обширного прорастания в сосуды средостения, трахею, пищевод. Тяжелая интоксикация, выраженные лейкопения и тромбоцитопения, декомпенсация легочно-сердечной, сердечно-сосудистой систем также являются препятствием для проведения лучевой терапии.
Лучевую терапию центрального рака легкого проводят с двух встречных фигурных полей сложной конфигурации, при необходимости с подключением третьего дополнительного поля (см. рис. 36 на цв. вклейке). В поля облучения включают опухоль, метастазы в лимфатических узлах (бронхолегочные, корневые, верхние и нижние трахеобронхиальные, паратрахеальные) или зоны их локализации. После достижения суммарной очаговой дозы 45- 50 Гр рекомендуется уменьшить поля облучения и довести дозу облучения
до 70-80 Гр.
При лучевой терапии периферического рака легкого в объем облучения включают опухоль, зоны регионарных лимфатических узлов и соединяющую их «дорожку» от опухоли к корню легкого. Иногда приходится формировать отдельные поля для опухоли, расположенной субплеврально, и зон регионарных лимфатических узлов. Суммарные дозы такие же, как при лечении центрального рака легкого.
Паллиативная лучевая терапия отличается от радикальной уменьшением суммарной очаговой дозы до 40-45 Гр.
При компрессионном синдроме, обусловленном сдавлением верхней полой вены увеличенными лимфатическими узлами средостения, облучение начинают через переднее прямоугольное поле разовой дозой 1 Гр, затем при уменьшении компрессии проводят лучевую терапию в обычном режиме фракционирования до суммарной поглощенной дозы 25-35 Гр. У 70-85 % больных это позволяет ликвидировать тяжкие клинические симптомы компрессионного синдрома. У части пациентов с выраженной положительной динамикой облучение может быть продолжено до дозы 45-50 Гр.
При комбинированном лечении применяют пред- и послеоперационные курсы лучевой терапии. Предоперационное облучение проводят у больных с относительно ограниченными новообразованиями или с целью перевода неоперабельной опухоли в операбельную. При этом используют методику интенсивно-концентрированного облучения с разовой дозой 4 Гр, суммарной дозой 20 Гр с условием проведения операции через 2-5 дней или методику динамического фракционирования дозы, при которой в течение 3 дней подводят разовые дозы 4 Гр, затем по 2 Гр ежедневно до суммарной дозы 30 Гр с планированием операции через 5-7 дней. При проведении облучения по классической методике подводят суммарную дозу 40 Гр по 2 Гр ежедневно. В зону облучения включают первичную опухоль и зоны регионарного
метастазирования. Лечение чаще всего проводят с двух противолежащих полей, размеры и форма которых зависят от особенностей распространения опухоли.
Послеоперационное облучение обычно также осуществляется с противолежащих полей через 3-4 нед после операции. Суммарные очаговые дозы при этом колеблются от 40 до 50 Гр и зависят от степени радикальности операции, гистологического строения, а также особенностей распространения удаленной опухоли. В объем облучения включают культю бронха и средостение.
При лечении больных распространенным и/или мелкоклеточным раком легкого используют субтотальное облучение тела (СТОТ). Облучению при этом подвергается верхняя половина тела, разовые дозы составляют 1,8-2 Гр, суммарные - 16-20 Гр. СТОТ применяют как вводный курс при мелкоклеточном раке легкого, затем поля переформировываются и продолжается облучение первичного очага и зон регионарного метастазирования. СТОТ может использоваться также как альтернатива химиотерапии, особенно в тех случаях, когда возможности лекарственного лечения исчерпаны. В схемы лечения распространенного или генерализованного мелко- клеточного рака легкого помимо СТОТ нередко включают профилактическое или лечебное облучение головного мозга. Такое облучение проводят с двух встречных височных полей в обычном режиме фракционирования до достижения суммарных очаговых доз порядка 20-30 Гр.
Удаление одиночного метастаза из головного мозга улучшает прогноз: 5-летняя выживаемость при этом составляет 10-20 %. После операции можно провести облучение головного мозга, поскольку общая и безрецидивная выживаемость после комбинированного лечения по поводу одиночного метастаза в головном мозге выше, чем после лучевой терапии.
Альтернативным методом лечения является стереотаксическое облучение метастаза (с последующим облучением головного мозга или без него). Этот метод используют при одиночных метастазах, хирургический доступ к которым невозможен, или при нескольких метастазах.
Симптоматическая лучевая терапия чаще всего применяется при костных метастазах рака легкого. Обычно для этого используют короткие курсы (4 Гр х 5; 6 Гр х 3; 8 Гр х 2), дающие выраженный анальгетический эффект. При метастатическом поражении печени также возможно ее облучение в дозах 30-40 Гр при условии достаточно эффективного облучения первичного очага и зон регионарного метастазирования.
В последние годы разрабатываются методы эндобронхиального лучевого лечения. Используют аппарат типа «Микроселектрон». Источником высокой мощности дозы излучения (12 Гр/ч) является радионуклид 192Ir активностью 5-10 Ки. Брахитерапия проводится по принципу afterloading. При наличии стеноза бронхов вначале перед установкой эндобронхостатов для брахитерапии проводят аргоноплазменную реканализацию бронхиального дерева.
После нескольких сеансов внутриполостного облучения восстанавливается вентиляция нижележащих бронхов, что позволяет проводить дистанционную лучевую терапию, а у части больных встает вопрос о возможности хирургического лечения. Дистанционное облучение проводят в режиме
классического фракционирования до суммарной очаговой дозы 40 Гр. К показаниям для проведения эндобронхиальной лучевой терапии относят наличие местно-распространенного рака трахеи с поражением одного или двух главных бронхов, а также продолженный рост и рецидивы, которые возникли после выполнения операции, облучения, комбинированного лечения. Возможно проведение такого лечения у больных, которым показано хирургическое лечение, но оно невыполнимо по другим, не связанным с резектабельностью опухоли, причинам.
С. Л. Дарьялова (2000) продемонстрировала результаты стойкого излечения при сочетании дистанционной лучевой терапии и эндобронхиальной лучевой терапии такой тяжелой когорты больных, как пациенты с тотальным поражением трахеи и обоих главных бронхов с декомпенсированной легочно-сердечной недостаточностью. Кроме того, такие же обнадеживающие результаты были получены при лечении эндобронхиального рецидива после проведенного ранее хирургического или комбинированного лечения. Устранение обструкции крупных бронхов может увеличить продолжительность жизни, особенно при резком снижении функциональных резервов системы дыхания.
7.2. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ОРОФАРИНГЕАЛЬНОЙ ЗОНЫ
К органам полости рта обычно относят слизистую поверхность губ, щек, ретромолярную часть, преддверие рта, слизистую оболочку верхнего и нижнего альвеолярных отростков, твердого неба, спинку и боковые края языка кпереди от валикообразных сосочков, а также его нижнюю поверхность, дно полости рта. Характерным свойством рака полости рта является раннее лимфогенное метастазирование. Наиболее неблагоприятны инфильтративно-язвенные формы и малодифференцированные раки. Первыми в метастатический процесс вовлекаются подбородочные и подчелюстные лимфатические узлы. Затем поражаются верхние и средние глубокие шейные группы узлов, далее в процесс вовлекаются глубокие шейные и надключичные лимфатические узлы. Нередко выявляются контралатеральные метастазы.
Злокачественные опухоли ротоглотки отличаются более агрессивным течением, чем опухоли полости рта. У большинства больных первым проявлением болезни считают наличие лимфогенных метастазов, для которых не выявлена этапность вовлечения разных групп лимфатических узлов, как при опухолях полости рта. Преобладающую часть опухолей слизистой полости рта составляют рак языка и слизистой дна полости рта.
Анатомические области и части Губа
1. Верхняя губа (красная кайма)
2. Нижняя губа (красная кайма)
3. Углы рта (комиссуры)
Полость рта
1. Слизистая оболочка рта:
а) слизистая поверхность верхней и нижней губ;
б) слизистая поверхность щек;
в) ретромолярная часть;
г) щечно-альвеолярные бороздки верхние и нижние (преддверие рта)
2. Верхний альвеолярный отросток и десна
3. Нижний альвеолярный отросток и десна
4. Твердое небо
5. Язык:
а) спинка и боковые края кпереди от валикообразных сосочков (передние две трети);
б) нижняя поверхность.
6. Дно полости рта.
Регионарными лимфатическими узлами являются шейные лимфатические узлы.
TNM Клиническая классификация T - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли
T0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (carcinoma in situ)
T1 - Опухоль до 2 см в наибольшем измерении
T2 - Опухоль до 4 см в наибольшем измерении
T3 - Опухоль более 4 см в наибольшем измерении
T4A - Губа: опухоль распространяется на кортикальный слой кости, нижний альвеолярный нерв, дно полости рта, кожу (подбородка или носа)
T4A - Полость рта: опухоль распространяется на кортикальный слой кости, глубокие или наружные мышцы языка, верхнечелюстную пазуху, кожу лица
T4B - Губа и полость рта: опухоль распространяется на жевательное пространство, крылья основной кости, основание черепа, оболочку внутренней сонной артерии
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Метастазы в одном лимфатическом узле на стороне поражения до 3 см в наибольшем измерении
N2 - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении или метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении, или метастазы в лимфатических узлах шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N2A - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении
N2B - Метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении
N2C - Метастазы в лимфатических узлах шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N3 - Метастазы в лимфатических узлах более 6 см в наибольшем измерении
M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов M0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям

Слюнные железы
Рак больших слюнных желез: околоушной, подчелюстной, подъязычной.
TNM Клиническая классификация T - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется
T1 - Опухоль до 2 см в наибольшем измерении без экстрапаренхимального распространения
T2 - Опухоль до 4 см в наибольшем измерении без экстрапаренхимального распространения
T3 - Опухоль более 4 см в наибольшем измерении и/или опухоль с экстрапаренхимальным распространением
Т4А - Опухоль распространяется на кожу, нижнюю челюсть, слуховой проход или лицевой нерв
T4B - Опухоль распространяется на основание черепа, крылья основной кости или оболочку сонной артерии
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Метастазы в одном лимфатическом узле на стороне поражения до 3 см в наибольшем измерении
N2 - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении или метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении, или метастазы в лимфатических узлах шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N2A - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении
N2B - Метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении
N2С - Метастазы в лимфатических узлах шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N3 - Метастазы в лимфатических узлах более 6 см в наибольшем измерении
M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов. M0 - Нет признаков отдаленных метастазов. M1 - Имеются отдаленные метастазы.
Группировка по стадиям.

Глотка
TNM Клиническая классификация. Ротоглотка
T1 - Опухоль до 2 см в наибольшем измерении T2 - Опухоль до 4 см в наибольшем измерении T3 - Опухоль более 4 см в наибольшем измерении
T4A - Опухоль распространяется на любую из следующих структур: гортань, глубокие мышцы языка, среднее крыло основной кости, твердое небо, нижнюю челюсть
T4B - Опухоль распространяется на любую из следующих структур: боковую крыловидную мышцу, крылья основной кости, боковую часть носоглотки, основание черепа, оболочку сонной артерии.
Носоглотка
T1 - Опухоль ограничена носоглоткой
T2 - Опухоль распространяется на мягкие ткани ротоглотки и/или носовую полость
T2A - Без распространения на окологлоточное пространство T2B - С распространением на окологлоточное пространство T3 - Опухоль распространяется на костные структуры и/или придаточные полости носа
T4 - Опухоль распространяется на основание черепа и/или поражает черепные нервы, височную ямку, гортаноглотку или орбиту, жевательное пространство
Гортаноглотка
T1 - Опухоль ограничена одной анатомической областью гортаноглотки и не более 2 см в наибольшем измерении
T2 - Опухоль поражает несколько анатомических частей гортаноглотки или прилежащих структур не более 4 см в наибольшем измерении без фиксации половины гортани
T3 - Опухоль размерами более 4 см в наибольшем измерении или с фиксацией половины гортани
T4A - Опухоль распространяется на любую из следующих структур: щитовидно-перстневидный хрящ, подъязычную кость, щитовидную железу, пищевод, центральную часть мягких тканей
T4B - Опухоль распространяется на предпозвоночную фасцию, оболочку сонных артерий, структуры средостения
N - Регионарные лимфатические узлы (рото- и гортаноглотки)
NX - Недостаточно данных для оценки регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Метастазы в одном лимфатическом узле на стороне поражения до 3 см в наибольшем измерении
N2 - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении или метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении, или метастазы в лимфатических узлах шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N2A - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении
N2B - Метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении
N2C - Метастазы в лимфатических узлах шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N3 - Метастазы в лимфатических узлах более 6 см в наибольшем измерении
M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов
M0 - Нет признаков отдаленных метастазов
M1 - Имеются отдаленные метастазы
N - Регионарные лимфатические узлы (носоглотки)
NX - Недостаточно данных для оценки регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Односторонние метастазы в лимфатическом (их) узле (ах) не более 6 см в наибольшем измерении и выше надключичной ямки
N2 - Двусторонние метастазы в лимфатическом (их) узле (ах) не более 6 см в наибольшем измерении, выше надключичной ямки
N3 - Метастазы в лимфатических узлах
N3A - Более 6 см в наибольшем измерении
N3B - В надключичной ямке.
M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов M0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям (ротоглотка, гортаноглотка)

Группировка по стадиям (носоглотка)

Лучевая терапия опухолей полости рта и ротоглотки у подавляющего большинства больных является основным методом лечения. Облучение может быть самостоятельным методом лечения или частью комбинированной терапии. В самостоятельном плане внутритканевая лучевая терапия чаще всего может быть применена при опухолях с индексом T1-T2. При небольших поверхностных односторонних поражениях ротоглотки, задних отделов языка и полости рта возможно дистанционное облучение через одно челюстно-подчелюстное поле.
На первом этапе сочетанной лучевой терапии проводят дистанционное облучение. Задачами дистанционной лучевой терапии при сочетанном лечении являются резорбция экзофитной части опухоли, воздействие на очаги мультицентрического роста, на внутриорганные метастазы. В объем облучения в зависимости от клинической ситуации входят область расположения первичной опухоли вместе с зоной возможного распространения, а также области расположения регионарных лимфатических узлов как первого этапа (подбородочные, подчелюстные) метастазирования, так и верхние, средние и нижние глубокие шейные и надключичные лимфатические узлы. Суммарные очаговые дозы от дистанционного облучения при проведении сочетанной лучевой терапии составляют: в опухоли - 30-36 Гр, в регионарных лимфатических узлах - 36-40 Гр. Пораженные метастазами лимфатические узлы продолжают облучать локальными полями до суммарной дозы 60-65 Гр. Далее проводят внутритканевую лучевую терапию. Очаговая доза планируется с учетом факторов ВДФ до 30-45 Гр.
При принятии решения о проведении только лучевого лечения суммарную очаговую дозу определяют в зависимости от размера опухоли. Так, при категории Т1 она составляет 60-65 Гр, Т2 - 65-70 Гр, Т3-4 - более 70 Гр.
Повышение СОД более 70 Гр должно осуществляться или в условиях конформного, или путем сочетания дистанционного и внутритканевого облучения. С радиобиологических позиций подведение добавочных доз к опухоли должно проводиться с помощью электронного пучка линейного ускорителя.
Применяют расщепленный курс, динамическое фракционирование, мультифракционирование, использование радиомодификаторов.
Дистанционное облучение носоглотки проводят с двух боковых противолежащих полей для облучения области опухоли и с переднего поля для облучения шейных лимфатических узлов. Верхняя граница боковых полей проходит по верхнему краю орбиты, нижняя - в проекции подъязычной кости, передняя - по латеральному краю орбиты, задняя - по задней поверхности шеи. Переднее поле для облучения лимфатических узлов имеет верхнюю границу по подъязычной кости, нижнюю границу - по яремной вырезке грудины, и боковые границы проходят вдоль боковых поверхностей шеи. На переднее поле подводят дозу порядка 46-48 Гр на глубине очага 3 см.
При облучении ротоглотки применяют два боковых поля - от скуловой кости до подъязычной с передней границей по линии середины нижней челюсти, в качестве задней границы - задняя поверхность шеи. Используют защитные блоки, закрывающие головной мозг.
В процессе дистанционного облучения больных с опухолями языка также применяют защиту головного мозга блоками. При разметке боковых полей облучения проводят верхнюю границу в проекции твердого неба, нижнюю - по проекции подъязычной кости, передняя граница - передний край нижней челюсти, задняя - задняя поверхность шеи. Применяются методики подвижного облучения.
При планировании облучения опухолей слизистой оболочки щеки формируют два поля - боковое соответственно стороне поражения и переднее.
Боковое поле размечают с проведением верхней границы по проекции твердого неба, нижней - по горизонтальной ветви нижней челюсти, передней границей является комиссура рта, задней - наружный слуховой проход. Переднее поле формируют на том же уровне с наружной границей по поверхности щеки и внутренней - по среднему отделу нижней челюсти.
Шейные лимфатические узлы облучают с одного переднего и двух задних, а надключичные узлы облучают с передних полей. При облучении лимфатических узлов используют защитные блоки, закрывающие гортань и верхушки легких.
Дистанционное облучение больным раком орофарингеальной области распространенных стадий проводят через стандартные два боковых и переднее поле с экранированием гортани, используя различные режимы фракционирования дозы с расщеплением курса, что позволяет добиться подведения необходимых для регресса опухоли доз порядка 60 Гр без возрастания частоты и степени тяжести лучевых реакций.
При комбинированном лечении выполняют операции на лимфатических узлах шеи. Наибольшее распространение получила двусторонняя верхняя шейная диссекция.
При выполнении предоперационного облучения на лимфатические узлы шеи, когда в них имеются лишь субклинические (микроскопические) изменения, достаточно подведения суммарной очаговой дозы 50 Гр.
При резекции первичной опухоли обычно осуществляют шейную лимфодиссекцию, после чего проводятся облучение в суммарной очаговой дозе не менее 60 Гр. В ряде случаев (поражение лимфатических узлов с выходом опухолевых масс за капсулу или наличие позитивных хирургических краев) необходима и более высокая суммарная очаговая доза - до 65-75 Гр. При вовлечении в процесс шейных лимфатических узлов рекомендуется выполнение лимфодиссекции, после чего через 4-6 нед проводят облучение в суммарной очаговой дозе 65-75 Гр. У части больных лимфатические узлы, считающиеся нерезектабельными, после лучевого лечения можно удалить. Профилактика лучевых реакций и осложнений включает правильное планирование лучевой терапии, режим питания, санацию полости рта, исключение вредных привычек (курение, употребление алкоголя и др.).
7.3. РАК ГОРТАНИ
Рак гортани составляет 4-6 % всех злокачественных опухолей. Среди злокачественных опухолей ЛОР-органов он встречается наиболее часто (50- 60 %). Чаще болеют мужчины в возрасте 35-65 лет. Городское население болеет раком гортани в 1,5-2 раза чаще сельского. Существенную роль в возникновении рака гортани играют вредные профессиональные и бытовые воздействия - работа в условиях повышенного содержания в пыли химических, радиоактивных веществ, курение, употребление алкоголя. Имеет значение наличие в анамнезе папилломатоза гортани. До 98 % опухолей гортани имеют гистологическое строение плоскоклеточного рака.
Онкологи придают важное значение условному анатомическому делению гортани на три области, так как опухоли разных анатомических отделов гортани различаются по прогнозу, метастазированию, симптомам и даже радиочувствительности в связи с особенностями слизистой оболочки, подслизистого слоя, крово- и лимфообращения.
Клинические симптомы заболевания определяются локализацией, степенью распространения и формой роста (экзофитная, эндофитная или инфильтративно-язвенная, смешанная) опухоли. При поражении надсвязочного (вестибулярного) отдела больные жалуются на парестезию, чувство инородного тела в горле, ощущение неудобства при глотании. В дальнейшем присоединяются боли при глотании, иррадиирующие в ухо на стороне поражения. Прогрессирование процесса приводит к появлению охриплости и поперхивания. Рак связочной части отдела гортани проявляется охриплостью, кашлем, при прогрессировании процесса появляются боли и признаки стеноза гортани. Постепенное увеличение стеноза, ухудшение дыхания на фоне медленно прогрессирующей охриплости свидетельствуют о поражении подсвязочного отдела. Гнилостный запах изо рта, кровохарканье являются признаками распада опухоли.
Чаще всего встречаются опухоли надсвязочной части (65 %). Они наиболее злокачественны, быстро распространяются и рано метастазируют. Сравнительно благоприятно протекает рак голосовых связок (32 %). Опухоли подсвязочного отдела встречаются редко (3 %), часто локализуются в подслизистом слое, что затрудняет диагностику и ухудшает прогноз. Чаще всего при первичном обращении диагностируется поражение двух отделов гортани.
TNM Клиническая классификация
Анатомические области и части
I. Надсвязочная часть
Надгортанная часть (включая краевую зону):
1) часть надгортанника выше подъязычной кости (включая верхушку, поверхность гортани, надгортанник, включая хрящевую зону);
2) черпало-подгортанная складка, гортанная часть;
3) черпаловидный хрящ;
Надсвязочная часть, исключая надгортанную:
4) часть надгортанника ниже подъязычной кости;
5) полости желудочков (ложные связки).
II. Связочная часть:
1) истинные голосовые связки;
2) передняя комиссура;
3) задняя комиссура.
III. Подсвязочная часть T - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли
T0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (Carcinoma in situ)
Надсвязочная часть
T1 - Опухоль ограничена одной анатомической областью надсвязочной части, подвижность голосовых связок сохранена
T2 - Опухоль поражает слизистую оболочку нескольких анатомических частей надсвязочной или связочной областей или область вне надсвязочной части (слизистую оболочку корня языка, язычно-надгортанное углубление, медиальную стенку грушевидного синуса) без фиксации гортани
T3 - Опухоль ограничена гортанью с фиксацией голосовых связок и/или распространяется на заднюю область гортанного хряща, преднадгортанную ткань; минимальная эрозия щитовидного хряща
T4A - Опухоль прорастает щитовидный хрящ и/или распространяется на ткани вокруг гортани: трахею, мягкие ткани шеи, включая глубокие/на- ружные мышцы языка, лентовидные мышцы, щитовидную железу, пищевод
T4B - Опухоль прорастает в предпозвоночное пространство, структуру средостения или оболочку сонной артерии
Связочная часть
T1 - Опухоль ограничена голосовыми связками (ой) без нарушения подвижности, может быть вовлечена передняя или задняя комиссуры T1A - Опухоль ограничена одной связкой T1B - Опухоль распространяется на обе связки
T2 - Опухоль распространяется на надсвязочную и/или подсвязочную области с нарушением подвижности голосовых связок
T3 - Опухоль ограничена гортанью с фиксацией голосовых связок, и/или прорастает в надсвязочное пространство, и/или вызывает небольшую эрозию щитовидного хряща
T4A - Опухоль прорастает щитовидный хрящ и/или распространяется на ткани вокруг гортани: трахею, мягкие ткани шеи, включая глубокие/на- ружные мышцы языка, лентовидные мышцы, щитовидную железу, пищевод
T4B - Опухоль прорастает в предпозвоночное пространство, структуру средостения или оболочку сонной артерии
Подсвязочная часть
T1 - Опухоль ограничена подсвязочной частью
T2 - Опухоль распространяется на одну или обе голосовые связки со свободной или ограниченной подвижностью
T3 - Опухоль ограничена гортанью с фиксацией связок T4A - Опухоль прорастает перстневидный или щитовидный хрящ и/или распространяется на ткани вокруг гортани: трахею, мягкие ткани шеи, включая глубокие/наружные мышцы языка, лентовидные мышцы, щитовидную железу, пищевод
T4B - Опухоль прорастает в предпозвоночное пространство, структуру средостения или оболочку сонной артерии
Регионарные лимфатические узлы - лимфатические узлы шеи
NX - Недостаточно данных для оценки состояния узлов N0 - Нет признаков метастатического поражения узлов N1 - Метастазы в одном лимфатическом узле на стороне поражения до 3 см в наибольшем измерении
N2 - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении, или метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении, или метастазы в лимфатических узлах шеи с обеих сторон, или с противоположной стороны до 6 см в наибольшем измерении
N2A - Метастазы в одном лимфатическом узле на стороне поражения до 6 см в наибольшем измерении
N2B - Метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении
N2C - Метастазы в лимфатических узлах с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N3 - Метастазы в лимфатических узлах более 6 см в наибольшем измерении
Примечание.
Лимфатические узлы срединной линии расцениваются как узлы на стороне поражения.
M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов M0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы.
Группировка по стадиям

Наиболее распространенными методами лечения рака гортани являются хирургический, лучевой и комбинированный.
В настоящее время у больных раком гортани I, II и III стадий предпочтительно начинать лечение с проведения лучевой терапии. Если есть противопоказания к облучению или невозможно было получить морфологическое подтверждение диагноза, проводят операцию, во время которой на первом этапе выполняют срочное гистологическое исследование. Лучевая терапия у больных I и II стадий, а также у части больных III стадии может быть самостоятельным видом лечения и привести к излечению.
Облучение проводят на гамма-терапевтических аппаратах, линейных ускорителях, бетатронах. Облучение чаще всего проводят с боковых встречных полей под углом 90° полями 6,0 на 10-12 см. При опухоли голосовых связок I-II стадий высота поля может быть уменьшена до 8 см.
При планировании лучевой терапии в объем облучения, кроме опухоли, включают зоны регионарного метастазирования на шее с обеих сторон. Соответственно, нижняя граница полей облучения проходит по проекции клю-
чицы. Верхнюю границу проводят по горизонтальной ветви нижней челюсти или на 1,5-2,0 см выше при локализации опухоли в надсвязочной части.
Облучение выполняют по радикальной программе с расщеплением курса. В первой половине курса подводят суммарную дозу 40 Гр. Можно использовать методику классического дробления дозы, однако С. Л. Дарьялова и С. А. Сергеев (2000) рекомендуют фракции по 3,3 Гр (1,65 Гр с каждого поля) 3 раза в неделю с интервалом 46 ч до дозы 33 Гр, что эквивалентно 40 Гр классического фракционирования. Через 10 дней после окончания облучения предлагается провести полное обследование с биопсией остаточной опухоли для оценки эффекта терапии с целью выбора дальнейшего метода лечения. При высокой степени резорбции опухоли по данным морфологического обследования продолжают облучение по радикальной программе, доводя суммарную дозу в опухоли до 70 Гр (66-75 Гр в зависимости от стадии). Вторую половину курса облучения проводят уже в более щадящем режиме, по 2 Гр 5 раз в неделю, чтобы избежать риска возникновения лучевого перихондрита.
При принятии решения после подведения дозы 40 Гр провести удаление оставшейся части опухоли необходимо планировать операцию не позднее чем через 2,5-3 нед, не давая возможности процессам репопуляции резистентных к лечению опухолевых клеток.
Хирургический этап лечения после предоперационного облучения определяется локализацией опухоли и ее распространенностью и варьирует от резекции - хордэктомии - боковой, переднебоковой или горизонтальной при ранних стадиях до сложных комбинированных и расширенных вертикальных и горизонтальных резекций. Внедрение функционально-щадящих операций вместо ларингэктомий стало возможным только после проведения необходимого предоперационного облучения.
В рамках комбинированного лечения больных с метастазами в регионарных лимфатических узлах проводят облучение опухоли и метастазов до 40 Гр, затем продолжают облучение первичного очага до 70 Гр и при полном его излечении удаляют метастазы на шее. Таким образом, для регионарных метастазов лучевая терапия является предоперационным курсом, а для первичной опухоли - самостоятельным видом лечения.
Лучевую терапию с паллиативной целью при распространенном опухолевом процессе проводят с использованием методики суперфракционирования дозы - по 1,2 Гр 2 раза в день с интервалом 4-5 ч до суммарной очаговой дозы 45-50 Гр.
С. Л. Дарьялова (2000) при подведении итогов многолетних наблюдений за больными, которым предоперационное облучение проводили в условиях гипербарической оксигенации, продемонстрировала повышение безрецидивной 5-летней выживаемости лечения у больных III стадии с 50 до 80 %.
7.4. РАК ПИЩЕВОДА
Рак пищевода составляет от 2 до 5 % всех злокачественных новообразований и занимает 7-8-е место в структуре онкологической заболеваемости. Рак пищевода встречается чаще всего у мужчин в возрасте 40-60 лет.
К факторам, предрасполагающим к развитию рака пищевода, относят привычку к приему горячей и острой пищи, курение, употребление алкоголя, хронические желудочно-кишечные инфекции, анатомические и функциональные нарушения (грыжи, дивертикулы, ахалазия и др.), а также высокую минерализацию питьевой воды. Предопухолевыми заболеваниями считаются лейкоплакия, хронический эзофагит, полипы, рубцы после ожогов.
Наиболее частым симптомом опухоли пищевода является дисфагия. Выделяют 5 степеней дисфагии:
• I степень - при глотании твердой пищи (хлеб, мясо) возникают неприятные ощущения (жжение, царапанье, иногда боль);
• II степень - затруднение прохождения твердой пищи (хлеб, мясо) по пищеводу, приходится запивать пищу водой;
• III степень - твердая пища не проходит, затруднение при прохождении кашицеобразной и полужидкой пищи (каша, пюре);
• IV степень - по пищеводу проходит только жидкость;
• V степень - полная непроходимость пищевода. Больные не в состоянии проглотить глоток воды, слюну.
Часто больных беспокоят боли, которые могут возникать не только во время приема пищи. В связи с локализацией болей за грудиной, в межлопаточной области появление болей относят к проявлению стенокардии, радикулита при остеохондрозе, что не способствует выявлению ранних стадий рака пищевода. Отмечаются также гиперсаливация, икота. При прогрессировании процесса появляются кашель, кровохарканье при прорастании опухоли в трахею или бронх. Приступообразный кашель при приеме пищи свидетельствует об образовании пищеводно-медиастинального или пищеводно-бронхиального (трахеального) свища. Иногда первыми проявлениями рака пищевода становятся отдаленные метастазы (над ключицей, в печени).
Для рака пищевода характерно лимфогенное метастазирование, причем прежде всего в параэзофагеальные лимфатические узлы на уровне поражения, а также на 4-5 см выше и ниже макроскопически видимых границ опухоли. Регионарными лимфатическими узлами шейного отдела пищевода являются шейные лимфатические узлы, включая надключичные; для внутригрудного отдела пищевода регионарными лимфатическими узлами являются лимфатические узлы средостения, перигастральные, исключая чревные лимфатические узлы.
При раке верхне- и среднегрудного отделов пищевода наблюдаются ретроградные метастазы в паракардиальные и забрюшинные лимфатические узлы. Гематогенные метастазы встречаются значительно реже. Причины гибели больных обычно связаны с местным распространением опухоли с прорастанием в трахею, бронхи, крупные сосуды.
Гистологически чаще всего диагностируется плоскоклеточный рак (95 %), реже опухоль имеет железистое или смешанное строение. Клинически выделяют экзофитную, эндофитную, смешанную и подслизистую формы роста опухоли.
TNM Клиническая классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется Tis - Преинвазивная карцинома (Carcinoma in situ) T1 - Опухоль инфильтрирует стенку пищевода до подслизистого слоя T2 - Опухоль инфильтрирует стенку пищевода до мышечного слоя Т3 - Опухоль инфильтрирует стенку пищевода до адвентиции T4 - Опухоль распространяется на соседние структуры N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценкирегионарных лимфатическихузлов N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Имеется поражение регионарных лимфатических узлов метастазами М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы Для опухолей нижнегрудного отдела пищевода: М1А - Метастазы в чревных лимфатических узлах М1B - Другие отдаленные метастазы Для опухолей верхнегрудного отдела пищевода: М1А - Метастазы в шейных лимфатических узлах М1В - Другие отдаленные метастазы
Для опухолей среднегрудного отдела пищевода: М1А - Не определены
М1В - Нерегионарные лимфатические узлы и другие отдаленные метастазы
Группировка по стадиям

Основными методами лечения рака пищевода являются хирургический, лучевой и комбинированный.
Радикальное хирургическое лечение выполняются менее чем у 10 % больных с впервые выявленным раком пищевода. Хирургическое вмешательство
при ранних стадиях рака пищевода делает вероятным радикальное излечение. При локализованном раке пищевода I-II стадий и отсутствии данных объективного обследования о наличии метастазов проводят органосохраняющее лечение: электро- и лазерную деструкцию опухоли. При этих стадиях можно провести лучевое лечение (дистанционное и сочетанное) по радикальной программе.
В настоящее время большинство больных нуждаются в комбинированном лечении. Предоперационное облучение проводятся с обязательным включением в объем облучения шейно-надключичных зон. Объем облучения устанавливают на основании полученных при обследовании данных о локализации, распространенности опухоли и с учетом для данной локализации регионарных путей лимфооттока. Суммарная очаговая доза составляет 40-45 Гр с использованием методики динамического фракционирования.
Через 10-14 дней после окончания предоперационного облучения проводят контрольное клиническое обследование для оценки эффекта и выработки дальнейшего плана лечения. Оценивают состояние опухоли: изменение ее протяженности по длиннику пищевода, степень стенозирования просвета органа, появление или увеличение в размерах изъязвления и т. п.
Планирование послеоперационной лучевой терапии зависит от проведенной операции. В объем облучения включают ложе пищевода от грудиноключичного сочленения до диафрагмы и параэзофагеального лимфатического коллектора, а также паракардиальную область и шейно-надключичные зоны с подведением СОД 40-45 Гр в режиме классического фракционирования или по схеме динамического фракционирования дозы. Необходимо прицельно облучить до 60-65 Гр участки опухолевой ткани, которые не были удалены в средостении из-за технических проблем.
Облучение после операций, которые оказались паллиативными, проводят в режиме классического фракционирования или суперфракционирования дозы. В объем облучения включают ложе пищевода, области шейнонадключичных и паракардиальных лимфатических коллекторов. На ложе пищевода подводят до 50 Гр, на зоны регионарного метастазирования -
40-45 Гр.
Дистанционная лучевая терапия остается одним из главных методов паллиативного лечения рака пищевода (см. рис. 37 на цв. вклейке). Используют гамма-излучение 60Со и тормозное излучение ускорителей с энергией 4-45 МэВ (преимущественно это дистанционное статическое и подвижное облучение). Низкие результаты лечения диктуют поиск новых методов лечения с возможностью подведения к опухоли пищевода большего уровня доз, чем это возможно при проведении дистанционного облучения.
В настоящее время в клиническую практику активно внедряются аппараты для брахитерапии с шагающим источником излучения. Одним из главных преимуществ брахитерапии является возможность подведения к патологическому очагу высоких доз облучения, значительно больших, чем в окружающих тканях. У части больных удалось с помощью такого облу-
чения получить выраженный эффект и продолжить лучевое лечение по радикальной программе, что привело к длительной частичной, иногда полной ремиссии, а также к улучшению качества жизни больных. Используют брахитерапевтические установки с высокой мощностью дозы излучения. В качестве источника излучения применяют 192Ir с активностью 5-10 Ки. Глубина референтной изодозы не превышает 10 мм от источника, что минимизирует воздействие на прилегающие к пищеводу жизненно важные органы. При этом дозу подводят равномерно с линией излучения до 24 см. Чаще всего проводят 3 сеанса облучения по 7 Гр с интервалом 7 дней. Брахитерапию сочетают с дистанционным облучением.
Проводят исследования по оценке эффективности применения аргоноплазменной коагуляции и сочетанной лучевой терапии (брахитерапия + дистанционное облучение).
Лучевая терапия позволяет у 60-80 % больных добиться регресса опухоли и исчезновения или значительного уменьшения тягостных симптомов, однако благоприятные непосредственные результаты оказываются кратковременными. Пятилетний срок даже после «радикального» лучевого лечения переживают не более 6-10 % больных.
7.5. РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Рак молочной железы - самая распространенная злокачественная опухоль у женщин. Заболеваемость и смертность от рака молочной железы за последние десятилетия продолжают возрастать. В мире ежегодно регистрируется более 1 миллиона случаев рака молочной железы. В России наиболее высокая заболеваемость отмечена в Москве, Санкт-Петербурге, в Северо-Западном регионе страны.
Возникновение рака молочной железы связывают с нарушением функции органов, продуцирующих и участвующих в метаболизме гормонов - яичников, надпочечников, щитовидной железы, гипофиза, гипоталамической системы.
Установлена высокая заболеваемость раком молочной железы в регионах, где женщины рожают редко, имеют поздние роды, делают много абортов, рано прерывают лактацию. Поздние первые роды приводят к резкому повышению уровня эстрадиола, что может стимулировать развитие рака. Считается, что при ранней первой беременности резко увеличивается уровень эстриола, тормозящий канцерогенное действие эстрадиола и эстрона. При лактации женщина также защищена от высокой эстрогенной активности этого периода. К факторам, влияющим на возникновение рака молочных желез, относят дисгормональные расстройства функции яичников на фоне острых и хронических воспалительных заболеваний. Значительно повышается риск заболевания при наличии рака молочной железы у кровных родственников. Имеют значение экзогенные факторы, под действием которых протоонкогены в нормальных клетках превращаются в активные онкогены. К таким факторам относят ионизирующую радиацию, химические канцерогены.
К предраковым заболеваниям относят мастопатию или дисплазию, в основе которых лежат нарушения гормонального статуса. Рак молочной железы, по данным гистологического исследования операционного материала, почти у половины пациенток сочетается с фиброаденоматозом.
Клиника рака молочной железы чаще всего заключается в появлении уплотнения в молочной железе. Отек железы или верхней конечности относятся к поздним симптомам, свидетельствующим о значительном местном или регионарном распространении процесса. Около 85 % злокачественных опухолей молочной железы обнаруживаются самими заболевшими, 10 % РМЖ выявляются при профилактических осмотрах, 5 % - при профилактических маммографических исследованиях.
Молочная железа делится на следующие анатомические части:
1) сосок;
2) центральная часть;
3) верхневнутренний квадрант;
4) нижневнутренний квадрант;
5) верхненаружный квадрант;
6) нижненаружный квадрант;
7) аксиллярный отросток.
Путями оттока лимфы от молочной железы являются подмышечный, подключичный, парастернальный, межреберный, позадигрудинный, перекрестный, а также путь Героты. Главное значение имеет подмышечный путь (до 97 % лимфы оттекает от молочной железы по подмышечным лимфатическим коллекторам); дополнительную роль играют подключичный, парастернальный и другие пути оттока. Опухоли наружных локализаций дают регионарные метастазы преимущественно в подмышечные и подключичные лимфоузлы. При центральном и внутреннем расположении повышается частота метастазов в парастернальные лимфоузлы. Новообразования, расположенные в нижних отделах молочной железы, часто метастазируют в печень. Отдаленные метастазы РМЖ могут возникать в любых тканях и органах, но чаще всего поражают кости, легкие и печень.
Регионарные лимфатические узлы.
1. Подмышечные (на стороне поражения) интерпекторальные (лимфатические узлы Роттера) и лимфатические узлы, располагающиеся вдоль аксиллярной вены и ее притоков, подразделяются на следующие уровни:
1) уровень I (нижние подмышечные): лимфатические узлы, расположенные латерально по отношению к боковой границе малой грудной мышцы;
2) уровень II (средние подмышечные): лимфатические узлы, расположенные между медиальным и латеральным краем малой грудной мышцы, и интрапекторальные (лимфатические узлы Роттера);
3) уровень III (апикальные подмышечные): лимфатические узлы, расположенные медиально по отношению к медиальному краю малой грудной мышцы, исключая подключичные.
Примечание.
Интрамаммарные лимфатические узлы кодируются как аксиллярные (подмышечные).
2. Подключичные на стороне поражения.
3. Внутренние лимфатические узлы молочной железы (на стороне поражения) располагающиеся в эндоторакальной фасции и межреберных пространствах вдоль края грудины.
4. Надключичные на стороне поражения.
Любые другие лимфатические узлы, пораженные метастазами, включая шейные или контралатеральные внутренние лимфатические узлы молочной железы, обозначают как отдаленные метастазы M1.
ВОЗ в 2003 году была принята Международная гистологическая классификация опухолей молочной железы. В классификацию включены эпителиальные опухоли молочной железы, миоэпителиальные нарушения, мезенхимальные и фиброэпителиальные опухоли, опухоли соска, злокачественные лимфомы молочной железы, метастатические опухоли, опухоли мужской грудной железы.
Эпителиальные опухоли, в свою очередь, подразделяются на инфильтрирующие раки, предраковые изменения, включающие дольковые и протоковые неоплазии, внутри-протоковые папиллярные нарушения и доброкачественные эпителиальные пролиферативные нарушения. Инфильтрирующий протоковый рак молочной железы является наиболее распространенной формой, встречается в 80% случаев всех инфильтрирующих раков молочной железы. Имеются различные системы градации степени злокачественности опухолей.
Кроме гистологического варианта строения, для оценки прогноза течения заболевания и чувствительности к гормональному лечению определяют уровень рецепторов стероидных гормонов (эстрогенов, прогестеронов и др.), через которые происходит действие гормонов на клетки опухоли.
По типу роста различают узловую и диффузную формы рака молочной железы. Диффузная форма отличается быстрым ростом и плохим прогнозом. Диффузная форма подразделяется на диффузно-инфильтративную, отечную, отечно-инфильтративную, панцирную, инфламматорную (рожеподобный и маститоподобный рак). На прогноз влияют скорость роста опухоли, локализация в молочной железе, степень дифференцировки, стадия, число пораженных лимфатических узлов. Наличие метастазов в лимфатических узлах надключичной области является признаком генерализации процесса.
Патогенетическая классификация выделяет следующие четыре основные формы рака молочной железы [Семиглазов В. Ф., 1979].
1. Тиреоидная - встречается у женщин в возрасте до 35 лет с патологией щитовидной железы, чаще с гипотиреозом, ожирением, поздним наступлением менструаций. Эта форма гормонорезистентного рака наблюдается у 4-5 % больных.
2. Яичниковая - встречается у женщин 30-50 лет с повышенной эстрогенизацией, ранним началом менструального цикла, нарушением функции яичников с воспалительными и гиперпластическими процессами, мастопатией, наличием в анамнезе рака молочной железы у кровных родственни-
ков. Эта форма болезни отличается неблагоприятным течением, встречается у 40-45 % больных.
3. Надпочечниковая, или гипертензионно-надпочечниковая - выявляется у женщин 50-60 лет с типичными симптомами нарушения стероидной функции надпочечников, с наличием гипертонической болезни, атеросклероза, сахарного диабета, поздним наступлением менопаузы. Встречается у 35-40 % больных. Прогноз такой формы относится к неблагоприятным, чувствительность к гормонотерапии улучшает результаты.
4. Инволютивная - диагностируется у женщин старше 60 лет, находящихся в глубокой менопаузе, с поздними первыми и последними родами. В семейном анамнезе встречаются опухоли женских половых органов и толстой кишки. Такая форма болезни наблюдается у 6-8 % больных, обладает относительно благоприятным течением.
TNM Клиническая классификация Т - Первичная опухоль
Tx - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется
- Преинвазивная карцинома (Carcinoma in situ)
(DCIS) - Интрадуктальная карцинома in situ
(LCIS) - Лобулярная карцинома in situ
(Paget) - Болезнь Педжета соска без наличия опухолевого узла Примечание. Болезнь Педжета, при которой пальпируется опухолевой узел, классифицируется по его размерам.
Т1 - Опухоль до 2 см в наибольшем измерении
T1 mic (микроинвазия) - До 0,1 см в наибольшем измерении
Пр имечание. Микроинвазия - распространение опухолевых клеток через базальную мембрану в прилегающие ткани фокусом не более 0,1 см в наибольшем измерении. При наличии множественных фокусов классификацию проводят по наибольшему измерению. Нельзя использовать сумму фокусов. Наличие множественных фокусов должно быть отмечено так же, как это делается при множественных инвазивных карциномах.
Т1А - До 0,5 см в наибольшем измерении
Т1В - До 1 см в наибольшем измерении
T1C - До 2 см в наибольшем измерении
Т2 - Опухоль до 5 см в наибольшем измерении
Т3 - Опухоль более 5 см в наибольшем измерении
Т4 - Опухоль любого размера с прямым распространением на грудную стенку или кожу так, как описано в Т4А-T4D
Примечан ие. Грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу, но без грудных мышц.
Т4А - Распространение на грудную стенку
Т4В - Отек (включая «лимонную корочку») или изъязвление кожи молочной железы, или сателлиты в коже железы Т4С - Признаки, перечисленные в 4А и Т4В
T4D - Воспалительная форма рака
Примечание. Воспалительная форма рака молочной железы характеризуется диффузным утолщением кожи с плотными краями обычно без подлежащей пальпируемой массы. Если биопсия кожи отрицательна и нет локализованной опухолевой массы, при патологической классификации употребляется категория рТХ, а при клинической - T4D. При оценке категории рТ определяется инвазивный компонент. Втяжение кожи, ретракция соска или другие кожные изменения, за исключением относящихся к Т4В и T4D, могут оцениваться как Т1, Т2 и Т3, не влияя на классификацию.
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Метастазы в смещаемых (ом) подмышечных (ом) лимфатических (ом) узлах (е) на стороне поражения
N2 - Метастазы в подмышечных лимфатических узлах, фиксированные друг с другом, или клинически определяемые метастазы во внутренних лимфатических узлах молочной железы на стороне поражения при отсутствии клинически определяемых метастазов в подмышечных лимфатических узлах на стороне поражения
N2А - Метастазы в подмышечных лимфатических узлах, фиксированных друг к другу или к другим структурам
N2В - Метастазы, определяемые только клинически, во внутренних лимфатических узлах при отсутствии клинически определяемых метастазов в подмышечных лимфатических узлах
N3 - Метастазы в подключичных лимфатических узлах с/без метастазов в подмышечных лимфатических узлах, или клинически определяемые метастазы во внутренних лимфатических узлах молочной железы на стороне поражения при наличии метастазов в подмышечных лимфатических узлах, или метастазы в надключичных лимфатических узлах на стороне поражения с/без метастазов в подмышечных или внутренних лимфатических узлах молочной железы
N3А - Метастазы в подключичных лимфатических узлах
N3В - Метастазы во внутренних лимфатических узлах молочной железы на стороне поражения
N3С - Метастазы в надключичных лимфатических узлах
Пр имечание. «Клинически определяемые» означает выявление метастазов в лимфатических узлах при физикальном осмотре или методах визуализации (исключая сцинтиграфию).
М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям

Примечание. *Т1 включает T1mic.
При раке молочной железы используют весь арсенал современной онкологии: хирургическое лечение, лучевую терапию, химио-, гормоно- и иммунотерапию, а также различные сочетания этих методов. Все лечебные мероприятия, используемые при раке молочной железы, разделяются на местно-регионарные (операция, лучевая терапия) и системные воздействия (химиотерапия, гормонотерапия, иммунотерапия).
Объем оперативного вмешательства различен. Существуют варианты операций - от наиболее типичной и общепринятой радикальной мастэктомии по Холстеду (одномоментное удаление единым блоком всей молочной железы с большой и малой грудными мышцами, подмышечной, подключичной и подлопаточной клетчаткой в пределах анатомических футляров) до радикальной секторальной резекции, относящейся к органосохраняющим операциям.
Хирургический метод в качестве самостоятельного может радикально излечивать больных только при начальных формах неинвазивной карциномы in situ I (ТN0М0) и IIA (Т2N0М0) стадий. При выполнении радикальной резекции после тщательного изучения гистологического материала устанавливают показания к послеоперационной лучевой терапии. Облучение оставшейся части молочной железы проводят при обнаружении неблагоприятных прогностических факторов: наличие долькового или внутрипротокового рака в первичной опухоли, очаги рака in situ в окружающих тканях и дисплазия эпителия III степени.
В ГУ РОНЦ имени Н. Н. Блохина РАМН при органосохраняющем лечении узлового РМЖ используют сочетание фотонного и протонного облучения. Облучению подвергали молочную железу, первичную опухоль, регионарные зоны; гипофиз облучали узкими пучками протонов как альтернативу хирургическому вмешательству с целью сохранения органа, а также у женщин, отказывающихся от операции или имеющих противопоказания к ней.
Лучевая терапия при лечении больных раком молочной железы, применяется в виде предили послеоперационного облучения, а также самостоятельно (см. рис. 38 на цв. вклейке). Предоперационное облучение преследует несколько целей: уменьшить объем опухоли, перевести ее в операбельную форму, уничтожить пролиферирующие клетки опухоли и снизить вероятность диссеминации опухолевых клеток во время операции.
Предоперационная лучевая терапия рекомендуется во всех операбельных случаях, кроме начальных стадий Т1-Т2N0М0 с размерами опухоли не более 3 см. Показаниями к предоперационному облучению являются:
- размеры опухоли более 3 см в диаметре;
- наличие явных регионарных метастазов;
- фиксация опухоли к коже или грудной клетке;
- наличие изъязвлений кожи;
- отек кожи;
- быстрый рост опухоли.
В тех случаях, когда предоперационное облучение планировалось с целью перевода опухоли в разряд резектабельных, но после окончания облучения операция все же оказывалась невыполнимой, лучевая терапия становится самостоятельным методом с доведением доз до уровня радикальных. В дальнейшем лечение дополняют химиотерапевтическим и/или гормональным воздействием.
При предоперационном облучении одновременному лучевому воздействию подвергаются молочная железа и зоны регионарного метастазирования. Облучение проводят на источниках высоких энергий. Используют статические и подвижные методики, поля сложной конфигурации, свинцовые блоки и т. п. Суммарные очаговые дозы составляют 40-50 Гр, подведенные за 4-5 нед. Существуют различные варианты предоперационного дистанционного облучения с подведением суммарных доз, эквивалентных 40-50 Гр, подведенных методом классического фракционирования.
1. При локализации опухоли в наружных квадрантах проводят концентрированное облучение, при котором на молочную железу ежедневно в течение 5-6 дней подводят по 5 Гр, а на зоны регионарного метастазирования (подмышечно-подключичную область) - по 4 Гр. Через 1-3 дня осуществляют операцию. Надключичную и парастернальную зоны облучают через 10-14 дней после операции, подводя на каждую область методом классического фракционирования 44-46 Гр.
2. Вариантом концентрированного предоперационного воздействия является однократное облучение молочной железы и подмышечно-подключичной области в дозе 10 Гр. Операцию в этом случае также выполняется через 1-3 дня.
3. При явных регионарных метастазах, центрально-медиальных локализациях опухолей, размерах новообразований более 3 см все зоны облучают одновременно разовыми дозами 1,8-2,0 Гр до суммарной дозы на молочную железу 45-50 Гр, подмышечно-подключичные области - 35-40 Гр, надключичные - 45 Гр, парастернальные - 45 Гр. На явно выраженные регионарные метастазы дозу доводят до 55-60 Гр. Операцию в этих случаях произ-
водят через 3-4 нед после окончания облучения, обычно к этому времени выраженные лучевые реакции стихают.
4. В схемах предоперационного лечения используют также локальную гипертермию в сочетании с облучением, а также регионарную химиотерапию через катетер, установленный во внутреннюю грудную артерию. Эти воздействия сочетают с облучением, как правило, концентрированным, и используют у больных с инфильтративно-отечными опухолями, новообразованиями больших размеров и т. п.
Послеоперационное облучение выполняют у больных, лечение которых было начато с операции, несмотря на большие размеры опухоли, неблагоприятную локализацию, наличие регионарных метастазов. Такое облучение начинают на 12-14-й день после операции, в зону лучевого воздействия включают область операционного рубца и зоны регионарного метастазирования. Дозы от послеоперационного облучения при обычном фракционировании доводят на область рубца до 50-60 Гр, на регионарные области - до 45-50 Гр. Для послеоперационного лучевого воздействия на парастернальные зоны применяют также методы контактного облучения, реализуемые на аппарате типа Microselectron. Внутреннюю грудную артерию используют в качестве естественного проводника для гибкого интрастата. Создается четко отграниченное дозное поле для облучения цепочки парастернальных лимфатических узлов.
Послеоперационное облучение широко используют при проведении органосохраняющих операций у больных с ограниченными опухолями. В этих случаях применяют также гормональное и химиотерапевтическое воздействие. При правильно определенных показаниях и адекватном лечении стойкое излечение отмечается более чем у 90 % этих больных.
Таким образом, лучевую терапию применяют:
1) при I (Т1N0М0) и IIA (Т2N0М0) стадиях рака - послеоперационное облучение при выявлении факторов риска рецидива;
2) при IIB (T1-2N1M0) и IIIA (T3N0M0) стадиях рака - предоперационное облучение укрупненными фракциями и послеоперационное облучение зон регионарного лимфооттока методом классического фракционирования;
3) При IIIB стадии рака (T3N1M0; T1-3N2M0) в плане комплексного лечения с применением химиогормональной терапии хирургического вмешательства;
4) при IIIB стадии рака (Т4N2М0) у больных с инфильтративно-отечной формой облучение молочной железы и зон регионарного лимфооттока проводят после массивных общих воздействий - гормонотерапии, медикаментозной и двусторонней овариэктомии и химиотерапии. В случае эффективности всего комплекса терапии проводят мастэктомию по Холстеду и повторные курсы полихимиотерапии.
Паллиативную лучевую терапию при рецидивах опухоли или при наличии отдаленных метастазов проводят на выявленные очаги до дозы 40-45 Гр.
Симптоматическое облучение часто используют для достижения быстрого анальгезирующего эффекта при костных метастазах РМЖ. При этом обычно применяют разовые дозы 4-7 Гр, а суммарные - 20-25 Гр.
При лечении больных РМЖ с метастазами в кости скелета применяютдистанционную локальную лучевую терапию, а также внутритканевую терапию препаратами, содержащими радионуклид стронция. При генерализованных формах РМЖ с множественными костными метастазами в качестве паллиативного лечения используют гипофизэктомию, которая может осуществляться в том числе лучевым методом. Целесообразно проводить протонную гипофизэктомию.
Современные методы лечения позволяют получить показатели 5-летней выживаемости при I стадии рака у 96 %, IIA - у 80 %, IIIA - у 87 %, IIIB - у 67 % больных.
7.6. РАК ГРУДНОЙ ЖЕЛЕЗЫ У МУЖЧИН
Встречается в 100 раз реже, чем у женщин, обычно поражает мужчин в возрасте старше 60 лет. В структуре онкологической заболеваемости частота рака грудной железы у мужчин составляет 0,1-0,3 на 100 000. Диагноз обычно бывает поздним, так как ни больной, ни врач долго не подозревают о наличии злокачественной опухоли.
Факторами, способствующими развитию рака грудной железы, могут быть изменения метаболизма половых гормонов при заболеваниях печени и почек, длительное введение экзогенных гормонов при заболеваниях предстательной железы, гормонпродуцирующие опухоли яичек, надпочечников, гипофиза, некоторые генетические заболевания (истинный гермафродитизм, синдром Клайнфельтера), травмы и др.
Наиболее частыми гистологическими формами являются папиллярный рак и слизистая карцинома. Метастазы рака грудной железы в регионарных, главным образом подмышечных, лимфатических узлах к моменту обращения к врачу обнаруживаются более чем в половине случаев.
Предоперационное облучение используют почти у всех больных, что связано с опухолевым поражением подмышечных узлов и высокой частотой язвенных форм. Лечение может включать химиотерапию и гормональные воздействия, в том числе не только лекарственные, но и гонад-, адренал- и гипофизэктомию. Прогноз значительно хуже, чем у женщин, что во многом связано с запущенностью заболевания.
7.7. РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Рак щитовидной железы составляет 1-3 % от всех злокачественных опухолей человека. Вместе с тем рак щитовидной железы - самая распространенная опухоль органов эндокринной системы. Пик заболеваемости приходится на возраст от 40 до 60 лет, женщины болеют в 3-4 раза чаще мужчин.
В последние годы происходит неуклонный рост частоты рака щитовидной железы, что связывают с влиянием неблагоприятных экологических факторов, прежде всего радиационного. Частота рака щитовидной железы возросла у детей и лиц молодого возраста после взрыва атомной бомбы
в Японии и после катастрофы в Чернобыле. Рак щитовидной железы нередко развивается на фоне длительно существующего, обычно узловатого зоба, однако возможно возникновение его и в неизмененной железе, редко - на фоне диффузного токсического зоба. Часто определяется многофокусное поражение щитовидной железы. Одна из форм рака щитовидной железы - медуллярный рак - часто сочетается с поражением надпочечников и околощитовидных желез, то есть развивается синдром Сипла - синдром множественной эндокринной неоплазии.
Начальный период развития опухолей щитовидной железы обычно протекает без симптомов. По мере увеличения размеров опухоли она становится доступной пальпации, а позднее - заметной на глаз. Клинические симптомы (уплотнение ткани железы, увеличение регионарных лимфатических узлов, охриплость голоса или появление триады Горнера вследствие поражения возвратного нерва и симпатического ствола опухолью или метастазами, боли, затруднение дыхания) обычно проявляются при достаточно распространенных новообразованиях. Повышенная выработка кальцитонина сопровождается поносом, болями в костях, остеопорозом.
Клиническое течение и прогноз болезни зависят главным образом от морфологической структуры опухоли. Существует четыре наиболее распространенных гистологических типа:
• папиллярная карцинома (включая фолликулярные фокусы);
• фолликулярная карцинома (включая так называемую Hurthle клеточную карциному);
• медуллярная карцинома;
• недифференцированная (анапластическая) карцинома. Папиллярный рак встречается чаще всего (в 60-75 % случаев), особенно
у молодых людей, и отличается относительно медленным прогрессированием и благоприятным прогнозом. Фолликулярный рак (10-15 %) наблюдается чаще у лиц старше 40 лет. В большинстве случаев выявляются папиллярнофолликулярные формы. Медуллярный рак, возникающий из парафолликулярных клеток (8-10 % всех злокачественных опухолей щитовидной железы), встречается во всех возрастных группах и отличается умеренной степенью злокачественности. Эта опухоль гормонально-активна, продуцирует кальцитонин. Недифференцированные, или анапластические, формы (5-12 %) чаще регистрируются у пожилых людей и относятся к наиболее злокачественным опухолям человека. Весьма злокачественно протекает и такая редкая форма опухоли, как плоскоклеточный рак. Неэпителиальные, смешанные, вторичные и неклассифицированные опухоли встречаются редко и составляют не более 3-6 % всех новообразований щитовидной железы.
TNM Клиническая классификация T - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется
Т1 - Опухоль до 2 см в наибольшем измерении, ограниченная тканью щитовидной железы
Т2 - Опухоль до 4 см в наибольшем измерении, ограниченная тканью щитовидной железы
Т3 - Опухоль более 4 см в наибольшем измерении, ограниченная тканью щитовидной железы, или любая опухоль с минимальным распространением за пределы капсулы (в m. sternothyroid или мягкие ткани около щитовидной железы)
T4A - Опухоль прорастает капсулу щитовидной железы и распространяется на любую из следующих структур: подкожные мягкие ткани, гортань, трахею, пищевод, возвратный нерв
T4В - Опухоль распространяется на предпозвоночную фасцию, сосуды средостения или оболочку сонной артерии
T4A* - Только недифференцированная (анапластическая карцинома) опухоль любого размера, ограниченная щитовидной железой**
T4В* - Только недифференцированная (анапластическая карцинома) опухоль любого размера, распространяется за пределы капсулы щитовидной железы***
Пр имечание. Многофокусные опухоли любого гистологического строения обозначаются m (классификация по наибольшему узлу), например T2(m).
*Все недифференцированные (анапластические) карциномы классифицируются как T4.
**Недифференцированная (анапластическая) опухоль, ограниченная щитовидной железой, считается резектабельной.
***Недифференцированная (анапластическая) опухоль, прорастающая капсулу, считается нерезектабельной.
Регионарные лимфатические узлы - лимфатические узлы шеи Регионарными лимфатическими узлами являются лимфатические узлы шеи и верхнего переднего средостения
NX - Недостаточно данных для оценки состояния узлов N0 - Нет признаков метастатического поражения узлов N1 - Имеется поражение регионарных лимфатических N1А - Метастазы в лимфатических узлах VI уровня (претрахеальные и паратрахеальные), включая окологортанные и лимфатические узлы Delphian а N2В - Поражены метастазами другие шейные лимфатические узлы на одной стороне или с обеих сторон, или на противоположной стороне, верхние/ передние медиастинальные M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов M0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям
Отдельная группировка по стадиям рекомендуется для папиллярного, фолликулярного, медуллярного и недифференцированного рака Папиллярный, фолликулярный рак

Папиллярный, фолликулярный и медуллярный рак
Недифференцированный (анапластический) рак

Хирургический метод является основным при лечении дифференцированных форм рака щитовидной железы. Объем оперативного вмешательства определяется стадией заболевания и морфологической формой рака и варьирует от органосохраняющих операций с тотальным удалением только пораженной доли и перешейка при дифференцированном раке ранних стадий до тиреоидэктомии с ревизией зон регионарного лимфооттока, в том числе околотрахеальной клетчатки и средостения. При обнаружении регионарных метастазов производят футлярную шейную диссекцию.
Недифференцированный рак щитовидной железы отличается чрезвычайно быстрым ростом первичной опухоли. Регионарные и гематогенные (преимущественно легочные) метастазы возникают достаточно рано, но в клинической картине преобладают симптомы, связанные с быстрым, разрушающим ростом первичной опухоли. К моменту госпитализации практически у всех больных имеется опухоль значительных размеров, выходящая за пределы железы. В этих условиях возникает необходимость в обширных оперативных вмешательствах, которые часто оказываются паллиативными.
Отдаленные результаты лечения мало зависят от объема выполненной операции: средняя продолжительность жизни больных анапластическим раком щитовидной железы не превышает 10-12 мес, однако при отсутствии лечения эти больные погибают уже через 1,5-3 мес. Тактика лечения недифференцированного рака щитовидной железы продолжает обсуждаться. В настоящее время представляется целесообразным на первом этапе выполнять разгрузочную операцию с наложением трахеостомы, что позволяет проводить последующее (лучевое или химиотерапевтическое) лечение с минимальным риском асфиксии.
Комбинированное лечение при дифференцированных опухолях щитовидной железы показано при значительном местном и регионарном распространении. Предоперационное дистанционное облучение обычно проводят с переднего поля, включающего область железы, а также лимфатических узлов шеи и переднего верхнего средостения в режиме обычного фракциони-
рования до суммарных доз 35-40 Гр. Операцию выполняют не позднее чем через 2-3 нед после окончания облучения.
Послеоперационная лучевая терапия рекомендуется в случаях, когда не проводилось предоперационное облучение при Т3-Т4, N2-N3, при недифференцированном раке, а также при нерадикальном удалении опухоли или метастазов. Для послеоперационной лучевой терапии используют дозы 45-50 Гр, а на зону нерадикально удаленной опухоли дозу облучения доводят до 60-70 Гр с уменьшенного прицельного поля.
Самостоятельную лучевую терапию при неоперабельных опухолях, а также при наличии множественных метастазов в регионарные лимфатические пути проводят с двух-трех полей, суммарную поглощенную дозу доводят до 60-70 Гр. При анапластическом раке предварительно выполняется наложение трахеостомы, что делает более возможной реализацию облучения.
Для лечения больных с отдаленными метастазами (около 25 % больных с впервые установленным диагнозом) рака щитовидной железы применяют радионуклидную терапию 131I. Метод основан на механизме активного транспорта 131I из крови посредством Na-I симпортера в фолликулярный эпителий щитовидной железы, накопления его в фолликулах в связанном с тирео-глобулином виде и секреции с эффективным периодом полувыведения в несколько дней. В связи с избирательным накоплением 131I тиреоидной тканью наибольшая часть энергии излучения поглощается опухолевыми клетками и метастазами, не повреждая окружающие ткани. Это происходит потому, что радионуклид йода является β-излучателем с длиной пробега электронов в тканях не более 4 мм. Процедура лечения безболезненна, больному надо лишь выпить приготовленный раствор. Радионуклид йода хорошо накапливается в легочных метастазах.
Чем выше дифференцировка клеток, тем выше йоднакопительная функция. К сожалению, при плоскоклеточном раке, недифференцированном медуллярном раке, а также при неэпителиальных опухолях происходит потеря йодпоглотительной способности клеток, и радионуклидная терапия становится неэффективной. Решающим, однако, является результат индивидуального обследования с введением индикаторного количества 131I (0,25 ГБк). Для избирательного накопления радионуклида опухолевыми и метастатическими клетками необходимо удаление здоровой ткани щитовидной железы, так как даже небольшие остатки ткани интенсивно забирают йод. Резкий подъем йоднакопительной функции метастазов отмечается через 3-4 нед после тотального удаления щитовидной железы, так как нарастает секреция гипофизом ТТГ, что обусловило рекомендации начала радионуклидной терапии именно в эти сроки.
При концентрации диагностической активности в остаточной здоровой ткани щитовидной железы необходимо провести лучевую аблацию остатков щитовидной железы путем введения 2-3 ГБк 131I или дистанционным облучением. Если повторное введение индикаторного количества йода (0,25 ГБк) через 4-6 нед выявляет накопление метастазами радионуклида, назначают курсы радионуклидной терапии.
Радионуклидную терапию проводят длительно - в течение 2-3 лет. Больных госпитализируют на 5-7 суток в специальные отделения, в которых есть так называемые «активные койки», то есть помещения с защитой окружающей среды. Если при измерении мощности дозы получают показатели менее 0,3 мР/ч на расстоянии 1 м, больного выписывают. Лечебную активность 2-4 ГБк вводят через 3-5 нед после отмены приема тиреоидных гормонов. Разовая доза определяется из расчета 1-1,5 mC/кг. Детям вводят в 2-3 раза меньше. В промежутках между введениями йода больные получают заместительной гормонотерапии. Таким образом, схема лечения состоит из последовательных чередований трех процедур: заместительной гормонотерапии, отмене гормонов, введении йода. Курс лечения повторяют каждые 3 мес. Радионуклидную терапию прекращают при исчезновении радионуклида в зонах метастазов при радионуклидном исследовании, но суммарное введение активности за весь период лечения не должно превысить 50 ГБк для взрослых пациентов. Детям нельзя превышать дозу 37 ГБк.
При выявлении метастазов рака щитовидной железы в костях проводят дистанционное облучение с использованием разных режимов фракционирования в зависимости от локализации и их числа в суммарных дозах 45-60 Гр.
5-летняя выживаемость больных раком щитовидной железы при высокодифференцированных формах достигает 90-95 %, при медуллярном раке в зависимости от стадии составляет 30-60 %. При недифференцированном раке продолжительность жизни больных даже после комбинированного лечения не превышает 10-15 месяцев.
7.8. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОЖИ
Среди всех онкологических заболеваний злокачественные опухоли кожи занимают 3-е место по частоте. В России отмечен неуклонный рост заболеваемости злокачественными опухолями кожи: он составляет примерно 30-32 случая на 100 000 населения. Выделяют две группы опухолей в зависимости от гистогенеза - эпителиальные (плоскоклеточный рак, базалиома) и неэпителиальные (меланома). Около 90 % опухолей составляют эпителиальные опухоли.
Базалиомой чаще болеют пожилые люди. В большинстве случаев базалиома локализуется на лице, шее, волосистой части головы. Иногда встречаются множественные базалиомы, в том числе и у лиц молодого возраста. Базалиомы кожи отличаются местно-деструирующим ростом, практически никогда не метастазируют, однако без лечения растут и разрушают окружающие ткани. С учетом преимущественной локализации на лице прорастание базалиомы происходит в орбиту, наружный слуховой проход, решетчатый лабиринт.
Существуют различные методы лечения базалиом, среди которых лучевая терапия всегда занимала ведущее место из-за высокой радиочувствительности опухоли, технических возможностей облучения поверхностных образований и хорошего косметического эффекта лечения, а также слож-
Рис. 39. Лучевая терапия базалиомы: а) до облучения, б) после облучения
ностей хирургического вмешательства при локализации в углу глаза, на верхнем веке, в области носа, наружного слухового прохода
Наиболее часто применяют близкофокусную рентгенотерапию. При базалиомах в зону облучения включают опухоль и окружающие ее ткани для исключения маргинальных реци-
дивов. Облучение проводят с одного поля 5 раз в неделю, разовые дозы - 3- 4 Гр, суммарные - 50-55 Гр (рис. 39).
Раку кожи нередко предшествуют хронические воспалительные заболевания, чаще всего при длительно незаживающих язвах, рубцах и свищах. Раковая опухоль может появляться и на фоне специфических хронических воспалений, связанных с туберкулезом кожи, сифилисом, красной волчанкой. Возникновению рака на фоне хронических воспалений обычно предшествует длительный период, иногда исчисляющийся десятилетиями.
В настоящее время факторы экзогенной и эндогенной природы, способствующие возникновению рака кожи, объединяются в три большие группы: 1) факторы внешней среды; 2) хронические воспалительные процессы специфической и неспецифической природы с явлениями патологической регенерации; 3) патологические состояния конституционального или возрастного характера.
К особой группе факторов относятся патологические состояния конституционального или возрастного характера, которые называются облигатными предраками, т. е. почти всегда приводят к возникновению рака кожи. К облигатным предракам относятся пигментная ксеродерма, болезнь Боуэна и эритроплазия Кейра.
Плоскоклеточный рак кожи подразделяется на дифференцированный и недифференцированный и метастазирует лимфогенным путем примерно у 10 % больных. Гематогенные метастазы возникают редко и только на поздних стадиях развития процесса. Особенно злокачественно протекает рак кожи нижних конечностей, иногда не уступая в этом отношении другим локализациям рака.
TNM Клиническая классификация.
Классификация применима только для рака кожи, исключая веко, вульву, половой член, а также злокачественную меланому. Должно быть гистологическое подтверждение диагноза, позволяющее подразделять опухоли на морфологические подвиды.
Т - Первичная опухоль
ТХ - Недостаточно данных для оценки первичной опухоли
Т0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (carcinoma in situ)
Т1 - Опухоль до 2 см в наибольшем измерении
T2 - Опухоль до 5 см в наибольшем измерении
T3 - Опухоль более 5 см в наибольшем измерении
T4 - Опухоль, прорастающая в глубокие экстрадермальные структуры: хрящ, мышцы, кости
Пр имечание. В случае синхронного развития множественных опухолей классификация производится по наибольшей, а количество опухолей указывается в скобках - Т2 (5).
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Имеется поражение регионарных лимфатических узлов метастазами
М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов Ml - Имеются отдаленные метастазы
Группировка по стадиям

В лечении рака кожи используют все методы, которые применяют для лечения злокачественных новообразований: операцию, облучение, криодеструкцию, локальную химиотерапию, лазерную терапию.
Хирургическое лечение рака кожи чаще всего применяют при опухолях кожи туловища и конечностей, где имеется достаточный «запас» кожи. Чем шире удалена опухоль, тем ниже частота рецидивов. Хирургический метод показан при рецидивах, а также при опухолях, развившихся на фоне рубцов и свищевых ходов.
Лучевая терапия является основным видом лечения рака кожи и методом выбора при его локализации на коже головы, особенно лица. Источниками излучения могут быть как близкофокусные рентгенотерапевтические установки, так и мегавольтные источники.
Для лечения плоскоклеточного рака кожи поле облучения должно превышать видимую границу опухоли на 1 см. Режим облучения такой же, как при лечении базалиом, но суммарные дозы доводят до 60-65 Гр.
При распространенных неоперабельных опухолях применяют дистанционную гамма-терапию, электронное излучение или проводят сочетанную лучевую терапию, включающую близкофокусную рентгенотерапию и дистанционную гамма-терапию. Суммарные дозы при этом составляют 60-65 Гр. Местная лучевая реакция при облучении кожи выражается влажным эпидермитом к концу или через 1-2 нед после окончания облучения. Лечение
эпидермита состоит в местном применении метилурациловой и ируксоловой мазей, солкосерила. Эпителизация обычно происходит в течение 4-6 нед.
При наличии увеличенных лимфатических узлов рекомендуется проведение облучения после лимфаденэктомии.
Рак кожи имеет наилучший прогноз среди всех злокачественных опухолей. Базалиомы излечиваются в 95 % случаев. При плоскоклеточном раке в случае отсутствия регионарных метастазов 5-летняя выживаемость составляет 75-85 %. Наличие метастазов в регионарные лимфатические узлы и врастание опухоли в прилежащие органы (Т4, N1) снижают показатели 5-летней выживаемости до 23-27 %.
7.9. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ МЯГКИХ ТКАНЕЙ
Злокачественные опухоли мягких тканей составляют около 1 % от общего числа злокачественных новообразований. Почти треть больных - моложе 30 лет. Саркомы мягких тканей примерно у половины больных локализуются на нижних конечностях, при этом чаще всего поражается бедро. У 25 % больных саркома располагается на верхних конечностях.
К опухолям мягких тканей относят большое количество разных гистологических форм, в зависимости от типа ткани, из которой они развиваются. Наиболее часто среди злокачественных опухолей встречаются рабдомиосаркомы, фибросаркомы, липосаркомы, реже синовиальные саркомы, злокачественные гемангиоперицитомы, мезенхимомы и др.
Истинной капсулы саркомы мягких тканей не имеют, однако в процессе роста новообразование сдавливает окружающие ткани, которые уплотняясь, образуют так называемую ложную капсулу, которая довольно четко контурирует опухоль. Злокачественное новообразование обычно возникает в толще глубоких слоев мускулатуры. По мере увеличения размеров опухоль постепенно распространяется к поверхности тела. Рост ускоряется под влиянием травмы, физиотерапии.
Опухоль обычно одиночна, но для некоторых видов сарком характерны множественные поражения. Иногда они возникают на большом расстоянии друг от друга.
Метастазирование злокачественных новообразований мягких тканей происходит преимущественно гематогенным путем (по кровеносным сосудам). Наиболее часто метастазами поражаются легкие, реже - печень и кости. Метастазы в лимфатические узлы встречаются в 8-10 % случаев.
TNM Клиническая классификация Т - Первичная опухоль
ТХ - Недостаточно данных для оценки первичной опухоли
Т0 - Первичная опухоль не определяется
Т1 - Опухоль до 5 см в наибольшем измерении
Т1А - Поверхностная опухоль*
Т1В - Глубокая опухоль*
Т2 - Опухоль более 5 см в наибольшем измерении Т2А - Поверхностная опухоль* Т2В - Глубокая опухоль*
Примечание.
*Поверхностные опухоли локализуются исключительно выше поверхности фасции без инвазии фасции; глубокие опухоли локализуются ниже поверхностной фасции или прорастают фасцию. Забрюшинные, средостенные саркомы и саркомы таза классифицируются как глубокие.
N - Регионарные лимфатические узлы
Регионарными лимфатическими узлами являются узлы, соответствующие локализации первичной опухоли
NX - Недостаточно данных для оценки состояния узлов N0 - Нет признаков метастатического поражения узлов N1 - Регионарные лимфатические узлы поражены метастазами М - Отдаленные метастазы
МХ - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов М1 - Имеются отдаленные метастазы М1А - Легкое
М1В - В другие отдаленные органы G - Гистопатологическая дифференцировка Высокодифференцированные (низкий grade) Низкодифференцированные (высокий grade)
Пр имечание. Внескелетная саркома Юинга и примитивные нейроэктодермальные опухоли классифицируются как низкодифференцированные.
Группировка по стадиям

Хирургический метод остается ведущим в лечении сарком мягких тканей. В большинстве случаев используют дополнительное лечение - химио- и лучевую терапию.
К преимуществам предоперационного облучения относят уменьшение риска рассеивания опухолевых клеток в ране во время хирургического вмешательства, увеличение резектабельности опухолей, однако возникают сложности с морфологической верификацией и получением полной информации об истинном распространении опухоли. Значительно чаще выполняют послеоперационное облучение.
Предоперационное облучение проводят в СОД до 50 Гр. После проведения органосохраняющей операции продолжают облучение в СОД от 14 до 22-26 Гр в зависимости от результатов морфологического изучения удаленной опухоли и оценки степени радикальности.
Послеоперационное радиационное воздействие может обеспечить частоту 5-летнего локального контроля порядка 80-90 %. СОД при послеоперационном облучении должна составлять не меньше 64-66 Гр.
При лечении сарком мягких тканей конечностей все больше начинают использовать преимущества брахитерапии - возможность подведения больших доз непосредственно к ложу опухоли, уменьшение повреждения окружающих здоровых тканей, раннее начало облучения после операции (через 5-6 дней), что резко уменьшает возможность репопуляции опухолевых клеток. Кроме того, брахитерапию проводят в течение 5-7 дней.
Комбинированное лечение применяют и в случаях рецидивов опухоли.
В ряде случаев радиотерапия при саркомах мягких тканей применяется и в виде самостоятельного, единственного способа лечения - у пациентов с нерезектабельными опухолями, в ситуациях, когда операция невозможна по медицинским показаниям либо при отказе от операции. В случае использования лучевой терапии как единственного метода лечения сарком мягких тканей необходимо стремиться к тому, чтобы СОД была не менее 65 Гр. Если дистанционное воздействие сочетается с брахитерапией, иногда СОД увеличивается до 70-80 Гр, причем вклад брахитерапии составляет порядка 25-35 Гр. При лучевом лечении 5-летняя выживаемость колеблется от 25 до 40 %, а частота локального контроля составляет около 30 %.
Паллиативная лучевая терапия может быть использована при неоперабельных опухолях для временного улучшения состояния больных и уменьшения болей.
При первично установленной генерализации опухоли проводят химиолучевое лечение (сочетание системной химиотерапии с облучением первичного очага и манифестированных метастазов).
Использование комбинированного лечения у больных с первичными опухолями и рецидивами болезни позволило снизить на треть процент рецидивов и достичь показателей 5-летней выживаемости 60-65 %.
7.10. РАК ПРЯМОЙ КИШКИ
Удельный вес рака прямой кишки среди всех злокачественных опухолей человека составляет 3-9 %, а среди опухолей толстой кишки - 70- 80 %. В последние десятилетия отмечается устойчивое повышение заболеваемости раком этой локализации, показатели которой достигают 15-18 на 100 000 населения. Раком прямой кишки чаще болеют мужчины.
К основным предопухолевым заболеваниям относятся полипоз (особенно диффузный), ворсинчатые аденомы, неспецифические язвенные и гранулематозные колиты. Описано раковое превращение прямокишечных свищей, актиномикоза параректальной клетчатки, эндометриоза прямой кишки.
В прямой кишке различают три отдела: нижнеампулярный (длина - 5 см), среднеампулярный (5-10 см) и верхнеампулярный (10-15 см). Рак нижнеампулярного отдела встречается в 25-30 % случаев, среднеампулярного - в 40-45 %, верхнеампулярного - в 23-26 % наблюдений.
Для рака прямой кишки характерны внутристеночный рост, опухолевые клетки, особенно при малодифференцированных и эндофитных формах, находят на расстоянии до 4 см от клинически определяемых границ опухоли. От 30 до 60 % больных с впервые установленным раком прямой кишки имеют метастазы в лимфатических узлах. Регионарными лимфатическими узлами считаются узлы около верхней, средней и нижней частей прямой кишки (геморроидальные), нижние брыжеечные, внутренние подвздошные, мезоректальные, боковые сакральные, пресакральные узлы Герота. Метастазы в других лимфатических узлах классифицируются как M1.
При гематогенном метастазировании чаще всего поражается печень (10-15 % первичных больных); реже отдаленные метастазы обнаруживают в головном мозге, легких и костях.
Клинические проявления рака прямой кишки определяются локализацией и анатомической формой роста опухоли. Чаще всего первым симптомом опухоли считают появление в кале примеси крови и слизи, этому могут сопутствовать чувство неполного опорожнения после акта дефекации. Лентовидный кал, ложные позывы, вздутие живота могут быть обусловлены сужением просвета прямой кишки и переполнением каловыми массами вышележащих отделов. Боль в крестце обычно свидетельствует о выходе опухоли в пресакральную клетчатку, а иногда и о прорастании крестца. Дизурические и половые расстройства у мужчин указывают на сдавление или прорастание мочевого пузыря и предстательной железы. Нарушения общего состояния больных (анемия, похудание, сухость кожи, иктеричность) обычно возникают на поздних этапах развития болезни.
Злокачественные опухоли прямой кишки могут расти экзофитно и эндофитно, выделяют также блюдцеобразную форму рака. Микроскопически 95-98 % опухолей имеют строение аденокарциномы; плоскоклеточный, смешанный и недифференцированный рак встречается редко.
TNM Клиническая классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется
Тis - Интраэпителиальная или с инвазией слизистой оболочки
T1 - Опухоль инфильтрирует стенку кишки до подслизистой
T2 - Опухоль инфильтрирует мышечный слой стенки кишки
Т3 - Опухоль инфильтрирует субсерозу или ткань неперитонизирован-
ных участков прямой кишки
T4 - Опухоль прорастает висцеральную брюшину или непосредственно
распространяется на соседние органы и структуры
Пр имечание. 1Tis включает раковые клетки до базальной мембраны (интраэпители-
альное распространение) или в слизистом слое без распространения в подслизистый слой.
2Прямое распространение при T4 включает распространение на другие сегменты прямо: кишки путем прорастания серозы.
3Прорастание опухоли в другие органы или структуры, определяемое макроскопически классифицируется как T4, однако если нет микроскопического подтверждения, то T3.
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки регионарных лимфатически узлов
N0 - Нет признаков метастатического поражения регионарных лимфа тических узлов
N1 - Метастазы в 1-3 регионарных лимфатических узлах
N2 - Метастазы в 4 и более регионарных лимфатических узлах
М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям

Основной метод лечения больных раком прямой кишки - хирургический. Органосохраняющие экономные операции могут выполняться только в начальных стадиях. Вид операции определяется степенью местного распространения и локализацией опухоли, характером ее роста, гистологическим строением, состоянием регионарного лимфатического аппарата, а также анатомо-топографическими особенностями расположения вышележащих отделов ободочной кишки и общим состоянием больного. Операции проводят с сохранением и без сохранения сфинктерного аппарата. Наиболее часто проводят: переднюю (чрезбрюшную) резекцию прямой кишки; брюшно-анальную резекцию прямой кишки; экстирпацию прямой кишки; операцию Гартмана. Пятилетняя выживаемость после хирургического радикального лечения больных раком прямой кишки колеблется в зависимости от степени распространения опухоли от 30 до 60 %.
У 20-35 % больных раком прямой кишки радикальные операции не могут быть выполнены вследствие значительного местного распространения опухоли либо в связи с наличием отдаленных метастазов. В этих случаях могут выполняться паллиативные хирургические вмешательства: удаление первичной опухоли (операбельный рак с единичными неудаляемыми метастазами, например в легкие) или отключение пораженной опухолью кишки
путем наложения колостомы (неоперабельные опухоли или соматические противопоказания к радикальной операции).
Основной причиной неудач в лечении являются местные рецидивы и метастазы в параректальной клетчатке и лимфатических узлах малого таза. Поэтому наиболее эффективным методом лечения больных раком прямой кишки является комбинированный, который обеспечивает показатели пятилетней выживаемости до 60-70 %. Лучевую терапию при комбинированном лечении проводят в пред- и послеоперационном периодах. Чаще используют предоперационное облучение, которое в том числе увеличивает частоту операбельных случаев.
При лучевой терапии больных раком прямой кишки используют дистанционное или внутриполостное облучение либо их сочетание. Дистанционное облучение позволяет одновременно воздействовать на опухоль и зоны регионарного метастазирования. При внутриполостном облучении основная доза концентрируется в первичной опухоли, при этом обеспечивается максимальное щажение окружающих нормальных тканей.
При предоперационном дистанционном облучении воздействию подвергают всю прямую кишку и клетчатку малого таза. Верхняя и нижняя границы полей облучения должны отстоять от границ опухоли не менее чем на 4- 5 см. Облучение проводят в подвижном режиме или с четырех полей, могут использоваться два встречных противолежащих поля. Суммарные очаговые дозы зависят от режима фракционирования и сроков выполнения операции и колеблются от 20 до 50 Гр. При сочетанном предоперационном облучении суммарные поглощенные дозы от внутриполостного облучения составляют 10-30 Гр, от дистанционного - 15-25 Гр.
При послеоперационном облучении обычно используют классическое фракционирование с доведением суммарной очаговой дозы до 50-60 Гр, а при проведении его в сочетании с предоперационным облучением - 30 Гр.
Лучевая терапия как самостоятельный метод лечения используется при неоперабельном раке прямой кишки, а также при наличии общих противопоказаний к оперативному вмешательству. В этих случаях предпочтительным является сочетанное облучение. На первом этапе проводят дистанционное облучение малого таза до суммарной поглощенной дозы 20-30 Гр. Затем подключают внутриполостное облучение, которое выполняют один или два раза в неделю, разовая доза составляет 5-8 Гр, суммарная - 60- 65 Гр. Дозу от дистанционного облучения на краевые отделы малого таза доводят до уровня 40-45 Гр, при этом на втором этапе облучения прямая кишка экранируется от дистанционного воздействия и облучается только внутриполостным методом. Стойкое излечение после радикальной лучевой терапии наступает только у 20-25 % больных, преимущественно с ограниченными опухолями.
Паллиативная лучевая терапия осуществляется по тем же принципам, что и радикальная, но суммарные поглощенные дозы при этом составляют не более 40-50 Гр.
В качестве факторов повышения эффективности лучевого лечения больных раком прямой кишки используют СВЧ-гипертермию, радиосенсиби-
лизаторы (метронидазол, гипербарическую оксигенацию, их сочетание и др.), проведение комплексного лечения - облучение и химиотерапию.
7.11. РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Рак предстательной железы является одним из наиболее распространенных онкологических заболеваний. Частота рака этой локализации постоянно растет, причем в России темпы прироста заболеваемости значительно опережают опухоли других локализаций. Смертность от рака предстательной железы также постоянно увеличивается. В настоящее время рак предстательной железы занимает 1-2-е место как причина смерти среди всех злокачественных опухолей у мужчин.
Уровень ПСА (простатоспецифический антиген) коррелирует с клинической и гистологической стадией рака предстательной железы и существенно влияет на выбор тактики терапии, а также используется для оценки эффективности проведенного лечения. Обычно верхней границей нормального содержания ПСА в сыворотке крови считается 4,0 нг/мл. Значения 4,0-10,0 нг/мл рассматриваются как промежуточные, именуемые «серой зоной», а более 10,0 нг/мл - как диагностически значимые. Уровни 10,0-20,0 нг/мл часто являются показателем прорастания опухоли за пределы капсулы предстательной железы, уровни выше 40,0 нг/мл свидетельствуют о наличии метастазов.
TNM Клиническая классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется
Т1 - Клинически не определяемая опухоль: не пальпируется, не видна при визуализации
- Случайно обнаружена при гистологическом исследовании, составляет не более 5 % резецированной ткани
Т1В - Случайно обнаружена при гистологическом исследовании, составляет более 5 % резецированной ткани
- Опухоль обнаружена при игловой биопсии (выполнена в связи с повышением ПСА)
T2 - Опухоль ограничена предстательной железой Т2А - Опухоль поражает одну долю Т2В - Опухоль поражает обе доли
Т3 - Опухоль распространяется за пределы капсулы предстательной железы Т3А - Экстракапсулярное распространение (с одной или двух сторон) Т3В - Опухоль прорастает семенные пузырьки
T4 - Опухоль несмещаема или распространяется на другие структуры, чем семенные пузырьки: шейку мочевого пузыря, наружный сфинктер, прямую кишку, леватор и/или стенку таза
Примечание.
1. Опухоль, выявляемая в одной или обеих долях с помощью игловой биопсии, но не пальпируемая и невидимая при визуализации, классифицируется как T1C
2. Распространение на верхушку предстательной железы или (но не через) капсулу классифицируется как T2.
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Имеются метастазы в регионарных лимфатических узлах M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов
М0 - Нет признаков отдаленных метастазов
Ml - Имеются отдаленные метастазы
М1А - Нерегионарные лимфатические (ий) узлы (ел)
М1В - Кость (и)
М1С - Другие локализации
Пр имечание. При наличии различных метастазов учитывается наиболее распространенная категория.
Группировка по стадиям

При лечении рака предстательной железы в настоящее время используют практически все современные методы специфического воздействия, применяемые у онкологических больных: хирургический, лучевой, гормональный, химиотерапевтический. Чаще всего применяют комбинированное лечение. Выбор метода лечения в первую очередь зависит от распространенности опухолевого процесса.
Лучевая терапия в последние десятилетия благодаря развитию и совершенствованию радиотерапевтической техники с мегавольтным излучением является одним из ведущих консервативных методов лечения рака предстательной железы во всех стадиях опухолевого процесса. Это объясняется рядом ее преимуществ перед другими методами терапии.
1. В начальной стадии заболевания лучевая терапия конкурирует с радикальной простатэктомией и служит методом выбора, особенно у лиц пожилого возраста с сопутствующими заболеваниями или при отказе больного от операции. Кроме того, отдаленные результаты обоих методов приблизительно одинаковы, однако после лучевого лечения нет тяжелых хирургичес-
ких осложнений (послеоперационная летальность, импотенция, недержание мочи и т. п.); следовательно, больному обеспечивается лучшее качество жизни.
2. Лучевая терапия является более эффективным методом лечения, чем гормонотерапия и тем более химиотерапия, которая имеет при раке предстательной железы вспомогательное значение. В то же время в отличие от гормонального лечения облучение не оказывает существенного отрицательного влияния на сердечно-сосудистую, свертывающую систему крови, другие системы и органы, изменения которых под воздействием гормонотерапии нередко приводят к преждевременной смерти.
3. Лучевая терапия является практически единственным методом лечения при гормонорезистентных формах рака предстательной железы. Первичная гормонорезистентность наблюдается у 20-30 % больных, а вторичная развивается в процессе гормонотерапии в течение 2-3 ближайших лет. Кроме того, для рака предстательной железы характерна первичная неоднородность морфологического состава. Фенотипически опухолевые клетки в предстательной железе состоят из нескольких типов: гормонозависимые, гормоночувствительные и гормонорезистентные. Лучевая терапия воздействует на все клоны опухолевых клеток.
4. Несомненным преимуществом дистанционной лучевой терапии является возможность локального воздействия не только на первичную опухоль, но и на зоны регионарного и отделенного метастазирования.
Положительная динамика пятилетней выживаемости больных с 10 % в 30-х гг. до 70 % в 80-х гг. при выраженном снижении частоты лучевых осложнений, несомненно, связана с совершенствованием технических возможностей лучевой терапии. Создание аппаратов для контактного облучения по типу afterloading позволило добиться локального излечения опухоли без хирургического вмешательства.
Радикальную лучевую терапию проводят: при стадии опухолевого процесса Т1-3; при отказе от операции или противопоказаниях к хирургическому лечению; при лечении рецидивов после операции, гормоноили химиотерапии, а также при первичной или вторичной гормонорезистентности.
Паллиативную и симптоматическую лучевую терапию проводят больным при стадии Т4 местного распространения; при одиночных и множественных отдаленных метастазов, а также для купирования выраженного болевого синдрома при отдаленных метастазах.
Лучевая терапия в том или ином плане показана практически всем больным РПЖ вне зависимости от стадии опухолевого процесса. Поэтому отбор пациентов для лучевой терапии зависит в основном от противопоказаний, которые выявляются в процессе обследования больного.
Дистанционная лучевая терапия (радикальная, паллиативная, симптоматическая, послеоперационная) может использоваться как самостоятельный метод и в плане комбинированного лечения. Условия облучения необходимо выбирать таким образом, чтобы зоны интереса входили в объем облучения и охватывались 80-90-процентной изодозой.
При точно установленной ранней локальной стадии заболевания Т1-2N0М0 возможно облучение только первичной опухоли (локальная лучевая терапия).
В объем облучения включают предстательную железу с перипростатической клетчаткой, семенные пузырьки, шейку мочевого пузыря, переднюю стенку прямой кишки.
Локальное лучевое воздействие проводится в подвижном режиме на линейном ускорителе в режиме тормозного излучения или гамма-терапевтическом аппарате. Чаще используется однозонная подвижная дистанционная лучевая терапия с углом качания спереди ±90...±120°. Размер поля на оси качания в зависимости от параметров опухоли колеблется от 6 х 8 до 9 х 11 см. В некоторых случаях возможно также использование двухфазной ротации.
В статическом режиме предпочтительнее применять четырехпольные методики облучения. В рекомендациях ВОЗ (2000) предлагается так называемая «Bох»-методика (см. рис. 40 на цв. вклейке). Облучение проводятся с двух противолежащих переднезадних и двух боковых полей под углом 90о к сагиттальной плоскости размерами 8-10 χ 8-10 см в режиме классического фракционирования до суммарной очаговой дозы 64-66 Гр.
В случае более распространенной стадии процесса Т1-2NX-1М0, Т3-4N0М0, в том числе и при риске поражения регионарных лимфатических узлов, необходимо проводить так называемую локорегионарную терапию. В объем облучения при низко- и недифференцированных формах, при которых частота метастазов в лимфатические узлы достигает 85 %, включаются регионарные лимфатические узлы малого таза, расположенные ниже бифуркации общих подвздошных артерий (см. рис. 41 на цв. вклейке).
На первом этапе проводят дистанционную мегавольтную (энергия - 15- 18 МэВ) лучевую терапию в статическом режиме через два противолежащих поля (переднее и заднее) размерами 14-16 χ 15-18 см с границами: верхняя - L5-S1 (допускается середина крестцово-подвздошного сочленения у ослабленных больных), нижняя - нижний край седалищного бугра, боковые - на 1-1,5 см кнаружи от тазового кольца. В режиме классического фракционирования подводится суммарная очаговая доза 44-46 Гр. При N1 СОД по возможности дозу увеличивают до 50 Гр и при высоком уровне ПСА проводится на фоне гормонотерапии.
На II этапе осуществляют локальное облучение предстательной железы в суммарной очаговой дозе, эквивалентной 66-70 Гр традиционного фракционирования.
При диссеминированном раке предстательной железы (Т1-4N0-1М1) тактика лучевой терапии зависит от распространенности опухолевого процесса. При поражении общих подвздошных и парааортальных лимфатических узлов они облучаются двумя противолежащими крупными фигурными полями вместе с очагом и регионарными узлами в режиме обычного фракционирования до СОД = 46-50 Гр. На пораженные метастазами тазовые лимфатические узлы дозу доводят до 50-60 Гр. Облучение первичной опухоли проводятся в суммарной очаговой дозе 64-70 Гр. При наличии одиночных отдаленных метастазов в кости их облучают параллельно локорегионарной лучевой терапией до СОД, эквивалентной 50-60 Гр.
В случае генерализации опухолевого процесса с поражением костей таза, нижнепоясничного, крестцового отделов позвоночника, верхней трети бед-
ренных костей, что наиболее характерно для рака предстательной железы, на первом этапе проводят сегментарное облучение всего таза через два противолежащих поля (0 и 180о) до СОД 20 Гр. Затем объем облучения сокращается до локорегионарного с доведением СОД на предстательную железу и регионарные лимфатические узлы до 44-46 Гр, а в последующем - до локального. При поражении крестцового отдела позвоночника, крестцовоподвздошных сочленений, лонных и седалищных костей СОД локорегионарно рекомендуется довести до 50 Гр. Локальное облучение предстательной железы осуществляют III этапом в режиме среднего фракционирования в РОД 3 Гр ежедневно, 5 фракций в неделю, предпочтительнее в подвижном режиме, до СОД, эквивалентной 64-70 Гр.
При наличии костных метастазов проводят гормонотерапию, вводят бифосфонаты, осуществляют системную лучевую терапию препаратами 898г-хлорида, лучевую (протонную или фотонную) гипофизэктомию, что значительно улучшает прогноз у большинства больных этой категории. Кроме этого остается возможность локального дистанционного облучения средними или крупными фракциями в РОД 3-5 Гр ежедневно до СОД, эквивалентной 30-50 Гр (в зависимости от локализации), наиболее болезненных или угрожающих патологическими переломами либо неврологическими осложнениями метастатических костных очагов вне таза.
В случаях субтотальной или тотальной диссеминации ведущим методом паллиативного лечения остается гормонотерапия. В сдерживании прогрессирования метастатического процесса, купировании болевого синдрома на фоне гормонотерапии или в самостоятельном плане при эндокринной резистентности могут иметь существенное значение методики дистанционного крупнопольного облучения и системная радионуклидная лучевая терапия (898г-хлорид).
Радионуклидную терапию рекомендуется проводить:
- пациентам с распространенными метастазами адъювантно к дистанционной лучевой терапии;
- больным с отсутствием болевых очагов, но при наличии перемежающихся болей в качестве первого плана;
- больным, у которых возможности облучения внешними источниками исчерпаны и достигнут предел толерантности здоровых тканей;
- пациентам, у которых ожидаемая продолжительность жизни составляет не менее 3 мес;
- пациентам с удовлетворительной мочевыделительной функцией и, учитывая гематологическую токсичность 89Sr, резервом костномозговой активности (гемоглобин не менее 110 г/л, тромбоциты не менее 150 млн/л, лейкоциты не менее 3 млн/л);
- больным с литическими метастазами с предварительным курсом лечения ингибиторами костной резорбции;
- для усиления эффекта в сочетании с радиосенсибилизирующими препаратами.
Основные направления повышения локальности облучения предстательной железы - это дистанционное конформное облучение, использование
брахитерапии, а также сочетание дистанционной конвенциональной фотонной радиотерапии с локальным протонным облучением или брахитерапией.
Чаще всего для контактного облучения предстательной железы применяют источники ионизирующего излучения 125I, 193Pd, 1921г, 137Cs. Импланты радиоактивных препаратов вводят непосредственно в железу (см. рис. 42 на цв. вклейке). Суммарная очаговая доза в зависимости от источника составляет обычно от 115 до 160 Гр при использовании брахитерапии в качестве единственного метода лечения у больных локализованным раком предстательной железы и 90- 110 Гр при применении в качестве «добавки» к дистанционному облучению.
Во всех случаях прецизионного локального облучения предстательной железы значительно уменьшается доза воздействия на прямую кишку и мочевой пузырь, что положительно сказывается на снижении частоты и тяжести лучевых повреждений со стороны этих органов.
Локальная гипертермия осуществляется чаще всего трансректально с помощью специальных внутриполостных антенн, излучающих электромагнитные волны микроволнового диапазона, на этапе локального облучения предстательной железы с укрупнением РОД до 3 Гр. Рекомендуется проводить локальную гипертермию 1-3 раза в неделю с температурой в опухоли 42-45 оС в течение 30-60 мин.
Еще одним путем улучшения результатов лучевой терапии в настоящее время является разработка методик мульти- и динамического фракционирования.
После самостоятельной гормонотерапии, которая считается методом выбора при лечении генерализованного рака предстательной железы, 5 лет переживают только 3,8 % пациентов. Применение расширенных программ дистанционного облучения существенно повысило эффективность лечения больных генерализованным раком предстательной железы. Сегментарное облучение таза в случаях преимущественно костных метастазов, использование фигурных полей у больных с генерализацией процесса по лимфатическим узлам, доведение дозы на первичную опухоль до терапевтического уровня позволили добиться того, что 5 лет переживают 27,5 % больных с костными метастазами (М1В) и 43,5 % больных с отдаленными метастазами в лимфатические узлы (М1А).
7.12. РАК МОЧЕВОГО ПУЗЫРЯ
Среди всех злокачественных новообразований рак мочевого пузыря составляет около 4,5 % у мужчин и 1 % у женщин. С каждым годом наблюдается неуклонный рост заболеваемости раком мочевого пузыря. Среди вновь выявляемых больных 20-30 % имеют инвазивный рак мочевого пузыря.
Основным симптомом опухолей мочевого пузыря является макроили микрогематурия. Макрогематурия бывает терминальной и тотальной. Первая наблюдается при локализации опухоли в шейке мочевого пузыря, вторая - при любой локализации. Тотальная гематурия может сопровож-
даться отхождением бесформенных сгустков крови, иногда вызывающих тампонаду мочевого пузыря.
Наиболее частая локализация опухоли - шейка мочевого пузыря и мочепузырный треугольник (треугольник Льето). В 95 % случаев опухоли возникают из переходного эпителия (уротелия) и имеют папиллярное строение.
Рак мочевого пузыря метастазирует довольно редко. Чаще всего метастазами поражаются регионарные лимфатические узлы малого таза, расположенные ниже бифуркации общих подвздошных артерий. Отдаленные метастазы имеют главным образом гематогенное происхождение и локализуются в печени, легких и костях, головном мозге.
TNM классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли T0 - Первичная опухоль не определяется ТА - Неинвазивная папиллярная карцинома
Tis - Преинвазивная карцинома (carcinoma in situ) (плоская опухоль) T1 - Опухоль распространяется на субэпителиальную соединительную ткань
Т2 - Опухоль распространяется на мышцы
T2А - Опухоль распространяется на поверхностную мышцу (внутренняя половина)
T2В - Опухоль распространяется на глубокую мышцу (наружная половина) Т3 - Опухоль распространяется на околопузырные ткани T3А - Микроскопическая
T3В - Макроскопическая (экстрапузырная масса)
Т4 - Опухоль распространяется на любую из следующих структур: предстательную железу, матку, влагалище, стенку таза, брюшную стенку
T4А - Опухоль распространяется на предстательную железу, или матку, или влагалище
T4В - Опухоль распространяется на стенку таза или брюшную стенку N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Имеются метастазы в одном или нескольких лимфатических узлах до 2 см в наибольшем измерении
N2 - Имеются метастазы в одном или нескольких лимфатических узлах до 5 см в наибольшем измерении
N3 - Имеются метастазы в лимфатических узлах более 5 см в наибольшем измерении
M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов Ml - Имеются отдаленные метастазы
Группировка по стадиям

При проведении хирургического лечения выполняют эндовезикальные, трансвезикальные вмешательства, а также цистэктомию и пластические операции. Основным методом среди эндовезикальных операций является трансуретральная резекция - радикальная операция при одиночных и множественных папилломах, стадиях Tis, TA, T1N0M0 и при рецидивных опухолях. Несмотря на совершенствование оперативных вмешательств, частота рецидивов остается высокой. Так, после трансуретральной резекции рецидивы возникают в 48-95 %, после расширенной резекции при инвазивном раке мочевого пузыря - в 55-67 % случаев. Радикальная цистэктомия также не всегда приводит к полному излечению больных раком мочевого пузыря, частота рецидивов составляет 10-60 %.
Современная лучевая терапия также рассматривается в качестве самостоятельного метода лечения больных раком мочевого пузыря. Показатели 5-летней безрецидивной выживаемости после лучевого лечения составляют при I стадии 60-70 %, при II - 35-45 %, при III-VI стадии - 25-31 %.
Результаты лечения больных раком мочевого пузыря во многом определяются локальной эффективностью противоопухолевых воздействий. До 60- 80 % неудач лечения связаны с первичной неизлеченностью опухоли, а также с локальными рецидивами. В этих условиях особенно важным становится достижение полного ответа при первичном лечении больных раком мочевого пузыря. Основными направлениями усиления противоопухолевого эффекта облучения являются дополнение хирургического и лучевого лечения химио- и иммунотерапией. Комбинированное лечение позволяет достигать 5-лет- ней выживаемости при I стадии в 80-90 %, при II - в 55-65 %, при III-IV стадии - в 40-45 % случаев. В то же время и эти показатели свидетельствуют о необходимости дальнейшего повышения эффективности терапии больных раком мочевого пузыря.
Тактика лечения и прогноз больных раком мочевого пузыря зависят от распространенности опухоли, то есть от стадии заболевания. В настоящее время рак мочевого пузыря принято рассматривать не как локальный процесс, а как заболевание всей слизистой оболочки. Кроме этого, к началу лечения у большей части больных могут быть микрометастазы, поэтому основным условием лечения больных является не только локальное хирурги-
ческое вмешательство в опухоль (например, ТУР), но и воздействие на всю слизистую путем использования химио-, лучевой и иммунотерапии.
Чаще всего применяется комбинированное лечение. При выборе метода лечения рак мочевого пузыря условно подразделяется на поверхностный (T0-1) и инвазивный (Т2-4).
При терапии поверхностной опухоли лечение обычно начинают с трансуретральной резекции (ТУР) мочевого пузыря, которая отличается малой травматичностью, относительной безопасностью и возможностью многократного повторения. В плане уменьшения числа рецидивов после ТУР применяют с профилактической целью внутрипузырную химио - и/или иммунотерапию (БЦЖ, интерферон-α).
Открытая классическая резекция мочевого пузыря в комбинации с лучевой терапией, в частности с предоперационным облучением, снижает число рецидивов, по данным Российского онкологического центра, в 2-3 раза и увеличивает 5-летнюю выживаемость примерно в 1,5 раза. Использование в послеоперационном периоде полихимиотерапии еще больше снижает возможность возникновения рецидива, особенно поверхностного рака.
Xотя цистэктомия остается единственным радикальным вмешательством при инвазивном раке мочевого пузыря, неудовлетворенность исходом этой операции в связи с калечащим характером, значительной послеоперационной смертностью, многочисленными осложнениями, а также противопоказаниями к операции у многих пациентов из-за сопутствующих заболеваний и преклонного возраста обусловила поиск альтернативных методов лечения. Прогресс в лучевой терапии и появление новых химиотерапевтических препаратов позволили при сочетании радио- и химиотерапии с органосохраняющим оперативным вмешательством добиться сопоставимой с радикальной цистэктомией 5-летней выживаемости, однако, в связи с сохранением нормальной функции мочевого пузыря качество жизни этих пациентов выше.
При одновременном химиолучевом лечении суммарная очаговая доза обычно снижается. Наиболее предпочтительной при инвазивном раке является системно-регионарная, а при метастатическом - системная полихимиотерапия.
Дистанционная лучевая терапия может использоваться как самостоятельный метод и в плане комбинированного лечения. Среди консервативных методов терапии она занимает ведущее место, а при запущенных формах является методом выбора. Несомненное преимущество лучевой терапии - возможность воздействия не только на первичный очаг, но и на зоны регионарного метастазирования. В зависимости от стадии заболевания и соответственно цели облучения (радикальная, паллиативная, симптоматическая, предили послеоперационная лучевая терапия) выбирают соответствующие условия облучения, режим фракционирования, оптимальную суммарную очаговую дозу.
Радикальную лучевую терапию проводят: операбельным больным, отказавшимся от операции либо с наличием противопоказаний к оперативному лечению; иноперабельным больным в сравнительно удовлетворительном состоянии (в ряде случаев наблюдается перевод опухоли в операбельное со-
стояние); больным после органосохраняющих операций (ТУР, резекция мочевого пузыря); больным с рецидивами рака мочевого пузыря после других методов лечения (оперативный, химиотерапия).
Радикальная лучевая терапия показана больным с множественными низкодифференцированными опухолями и плоскоклеточным раком в стадии Т1, которые имеют худший прогноз. При точно установленной стадии Т1N0М0 можно ограничиться локальным облучением мочевого пузыря с перивезикальной клетчаткой. Суммарная очаговая доза должна быть не менее 60-66 Гр при разовой очаговой дозе 2 Гр за фракцию.
В случае T1NXM0 и T2-3N0M0 проводится радикальный курс лучевой терапии с включением в объем облучения на первом этапе не только мочевого пузыря с перивезикальной клетчаткой, но и регионарных тазовых лимфатических узлов. Рекомендуемая доза - 44-46 Гр в режиме обычного фракционирования, по 2 Гр ежедневно, 5 фракций в неделю. Затем прицельно на мочевой пузырь с перивезикальной клетчаткой в подвижном режиме либо через сокращенные статические поля разовыми очаговыми дозами 2-3 Гр ежедневно суммарную очаговую дозу доводят до эквивалентной
68-70 Гр.
Паллиативную и симптоматическую лучевую терапию проводят в стадиях T4N0M0, T1-4N1M0, T1-4N0M1.
Паллиативную лучевую терапию выполняют при распространенном местном процессе; ослабленным больным с выраженной сопутствующей патологией; в случае нерадикального удаления опухоли при выявлении прорастания в соседние органы во время операции (послеоперационная лучевая терапия с паллиативной целью). При возможности паллиативное облучение начинают проводить в тех же режимах, что и радикальное, поскольку часто удается не ограничиваться паллиативной дозой 30-40 Гр и при удовлетворительной переносимости и хорошей симптоматической динамике подвести более высокие и даже «радикальные» дозы, что способствует большему регрессу опухоли, регионарных метастазов, снятию отягчающих симптомов и увеличивает продолжительность ремиссии с улучшением качества жизни пациентов.
Симптоматическую лучевую терапию применяют для снятия выраженного болевого синдрома в тазе при местно распространенных опухолях и метастазах, особенно в кости; для купирования макрогематурии у не леченных облучением больных. В случае одиночных метастазов в кости с болевым синдромом проводят локальную лучевую терапию с анальгезирующей целью в режиме среднего или крупного фракционирования до суммарной очаговой дозы, эквивалентной 30-50 Гр, в зависимости от локализации депозитов, лучше с одновременным лечением бифосфонатами при остеолитических изменениях. При множественных костных метастазах симптоматическое облучение проводят на болевые и угрожающие патологическими переломами очаги крупными фракциями по 4-5 Гр также желательно на фоне бифосфонатов. Через 1 мес после окончания лечения бифосфонатами остеолитических метастазов целесообразно провести системную радионуклидную лучевую терапию введением 150 МБк 89-стронция хлорида.
Внутриполостную гамма-терапию осуществляют на аппарате типа «АгатВУ» методом afterloading до суммарной очаговой дозы 45-50 Гр. При проведении сочетанной лучевой терапии доза от внутриполостного этапа облучения составляет 30 Гр.
С целью повышения суммарной очаговой дозы при радикальной лучевой терапии до 70-74 Гр без увеличения частоты лучевых повреждений необходимо использовать методики мульти- и динамического фракционирования.
7.13. ЛУЧЕВАЯ ТЕРАПИЯ СЕМИНОМ
Опухоли яичек составляют 1-3 % всех злокачественных новообразований у мужчин. Чаще всего эти опухоли встречаются в возрасте от 20 до 50 лет, обычно являются односторонними.
К предрасполагающим факторам относятся крипторхизм, при котором частота злокачественных превращений повышается в десятки раз, травма яичка (у 20-60 % больных раком яичка в анамнезе), пороки развития, врожденные деформации. Имеются указания на роль гормональных нарушений в возникновении опухолей этой локализации (снижение уровня половых гормонов, увеличение концентрации гонадотропинов).
Основным клиническим симптомом опухоли яичка является его увеличение. Уплотнение консистенции яичка, бугристость его поверхности, появление чувства тяжести в мошонке и болей встречаются более чем у половины впервые выявленных больных. Повышение температуры тела наблюдается при далеко зашедшем процессе. В случаях, когда опухоль возникает в неопустившемся в мошонку яичке, наиболее частыми симптомами являются боли в животе и пояснице, расстройство стула, явления частичной кишечной непроходимости и наличие опухолевого образования в брюшной полости.
Принято различать герминогенные опухоли яичка (из семенного эпителия) и негерминогенные (из элементов стромы). Семиномы составляют 60- 70 % всех герминогенных опухолей. Лучевую терапию чаще всего используют при лечении больных семиномой.
От 30 до 50 % больных при первом обращении уже имеют метастазы. Метастазирование происходит преимущественно в забрюшинные лимфатические узлы. Ретроградное метастазирование происходит в пахово-подвздошные лимфатические узлы. Гематогенные метастазы чаще обнаруживаются в легких и печени.
Для герминогенных опухолей яичка характерно повышение уровней специфических маркеров: бетахорионического гонадотропина и α-фетопротеина. С помощью этого метода устанавливают диагноз в ранних стадиях, обнаруживают наличие метастазов до их клинического проявления и контролируют эффективность лечения. Повышение уровня α-фетопротеина практически никогда не обнаруживают у больных с семиномой и негерминогенными опухолями.
TNM Клиническая классификация Правила классификации
Классификация применима только для герминативных опухолей яичка. Должно быть гистологическое подтверждение диагноза и выделены морфологические подвиды опухоли. Гистопатологическая дифференцировка не применяется.
При данном заболевании часто встречается повышение в сыворотке уровня опухолевых маркеров: α-фетопротеина (АФП), бета-хорионического гонадотропина (β-XГТ), лактатдегидрогеназы (ЛДГ). Стадирование основывается на анатомическом распространении и оценке уровня опухолевых маркеров в сыворотке.
Для оценки N-, M- и S-категории применяют следующие методы:
- N-категории - физикальный осмотр, методы визуализации;
- M-категории - физикальный осмотр, методы визуализации, биохимические тесты;
- S-категории - опухолевые маркеры сыворотки.
Стадии подразделяются с учетом наличия и степени повышения опухолевых маркеров. Сывороточные опухолевые маркеры определяют сразу после удаления яичка. При повышении их уровня выполняют серийное исследование согласно нормальной скорости снижения (распада) АФП (полураспад - 7 дней) и XГТ (полураспад - 3 дня) для оценки степени повышения уровня маркера. Классификация основана на самой низкой оценке и АФП после удаления яичка. Уровень ЛДГ в сыворотке (но не уровень полураспада) имеет прогностическое значение у больных с метастазами и применяется для стадирования.
Т - Первичная опухоль
Степень распространения первичной опухоли оценивают после радикальной орхидэктомии, см. рТ. Если орхидэктомия не производилась, употребляют символ TX.
N - Регионарные лимфатические узлы
Регионарными лимфатическими узлами являются абдоминальные парааортальные, паракавальные, внутритазовые и паховые. Узлы, расположенные вдоль v. spermatic, считаются регионарными. Внутритазовые и паховые узлы относятся к регионарным после операций на мошонке и в паху. Категория N не зависит от локализации регионарных метастазов.
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Имеются метастазы в одном или нескольких лимфатических узлах до 2 см в наибольшем измерении
N2 - Имеются метастазы в одном или нескольких лимфатических узлах до 5 см в наибольшем измерении
N3 - Имеются метастазы в лимфатических узлах более 5 см в наибольшем измерении
М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов
М0 - Нет признаков отдаленных метастазов Ml - Имеются отдаленные метастазы
М1А - Поражены метастазами нерегионарные лимфатические узлы или легкие
М1В - Другие отдаленные метастазы
pTNM Патологическая классификация
рТ - Первичная опухоль
рTX - Недостаточно данных для оценки первичной опухоли (без радикальной орхидэктомии применяется категория рTX)
рТ0 - Первичная опухоль не определяется (то есть гистологический рубец в яичке)
pTis - Внутриканальчатая герминогенная неоплазия (преинвазивный рак)
рТ1 - Опухоль ограничена яичком и придатком без сосудистой лимфатической инвазии, опухоль может врастать в белочную оболочку яичка, но не во влагалищную оболочку
рТ2 - Опухоль ограничена яичком и придатком, имеется сосудистая/ лимфатическая инвазия или опухоль прорастает через белочную оболочку яичка и врастает во влагалищную оболочку
рТ3 - Опухоль распространяется на семенной канатик с/без сосудистой/ лимфатической инвазии
рТ4 - Опухоль распространяется на мошонку с/без сосудистой/лимфа- тической инвазии
pN - Регионарные лимфатические узлы
pNX - Недостаточно данных для оценки регионарных лимфатических узлов
- Метастазы в регионарных лимфатических узлах отсутствуют pN1 - Имеются метастазы до 2 см в наибольшем измерении с поражением до 5 узлов
рN2 - Имеются метастазы до 5 см в наибольшем измерении с поражением до 5 узлов, или распространение опухоли за пределы узла
pN3 - Метастазы в лимфатических узлах более 5 см в наибольшем измерении
рМ - Отдаленные метастазы
рМ-категории соответствуют М-категориям
S - Опухолевые маркеры сыворотки
SX - Невозможна оценка маркеров сыворотки
S0 - Уровни маркеров соответствуют норме
N указывает высшую границу нормы для оценки ЛДГ. *лактатдегидрогеназа. **β-хорионический гонадотропин. ***α-фетопротеин.
Группировка по стадиям

При лечении опухолей яичка применяют хирургический метод, химиотерапию, а также лучевую терапию. Лечение больных начинают с операции - орхофуникулэктомии. Исключение составляют лишь очень большие опухоли, особенно опухоли яичка, задержавшегося в брюшной полости. Здесь возможны предварительное лучевое лечение или химиотерапия.
Вариант органосохраняющей операции в качестве альтернативы орхофуникулэктомии обсуждается при наличии синхронных билатеральных опухолей, метахронных контралатеральных опухолей или опухоли единственного яичка при нормальном уровне тестостерона. Если в резецированном яичке обнаружена внутрипротоковая карцинома, то рекомендуется проведение адъювантной лучевой терапии на оставшуюся часть яичка, как это делается при внутрипротоковой карциноме единственного яичка.
Дальнейший план лечения больных определяется гистологическим строением опухоли.
Опухолевые маркеры необходимо определять перед орхофуникулэктомией и после нее (обычно через 7 дней) для оценки времени их полужизни (норма для АФП < 7 дней,β-ХГ< 3 дней).
Больным семиномами одного гистологического типа при I стадии заболевания и отсутствии метастазов после орхофуникулэктомии с целью профилактики метастазов проводят облучение зон регионарного метастазирования либо курсы химиотерапии. При облучении больных семиномой
I стадии в зону лучевого воздействия включают парааортальные и паракавальные лимфатические узлы и подвздошные лимфатические узлы на стороне расположения опухоли. Обычно используют фигурные поля сложной конфигурации. Верхняя граница зоны облучения находится на уровне ТХI, нижняя - по нижнему краю запирательного отверстия. В объем облучения включают лимфатические узлы в области почечной ножки на одноименной стороне. Латеральные границы парааортального поля должны находиться на 1 см латеральнее поперечных отростков позвонков. Облучение проводят разовыми очаговыми дозами 1,8-2 Гр до суммарной очаговой дозы 20-25 Гр. Блоками защищают головку бедра, контралатеральное яичко. Контралатеральное яичко должно быть защищено от рассеянного излучения свинцовой пластинкой толщиной не менее 1 см.
Облучение зон паховых лимфатических узлов с одного переднего поля проводят при наличии опухолевых клеток в зоне операции по ходу семенного канатика, опухолевой инфильтрации общей влагалищной оболочки яичка и тканей мошонки, а также при выполнении орхифуникулэктомии чрезмошоночным доступом, если в анамнезе у пациента было низведение яичка по поводу крипторхизма.
При IIА и IIВ стадиях семиномы проводят лучевую терапию на те же области, что и при I стадии. При местно распространенной опухоли с вовлечением мошонки или при использовании мошоночного разреза дополнительно облучают мошонку. Рекомендуется облучение электронами 6-12 МэВ. Суммарная очаговая доза составляет 30 Гр, на зоны поражения дозу доводят до 36-40 Гр.
При лечение семином IIC-IIIC стадий сочетают полихимиотерапию с лучевой терапией с индивидуальным планированием объема облучения в зависимости от эффективности химиотерапии, локализации и размеров метастазов.
Лучевая терапия при несеминомных опухолях малоэффективна. Необходимо отметить, что если после гистологического исследования выставлен диагноз семиномы, но имеется повышенный уровень α-фетопротеина, подход к дальнейшему лечению такой же, как при лечении несеминомных опухолей. Это же относится и к опухолям яичка смешанного типа, содержащим элементы семиномы.
Прогноз при опухолях яичка зависит от стадии заболевания, а также от гистологического строения опухолей и является наиболее благоприятным при семиномах. Показатели 5-летней выживаемости при I стадии - более 95 %, при II стадии - около 95 %, при III стадии - до 75 %, при IV стадии - меньше 10 %.
7.14. РАК ШЕЙКИ МАТКИ
Рак шейки матки остается одной из наиболее распространенных злокачественных опухолей у женщин. Несмотря на успехи профилактических мероприятий, до сих пор ежегодно в мире выявляется около 500 000 новых случаев рака шейки матки. Во всем мире рак шейки матки занимает второе
место у женщин по частоте после рака молочной железы. Это наиболее часто встречающаяся опухоль у женщин в Африке, Центральной Америке, тропической Южной Америке, Китае, Индии и других странах Азии. В Северной Америке и в Европе рак шейки матки по частоте занимает четвертое место.
В России за год диагностируется около 12 000 больных инвазивным раком шейки матки. У значительной части пациенток опухоль данной локализации выявляется на поздних стадиях, когда эффективность современных методов лечения резко снижается. Не менее 40 % больных умирает в ближайшие годы после окончания первичного лечения от прогрессирования заболевания.
В этиологии рака шейки матки значительную роль играют экзогенные факторы, среди которых особое значение придается особенностям сексуальной и генеративной функций. У больных раком шейки матки отмечают более раннее начало и большую длительность половой жизни по сравнению с контрольными группами. Риск заболевания возрастает по мере увеличения числа сексуальных партнеров, особенно высока заболеваемость раком шейки матки среди проституток. Риск рака шейки матки возрастает десятикратно для женщин, имевших 6 и более сексуальных партнеров, или при начале половой жизни ранее 15 лет. Беспорядочность половой жизни партнера-мужчины также увеличивает риск заболевания рака шейки матки для женщины. В последнее время сообщается о росте заболеваемости среди молодых женщин. Рак шейки матки во многих развивающихся странах поражает женщин из малообеспеченных социально-экономических групп населения. Как правило, это женщины в возрасте 40-55 лет, имеющие до 15 детей (в среднем - 6-7), преимущественно необразованные и проживающие в сельской местности. У больных раком шейки матки повышена частота нахождения антител к вирусу простого герпеса серотипа 2, цитомегаловируса, а также к вирусам папилломы человека типов 16 и 18.
В 90-95 % опухоль имеет гистологическое строение плоскоклеточного рака различной степени зрелости, в 5-8 % - аденокарциномы.
Рак шейки матки у большинства больных отличается «ортодоксальным» клиническим течением. Прогрессия дисплазии и преинвазивного рака приводит к формированию микроинвазивной опухоли. Превращение в инвазивный рак обычно сопровождается снижением дифференцировки опухоли. Возникновение регионарных метастазов - важный момент клинического развития опухоли. При I стадии заболевания частота метастазов в лимфатических узлах таза составляет 15-20 %; при II - 25-30 %; при III - 40-50 %; при IV стадии - 60-80 %. При изучении результатов патологоанатомических исследований установлено, что ведущим осложнением было сдавление мочеточников на двух уровнях: параметральными инфильтратами и конгломератами в области узлов таза или метастазами в поясничных лимфатических узлах. В 75 % наблюдений была отмечена гнойная инфекция мочевых путей, причем в 22 % случаев непосредственной причиной смерти была уремия. Истощение и интоксикация отмечены в 58 %, перитонит - в 8 % случаев. По образному выражению Я. В. Бохмана, рак шейки матки в большинстве случаев «убивает чужими руками», при этом главную роль играют осложнения со стороны мочевыводящих путей.
TNM Клиническая классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли
T0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (carcinoma in situ)
T1 - Рак шейки матки, ограниченный маткой (распространение на тело не учитывается)
T1А - Инвазивная карцинома, диагностируется только микроскопически.
Все опухоли, определяемые макроскопически, даже при поверхностном распространении, оцениваются T1В/стадия IB
T1A1 - Инвазия стромы не более 3,0 мм в глубину и 7,0 мм по горизонтали
T1A2 - Инвазия стромы вглубь до 5,0 мм, горизонтальное распространение до 7,0 мм
T1В - Клинически видимая опухоль, ограниченная шейкой, или микроскопическая опухоль больше T1A2/IA2
T1В1 - Клинически определяемая опухоль до 4,0 см в наибольшем измерении
T1В2 - Клинически определяемая опухоль более 4,0 см в наибольшем измерении
T2 - Опухоль шейки с распространением на матку, но без прорастания стенки таза или нижней трети влагалища T2A - Без инвазии параметрия T2В - С инвазией параметрия
T3 - Рак шейки с распространением на стенку таза и/или вовлечением нижней трети влагалища, и/или приводит к гидронефрозу, или не функционирующей почке
T3A - Опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза
T3В - Опухоль распространяется на стенку таза и/или приводит к гидронефрозу или не функционирующей почке
T4 - Опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или распространяется далее малого таза
Пр имечание. Наличия буллезного отека недостаточно для классификации опухоли как Т4.
N - Регионарные лимфатические узлы
Регионарными являются лимфатические узлы, расположенные около шейки и тела матки, подчревные (внутренние подвздошные, обтураторные), общие и наружные подвздошные, прекрестцовые и боковые сакральные
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Метастазы в регионарных лимфатических узлах М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов
М0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям

В настоящее время основными методами лечения больных раком шейки матки являются хирургический, лучевой и комбинированный.
Xирургическое лечение проводят в основном у больных с ограниченными опухолями шейки матки. Для большинства больных с преинвазивным раком методом выбора является конусовидная электроэксцизия шейки матки. У больных с преинвазивным раком экстирпацию матки выполняют по следующим основным показаниям:
1) возраст старше 50 лет;
2) преимущественная локализация опухоли в шеечном канале;
3) распространенный анапластический вариант опухоли с врастанием в железы;
4) отсутствие в препарате после проведенной ранее конизации участков, свободных от преинвазивного рака (особенно по линии разреза);
5) техническая невозможность выполнить широкую электроэксцизию (коническая или укороченная шейка матки при сглаженных влагалищных сводах);
6) сочетание преинвазивного рака с миомой матки или опухолями придатков.
В случаях перехода преинвазивного рака на влагалищные своды показана экстирпация матки с верхней третью влагалища. Практически все больные преинвазивным раком шейки матки могут быть излечены.
Оперативное вмешательство широко используется и при лечении больных инвазивным раком шейки матки. Стандартным объемом операции является расширенная экстирпация матки (операция Вертгейма). Операция Вертгейма относится к числу наиболее серьезных онкологических вмешательств; нередко она осложняется повреждением мочевыводящих путей, возникновением так называемых лимфатических кист и лимфостаза.
Комбинированный метод лечения состоит из двух компонентов: хирургического и лучевого, последовательность применения которых может быть различной.
Показаниями к комбинированному лечению являются: IB стадия заболевания (большая экзофитная опухоль; неблагоприятные прогностические факторы; инвазия, превышающая 10 мм), II стадия в тех случаях, когда опухоль сочетается с беременностью и гинекологическими заболеваниями (воспалительный процесс придатков; опухоли матки и яичников), III стадия с поражением регионарных лимфатических узлов (метастатический вариант), невозможность проведения сочетанного лучевого лечения, а также резистентность опухоли к облучению, выявленная при проведении лучевой терапии.
При IB стадии последовательность методов лечения не оказывает существенного влияния на его результативность. Между тем оперативное вмешательство в качестве первого этапа лечения технически проще выполнимо и, соответственно, более эффективно.
Предоперационная лучевая терапия показана при больших экзофитных опухолях (IB стадия); обоснованных подозрениях на метастазы в регионарные лимфатические узлы; некоторых вариантах II стадии рака шейки матки у молодых женщин (переход опухоли на ближайшие к матке отделы параметральной клетчатки или своды влагалища). Основными вариантами предоперационной лучевой терапии являются следующие:
1. Дистанционное облучение первичного очага и зон регионарного метастазирования в статическом или подвижном режиме. Разовые поглощенные дозы составляют 2 Гр, суммарные - порядка 30 Гр. Операция выполняется через 12-14 дней после завершения облучения.
2. Дистанционное облучение тазовых лимфатических узлов через статические поля, разовая очаговая доза в точках В - 4 Гр, суммарная - 16 Гр. На первичный опухолевый очаг до и после дистанционного облучения проводят внутриполостное воздействие по 5-7 Гр в точке А за фракцию. Операцию проводят через 3-7 дней по окончании лучевой терапии.
3. Интенсивное концентрированное дистанционное облучение в подвижном режиме, разовая очаговая доза - 5-6 Гр, суммарная - 20-24 Гр. Расширенную экстирпацию матки проводят на второй-третий день после облучения.
Цель послеоперационного облучения - воздействие на опухолевые клетки, оставшиеся в зоне операции, а также на субклинические очаги поражения. Послеоперационную лучевую терапию осуществляют также у больных, имевших противопоказания к предоперационному облучению, при наличии глубокой инвазии опухоли и при метастазах в регионарные лимфатические узлы, выявленных при гистологическом исследовании удаленного препарата. Достоинством послеоперационного облучения является его целенаправленность, обусловленная четким представлением о распространенности опухолевого процесса.
Послеоперационную дистанционную лучевую терапию проводят с помощью источников высоких энергий (гамма-терапия, линейные ускорите-
ли электронов с энергией тормозного излучения 5-20 МэВ) в статическом или подвижном режиме. Разовые поглощенные дозы при этом обычно составляют 2 Гр, суммарные - 40-46 Гр.
При наличии неблагоприятных прогностических признаков (низкая дифференцировка опухоли, глубокая инвазия, распространение на тело матки, наличие метастазов в регионарных лимфатических узлах) послеоперационная дистанционная лучевая терапия дополняется профилактическим облучением стенок влагалища. При этом разовые дозы на глубине 0,5-1 см составляют около 5 Гр, суммарные - 30-35 Гр. Внутриполостное облучение проводят с ритмом два раза в неделю в дни, свободные от дистанционной лучевой терапии.
Самостоятельная сочетанная лучевая терапия является основным методом лечения, при этом почти у 75 % пациенток лучевая терапия - единственный метод лечения.
Эффективность лучевой терапии неуклонно повышается, что является результатом внедрения новых достижений ядерной физики и клинической дозиметрии, однако до сих пор 30-45 % больных раком шейки матки погибает от основного заболевания, а у 10-30 % пациенток формируются лучевые повреждения, в первую очередь мочевого пузыря и прямой кишки.
Проводят сочетанную лучевую терапию, включающую внутриполостное и дистанционное облучение. Главная цель внутриполостного лучевого воздействия - разрушение первичного опухолевого очага. Оптимальное распределение дозы от внутриполостного облучения достигается размещением источников в полости матки и овоидов в сводах влагалища (рис. 43). Доза при этом рассчитывается на опорную точку А, располагающуюся на 2 см вверх от латерального свода влагалища и на 2 см вбок от оси цервикального канала. Точка В расположена в 5 см от центральной оси таза и анатомически соответствует группе запирательных лимфатических узлов.
Радиоактивные источники размещаются в аппликаторах, которые вводят в полость матки и влагалище. Аппликаторы могут представлять собой просто резиновую внутриматочную трубку и овоиды, вводимые в своды вла-
галища, либо специальные металлические или пластиковые аппликаторы с современными приспособлениями для последовательного введения.
Для внутриполостной лучевой терапии используются 137Cs и 60Co. Аппараты «Агат-В», «Агат-В3», «Агат-ВУ» обеспечивают автоматизацию всего технологического цикла облучения на основе применения средств современной
Рис. 43. Рак шейки матки. Точки учета доз на фронтальной схеме матки
микропроцессорной техники. Эти средства включают в себя систему сигнализации, радиационного контроля, дистанционного компьютерного управления полипозиционным перемещением высокоактивных источников, а также наблюдения за больным в процессе сеанса облучения.
В зависимости от активности источников методики внутриполостного облучения проводят с низкой мощностью дозы (НМД), при которой мощность дозы в точке А составляет 50-70 сГр/ч; средней (СМД) - 15-20 сГр/мин и высокой мощности дозы (ВМД) - более 200 сГр/мин. Физическая доза при переходе от НМД к СМД и ВМД соответственно уменьшается на 10-15 % и на 35- 40 %, что позволяет достичь примерно равного биологического эффекта.
Суммарная очаговая доза от внутриполостного облучения в точках А зависит от стадии заболевания и мощности дозы ионизирующего излучения. При использовании источников НМД у больных I стадии рекомендуется подводить СОД порядка 60-70 Гр, при II стадии - 70-75 Гр, при III стадии - 80-90 Гр.
Дистанционное облучение проводят на зоны регионарного метастазирования, на краевые отделы первичной опухоли, а в некоторых клинических ситуациях - на область первичного очага.
Источниками дистанционного облучения являются линейные ускорители и гамма-терапевтические аппараты. Облучение осуществляют в статическом или подвижном режимах. Разовые поглощенные дозы составляют 2-3 Гр, суммарные - 40-46 Гр.
При местно распространенном раке шейки матки дистанционное облучение на первом этапе может проводиться с двух встречных открытых полей до достижения суммарной очаговой дозы 20-30 Гр. Затем мочевой пузырь, прямая кишка и первичный очаг экранируются (формирующие блоки, поля сложной конфигурации, мето-
дики 4-польного облучения) и доза на точку В доводится до 40-46 Гр (рис. 44). При проведении лучевой терапии у больных I-II стадии первичный опухолевый очаг облучается преимущественно за счет внутриполостных источников. В этих случаях экранирование очага и смежных органов проводится с самого начала облучения.
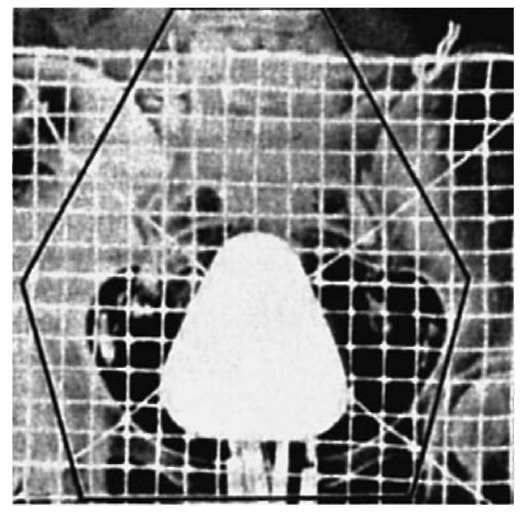
Рис. 44. Рак шейки матки. Дистанционное облучение с использованием формирующего блока(схема фронтального сечения
тела)
Применение в качестве радиомодификатора метронидазола, растворенного в диметилсульфоксиде (ДМСО), позволило повысить пятилетнюю выживаемость больных II стадии на 13 %, III стадии - на 23 %.
ДМСО проявляет свои протекторные свойства, как при самостоятельном применении, так и в качес-
тве растворителя метронидазола. Частота лучевых повреждений прямой кишки и мочевого пузыря при использовании ДМСО снижается в 4-6 раз. При этом удается полностью избежать тяжелых (язвенных или фистульных) лучевых повреждений.
При I стадии рака шейки матки 5-летняя выживаемость колеблется от 73 до 97,5 %. При II стадии, согласно статистическим данным, охватывающим результаты лечения в крупных клиниках мира, 5-летняя выживаемость больных в среднем составляет 48-50 %.
При III стадии злокачественного процесса 5-летняя выживаемость варьирует от 12,5-35 до 63-69,1 %, и при IV стадии - от 0 до 29,2 %.
7.15. РАК ЭНДОМЕТРИЯ (РАК ТЕЛА МАТКИ)
Частота рака эндометрия в последние годы неуклонно возрастает. Рак эндометрия в структуре заболеваемости опухолями женских половых органов занимает около 17,5 %. Показатели заболеваемости раком эндометрия увеличились с 6-7 в 1970 г. до 14-16 на 100 000 женщин в 2004 г.; ежегодный прирост заболеваемости составляет 8-10 %. Увеличение частоты рака эндометрия отмечается преимущественно в странах с высоким экономическим уровнем жизни.
В России за последние 20 лет заболеваемость раком эндометрия увеличилась в 2 раза. Рост заболеваемости связывается с повышением материального уровня жизни, изменением принципов питания (увеличением использования мяса и животных жиров), широким неконтролируемым применением контрацептивов и медикаментов гормональной природы, а также с увеличением общей продолжительности жизни женщин. Летальность от рака эндометрия составляет в мире 4,1; в Европе - 5,7; в России - 5,9 на 100 000 женского населения.
Рак эндометрия является гормонозависимой опухолью, в патогенезе заболевания особую роль играют эстрогены, которые в норме вызывают пролиферативные изменения эндометрия, а при недостаточном влиянии прогестерона приводят к развитию гиперпластических процессов. Основной причиной гиперэстрогении является нарушение овуляции. Клинически это часто проявляется в виде ановуляторных маточных кровотечений. Причина возникновения ювенильных и климактерических кровотечений - персистенция фолликулов, которая создает длительную, повышенную секрецию эстрогенов при низком уровне секреции прогестерона. В этих условиях в эндометрии происходят изменения, свойственные железистой гиперплазии.
Основной симптом рака эндометрия - маточные кровотечения, которые встречаются у 95-98 % больных. В далеко зашедших случаях беспокоят боли, которые связаны с компрессией запирательного или седалищного нерва лимфогенными метастазами или опухолевыми инфильтратами.
Основной путь метастазирования рака эндометрия - лимфатический, при этом в отличие от рака шейки матки поясничные лимфатические узлы
поражаются не реже, чем тазовые. Частота лимфогенных метастазов зависит от степени дифференцировки опухоли, ее локализации, патогенетического варианта, возраста больных, а также глубины инвазии. Отдаленные метастазы выявляются в легких, яичниках, костях скелета.
Аденокарцинома составляет более 90 % всех злокачественных опухолей эндометрия. В зависимости от степени гистологической дифференцировки аденокарцинома эндометрия делится на три основных варианта: высокодифференцированный рак, умеренно дифференцированный, в том числе железисто-солидный рак, низкодифференцированный рак. Высокодифференцированные формы выявляются у 67 % больных, умеренно дифференцированные - у 20 %, и низкодифференцированные - у 9 % пациентов.
ТNМ Клиническая классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли
T0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (carcinoma in situ)
T1 - Опухоль ограничена телом матки
T1A - Опухоль ограничена эндометрием
ПВ - Опухоль распространяется не менее чем на половину миометрия T1С - Опухоль распространяется больше чем на половину миометрия T2 - Опухоль распространяется на шейку, но не за пределы матки T2A - Вовлечены только эндоцервикальные железы T2В - Инвазия стромы шейки
T3 и/или N1 - Местное и/или регионарное распространение как в Т3А,
В N1
T3A - Опухоль вовлекает серозу и/или яичник (прямое распространение или метастазы) и/или раковые клетки в асците или промывных водах
T3В - Опухоль распространяется на влагалище (прямое или метастазы)
N1 - Метастазы в тазовые и/или парааортальные лимфатические узлы T4 - Опухоль распространяется на слизистую оболочку мочевого пузыря и/или толстой кишки
Примечание. Присутствия буллезного отека недостаточно для отнесения опухоли
к Т4.
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Метастазы в регионарных лимфатических узлах М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
Группировка по стадиям

Ведущими методами лечения больных раком эндометрия являются хирургический и комбинированный. При хирургическом лечении больных раком эндометрия используют три вида оперативного вмешательства: простая гистерэктомия; модифицированная расширенная гистерэктомия по Я. В. Бохману и операции Вертгейма.
Простая экстирпация матки может быть выполнена при локализованной (T1-2N0M0), дифференцированной (G1-2) опухоли, а также при наличии у больной серьезной сопутствующей патологии. Модифицированную экстирпацию (гистерэктомия с придатками и тазовыми лимфатическими узлами) выполняется при локализованных (T1-2N0M0) опухолях сниженной дифференцировки (G2-3), а также при местно распространенном (T3АN1M0) процессе независимо от степени дифференцировки опухоли (G1-3). В случаях значительного местного распространения опухоли (T2-3N1M0), перехода ее на цервикальный канал необходимой становится операция Вертгейма.
Комбинированный метод считается основным при лечении больных I-II стадий рака эндометрия с проведением предоперационного или послеоперационного облучения, однако у 18-20 % больных раком эндометрия лучевая терапия является самостоятельным и единственным методом лечения.
Основные принципы лучевой терапии больных раком эндометрия:
1) подведение дозы порядка 55-60 Гр от внутриполостного облучения по наружному контуру матки;
2) сочетанная лучевая терапия (внутриполостное + дистанционное облучение) при наличии неблагоприятных прогностических факторов (тотальное поражение полости матки, переход опухоли на цервикальный канал, выход ее за пределы органа, а также при низкой (G3) дифференцировке новообразования);
3) проведение внутриполостного профилактического облучения стенок влагалища у больных с неблагоприятными факторами прогноза;
4) сочетание лучевой терапии с гормональными препаратами (прогестинами) у больных с новообразованиями высокой и умеренной степени дифференцировки;
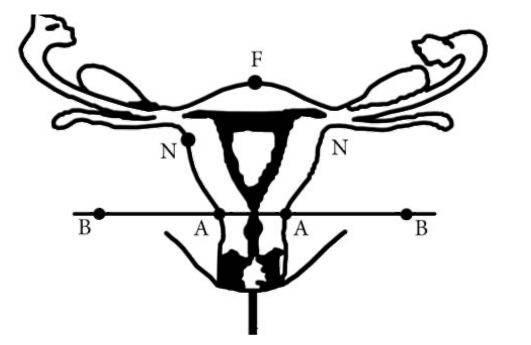
Рис. 45. Рак тела матки. Точки учета доз на фронтальной схеме матки
5) локальное применение электронакцепторных соединений (метронидазола) перед сеансами внутриполостного облучения.
При предлучевой подготовке больных к проведению внутриполостного облучения проводят гистероцервикографию (ГЦГ). При этом выполняют рентгенограммы в двух перпендикулярных проекциях. На прямых рентгенограммах оценивают состояние
боковых контуров полости матки, а также ее поперечный размер. На гистерограмме в боковой проекции оценивают состояние передней и задней стенки матки, определяют длину полости матки от внутреннего зева до дна. С помощью УЗИ определяют наружные контуры матки. После выполнения ГЦГ для каждой больной изготавливают фронтальную схему сечения матки, которая служит основой планирования облучения.
Нормировку разовой поглощенной дозы от внутриполостного облучения проводят в 5 точках. Целью внутриполостного облучения является подведение дозы терапевтического уровня ко всему объему матки, поэтому нормировка доз осуществляется не только в стандартных точках А, соответствующих области внутреннего зева, но и в точках N, расположенных на наиболее удаленных друг от друга боковых стенках матки, и в точке F, расположенной в центре дна матки. Внутриполостная лучевая терапия осуществляется на аппаратах «Агат-В» и «Агат-ВУ» два раза в неделю с разовой дозой в опорной точке 5 Гр до суммарных доз по периметру матки порядка 55-60 Гр.
При каждом сеансе внутриполостного облучения регистрируется поглощенная доза в каждой точке учета (рис. 45).
Пятилетняя выживаемость больных РЭ после проведения лучевой терапии в качестве самостоятельного метода лечения составляет при I стадии 57-86 %; при II стадии - 53-77 %; при III стадии - 37-45 %; и при IV стадии - 25 %.
7.16. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ВУЛЬВЫ
Злокачественные опухоли вульвы составляют от 2,5 до 5 % среди всех онкогинекологических заболеваний, уступая по частоте только раку шейки, тела матки и яичников. Средний возраст больных раком вульвы высок по сравнению с другими злокачественными опухолями репродуктивной системы. В постменопаузе заболеваемость возрастает, а у женщин старше 85 лет частота рака вульвы почти сравнивается с уровнем заболеваемости
раком шейки и тела матки. Следует отметить, что средний возраст больных лейкоплакией и краурозом вульвы, на фоне которых чаще всего возникает рак, на 10 лет меньше, чем у больных со злокачественной опухолью вульвы. Эти цифры дают представление о темпах перерождения предраковой патологии данной локализации.
По форме роста выделяют экзофитную, эндофитную и инфильтративноотечную. Чаще всего встречается экзофитная форма роста, опухоль имеет вид «цветной капусты» или грибовидную форму. Она может иметь ножку, но чаще широким основанием инфильтрирует подлежащие ткани. При эндофитной форме роста опухоль выглядит в виде язвы и не выступает над поверхностью кожно-слизистых покровов.
Xарактерной особенностью рака вульвы является развитие нескольких очагов малигнизации, которые возникают синхронно или метахронно. Этот признак отличает рак вульвы от других злокачественных опухолей женских половых органов и соответствует особенностям рака кожи.
Примерно у половины больных раком вульвы до начала лечения пахово-бедренные лимфатические узлы уже поражены метастазами. Частота регионарных метастазов зависит от величины первичной опухоли. По мере увеличения глубины инвазии опухоли частота регионарных метастазов увеличивается.
TNM - классификация злокачественных опухолей вульвы применима только для первичного рака вульвы. Должно быть гистологическое подтверждение диагноза. Рак вульвы, распространяющийся на влагалище, классифицируется как рак вульвы.
Регионарными лимфатическими узлами являются бедренные и паховые.
TNM Клиническая классификация Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли
Т0 - Первичная опухоль не определяется
Tis - Преинвазивная карцинома (carcinoma in situ)
Т1 - Опухоль ограничена вульвой или вульвой и промежностью, не более 2 см в наибольшем измерении
Т1А - Опухоль ограничена вульвой или вульвой и промежностью до 2 см в наибольшем измерении с инвазией стромы не более 1,0 см*
Т1В - Опухоль ограничена вульвой или вульвой и промежностью, до 2 см в наибольшем измерении с инвазией больше 1,0 см*
Т2 - Опухоль ограничена вульвой или вульвой и промежностью более 2 см в наибольшем измерении
Т3 - Опухоль распространяется на любую из следующих структур: нижнюю уретру, влагалище, анальное кольцо
Т4 - Опухоль распространяется на любую из следующих структур: слизистую оболочку мочевого пузыря, слизистую оболочку верхней части уретры, слизистую оболочку прямой кишки или опухоль фиксирована к кости
Примечание. *Глубина инвазии определяется как распространение опухоли от эпителиально-стромального соединения прилежащих наиболее поверхностных дермальных сосочков до наиболее глубокой точки инвазии.
N - Регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфа тических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатичес ких узлов
N1 - Метастазы в регионарных лимфатических узлах с одной стороны N2 - Метастазы в регионарных лимфатических узлах с обеих сторон М - Отдаленные метастазы
МХ - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов
М1 - Имеются отдаленные метастазы (включая метастазы в лимфати ческие узлы таза)
Группировка по стадиям

Наиболее эффективным методом лечения рака вульвы является комбинированный метод. Предоперационное облучение применяются в основном при III стадии заболевания (Т3N0-2М0), а также у некоторых больных при II стадии при больших опухолях клитора, задней спайки и промежности. Методом выбора лучевой терапии рака вульвы в настоящее время единодушно признается облучение электронами с энергией 10-15 МэВ. При предоперационном облучении в зону воздействия включают область первичной опухоли, разовые дозы на ложе новообразования составляют порядка 3 Гр, суммарные - 35-40 Гр.
Применение доз более высокого порядка при предоперационном облучении почти всегда ведет к развитию лучевого вульвита, что увеличивает сроки между облучением и операцией, а также существенно повышает риск послеоперационных осложнений. При гамма-облучении, которое может проводиться в отсутствие электронной терапии, суммарные дозы обычно составляют 30-35 Гр. В случаях распространения опухолевого процесса на влагалище или уретру дистанционное облучение дополняют внутриполостной гамма-терапией. В зависимости от особенностей распространения опухоли внутриполостное облучение осуществляется либо эндовагинально
(аппарат типа «Агат-В», установка излучающей системы вдоль оси влагалища, разовая доза на поверхность слизистой - 5-7 Гр, ритм облучения - 1- 2 раза в неделю, суммарная поглощенная доза - 45-60 Гр), либо эндоуретрально в аналогичном режиме.
Через 3-5 недель после завершения предоперационного облучения выполняют расширенную одномоментную вульвэктомию и пахово-бедренную лимфаденэктомию. У пациенток с распространенными новообразованиями лечение может быть дополнено послеоперационным облучением зоны вульвэктомии. Суммарные дозы при этом обычно не превышают 30-40 Гр.
Комбинированный метод с послеоперационным облучением применяется при II-III стадиях после радикальной операции, при I-III стадиях после операций, радикальность которых вызывает сомнения, а также при рецидивах заболевания.
Послеоперационная лучевая терапия осуществляется быстрыми электронами с энергией 10-15 МэВ, а при отсутствии такой возможности - посредством гамма-терапии. Зона вульвэктомии подвергается облучению через 2-4 недели после операции, разовые дозы составляют обычно около 2 Гр, суммарные - 40-50 Гр. Зона регионарных лимфатических узлов подвергается послеоперационному облучению преимущественно после вульвэктомий без лимфаденэктомии. В этих случаях разовые дозы на глубине 4,5-5 см составляют 2-3 Гр, суммарные - 45-55 Гр.
Комбинированное лечение рака вульвы позволяет добиться наиболее высоких и стабильных результатов, однако не у всех больных оно может быть выполнено. Это может быть связано с исходным распространением опухоли, а также с общими противопоказаниями к хирургическому вмешательству. Среди больных раком вульвы, средний возраст которых составляет 68 лет, тяжелые сопутствующие заболевания встречаются весьма часто. В этих условиях лучевая терапия становится единственным методом лечения.
Лучевое лечение больных раком вульвы проводят электронами с энергией 10-15 МэВ. При этой энергии пробег частиц в тканях составляет 5-7,5 см, а 80-процентная изодоза проходит на глубине 3-5 см от поверхности. Граница поля должна отстоять на 2-3 см от видимой границы новообразования. При использовании быстрых электронов применяют режим среднего фракционирования, при котором разовая доза на ложе опухоли составляет 3 Гр, суммарную дозу доводят до 50-60 Гр. При отсутствии возможности облучения быстрыми электронами у больных раком вульвы I-II стадии может быть использована внутритканевая гамма-терапия или близкофокусная рентгенотерапия.
Одновременно с воздействием на первичный очаг проводится облучение регионарных лимфатических узлов. Нормировка дозы осуществляется на глубину 4,5 см. При отсутствии клинических признаков метастазов суммарная доза доводится до 35-40 Гр. В случаях увеличенных, а тем более несмещаемых лимфатических узлов доза от дистанционного облучения доводится до уровня 50-60 Гр.
Ткани наружных половых органов отличаются высокой радиочувствительностью. Лучевая терапия рака вульвы связана с высоким риском луче-
вых повреждений и потому должна проводиться на фоне активных профилактических мероприятий. К их числу относятся тщательная предлучевая подготовка и выверенное дозиметрическое планирование (выбор разовых и суммарных очаговых доз, «расщепление» курса облучения, учет индивидуальных особенностей реакции на облучение опухоли и нормальных тканей).
Кроме того, с самого начала облучения необходимо проводить местную профилактику лучевых повреждений (аппликации мазей, димексида и т. п.). Соблюдение этих правил позволяет свести к минимуму риск возникновения тяжелых лучевых повреждений.
Эффективность лечения рака вульвы определяется в основном степенью исходного распространения опухоли, ее локализацией и гистологическим строением, возрастом больных, а также адекватностью проведенного лечения. При I стадии заболевания показатели 5-летней выживаемости составляют 68-75 %; при II - 42-49 %; при III - 27-35 %; при IV стадии -
3-12 %.
Определенные надежды возлагаются на сочетанную лучевую терапию - брахитерапию 192Ir в сочетании с дистанционной лучевой терапией с использованием нетрадиционных режимов фракционирования дозы.
7.17. РАК ВЛАГАЛИЩА
Рак влагалища встречается относительно редко и составляет примерно 1-2 % от всех злокачественных опухолей женских половых органов. В несколько раз чаще наблюдаются метастатические опухоли влагалища.
Рак влагалища имеет три возрастных пика заболеваемости. Первичные опухоли влагалища у детей первых 5 лет представлены ботриоидными эмбриональными рабдомиосаркомами, в 14-20 лет - светлоклеточными аденокарциномами, а в более старших возрастных группах встречаются почти исключительно опухоли плоскоклеточного строения, поэтому при обнаружении у взрослых другого гистотипа опухоли следует прежде всего думать о метастатическом происхождении новообразования.
По правилам Международной федерации акушеров и гинекологов (FIGO) при одновременном обнаружении плоскоклеточного рака шейки матки и влагалища относят данное наблюдение к раку шейки матки. При одновременном поражении опухолью влагалища и вульвы исходной локализацией считается вульва. Средний возраст больных раком влагалища составляет около 62 лет.
У каждой четвертой больной раком шейки матки определяются мультицентрические очаги Ca in situ во влагалище. Кроме того, рак влагалища иногда сочетается с раком вульвы и шейки матки. Эти факты являются основой теории «общего опухолевого поля» дистальных отделов женских половых органов, выстланных многослойным плоским эпителием. Под воздействием экзогенных факторов, таких как вирусная инфекция HPV и HPV-2, в различных участках этого опухолевого поля могут возникать дисплазия и преинвазивный рак.
Радиоиндуцированный рак влагалища, как правило, возникает у больных, перенесших сочетанную лучевую терапию по поводу рака шейки матки. При этом средний интервал между лучевой терапией рака шейки матки и появлением рака влагалища составляет 14-18 лет. Относительный риск рака влагалища после лучевого лечения рака шейки матки в 300 раз больше, чем в общей популяции.
В начале 70-х гг. отмечено значительное увеличение частоты светлоклеточной аденокарциномы влагалища и шейки матки. Специальные исследования показали, что это заболевание возникает преимущественно у девочек и молодых женщин, матери которых во время беременности получали диэтилстильбэстрол или сходные с ним по химическому строению нестероидные препараты. Эстрогенотерапия при беременности, главным образом в связи с лечением угрожающего выкидыша, была широко распространена в США и некоторых странах Западной Европы в послевоенные годы. Латентный период возникновения рака шейки матки и влагалища составил в среднем 18 лет. Эти данные послужили основанием для запрета применения эстрогенов во время беременности.
Предраковым заболеванием влагалища является дисплазия, которая в зависимости от выраженности делится на легкую, умеренную и тяжелую.
Преинвазивный рак выявляются в среднем на 10-12 лет раньше, чем инвазивный. Он чаще локализуется в верхней трети влагалища и более чем в 50 % наблюдений характеризуется мультицентрическим ростом. Инвазивный плоскоклеточный рак влагалища макроскопически может быть экзофитным, эндофитным или смешанным. Гистологическая структура плоскоклеточного рака представлена тремя формами: ороговевающий, крупноклеточный неороговевающий и мелкоклеточный. Аденокарцинома влагалища у взрослых встречается редко, еще реже регистрируются неэпителиальные злокачественные опухоли влагалища - саркомы и меланомы.
Метастатические опухоли влагалища чаще всего имеют первичным источником рак шейки и тела матки, саркому матки, хорионкарциному, реже рак яичников и гипернефрому. Плоскоклеточные новообразования влагалища, возникающие через 6-30 лет после лучевой терапии рака шейки матки, чаще всего являются первично множественными радиоиндуцированными опухолями.
Преимущественный тип распространения рака влагалища - лимфогенный. Область лимфогенных метастазов определяется локализацией опухоли. При поражении верхней трети влагалища метастазирование происходит, как и при раке шейки матки, в подвздошные и запирательные лимфатические узлы. Опухоли нижней трети влагалища метастазируют, подобно раку вульвы, в пахово-бедренные лимфатические узлы. Относительно редкие опухоли средней трети влагалища могут метастазировать и в лимфатические узлы таза, и в пахово-бедренные. Поскольку во влагалище выражена сеть внутриорганных анастомозов, могут наблюдаться случаи метастазирования опухолей верхней трети влагалища в паховые лимфатические узлы, а нижней трети - в подвздошные.
Регионарными для верхних двух третей влагалища являются тазовые лимфатические узлы, а для нижней трети - паховые лимфатические узлы.
TNM Клиническая классификация Т - первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли Т0 - Первичная опухоль не определяется Tis - Преинвазивная карцинома (carcinoma in situ) Т1 - Опухоль ограничена влагалищем
Т2 - Опухоль вовлекает паравагинальные ткани, но не распространяется на стенки таза
Т3 - Опухоль распространяется на стенки таза
Т4 - Опухоль вовлекает слизистую оболочку мочевого пузыря или прямой кишки и/или распространяется за пределы таза
Примечание. Наличия буллезного отека недостаточно для классификации опухоли как Т4.
N - регионарные лимфатические узлы
NX - Недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - Нет признаков поражения метастазами регионарных лимфатических узлов
N1 - Метастазы в тазовых или паховых лимфатических узлах М - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов М0 - Нет признаков отдаленных метастазов М1 - Имеются отдаленные метастазы
Группировка по стадиям

Лечение рака влагалища зависит от степени распространенности злокачественного новообразования.
Лучевая терапия преинвазивного рака влагалища в настоящее время применяется главным образом в тех случаях, когда предшествующее лечение (локальная химиотерапия, лазерная или криодеструкция и др.) было неэффективным, либо при возникновении рецидива заболевания. В этих клинических ситуациях используют внутриполостное облучение, которое в нашей стране осуществляется преимущественно на аппаратах типа «Агат-В» или «АгатВУ». Обычно источники излучения располагаются по всей длине влагалища (преинвазивный рак нередко бывает мультицентрическим), нормировка дозы
производится на поверхность слизистой органа. Облучение всех стенок влагалища осуществляют до суммарной дозы порядка 30-35 Гр. Затем в тех случаях, когда процесс носит ограниченный характер, облучение локализуется на область клинически выраженного поражения. Для этого источники, находящиеся в кольпостате, экранируются с одной стороны специальным свинцовым фильтром, входящим в стандартный комплект аппарата для внутриполостного облучения. Протяженность облучения по длине влагалища также сокращается таким образом, чтобы активные концы источников либо область прохождения одного препарата (аппарат «Агат-ВУ») на 1,5-2 см превышала длину поражения с каждой из его сторон. Режим фракционирования остается прежним, суммарная доза от локализованного облучения доводится до 55- 65 Гр. Такое лечение приводит к стойкому излечению у 90-95 % больных Ca in situ влагалища и не сопровождается риском серьезных лучевых повреждений.
Основным методом лечения инвазивного рака влагалища является лучевая терапия, главный компонент которой - внутриполостное облучение. Принципы внутриполостного лечения инвазивного рака влагалища близко соответствуют используемым для Ca in situ. К основным отличительным особенностям можно отнести необходимость подведения более высоких суммарных доз. Так, тотальное облучение всех стенок влагалища осуществляется до уровня доз порядка 55-65 Гр, оптимальным режимом фракционирования является облучение два раза в неделю по 5-6 Гр на слизистую. При наличии остаточной опухоли к концу облучения воздействие может быть локализовано (укорочение излучающей системы, использование свинцового фильтра) с доведением суммарной дозы до 70-80 Гр. Дальнейшее увеличение дозы не ведет к улучшению результатов лечения и чревато риском серьезных лучевых осложнений.
Дистанционное облучение у больных раком влагалища применяют преимущественно при II и III стадиях заболевания. В случаях локализации опухоли в верхних отделах органа облучению подвергают группы тазовых лимфатических узлов. Разовые дозы обычно составляют около 2 Гр, суммарные - 40-46 Гр. При опухолях, располагающихся в нижней трети влагалища, дистанционному лучевому воздействию подвергаются группы пахово-бедренных лимфатических узлов. Нормировку дозы осуществляют на глубину 4-5 см, облучение проводят с двух передних полей, разовые дозы - 2-3 Гр, суммарные - 42-46 Гр. При наличии увеличенных конгломератов лимфатических узлов суммарные дозы могут быть доведены до 55-60 Гр.
Показания к хирургическому лечению больных раком влагалища возникают довольно редко. При локализации опухоли в верхней трети влагалища у больных молодого и среднего возраста может выполняться расширенная гистерэктомия с удалением половины влагалища. В случаях выявления метастазов в регионарных лимфатических узлах после завершения лучевой терапии первичной опухоли и уверенности в ее полном излечении может выполняться регионарная лимфаденэктомия.
Эффективность лечения больных раком влагалища прежде всего зависит от степени исходного распространения опухоли. Самостоятельное хирургическое лечение эффективно при I стадии заболевания и локализации опу-
холи в верхних отделах органа. В этих случаях расширенная гистерэктомия с удалением верхней половины влагалища обеспечивает показатели 5-летней выживаемости порядка 80-85 %. В случаях местно распространенных новообразований хирургическое вмешательство не обеспечивает радикального удаления опухоли даже при прорастании в подлежащие ткани на 1-2 см.
5-летняя выживаемость после лучевой терапии при I стадии составляет порядка 65-70 %, при II - 60-65 %, при III - 25-37 %, при IV стадии - 0-3 %.
В целом принципы лучевой терапии рака влагалища можно сформулировать следующим образом. При I стадии лечение ограничивается проведением внутриполостного облучения до суммарной дозы 60-70 Гр. При II и III стадиях внутриполостное облучение сочетается с дистанционным. У больных IV стадии паллиативная лучевая терапия состоит из равномерного облучения малого таза с противолежащих открытых полей до суммарной дозы 45-50 Гр, внутриполостное воздействие осуществляется по индивидуальному плану.
Регионарная химиотерапия рака влагалища может стать существенным дополнением лучевого воздействия. Более молодой, чем при раке вульвы, возраст больных, хорошее кровоснабжение органа являются предпосылками успешного использования интервенционных вмешательств.
Локальная гипертермия также может служить методом усиления повреждающего действия ионизирующего излучения. Сочетание же внутриартериальной химиотерапии, локальной гипертермии и селективной гипергликемии при раке влагалища может оказаться столь же эффективным, как у больных с опухолями малого таза других локализаций.
Модификация радиочувствительности нормальных и опухолевых тканей также представляет реальный резерв повышения эффективности лечения. При раке влагалища применение модификаторов, особенно местное, может улучшить показатели выживаемости больных раком влагалища в той же степени, как это было у пациенток раком шейки матки.
В целом результаты лечения при раке влагалища в основном определяются эффективностью лучевой терапии, поэтому возможности улучшения этих результатов теснейшим образом связаны с перспективами развития методов лучевого лечения.
7.18. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОСТЕЙ
Злокачественные опухоли костей в структуре онкологической заболеваемости составляют примерно 1 % от всех злокачественных новообразований. Первичные злокачественные опухоли костей наблюдаются в любом возрасте, но чаще всего в 15-40 лет. Среди злокачественных опухолей костей наиболее часто встречается остеогенная саркома (50-60 %), на втором месте - саркома Юинга, далее следуют хондросаркома, фибросаркома и др. У части больных злокачественные опухоли развиваются в результате малигнизации доброкачественных опухолей и диспластических процессов. Значительно чаще первичных опухолей в костях встречаются метастазы различных злокачественных опухолей.
TNM - Клиническая классификация
Классификация применима для всех первичных злокачественных опухолей костей, за исключением злокачественной лимфомы, множественной миеломы, поверхностной/юкстакортикальной остео- и юкстакортикальной хондросаркомы. Должно быть гистологическое подтверждение диагноза, позволяющее определить морфологический тип опухоли и степень злокачественности.
Регионарные лимфатические узлы
Регионарными лимфатическими узлами являются узлы, соответствующие локализации первичной опухоли. Поражение регионарных лимфатических узлов наблюдается редко; в случае, когда их состояние невозможно определить клинически или морфологически, они классифицируются как N0, а не NX или pNX.
Т - Первичная опухоль
TX - Недостаточно данных для оценки первичной опухоли
Т0 - Первичная опухоль не определяется
T1 - Опухоль до 8 см в наибольшем измерении
T2 - Опухоль более 8 см в наибольшем измерении
Т3 - Прерывистая опухоль в первично пораженной кости
N - Регионарные лимфатические узлы
NX - Недостаточно данных для определения регионарных лимфатических узлов
N0 - Нет признаков метастатического поражения регионарных лимфатических узлов
N1 - Регионарные лимфатические узлы поражены метастазами M - Отдаленные метастазы
MX - Недостаточно данных для определения отдаленных метастазов M0 - Нет признаков отдаленных метастазов M1 - Имеются отдаленные метастазы
- Метастазы в легких M1B - Метастазы в других органах и тканях G - Гистопатологическая дифференцировка
Опухоли делятся на высокодифференцированные (низкая степень злокачественности) и низкодифференцированные (высокая степень злокачественности). Саркома Юинга оценивается как низкодифференцированная.
Группировка по стадиям


Основными методами лечения опухолей костей являются комбинированный с использованием химио - и/или лучевой терапии и операции, а также их различных сочетаний. Выбор лечения зависит от гистологического типа опухоли, степени ее злокачественности, размеров, локализации и распространенности. Учитывается степень чувствительности к химиотерапии и облучению.
Опухоль Юинга локализуется преимущественно в диафизах длинных трубчатых костей, но встречается и в плоских и коротких трубчатых костях. Опухоль чувствительна к облучению, но проведение только лучевой терапии даже в комбинации с операцией не приводит к стойким результатам. Современные принципы лечения состоят в сочетании химиотерапии, облучения и операции, при этом иногда применяют органосохраняющие операции. Благодаря такому сочетанию методов лечения показатели 5-лет- ней выживаемости больных выросли с 4-5 до 60 %.
Обычно проводят химиотерапию, после чего решают вопрос об объеме хирургического вмешательства. Если после индукционной химиотерапии объем регрессии опухоли не позволяет выполнить радикальную органосохраняющую операцию, продолжают химиотерапию и одновременно проводят предоперационную лучевую терапию в суммарной очаговой дозе 45-50 Гр. Операцию выполняют после стихания лучевых реакций.
Если в результате индукционной химиотерапии получена полная или значительная клиническая регрессия опухоли, в дальнейшем можно сделать выбор между операцией и лучевой терапией в туморицидных дозах - 60- 66 Гр в режиме классического фракционирования, продолжая при этом химиотерапию (см. рис. 46 на цв. вклейке).
После операции может быть проведена лучевая терапия у пациентов, которым не проводилась предоперационная лучевая терапия. Показания к ее проведению определяются видом оперативного вмешательства (радикальное, нерадикальное), степенью регресса опухоли под влиянием предоперационной химиотерапии.
Лучевую терапию проводят с паллиативной целью, подводя к первичному очагу 56-66 Гр, при метастазах в легких - облучение легких до СОД 12 Гр и дополнительное локальное облучение метастазов в СОД до 30 Гр. При полной регрессии метастатических очагов в легких на фоне проводимой химиотерапии проводят облучение обоих легких в дозе не более 12-13 Гр.
Паллиативное и симптоматическое облучение проводят при хондросаркоме, остеогенной саркоме, хотя основным методом лечения этих опухолей
является хирургический, а при остеогенной саркоме - хирургический и химиотерапевтический. Лучевую терапию применяют при расположении опухоли в костях таза или позвоночнике.
7.19. ЛУЧЕВАЯ ТЕРАПИЯ МЕТАСТАЗОВ В КОСТИ
Лучевая терапия является одним из наиболее эффективных методов лечения костных метастазов. Облучение не только обладает высоким обезболивающим эффектом, но и применяется для профилактики патологических переломов костей. Облучение пораженных позвонков может уменьшить или предупредить компрессию спинного мозга. В результате облучения костных метастазов наблюдается не только задержка роста опухоли, но и уничтожение метастаза с восстановлением костной структуры или развитием остеосклероза на месте деструктивного процесса.
При облучении пораженных метастазами позвонков в поле лучевого воздействия включаются рядом расположенные позвонки. Наиболее часто используется режим фракционирования по 4-5 Гр в сутки, 5-6 фракций до суммарных доз 20-28 Гр, что изоэффективно дозам 36-40 Гр. При локализации метастазов в шейном отделе позвоночника разовую дозу обычно уменьшают до 3 Гр и доводят облучение до СОД 18-21 Гр. При локализованном поражении позвонка СОД может быть увеличена до 45-50 Гр, при этом облучение проводят в режиме обычного фракционирования разовой дозой 2 Гр 5 раз в неделю.
При множественном поражении ребер, трубчатых костей или костей таза, позвоночника и выраженных болях у ослабленных больных применяют 2-3 облучения разовыми дозами 6-8 Гр с интервалом между ними 2-3 дня.
При лечении больных с метастазами в кости скелета проводится не только дистанционная локальная лучевая терапия, но и системная радионуклидная терапия препаратами 898г-хлорида, самария оксабифора 153Sm. При генерализованных формах рака молочной железы, предстательной железы с множественными костными метастазами внутривенно вводят самарий оксабифор, 153Sm из расчета 37 МБк на 1 кг массы тела или внутривенно 150 МБк 89Sг-хлорида. Проводится лучевая гипофизэктомия: протонная - путем однократного воздействия в дозе 80-120 Гр; или фотонная - разовыми дозами 9 Гр 3 раза в неделю до суммарной дозы 54-63 Гр.
7.20. ЛИМФОМА ХОДЖКИНА (ЛИМФОГРАНУЛЕМАТОЗ)
Лимфома Ходжкина (лимфогранулематоз) - опухолевое заболевание лимфатической системы, симптомы которого впервые описал T. Hodgkin в 1832 г. Заболеваемость в России составляет 2,3 случая на 100 000 населения. Болеют лимфомой Ходжкина люди любого возраста, несколько чаще мужчины. Пик заболеваемости приходится на возраст 15-40 лет. В насто-
ящее время успехи в лечении лимфогранулематоза позволяют считать его потенциально излечимым онкологическим заболеванием.
Диагноз устанавливают исключительно при гистологическом исследовании ткани опухоли, полученной в результате биопсии. При гистологическом исследовании обнаруживают специфические многоядерные клетки Штернберга (синонимы - «клетка Березовского-Штернберга» или «Штернберга- Рид»). В сложных случаях проводят иммунофенотипирование.
В Международной морфологической классификации лимфом (ВОЗ, 2001) по иммуноморфологическим характеристикам выделяют 4 гистологических варианта классической лимфомы Ходжкина:
1) богатый лимфоцитами (5-6 %);
2) нодулярный (узловатый) склероз (30-45 %);
3) смешанно-клеточный (35-50 %);
4) лимфоидное истощение - до 10 %.
Отдельно выделена небольшая группа больных, имеющая сходную с классической лимфомой Ходжкина морфологическую характеристику, но иную иммунологическую. Эта форма болезни имеет наиболее благоприятный прогноз и получила название «нодулярная с лимфоидным преобладанием лимфома Ходжкина».
В течение лимфогранулематоза выделяют четыре стадии согласно классификации, принятой в 1971 г. на конференции, проходившей в городе Энн Арбор (США).
Классификация стадий лимфогранулематоза Клиническое стадирование
Стадия I - поражение лимфатических узлов одной области (I) или локализованное поражение одного экстралимфатического органа либо ткани (IE).
Стадия II - поражение лимфатических узлов двух или более областей по одну сторону диафрагмы (II) или локализованное поражение экстралимфатического органа либо ткани и их регионарных лимфатических узлов (а) с поражением или без поражения других лимфатических областей по ту же сторону диафрагмы (IIE).
Примечание. Количество пораженных лимфатических областей может указываться следующим образом (II3).
Стадия III - поражение лимфатических узлов по обе стороны диафрагмы (III), которое может сочетаться с локализованным поражением одного экстралимфатического органа/ткани (IIIE) или с поражением селезенки (IIIS) либо поражение того и другого (IIIS+E).
Стадия IV - диссеминированное (многофокусное) поражение одного или нескольких экстралимфатических органов, с поражением или без поражения лимфатических узлов; или изолированное поражение экстралимфатического органа с поражением отдаленных (нерегионарных) лимфатических узлов.
Пр имечание. Причина отнесения больного к IV стадии дополнительно обозначается определенным буквенным символом, соответствующим пораженному органу или ткани.
Каждая стадия должна быть разделена на А и В в зависимости от отсутствия (А) или наличия (В) общих симптомов. Среди них:
1) необъяснимая потеря массы тела более чем на 10 % за последние 6 месяцев до обращения к врачу;
2) необъяснимые подъемы температуры выше 38 °C;
3) ночные поты.
В начале XX в. лимфогранулематоз относили к практически неизлечимым заболеваниям. Впоследствии результаты лечения лимфогранулематоза стали называть «символом успехов лучевой терапии». Лучевая терапия в настоящее время применяется на разных этапах течения заболевания в сочетании с различными другими методами лечения.
В 1928 г. R. Gilbert предложил облучать не только увеличенные лимфатические узлы, но и смежные с ними области, то есть зоны субклинического поражения. В дальнейшем V. Peters внедрила облучение большими полями, а H. Kaplan впервые применил облучение больных с локальными стадиями лимфогранулематоза по радикальной программе на медицинском ускорителе. При этом ранее считавшимся фатальным заболевании были получены 75 % 6-летней безрецидивной выживаемости у больных локализованными формами.
С 70-х гг. XX века в специализированных клиниках стали применять многопольное или мантиевидное облучение в зависимости от наличия необходимых источников излучения. В России также была налажена методика облучения через фигурные поля сложной конфигурации, предложенная в 1962 г. H. Kaplan. В ЦНИРРИ (Л. П. Симбирцева) проводили облучение больных на линейном ускорителе встречными полями больших размеров (40 х 40 см) через индивидуально изготовленные матрицы с экранированием критически важных органов. В ведущих центрах Москвы (А. С. Павлов, И. А. Переслегин, Е. М. Филькова, Г. Д. Байсоголов) использовалась радикальная программа с применением и многопольной методики облучения лимфатических коллекторов.
В настоящее время выбор метода лечения ориентирован на прогноз - благоприятный, промежуточный и неблагоприятный.
К благоприятной прогностической группе относят больных с IА и НА стадиями без факторов риска. Лучевая терапия в качестве самостоятельного лечения применяется у этих больных, однако часто облучение проводят через 2-3 нед после завершения 2-4 курсов ПXT. Облучению подвергают зоны исходного поражения в дозе 30-36 Гр. Режим облучения - 5 раз в неделю, разовая доза - 1,8 Гр. Суммарная очаговая доза зависит от эффекта химиотерапии: при полной регрессии опухоли - 30 Гр, при частичной - 36 Гр. На зоны исходно больших конгломератов СОД доводят до 40 Гр. Пациенткам молодого возраста, у которых имеется поражение подвздошных лимфатических узлов, возможно сохранение детородной функции путем хирургического перемещения яичников из зоны облучения.
К больным промежуточной прогностической группы относят пациентов с I и II стадиями и наличием хотя бы одного фактора риска:
- массивное поражение средостения: МТИ (медиастинально-торакальный индекс) ≥ 0,33 (по данным рентгенографии) или опухоль средостения ≥ 7,5 см (по данным КТ);
- массивное поражение селезенки (наличие пяти и более очагов, диффузная инфильтрация органа);
- экстранодальное поражение;
- СОЭ ≥ 30 мм/ч в стадии Б и СОЭ ≥ 50 мм/ч в стадии А;
- поражение трех и более лимфатических областей;
- наличие отдельных лимфатических узлов диаметром > 5 см или конгломерата лимфатических узлов размером > 10 см;
- возраст > 60 лет.
Лечение больных этой группы начинают с проведения 4 курсов ПXT, затем через 2-3 нед после завершения химиотерапии осуществляют облучение зон исходного поражения в СОД 30-36 Гр. Облучение проводят 5 раз в неделю, разовая доза - 1,8 Гр. СОД зависит от эффекта химиотерапии: при полной регрессии опухоли - 30 Гр, при частичной - 36 Гр. На зоны исходно больших конгломератов СОД может быть доведена до 40 Гр.
К группе с неблагоприятным прогнозом относят больных с III и IV стадиями заболевания. Лечение таких больных начинают с проведения не менее 8 курсов ПXT. Через 3 нед после окончания ПXT проводят следующие варианты объемов облучения:
- исходные большие массивы (первичные размеры опухоли > 7,5см) и не полностью регрессировавшие очаги отде-
льных зон исходного поражения (остаточные патологически измененные лимфатические узлы после 8 курсов химиотерапии) в СОД 30-36 Гр;
- все исходные очаги;
- исходные очаги и профилактическое облучение смежных зон;
- тотальное облучение лимфатических узлов или субтотальное (без подвздошных и паховых зон) нодальное облучение (рис. 47);
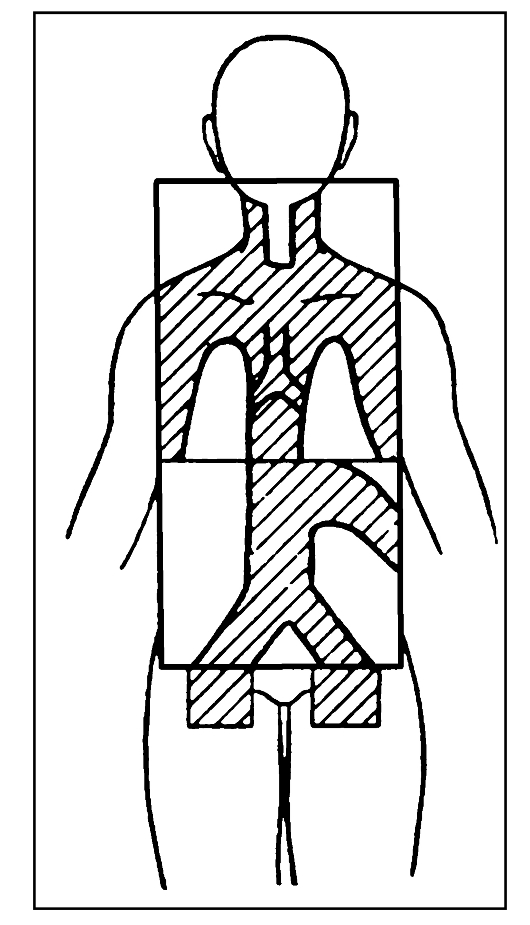
Рис. 47. Лимфома Ходжкина. Схема облучения через фигурные поля сложной конфигурации
- радикальная программа с профилактическим облучением легких и/или печени.
Облучение проводят 5 раз в неделю, разовая доза - 1,8 Гр. Очаги поражения скелета также подвергают облучению.
При возникновении рецидивов лимфомы Xоджкина используют химиолучевое лечение, причем у больных с локальным рецидивом в ранее не облученной или недостаточно облученной зоне можно применить только облучение. Кроме того, облучение сочетают с высокодозной химиотерапией в период подготовки к трансплантации стволовых кроветворных клеток.
В первой половине XX в. показатели 5-летней выживаемости при лимфогранулематозе составляли около 5 %. При проведении современных программ лечения 20-летняя безрецидивная выживаемость больных лимфомой Ходжкина составляет 60 %, при этом в группе больных с локальными стадиями эти показатели достигают 80-90 %.
7.21. НЕХОДЖКИНСКИЕ ЛИМФОМЫ
Неходжкинские лимфомы являются гетерогенной группой неопластических заболеваний, происходящих из клеток лимфатической (иммунной) системы. Прогноз зависит от вида, стадии лимфомы и колеблется от благополучного (продолжительность жизни - до 20 лет) до крайне неблагоприятного (продолжительность жизни - менее 1 года).
Причина возникновения лимфом остается неизвестной. Среди факторов риска рассматриваются ионизирующая радиация, химические канцерогены, вирусы.
Больные лимфомой часто страдают инфекционными заболеваниями в связи с тем, что опухолевые клетки подавляют развитие аналогичных нормальных клеток и вызывают иммунодефицитное состояние. В настоящее время увеличивается число больных неходжкинскими лимфомами среди заболевших СПИДом.
В 2001 г. была принята классификация Всемирной организации здравоохранения (ВОЗ), которой сегодня пользуются в большинстве стран мира. Диагноз лимфомы может быть установлен только при исследовании морфологического субстрата, полученного при биопсии опухоли. Увеличение лимфатического узла без видимых причин до размера более 1 см и существование такого увеличенного узла более 1 мес является основанием для выполнения биопсии.
По распространенности пораженных лимфатических узлов определяют стадию заболевания. Неходжкинские лимфомы подразделяются на стадии так же, как и лимфома Ходжкина [Энн Арбор, 1971].
Неходжкинские лимфомы имеют много подвидов, которые отличаются по гистологической картине, клиническим проявлениям. В зависимости от течения болезни принято различать индолентные и агрессивные лимфомы. Индолентные лимфомы имеют медленное и благоприятное течение. Таких пациентов часто длительное время наблюдают без специального лечения. Агрессивные лимфомы характеризуются быстрым прогрессированием, большим количеством симптомов и требуют немедленного начала лечения. Встречаются лимфомы с промежуточными характеристиками; лимфомы, при которых поражаются органы и ткани без поражения лимфатических узлов, называются экстранодальными.
Современные программы лечения включают полихимиотерапию и лучевую терапию. При отсутствии лейкемизации (поражения костного мозга) заболевания, обычно сопровождающейся цитопенией, проводят интенсивную полихимиотерапию с последующей трансплантацией аутологичного кост-
ного мозга, заготовленного у больного до проведения интенсивного лечения. Иногда применяют аллогенную трансплантацию костного мозга.
Лечение индолентной лимфомы начинают при появлении первых признаков прогрессирования заболевания. При местно распространенных стадиях часто используют облучение пораженных лимфатических узлов. При генерализованных стадиях проводят химиолучевое лечение.
Агрессивные и высокоагрессивные лимфомы требуют проведения химиотерапии, как при острых лимфобластных лейкозах.
В настоящее время на фоне современных возможностей полихимиотерапии имеется тенденция к снижению ранее принятых объемов облучения до облучения пораженных зон, крупных очагов, а также к уменьшению разовых очаговых доз до 1,7-1,8 Гр при обычном фракционировании или до 1,2-1,3 Гр 2 раза в день через 4 ч при мультифракционировании. Суммарные дозы на пораженные лимфатические узлы - 36 Гр, на непораженные области при радикальном облучении - не больше 30 Гр. На исходно крупные очаги и оставшиеся после ПХТ рекомендуется подводить СОД 42-44 Гр.
При I-II стадиях НХЛ низкой степени злокачественности при отсутствии неблагоприятных прогностических факторов проводят радикальную лучевую терапию с облучением лимфатических коллекторов выше и ниже диафрагмы через фигурные поля сложной индивидуальной конфигурации в суммарных очаговых дозах 30-36 Гр. При наличии неблагоприятных прогностических факторов радикальную лучевую терапию проводят после 2- 3 циклов ПХТ.
У больных III-IV стадий НХЛ низкой степени злокачественности, которые чаще всего являются фолликулярными, радикальная лучевая терапия также эффективна, так как фолликулярная лимфома очень чувствительна к облучению.
Пациентам с III-IV стадией НХЛ высокой степени злокачественности проводят облучение исходно пораженных очагов после достижения полной ремиссии после ПХТ.
Облучение применяют при лечении экстранодальных форм НХЛ. Уровень разовых и суммарных очаговых доз зависят от органа, подвергаемого облучению. При облучении легких РОД составляет 1-1,2 Гр, СОД - 16- 18 Гр на одно легкое тотально, СОД на оба легких тотально - 7-8 Гр, на очаг в легком СОД доводят до 30-36 Гр. Облучение печени проводят с использованием РОД 1,5 Гр до СОД 22-24 Гр на всю печень. Очаги поражения кости облучают разовыми дозами 2 Гр, суммарными - 36-38 Гр. Облучение всей почки проводят разовыми дозами 1,5 Гр до СОД 15 Гр на всю почку, а на патологический очаг в почке подводят СОД 32-36 Гр. Головной и спинной мозг облучают разовыми дозами 1,5-1,8 Гр до СОД 22-24 Гр, очаги в ЦНС облучают в суммарных дозах 40 Гр. Лучевую терапию используют при лечении больных лимфомой желудка, орбиты, кожи, гортани, слюнных желез, щитовидной железы, мочевого пузыря, молочной железы, органов желудочнокишечного тракта. В ЦНИРРИ (Н. В. Ильин) разработан способ тотального электронного облучения лимфомы кожи на ЛУЭ.
Начаты разработки радиоиммунотерапии лимфом путем применения моноклональных антител, меченных 131I.
При лечении рецидивов НXЛ в ЦНИРРИ (Н. В. Ильин) в качестве альтернативы ПXT используют субтотальное облучение тела разовой дозой 1 Гр до СОД 5 Гр. При лечении фолликулярных НXЛ в некоторых странах иногда применяют низкодозное тотальное облучение тела по 0,1-0,25 Гр за сеанс, 3-4 фракции в неделю, до СОД 1,5-2 Гр.
7.22. ЛУЧЕВАЯ ТЕРАПИЯ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА
В течение последних 10-20 лет наблюдается тенденция к неуклонному росту заболеваемости первичными и метастатическими опухолями головного мозга. Заболеваемость первичными доброкачественными и злокачественными опухолями головного мозга в настоящее время составляет 10,9-12,8 на 100 000 населения. Среди первичных опухолей головного мозга приблизительно 60 % относятся к злокачественным глиомам. Более половины больных с опухолями головного мозга старше 40 лет. В 2000 г. ВОЗ была принята гистологическая классификация опухолей нервной системы, в которой существует деление на нейроэпителиальные опухоли, опухоли менингеальных оболочек, опухоли селлярной области, герминоклеточные опухоли ЦНС, лимфомы и гемопоэтические новообразования ЦНС, метастатические опухоли.
Классическая лучевая терапия супратенториальных опухолей головного мозга применяется в плане комбинированного лечения после операции, а также в случае рецидива заболевания.
Целью послеоперационной лучевой терапии является дополнительное воздействие на опухоль при нерадикальном ее удалении или облучение ложа опухоли после радикальных операций для предупреждения рецидива.
Лучевая терапия глиальных опухолей осуществляется дистанционными и радиохирургическими методами или их сочетанием. Дистанционную лучевую терапию проводят на высокоэнергетических источниках излучения - гамма-терапевтических установках и линейных ускорителях электронов (ЛУЭ). Чаще всего применяется статическое многопольное облучение (см. рис. 48 на цв. вклейке, рис. 49).
Для проведения интраоперационной лучевой терапии используют высокоэнергетические электроны (10-15 МэВ), генерируемые линейными или циклическими ускорителями. Регулированием энергии электронного пучка, подбора различных формирующих поля блоков или тубусов можно добиться точного и максимального облучения опухоли и минимального облучения нормальных тканей.
Во время операции к опухоли за один сеанс облучения подводят суммарную поглощенную дозу 15-20 Гр. Такая доза эквивалентна примерно 40 Гр, подведенным обычным способом - 2 Гр ежедневно 5 раз в неделю. Однократное облучение опухоли в дозе 15-20 Гр не влияет на течение послеоперационного периода, вызывает гибель большинства субклинических метастазов
Рис. 49. Опухоль головного мозга. КТ до (а) и после (б) лучевой терапии. План облучения (в)
и радиочувствительных клеток, предупреждая диссеминацию жизнеспособных опухолевых клеток во время операции. После удаления опухоли осуществляется обычное послеоперационное облучение до суммарной дозы 60 Гр.
При стереотаксическом радиохирургическом лечении осуществляют прицельное облучение малых мишеней, для чего применяют специальные стереотаксические устройства -
«Гамма-нож» (gamma-knife) и «Кибер-нож» (cyber-knife). Используются точные оптические направляющие системы для трехмерной (three-dimensional - 3D) радиотерапии множественными источниками.
Некоторые критерии отбора больных для стереотаксического радиохирургического лечения:
- наличие одного или более метастазов в головном мозге (до 10);
- диаметр очагов - не более 3-3,5 см;
- локализация очагов в функционально важных зонах или в глубинных структурах мозга;
- удовлетворительное физическое и психическое состояние пациентов (по шкале Карновского - не менее 70 баллов).
Ограничение по диаметру очага, а соответственно, и по его объему обусловлено предупреждением развития лучевых повреждений.
Противопоказания к стереотаксическому радиохирургическому вмешательству:
- большие размеры патологического очага (более 3,5 см в диаметре);
- серьезные снижения уровня психического и физического состояния пациента;
- наличие быстро прогрессирующего неврологического дефицита и симптомов дислокации мозга;
- выраженная диссеминация интракраниального метастатического процесса;
- неэффективное лечение экстракраниальных опухолевых очагов. Суммарная очаговая доза при проведении облучения метастазов зависит
от ранее проведенного облучения всего головного мозга. Рекомендуемые дозы после подведения дозы 30 Гр на весь головной мозг: доза по краю опухоли 24 Гр для очагов диаметром менее 20 мм и 18 Гр - для метастазов диаметром более 20 мм.
После проведения стереотаксического радиохирургического вмешательства могут развиться постлучевые реакции в виде отека в зоне облучения с возможным увеличением как самого очага, так и зоны перифокального отека, а также формирование внутримозговых кист. Применение ПЭТ позволяет провести дифференциальный диагноз между продолженным ростом метастаза и лучевой реакцией.
При лечении некоторых опухолей головного мозга применяют бор-нейтрон-захватную терапию. Используют феномен накопления в опухоли бора (10В), который в результате реакции нейтронного захвата при облучении нейтронами низких энергий (тепловых) выделяет альфа-частицы с высокой поражающей способностью и малой длиной пробега.
Лучевую терапию применяют и при лечении субтенториальных опухолей головного мозга. Медуллобластомы наиболее чувствительны к облучению. Лучевую терапию в качестве самостоятельного вида лечения обычно выполняют после декомпрессии и биопсии опухоли. Медуллобластомы склонны к метастазированию по спинномозговому каналу, поэтому облучению подвергают не только мозжечок, но и весь спинной мозг. Существуют разные варианты облучения. Например, облучение полушарий головного мозга проводят в дозе 30-35 Гр, задней черепной ямки - в суммарной дозе 50-55 Гр, а также всего спинного мозга в дозе около 30 Гр. При других вариантах спинной мозг не облучают до первого рецидива по спинномозговому каналу. После подтверждения распространения опухоли облучают спинной мозг в дозах 30-35 Гр.
При проведении операции в зависимости от радикальности хирургического вмешательства облучению подвергают ложе удаленной опухоли или ее неудалимую часть в дозах 45-60 Гр, весь головной мозг - в дозе 30- 35 Гр, а также спинной мозг в дозе 30 Гр.
Саркомы мозжечка подвергают облучению в суммарных дозах не менее 60 Гр, доза за фракцию составляет 1,8 Гр.
Больным анапластическими эпендимомами проводят облучение в плане комбинированного лечения после оперативного вмешательства и в сочета-
нии с химиотерапией. Производят облучение области первичного поражения, которое сочетают с облучением всего головного мозга или с учетом распространения опухоли - всего спинного мозга. Суммарные поглощенные дозы в первичной опухоли составляют 45-60 Гр.
Целью облучения увеличенного гипофиза является его разрушение. Чаще всего это связано с наличием аденом. Облучение неизмененного гипофиза является гормональным воздействием при лечении больных генерализованными опухолями молочной железы, предстательной железы при наличии костных метастазов. В большинстве случаев уменьшается выраженность болей, увеличивается на 6-12 мес продолжительность жизни.
Лучевую терапию аденом гипофиза проводят в качестве самостоятельного вида лечения или после хирургического вмешательства с целью предупреждения рецидивов.
Облучение гипофиза осуществляют на гамма-аппаратах и линейных ускорителях электронов (ЛУЭ) в статических и подвижных режимах, а также на синхроциклотронах, формирующих узкие протонные пучки.
Облучение неувеличенного гипофиза проводится через поля небольших размеров (2 х 2 см); при облучении аденом гипофиза, выходящих за пределы турецкого седла, размеры полей подбираются индивидуально.
Статическое облучение проводят через два височных поля или через три поля - два височных и лобное. Обычно облучают два поля в день, разовая доза с двух полей составляет 1,8 Гр. Суммарные поглощенные дозы находятся в интервале 55-70 Гр. Часто используется метод расщепления дозы, при котором необходимую суммарную дозу подводят за два курса с перерывом в 4-6 мес.
Глубокое расположение гипофиза, являющегося небольшим образованием, необходимость тщательного щажения окружающих мозговых тканей требуют применения подвижных методов лучевой терапии или прецизионных, сверхточных воздействий. Проводят подвижное, или ротационное, облучение с углом качания 180о.
При протонной терапии аденом гипофиза используют пучок протонов диаметром 5-10 мм по 50-процентной изодозе. Облучение однократное в течение 8-20 мин. Поглощенные дозы составляют 80-120 Гр. При облучении аденом гипофиза больших размеров выполняют двухили трехзонное облучение.
7.23. ЛУЧЕВАЯ ТЕРАПИЯ ОПУХОЛЕЙ СПИННОГО МОЗГА
Лучевая терапия опухолей спинного мозга показана только после оперативного их удаления или с симптоматической целью. В качестве самостоятельного вида лечения облучение проводят в случаях поражения спинного мозга при неходжкинских лимфомах, лимфогранулематозе, эндотелиомах, ангиомах и других процессах, отличающихся радиочувствительностью.
Выполняют дистанционное облучение на высокоэнергетических источниках - гамма-аппаратах и линейных ускорителях электронов. Лучевую те-
рапию осуществляют в статическом или подвижном режиме. При статической лучевой терапии облучение проводят с двух паравертебральных полей с наклоном к продольной оси на 15-20°. Разовая поглощенная доза - 2 Гр, суммарная поглощенная доза зависит от гистологического варианта опухоли, ее размеров и составляет от 40 до 60 Гр.
Ротационное облучение проводят в виде маятникового, с углом качания 120о. Разовые поглощенные дозы также составляют 2 Гр, а суммарные - в зависимости от вида опухоли варьируют от 40 до 60 Гр.
При планировании облучения учитывают, что толерантные дозы применительно к гамма-облучению составляют 57 Гр при облучении участка спинного мозга длиной 20 см и 30 Гр при высоте поля облучения более 20 см.