Лучевая терапия: учебник. - Т. 2. - Труфанов Г.Е., Асатурян М.А., 2010. - 192 с. : ил.
|
|
|
|
Глава 3. РАДИОБИОЛОГИЧЕСКИЕ ОСНОВЫ ЛУЧЕВОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ И НЕОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
При облучении тканей энергия излучения поглощается и взаимодействует с веществом. В результате в веществе происходят биохимические, физико-химические, биофизические процессы, которые приводят к морфологическим и функциональным изменениям. Начальный этап - поглощение энергии излучения, взаимодействие с клетками, т. е. ионизация, возбуждение атомов - происходит очень быстро. Развитие следующих этапов - морфологические, функциональные изменения - может протекать в течение разного времени (от нескольких минут до нескольких лет).
В результате ионизации атома или молекулы возникают два иона, с положительным и отрицательным зарядом. При этом они химически активны, вступают в реакции с другими молекулами, приводят молекулы в возбужденное состояние, которое сопровождается разрывом прежних молекулярных связей. Запускается процесс, при котором продукты расщепления молекул, будучи также химически активными, вступают в химические реакции с нейтральными молекулами. Ионизация молекул воды приводит к образованию сильнейших окислителей - Н+, ОН, Н2О2, Н2 Эти продукты ионизации и расщепления воды окисляют растворенные в ней вещества.
Физические процессы - ионизация и возбуждение атомов и молекул - приводят к химической перестройке облученных молекул. Различают прямое и непрямое действие излучения.
Прямое действие - это изменения, возникающие в молекулах клеток в результате ионизации или возбуждения.
Непрямое действие излучения - это поражение структур клетки продуктами радиолиза воды, возникшего под влиянием облучения. При прямом действии облучения на молекулу ДНК или под влиянием радикалов происходят однонитевые или двунитевые разрывы, то есть нарушается непрерывность нити ДНК.
На клеточном уровне под влиянием облучения выявляются замедление клеточного деления, образование хроматидных и хромосомных аберраций, возникновение микроядер. Гибель клетки может происходить по апоптотическому и некротическому путям. Большая часть клеток погибает до вступления клеток в митоз. Апоптотическая гибель клеток характерна для лимфоцитов, причем на фоне небольших доз облучения.
Очень важным для радиационных онкологов является обнаруженный «коммунальный эффект», или «эффект свидетеля». Эффект, обнаруженный не только в культуре клеток, но и в тканях, состоит в поражении клеток, наступающем после облучения других клеток, находящихся в составе одной ткани.
Наиболее известная реакция клеток на облучение - задержка клеточного деления. Многие исследователи обнаружили, что в культуре клеток задержка деления происходит на 1 ч в ответ на облучение в дозе 1 Гр. Таким образом, при увеличении дозы увеличивается продолжительность задержки деления каждой облученной клетки.
На отдельных стадиях клеточного цикла происходит и разное время задержки деления. Самое короткое время задержки зафиксировано при облучении клеток, уже находящихся в митозе. При воздействии на клетки в стадии синтеза ДНК или в постсинтетической стадии задержка деления более длительна.
Механизмы временной задержки первого деления после облучения окончательно не установлены. Еще сложнее оказалась интерпретация изменений при повторных облучениях, которые наиболее часто используются при лечении больных.
После подведения больших доз может наступить утрата способности клеток к делению. Часто фиксируют образование патологических форм гигантских клеток. Потерю способности клетки к делению радиобиологи называют клеточной гибелью, т. е. репродуктивной гибелью. Основной причиной такой гибели считают повреждения ДНК.
Клетки, ткани, органы человека в разной степени чувствительны к облучению. Степень восприимчивости к излучению называют радиочувствительностью. К наиболее радиочувствительным относятся кроветворная система, эпителий слизистой тонкой кишки, к радиорезистентным - мышечная, нервная, костная ткани. При изучении радиочувствительности опухолей были установлены значительные различия в зависимости от локализации и гистологического строения. К радиочувствительным опухолям относят лимфомы, семиномы, плазмоцитомы, опухоли головы и шеи. Промежуточной радиочувствительностью обладают опухоли молочной железы, немелкоклеточный рак легкого. К резистентным опухолям относят нейрогенные опухоли, остеосаркомы, фибросаркомы, рак почки. Низкодифференцированные опухоли в целом более радиочувствительны, чем высокодифференцированные. Уровни радиочувствительности опухоли в организме и клеточной линии этой опухоли могут существенно различаться.
Известно, что деление на радиочувствительные и радиорезистентные ткани относительно условно, так как радиочувствительность к излучению может меняться в зависимости от состояния организма, содержания кислорода и т. д. Клетки наиболее чувствительны к облучению во время митоза. Мерой количественной оценки радиочувствительности является доза, при которой возникают изменения под влиянием облучения. Вычисление доли клеток с хромосомными перестройками, аберрациями используют для количественной оценки радиационного повреждения, так как число перестроек зависит от дозы излучения.
Для лучевых терапевтов существенным является особенность, на которую обращает внимание С. П. Ярмоненко (2004). Следует знать, что даже при малых дозах облучения может быть обнаружена с очень малой вероятностью гибель клетки; но также с очень малой вероятностью при очень больших дозах обнаруживают отдельные жизнеспособные клетки.
Радиобиологи в экспериментах обнаружили, что ядро обладает большей радиочувствительностью, чем цитоплазма. В итоге, повреждение генетического аппарата клетки является главной причиной репродуктивной гибели клеток при облучении.
В 1959 г. В. И. Корогодин открыл существование пострадиационного восстановления клеток. Однако эффекты, получаемые при облучении клеток в эксперименте, могут довольно сильно отличаться от реакций клеток в организме. Известно, что вклад репарации потенциально летальных повреждений клеток у млекопитающих значительно меньше, чем в культуре. Восстановление от сублетальных повреждений проявляется при разделении суммарной дозы облучения на порции или фракции. Для восстановления требуется время, которое в экспериментальных исследованиях определено как более 6 ч. Восстановление происходит с разной эффективностью, в зависимости от вида излучения: чем больше ЛПЭ (линейная плотность излучения), чем хуже происходит пострадиационное восстановление.
На биологический эффект облучения оказывает сильное влияние кислород. Именно в присутствии кислорода возникает большое количество химически активных радикалов и перекисей, усиливающих процессы окисления в облучаемых тканях. Установлено, что кислород присоединяется к молекулам ДНК в местах разрывов межатомных связей, снижая возможность процессов репарации. Таким образом, в присутствии кислорода повышается радиочувствительность клетки. Кислородный эффект наиболее выражен при излучении электромагнитной природы. При фракционированном облучении выраженность кислородного эффекта оказалась выше, чем при однократном облучении. Кстати, насыщение тканей кислородом после облучения способствует более быстрому восстановлению их после лучевого воздействия.
Снижение радиочувствительности тканей происходит под действием так называемых протекторов. Радиопротекторы - вещества, подавляющие развитие реакции непрямого действия. Основным механизмом протекции, защиты является способность этих веществ связывать кислород и радикальные группы. Радиорезистентность клеток увеличивается при гипоксии тканей, то есть при падении напряжения кислорода.
Биологический эффект облучения зависит от исходного состояния организма и от характеристики излучения. Основными физическими факторами являются доза облучения, мощность дозы, увеличение которых усиливает биологический эффект. Кроме того, имеет значение качество излучения, ЛПЭ и ЛПИ, то есть не только уровень поглощенной энергии, но и ее распределение в тканях.
Было установлено, что облучение разными видами излучения при одинаковой поглощенной дозе оказывает разные по величине эффекты. Чтобы
количественно оценить качество излучения по биологическому эффекту, ввели понятие относительной биологической эффективности - ОБЭ. В качестве стандартного излучения приняли рентгеновское излучение с энергией 180-250 кэВ. Значение (коэффициент) этого излучения приняли равным 1. ОБЭ оценивают сравнением дозы излучения, вызывающей определенный биологический эффект, с дозой стандартного излучения, приводящей к такому же эффекту. Значение ОБЭ вычисляют по формуле:
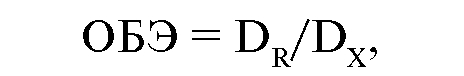
где DR - доза рентгеновского (стандартного) излучения, DX - доза изучаемого излучения.
Протоны, дейтроны и α-частицы, ускоренные до высоких энергий (200 МэВ и более), имеют примерно такую же ОБЭ, как и рентгеновское стандартное излучение.
При проведении лучевой терапии злокачественных опухолей перед радиологами стоит задача подведения дозы к опухоли, необходимой для уничтожения опухолевых клеток, сохраняя при этом жизнеспособность окружающих нормальных тканей. Для сенсибилизации гипоксических опухолевых клеток радиологи-онкологи применяют во время сеанса облучения кислород, проводят облучение в условиях гипербарической оксигенации (ГБО). Другой путь - гипоксирадиотерапия, вдыхание смесей, содержащих 8-10 % кислорода. При этом радиорезистентность нормальных тканей повышается быстрее и в большей степени, чем уже исходно гипоксических резистентных опухолевых клеток. Усиление гибели опухолевых клеток происходит при терморадиотерапии, при которой производят нагрев опухоли с помощью СВЧдатчиков до температуры 41-43,5 °C и облучение. Считается, что опухоль прогревается больше, чем нормальные ткани, так как из-за неполноценности развития сосудистой сети уменьшен отвод тепла от опухоли и в ней подавляются процессы репарации. Улучшение пространственного распределения дозы происходит при применении тяжелых заряженных частиц - протонов, π-мезонов и тяжелых ионов. Особенностью радиобиологического действия этих тяжелых частиц и нейтронов является ослабление радиозащитного эффекта опухолевой гипоксии.
Получено радиобиологическое обоснование применения режимов фракционирования, отличающихся от классических, например режим мультифракционирования, при котором дробление дневной дозы приводит к снижению тяжести лучевых осложнений.
В 1969 г. F. Ellis предложил формулу, в которой попытался учесть связь биологического эффекта облучения с суммарной дозой, числом фракций, временем лечения. Было введено понятие «НСД» - «номинальная стандартная доза», которая и являлась коэффициентом связи между всеми факторами. Толерантность всех органов и тканей по F. Ellis равноценна толерантности соединительной ткани. Величины толерантных доз были получены на базе многочисленных экспериментальных и клинических данных. В то время было уже хорошо известно об уровне толерантности нормальных тканей
при типичных курсах лучевой терапии, при которых суммарная очаговая доза 60 Гр подводилась к опухоли ежедневными разовыми очаговыми дозами 2 Гр 5 раз в неделю за 6 нед. НСД применима только при курсах лечения постоянной разовой дозой, числом фракций более 4 и длительностью лечения от 10 до 100 дней. Предел толерантности достигается при НСД = 1800. При этих значениях вероятность риска лучевых повреждений здоровых тканей не превышает 5 % при площади облучения 100 см2. Предложенная F. Ellis формула имела следующий вид:
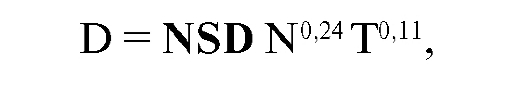
где D - суммарная доза за весь курс лечения, N - число фракций, T - время лечения в днях, NSD (НСД) - номинальная стандартная доза.
При изменении общего времени курса, разовой дозы, числа фракций используют расчеты на основе концепции ВДФ (время - доза - фракционирование), разработанной С. Ортоном и Ф. Эллисом (C. Orton и F. Ellis). При этом рассчитывают дозу, характеризующую степень лучевого поражения ткани, но с учетом поправок на восстановление ткани в перерывах между фракциями, на восстановление клеточной популяции за все время курса лучевой терапии.
Фактор ВДФ (время - доза - фракционирование) - это количественная оценка эффекта облучения по критерию предельной толерантности нормальной соединительной ткани и кожи. С помощью модели ВДФ (время - доза - фракционирование) при планировании лучевой терапии можно решить следующие задачи: сравнить различные режимы фракционирования дозы, определить изоэффективные дозы для различных схем фракционирования, учесть перерывы в облучении. Значения фактора ВДФ позволяют планировать следующие параметры внутриполостного облучения: суммарную поглощенную дозу, время облучения, мощность дозы облучения.
Концепция была создана путем математической интерпретации результатов клинических наблюдений и радиобиологических экспериментов. В конечном счете была создана формула для расчетов, которые сведены в удобные таблицы (см. Приложение). По этим таблицам можно определить фактор ВДФ при разных дозах за фракцию, количество фракций, соответствующих разным дозам за фракцию. Формула расчета фактора ВДФ имеет следующий вид:
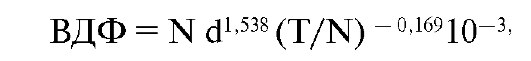
где d - разовая доза облучения здорового органа (сГр),
T - длительность курса лечения (сутки), N - число фракций облучения.
Предельное значение ВДФ составляет 100 единиц.
Критерий ВДФ можно использовать при любых условиях облучения - при расщепленном курсе, при разных методах (дистанционная и контакт-
ная) лучевой терапии. Критерий ВДФ является универсальной величиной, учитывающий дозу на орган, условия фракционирования, условия облучения, длительность курса.
Кумулятивный радиационный эффект (КРЭ) - это количественная оценка постепенного накопления эффекта облучения в нормальной соединительной ткани. Параметр основан на клеточно-кинетической модели и программе расчета относительного числа выживших клеток для любой ткани при разных условиях фракционирования. Величина КРЭ выражается через ВДФ.
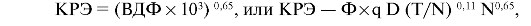
где Ф - поправочный коэффициент для учета объема облучения, q - коэффициент относительной биологической эффективности.
Единицей КРЭ является ерэ - единица радиационного эффекта. Толерантность кожи и соединительной ткани определяется величиной КРЭ = 1800 ерэ, что соответствует величине ВДФ, равной 100. Существуют кривые значений КРЭ в зависимости от числа фракций и разовой дозы при облучении два, три, четыре, пять раз в неделю. С помощью коэффициента снижения Ксн= e-0,003Tп можно учесть снижение КРЭ за счет частичного восстанов-
ления поврежденных тканей, зная время перерыва в лечении Тп.
Использование модели ВДФ, разработанной применительно к универсальной соединительной ткани, сохраняет свое значение, но более широкие возможности имеет линейно-квадратичная модель (LQ-модель). В основе модели лежат представления радиобиологов о том, что поражение ДНК может быть летальным и нелетальным, но нелетальные поражения, например однонитевые разрывы ДНК, могут превратиться в летальные при совпадении однонитевых разрывов в противоположных нитях ДНК, так как они становятся двунитевыми. В соответствии с этими представлениями гибель клеток, обусловленная одномоментными двойными разрывами, то есть летальное поражение клеток, характеризуется функцией, линейно зависящей от дозы излучения, а гибель клеток с возможностью сублетальных повреждений линейно нарастает с квадратом дозы. Эти процессы отражены в модели параметрами α и β. Значения этих параметров определяются по кривым выживаемости стволовых клеток. Определить величину этих параметров отдельно для клеток в составе ткани невозможно, но возможна оценка отношения α/β при равноэффективных режимах. Отношение α/β измеряется в Гр и численно соответствует дозе, при которой линейная функция, характеризующая гибель клеток αd), эквивалентна квадратичной βd2).
На основе этой модели, учитывающей клеточную выживаемость, Н. D. Тhames и J. H. Неndгу в 1987 г. предложили метод (формулу) для практического использования, названный ими Fгасtionation-dosage factor - ФДФ (фактор-доза=фракционирование). Оценка эффекта при контактном облучении источниками высокой активности производится по формуле для дистанционного облучения, а при использовании источников низкой активности авторами вводится коэффициент непрерывного восстановления g,
зависящий от времени облучения и времени полувосстановления клеток от сублетальных повреждений. Для режима мультифракционирования, когда времени между двумя дневными фракциями недостаточно для полного восстановления клеток от сублетальных повреждений, авторы формулы также вводят для первой дозы коэффициент неполного восстановления hm, зависящий от времени между дневными сеансами и времени полувосстановления. Таблицы значений отношения α/β, hm и g приведены в книге авторов метода.
Уравнение, которое определяет фракцию клеток, выживших после облучения, имеет вид:
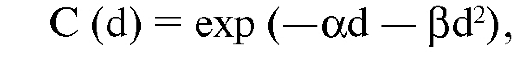
где d - поглощенная доза,
α - параметр модели, характеризующий значимость летального поражения ДНК (линейная функция дозы),
β - параметр модели, характеризующий сублетальное повреждение (квадратичная функция дозы).
После некоторых преобразований эффект от дистанционной фракционированной лучевой терапии можно выразить уравнением:
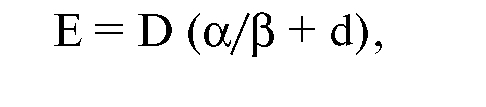
где D - суммарная доза.
Суммарная доза была названа авторами метода дозовым фактором, а (α/β + d) - фактором фракционирования.
С помощью линейно-квадратичной модели оказалось возможным выявить различия в соотношениях доза-время для быстро и медленно или непролиферирующих тканей. В первом случае рано реагирующие на облучение ткани, а также большинство злокачественных опухолей имеют значение коэффициента α/β, равное 7-20 Гр, а поздно реагирующие ткани - 1-6 Гр.
Разными авторами было предложено несколько формул для расчетов с учетом поправки на неполную репарацию, были введены параметры фактора времени для конкретной ткани. В нашей стране на основе линейноквадратичной модели созданы доступные для практической работы таблицы биологически изоэффективных доз относительно стандартного фракционирования по критерию возникновения поздних лучевых повреждений различных тканей (см. Приложение). Таким образом, результаты научных исследований в области экспериментальной и клинической радиобиологии позволяют планировать дозы и число фракций, при которых не будет превышен уровень толерантности нормальных тканей, применять различные режимы фракционирования, а также использовать радиомодификаторы для усиления поражающего действия ионизирующего излучения на опухолевые клетки и защиты окружающих здоровых органов и тканей. Большой вклад в развитие радиобиологических предпосылок лучевой терапии внес отечественный ученый, профессор С. П. Ярмоненко (рис. 19).

Рис. 19. Самуил Петрович Ярмоненко, профессор, доктор биологических наук, лауреат Государственной премии СССР
Радиобиологические основы лу чевой терапии неопухолевых забо леваний. Механизмы локального терапевтического действия так на зываемых малых доз радиации еще недостаточно изучены, несмотря на более чем столетний опыт лучевой терапии неопухолевых заболеваний Сначала эмпирическим путем были выявлены местные эффекты - вы раженный противовоспалительный противоотечный, обезболивающий десенсибилизующий. Эти эффекты приводили к местному улучшению трофики тканей и ликвидации раз личных видов патологических из менений. Отсутствие в начале XX в современной антибактериальной терапии и получение явных положи тельных эффектов при облучении привели к широкому применению лучевой терапии в лечении неопухолевых заболеваний. Среди множества
экспериментальных и клинических исследований того времени выделяются работы М. И. Неменова с сотрудниками. Наряду с местными эффектами ими изучалось действие рентгеновских лучей на нервную систему, в результате чего была создана нейрорегуляторная теория. Согласно этой теории, главным фактором лучевого воздействия является действие на вегетативную нервную систему, гипофизарно-гипоталамическую область, надпочечники. Эта теория служила обоснованием так называемой функциональной лучевой терапии неопухолевых заболеваний.
В те же годы начала развиваться клеточно-ферментативная теория, в которой главным фактором местного лучевого действия является разрушение клеток, прежде всего лейкоцитов, после чего клеточные продукты распада, включая протеолитические ферменты, оказывают положительное влияние на местные тканевые процессы.
Электрохимическая теория исходит из того, что сразу после лучевого воздействия наступает кратковременное усиление ацидоза, который через 6- 24 ч сменяется медленно нарастающим и длительно (8-16 дней) держащимся алкалозом. При этом длительный местный алкалоз способствует угнетению воспаления, устраняет боль, регулирует клеточную проницаемость.
Согласно другой теории - теории ингибирования различных процессов под влиянием облучения, ингибирование порождает вторичную стимуляцию местных процессов и приводит к противовоспалительному, антиспастическому, антисекреторному, десенсибилизирующему и другим местным эффектам радиации.
В настоящее время считается, что лечебные дозы вызывают изменение проницаемости капилляров, усиление дренирования очага воспаления путем улучшения венозного и лимфооттока, уменьшение отека. Все это приводит к последующему стиханию болей, улучшению кровотока и местных трофических процессов. Кроме того, доказано непосредственное воздействие облучения на нервные окончания с изменением функционального состояния нервных центров и узлов в сторону снятия их патологического возбуждения. По-видимому, это приводит к обезболивающему эффекту и улучшению проводимости по нервам.
Накопленные знания об отдаленных эффектах облучения, а также появление других эффективных методов лечения сузили показания к лучевой терапии неопухолевых заболеваний, однако продолжается эффективное лечение больных в тех случаях, когда не помогают другие виды лечения, а также в ситуациях, когда облучение имеет заведомые преимущества.
С учетом нейроэндокринной теории обосновывается применение наряду с облучением области патологических изменений так называемого непрямого облучения - облучения цепочек симпатических узлов, пограничных стволов. Такое облучение улучшает нервно-мышечную проводимость при постампутационном синдроме, фантомных болях, сирингомиелии. Функциональное подавление секреции позволяет использовать этот радиационный эффект, например для временного снижения функции слюнной железы при проведении облучения по поводу невирусного паротита, а также для снижения продукции цереброспинальной жидкости в профилактике отека головного мозга в начале противоопухолевой терапии.