Лучевая терапия: учебник. - Т. 2. - Труфанов Г.Е., Асатурян М.А., 2010. - 192 с. : ил.
|
|
|
|
Глава 2. ФИЗИЧЕСКИЕ ОСНОВЫ ЛУЧЕВОЙ ТЕРАПИИ
Ионизирующее излучение условно можно разделить на фотонное и корпускулярное. К фотонному излучению относят электромагнитные колебания, к корпускулярному - поток частиц. Понятия «электромагнитного», «квантового», «фотонного» излучения можно считать эквивалентными.
Тип взаимодействия фотонов с атомами вещества зависит от энергии фотонов. Для измерения энергии и массы микрочастиц используют внесистемную единицу энергии - электронвольт. 1 эВ - кинетическая энергия, которую приобретает частица, несущая один элементарный заряд, под действием разности потенциалов в 1В. 1эВ = 1,6 х 1019 Дж. Кратные единицы: 1 кэВ = 103 эВ; 1 МэВ = 106 эВ.
Согласно современным представлениям, заряженные частицы (α-, β-частицы, протоны и др.) ионизируют вещество непосредственно, а нейтральные частицы (нейтроны) и электромагнитные волны (фотоны) являются косвенно ионизирующими. Поток нейтральных частиц и электромагнитных волн, взаимодействуя с веществом, вызывают образование заряженных частиц, которые и ионизируют среду.
2.1. ФОТОННОЕ И КОРПУСКУЛЯРНОЕ ИЗЛУЧЕНИЕ
Электромагнитные излучения. В лучевой терапии используют рентгеновское излучение рентгенотерапевтических аппаратов, гамма-излучение радионуклидов и тормозное (рентгеновское) излучение высоких энергий.
Рентгеновское излучение - фотонное излучение, состоящее из тормозного и (или) характеристического излучения.
Тормозное излучение - коротковолновое электромагнитное излучение, возникающее при изменении скорости (торможении) заряженных частиц при взаимодействии с атомами тормозящего вещества (анода). Длины волн тормозного рентгеновского излучения не зависят от атомного номера тормозящего вещества, а определяются только энергией ускоренных электронов. Спектр тормозного излучения непрерывный, с максимальной энергией фотонов, равной кинетической энергии тормозящихся частиц.
Характеристическое излучение возникает при изменении энергетического состояния атомов. При выбивании электрона из внутренней оболочки
атома электроном или фотоном атом переходит в возбужденное состояние, а освободившееся место занимает электрон из внешней оболочки. При этом атом возвращается в нормальное состояние и испускает квант характеристического рентгеновского излучения с энергией, равной разности энергий на соответствующих уровнях. Характеристическое излучение имеет линейный спектр с определенными для данного вещества длинами волн, которые, как и интенсивность линий характеристического спектра рентгеновского излучения, определяются атомным номером элемента Z и электронной структурой атома.
Интенсивность тормозного излучения обратно пропорциональна квадрату массы заряженной частицы и прямо пропорциональна квадрату атомного номера вещества, в поле которого происходит торможение заряженных частиц. Поэтому для увеличения выхода фотонов используют относительно легкие заряженные частицы - электроны и вещества с большим атомным номером (молибден, вольфрам, платину).
Источником рентгеновского излучения для целей лучевой терапии является рентгеновская трубка рентгенотерапевтических аппаратов, которые в зависимости от уровня генерируемой энергии делятся на близкофокусные и дистанционные. Рентгеновское излучение близкофокусных рентгенотерапевтических аппаратов генерируется при анодном напряжении менее 100 кВ, дистанционных - до 250 кВ.
Тормозное излучение высокой энергии, как и тормозное рентгеновское излучение, - это коротковолновое электромагнитное излучение, возникающее при изменении скорости (торможении) заряженных частиц при взаимодействии с атомами мишени. Этот вид излучения отличается от рентгеновского высокой энергией. Источниками тормозного излучения высокой энергии являются линейные ускорители электронов - ЛУЭ с энергией тормозного излучения от 6 до 20 МэВ, а также циклические ускорители - бетатроны. Для получения высокоэнергетического тормозного излучения используют торможение резко ускоренных электронов в вакуумных системах ускорителей.
Гамма-излучение - коротковолновое электромагнитное излучение, испускаемое возбужденными атомными ядрами при радиоактивных превращениях или ядерных реакциях, а также при аннигиляции частицы и античастицы (например, электрона и позитрона).
Источниками гамма-излучения являются радионуклиды. Каждый радионуклид испускает γ-кванты своей определенной энергии. Радионуклиды производят на ускорителях и в ядерных реакторах.
Под активностью радионуклидного источника понимают количество распадов атомов в единицу времени. Измерения производят в Беккерелях (Бк). 1 Бк - активность источника, в котором происходит 1 распад в секунду. Несистемная единица активности - Кюри (Ки). 1 Ки = 3,7 х 1010 Бк.
Источниками γ-излучения для дистанционной и внутриполостной лучевой терапии являются 60Со и 137Cs. Наибольшее распространение получили препараты 60Co с энергией фотонов в среднем 1,25 МэВ (1,17 и 1,33 МэВ).
Для проведения внутриполостной лучевой терапии применяют 60Co,
137Cs, 192Ir.
При взаимодействии фотонного излучения с веществом происходят явления фотоэффекта, эффекта Комптона, процесс образования электронпозитронных пар.
Фотоэффект состоит во взаимодействии гамма-кванта со связанным электроном атома (рис. 10). При фотоэлектрическом поглощении вся энергия падающего фотона поглощается атомом, из которого выбивается электрон. После вылета фотоэлектрона в атомной оболочке образуется вакансия. Переход менее связанных электронов на вакантные уровни сопровождается выделением энергии, которая может передаваться одному из электронов верхних оболочек атома, что приводит к его вылету из атома (эффект Оже), или трансформироваться в энергию характеристического рентгеновского излучения. Таким образом, при фотоэффекте часть энергии первичного гамма-кванта преобразуется в энергию электронов (фотоэлектроны и электроны Оже), а часть выделяется в виде характеристического излучения. Атом, потерявший электрон, превращается в положительный ион, а выбитый электрон - фотоэлектрон - в конце пробега теряет энергию, присоединяется к нейтральному атому и превращает его в отрицательно заряженный ион. Фотоэффект происходит при относительно малых энергиях - от 50 до 300 кэВ, которые используются при рентгенотерапии.
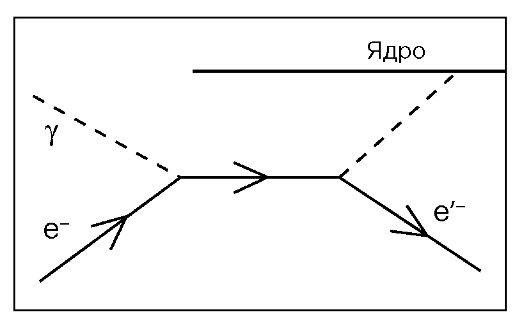
Рис.10. Фотоэффект
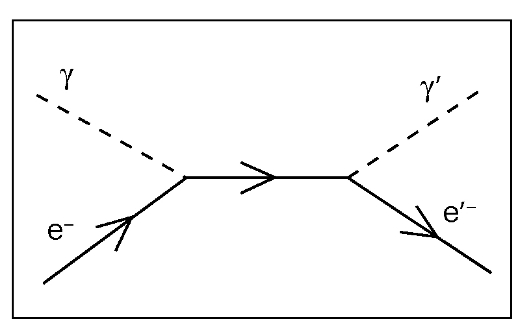
Рис. 11. Эффект Комптона
Эффект Комптона (некогерентное рассеяние) возникает при энергии фотона от 120 кэВ до 20 МэВ, то есть при всех видах ионизирующих излучений, применяемых при лучевой терапии. При эффекте Комптона падающий фотон в результате упругого столкновения с электронами теряет часть своей энергии и изменяет направление первоначального движения, а из атома выбивается электрон отдачи (комптоновский электрон), который производит дальнейшую ионизацию вещества (рис. 11).
Образование электрон-позитронных пар - процесс превращения энергии первичного фотона в кинетическую энергию электрона и позитрона и в энергию аннигиляционного излучения. Энергия кванта должна быть больше 1,02 МэВ (удвоенной энергии покоя электрона). Такое взаимодействие квантов с веществом происходит при облучении больных на высокоэнергетических линейных ускорителях пучком тормозного излучения высокой энергии. Фотон исчезает в кулоновском поле ядра (или электрона).
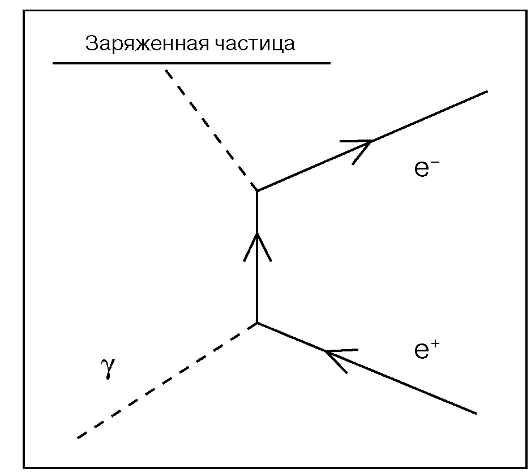
Рис. 12. Образование электрон-позитронных пар
При этом возникшей паре передается вся энергия падающего фотона за вычетом энергии покоя пары. Возникающие в процессе поглощения гамма-квантов электроны и позитроны теряют свою кинетическую энергию в результате ионизации молекул среды, а при встрече аннигилируют с испусканием двух фотонов с энергией 0, 511 МэВ каждый (рис. 12).
В результате перечисленных выше процессов взаимодействия фотонного излучения с веществом возникает вторичное фотонное и корпускулярное излучение (электроны и позитроны). Ионизационная способность частиц значительно больше, чем фотонного излучения. При чередовании процессов образования электрон-позитронных пар, тормозного излучения в среде создается огромное число фотонов и заряженных частиц, так называемая лавина излучения, которая с уменьшением энергии каждых вновь образующихся фотонов и частиц затухает.
Взаимодействие рентгеновского излучения с веществом сопровождается его ионизацией и определяется двумя основными эффектами - фотоэлектрическим поглощением и комптоновским рассеянием. При взаимодействии тормозного излучения высокой энергии с веществом происходит комптоновское рассеяние, а также образование пар ионов, так как энергия фотонов больше 1,02 МэВ.
Интенсивность фотонного излучения точечного источника изменяется в пространстве обратно пропорционально квадрату расстояния.
Корпускулярное излучение - потоки заряженных частиц: электронов, протонов, тяжелых ионов (например, ядер углерода) с энергиями в несколько сот МэВ, а также нейтральных частиц - нейтронов. Облучение с помощью потока частиц в настоящее время начали называть адронной терапией. К адронам (от греческого слова hadros - «тяжелый») относятся нуклоны, входящие в них протоны и нейтроны, а также π-мезоны и др. Источниками частиц являются ускорители и ядерные реакторы. В зависимости от максимальной энергии ускоряемых протонов условно ускорители делят на 5 уровней, причем ускорители 5-го уровня с Ep > 200 МэВ (мезонные фабрики)
используются для производства отдельных радионуклидов. Как правило, производство этих радионуклидов на циклотронах другого уровня невозможно или неэффективно.
Электронный пучок высокой энергии генерируется такими же ускорителями электронов, как и при получении тормозного излучения. Используют пучки электронов с энергией от 6 до 20 МэВ. Электроны высокой энергии обладают большой проникающей способностью. Средняя длина свободного пробега таких электронов может достигать в тканях человеческого организма 10-20 см. Электронный пучок, поглощаясь в тканях, создает дозное поле, при котором максимум ионизации образуется вблизи поверхности тела. За пределами максимума ионизации происходит довольно быстрый спад дозы. На современных линейных ускорителях имеется возможность регулировать энергию пучка электронов, а соответственно, создавать требуемую дозу на необходимой глубине.
Нейтрон - частица, не имеющая заряда. Процессы взаимодействия нейтронов (нейтральных частиц) с веществом зависят от энергии нейтронов и атомного состава вещества. Основной эффект действия тепловых (медленных) нейтронов с энергией 0,025 эВ на биологическую ткань происходит под действием протонов, образующихся в реакции (n, p) и теряющих всю свою энергию в месте рождения. Большая часть энергии медленных нейтронов расходуется на возбуждение и расщепление молекул тканей. Почти вся энергия быстрых нейтронов с энергией от 200 кэВ до 20 МэВ теряется в ткани при упругом взаимодействии. Дальнейшее выделение энергии происходит в результате ионизации среды протонами отдачи. Высокая линейная плотность энергии нейтронов препятствует репарации облученных опухолевых клеток.
Еще один вид воздействия нейтронами - нейтронозахватная терапия, которая является бинарным методом радиотерапии, соединяющим два компонента. Первый компонент - это стабильный изотоп бора 10B, который при введении в составе препарата может накапливаться в клетках определенных видов опухолей головного мозга и меланомах. Второй компонент - поток низкоэнергетических тепловых нейтронов. Образующиеся в результате захвата ядром 10B теплового нейтрона тяжелые высокоэнергетические заряженные частицы (бор распадается на атомы лития и α-частицы) уничтожают только клетки, находящиеся в непосредственной близости к атомам бора, почти не поражая прилегающие нормальные клетки. Помимо бора, в нейтронозахватной терапии перспективно использование препаратов с гадолинием. Для глубокорасположенных опухолей перспективным является использование эпитепловых нейтронов в диапазоне энергий 1 эВ - 10 кэВ, которые обладают большой проникающей способностью и, замедляясь в ткани до тепловых энергий, позволяют осуществить нейтронозахватную терапию опухолей, расположенных на глубине до 10 см. Получение высоких потоков тепловых и эпитепловых нейтронов осуществляется с использованием ядерного реактора.
Протон - положительно заряженная частица. Используется метод облучения на «пике Брэгга», когда максимальная энергия заряженных частиц выделяется в конце пробега и локализуется в ограниченном объеме облуча-
емой опухоли. В результате образуется большой градиент доз на поверхности тела и в глубине облучаемого объекта, после чего происходит резкое затухание энергии. Меняя энергию пучка, можно изменять место его полной остановки в опухоли с большой точностью. Применяются пучки протонов с энергией 70-200 МэВ и техника многопольного облучения с разных направлений, при которой интегральная доза распределяется на большой площади поверхностных тканей. При облучении на синхроциклотроне в ПИЯФ (Петербургский институт ядерной физики) используют фиксированную энергию выведенного протонного пучка - 1000 МэВ и применяют методику облучения напролет. Протоны такой высокой энергии легко проходят сквозь облучаемый объект, производя равномерную ионизацию вдоль своего пути. При этом происходит малое рассеяние протонов в веществе, поэтому сформированный на входе узкий с резкими границами пучок протонов остается практически таким же узким и в зоне облучения внутри объекта. В результате применения облучения напролет в сочетании с ротационной техникой облучения обеспечивается очень высокое отношение дозы в зоне облучения к дозе на поверхности объекта - порядка 200:1. Узкий протонный пучок с размерами на половине интенсивности в 5-6 мм используют для лечения различных заболеваний головного мозга, таких как артериовенозные мальформации головного мозга, аденомы гипофиза и др. Поражающий эффект ионов углерода оказывается в пике Брэгга выше чем у протонов в несколько раз. Происходят многократные двойные разрывы спирали ДНК атомов облучаемого объема, которые после этого уже не подлежат восстановлению.
π-Мезоны - бесспиновые элементарные частицы с массой, величина которой занимает промежуточное место между массами электрона и протона. π-Мезоны с энергиями 25-100 МэВ проходят весь путь в ткани практически без ядерных взаимодействий, а в конце пробега захватываются ядрами атомов ткани. Акт поглощения π-мезона сопровождается вылетом из разрушенного ядра нейтронов, протонов, α-частиц, ионов Li, Be и др. Активному внедрению в клиническую практику адронной терапии пока препятствует высокая стоимость технологического обеспечения процесса.
Преимуществами использования излучения высокой энергией для лечения злокачественных опухолей, находящихся на глубине, являются при увеличении энергии возрастание глубинной дозы и уменьшение поверхностной, более высокая проникающая способность с увеличением относительной глубинной дозы, меньшая разница между поглощенной дозой в костях и мягких тканях. При наличии линейного ускорителя или бетатрона отпадает необходимость захоронения радиоактивного источника, как при использовании радионуклидов.
При проведении брахитерапии, системной радионуклидной терапии используют α-, β-, γ-излучающие радионуклиды, а также источники, обладающие смешанным, например γ- и нейтронным (n), излучением.
α-Излучение - корпускулярное излучение, состоящее из ядер 4Не (два протона и два нейтрона), испускаемых при радиоактивном распаде ядер или при ядерных реакциях, превращениях. α-Частицы испускаются при радиоактивном распаде элементов тяжелее свинца или образуются в ядерных
реакциях. α-Частицы обладают высокой ионизирующей способностью и малой проникающей способностью, несут два положительных заряда.
Радионуклид 225Ac с периодом полураспада 10,0 сут в соединении с моноклональными антителами применяют для радиоиммунотерапии опухолей. В перспективе - использование для этих целей радионуклида 149Tb с периодом полураспада 4,1 ч. α-Излучатели начали использовать для облучения эндотелиальных клеток в коронарных артериях после проведения операций - аортокоронарного шунтирования.
β-Излучение - корпускулярное излучение с непрерывным энергетическим спектром, состоящее из отрицательно или положительно заряженных электронов или позитронов (β- или β+ частиц) и возникающее при радиоактивном β-распаде ядер или нестабильных частиц. β-Излучатели используются при лечении злокачественных опухолей, локализация которых позволяет обеспечить непосредственный контакт с этими препаратами.
Источниками β-излучения являются 106Ru, β--излучатель с энергией 39,4 кэВ и периодом полураспада 375, 59 дня, 106Rh, β--излучатель с энергией 3540,0 кэВ и периодом полураспада 29,8 с. Оба β-излучателя 106Ru + 106Rh входят в комплекты офтальмологических аппликаторов.
β--Излучатель 32P с энергией 1,71 МэВ и периодом полураспада 14,2 дня используется в кожных аппликаторах для лечения поверхностных заболеваний. Радионуклид 89Sr является практически чистым β-излучателем с периодом полураспада 50,6 дня и средней энергией β-частиц 1,46 МэВ. Раствор 89Sr - хлорида используется для паллиативного лечения костных метастазов.
153Sm с энергиями β-излучения 203,229 и 268 кэВ и с энергиями γ-излучения 69,7 и 103 кэВ, периодом полураспада 46,2 ч входит в состав отечественного препарата самария-оксабифора, предназначенного для воздействия на метастазы в костях, а также применяемого у больных с выраженным болевым синдромом в суставах при ревматизме.
90Y с периодом полураспада 64,2 ч и максимальной энергией 2,27 МэВ используется для различных терапевтических целей, включая радиоиммунотерапию с мечеными антителами, лечение опухолей печени и ревматоидного артрита.
Радионуклид 59Fe в составе таблетированного радиофармацевтического препарата применяют в Российском научном центре рентгенорадиологии (Москва) для лечения больных раком молочной железы. Принцип действия препарата, по мнению авторов, заключается в распространении железа током крови, избирательном накоплении в клетках опухолевой ткани и воздействии на них β-излучением. 67Cu с периодом полураспада 2,6 сут соединяют с моноклональными антителами для радиоиммунной терапии опухолей.
186Re в составе препарата (рения сульфид) с периодом полураспада 3,8 сут используют для лечения болезней суставов, а баллонные катетеры с раствором перрената натрия применяют для проведения эндоваскулярной брахитерапии. Считается, что есть перспектива для применения β+-излучателя 48V с периодом полураспада 16,9 сут для проведения внутрикоронарной брахитерапии с использованием артериального стента из сплава титана и никеля.
131I применяют в виде растворов для лечения заболеваний щитовидный железы. 131I распадается с испусканием сложного спектра β- и γ-излучения. Имеет период полураспада 8,06 дня.
К рентгеновским и Оже-электронным излучателям относят 103Pd с периодом полураспада 16,96 дней и 111In с периодом полураспада 2,8 сут. 103Pd в виде закрытого источника в титановой капсуле применяют при брахитерапии опухолей. 111In применяют при радиоиммунотерапии с использованием моноклональных антител.
125I, являющийся γ-излучателем (тип ядерного превращения - электронный захват с превращением йода в теллур и выделением γ-кванта), используют в виде закрытого микроисточника для брахитерапии. Период полураспада - 60,1 сут.
Смешанное γ+нейтронное излучение свойственно 252Cf с периодом полураспада 2,64 года. Применяют для контактного облучения, причем с учетом нейтронной составляющей, при лечении высокорезистентных опухолей.
2.2. КЛИНИЧЕСКАЯ ДОЗИМЕТРИЯ
Клиническая дозиметрия - раздел дозиметрии ионизирущего излучения, являющийся неотъемлемой частью лучевой терапии. Основная задача клинической дозиметрии состоит в выборе и обосновании средств облучения, обеспечивающих оптимальное пространственно-временное распределение поглощенной энергии излучения в теле облучаемого больного и количественное описание этого распределения.
Клиническая дозиметрия использует расчетные и экспериментальные методики. Расчетные методы основаны на уже известных физических законах взаимодействия различных видов излучения с веществом. С помощью экспериментальных методов моделируют лечебные ситуации с измерениями в тканеэквивалентных фантомах.
Задачами клинической дозиметрии являются:
- измерение радиационных характеристик терапевтических пучков излучения;
- измерение радиационных полей и поглощенных доз в фантомах;
- прямые измерения радиационных полей и поглощенных доз на больных;
- измерение радиационных полей рассеянного излучения в каньонах с терапевтическими установками (в целях радиационной безопасности пациентов и персонала);
- проведение абсолютной калибровки детекторов для клинической дозиметрии;
- проведение экспериментальных исследований новых терапевтических методик облучения.
Основными понятиями и величинами клинической дозиметрии являются поглощенная доза, дозное поле, дозиметрический фантом, мишень.
Доза ионизирующего излучения: 1) мера излучения, получаемого облучаемым объектом, поглощенная доза ионизирующего излучения;
2) количественная характеристика поля излучения - экспозиционная доза и керма.
Поглощенная доза - это основная дозиметрическая величина, которая равна отношению средней энергии, переданной ионизирующим излучением веществу в элементарном объеме, к массе вещества в этом объеме:
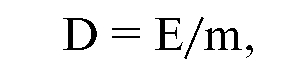
где D - поглощенная доза,
E - средняя энергия излучения,
m - масса вещества в единице объема.
В качестве единицы поглощенной дозы излучения в СИ принят Грей (Гр) в честь английского ученого Грея (L. Н. Gray), известного своими трудами в области радиационной дозиметрии. 1 Гр равен поглощенной дозе ионизирующего излучения, при которой веществу массой в 1 кг передается энергия ионизирующего излучения, равная 1 Дж. В практике распространена также внесистемная единица поглощенной дозы - рад (radiation absorbed dose). 1 рад = 102Дж/кг = 100 эрг/г = 102 Гр или 1 Гр = 100 рад.
Поглощенная доза зависит от вида, интенсивности излучения, энергетического и качественного его состава, времени облучения, а также от состава вещества. Доза ионизирующего излучения тем больше, чем длительнее время излучения. Приращение дозы в единицу времени называется мощностью дозы, которая характеризует скорость накопления дозы ионизирующего излучения. Допускается использование различных специальных единиц (например, Гр/ч, Гр/мин, Гр/с и др.).
Доза фотонного излучения (рентгеновского и гамма-излучения) зависит от атомного номера элементов, входящих в состав вещества. При одинаковых условиях облучения в тяжелых веществах она, как правило, выше, чем в легких. Например, в одном и том же поле рентгеновского излучения поглощенная доза в костях больше, чем в мягких тканях.
В поле нейтронного излучения главным фактором, определяющим формирование поглощенной дозы, является ядерный состав вещества, а не атомный номер элементов, входящих в состав биологической ткани. Для мягких тканей поглощенная доза нейтронного излучения во многом определяется взаимодействием нейтронов с ядрами углерода, водорода, кислорода и азота. Поглощенная доза в биологическом веществе зависит от энергии нейтронов, так как нейтроны различной энергии избирательно взаимодействуют с ядрами вещества. При этом могут возникать заряженные частицы, γ-излучение, а также образовываться радиоактивные ядра, которые сами становятся источниками ионизирующего излучения.
Таким образом, поглощенная доза при облучении нейтронами формируется за счет энергии вторичных ионизирующих частиц различной природы, возникающих в результате взаимодействия нейтронов с веществом.
Поглощение энергии излучения вызывает процессы, приводящие к различным радиобиологическим эффектам. При конкретном виде излучения выход радиационно индуцированных эффектов определенным образом
связан с поглощенной энергией излучения, часто простой пропорциональной зависимостью. Это позволяет дозу излучения принимать в качестве количественной меры последствий облучения, в частности живого организма.
Разные виды ионизирующего излучения при одной и той же поглощенной дозе оказывают на ткани живого организма различный биологический эффект, что определяется их относительной биологической эффективностью - ОБЭ.
ОБЭ излучений зависит главным образом от различий в пространственном распределении актов ионизации, вызываемых корпускулярным и электромагнитным излучением в облучаемом веществе. Энергию, переданную заряженной частицей на единице длины ее пробега в веществе, называют линейной передачей энергии (ЛПЭ). Различают редкоионизирующие (ЛПЭ < 10 кэВ/мкм) и плотноионизирующие (ЛПЭ > 10 кэВ/мкм) виды излучений.
Биологические эффекты, возникающие при разных видах ионизирующего излучения, принято сравнивать с аналогичными эффектами, возникающими в поле рентгеновского излучения с граничной энергией фотонов 200 кэВ, которое принимают за образцовое.
Коэффициент ОБЭ определяет отношение поглощенной дозы стандартного излучения, вызывающей определенный биологический эффект, к поглощенной дозе данного излучения, дающей тот же эффект.
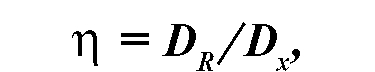
где Dx - доза данного вида излучения, для которого определяется ОБЭ, DR - доза образцового рентгеновского излучения.
На основе данных об ОБЭ разные виды ионизирующего излучения характеризуются своим радиационным коэффициентом излучения.
Взвешивающий радиационный коэффициент (радиационный коэффициент излучения) - безразмерный коэффициент, на который должна быть умножена поглощенная доза излучения в органе или ткани для расчета эквивалентной дозы излучения, чтобы учесть эффективность различных видов излучений. Понятие эквивалентной дозы применяют, чтобы оценивать биологический эффект облучения независимо от вида излучения, что необходимо для целей противорадиационной защиты персонала, работающего с источниками ионизирующего излучения, а также пациентов при радиологических исследованиях и лечении.
Эквивалентная доза определяется как средняя величина поглощенной дозы в органе или ткани с учетом среднего взвешивающего радиационного коэффициента.
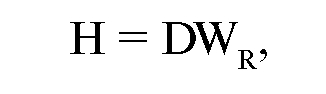
где Н - эквивалентная поглощенная доза,
WR - взвешивающий радиационный коэффициент, установленный на данный момент нормами радиационной безопасности.
Единицей эквивалентной дозы в СИ является Зиверт (Зв) - по имени шведского ученого Зиверта (R. М. Sievert), первого председателя Международной комиссии по радиологической защите (МКРЗ). Если в последней формуле поглощенную дозу излучения (D) выразить в Греях, то эквивалентная доза будет выражена в Зивертах. 1 Зв равен эквивалентной дозе, при которой произведение поглощенной дозы (D) в живой ткани стандартного состава на средний радиационный коэффициент (WR) равно 1 Дж/кг.
В практике распространена также внесистемная единица эквивалентной дозы - бэр (1 Зв = 100 бэр), если в той же формуле поглощенную дозу излучения выразить в радах.
Взвешивающие коэффициенты для отдельных видов излучения при расчете эквивалентной дозы.

Эффективная эквивалентная доза - понятие, используемое для дозиметрической оценки облучения здоровых органов и тканей и вероятности появления отдаленных эффектов. Эта доза равна сумме произведений эквивалентной дозы в органе или ткани на соответственный весовой множитель (взвешивающий коэффициент) для наиболее важных органов человека:
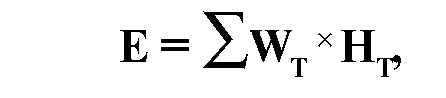
где E - эффективная эквивалентная доза,
НТ - эквивалентная доза в органе или ткани Т,
WT - взвешивающий коэффициент для органа или ткани Т.
Единицей эффективной эквивалентной дозы в СИ является Зиверт (Зв).
Для дозиметрической характеристики поля фотонного ионизирующего излучения служит экспозиционная доза. Она является мерой ионизирующей способности фотонного излучения в воздухе. Единица экспозиционной дозы в СИ - Кулон на килограмм (Кл/кг). Экспозиционная доза, равная 1 Кл/кг, означает, что заряженные частицы, освобожденные в 1 кг атмосферного воздуха при первичных актах поглощения и рассеяния фотонов,
образуют при полном использовании своего пробега в воздухе ионы с суммарным зарядом одного знака, равным 1 Кулону.
В практике часто применяют внесистемную единицу экспозиционной дозы Рентген (Р) - по имени немецкого физика Рентгена (W. К. Rontgen): 1 Р = 2,58 х 10-4 Кл/кг.
Экспозиционную дозу используют для характеристики поля только фотонного ионизирующего излучения в воздухе. Она дает представление о потенциальном уровне воздействия ионизирующего излучения на человека. При экспозиционной дозе 1 Р поглощенная доза в мягкой ткани в этом же радиационном поле равна приблизительно 1 рад.
Зная экспозиционную дозу, можно рассчитать поглощенную дозу и ее распределение в любом сложном объекте, помещенном в данное радиационное поле, в частности в теле человека. Это позволяет планировать и контролировать заданный режим облучения.
В настоящее время чаще в качестве дозиметрической величины, характеризующей поле излучения, применяют керму (KERMA - аббревиатура выражения: Kinetic Energy Released in Material). Керма - это кинетическая энергия всех заряженных частиц, освобожденных ионизирующим излучением любого вида, в единице массы облучаемого вещества при первичных актах взаимодействия излучения с этим веществом. При определенных условиях керма равна поглощенной дозе излучения. Для фотонного излучения в воздухе она является энергетическим эквивалентом экспозиционной дозы. Размерность кермы такая же, как и поглощенной дозы, выражается в Дж/кг.
Таким образом, понятие «экспозиционная доза» необходимо для оценки уровня дозы, генерируемой источником излучения, а также контроля режима облучения. Понятие «поглощенная доза» применяется при планировании проведения лучевой терапии с целью достичь необходимого эффекта (табл. 2.1).
Дозное поле - это пространственное распределение поглощенной дозы (или ее мощности) в облучаемой части тела больного, тканеэквивалентной среде или дозиметрическом фантоме, моделирующем тело больного по физическим эффектам взаимодействия излучения с веществом, форме и размерам органов и тканей и их анатомическим взаимоотношениям. Информацию о дозном поле представляют в виде кривых, соединяющих точки одинаковых значений (абсолютных или относительных) поглощенной дозы. Такие кривые называют изодозами, а их семейства - картами изодоз. За условную единицу (или 100 %) можно принять поглощенную дозу в любой точке дозного поля, в частности максимальную поглощенную дозу, которая должна соответствовать подлежащей облучению мишени (то есть области, охватывающей клинически выявленную опухоль и предполагаемую зону ее распространения).
Физическая характеристика поля облучения характеризуется различными параметрами. Число частиц, проникших в среду, называют флюенсом. Сумма всех проникших частиц и рассеянных в данной среде частиц составляет поток ионизирующих частиц, а отношение потока к площади составляет плотность потока. Под интенсивностью излучения, или плотностью потока
Таблица 2.1. Основные радиационные величины и их единицы
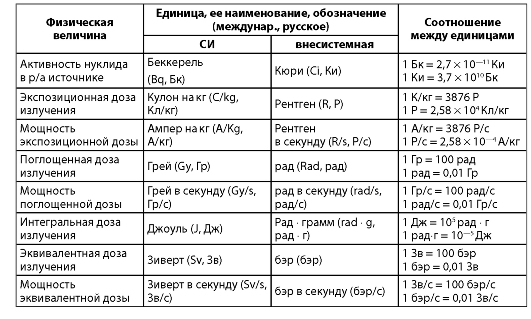
энергии, понимают отношение потока энергии к площади объекта. Интенсивность излучения зависит от плотности потока частиц. Кроме линейной передачи энергии (ЛПЭ), характеризующей средние энергетические потери частиц (фотонов), определяют линейную плотность ионизации (ЛПИ), количество пар ионов на единицу длины пробега (трека) частицы или фотона.
Формирование дозного поля зависит от вида и источника излучения. При формировании дозного поля при фотонном излучении учитывают, что интенсивность фотонного излучения точечного источника падает в среде обратно пропорционально квадрату расстояния до источника. При дозиметрическом планировании используют понятие средней энергии ионизации, которая включает в себя энергию непосредственной ионизации и энергию возбуждения атомов, приводящую ко вторичному излучению, также вызывающему ионизацию. Для фотонного излучения средняя энергия ионизации равна средней энергии ионообразования электронов, освобожденных фотонами.
Дозное распределение пучка γ-излучения неравномерно. Участок 100 % изодозы имеет сравнительно небольшую ширину, и далее относительная величина дозы падает по кривой достаточно круто. Размер поля облучения определяется по ширине 50 % дозы. При формировании дозного поля тормозного излучения имеется крутой спад дозы на границе поля, определяемый малым размером фокусного пятна. Это приводит к тому, что ширина 100 % изодозы близка к ширине 50 % изодозы, которая определяет дозиметрическую величину размера поля облучения. Таким образом, в формировании дозного распределения при облучении пучком тормозного излучения имеются преимущества перед пучком γ-излучения, так как уменьшаются дозы облучения здоровых органов и тканей вблизи патологического очага (табл. 2.2).
Таблица 2.2. Глубина расположения 100 %, 80 % и 50 % изодоз при наиболее часто используемых энергиях излучения
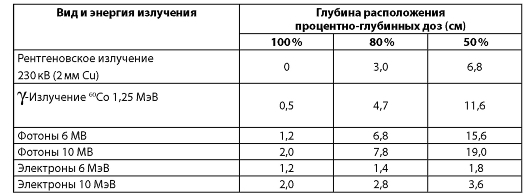
Примечание. Расстояние источник-поверхность для рентгенотерапевтического аппарата - 50 см; гамма-терапевтического - 80 см; линейных ускорителей - 100 см.
Из данных табл. 2.2 видно, что мегавольтное излучение в отличие от ортовольтного рентгеновского имеет максимум дозы не на поверхности кожи, глубина его возрастает с повышением энергии излучения (рис. 13). После достижения электронами максимума отмечается крутой градиент дозы, что позволяет снизить дозовую нагрузку на подлежащие здоровые ткани.
Протоны отличаются отсутствием рассеяния излучения в теле, возможностью торможения пучка на заданной глубине. При этом с глубиной проникновения линейная плотность энергии (ЛПЭ) возрастает, величина поглощенной дозы увеличивается, достигая максимума в конце пробега частиц,
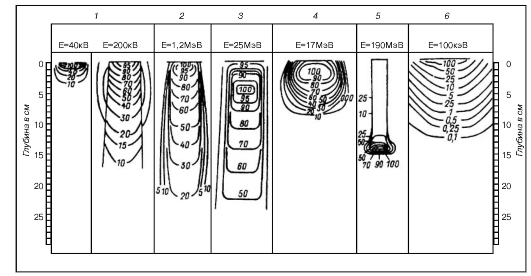
Рис. 13. Распределение энергии разных видов излучения в тканеэквивалентном фантоме: 1 - при близкофокусной рентгенотерапии 40 кВ и глубокой рентгенотерапии 200 кВ; 2 - при гамма-терапии 1,25 МэВ; 3 - при тормозном излучении 25 МэВ; 4 - при облучении быстрыми электронами 17 МэВ; 5 - при облучении протонами 190 МэВ; 6 - при облучении медленными нейтронами 100 кэВ
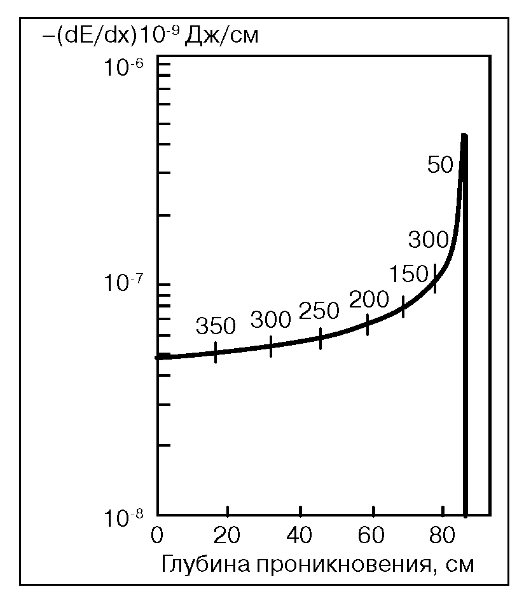
Рис.14. Пик Брэгга
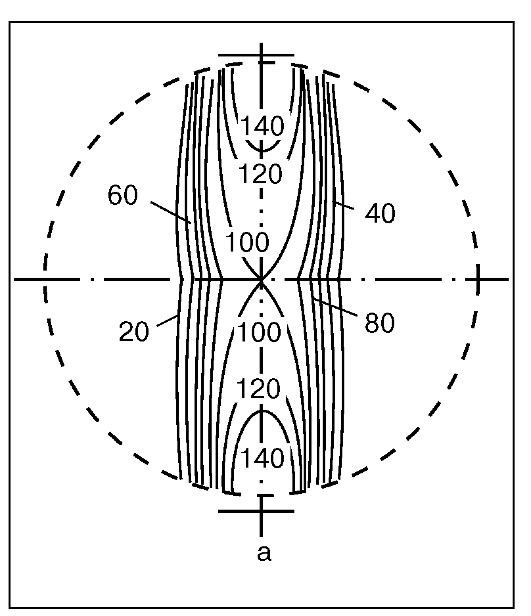
Рис. 15. Распределение дозы гамма-излучения с двух открытых параллельных противолежащих полей
так называемого пика Брэгга, где доза может быть намного больше, чем на входе пучка, с крутым градиентом дозы за волной пика Брэгга почти до 0 (рис. 14).
Часто при облучении применяются параллельные противолежащие поля (рис. 15, см. рис. 16 на цв. вклейке). При относительно центральном расположении очага доза с каждого поля обычно одинакова; если же зона расположения мишени эксцентрична, меняют соотношение доз в пользу ближнего к опухоли поля, например 2:1, 3:1 и т. п.
В тех случаях, когда дозу подводят с двух непараллельных полей, то чем меньше угол между их центральными осями, тем больше проводится выравнивание изодоз с помощью кли-
новидных фильтров, позволяющих гомогенизировать распределение дозы (см. рис. 17 на цв. вклейке). Для лечения глубокорасположенных опухолей обычно применяют трех- и четырехпольные методики облучения (рис. 18).
На линейном ускорителе электронов формируется прямоугольное радиационное поле тех или иных размеров при помощи металлических кол-
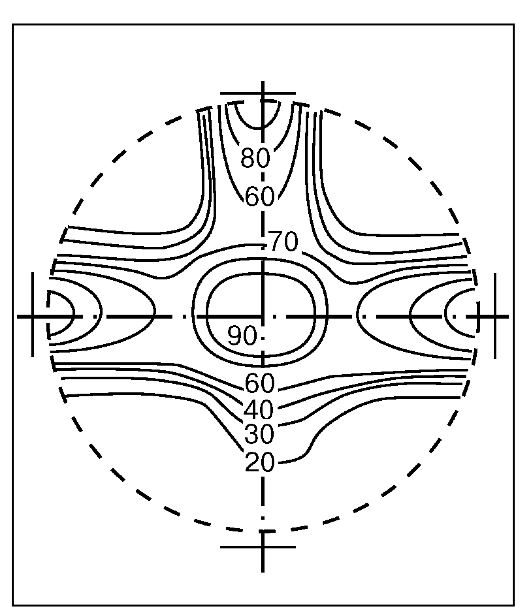
Рис. 18. Распределение дозы гамма-излучения с трех полей
лиматоров, встроенных в аппарат. Дополнительное формирование пучка достигается использованием комбинации этих коллиматоров и специальных блоков (набор свинцовых блоков или блоков из сплава Вуда различных форм и размеров), присоединенных к ЛУЭ после коллиматоров. Блоки перекрывают части прямоугольного поля вне объема мишени и защищают ткани за границами мишени, формируя таким образом поля сложной конфигурации.
Новейшие линейные ускорители позволяют осуществить контроль над позициями и перемещением формирующих поле многолепестковых коллиматоров. Типичные многолепестковые коллиматоры имеют от 20 до 80 лепестков или более, расположенных парами. Компьютерное управление положением большого количества узких, плотно прилегающих друг к другу лепестков дает возможность генерировать поле необходимой формы. Устанавливая лепестки в требуемую позицию, получают поле, наиболее соответствующее форме опухоли. Регулировка поля проводится посредством изменений в компьютерном файле, содержащем установки для лепестков.
При планировании дозы учитывают, что максимальная доза (95-107 %) должна быть подведена к планируемому объему мишени, при этом ≥ 95 % этого объема получает ≥ 95 % от планируемой дозы. Другое необходимое условие - только 5 % объема органов риска могут получать ≥ 60 % от планируемой дозы.
Обычно в линейных ускорителях имеется дозиметр, детектор которого вмонтирован в устройство формирования первичного пучка тормозного излучения, то есть осуществляется мониторирование подводимой дозы излучения. Монитор дозы часто градуируется по дозе в опорной точке, находящейся на глубине максимума ионизации.
Дозиметрическое обеспечение внутриполостной γ-терапии источниками высокой активности рассчитано на индивидуальное формирование дозных распределений с учетом локализации, протяженности первичной опухоли, линейных размеров полости. При планировании могут быть использованы расчетные данные в виде атласа многоплоскостных изодозных распределений, прилагаемых к внутриполостным γ-терапевтическим аппаратам, а также данные систем планирования для внутриполостных аппаратов на базе персональных компьютеров.
Наличие системы компьютерного планирования контактной терапии позволяет проводить клинико-дозиметрический анализ для каждой конкретной ситуации с выбором дозного распределения, наиболее полно соответствующего форме и протяженности первичного очага, что позволяет снижать интенсивность лучевого воздействия на окружающие органы.
Перед использованием источников излучения для контактной лучевой терапии проводят предварительную дозиметрическую их аттестацию, для чего применяют клинические дозиметры и комплекты тканеэквивалентных фантомов.
Для фантомных измерений дозных полей используют клинические дозиметры с малогабаритными ионизационными камерами или другими (полупроводниковыми, термолюминесцентными) детекторами, анализаторы
дозного поля или изодозографы. Термолюминесцентные детекторы (ТЛД) используют также для контроля поглощенных доз у больных.
Дозиметрические приборы. Дозиметрические приборы могут служить для измерения доз одного вида излучения или смешанного излучения. Радиометрами измеряют активность или концентрацию радиоактивных веществ.
В детекторе дозиметрического прибора происходит поглощение энергии излучения, приводящее к возникновению радиационных эффектов, величина которых измеряется с помощью измерительных устройств. По отношению к измерительной аппаратуре детектор является датчиком сигналов. Показания дозиметрического прибора регистрируются выходным устройством (стрелочные приборы, самописцы, электромеханические счетчики, звуковые или световые сигнализаторы и т. п.).
По способу эксплуатации различают дозиметрические приборы стационарные, переносные (можно переносить только в выключенном состоянии) и носимые. Дозиметрический прибор для измерения дозы излучения, получаемой каждым человеком, находящимся в зоне облучения, называется индивидуальным дозиметром.
В зависимости от типа детектора различают ионизационные дозиметры, сцинтилляционные, люминесцентные, полупроводниковые, фотодозиметры и т. д.
Ионизационная камера - это прибор для исследования и регистрации ядерных частиц и излучений. Его действие основано на способности быстрых заряженных частиц вызывать ионизацию газа. Ионизационная камера представляет собой воздушный или газовый электрический конденсатор, к электродам которого приложена разность потенциалов. При попадании ионизирующих частиц в пространство между электродами там образуются электроны и ионы газа, которые, перемещаясь в электрическом поле, собираются на электродах и фиксируются регистрирующей аппаратурой. Различают токовые и импульсные ионизационные камеры. В токовых ионизационных камерах гальванометром измеряется сила тока, создаваемого электронами и ионами. Токовые ионизационные камеры дают сведения об общем количестве ионов, образовавшихся в течение 1 с. Они обычно используются для измерения интенсивности излучений и для дозиметрических измерений.
В импульсных ионизационных камерах регистрируются и измеряются импульсы напряжения, которые возникают на сопротивлении при протекании по нему ионизационного тока, вызванного прохождением каждой частицы.
В ионизационных камерах для исследования γ-излучений ионизация обусловлена вторичными электронами, выбитыми из атомов газа или стенок ионизационных камер. Чем больше объем ионизационных камер, тем больше ионов образуют вторичные электроны, поэтому для измерения γ-излучения малой интенсивности применяют ионизационные камеры большого объема.
Ионизационная камера может быть использована и для измерения нейтронов. В этом случае ионизация вызывается ядрами отдачи (обычно прото-
нами), создаваемыми быстрыми нейтронами, либо α-частицами, протонами или γ-квантами, возникающими при захвате медленных нейтронов ядрами 10B, 3He, 113Cd. Эти вещества вводятся в газ или стенки ионизационных камер.
В ионизационных камерах состав газа и вещества стенок выбирают таким образом, чтобы при тождественных условиях облучения обеспечивалось одинаковое поглощение энергии (в расчете на единицу массы) в камере и биологической ткани. В дозиметрических приборах для измерения экспозиционных доз камеры наполняют воздухом. Пример ионизационного дозиметра - микрорентгенметр МРМ-2, который обеспечивает диапазон измерения от 0,01 до 30 мкр/с для излучений с энергиями фотонов от 25 кэВ до 3 МэВ. Отсчет показаний производят по стрелочному прибору.
В сцинтилляционных дозиметрических приборах световые вспышки, возникающие в сцинтилляторе под действием излучения, преобразуются с помощью фотоэлектронного умножителя в электрические сигналы, которые затем регистрируются измерительным устройством. Сцинтилляционные дозиметры применяются чаще всего в дозиметрии радиационной защиты.
В люминесцентных дозиметрических приборах используется тот факт, что люминофоры способны накапливать поглощенную энергию излучения, а затем освобождать ее путем люминесценции под действием дополнительного возбуждения, которое осуществляется либо нагревом люминофора, либо его облучением. Интенсивность световой вспышки люминесценции, измеряемая с помощью специальных устройств, пропорциональна дозе излучения. В зависимости от механизма люминесценции и способа дополнительного возбуждения различают термолюминесцентные (ТЛД) и радиофотолюминесцентные дозиметры. Особенностью люминесцентных дозиметров является способность сохранять информацию о дозе.
Дальнейшим этапом развития люминесцентных дозиметров явились дозиметрические приборы, основанные на термоэкзоэлектронной эмиссии. При нагреве некоторых люминофоров, предварительно облученных ионизирующим излучением, с их поверхности вылетают электроны (экзоэлектроны). Их число пропорционально дозе излучения в веществе люминофора. Термолюминесцентные дозиметры наиболее широко используются в клинической дозиметрии для измерения дозы на больном, в полости тела, а также в качестве индивидуальных дозиметров.
Полупроводниковые (кристаллические) дозиметры меняют проводимость в зависимости от мощности дозы. Широко используются наряду с ионизационными дозиметрами.
В России имеется радиационная метрологическая служба, которая ведет поверку клинических дозиметров и дозиметрическую аттестацию радиационных аппаратов.
На этапе дозиметрического планирования с учетом данных топометрической карты и клинического задания инженер-физик проводит оценку дозного распределения. Полученное в виде совокупности изолиний (изодоз) дозное распределение наносят на топометрическую карту, и оно служит для определения таких параметров облучения, как размер поля облучения, расположение точки центрации осей пучков излучения и их направлений.
Определяются разовая поглощенная доза, суммарная поглощенная доза, вычисляется время облучения. Документом является протокол, содержащий все параметры облучения конкретного больного на выбранной терапевтической установке.
При проведении брахитерапии используют аппарат совместно с соответствующей ультразвуковой аппаратурой, что дает возможность оценить в системе реального времени позицию источников и изодозное распределение в органе благодаря планирующей системе. Другой вариант - введение источников в опухоль под контролем компьютерной томографии.
Пучок излучения необходимой формы и определенных размеров формируют с помощью регулируемой диафрагмы, коллимирующего устройства, сменных типовых и индивидуальных защитных блоков, клиновидных и компенсирующих фильтров и болюсов. Они позволяют ограничивать область и поле облучения, повышать градиент дозы на его границах, выравнивать внутри поля распределение дозы ионизирущего излучения или, напротив, распределять ее с необходимой неравномерностью, создавать области и поля, в том числе фигурные и многосвязные (с внутренними экранированными участками).
Для правильного воспроизведения и контроля индивидуальной программы облучения больного пользуются устройствами визуализации пучка, механическими, оптическими и лазерными центраторами, типовыми и индивидуальными фиксаторами для иммобилизации больного во время облучения, а также рентгеновскими и другими средствами интроскопии. Частично их встраивают в радиационную головку, стол для больного и другие части аппарата. Лазерные центраторы монтируют на стенах процедурного помещения. Рентгеновские интроскопы помещают вблизи терапевтического пучка на напольном или потолочном штативе, имеющем фиксаторы для настройки, в необходимом положении больного.