Клиническая генетика: Учебник. - 3-е изд., испр. и доп. -Н.П. Бочков, 2004. - 480 с.: ил.
|
|
|
|
ГЛАВА 8. ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ
Общие вопросы
Многие формы наследственной патологии проявляются настолько специфическим фенотипом, что клинический анализ с синдромологическим подходом позволяет установить точный диагноз. В дополнение к методам клинической диагностики применяют генеалогический метод, который еще больше повышает вероятность правильного диагноза. Однако широкий клинический полиморфизм наследственных болезней, их фенокопии, частичное совпадение симптомов разных заболеваний (наследственных и ненаследственных), необходимость выявления гетерозиготных носителей или носителей балансированных транслокаций (инверсий) требуют применения лабораторных методов диагностики, которые при наследственной патологии всегда более точны, чем клинические методы.
Хотя история применения лабораторных методов диагностики наследственных болезней насчитывает почти 100 лет, первая половина этого пути отмечена лишь единичными примерами диагностики отдельных болезней с использованием качественных биохимических реакций (моча) или патогистологических методов. Применение биохимических методов началось с диагностики алкаптонурии в начале XX века, что и позволило А. Гарроду открыть наследственные болезни обмена веществ, обусловленные блоком ферментативной реакции. В 30-х годах была открыта простая реакция мочи с хлоридом железа (зеленая окраска) при фенилкетонурии. Морфологическими методами подтверждались диагнозы нейрофиброматоза, наследственных кожных болезней (конец XIX века).
Широкое применение лабораторных методов диагностики наследственных болезней началось в 50-х годах XX века. Это было связано, по-видимому, не только с прогрессом лабораторной диагностики (клиническая биохимия, гематология, цитология, цитохимия, иммунология), но и с повышенным интересом в этот период к наследственной патологии. Кроме того, усовершенствование цитогенетических методов в 50-х годах позволило открыть новую группу болезней человека - хромосомные болезни.
Таким образом, генетика человека и медицинская генетика взяли на вооружение многочисленные методы лабораторных исследований (биохимические, иммунологические, цитологические, гематологические, цитогенетические, немного позже и молекулярно-биологические). Это и обусловило формирование клинической генетики как медицинской дисциплины и ее интенсивное развитие.
Лабораторная диагностика наследственных болезней (феноили генотипирование индивидов) может быть направлена на идентификацию одной из трех ступеней болезни. Во-первых, это выявление причины наследственной патологии, или характеристика генотипа, т.е. определение конкретной мутации (генной, хромосомной, геномной). Эти цели достигаются с помощью цитогенетических или молекулярно-генетических методов. Во-вторых, лабораторные (биохимические и иммунологические) методы позволяют регистрировать первичный продукт гена. В-третьих, возможна регистрация специфических метаболитов, возникших в процессе патологического действия мутации. Такая регистрация возможна на уровне жидкостей (кровь, моча, секрет) или клеток. Следовательно, на этой ступени можно применять биохимические, иммунологические и цитологические методы, что и нашло подтверждение в клинической практике.
Иммунологические методы широко применяют для диагностики первичных (наследственных) иммунодефицитов, антигенной несовместимости матери и плода.
Цитологические клинические анализы помогают выявить некоторые наследственные болезни обмена веществ. Например, на рис. 8.1 представлены препараты мазков крови при ганглиозидозе (а) и мукополисахаридозе (б). Эти болезни имеют диагностические цитологические признаки при клинико-лабораторном анализе крови.
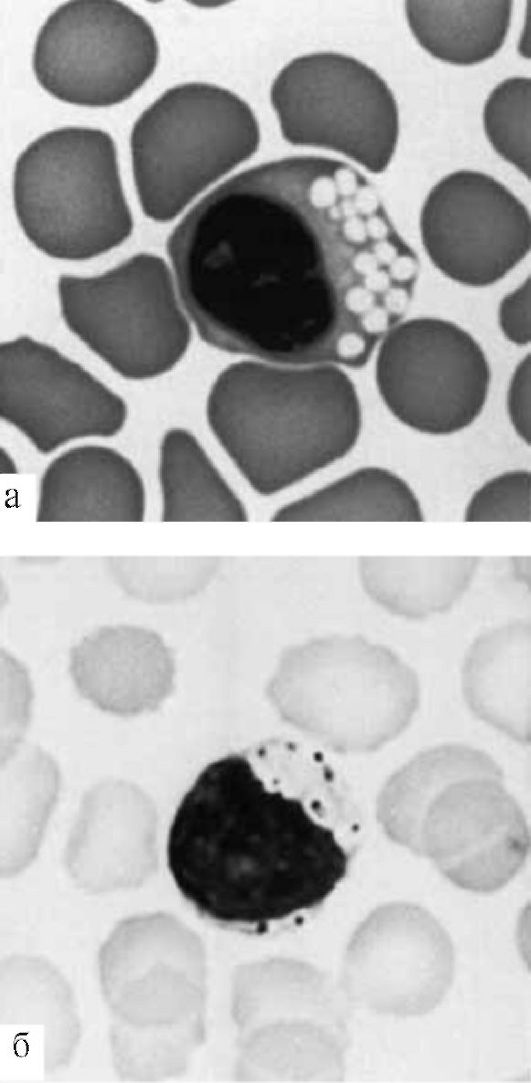 Рис. 8.1. Препараты мазков крови при ганглиозидозе (а) и мукополисахаридозе (б).
Рис. 8.1. Препараты мазков крови при ганглиозидозе (а) и мукополисахаридозе (б).
Цитогенетические методы
Микроскопические методы изучения хромосом человека применяются с конца XIX века. Соединение цитологического наблюдения хромосом с генетическим анализом сегрегации и сцепления генов привело к рождению цитогенетики. Первоначально цитогенетика концентрировалась на проблемах корреляции генетических и цитологических (хромосомных) признаков. В последующем цитогенетика методически отделилась от генетики. Под термином «цитогенетика» понимают область науки, изучающей структуру и функции хромосом.
Цитогенетические методы предназначены для изучения структуры хромосомного набора или отдельных хромосом. Наиболее распространенным методом в цитогенетике человека является световая микроскопия, а электронная и конфокальная лазерная микроскопия применяется только с исследовательскими целями. Во всей медико-генетической практике используется световая микроскопия (главным образом в проходящем свете), в том числе люминесцентная микроскопия.
Объектом цитогенетических наблюдений могут быть соматические делящиеся, мейотические и интерфазные клетки. Каждый из этих объектов имеет свои преимущества и недостатки. Выбор объекта определяется целью исследования.
Большинство цитогенетических исследований выполняют на соматических клетках, поэтому остановимся на описании этих методов.
Получение препаратов митотических хромосом
Первое условие цитогенетической диагностики - наличие делящихся клеток в цитологическом препарате.
Костный мозг, ткани семенника и хорион имеют достаточный митотический индекс для использования в цитогенетике. Однако, как показал опыт, несравненно информативнее исследование на культурах клеток: клетки освобождены от элементов соединительной ткани и хорошо суспендируются. Митотический индекс в культуре клеток много выше, чем в тканях организма.
Культуры клеток можно получать из кусочков кожи (растут фибробласты), костного мозга, эмбриональных тканей, хориона,
клеток амниотической жидкости. Наиболее удобным объектом для медицинских генетиков оказалась культура лимфоцитов периферической крови (рис. 8.2). Для ее получения достаточно взять 1-
2 мл венозной крови и добавить ее в смесь питательной среды с фитогемагглютинином (белок бобовых растений). Он вызывает иммунную трансформацию и деление лимфоцитов. Продолжительность культивирования составляет 48-72 ч.
Вторым методическим условием цитогенетических исследований является использование колцемида (или колхицина), разрушающего веретено деления и останавливающего клеточное деление на стадии метафазы. Колцемид добавляют в культуры клеток за 2-
3 ч до окончания культивирования: митотический индекс в культуре клеток за 2-3 ч повышается в 2-3 раза. Даже без культивирования экспозиция с колцемидом увеличивает число метафаз. Хромосомы в присутствии колцемида укорачиваются в результате
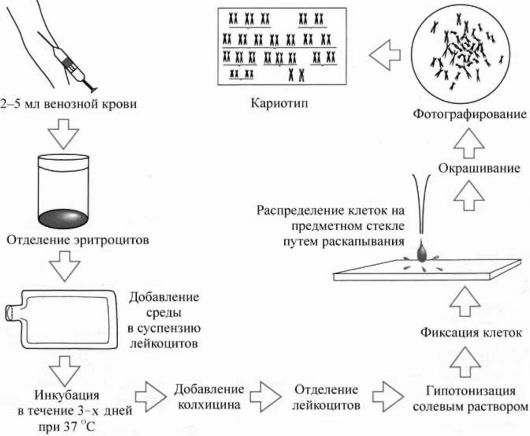 Рис. 8.2. Приготовление цитогенетических препаратов путем культивирования лимфоцитов периферической крови.
Рис. 8.2. Приготовление цитогенетических препаратов путем культивирования лимфоцитов периферической крови.
продолжающейся конденсации, следовательно, в препарате они легче отделяются одна от другой.
Если необходим детальный анализ определенного района хромосомы, сильно конденсированные хромосомы на стадии метафазы (метод называется метафазным) непригодны для анализа. Клетку нужно зафиксировать на стадии, предшествующей метафазе, когда хромосома редуплицировалась, но еще не полностью конденсировалась. Это стадия прометафазы. Хотя хромосомы на стадии прометафазы плохо разъединены (они еще очень длинные) и в препарате много наложений одной хромосомы на другую, все же в отдельных клетках можно найти участок, пригодный для анализа. Этот метод (или подход), в отличие от метафазного метода, называют прометафазным, или методом высокоразрешающей цитогенетики. Суть модификации метода состоит в прекращении процесса спирализации и конденсации хромосом в профазе с помощью препаратов, которые вводят в культуру клеток за несколько часов до фиксации.
Следующим условием для получения хороших метафазных пластинок является гипотонизация клеток (гипотонический шок). Обычно для этого используют гипотонический раствор хлорида кальция или цитрата натрия. В гипотоническом растворе клетки набухают, ядерная оболочка разрывается, межхромосомные связи рвутся и хромосомы свободно плавают в цитоплазме.
Культивирование клеток, применение колцемида и гипотонизация стали условиями, при которых сформировались современные цитогенетические методы.
Клеточную суспензию фиксируют смесью метанола и уксусной кислоты (3:1), затем суспензию центрифугируют и меняют фиксатор. Смесь клеток с фиксатором может сохраняться при температуре +4 °С в течение нескольких недель. При нанесении такой суспензии на чистое предметное стекло метафазная пластинка расправляется и в ее пределах располагаются отдельно лежащие хромосомы. При высыхании фиксатора клетки прочно прикрепляются к стеклу.
Выше описана методика получения препаратов из культуры лимфоцитов, которая используется наиболее часто. Для диагностических целей можно готовить препараты из хориона, костного мозга, семенников, культуры фибробластов, культуры амниоцитов. Процедуры для каждого объекта отличаются от описанной выше, но общий принцип сохраняется: накопление метафаз, гипотонизация, фиксация, капанье на предметное стекло.
Окраска препаратов
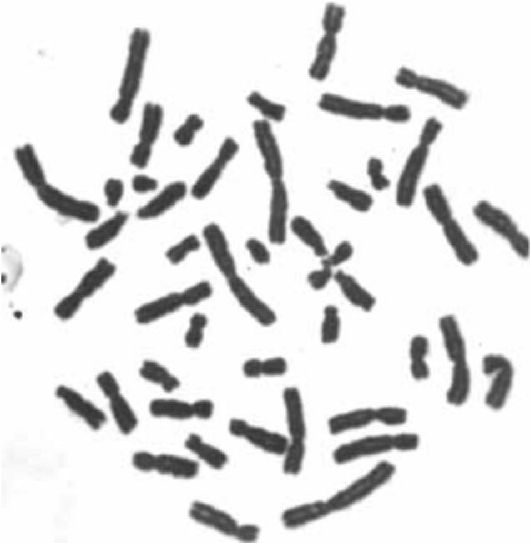 Рис. 8.3. Метафазная пластинка при простой окраске.
Рис. 8.3. Метафазная пластинка при простой окраске.
Следующая стадия цитогенетических методов - окраска препаратов. Методы окраски бывают простыми, дифференциальными, флюоресцентными.
Наиболее распространен метод окраски по Гимзе, или простая окраска (в русскоязычной литературе распространен также термин «рутинная окраска»). Краситель Гимзы окрашивает все хромосомы равномерно по всей длине (рис. 8.3). При этом контурируются центромера, спутники (иног-
да со спутничными нитями) и вторичные перетяжки. Механизм связывания красителя Гимзы хромосомами неясен. Он не является специфичным для какого-либо азотистого основания ДНК.
При простой окраске возможна только групповая идентификация хромосом, поэтому данный метод используется для ориентировочного определения числовых аномалий кариотипа. Структурные хромосомные аномалии (делеции, транслокации, инверсии), выявляемые при простой окраске, должны быть идентифицированы с помощью дифференциальной окраски.
Простая окраска широко применяется для изучения хромосомного мутагенеза (учет хромосомных аберраций) при проверке факторов окружающей среды на мутагенность. На рис. 8.4 и 8.5 хорошо видны аберрации, возникшие под влиянием радиации и химических мутагенов.
Метод простой окраски хромосом как единственный метод изучения кариотипа человека применялся до начала 70-х годов XX века. С его помощью за 10 лет были открыты основные хромосомные болезни, показана роль хромосомных аномалий в спонтанных абортах, врожденных пороках развития и канцерогенезе, разработаны принципы биологической дозиметрии.
Морфологическая однородность хромосомы по длине на стандартно приготовленных и окрашенных по Гимзе препаратах обманчива. Прогресс цитогенетики человека позволил выявить глубокую линейную дифференцированность не только функции, но и струк-
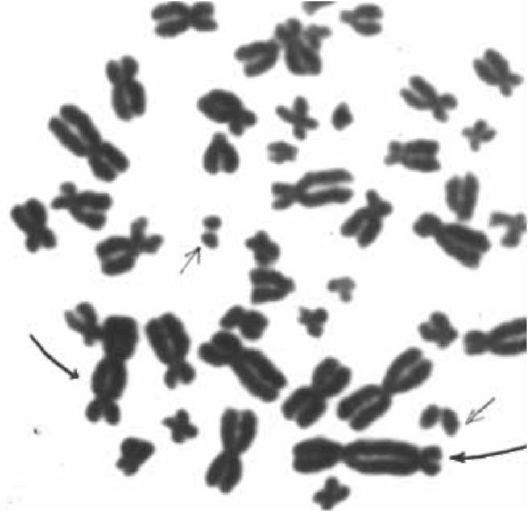 Рис. 8.4. Метафазная пластинка с радиационно-индуцированными хромосомными аберрациями.
Рис. 8.4. Метафазная пластинка с радиационно-индуцированными хромосомными аберрациями.
 Рис. 8.5. Метафазная пластинка (неполная) с химически индуцированными аберрациями.
Рис. 8.5. Метафазная пластинка (неполная) с химически индуцированными аберрациями.
туры хромосом. В 70-х годах в практику вошли методы дифференциального окрашивания и хронологии репликации ДНК в хромосомах.
Под дифференциальной окрашиваемостью хромосом понимают их способность к избирательному окрашиванию по длине без прижизненной модификации какими-либо воздействиями. Дифференциальное окрашивание хромосом обеспечивается сравнительно простыми температурно-солевыми воздействиями на фиксированные хромосомы. При этом выявляется структурная дифференцировка хромосом по длине, выражающаяся в чередовании эу- и гетерохроматиновых районов (темные и светлые полосы). Протяженность этих участков специфична для каждой хромосомы, соответствующего плеча и района. Как видно из рис. 8.6 и 8.7, при дифференциальной окраске идентифицируются все хромосомы, плечи и даже определенные районы. Каждая хромосома имеет свой рисунок исчерченности. При дифференциальной окраске метафазных хромосом в кариотипе можно оценить около 200-400 участков (разрешающая способность метода).
Первоначально при специальном окрашивании хромосом использовали флюоресцентное алкилирующее вещество акрихиниприт. Этот вариант был назван Q-методом, он требует быстрой обработки препарата, что не всегда удобно. Для просмотра препарата надо пользоваться люминесцентным микроскопом.
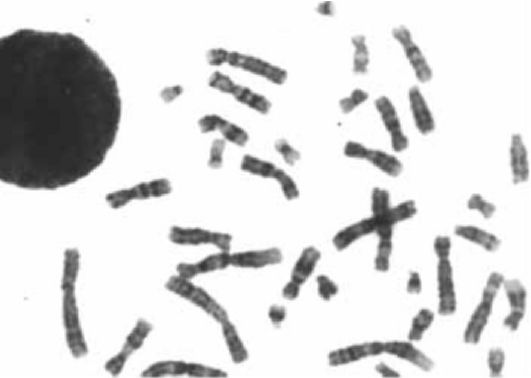 Рис. 8.6. Метафазная пластинка (неполная) после дифференциальной окраски.
Рис. 8.6. Метафазная пластинка (неполная) после дифференциальной окраски.
В последующем была разработана методика дифференциальной окраски без флюоресцентных красителей. Наиболее широко используется G-окрас- ка (по Гимзе). Хромосомы нужно предварительно обрабатывать (инкубация в солевом растворе либо обработка протеазой). Предварительная обработка частично нарушает структуру хромосом, в некоторых участках она восстанавливается при окраске, что и придает хромосоме индивидуальную исчерченность. Механизм образования сегментов пока недостаточно ясен. Предполагается, что окрашенные сегменты - это гетерохроматиновые, поздно реплицирующиеся участки хромосом с повторяющимися последовательностями ДНК, а неокрашенные - это эухроматиновые участки, в которых расположены кодирующие последовательности.
Для идентификации хромосом, помимо методов выявления линейной структурной дифференцированности, можно воспользоваться одной из важных характеристик хромосом человека - асинхронностью их репликации по длине. «Рисунки» последовательности
 Рис. 8.7. Кариотипы при простой (а) и дифференциальной (б) окраске.
Рис. 8.7. Кариотипы при простой (а) и дифференциальной (б) окраске.
 Рис. 8.8. Метафазная пластинка с дифференциальной окраской сестринских хроматид.
Рис. 8.8. Метафазная пластинка с дифференциальной окраской сестринских хроматид.
репликации (рано или поздно реплицирующиеся участки) специфичны для каждой хромосомы. Для выявления последовательности репликации применяется аналог тимидина - 5-бромдезоксиури- дин. Участки хромосомы, включившие этот аналог, окрашиваются плохо. Используя этот метод, можно идентифицировать любую хромосому или хромосомную перестройку.
Аналог 5-бромдезоксиуридина вводят в культуру на 24 ч и более для дифференциальной окраски сестринских хроматид. Если 5-бромдезоксиуридин ввести на полный клеточный цикл, то вновь образуемая хроматида включит аналог тимидина и будет окрашиваться слабо. Другая хроматида (старая) окрашивается, как обычно, интенсивно (рис. 8.8). Этот метод позволяет легко выявлять обмены между сестринскими хроматидами, число которых увеличивается при наследственных болезнях с хромосомной нестабильностью (анемия Фанкони, пигментная ксеродерма и др.) (рис. 8.9). Число сестринских хроматид
 Рис. 8.9. Хроматидные аберрации (а) и сестринские хроматидные обмены (б) при заболеваниях с хромосомной нестабильностью.
Рис. 8.9. Хроматидные аберрации (а) и сестринские хроматидные обмены (б) при заболеваниях с хромосомной нестабильностью.
увеличивается также при мутагенных воздействиях, поэтому метод учета сестринских хроматид широко используется при изучении мутационного процесса у человека.
Молекулярно-цитогенетические методы
Благодаря успехам в молекулярной генетике человека разработан принципиально новый метод изучения хромосом - метод флюоресцентной гибридизации in situ (FISH). Принцип этого метода показан на рис. 8.10.
1. Для изучаемой хромосомы или ее конкретного участка (в связи со специфичностью последовательности оснований ДНК) готовят однонитевой участок ДНК, к которому присоединяется биотин или дигоксигенин. Такой помеченный участок ДНК называется зондом.
2. На микроскопическом препарате in situ при обработке щелочью хромосомная ДНК денатурируется, т.е. разрываются связи между двумя нитями ДНК.
3. Зондом обрабатывают препарат. Поскольку последовательность оснований ДНК зонда и соответствующий участок хромосомы взаимно комплементарны, зонд присоединяется к хромосоме. В этом участке происходит ренатурация ДНК.
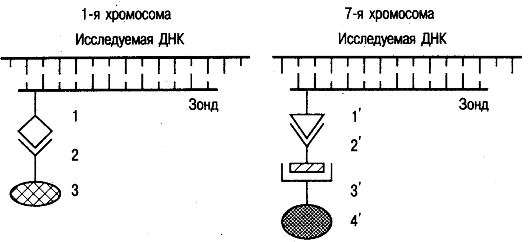 Рис. 8.10. Двойная специфическая флюоресценция гибридизации in situ.
Рис. 8.10. Двойная специфическая флюоресценция гибридизации in situ.
1 - биотин; 2 - стрептовидин; 3 - родамин; l'-диоксигенин; 2'-антиди- гоксигениновое антитело; 3', 4'-флюоросцеина изотиоцианат.
4. После этого препарат обрабатывают веществом, которое способно избирательно присоединиться к биотину или дигоксигенину. Для биотина это стрептовидин, для дигоксигенина - антидигоксигениновое антитело. К этим веществам могут быть присоединены в один или два этапа флюоресцентные красители (родамин - красный цвет или флюоресцеина изотиоцианат - зеленый цвет).
5. С помощью люминесцентного микроскопа окрашенные хромосомы можно увидеть на фоне неокрашенных.
На рис. 8.10 приведена двойная гибридизация, однако современные методические возможности позволяют увеличить число цветов.
Метод FISH применяется очень широко - от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Следует подчеркнуть, что сочетание молекулярно-генетических и цитологических методов делает почти неограниченными возможности диагностики хромосомных аномалий, как очень сложных, так и очень мелких. Двух- и трехцветная флюоресцентная гибридизация in situ применяется для учета симметричных хромосомных аберраций у лиц, много лет назад получивших дозу ионизирующего излучения. Метод требует меньше времени, чем кариотипирование дифференциально окрашенных метафаз.
В клинической цитогенетике метод FISH занимает все большее место. В случаях сложных хромосомных перестроек, захватывающих более двух хромосом, дифференциальная G-окраска не всегда позволяет идентифицировать измененные сегменты хромосом. В этих случаях применяют трехцветный вариант метода FISH. Например, у ребенка с множественными врожденными аномалиями при G-анализе обнаружены сложные перестройки в 6 хромосомах (1, 4, 7, 8, 9 и 12) с 10 разрывами. Полная идентификация разрывов возможна только с помощью FISH-окраски.
Метод FISH можно применять для диагностики анеуплоидий в интерфазных ядрах. Принцип метода в этом варианте такой же, как и для метафазных пластинок, описанный выше. Например, специфичный для хромосомы 21 зонд ДНК, соединенный с биотином, гибридизируется с денатурированными клетками из амниотической жидкости на предметном стекле. В норме, т.е. если у плода есть дисомия по хромосоме 21, в ядре будут видны 2 флюоресцирующие соответствующим цветом точки. Если плод трисомный, то в ядре будут видны 3 точки. Такой методический прием называют интерфазной цитогенетикой. Метод прост, экономичен и занимает всего несколько часов.
Метод сравнительной геномной гибридизации (comparative genome hybridization - CGH). Область использования - онкологическая цитогенетика, назначение - определение районов хромосом, которые делетируются или амплифицируются в определенном типе опухоли. Районы делеций, как правило, содержат гены-супрессоры опухолевого роста, а районы амплификации - онкогены. Таким образом, метод используется в большей степени для картирования и клонирования генов, вовлеченных в канцерогенез.
Иногда достаточно сложно получить хромосомные препараты хорошего качества из солидной опухоли или у пациентов с гематологическими онкологическими заболеваниями. В связи с этим был разработан оригинальный метод косвенного анализа хромосом в опухоли. Суть метода CGH состоит в том, что из опухоли выделяют ДНК и метят ее определенным флюорохромом. ДНК, выделенную из нормальной ткани, метят другим флюорохромом. Хромосомные препараты приготавливают стандартным способом из лимфоцитов периферической крови контрольного индивида. Меченую ДНК из опухоли и неизмененной ткани гибридизуют с хромосомным препаратом. По интенсивности свечения метки определяют области делеций и амплификаций. Область разрешения - 5-10 млн. пар нуклеотидов. Для обработки данных используют программы компьютерного анализа хромосом.
Спектроскопический анализ хромосом (SKY). При этом методе используются флюоресцентные красители, имеющие сродство к определенным участкам хромосом. При использовании набора специфических зондов с разными красителями каждая пара хромосом имеет свои уникальные спектральные характеристики. Особенность метода - использование интерферометра, аналогичного используемым для измерения спектра астрономических объектов. Незначительные вариации в спектральном составе, не различимые человеческим глазом, учитываются при компьютерной обработке и затем программа назначает каждой паре хромосом легкораспознаваемые цвета. Результат в виде цветного изображения чаще используется в цифровой форме. Анализ кариотипа значительно облегчается, поскольку гомологичные хромосомы имеют один и тот же цвет, а аберрации становятся легкоразличимыми. Кроме того, спектральное кариотипирование используется для выявления транслокаций, не распознаваемых традиционными методами. Область использования метода - онкоцитогенетика. Благодаря такому подходу удается точно описать множественные структурные перестройки хромосом, происходящие в опухолевых клетках.
В клинической цитогенетике удается определять очень незначительные по величине транслокации, инсерции и маленькие маркерные хромосомы. Однако использование метода ограничено высокой стоимостью оборудования для анализа.
Показания для проведения цитогенетических исследований
Показания для цитогенетического исследования достаточно широкие, особенно при акушерско-гинекологической и детской патологии. Ниже приводится перечень (возможно, неполный) состояний, при которых для диагностики надо иметь результаты цитогенетического исследования у пациента (пробанда) и в случае необходимости у его родственников.
1. Подозрение на хромосомную болезнь по клинической симптоматике (для подтверждения диагноза).
2. Наличие у ребенка множественных врожденных пороков развития, не относящихся к генному синдрому.
3. Многократные (более двух) спонтанные аборты, мертворождения или рождения детей с врожденными пороками развития.
4. Нарушение репродуктивной функции неясного генеза у женщин и мужчин (первичная аменорея, бесплодный брак и др.).
5. Существенная задержка умственного и физического развития у ребенка.
6. Пренатальная диагностика (по возрасту, в связи с наличием транслокации у родителей, при рождении предыдущего ребенка с хромосомной болезнью).
7. Подозрение на синдромы с хромосомной нестабильностью (учет хромосомных аберраций и сестринских хроматид).
8. Лейкозы (для дифференциальной диагностики, оценки эффективности лечения и прогноза).
9. Оценка мутагенных воздействий (радиационных, химических). Медицинских ограничений для применения цитогенетических
методов нет. Однако необходимо помнить, что эти методы трудоемкие, дорогие, их назначение наугад не оправдано (по принципу «если неясно, то давайте назначим»). Правильнее назначать цитогенетическое исследование по рекомендации врача-генетика после проведения медико-генетического консультирования.
Опыт работы зарубежных медицинских учреждений показал необходимость создания цитогенетических лабораторий при боль-
ших многопрофильных больницах и медико-генетических консультациях, комплексно обслуживающих какой-либо район или город. В России цитогенетические исследования проводятся в медико-генетических кабинетах и медико-генетических консультациях.
Биохимические методы
Биохимические методы в лабораторной диагностике наследственных болезней применяются с начала XX века. Биохимические показатели (первичный белковый продукт гена, накопление патологических метаболитов внутри клетки и во внеклеточных жидкостях) лучше отражают сущность болезни, чем клинические симптомы, не только в диагностическом, но и в генетическом аспекте. Значимость биохимических методов повышалась по мере описания наследственных болезней и совершенствования этих методов (электрофорез, хроматография, спектроскопия и др.). В 80-х годах ХХ века был выделен целый раздел - наследственные болезни обмена веществ, т.е. заболевания с различными биохимическими нарушениями.
Биохимические методы направлены на выявление биохимического фенотипа организма. Уровни, на которых оценивается фенотип, могут быть разными: от первичного продукта гена (полипептидной цепи) до конечных метаболитов в крови, моче или поте. Биохимические методы чрезвычайно многообразны, и их значение в диагностике наследственных болезней постоянно возрастает. Разработка молекулярно-генетических методов диагностики наследственных болезней частично отодвинула интерес к биохимическим исследованиям, но вскоре стало ясно, что в большинстве случаев указанные методы дополняют друг друга, поскольку молекулярногенетически описывается генотип, а биохимически - фенотип. Болезнь - это в конечном счете фенотип. В связи с этим, несмотря на сложность, а иногда и дороговизну биохимических методов, им принадлежит ведущая роль в диагностике моногенных наследственных болезней. Современные высокоточные технологии (высокоэффективная жидкостная хроматография, тандемная масс-спектрометрия, магнитно-резонансная спектроскопия, бомбардировка быстрыми нейтронами) позволяют идентифицировать любые метаболиты, специфичные для конкретной наследственной болезни.
На первый взгляд может показаться, что самым точным методом диагностики является определение мутации на уровне ДНК. Однако это не всегда так. Реализация действия гена - сложный процесс, поэтому «нормальная» структура гена, а точнее, необнаружение мутации, не всегда является полной гарантией нормального биохимического фенотипа.
Принципы биохимической диагностики наследственных болезней менялись в процессе развития генетики человека и биохимии. Так, до 50-х годов XX века диагностика была направлена на поиски специфичных для каждой болезни метаболитов в моче (алкаптонурия, фенилкетонурия). С 50-х до 70-х годов упор в диагностике был сделан на выявление энзимопатий. Разумеется, поиски метаболитов в конечных реакциях при этом не исключались. Наконец, с 70-х годов главным объектом при диагностике стали белки разных групп. К настоящему времени все эти объекты являются предметом биохимической диагностики.
В связи с многообразием биохимических методов, применяемых в лабораторной диагностике наследственных болезней, в использовании этих методов должна быть определенная система. У пробанда или члена его семьи нереально исключить все наследственные болезни, которые могут быть в поле зрения при обследовании. Если применять максимально возможное число методов диагностики, то каждое обследование станет очень трудоемким и долгим. Исходная схема обследования строится на клинической картине болезни, генеалогических сведениях и биохимической стратегии, которые позволяют определить ход обследования на основе поэтапного исключения определенных классов наследственных болезней обмена (просеивающий метод).
Необходимо подчеркнуть, что биохимические методы (в отличие от цитогенетических) многоступенчаты. Для их проведения требуется аппаратура разных классов. Материалом для биохимической диагностики могут быть моча, пот, плазма и сыворотка крови, форменные элементы крови, культуры клеток (фибробласты, лимфоциты), биоптаты мышц. При использовании просеивающего метода в биохимической диагностике можно выделить два уровня: первичный и уточняющий. Каждый из этих уровней может быть по-разному «нагружен» реакциями в зависимости от возможностей лаборатории.
Основная цель первичной диагностики заключается в том, чтобы выявить здоровых людей и отобрать пациентов для последующего уточнения диагноза. В таких программах первичной диагностики
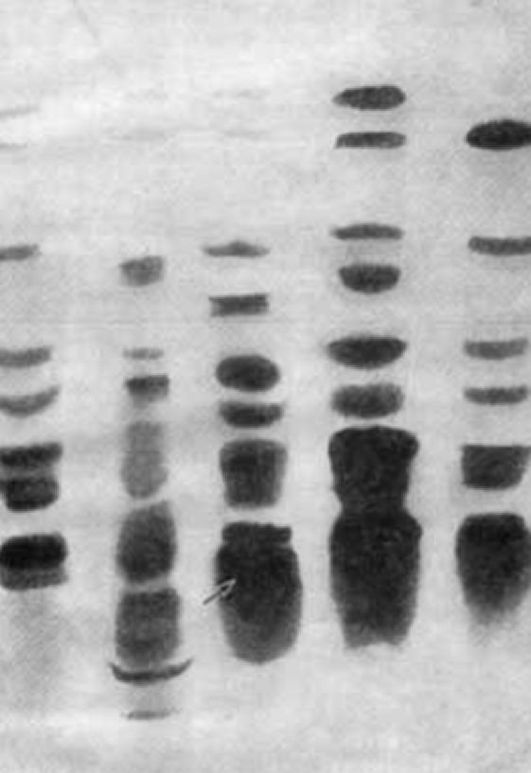 Рис. 8.11. Хроматограммы образца из суточной порции мочи больного с лизинурической непереносимостью белка.
Рис. 8.11. Хроматограммы образца из суточной порции мочи больного с лизинурической непереносимостью белка.
Стрелкой указаны слившиеся пятна диаминокислот (преобладание лизина).
в качестве материала используются моча и небольшое количество крови. Программы первичной биохимической диагностики наследственных болезней могут быть массовыми и селективными. Массовые просеивающие программы в диагностике фенилкетонурии, врожденного гипотиреоза, адреногенитального синдрома, врожденных аномалий развития нервной трубки и болезни Дауна описаны в главе 10.
Селективные диагностические программы предусматривают проверку биохимических аномалий обмена (моча, кровь) у пациентов с подозрением на генные наследственные болезни. Фактически такие программы должны функционировать в каждой большой больнице. Показания для их применения достаточно широкие, стоимость каждого анализа невысокая.
В селективных программах могут использоваться простые качественные реакции (например, тест с хлоридом железа для выявления фенилкетонурии или с динитрофенилгидразином для выявления кетокислот) или более точные методы, позволяющие обнаруживать большие группы отклонений. Например, с помощью тонкослойной хроматографии мочи и крови можно диагностировать наследственные нарушения обмена аминокислот, олигосахаридов и гликозаминогликанов (мукополисахаридов). Газовая хроматография применяется для выявления наследственных болезней обмена органических кислот, ряда аминоацидопатий. С помощью электрофореза гемоглобинов диагностируется вся группа гемоглобинопатий. На рис. 8.11-8.13 представлены результаты биохимической диагностики наследственных болезней.
Нередко приходится углублять биохимический анализ от количественного определения метаболита до определения активности фермента (использование нативных тканей или культивированных клеток), например, с помощью спектрофлюориометрии.
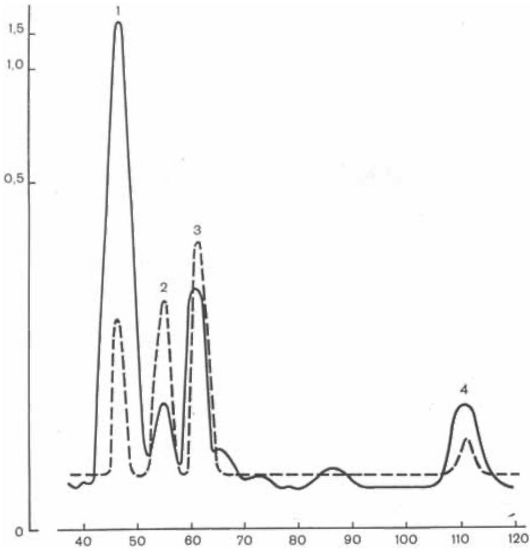 Рис. 8.12. Количественное
содержание диаминокислот в образце суточной мочи больного с
лизинурической непереносимостью белка. Выполнено на аминокислотном
анализаторе.
Рис. 8.12. Количественное
содержание диаминокислот в образце суточной мочи больного с
лизинурической непереносимостью белка. Выполнено на аминокислотном
анализаторе.
По оси абсцисс - время элюирования, мин; по оси ординат - концентрация, мкМ. Сплошная линия - больной; пунктирная линия - норма, 1 - лизин; 2 - гистидин; 3 - аммиак; 4 - аргинин.
В современных условиях очень многие этапы биохимической диагностики осуществляются автоматически, в частности аминоанализаторами.
В Медико-генетическом научном центре РАМН разработана программа селективного скрининга на наследственные болезни обмена веществ с острым течением и ранним летальным исходом.
Первый этап программы включает 14 качественных и количественных тестов с мочой и кровью на белок, на кетокислоты, на цистин и гомоцистеин, креатинин, ионы аммония и др. Второй этап включает методы тонкослойной хроматографии мочи и крови для выявления аминокислот,
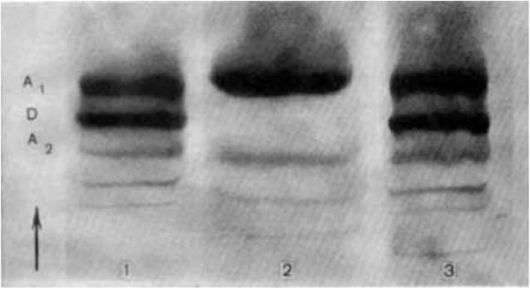 Рис. 8.13. Электрофореграмма гемоглобинов (ацетатцеллюлозная пленка рН 8,6).
Рис. 8.13. Электрофореграмма гемоглобинов (ацетатцеллюлозная пленка рН 8,6).
А1, D, А2 - гемоглобины; 1, 3 - больные; 2 - здоровый донор.
фенольных кислот, моно- и дисахаридов и других соединений. С помощью электрофореза мочи выявляют гликозаминогликаны.
Селективные диагностические программы обеспечивают только предположительное выявление больных с наследственными болезня-
Таблица. 8.1. Методы подтверждающей диагностики
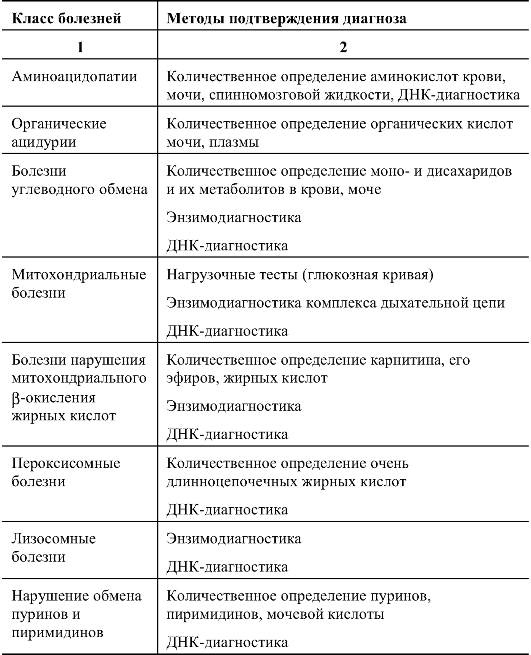 Окончание таблицы 8.1.
Окончание таблицы 8.1.
 ми
обмена веществ. Методы подтверждающей диагностики включают
количественное определение метаболитов, исследование их кинетики,
энзимодиагностику, ДНК-диагностику (табл. 8.1).
ми
обмена веществ. Методы подтверждающей диагностики включают
количественное определение метаболитов, исследование их кинетики,
энзимодиагностику, ДНК-диагностику (табл. 8.1).
Как видно из табл. 8.1, методы подтверждения диагноза многообразны и специфичны для разных классов болезней.
Показаниями для применения биохимических методов диагностики у новорожденных являются судороги, кома, рвота, гипотония, желтуха, специфический запах мочи и пота, ацидоз, нарушенное кислотно-основное равновесие, остановка роста. У детей биохимические методы используют во всех случаях подозрения на наследственные болезни обмена веществ (задержка физического и умственного развития, потеря приобретенных функций, клиническая картина, специфичная для какой-либо наследственной болезни).
Биохимические методы применяют для диагностики наследственных болезней и гетерозиготных состояний у взрослых (гепатолентикулярная дегенерация, недостаточность α1-антитрипсина, недостаточность глюкозо-6-фосфатдегидрогеназы и т.д.). Для диагностики многих болезней биохимические методы заменяют молекулярно-генетическими в связи с их большей точностью или экономичностью.
Молекулярно-генетические методы
Общие процедуры
Молекулярно-генетические методы - это большая и разнообразная группа методов, в конечном счете предназначенных для
выявления вариаций в структуре исследуемого участка ДНК (аллеля, гена, региона хромосомы) вплоть до расшифровки первичной последовательности оснований. В основе этих методов лежат манипуляции с ДНК и РНК. В результате бурного развития молекулярной генетики человека в 70-80-х годах XX века и последующего успешного изучения генома человека молекулярно-генетические методы прочно вошли в медико-генетическую практику.
Ниже схематично описаны основные этапы и варианты молекулярно-генетических методов. Освоение этих методов, как и других методов лабораторной диагностики, требует специальной подготовки в соответствующих лабораториях.
Получение образцов ДНК (или РНК) - первый этап всех методов. Он включает выделение всей ДНК (тотальной или геномной) из клеток или накопление определенных фрагментов, которые предполагается анализировать, с помощью ПЦР.
Источником геномной ДНК могут быть любые ядросодержащие клетки. Выделенная из клеток ДНК представляет собой весь геном организма, поэтому такие образцы называют геномной ДНК. На практике чаще используют периферическую кровь (лейкоциты), хорион, амниотические клетки, культуры фибробластов. Для одного анализа необходимо иметь (в зависимости от используемого метода) от нескольких нанограммов до нескольких микрограммов ДНК. Для этого требуется небольшое количество биологического материала, например 20-40 мг хориона, 1 мл крови, 5-10 мг культуры клеток. При использовании некоторых методов достаточно иметь одну каплю крови или соскоб эпителия со слизистой оболочки щеки либо несколько волосяных луковиц. Возможность проведения молекулярно-генетического анализа с небольшим количеством легкодоступного биологического материала является преимуществом методов этой группы. Можно добавить, что выделенная ДНК одинаково пригодна для проведения различных вариантов методов и может долго сохраняться в замороженном виде.
В большинстве случаев для успешной диагностики болезни или гетерозиготного состояния достаточно исследовать небольшой фрагмент генома. Необходимо получить достаточное количество таких фрагментов, т.е. амплифицировать (умножить) их. Ранее решение этой задачи было трудоемким: создание рекомбинантной плазмиды → введение плазмиды в бактериальную клетку → размножение бактериальных клеток → выделение заданных фрагментов ДНК. Теперь накопление нужных фрагментов ДНК обеспечивает ПЦР.
Открытие этой реакции совершило революцию в изучении генома человека и молекулярно-генетической диагностике наследственных болезней.
Полимеразная цепная реакция - это метод амплификации ДНК in vitro. За несколько часов можно размножить определенную последовательность ДНК в количестве, превышающем исходное в миллион раз и более. Следовательно, исходно требуется незначительное количество материала. Для проведения ПЦР нужно знать нуклеотидную последовательность амплифицируемого фрагмента.
В соответствии с нуклеотидной последовательностью концов 5' и 3' исследуемого участка синтезируется два олигонуклеотидньгх праймера (затравки). Длина праймеров составляет 20-30 нуклеотидов.
Процесс амплификации состоит в повторяющихся циклах. Каждый цикл включает 3 стадии: температурную денатурацию ДНК (разделение двухцепочечной ДНК на одноцепочечные молекулы) - присоединение праймеров к комплементарным последовательностям одноцепочечных молекул (отжиг) - синтез полинуклеотидных цепей на одноцепочечных молекулах в границах присоединенных праймеров с помощью полимеразы (рис. 8.14).
Рестрикция ДНК на фрагменты, необходимый этап молекулярно-генетической диагностики, осуществляется рестриктазами, относящимися к группе бактериальных эндонуклеаз. В генетике человека используют несколько десятков разных рестриктаз. Они способны разрывать двухцепочечную ДНК в пределах строго определенных для каждого фрагмента последовательностей нуклеотидов протяженностью 4-6 пар оснований (редко больше). При обработке геномной ДНК рестриктазой получается закономерный для данного фермента набор фрагментов различной длины.
Электрофорез фрагментов ДНК обеспечивает разделение этих фрагментов при их распределении на поверхности агарозного или полиакриламидного геля. Фрагменты ДНК движутся в геле, помещенном в постоянное электрическое поле, от отрицательного полюса к положительному в зависимости от размеров (чем больше относительная молекулярная масса фрагмента, тем медленнее он движется в электрическом поле). После окончания электрофореза каждый фрагмент ДНК занимает определенное положение в виде дискретной полосы в конкретном месте геля. Длину каждого фрагмента можно определить путем сравнения пройденного фрагментом расстояния с расстоянием, пройденным стандартным образцом ДНК с известными размерами.
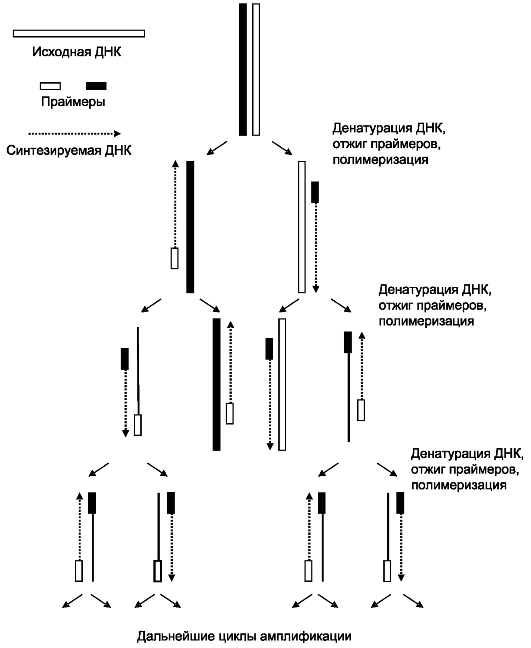 Рис. 8.14. Полимеразная цепная реакция.
Рис. 8.14. Полимеразная цепная реакция.
Визуализация и идентификация фрагментов ДНК в геле становятся либо конечным этапом диагностики, либо элементом дальнейшего анализа.
Визуализация фрагментов ДНК после ПЦР осуществляется сравнительно легко. После окончания ПЦР проводят электрофорез в агарозном геле, после чего гель обрабатывают этидия бромидом, который связывается с ДНК. При ультрафиолетовом облучении поверхности геля выявляется свечение в красной области спектра.
Разработаны и другие методы окраски ПЦР-фрагментов. В некоторых вариантах методов возможна автоматическая регистрация результатов.
Идентификацию конкретных фрагментов в геле среди геномной ДНК провести труднее. Из-за больших размеров генома человека после рестрикции образуется так много рестриктных фрагментов, что агарозный гель после электрофореза и окраски этидия бромидом в ультрафиолетовых лучах выглядит более или менее
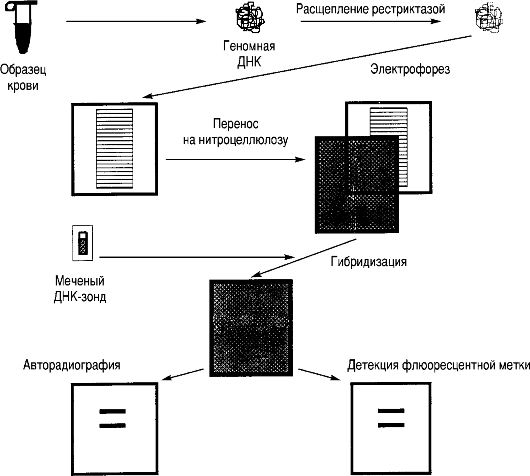 Рис. 8.15. Блот-гибридизация по Саузерну.
Рис. 8.15. Блот-гибридизация по Саузерну.
равномерно окрашенным. Специфические фрагменты ДНК выявляют путем блот-гибридизации по Саузерну. Эта методика состоит из следующих этапов (рис. 8.15).
1. После окончания электрофореза гель помещают в раствор основания (щелочи), в котором двухцепочечные фрагменты ДНК теряют связи и становятся одноцепочечными.
2. Перенос ДНК с геля на нитроцеллюлозный или нейлоновый фильтр производится в буферном растворе. Непосредственно на поверхность геля кладут фильтр и стопку фильтровальной бумаги. В результате капиллярного эффекта создается ток буфера, перпендикулярный плоскости геля. Вымываемая из геля ДНК задерживается фильтром и практически полностью оказывается на его поверхности. После переноса одноцепочечные нити фиксируют на фильтре. Расположение фрагментов на фильтре точно соответствует их расположению в геле.
3. Для того чтобы визуально выявить нужные фрагменты (фиксированная на фильтре ДНК не видна), проводят гибридизацию со специфическим по нуклеотидной последовательности меченым радионуклидом или флюоресцентной меткой олигонуклеотидным синтетическим зондом (такой зонд состоит из 16-30 пар оснований) либо клонированным фрагментом ДНК. Нуклеотидная последовательность зонда должна быть полностью или частично комплементарна изучаемому участку геномной ДНК.
4. При инкубации фильтра с раствором, содержащим меченый зонд, происходит гибридизация комплементарных цепей ДНК зонда и фрагмента на фильтре. Неспецифически связанные молекулы зонда отмываются с помощью специальной процедуры. Радиоактивно меченные участки выявляют путем экспонирования фильтра с рентгеновской пленкой (ауторадиография). После проявления на пленке видны полосы меченной зондом ДНК. Нерадиоактивные метки визуализируют с помощью флюоресценции или опосредованно с помощью антител.
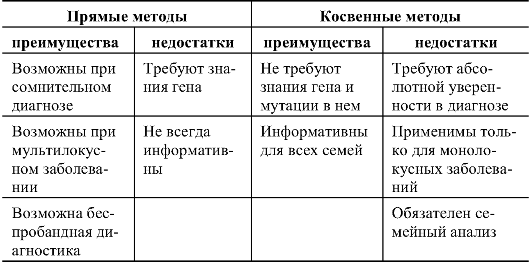
Прямые и косвенные методы ДНК-диагностики
ДНК-диагностика бывает подтверждающей, пресимптоматической, пренатальной, а также ДНК-диагностикой носительства.
Принципиально различают прямую и косвенную ДНК-диагностику моногенных наследственных болезней. Прямые методы
возможны лишь при условии, что ген заболевания клонирован, известна его экзон-интронная организация или нуклеотидная последовательность полноразмерной комплементарной ДНК. При прямой диагностике предметом анализа являются мутации гена.
Однако для ряда наследственных заболеваний ген не клонирован или заболевание является генетически гетерогенным, т.е. обусловлено повреждениями в разных генах, либо молекулярная организация гена не позволяет использовать прямые методы. Эти трудности можно преодолеть с помощью косвенных методов ДНКдиагностики, основанных на использовании сцепленных с геном полиморфных маркеров. В этом случае определяется гаплотип хромосомы, несущей мутантный ген в семьях высокого риска, т.е. у родителей больного и его ближайших родственников. Такой подход возможен практически для всех моногенных заболеваний с известной локализацией гена.
Прямые методы диагностики мутаций. В ДНК-диагностике в настоящее время используются два типа прямых методов. Наиболее просто обнаруживаются мутации, изменяющие длину амплифицированных фрагментов ДНК, которые выявляются при электрофоретическом анализе.
Методы детекции известных мутаций. Если мутации известны, то можно их выявлять либо с помощью ферментов-рестриктаз, которые распознают строго определенные нуклеотидные последовательности, либо на основе ДНК-гибридизации.
Рестрикционный анализ является наиболее простым методом прямой детекции мутаций (рис. 8.16). Его суть состоит в том, что рестрикционные эндонуклеазы (бактериальные ферменты) разрезают двойную нить ДНК в определенных последовательностях из 4-8 нуклеотидов. Разрезание мутантной ДНК дает участки, отличающиеся по длине от нормальных участков, что и выявляется на электрофореграмме. Если в состав сайта рестрикции входит полиморфный нуклеотид, эту мутацию можно выявить абсолютно достоверно. Если полиморфные нуклеотиды лежат в неузнаваемых рестриктазой участках, то метод рестрикционного анализа неприменим.
Аллельспецифичная ПЦР используется для выявления точковых мутаций, небольших делеций и инсерций в исследуемых генах. ПЦР позволяет многократно увеличить уникальную последовательность ДНК, а затем проанализировать ее на предмет мутации. С помощью специфических олигонуклеотидных праймеров проводят амплификацию кодирующих участков геномной ДНК.
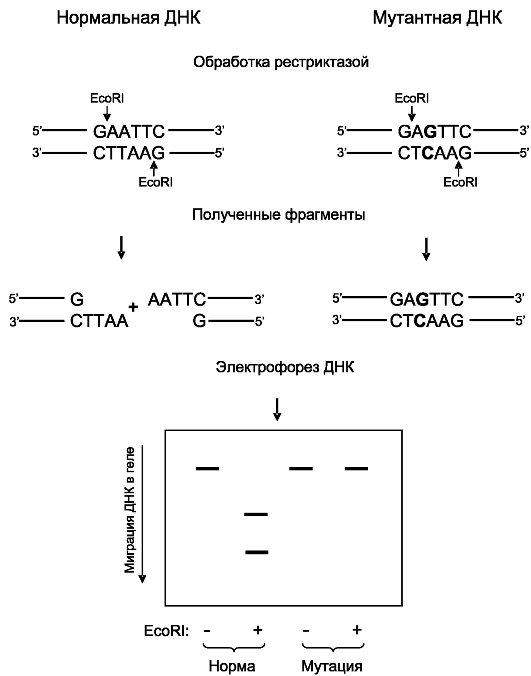 Рис. 8.16. Рестрикционный анализ с ферментом EcoRI.
Рис. 8.16. Рестрикционный анализ с ферментом EcoRI.
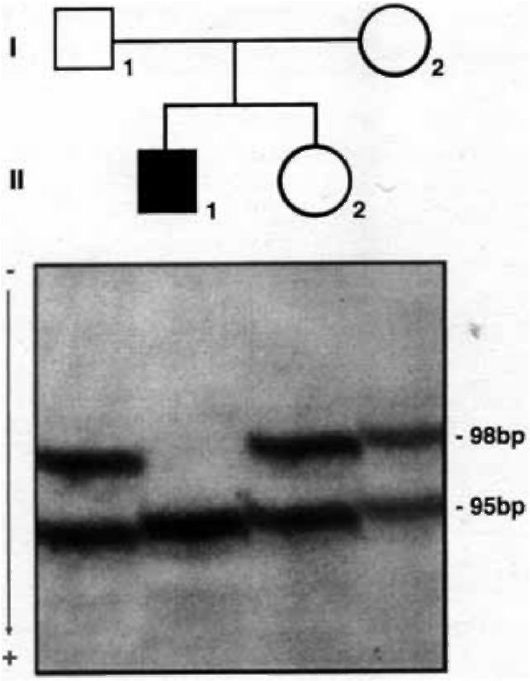 Рис. 8.17. ДНК-диагностика муковисцидоза с помощью технологии ПЦР в сайте ΔF 508. Объяснение в тексте.
Рис. 8.17. ДНК-диагностика муковисцидоза с помощью технологии ПЦР в сайте ΔF 508. Объяснение в тексте.
На рис. 8.17 представлены результаты ДНК-диагностики в семье с мальчиком, страдающим муковисцидозом. Молекулярная структура этого гена хорошо известна. ПЦР-амплификация проведена по участку (сайту) расположения мутации F508 в гене муковисцидоза у детей и родителей. Как видно из электрофоретической картины, отец, мать и дочь (они здоровы) имеют две полосы (98 и 95 п.н.), следовательно, они гетерозиготы. У больного мальчика одна полоса (95 п.н.), т.е. он гомозиготен по мутантному аллелю F508. Обычно параллельно ставят реакции с праймерами, соответствующими мутантному и нормальному аллелям. Использование нормального праймера
служит положительным контролем, свидетельствующим о нормальном ходе амплификации.
Наряду с двумя разобранными выше прямыми методами детекции известных мутаций есть еще несколько методов, не менее точных, но более трудоемких. Это рестрикционный анализ; аллельспецифичная ПЦР; ПЦР в реальном времени, пробы Tag Man, гибридизация с аллельспецифичными олигонуклеотидами, аллельспецифичная лигазная реакция, минисеквенирование, пиросеквенирование. Характеристики этих методов можно найти в специальной литературе.
Чувствительность и специфичность методов высокие. Наиболее распространены 3: рестрикционный анализ, аллельспецифичная ПЦР и ПЦР в реальном времени. Врач-лаборант или исследователь в каждом случае останавливается на каком-то методе, а потом может перейти на другой. Все методы очень точные. Они позволяют однозначно определять мутацию ДНК, даже если разница составляет одно основание.
Методы мутационного скрининга. Если характер мутации неизвестен, а клиническая картина заболевания позволяет предположить, в каких генах могла произойти мутация, то в лабораторной диагно-
стике применяются следующие методы мутационного скрининга: 1) анализ перестроек ДНК-блотингом по Саузерну; 2) анализ полиморфизма конформации одноцепочной ДНК; 3) электрофорез двухцепочечной ДНК в градиенте денатуранта; 4) гетеродуплексный анализ; 5) денатурирующая высокоэффективная жидкостная хроматография; 6) химическое обнаружение неспаренных нуклеотидов; 7) защита от РНКазы.
Чувствительность скрининговых методов обнаружения мутаций не абсолютна. Однако соотношение между их информативностью и стоимостью достаточно высокое, поэтому они широко используются в практике. В то же время их отрицательная сила невелика, т.е если не обнаружено изменений, это не значит, что их на самом деле нет.
Ниже будут приведены характеристики некоторых методов мутационного скрининга.
SSCР (Single Strand Conformation Polymorphism) - метод анализа конформационного полиморфизма однонитевой ДНК - основан на регистрации различий в электрофоретической подвижности однонитевых ДНК, одинаковых по величине, но различающихся вследствие нуклеотидных замен по пространственной организации молекул (рис. 8.18). Конформация небольших однонитевых ДНК зависит от нуклеотидной последовательности, поэтому замена даже одного нуклеотида приводит к изменению пространственной структуры. Метод включает амплификацию фрагментов ДНК размером до 300 п.н., денатурацию продуктов ПЦР и высокоразрешающий электрофорез в полиакриламидном геле.
Конформационный метод выявления точковых мутаций получил широкое распространение вследствие относительной простоты и способности обнаруживать любые типы замен. Ограничением является размер исследуемого фрагмента ДНК, так как высокая эффективность детекции мутаций, составляющая 80-90%, показана при длине фрагментов менее 200 п.н., а для фрагментов более 400 п.н. вероятность обнаружения мутаций уменьшается до 50%.
В настоящее время разрешающая способность метода значительно повышена. В частности, разработаны подходы для идентификации точковых мутаций методом SSCP-анализа в амплифицированных фрагментах ДНК размером до 800 п.н. Для этого используется полиакриламидный гель с низким pH.
HA (Heteroduplex Analysis) - гетеродуплексный анализ позволяет выявлять мутации, находящиеся в гетерозиготном состоянии, а также инсерции и делеции. Принцип этого метода заключается в следующем.
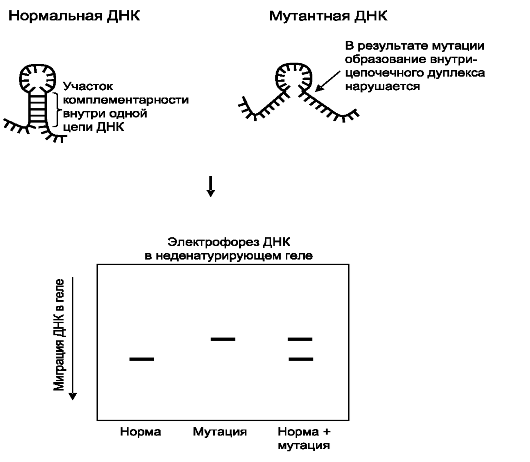 Рис. 8.18. Анализ полиморфизма конформации одноцепочечной ДНК.
Рис. 8.18. Анализ полиморфизма конформации одноцепочечной ДНК.
При амплификации фрагментов генов гетерозигот, последующей денатурации и медленной ренатурации полученных продуктов ПЦР в амплификационной смеси наряду с двумя типами гомодуплексов образуются гетеродуплексы между нормальной и мутантной цепями ДНК (рис. 8.19). Такие гетеродуплексные молекулы отличаются по электрофоретической подвижности от гомодуплексов из-за конформационных особенностей в местах несовпадения нуклеотидов, поскольку электрофоретическая подвижность гетеродуплексов значительно ниже, чем гомодуплексов. Эти различия обнаруживаются при электрофорезе в обычном полиакриламидном геле.
Наиболее распространенным способом скрининга мутаций является комбинация анализа гетеродуплексов и метода однонитевого конформационного полиморфизма, позволяющая выявить точковые мутации почти в 100% случаев и не требующая больших затрат времени.
DGGE (Denaturating Gradient Gel Electrophoresis)- денатурирующий градиентный гель-электрофорез (рис. 8.20). ДНК-дуплексы подвергаются миграции в геле с градиентом денатурирующих условий (можно использовать и температурный градиент). Миг-
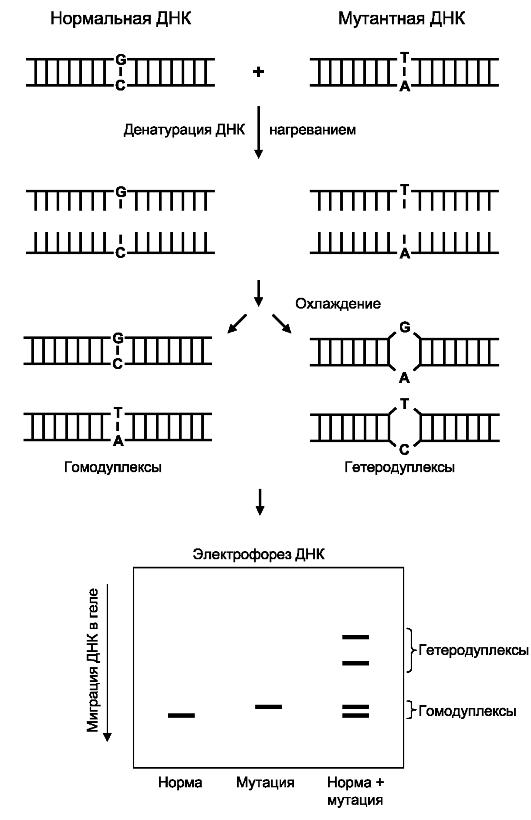 Рис. 8.19. Гетеродуплексный анализ.
Рис. 8.19. Гетеродуплексный анализ.
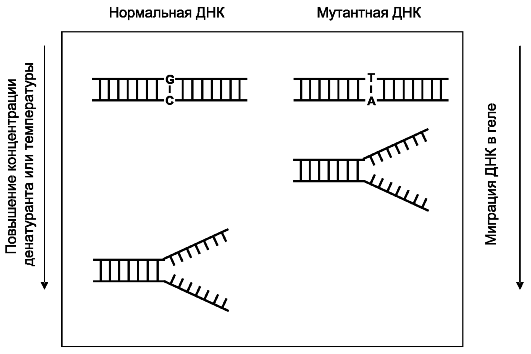 Рис. 8.20. Электрофорез в градиенте денатуранта.
Рис. 8.20. Электрофорез в градиенте денатуранта.
рация продолжается до тех пор, пока ДНК-дуплексы не достигают в геле точки плавления и не разделяются, после чего миграция фрагментов останавливается. Однонуклеотидные различия в нормальной и тестируемой ДНК выявляются по различной электрофоретической подвижности в геле. Высокая чувствительность метода (95%) достигается благодаря специфическим праймерам с так называемым GC-зажимом, представленным чередованием гуанина и цитозина в пределах до 20 нуклеотидов. В результате температура плавления продукта амплификакии сильно увеличивается, что повышает эффективность определения мутации. Однако праймеры с GC-зажимом достаточно дороги, поэтому применение метода ограничено.
CCM (Chemical Cleavage of Mismatch) - метод химического расщепления неспаренных оснований. Метод основан на гибридизации радиоактивно меченной ДНК-пробы с тестируемой ДНК. Места ошибок затем выявляют с помощью серии химических реакций (модификация с использованием тетрахлорида осмия), которые происходят с однонитевой ДНК в сайтах неправильного спаривания. Этот метод можно применять для тестирования фрагментов ДНК размером до 1000 п.н., он выявляет локализацию ошибки и доволь-
но чувствителен. Однако метод не нашел широкого распространения вследствие токсичности химических реагентов и методической сложности. Подобное расщепление неспаренных нуклеотидов может быть и энзиматическим, что позволяет исключить использование токсичных химикатов. Метод основан на расщеплении неспаренных оснований в гетеродуплексе, образуемом между тестируемой ДНК и нормальной последовательностью посредством таких ферментов, как резолваза фага Т4 или эндонуклеаза VII. Однако этот метод еще более «капризный», чем ССМ.
Заключительным этапом анализа мутаций является их секвенирование, т.е. определение нуклеотидной последовательности фрагмента ДНК, показавшего аномальную электрофоретическую подвижность. Последовательность нуклеотидов этого фрагмента сравнивается с нормой, в результате чего патология приобретает свою окончательную характеристику.
Метод секвенирования. Любые типы мутаций можно обнаружить путем прямого секвенирования мутантной кДНК или отдельных экзонов. Первичный поиск нарушений в кодирующих областях гена часто осуществляют именно таким образом. Для некоторых генов, имеющих небольшие размеры, прямое секвенирование с успехом применяется как основной метод сканирования мутаций. Так, в частности, особенно удобным оказалось его применение для детекции мутаций в сравнительно небольших генах, таких, как ген фактора IX свертывания крови (гемофилия В).
Разработанные в последние годы модификации методов ПЦР значительно облегчили секвенирование амплифицированных фрагментов и повысили эффективность секвенирования. Так, в частности, предложен вариант асимметричной ПЦР, когда при амплификации концентрация одного из олигопраймеров в несколько десятков раз превосходит концентрацию другого праймера, в результате чего синтезируется преимущественно только одна, нужная для секвенирования цепочка ДНК.
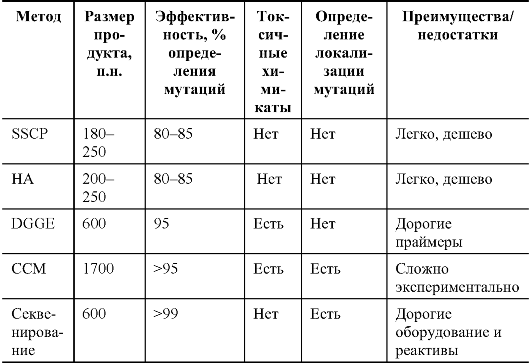
В табл. 8.2 представлены характеристики разных скрининговых методов ДНК-диагностики. Врач лаборант-генетик заранее определяет стратегию поиска в соответствии с оснащенностью лаборатории.
Многие мутации прерывают синтез белкового продукта. В этих случаях образуются укороченные полипептидные цепи, функционально незначимые. Для диагностики таких мутаций можно применять метод трансляции белкового продукта. Он проводится in vitro на основе полученной специфической мРНК с добавлением лизата ретикулоцитов (в нем содержатся все необходимые компоненты для синтеза бел-
ка). В этой системе синтезируется белковый продукт соответствующего гена. Продукт трансляции анализируют с помощью электрофореза. Изменение электрофоретической подвижности белка свидетельствует о наличии мутации (нонсенс-мутация, нарушение сплайсинга РНК, сдвиг рамки считывания), приводящей к обрыву синтеза полипептидной цепочки.
Таблица 8.2. Эффективность основных скрининговых методов ДНК-диагностики
 Косвенное выявление мутаций применяется
тогда, когда нуклеотидная последовательность гена еще неизвестна и
вместе с тем имеется информация об относительном положении гена на
генетической карте. Фактически это соответствует диагностике с помощью
метода сцепления генов.
Косвенное выявление мутаций применяется
тогда, когда нуклеотидная последовательность гена еще неизвестна и
вместе с тем имеется информация об относительном положении гена на
генетической карте. Фактически это соответствует диагностике с помощью
метода сцепления генов.
Косвенная ДНК-диагностика по существу сводится к анализу полиморфных генетических маркеров у больных и здоровых членов семьи. Эти маркеры должны быть расположены в том же хромосомном регионе, где и ген болезни, т.е. они сцеплены. Такими маркерами могут быть участки ДНК, существующие в популяции в нескольких аллельных вариантах. Различия могут быть по составу нуклеотидов, по числу динуклеотидных повторов. На основе вариабельности со-
става маркерных участков ДНК можно дифференцировать материнское или отцовское происхождение конкретного варианта маркера, сцепленного с геном болезни. Сцепление означает, что маркер и ген болезни располагаются близко друг к другу; они передаются в составе одного хромосомного сегмента. Благодаря анализу полиморфных генетических маркеров можно проследить в ряду поколений наследование каждой из родительских хромосом.
Технические приемы в косвенной диагностике те же самые, что и в прямой (получение ДНК, рестрикция, электрофорез и т.д.). Естественно, к этому добавляется математический анализ сцепления признаков.
Использование косвенных подходов оказалось возможным благодаря существованию в геноме полиморфных участков (локусов) ДНК. Нуклеотидные замены достаточно часто встречаются в некодирующих участках ДНК. Значительное число нуклеотидных замен приводит к изменению мест рестрикции. Эти изменения можно выявить с помощью блот-гибридизации по Саузерну, поскольку изменяется длина рестриктных фрагментов. Эта разновидность полиморфизма ДНК получила название полиморфизма по длине рестриктных фрагментов.
Расположенный вблизи изучаемого гена или внутри него полиморфный сайт может служить маркером аллельных вариантов этого гена, в том числе маркером патологических мутаций.
Полиморфизм, обусловленный нуклеотидными заменами или делециями, как правило, диаллелен, а, значит, его информационная ценность ограничена. Более информативны кластеры тандемных повторов, которые обусловливают полиморфизм по количеству копий (VNTR - variable number of tandem repeatеs), так называемый полиморфизм мини- и микросателлитных последовательностей.
Микросателлиты - короткие тандемные повторы, обычно двугексануклеотидные. Самым распространенньгм из них является CA- повтор. Показано, что кластеры СА-повторов встречаются в среднем 1 на 30 000 п.н. Они локализованы, как правило, в некодирующих районах ДНК. Блоки СА-повторов имеют менделевское наследование в семьях и не обнаруживают новых мутаций (рис. 8.21). Немаловажным положительным фактором является относительная простота обнаружения таких повторов в геноме человека. Кроме СА-повторов, достаточно распространены GA-повторы и другие кластеры тандемных повторов (ТТТА) n, (TCTA) n, (TTTC) n, также обнаруживающие вариабельность по числу повторов. Широкая распространенность в геноме (частота различных микросателлитов, взятых вместе, составляет 1 на 6000 п.н.) и высокий уровень полиморфизма делают микро-
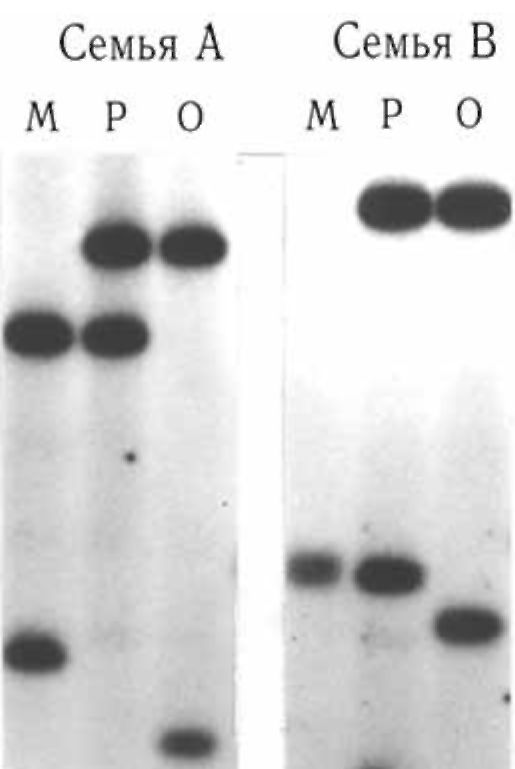 Рис. 8.21. Семейный анализ фрагментов ДНК с помощью блот-гибридизации по Саузерну: М - мать, Р - ребенок, О - отец.
Рис. 8.21. Семейный анализ фрагментов ДНК с помощью блот-гибридизации по Саузерну: М - мать, Р - ребенок, О - отец.
и мини-сателлиты идеальными полиморфными маркерами для картирования генов наследственных заболеваний и проведения косвенной ДНК-диагностики.
Полиморфные ДНК-маркеры и интегральная карта их расположения позволяют определить и проследить в поколениях хромосому, несущую патологический ген, а также подробнейшим образом охарактеризовать определенный хромосомный район, выявить субмикроскопические перестройки, определить наименьший район их перекрывания и локализовать генкандидат, ответственный за заболевание.
Основной недостаток косвенных методов диагностики - обязательное предварительное изучение генотипа (гаплотипа) хотя бы одного пораженного родственника. В случае отсутствия пораженных родственников, доступных для обследования, диагностика (за редким исключением) становится невозможной.
Итак, существует достаточно много молекулярно-генетических методов диагностики наследственных болезней. Эти методы оказались настолько универсальными, что нашли применение не только в медицинской генетике, но и диагностике инфекционных заболеваний. Каждый из представленных в табл. 8.3 методов имеет много вариантов. Одни и те же болезни можно диагностировать разными методами. Можно диагностировать болезнь даже в трудных случаях (невозможность обследования родителей, малое количество биологического материала, отсутствие сведений о гене и т.д.).
Вся методология молекулярно-генетической диагностики наследственных болезней представлена на рис. 8.22. в виде алгоритма.
Поскольку генодиагностика проводится в специализированных, хорошо оснащенных лабораториях и сопряжена с немалыми расходами, должны быть строгие клинические показания для проведения анализа. Лечащий врач и врач-генетик совместно составляют схему обследования больного. Такое взаимодействие, как правило, обеспечивает успех.
Таблица 8.3. Сравнительные характеристики прямых и непрямых методов ДНК-диагностики
 Автоматизация
существующих методов и разработка принципиально новых подходов к
изучению структуры нуклеиновых кислот наряду с ускоренными темпами
изучения генома человека и клонирования генов, ответственных за развитие
моногенной па-
Автоматизация
существующих методов и разработка принципиально новых подходов к
изучению структуры нуклеиновых кислот наряду с ускоренными темпами
изучения генома человека и клонирования генов, ответственных за развитие
моногенной па-
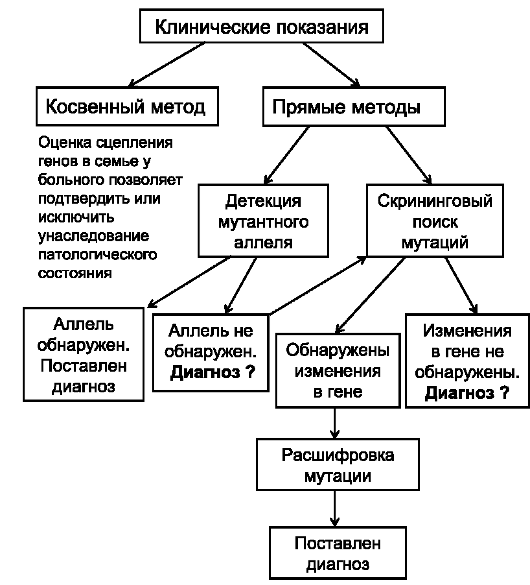 Рис. 8.22. Алгоритм генодиагностики наследственных заболеваний.
Рис. 8.22. Алгоритм генодиагностики наследственных заболеваний.
тологии, позволяют прогнозировать появление в недалеком будущем средств диагностики большинства известных наследственных болезней человека.
Ключевые слова и понятия
Асинхронность репликации ДНК Блот-гибридизация по Саузерну Высокоразрешающие цитогенетические методы
Диагностика путем анализа полиморфизма по длине рестриктных фрагментов
Диагностика путем секвенирования гена
Интерфазная цитогенетика
Лабораторная идентификация ступеней болезни
Массовые просеивающие программы
Материал для цитогенетических методов
Методические условия цитогенетических исследований
Олигонуклеотидные зонды
Показания для биохимических исследований
Показания для цитогенетических исследований
Полимеразная цепная реакция (ПЦР)
Принципы биохимической диагностики наследственных болезней
Просеивающий подход
Прямая детекция мутаций (варианты)
Селективные диагностические программы
Специфические зонды ДНК
Сущность молекулярно-генетической диагностики Флюоресцентная гибридизация (FISH-метод)
Контрольные вопросы
1. В основу современной классификации хромосом положены:
а) интенсивность окрашивания;
б) характер поперечной исчерченности при дифференциальной окраске;
в) размер и расположение центромеры;
г) длина плеч хромосом.
2. Массовый биохимический скрининг предполагает:
а) обследование детей из учреждений для слабовидящих;
б) исследование крови и мочи новорожденных на содержание гликозаминогликанов (мукополисахаридов);
в) обследование новорожденных с целью выявления определенных форм
наследственной патологии в доклинической стадии;
г) обследование детей с судорожным синдромом, отставанием в психомоторном развитии, параплегией.
3. Для проведения цитогенетического анализа используются:
а) клетки костного мозга;
б) клетки печени;
в) лимфоциты периферической крови;
г) биоптат семенника.
4. Показания для проведения биохимического исследования:
а) задержка психического развития в сочетании с признаками мочекислого диатеза;
б) легкая олигофрения, задержка полового созревания;
в) олигофрения в сочетании с общей диспластичностью;
г) мышечная гипертония, гипопигментация, задержка моторного и речевого развития.
5. Молекулярный зонд - это:
а) комплементарный участок ДНК;
б) протяженный участок ДНК, комплементарный последовательности ДНК,
содержащей мутантный ген;
в) синтетическая олигонуклеотидная меченная (радиоактивно или флюоресцентно) последовательность, комплементарная мутантному или нормальному гену.
6. Хромосомы с концевым расположением центромеры называются:
а) метацентриками;
б) акроцентриками;
в) субметацентриками;
г) дицентриками.
7. Показания для проведения специальных биохимических тестов:
а) умственная отсталость, врожденные пороки развития различных органов и систем;
б) привычное невынашивание;
в) катаракта, гепатоспленомегалия, отставание в развитии;
г) расторможенность, нарушение поведения, имбецильность, необычный запах мочи.
8. Эухроматиновые участки хромосом содержат:
а) множественные повторы последовательностей ДНК;
б) гены;
в) нетранскрибируемые локусы;
г) регуляторные области.
9. Биохимическая диагностика показана при:
а) сочетании задержки психомоторного развития с гипопигментацией и необычным запахом мочи;
б) гипогенитализме, гипогонадизме, бесплодии;
в) прогредиентном утрачивании приобретенных навыков.
10. Для диагностики болезней, для которых мутантный ген неизвестен и не локализован, применяется:
а) прямая детекция с использованием специфических молекулярных зондов;
б) семейный анализ распределения нормального полиморфизма длины рестриктных фрагментов;
в) метод специфических рестриктаз;
г) прямой сиквенс.
11. С применением цитогенетических методов диагностируются:
а) наследственные дефекты обмена веществ;
б) мультифакториальные болезни;
в) болезни, обусловленные изменением числа и структуры хромосом.
12. Показания для проведения биохимического исследования:
а) повторные случаи хромосомных перестроек в семье;
б) отставание в физическом развитии, гепатоспленомегалия, непереносимость каких-либо пищевых продуктов;
в) множественные врожденные пороки развития;
г) повторные спонтанные аборты.
13. Для диагностики небольших структурных перестроек применяются методы окраски:
а) простой (рутинный);
б) дифференциальный;
в) флюоресцентный.
14. Массовому биохимическому скринингу подлежат заболевания:
а) нейрофиброматоз;
б) гемохроматоз;
в) мукополисахаридозы;
г) фенилкетонурия;
д) адреногенитальный синдром.
15. Эндонуклеазные рестриктазы - это:
а) ферменты, разрезающие ДНК в строго специфических местах;
б) ферменты, сшивающие разрывы молекулы ДНК;
в) ферменты, обеспечивающие соединения, осуществляющие репарацию ДНК.
16. При повторных спонтанных абортах (более 3-х) на ранних сроках беременности и при мертворождениях в анамнезе цитогенетический анализ назначается:
а) обоим супругам;
б) одной женщине;
в) родителям женщины;
г) плоду.
17. Проведения специальных биохимических исследований требуют:
а) мышечная гипотония, рвота, отставание в психомоторном развитии, нарушение координации движений, тромбоцитопения;
б) хронические пневмонии, нарушение всасывания в кишечнике, гипотрофия;
в) шейный птеригиум, лимфатический отек кистей и стоп, низкий рост;
г) снижение зрения, кифосколиоз, гепатоспленомегалия, умственная отсталость.
18. Наиболее часто используются в пренатальной диагностике методы разделения фрагментов ДНК:
а) центрифугирование в градиенте плотности солей цезия;
б) методы одномерного электрофореза.
19. Для диагностики геномных мутаций применяют:
а) метод G-окраски;
б) метод С-окраски;
в) рутинную окраску;
г) метод с использованием флюоресцентных красителей.
20. Одно из условий проведения массового биохимического скрининга новорожденных:
а) низкая частота гена болезни в популяции;
б) отсутствие методов патогенетического лечения;
в) наличие быстрого, точного, простого в выполнении и недорогого метода диагностики биохимического дефекта;
г) выраженный клинический полиморфизм болезни.
21. Явление полиморфизма по длине рестриктных фрагментов обусловлено:
а) химической и функциональной гетерогенностью ДНК;
б) наследуемыми, фенотипически не проявляющимися различиями в последовательности групп оснований в геноме;
в) существованием различных уровней конформационной организации ДНК.
22. Гетерохроматические участки хромосом содержат:
а) множественные повторы последовательностей ДНК;
б) гены;
в) нетранскрибируемые локусы;
г) регуляторные области.
23. Подлежат массовому биохимическому скринингу:
а) врожденный гипотиреоз;
б) маннозидоз;
в) синдром Марфана;
г) множественная эндокринная неоплазия;
д) фенилкетонурия.
24. Амплификация генов - это:
а) идентификация последовательности оснований ДНК;
б) многократное повторение какого-либо участка ДНК;
в) выделение фрагмента ДНК, содержащего изучаемый ген.
25. Цитогенетический метод является решающим для диагностики:
а) моногенной патологии с известным первичным биохимическим дефектом;
б) синдромов с множественными врожденными пороками развития;
в) хромосомной патологии;
г) мультифакториальных болезней.
26. Показания для проведения специальных биохимических исследований:
а) комплексы врожденных пороков развития и микроаномалий развития
на фоне пре- и постнатальной задержки физического развития;
б) рвота, дегидратация, нарушение дыхания, асцит у ребенка 1-го года жизни при исключении пороков развития ЖКТ;
в) прогредиентная умственная отсталость и неврологическая симптоматика после периода нормального развития различной длительности.
27. Для диагностики болезней, обусловленных мутантным геном известной последовательности, применяют:
а) специфичную рестриктазу;
б) прямую детекцию с использованием специфических молекулярных зондов;
в) семейный анализ распределения нормального полиморфизма длины рестриктных фрагментов.
28. Для проведения цитогенетического анализа используют:
а) мышечные клетки;
б) эритроциты;
в) биоптат хориона;
г) эмбриональную ткань.
29. Проведения биохимических исследований требуют:
а) микроцефалия, умственная отсталость, лицевые дизморфии, пороки развития почек и сердца;
б) судороги, повышенная возбудимость, отставание в психомоторном развитии;
в) повышенная фоточувствительность кожи, тетраплегия, полиневриты, изменение цвета мочи;
г) низкий рост, пороки развития сердца и ЖКТ, брахидактилия, эпикант, мышечная гипотония.
30. Секвенирование ДНК - это:
а) идентификация последовательности оснований ДНК;
б) многократное повторение какого-либо участка ДНК;
в) выделение фрагмента ДНК, содержащего изучаемый ген.
31. Современные цитогенетические методики:
а) исследование полового хроматина;
б) интерфазный анализ хромосом;
в) молекулярно-цитогенетический метод;
г) метод рутинной окраски.
32. Массовому биохимическому скринингу подлежат болезни с:
а) тяжелым течением, летальностью в раннем возрасте независимо от проводимого лечения;
б) высокой частотой гена болезни в популяции;
в) курабельностью при назначении специфической патогенетической терапии.
33. Для получения образцов ДНК можно использовать:
а) кровь;
б) сыворотку;
в) ворсины хориона;
г) амниотическую жидкость;
д) клетки амниотической жидкости;
е) биоптаты кожи, мышц, печени.
34. Микрохромосомные перестройки (микроделеции, микродупликации, транслокации небольших участков хромосом) выявляются с помощью:
а) прометафазного анализа хромосом;
б) метода С-окрашивания;
в) анализа полового хроматина;
г) молекулярно-цитогенетических методов.
35. Для проведения блот-гибридизации по Саузерну необходимы:
а) нитроцеллюлозный или нейлоновый фильтр;
б) ДНК пациента;
в) последовательность ДНК используемого зонда;
г) специфичная рестриктаза;
д) ДНК-зонд.
36. Верные утверждения относительно аллельспецифичной гибридизации с олигонуклеотидными зондами:
а) необходимо знание мутации, обусловливающей данное заболевание;
б) перед началом ДНК-диагностики необходимо знание последовательности
всего гена, включая фланкирующие регуляторные последовательности;
в) может использоваться для диагностики серповидно-клеточной анемии;
г) для диагностики достаточно ДНК нескольких членов семьи;
д) этот диагностический метод применим для небольшого числа генных болезней.