Клиническая генетика: Учебник. - 3-е изд., испр. и доп. -Н.П. Бочков, 2004. - 480 с.: ил.
|
|
|
|
ГЛАВА 2. НАСЛЕДСВЕННОСТЬ И ПАТОЛОГИЯ
Изменчивость наследственных признаков как основа патологии
Стабильность генетического аппарата и обусловливаемый этим аппаратом консерватизм наследственности - лишь одна сторона биологических закономерностей. Другая ее сторона, столь же неотъемлемая от живого, как и первая, - изменчивость. Наследственность и изменчивость в совокупности обеспечили и сохранение жизни на Земле, и непрекращающуюся биологическую эволюцию. Наследственная изменчивость организма обеспечивает его приспособляемость к условиям существования как в пределах жизни одного индивида, так и в рамках существования биологического вида в целом.
Наследственное многообразие человека - результат длительной эволюции живой материи. Эволюция человека как биологического и социального существа имеет свои особенности. У человека как социального существа естественный отбор со временем принимал все более специфические формы, что, безусловно, расширяло наследственное разнообразие популяций. Сохранялось то, что могло «отметаться» у животных, или, наоборот, терялось то, что животным нужно. Например, более полноценное обеспечение пищей и возможность удовлетворять потребность в витамине С привели к тому, что человек в процессе эволюции утерял ген L-гулонолактонокси- дазы, катализирующей у животных синтез аскорбиновой кислоты. Этот ген у животных предохраняет их от цинги, а человек из-за такой «всеобщей врожденной ошибки метаболизма» подвержен авитаминозу С. В процессе эволюции человек приобретал и нежелательные признаки, имеющие прямое отношение к патологии. Большинство видов животных невосприимчивы к дифтерийному токсину и вирусу полиомиелита, потому что у животных отсутствуют компоненты мембраны клеток, обеспечивающие восприятие того или другого патогенного фактора. У человека эти компоненты есть. Гены, их детерминирующие, уже идентифицированы. Например, ген для восприятия дифтерийного токсина локализован в хромосоме 5, для вируса полиомиелита - в хромосоме 19.
Большинство мутаций увеличивают полиморфизм человеческих популяций (группа крови, цвет волос, рост, разрез глаз и др.), но иногда мутации затрагивают жизненно важные функции, а это приводит к болезни. Таким образом, наследственная патология - это часть наследственной изменчивости, накопившейся за время эволюции человека. Человек, став биологическим видом Homo sapiens, как бы заплатил за «сапиентацию» своего вида накоплением патологических мутаций. На основе этих положений формулируется одна из главных концепций медицинской генетики об эволюционном накоплении патологических мутаций в человеческих популяциях. Подтверждением этой концепции служат патологические мутации у животных, сходные по проявлениям с наследственными болезнями у человека (ахондроплазии, гемофилии, мышечные дистрофии и др.), а также наследственные болезни у людей, живших несколько тысячелетий назад (об этом можно судить по находкам скелетов с признаками патологических процессов в раскопках и по произведениям искусства).
На рис 2.1 представлена скульптура супружеской пары с двумя детьми периода 2563-2423 г. до н.э. (Музей египетского искусства в Каире). Дети и женщина нормальные, у мужчины укороченные конечности, уменьшенные кисти и стопы. Диагноз: одна из форм хондродистрофий, наиболее вероятно гипохондроплазия.
На некоторых картинах знаменитого испанского художника Р. Веласкеса (1599- 1660) изображены люди низкого роста. На одном из его лучших полотен, «Sebastian de Morra» (1628), у человека большая голова, запавшая переносица, ризомелически
 Рис. 2.1. Больной с гипохондроплазией, живший 4500 лет назад, в скульптурном изображении.
Рис. 2.1. Больной с гипохондроплазией, живший 4500 лет назад, в скульптурном изображении.
 Рис. 2.2. Больной с ахондроплазией (с картины Р. Веласкеса).
Рис. 2.2. Больной с ахондроплазией (с картины Р. Веласкеса).
укороченные конечности. Диагноз: ахондроплазия (рис. 2.2).
Эволюция любого вида, в том числе и человека, в конечном счете сводится к эволюции генотипа. В биологической эволюции человека болезнь как фактор естественного отбора могла играть существенную роль, а эволюция генотипа в свою очередь меняла нозологию патологических процессов. Зависимость эволюции болезни от эволюции генотипа вряд ли может вызывать сомнение. Выше были приведены конкретные формы этой зависимости (цинга, дифтерия, полиомиелит). Факторы эволюции долго влияли не только на формирование биохимических, иммунных, физиологических или морфологических свойств организма, но и на его пато-
логические реакции, обусловливая значительно большее многообразие нозологических форм болезней у человека, чем у животных.
Основным источником многообразия наследственных признаков и их непрекращающейся эволюции служит мутационная изменчивость. Способность ДНК мутировать сложилась в эволюции и закрепилась отбором, по-видимому, так же, как и способность противостоять мутационным изменениям, т.е. репарировать их. В организации ДНК заложена возможность ошибок ее репликации наряду с возможностью изменения первичной структуры. Вероятность сбоя в точности репликации молекулы ДНК невелика и составляет 1:10-5-1:10-7. Однако, принимая во внимание исключительно большое число нуклеотидов в геноме (3,2?109 на гаплоидный набор), следует признать, что в сумме на геном клетки на одно ее поколение приходится несколько мутаций в структурных генах. По мнению разных авторов, каждый индивид наследует 2-3 новые вредные мутации, которые могут давать летальный эффект или
подхватываться отбором, увеличивая генетическое разнообразие человеческих популяций.
Изменение нуклеотидной последовательности молекулы ДНК может отразиться на первичной (аминокислотной) структуре белка или на регуляции его синтеза. Так, большой опыт изучения молекулярной природы мутаций гемоглобина показывает, что значительная часть таких мутаций не изменяет функции гемоглобина. Такие мутации нейтральны и не подвергаются отбору. Другие мутации приводят к функциональным отклонениям в молекуле белка. Эти отклонения в каких-то условиях жизни организма могут оказаться полезными, т.е. иметь адаптивное значение, поэтому сохранятся, а иногда и умножатся в последующих поколениях. Таким путем возникали и сохранялись в популяциях разнообразные варианты структурных, транспортных и ферментных белков организма. Свойственный организму человека широкий белковый полиморфизм, благодаря которому каждый индивид биохимически неповторим, исходно обусловлен мутационной изменчивостью и отбором адаптивных белковых вариантов.
Однако если структурные отклонения несовместимы с выполнением белком его функции, а она жизненно важна для клетки (организма), мутация становится патологической и в дальнейшем либо исключается из популяции вместе с нежизнеспособной клеткой (организмом), либо сохраняется, обусловливая наследственную болезнь. В отдельных случаях гетерозиготные носители патологической мутации подвергаются положительному отбору. Примером этого служит ген серповидно-клеточной анемии, который широко распространился в популяциях, проживающих в эндемичных по малярии районах, вследствие большой устойчивости гетерозиготных носителей аномального гена (мутантного аллеля) к малярийному плазмодию.
Различные признаки организма по-разному устойчивы к мутационным изменениям, что связано, по-видимому, со значением признака и с его эволюционным «возрастом». Такие признаки, как гистоновые белки, входящие в состав хромосом, или сократительные белки актин и тубулин, или ферментные белки репликации и транскрипции весьма консервативны и одинаковы не только у разных представителей человечества, но и у биологических видов значительной филогенетической отдаленности. По-видимому, мутации в соответствующих генах летальны. Большинство белков организма, особенно ферментных, существует в нескольких изоформах и подвержено таким мутационным изменениям, которые ведут к патологии.
Мутации различны по способности сохраняться и распространяться в популяциях. Одни из них, позволяющие их носителю сохранять плодовитость и не вызывающие серьезных неблагоприятных сдвигов в фенотипе, могут долго передаваться из поколения в поколение. Признаки, обусловленные такими мутациями, сегрегируют в поколениях согласно законам Менделя, и обусловленный ими генетический груз в популяциях может долго сохраняться. Некоторые комбинации условно патологических рецессивных аллелей могут давать селективное преимущество индивидам (выживаемость, плодовитость). Частота таких аллелей в популяции будет повышаться до определенного уровня в ряду поколений, пока не наступит равновесие между интенсивностью мутационного процесса и отбора. Частота разных мутантных аллелей этого рода может быть неодинаковой в различных популяциях, что определяется популяционными закономерностями (эффект родоначальника, частота кровнородственных браков, миграция и экологические условия).
Если вновь возникшая мутация имеет доминантное патологическое проявление и ведет к летальному генетическому исходу (индивид не оставляет потомства), то такой мутационный груз не передается следующему поколению. Это обычно доминантные формы тяжелых болезней, а также большая часть хромосомных болезней.
В целом эффекты генетического груза у человека выражены в эволюционно-генетических явлениях балансированного полиморфизма, летальности и сниженной фертильности.
На основе постоянного изменения наследственности (мутаций) и отбора генотипов в процессе длительной эволюции человека в популяциях сформировался балансированный полиморфизм. Под этим названием понимают, что в популяции представлены 2 формы или более аллелей одного гена, причем частота редкого аллеля не менее 1%. Поскольку возникновение мутаций - редкое событие (1?10-7), частоту мутантного аллеля в популяции более 1% можно объяснить только каким-то селективным преимуществом этого аллеля для организма и постепенным накоплением в ряду поколений после его появления. Примерами балансированного полиморфизма являются группы крови АВ0, резус-фактор, гены муковисцидоза, фенилкетонурии, первичного гемохроматоза. Генетическое многообразие человека основано на балансированном полиморфизме, формировавшемся в течение десятков и сотен тысячелетий. Такое многообразие - основа развития человека как биологического вида. Вероятность возникновения и фиксации в популяциях какой-либо мутации с положительным эффектом в эволюционно отлаженном
человеческом организме существует и в настоящее время, но она крайне мала. Новые мутации практически всегда дают отрицательный эффект.
К эффектам мутационного груза относится летальность. Она проявляется гибелью гамет, зигот, эмбрионов, плодов, детей. Наиболее интенсивно летальные эффекты в человеческих популяциях выражены на уровне зигот. Примерно 60% зигот погибают до имплантации, т.е. до клинической регистрации беременности. Исходы всех клинически зарегистрированных беременностей: спонтанные аборты - 15%, мертворождения - 1%, живорождения - 84%. Из 1000 живорожденных не менее 5 умирают в возрасте до 1 года по причине наследственной патологии, несовместимой с жизнью. Таков объем летального груза мутационной изменчивости в популяциях человека с медицинской точки зрения.
Большинство наследственных болезней сопровождается сниженной фертильностью из-за нарушения репродуктивной функции. Это ведет к уменьшенному воспроизводству потомства (и больного, и здорового) в семьях с наследственной патологией.
Медицинские и социальные последствия мутационного процесса - социальная дизадаптация (инвалидность) больных, повышенная потребность в медицинской помощи и сниженная продолжительность жизни (см. главу 10).
Роль наследственности и среды в развитии патологии
Любые проявления жизнедеятельности организма являются результатом взаимодействия наследственных и средовых факторов. Болезнь также развивается на основе тесного взаимодействия внешних повреждающих и внутренних факторов. Если внутренние факторы наследственно изменены, то возникает патологический процесс. Факторы внутренней среды - это в конечном счете результат взаимодействия генетических и средовых факторов в онтогенезе, потому что уровень гормонов в организме, особенности обмена веществ, иммунные реакции исходно определяются функционированием соответствующих генов, другими словами, генетической конституцией.
Наследственные факторы, определяющие основу внутренней среды организма в широком смысле слова, принимают самое не-
посредственное участие в формировании патологических процессов, либо выступая в роли этиологического фактора, либо участвуя в патогенезе заболевания. Процессы выздоровления и исход болезни при прочих равных условиях во многом определяются генетической конституцией организма. Более того, генетические факторы существенно определяют даже смертность в возрасте от 20 до 60 лет. Об этом можно судить на основании обстоятельного близнецового исследования. Конкордантность близнецов по смертности в возрасте 20-60 лет от всех болезней составила у монозиготных пар 30,1%, а у дизиготных - 17,4%. Даже по смертности от травм конкордантность у монозиготных близнецов выше (6,9%), чем у дизиготных (3,9%).
С генетической точки зрения все болезни в зависимости от относительной значимости наследственных и средовых факторов в их развитии можно разделить на наследственные болезни, болезни с наследственной предрасположенностью и ненаследственные болезни (рис. 2.3).
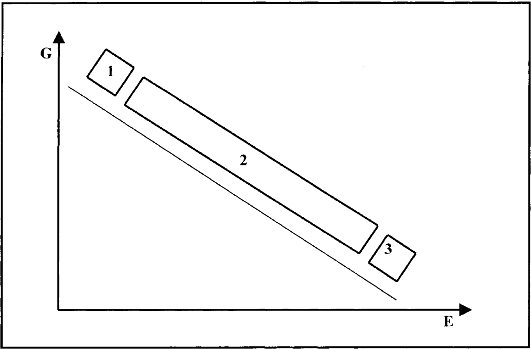 Рис. 2.3. Относительная роль генетических (G) и средовых (Е) факторов в развитии болезней человека.
Рис. 2.3. Относительная роль генетических (G) и средовых (Е) факторов в развитии болезней человека.
1 - строго наследственные болезни; 2 - болезни с наследственной предрасположенностью; 3 - ненаследственные болезни.
Наследственными болезнями называют болезни, вызванные мутациями. Проявление патологического действия мутации как этиологического фактора практически не зависит от среды. Среда может только менять выраженность симптомов болезни и тяжесть ее течения. К заболеваниям этой группы относятся хромосомные и генные наследственные болезни с полным проявлением (болезнь Дауна, нейрофиброматоз, гемофилия, фенилкетонурия, муковисцидоз, ахондроплазия и др.). Болезнь может проявляться не обязательно в детском возрасте, она диагностируется у человека любого возраста в соответствии с временными закономерностями генной экспрессии (например, средний возраст начала хореи Гентингтона равен 38-40 годам).
О болезнях с наследственной предрасположенностью говорят тогда, когда болезнь развивается у лиц с определенной генетической характеристикой под влиянием факторов окружающей среды. Эти болезни называют также мультифакториальными. Наследственность служит и этиологическим, и патогенетическим фактором. Для пенетрантности мутантных генов необходим соответствующий фактор окружающей среды. К таким заболеваниям относятся, например, некоторые формы подагры, диабета, фармако- и экогенетические болезни. Подобные заболевания развиваются после контактов с проявляющим болезнь внешним фактором, специфичным для каждого мутантного гена. Этиологическими факторами могут быть средовые влияния, но частота возникновения и тяжесть течения болезней существенно зависят от наследственной предрасположенности (как в индивидуальном, так и в групповом варианте). К таким болезням относятся атеросклероз, гипертоническая болезнь, туберкулез, экзема, псориаз, язвенная болезнь и др. Они возникают под действием внешних факторов (иногда не одного, а сочетания многих) гораздо чаще у лиц с наследственной предрасположенностью.
В происхождении ненаследственных болезней определяющую роль играет среда. Сюда относится большинство травм, инфекционных болезней, ожогов и т.д. Генетические факторы могут влиять только на течение патологических процессов (выздоровление, восстановительные процессы, компенсация нарушенных функций).
Приведенное выше объяснение (см. рис. 2.3) в некоторой степени условно, но оно помогает оценить относительное значение наследственности и среды в развитии болезней человека. Диалектическое понимание процессов развития показывает значение наследственных и средовых факторов. Анализ патологических про-
цессов возможен только с учетом взаимодействия факторов наследственности и среды.
Генетическая программа индивида может участвовать в развитии патологии прямо или опосредованно. Передаваясь из поколения в поколение, она обеспечивает воспроизведение типологических характеристик человека как биологического вида и создает каждый раз (на основе генетических явлений и закономерностей) индивида, уникального по генотипу, в том числе по патологическим вариациям. При образовании гамет и затем зигот возможна любая перекомбинация аллелей от отца и матери, пополняемая новыми мутациями.
Факты, накопленные медицинской генетикой, показывают многообразие относительной роли наследственности и среды в развитии любых видов патологии, кроме двух крайних ситуаций, т.е. полной независимости от генетических или средовых факторов. Вклад каждого компонента может быть различным при разных видах патологии. Так, мутации этиологически обусловливают возникновение наследственных болезней. Факторы среды будут влиять в этом случае только на клиническую картину. Известно, что даже при жесткой генетической детерминации патологии условия внешней среды и весь генотип в целом могут существенно модифицировать характер и степень проявления эффектов патологического гена.
Ряд внешнесредовых причин, несомненно, обусловливает заболевания при любом генотипе (ожоги, травмы). Но и в этом случае восстановление, интенсивность и разнообразие клинических проявлений, спектр возможных осложнений и исходов могут определяться не только собственно повреждением, но и генетической конституцией организма.
Мутации как этиологический фактор
Этиологическими факторами наследственных болезней являются геномные, хромосомные и генные мутации. Заболевания, связанные с геномными (изменение числа хромосом) и хромосомными (изменение структуры хромосом) мутациями, называются хромосомными болезнями. При хромосомных болезнях нарушаются, как правило, сбалансированность набора генов и строгая детерминированность нормального развития организма. Это приводит к внутриутробной гибели эмбрионов и плодов, появлению врожден-
ных пороков развития и других элементов клинической картины хромосомных болезней.
Большинство форм наследственных заболеваний обусловлено генными мутациями, т.е. молекулярными изменениями на уровне ДНК (муковисцидоз, гемофилия, фенилкетонурия, нейрофиброматоз, миопатия Дюшенна и др.). Это генные болезни.
Мутации транскрибируемых участков (определяющих аминокислотную последовательность в молекуле синтезируемого белка) приводят к синтезу аномального продукта, а мутации нетранскрибируемых областей могут приводить к замедлению синтеза незаменимого белка разной выраженности. Фенотипически генные мутации могут проявляться на молекулярном, клеточном, тканевом и органном уровнях.
Множественность метаболических путей, функций белков в организме, ограниченность наших представлений о нормальном метаболизме затрудняют разработку обоснованной этиологической классификации генных болезней. Даже число генных болезней можно определить только ориентировочно (4500-5000), потому что нет строгих критериев для нозологических форм ни с клинической, ни с генетической точки зрения. Например, с клинической точки зрения миопатии Дюшенна и Беккера являются разными формами, а с генетической точки зрения это результат мутации в одном и том же локусе. Более определенно можно говорить о тех генах, в которых идентифицированы обусловливающие болезнь мутации. В настоящее время известно около 1500 таких генов. Однако в ближайшее время на основе знаний генома человека обнаружение генов и мутаций в них, вероятно, будет ускорено. В связи с тем что различные мутации в одном и том же гене часто приводят к различным нарушениям, общее число болезней с установленной мутационной природой можно считать равным 2000.
Унаследование патологического гена (а в случае рецессивных мутаций - двух аллелей) не всегда сопровождается развернутой клинической картиной. Выше уже говорилось о возможном влиянии факторов внешней среды на проявление генов. Однако и другие гены, формирующие генотип особи, т.е. генетическую конституцию индивида, могут модифицировать проявление патологического гена. В таких случаях говорят о неполной пенетрантности и варьирующей экспрессивности. Поскольку генетическая среда для патологического гена всегда индивидуальна, возникают широкие возможности для разного проявления этого гена у различных индивидов.
Многие генные мутации обусловливают возникновение таких молекулярных форм белков, патологическое действие которых вы-
является не в обычных условиях, а только при взаимодействии со специфическими факторами внешней среды. Это так называемые экогенетические варианты. Например, у лиц с мутациями в локусе глюкозо-6-фосфатдегидрогеназы при лечении сульфаниламидами возникает гемолиз эритроцитов, у лиц с аномальной холинэстеразой введение дитилина приводит к длительной остановке дыхания (см. главу 7).
Наследственность и патогенез
Многие специфические стороны патогенеза наследственных болезней определяются характером повреждения генетических структур, но формируются на уровне целостного организма, что и обусловливает индивидуальные особенности патологических процессов.
При хромосомных болезнях отклонения от нормального развития коррелируют, как правило, с выраженностью хромосомного дисбаланса. Чем больше хромосомного материала вовлечено в мутацию, тем раньше заболевание проявится в онтогенезе и тем значительнее будут нарушения в физическом и психическом развитии индивида. Как правило, избыток хромосом (или их частей) переносится гораздо легче, чем их недостаток.
Сопоставление фено- и кариотипа при хромосомных болезнях показывает, что специфические проявления синдрома зависят от небольших сегментов хромосом. Дисбаланс по большому объему генетического материала приводит к более неспецифической картине поражения.
Каких-либо специфических черт патогенеза хромосомных болезней не обнаружено ни на молекулярном, ни на клеточном уровне. Основная черта хромосомного дисбаланса - множественность пороков развития разных органов и систем (черепно-лицевые дизморфии, пороки развития скелета, сердечно-сосудистой, нервной и мочеполовой систем).
Механизмы патогенеза моногенных заболеваний весьма разнообразны. Специфичность этих механизмов во многом определяется биохимическими нарушениями, обусловленными данной мутацией.
Некоторые общие закономерности патогенеза менделирующей патологии можно рассмотреть на примере наследственных болезней обмена веществ, для которых установлена связь между мутантным геном и биохимической реакцией.
Патологические проявления развиваются как следствие сложного взаимодействия биохимических сдвигов и физиологических изменений в организме. Даже при сходстве вида нарушения, например накопления субстрата, патогенетические механизмы развития различных заболеваний будут различны. В одном случае накапливающийся субстрат может откладываться в клетках, приводя их к гибели, в других он легко покидает клетки и его концентрация в биологических жидкостях может многократно превысить нормальный уровень. В результате возникают условия для существенного изменения кислотно-основного равновесия крови, конкуренция с физиологическим аналогом при транспорте через гематоэнцефалический барьер, накопление вещества в разных тканях.
Роль генетических факторов в патогенезе болезней неинфекционной природы выясняют через обнаружение ассоциаций таких болезней с менделирующими признаками (их называют генетическими маркерами). Для некоторых заболеваний уже выяснена патогенетическая роль маркеров. Так, например, большая встречаемость группы крови 0(I) по системе АВ0 и статуса «несекретор» при некоторых формах язвенной болезни двенадцатиперстной кишки обусловлена участием этих систем в комплексе защитных свойств слизистой оболочки. При фенотипе 0(I) и статусе «несекретор» способность к слизеобразованию и защите слизистой оболочки снижена.
Специфичность патогенеза многих наследственных и ненаследственных болезней во многом может определяться состоянием иммунной и эндокринной систем, функции которых генетически детерминированы. Неблагоприятный наследственный фон может стать провоцирующим моментом в развитии любой патологии. Например, как правило, бессимптомная гетерозиготность по гену β-талассемии во время беременности приводит к развитию выраженной анемии, требующей терапевтического вмешательства. При мутациях в генетических системах репарации ДНК мутагенные и канцерогенные факторы ускоряют развитие злокачественных новообразований.
Наследственность и клиническая картина болезни
Многоплановость клинических и лабораторных проявлений любого заболевания охватывается понятием клинического полиморфизма.
О причинах клинического полиморфизма в общей форме можно сказать, что он обусловлен взаимодействием генетических и средовых факторов. В связи с этим объяснение клинического разнообразия болезней тесно связано с расшифровкой таких фундаментальных понятий генетики, как генетическая гетерогенность, пенетрантность, экспрессивность, плейотропия.
Генетические причины полиморфизма наследственных болезней обусловлены генетической уникальностью каждого индивида, а конкретные механизмы обусловлены либо генетической гетерогенностью (мутации в разных локусах или множественные аллели), либо модифицирующим влиянием всего генотипа особи, т.е. генотипической конституцией индивида.
Истинный клинический полиморфизм наследственных болезней может быть обусловлен модифицирующим влиянием генотипа на проявление патологического гена, т.е. взаимодействием генов. На эту сторону клинического полиморфизма впервые обратил внимание С.Н. Давиденков, изучая наследование отдельных симптомов нервных болезней среди родственников больного. Согласно его гипотезе, клинические проявления заболевания становятся наибольшими, если в одном генотипе объединяются «патологический задаток» и другие наследственные факторы сходно направленного действия. Усилительный тропизм, по С.Н. Давиденкову, специфичен для каждого гена.
Несмотря на общепринятость представлений о значении наследственности в реализации патологических процессов, до недавнего времени роль наследственности представляли в виде некоего недифференцированного фона. Однако многочисленные примеры связей некоторых генетически детерминированных полиморфных систем с особенностями патологических процессов убедительно свидетельствуют о значимой роли наследственности в индивидуальной патологии. Таким образом, в целом наследственная конституция организма - это база, которая может во многом определять индивидуальную специфику клинической картины наследственных и ненаследственных болезней. Хорошая иллюстрация сказанного - большие индивидуальные различия иммунного ответа.
Не меньшую роль, чем генотипическая среда, в происхождении клинического полиморфизма наследственных болезней могут играть факторы внешней среды, взаимодействуя с наследственными факторами на любом этапе внутриутробной или постнатальной жизни. Например, богатая фенилаланином пища беременной усиливает развитие фенилкетонурии у будущего гомозиготного ребенка.
Более того, у генетически нормальных потомков женщин с фенилкетонурией наблюдаются внутриутробная задержка роста, отставание в умственном развитии, микроцефалия. Эти нарушения связаны с воздействием на плод высоких концентраций фенилаланина и его метаболитов в сыворотке крови беременной.
Болезни с наследственной предрасположенностью имеют еще больший клинический полиморфизм по сравнению с моногенными заболеваниями, поэтому при многих мультифакториальных болезнях речь идет о клиническом континууме с многообразием форм - от субклинических до тяжелых.
Наследственность и исходы заболеваний
Патологическое действие мутации (или мутаций) может приводить к летальному исходу на разных стадиях онтогенеза. Существенный вклад летальных и полулетальных мутаций во внутриутробную гибель и в раннюю постнатальную смертность не вызывает сомнений, хотя и не всегда можно определить, прямое это действие (этиологическое) или опосредованное через патогенез. Летальный эффект мутаций может проявиться сразу после оплодотворения. По-видимому, 50% всех зачатий не реализуется в беременность и в большинстве случаев - в результате наследственных нарушений. Около 50% всех спонтанных абортов связано с генетическими факторами. В первой половине беременности происходит наибольшая элиминация эмбрионов и плодов. При этом чем раньше прерывается беременность, тем вероятнее, что причиной аборта были хромосомные аномалии. Хотя механизмы гибели различны, в целом они связаны с нарушениями генетического контроля различных этапов эмбриогенеза - от невозможности имплантации бластоцисты до неспособности кариотипически аномальных клеток формировать тканевые структуры.
Не только хромосомные аномалии, но и генные мутации обусловливают внутриутробную гибель. Известно более 150 таких нозологических форм. Генетические факторы имеют существенное значение и в перинатальной смертности. Почти у каждого 3-го перинатально умершего обнаруживается наследственная и врожденная патология.
Значение генетических факторов в летальных исходах не отрицает и не умаляет значения внешних факторов в структуре смерт-
ности, а лишь подчеркивает, что повреждающие воздействия (гипоксия, родовая травма, интоксикация, гипотрофия, инфекции) у детей с аномальным генотипом скорее приведут к гибели, чем у нормальных детей. Многие наследственные болезни приводят к смерти большинство больных с наследственной патологией в качестве первопричины либо служат неблагоприятным фоном, утяжеляющим течение ненаследственных болезней.
Существенный вклад в причины детской смертности вносят хромосомные болезни и такие наследственные генные болезни, как муковисцидоз, гипотиреоз, адреногенитальный синдром, фенилкетонурия и др.
Патологические мутации как этиологический фактор могут быть причиной хронических болезней. Наследственные болезни практически всегда относятся к хроническим процессам, если только мутация не приводит к гибели на эмбриональной стадии либо к смерти в раннем детстве. Хроническое течение свойственно как генным, так и хромосомным наследственным болезням. Большинство наследственных болезней (в том числе болезни обмена веществ) имеют, как правило, прогредиентное течение. Генные мутации могут давать не только специфические проявления, но и неспецифическое снижение сопротивляемости организма сопутствующим заболеваниям, обусловливая их хронизацию.
Наследственная конституция может существенно изменять эффективность лечебных мероприятий. Во-первых, это широко известные наследственно обусловленные патологические реакции на различные лекарственные вещества; во-вторых, это полиморфизм по скорости выведения или окисления некоторых лекарственных веществ либо метаболитов, модифицирующих фармакокинетику ряда лекарственных препаратов.
Значение наследственности в исходе (летальный эффект или хроническое течение) известно не только для наследственных (как хромосомных, так и генных), но и для ненаследственных болезней. Хотя роль генетических факторов в выздоровлении при ненаследственных болезнях изучена недостаточно, но в общей форме ясно, что отдельные мутации или их сочетания приводят к пониженной способности организма выдерживать повреждающее влияние среды. Следовательно, у таких лиц выздоровление будет затягиваться, что обусловит переход патологического процесса в хронический. Действие конкретных генов в хронизации ненаследственных болезней осуществляется через измененную направленность биохи-
мических реакций, нарушение гормонального статуса, снижение иммунного ответа и т.д. Например, при отсутствии каталазы в крови (наследственная акаталазия) наблюдаются хронические воспаления слизистых оболочек, при наследственных иммунодефицитных состояниях - хронические заболевания верхних дыхательных путей, носоглотки.
Классификация наследственной патологии
В связи со сложной природой наследственной патологии есть несколько вариантов ее классификации и с генетической, и с клинической точек зрения. Прямое отношение к классификации наследственной патологии имеет терминология, употребляемая в медицинской литературе.
Термин «наследственные болезни» не равен понятию «врожденные болезни». Под врожденными болезнями понимают такие состояния, которые существуют уже при рождении ребенка. Врожденные болезни могут быть обусловлены наследственными и ненаследственными факторами. Последние вызывают врожденные пороки, возникшие в результате тератогенного действия внешних факторов, врожденные инфекции (сифилис, краснуха и др.). В то же время не все наследственные болезни являются врожденными (очевидно, их около 50%). Некоторые заболевания проявляются в детском (миопатия Дюшенна, муковисцидоз), другие в зрелом (миотоническая дистрофия, хорея Гентингтона) и даже в пожилом (болезнь Альцгеймера) возрасте.
Термин «семейные болезни» не является синонимом термина «наследственные болезни». Семейные болезни могут быть наследственными и ненаследственными. Этот термин говорит только о том, что заболевание встречается у членов одной семьи, да и само понятие «семья» включает родственников от двух до нескольких поколений. Болезнь может быть обусловлена влиянием одного и того же вредного фактора в семье: неправильного питания, плохой освещенности, сырой квартиры, одной и той же профессии (шахтеры, ткачи и др.). Иногда заболевания разделяют на семейные и спорадические. При этом для семейного заболевания подразумевается его наличие у родственников, а для спорадического - отсутствие в семье. Таким образом, при подобной классификации большинство рецессивных заболеваний будет относиться к спорадическим, по-
скольку в родословных (особенно если родословная не очень большая) часто не наблюдается других случаев этого заболевания. Термин «спорадический» можно с известной долей условности применять в случаях доминантных и хромосомных болезней. Спорадические случаи противопоставляются унаследованным от больного родителя, т.е. термин «спорадичность» подчеркивает первичное возникновение мутации.
Генетическая классификация наследственных болезней
В основу генетической классификации наследственных болезней положен этиологический принцип, а именно тип мутаций и характер взаимодействия со средой. Всю наследственную патологию можно разделить на 5 групп: генные болезни, хромосомные болезни, болезни с наследственной предрасположенностью (синоним: мультифакториальные), генетические болезни соматических клеток и болезни генетической несовместимости матери и плода. Каждая из этих групп в свою очередь подразделяется в соответствии с более детальной генетической характеристикой и типом наследования.
Генные и хромосомные болезни. Как известно, в зависимости от уровня организации наследственных структур различают генные, хромосомные и геномные мутации, а в зависимости от типа клеток - гаметические и соматические.
Наследственные болезни в строгом смысле слова подразделяют на генные и хромосомные. Генные болезни - это болезни, вызываемые генными мутациями. Хромосомные болезни определяются хромосомными и геномными мутациями.
Деление наследственных болезней на эти две группы неформальное. Генные мутации передаются из поколения в поколение в соответствии с законами Менделя, а большинство хромосомных болезней, обусловленных анеуплоидиями, вообще не наследуется (летальный эффект с генетической точки зрения), структурные перестройки (инверсии, транслокации) передаются с дополнительными перекомбинациями, возникающими в мейозе носителя перестройки.
Болезни с наследственной предрасположенностью могут быть моногенными и полигенными. Для их реализации недостаточно соответствующей генетической конституции индивида, нужен еще фак-
тор или комплекс факторов среды, запускающих формирование мутантного фенотипа (или болезни). С помощью средового фактора реализуется наследственная предрасположенность.
Генетические болезни соматических клеток выделены в самостоятельную группу наследственной патологии недавно. Поводом к этому послужило обнаружение при злокачественных новообразованиях специфических хромосомных перестроек в клетках, вызывающих активацию онкогенов (ретинобластома, опухоль Вильмса). Эти изменения в генетическом материале клеток являются этиологическими и/или патогенетическими для злокачественного роста, поэтому их можно отнести к категории генетической патологии. Имеются уже первые доказательства того, что спорадические случаи врожденных пороков развития являются результатом мутации в соматических клетках в критическом периоде эмбриогенеза. Следовательно, такие случаи можно рассматривать как генетическую болезнь соматических клеток.
Весьма вероятно, что аутоиммунные процессы и старение будут отнесены к этой же категории генетической патологии.
Болезни, возникающие при несовместимости матери и плода по антигенам (Аг), развиваются в результате иммунной реакции матерей на Аг плода. Небольшое количество крови плода попадает в организм беременной. Если плод унаследовал от отца такой аллель Аг (Аг+), которого нет у матери (Аг-), то организм беременной отвечает иммунной реакцией. Антитела матери, проникая в кровь плода, вызывают у него иммунный конфликт. Наиболее типичное и хорошо изученное заболевание этой группы - гемолитическая болезнь новорожденных, возникающая в результате несовместимости матери и плода по резус-Аг. Болезнь возникает тогда, когда мать имеет Rh-- отрицательную группу крови, а плод унаследовал Rh+-аллель от отца.
Иммунные конфликты развиваются и при несовместимых комбинациях по Аг группы АВ0 у беременной и плода.
В целом такая несовместимость составляет значительную часть патологии (в некоторых популяциях у 1% новорожденных) и довольно часто встречается в практике акушера-гинеколога и в медико-генетических консультациях.
Клиническая классификация наследственных болезней
Клиническая классификация наследственных болезней ничем не отличается от классификации наследственных болезней по орган-
ному, системному принципу или по типу обмена веществ, поэтому она очень условна. Наследственные болезни едины по этиологическому принципу (мутации), и основу их классификации составляет прежде всего системный и органный принцип: нервные, нервно-мышечные, психические, болезни опорно-двигательного аппарата, кожи, зубочелюстной системы, крови и др. Естественно, такой подход неоднозначен. Например, нейрофиброматоз (доминантная мутация) встречается и в нейрохирургических клиниках (у больных развиваются опухоли мозга), и в дерматологических клиниках, поскольку у этих больных первоначально появляются светло-коричневые обширные пятна и нейрофиброматозные узелки на коже, и в клиниках нервных болезней в связи с глубокими нейрофибромами. Больные с хореей Гентингтона являются пациентами и невропатолога, и психиатра, больные с гепатолентикулярной дегенерацией - терапевта и невропатолога. При очень немногих наследственных болезнях избирательно поражается одна система. Даже моногенно детерминируемые болезни вследствие плейотропного действия гена и вторичных патогенетических звеньев затрагивают разные органы и системы. Большинство генных мутаций, а тем более хромосомные и геномные, вызывают генерализованное повреждение какой-либо ткани (например, болезни соединительной ткани) или захватывают несколько органов. В связи с этим многие наследственные болезни проявляются в виде синдромов или комплекса патологических признаков, на первый взгляд, не связанных между собой.
Классификация наследственных болезней, выражающихся в нарушении обмена веществ, проведена по типу повреждения первичного звена обмена. Такая биохимическая классификация как бы объединяет генетический и физиологический (клинический) подходы. По такому принципу различают наследственные болезни обмена углеводов, липидов, аминокислот, витаминов, пуринов и пиримидинов, биосинтеза гормонов и т.д.
Генетические основы гомеостаза
Болезнь - одно из проявлений приспособительных реакций на действие повреждающих факторов окружающей среды. Поскольку каждый человек с генетической точки зрения строго индивидуален и неповторим, то и реакции каждого человека специфичны. То,
что является благоприятным фактором для одного, может быть резко патогенным для другого индивида.
По мере развития медицины и проникновения биологической науки в глубинные механизмы «построения» и жизнедеятельности человека будут полнее распознаваться и условия, при которых происходит гармоничное развитие человека, сохраняется и укрепляется его здоровье или, наоборот, возникают нарушения функций и болезнь.
Гомеостаз как способность организма сохранять равновесие своей внутренней среды в условиях постоянно изменяющейся окружающей среды всегда основан на норме реакции, под которой понимают размах колебаний реакций организма на внешние воздействия без патологических отклонений. Эти реакции обусловлены врожденными характеристиками организма, которые обеспечивают ему возможность вариаций любых признаков или параметров (физиологических, морфологических, биохимических, иммунологических) в допустимых пределах без неблагоприятных последствий. Не вызывает сомнений изначальная наследственная обусловленность и индивидуальных, и видовых признаков организма.
Наследственная информация, реализующаяся в индивидуальном развитии организма через биосинтез РНК и белков, обеспечивает формирование признаков и свойств организма не как стабильных, инвариантных по отношению к изменяющейся среде, а как способных к определенной вариабельности. Размах этой вариабельности, его нижние и верхние границы строго индивидуальны. Таким образом, норма реакции генетически обусловлена и формируется в процессе онтогенеза как один из элементов фенотипа в целом. В эволюционном формировании как самой нормы реакции, так и ее генотипической обусловленности естественный отбор закрепил гибкие и варьирующие реакции организма на внешние воздействия или, другими словами, закрепил норму реакции. Следовательно, с позиции генетики гомеостаз - генетически обусловленный компонент фенотипа.
На рис. 2.4 представлено взаимодействие факторов среды и генетически детерминированных норм реакций в обеспечении здоровья или развития болезни.
Здоровье поддерживается при условии сохранения гомеостаза всех компонентов внутренней среды организма на основе нормы реакции. Нарушение гомеостаза (дисгомеостаз) проявляется в виде болезни. Причинами дисгомеостаза могут быть либо усиленные воздействия факторов среды, либо ограниченные возможности врожденной нормы реакции организма.
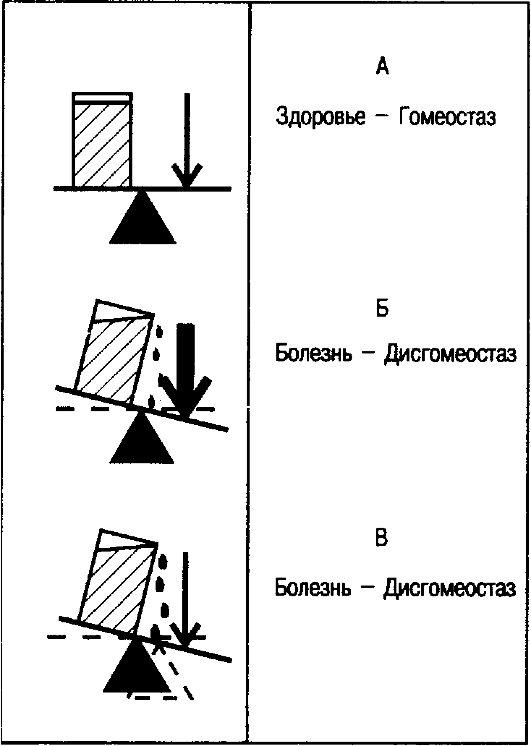 Рис. 2.4. Здоровье как гомеостаз (по Ч. Скрайверу, модифицировано).
Рис. 2.4. Здоровье как гомеостаз (по Ч. Скрайверу, модифицировано).
а - здоровье поддерживается на основе генетически детерминированной нормы реакции, обеспечивающей гомеостаз при умеренном воздействии факторов среды (гомеостаз); б - болезнь, обусловленная усиленным действием факторов среды, которые выходят за пределы возможной нормы реакции (дисгомеостаз); в - болезнь, обусловленная генетически уменьшенной нормой реакции, при которой дисгомеостаз возникает при умеренных воздействиях факторов среды.
Основу надежности генотипа составляют дублированность его структурных элементов, матричный принцип биосинтеза, способность к репарации, регуляция генной активности.
В эволюционном развитии живого появление диплоидных организмов обеспечило пересортировку и рекомбинацию генетического материала при образовании каждой новой половой клетки и при оплодотворении, что увеличивает размах генетической вариабельности. Существование всех генетических локусов в двойном количестве повышает надежность генетической детерминации признаков.
Стабильность генотипа обеспечивается не только дублированностью генетических элементов. Постоянство генотипа заложено в матричном принципе биосинтеза ДНК (репликация) и РНК (транскрипция). Этот принцип обеспечивается двумя замечательными особенностями молекулы ДНК: двуспиральностью молекулярной структуры и способностью каждой из полинуклеотидных нитейспиралей служить матрицей
для синтеза новой нуклеотидной нити, которая комплементарна исходной нити и поэтому полностью соответствует ей. В процессе репликации самой ДНК обеспечивается точное воспроизведение генетической информации в ряду последовательных актов синтеза ДНК и последующих клеточных делений. В процессе транскрип-
ции матричный синтез гарантирует точную, неискаженную трансформацию закодированной в ДНК генетической информации через нуклеотидные последовательности РНК в первичную аминокислотную последовательность молекул специфических белков.
Эволюция снабдила клетки разносторонними механизмами устранения (или репарации) повреждений генетических структур (ДНК и хромосом). В организме не может быть ничего абсолютно стабильного, в том числе не может быть абсолютно устойчивым генетический аппарат клеток. Первичная структура ДНК может изменяться при репликации ДНК, хотя и с малой частотой. Эти события известны как «ошибки репликации». ДНК повреждается гораздо больше от воздействия мутагенов окружающей среды или мутагенов, возникающих в организме.
К настоящему времени открыто несколько механизмов, с помощью которых устраняются те или иные повреждения ДНК. В их основе лежат ферментативные процессы.
Гомеостаз внутренней среды организма должен обеспечиваться, помимо только что изложенных фундаментальных механизмов, надежностью генетического контроля генной активности. Механизмы такого контроля на молекулярном и надмолекулярном уровнях пока не раскрыты. Однако кажется несомненным, что такой контроль удивительно помехоустойчив.
Хотя еще не полностью выяснено, какими генетическими механизмами обеспечивается постоянство внутренней среды организма (фенотипический уровень), можно предположить молекулярно-генетические и биохимические цепочки событий от гена до признака. В ряде примеров можно расчленить физиологические механизмы гомеостатической реакции на составляющие.
В общей форме можно говорить о двух видах генетической детерминации гомеостаза. Один из них - контроль элементарных проявлений гомеостаза (выделение гормона, синтез фермента и т.д.), другой - системные проявления. Разумеется, границы между элементарными и системными проявлениями гомеостаза условны. Чем больше расшифровывается цепочек генетической детерминации элементарных проявлений гомеостаза, чем глубже познаются звенья каждой из них, тем полнее и предметнее становятся наши представления о генетике и физиологии гомеостаза в целом. В качестве примера генетической обусловленности элементарной гомеостатической реакции можно привести генетический контроль свертываемости крови.
Генетический анализ системных проявлений гомеостаза представляет трудную задачу. Эти проявления интегральны, их невозможно
свести к сумме элементарных реакций, за которыми стоят конкретные цепочки: ген → его первичный продукт →метаболические превращения продукта. На более высоком системно-органном уровне вступают в действие физиологические механизмы регуляции функций. Однако и в этом случае глубинную основу таких регуляций составляют унаследованные нормы реакций.
Ключевые слова и понятия
Болезни с наследственной предрасположенностью Врожденные болезни Генетическая классификация болезней Генетическая несовместимость матери и плода Генетическая обусловленность гомеостаза Генетические болезни соматических клеток Генетические маркеры
Генетические основы хронических болезней Клиническая классификация наследственных болезней Менделирующие болезни и признаки Моногенные болезни Наследственность и выздоровление Наследственность и исходы болезней Наследственные болезни Норма реакции
Причины клинического полиморфизма болезней
Роль наследственности в патогенезе
Семейные болезни
Спорадический случай
Унаследованные болезни
Хромосомные болезни
Эволюция генотипа человека
Элементы стабильности генотипа
Этиология наследственных болезней
Контрольные вопросы
1. Врожденные заболевания - это:
а) заболевания, обусловленные мутацией генов;
б) заболевания, проявляющиеся на 1-м году жизни ребенка;
в) заболевания, проявляющиеся при рождении;
г) заболевания, не поддающиеся лечению.
2. Выберите верное утверждение:
а) механизмы естественного отбора у человека и животных не различаются;
б) в процессе эволюционного развития человеческой популяции происходило накопление патологических мутаций, что привело к большему количеству нозологических форм у человека по сравнению с животными;
в) в процессе эволюции организмов выработались механизмы защиты ДНК от мутационных изменений.
3. Генетическая гетерогенность клинически схожих заболеваний обусловлена:
а) разными аллелями одного гена;
б) мутациями в разных локусах;
в) взаимодействием генетической конституции и среды.
4. Спорадический случай наследственной болезни - это:
а) пациент с наследственной болезнью, впервые обратившийся за медицинской помощью;
б) первый случай аутосомно-доминантной или хромосомной болезни в родословной;
в) единственный случай данной наследственной болезни в родословной;
г) пациент с наследственной болезнью, имеющий здоровых родителей.
5. При ненаследственных болезнях генетические факторы не влияют на:
а) этиологию;
б) сроки выздоровления;
в) исход заболевания;
г) эффективность лечения.
6. К генетическим болезням соматических клеток относятся:
а) болезни, не передающиеся по наследству;
б) злокачественные новообразования;
в) сахарный диабет;
г) некоторые спорадические случаи врожденных пороков развития;
д) психические заболевания.
7. Хромосомные болезни обусловлены:
а) генными мутациями;
б) хромосомными мутациями;
в) геномными мутациями;
г) изменениями межгенных участков структуры ДНК;
д) изменением числа и структуры хромосом.
8. Балансированный полиморфизм - это существование в популяции двух или более форм аллелей одного гена, при этом частота редкого аллеля составляет не менее:
а) 10%;
б) 5%;
в) 1%;
г) 0,1%.
9. Проявления клинического полиморфизма этиологически единой формы за-
болевания выражаются:
а) различным временем манифестации;
б) различной тяжестью течения;
в) вариантами ответов на терапию;
г) числом больных родственников.
10. К эффектам мутационного груза относятся:
а) акселерация;
б) летальность;
в) сниженная фертильность;
г) повышение приспособляемости на популяционном уровне;
д) снижение продолжительности жизни.
11. Выберите верное утверждение:
а) фенотипические проявления небольших по протяженности мутаций более специфичны, чем проявления крупных мутаций;
б) клинический полиморфизм обусловлен только генетическими и средовыми, но не межгенными взаимодействиями;
в) около 90% всех спонтанных абортов связано с генетическими нарушениями у эмбриона;
г) клинический полиморфизм болезней с наследственной предрасположенностью больше, чем моногенных заболеваний.
12. Возможные последствия изменений нуклеотидной последовательности ДНК:
а) изменение аминокислотной структуры белка;
б) изменение функции белка;
в) синтез белка - продукта другого гена;
г) изменение регуляции синтеза белка;
д) отсутствие изменения функции белка.
13. Стабильность генотипа обеспечивается:
а) системой репарации ДНК;
б) дублированностью структурных элементов генотипа;
в) полуконсервативным характером редупликации ДНК;
г) матричным принципом биосинтеза;
д) адаптацией организма к факторам внешней среды.
14. Наследственные болезни человека появились:
а) в связи с уменьшением инфекционной заболеваемости;
б) в связи с улучшением условий жизни и медицинской помощи;
в) в процессе эволюционного формирования человека как биологического вида;
г) в процессе социального формирования человеческого общества.