Клиническая генетика: Учебник. - 3-е изд., испр. и доп. -Н.П. Бочков, 2004. - 480 с.: ил.
|
|
|
|
ГЛАВА 10. ПРОФИЛАКТИКА НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
Груз наследственной патологии в медицинском и социальном аспектах
Каждая семья мечтает иметь здоровых детей. Это становится особенно актуальным после рождения больного ребенка. Уменьшение числа детей в семьях в развитых странах делает чрезвычайно важным оптимальный исход каждой беременности. В этом смысле профилактика наследственных болезней должна занимать ведущее место как в работе врача, так и в системе здравоохранения.
Известно, что вся наследственная патология определяется грузом мутаций, вновь возникающих и унаследованных из предыдущих поколений. Эффекты мутационного процесса для популяций человека выражаются в эволюционно-генетическом, медицинском и социальном аспектах. Эволюционно-генетические последствия мутационного процесса (балансированный полиморфизм, летальность) рассмотрены в главе 1.
Медицинские последствия мутационного груза - это повышенная потребность в медицинской помощи и сниженная продолжительность жизни больных.
Медицинскую помощь лицам с наследственными болезнями в поликлинических условиях оказывают в 5-6 раз чаще, чем людям без такой патологии. В детских больницах общего профиля от 10 до 20% пациентов составляют дети с наследственной патологией, что в 5-10 раз выше частоты таких больных в популяции. Более частое обращение к врачу людей с наследственной патологией вполне понятно, так же как и более длительная их госпитализация. Во-первых, сама болезнь требует большого объема медицинской помощи, а иногда и постоянного лечения. Во-вторых, наследственная болезнь не исключает ожог, травму, инфекционные заболевания. Напротив, они возникают чаще, протекают тяжелее и длительнее в связи с меньшими возможностями поддержания биохимического, иммунного и гормонального гомеостаза у больных с наследственной патологией.
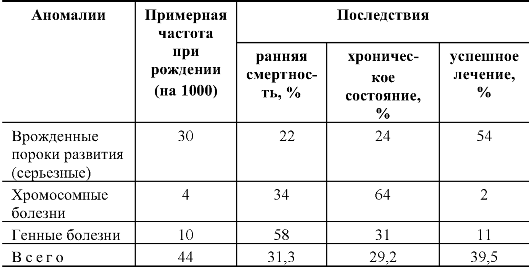
В обобщенной форме медицинские последствия врожденных пороков развития и наследственных болезней представлены в табл. 10.1.
Таблица 10.1. Последствия врожденных аномалий различных типов в развитых странах (по материалам ВОЗ)
 У
детей с врожденными пороками развития в основном применяют
хирургические методы; при хромосомных болезнях - социальную поддержку,
при генных болезнях - лечение и социальную поддержку.
У
детей с врожденными пороками развития в основном применяют
хирургические методы; при хромосомных болезнях - социальную поддержку,
при генных болезнях - лечение и социальную поддержку.
Продолжительность жизни больных с наследственной патологией зависит не только от самой болезни, но и от уровня медицинской помощи. Хотя точные расчеты еще не сделаны, для стран с хорошо развитой системой здравоохранения можно с большой уверенностью полагать, что не менее 50% всех пациентов с наследственными болезнями умирают в детском возрасте. В Канаде проведена комплексная оценка ожидаемой продолжительности жизни для всех больных с наследственной патологией (с разным возрастом начала болезней и разной их тяжестью). Она оказалась на 20 лет меньше средней по стране (50 лет вместо 70).
О социальной и медицинской значимости профилактики наследственных болезней говорят высокий уровень инвалидности больных и экономические затраты на их содержание. В течение многих лет такие больные остаются инвалидами, которые не могут себя обслуживать. В домах-интернатах для детей-инвалидов средние расходы на 1 ребенка в месяц равны среднемесячной зарплате по стране. Такие дети в интернатах живут в среднем до
10 лет. Из 1 млн новорожденных примерно 5000 кандидатов на многолетнюю тяжелую инвалидность с детства.
Наряду с медицинской и социальной значимостью профилактики наследственных болезней не менее важны психологические аспекты в семье с больным ребенком. Тяжесть и прогредиентность течения болезни создают, как показывают наблюдения, психологическую напряженность даже в очень дружных семьях. Супруги или родственники выясняют (или подозревают), кто виноват в рождении больного ребенка. Члены семьи имеют разное мнение о передаче ребенка в интернат (отказе от ребенка), особенно если он жил с родителями. Постоянный уход за больным ребенком требует больших материальных затрат, моральных и физических сил, что так или иначе вызывает конфликты. К тревоге за больного ребенка присоединяется страх за возможную болезнь у других детей.
Хотя наследственные болезни, с обывательской точки зрения, встречаются редко, жизнь конкретной семьи концентрируется на больном ребенке.
Наконец, необходимость профилактики наследственных болезней диктуется и популяционными закономерностями их распространения. При улучшении медицинской помощи больные будут не только дольше жить, что автоматически повышает число больных с наследственной патологией в популяции, но и передавать мутации следующим поколениям. Например, за последние 100 лет в Англии повысилась частота мутантного гена, обусловливающего врожденный стеноз привратника. Операция по рассечению мышцы привратника превратила эту аномалию из смертного приговора в рубец на брюшной стенке. Носители мутантного гена (после операции они уже не являются больными в строгом смысле) оставляют потомство, часть которого также имеет мутантный ген, а в популяции дополнительно возникают новые случаи заболевания в результате мутационного процесса.
В связи с планируемым размером семьи (как правило, 1-3 ребенка) разница в числе детей у здоровых и наследственно отягощенных супругов во многом нивелируется (репродуктивная компенсация). Естественный отбор перестает регулировать численность потомства. В наследственно отягощенных семьях бывает больше беременностей (понятно, что часть беременностей заканчивается гибелью потомства на любой стадии внутриутробного развития), но число живых детей такое же, как и в неотягощенных семьях. Часть таких детей являются гетерозиготами, в результате искусственно поддерживается повышенный уровень репродукции мутантных аллелей.
Генетические основы профилактики наследственной патологии
Общие положения
С профилактической точки зрения всю наследственную патологию целесообразно подразделить на 3 категории: вновь возникающие мутации (в первую очередь это анеуплоидии и тяжелые формы доминантных мутаций); унаследованные от предыдущих поколений (как генные, так и хромосомные); болезни с наследственной предрасположенностью.
Различают 3 вида профилактики наследственной патологии.
Первичная профилактика
Под первичной профилактикой понимают действия, которые должны предупредить зачатие больного ребенка; это планирование деторождения и улучшение среды обитания человека.
Планирование деторождения включает 3 основные позиции:
- оптимальный репродуктивный возраст, который для женщин составляет 21-35 лет (более ранние или поздние беременности увеличивают вероятность рождения ребенка с врожденной патологией и хромосомными болезнями) (см. рис. 5.28);
- отказ от деторождения в случаях высокого риска наследственной и врожденной патологии (при отсутствии надежных методов дородовой диагностики, лечения, адаптации и реабилитации больных);
- отказ от деторождения в браках с кровными родственниками и между двумя гетерозиготными носителями патологического гена.
Улучшение среды обитания человека должно быть направлено главным образом на предупреждение вновь возникающих мутаций путем жесткого контроля содержания мутагенов и тератогенов в окружающей среде. Это особенно важно для профилактики всей группы соматических генетических болезней (врожденные пороки развития, злокачественные новообразования, иммунодефициты и т.п.).
Вторичная профилактика
Вторичная профилактика состоит в прерывании беременности
при высокой вероятности заболевания плода или пренатально диагностированной болезни. Прервать беременность можно только в установленные сроки и с согласия женщины. Основанием для элиминации эмбриона или плода является наследственная болезнь.
Прерывание беременности - не самое лучшее решение, но пока это единственный практически пригодный метод при большинстве тяжелых и смертельных генетических дефектов.
Третичная профилактика
Под третичной профилактикой наследственной патологии понимают коррекцию проявления патологических генотипов. Это можно назвать и нормокопированием, поскольку при патологическом генотипе стремятся получить нормальный фенотип.
Третичная профилактика проводится как при наследственных болезнях, так и (особенно часто) при болезнях с наследственной предрасположенностью. С ее помощью можно добиться полной нормализации функций или снижения выраженности патологического процесса. Для некоторых форм наследственной патологии она может совпадать с лечебными мероприятиями в общемедицинском смысле.
Предотвратить развитие наследственного заболевания (нормокопирование) можно внутриутробно или после рождения.
Для некоторых наследственных заболеваний возможно внутриутробное лечение (например, при резус-несовместимости, некоторых ацидуриях, галактоземии).
Развитие заболевания в настоящее время можно предотвратить путем коррекции (лечения) после рождения больного. Типичными примерами третичной профилактики могут быть галактоземия, фенилкетонурия, гипотиреоз (см. ниже) и др. Например, целиакия проявляется с началом прикорма ребенка манной кашей. В основе болезни лежит аллергия на злаковый белок глютен. Исключение глютена из пищи полностью гарантирует избавление от тяжелейшей патологии ЖКТ.
Профилактика наследственных болезней и болезней с наследственной предрасположенностью должна включать несколько этапов и проводиться на популяционном уровне. Современные представле-
ния о наследственной патологии и методические возможности позволяют осуществлять профилактику на разных уровнях онтогенеза. Их характеристики и целевые установки представлены в табл. 10.2.
Таблица 10.2. Характеристика основных типов популяционно-генетических профилактических программ
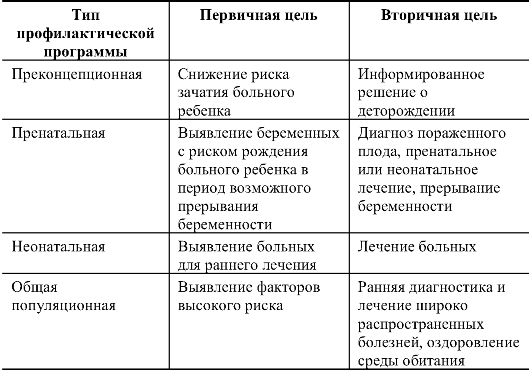 Как
видно из табл. 10.2, мероприятия по профилактике можно проводить до
зачатия и заканчивать общепопуляционным обследованием. При этом
желательно использовать одновременно два принципиально разных подхода:
семейный и популяционный. В табл. 10.3 представлены разрешающие
возможности и описание этих подходов для основных групп болезней.
Как
видно из табл. 10.2, мероприятия по профилактике можно проводить до
зачатия и заканчивать общепопуляционным обследованием. При этом
желательно использовать одновременно два принципиально разных подхода:
семейный и популяционный. В табл. 10.3 представлены разрешающие
возможности и описание этих подходов для основных групп болезней.
Современной основой профилактики наследственной патологии являются теоретические разработки в области молекулярной природы наследственных болезней, механизмов и процессов их развития в пре- и постнатальном периодах, закономерностей сохранения мутаций (а иногда и распространения) в семьях и популяциях, а также изучение процессов возникновения и становления мутаций в зародышевых и соматических клетках.
В генетическом плане можно выделить 5 подходов к профилактике наследственной патологии, которые рассмотрены ниже.
Таблица 10.3. Распознаваемость патологических плодов на основе семейного и популяционного просеивания
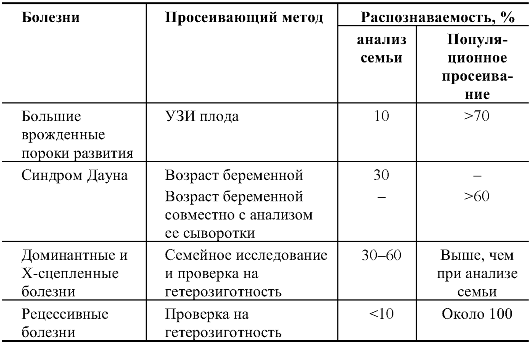 Управление экспрессией генов
Управление экспрессией генов
В середине 20-х годов XX века в экспериментах были обнаружены явления пенетрантности и экспрессивности, которые вскоре стали предметом изучения медицинской генетики. Выше отмечалось, что Н.К. Кольцов сформулировал понятие «евфеника», под которым он понимал формирование хороших качеств или исправление болезненных проявлений наследственности у человека путем создания соответствующих условий (лекарства, диета, воспитание и др.). Эти идеи стали реализовываться только в 60-х годах XX века, когда накопились сведения о первичных продуктах патологического гена и молекулярных механизмах патогенеза наследственных болезней. Зная механизмы действия патологических генов, можно разрабатывать методы их фенотипической коррекции, другими словами, управлять пенетрантностью и экспрессивностью.
По мере прогресса науки накапливаются сведения о методах профилактики наследственной патологии на разных стадиях онтогенеза - о лечебных или диетических воздействиях. Клиническим
примером управления экспрессией генов, уже прошедшим длительную проверку практикой, является предупреждение последствий фенилкетонурии, галактоземии и врожденного гипотиреоза. Клиническая картина этих болезней формируется в раннем постнатальном периоде, в связи с чем принцип третичной профилактики сравнительно простой. Болезнь должна быть диагностирована в течение нескольких дней после рождения, чтобы сразу применить профилактическое лечение, предупреждающее развитие патологического фенотипа (клинической картины). Нормокопирование может достигаться диетическими (при фенилкетонурии, галактоземии) или лекарственными (при гипотиреозе) методами.
Коррекция проявления патологических генов может начинаться с эмбриональной стадии развития. Закладываются основы так называемой преконцепционной и пренатальной профилактики наследственных болезней (в течение нескольких месяцев до зачатия и до родов). Так, например, гипофенилаланиновая диета для матери во время беременности уменьшает проявления фенилкетонурии в постнатальном периоде у ребенка. Отмечено, что врожденные аномалии нервной трубки (полигенный характер наследования) реже встречаются у детей женщин, получающих достаточное количество витаминов. Дальнейшая проверка показала, что если провести лечение женщин в течение 3-6 мес до зачатия и на протяжении первых месяцев беременности гипервитаминной (витамины С, Е, фолиевая кислота) диетой, то вероятность развития у ребенка аномалий нервной трубки существенно уменьшается. Это важно для семей, в которых уже есть больные дети, а также для популяций с высокой частотой патологических генов (например, по врожденным аномалиям нервной трубки - население Ирландии).
В перспективе могут быть разработаны новые методы внутриутробной коррекции патологического проявления генов, что особенно важно для семей, в которых по религиозным соображениям неприемлемо прерывание беременности.
В табл. 10.4 приведены примеры врожденных аномалий, для которых уже разработаны методы внутриутробного лечения.
Опыт пренатальной терапии плодов женского пола с дефицитом 21-гидроксилазы может служить отправной точкой для разработки методов лечения других наследственных болезней. Лечение проводится по следующему плану.
Беременным, имеющим риск рождения ребенка с врожденной гиперплазией коры надпочечников, до 10-й недели беременности назначают дексаметазон (20 мкг/кг) независимо от состояния и
пола плода. Дексаметазон подавляет секрецию андрогенов эмбриональными надпочечниками. Одновременно необходимо провести пренатальную диагностику пола плода и ДНК-диагностику мутаций в гене (путем либо биопсии хориона, либо амниоцентеза). Если обнаруживается, что плод мужского пола или что плод женского пола не поражен, то пренатальную терапию прекращают, а если у плода женского пола находят мутации в гомозиготном состоянии, то лечение продолжают до родов.
Таблица 10.4. Примеры внутриутробного лечения врожденных болезней
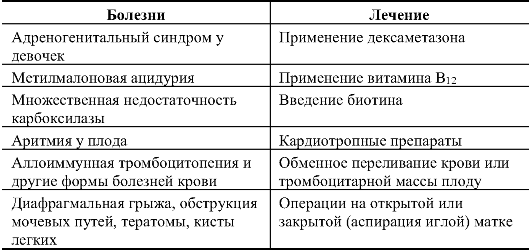 Пренатальное
лечение низкими дозами дексаметазона вряд ли дает побочные эффекты. При
наблюдении за детьми до 10-летнего возраста не обнаружено никаких
отклонений. У женщин, получающих дексаметазон, наблюдаются небольшие
побочные эффекты (колебания настроения, прибавка массы тела, повышение
артериального давления, общий дискомфорт), но они согласны переносить
эти неудобства ради здоровья дочерей. Положительные результаты лечения
женских плодов с дефицитом 21-гидроксилазы существенно перевешивают
отрицательные моменты.
Пренатальное
лечение низкими дозами дексаметазона вряд ли дает побочные эффекты. При
наблюдении за детьми до 10-летнего возраста не обнаружено никаких
отклонений. У женщин, получающих дексаметазон, наблюдаются небольшие
побочные эффекты (колебания настроения, прибавка массы тела, повышение
артериального давления, общий дискомфорт), но они согласны переносить
эти неудобства ради здоровья дочерей. Положительные результаты лечения
женских плодов с дефицитом 21-гидроксилазы существенно перевешивают
отрицательные моменты.
Третичная профилактика на основе управления экспрессией генов особенно важна и эффективна для предупреждения болезней с наследственной предрасположенностью. Исключение из среды факторов, способствующих развитию патологического фенотипа, а иногда и обусловливающих его, - прямой путь к профилактике таких болезней.
Профилактике поддаются все моногенные формы наследственной предрасположенности. Это исключение из среды обитания про-
являющих факторов, в первую очередь фармакологических средств у носителей недостаточности глюкозо-6-фосфатдегидрогеназы, аномальной псевдохолинэстеразы, мутантной ацетилтрансферазы. Это первичная (врожденная) непереносимость лекарств, а не приобретенная лекарственная болезнь.
Для работы в производственных условиях, провоцирующих болезненные состояния у лиц с мутантными аллелями (например, контакты со свинцом, пестицидами, окислителями), необходимо проводить отбор рабочих в соответствии с установленными принципами.
Хотя профилактика мультифакториальных состояний более сложная, поскольку они вызываются взаимодействием нескольких факторов среды и полигенных комплексов, все же при правильном семейном анализе можно добиться заметного замедления развития болезни и уменьшения ее клинических проявлений в результате исключения действия проявляющих средовых факторов. На этом принципе основана профилактика гипертонической болезни, атеросклероза, рака легких.
Элиминация эмбрионов и плодов с наследственной патологией
Механизмы элиминации нежизнеспособных эмбрионов и плодов отрабатывались эволюционно. У человека это спонтанные аборты и преждевременные роды. Конечно, не все они происходят по причине неполноценности эмбриона или плода; часть из них связана с условиями вынашивания, т.е. с состоянием женского организма. Однако определенно не менее чем в 50% случаев прерванных беременностей у плодов имеются либо врожденные пороки развития, либо наследственные болезни.
Таким образом, элиминация эмбрионов и плодов с наследственной патологией заменяет спонтанный аборт как природное явление. Методы пренатальной диагностики быстро развиваются, поэтому этот профилактический подход получает все большее значение. Установление диагноза наследственного заболевания у плода служит показанием для прерывания беременности.
Процедура пренатальной диагностики и особенно прерывание беременности должны проводиться с согласия женщины. Как указывалось выше, в некоторых семьях по религиозным соображениям беременность не может быть прервана.
Естественный отбор у человека в течение внутриутробного периода позволил американскому эмбриологу Дж. Уоркани в 1978 г. сформулировать концепцию тератаназии. Под термином «тератаназия» понимается естественный процесс просеивания (или отсеивания) плодов с врожденной патологией. Тератаназия может осуществляться путем создания непереносимых условий для плода с патологией, хотя такие условия вполне приемлемы для нормального плода. Эти факторы как бы выявляют патологическое состояние и одновременно вызывают гибель плода. Некоторые экспериментальные доказательства в пользу такой точки зрения уже имеются. Научные разработки могут быть направлены на поиск методов индуцированной селективной гибели плода с патологическим генотипом. Методы должны быть физиологичными для матери и абсолютно безопасными для нормального плода.
Генная инженерия на уровне зародышевых клеток
Профилактика наследственных болезней может быть наиболее полной и эффективной, если в зиготу будет встроен ген, по функции заменяющий мутантный ген. Устранение причины наследственной болезни (а именно это и есть наиболее фундаментальный аспект профилактики) означает достаточно серьезное маневрирование с генетической информацией в зиготе. Это могут быть введение нормального аллеля в геном путем трансфекции, обратная мутация патологического аллеля, включение нормального гена в работу, если он блокирован, выключение мутантного гена. Сложности этих задач очевидны, но интенсивные экспериментальные разработки в области генной инженерии свидетельствуют о принципиальной возможности их решения. Генно-инженерная профилактика наследственных болезней стала уже не утопией, а перспективой, хотя и неблизкой.
Предпосылки для коррекции генов человека в зародышевых клетках уже созданы. Их можно обобщить в виде следующих положений:
1. Первичная расшифровка генома человека завершена, особенно на уровне секвенирования нормальных и патологических аллелей. Можно надеяться, что для большинства наследственных болезней мутации будут секвенированы в ближайшие годы. Интенсивно развивается функциональная геномика, благодаря которой будут известны межгенные взаимодействия.
2. Любые гены человека нетрудно получать в чистом виде на основе химического или биологического синтеза. Интересно, что ген глобина человека был одним из первых искусственно полученных генов.
3. Разработаны методы включения генов в геном человека с разными векторами или в чистом виде путем трансфекции.
4. Методы направленного химического мутагенеза позволяют индуцировать специфические мутации в строго определенном локусе (получение обратных мутаций - от патологического аллеля к нормальному).
5. В экспериментах на разных животных получены доказательства трансфекции отдельных генов на стадии зигот (дрозофила, мышь, коза, свинья и др.). Введенные гены функционируют в организме-реципиенте и передаются по наследству, хотя и не всегда по законам Менделя. Например, ген гормона роста крыс, введенный в геном зигот мышей, функционирует у родившихся мышей. Такие трансгенные мыши значительно больше по размерам и массе тела, чем обычные.
Генно-инженерная профилактика наследственных болезней на уровне зигот разработана пока слабо, хотя выбор способов синтеза генов и способов их доставки в клетки уже достаточно широк. Решение вопросов трансгеноза у человека сегодня упирается не только в генно-инженерные трудности, но и в этические проблемы. Ведь речь идет о композиции новых геномов, которые создаются не эволюцией, а человеком. Эти геномы вольются в генофонд человечества. Какова будет их судьба с генетической и социальной точек зрения, будут ли они функционировать как нормальные геномы, готово ли общество принять на себя последствия неудачных исходов? Сегодня ответить на эти вопросы трудно, а без ответа на них нельзя начинать клинические испытания, поскольку произойдет безвозвратное вмешательство в геном человека. Без объективной оценки эволюционных последствий генной инженерии нельзя применять эти методы у человека (даже с медицинскими целями на стадии зигот). Генетика человека еще далека от полного понимания всех особенностей функционирования генома. Неясно, как геном будет работать после введения в него дополнительной генетической информации, как он будет вести себя после мейоза, редукции числа хромосом, в сочетании с новой зародышевой клеткой и т.п.
Все сказанное выше дало основание специалистам в области биомедицинской этики на международном уровне (ВОЗ, ЮНЕСКО,
Совет Европы) временно воздержаться от проведения экспериментов, а тем более от клинических испытаний с трансгенозом зародышевых клеток.
Планирование семьи
При высоком (более 20%) риске рождения больного ребенка и отсутствии возможностей пренатальной диагностики рекомендуется отказ от деторождения. Понятно, что такая рекомендация должна быть дана после квалифицированной медико-генетической консультации, когда нет методов пренатальной диагностики или для семьи по различным соображениям неприемлемо прерывание беременности.
Как известно, кровнородственные браки повышают вероятность рождения ребенка с наследственной болезнью. Отказ от кровнородственных браков или ограничение деторождения в них может рассматриваться как метод профилактики наследственной патологии. Об этом говорят следующие факты.
Кровнородственные браки на уровне двоюродных сибсов предпочитает не менее 20% населения всего мира. По меньшей мере 8,4% детей рождаются от родителей-родственников. Этот обычай распространен в Восточном Средиземноморье и Южной Индии, а также среди многих популяций, ведущих племенной образ жизни на протяжении тысячелетий.
В США, Канаде, России, большинстве европейских стран, в Австралии, Новой Зеландии частота кровнородственных браков менее 1%, в среднеазиатских республиках, Японии, Северной Индии, южноамериканских странах - 1-10%, в странах Северной Африки, Среднего Востока, Южной Индии - от 10 до 50%.
Обычай кровнородственных браков в прошлом поддерживал женщину и семью. Однако это отражается на частоте рождения детей с рецессивными болезнями. Для родителей-неродственников общий риск мертворождений, младенческой и детской смертности или серьезных врожденных пороков развития равен примерно 2,5%, риск некоторой степени умственного недоразвития составляет еще 3%. Суммарно эти риски примерно удваиваются для супружеских пар - двоюродных сибсов. Если младенческая смертность в регионе высокая, то этот эффект мало заметен, а если она низкая, то эффект кровного родства в виде врожденных
пороков развития и хронических инвалидизирующих заболеваний становится явным.
В популяциях с высокой частотой какой-либо болезни, в которых проводится диагностика носительства, возможен отказ от браков гетерозиготных носителей.
Для женщин после 30-35 лет повышается вероятность рождения ребенка с хромосомной болезнью (см. главу 5), для мужчин - вероятность рождения ребенка с некоторыми генными болезнями
(табл. 10.5).
Таблица 10.5. Средний возраст отцов к моменту рождения детей с аутосомно-доминантными заболеваниями (спорадические случаи)
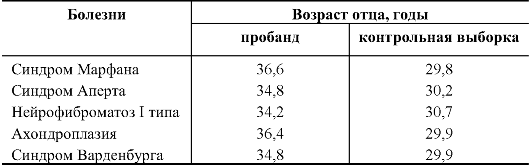 Разница
в возрасте отцов пробандов и отцов в контрольной выборке составляет в
среднем 5 лет. Причины этого явления неясны, но для профилактики
наследственных болезней его надо принимать во внимание.
Разница
в возрасте отцов пробандов и отцов в контрольной выборке составляет в
среднем 5 лет. Причины этого явления неясны, но для профилактики
наследственных болезней его надо принимать во внимание.
Таким образом, окончание деторождения до 30-35 лет является одним из факторов профилактики наследственных болезней. При планировании рождения 2-3 детей такого периода вполне достаточно для большинства семей.
Охрана окружающей среды
Наследственная изменчивость человека постоянно пополняется новыми мутациями. Вновь возникающие спонтанные мутации определяют в целом до 20% всей наследственной патологии. Для некоторых тяжелых доминантных форм новые мутации являются причиной 90% наследственных болезней и более. Наследственные болезни, обусловленные вновь возникшими мутациями, фактически нельзя предсказать. Это случайные события, редкие для каждого гена.
Пока нет предпосылок вмешиваться в процесс спонтанного мутагенеза у человека, хотя интенсивные исследования антимутагенеза и антитератогенеза могут привести к созданию новых методов профилактики наследственных болезней и врожденных пороков развития.
Наряду со спонтанным мутагенезом у человека возможен индуцированный мутагенез (радиационный, химический, биологический). Универсальный характер индуцированного мутагенеза на всех уровнях организации наследственности для всех живых существ не вызывает сомнений. Естественно, что индуцированный мутагенез может служить дополнительным источником наследственных болезней. С точки зрения профилактики наследственных болезней он должен быть полностью исключен.
Необходимо подчеркнуть, что индуцированный мутационный процесс опасен в плане не столько индивидуального прогноза, сколько популяционного. Отсюда вытекает, что исключение мутагенных факторов из среды обитания человека является методом популяционной профилактики наследственных болезней.
Методы проверки внешних факторов на мутагенность разработаны, их можно ввести в гигиенические регламентации при охране окружающей среды. Этот вопрос очень важен, потому что мутагенные эффекты факторов окружающей среды проявляются не в экспонированной популяции, а в потомстве в нескольких поколениях.
К охране среды обитания человека относится также исключение из нее факторов, вызывающих экогенетические патологические реакции. Например, для лиц с пигментной ксеродермой (гомозигот) надо исключить контакт с ультрафиолетовыми лучами, для лиц с недостаточностью ингибитора протеаз - с пылью, для носителей мутации порфиринового гена - с барбитуратами и т.д.
Медико-генетическое консультирование
Общие положения
Медико-генетическое консультирование - специализированный вид медицинской помощи - является наиболее распространенным методом профилактики наследственных болезней.
Его суть заключается в определении прогноза рождения ребенка с наследственной патологией на основе уточненного диагноза,
объяснении вероятности этого события консультирующимся и помощи семье в принятии решения о дальнейшем деторождении.
Еще в конце 20-х годов С.Н. Давиденков впервые в мире организовал медико-генетическую консультацию при Институте нервно-психиатрической профилактики. Он четко сформулировал задачи и методы медико-генетического консультирования. Однако развитие данной области профилактики и генетики человека в целом затормозилось в 30-х годах практически во всех развитых странах. Это было связано с тем, что в нацистской Германии для обоснования геноцида использовали генетические концепции и ввели насильственную стерилизацию как метод «оздоровления расы». Евгеническая стерилизация широко проводилась в США, Дании, Швеции и других странах. Во многом в связи с евгеникой, а также по политическим соображениям в Москве был закрыт Медико-генетический институт (1936).
Хотя в США медико-генетические консультации (кабинеты) начали организовываться уже в 40-х годах, действительно интенсивное развитие такой помощи в разных странах (в том числе в России и Германии) началось в 60-70-х годах. К этому времени произошел большой прорыв в изучении хромосомной патологии и наследственных болезней обмена веществ.
Термин «медико-генетическая консультация» определяет два понятия: врачебное заключение врача-генетика и специализированное учреждение здравоохранения (как самостоятельное, так и в составе объединения).
Показания для медико-генетического консультирования:
- установленная или подозреваемая наследственная болезнь в семье в широком смысле слова:
• рождение ребенка с врожденным пороком развития;
• задержка физического развития или умственная отсталость у ребенка;
• повторные спонтанные аборты, выкидыши, мертворождения;
• выявление патологии в ходе просеивающих врограмм;
- близкородственные браки;
- воздействие или известных, или возможных тератогенов в первые 3 мес беременности;
- неблагополучное протекание беременности.
В принципе каждой супружеской паре желательно пройти медико-генетическое консультирование до планирования деторождения (проспективно) и, безусловно, необходимо после рождения больного ребенка (ретроспективно).
Функции врача-генетика
Врач-генетик выполняет две основные функции. Во-первых, он с помощью других узких специалистов устанавливает диагноз, используя при дифференциальной диагностике специальные генетические методы; во-вторых, он определяет прогноз здоровья будущего (или уже родившегося) потомства. Перед врачом всегда возникают врачебные, генетические и деонтологические проблемы; на разных этапах консультирования преобладают то одни, то другие.
Медико-генетическая консультация включает 4 этапа: диагностику, прогнозирование, заключение, совет. Общение врача-генетика с семьей больного должно быть доверительным и доброжелательным.
Диагностика. Консультирование всегда начинается с уточнения диагноза наследственной болезни, поскольку точный диагноз остается необходимой предпосылкой любой консультации. Прежде чем направить пациента в медико-генетическую консультацию, лечащий врач должен с помощью доступных ему методов максимально уточнить диагноз и определить цель консультации. Если необходимо дополнительно применять генеалогический, цитогенетический, биохимические и другие специальные генетические методы (например, определить сцепление генов или использовать молекулярно-генетические методы и т.п.), то пациента направляют на медико-генетическую консультацию и врач-генетик помогает лечащему врачу в установлении диагноза. При этом может возникнуть необходимость направления пациента или его родственников на дополнительное обследование. Со своей стороны врач-генетик может поставить перед другими специалистами (невропатологом, эндокринологом, ортопедом, офтальмологом и др.) конкретную задачу - распознать симптомы предполагаемой наследственной болезни у пациента или его родственников. Сам врач-генетик не может иметь столь универсальных знаний, чтобы в полном объеме обеспечить клиническую диагностику нескольких тысяч наследственных болезней.
На первом этапе консультирования перед врачом-генетиком возникает много сугубо генетических задач (генетическая гетерогенность болезни, унаследованная или вновь возникшая мутация, средовая или генетическая обусловленность данного врожденного заболевания и т.д.), к решению которых он подготавливается в процессе специализации.
Диагноз уточняют в медико-генетической консультации с помощью генетического анализа. С этой целью врач-генетик пользу-
ется клинико-генеалогическим, цитогенетическим и молекулярно-генетическими методами, а также анализом сцепления генов, методами генетики соматических клеток. Из негенетических методов широко используются биохимические, иммунологические и другие параклинические методы, которые помогают установить точный диагноз.
Клинико-генеалогический метод при условии тщательного сбора родословной дает определенную информацию для установления диагноза наследственной болезни. Клинико-генеалогический метод позволяет описать впервые встретившуюся, новую форму заболевания. Если в родословной четко прослеживается тип наследования, то консультирование возможно даже при неустановленном диагнозе (особенности использования клинико-генеалогического метода и его разрешающие возможности рассмотрены выше). В медико-генетической консультации указанный метод применяется во всех случаях без исключения.
Цитогенетическое исследование, как свидетельствует опыт работы многих консультаций, применяется не менее чем в 10% консультаций. Это обусловлено необходимостью прогноза для потомства при установленном диагнозе хромосомной болезни и потребностью в уточнении диагноза в неясных случаях при врожденных пороках развития. С такими проблемами часто встречаются в практике консультирования. Обследуют, как правило, не только пробандов, но и родителей.
Биохимические, иммунологические и другие параклинические методы не являются специфичными для генетической консультации, но применяются так же широко, как и при диагностике ненаследственных болезней. При наследственных болезнях часто применяют одни и те же тесты не только у пациента, но и у других членов семьи (составление биохимической или иммунологической «родословной»).
В процессе генетического консультирования часто возникает потребность в дополнительном параклиническом обследовании. В таких случаях больного или его родственников направляют в соответствующие специализированные учреждения.
В конечном счете в медико-генетической консультации диагноз уточняется путем генетического анализа всех полученных сведений, в том числе (если это необходимо) данных о сцеплении генов или результатов исследования культивированных клеток. Врач-генетик должен быть высококвалифицированным специалистом в области медицинской генетики.
Прогноз для потомства. После уточнения диагноза определяют прогноз для потомства. Врач-генетик формулирует генетическую задачу, решение которой основывается либо на теоретических расчетах с использованием методов генетического анализа и вариационной статистики, либо на эмпирических данных (таблицы эмпирического риска). Ясно, что обычная подготовка врача общей практики не позволяет квалифицированно сделать такой прогноз. Ошибка врача при неправильном прогнозе для семьи может быть роковой: повторно родится тяжелобольной ребенок либо семья неправомерно откажется от деторождения.
Если применяется пренатальная диагностика, не требуется решения генетической задачи. В таких случаях не прогнозируется рождение ребенка с болезнью, а диагностируется заболевание у плода.
Заключение медико-генетического консультирования и советы родителям
Заключение медико-генетического консультирования и советы родителям можно объединить. Заключение врача-генетика обязательно должно быть письменным, потому что члены семьи могут возвратиться к обдумыванию ситуации. Наряду с этим необходимо устно в доступной форме объяснить смысл генетического риска и помочь семье принять решение.
Заключительные этапы консультирования требуют самого пристального внимания. Как бы ни совершенствовались методы расчета риска (эмпирического или теоретического), как бы полно ни внедрялись достижения медицинской генетики в работу консультаций, консультирование будет неэффективным, если пациенты неправильно поймут объяснение врача-генетика. Помогает и контакт с семейным врачом, которому супруги доверяют, поэтому очень важна согласованность действий семейного (лечащего) врача и врача-генетика. Например, даже при установленном в пренатальном периоде диагнозе у плода не все женщины принимают решение о прерывании беременности. При тяжелых хромосомных болезнях (трисомии 13, 18, 21) прерывают беременность 83% женщин, при пороках нервной трубки - 76%, при синдроме Тернера - 70%, при других формах хромосомных аномалий - 30%.
Для достижения цели консультирования при беседе с пациентами следует учитывать уровень их образования, социально-экономичес-
кое положение семьи, структуру личности и взаимоотношения супругов. Многие пациенты не подготовлены к восприятию информации о наследственных болезнях и генетических закономерностях. Одни склонны чувствовать вину за случившееся несчастье и страдают от комплекса неполноценности, другие вполне серьезно доверяют рассказам знакомых, третьи приходят в консультацию с нереальными запросами или ожиданиями, в связи с тем что были неправильно осведомлены о возможностях генетической консультации (в том числе иногда лечащими врачами). Необходимо иметь в виду, что почти все консультирующиеся супруги хотят иметь ребенка (иначе бы они не обратились за консультацией). Это значительно повышает профессиональную ответственность и лечащего врача, и врача-генетика. Каждое неточное слово может интерпретироваться в том направлении, в котором настроены супруги. Если супруги сильно опасаются иметь больного ребенка и хотят родить здорового, то каждая неосторожная фраза врача об опасности усиливает страх, хотя на самом деле риск может быть небольшим. Наоборот, желание иметь ребенка бывает настолько сильным, что даже при большом риске супруги принимают решение о деторождении, потому что врач сказал о некоторой вероятности рождения здорового ребенка.
Изложение сведений о риске должно быть индивидуально приспособлено к каждому случаю. В одних случаях следует говорить о 25% шансов иметь больного ребенка, в других - о 75% вероятности рождения здорового ребенка. Однако всегда нужно убедить пациентов в случайном распределении наследственных факторов, чтобы устранить чувство вины за рождение больного ребенка. Иногда это чувство бывает очень сильным.
На медико-генетическую консультацию целесообразно направлять супругов не раньше чем через 3-6 мес после установления диагноза наследственной болезни, так как в этот период происходит адаптация к ситуации в семье, а раньше какая-либо информация о будущих детях воспринимается плохо.
Тактика врача-генетика в помощи пациентам в принятии решения окончательно не определена. Безусловно, она зависит от конкретной ситуации. Хотя решение принимают сами пациенты, в принятии решения семьей роль врача может быть активной или сводиться только к объяснению смысла риска. По нашему мнению, врач-генетик и лечащий врач (особенно семейный) должны помогать советом в принятии решения, так как при существующем уровне знаний в области генетики у населения консультирующимся трудно самостоятельно принять адекватное решение.
Медицинские задачи консультирования решаются легче, чем социально-этические проблемы. Например, не вызывает сомнения, что чем тяжелее наследственная болезнь, тем настоятельнее врач должен рекомендовать отказаться от деторождения. Однако при одной и той же болезни, при одной и той же вероятности рождения больного ребенка разная обстановка в семье (обеспеченность, взаимоотношения супругов и др.) требует различных подходов к объяснению риска. В любом случае принятие решения о деторождении остается за семьей.
Организационные вопросы
При организации медико-генетических консультаций как структурных подразделений нужно опираться на сложившуюся в стране систему здравоохранения и учитывать степень развития медицины в целом, в том числе уровень знаний генетики у врачей. Консультации функционируют как звено существующей системы медицинской помощи населению.
В большинстве зарубежных стран с развитым здравоохранением система консультирования является 3-х ступенчатой: в простых случаях прогноз для потомства определяется семейным врачом; более сложные случаи попадают к врачу-генетику, работающему в крупном медицинском центре; консультирование в сложных генетических ситуациях осуществляется в специальных генетических консультациях. Для реализации этой в целом эффективной системы необходимо, чтобы каждый семейный или лечащий врач хорошо понимал клиническую генетику, а организация медицинской помощи населению должна быть адекватной.
Медико-генетические консультации как структурные подразделения лечебно-профилактических учреждений могут быть как общепрофильными, так и специализированными.
Пробанды, обращающиеся в консультацию общего профиля по нозологическому принципу, имеют самую различную патологию. Поскольку работа по уточнению диагноза в консультации занимает большое место, разнообразный профиль заболеваний пробандов заставляет обследовать и пробандов, и родственников. В связи с этим генетические консультации целесообразно создавать на базе крупных многопрофильных лечебно-профилактических учреждений республиканского или областного подчинения. Больной и его
родственники в этом случае могут получить консультацию у специалистов и при необходимости госпитализироваться. Кроме того, консультация должна иметь возможность направлять на специализированное (томография, исследование гормонального профиля и др.) обследование в другие учреждения, если больница, на базе которой функционирует консультация, не располагает такими возможностями. Тесный контакт с другими отделениями и их правильная соподчиненность являются важным принципом работы медико-генетической консультации общего профиля.
Специализированные медико-генетические консультации могут быть организованы при крупных специализированных больницах, в которых врач-генетик приобретает опыт консультирования по наследственным болезням одного профиля. В трудных случаях консультации общего профиля могут направлять больных в специализированную консультацию.
Две консультации - общего профиля и специализированные - могут функционировать параллельно, но независимо.
В штат консультации общего профиля должны входить врачи-генетики, цитогенетики и биохимики-генетики. Врач-генетик, ведущий прием населения, должен иметь всестороннюю генетическую подготовку, так как ему приходится решать самые разнообразные генетические задачи. Объектом исследования врача-генетика является семья, а пробанд - лишь отправное лицо в этом исследовании. Любая консультация требует сбора сведений о родственниках, а иногда и их обследования. Заключение врача-генетика о повторном риске заболевания предназначается непосредственно семье, обратившейся за помощью, поэтому смысл заключения надо разъяснять в доступной форме (нередко нескольким членам семьи). Все это занимает гораздо больше времени, чем прием больного любым другим специалистом. На первичный осмотр пробанда и его родителей, а также на сбор семейного анамнеза требуется от 1 до 1,5 ч. Повторная консультация (письменное заключение, объяснение в доступной форме, помощь в принятии решения) занимает в среднем 30 мин. Таким образом, один врач-генетик в течение рабочего дня может принять не более 5 семей.
Из всех специальных исследований наибольшая потребность возникает в цитогенетических анализах (в среднем 1 исследование на 1 семью). Большая потребность в применении цитогенетического метода обусловлена направлением на медико-генетическую консультацию прежде всего пациентов с хромосомной патологией, врожденными пороками развития и акушерской патологией. При этом, как правило, обследуются не 1 человек, а 2 или 3.
Потребность в биохимических исследованиях составляет около 10% числа обратившихся в консультацию. Это довольно высокая цифра. Однако при большом разнообразии наследственных болезней обмена веществ повторное применение одних и тех же биохимических методов в консультации бывает очень редко. В крупных городах целесообразно создавать специализированные биохимические лаборатории с широкими методическими возможностями для обследования больных с разнообразными нарушениями обмена веществ.
В медико-генетической консультации проводится просеивающая диагностика (такие методы приспособлены для широкой практики) без уточняющего этапа, о котором сказано выше.
Таким образом, генетическая консультация как структурное подразделение представляет собой звено поликлинической службы, состоящее из кабинета врача-генетика, процедурной (взятие крови) и лаборатории для проведения цитогенетических и просеивающих биохимических исследований. Клинические, параклинические, молекулярно-генетические, биохимические, иммунологические и другие исследования проводят в специализированных лабораториях и лечебно-профилактических учреждениях, к которым прикреплена консультация. Такие консультации в больницах не исключают организации высокоспециализированных медикогенетических центров со всеми необходимыми подразделениями.
Анализ обращаемости в медико-генетическую консультацию
До сих пор только незначительное число семей (вряд ли более 10%), которым требуется совет врача-генетика, обращается за такой специализированной помощью. При этом более 50% направленных на консультацию лиц имеют неправильные показания для ее проведения. Это несоответствие связано с недостаточным уровнем медико-генетических знаний у врачей и населения и с недостаточным пониманием организаторами здравоохранения значения медико-генетического консультирования как метода профилактики наследственных болезней.
Поскольку основным проводником идеи медико-генетического консультирования является врач общей практики, от его знаний и понимания задач консультаций зависит направление на такую консультацию. Осведомленность населения по вопросам наследствен-
ных болезней также влияет на обращаемость в медико-генетическую консультацию. Однако обоснованность обращений целиком зависит от компетентности врача.
Соотношение пациентов, направленных врачами и самостоятельно обратившихся в консультацию, сильно колеблется. В разных консультациях доля самостоятельно обратившихся составляет от 10 до 80%. Это зависит от того, на кого (на врачей или на население) была направлена пропаганда, которая в значительной мере определяет и обоснованность обращений, т.е. точный диагноз и правильные показания для проведения консультации.
Распределение обратившихся в консультацию по группам заболеваний должно соответствовать относительной частоте таких болезней в популяциях человека. Однако анализ обращаемости по нозологическому принципу в консультациях разных стран показывает отклонения от теоретически ожидаемого распределения.
Чаще всего в консультации обращаются семьи, имеющие детей с хромосомными болезнями, врожденными пороками развития и нервно-психическими заболеваниями.
Социальная характеристика пациентов в разных консультациях однотипна. Большинство пациентов имеют высшее образование и хорошо обеспечены. Мотивами для обращения в консультацию являются желание иметь здорового ребенка (около 90% опрошенных) и желание вылечить больного ребенка (около 10% случаев). В 50% семей отмечаются конфликтные взаимоотношения супругов.
Эффективность медико-генетических консультаций
Целью генетического консультирования в общепопуляционном смысле является снижение груза патологической наследственности, а цель отдельной консультации - это помощь семье в принятии правильного решения по вопросам планирования семьи, лечения и прогноза здоровья больного. Следовательно, критерием эффективности медико-генетического консультирования в широком смысле служит изменение частоты патологических генов, а результатом работы отдельной консультации - изменение поведения супругов, обращающихся в консультацию по вопросам деторождения.
При широком внедрении медико-генетического консультирования могут быть достигнуты некоторое уменьшение частоты наследственных болезней, а также снижение смертности (особенно детской). Расчеты показывают, что из каждых 100 проконсультированных семей в 3-5 не рождаются больные дети (без консультации они бы родились), несмотря на то что 25-30% проконсультированных не следуют совету врача-генетика. Если бы лечащие (или семейные) врачи помогли супругам следовать таким рекомендациям, то эффективность медико-генетического консультирования была бы еще выше.
Популяционные эффекты медико-генетического консультирования выражаются в изменении частоты патологических аллелей. Этот показатель изменится мало, потому что основной вклад в частоту генов в популяциях вносят гетерозиготные носители, а их частота в результате консультирования практически не изменится. Если консультируемые будут следовать советам врача-генетика, то уменьшится только число гомозиготных носителей. Снижение частоты тяжелых доминантных болезней в популяциях в результате медико-генетического консультирования не будет существенным, потому что 80-90% из них являются результатом новых мутаций.
Кабинеты медико-генетического консультирования должны быть организованы во всех областных и крупных городских больницах. Стабильности в этом виде помощи в нашей стране пока нет из-за тяжелого экономического положения здравоохранения. Объем медико-генетического консультирования, безусловно, зависит от уровня медицинской помощи в стране.
При развитом здравоохранении реальные потребности в медико-генетическом консультировании достаточно большие. Например, всем семьям, где родились дети с врожденной и наследственной патологией (их около 5%), требуется медико-генетическая помощь. Следовательно, в России при расчетном числе 1 700 000 родов в год таких семей будет 70 000. В медико-генетическом консультировании нуждаются женщины старше 35 лет, решившие родить ребенка. В год в России рожает более 70 000 женщин старше 35 лет. Другие расчеты консультаций по поводу ранних форм сердечно-сосудистых заболеваний, рака, нервных, психических и других болезней показывают, что каждая 5-10-я семья нуждается в общем или специализированном медико-генетическом консультировании.
Пренатальная диагностика
Общие вопросы
Выше отмечалось, что элиминация эмбрионов и плодов является одним из методов первичной профилактики наследственных болезней. Естественно, что прерывание беременности с целью предупреждения этих болезней у потомства возможно только при условии пренатальной диагностики в положенные сроки (до 22 нед беременности).
Пренатальная диагностика наследственных болезней - это комплексная быстро развивающаяся область медицины, использующая и УЗИ, и оперативную технику (хорионбиопсия, амнио- и кордоцентез, биопсия мышц и кожи плода), и лабораторные методы (цитогенетические, биохимические, молекулярно-генетические). Забота семьи о здоровье будущего ребенка (а иногда и необоснованная обеспокоенность) требует не только оценки генетических и средовых факторов риска исхода беременности (медико-генетическая консультация), но и использование методов пренатальной диагностики.
При организации и развитии системы пренатальной диагностики должны выполняться следующие условия:
1. Врачи, определяя показания к пренатальной диагностике, должны знать вероятность ложноположительных и ложноотрицательных диагнозов, или, другими словами, ограничения метода.
2. Пренатальная диагностика должна включать два этапа. Первый этап - выявление и отбор женщин (точнее, семей) с повышенным риском неблагополучного в генетическом плане исхода беременности при медико-генетическом консультировании или первичном обследовании беременных, в том числе с использованием методов просеивающей диагностики. Второй этап - уточняющая пренатальная диагностика. Любые методы уточняющей диагностики (инвазивные или неинвазивные, лабораторные, дорогостоящие, трудоемкие) применяют только у женщин с факторами риска.
3. Специалисты по пренатальной диагностике (акушер-гинеколог, врач-генетик, врач лаборант-генетик) должны знать диагностические ограничения метода не вообще, а конкретно в их лаборатории (ультразвуковая техника, возможность взятия образцов тканей и клеток плода и др.). Нужно учитывать, что соответствующая лабораторная диагностика может быть недоступной или ограниченной.
4. Специалисты должны строго соблюдать стандарты определения показаний и выполнения процедур и лабораторных анализов, осуществлять текущий контроль качества работы, а также иметь статистику исходов беременностей и расхождений диагнозов (контроль после абортов или после рождения).
Важность соблюдения всех перечисленных условий связана не только с медицинскими, но и с деонтологическими соображениями: все эти вопросы обостряются в семье в ожидании ребенка.
Методы пренатальной диагностики можно разделить на просеивающие, неинвазивные и инвазивные (с последующей лабораторной диагностикой). Для каждого метода есть показания и противопоказания, разрешающие возможности и осложнения. Выбор метода и вся тактика пренатальной диагностики должны быть строго индивидуализированы в соответствии с конкретной ситуацией в семье и с состоянием беременной.
Просеивающие методы
Такие методы позволяют выделить женщин, имеющих повышенный риск рождения ребенка с наследственной или врожденной болезнью. Методы должны быть доступными для широкого применения и недорогими.
Безусловно, медико-генетическое консультирование семей просеивает их на предмет пренатальной диагностики. Оптимальным вариантом просеивания с целью профилактики наследственной патологии путем пренатальной диагностики было бы медико-генетическое консультирование с проведением генеалогического анализа всех семей, планирующих деторождение. В этом случае, по-видимому, около 10% женщин нуждались бы в более глубоком обследовании. При медикогенетическом консультировании на пренатальную диагностику направляют женщин по следующим показаниям: возраст 35 лет и старше (мужчин 45 лет и старше), наличие в семье или в популяции пренатально выявляемой наследственной болезни, неблагоприятный акушерский анамнез (повторные спонтанные прерывания беременности или рождение ребенка с врожденными пороками развития), сахарный диабет, эпилепсия, инфекции у беременной, лекарственная терапия, контакты с тератогенными факторами.
К просеивающим лабораторным методам, определяющим необходимость пренатальной диагностики, относятся:
• Определение в сыворотке крови беременной веществ, получивших название сывороточных маркеров матери: 1) концентрации α-фетопротеина (АФП); 2) уровня хорионического гонадотропина человека (ХГЧ); 3) уровня несвязанного эстриола, 4) ассоциированного с беременностью плазменного белка А (РААР-А - Pregnancy Associated Plasma Protein A), 5) выделение клеток или ДНК плода из организма матери. АФП вырабатывает печень эмбриона и плода. Этот белок проникает в кровь беременной через плодные оболочки и плаценту. Его содержание меняется в течение беременности. В каждой лаборатории должны быть установлены нормы в медианном выражении содержания белка для каждой недели беременности, потому что концентрации АФП колеблются у представительниц разных рас и в различных географических зонах, причем распределение концентраций не подчиняется закону нормального распределения. Отклонение от среднего (нормального) уровня показателя (обозначается в единицах МОМ - multiples of median) оценивается по отношению величины содержания АФП в крови конкретной женщины к усредненной величине (медиане) содержания данного белка у многих женщин при том же сроке нормальной беременности. Этот метод позволяет заподозрить врожденные дефекты нервной трубки и брюшной стенки. При такой патологии концентрация АФП в сыворотке крови беременной существенно выше, чем в норме (рис. 10.1).
Поскольку в некоторых популяциях аномалии развития нервной трубки встречаются в несколько раз чаще, чем в среднем, в таких популяциях необходимо определять концентрацию АФП у всех беременных. Показанием к данному исследованию является также отягощенная родословная, т.е. наличие в ней больного с аномалией нервной трубки в пределах III степени родства по обеим линиям супругов.
Концентрация АФП снижена в крови женщин, вынашивающих плод с болезнью Дауна (рис. 10.2).
Механизм этой ассоциации неясен, но ее существование не вызывает сомнений. Такое обследование беременных позволяет выявить до 20% случаев болезни Дауна.
Медицинских противопоказаний для определения концентрации АФП нет. Женщину с измененным уровнем АФП направляют на дополнительное обследование. Если концентрация белка повышена, то для уточнения диагноза аномалии нервной трубки проводят УЗИ и определяют концентрацию АФП в амниотичес-
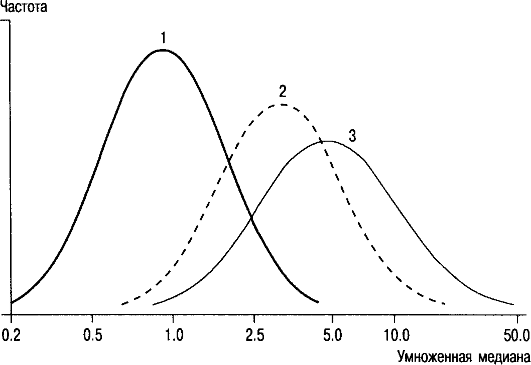 Рис. 10.1. Концентрация
(по оси абсцисс) АФП в сыворотке крови беременной при вынашивании
нормального плода и плода с врожденным дефектом нервной трубки.
Рис. 10.1. Концентрация
(по оси абсцисс) АФП в сыворотке крови беременной при вынашивании
нормального плода и плода с врожденным дефектом нервной трубки.
1 - непораженные; 2 - открытая spina bifida; 3 - анэнцефалия.
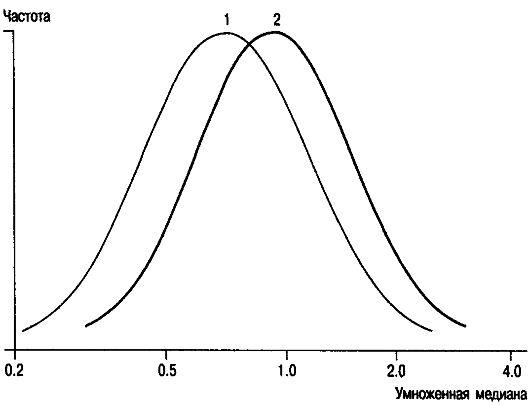 Рис. 10.2. Концентрация (по оси абсцисс) АФП в сыворотке крови беременной при вынашивании плода с синдромом Дауна.
Рис. 10.2. Концентрация (по оси абсцисс) АФП в сыворотке крови беременной при вынашивании плода с синдромом Дауна.
1 - синдром Дауна; 2 - непораженные.
кой жидкости. Если концентрация белка понижена, то назначают цитогенетическое исследование клеток (амниоцитов или лимфоцитов) плода.
Повысить эффективность просеивающей диагностики болезни Дауна путем анализа АФП позволяет определение уровня ХГЧ в сыворотке крови будущей матери. В норме содержание ХГЧ уменьшается до низких цифр после I триместра беременности. У 68% женщин, вьшашивающих плод с хромосомной болезнью, этот показатель остается повышенным до родов. Медиана концентрации ХГЧ при синдроме Дауна повышена в 2 раза и более (рис. 10.3). Ложноположительные результаты получают редко.
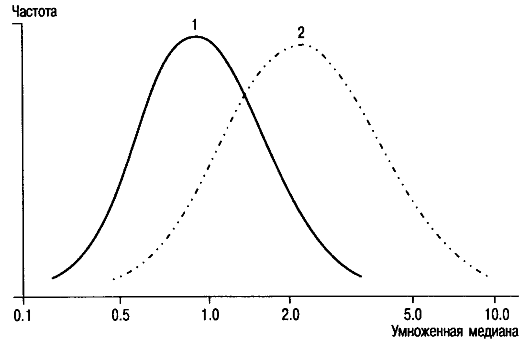 Рис. 10.3. Концентрация (по оси абсцисс) ХГЧ в сыворотке крови беременной при вынашивании плода с синдромом Дауна.
Рис. 10.3. Концентрация (по оси абсцисс) ХГЧ в сыворотке крови беременной при вынашивании плода с синдромом Дауна.
1 - непораженные; 2 - синдром Дауна.
Введение в просеивающую программу определения содержания неконъюгированного эстриола в сыворотке крови беременной еще более расширяет диагностические возможности метода, правда, при этом существенно увеличивается относительное число ложноположительных ответов. Уровень этого гормона значительно ниже при вынашивании плода с болезнью Дауна (рис. 10.4).
Наибольшие диагностические возможности предоставляет комбинация трех описанных указанных тестов (рис. 10.5).
В последние годы активно обсуждается возможность использования и некоторых других сывороточных маркеров матери (на-
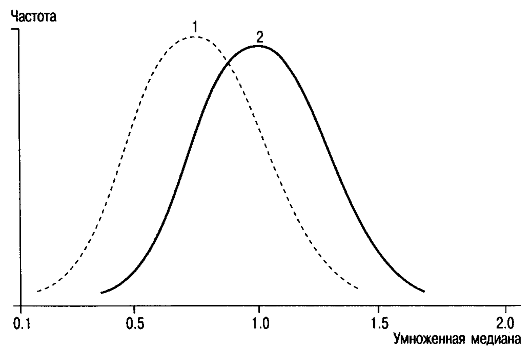 Рис. 10.4. Концентрация (по оси абсцисс) неконъюгированного эстриола в сыворотке крови беременной при вынашивании плода с синдромом Дауна.
Рис. 10.4. Концентрация (по оси абсцисс) неконъюгированного эстриола в сыворотке крови беременной при вынашивании плода с синдромом Дауна.
1 - синдром Дауна; 2 - непораженные.
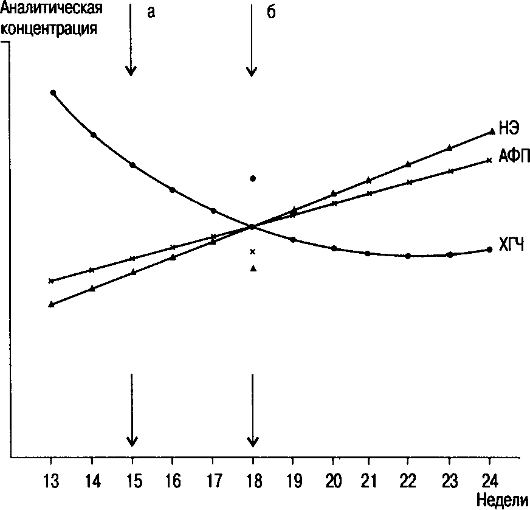 Рис. 10.5. Комбинация результатов просеивающей биохимической диагностики врожденных аномалий нервной трубки и синдрома Дауна.
Рис. 10.5. Комбинация результатов просеивающей биохимической диагностики врожденных аномалий нервной трубки и синдрома Дауна.
По ее абсцисс - срок беременности; по оси ординат - аналитическая концентрация.
а - низкий риск; б - высокий риск. НЭ - неконъюгированный эстриол.
пример, РАРР-А), изменение которых также тесно коррелирует с трисомиями у плода уже в I триместре.
Компьютерные программы позволяют сопоставлять результаты и использовать полученные показатели с достаточной степенью достоверности.
Во время беременности в кровотоке беременной постоянно обнаруживаются конгломераты клеток плодного происхождения. Эти клетки можно выделить из крови (для этого берут 8-10 мл венозной крови) и использовать для пренатальной диагностики. Известен метод, позволяющий осуществлять пренатальную диагностику (в частности, определение пола плода) по крови женщины с высокой степенью точности и воспроизводимости. Для этого производится предварительное обогащение крови матери плодными клетками с помощью флюоресцентно-активируемой клеточной сортировки (FACS). Клеточная сортировка обычно осуществляется с активацией флюоресценции на нескольких длинах волн. Анализ материала после сортировки проводится с применением методов ПЦР или FISH. Установлен значительный разброс в количестве плодных клеток, циркулирующих в крови женщин. Оказалось, что на 1 клетку плода может приходиться от нескольких тысяч до сотен тысяч и даже миллионов материнских клеток. Это объясняет предшествующие неудачи при попытках неинвазивного определения пола цитогенетическими методами.
Хотя возможность достоверного неинвазивного пренатального определения патологии или пола плода по периферической крови посредством предварительного обогащения клеток с помощью FACS сомнению не подвергается, применение этого метода не выходит за пределы научных исследований по причине дороговизны. Для применения в клинике делаются попытки изменить способ предварительного обогащения плодных клеток, например, посредством применения магнитно-активируемой клеточной сортировки (MACS), а также попытки разработать хорошо воспроизводимые методы, позволяющие вообще отказаться от предварительного обогащения плодного материала.
Помимо попыток выявления плодного материала в кровотоке беременной, разрабатывают воспроизводимые методы диагностики по клеткам плода, которые, как предполагается, могут обнаруживаться в цервикальном канале женщины. Материалом для подобного анализа служат мазки, аспираты, смывы. Несмотря на обнадеживающие результаты, возможность подобной диагностики остается предметом дискуссий.
Неинвазивные методы
Это методы обследования плода без оперативного вмешательства. В настоящее время к ним относится фактически только УЗИ. Радиоили рентгенография применялась 20-30 лет назад (да и то не очень широко) на начальных этапах пренатальной диагностики. В последние годы постепенно становится возможным применение с целью визуализации плода МРТ. Несмотря на высокую разрешающую способность, ценность метода значительно снижается из-за небольшой скорости формирования изображения (секунды и десятки секунд), что вследствие подвижности плода может приводить к неверным результатам. УЗИ позволяет выявить как врожденные пороки развития, так и функциональное состояние плода, плаценты, пуповины, оболочек. Сроки проведения УЗИ в России определены приказом Министерства здравоохранения. Это 10-13, 20-22 и 30-32-я недели беременности. УЗИ можно также использовать для выявления задержки роста эмбриона или плода, начиная с 6-8-й недели беременности.
УЗИ можно применять и как просеивающий, и как уточняющий метод. В некоторых странах УЗИ проводят всем беременным. Это позволяет предупредить рождение 2-3-х детей с серьезными врожденными пороками развития на 1000 новорожденных, что составляет примерно 30% всех детей с такой патологией. Для проведения детального повторного УЗИ как уточняющей диагностической процедуры можно выделить следующие показания:
- выявление отклонений (маркеров патологии) или пороков развития плода в ходе просеивающего УЗИ;
- несоответствие размеров плода сроку беременности;
- рождение предыдущего ребенка с врожденными пороками развития;
- болезни у женщины (сахарный диабет, эпилепсия, алкоголизм и др.), повышающие риск рождения ребенка с врожденными пороками развития;
- воздействие тератогенного фактора (радиация, химические вещества, инфекции) в первые 10 нед беременности;
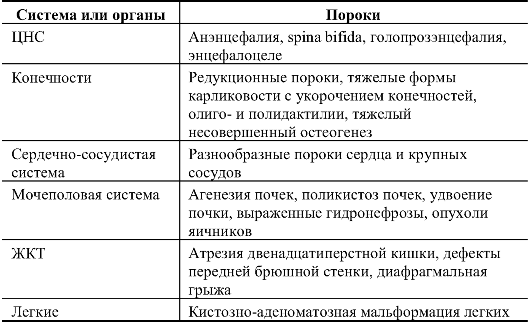
- врожденные пороки развития у кого-либо из супругов (или у родственников I-III степени родства по линиям обоих супругов). Краткий перечень врожденных пороков развития, диагностируемых с помощью УЗИ приблизительно в 80-90% случаев, представлен в табл. 10.6. Диапазон пороков, распознаваемых с помощью этого метода, достаточно широк. Этими сведениями должен владеть каждый врач.
Таблица 10.6. Врожденные пороки развития, диагностируемые с помощью УЗИ
 Инвазивные методы
Инвазивные методы
Первоначально к инвазивным методам относилась только фетоскопия, проводимая с помощью волоконной или стеклянной оптики. Теперь инвазивными методами получают клетки и ткани эмбриона, плода и провизорных органов в любом периоде гестации. Разработка методов взятия материала стимулировалась появлением более совершенных методов лабораторной диагностики наследственных болезней. Инвазивные методы совершенствуются в нескольких направлениях: более раннее получение образцов для исследования, более широкий спектр образцов, более безопасные для беременной и плода методы взятия образцов.
К настоящему времени в мировой практике имеется достаточный опыт (сотни тысяч обследованных) по применению хорион- и плацентобиопсии, получению амниотической жидкости (амниоцентез), биопсии тканей плода, взятию крови плода (кордоцентез).
Хорион- и плацентобиопсия применяются для получения небольшого количества ворсин хориона или кусочков плаценты в период с 7-й по 16-ю неделю беременности. Процедура осуществляется трансабдоминально или трансцервикально под контролем УЗИ (рис. 10.6, 10.7). Принципиальной разницы между показаниями
для применения этих двух способов биопсии нет. Результативность процедуры зависит от того, каким методом специалист владеет лучше. Хотя хорионбиопсия технически проста, необходимы достаточный опыт и постоянное техническое совершенствование. Хорошие результаты получают акушеры, делающие не менее 200- 400 хорионбиопсий в год, неудачи составляют 1%. На основе большого материала (несколько миллионов случаев) сделаны выводы об осложнениях после хорионбиопсии. После трансцервикальной хорионбиопсии примерно у 10% женщин возникает небольшое кровотечение, очень редко - маточная инфекция, после трансабдоминального способа у 2,5% женщин отмечаются сокращения мускулатуры матки.
Одним из осложнений хорионбиопсии является спонтанный аборт (выкидыш). Общие потери плода после хорионбиопсии составляют в среднем 2,5-3%, в эти цифры входит и частота спонтанных выкидышей. Собственно хорионбиопсия индуцирует, очевидно, не более 2% случаев прерывания беременности.
Каких-либо нарушений плаценты, роста плода, появления врожденных пороков развития и увеличения перинатальной смер-
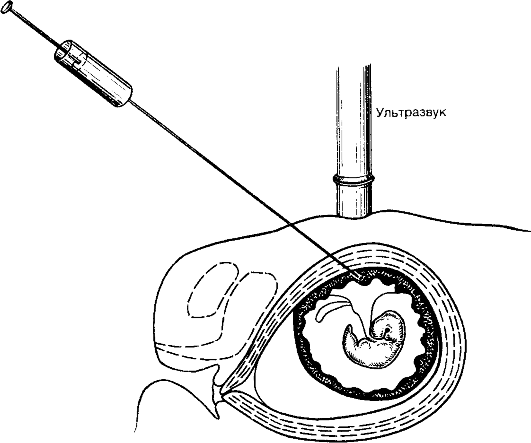 Рис. 10.6. Трансабдоминальная хорионили плацентобиопсия.
Рис. 10.6. Трансабдоминальная хорионили плацентобиопсия.
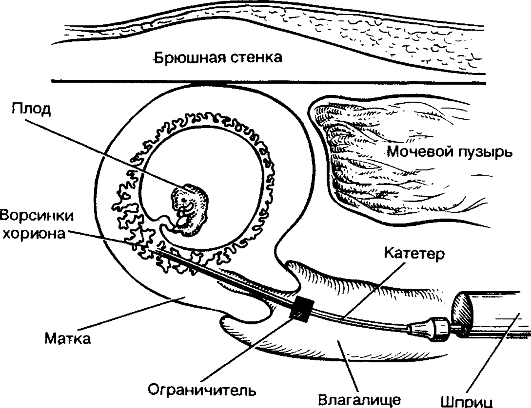 Рис. 10.7. Трансцервикальная хорионили плацентобиопсия.
Рис. 10.7. Трансцервикальная хорионили плацентобиопсия.
тности после хорионбиопсии не наблюдается. В некоторых центрах отмечено, что ранняя хорионбиопсия (в срок до 8 нед беременности) может индуцировать поперечные врожденные ампутации конечностей, так называемые редукционные пороки. В связи с этим (с 1992 г.) хорионбиопсию рекомендуется проводить после 8-й недели беременности, а после 11-й недели делают плацентобиопсию.
Образцы хориона (ворсины) подлежат лабораторному (цитогенетическому, молекулярно-генетическому, биохимическому) исследованию на предмет наследственных болезней. При аспирации ворсин хориона в материал могут попадать клетки децидуальной оболочки матки, что может приводить к диагностическим ошибкам. Считается, что в 4% случаев лабораторная диагностика биоптатов хориона дает ложноположительные результаты (например, в 1,5% анализов отмечается хромосомный мозаицизм, который является мозаицизмом хориона, а не эмбриона), а иногда (хотя и крайне редко) - ложноотрицательные результаты. Точность анализов во многом зависит от квалификации врача лаборанта-генетика.
Амниоцентез, или прокол плодного пузыря, с целью получения околоплодной жидкости и находящихся в ней слущенных клеток
амниона и плода используется для пренатальной диагностики с начала 70-х годов. Накоплен огромный опыт проведения этой процедуры. Диагностическая значимость метода не вызывает сомнений. Обычно процедура осуществляется на 15-18-й неделе беременности, ранний амниоцентез проводят на 12-15-й неделе беременности. Риск осложнений беременности при амниоцентезе меньше, чем при хорионбиопсии, по данным некоторых авторов, всего 0,2%. По этой причине во многих центрах пренатальной диагностики предпочитают делать амниоцентез, а не хорионбиопсию. В случае неудавшегося анализа хорионбиоптатов пренатальную диагностику повторяют с помощью амниоцентеза.
Амниоцентез делают через переднюю брюшную стенку женщины под контролем УЗИ (рис. 10.8). Чрезвлагалищный амниоцентез возможен, но применяется редко. Из амниотической полости извлекают 3-30 мл жидкости.
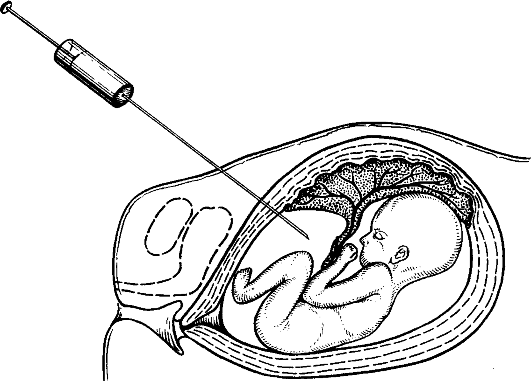 Рис. 10.8. Амниоцентез.
Рис. 10.8. Амниоцентез.
Предлагавшиеся ранее биохимическое и вирусологическое исследования амниотической жидкости малоинформативны для пренатальной диагностики. Из биохимических показателей жидкости только концентрация АФП диагностически значима. Уровень АФП существенно повышается при аномалиях нервной трубки и дефектах передней брюшной стенки.
Основным диагностическим материалом при амниоцентезе являются клетки. Их обязательно надо культивировать (на это затрачивается 2-4 нед) и для цитогенетических, и для биохимических исследований. Только молекулярно-генетические варианты диагностики с помощью ПЦР не требуют культивирования клеток.
Кордоцентез, т.е. взятие крови из пуповины, стал использоваться шире после того, как эту процедуру начали осуществлять под контролем УЗИ, т.е. без фетоскопии (рис. 10.9) с 20-й недели беременности. Образцы крови используют для цитогенетической (культивируются лимфоциты), молекулярно-генетической и биохимической диагностики наследственных болезней.
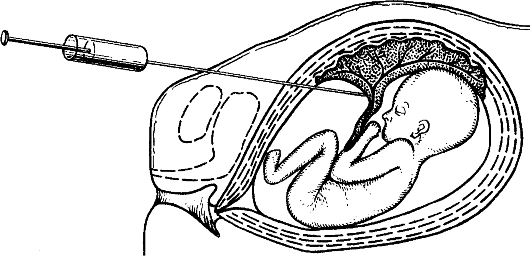 Рис. 10.9. Кордоцентез.
Рис. 10.9. Кордоцентез.
Кордоцентез применяют для диагностики хромосомных болезней, наследственных болезней крови (гемоглобинопатии, коагулопатии, тромбоцитопении), иммунодефицитов, гематологического статуса при резус-сенсибилизации, внутриутробных инфекций.
По данным мультицентрового исследования, частота осложнений при кордоцентезе суммарно по 16 российским центрам пренатальной диагностики не превышает 2%. Первая попытка получить материал успешна в 80-97% случаев. Преимущество кордоцентеза по сравнению с амниоцентезом заключается в том, что кровь удобнее для исследования, чем клетки амниотической жидкости. Лимфоциты культивируются быстрее (2-3 дня) и надежнее, чем амниоциты.
Биопсия тканей плода как диагностическая процедура осуществляется во II триместре гестации под контролем УЗИ (ранее под визуальным фетоскопическим контролем).
Для диагностики тяжелых наследственных болезней кожи (ихтиоз, эпидермолиз) делают биопсию кожи плода с патоморфологическим (а иногда и с электронно-микроскопическим) исследованием материала. Морфологические критерии наследственных болезней кожи позволяют установить точный диагноз или уверенно отвергнуть его.
Для диагностики мышечной дистрофии Дюшенна на внутриутробной стадии разработан иммунофлюоресцентный метод. Для этого производят биопсию мышц плода. Биоптат обрабатывают моноклональными мечеными антителами к белку дистрофину, который у больных не синтезируется. Соответствующая флюоресцентная обработка высвечивает белок. При унаследовании патологического гена свечение отсутствует. Этот прием является примером диагностики наследственной болезни на уровне первичного продукта гена. В случае миопатии Дюшенна такой метод дает более точные результаты, чем молекулярно-генетическая диагностика.
Фетоскопия (введение зонда и осмотр плода) при современной гибкой оптической технике не представляет больших трудностей. Однако визуальное обследование плода для выявления врожденных пороков развития используется редко, только при особых показаниях. Он проводится на 18-23-й неделе гестации. Дело в том, что почти все врожденные пороки развития, которые можно увидеть с помощью оптического зонда, диагностируются с помощью УЗИ. Понятно, что процедура УЗИ проще и безопаснее. Для фетоскопии требуется ввести зонд в амниотическую полость, что может вызвать осложнения. Выкидыши отмечаются в 7-8% случаев фетоскопии.
Заключение
Врачу общей практики необходимо иметь представление о методах пренатальной диагностики, их возможностях и ограничениях, о показаниях для направления на пренатальную диагностику. Конкретные сроки ее проведения и выбор метода (а иногда методов) определяет группа (команда) пренатальной диагностики (врачгенетик, акушер-гинеколог и врач лаборант-генетик), основываясь на состоянии здоровья беременной, течении беременности, психологической готовности женщины к процедуре. Объем и возможности вторичной профилактики наследственных болезней путем элиминации эмбрионов и плодов (тератаназия) после пренатальной диагностики представлены в суммированном виде в табл. 10.7-10.9.
Таблица 10.7. Методы пренатальной диагностики
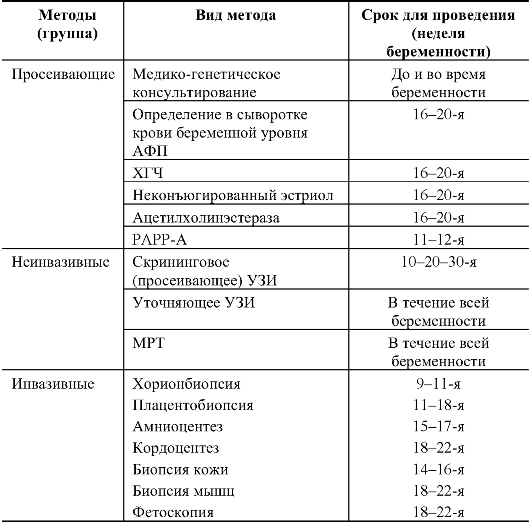 Таблица 10.8. Сравнительная
характеристика методов пренатальной диагностики с использованием
трансабдоминальной техники взятия образцов (по материалам ВОЗ)
Таблица 10.8. Сравнительная
характеристика методов пренатальной диагностики с использованием
трансабдоминальной техники взятия образцов (по материалам ВОЗ)
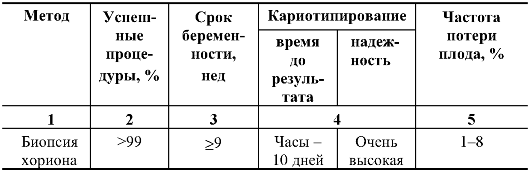 Таблица 10.8. Окончание
Таблица 10.8. Окончание
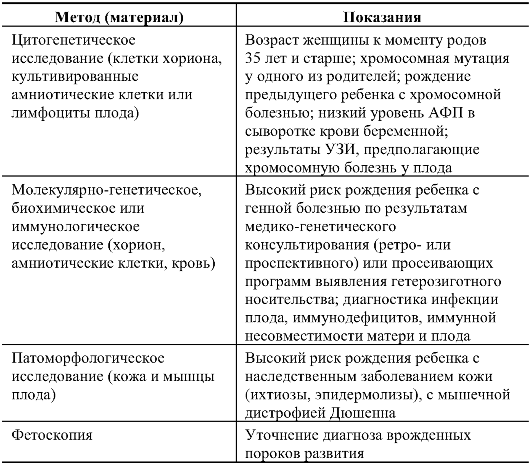
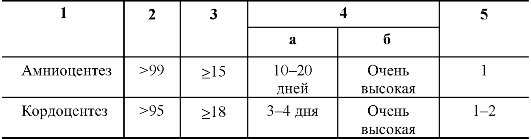 Таблица 10.9. Показания для применения разных методов инвазивной пренатальной диагностики
Таблица 10.9. Показания для применения разных методов инвазивной пренатальной диагностики
 Предымплантационная диагностика
Предымплантационная диагностика
Успехи биологии и медицины обеспечили возможность нехирургического лаважа яйцеклеток человека, оплодотворения и разви-
тия зиготы до стадии бластоцисты в лабораторных условиях (in vitro). Затем такой зародышевый пузырек имплантируют в матку, где проходит его дальнейшее нормальное развитие. Этот метод широко используется в акушерской практике.
Такое манипулирование с зародышевыми клетками и зародышем натолкнуло генетиков на мысль о диагностике наследственных болезней у зародыша ранних стадий развития. Это направление исследований (середина 80-х годов) было названо предымплантационной диагностикой.
Такая диагностика относится к методам первичной профилактики наследственньгх болезней. Ее преимущество заключается в том, что она помогает избежать повторных абортов после обычной пренатальной диагностики в семьях с высоким риском наследственной патологии.
Предымплантационная диагностика успешна при следующих условиях: 1) получение зародыша на предымплантационной стадии развития (до 5-7-го дня после оплодотворения); 2) наличие диагностических (аналитических) микрометодов на уровне одной или нескольких клеток; 3) микрохирургическая техника (микробиопсия) для взятия минимального числа клеток без повреждения зародышевого пузырька; 4) точные медицинские показания со стороны семьи для диагностики.
Получение предымплантационных зародышей
Получение предымплантационных эмбрионов возможно нехирургическим маточным лаважем и оплодотворением в пробирке.
С помощью маточного лаважа можно получить еще не имплантировавшийся зародыш в течение 90-130 ч после оплодотворения. К этому времени зародыш спускается из маточной трубы в матку. Эта процедура безболезненная и безопасная. Соответствующие приспособления (улавливатель, проводник и катетер) уже прошли испытание. Процедура не влияет на последующие овариальные циклы и не препятствует будущим беременностям.
После подсадки зародыша в матку нормальная беременность наступает в 50% случаев.
Экстракорпоральное оплодотворение и дробление зиготы хорошо зарекомендовали себя в акушерской практике. Этот метод применяют для преодоления бесплодия по причине непроходимости труб. Несмотря на то что только 10-20% подсадок успешны, метод используется все шире.
Микрохирургическая процедура осуществляется с помощью микроманипулятора (рис. 10.10). От зародыша на стадии 8-16 клеток
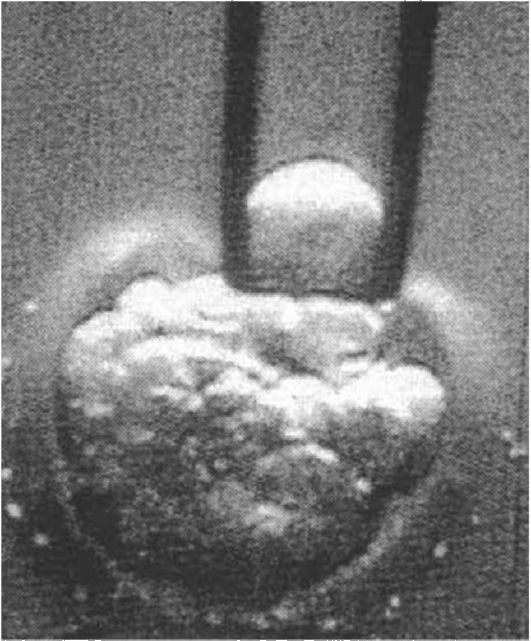 Рис. 10.10. С помощью микроманипулятора удаляется одна клетка (с ядром) из человеческого эмбриона на стадии 12 клеток. Фото с видеозаписи.
Рис. 10.10. С помощью микроманипулятора удаляется одна клетка (с ядром) из человеческого эмбриона на стадии 12 клеток. Фото с видеозаписи.
можно отделить 1-2 клетки. Иногда исследование ограничивается вторичным полярным тельцем (оно несет геном яйцеклетки). Зародыш сохраняют в условиях глубокой заморозки (или зародыш продолжает развиваться в искусственных условиях), пока проводится анализ клетки.
Подсадка после заморозки возможна во время любого другого овариального цикла, не обязательно в тот же месяц, когда взята яйцеклетка.
Диагностика на уровне одной или нескольких клеток в настоящее время реальна при некоторых болезнях. Ее проводят с использованием ПЦР, моноклональных антител, ультрамикроаналитических методов. Уже появились сообщения об успешной диагностике на предымплантационной стадии синдрома Марфана, миотонической дистрофии, хореи Гентингтона, семейного полипозного рака толстой кишки, муковисцидоза, Оm2-ганглиозидоза (болезнь Тея- Сакса), синдрома Леша-Нихена, талассемии, спинальной мышечной атрофии, мышечной дистрофии Дюшенна, умственной отсталости с ломкой Х-хромосомой.
Можно надеяться, что в ближайшие годы методические возможности предымплантационной диагностики расширятся в области как получения диагностического материала, так и аналитических методов (культивирование предымплантационных эмбрионов и их бластомеров, микроманипуляции, криопресервация и др.).
Доклиническая диагностика и профилактическое лечение, просеивающие программы
Концепция доклинической диагностики и возможности нормокопирования фенотипа
Такая концепция диагностики патологических мутаций «родилась» из теоретических исследований по изучению экспрессивно-
сти генов. Если при одном и том же генотипе фенотипы особей различны, то на проявляемость (экспрессивность) генов можно влиять. На такой постановке вопроса настаивал С.Н. Давиденков, выступая с критикой господствовавшей в 20-30-х годах теории о вырождении семей с наследственными болезнями и об обреченности таких больных.
Выше рассматривались теоретические основы профилактики на основе управления действием генов. Следует подчеркнуть, что с таких позиций в 20-х годах особенно активно выступал выдающийся биолог Н.К. Кольцов. По поводу его экспериментов довольно метко высказался В.В. Маяковский: «Говорят - за изящную фигуру и лицо, предчувствуя надобность близкую, артиста Ильинского профессор Кольцов переделал в артистку Ильинскую».
Для нескольких болезней уже разработаны не только теоретические основы диагностики (до развития клинической картины), но и методы профилактического лечения. Поскольку отдельные формы наследственных болезней редки (распространенных генных болезней немного), для их выявления должны быть простые и дешевые методы просеивающей диагностики. Их также называют скрининговыми.
Идея просеивания (скрининга) родилась в США в начале ХХ века (осмотр школьников, профилактические осмотры на выявление туберкулеза, регулярные обследования рабочих и др.). Перечисленные приемы уверенно вошли в практику мирового здравоохранения. Скрининг предполагает массовое и безотборное обследование, профилактическую направленность и двухэтапность (по меньшей мере) диагностики.
Просеивание можно определить как идентификацию нераспознанных болезней с помощью быстро осуществляемых проверок (тестов). Это обеспечивает отбор лиц с вероятным заболеванием. Людей с высокой вероятностью заболевания повторно обследуют с применением уточняющих диагностических методов, позволяющих либо отвергнуть предполагавшийся на первом этапе диагноз, либо уверенно подтвердить его.
Идея просеивающего обследования новорожденных на унаследованную комбинацию аллелей, обусловливающую развитие наследственной болезни, стала проверяться в 60-х годах. К настоящему времени уже окончательно сложились основные положения массовой диагностики наследственных болезней на доклинической стадии (критерии наследственных болезней и диагностические методы).
Массовое просеивание новорожденных проводится на наследственные болезни, если они:
- без своевременного профилактического лечения существенно снижают жизнеспособность, приводят к инвалидности, больной нуждается в специальной помощи;
- поддаются точной биохимической или молекулярно-генетической диагностике на доклинической стадии;
- поддаются эффективному профилактическому лечению;
- имеют частоту 1:10 000 и выше. Лишь в некоторых странах при наличии исследовательской группы просеивание новорожденных осуществляется для болезней, встречающихся с частотой 1:20 000-1:40 000.
Диагностические методы массового просеивания новорожденных должны отвечать следующим критериям:
1. Экономичность. Методы должны быть технически простыми и дешевыми в массовых исследованиях.
2. Диагностическая значимость. Ложноотрицательных результатов практически не должно быть, а соотношение истинно положительных и ложноположительных должно быть не менее 1:5. Это можно назвать чувствительностью и специфичностью метода.
3. Надежность или воспроизводимость. Результаты обследования должны одинаково воспроизводиться в работе разных исследователей.
4. Доступность биологического материала. Метод должен быть приспособлен к анализу биологического материала, легко получаемого в малом количестве, хорошо сохраняемого (хотя бы несколько дней) и приемлемого для пересылки в централизованную лабораторию.
Основная цель программ массового просеивания новорожденных на наследственные болезни - это раннее выявление заболевания на доклинической (досимптомной) стадии и организация лечения. Программа обязательно включает следующие этапы: 1) взятие биологического материала для исследования у всех новорожденных и доставка материала в диагностическую лабораторию; 2) лабораторная просеивающая диагностика; 3) уточняющая диагностика всех случаев с положительными результатами при просеивании; 4) лечение и диспансеризация больных с контролем за ходом лечения; 5) медико-генетическое консультирование семьи.
Таким образом, программы массового обследования на наследственные болезни, поддающиеся профилактическому лечению, могут учреждаться только в рамках федерального или региональ-
ного (в том числе городского) здравоохранения. Для этого нужны организация специального звена в структуре здравоохранения и немалые экономические затраты, которые в общегосударственном масштабе компенсируются уменьшением числа инвалидов с детства. Многочисленные исследования, проведенные в разных странах, показали, что экономическая эффективность просеивающих программ (сохранение здоровья леченых индивидов) дает государству 5-10-кратную экономическую выгоду.
Первая программа скрининга новорожденных на фенилкетонурию была организована в США примерно 25 лет назад. За прошедшее время в разных странах проверялись также программы более чем для 10 наследственных болезней обмена веществ. В результате были отработаны изложенные выше критерии массовой диагностики наследственных болезней. В конечном счете страны с развитым здравоохранением стали проводить массовое просеивание новорожденных лишь для нескольких болезней, характеристики которых представлены в табл. 10.10. Следует отметить, что эти рекомендации справедливы для популяций европеоидной расы. Для других рас, а иногда популяций частоты указанных болезней могут быть ниже, и тогда не будет показаний для их массовой диагностики.
Как видно из табл. 10.10, лишь 3 болезни (фенилкетонурия, гипотиреоз, врожденная гиперплазия надпочечников) удовлетворяют всем критериям массовой диагностики. Галактоземию также
Таблица 10.10. Характеристики болезней, по которым проводится массовое просеивание новорожденных
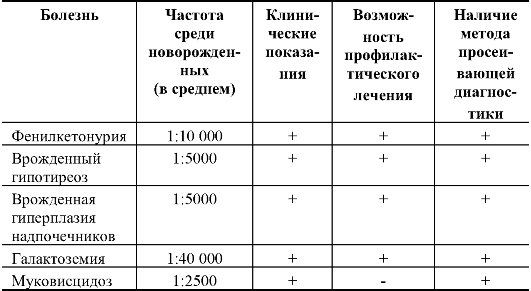 можно
включить в этот список, но она встречается редко и ее диагностика
весьма дорогая. По этой причине скрининг на галактоземию проводится
ограниченно. Для муковисцидоза еще не разработаны методы
профилактического лечения, поэтому раннее выявление патологии не
предупреждает развития заболевания.
можно
включить в этот список, но она встречается редко и ее диагностика
весьма дорогая. По этой причине скрининг на галактоземию проводится
ограниченно. Для муковисцидоза еще не разработаны методы
профилактического лечения, поэтому раннее выявление патологии не
предупреждает развития заболевания.
Приведем описание просеивающей диагностики и профилактического лечения трех форм врожденных болезней обмена. Применение этих программ дало хорошие результаты (в том числе и в нашей стране, хотя и в ограниченном масштабе).
Фенилкетонурия
Материалом для просеивающей диагностики фенилкетонурии являются высушенные пятна капиллярной крови новорожденных на хроматографической бумаге (при некоторых модификациях метода можно использовать фильтровальную бумагу). Диагностический материал можно пересылать по почте в централизованную лабораторию.
Кровь берут на 3-5-й день после рождения, т.е. еще в родильном доме. Если взять кровь раньше этого срока, то может быть ложноотрицательное заключение.
Централизованные биохимические лаборатории целесообразно организовывать для региона с числом новорожденных 50 000- 100 000 в год. В таких лабораториях определяют количество фенилаланина с помощью качественного микробиологического теста Гатри или количественной флюориметрии, иногда используют полуколичественную распределительную хроматографию на бумаге и тонкослойную хроматографию. В России в последние десятилетия введена федеральная программа скрининга, основанная на флюориметрическом количественном методе определения фенилаланина в крови. В разных странах применяются различные методы. Опыт показал, что пропущенные случаи фенилкетонурии являются не ошибками лабораторных методов, а следствием недобросовестности или небрежности при взятии крови в родильных домах.
В случае положительного результата проводят уточняющую биохимическую диагностику. Это уже более сложная, иногда многоэтапная процедура. Во-первых, необходимо подтвердить гиперфенилаланинемию, во-вторых, следует разобраться в ее причине. Она может быть обусловлена типичной фенилкетонурией (недостаточ-
ность фенилаланингидроксилазы), вариантными или атипичными формами этой болезни, резистентными к диетотерапии, наследственной гиперфенилаланинемией (доброкачественной), другими формами нарушения метаболизма.
При подтверждении диагноза фенилкетонурии ребенка переводят на искусственную (бесфенилаланиновую) диету.
В табл. 10.11 приведены названия препаратов для питания детей с фенилкетонурией.
Таблица 10.11. Бесфинилаланиловые препараты
 Витамины
и минеральные соли дают в виде фармакологических препаратов. Со
временем диету расширяют. Дети старше 1 года легче переносят пищевой
фенилаланин. Лечение диетой проводится под регулярным биохимическим
контролем концентрации фенилаланина в крови: 2 раза в неделю в 1-й месяц
(обычно это период госпитализации), еженедельно до 6-месячного
возраста, 2 раза в месяц в возрасте 6 мес-1 года и ежемесячно в
дальнейшем. Этот контроль позволяет определять адекватность терапии.
Витамины
и минеральные соли дают в виде фармакологических препаратов. Со
временем диету расширяют. Дети старше 1 года легче переносят пищевой
фенилаланин. Лечение диетой проводится под регулярным биохимическим
контролем концентрации фенилаланина в крови: 2 раза в неделю в 1-й месяц
(обычно это период госпитализации), еженедельно до 6-месячного
возраста, 2 раза в месяц в возрасте 6 мес-1 года и ежемесячно в
дальнейшем. Этот контроль позволяет определять адекватность терапии.
При своевременном начале лечения бесфенилаланиновой диетой в первые месяцы после рождения у детей, гомозиготных по гену недостаточности фенилаланингидроксилазы, не отмечается никаких клинических признаков задержки психического или физического развития. С 9-11 лет у таких пациентов диету можно существенно расширить, но они остаются под наблюдением спе-
циалиста-генетика. Это особенно актуально для женщин, больных фенилкетонурией, так как во время беременности повышенный уровень фенилаланина и его дериватов в сыворотке женщины токсичен для внутриутробного (генетически здорового) плода. Это требует специальных профилактических мероприятий.
Врожденный гипотиреоз
Под названием «врожденный гипотиреоз» понимают сумму наследственной и ненаследственной патологии: агенезию щитовидной железы, эктопию щитовидной железы, дисгормоногенез (наследственные болезни), аутоиммунные процессы. Основные клинические проявления: умственная отсталость, резкое отставание в росте, отечность кожных покровов, а при дисгормоногенезе и развитие зоба. Для всех форм болезни приемлема одна и та же программа массового просеивания, поскольку биохимическими маркерами являются снижение в плазме крови содержания тироксина и увеличение содержания тиреотропного гормона (ТТГ). Диагностическая значимость просеивания в полной мере проявляется при определении обоих маркеров, но по экономическим соображениям часто останавливаются на определении ТТГ, что вполне информативно при взятии крови с 3-го по 7-й день жизни. При исследовании крови, взятой в более ранние сроки, чаще получают ложноположительные результаты. В некоторых программах рекомендуется повторное обследование всех новорожденных через 2 нед после первого обследования.
Применяют радиоиммунный и иммуноферментный (иммунофлюоресцентный) методы просеивающей диагностики. Их чувствительность и специфичность примерно одинаковы. Иммуноферментный метод предпочтительнее по техническим соображениям. Тироксин и ТТГ определяют в образцах крови новорожденных, высушенных на специальной фильтровальной бумаге.
При положительном результате диагноз должен быть подтвержден эндокринологом в клинических условиях и результатом лабораторного анализа сыворотки крови на тироксин, ТТГ и другие гормоны.
Заместительную терапию тиреоидином (L-тироксин) нужно начинать у детей с положительным просеивающим тестом еще до окончательного подтверждения диагноза. Задержка с началом лечения опасна. Эффективность терапии достаточно высока, но лечение, начатое после 2-го месяца жизни, неэффективно, хотя к этому возрасту заболевание клинически проявляется только у 4% больных. Это делает особенно важной раннюю диагностику.
Врожденная гиперплазия надпочечников
Эта клиническая форма объединяет 9 наследственных нарушений ферментных процессов в трех взаимосвязанных метаболических путях стероидогенеза. Наиболее часто встречается недостаточность 21-гидроксилазы, на основе чего разработаны методы просеивающей диагностики у новорожденных. Эти методы в данном случае выявляют биохимический маркер болезни - увеличение содержания 17-α-оксипрогестерона в крови (образцы высушивают на фильтровальной бумаге). Разработаны радиоиммунный и иммуноферментный методы, позволяющие четко улавливать повышенный уровень 17-а-оксипрогестерона. Чувствительность обоих методов достаточно высокая, но по техническим соображениям предпочтительнее иммуноферментный метод.
При установлении диагноза по клинической картине необходимо лабораторное подтверждение.
Лечение - заместительная гормональная терапия (кортикоиды), обычно успешное.
Итак, предотвратить клинические проявления наследственной патологии можно путем профилактического лечения болезни на предсимптоматической стадии. Прогресс молекулярной и клинической медицины позволяет идти дальше по пути нормокопирования патологических генетических состояний. Уже разрабатываются методы пренатального лечения (см. табл. 10.4), имеется опыт лечения метилмалоновой ацидурии на внутриутробной стадии большими дозами витамина В12. Недостаточность карбоксилазы лечат пренатально введением биотина. Лечение дексаметазоном врожденной недостаточности 21-гидроксилазы можно начинать со II триместра гестации и даже с 9- й недели, если проведена пренатальная диагностика. Женщинам, гетерозиготным по гену фенилкетонурии, во время беременности рекомендуется диета с низким содержанием фенилаланина.
Знание механизмов воздействия материнского организма на проявление различных аллелей (или их комбинаций) у зародыша (плода) позволяет искать новые пути профилактики наследственной патологии.
В последнее время развивается гипотеза преконцепционной профилактики. Период такой профилактики включает несколько месяцев до зачатия и ранние сроки развития зародыша. Предполагается, что подготовка организма женщины (полноценная витаминизированная диета, антиоксидантная терапия, коррекция иммунитета, отсутствие стрессов) до зачатия и на ранних стадиях развития зародыша
(до 10 нед) способствует уменьшению частоты врожденных пороков развития мультифакториальной природы. Особенно четко это показано для аномалий нервной трубки (различные варианты спинномозговых грыж) и врожденных пороков сердца. Частота повторного рождения ребенка с таким пороком в среднем равна 4,6%, а у женщин, которые принимали фолиевую кислоту и витамин С, - 0,7%.
Классическим примером преконцепционной профилактики врожденной патологии является лечение сахарного диабета у женщины до зачатия и во время беременности. В этом случае частота врожденных пороков развития у ребенка приближается к общепопуляционному уровню: около 2% вместо 7-9% у больных диабетом женщин без лечения до зачатия и на ранних сроках беременности.
Ключевые слова и понятия
Генная инженерия и первичная профилактика
Груз наследственной патологии (медицинские последствия)
Лабораторная пренатальная диагностика
Медико-генетическое консультирование
Методы пренатальной диагностики
Методы просеивающей пренатальной диагностики
Первичная, вторичная и третичная профилактика наследственных болезней
Преконцепционная профилактика
Показания для пренатальной диагностики
Предымплантационная диагностика
Пренатальное лечение
Прогноз здоровья потомства
Просеивающие программы диагностики болезней обмена для новорожденных
Профилактическое лечение Тератаназия
Ультразвуковая диагностика врожденных пороков развития Фенотипическая коррекция Функции врача-генетика
Контрольные вопросы
1. Определение концентрации АФП в крови беременной является скринирующим методом дородовой диагностики:
а) хромосомной патологии;
б) наследственных ферментопатий;
в) врожденных пороков развития;
г) гетерозиготности по гену Gm2-ганглиозидоза (болезни Тея-Сакса).
2. С помощью молекулярно-генетических методов пренатально диагностируют:
а) муковисцидоз;
б) синдром «кошачьего крика»;
в) талассемию;
г) хронический лимфолейкоз.
3. Определение концентрации АФП и ХГЧ в крови беременной является скри-
нирующим методом дородовой диагностики:
а) наследственных дефектов обмена аминокислот;
б) наследственной патологии крови;
в) пороков развития;
г) наследственных дефектов обмена углеводов.
4. Требования к методам биохимического скрининга:
а) диагностическая значимость (небольшой процент ложноположительных и отсутствие ложноотрицательных результатов);
б) стоимость диагностической программы не больше стоимости содержания обществом больных;
в) использование легкодоступного биологического материала в малом количестве;
г) при положительном результате отсутствие необходимости в проведении повторного исследования с целью подтверждения диагноза.
5. Понятие генетического риска включает:
а) повышенную вероятность иметь определенное заболевание в течение жизни;
б) вероятность возникновения наследственной болезни или болезни с наследственной предрасположенностью;
в) вероятность внутриутробной гибели плода.
6. С помощью УЗИ у плода диагностируют:
а) фенилкетонурию;
б) анэнцефалию;
в) редукционные пороки конечностей;
г) синдром Марфана.
7. С целью диагностики наследственной патологии у плода проводят амниоцентез в сроки гестации:
а) 7-8 нед;
б) 11-12 нед;
в) 16-18 нед;
г) 24-26 нед.
8. Высокий генетический риск составляет:
а) 100%;
б) 5-10%;
в) 10-20%;
г) 20-25%.
9. Массовую преклиническую диагностику проводят, если:
а) частота болезни среди населения до 1%;
б) эффективны профилактические мероприятия;
в) есть методы ДНК-диагностики;
г) заболевание имеет тяжелое течение.
10. Оптимальные сроки проведения биопсии хориона:
а) 10-12 нед;
б) 7-9 нед;
в) 4-6 нед.
11. С помощью биопсии хориона диагностируют:
а) наследственные дефекты обмена веществ;
б) множественные врожденные пороки развития;
в) хромосомные синдромы;
г) изолированные врожденные пороки развития.
12. Средний генетический риск составляет:
а) 10-20%;
б) 50%;
в) 6-10%;
г) 20-25%.
13. С помощью УЗИ диагностируют:
а) анэнцефалию;
б) галактоземию;
в) мукополисахаридоз;
г) ахондроплазию.
14. Кордоцентез проводят в сроки гестации:
а) 5-8 нед;
б) 9-11 нед;
в) 16-18 нед;
г) 20-22 нед.
15. Кордоцентез проводят при повышенном риске по:
а) хромосомным синдромам, обусловленным структурными мутациями;
б) наследственным болезням крови;
в) порокам развития;
г) хромосомным синдромам, обусловленным числовыми мутациями.
16. Диагностировать пренатально до 20 нед гестации можно:
а) адреногенитальный синдром;
б) гемофилию;
в) изолированную расщелину нёба;
г) синдром Эдвардса.
17. Первичная профилактика - это:
а) комплекс мероприятий, направленных на предупреждение рождения или зачатия детей с наследственными болезнями;
б) комплекс мероприятий, направленных на предотвращение развития унаследованного заболевания;
в) фенотипическая коррекция дефекта.
18. Неинвазивные методы пренатальной диагностики:
а) фетоскопия;
б) УЗИ;
в) хорионбиопсия;
г) анализ ХГЧ в сыворотке беременной;
д) кордоцентез.
19. Пренатальная диагностика - это:
а) комплекс мероприятий, направленных на предупреждение развития заболевания у ребенка;
б) предотвращение беременности при высоком риске рождения больного ребенка;
в) диагностика болезни у эмбриона или плода;
г) оценка риска развития заболевания у будущего ребенка;
д) диагностика гетерозиготного носительства рецессивных патологических генов у беременной.
20. Третичная профилактика используется при:
а) фенилкетонурии;
б) врожденном гипотиреозе;
в) хорее Гентингтона;
г) альбинизме;
д) целиакии.
21. Женщине 27 лет был проведен амниоцентез на 16-й неделе беременности в связи с множественными аномалиями у плода по результатам УЗИ. При цитогенетическом исследовании у плода выявили трисомию 21. Тактика врача-генетика:
а) рекомендовать прерывание беременности;
б) предоставить семье полную информацию о вероятном состоянии здоровья ребенка, возможностях его лечения и социальной адаптации;
в) предоставить право окончательного решения о пролонгировании или прерывании беременности родителям;
г) рекомендовать повторную беременность.
22. Для просеивающей диагностики фенилкетонурии у новорожденного берут кровь:
а) в процессе родов (пуповинная кровь);
б) на 7-10-й день жизни;
в) на 3-5-й день жизни.
23. Женщина 31 года на 6-й неделе беременности очень обеспокоена тем, что ее сестра недавно родила дочь с синдромом Дауна. Пациентка хотела бы провести амниоцентез. Тактика врача:
а) амниоцентез на сроке 15-16 нед;
б) детальное УЗИ плода на 18-20-й неделе гестации;
в) запросить результаты кариотипирования больного ребенка;
г) специфическая пренатальная диагностика в данном случае не требуется.
24. Показания для пренатального цитогенетического исследования:
а) возраст матери 39 лет;
б) рождение ребенка с синдромом Дауна в анамнезе;
в) кистозная гигрома шеи у плода при УЗИ;
г) расщелина позвоночника (spina bifida) у троюродного брата;
д) робертсоновская транслокация у отца.
25. К каждой ситуации подберите наиболее вероятный вариант этиологии.
1) Повторные выкидыши на ранних сроках беременности.
2) Аутосомно-доминантное заболевание вследствие новой мутации.
3) Аутосомно-рецессивное заболевание.
4) Х-сцепленное заболевание.
5) Трисомия 13.
а) сходная клиническая картина отмечается также у двух дядей по материнской линии;
6) возраст отца 50 лет;
в) возраст матери 40 лет;
г) сбалансированная транслокация;
д) кровнородственный брак.
26. Для каждой ситуации подберите наиболее целесообразный метод пренатальной диагностики.
1) 30-летняя женщина, в анамнезе рождение мертвого ребенка с множественными пороками развития (полидактилия, расщелина нёба, порок сердца) и нормальным кариотипом.
2) В семейном анамнезе миодистрофия Дюшенна, беременная - носительница семейной делеции в гене дистрофина.
3) У плода на 9-й неделе гестации при УЗИ обнаружили увеличение толщины шейной складки, атрезию или стеноз двенадцатиперстной кишки.
4) 25-летняя женщина очень обеспокоена возможностью рождения ребенка с синдромом Дауна. Индивидуальный и семейный анамнез без особенностей.
5) 36-летняя женщина на 14-й неделе беременности. а) биопсия ворсин хориона;
6) определение концентрации АФП в сыворотке матери;
в) амниоцентез;
г) детальное УЗИ;
д) кордоцентез.