Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 5 ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
Структура модуля | Темы |
Модульная единица 1 | 5.1. Взаимосвязь обмена веществ и энергии 5.2. Тканевое дыхание 5.3. Митохондриальная цепь переноса электронов 5.4. Сопряжение тканевого дыхания и синтеза АТФ 5.5. Дыхательный контроль 5.6. Разобщение дыхания и синтеза АТФ 5.7. Терморегуляторная функция дыхания 5.8. Ингибиторы дыхания |
Модульная единица 2 | 5.9. Заключительный этап катаболизма пищевых веществ. Специфические и общий пути катаболизма (ОПК) 5.10. Анаболические функции общего пути катаболизма (ОПК) 5.11. Регуляция ОПК 5.12. Гипоэнергетические состояния |
Модульная единица 1 ВЗАИМОСВЯЗЬ ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ. ТКАНЕВОЕ ДЫХАНИЕ. МИТОХОНДРИАЛЬНАЯ ЦЕПЬ ПЕРЕНОСА ЭЛЕКТРОНОВ. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Цели изучения Уметь:
1. Оценивать значение основных этапов обмена веществ в получении энергии, необходимой для процессов жизнедеятельности.
2. Анализировать этапы трансформации энергии пищевых веществ в энергию химических связей АТФ как основного аккумулятора энергии в организме.
3. Определять энергетический эффект окисления различных субстратов (в молях АТФ).
4. Оценивать эффективность тканевого дыхания как главного механизма синтеза АТФ.
5. Прогнозировать последствия действия на организм некоторых лекарственных веществ и ядов, нарушающих тканевое дыхание и синтез
АТФ.
Знать:
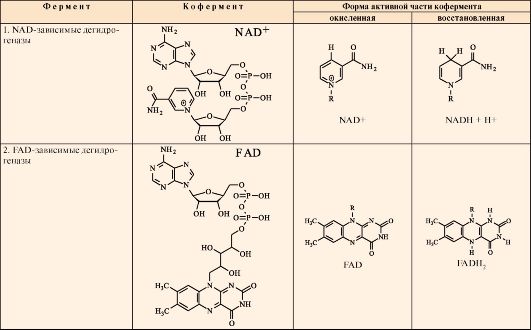
1. Строение ферментов и коферментов дыхательной цепи.
2. Строение и роль витаминов, участвующих в тканевом дыхании.
3. Этапы переноса электронов и протонов от дегидрируемых субстратов к кислороду.
4. Основные положения, объясняющие механизм сопряжения дыхания и синтеза АТФ.
5. Примеры ингибиторов и разобщителей тканевого дыхания и механизмы их действия.
6. Роль тканевого дыхания в регуляции теплопродукции в организме.
ТЕМА 5.1. ВЗАИМОСВЯЗЬ ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ
Обмен веществ включает:
• поступление веществ в организм;
• метаболизм или промежуточный обмен;
• выделение конечных продуктов обмена (рис. 5.1).
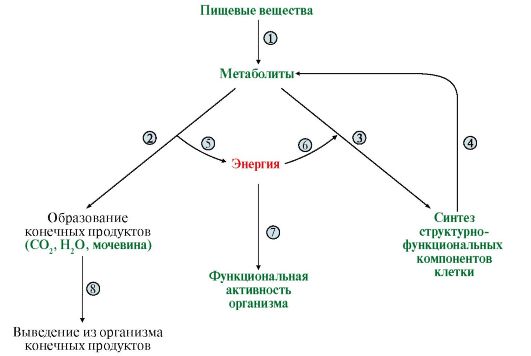 Рис. 5.1. Этапы обмена веществ. Взаимосвязь обмена веществ и энергии:
Рис. 5.1. Этапы обмена веществ. Взаимосвязь обмена веществ и энергии:
1 - пищеварение; 2, 4 - катаболизм; 3 - анаболизм; 5 - экзергонические реакции; 6, 7 - эндергонические реакции; 8 - выделение конечных продуктов
1. Поступление веществ в организм происходит в результате дыхания, питания и пищеварения. При пищеварении происходит гидролиз полимеров (белков, углеводов, липидов) до мономеров, которые легко всасываются в кровь.
Метаболизм представляет собой совокупность двух разнонаправленных процессов: катаболизма и анаболизма. В процессе катаболизма сложные органические молекулы превращаются в конечные продукты: СО2, Н2О и мочевину. Анаболизм представляет собой совокупность реакций синтеза сложных полимеров.
Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции), а ее использование происходит в реакциях анаболизма и при выполнении различных видов работы (эндергонические реакции).
2. АТФ-AДФ цикл. Центральную роль в энергетическом обмене играет АТФ.
В высокоэргических связях АТФ аккумулируется энергия, выделяемая в процессах катаболизма. Энергия, выделяющаяся при окислении пищевых веществ, обеспечивает синтез АТФ из АДФ и Н3РО4, а энергия гидролиза АТФ, в свою очередь, используется в различных видах работы (рис. 5.2).
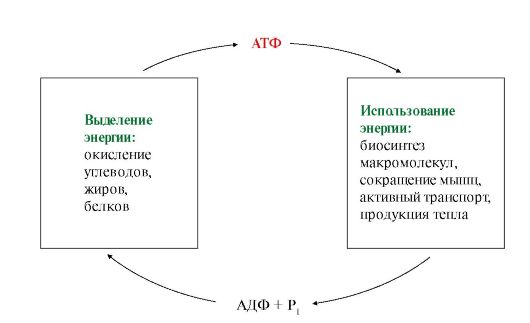 Рис. 5.2. Цикл АТФ-АДФ
Рис. 5.2. Цикл АТФ-АДФ
За сутки в организме образуется и распадается около 60 кг АТФ. Однако в клетке АТФ не накапливается, а расходуется в течение 1 минуты после образования, что требует ее непрерывного пополнения (АТФ-AДФ цикл).
Синтез и использование АТФ происходят постоянно, и то количество АТФ, которое было израсходовано клеткой, восполняется в процессе ее синтеза.
ТЕМА 5.2. ТКАНЕВОЕ ДЫХАНИЕ
Наиболее важными экзергоническими реакциями метаболизма являются реакции окисления органических веществ, в которых используется кислород и образуется вода и СО2. Совокупность этих реакций называтся тканевым дыханием (рис. 5.3).
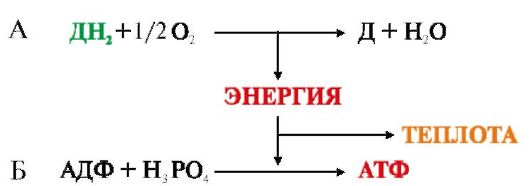 Рис. 5.3. Этапы тканевого дыхания:
Рис. 5.3. Этапы тканевого дыхания:
А - окисление субстратов путем дегидрирования и многоэтапный процесс переноса электронов на кислород; Б - перенос электронов сопровождается уменьшением свободной энергии; часть этой энергии рассеивается в виде теплоты, а -40% используется на синтез АТФ
Синтез АТФ из AДФ и Н3РО4 за счет энергии, выделяющейся при тканевом дыхании, называется окислительным фосфорилированием.
Первый этап тканевого дыхания - дегидрирование различных субстратов, образующихся в реакциях катаболизма.
Ферменты, отщепляющие водород от субстратов (дегидрогеназы), находятся в основном в матриксе митохондрий. В зависимости от строения коферментов дегидрогеназы делятся на две группы: NAD-зависимые и FAD -зависимые дегидрогеназы. В NAD -зависимых дегидрогеназах NAD непрочно связан с ферментом; в восстановленной форме (NADH) он отделяется от апофермента и служит донором водорода для другого фермента (рис. 5.4).
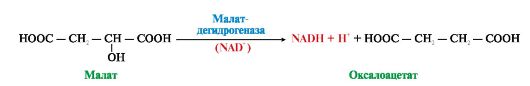 Рис. 5.4. Дегидрирование малата
Рис. 5.4. Дегидрирование малата
В FAD-зависимых дегидрогеназах FAD ковалентно связан с апоферментом, поэтому в реакциях, катализируемых FAD-зависимыми дегидрогеназами, участвует второй субстрат (акцептор водорода). Для всех флавиновых ферментов этим субстратом служит убихинон (коэнзимQ).
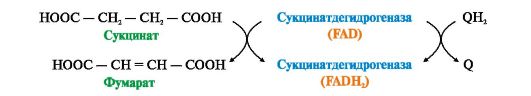 Рис. 5.5. Дегидрирование сукцината
Рис. 5.5. Дегидрирование сукцината
ТЕМА 5.3. МИТОХОНДРИАЛЬНАЯ ЦЕПЬ ПЕРЕНОСА ЭЛЕКТРОНОВ
1. Перенос электронов на кислород происходит при участии системы переносчиков, локализованных во внутренней мембране митохондрий и образующих цепь переноса электронов (ЦПЭ) (рис. 5.6).
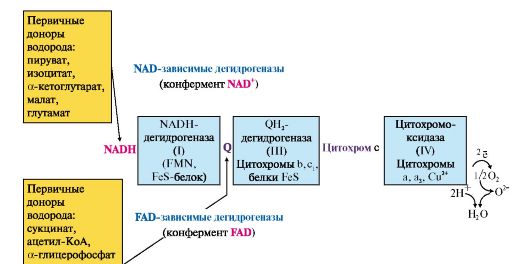 Рис. 5.6. Пути поступления электронов и протонов в ЦПЭ от первичных доноров.
Рис. 5.6. Пути поступления электронов и протонов в ЦПЭ от первичных доноров.
Высокомолекулярные комплексы, расположенные во внутренней мембране митохондрий: NADH-дегидрогеназа (комплекс I), СН2-дегидрогеназа (комплекс III), цитохромоксидаза (комплекс IV). NAD-зависимые дегидрогеназы локализованы в матриксе митохондрий. Большинство FAD-зависимых дегидрогеназ также находится в матриксе; сукцинатдегидрогеназа (комплекс II), в отличие от других FAD- зависимых дегидрогеназ, является компонентом внутренней мембраны митохондрий, но на рисунке не представлена
В состав ЦПЭ входят: NADH-дегидрогеназа (комплекс I), сукцинатдегидрогеназа (комплекс II), QН2-дегидрогеназа (комплекс III), цитохромоксидаза (комплекс IV), а также низкомолекулярные переносчики (кофермент Q и цитохром с).
2. Все компоненты ЦПЭ расположены в митохондриальной мембране в порядке возрастания редокс-потенциалов; самый высокий редокс-потенциал у кислорода. Это обеспечивает последовательное перемещение электронов от дегидрируемых субстратов на кислород, сопровождающееся освобождением части свободной энергии электронов (рис. 5.7).
Около 40% этой энергии трансформируется в энергию химических связей в процессе окислительного фосфорилирования.
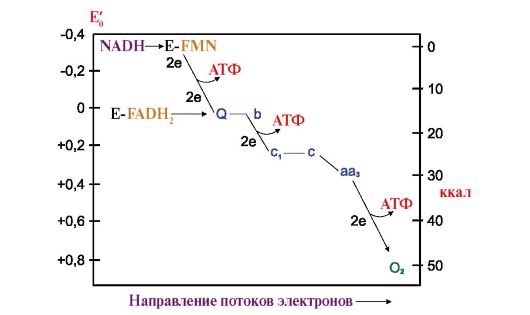 Рис. 5.7. Изменение свободной энергии (Е0) при переносе электронов по ЦПЭ.
Рис. 5.7. Изменение свободной энергии (Е0) при переносе электронов по ЦПЭ.
E-FMN - комплекс I; E-FAD - комплекс II; b-j - комплекс III; a-a3 - комплекс IV. На этапах ЦПЭ, где перенос электронов сопровождается большим снижением свободной энергии, создаются условия для синтеза АТФ
ТЕМА 5.4. СОПРЯЖЕНИЕ ТКАНЕВОГО ДЫХАНИЯ И СИНТЕЗА АТФ
1. Перенос электронов по ЦПЭ при участии комплексов I, III и IV сопровождается выделением наибольшего количества энергии (рис. 5.7). Часть этой энергии используется для переноса Н+ из матрикса в межмембранное пространство, в результате чего возрастает протонный электрохимический потенциал ΔμΗ+, основной составляющей которого является протонный градиент (рис. 5.8).
2. При достижении определенного протонного градиента происходит активация АТФ-синтазы (комплекс V), в ней открывается канал, через который протоны возвращаются в матрикс из межмембранного пространства, а энергия ΔμΗ+ используется для синтеза АТФ.
3. Каждый из трех комплексов ЦПЭ (I, III, IV) обеспечивает необходимый протонный градиент для активации АТФ-синтазы и синтеза одной молекулы АТФ. Количество молекул АТФ, образованных при восстановлении одного атома кислорода до Н2О при прохождении двух электронов по ЦПЭ, эквивалентно количеству использованного фосфата Н3РО4 (Р) и выражается коэффициентом окислительного фосфорилирования (Р/О). Если водород поступает в ЦПЭ от кофермента NADH, то Р/О имеет максимальное значение, равное 3. Если водород поступает от FAD-зависимых дегидрогеназ, то Р/О равен 2 (реальные значения Р/О несколько ниже, так как часть энергии электрохимического потенциала рассеивается в форме теплоты).
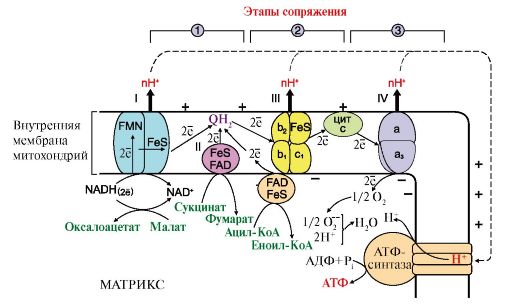 Рис. 5.8. Сопряжение дыхания и синтеза АТФ в митохондриях.
Рис. 5.8. Сопряжение дыхания и синтеза АТФ в митохондриях.
I - NADH - дегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза, V-АТФ-синтаза. Энергия протонного электрохимического потенциала используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы
При участии АТФ-АДФ транслоказы, расположенной во внутренней мембране митохондрий, АТФ транспортируется в цитоплазму в обмен на АДФ. В цитоплазме АТФ используется как источник энергии в различных процессах.
4. Таким образом, трансформация энергии в организме проходит следующие этапы.
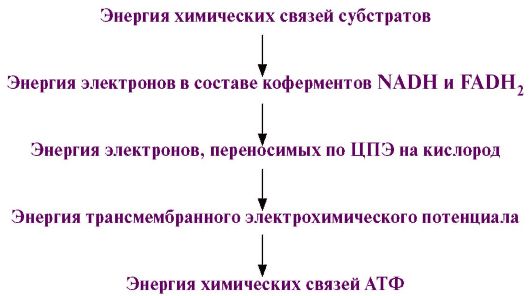 На всех этапах этого процесса часть энергии рассеивается в виде теплоты.
На всех этапах этого процесса часть энергии рассеивается в виде теплоты.
ТЕМА 5.5. ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Перенос электронов по ЦПЭ и синтез АТФ тесно сопряжены, т.е. могут происходить только одновременно и синхронно.
При увеличении расхода АТФ в клетке увеличивается количество АДФ и его поступление в митохондрии. Повышение концентрации АДФ (субстрата АТФ-синтазы) увеличивает скорость синтеза АТФ. При этом снижается протонный градиент, что стимулирует окисление первичных доноров и увеличивает скорость переноса электронов по ЦПЭ. Перенос электронов сопровождается увеличением поглощения кислорода, транспорта протонов из матрикса в межмембранное пространство и повышением протонного градиента, необходимого для активации АТФ-синтазы. Таким образом, скорость синтеза АТФ точно соответствует потребности клетки в энергии. Ускорение тканевого дыхания и окислительного фосфорилирования при повышении концентрации AДФ называется дыхательным контролем.
В реакциях ЦПЭ часть энергии не превращается в энергию макроэргических связей АТФ, а рассеивается в виде теплоты.
ТЕМА 5.6. РАЗОБЩЕНИЕ ДЫХАНИЯ И СИНТЕЗА АТФ
Некоторые липофильные вещества (2,4-динитрофенол, некоторые лекарства, жирные кислоты) могут переносить ионы водорода через внутреннюю мембрану митохондрий в матрикс, минуя канал АТФ-синтазы. В результате этого снижается протонный градиент и прекращается синтез АТФ. Это явление называется разобщением, а вещества - разобщителями дыхания и фосфорилирования (рис. 5.9).
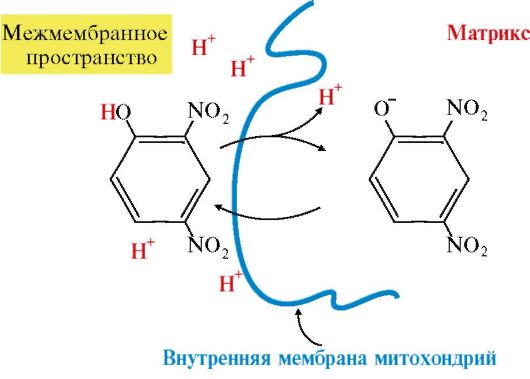 Рис. 5.9. Снижение протонного градиента под влиянием 2,4-динитрофенола.
Рис. 5.9. Снижение протонного градиента под влиянием 2,4-динитрофенола.
2,4-Динитрофенол протонируется в межмембранном пространстве, где концентрация протонов выше, и диффундирует через внутреннюю мембрану митохондрий в матрикс. В матриксе, где концентрация протонов ниже, 2,4-динитрофенол теряет протон, переходит в ионизированную форму и может возвращаться в межмембранное пространство
Подобным образом действуют протонофоры, увеличивающие проницаемость мембраны для ионов Na+ и К+. При действии разобщающих факторов большая часть энергии выделяется в виде теплоты, количество АДФ и поглощение кислорода при этом увеличиваются.
ТЕМА 5.7. ТЕРМОРЕГУЛЯТОРНАЯ ФУНКЦИЯ ДЫХАНИЯ
При переносе электронов по ЦПЭ часть энергии рассеивается в виде теплоты, которая используется теплокровными животными для поддержания температуры тела. При использовании АТФ для совершения работы значительная часть энергии также превращается в теплоту. При снижении температуры тела включается механизм дрожания (несогласованного сокращения отдельных групп мышц). При этом за счет АТФазной активности актомиозина происходит гидролиз АТФ до АДФ и Н3РО4, что стимулирует тканевое дыхание. Полезной работы при этом не происходит, большая часть энергии переходит в теплоту и температура тела повышается.
Кроме того, дополнительное образование теплоты может происходить путем разобщения дыхания и фосфорилирования в процессе адаптации к холоду. При охлаждении в жировой ткани из симпатических нервных окончаний освобождается норадреналин, который активирует ТАГ-липазу. При активации липазы в клетках повышается концентрация свободных жирных кислот, которые способны разобщать тканевое дыхание и окислительное фосфорилирование, участвуя в транспорте протонов через митохондриальную мембрану (рис. 5.10).
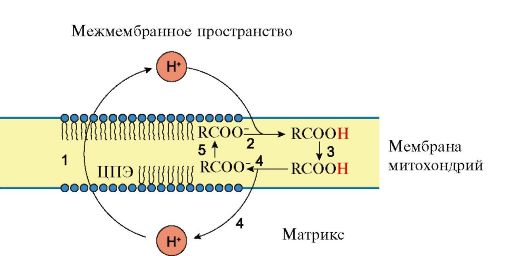 Рис. 5.10. Перенос ионов водорода через внутреннюю мембрану митохондрий при участии жирных кислот:
Рис. 5.10. Перенос ионов водорода через внутреннюю мембрану митохондрий при участии жирных кислот:
1 - транспорт H+при участии ЦПЭ; 2 - протонирование аниона жирной кислоты; 3 - диффузия протонированной жирной кислоты (R-COOH) к внутренней поверхности мембраны митохондрий; 4 - диссоциация R-COOH в мембране и выход протона в матрикс; 5-перенос R-COO- при участии АДФ/АТФ транслоказы к наружной поверхности митохондриальной мембраны
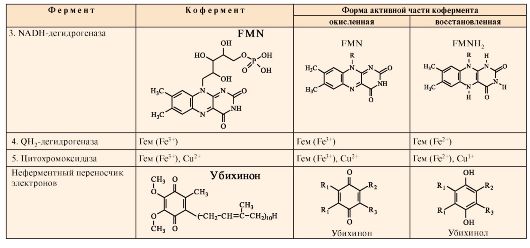
Таблица 5.1. Компоненты митохондриальной ЦПЭ
 Окончание табл. 5.1
Окончание табл. 5.1
 У новорожденных и зимнеспящих животных разобщение связано с наличием разобщающего белка - термогенина в
бурой жировой ткани. Термогенин близок по структуре к
АТФ/АДФ-антипортеру. Он может переносить анионы жирных кислот, но не
обладает способностью к транспорту нуклеотидов.
У новорожденных и зимнеспящих животных разобщение связано с наличием разобщающего белка - термогенина в
бурой жировой ткани. Термогенин близок по структуре к
АТФ/АДФ-антипортеру. Он может переносить анионы жирных кислот, но не
обладает способностью к транспорту нуклеотидов.
ТЕМА 5.8. ИНГИБИТОРЫ ДЫХАНИЯ
Некоторые лекарственные вещества, химические реагенты и антибиотики вызывают ингибирование ферментов, либо собственно дыхательной цепи, либо окислительного фосфорилирования.
1. Ингибиторы, блокирующие дыхательную цепь: барбитураты, ротенон - ингибиторы NADH-дегидрогеназы; антимицин А - ингибитор QH2-дегидрогеназы; СО, H2S, цианид - ингибируют цитохромоксидазу.
2. Антибиотик олигомицин не влияет непосредственно на перенос электронов, но ингибирует процесс фосфорилирования на уровне АТФ-синтазы.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Выучите названия компонентов и последовательность реакций в митохондриальной ЦПЭ (рис. 5.8).
2. Запомните названия и строение коферментов дыхательных ферментов и запишите формулы их активных частей в окисленной и восстановленной форме (табл. 5.1).
3. Внесите в табл. 5.2 названия ферментных комплексов, катализирующих окислительно-восстановительные реакции ЦПЭ, и подберите для каждого из них донор, акцептор электронов и ингибитор.
Таблица 5.2. Ферментные комплексы ЦПЭ и их ингибиторы
Название ферментного комплекса | Донор электронов | Акцептор электронов | Ингибитор |
4. Определите различия в энергетическом эффекте окисления малата и сукцината. Для этого:
а) напишите реакции дегидрирования малата и сукцината;
б) нарисуйте схемы, показывающие путь водорода от этих субстратов к кислороду, используя схему ЦПЭ (рис. 5.8);
в) выпишите названия ферментов, обеспечивающих сопряжение дыхания с синтезом АТФ;
г) определите количество этапов сопряжения для каждого субстрата и сравните величины Р/О для них.
5. Определите характер и причины изменений скорости дыхания в эксперименте с изолированными митохондриями при использовании в качестве окисляемого субстрата малата, если:
а) в инкубационную смесь добавить ингибитор NADH-дегидрогеназы;
б) вместе с этим ингибитором добавить сукцинат;
в) цианид;
г) 2,4-динитрофенол.
6. Суспензию митохондрий инкубировали в оптимальных условиях. Поглощение кислорода определяли после добавления АДФ и 2,4-динитрофенола. В обоих случаях поглощение кислорода увеличивалось. Как объяснить результаты эксперимента? Для этого:
а) вспомните, что такое «дыхательный контроль»;
б) объясните роль АДФ в процессе тканевого дыхания;
в) вспомните механизм действия разобщителей дыхания и окислительного фосфорилирования;
г) сравните и объясните причины увеличения поглощения кислорода в обоих случаях.
7. В атмосфере кислорода глюкоза окисляется до H2O и CO2. Если окисление глюкозы проводить в атмосфере радиоактивного кислорода, в каком из продуктов окажется метка?
Обоснуйте свой выбор, изобразив необходимые схемы и реакции.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ. Последовательность реакций в ЦПЭ определяется:
A. Строением окисляемого субстрата
Б. Величинами окислительно-восстановительных потенциалов компонентов ЦПЭ
B. Локализацией ферментов в митохондриальной мембране Г. Прочностью связи апоферментов с коферментами.
Д. Строением кофермента.
2. Установите соответствие. Кофермент:
A. FAD Б. Гем
B. FMN
Г. NAD+
Д. Убихинон
Фермент:
1. NADH-дегидрогеназа
2. QH2-дегидрогеназа
3. Сукцинатдегидрогеназа
3. Выберите правильные ответы. Реакции, сопряженные с синтезом АТФ:
A. NADH + H+ + Q - NAD+ + QH2 Б. Сукцинат + Q - Фумарат + QH2
B. QH2 + 2 Цит с (Fe3+) - Q + 2 Цит с (Fe2+) + 2H+ Г. Малат + NAD+ - Оксалоацетат + NADH + H+ Д. 2 Цит с (Fe2+) + О2 - 2 Цит с (Fe3+) + H2 О
4. Выполните «цепное» задание:
а) одним из первичных доноров водорода для ЦПЭ является:
A. Фумарат
Б. Оксалоацетат
B. Малат Г. Цитрат
б) окисление этого субстрата катализирует:
A. NAD-зависимая дегидрогеназа Б. QH2-дегидрогеназа
B. Цитохромоксидаза
Г. NADH-дегидрогеназа
в) кофермент этого фермента:
A. Убихинон Б. NADP+
B. NAD+ Г. FMN Д. FAD
г) этот кофермент является производным витамина:
A. РР
Б. в2
B. В1
Г. в6
Д. Н
д) напишите рабочую часть кофермента в окисленной и восстановленной форме.
5. Выполните «цепное» задание:
а) кофермент изоцитратдегидрогеназы:
A. FMN
Б. Гем
B. FAD Г. NAD+
б) этот кофермент образуется из витамина:
A. В1 Б. Н
B. в2
Г. в6
Д. РР
в) в восстановленной форме он служит донором водорода для:
A. QH2-дегидрогеназы Б. NADH-дегидрогеназы
B. Сукцинатдегидрогеназы
г) этот фермент находится в:
A. Цитозоле
Б. Внутренней мембране митохондрий
B. Межмембранном пространстве
д) он содержит кофермент:
A. FMN
Б. Гем
B. FAD Г. NAD+
е) напишите рабочую часть этого кофермента в окисленной и восстановлен-
ной форме. 6. Установите соответствие. Акцептор электронов:
A. Цитохром С
Б. о2
B. Убихинон
Г. NAD+ Д. FAD
Фермент
1. NADH-дегидрогеназа
2. QH2-дегидрогеназа
3. Цитохромоксидаза
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. Б
2. 1-В, 2-Б, 3-А
3. А, В, Д
4. а) В, б) А, в) В, г) А, д) см. табл. 5.1
5. а) Г, б) Д, в) Б, г) Б, д) А, е) см. табл. 5.1
6. 1-В, 2-А, 3-Б
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Обмен веществ
2. Метаболизм
3. Катаболизм
4. Анаболизм
5. Экзергонические реакции
6. Эндергонические реакции
7. АТФ-АДФ цикл
8. Тканевое дыхание
9. Митохондриальная ЦПЭ
10. Окислительное фосфорилирование
11. Сопряжение переноса электронов и синтеза АТФ
12. Коэффициент окислительного фосфорилирования (Р/О)
13. Дыхательный контроль
14. Разобщители дыхания и фосфорилирования
15. Ингибиторы дыхания
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В эксперименте с изолированными митохондриями в качестве окисляемого субстрата использовали малат. В присутствии каких из указанных ниже веществ будет тормозиться окисление этого субстрата? Для подтверждения вашего выбора нарисуйте схему ЦПЭ и объясните, на какие этапы и каким образом влияют выбранные вами соединения:
А - амитал натрия Б - 2,4 динитрофенол
В - NADH
Г - AДФ Д - АТФ
2. Митохондрии инкубировали в закрытом сосуде в фосфатном буфере с использованием малата в качестве донора водорода. О скорости реакции судили по поглощению кислорода в опытной пробе (по уменьшению газа в сосуде). После каждого добавления АДФ поглощение кислорода быстро увеличивалось и практически не менялось до добавления следующей порции АДФ. Как это объяснить? (Результаты опыта представлены на рис. 5.11):
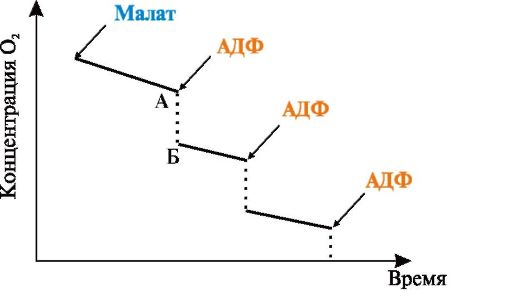 Рис. 5.11. Влияние АДФ на поглощение кислорода митохондриями:
Рис. 5.11. Влияние АДФ на поглощение кислорода митохондриями:
А - объем поглощенного кислорода до добавления АДФ; Б - объем поглощенного кислорода после добавления АДФ
а) напишите реакцию дегидрирования малата и представьте путь электронов и протонов к кислороду, используя схему ЦПЭ;
б) объясните связь между переносом электронов по ЦПЭ и синтезом
АТФ;
в) дайте определение понятия «дыхательный контроль»;
г) опишите последовательность событий, происходящих в митохондриях после каждого добавления АДФ.
3. Барбитураты (амитал натрия и др.) используются в медицинской практике как снотворные средства. Однако передозировка этих лекарств, превышающая в 10 раз лечебную дозу, может привести к летальному исходу. На чем основано токсичное действие барбитуратов на организм? Для обоснования ответа:
а) изобразите схему процесса, на который влияют эти препараты;
б) на схеме укажите этап процесса, который первично ингибируется барбитуратами;
в) опишите последствия их действия на организм;
г) объясните причины летального исхода при передозировке этих лекарств.
4. Цианид калия - смертельный яд. Отравления им крайне редки в связи с его недоступностью. Однако встречаются случаи отравления абрикосовыми косточками, содержащими амигдалин, из которого в организме освобождается синильная кислота HCN. Анион этой кислоты обладает высоким сродством к Fe3+, вследствие чего образует с ним прочный комплекс. При отравлении цианидами наблюдается угнетение дыхания, гиперемия кожных покровов и слизистых оболочек, судороги. Характерным признаком отравления является ярко алый цвет венозной крови. Что является причиной возникновения описанных симптомов? Для ответа на вопрос:
а) нарисуйте схему метаболического пути, который нарушается цианидами, назовите ингибируемый фермент, опишите особенности его строения и функции;
б) объясните, почему именно этот фермент имеет большее сродство к цианиду, чем другие гемопротеины;
в) объясните алый цвет венозной крови и остановку дыхания при отравлении цианидом?
5. В опытах по изучению механизмов адаптации животных к низким температурам использовали остриженных (без оперения) голубей, которых выдерживали в течение нескольких часов при -10 оС. В первые 20-25 минут у животных отмечалось резкое падение температуры тела (до 37,5 оС при норме 41,5 оС), что сопровождалось резкой дрожью. Однако в дальнейшем температура тела голубей оставалась постоянной в течение нескольких часов. Как объяснить наблюдаемые явления? Для объяснения результатов опыта:
а) перечислите механизмы адаптации организма к охлаждению;
б) объясните роль дрожания при охлаждении;
в) назовите другие способы терморегуляции у животных и человека;
г) объясните роль норадреналина в адаптации к охлаждению; изобразите схему, иллюстрирующую механизм его действия.
6. Педиатры рекомендуют родителям не слишком тепло одевать детей для прогулок на воздухе, чтобы не наступало перегрева, повышенной потливости и беспокойства. На чем основана такая рекомендация? Составьте план решения задачи и изобразите необходимые схемы и реакции.
7. В начале 20-го столетия медиками было замечено, что тучные люди, работающие на военных заводах по производству взрывчатых веществ, таких, как 2,4-динитрофенол, быстро теряют избыточный вес. На этом основании в медицине некоторое время применяли 2,4-динитрофенол для похудения как жиросжигающее средство. Однако вскоре препарат прекратили использовать из-за высокой токсичности и тяжелых осложнений со смертельным исходом.
В чем причина высокой токсичности 2,4-динитрофенола? Для ответа на вопрос:
а) напишите формулу 2,4-динитрофенола;
б) опишите механизм его действия и объясните жиросжигающий эффект.
Модульная единица 2 ЗАКЛЮЧИТЕЛЬНЫЙ ЭТАП КАТАБОЛИЗМА ПИЩЕВЫХ ВЕЩЕСТВ. СПЕЦИФИЧЕСКИЕ И ОБЩИЙ ПУТЬ КАТАБОЛИЗМА (ОПК)
Цели изучения Уметь:
1. Представлять в виде схемы основные этапы катаболизма пищевых веществ и их связь с цепью переноса электронов.
2. Анализировать изменения энергетического обмена при различных физиологических состояниях организма и при их нарушениях.
3. Объяснять анаболические функции ОПК.
Знать:
1. Строение основных метаболитов цикла трикарбоновых кислот, ферментов, коферментов и последовательность реакций с их участием.
2. Способы регуляции ключевых ферментов общего пути катаболизма и связь скорости дыхания с энергетическим статусом организма.
3. Основные типы гипоксии; причины и последствия гипоэнергетических состояний.
ТЕМА 5.9. ЗАКЛЮЧИТЕЛЬНЫЙ ЭТАП КАТАБОЛИЗМА ПИЩЕВЫХ ВЕЩЕСТВ. СПЕЦИФИЧЕСКИЕ И ОБЩИЙ ПУТИ
КАТАБОЛИЗМА (ОПК)
1. Начальные этапы катаболизма (специфические пути катаболизма) основных пищевых веществ (белков, жиров и углеводов) происходят при участии ферментов специфических для каждого класса веществ и завершаются образованием двух метаболитов - пировиноградной кислоты (С3) и уксусной кислоты (С2) в форме ацетил-КоА (рис. 5.12).
2. После образования пировиноградной кислоты дальнейший путь распада веществ до конечных продуктов СО2 и Н2О происходит через одну и ту же совокупность реакций независимо от того, из каких исходных субстратов образовался пируват [общий путь катаболизма (ОПК)].
Общий путь катаболизма включает:
• реакцию окислительного декарбоксилирования пирувата;
• цитратный цикл (цикл Кребса или цикл трикарбоновых кислот, ЦТК).
3. В общем пути катаболизма образуются первичные доноры водорода для ЦПЭ, которые окисляются NAD+-зависимыми и FAD-зависимой дегидрогеназами, передающими водород в ЦПЭ (рис. 5.13).
Реакции общего пути катаболизма происходят в матриксе митохондрий и восстановленные коферменты передают водород непосредственно на компоненты ЦПЭ, расположенные во внутренней мембране митохондрий.
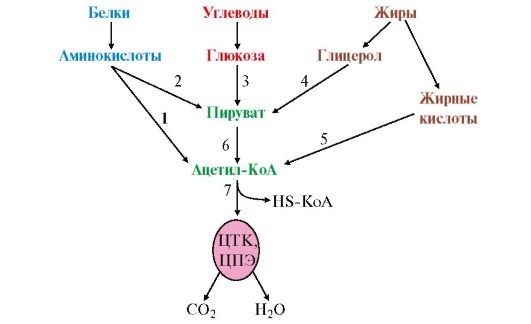 Рис. 5.12. Специфические и общий пути катаболизма:
Рис. 5.12. Специфические и общий пути катаболизма:
1-5 - специфические пути катаболизма; 6 - первый этап общего пути катаболизма; 7 - второй этап общего пути катаболизма (цитратный цикл и ЦПЭ)
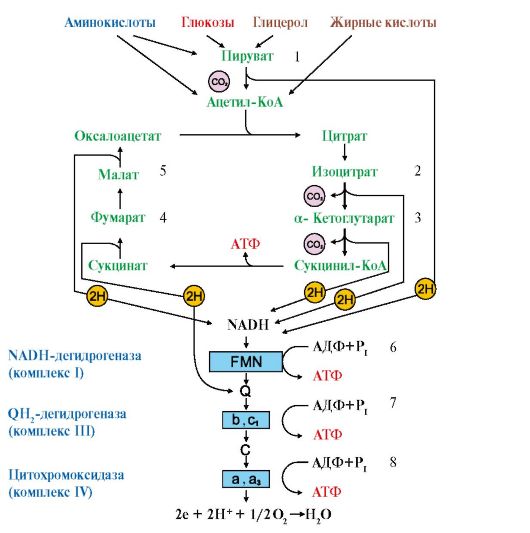 Рис. 5.13. Связь реакций общего пути катаболизма с ЦПЭ:
Рис. 5.13. Связь реакций общего пути катаболизма с ЦПЭ:
1-5 - первичные доноры водорода для ЦПЭ; 1, 2, 3, 5 - субстраты NAD-зависимых дегидрогеназ; 4 - субстрат FAD-зависимой сукцинатдегидрогеназы; 6, 7, 8 - этапы сопряжения дыхания и окислительного фосфорилирования
Окислительное декарбоксилирование пирувата
1. Первая реакция ОПК - реакция окислительного декарбоксилирования пирувата описывается следующим суммарным уравнением (рис. 5.14).
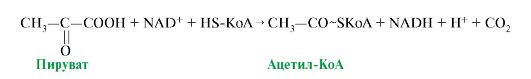 Рис. 5.14. Суммарное уравнение окислительного декарбоксилирования пирувата
Рис. 5.14. Суммарное уравнение окислительного декарбоксилирования пирувата
Эту реакцию катализирует сложно организованный пируватдегидрогеназный комплекс (ПДК).
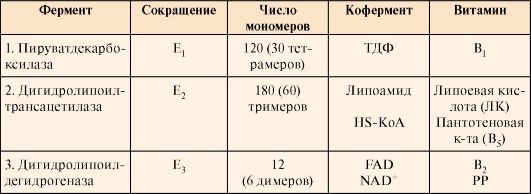
1. Пируватдегидрогеназный комплекс (ПДК) состоит из трех типов каталитических протомеров, образующих три фермента: Е1 - пируватдекарбоксилазу, Е2 - дигидролипоилтрансацетилазу и Е3 - дигидролипоилдегидрогена-
зу. Каждый фермент содержит разное количество протомеров. Протомеры каждого из трех ферментов содержат в своем составе прочно связанные с белками коферменты (табл. 5.2). Коферменты NAD+и HS-KoA включаются в состав комплекса только в момент реакций и освобождаются при завершении процесса в составе конечных продуктов - Ацетил-КоА и NADH + H+.
Таблица 5.3. Пируватдегидрогеназный комплекс (ПДК) млекопитающих
 Все
ферменты, входящие в состав комплекса, располагаются в пространстве
таким образом, что обеспечивают одновременное протекание однотипных
реакций в нескольких местах комплекса. Промежуточные метаболиты
передаются от одного активного центра к другому, что делает работу
ферментного комплекса максимально эффективной (рис. 5.15). В состав
комплекса входят также регуляторные протомеры: киназа и фосфатаза ПДК,
роль которых рассматривается в теме 5.11 (см. рис. 5.22).
Все
ферменты, входящие в состав комплекса, располагаются в пространстве
таким образом, что обеспечивают одновременное протекание однотипных
реакций в нескольких местах комплекса. Промежуточные метаболиты
передаются от одного активного центра к другому, что делает работу
ферментного комплекса максимально эффективной (рис. 5.15). В состав
комплекса входят также регуляторные протомеры: киназа и фосфатаза ПДК,
роль которых рассматривается в теме 5.11 (см. рис. 5.22).
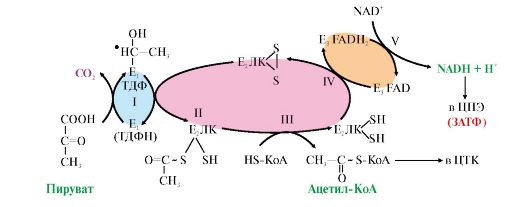 Рис. 5.15. Окислительное декарбоксилирование пировиноградной кислоты.
Рис. 5.15. Окислительное декарбоксилирование пировиноградной кислоты.
Каждый фермент, входящий в ПДК, катализирует определенный этап реакции: I - Е1 - пируватдекарбоксилаза катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ с образованием гидроксиэтила; II - Е2 - дигидролипоилтрансацетилаза катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на амид липоевой кислоты; III - ацетилированная трансацетилаза взаимодействует с HS-КоА с образованием восстановленной формы липоамида и ацетил-КоА; IV - восстановленная форма трансацетилазы дегидрируется дигидролипоилдегидрогеназой (Е3), содержащей FAD; V - FADH2 в составе Е3 дегидрируется при участии NAD+. В реакциях, катализируемых ПДК, липоевая кислота, связанная в ферменте Е2 с остатками лизина, функционирует как «поворотный кронштейн», переносящий атомы водорода и ацетильные остатки от одного фермента к другому
2. Ацетил-КоА, образовавшийся в реакции, катализируемой ПДК, далее вступает в цитратный цикл (рис. 5.16).
Цитратный цикл [цикл трикарбоновых кислот (ЦТК), цикл Кребса] - основной источник доноров водорода для ЦПЭ. Этот метаболический путь состоит из реакций, в результате которых ацетильный остаток ацетил-КоА окисляется до CO2 и Н2О. В ацетил-КоА связь между атомами углерода устойчива к окислению; включаясь в цитратный цикл, ацетильный остаток перестраивается и в конечном итоге,углерод ацетильной группы окисляется до двух молекул CO2, а атомы водорода, освобождающиеся в реакциях дегидрирования, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ.
• Первая реакция цикла представляет собой конденсацию оксалоацетата с ацетил-КоА, катализируемую цитратсинтазой (рис. 5.17). В этой реакции выделяется большое количество энергии (AG = -8 ккал/моль), что сдвигает равновесие в сторону образования цитрата и определяет дальнейшее направление реакций ЦТК. На образование цитрата в каждом обороте цикла затрачивается одна молекула оксалоацетата; по завершении цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков, выполняя функцию своеобразного катализатора цикла.
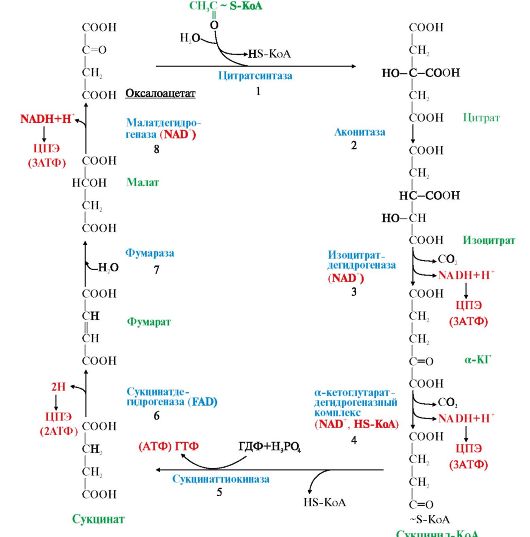 Рис. 5.16. Цитратный цикл.
Рис. 5.16. Цитратный цикл.
Цифры 1-8 обозначают реакции одного оборота цикла. На каждую молекулу NADH (реакции 3, 4, 8) в ЦПЭ синтезируется 3 молекулы АТФ; на каждую молекулу FADH2 (реакция 6) - 2 молекулы АТФ. Таким образом, каждый оборот цикла сопровождается синтезом 11молекул АТФ путем окислительного фосфорилирования; 1 молекула АТФ образуется за счет субстратного фосфорилирования (реакция 5)
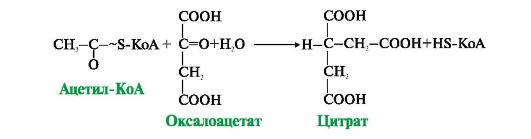 Рис. 5.17. Образование цитрата при участии цитратсинтазы
Рис. 5.17. Образование цитрата при участии цитратсинтазы
• В одном обороте цикла, включающем 8 реакций, происходят 2 реакции декарбоксилирования с образованием 2 молекул CO2 . В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NADH и 1 молекулы FADH2 в составе сукцинатдегидрогеназы.
• Ацетильный остаток ацетил-КоА (С2) полностью окисляется в ЦТК, в результате чего в ЦПЭ синтезируется 11 молекул АТФ путем окислительного фосфорилирования (рис. 5.16).
• Одна молекула АТФ в ЦТК синтезируется путем субстратного фосфорилирования (рис. 5.18).
 Рис. 5.18. Субстратное фосфорилирование ГДФ
Рис. 5.18. Субстратное фосфорилирование ГДФ
В этой реакции донором энергии для синтеза ГТФ является молекула субстрата, поэтому такой способ синтеза ГТФ называется субстратным фосфорилированием. ГТФ и АТФ являются энергетическими эквивалентами.Энергия ГТФ может трансформироваться в энергию АТФ при участии нуклеозиддифосфаткиназы:
 Следовательно,
суммарный выход АТФ при окислении 1 молекулы ацетил-КоА составляет 12
молекул; из них 11 молекул образуется путем окислительного
фосфорилирования и 1 путем субстратного.
Следовательно,
суммарный выход АТФ при окислении 1 молекулы ацетил-КоА составляет 12
молекул; из них 11 молекул образуется путем окислительного
фосфорилирования и 1 путем субстратного.
ТЕМА 5.10. АНАБОЛИЧЕСКИЕ ФУНКЦИИ ОБЩЕГО ПУТИ КАТАБОЛИЗМА (ОПК)
1. Метаболиты ОПК служат предшественниками в синтезе ряда веществ в организме: аминокислот, глюкозы, жирных кислот и других соединений (рис. 5.19).
2. Убыль метаболитов цитратного цикла восполняется с помощью анаплеротических («пополняющих») реакций, главной из которых является реакция карбоксилирования пирувата.

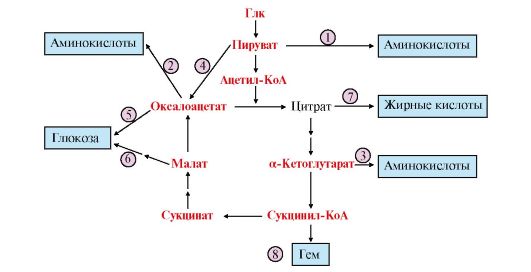 Рис. 5.19. Использование метаболитов ОПК в синтезе различных соединений:
Рис. 5.19. Использование метаболитов ОПК в синтезе различных соединений:
1, 2, 3 - заменимых аминокислот; 4, 5, 6 - глюкозы; 7 - жирных кислот; 8 - гема
3. Метаболиты цитратного цикла не только используются как субстраты для синтеза АТФ и углеродного скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ.
Например, малат, образовавшийся в ЦТК, может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик фермент), катализирующая реакцию окислительного декарбоксилирования малата (рис. 5.20).
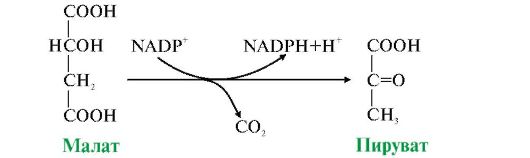 Рис. 5.20. Реакция, катализируемая малик ферментом
Рис. 5.20. Реакция, катализируемая малик ферментом
Эта реакция служит одним из важнейших, хотя не единственным источником NADPH, который образуется также в окислительных реакциях пентозофосфатного пути окисления глюкозы (модуль 6).
ТЕМА 5.11. РЕГУЛЯЦИЯ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА
1. Синтез АТФ в клетке регулируется потребностью в энергии, что достигается согласованной регуляцией скоростей реакций ЦПЭ и ОПК. Основными сигналами о состоянии энергетического обмена служат уровень АТФ и АДФ, NAD+ и NADH Общий фонд этих метаболитов в клетке относительно
постоянен. Таким образом, если увеличивается потребление АТФ и его концентрация снижается, концентрация АДФ возрастает. Подобно этому снижение концентрации NADH сопровождается повышением концентрации NAD+, что приводит к увеличению скорости реакций, катализируемых NAD-зависимыми ферментами, и к увеличению скорости общего пути катаболизма в целом (рис. 5.21).
2. Увеличение концентрации АДФ при повышении физиологической активности ускоряет окисление NADFI в ЦПЭ (дыхательный контроль) и приводит к увеличению скорости синтеза АТФ.
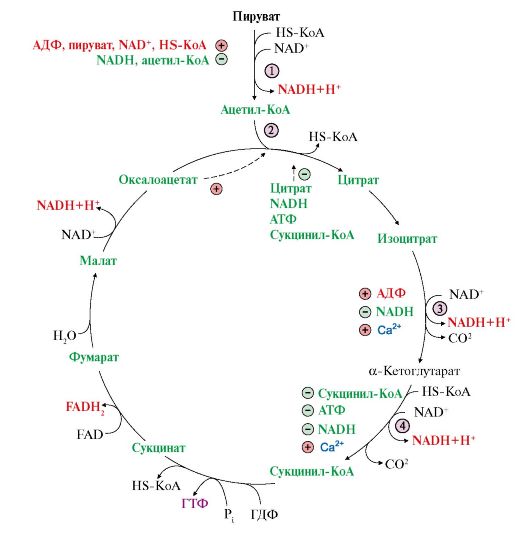 Рис. 5.21. Регуляция общего пути катаболизма.
Рис. 5.21. Регуляция общего пути катаболизма.
Скорость ОПК регулируется на уровне четырех регуляторных реакций, катализируемых: 1-пируватдегидрогеназным комплексом; 2-цитратсинтазой; 3-изоцитратдегидрогеназой; 4-а-кетоглутаратдегидрогеназным комплексом
3. Кроме того, АДФ аллостерически активирует некоторые ферменты ОПК
(пируватдегидрогеназный комплекс, изоцитратдегидрогеназу). Такая согласованная регуляция ЦПЭ и ОПК приводит к тому, что вместо использованных молекул АТФ синтезируется адекватное количество новых; чем больше использовано АТФ, тем больше его синтезируется.
4. Скорость ОПК регулируется на уровне четырех регуляторных реакций, катализируемых:
• пируватдегидрогеназным комплексом;
• цитратсинтазой;
• изоцитратдегидрогеназой (самая медленная реакция цитратного цикла);
• α-кетоглутаратдегидрогеназным комплексом.
5. Регуляция пируватдегидрогеназного комплекса (рис. 5.22).
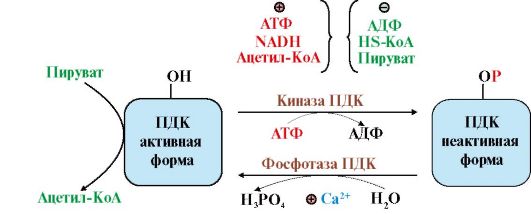 Рис. 5.22. Регуляция пируватдегидрогеназного комплекса.
Рис. 5.22. Регуляция пируватдегидрогеназного комплекса.
В составе ПДК содержатся две регуляторные субъединицы - киназа и фосфатаза. В результате фосфорилирования под действием киназы ПДК переходит в неактивную форму, при дефосфорилировании фосфатазой - активируется. Киназа и фосфатаза, в свою очередь, регулируются аллостерически. Киназа ПДК аллостерически активируется NADH, ацетил-КоА и АТФ и ингибируется пируватом, AДФ, HS-KoA, Ca2. Фосфатаза активируется Са2+
В составе ПДК содержатся две регуляторные субъединицы - киназа и фосфатаза. В результате фосфорилирования под действием киназы ПДК переходит в неактивную форму, при дефосфорилировании фосфатазой - активируется. Киназа и фосфатаза, в свою очередь, регулируются аллостерически. Киназа ПДК аллостерически активируется NADH, ацетил-КоА и АТФ и ингибируется пируватом, AДФ, HS-KoA, Ca2+. В абсорбтивный период глюкоза поступает в клетки и распадается с образованием пирувата. Высокая концентрация пирувата влияет на активность ПДК двумя способами:
- поддерживает ПДК в дефосфорилированной активной форме, так как пируват наиболее сильный ингибитор киназы ПДК;
- пируват аллостерически активирует дефосфорилированную активную форму ПДК, действуя согласованно с другими активаторами - субстратами реакций - NAD+ и HS-KoA. В результате создаются условия для образования ацетил-КоА из глюкозы. В печени ацетил-КоА используется для синтеза жирных кислот.
• В адипоцитах под влиянием инсулина увеличивается концентрация Са2+ в митохондриях, что активирует фосфатазу пируватдегидрогеназного комплекса и переводит его в активное дефосфорилированное состояние. В результате создаются условия для превращений: пируват - ацетил-КоА - жирные кислоты - жиры (основная форма запасания энергии в организме).
• Регуляция ионами Са2+ особенно важна в мышцах. Потенциал действия увеличивает концентрацию Са2+ в митохондриях, что одновременно ингибирует киназу и активирует фосфатазу; это быстро переводит ПДК в активную дефосфорилированную форму. Одновременно Са2+ активирует регуляторные ферменты ЦТК и ацетил-КоА быстро окисляется, обеспечивая синтез АТФ для мышц.
• Цитратсинтаза не является аллостерическим ферментом. Активность фермента регулируется, главным образом, концентрациями оксалоацетата - субстрата фермента и цитрата - продукта реакции (см. рис. 5.21). Когда отношение NADH-NAD+ снижается, ускоряется превращение малата в оксалоацетат и увеличивается скорость образования цитрата; при повышении концентрации цитрата скорость его синтеза соответственно снижается.
• Изоцитратдегидрогеназа - самый медленный фермент ЦТК. Фермент аллостерически активируется АДФ и Са2+. Кроме того, активность изоцитратдегидрогеназы зависит от величины отношения NADH-NAD+, как у всех NAD-зависимых дегидрогеназ (см. рис. 5.21).
• α-Кетоглутаратдегидрогеназный комплекс по структуре и функциям сходен с ПДК. В его состав входят 3 ферментных комплекса: α-кетоглутаратдекарбоксилаза, дигидролипоилтранссукцинилаза и дигидролипоилдегидрогеназа. Набор коферментов аналогичен таковому в ПДК. Однако в отличие от ПДК в этом комплексе отсутствуют регуляторные протомеры. Активность фермента зависит от концентраций АТФ и АДФ, NAD+ и NADH, ингибируется сукцинил-КоА и активируется Са2+ (рис. 5.21).
ТЕМА 5.12. ГИПОЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ
1. Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические». Причинами гипоэнергетических состояний могут быть: голодание, гиповитаминозы В1, РР, В2 гипоксия. Гипоксия может возникать:
• при недостатке кислорода во вдыхаемом воздухе;
• при заболеваниях легких и нарушении легочной вентиляции;
• при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей.
• наследственные или приобретенные нарушения структуры гемоглобина (гемоглобинопатии);
• нарушения процессов использования кислорода в клетках (тканевая гипоксия).
Причинами тканевой гипоксии могут быть:
• действие ингибиторов и разобщителей в ЦПЭ;
• железодефицитные анемии;
• снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушается перенос электронов и синтез АТФ;
• наследственные дефекты ферментов ЦПЭ и цитратного цикла.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Определите количество моль АТФ, синтезируемое за счет окисления 1 моль пирувата.
Для этого:
а) напишите суммарное уравнение окислительного декарбоксилирования пирувата, назовите ферменты и коферменты ПДК;
б) используя схему ЦПЭ, покажите путь водорода от пирувата до кислорода;
в) напишите определение коэффициента окислительного фосфорилирования и рассчитайте его для данной реакции.
2. Перенесите в тетрадь рис. 5.16, укажите номера реакций:
а) дегидрирования;
б) субстратного фосфорилирования;
в) декарбоксилирования;
г) происходящих с использованием коферментов, производных витаминов В1, В2, РР.
3. Используя схему связи общего пути катаболизма с ЦПЭ (см. рис. 5.13), проследите путь водорода от окисляемых субстратов к кислороду и оцените выход АТФ для отдельных реакций и общего пути катаболизма в целом.
4. В уравнение окислительного декарбоксилирования пирувата подставьте соответствующие стехиометрические коэффициенты.
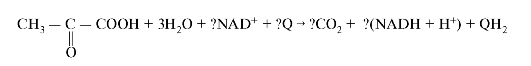 Для этого:
Для этого:
а) найдите на рис. 5.13 реакции, в которых происходит декарбоксилирование, напишите эти реакции формулами;
б) реакции дегидрирования и напишите эти реакции; определите коэффициенты Р/О для каждой из них;
в) изобразите схему ЦПЭ и отметьте компоненты цепи, на которые поступает водород от первичных доноров; определите коэффициенты Р/О для каждой из них.
5. Изучите схему регуляции ОПК (рис. 5.21) и заполните табл. 5.4.
Таблица 5.4. Регуляции ОПК
 6. При
добавлении к суспензии митохондрий малоновой кислоты, структурного
аналога сукцината, происходило резкое снижение поглощения клетками
кислорода. Добавление цитрата не влияло на потребление кислорода, в то
время как добавление фумарата оказывало стимулирующий эффект. Объясните
результаты эксперимента. Для этого:
6. При
добавлении к суспензии митохондрий малоновой кислоты, структурного
аналога сукцината, происходило резкое снижение поглощения клетками
кислорода. Добавление цитрата не влияло на потребление кислорода, в то
время как добавление фумарата оказывало стимулирующий эффект. Объясните
результаты эксперимента. Для этого:
а) найдите на схеме ЦТК реакцию, которая ингибируется малонатом и запишите ее;
б) проследите по схеме цитратного цикла пути превращений фумарата и цитрата и объясните, как повлияет присутствие малоната на эти реакции.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Подберите ферменты к соответствующим реакциям:
 2. Установите соответствие.
2. Установите соответствие.
Фермент:
A. Фумараза
Б. Цитратсинтаза
B. Сукцинаттиокиназа
Г. Изоцитратдегидрогеназа Д. Малатдегидрогеназа Реакция:
1. Оксалоацетат + Ацетил-КоА + Н2О - Цитрат + HS-KoA
2. Изоцитрат + NAD+ - α-Кетоглутарат + СО2 + NADH + Н+
3. Сукцинил-КоА + ГДФ + Н3РО4 - Сукцинат + ГТФ + HS-KoA
3. Установите соответствие.
Фермент:
A. Сукцинатдегидрогеназа Б. Изоцитратдегидрогеназа
B. NADH-дегидрогеназа Г. Пируватдекарбоксилаза Д. Пируваткарбоксилаза
Кофермент:
1. FAD
2. ТДФ
3. FMN
4. Выполните «цепное» задание:
а) реакцию образования ацетил-КоА из пирувата катализирует:
A. Пируватдегидрогеназный комплекс
Б. α-Кетоглутаратдегидрогеназный комплекс
B. Ацетил-КоА карбоксилаза
б) этот комплекс содержит в своем составе:
A. Пируватдекарбоксилазу Б. NADH-дегидрогеназу
B. АТФ-синтазу
Г. Пируваткарбоксилазу
в) коферментом этого фермента является:
A. HS-KoA Б. NAD+
B. ТДФ Г. FMN Д. FAD
г) этот кофермент участвует в переносе ацетильного остатка на:
A. Липоевую кислоту
Б. Дигидролипоилдегидрогеназу
B. HS-KoA Г. ТДФ
д) при взаимодействии этого соединения с коферментом А образуется:
A. Пируват
Б. Оксалоацетат
B. Ацетил-КоА Г. Цитрат
Д. Сукцинил-КоА
5. Выберите правильные ответы.
К тканевым формам гипоэнергетических состояний относятся:
A. Недостаток О2 во вдыхаемом воздухе Б. Гиповитаминозы витаминов В1, В2, РР
B. Нарушение кровообращения
Г. Действие разобщителей дыхания и фосфорилирования Д. Железодефицитные анемии
6. Выберите правильные ответы.
Скорость реакций ОПК снижается при недостатке витаминов:
A. Тиамин
Б. Пиридоксин
B. Пантотеновая кислота Г. Никотинамид
Д. Рибофлавин
7. Установите соответствие.
Кофермент:
A. HS-КоА Б. Липоамид
B. ТДФ
Г. FAD
Д. NAD+
Витамин:
1. Тиамин (В1)
2. Рибофлавин (В2)
3. Пантотеновая кислота (В5)
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-А, 2-В, 3-Г
2. 1-Б, 2-Г, 3-В
3. 1-А; 2-Г; 3-В
4. а) А, б) А, в) В, г) А, д) В
5. Б, Г, Д
6. А, В, Г, Д
7. 1-В, 2-Г, 3-А
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Специфические пути катаболизма
2. Общий путь катаболизма
3. Окислительное декарбоксилирование пирувата
4. Цикл трикарбоновых кислот
5. Субстратное фосфорилирование
6. Анаболические функции ОПК
7. Анаплеротические реакции ОПК
8. Регуляторные ферменты ОПК
9. Терморегуляторная функция тканевого дыхания
10. Гипоэнергетические состояния
11. Тканевая гипоксия
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Глутамат легко образуется из α-КГ путем аминирования:
α-КГ + NH3 + NADH + H+ →Глу + NAD+.
Определите, сколько молекул пирувата, требуется затратить на синтез одной молекулы глутамата, чтобы концентрация метаболитов цитратного цикла оставалась постоянной.
Алгоритм решения задачи:
а) используя схему ОПК (рис. 5.19), определите, какие соединения должны образоваться из пирувата, чтобы «запустить» цитратный цикл;
б) напишите реакции превращения пирувата в эти соединения, составьте схему их превращений до образования α-КГ;
в) проведите необходимые расчеты, учитывая, что оксалоацетат должен быть в избытке, чтобы цитратный цикл не прерывался.
2. Синтез гема происходит в ретикулоцитах. Для синтеза одного пиррольного кольца используются две молекулы глицина и две молекулы сукцинил-КоА. Рассчитайте, сколько молекул пирувата необходимо затратить для синтеза одной молекулы гема, чтобы концентрация метаболитов цитратного цикла оставалась постоянной.
Решите задачу, предварительно составив алгоритм решения по образцу предыдущей.
3. В суспензию митохондрий добавили 2 ммоль цитрата и 2 ммоль АДФ. Скорость окисления субстрата измеряли по поглощению кислорода. Через некоторое время реакция прекратилась. Почему?
Для решения задачи:
а) напишите реакции превращения цитрата в ЦТК до образования α-КГ;
б) определите, какой этап этих превращений сопряжен с поглощением кислорода и использованием АДФ; назовите окисляемый субстрат;
в) представьте в виде схемы ЦПЭ путь водорода от окисляемого субстрата к кислороду; определите коэффициент Р/О.
г) проведите необходимые расчеты и ответьте на вопросы:
1. Сколько ммоль субстрата осталось неокисленным?
2. Какое вещество (или вещества) можно добавить, чтобы реакция возобновилась?
4. У пациента выявлен генетический дефект пируваткарбоксилазы.
К каким последствиям это может привести? Для решения задачи:
а) напишите реакцию, катализируемую этим ферментом;
б) используя рис. 5.19, выпишите названия метаболических путей, в которых используется продукт этой реакции;
в) сделайте выводы о последствиях нарушений этих процессов.
5. Митохондриальная ДНК кодирует 13 субъединиц белковых комплексов, участвующих в ЦПЭ: 7 из 42 субъединиц комплекса I, 1 из 11 субъединиц комплекса III, 3 из 13 субъединиц комплекса IV и 2 субъединицы АТФ-синтазы. Мутации в митохондриальной ДНК приводят к возникновению наследственных заболеваний, которые наследуются по материнской линии, так как митохондриальная ДНК передается с цитоплазмой яйцеклеток. Характерными клиническими признаками заболеваний являются: мышечная слабость, миокардиопатия, задержка умственного развития у детей. Как объяснить возникновение указанных симптомов? Для ответа на вопрос:
• нарисуйте схему ЦПЭ и укажите этапы, которые нарушаются при мутациях митохондриальной ДНК;
• напишите реакции ОПК, катализируемые регуляторными ферментами; опишите механизы их регуляции и объясните причины снижения активности ферментов при нарушении работы дыхательной цепи;
• почему при описанных заболеваниях в первую очередь нарушается метаболизм в мышечной и нервной тканях?
6. Апоптоз - это запрограммированная гибель клеток. При некоторых патологических состояниях (вирусные инфекции, радиация, действие химических веществ, являющихся оксидантами) может происходить преждевременная гибель клеток. В организме человека вырабатываются защитные белки, предотвращающие преждевременный апоптоз. Одним из них является белок Bcl-2, который увеличивает отношение NADH-NAD+ и ингибирует освобождение Са2+ из ЭПР. В настоящее время известно, что вирус СПИДа содержит протеазу, разрушающую Bcl-2. Скорость каких реакций при этом меняется и почему?
Для ответа на вопрос:
• нарисуйте схему процесса, скорость которого регулируется отношением NADH/ NAD+;
• назовите регуляторные ферменты, опишите их строение и роль в энергетическом обмене;
• объясните, как изменится скорость этих реакций при разрушении Bcl-2;
• объясните, почему эти изменения могут оказаться губительными для клеток.