Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 3 МАТРИЧНЫЕ БИОСИНТЕЗЫ
Структура модуля | Тема |
Модульная единица 1 | 3.1. Строение и функции ДНК и РНК 3.2. Биосинтез ДНК (репликация) 3.3. Репарация ошибок и повреждений ДНК 3.4. Биосинтез РНК (транскрипция). Посттранскрипционные модификации РНК |
Модульная единица 2 | 3.5. Трансляция как механизм перевода генетической информации в фенотипические признаки 3.6. Ингибиторы матричных биосинтезов: лекарственные препараты, яды и бактериальные токсины 3.7. Механизмы адаптивной регуляции активности генов у прокариотов и эукариотов |
Модульная единица 3 | 3.8. Механизмы, обеспечивающие разнообразие белков у эукариотов 3.9. Механизмы генетической изменчивости: эволюционная изменчивость, полиморфизм белков. Наследственные болезни 3.10. Использование рекомбинантных ДНК в медицине |
Модульная единица 1 БИОСИНТЕЗ ДНК И РНК. РЕПАРАЦИЯ ОШИБОК И ПОВРЕЖДЕНИЙ ДНК
Цели изучения Уметь:
1. Использовать знания о биосинтезе ДНК и РНК для понимания процессов роста и развития организма.
2. Интерпретировать сведения о работе репарирующих ферментов как об основе устойчивости генетического материала к повреждающим воздействиям внешней и внутренней среды.
3. Объяснять, что снижение эффективности репарации сопровождается накоплением ошибок в геноме и является причиной онкологических болезней и старения.
Знать:
1. Строение и функции ДНК и разных видов РНК.
2. Механизмы репликации и репарации ДНК.
3. Синтез и посттранскрипционные модификации разных видов РНК.
ТЕМА 3.1. СТРОЕНИЕ И ФУНКЦИИ ДНК И РНК
1. ДНК и РНК представляют собой линейные полимеры, построенные из нуклеотидов. Каждый нуклеотид состоит из трех компонентов: азотистого основания, являющегося производным пурина или пиримидина, пентозы (рибозы или дезоксирибозы) и остатка фосфорной кислоты. В состав любой из нуклеиновых кислот входят два производных пурина (аденин, гуанин) и два производных пиримидина: в РНК - цитозин и урацил, а в ДНК - цитозин и тимин (табл. 3.1 и 3.2).
Таблица 3.1. Строение нуклеотидов РНК
Азотистое основание | Пентоза | Нуклеозид | Нуклеотид | Однобуквенный код |
Аденин | Рибоза | Аденозин | Аденозинмонофосфат (АМФ) | А |
Гуанин | Рибоза | Гуанозин | Гуанозинмонофосфат (ГМФ) | G |
Урацил | Рибоза | Уридин | Уридинмонофосфат (УМФ) | U |
Цитозин | Рибоза | Цитидин | Цитидинмонофосфат (ЦМФ) | С |
Таблица 3.2. Строение нуклеотидов ДНК
Азотистое основание | Пентоза | Нуклеозид | Нуклеотид | Однобуквенный код |
Аденин | Дезоксирибоза | д-Аденозин | Дезоксиаденозинмонофосфат (дАМФ) | А |
Гуанин | Дезоксирибоза | д-Гуанозин | Дезоксигуанозинмонофосфат (дГМФ) | G |
Цитозин | Дезоксирибоза | д-Цитидин | Дезоксицитидинмонофосфат (дЦМФ) | С |
Тимин | Дезоксирибоза | д-Тимидин | Дезокситимидинмонофосфат (дТМФ) | Т |
Первичная структура нуклеиновых кислот (НК) - это порядок чередования нуклеотидов в полинуклеотидной цепи, связанных между собой 3',5'-фосфодиэфирной связью. Образующиеся полимеры имеют фосфатный остаток на 5'-конце и свободную -ОН-группу пентозы на 3'-конце (рис. 3.1). Штрихами обозначают углеродные атомы пентозы для того, чтобы отличать их от атомов, входящих в азотистые основания.
Для краткого изображения последовательности нуклеотидов в нуклеиновых кислотах пользуются однобуквенным кодом. При этом запись осуществляют слева направо таким образом, что первый нуклеотид имеет свободный 5'-фосфатный конец, а последний -ОН-группу в 3'-положении рибозы или дезоксирибозы.
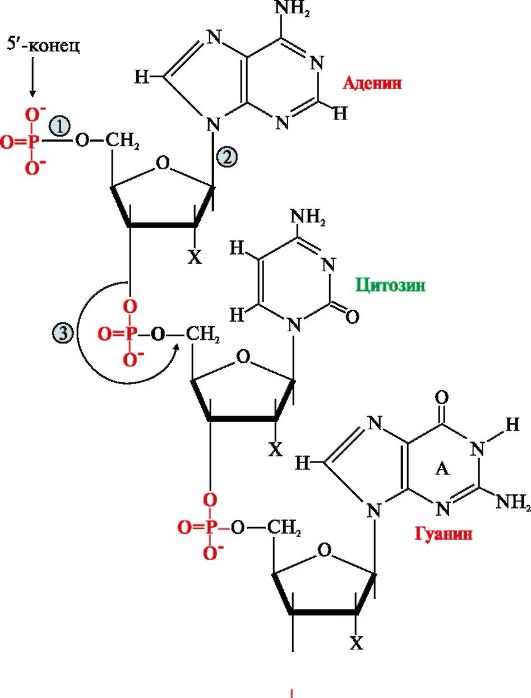
Рис. 3.1. Первичная структура нуклеиновых кислот.
Х = Н для ДНК, Х = ОН для РНК Связи в молекуле нуклеиновых кислот:
1 - 5'-фосфоэфирная; 2 - N-гликозидная; 3 - 3' ,5'-фосфодиэфирная
2. Пространственная структура ДНК. Вторичная структура представляет собой правозакрученную спираль (рис. 3.2), в которой две полинуклеотидные цепи расположены антипараллельно и удерживаются относительно друг друга за счет водородных связей между комплементарными азотистыми основаниями: А = Т и G = С.
Цепи молекулы ДНК не идентичны, но комплементарны друг другу: если известна первичная структура одной цепи, то последовательность нуклеотидов другой цепи задается правилом комплементарности оснований: Т одной цепи соответствует А, а С - G в другой цепи. Поэтому в молекуле ДНК количество адениловых нуклеотидов равно количеству тимидиловых нуклеотидов (А = Т), а количество гуаниловых равно количеству цитидиловых нуклеотидов (G = С). Соотношение А + Т / G + С - величина постоянная и является видоспецифической характеристикой организма. Основания нуклеотидов обращены внутрь молекулы и лежат в одной плоскости, которая практически перпендикулярна оси спирали. Между основаниями,
расположенными друг под другом, возникают гидрофобные взаимодействия. Дезоксирибозофосфатные остатки образуют остов спирали. На один виток спирали приходится 10 нуклеотидных пар.
Третичная структура ДНК формируется в результате ее взаимодействия с белками. Каждая молекула ДНК упакована в отдельную хромосому, в составе которой разнообразные белки связываются с отдельными участками ДНК и обеспечивают суперспирализацию и компактизацию молекулы. В период покоя комплексы ДНК с белками распределены равномерно по объему ядра, образуя хроматин. Белки хроматина включают две группы: гистоны и негистоновые белки.
Гистоны - небольшие белки с молекулярной массой от 11 000 до 22 000 Д и высоким содержанием лизина и аргинина. Четыре типа гистонов в количестве восьми молекул (по две каждого вида) образуют комплекс - нуклеосомный кор. Этот комплекс за счет ионных связей взаимодействует с отрицательно заряженными фосфатными группами участка ДНК длиной около 146 нуклеотидных пар (примерно 1,75 витка вокруг кора) и образует структуру, называемую нуклеосомой. Между нуклеосома-
ми находятся участки ДНК длиной около 30 нуклеотидных пар - линкерные участки, к которым присоединяются молекулы гистона Н1 (рис. 3.3).
Негистоновые белки представлены множеством ферментов и белков, участвующих в синтезе ДНК, РНК, регуляции этих процессов и компактизации
ДНК.
3. Пространственная структура РНК. В клетке существует три вида РНК: рибосомная (рРНК), транспортная (тРНК) и матричная (мРНК), каждая из которых выполняет свою особую функцию в синтезе белка.
Вторичная структура РНК формируется в результате спирализации отдельных участков одноцепочечной РНК. В спирализованных участках, или шпильках, между комплементарными парами азотистых оснований А и U, G и С возникают водородные связи. Двуцепочечные фрагменты чередуются с неспирализованными участками молекулы, образующими петли.
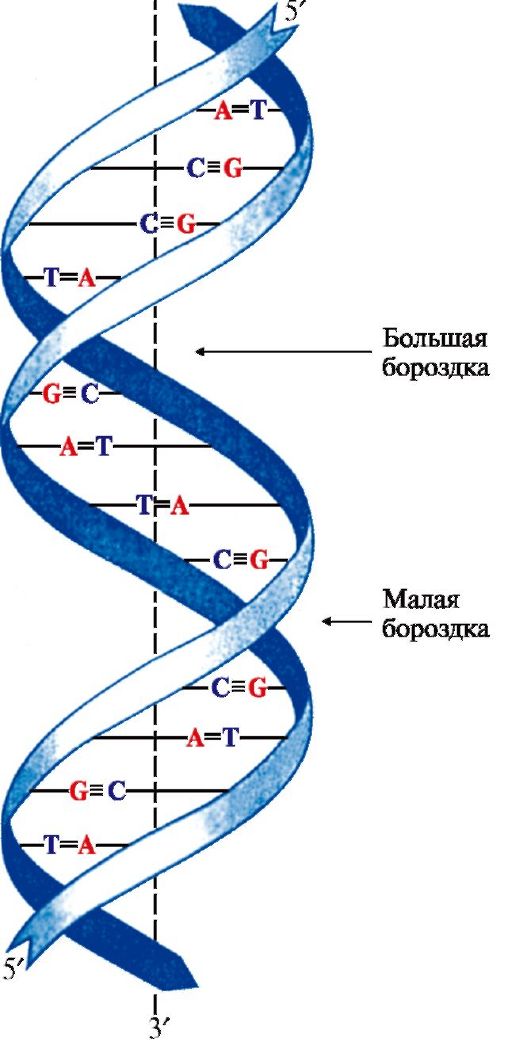 Рис. 3.2. Двойная спираль ДНК.
Рис. 3.2. Двойная спираль ДНК.
Аденин и тимин связывают две, а гуанин и цитозин - три водородные связи
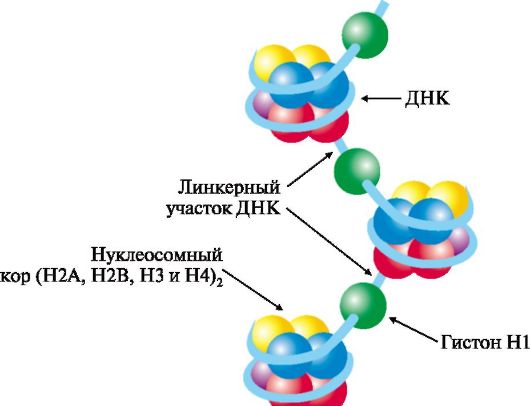 Рис. 3.3. Структура нуклеосом.
Рис. 3.3. Структура нуклеосом.
Восемь молекул гистонов четырех видов (Н2А, Н2В, Н3 и Н4) составляют нуклеосомный кор (ядро), на который наматывается ДНК, образуя примерно два витка
Третичная структура РНК образуется за счет дополнительных водородных связей между нуклеотидами неспирализованных участков, полинуклеотидной цепью рРНК или мРНК и белками, обеспечивает дополнительную компактизацию и стабилизацию пространственной структуры молекулы.
4. Структура молекул ДНК и РНК является видоспецифической характеристикой организмов. Об этом свидетельствуют эксперименты по гибридизации ДНК-ДНК и ДНК-РНК. При нагревании до 80-90°С нуклеиновые кислоты денатурируют с разрушением пространственной структуры, образуя одноцепочечные молекулы. При медленном охлаждении такие молекулы способны восстанавливать двойную спираль и либо приобретать исходную структуру, либо образовывать гибриды: совершенные или несовершенные в зависимости от комплементарности нитей друг другу по всей длине цепей. На этой способности двух образцов ДНК или ДНК и РНК образовывать гибриды в процессе охлаждения после денатурации основан метод молекулярной гибридизации.
Этот метод позволил установить следующие закономерности:
• ДНК всех клеток одного организма идентична, а ДНК разных организмов одного вида обнаруживает очень высокое сходство, обеспечивая образование «совершенных гибридов»;
• ДНК специфична для каждого вида и чем больше филогенетическая дистанция между видами, тем больше различий в строении принадлежащих им ДНК;
• ДНК, выделенная из тканей определенного организма, содержит информацию о структуре всех видов РНК данного организма.
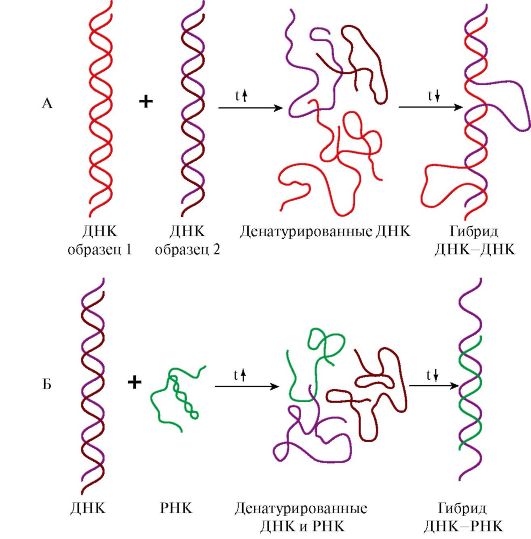 Рис. 3.4. Гибридизация нуклеиновых кислот:
Рис. 3.4. Гибридизация нуклеиновых кислот:
А - гибридизация ДНК-ДНК; Б - гибридизация ДНК-РНК
ТЕМА 3.2. БИОСИНТЕЗ ДНК (РЕПЛИКАЦИЯ)
1. Репликация - матричный процесс. Во время репликации каждая из двух цепей ДНК служит матрицей для образования новой цепи. Субстратами и источниками энергии для синтеза ДНК являются дезоксирибонуклеозидтрифосфаты (дНТФ: дАТФ, дГТФ, дЦТФ, дТТФ).
Процесс включает следующие основные этапы.
I. Формирование репликативной вилки.
II. Синтез новых цепей ДНК.
III. Исключение праймеров. Завершение формирования отстающей цепи
ДНК.
I. Формирование репликативной вилки (рис. 3.5) идет при участии:
ДНК-топоизомеразы, которая является «обратимой нуклеазой». Сначала фермент разрывает 3'-,5'-фосфодиэфирную связь в одной из цепей ДНК
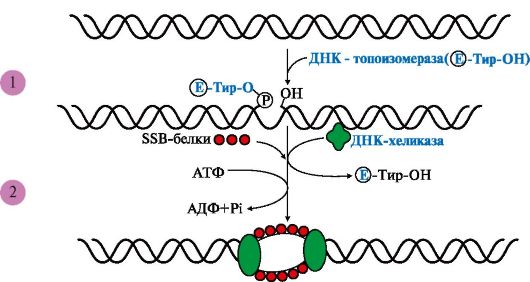 Рис. 3.5 Участие ДНК-топоизомеразы в образовании репликативной вилки.
Рис. 3.5 Участие ДНК-топоизомеразы в образовании репликативной вилки.
1 - фермент расщепляет 3',5'-фосфодиэфирную связь в одной из цепей ДНК и присоединяется к 5'-концу в точке разрыва; 2 - в область разрыва цепи присоединяются две молекулы ДНК-хеликаз и обеспечивают локальное разделение двойной спирали ДНК. ДНК-топоизомераза восстанавливает расщепленную 3',5'-фосфодиэфирную связь и отделяется, а к одноцепочечным участкам присоединяются SSB белки
и присоединяется к 5'-концу в точке разрыва, вызывая сброс суперспиралей ДНК-хроматина. Это облегчает присоединение в область разрыва цепи двух молекул ДНК-хеликаз и образование репликативной вилки. По окончании формирования репликативной вилки ДНК-топоизомераза восстанавливает целостность молекулы ДНК и отделяется;
ДНК-хеликаз - ДНК-зависимых АТФаз, использующих энергию АТФ для расплетения двойной спирали ДНК;
SSB (single strand binding)-белков, связывающихся с одноцепочечными участками ДНК. Эти белки, не закрывая оснований, предотвращают повторное комплементарное скручивание матричных цепей и образование шпилек.
II. Синтез новых цепей ДНК
На этой стадии дочерние нити ДНК образуются на обеих нитях материнской ДНК. Процесс катализирует несколько ДНК-полимераз, которые синтезируют полинуклеотидные цепи из дНТФ: дАТФ, дГТФ, дТТФ и дЦТФ в направлении от 5'- к 3'-концу антипараллельно матрице, имеющей направление от 3'- к 5'-концу (рис. 3.6).
Новые цепи синтезируются по-разному. На матрице ДНК с направлением от 3'- к 5'-концу цепь растет непрерывно по ходу движения репликативной вилки и называется лидирующей. На матрице с направлением от 3'- к 5'-концу вторая цепь синтезируется против движения репликативной вилки в виде коротких отрезков - фрагментов Оказаки. Рост этой цепи начинается только тогда, когда на матрице ДНК появляется одноцепочечный участок длиной около 200 нуклеотидов, поэтому ее называют запаздывающей или отстающей.
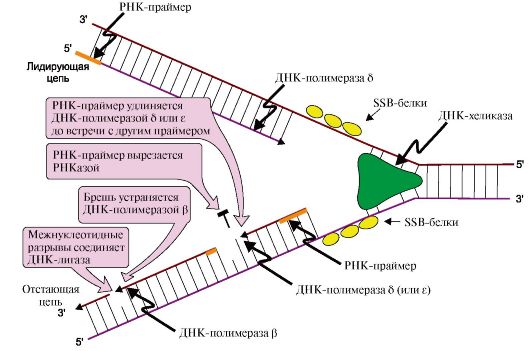 Рис. 3.6. Рост новых цепей в области репликативной вилки.
Рис. 3.6. Рост новых цепей в области репликативной вилки.
Лидирующая нить растет непрерывно, а отстающая - в виде фрагментов Оказаки, каждый из которых включает:
- РНК-праймер ( ~10 нуклеотидов);
- участок ДНК, примерно равный длине цепи из 150 нуклеотидов
ДНК-полимеразы δ, β и ε не способны инициировать синтез новых цепей ДНК, они могут лишь удлинять имеющуюся нуклеотидную цепь. Синтез лидирующей и отстающей нитей начинается с образования затравки или праймера-олигорибонуклеотида (РНК), включающего около 10 мононуклеотидов. Его образование катализирует праймаза - субъединица ДНК-полимеразы α. Далее этот же фермент, используя в качестве субстратов дНТФ, переключается на образование ДНК и включает во вновь синтезируемую нить 20-50 дезоксирибонуклеотидов, после чего заменяется другими ДНК-полимеразами. Синтез лидирующей цепи продолжает ДНК-полимераза δ, а отстающей - ДНК-полимераза δ или ε. Оба фермента, помимо, полимеразной обладают еще и экзонуклеазной активностью. В ходе синтеза они могут исправлять допущенную ошибку и отщеплять неправильно включенный нуклеотид, что обеспечивает высокую точность синтеза ДНК.
III. Исключение праймеров. Завершение формирования отстающей цепи ДНК
В отстающей нити праймер удаляется эндонуклеазой или РНКазой. Затем ДНК-полимераза β заполняет образованную «брешь», присоединяя по принципу комплементарности матрице дезоксирибонуклеотиды в количестве,
равном вырезанному праймеру. Связывание 3'-ОН-группы одного фрагмента с 5'-фосфатом предыдущего фрагмента и образование фосфодиэфирной связи катализирует ДНК-лигаза. Фермент, используя энергию АТФ, из множества фрагментов Оказаки образует непрерывную цепь ДНК.
2. Результатом процесса является образование дочерних цепей, комплементарных и антипараллельных нитям материнской ДНК. Без учета НТФ, участвующих в синтезе праймеров и объединении фрагментов Оказаки, суммарное уравнение синтеза ДНК может быть записано следующим образом:
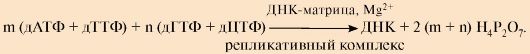 В активном центре всех ДНК- и РНК-полимераз находится ион Zn2+ (кофактор фермента). Для взаимодействия полимераз с субстратами необходимо также присутствие ионов М§2+, которые образуют с нуклеотидами комплексы и повышают их реакционную способность.
В активном центре всех ДНК- и РНК-полимераз находится ион Zn2+ (кофактор фермента). Для взаимодействия полимераз с субстратами необходимо также присутствие ионов М§2+, которые образуют с нуклеотидами комплексы и повышают их реакционную способность.
3. Молекула ДНК человека имеет очень большие размеры, поэтому инициация синтеза ДНК происходит в нескольких точках хромосомы, которые называются точками инициации репликации, или ориджинами («оrigm») репликации (рис. 3.7). Ориджины репликации имеют специфическую нуклеотидную последовательность.
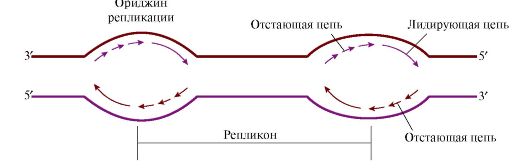 Рис. 3.7. Образование репликативных вилок, перемещающихся в противоположных направлениях от ориджина.
Рис. 3.7. Образование репликативных вилок, перемещающихся в противоположных направлениях от ориджина.
Синтез начинается в области ориджина и идет в противоположных направлениях. В каждом ориджине образуется две репликативные вилки. Процесс полуконсервативный, и каждая дочерняя молекула ДНК получает одну родительскую и одну вновь синтезированную нить
Единица репликации у эукариотов называется репликоном - это участок ДНК между соседними ориджинами. На ориджинах инициируется двунаправленная репликация, т.е. образуются две репликативные вилки, перемещающиеся в противоположных направлениях, до тех пор пока не встретятся со следующим репликоном.
4. По завершении репликации образуется тетраплоидный набор молекул двухспиральной ДНК, каждая из которых содержит одну «материнскую» нить и одну «дочернюю» - вновь синтезированную (полуконсервативный механизм образования новых молекул ДНК). В результате митоза дочерняя клетка получает диплоидный набор хромосом, идентичный материнской клетке. Таким образом, репликация обеспечивает воспроизведение генотипа в новых поколениях.
5. Репликация происходит в S-фазу клеточного цикла. В регуляции клеточного цикла участвуют белки циклины. Различают циклины А, В, D, Е. Циклины являются активаторами циклин-зависимых протеинкиназ, которые в активной форме могут фосфорилировать специфические белки, участвующие в подготовке и продвижении клетки по клеточному циклу. В каждом цикле концентрация циклинов постепенно возрастает от нуля, а затем резко падает опять до нуля.
Таблица 3.3. Циклины, регулирующие прохождение клеточного цикла
Циклин | Функция |
D | Регулируют переход клетки из Gl-фазы в фазу S |
Е, А | Активируют синтез ДНК на начальной стадии S-фазы |
В | Регулируют переход клетки из G2-фазы в М-фазу |
ТЕМА 3.3. РЕПАРАЦИЯ ОШИБОК И ПОВРЕЖДЕНИЙ ДНК
1. Молекула ДНК постоянно подвергается разнообразным изменениям, вызванным действием различных веществ внешней и внутренней среды, радиацией и ультрафиолетовым облучением. Под влиянием этих факторов в структуре ДНК происходит:
• дезаминирование оснований, при котором цитозин превращается в урацил, аденин - в гипоксантин, а гуанин - в ксантин. Чаще всего дезаминируется цитозин;
• депуринизация, или депиримидинизация, результатом которой является появление в ДНК остатков дезоксирибозы, лишенных основания;
• образование под действием ультрафиолета (УФО) пиримидиновых димеров между рядом расположенными в цепи основаниями;
• разрыв нуклеотидных цепей;
• появление ковалентных сшивок между цепями или цепями и гистонами;
• возникновение ошибок репликации;
• образование продуктов алкилирования ДНК (6-метилгуанина, 7-метил- гуанина, 3-метиладенина) под воздействием некоторых химических веществ.
2. Поврежденные основания ДНК обнаруживаются и удаляются ДНК- N-гликозилазами. Ферменты гидролитически расщепляют N-гликозидную связь между поврежденным основанием и остатком дезоксирибозы. Участки на молекуле ДНК, лишенные азотистого основания, получили название АП-сайтов (от англ. «apurinic» - apyrimidinic site). АП-сайты могут также
возникать в результате самопроизвольного гидролитического отщепления пуриновых или пиримидиновых оснований. Дальнейший ход репарации идет по одному из двух путей:
• либо фермент ДНК-инсертаза может присоединять к дезоксирибозе основание в соответствии с правилом комплементарности;
• либо эндонуклеаза определяет место повреждения (если это дезоксирибоза, лишенная основания, то фермент называют АП-эндонуклеазой) и гидролизует 3', 5'-фосфодиэфирную связь (рис. 3.8).
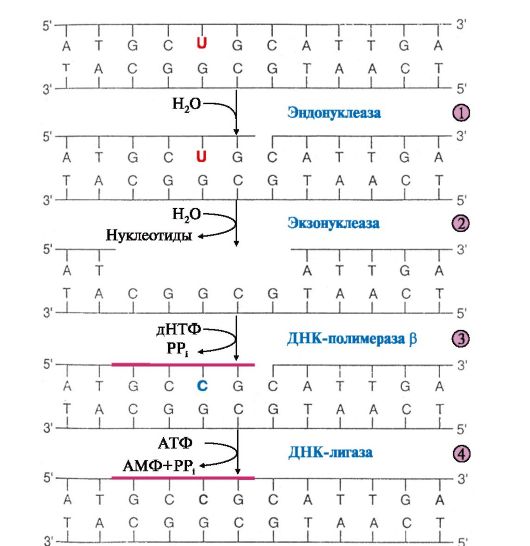 Рис. 3.8. Репарация эукариотической ДНК
Рис. 3.8. Репарация эукариотической ДНК
Экзонуклеаза находит место разрыва цепи и удаляет поврежденный участок. ДНК-полимераза β присоединяется к З'-концу образовавшейся «бреши» и достраивает недостающий участок цепи (ликвидирует «брешь»). Матрицей служит неповрежденная цепь ДНК.
ДНК-лигаза соединяет неповрежденный и вновь синтезированный участки цепи ДНК.
3. Репарация возможна благодаря существованию двух цепей в молекуле ДНК - двух копий генетической информации. Если одновременно повреждается комплементарная пара нуклеотидов, репарация в гаплоидных клетках невозможна, а в диплоидных может идти за счет присутствия идентичного гена в гомологичной хромосоме.
Репарация необходима для сохранения генетического материала на протяжении всей жизни организма (сохранение структуры генома). Все ферменты постоянно активны и процесс идет непрерывно. Снижение активности ферментов репарации приводит к накоплению повреждений (мутаций) в ДНК.
ТЕМА 3.4. БИОСИНТЕЗ РНК (ТРАНСКРИПЦИЯ). ПОСТТРАНСКРИПЦИОННЫЕ МОДИФИКАЦИИ РНК
1. Транскрипцией называется синтез РНК на ДНК-матрице. В результате образуются первичные траскрипты мРНК, тРНК, рРНК, комплементарные матричной цепи ДНК, имеющей направление от 3'-, к 5'-концу. Субстратами и источниками энергии для синтеза РНК являются рибонуклеозидтрифосфаты ( НТФ: АТФ, ГТФ, ЦТФ, УТФ).
Катализируют синтез РНК ферменты РНК-полимеразы. В ядре клеток эукариотов обнаружены три фермента:
• РНК-полимераза I, синтезирующая пре-рРНК;
• РНК-полимераза II, ответственная за синтез пре-мРНК;
• РНК-полимераза III, синтезирующая пре-тРНК.
В основе процесса лежит принцип комплементарности оснований в полинуклеотидной цепи матричной ДНК и синтезируемой РНК, когда против А встает U, против G - С, а против Т - А.
Суммарное уравнение синтеза РНК можно представить следующим образом:
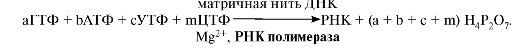 2. Специфическая
последовательность ДНК (сайт), в которой РНК-полимераза связывается с
матрицей и начинает синтез РНК, называется промотором, а последовательность, на которой завершается синтез РНК, - сайтом терминации. Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции - транскриптон. У эукариотов в состав транскриптона, как правило, входит только один ген.
2. Специфическая
последовательность ДНК (сайт), в которой РНК-полимераза связывается с
матрицей и начинает синтез РНК, называется промотором, а последовательность, на которой завершается синтез РНК, - сайтом терминации. Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции - транскриптон. У эукариотов в состав транскриптона, как правило, входит только один ген.
Существование на молекуле ДНК множества транскриптонов позволяет с разной активностью проводить индивидуальное считывание (транскрипцию) разных генов. РНК-полимеразы - большие, олигомерные ферменты, состоящие из нескольких субъединиц и имеющие несколько центров связывания регуляторных факторов. В процессе транскрипции различают стадии инициации, элонгации и терминации (рис. 3.9).
3. «Активация» промотора происходит с помощью белка, который получил название ТАТА-фактора, потому что он взаимодействует со специфической последовательностью нуклеотидов промотора -ТАТА-. ТАТА-фактор облегчает взаимодействие промотора с РНК-полимеразой. Связывание РНК-полимеразы с промотором увеличивает сродство фермента к факторам инициации (А, В), которые обеспечивают раскручивание примерно одного витка двойной спирали ДНК.
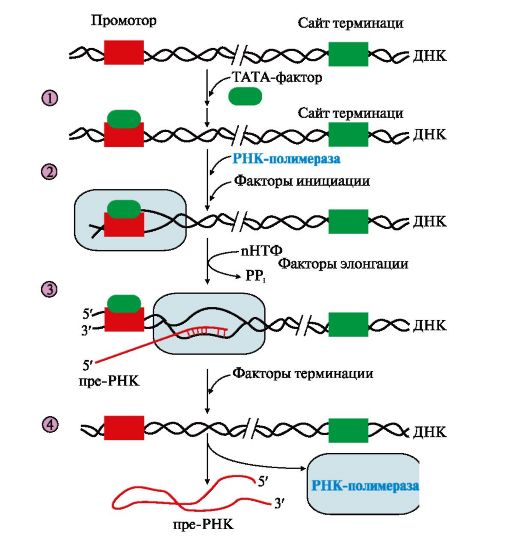 Рис. 3.9. Стадии транскрипции:
Рис. 3.9. Стадии транскрипции:
1 - присоединение в область промотора белка, который называется «ТАТА-фактор»;
2 - включение РНК-полимеразы в промоторный участок, при этом в зоне присоединения РНК-полимеразы происходит локальное расплетение двойной спирали ДНК; 3 - рост нити пре-РНК; 4 - освобождение в сайте терминации пре-РНК и РНК-полимеразы из комплекса с ДНК ускоряют факторы терминации
Факторы элонгации (E, H, F) повышают активность РНК-полимеразы и облегчают локальное расхождение нуклеотидных цепей. Синтез молекулы РНК идет от 5 - к 3-концу на матричной цепи ДНК по принципу комплементарности и антипараллельности. По мере продвижения РНК-полимеразы по цепи ДНК в направлении от 3'- к 5'-концу впереди нее происходит расхождение, а позади - восстановление двойной спирали.
Расхождение двойной спирали ДНК в области сайта терминации делает его доступным для факторов терминации. Когда РНК-полимераза достигает сайта терминации, транскрипция прекращается. Факторы терминации облегчают отделение первичного транскрипта от матрицы.
4. Посттранскрипционные модификации. Прежде чем выйти из ядра, каждый первичный транскрипт после ряда ковалентных модификаций превращается в «зрелую» молекулу РНК.
• Модификации пре-мРНК начинаются на стадии элонгации. Когда длина первичного транскрипта достигает примерно 30 нуклеотидов, происходит «кэпирование» 5'-конца. Остаток ГТФ присоединяется своим 5'-концом к 5'-концу фрагмента пре-мРНК с образованием 5'-, 5'-фосфодиэфирной связи. Последующее метилирование гуанина в составе ГТФ завершает образование «кэпа»:
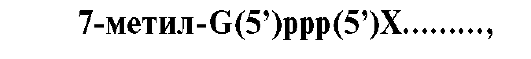 где 7-метилгуанозинтрифосфат присоединен к 5'-концу первого нуклеотида (Х) в составе пре-мРНК.
где 7-метилгуанозинтрифосфат присоединен к 5'-концу первого нуклеотида (Х) в составе пре-мРНК.
По завершении транскрипции на 3'-конце первичного транскрипта мРНК специальным ферментом поли-А-полимеразой синтезируется поли-Апоследовательность, которая состоит из 100-200 остатков адениловой кислоты. Наличие поли-А-последовательности на 3'-конце облегчает выход мРНК из ядра и замедляет ее гидролиз в цитоплазме. Молекулы тРНК и рРНК не содержат «кэпа» и поли-А-последовательности.
Первичный транскрипт или пре-мРНК комплементарен гену, содержит как экзоны - последовательности, кодирующие определенные участки молекулы белка, так и интроны - некодирующие последовательности. В процессе образования молекул «зрелой» мРНК интроны вырезаются из первичного транскрипта, концы экзонов соединяются друг с другом - эту реакцию называют сплайсингом РНК (рис. 3.10).
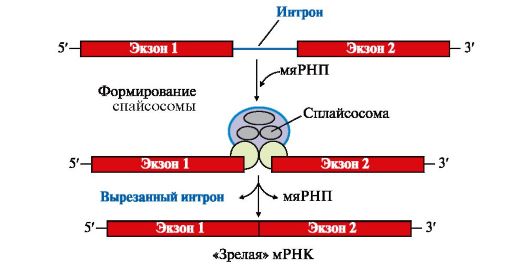 Рис. 3.10. Сплайсинг пре-мРНК
Рис. 3.10. Сплайсинг пре-мРНК
Процесс вырезания интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП), которые образуют комплексы - сплайсосомы. мяРНП состоят из малой ядерной РНК (мяРНК), связанной с белковым остовом, в который входит несколько протомеров. Отдельные мяРНП по принципу комплементарности узнают специфические последовательности интронов в первичном транскрипте, они катализируют реакцию расщепления 3', 5'-фосфодиэфирной связи на границе экзона с интроном и последующее соединение двух экзонов. После завершения сплайсинга «зрелая»
мРНК становится примерно в четыре раза короче первичного транскрипта. Сплайсинг происходит в ядре, в цитоплазму переносится уже «зрелая» мРНК (рис. 3.11).
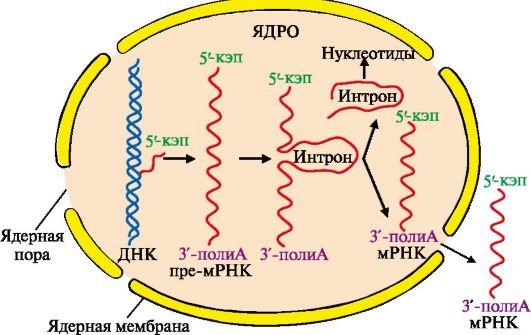 Рис. 3.11. Образование и выход из ядра зрелой мРНК
Рис. 3.11. Образование и выход из ядра зрелой мРНК
Модификации пре-тРНК. В процессе посттранскрипционных модификаций первичных транскриптов тРНК:
• молекулы укорачиваются с 5'- и 3'-концов и удаляется интрон;
• 10-15% азотистых оснований в молекулах модифицируется;
• на 3'-конце формируется акцепторный участок (-ССА) для присоединения аминокислот, а в средней части антикодон - триплет нуклеотидов, обеспечивающий взаимодействие тРНК с кодоном мРНК (рис. 3.12).
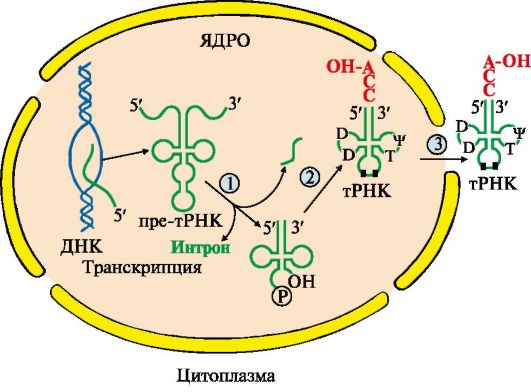 Рис. 3.12. Посттранскрипционные модификации пре-тРНК:
Рис. 3.12. Посттранскрипционные модификации пре-тРНК:
1 - удаляются участки полинуклеотидной цепи на 5'- и 3'-концах молекулы претРНК и интрон в центральной области молекулы; 2 - модифицируются азотистые основания (■), к 3'-концу присоединяется триплет-ССА; 3 - в цитоплазму выходят зрелые тРНК
Посттранскрипционные модификации пре-рРНК сопровождаются образованием из высокомолекулярного предшественника 28S, 18S и 5,8S «зрелых» рРНК, входящих в рибосому - органеллу клетки, участвующую в биосинтезе белка. В состав рибосом входят рРНК и белки, выполняющие структурную, регуляторную и каталитическую функции. Рибосома эукариотов (80S) состоит из двух (большой и малой) субъединиц - 60S и 40S (рис. 3.13). Величина S характеризует скорость оседания (седиментации) субъединиц рибосом при ультрацентрифугировании. Она пропорциональна молекулярной массе частиц. Рибосома прокариотов (70S) состоит из 50S и 30S. Рибосомы эукариотов и прокариотов различаются по молекулярной массе субъединиц, количеству рРНК, массе рРНК, количеству и разнообразию белков, способных
связывать специфические лиганды.
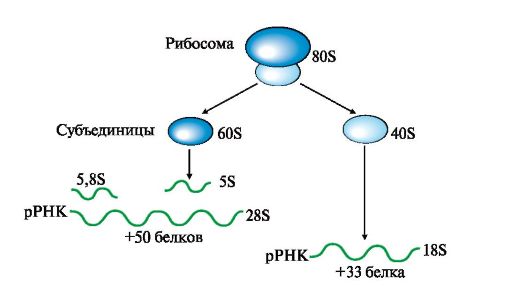 Рис. 3.13. Строение эукариотических рибосом
Рис. 3.13. Строение эукариотических рибосом
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Напишите формулы нуклеотидов, входящих в состав РНК и ДНК. При этом обратите внимание на положение N-гликозидной связи между азотистым основанием и пентозой и различие между нуклеотидами РНК и ДНК.
2. Напишите фрагменты цепи ДНК и РНК следующего состава:
а) -dA-dT-dG-;
б) -U-A-C-;
в) отметьте 3',5'-фосфодиэфирную связь, 5'- и 3'- концы фрагментов.
3. а) перенесите в тетрадь схему репликации (рис. 3.14):
б) укажите: 3'- и 5'-концы матричных цепей ДНК и вновь синтезированных фрагментов, лидирующую и отстающую цепи;
 Рис. 3.14. Схема репликации
Рис. 3.14. Схема репликации
в) на отдельном рисунке изобразите, как идет синтез высокомолекулярного фрагмента на отстающей цепи ДНК. Перечислите ферменты, участвующие в образовании фрагментов Оказаки и их связывании в высокомолекулярный продукт;
г) напишите суммарное уравнение репликации и назовите ферменты репликативного комплекса, кофакторы процесса и объясните их роль в синтезе.
4. Напишите реакции дезаминирования цитозина, аденина и гуанина, происходящие в результате действия на ДНК-факторов внешней среды. Укажите основания, не характерные для цепей ДНК. Назовите ферменты, устраняющие эти повреждения.
5. Дополните предложения недостающими словами.
Нуклеиновые кислоты являются ............... полимерами, состоящими
из ..............., связанных между собой ............... связями. ДНК состоит
из ............... цепей, связанных между собой ............... связями. Нити
...............друг другу, имеют...............направление и закручены в...............
спираль.
6. Перенесите в тетрадь табл. 3.4 и заполните графы I, II, III.
Таблица 3.4. Матричные процессы
Процесс | Репликация I | Репарация П | Транскрипция Ш | Трансляция IV |
Матрица | ||||
Субстраты | ||||
Источники энергии | ||||
Ферменты Кофакторы | ||||
Направление синтеза новых цепей | ||||
Локализация процесса | ||||
Характеристика продукта* |
*Выберите соответствующий ответ:
А - продукт идентичен матрице;
В - продукт комплементарен матрице;
С - продукт не комплементарен, но колинеарен матрице.
7. Установите порядок событий. При репарации происходит:
A. Соединение неповрежденного участка цепи ДНК и вновь синтезированного
Б. Удаление поврежденного участка
B. Определение места повреждения Г. Достройка поврежденной цепи
Д. Присоединение ДНК-полимеразы β к 3'-концу поврежденной цепи
8. Выберите правильные ответы.
Ферментами репарации устраняются:
A. Дезаминированные нуклеотиды Б. Димеры тимина
B. Комплементарные пары поврежденных нуклеотидов Г. Ацилированные нуклеотиды
Д. Продукты депуринизации нуклеотидов
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1 . Установите соответствие.
A. Репликация Б. Репарация
B. Транскрипция
Г. Созревание пре-тРНК Д. Сплайсинг
1. Приводит к образованию молекул, содержащих до 15% модифициро-
ванных азотистых оснований
2. Синтезирует продукт, идентичный матрице
3. Обеспечивает образование зрелых мРНК
2. Установите порядок событий.
В процессе синтеза отстающей цепи ДНК:
A. ДНК-лигаза устраняет разрывы между предыдущим и последующим фрагментами Оказаки
Б. ДНК-полимераза α синтезирует РНК-праймер и небольшой участок молекулы ДНК
B. ДНК-полимераза β устраняет брешь между предыдущим и вновь синтезированным фрагментом Оказаки
Г. ДНК-полимераза δ или ε удлиняет нить в направлении от 5'- к 3'-концу Д. Праймеры вырезаются РНКазой
3. Выполните «цепное» задание:
а) в ходе репликации матрицей для синтеза новых молекул ДНК служат:
A. Неповрежденная нить ДНК
Б. мРНК
B. Обе нити ДНК
Г. тРНК
б) на этапе инициации эта нуклеиновая кислота связывается с:
A. ДНК-полимеразой α Б. SSB-белками
B. РНК-полимеразой
Г. ДНКтопоизомеразой
в) с помощью выбранного компонента происходит:
A. Гидролиз 3',5'-фосфодиэфирной связи в одной из цепей ДНК Б. Синтез олигорибонуклеотида
B. Удлинение новых цепей ДНК
г) к полученному продукту присоединяется:
A. ДНК-полимераза β Б. ДНК-полимераза δ
B. ДНК-хеликаза Г. ДНК-лигаза
д) фермент катализирует:
A. Расплетение двойной спирали ДНК за счет энергии АТФ Б. Удлинение нити ДНК
B. Соединение фрагментов Оказаки
Г. Заполнение бреши между двумя фрагментами ДНК
е) это обеспечивает:
A. Образование высокомолекулярного продукта Б. Присоединение ДНК-полимеразы α
B. Комплементарное взаимодействие матрицы и продукта Г. Рост лидирующей цепи ДНК
4. Установите соответствие.
A. ДНК-полимераза β Б. ДНК-лигаза
B. Эндонуклеаза
Г. ДНК- N-гликозилаза Д. ДНК-инсертаза
1. Устраняет «брешь» на поврежденной нуклеотидной цепи
2. Гидролитически удаляет поврежденное основание
3. Катализирует образование N-гликозидной связи
5. Выполните «цепное» задание:
а) в процессе синтеза РНК активация промотора происходит с помощью:
A. РНК-полимеразы
Б. Фактора терминации
B. ТАТА-фактора
Г. Фактора элонгации
б) присоединение этого вещества облегчает взаимодействие промотора с:
A. ДНК-полимеразой Б. РНК-полимеразой
B. ДНК-лигазой Г. ДНК-хеликазой
в) активность выбранного фермента повышается при взаимодействии с:
A. РНК-праймером
Б. мяРНП
B. Факторами элонгации Г. Факторами терминации
г) взаимодействие фермента с выбранным в пункте «в» компонентом:
A. Изменяет стабильность РНК
Б. Устраняет интроны из первичного транскрипта
B. Облегчает расхождение цепей ДНК-матрицы и синтез продукта Г. Ускоряется отделение первичного транскрипта от матрицы
д) этот процесс использует в качестве источников энергии и субстратов:
A. АТФ Б. ГТФ
B. 4 x НТФ Г. 4 x дНТФ
е) эти нуклеотиды обеспечивают рост цепи ( выберите правильные ответы):
A. От 5'- к 3'-концу Б. От 3'- к 5'-концу
B. Антипараллельно матрице Г. Параллельно матрице
6. Установите соответствие.
Ферменты репликации:
A. ДНК-полимераза δ
Б. РНКаза
B. ДНК-лигаза
Г. ДНК-полимераза β Д. ДНК-полимераза α
Функции:
1. Связывает фрагменты Оказаки друг с другом
2. Синтезирует РНК-праймер
3. Катализирует синтез лидирующей цепи ДНК
7. Установите соответствие.
Ферменты репарации:
A. Эндонуклеаза Б. Экзонуклеаза
B. Инсертаза
Г. ДНК-полимераза β Д. ДНК N-гликозилаза Функции:
1. Расщепляет связь между поврежденным азотистым основанием и пентозой
2. Гидролизует 3'- ,5'-фосфодиэфирную связь в поврежденной цепи
ДНК
3. Присоединяет азотистое основание к АП-сайту в цепи ДНК
8. Установите соответствие.
A. Пре-тРНК Б. тРНК
B. рРНК Г. мРНК Д. мяРНК
1. Содержит специфическую последовательность -ССА на 3'-конце
2. Имеет «кэп» на 5'-конце
3. Входит в состав сплайсосом
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-Г, 2-А, 3-Д
2. Б→Г→Д→В→А
3. а) В, б) Г, в) А, г) В, д) А, е) Б
4. 1-А, 2-Г, 3-Д
5. а) В, б) Б, в) В, г) В, д) В, е) А, В
6. 1-В, 2-Д, 3-А
7. 1-Д, 2-А, 3-В
8. 1-Б, 2-Г, 3-Д
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Нуклеозиды, нуклеотиды.
2. Первичная структура нуклеиновых кислот.
3. Двойная спираль ДНК. Особенности строения.
4. Гистоны и их роль в формировании третичной структуры ДНК.
5. Нуклеосомы.
6. Строение и функции мРНК, тРНК и рРНК.
7. Метод молекулярной гибридизации.
8. Репликация.
9. Репарация.
10. Транскрипция, посттранскрипционные модификации РНК.
11. мяРНП, сплайсосомы.
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В биохимической лаборатории имелись три пробирки с ДНК, выделенной из печени мыши, мышц мыши и печени лошади. В процессе хранения надписи на пробирках стерлись. Объясните, как экспериментатору, используя метод молекулярной гибридизации, удалось установить, из ткани какого животного была выделена ДНК. Для этого составьте схему экспериментов, которые нужно было провести ученому.
2. Операции частичной гепатоэктомии (удаление части органа), осуществляющиеся при опухолевом поражении печени или травмах, стимулируют рост и деление клеток в сохранной части органа вплоть до восстановления первичного объема. Опишите процесс, стимулирующий увеличение числа гепатоцитов. Для этого:
а) изобразите его схему;
б) укажите субстраты, ферменты, источники энергии, кофермент;
в) перечислите основные белки, которые участвуют в регуляции клеточного цикла и их роль в подготовке к делению.
3. В процессе дифференцировки кроветворных клеток на стадии ретикулоцитов идет активный синтез α- и β-цепей глобина. Опишите механизм, обеспечивающий клетки матрицами для синтеза этих цепей. Для этого:
а) изобразите схему, отражающую синтез матрицы, содержащей информацию о структуре белковых цепей НЬ;
б) укажите субстраты, фермент, источники энергии, кофермент и напишите суммарное уравнение процесса;
в) на схеме покажите модификации, которым подвергается продукт реакции, прежде чем он станет зрелой матрицей для синтеза полипептидных цепей.
4. В последнее время все большее число молодежи посещает солярии, аргументируя свои действия тем, что солнечный свет полезен для здоровья. Многие из них даже не догадываются, к каким последствиям может привести УФО при чрезмерном увлечении солнечными ваннами. Укажите, какие повреждения в ДНК фибробластов кожи может вызывать УФ-облучение и как они устраняются в норме. Для этого:
а) напишите схему процесса, который обеспечивает восстановление нативной структуры ДНК;
б) назовите заболевания, которые могут возникнуть у пациентов с недостаточностью ферментов этого процесса.
5. Некоторые химические вещества способны алкилировать ДНК, включая метильные группы в азотистые основания пуриновых нуклеотидов с образованием 7-метилгуанина, 6-метилгуанина, 3-метиладенина. Объясните с помощью каких механизмов в норме удаляются эти повреждения в молекуле ДНК. С этой целью:
а) представьте универсальный и вспомогательные механизмы, обеспечивающие восстановление нативной структуры ДНК;
б) укажите матрицу, субстраты, ферменты этого процесса;
в) объясните биологическое значение этих механизмов.
Модульная единица 2 БИОСИНТЕЗ БЕЛКОВ. ИНГИБИТОРЫ МАТРИЧНЫХ БИОСИНТЕЗОВ. МЕХАНИЗМЫ РЕГУЛЯЦИИ АКТИВНОСТИ ГЕНОВ
Цели изучения Уметь:
1. Использовать знания об основных этапах биосинтеза белков для объяс-
нения механизмов трансформации генетической информации в фенотипические признаки.
2. Интерпретировать действие интерферонов, антибиотиков, ядов, токси-
нов и некоторых лекарственных препаратов как ингибиторов матричных биосинтезов.
3. Объяснять адаптацию организмов к меняющимся условиям среды как результат регуляции скорости биосинтеза белков.
Знать:
1. Основные этапы биосинтеза и посттрансляционных модификаций белков.
2. Примеры лекарств - ингибиторов матричных биосинтезов и механизмы их действия.
3. Основы регуляции экспрессии генов у прокариотов.
4. Особенности адаптивной регуляции биосинтеза белков у эукариотов.
ТЕМА 3.5. ТРАНСЛЯЦИЯ КАК МЕХАНИЗМ ПЕРЕВОДА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ В ФЕНОТИПИЧЕСКИЕ
ПРИЗНАКИ
Синтез белка отличается от других матричных биосинтезов тем, что между матрицей (мРНК) и продуктом-белком нет комплементарного соответствия. Поскольку матрица построена из 4 нуклеотидов, а продукт - полипептидная цепь из 20 аминокислот, то существует определенный закон шифрования аминокислот в нуклеотидной последовательности матрицы, т.е. биологический код.
1. Биологический код - это способ записи информации об аминокислотной последовательности белков с помощью последовательности нуклеотидов в ДНК или РНК. Его характеризуют следующие свойства: триплетность и наличие терминирующих кодонов, специфичность, вырожденность, универсальность, однонаправленность, колинеарность (табл. 3.5).
Таблица 3.5. Свойства биологического кода
Триплетность и наличие терминирующих кодонов | Кодовое число равно 3. Три нуклеотидных остатка (триплет) кодируют одну аминокислоту. Терминирующие триплеты - UАА, UАG, UGА не кодируют аминокислот, а являются сигналами к прекращению синтеза белка |
Специфичность | Каждый триплет кодирует только одну аминокислоту |
Вырожденность | Одну аминокислоту могут кодировать несколько триплетов (от 2 до 6) |
Универсальность | Почти у всех видов организмов биологический код одинаков |
Однонаправленность | Информация, записанная в зрелой мРНК в виде линейной последовательности кодонов (триплетов), считывается в направлении от 5'- к 3'-концу |
Колинеарность | Последовательность кодонов в зрелой мРНК соответствует последовательности аминокислот в синтезированном белке |
2. Основными компонентами синтеза белка являются: аминокислоты, тРНК, аминоацил-тРНК-синтетазы, мРНК, рибосомы, источники энергии, белки - факторы инициации, элонгации и терминации и кофакторы (табл. 3.6).
Таблица 3.6. Основные компоненты белок-синтезирующей системы и их функции в процессе трансляции
Необходимые компоненты | Функции |
1. Аминокислоты | Субстраты для синтеза белков |
2. тРНК | Выполняют функцию адапторов - приспособителей аминокислот к кодонам мРНК. Акцепторным концом (-ССА) они взаимодействуют с аминокислотами, а антикодоном - с кодоном мРНК |
3. Аминоацил-тРНКсинтетазы | Каждый фермент катализирует реакцию специфического связывания 1 из 20 аминокислот с соответствующей тРНК |
4. мРНК | Матрица содержит линейную последовательность кодонов, определяющих первичную структуру белков |
5. Рибосомы | Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков |
6. АТФ, ГТФ | Источники энергии |
7. Белковые факторы инициации (IF), элонгации (EF), терминации (RF) | Специфические внерибосомные белки, необходимые для процесса трансляции |
8. Ионы магния | Кофактор, стабилизирующий структуру рибосом |
Аминоацил-тРНК-синтетазы катализируют синтез аминоацил-тРНК - соединений, которые обеспечивают включение аминокислот в полипептидную цепь. Они обладают абсолютной специфичностью к аминокислоте и относительной к тРНК, так как в связи с вырожденностью кода разных типов тРНК больше, чем аминокислот. Существуют изоакцепторные тРНК, отличающиеся по строению антикодона, но связывающиеся с одной и той же
аминокислотой. Указанием на способность тРНК присоединять определенную аминокислоту служит индекс в верхнем правом углу: тРНК, связывающаяся с глутаматом, обозначается как тРНКГлу, а с аланином - тРНКАла. Название каждой из 20 аминоацил-тРНК-синтетаз отражает название аминокислоты, которая активируется в ходе этой реакции. Так, реакцию активации аспартата катализирует аспарагил-тРНК-синтетаза, которая присоединяет α-СООН-группу аминокислоты к 3'-ОН концу тРНК за счет энергии АТФ (рис. 3.15).
 Рис. 3.15. Реакция активации аспартата, катализируемая аспарагил-тРНК-синтетазой
Рис. 3.15. Реакция активации аспартата, катализируемая аспарагил-тРНК-синтетазой
3. События на рибосоме включают этапы: инициации, элонгации и терминации (рис. 3.16).
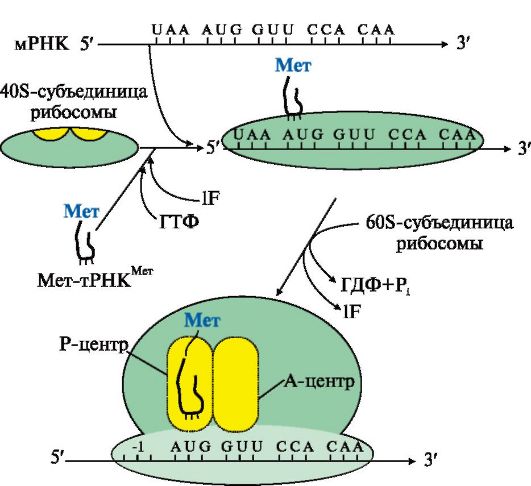 Рис. 3.16. Инициация белкового синтеза.
Рис. 3.16. Инициация белкового синтеза.
Комплекс, состоящий из 40S-субъединицы рибосомы, Мет-тРНКМет, факторов инициации и молекулы ГТФ, присоединяется к мРНК и перемещается по ней до встречи с инициирующим кодоном AUG. Антикодон Мет-тРНКМет связывается с кодоном AUG, это сопровождается присоединением к комплексу 608-субъединицы рибосомы, гидролизом ГТФ и удалением факторов инициации. На рибосоме формируются А- и Р-центры. Мет-тРНКМет оказывается в Р-центре рибосомы. В процессе инициации участвует более 10 факторов инициации
Инициация начинается с присоединения к мРНК в области «кэпа» малой субъединицы рибосомы 40S, факторов инициации (IF), инициирующей Мет-тРНКМет и ГТФ. Когда в результате движения этого комплекса по мРНК антикодон Мет-тРНКМет свяжется с инициирующим кодоном АUG, комплекс останавливается. Происходит присоединение 60S-субъединицы рибосомы, сопровождающееся гидролизом ГТФ и отделением факторов инициации. Формируется 80S-рибосома с двумя активными центрами: Р (пептидильным) центром, в котором находится Мет-тРНКМет, и А (аминоацильным) центром, в область которого поступает первый смысловой кодон
мРНК.
Этап элонгации включает три последовательные стадии
(рис. 3.17).
Связывание аа-тРНКаа в А-центре.
' В свободный А-центр присоединяется первая аа1-тРНКаа1 (на рисунке это Вал-тРНКВал), у которой антикодон комплементарен кодону мРНК, находящемуся в области этого центра. Эта фаза процесса требует затраты энергии ГТФ и участия фактора элонгации EF1.
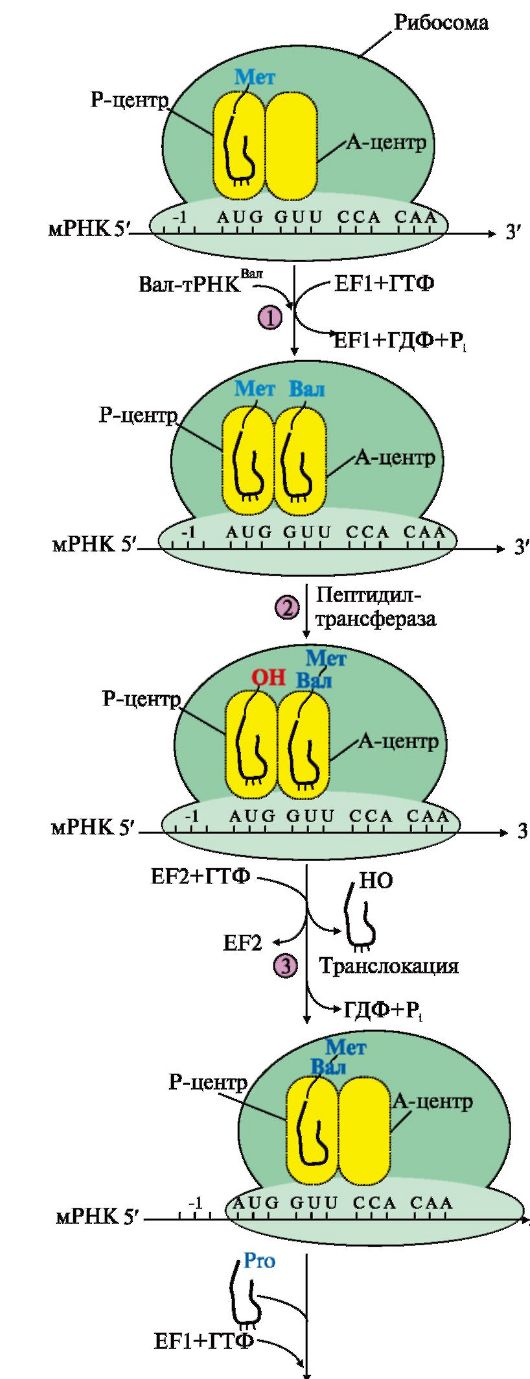 Рис. 3.17. Элонгация полипептидной цепи:
Рис. 3.17. Элонгация полипептидной цепи:
1 - связывание аа-тРНКаа в А-центре требует затраты энергии ГТФ и участия фактора элонгации EF1 (на схеме аа-тРНКаа - Вал-тРНКВал);
2 - образование пептидной связи катализирует пептидилтрансфераза, активный центр которой формируется рРНК, входящей в состав большой субъединицы
рибосомы; 3 - перемещение рибосомы по мРНК на один кодон в направлении от 5'- к 3'-концу идет с использованием энергии ГТФ (транслокация) и при участии фактора EF2
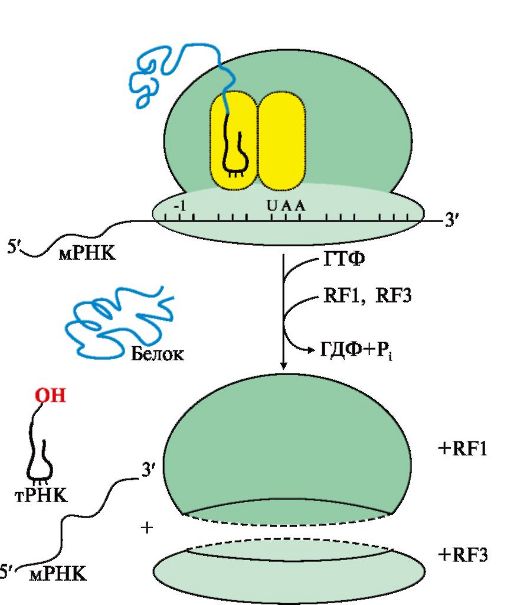 Рис. 3.18. Терминация синтеза белка.
Рис. 3.18. Терминация синтеза белка.
При попадании в А-центр стоп-кодона вновь синтезированный пептид высвобождается из связи с тРНК и рибосомой с участием факторов терминации и энергии ГТФ
Образование пептидной Пептидил-тРНК
связи. На этой стадии происходит пептидилтрансферазная реакция, в ходе которой метионин от Мет-тРНКМет, входящей в Р-центр, переносится на α-аминогруппу аминокислоты (валина), находящейся в А-центре в составе аа-тРНКаа, с образованием дипептидилтРНК. В пептидилтрансферазной реакции ферментативную активность проявляет рРНК большой субъединицы рибосомы.
Транслокация - перемещение рибосомы по мРНК. В ходе этой стадии рибосома сдвигается на один кодон в направлении от 5'- к 3'-концу мРНК за счет энергии ГТФ и при участии фактора элонгации EF2. В результате дипептидил-тРНК (Мет-Вал-тРНК) из А-центра попадает в Р-центр, а в А-центре оказывается следующий кодон. Свободная тРНКМет теряет связь с Р-центром и покидает рибосому. Далее процесс продолжается по описанной схеме, повторяя стадии: Η 2 -> 3.
Терминация трансляции происходит после включения в А-центр одного из стоп кодонов: UAG, UGA, UAA (рис. 3.18). Белковые факторы терминации RF1 и RF3, взаимодействуя с этими кодонами, при участии пептидилтрансферазы обеспечивают гидролитическое отщепление синтезированного полипептида от тРНК, а также освобождение тРНК из пептидильного центра и диссоциацию рибосомы на субъединицы с затратой энергии молекулы ГТФ. Название факторов происходит от англ. releasing factor - RF, а цифры указывают на их сходство по строению с RF-факторами 1-го и 3-го прокариотов.
Одновременно несколько рибосом могут участвовать в трансляции одной мРНК. Каждая рибосома занимает участок, равный примерно 80 нуклеотидам мРНК. Таким образом, рибосомы располагаются на мРНК с интервалами около 100 нуклеотидов, образуя комплекс, называемый полисомой.
4. Функционально активные белки образуются в результате посттрансляционных модификаций полипептидных цепей, синтезированных на рибосомах. Они включают:
• частичный протеолиз;
• фолдинг, или формирование пространственной структуры, в котором принимают участие белки-шапероны, обеспечивающие образование функционально активной конформации полипептидной цепи;
• модификации аминокислот: карбоксилирование, фосфорилирование, йодирование, гидроксилирование, ацилирование и гликозилирование;
• образование дисульфидных связей между остатками цистеина, участвующими в формировании трехмерной структуры белка;
• присоединение простетических групп;
• образование олигомерных структур, которое также осуществляется при участии шаперонов.
ТЕМА 3.6. ИНГИБИТОРЫ МАТРИЧНЫХ БИОСИНТЕЗОВ: ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ЯДЫ И БАКТЕРИАЛЬНЫЕ ТОКСИНЫ
Подавление матричных биосинтезов может быть достигнуто путем:
• структурной модификации матрицы и рибосом;
• инактивации ферментов;
• снижения синтеза исходных субстратов (НТФ и дНТФ).
Остановка любого из матричных биосинтезов опасна для клеток и может вызвать их гибель, поэтому многие ингибиторы матричных биосинтезов являются ядами для организма человека.
1. α-Аманитин - токсин, который содержится в бледной поганке Amanita phalloides и ингибирует эукариотические РНК-полимеразы, в особенности РНК-полимеразу II, которая отвечает за синтез мРНК.
2. Возбудитель дифтерии Corynebacterium diphtheriae выделяет токсин, который в организме человека подвергается гидролитическому расщеплению. Образуется фрагмент, являющийся специфическим ингибитором трансляции у эукариотов. Он обладает ферментативной активностью и катализирует AДФ-рибозилирование - перенос остатка АДФ-рибозы с NAD+ на ОН-группу остатка серина в молекуле фактора элонгации EF2. Инактивация фактора ингибирует продвижение рибосомы по мРНК на стадии транслокации. В результате растущая пептидная цепь остается в аминоацильном центре рибосомы, биосинтез белков в инфицированных клетках слизистой зева и гортани прекращается.
3. Некоторые ингибиторы матричных биосинтезов нашли применение в медицине. Так, антибиотики, подавляющие процесс транскрипции и трансляции и специфичные в отношении белок-синтезирующей системы прокариотов, могут использоваться как антибактериальные препараты, а антибиотики, нарушающие матричную функцию ДНК, нашли применение при лечении злокачественных новообразований и являются противоопухолевыми препаратами.
Избирательность противоопухолевых препаратов: доксорубицина, дауномицина - интеркаляторов, циклическая структура которых встраивается между комплементарными основаниями G:::C, и других лекарств, взаимодействующих с ДНК трансформированных клеток, невелика. Она обеспечивается, как правило, более высокой скоростью синтеза ДНК и РНК в этих клетках, а также повышенной проницаемостью клеточных мембран для метаболитов по сравнению с покоящимися, нормальными клетками. Эти соединения ингибируют репликацию и транскрипцию, токсичны для быстроделящихся нормальных клеток организма, таких, как стволовые клетки кроветворной системы, клетки слизистой желудка и кишечника, фолликулов волос. В последние годы проводятся исследования по созданию препаратов, обеспечивающих доставку ингибитора только в опухолевые клетки. Это достигается связыванием цитотоксических антибиотиков с белками, рецепторы к которым имеются главным образом на опухолевых клетках.
Некоторые лекарства и антибиотики селективно ингибируют синтезы: ДНК - семейство фторхинолонов, РНК - рифамицины, белка - эритромицин, тетрациклин только в бактериальных клетках, практически не влияя на матричные синтезы в клетках млекопитающих. Высокая избирательность этой группы соединений объясняется различиями в структуре ферментов и рибосом эукариотических и прокариотических клеток.
4. Течение многих вирусных инфекций сопровождается гибелью зараженных клеток. Многие вирусы, например оспы, гриппа, полиомиелита, попадая в эукариотические клетки, прекращают в них синтез нуклеиновых кислот и белков, характерных для данного организма, переключая ферментные системы и энергетические ресурсы на воспроизведение вирусных частиц.
5. Защиту организма от вирусных инфекций обеспечивают интерфероны.
Семейство этих белков синтезируется в клетках эукариотов в ответ на вирусную инфекцию. Они индуцируют в зараженных клетках образование протеинкиназы, которая фосфорилирует фактор инициации трансляции IF2 и таким образом прекращает работу белок-синтезирующего аппарата. Кроме того, интерфероны повышают активность РНКаз, расщепляющих матричные и рибосомные РНК клетки, что также ведет к прекращению синтеза белка и гибели инфицированных клеток.
ТЕМА 3.7. МЕХАНИЗМЫ АДАПТИВНОЙ РЕГУЛЯЦИИ АКТИВНОСТИ ГЕНОВ У ПРОКАРИОТОВ И ЭУКАРИОТОВ
Адаптация организмов к различным воздействиям окружающей среды часто осуществляется путем изменения экспрессии (активности) генов, т.е. изменения скорости транскрипции определенных участков на молекулах ДНК. Этот процесс, в деталях изученный на бактериях, включает взаимодействие специфических белков с участками ДНК в непосредственной близости от стартового участка транскрипции - промотора.
1. Адаптивная регуляция активности генов у прокариотов получила объяснение в теории оперона. Согласно этой теории на молекуле ДНК прокариотов присутствуют определенные участки - опероны. В состав этих участков ДНК входят структурные гены, содержащие информацию о группе функционально взаимосвязанных белков, которые участвуют в одном и том же метаболическом пути, промотор и оператор. Участки промотора и оператора частично перекрываются. Транскрипцию структурных генов контролирует оператор, присоединение к которому белка-репрессора не позволяет РНК-полимеразе связаться с промотором и начать транскрипцию. Белок-репрессор синтезируется в клетке с постоянной скоростью, его строение кодирует мРНК, транскрибируемая с гена-регулятора, расположенного на некотором расстоянии от оперона, работу которого контролирует его белковый продукт.
Если оперон регулируется по механизму индукции (например, лактозный оперон), то в отсутствии индуктора (лактозы) белок-репрессор связан с оператором. Комплекс белок-репрессор-оператор препятствует связыванию РНК-полимеразы с промотором, и транскрипция структурных генов оперона не идет. Когда концентрация индуктора в клетке возрастет, то он присоединится к белку-репрессору, который имеет центр для связывания индуктора, изменяет его конформацию и снижает сродство к оператору. Комплекс индуктор-белок-репрессор теряет сродство к ДНК и уходит в цитозоль клетки. РНК-полимераза связывается с промотором и транскрибирует структурные гены. Идет синтез белков, закодированных в данном опероне (рис. 3.19).
При регуляции оперона по механизму репрессии (например, гистидиновый или триптофановый опероны) белок-репрессор, постоянно синтезируемый в клетках, не имеет сродства к оператору. Когда к белку-репрессору присоединится небольшая молекула - корепрессор (гистидин или триптофан, как правило, конечный продукт метаболического пути, ферменты которого закодированы в структурных генах оперона), то в результате конформационных изменений комплекс белка-репрессора с корепрессором приобретает сродство к оператору и прекращает транскрипцию. Так, гистидиновый оперон содержит 10 структурных генов, кодирующих строение ферментов синтеза гистидина. Добавки гистидина в среду выращивания клеток E. coli вызывают снижение количества, а затем и полное исчезновение из внутриклеточного содержимого ферментов синтеза гистидина (рис. 3.20).
2. Адаптивная регуляция активности генов у эукариотов обеспечивает изменения скорости транскрипции отдельных генов в ответ на меняющиеся условия внутренней и внешней среды. В клетках многоклеточных организмов часть генов кодирует белки «домашнего хозяйства», которые синтезируются с постоянной скоростью и обеспечивают жизнеспособность клеток. Это - гены ферментов, участвующие в биологическом окислении, синтезе АТФ, образовании компонентов мембран и т.д.
Регуляция у высших организмов отличается от регуляции транскрипции у прокариотов многообразием сигналов, которые контролируют не только начало процесса на молекуле ДНК, но и частоту, с которой он
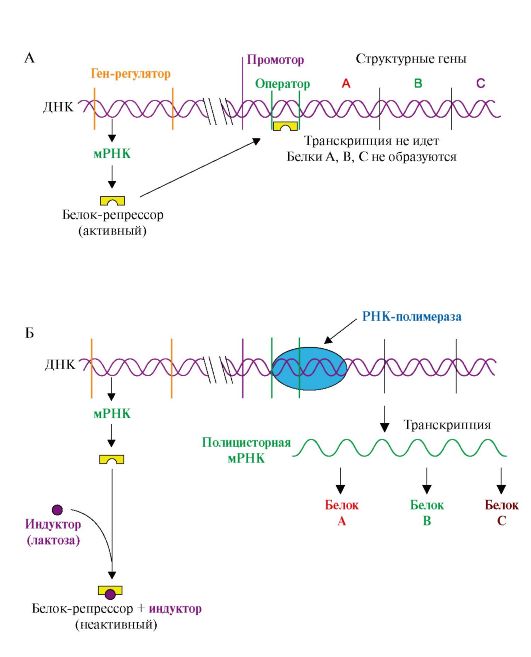 Рис. 3.19. Оперон, регулируемый по механизму индукции (лактозный оперон):
Рис. 3.19. Оперон, регулируемый по механизму индукции (лактозный оперон):
А - в отсутствие индуктора в среде белок-репрессор связывается с оператором. РНК-полимераза не может присоединиться к промотору, транскрипция не идет; Б - в присутствии индуктора белок-репрессор образует комплекс с молекулами индуктора, меняет конформацию и теряет сродство к оператору. РНК-полимераза транскрибирует гены А, В, С и происходит синтез белков: β-галактозидазы, пермиазы, галактозидтрансацетилазы, участвующих в утилизации лактозы
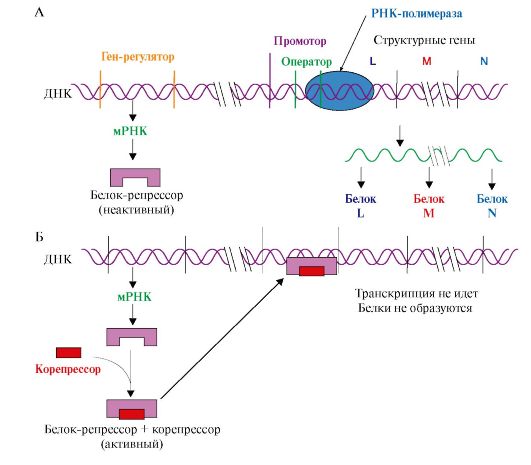 Рис. 3.20. Оперон, регулируемый по механизму репрессии:
Рис. 3.20. Оперон, регулируемый по механизму репрессии:
А - в отсутствие корепрессора белок-репрессор неактивен и не имеет сродства к оператору до тех пор, пока небольшая молекула-корепрессор не свяжется с ним; Б - в присутствии корепрессора комплекс белок-репрессор-корепрессор связывается с оператором и прекращает транскрипцию
происходит (рис. 3.21). ТАТА-участок промотора присоединяет ТАТА-связывающий белок, факторы транскрипции обеспечивают взаимодействие с РНК-полимеразой и определяют стартовую точку транскрипции. Минимальный синтез мРНК становится возможным после связывания РНК-полимеразы с группой дополнительных транскрипционных факторов. Если кроме указанных компонентов с РНК-полимеразным комплексом связываются белки, присоединенные к регуляторным участкам ДНК, то скорость транскрипции меняется. Она возрастает, если это будут белки, взаимодействующие с участками ДНК-энхансерами (усилителями), и снижается, если к транскрипционному комплексу
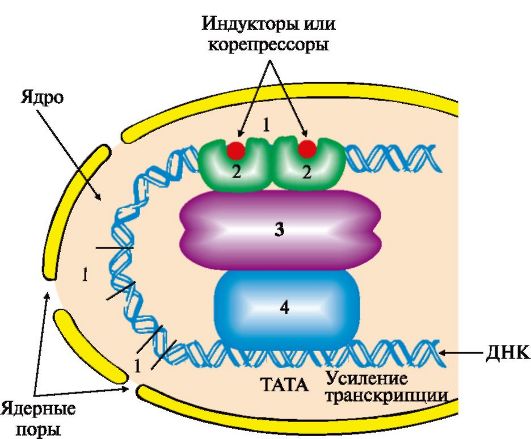 Рис. 3.21. Адаптивная регуляция транскрипции генов у эукариотов.
Рис. 3.21. Адаптивная регуляция транскрипции генов у эукариотов.
Область, обеспечивающая регуляцию экспрессии генов, включает в себя промоторный участок и дополнительные регуляторные последовательности, в которые входят энхансеры, сайленсеры, гормон-чувствительные участки, последовательности GC, СААТ и др. Белки, связывающиеся с ДНК в этих участках, называют специфическими регуляторными белками. Они влияют на скорость транскрипции генов, взаимодействуя с белками-посредниками или коактиваторами, передающими сигнал на основные транскрипционные факторы и РНК-полимеразу:
1 - регуляторные участки ДНК; 2 - регуляторные белки; 3 - белки-коактиваторы; 4 - РНК-полимеразный комплекс
присоединится белок, связывающийся с участком сайленсера (тушитель транскрипции). Регуляторные зоны ДНК - энхансеры и сайленсеры, гормон-чувствительные участки, специфические регуляторные последовательности (например, GC, CAAT и др.) различны по числу и расположению на молекуле ДНК для разных генов в разных тканях, т.е. являются тканеспецифическими характеристиками. Они могут располагаться за тысячи нуклеотидных пар от стартовой точки транскрипции впереди, после или внутри гена, связывать комплексы белков с метаболитами или гормонами и влиять на конформацию гена.
Индукторами или корепрессорами, стимулирующими присоединение регуляторных белков к ДНК, могут быть гормоны, ионы металлов, субстраты или продукты метаболических путей.
Определенное значение в регуляции состава и содержания белков имеют посттранскрипционные превращения пре-мРНК в процессе альтернативного сплайсинга, изменение стабильности РНК в разные периоды жизни клетки. Описаны примеры влияния факторов среды на сродство рибосом к мРНК, посттрансляционные модификации полипептидных цепей и изменения продолжительности жизни белковых молекул.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Напишите реакцию образования Тре-тРНКТре. Укажите название и класс фермента. С помощью однобуквенных обозначений изобразите строение антикодона и отметьте 5'- и 3'-концы.
2. Перенесите в тетрадь и дополните рис. 3.22, который отражает события на рибосоме на стадии включения в растущую полипептидную цепь аминокислоты, занимающей третье положение в синтезируемом пептиде. К компонентам, обозначенным цифрами, подберите соответствующие буквы:
A. ГТФ Б. Н3РО4
B. Факторы элонгации
Г. ГДФ Д. Тре-тРНК
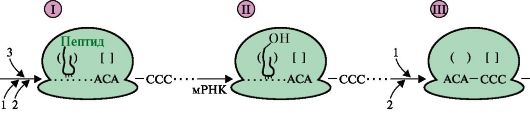 Рис. 3.22. События на рибосоме в ходе элонгации:
Рис. 3.22. События на рибосоме в ходе элонгации:
I-III - стадии элонгации
Ответьте на вопросы:
а) какое событие на рибосоме представлено в схеме рис. 3.22 под ? I?
б) какая нуклеиновая кислота участвует в пептидилтрансферазной реакции и за счет какой энергии происходит образование новой пептидной связи на стадии II?
в) как называется стадия элонгации, в ходе которой рибосома перемещается по мРНК на один кодон, как это показано на схеме III?
3. Заполните графу IV в табл. 3.4 модульной единицы 1.
4. Перенесите табл. 3.7 в тетрадь и, используя приведенные в ней данные, определите и запишите посттрансляционные модификации, которые происходят с полипептидами-предшественниками НЬА, инсулина и тропоколлагена типа I при их превращении в функционально активные молекулы.
5. Перенесите табл. 3.8 в тетрадь и распределите лекарственные препараты, используемые в клинике для подавления матричных синтезов, на две группы: А - антибактериальные и В - противоопухолевые препараты.
6. Изучив механизмы адаптивной регуляции у прокариотов, перенесите в тетрадь и заполните табл. 3.9 и 3.10.
Таблица 3.7. Посттрансляционные изменения структуры некоторых белков
Белки | Характеристика полипептидных цепей, образующихся в процессе трансляции | Характеристика функционально активных молекул |
А. Инсулин | Одна полипептидная цепь препроинсулина, состоящая из 104 аминокислотных остатков | Две полипептидные цепи, содержащие 21 и 30 аминокислотных остатков, соединенные двумя межцепочечными и одной внутрицепочечной -S-S-связями |
Б. НЬА | Две неидентичные α- и β-цепи, содержащие большее количество аминокислотных остатков, чем протомеры «зрелого» белка | Почти сферическая частица, состоящая из 4 протомеров (2α, 2β), каждый из которых связан с гемом |
В. Тропокол лаген 1 | Три более длинные, чем зрелые полипептидные цепи, содержащие остатки Про, Лиз, Гли | Фибриллярный белок - гликопротеин, состоит из 3 цепей, образующих правозакрученную суперспираль и содержащих много остатков гидроксипролина и гидроксилизина |
Таблица 3.8. Лекарственные препараты - ингибиторы матричных биосинтезов
Препарат | Группа | Механизм действия |
Доксорубицин | Связывается с ДНК, внедряясь между основаниями, генерирует активные формы кислорода, вызывая разрывы в структуре макромолекулы | |
Рифамицин | Связывается с РНК-полимеразой бактерий, ингибирует начало синтеза РНК | |
Мелфалан | Алкилирует молекулу ДНК и повреждает ее структуру | |
Эритромицин | Связывается с 50S-субъединицей рибосомы и предотвращает транслокацию | |
Винбластин | Останавливает клетки в G2-фазе и препятствует митозу | |
Блеомицин | Вызывает хромосомные разрывы и фрагментацию ДНК | |
Тетрациклин | Присоединяется к 30S-субъединице рибосомы и ингибирует связывание аа-тРНК в А-центре |
Таблица 3.9. Структурные компоненты оперона и их функции
Структурный компонент оперона | Функция |
Структурные гены | |
Оператор | |
Промотор | |
Ген-регулятор |
Таблица 3.10. Регуляция синтеза ферментов у прокариотов
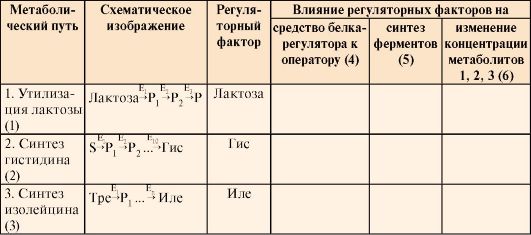 1, 2, 3 - метаболиты, изменение концентрации которых в клетке является результатом регуляции
1, 2, 3 - метаболиты, изменение концентрации которых в клетке является результатом регуляции
В табл. 3.10 в колонках 4, 5, 6 укажите влияние регуляторных факторов на:
а) сродство белка-регулятора к оператору (повышается ↑ tили понижается ↓);
б) синтез ферментов регулируется путем индукции или репрессии;
в) изменение концентрации метаболитов, являющихся исходными субстратами (лактоза) или конечными продуктами (Гис или Иле) метаболических путей ↑или ↓).
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выполните «цепное» задание:
а) на рис. 3.23 изображен этап в процессе синтеза белка:
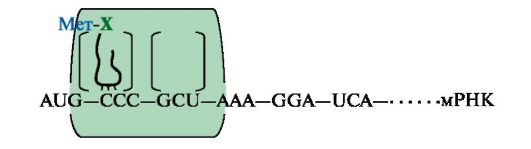 Рис. 3.23. Этап синтеза белка
Рис. 3.23. Этап синтеза белка
A. Инициация Б. Элонгация
B. Терминация
б) на этом этапе к рибосоме присоединяется в А-центр тРНК, связанная с аминокислотой:
A. Глу Б. Ала
B. Про
Г. Мет Д. Фен
в) эта аа-тРНК будет участвовать в:
A. Образовании пептидной связи Б. Связывании аа-тРНК в А-центре
B. Транслокации Г. Терминации
г) за ней будет следовать:
A. Образование пептидной связи Б. Терминация
B. Транслокация
Г. Перемещение аа-тРНК в Р-центр
д) в ходе которой требуется затрата энергии:
A. АТФ Б. ГТФ
B. Макроэргической связи пептидил-тРНК
Г. Макроэргической связи молекулы аа-тРНК
е) эта энергия тратится на:
A. Образование новой пептидной связи в А-центре рибосомы Б. Образование новой пептидной связи в Р-центре рибосомы
B. Перемещение рибосомы по мРНК на один кодон в направлении от 5'- к 3'-концу
Г. Диссоциацию рибосомы
2. Установите соответствие.
A. Противоопухолевые антибиотики Б. Антибактериальные антибиотики
B. Интерфероны
Г. Дифтерийный токсин Д. α-Аманитин
1. Блокируют синтез РНК и белка у микроорганизмов
2. Нарушают стадию транслокации рибосом в клетках эукариотов
3. Взаимодействуют с ДНК и нарушают ее матричную функцию
3. Выберите правильные ответы.
Интерфероны:
A. Представляют собой группу родственных белков, которые синтезируются в вирус-инфицированных клетках
Б. Прекращают синтез белков в зараженных клетках
B. Повышают активность рибонуклеазы
Г. Стимулируют фосфорилирование фактора инициации IF2 Д. Присоединяются к 50S-субъединице рибосомы
4. Выберите правильные ответы.
В клетках, инфицированных вирусами:
A. Прекращается синтез РНК и белка клеток хозяина Б. Активируется синтез интерферонов
B. Белок-синтезирующий аппарат клеток хозяина используется для воспроизводства вирусных белков
Г. Наблюдается модификация азотистых оснований в молекуле ДНК Д. Активируется фосфорилирование фактора элонгации EF2
5. Установите правильный порядок событий.
Регуляция синтеза холестерола осуществляется следующим образом:
A. Снижается скорость транскрипции гена, кодирующего структуру регуляторного фермента синтеза холестерола
Б. Холестерол в клетках гепатоцитов связывается с белком-рецептором
B. Присоединение комплекса холестерол-рецептор изменяет конформа-
цию ДНК
Г. Комплекс холестерол-рецептор связывается с участком сайленсера на
молекуле ДНК Д. Комплекс холестерол-рецептор проходит в ядро
6. Выполните «цепное» задание.
Кортизол - гормон коры надпочечников, легко проходит плазматическую мембрану гепатоцитов и повышает синтез глюкозы из аминокислот и пирувата:
а) в клетках гормон взаимодействует с:
A. тРНК Б. ДНК
B. Белком-рецептором Г. РНК-полимеразой
б) комплекс гормона с выбранным вами веществом поступает в:
A. Ядрышко
Б. ЭПР
B. Цитоплазму Г. Ядро
в) в этом компартменте комплекс взаимодействует с:
A. Рибосомой Б. Энхансером
B. Сайленсером
Г. Белок-синтезирующим комплексом Д. РНК-полимеразой
г) результатом взаимодействия является (выберите правильные ответы):
A. Изменение конформации ДНК Б. Ускорение транскрипции генов
B. Снижение скорости транскрипции
Г. Увеличение содержания мРНК, кодирующих ферменты синтеза глюкозы
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. а) Б, б) Б, в) А, г) В, д) Б, е) В
2. 1-Б, 2-Г, 3-А
3. А, Б, В
4. А, Б, В
5. Б-Д-Г-В-А
6. а) В, б) Г, в) Б, г) А, Б, Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Генетический код и его свойства: триплетность, специфичность, вырожденность, однонаправленность, универсальность, колинеарность
2. Аминоацил-тРНК-синтетазы
3. Инициация, элонгация, терминация - этапы биосинтеза белка
4. Транслокация как этап в процессе перемещения рибосомы по мРНК
5. Посттрансляционные модификации
6. Ингибиторы матричных биосинтезов: репликации, транскрипции и трансляции
7. Оперон: структура и функции
8. Адаптивная регуляция генов эукариотов
9. Энхансеры и сайленсеры
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Митохондриальная ДНК кодирует 13 ферментов, участвующих в биологическом окислении. При синдроме MELAS у пациентов обнаруживается накопление в крови молочной кислоты, энцефалопатия и инсультоподобные эпизоды. Оказалось, что причиной заболевания является мутация в гене, кодирующем строение тРНКЛей, связывающейся с лейцином. Объясните, какие этапы в синтезе митохондриальных ферментов будут нарушены при этой патологии по сравнению с нормой.
Для этого:
а) напишите реакцию связывания Лей с тРНКЛей, назовите фермент;
б) на схеме представьте включение Лей-тРНКЛей в растущую полипептидную цепь;
в) назовите этапы этого процесса и укажите, какая из стадий этого этапа будет нарушена при синдроме MELAS.
2. Пациенту, страдающему полимиелитом, назначено введение интерферона. Объясните правомерность такого назначения. Для этого:
а) опишите механизм действия интерферонов на синтетические процессы в клетке;
б) укажите, с какими клетками - здоровыми или пораженными вирусами - взаимодействуют интерфероны и какова судьба зараженных клеток.
3. Камптотецин и левомицетин (хлорамфеникол) - ингибиторы матричных биосинтезов, нашедшие применение в медицинской практике. Камптотецин образует комплекс с ДНК-топоизомеразой I и нарушает ее активность, а левомицетин присоединяется к 50S-субъединице рибосомы и ингибирует активность пептидилтрансферазы. Предположите, в какой из областей медицины используется каждый из описанных препаратов.
Для ответа:
а) назовите, какие матричные биосинтезы и в каких клетках ингибируют эти препараты;
б) изобразите схемы процессов и отметьте стадии, протекание которых блокируют указанные лекарства;
в) укажите, какова степень их избирательности и токсичности.
4. Пациенту с тяжелой формой пневмонии назначили антибактериальный препарат - рифампицин. Объясните, каков механизм бактерицидного действия рифампицина. Для этого:
а) изобразите схему процесса, который ингибирует рифампицин;
б) укажите причины нарушения синтеза бактериальных белков в организме больного под влиянием препарата и его высокую избирательность.
5. В клетках Е. coli аминокислота Иле синтезируется из аминокислоты Тре. В присутствии высоких концентраций Иле в питательной среде выращивания синтез этой аминокислоты прекращается. Объясните, информация о каких белках закодирована в структурных генах Иле-оперона и как меняется их экспрессия в этих условиях. Для этого:
а) нарисуйте схему Иле-оперона и отметьте регуляторные и структурные участки;
б) объясните функции этих участков;
в) укажите, по какому механизму Иле регулирует активность оперона.
6. В случае синтеза в организме избыточного количества гормона альдостерона наблюдается снижение содержания ионов в моче при одновременном повышении их концентрации в крови и внеклеточной жидкости за счет увеличения количества белков-переносчиков этих ионов в канальцах нефронов. Объясните, как и почему при гиперпродукции альдостерона меняется содержание ионов в моче и крови.
Для этого:
а) представьте схему, отражающую влияние альдостерона на содержание белков-переносчиков ионов в канальцах нефронов;
б) назовите участок ДНК, с которым будет взаимодействовать комплекс гормон-рецептор;
в) укажите матричный процесс, который ускоряется первично при действии гормона.
Модульная единица 3 МЕХАНИЗМЫ ГЕНЕТИЧЕСКОЙ ИЗМЕНЧИВОСТИ И ВОЗНИКНОВЕНИЯ РАЗНООБРАЗИЯ БЕЛКОВ У ЭУКАРИОТОВ. ПОЛИМОРФИЗМ БЕЛКОВ, НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ. ДНК-ТЕХНОЛОГИИ
В МЕДИЦИНЕ
Цели изучения Уметь:
1. Объяснять фенотипическую изменчивость как результат разной доступности генов для транскрипции и изменений первичной структуры ДНК, т.е. как следствие генетической изменчивости.
2. Обосновывать представления о полиморфизме белков в популяции человека как о результате генотипической гетерогенности и о наследственных болезнях, являющихся следствием дефектов в генотипе.
3. Интерпретировать данные генно-инженерных исследований, основанные на использовании рекомбинантных ДНК.
4. Интерпретировать результаты анализа ДНК методом полимеразной цепной реакции (ПЦР).
Знать:
1. Механизмы, обеспечивающие разнообразие белков у эукариотов. Происхождение разнообразия антител. Иммунодефициты.
2. Причины возникновения наследственных болезней.
3. Молекулярные механизмы генетической изменчивости.
4. Формирование рекомбинантных ДНК. Клонирование химерных молекул ДНК и ПЦР как методы изучения генома.
5. Принципы метода ПЦР и области его применения.
ТЕМА 3.8. МЕХАНИЗМЫ, ОБЕСПЕЧИВАЮЩИЕ РАЗНООБРАЗИЕ БЕЛКОВ У ЭУКАРИОТОВ
У эукариотов набор и количество синтезирующихся белков может зависеть от доступности генов для транскрипции, перестройки генов, альтернативного сплайсинга и изменения стабильности мРНК.
1. В организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям, хотя количество и структура ДНК в них практически одинаковы. Существование специализированных органов и тканей зависит от экспрессии генов, при которой в дифференцированных клетках разных тканей транскрибируются разные участки хроматина. Это достигается благодаря существованию механизма стойкой репрессии транскрипции части генов на протяжении всей жизни организма. В разных тканях стабильной репрессии подвергаются разные
гены. Формирование зон стабильной репрессии происходит в процессе онтогенеза и дифференцировки клеток.
Транскрипционно неактивные или стабильно репрессированные участки хроматина получили название гетерохроматина. Стойкая репрессия генов в участках гетерохроматина обеспечивается:
• высококонденсированным состоянием ДНК;
• метилированием дезоксицитидина в CpG-последовательностях ДНК (эта модификация изменяет конформацию хроматина и препятствует транскрипции);
• связыванием ДНК с гистонами и образованием нуклеосом.
В хроматине клеток разных органов и тканей наряду с нетранскрибируемыми зонами ДНК имеются активные или потенциально активные участки - участки эухроматина. В областях эухроматина на ДНК расположены транскрибируемые гены. Эти области характеризуются:
• наличием молекул гистонов, в которых метилированы или ацетилированы аминогруппы в радикалах Лиз и Арг, а остаток Сер фосфорилирован. Это снижает суммарный положительный заряд гистонов и ослабляет их связь с ДНК в нуклеосомах;
• наличием участков, более чувствительных к действию ДНКаз.
За исключением лимфоцитов каждая клетка организма содержит один и тот же набор генов. Однако «активность» одних и тех же генов в клетках тканей может существенно различаться. Например, в ретикулоцитах участок ДНК, содержащий ген β-глобина, находится в области «активного» хроматина, а в мышечных клетках локализован в районе «неактивного» хроматина.
2. Перестройка генов. Это явление наиболее отчетливо наблюдается при формировании разнообразия иммуноглобулинов (Ig). В зародышевых и всех соматических клетках нет полных генов, кодирующих L- и H-цепи Ig. Информация об отдельных участках цепи Ig представлена в виде соответствующих фрагментов молекулы ДНК-сегментов. В молекулах ДНК сегменты, кодирующие вариабельные (V) и константные (C) домены L- и Н-цепей (легких и тяжелых цепей соответственно), разделены протяженными нуклеотидными последовательностями. Обнаружено три разных семейства сегментов. Это два семейства, ответственные за синтез легких цепей, - λ (локализованное в 22-й хромосоме) и κ (2-я хромосома) - и одно семейство, содержащее информацию о всем разнообразии Н-цепей (14-я хромосома). Каждая легкая цепь кодируется тремя отдельными сегментами: V (вариабельным), J (соединяющим) и С (константным). Для κ-цепей существует по 250 V-сегментов, 5 J-сегментов и 1 С-сегмент (рис. 3.24). Тяжелые цепи кодируются 4 сегментами ДНК: VH, D (сегмент разнообразия), JH и CH. У человека около 1000 Vjj-сегментов, более 12 D-сегментов и 4 Jjj-сегмента.
В ходе дифференцировки клеток - предшественников В-лимфоцитов полные гены L-цепей собираются из трех сегментов в результате одной соматической рекомбинации: один из 250-ти VL сегментов соединяется с одним из 5 J-сегментов с образованием смешанного VJ-экзона,
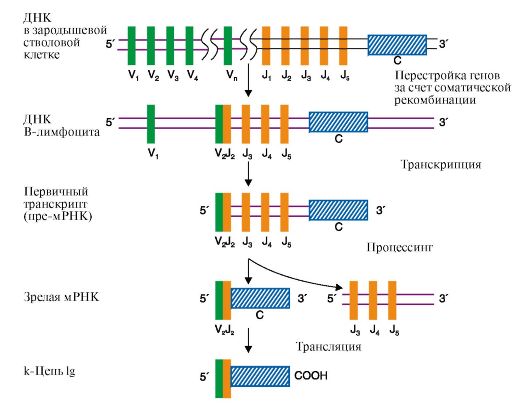
Рис. 3.24. Синтез легкой κ-цепи иммуноглобулина
Рекомбинация объединяет один V-сегмент вариабельного домена с одним из J-сегментов и приближает их к константному сегменту (C). После транскрипции образуется первичный транскрипт (пре-мРНК). Удаление лишних J-сегментов и интронов происходит в ходе посттранскрипционной модификации этой пре-мРНК, что приводит к появлению зрелой мРНК, после трансляции которой появляется белковый вариант легкой цепи Ig. Молекула ДНК показана в виде одной цепи
а нуклеотидная последовательность ДНК между выбранными сегментами удаляется. С помощью такой перегруппировки VL- и JL-сегменты, выбранные из множества им подобных, транскрибируются с образованием единой молекулы мРНК предшественника. После созревания она превращается в мРНК, кодирующую одну из L-цепей Ig. Сходным образом образуются легкие λ-цепи.
При формировании полного гена Н-цепи первоначально собирается смешанный экзон из двух любых D- и J-сегментов в процессе первой рекомбинации. Затем в ходе второй рекомбинации к DJ-экзону присоединяется один из VH-сегментов и образуется полный ген Н-цепи IgM, поскольку к смешанному VHDHJH-экзону, кодирующему вариабельный домен Н-цепи, ближе всего находится СH-сегмент. Десять СН-сегментов константной
области: Сμ Сδ, Су3, Су1, Са1, Су2, Су4, Се и др. - содержат информацию о строении доменов этой области и определяют классы и подклассы иммуноглобулинов IgM, IgG, IgA и т.д. Соединяя различные кодирующие V-, D-, J- и C-сегменты, организм может синтезировать миллионы разных молекул Ig.
Иммуноглобулины (Ig) являются гликопротеинами, поэтому одной из посттрансляционных модификаций, которым подвергаются Н-цепи Ig, является синтез олигосахарида в С-области молекулы.
Первыми в иммунном ответе появляются IgM, поскольку ген, кодирующий Сμсегмент Н-цепи, расположен на 5'-конце кодирующей области ДНК впереди всех остальных С-сегментов. Переключение классов Ig сопряжено с дополнительной специфической рекомбинацией, в процессе которой удаляются С-сегменты между полным геном вариабельной части и С-областью синтезируемого класса Ig. Таким образом, перестройка генетического материала в процессе формирования полных генов Ig проходит в несколько последовательных этапов, и каждый из них приурочен к строго определенной стадии дифференцировки В-лимфоцитов. Аналогичные процессы наблюдаются и в ходе дифференцировки Т-лимфоцитов.
3. Альтернативный сплайсинг мРНК. В ядре синтезируется значительно больший набор первичных транскриптов, чем количество зрелых мРНК в цитоплазме. Контрольные механизмы клетки определяют, какие из пре-мРНК подлежат процессингу, а какие будут расщепляться до нуклеотидов. Ранее уже говорилось о том, что созревание мРНК включает несколько этапов:
- кэпирование 5'-конца;
- присоединение поли-(А)-фрагмента к 3'-концу;
- сплайсинг (удаление интронов).
В некоторых случаях наблюдается альтернативный сплайсинг в сочетании с полиаденилированием, что приводит к образованию нескольких «зрелых» мРНК, кодирующих различающиеся между собой белки из одного и того же первичного транскрипта. Так, в парафолликулярных клетках щитовидной железы в ходе транскрипции гена кальцитонина образуется мРНК, которая содержит информацию о гормоне белковой природы, ответственном за регуляцию обмена ионов кальция (рис. 3.25). В мозге тот же первичный транскрипт подвергается другому варианту сплайсинга и полиаденилирования, и получается мРНК, кодирующая белок, ответственный за вкусовое восприятие.
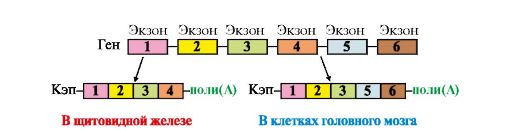 Рис. 3.25. Сплайсинг пре-мРНК гена кальцитонина в клетках щитовидной железы и мозга
Рис. 3.25. Сплайсинг пре-мРНК гена кальцитонина в клетках щитовидной железы и мозга
Альтернативный сплайсинг описан для большого числа транскрибируемых генов. В частности, он показан для генов, кодирующих Ig. На ранних стадиях развития пре-В-лимфоциты продуцируют IgM, которые связаны с клеточной мембраной. Они синтезируются на мРНК, содержащей экзон, в котором имеется информация о гидрофобном участке С-области Ig. С помощью этого участка происходит «заякоревание» IgM в мембране (рис. 3.26).
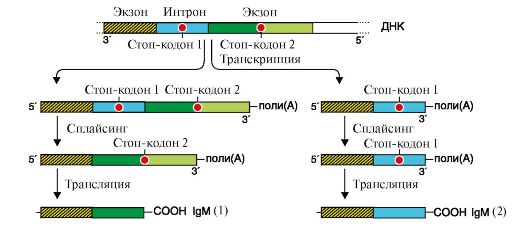 Рис. 3.26. Образование матриц для синтеза мембранно-связанных (1) и секреторных (2) форм Ig.
Рис. 3.26. Образование матриц для синтеза мембранно-связанных (1) и секреторных (2) форм Ig.
Участок ДНК Сμсегмента (показана одна цепь ДНК) включает экзоны и содержит два стоп-кодона: один - в области интрона между двумя экзонами, второй - в составе второго экзона. В процессе транскрипции этого участка ДНК образуются два варианта первичного транскрипта как результат прочтения разных стоп-кодонов. После трансляции транскриптов образуются две разные формы IgM: «заякоренной» (1) в мембране и секреторной (2)
В ходе дифференцировки образуются плазматические клетки, в которых за счет остановки транскрипции на стоп-кодоне 1, входящем в интрон, и альтернативного полиаденилирования исчезает экзон, кодирующий гидрофобный участок молекулы, и синтезируются укороченные молекулы антител, которые секретируются в кровь.
ТЕМА 3.9. МЕХАНИЗМЫ ГЕНЕТИЧЕСКОЙ ИЗМЕНЧИВОСТИ: ЭВОЛЮЦИОННАЯ ИЗМЕНЧИВОСТЬ, ПОЛИМОРФИЗМ БЕЛКОВ. НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ
Существование живого организма невозможно без генетической изменчивости, которая возникает за счет мутаций и рекомбинаций в процессе мейоза. В последнем случае происходит обмен участками ДНК между гомологичными хромосомами родителей. Мутации - это нерепарированные изменения (альтерации) первичной структуры ДНК, появляющиеся в молекуле в результате ошибок в работе ДНК-полимераз или ДНК-репарирующих систем,
воздействия факторов внешней (радиация) и внутренней (мутагены) среды. Мутации возникают при действии алкилирующих агентов. Алкильная группа присоединяется к N7 пуринового кольца гуанина, изменяя его ионизацию и характер связывания с другим нуклеотидом в комплементарной паре. В результате против алкилированного гуанина встает тимин, а следовательно, в последующем поколении пара G-C заменяется на А-Т. Мутации могут быть вызваны и веществами, интеркалирующими между азотистыми основаниями молекулы ДНК.
Точечные мутации в основном бывают трех видов:
• замены (это наиболее распространенный тип повреждений молекулы ДНК);
• вставки;
• делеции (выпадения) нуклеотидов (табл. 3.11).
Таблица 3.11. Виды мутаций в ДНК и их влияние на структуру белка
Виды мутаций | Изменения в структуре ДНК | Изменения в структуре белка |
ЗАМЕНА: без изменения смысла кодона (молчащая, или нейтральная, мутация) | Замена одного нуклеотида в кодоне | Белок не изменен |
с изменением смысла кодона (миссенсмутация) | Происходит замена одной аминокислоты на другую | |
с образованием терминирующего кодона (нонсенс-мутация) | Синтез пептидной цепи прерывается на этом кодоне и образуется незавершенный белок | |
ВСТАВКА: без сдвига рамки считывания информации | Вставка фрагмента ДНК из трех нуклеотидов или с числом нуклеотидов, кратным трем | Происходит удлинение полипептидной цепи на одну или несколько аминокислот |
со сдвигом рамки считывания информации | Вставка одного или нескольких нуклеотидов, не кратных трем | Синтезируется пептид со «случайной» последовательностью аминокислот, так как изменяется смысл всех кодонов, следующих за местом мутации |
ДЕЛЕЦИЯ: без сдвига рамки считывания информации | Выпадение фрагмента ДНК из трех нуклеотидов или с числом нуклеотидов, кратным трем | Происходит укорочение белка на одну или несколько аминокислот |
со сдвигом рамки считывания информации | Выпадение одного или нескольких нуклеотидов, не кратных трем | Синтезируется пептид со «случайной» последовательностью аминокислот, так как изменяется смысл всех кодонов, следующих за местом мутации |
Каждый тип мутации вызывает разные последствия. Так, замена нуклеотида может приводить:
• к «молчащей» (нейтральной) мутации, которая не проявится в белке, если кодирующий триплет, в котором находится мутантный нуклеотид, из-за вырожденности кода обеспечивает включение в белок той же аминокислоты, что и исходный кодон;
• к включению в белок одной измененной аминокислоты (миссенсмутация);
• к образованию «терминирующего» кодона (нонсенс-мутация), на котором работа белок-синтезирующего аппарата будет остановлена и результатом будет формирование укороченной молекулы белка.
Делеции и вставки также приводят к неоднозначным результатам:
• если включается или выпадает один нуклеотид или участок ДНК, количество нуклеотидов в котором не кратно трем, то происходит «сдвиг рамки считывания информации» и при трансляции вся информация, расположенная за местом мутации, читается неверно. В результате синтезируется белок, у которого за местом возникновения мутации расположена «случайная» последовательность аминокислот;
• если выпадает или включается в ДНК участок с длиной цепи, кратной трем, то сдвига рамки считывания информации не происходит («делеция или вставка без сдвига рамки считывания информации»). Белок, который зашифрован такой матрицей, будет либо укорочен (при делеции), либо удлинен (при вставке) на одну или несколько аминокислот.
В большинстве случаев мутации влияют на экспрессию или структуру генов, что проявляется в снижении количества или в изменении структуры белкового продукта, а следовательно, и его функциональной активности. Иногда снижение или полное отсутствие белка является результатом мутаций в регуляторных участках генов (области CpG-островков в промоторах).
Мутации в половых клетках передаются по наследству и могут проявляться в фенотипе потомства в виде наследственной болезни, связанной со структурным и функциональным изменением белка. Мутации в соматических клетках вызывают, как правило, различные функциональные нарушения.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является изменение генома в филогенезе и образование семейств родственных белков.
Аллельные варианты одного гена, занимающие в хромосомах гомологичные локусы, кодируют белки с близкой аминокислотной последовательностью и функциями - полиморфные разновидности одного и того же белка. Каждый индивидуум может иметь только два варианта любого белка, тогда как в популяции число вариантов может быть огромно. Так, по всем аллелям НЬА популяция людей образует более 600 генетически различающихся групп. Полиморфизм белков настолько велик, что можно говорить о биохимической индивидуальности каждого человека.
Геномы всех людей, за исключением однояйцовых близнецов, различны.
Этнические и индивидуальные различия геномов обусловлены мутациями, приводящими к генетическому полиморфизму.
Генетический полиморфизм может быть качественным, когда происходят замены нуклеотидов, либо количественным, когда в ДНК варьирует число нуклеотидных повторов различной протяженности. Генетический полиморфизм встречается как в интронных, так и в экзонных последовательностях молекулы ДНК.
Поскольку наша внешняя и внутренняя индивидуальность - продукт деятельности наших генов, то можно утверждать, что существует большая вариабельность человеческих геномов. Генетический полиморфизм характеризуется на молекулярном уровне небольшими отклонениями в нуклеотидных последовательностях ДНК, которые совместимы с нормальной функцией организма в онтогенезе, но приводят к определенным вариациям в структуре белков и таким образом формируют биохимическую индивидуальность каждой личности.
Все люди отличаются друг от друга индивидуальными реакциями на внешние факторы окружающей среды, инфекции, особенности диеты, токсины и лекарственные препараты. Все это - результат множественного полиморфизма, связанного с наличием множественных форм (изоформ) ферментов детоксикации. У некоторых людей проявляется непереносимость лактозы (неспособность употреблять свежее молоко), повышенная чувствительность к соланину - гликозиду клубней зеленого картофеля, ингибирующему фермент псевдохолинэстеразу. Существуют этнические различия в чувствительности к алкоголю, обусловленные высоким уровнем мутаций в гене алкогольдегидрогеназы у лиц монголоидной расы. Известны семьи, предрасположенные к диабету, атеросклерозу, заболеваниям легких, сердца, почек, психическим отклонениям или с высокой склонностью к онкологии (результат полиморфизма ферментов детоксикации, рецепторов и белков, регулирующих клеточный цикл).
Эти различия между людьми являются результатом генетического разнообразия человека, т.е. наличия у каждого из нас неповторимого набора генов (генома), составляющего наследственную основу биохимической индивидуальности человека и проявляющегося при определенных условиях окружающей среды.
ТЕМА 3.10. ИСПОЛЬЗОВАНИЕ РЕКОМБИНАНТНЫХ ДНК
В МЕДИЦИНЕ
Для изучения генетической неоднородности специфическую ДНК, содержащую информацию об интересующем нас гене или его фрагменте, необходимо выделить из соответствующего источника и получить в достаточном для исследования количестве. Ген или его фрагмент получают, используя:
• обратные транскриптазы - ферменты ретровирусов, которые катализируют синтез ДНК на матрице мРНК;
• химический синтез, позволяющий на автоматическом синтезаторе получать одноцепочечные фрагменты ДНК с заданной последовательностью и длиной до 100 нуклеотидов;
• рестриктазы - бактериальные ферменты из группы эндонуклеаз. Они «узнают» короткую специфическую последовательность нуклеотидов в ДНК длиной в 4-6, реже в 8-12 пар оснований и расщепляют обе нити. В настоящее время из бактериальных источников выделены сотни рестриктаз с разной субстратной специфичностью. Расщепление обеих нитей ДНК может происходить двояким путем - с образованием двухцепочечных («тупых») или одноцепочечных («липких») концов. Синтез рекомбинантных ДНК. Образованные с помощью рестриктаз фрагменты гена, имеющие «липкий» конец, могут по принципу комплементарности взаимодействовать с «липким» концом другого, не родственного ему фрагмента ДНК, который может принадлежать бактериофагу, вирусу или плазмиде и получаться при действии на ДНК той же самой рестриктазы (рис. 3.27). Фрагменты ковалентно соединяют друг с другом с помощью фермента ДНК-лигазы и получают рекомбинантные (или гибридные) ДНК.
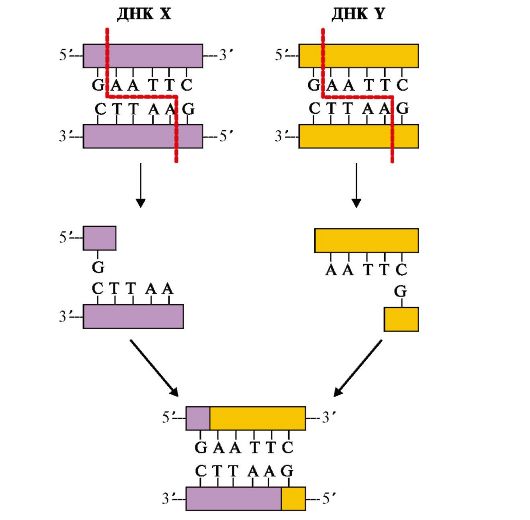 Рис. 3.27. Образование молекул рекомбинантной ДНК с помощью рестриктаз и ДНКлигазы:
Рис. 3.27. Образование молекул рекомбинантной ДНК с помощью рестриктаз и ДНКлигазы:
ДНК Х и ДНК Y - две молекулы ДНК из различных источников; Eco RI - бактериальная рестрикционная эндонуклеаза
Клонирование ДНК. Методика клонирования и размножения рекомбинантной ДНК в бактериях позволяет получить интересующие нас продукты: ДНК, РНК или белки в достаточно больших количествах (рис. 3.28). Бактериофаги, бактериальные плазмиды - экстрахромосомные кольцевые ДНК - используются в качестве векторов, с помощью которых чужеродный ген вносится в бактерию, где обеспечивается его репликация, транскрипция и трансляция с образованием нужного белкового продукта.
Полимеразная цепная реакция (ПЦР) - метод амплификации, т.е. получения большого числа копий интересующего нас гена или его фрагмента в условиях in vitro. Реакционная смесь для получения интересующей нас ДНК содержит: исследуемую ДНК-матрицу, субстраты реакции - четыре дНТФ (дАТФ, дГТФ, дТТФ, дЦТФ), два праймера, термостабильную Taq-полимеразу и реакционный буфер, содержащий ионы Mg2+ в качестве кофактора.
Праймеры - это искусственно синтезированные короткие однонитевые ДНК (20-30 нуклеотидов), выполняющие функцию «затравок» при ферментативном синтезе ДНК. В ПЦР обычно используют два праймера, которые комплементарны 3'-концевым последовательностям амплифицируемого участка на обеих нитях ДНК-матрицы соответственно. Концентрация праймеров значительно превышает количество ДНК-матрицы в реакционной смеси. Расстояние между праймерами определяет длину синтезируемых в ПЦР фрагментов ДНК.
В один цикл ПЦР включается три этапа (рис. 3.29):
• денатурация - исходная смесь нагревается до 94 °С, при этом имеет место разрушение двуспиральной структуры ДНК и расхождение цепей;
• отжиг - на этом этапе температура реакционной смеси снижается до 52-60 °С и происходит комплементарное связывание праймеров с нитями матричной ДНК;
• полимеризация, в ходе которой Taq-полимераза катализирует удлинение праймеров (с 3'-конца) и синтез новых цепей ДНК. Температура смеси для проявления оптимальной активности Taq-полимеразы соответствует 72 °С.
Эти этапы повторяются многократно в автоматическом приборе - амплификаторе (термоциклере), что позволяет получить огромное количество копий интересующего нас фрагмента ДНК. Так, в результате проведения 20 циклов ПЦР анализируемый участок ДНК амплифицируется более чем в миллион раз. Продолжительность каждого этапа цикла ПЦР определяется экспериментально и обычно длится 1-2 минуты.
Механизм образования рекомбинантных ДНК дает возможность:
• использовать микроорганизмы в качестве продуцентов необходимых для человека веществ: белковых гормонов (инсулин, гормон роста, соматостатин), биологически активных пептидов, вакцин (например, против гепатита С), факторов, участвующих в свертывании крови (фактор VIII для лечения гемофилии);
• создавать новые полезные для человека формы растений и животных;
• предпринимать попытки лечения наследственных болезней путем введения в клетки нормальных копий дефектных генов.
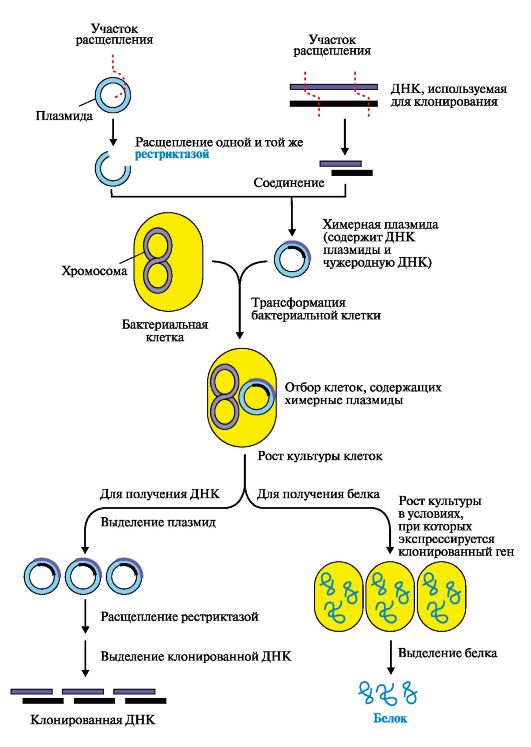 Рис. 3.28. Клонирование ДНК в бактериальных клетках
Рис. 3.28. Клонирование ДНК в бактериальных клетках
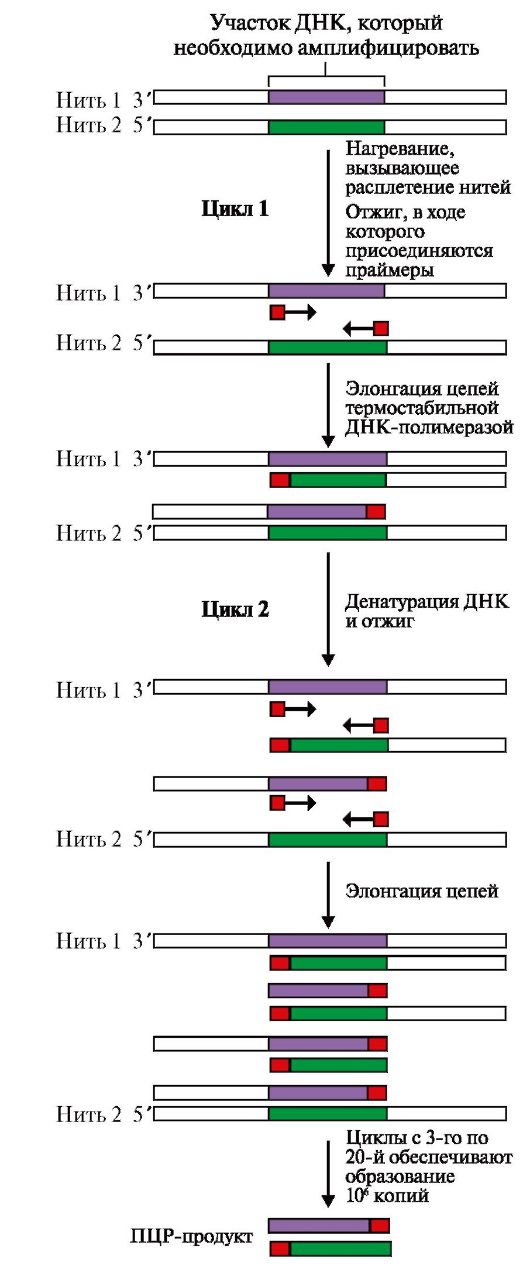 Рис. 3.29. Полимеразная цепная реакция
Рис. 3.29. Полимеразная цепная реакция
Благодаря использованию методов клонирования ДНК удается решать вопросы генетического картирования (т.е. составления генетической карты организма), установления хромосомной локализации многих генетических нарушений, таких, как серповидноклеточная анемия (11-хромосома), фенилкетонурия (12-хромосома), мышечная дистрофия Дюшена (10-я хромосома) и др., проводить пренатальную диагностику наследственных заболеваний.
Использование техники рекомбинанатных ДНК для диагностики и лечения заболеваний
Полиморфизм длины рестрикционнных фрагментов. Замены, делеции и вставки нуклеотидов вызывают изменения в первичной структуре ДНК, а следовательно, и в расположении сайтов рестрикции. После обработки рестриктазами мутированной ДНК образуются фрагменты иного размера, чем в случае анализа нормальной ДНК. Этим пользуются при обследовании пациентов на носительство патологических генов (в частности, при обследовании семей, в которых родители являются гетерозиготами по гену серповидноклеточной анемии).
Определение мутаций с помощью аллель-специфических проб. Синтезируются два коротких олигодезоксинуклеотида, меченных изотопом Р32, один из которых содержит ДНК-последовательность, включающую мутацию, а другой не изменен. С помощью этих аллель-специфических проб ДНК пациентов проверяют
на носительство исследуемой мутации. Для этого область гена, содержащая интересующий нас участок, амплифицируется с помощью ПЦР. Образцы наносят на узкие полоски нитроцеллюлозы и обрабатывают мечеными олигонуклеотидами, содержащими нормальную или мутантную последовательность. Радиоавтографически оценивают, с какой из проб преимущественно связывается ДНК пациента.
Генная терапия. Основная цель этого направления - терапия наследственных и ненаследственных (инфекционных) заболеваний путем введения в клетки пациентов генов, устраняющих генные дефекты или придающие им новые функции. Впервые эта задача была решена в 1990 г., когда четырехлетней девочке, страдающей наследственным иммунодефицитом, вызванным мутацией в гене аденозиндезаминазы (АДА), были пересажены ее собственные лимфоциты с предварительно введенным in vitro ретровирусным ДНК-вектором, содержащим нормальный ген АДА. К настоящему времени подобным способом пытаются лечить некоторые наследственные, онкологические заболевания и ВИЧ-инфекции.
С 1990 г. ученые всего мира участвуют в международном проекте «Геном человека», цель которого заключается в выяснении последовательности нуклеотидов во всех молекулах ДНК клеток человека с одновременным установлением локализации всех генов. Решение поставленных задач станет возможным благодаря внедрению новейших технологий второго и третьего поколений.
Из почти 10 000 различных заболеваний человека 3 000 - наследственные. Они не обязательно должны быть наследуемыми и передаваться от поколения к поколению. В этом контексте слово «наследственные» означает, что причина болезни заключается в повреждении наследственного аппарата. В настоящее время сотни генов, повреждение в которых вызывает болезнь, полностью секвенированы. Ожидается, что будут изучены все гены, вовлеченные в развитие патологических процессов у человека. Это поможет вывести на новый уровень методы ранней диагностики и лечения заболеваний.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Составьте схему образования мРНК тяжелой цепи иммуноглобулина и объясните на ее примере возможность формирования многообразия антител.
2. В клетках щитовидной железы в ходе транскрипции гена кальцитонина образуется мРНК, содержащая информацию о гормоне белковой природы и о белке, отвечающем за вкусовое восприятие. Перенесите рис. 3.24 в тетрадь и укажите:
а) вид сплайсинга;
б) количество экзонов, которое содержит ген кальцитонина;
в) транскрипты скольких экзонов используются при образовании зрелых мРНК кальцитонина и белка, ответственного за вкусовое восприятие;
г) количество экзонов гена, являющихся общими для обоих белков;
д) рибонуклеопротеины, обеспечивающие механизм образования разных зрелых мРНК из одной пре-мРНК.
3. Заполните табл. 3.12. В соответствующих столбцах укажите кратко словами, к чему может привести та или иная мутация. Например, при мутации «замена нуклеотида» структура белка не изменена, если «образовавшийся триплет кодирует ту же аминокислоту».
Таблица 3.12. Влияние мутаций на структуру синтезируемого белка
Характер мутации | Структура белка не изменена | Структура белка изменена | Полноразмерный белок не образуется |
1. Замена нуклеотида | |||
2. Делеция | |||
3. Вставка |
4. Фрагмент транскрибируемой нити ДНК
 Определите, какие изменения произойдут в данном белке при следующих мутациях:
Определите, какие изменения произойдут в данном белке при следующих мутациях:
а) замена С6 на Т;
б) замена Т4 на С;
в) замена Т4 на А;
г) вставка С между G1 и А2;
д) делеция А2. Для этого:
1) запишите последовательность нуклеотидов во фрагментах полученных мутантных ДНК в пп. а-д;
2) определите последовательность нуклеотидов в мРНК, которая синтезируется на мутантных ДНК;
3) пользуясь таблицей биологического кода, установите последовательность аминокислот в пептиде, закодированном в мутантных мРНК, и сделайте вывод об изменениях структуры мутантных белков по сравнению с исходной молекулой;
4) для каждого из полученных белков предположите возможную функциональную активность, выбрав соответствующие буквы:
A. Не изменится Б. Может возрасти
B. Может снизиться
Г. Может полностью утратиться Ответ может быть неоднозначным.
5. Используя рис. 3.28, выпишите последовательность событий процесса, приводящего к образованию рекомбинантных ДНК. Объясните роль рестриктаз и ДНК-лигазы в этом процессе (см. также рис. 3.27).
6. Познакомьтесь с методом проведения полимеразной цепной реакции. Выпишите принцип метода и схему ПЦР. Укажите значение данного метода.
7. Реакционную смесь для ПЦР помещают в амплификатор, где в разные периоды инкубации происходят повторяющиеся изменения температурного режима: 55 °С, 72 °С и 92 °С. Объясните, какую функцию выполняет процесс выдерживания реакционной смеси при 92 °С.
8. Опишите стадии одного цикла ПЦР и объясните физический смысл каждой стадии.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы.
Различия в наборе белков, синтезирующихся в разных органах и тканях организма, обусловлены тем, что:
A. Геном разных типов клеток одинаков, но функционально активны разные гены
Б. Стойко репрессированные гены могут активироваться под воздействием факторов внешней и внутренней среды
B. Первичные транскрипты генов подвергаются альтернативному сплайсингу
Г. Участки «активного» хроматина различны в разных клетках. Д. Дифференцировка некоторых клеток сопровождается перестройкой генов
2. Выберите правильные утверждения и установите порядок событий при образовании Н-цепи иммуноглобулина М:
A. Образуется полный ген вариабельной части из сегментов V;, Dx, Jy.
Б. Сегменты Dx и Jy соединяются в результате соматической рекомбинации
B. Связывание V; c Dx Jy сопровождается удалением протяженной нуклеотидной последовательности
Г. При соединении полного вариабельного гена с Сμ сегментом происходит третья соматическая рекомбинация
Д. Первичный транскрипт полного гена Н цепи IgM подвергается созреванию (процессингу)
3. Установите соответствие.
Мутации:
A. Миссенс-мутация Б. Нонсенс-мутация
B. Делеция без сдвига рамки считывания информации Г. Вставка со сдвигом рамки считывания информации Д. Вставка без сдвига рамки считывания информации
Изменения в структуре белка:
1. Укорочение белка на одну или несколько аминокислот
2. Синтез белка, лишенного С-концевого фрагмента молекулы
3. Образование белкового продукта со случайной последовательностью аминокислот за местом мутации
4. Выберите правильные ответы. Использование метода ПЦР позволяет:
A. Идентифицировать мутации в структуре ДНК
Б. Получать участок ДНК в количествах, достаточных для дальнейших исследований
B. Идентифицировать чужеродные гены при инфицировании организма вирусами и патогенными организмами
Г. Устанавливать генетическое родство организмов
Д. Установить принадлежность гена к эуили гетерохроматину
5. Выберите правильные ответы.
Делеция одного нуклеотида может привести к следующим последствиям:
A. Укорочение полипептидной цепи на одну аминокислоту Б. Удлинение белка на одну аминокислоту
B. Синтез незавершенной молекулы белка
Г. Синтез белка со «случайной» последовательностью аминокислот на
участке за местом мутации Д. Синтез белка с одной измененной аминокислотой
6. Выберите правильные ответы. Рестриктазы:
A. Отщепляют 5'-концевые нуклеотиды от двуспиральной ДНК Б. Осуществляют сайт-специфический разрез в обеих нитях ДНК
B. Используют для получения рекомбинантных ДНК
Г. Образуют 3-гидроксильные и 5-фосфатные концы в молекуле ДНК Д. Могут расщеплять обе нити ДНК с образованием одноцепочечных «липких» концов
7. Выберите правильные ответы.
Использование термоциклера (амплификатора) в методе ПЦР позволяет:
A. Поддерживать определенный температурный режим Б. Автоматизировать процесс
B. Денатурировать ДНК
Г. Получать миллионы копий исследуемой ДНК за 1-2 часа Д. Использовать термостабильную ДНК-полимеразу
ЭТАЛОНЫ ОТВЕТОВ К
«ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, В, Г, Д
2. Б→В→А→Д
3. 1-В, 2-Б, 3-Г
4. А, Б, В, Г
5. В, Г
6. Б, В, Г, Д
7. А, Б, В, Г, Д
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Дифференцировка клеток как результат стойкой репрессии отдельных генов
2. Соматические рекомбинации в процессе образования генов иммуноглобулинов
3. Типы мутаций
4. Полиморфизм белков
5. Наследственные болезни как результат полиморфизма белков
6. Рестрикция ДНК
7. Синтез рекомбинантных ДНК
8. Клонирование ДНК
9. Полимеразная цепная реакция (ПЦР)
10. Полиморфизм длины рестрикционных фрагментов
11. Определение мутаций с помощью аллель-специфических проб
12. Генная терапия
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. На поверхности В-лимфоцитов располагаются иммуноглобулины, гидрофобный домен которых пронизывает плазматическую мембрану. Когда определенная группа (клон) В-лимфоцитов активируется и превращается в плазматические клетки, в них начинается синтез секреторных форм иммуноглобулинов. Изучив схему синтеза матриц мРНК, мембранных и секреторных форм Ig (см. рис. 3.26), определите, какой механизм лежит в основе изменения структуры этих белков. Для этого объясните, где в клетке и на какой стадии реализации информации произошли изменения в структуре матриц.
2. В структурном гене соматической клетки произошла делеция 25 нуклеотидов. Объясните:
а) наблюдается ли в этом случае в ходе трансляции сдвиг рамки считывания информации гена;
б) может ли такая мутация быть причиной наследственной болезни.
3. В яйцеклетке в смысловой части гена фермента оксигеназы гомогентизиновой кислоты произошла замена 7-го нуклеотида с образованием терминирующего кодона. Объясните, какие изменения в структуре белка произойдут в ходе трансляции мутантного гена. К каким фенотипическим проявлениям приведет эта мутация?
4. Фермент глюкозо-6-фосфат-дегидрогеназа встречается в популяции людей в двух вариантах, которые различаются по одной аминокислоте: в одном из вариантов аминокислота Асп заменена на Асн. Определите, какие изменения в кодоне гена этого фермента привели к появлению указанных вариантов. Для этого:
а) объясните, что такое полиморфизм белков;
б) укажите, являются ли описанные варианты ферментов примером этого явления;
в) запишите состав кодонов Асп и Асн.
5. Белковый ингибитор многих протеаз α-2-антитрипсин представлен в человеческой популяции четырьмя аллельными вариантами А, В, С и D. Определите, на какие генетически различные группы можно разделить всех людей по этому признаку.
6. Мутация, которая вызывает серповидно-клеточную анемию (СКА), при расщеплении ферментом MstII гена β-глобина приводит к исчезновению сайта рестрикции. В мутантной ДНК рестрикционный фрагмент, образующийся под действием MstII и включающий 5'-конец β-глобинового гена будет больше для пациентов со СКА [1,3 тыс. пар нуклеотидов (т.п.н.)], чем для здоровых людей (1,1 т.п.н.). В связи с этим:
а) покажите, как будут располагаться фрагменты рестрикции на электрофореграмме для пациента, являющегося гетерозиготой по гену СКА (дорожка X), если известно, что на электрофореграмме (рис. 3.30) фрагменты рестрикции гена β-глобина здорового человека и гомозиготного пациента по СКА дают по одной полосе;
б) исходя из данных задачи, определите, какая из дорожек соответствует рестрикционному фрагменту здорового человека, а какая - больного.
7. Из-за небрежности медицинской сестры в одном из роддомов принадлежность роженицам двух детей не была своевременно отмечена. Чтобы найти истинных родителей, возникла необходимость исследовать ДНК детей и родителей методом полиморфизма длины рестрикционных фрагментов (ПДРФ). У обследуемых была взята кровь, из лейкоцитов экстрагировали ДНК и провели ПЦР. Полученную ДНК обработали рестриктазой и образующиеся фрагменты разделили с помощью гель-электрофореза. На электрофореграмме продукты рестрикции обнаруживали с помощью радиоактивно меченых олигонуклеотидов, которые специфически связывались с участками фрагментов ДНК, полученных при рестрикции. Рассмотрите электрофореграмму (рис. 3.31) и определите, какой из
родительских пар принадлежат дети Рх и Рy . если Ма и Оа - мать и отец из
одной супружеской пары, а Мь и Оь - из другой.
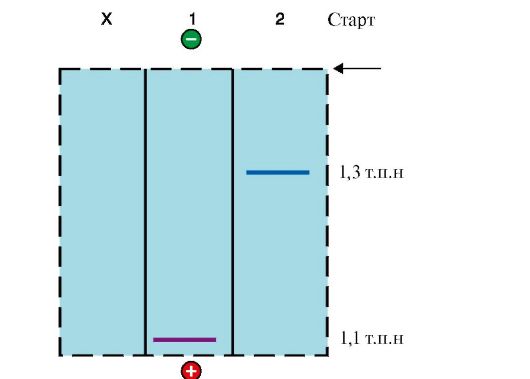 Рис. 3.30. Электрофореграмма продуктов расщепления гена β-глобина, образующихся под действием MstII рестриктазы
Рис. 3.30. Электрофореграмма продуктов расщепления гена β-глобина, образующихся под действием MstII рестриктазы
 Рис. 3.31. Электрофореграмма продуктов рестрикции:
Рис. 3.31. Электрофореграмма продуктов рестрикции:
2-10 - размер ДНК-фрагментов, т.п.н.